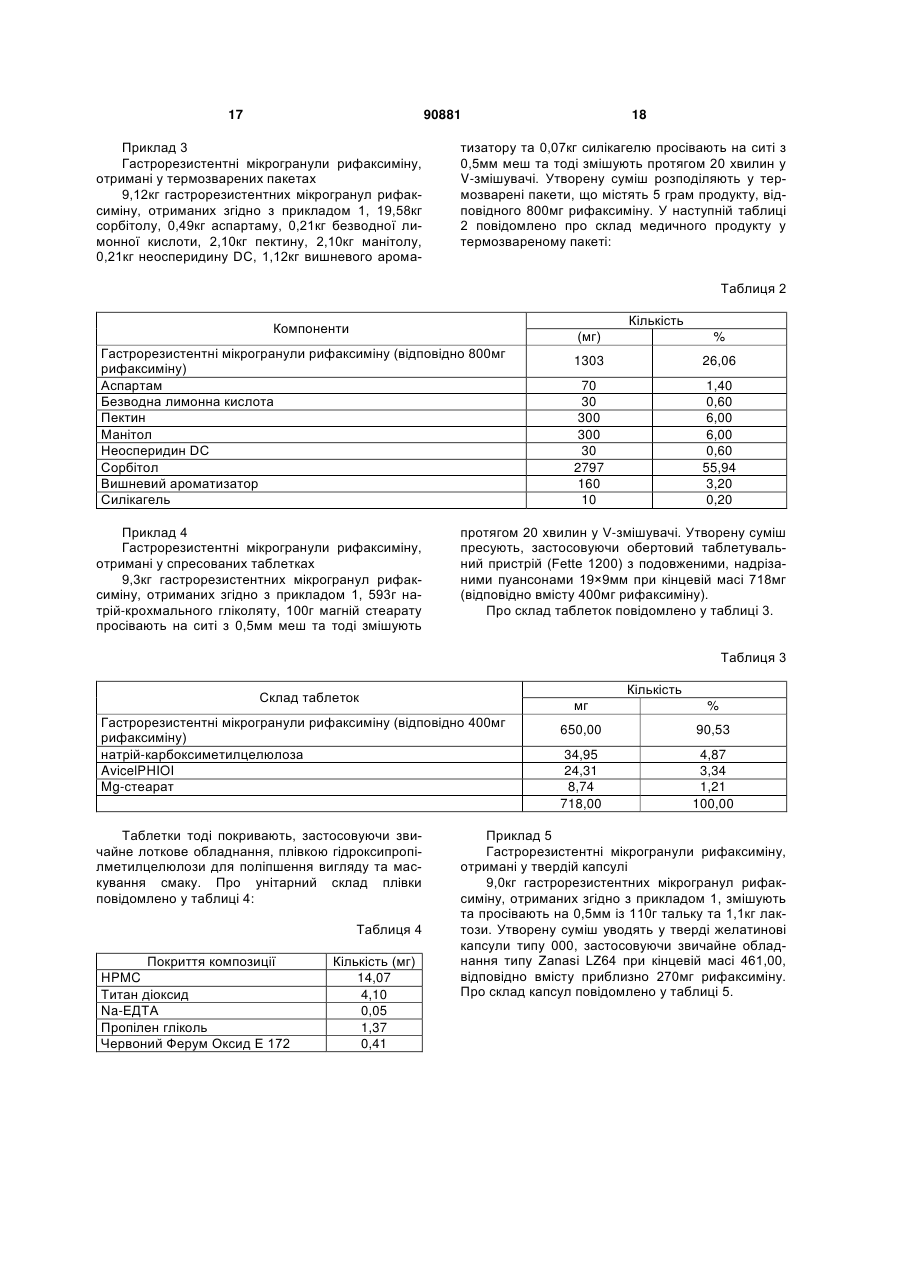
Гастрорезистентна фармацевтична композиція, що містить рифаксимін
Номер патенту: 90881
Опубліковано: 10.06.2010
Автори: Палаззіні Ернесто, Віскомі Джузеппе К., Панталео Марія Росарія, Замбоні Вілл'ям
Формула / Реферат
1. Фармацевтична композиція, що містить гастрорезистентні мікрогранули рифаксиміну в кристалічній або аморфній формі, де мікрогранули мають діаметр від приблизно 1 мікрона до приблизно 900 мікронів, мікрогранули містять полімер, нерозчинний при величинах рН між 1,5 та 4,0 та розчинний при величинах рН між 5,0 та 7,7.
2. Фармацевтична композиція за п 1, де гастрорезистентні мікрогранули рифаксиміну мають діаметр приблизно від 10 мікронів до 500 мікронів.
3. Фармацевтична композиція за п. 1, де полімери вибрані з акрилового кополімеру, кополімерів метакрилової кислоти з акриловим та метакриловим естером, ацетатофталату целюлози, полівінілацетатфталату, кополімеру флюїдизованої метакрилової кислоти з етилакрилатом.
4. Фармацевтична композиція за п. 1, де кількість полімерів складає 5-75 мас. % від загальної маси мікрогранул.
5. Фармацевтична композиція за п. 1, де гастрорезистентні мікрогранули додатково містять один або більше розріджувачів, пластифікаторів, антиагломеративних, антизлипальних, ковзних, антиспінювальних засобів та барвників.
6. Фармацевтична композиція за п. 1, де гастрорезистентні мікрогранули рифаксиміну містять одну або більше поліморфних форм рифаксиміну або неочищену форму рифаксиміну.
7. Фармацевтична композиція за п. 6, де поліморфні форми рифаксиміну вибрані з Форми α, Форми β, Форми γ, Форми δ або Форми ε чи суміші двох або більше форм.
8. Фармацевтична композиція за п. 6, яка містить:
від приблизно 1 до приблизно 3000 мг гастрорезистентних мікрогранул рифаксиміну, від приблизно 0 до 450 мг підсолоджувача, вибраного з одного чи більше з сорбітолу, аспартаму, цукру, ксилітолу, лактитолу, натрій цикламату, декстрози, фруктози, глюкози, лактози та сахарози, або неогеспередин DC,
приблизно від 0 до 50 мг органічної кислоти, вибраної з одної чи більше з лимонної, оцтової, адипінової, лимонної, фумарової, глутарової, яблучної, бурштинової чи винної кислоти,
від приблизно 0 до 500 мг суспендувального засобу, вибраного з одного чи більше з полівінілпіролідону (ПВП), натрійкарбоксиметилцелюлози, пектину, ксантанової камеді чи агар-агару,
приблизно від 0 до 500 мг манітолу,
приблизно від 0 до 4000 мг цукрового спирту, вибраного з одного чи більше з лактитолу, мальтитолу, манітолу, сорбітолу та ксилітолу, ксантанової камеді, декстрину чи мальтодекстрину,
приблизно від 0 до 300 мг ароматизатора, вибраного з одного чи більше з фруктового чи рослинного ароматизатора, та
приблизно від 0 до 100 мг ковзного засобу, вибраного з одного чи більше з силікагелю, стеарату магнію чи тальку, у термозвареному пакеті.
9. Фармацевтична композиція за п. 6, яка містить:
від приблизно 50 до приблизно 450 мг гастрорезистентних мікрогранул рифаксиміну,
приблизно від 0 до 25 мг лубрикантів, вибраних а одного чи більше з тальку, стеарату магнію, стеарату кальцію, стеаринової кислоти, гідрогенованих рослинних олій, поліетиленгліколю,
від приблизно 1 до приблизно 225 мг розріджувача, вибраного з одного чи більше з фосфату дикальцію, сульфату кальцію, целюлози, мікрокристалічної целюлози, гідроксипропілметилцелюлози, кукурудзяного крохмалю, лактози, каоліну, манітолу, хлориду натрію та сухого крохмалю.
10. Фармацевтична композиція за п. 1, яка є у формі пресованих таблеток.
11. Фармацевтична композиція за п. 10, де таблетка містить:
приблизно від 0 до 50 мг полімерів, вибраних з одного чи більше з целюлози, гідроксипропілцелюлози, гідроксиметилцелюлози, гідроксипропілметилцелюлози, акрилових, метакрилатних та метилметакрилатних кополімерів,
приблизно від 0 до 5 мг пластифікаторів, вибраних з одного чи більше з гліцерину, пропіленгліколю, поліетиленгліколю, триацетину, ацетильованих моногліцеридів, цитратних естерів та фталатних естерів,
приблизно від 0 до 1 мг стабілізатора,
приблизно від 0 до 10 мг барвника, вибраного з одного чи більше з альбумінового барвникового лаку, діоксиду титану, оксиду феруму.
12. Фармацевтична композиція за п. 11, де стабілізатором є ЕДТА.
13. Фармацевтична композиція за п. 10, яка містить:
від приблизно 50 до приблизно 1000 мг гастрорезистентних мікрогранул рифаксиміну,
від приблизно 1 до приблизно 500 мг розріджувачів, вибраних з одного чи більше з фосфату дикальцію, сульфату кальцію, целюлози, мікрокристалічної целюлози, гідроксипропілметилцелюлози, кукурудзяного крохмалю, лактози, каоліну, манітолу, хлориду натрію та сухого крохмалю,
від приблизно 1 до приблизно 500 мг зв'язуючих, вибраних з одного чи більше з крохмалю, желатину, цукрів, як-то сахароза, глюкоза, декстроза, лактоза, синтетичної камеді, альгінату натрію, карбоксиметилцелюлози, метилцелюлози, полівінілпіролідону, поліетиленгліколю, етилцелюлози, води, восків та спирту,
приблизно від 0 до 20 мг лубрикантів, вибраних з одного чи більше з тальку, стеарату магнію, стеарату кальцію, стеаринової кислоти, гідрогенованих рослинних олій та поліетиленгліколю,
приблизно від 0 до 20 мг ковзних засобів, вибраних з одного чи більше з колоїдного діоксину кальцію та тальку,
приблизно від 0 до 200 мг дезінтегрантів, вибраних з одного чи більше з натрійкарбоксиметилцелюлози, кукурудзяного чи картопляного крохмалю, кроскармелози, кросповідону, натрійкрохмальгліколяту,
приблизно від 0 до 10 мг барвників, вибраного з одного чи більше з діоксиду титану та оксиду феруму,
приблизно від 0 до 500 мг підсолоджувачів, вибраних з одного чи більше з цукрози, сорбітолу, манітолу, сахарину, ацесульфаму, неогеспередину.
14. Фармацевтична композиція за п. 1, де композиція є у твердих желатинових капсулах.
15. Фармацевтична композиція за п. 14, де капсула містить:
від приблизно 50 до приблизно 450 мг гастрорезистентних мікрогранул рифаксиміну,
приблизно від 0 до 25 мг лубрикантів, вибраних з одного чи більше з тальку, стеарату магнію, стеарату кальцію, стеаринової кислоти, гідрогенованих рослинних олій та поліетиленгліколів,
від приблизно 1 до приблизно 225 мг розріджувачів, вибраних з одного чи більше з фосфату дикальцію, сульфату кальцію, целюлози, мікрокристалічної целюлози, гідроксипропілметилцелюлози, кукурудзяного крохмалю, лактози, каоліну, манітолу, хлориду натрію та сухого крохмалю.
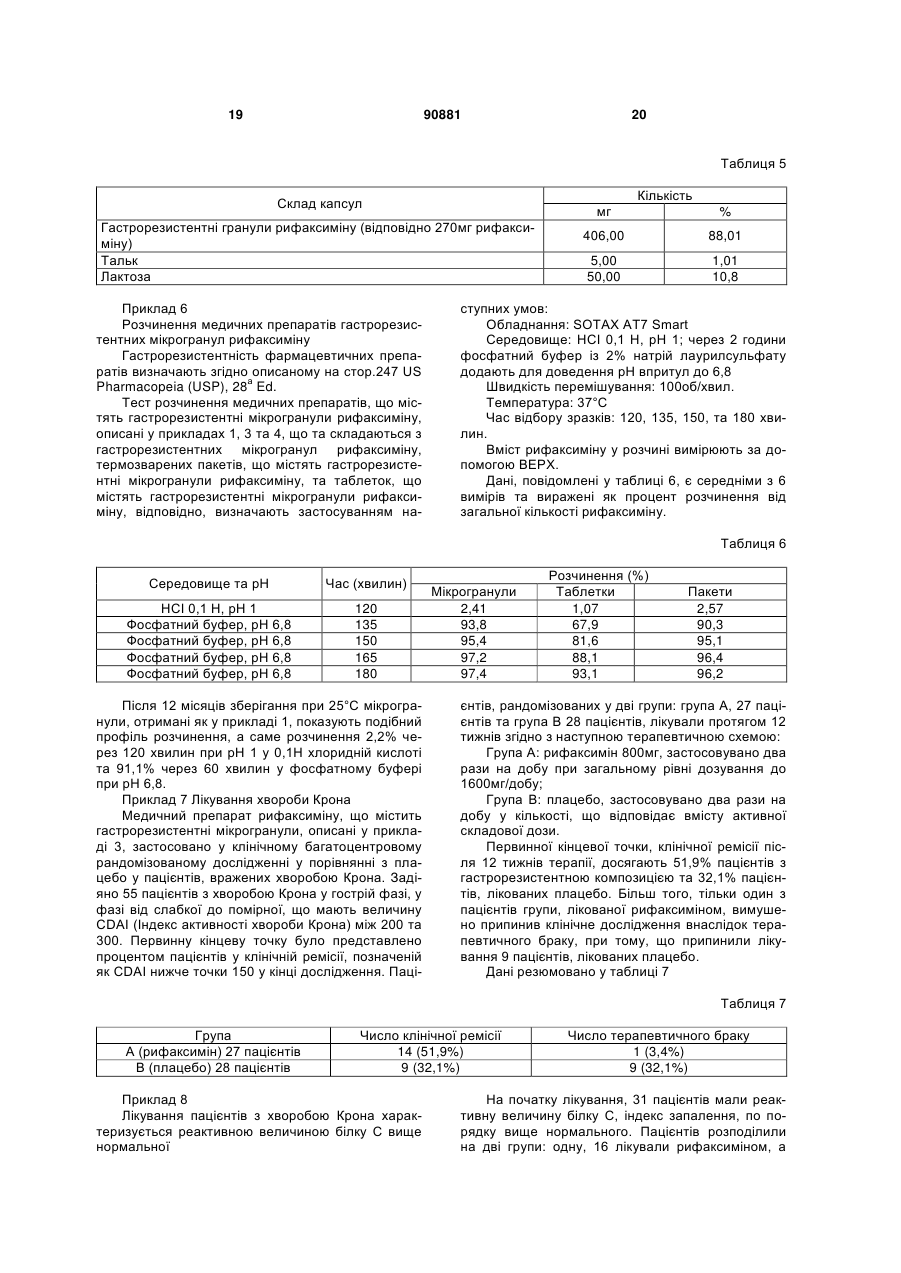
16. Спосіб введення рифаксиміну суб'єкту, який полягає у нижченаведеному:
обстеженні суб'єкта, який цього потребує,
отриманні фармацевтичної композиції, що містить гастрорезистентні мікрогранули рифаксиміну в кристалічній або аморфній формі, де мікрогранули мають діаметр від приблизно 1 мікрону до приблизно 900 мікронів, мікрогранули містять полімери, нерозчинні при величинах рН між 1,5 та 4,0, та розчинні при величинах рН між 5,0 та 7,7, та
пероральному прийомі композиції суб'єктом.
17. Спосіб за п. 16, де принаймні частина рифаксиміну вивільняється у шлунку, тонкому кишечнику, товстому кишечнику та прямій кишці.
18. Спосіб за п. 16, де суб'єкт потерпає від стану, вибраного з коліту, хвороби Крона та синдрому подразненого кишечника.
19. Спосіб за п. 18, де значення С-реактивного білка у пацієнтів, які потерпають від хвороби Крона, є вищим за стандартне.
20. Спосіб одержання фармацевтичної композиції, яка містить гастрорезистентні мікрогранули рифаксиміну в кристалічній або аморфній формі, де:
мікрогранули мають діаметр від приблизно 1 мікрона до приблизно 900 мікронів, та
мікрогранули містять полімери, нерозчинні при величинах рН між 1,5 та 4,0, та розчинні при величинах рН між 5,0 та 7,7;
спосіб полягає у розпиленні через форсунку водної суспензії, яка містить рифаксимін, гастрорезистентний полімер та фармацевтичні ексципієнти в апараті з псевдозрідженим шаром, де напилювання здійснюють під тиском між 1,0 та 1,5 бар та при швидкості потоку між 150 та 300 г/хвилину, та де рифаксимін утримують у водній суспензії у суспендованому стані потоком гарячого повітря.
Текст
1. Фармацевтична композиція, що містить гастрорезистентні мікрогранули рифаксиміну в кристалічній або аморфній формі, де мікрогранули мають діаметр від приблизно 1 мікрона до приблизно 900 мікронів, мікрогранули містять полімер, нерозчинний при величинах рН між 1,5 та 4,0 та розчинний при величинах рН між 5,0 та 7,7. 2. Фармацевтична композиція за п. 1, де гастрорезистентні мікрогранули рифаксиміну мають діаметр приблизно від 10 мікронів до 500 мікронів. 3. Фармацевтична композиція за п. 1, де полімери вибрані з акрилового кополімеру, кополімерів метакрилової кислоти з акриловим та метакриловим естером, ацетатофталату целюлози, полівінілацетатфталату, кополімеру флюїдизованої метакрилової кислоти з етилакрилатом. 4. Фармацевтична композиція за п. 1, де кількість полімерів складає 5-75 мас. % від загальної маси мікрогранул. 5. Фармацевтична композиція за п. 1, де гастрорезистентні мікрогранули додатково містять один або більше розріджувачів, пластифікаторів, антиагломеративних, антизлипальних, ковзних, антиспінювальних засобів та барвників. 6. Фармацевтична композиція за п. 1, де гастрорезистентні мікрогранули рифаксиміну містять одну 2 (19) 1 3 90881 4 кукурудзяного крохмалю, лактози, каоліну, манітолу, хлориду натрію та сухого крохмалю. 10. Фармацевтична композиція за п. 1, яка є у формі пресованих таблеток. 11. Фармацевтична композиція за п. 10, де таблетка містить: приблизно від 0 до 50 мг полімерів, вибраних з одного чи більше з целюлози, гідроксипропілцелюлози, гідроксиметилцелюлози, гідроксипропілметилцелюлози, акрилових, метакрилатних та метилметакрилатних кополімерів, приблизно від 0 до 5 мг пластифікаторів, вибраних з одного чи більше з гліцерину, пропіленгліколю, поліетиленгліколю, триацетину, ацетильованих моногліцеридів, цитратних естерів та фталатних естерів, приблизно від 0 до 1 мг стабілізатора, приблизно від 0 до 10 мг барвника, вибраного з одного чи більше з альбумінового барвникового лаку, діоксиду титану, оксиду феруму. 12. Фармацевтична композиція за п. 11, де стабілізатором є ЕДТА. 13. Фармацевтична композиція за п. 10, яка містить: від приблизно 50 до приблизно 1000 мг гастрорезистентних мікрогранул рифаксиміну, від приблизно 1 до приблизно 500 мг розріджувачів, вибраних з одного чи більше з фосфату дикальцію, сульфату кальцію, целюлози, мікрокристалічної целюлози, гідроксипропілметилцелюлози, кукурудзяного крохмалю, лактози, каоліну, манітолу, хлориду натрію та сухого крохмалю, від приблизно 1 до приблизно 500 мг зв'язуючих, вибраних з одного чи більше з крохмалю, желатину, цукрів, як-то сахароза, глюкоза, декстроза, лактоза, синтетичної камеді, альгінату натрію, карбоксиметилцелюлози, метилцелюлози, полівінілпіролідону, поліетиленгліколю, етилцелюлози, води, восків та спирту, приблизно від 0 до 20 мг лубрикантів, вибраних з одного чи більше з тальку, стеарату магнію, стеарату кальцію, стеаринової кислоти, гідрогенованих рослинних олій та поліетиленгліколю, приблизно від 0 до 20 мг ковзних засобів, вибраних з одного чи більше з колоїдного діоксину кальцію та тальку, приблизно від 0 до 200 мг дезінтегрантів, вибраних з одного чи більше з натрійкарбоксиметилцелюлози, кукурудзяного чи картопляного крохмалю, кроскармелози, кросповідону, натрійкрохмальгліколяту, приблизно від 0 до 10 мг барвників, вибраного з одного чи більше з діоксиду титану та оксиду феруму, приблизно від 0 до 500 мг підсолоджувачів, вибраних з одного чи більше з цукрози, сорбітолу, манітолу, сахарину, ацесульфаму, неогеспередину. 14. Фармацевтична композиція за п. 1, де композиція є у твердих желатинових капсулах. 15. Фармацевтична композиція за п. 14, де капсула містить: від приблизно 50 до приблизно 450 мг гастрорезистентних мікрогранул рифаксиміну, приблизно від 0 до 25 мг лубрикантів, вибраних з одного чи більше з тальку, стеарату магнію, стеарату кальцію, стеаринової кислоти, гідрогенованих рослинних олій та поліетиленгліколів, від приблизно 1 до приблизно 225 мг розріджувачів, вибраних з одного чи більше з фосфату дикальцію, сульфату кальцію, целюлози, мікрокристалічної целюлози, гідроксипропілметилцелюлози, кукурудзяного крохмалю, лактози, каоліну, манітолу, хлориду натрію та сухого крохмалю. 16. Спосіб введення рифаксиміну суб'єкту, який полягає у нижченаведеному: обстеженні суб'єкта, який цього потребує, отриманні фармацевтичної композиції, що містить гастрорезистентні мікрогранули рифаксиміну в кристалічній або аморфній формі, де мікрогранули мають діаметр від приблизно 1 мікрону до приблизно 900 мікронів, мікрогранули містять полімери, нерозчинні при величинах рН між 1,5 та 4,0, та розчинні при величинах рН між 5,0 та 7,7, та пероральному прийомі композиції суб'єктом. 17. Спосіб за п. 16, де принаймні частина рифаксиміну вивільняється у шлунку, тонкому кишечнику, товстому кишечнику та прямій кишці. 18. Спосіб за п. 16, де суб'єкт потерпає від стану, вибраного з коліту, хвороби Крона та синдрому подразненого кишечника. 19. Спосіб за п. 18, де значення С-реактивного білка у пацієнтів, які потерпають від хвороби Крона, є вищим за стандартне. 20. Спосіб одержання фармацевтичної композиції, яка містить гастрорезистентні мікрогранули рифаксиміну в кристалічній або аморфній формі, де: мікрогранули мають діаметр від приблизно 1 мікрона до приблизно 900 мікронів, та мікрогранули містять полімери, нерозчинні при величинах рН між 1,5 та 4,0, та розчинні при величинах рН між 5,0 та 7,7; спосіб полягає у розпиленні через форсунку водної суспензії, яка містить рифаксимін, гастрорезистентний полімер та фармацевтичні ексципієнти в апараті з псевдозрідженим шаром, де напилювання здійснюють під тиском між 1,0 та 1,5 бар та при швидкості потоку між 150 та 300 г/хвилину, та де рифаксимін утримують у водній суспензії у суспендованому стані потоком гарячого повітря. Об'єктом винаходу є фармацевтичні композиції, що містять рифаксимін у формі мікро-гранул, зроблених гастрорезистентними полімером, нерозчинним при величинах рН між 1,5 та 4,0, та розчинним при величинах рН між 5,0 та 7,5, їх отримання та їх застосування у виробленні медичних препаратів, корисних у лікуванні запальної хвороби кишечнику (ЗХК), а головним чином хвороби Крона. 5 Кишковий апарат вражають багато запальних хвороб, загалом відомих як запальні хвороби кишечнику. Зокрема, хвороба Крона є суворою хронічною запальною хворобою, що вражає різні рівні травного тракту від рота до анусу, особливо можна спостерігати в останній частині тонкої кишки, будь-чому зі здухвинної кишки, ободової кишки або обох, а іноді у слизовій мембрані ободової кишки та у анального регіону також. У причетній кишковій частині запалення, набрякання та утворення виразок відбувалося по всій кишковій стінці, викликаючи стеноз, виразки з кровотечею та біль, а не вражені частини тканин виявляються нормальними. Хвороба Крона показує чергування періодів запальних симптомів різної тяжкості із симптомами, як-то: діарея, абдомінальний біль, втрата маси, часто супроводжувана тріщинами шкіри або периректальними фістулами. Від двох третіх до трьох четвертих пацієнтів з хворобою Крона потребують хірургії у деякі моменти у їх житті. Хірургію застосовують для послаблення симптомів, що не реагують на медичну терапію або для корекції ускладнень, як-то блокування, перфорація, абсцес або кровотеча у кишечнику. Роль кишкової бактеріальної флори у етіопатогенезі кишкових запальних хвороб, а зокрема у хвороб Крона є доказаною, наприклад, частотою локалізації у зонах з високою концентрацією бактерій, дивись Jannowitz, Н.D., у lnflamm. Bowel Dis., 1998, 44, 29-39; відхилення руху фекалій визначає ремісію ендоскопічних пошкоджень, котрі знов виявляються при реабілітації каналізації, дивись Rutgeerts, P., Lancet, 1991, 338, 771-774; експериментальні моделі, наприклад, нокаутні миші стосовно гена IL-10 або інші, показують, що спонтанний коліт не розвивається якщо підтримують "позбавлений мікробів" стан, дивись Blumberg R.S., Curr. Оріп. Immunol., 1999, 11(6), 648-56; запалення кишкової слизової мембрани розвивається після контакту із фекаліями, дивись Harper P.H., Gut 1985, 26(3), 279-84; після хірургічного "цілющого" лікування, яке полягає у ілеоколоанастомозі, лікування антибіотиками затримує розвиток ендоскопічних та клінічних рецидивів, дивись Cameron J.L. у Ann.Surg., 1992, 215, 546-52; а присутність фістул або точок абсцесу-кісти гасить наступний бактеріальний внесок у розвиток хвороби. Хворобу Крона раніше лікували ліками, що здатні знижувати або контролювати запалення, якто, кортизони, салазоприн, мезалазин, імуносупресори, специфічні хемотерапевтичні засоби, антибіотики та інгібітори білків дії фактору некрозу пухлини (TNF). Протягом лікування гострої фази запальної хвороби кишечнику, сильніше лікування є часто обов'язковим для гарантування парентерального підкріплення для відтворення втрати білків, рідини та солей, для дозволу кишечнику відпочити для полегшення загоєння виразок. Метою терапії є зниження частот повторного виявлення симптомів та зменшення серйозності гострих епізодів, коли вони виявляються. Однак, при сучасній терапії, гострі епізоди реагують у приблизно 50-70% випадків, але рецидиви відбувалися у 80% пацієнтів. 90881 6 Антибіотики звичайно застосовують для зниження росту люмінальних бактерій; для зниження запального стану підтримуваного в результаті бактеріального росту; для зменшення симптомів гострої фази хвороби, як-то, діарея, кишковий біль та метеоризм; та для попередження та зцілення септичних ускладнень, як-то, абсцеси, фістули та токсичний стан. Найбільш часто застосовуваними антибіотиками є систематично абсорбовані, наприклад, метронідазол (активний проти деяких паразитів разом з багатьма анаеробними бактеріями) та ципрофлоксацин (активний проти таких же бактерій як Е. CoIi та аеробні кишкові бактерії). Метронідразол застосовано у дозі 10-20мг/кг/добу протягом 4 місяців (Sunterland, L. Gut, 1991 32, 1071-5), ципрофлоксацин застосовано у дозі 1000мг/добу протягом 6 тижнів (Colombel J.F. у Am.J. Gastoentherol., 1999, 94, 674-8), a Prantera у Am. J. Gastoentherol., 1996, 91, 328-32, застосовував комбінацію двох антибіотиків, застосовуючи метронідазол у дозі 1000мг/добу та ципрофлоксацин у дозі 1000мг/добу протягом 12 тижнів. Висока системна біологічна засвоюваність цих антибіотики є відміченою разом з їх високою побічною дією у довготерміновій терапії, котра негативно впливає на їх застосування. Випадки побічної дії при застосуванні метронідазолу є у межах від 10% до 20%, залежно від дози та тривалості лікування. Найбільш часто побічна дія охоплює металічний смак, шлункова нестерпність, нудота, запалення язика, цефалія, запаморочення, атаксія, конвульсії та нейротоксичність. Периферійну нейропатію зареєстровано у 50-85% довготерміново лікованих пацієнтів, вона може регресувати тільки після кількох місяців терапевтичної перерви. Процент побічної дії, описаний у дослідженнях ципрофлоксацину, є змінним та залежить частково від дозування та тривалості лікування. Найбільш часто побічна дія має шлунково-кишкове походження, але збільшення трансамінази та реакції шкіри також часто описують. Таким чином, є потреба у рівні техніки у альтернативному довготерміновому лікуванні запальних хвороб травного тракту, наприклад, шлунково-кишкових патологій. Сприятливим є для фармацевтичного препарату, застосовуваного для лікування запальних хвороб кишечнику (наприклад, шлунково-кишкових патологій), на основі антибіотиків мати одну чи більше з таких характеристик: активність на кишковому рівні, низьке поглинання, контроль рівня бактерій у кишковій порожнині, широкий спектр дії проти мікробів (як-то, кишкові Грам-позитивні, Грам-негативні, аеробні та анаеробні компоненти), можливість довготермінової терапії без побічної дії, легкість застосування для полегшення схвалення навіть із потенційною необхідністю високого дозування, як-то, довготермінове дозування та/або багатократне дозування на добу. Антибіотиком, що виявляє кілька цих характеристик є рифаксимін (INN; дивись The Merck Index, XIII Ed., 8304), котрий характеризується широким спектром дії проти багатьох Грам-позитивних та Грам-негативних бактерій, охоплюючи аеробні та анаеробні бактерії. Біологічна засвоюваність у 7 дослідженнях на здорових волонтерах показали, що при пероральному застосуванні менше 1% рифаксиміну поглинається і він концентрується у кишковій порожнині та у фекаліях, що описано тут (Descombe J.J. et al. Pharmacokinetic study of rifaximin after oral administration in healthy volunteers. Int J Clin Pharmacol Res, l£ (2), 51-56, (1994)). Відсутність поглинання рифаксиміну підтверджено у пацієнтів, вражених хронічною хворобою кишечнику, (дивись Rizzello, Eur. J. Clin. Pharmacol.(1998) 54, 91-93). Більш того, низький профіль поглинання рифаксиміну зменшує випадки побічної дії та небажаного ризику фармакологічної взаємодії. Таким чином, рифаксимін можна розглядати як корисний у терапії запальної хронічної хвороби кишечнику, а особливо у хворобі Крона. Потенційна ефективність рифаксиміну у хронічній запальній хворобі кишечнику підтверджено, дивись Gionchetti, P., Dig. Dis. ScL, 1999, 44, 12201, хто припустив застосування рифаксиміну у пацієнтів із помірним або суворим виразковим колітом, непокірливим до лікування стероїдами. Рифаксимін описано у патенті Італії IT 1154655 (1980) та патенті EP 0161534 (1985), які уведені як посилання. EP 016153 розкриває спосіб продукування рифаксиміну, застосовуючи рифаміцин O як вихідний матеріал (The Merck Index, XIII Ed., 8301). Інструкції стосовно кристалізації та сушки рифаксимін описані у патентній заявці Італії № МІ2003А002144 (2003), в Європейській патентній заявці № EP 1557421 (2003); у патентній заявці США №10/728,090 (2003) у патентній заявці PCT № WO2005/044823; усі які уведені як посилання. Експериментальні умови, описані у цих патентах, дають поліморфні форми рифаксиміну, названі Форма , Форма , Форма , Форма та Форма , відповідно. Рифаксимін узгоджено у деяких країнах для лікування патологій, чия етіологія є частково або загалом наслідком кишкової гострої та хронічної інфекції, підтримуваної Грам-позитивними та Грам-негативними бактеріями, із синдромами діареї, зміненої кишкової мікробної флори, діареї типу літньої, діареї мандрівників та ентероколіту; профілактики до та після хірургії інфекційних ускладнень у шлунково-кишковій хірургії; та терапії гіперамоніемії як помічнику. Рифаксимін зараз продають як таблетки або капсули у дозі 100мг та 200мг, у готовому до застосування препараті для дітей, або як мазь для лікування місцевих інфекцій. Дослідження на комерційно доступних зразках, особливо таблетках 200мг, показали потенціальну корисність рифаксиміну у попередженні рецидиву хвороби Крона після ендоскопічної резекції. Однак, відсутність плацебо-груп у клінічних умовах не дає зробити упевнені висновки, дивись Rizzello, Gut, 2000, 47, Supp. 3, А12. Однак, вчення про застосування ліків підказує, що таблетки рифаксиміну 200мг треба розглядати субоптимальними внаслідок потреб аж до 6 таблеток/добу протягом 3 місяців, призводячи до поганого схвалення пацієнтами. Таблетки рифаксиміну 200мг також застосовувані у лікуванні хвороби Крона із дозу 90881 8 ванням 600мг/добу протягом 16 тижнів, як описано Shafran, I., Am. J. Gastroenterol., 2003, 98 (Suppl.) S-250. Таким чином, у рівні техніки є потреба у фармацевтичній композиції рифаксиміну для лікування інфекцій, особливо локалізованих у кишковому тракті. Попередні композиції після застосування вивільняються та поширюються між шлунком та кишечником. Таким чином, коли рифаксимін зрештою досягає кишкового тракту, концентрація є настільки низькою, що потребує збільшення дозування. Для максимізації терапевтичної ефективності рифаксиміну у лікуванні хвороб кишечнику тут запропоновано нові фармацевтичні композиції, які охоплюють, наприклад, мікрогранули рифаксиміну, покриті гастрорезистентною плівкою, котра розчиняється, вивільняючи антибіотик тільки у кишковому тракті. Ця нова композиція максимізує контакт між активним інгредієнтом та кишковою слизовою частково внаслідок високої зовнішньої площі мікрогранул. Нові композиції також надають легкості застосування високих та низьких доз, наприклад, при педіатричному застосуванні. Нові гастрорезистентні композиції рифаксиміну дають перевагу тим, що відмінність рН між шлунковим середовищем (наприклад, величиною приблизно від 1,5 до 4,0, залежно від присутності їжі) та кишковою порожниною (наприклад, величиною від 5,0 до 7,5, залежно від розгляденого тракту). Нові форми також можуть містити поліморфні форми рифаксиміну. Покриття фармацевтичних мікрогранул гастрорезистентною плівкою відоме багато років у фармацевтиці. Це загалом проводять у два етапи: гранулювання та покриття. Однак, багато активних речовин, охоплюючи рифаксимін, характеризуються дуже дрібним розміром частинок, наприклад, у випадку рифаксиміну приблизно 50% частинок має діаметр частинок між 10мкм та 40мкм. У таких умовах дуже важко застосовувати звичайні системи типу покриття у псевдозрідженому шарі або лоткову технологію. Дуже часто відбувається агломерація або звичайно отримують довільну суміш покритих та непокритих частинок. Ми виявили, і це є об'єктом винаходу, що можливо отримувати мікрогранули рифаксиміну з кишково-розчинним покриттям застосуванням технології псевдозрідженого шару, що несподівано відбувається одним етапом, а у той же час проводити вологе гранулювання порошку та покриття утворених мікрогранул полімером, резистентним до шлункового середовища, звичайно під назвою кишково-розчинне покриття. Із цим підходом мінімізують головні недоліки вологого гранулювання та покриття мікрогранул, котрі відбуваються окремими етапами, а також час та працю, обов'язкові для виконання усього процесу, особливо у великому масштабі. Це є результатом комбінації властивостей рифаксиміну та збалансованої кількості рифаксиміну, кишково-розчинного полімеру, пластифікатору та параметрів процесу. Ефективність цієї технології у забезпеченні повного покриття рифаксиміну продемонстровано СЕМ-мікроскопією як показано у Фіг.1а (Сканува 9 льна електронна мікроскопія гастрорезистентних мікрогранул рифаксиміну) та 1b (Сканувальна електронна мікроскопія одної гранули з мікрогранул рифаксиміну), де ясно показано, що рифаксимін повністю покрито кишково-розчинним полімером. Розмір частинок є цілком гомогенним без великих грудок або дуже дрібного порошку. При наявності одного або обох з цих аспектів міг би бути негативний вплив у будь-якому наступному медичному препараті. Як підтвердження повноти покриття, профіль розчинення гастрорезистентних мікрогранул рифаксиміну показує, що рифаксимін повністю залишається при низькому рН та вивільняється при рН вище 5,0, як показано у Фіг.2 (Профілі розчинення). Для максимізації вивільнення активного інгредієнту поблизу мембран кишкової слизової застосовано високу відмінність рН між шлунковим середовищем, величини від 1,5 до 4,0 залежно від стану голодування або у присутності їжі, та кишковою порожниною, величини 5,0-7,5 залежно від розгляданих трактів. Для цієї мети застосовано кишково-розчинні полімерні матеріали, що мають властивість розчинятися при величинах рН між 5,0 та 7,5, і охоплюють: копо-лімери метакрилової кислоти з акриловим або метакриловим естером типу кополімеру мета-крилова кислотаетилакрилат (1:1) та кополімеру метакрилова кислота-етилметакрилат (1:2), полівініл-ацетатфталат, гідроксипропілцелюлоза-ацетат-фталат та целюлоза-ацетат-фталат, продукти комерційно доступні, наприклад, під торговою маркою KОLLIСОАТ®, EUDRAGIT®, AQUATERIC®, AQOAT®. Нанесення цих гастрорезистентних плівок на порошок або гранули рифаксиміну проводять у звичайній апаратурі для покриття у псевдозрідженому шарі. Плівку покриття, розчинену в органічних розчинниках або суспендовану у воді, застосовують напилюванням на порошки або гранули, підтримувані у суспензії повітрям у псевдозріджених системах. Найбільш застосовуваними органічними розчинниками є: метиленхлорид, метиловий спирт, ізопропіловий спирт, ацетон, триетилацетат та етиловий спирт. Альтернативно, полімерний гастрорезистентний матеріал можна застосовувати суспендованим у воді. Цей спосіб є переважним, оскільки це не потребує застосування розчинників та таким чином позбавляє від проблем пов'язаних з токсичністю та безпечністю. Інші наповнювачі з антіагломеративними властивостями, типу тальку; пластифікувальними властивостями, типу ацетилованих гліцеридів, діетилфталату, пропіленгліколю та поліетиленгліколю; сурфактанти типу полісорбату та поліоксіетиленатних естерів, антиспінюваль-ні, а також антизлипальні засоби можна додавати разом з полімерним матеріалом. Успішне застосування вищезгаданої технології для покриття порошку рифаксиміну є чудовим, оскільки у рівні техніки технології псевдозрідженого шару нема напилювання кишково-розчинного полімеру безпосередньо на активний інгредієнт без будь-якої попередньої обробки типу гранулю 90881 10 вання або нашарування активного інгредієнту на інертні частинки. Безумовно, кілька вад могли б відбуватися без будь-якої попередньої обробки порошку, як-то утворення великих буртів, частинок великого діаметру, негомогенної композиції мікрогранул, відсутність однорідного шару покриття. Випадки деяких цих вад є звичайними для рифаксиміну, порошок якого складається з дрібних частинок, та є надзвичайно гідрофобним, електростатичним, гігроскопічним та важким для змішування із звичайними наповнювачами. Більш того має схильність до сегрегації без утворення гомогенної суміші. При таких несприятливих характеристиках, щоб отримувати покритий рифаксимін, потрібні більше одного етапу та велика кількість наповнювачів, котрі обмежують дозування людині. Як наступна перевага заявленого винаходу, гастрорезистентні мікрогранули рифаксиміну, отримані на основі описаної технології заявленого винаходу, можна застосовувати безпосередньо для заповнення капсули або можуть бути змішаними із наповнювачами та підсолоджувачами даючи можливість застосування суспензії у воді. На додаток та найвищою мірою гастрорезистентні мікрогранули рифаксиміну можуть також бути безпосередньо застосовуваними для отримання таблеток безпосереднім пресуванням з додаванням звичайних наповнювачів або носіїв. Як додаткова перевага, таблетки можуть бути надрізаними для модуляції дози або для руйнування для полегшення ковтання без втрати гастрорезистентних властивостей мікрогранул. Усі ці можливості надають значних переваг технології, описаній у заявленому винаході для отримання гастрорезистентних мікрогранул рифаксиміну, роблячи її придатною для широкої модуляції дозувань та фармацевтичних форм. Як висновок, заявлений винахід показує чудове поліпшення відносно інших продажних препарати рифаксиміну, що можна резюмувати як можливість вироблення тільки одним етапом гастрорезистентних мікрогранул рифаксиміну, котрі залишаються нерозчинними у шлунку (наприклад, при рН приблизно між 1,5 та приблизно 4,0) та розчинними у кишечнику (наприклад, при вищих рН, наприклад, приблизно між 5,5 та приблизно 7,5.), для застосування високих доз, досягнення максимуму вивільнення активного інгредієнту у кишечнику, а у той же час максимізації його контакту з мембраною кишкової слизової внаслідок високої зовнішньої площі мікрогранул. Об'єктом заявленого винаходу є фармацевтичні композиції, що містять мікрогранули рифаксиміну, покриті гастрорезистентним полімером, котрі нерозчинні при величинах рН між 1,5 та 4,0 та розчинні при величинах рН між 5,0 та 7,5, їх отримання та їх застосування при кишкових запальних хворобах кишечнику та зокрема при хворобі Крона. Мікрогранули можуть бути від приблизно 1 мікрон до 900 мікрон у діаметрі, або більш переважно від приблизно 10 мікрон до 500 мікрон у діаметрі. Гастрорезистентність можна отримувати, застосовуючи будь-який матеріал, нерозчинний при 11 величинах рН приблизно 1-4,9, приблизно 1,4-4,2, або приблизно 1,5-4,0. Придатні полімери можуть також бути розчинними при величинах рН у межах приблизно 5,0-7,0, 5,0-7,5, або 5,0 та приблизно 7,7 і вище. Полімерні матеріали, застосовувані у гастрорезистентних композиціях рифаксиміну розчиняються, як обговорено вище, при величинах рН у кишковій порожнині, наприклад, приблизно 4,9-7,7, та їх можна застосовувати як гастрорезистентні, кишково-розчинні покриття для вивільнення ліків у кишечнику, коли бажано. Приклади придатних полімерних матеріали охоплюють, наприклад, кополімери метакрилової кислоти з акриловим або метакриловим естером типу кополімеру метакрилова кислота-етилакрилат (1:1) та кополімеру метакрилова кислота-етилметакрилат (1:2), полівінілацетат-фталат, гідроксипропілцелюлоза-ацетатфталат та целюлоза-ацетат-фталат, продукти комерційно доступні, наприклад, KOLLIКОАТ®, EDRAGIT® (наприклад, EUDRAGIT 40), AQUATERIC®, AQOAT®. Кишково-розчинні матеріали, котрі розчиняють при вищих величинах рН, часто застосовують для системи специфічної доставки до ободової кишки та є працездатними у гастрорезистентних композиціях рифаксиміну, описаних тут. Застосовувані кишково-розчинні полімери можна також модифікувати змішуванням з іншими матеріалами покриття, що не є рН-чутливими. Приклади матеріалів покриття охоплюють, наприклад, нейтральні естери метакрилової кислоти з невеликою частиною триметиламоніоетилметакрилат хлориду під товарним знаком EUDRAGIT® та EUDRAGІT® RL; дисперсія нейтрального естеру без будь-яких функціональних груп під товарним знаком EUDRAGIT® NE30D та EUDRAGIT® NE30, EUDRAGIT® 40; полісахариди, типу амілози, хітозану, хондроїтин сульфату, декстрану, гуарової камеді, інуліну та пектину; та інші незалежні від рН матеріали покриття. Полімером є приблизно 5%-75% маси мікрогранули. В інших втіленнях полімер є у кількості від приблизно 10% та приблизно 60%, 20% та приблизно 55%, приблизно 30% до 80%, або 25% та приблизно 50% маси мікрогранули. Mac-процент полімеру стосовно маси мікро-гранули може частково залежати від застосовуваного полімеру, температури полімеру, композиції (як-то, пакет, пілюля, капсул, тощо), та рН, при котрому полімер розчиняється. Гастрорезистентні мікрогранули рифаксиміну можуть крім того містити один або більше розріджувачів, пластифікаторів, антиагломеративних засобів, антизлипальних засобів, ковзних засобів, антиспінювальних сурфактантів або барвників. Це разом з іншими полімерами та покриттями (наприклад, захисними покриттями, зверх-покриттями, та плівками) описані нижче. Придатні інгредієнти можна уводити у композицію покриття, а саме пластифікатори, котрі охоплюють, наприклад, адипати, азелати, бензоати, цитрати, ізоебукати, фталати, себацинати, стеарати та гліколі. Представлені пластифікатори охоплюють ацетиловані моногліцериди, бутилфталат 90881 12 бутилгліколят, дибутилтартрат, діетилфталат, диметилфталат, етилфталілетил-гліколят, гліцерин, етиленгліколь, пропіленгліколь, триацетин-цитрат, триацетин, трипропіноїн, діацетин, дибутилфталат, ацетилмоногліцерид, поліетиленгліколі, рицинову олію, триетилцитрат, багатоатомні спирти, ацетат естери, гліцерин триацетат, ацетилтриетилцитрат, дибензи-лфталат, дигексилфталат, бутил-октилфталат, діізононілфталат, бутилоктилфталат, діокти-лазелат, епоксидований тапат, триізоктилтримелітат, діетилгексилфталат, дін-октилфталат, ді-1-октилфталат, ді-1децилфталат, ді-н-ундецилфталат, ді-нтридецилфталат, три-2-етилгексил тримелітат, ді2-етилгексиладипат, ді-2-етилгексилсебацинат, ді2-етилгексилазелат, дибутилсебацинат, гліцерилмонокаприлат та гліцерилмонокапрат. Інші різні шари, які відомі спеціалісту, передбачено також. Кількість пластифікатору, застосовуваного у полімерному матеріалі, звичайно є приблизно від 10% до 50%, наприклад, приблизно 10, 20, 30, 40, або 50%, на основі маси сухого полімеру. Довільні модифікувальні компоненти захисного шару, котрі можна застосовувати зверх кишково-розчинного або іншого покриття, охоплюють водонепроникний шар (напівпроникний полімер), котрий може бути послідовно нанесеним після кишково-розчинного або іншого покриття для зменшення швидкості проникнення води через шар кишково-розчинного покриття та таким чином збільшення часу затримки вивільнення ліків. Покриття, звичайно відомі спеціалісту, можна застосовувати для цієї мети способами нанесення, як-то нанесення у псевдозрідженому шарі, застосовуючи розчини полімерів у воді або придатних органічних розчинниках, або застосуванням водної дисперсії полімеру. Наприклад, корисні матеріали охоплюють ацетат целюлози, ацетат-бутират целюлози, ацетат-пропіонат целюлози, етилцелюлозу, жирні кислоти та їх естери, воски, зеїн та водні дисперсії полімерів, як-то EUDRAGIT® RS та RL 30D, EUDRAGIT® NE30D, EUDRAGIT® 40, AQUACOAT® SURELEASE®, латекс ацетату целюлози. Комбінації полімерів та гідрофільних полімерів, як-то гідроксіетилцелюлоза, гідрокси п роп ілцелюлоза (KLUCEL®, Hercules Corp.), гідроксипропілметилцелюлоза (METHOCEL®, Dow Chemical Соф.), полівінілпіролідон можна застосовувати також. Антиспінювальні засоби можна також уводити у гастрорезистентні композиції рифаксиміну. В одному втіленні антиспінювальним засобом є симетикон. Кількість антиспінювального застосовуваного засобу звичайно від 0%-0,5% кінцевої композиції. Інші засоби можна додавати для підвищення легкості обробки ущільнювального або бар'єрного шару. Так засоби охоплюють, наприклад, тальк, колоїдний діоксид силіцію, полівініловий спирт, титан діоксид, мікроізований діоксид силіцію, аеросил, гліцерин моностеарат, магній трисилікат та магній стеарат або їх суміш. Кількість полімеру для застосування у гастрорезистентних композиціях звичайно підганяють для досягнення бажаних властивостей доставки ліків, охоплюючи кількість ліків, що треба достави 13 ти, швидкість та локалізацію доставки ліків, час затримання вивільнення ліків, та розмір множинності частинок у композиції. Комбінація усіх твердих компонентів полімерного матеріалу, охоплюючи кополімери, наповнювачі, пластифікатори та довільні наповнювачі та допоміжники обробки, звичайно стосується приблизно 1%-50% маси серцевини. Гастрорезистентні мікрогранули рифаксиміну містять рифаксимін у поліморфній формі та/або необробленій формі. Форми у будь-якій мікрогранулі можуть бути сумішшю або чистою формою. Форма рифаксиміну може частково залежати від форми рифаксиміну, що є покритою, композиції наповнювачів та способу, застосовуваного для утворення мікрогранул. Поліморфні форми рифаксиміну вибрані з Форми , Форми , Форми , Форми , або Форми рифаксиміну, згаданих вище. Суміш, що містить гастрорезистентний матеріал, отримують суспендуванням компонентів у демінералізованій воді та гомогенізуванням суспензії системою з високою швидкістю змішування, переважно гомогенізатором Ultra Тurах, для отримання гомогенної суспензії, що містять 15%-30% твердих частинок. Гомогенну суспензію, що містить гастрорезистентний матеріал, можна застосовувати засобами або апаратурою нанесення у псевдозрідженому шарі. У заявленому винаході застосовано технології псевдозрідженого шару. Суміш з активним інгредієнтом підтримують у суспензії потоком гарячого повітря, у той же час гастрорезистентну суспензію напилюють форсункою у верхній частині (верхнє напилювання) або у нижній частині (донне напилювання - система Wurster) апаратури. Наприклад, апаратуру покриття у псевдозрідженому шарі типу Glatt GPG 30 застосовано із системою Wurster 18 дюймів із форсункою для напилювання 1,8мм. Параметри процесу, охоплюючи температуру вхідного повітря, температуру продукту та швидкість нанесення плівки є особливо контрольованими. Швидкість нанесення плівки та температуру повітря збалансовують для позбавлення від перегріву продукту, утвореного у негомогенній композиції гастрорезистентних мікрогранул (надто швидка сушка продукту) або агломерації суміші, яку треба покрити, для уповільнення сушки продукту. У композиції, наприклад, партії 25кг гастрорезистентного рифаксиміну, можна застосовувати напилювання форсункою між 150 та 300г/хвилину. Напилювання форсункою 150 та 250г/хвилину, та тиски між 1,0 та 1,5 бар можна застосовувати також. Швидкістю та тиском можна маніпулювати незалежно. Температуру продукту протягом напилювання підтримують постійною приблизно між 20°C та приблизно 40°С. Температуру повітря на вході можна також регулювати приблизно між 40°С та приблизно 75°C, переважно приблизно між 60°C та приблизно 70°C Отримані гастрорезистентні мікрогранули створюють для медичних препаратів для отримання після додавання води суспензії із приємним смаком для пацієнтів. Підсолоджувачі типу: сахароза, сорбітол, манітол, сахарин, ацесульфам, неогеспередин; суспендувальні засоби типу: полі 90881 14 вінілпіролідон (ПВП), натрійкарбоксиметилцелюлоза, пектин, ксантанова камедь, агар та ковзні засоби типу силікагелю можна додавати до гастрорезистентних мікрогранул до цього кінця. Гастрорезистентні мікрогранули змішують з вищезгаданими наповнювачами у придатній апаратурі типу біконічного змішувачу або V-змішувачу протягом часу обов'язкового для отримання гомогенності суміші гастрорезистентних мікрогранул. Співвідношення між гастрорезис-тентними мікрогранулами та наповнювачами є між 1:0,1 та 1:10, переважно між 1:0,5 та 1:5. Отриману суміш можна розподіляти у пакети, що містять кількість рифаксиміну між 1мг та 3000мг, переважно між 50мг та 800мг. Отримані гастрорезистентні мікрогранули рифаксиміну можна безпосередньо пресувати у таблетки після змішування з доречними наповнювачами, як-то розріджувачі, як-то дикальцій фосфат, кальцій сульфат, целюлоза, мікрокристалічна целюлоза (AVICEL®), гідроксипропілметилцелюлоза, кукурудзяний крохмаль, лактоза, каолін, манітол, натрій хлорид, сухий крохмаль; зв'язуючі, як-то крохмаль, желатин, цукри як-то сахароза, глюкоза, декстроза, лактоза, синтетична камедь, натрій альгінат, карбоксиметилцелюлоза, метилцелюлоза, полівінілпіролідон, поліетиленгліколь, етилцелюлоза, вода, воски, спирт; лубриканти, як-то тальк, магній стеарат, кальцій стеарат, стеаринова кислота, гідрогеновані рослинні олії, поліетиленгліколь; ковзних засобів, як-то колоїдний силіцій діоксид, тальк; дезінтегратори, як-то кукурудзяний та картопляний крохмаль, кроскармелоза, кросповідон, натрій-крохмальний гліколят, барвники, підсолоджувачі, як-то сахароза, сорбітол, манітол, сахарин, ацесульфам, неогеспередин. Звичайну технологію та апаратуру, відомі спеціалістам з отримання таблеток можна застосовувати. Гастрорезистентні мікрогранули змішують з вищезгаданими наповнювачами у придатній апаратурі типу біконічного змішувачу або V-змішувачу протягом часу, обов'язкового для отримання гомогенності суміші гастрорезистентних мікрогранул. Гастрорезистентні гранули рифаксиміну мають гарні властивості стосовно здатності вільно струменіти, когезійної здатності та змащувальної здатності, тому співвідношення між гастрорезистентними мікрогранулами та наповнювачами є між 1:0,2 та 1:0,05, переважно між 1:0,15 та 1:0,1. Отриману суміш можна пресувати для отримання таблеток, що містять кількість рифаксиміну між 50мг та 600мг, переважно між 100мг та 500мг, застосовуючи придатний пуансон. Як описано вище, сприятливі властивості гастрорезистентних мікрогранул рифаксиміну дають досягнути придатної суміші для безпосереднього пресування з додаванням мінімальної кількості наповнювачів. Можливість отримання таблеток, застосовуючи суміш, що містить аж до 93% гастрорезистентних мікро гранул, дає наступну перевагу: це підтримує дозу 400мг у придатному розмірі для гарного схвалення пацієнтом. 15 90881 Таблетки можуть бути послідовно покритими звичайною гідрофільною плівкою для досягнення властивості маскування смаку та поліпшення вигляду. Придатними матеріалами можуть бути: гідроксіетилцелюлоза, гідроксипропілцелюлоза (KLUCEL®, Hercules Corp.), гідроксипропілметилцелюлоза (METHOCEL®, Dow Chemical Corp.), полівінілпіролідон. Таблетка, що містить гастрорезистентні мікрогранули рифаксиміну, може бути крім того покритою плівкою звичайним способом, відомим спеціалісту, вибираючи як полімер одне або більше з целюлози та її замінників, як-то гідропропілцелюлоза, гідрометилцелюлоза, гідропропілметилцелюлоза. Альтернативами етерам целюлози є деякі акрилові кополімери, як-то метакрилатні та метилметакрилатні. Полімери можна застосовувати як розчини у системі на основі водного або органічного розчиннику. Уведенням пластифікатору підвищують гнучкість плівки покриття; додаванням пластифікаторів зменшують ризик розриву плівки та підвищують адгезію плівки до субстрату. Приклади звичайних пластифікаторів охоплюють гліцерин, пропіленгліколь, поліетиленгліколь, триацетин, ацетиловані моногліцериди, цитратні естери та фталатні естери. Барвники звичайно застосовують для поліпшення вигляду продукту. Водорозчинні та/або розчинні в органічному розчиннику барвники типу альбумінового лаку, титан діоксиду, ферум оксиду можна застосовувати. Зрештою, стабілізатори, як-то ЕДТА, можна додавати до покриття. Картинка, показана у Фіг.3 (Сканувальна електронна мікроскопія гастрорезистентних мікрогранул рифаксиміну, спресованих у таблетки) та дані Фіг.2 показують, що пресування не змінює цілісності гастрорезистентного шару мікро гранул, спресованих у таблетки. Крім того отримані гастрорезистентні мікрогранули рифаксиміну мають такі сприятливі властивості стосовно розміру частинок та здатності вільно струменіти для безпосереднього застосу 16 вання з додаванням інертних розріджувачів та ковзних засобів для заповнення твердих желатинових капсул. Приклади звичайних розріджувачів охоплюють дикальцій фосфат, кальцій сульфат, целюлозу, мікрокристалічну целюлозу, гідроксипропілметилцелюлозу, кукурудзяний крохмаль, лактозу, каолін, манітол, натрій хлорид, сухий крохмаль, приблизно від 1 до 225мг. У цьому випадку густина гастрорезистентних мікрогранул, між 0,25 та 0,45мг/мл дає для заповнення приблизно 140250мг рифаксиміну звичайних 000 твердих желатинових капсул відповідно вмісту рифаксиміну у гастрорезистентних мікрогранулах. Усі медичні препарати, а саме термозварені пакети, таблетки та капсули можуть бути корисно застосовуваними у терапії запальної хвороби кишечнику, що охоплює хворобу Крона. Наступні приклади є ілюстрацією винаходу без його обмеження. Приклад 1 Препарат рифаксиміну у гастрорезистентних мікрогранулах В апаратуру покриття у псевдозрідженому шарі, Glatt GPC 30 із системою Wurster 18 дюймів з форсункою для напилювання 1,8мм, завантажують 25000г порошку рифаксиміну та 125г аеросилу як розріджувачу. Одночасно у змішувачі із струшуванням отримують суспензію застосовуючи 48107г демінералізованої води, 9281г кополімеру метакрилова кислота-етилакрилат під торговою маркою KOLLICOAT® МАЕ 100 Р, 1392г пропілгліколю, 2475г тальку, 557г титан діоксиду FU та 62г ферум оксиду E 172. Тверді компоненти суспензії гомогенно змішують у демінералізованій воді гомогенізатором високої швидкості (Ultra Turrax). Отриману суспензію подають у систему напилювання апаратури покриття у псевдозрідженому шарі та розпилюють при тиску між 1,0 та 1,5 бар, через форсунку 1,8мм на суміш порошку рифаксиміну та аеросилу 200, підтримувану у суспензії у псевдозрідженому шарі потоком гарячого повітря. Застосовані умови описані у таблиці 1: Таблиця 1 Параметри процесу 3 Потік повітря на вході (м /годину) Температура повітря на вході (°С) Температура продукту (°С) Тиск форсунки (бар) (початкова фаза) Швидкість форсунки (г/хвилину) Попередньо нагріта фаза 400±100 60±2 32 Отримані мікрогранули піддають гранулометричному аналізу за допомогою Light Scattering, застосовуючи апаратуру Malvern Mastersizer 2000, отримуючи наступні дані: 100% менше 200 мікрон 99,17% менше 150 мікрон 90,03% менше 100 мікрон 48,37% менше 50 мікрон 6,20% менше 10 мікрон Рифаксимін у препараті гастрорезистентних мікрогранул відповідає 61,4% загальної маси частинок. Застосування розчину покриття Сушка 550 ±100 60°С±10 25-27 1-1,5±0,1 150-200 350±50 50±2 30±2 Приклад 2 СЕМ-мікроскопія гастрорезистентних мікрогранул рифаксиміну Прилад SEM Philips 515 застосовують для спостережень. Гастрорезистентні мікрогранули рифаксиміну напилюють золотом при струмі 30мА, отримуючи шар Au приблизно 100нм. Застосовують прискорювальну напругу 15кВ. Відображення чисельно реєструють камерою CCD. Відображення мікрогранул рифаксиміну показане у Фіг.1А, а у Фіг.1В показана деталь одної мікрогранули. 17 90881 Приклад 3 Гастрорезистентні мікрогранули рифаксиміну, отримані у термозварених пакетах 9,12кг гастрорезистентних мікрогранул рифаксиміну, отриманих згідно з прикладом 1, 19,58кг сорбітолу, 0,49кг аспартаму, 0,21кг безводної лимонної кислоти, 2,10кг пектину, 2,10кг манітолу, 0,21кг неосперидину DC, 1,12кг вишневого арома 18 тизатору та 0,07кг силікагелю просівають на ситі з 0,5мм меш та тоді змішують протягом 20 хвилин у V-змішувачі. Утворену суміш розподіляють у термозварені пакети, що містять 5 грам продукту, відповідного 800мг рифаксиміну. У наступній таблиці 2 повідомлено про склад медичного продукту у термозвареному пакеті: Таблиця 2 Кількість Компоненти (мг) Гастрорезистентні мікрогранули рифаксиміну (відповідно 800мг рифаксиміну) Аспартам Безводна лимонна кислота Пектин Манітол Неосперидин DC Сорбітол Вишневий ароматизатор Силікагель Приклад 4 Гастрорезистентні мікрогранули рифаксиміну, отримані у спресованих таблетках 9,3кг гастрорезистентних мікрогранул рифаксиміну, отриманих згідно з прикладом 1, 593г натрій-крохмального гліколяту, 100г магній стеарату просівають на ситі з 0,5мм меш та тоді змішують % 1303 26,06 70 30 300 300 30 2797 160 10 1,40 0,60 6,00 6,00 0,60 55,94 3,20 0,20 протягом 20 хвилин у V-змішувачі. Утворену суміш пресують, застосовуючи обертовий таблетувальний пристрій (Fette 1200) з подовженими, надрізаними пуансонами 19×9мм при кінцевій масі 718мг (відповідно вмісту 400мг рифаксиміну). Про склад таблеток повідомлено у таблиці 3. Таблиця 3 Кількість Склад таблеток мг Гастрорезистентні мікрогранули рифаксиміну (відповідно 400мг рифаксиміну) натрій-карбоксиметилцелюлоза AvicelPHIOI Mg-стеарат Таблетки тоді покривають, застосовуючи звичайне лоткове обладнання, плівкою гідроксипропілметилцелюлози для поліпшення вигляду та маскування смаку. Про унітарний склад плівки повідомлено у таблиці 4: Таблиця 4 Покриття композиції HPMC Титан діоксид Na-ЕДТА Пропілен гліколь Червоний Ферум Оксид E 172 Кількість (мг) 14,07 4,10 0,05 1,37 0,41 % 650,00 90,53 34,95 24,31 8,74 718,00 4,87 3,34 1,21 100,00 Приклад 5 Гастрорезистентні мікрогранули рифаксиміну, отримані у твердій капсулі 9,0кг гастрорезистентних мікрогранул рифаксиміну, отриманих згідно з прикладом 1, змішують та просівають на 0,5мм із 110г тальку та 1,1кг лактози. Утворену суміш уводять у тверді желатинові капсули типу 000, застосовуючи звичайне обладнання типу Zanasi LZ64 при кінцевій масі 461,00, відповідно вмісту приблизно 270мг рифаксиміну. Про склад капсул повідомлено у таблиці 5. 19 90881 20 Таблиця 5 Кількість Склад капсул мг Гастрорезистентні гранули рифаксиміну (відповідно 270мг рифаксиміну) Тальк Лактоза Приклад 6 Розчинення медичних препаратів гастрорезистентних мікрогранул рифаксиміну Гастрорезистентність фармацевтичних препаратів визначають згідно описаному на стор.247 US Pharmacopeia (USP), 28а Ed. Тест розчинення медичних препаратів, що містять гастрорезистентні мікрогранули рифаксиміну, описані у прикладах 1, 3 та 4, що та складаються з гастрорезистентних мікрогранул рифаксиміну, термозварених пакетів, що містять гастрорезистентні мікрогранули рифаксиміну, та таблеток, що містять гастрорезистентні мікрогранули рифаксиміну, відповідно, визначають застосуванням на % 406,00 88,01 5,00 50,00 1,01 10,8 ступних умов: Обладнання: SOTAX АТ7 Smart Середовище: HCI 0,1 H, рН 1; через 2 години фосфатний буфер із 2% натрій лаурилсульфату додають для доведення рН впритул до 6,8 Швидкість перемішування: 100об/хвил. Температура: 37°С Час відбору зразків: 120, 135, 150, та 180 хвилин. Вміст рифаксиміну у розчині вимірюють за допомогою ВЕРХ. Дані, повідомлені у таблиці 6, є середніми з 6 вимірів та виражені як процент розчинення від загальної кількості рифаксиміну. Таблиця 6 Середовище та рН Час (хвилин) HCI 0,1 H, рН 1 Фосфатний буфер, рН 6,8 Фосфатний буфер, рН 6,8 Фосфатний буфер, рН 6,8 Фосфатний буфер, рН 6,8 120 135 150 165 180 Після 12 місяців зберігання при 25°С мікрогранули, отримані як у прикладі 1, показують подібний профіль розчинення, а саме розчинення 2,2% через 120 хвилин при рН 1 у 0,1H хлоридній кислоті та 91,1% через 60 хвилин у фосфатному буфері при рН 6,8. Приклад 7 Лікування хвороби Крона Медичний препарат рифаксиміну, що містить гастрорезистентні мікрогранули, описані у прикладі 3, застосовано у клінічному багатоцентровому рандомізованому дослідженні у порівнянні з плацебо у пацієнтів, вражених хворобою Крона. Задіяно 55 пацієнтів з хворобою Крона у гострій фазі, у фазі від слабкої до помірної, що мають величину CDAI (Індекс активності хвороби Крона) між 200 та 300. Первинну кінцеву точку було представлено процентом пацієнтів у клінічній ремісії, позначеній як CDAI нижче точки 150 у кінці дослідження. Паці Мікрогранули 2,41 93,8 95,4 97,2 97,4 Розчинення (%) Таблетки 1,07 67,9 81,6 88,1 93,1 Пакети 2,57 90,3 95,1 96,4 96,2 єнтів, рандомізованих у дві групи: група А, 27 пацієнтів та група В 28 пацієнтів, лікували протягом 12 тижнів згідно з наступною терапевтичною схемою: Група А: рифаксимін 800мг, застосовувано два рази на добу при загальному рівні дозування до 1600мг/добу; Група В: плацебо, застосовувано два рази на добу у кількості, що відповідає вмісту активної складової дози. Первинної кінцевої точки, клінічної ремісії після 12 тижнів терапії, досягають 51,9% пацієнтів з гастрорезистентною композицією та 32,1% пацієнтів, лікованих плацебо. Більш того, тільки один з пацієнтів групи, лікованої рифаксиміном, вимушено припинив клінічне дослідження внаслідок терапевтичного браку, при тому, що припинили лікування 9 пацієнтів, лікованих плацебо. Дані резюмовано у таблиці 7 Таблиця 7 Група А (рифаксимін) 27 пацієнтів В (плацебо) 28 пацієнтів Число клінічної ремісії 14 (51,9%) 9 (32,1%) Приклад 8 Лікування пацієнтів з хворобою Крона характеризується реактивною величиною білку C вище нормальної Число терапевтичного браку 1 (3,4%) 9 (32,1%) На початку лікування, 31 пацієнтів мали реактивну величину білку С, індекс запалення, по порядку вище нормального. Пацієнтів розподілили на дві групи: одну, 16 лікували рифаксиміном, а 21 інших лікували плацебо, як описано у прикладі 3. Первинну кінцеву точку, клінічну ремісію, отримано у 62,5% пацієнтів, лікованих новою 5 композицією рифаксиміну та тільки у 20,5% пацієнтів, лікованих плацебо. Більш того, жодного з 90881 22 пацієнтів з підгрупи, лікованої рифаксиміном, не відсторонювали від дослідження внаслідок терапевтичного браку, на відміну від 6 пацієнтів підгрупи, лікованої плацебо. Таблиця 8 показує отримані дані. Таблиця 8 Підгрупа із величиною білку C вище нормальної величини 16 пацієнтів, лікованих рифаксимін 15 пацієнтів, лікованих плацебо Випадки побічної дії подібні у двох групах, підтверджуючи чудову толерантність композиції ри Число клінічної ремісії Число терапевтичного браку 10 (62,5%) 3 (20%) 0 (0%) 6 (40%) факсиміну у безперервному та подовженому застосуванні. 23 Комп’ютерна верстка А. Рябко 90881 Підписне 24 Тираж 28 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюGastroresistant pharmaceutical formulations containing rifaximin
Автори англійськоюViscomi Giuseppe C., Palazzini Ernesto, Zamboni Villiam, Pantaleo Maria Rosaria
Назва патенту російськоюГастрорезистентная фармацевтическая композиция, которая содержит рифаксимин
Автори російськоюВискоми Джузеппе К., Палаззини Ернесто, Замбони Вилл'ям, Панталео Мария Росария
МПК / Мітки
МПК: A61P 1/00, A61K 47/30, A61K 31/44, A61K 9/16
Мітки: рифаксимін, містить, гастрорезистентна, фармацевтична, композиція
Код посилання
<a href="https://ua.patents.su/12-90881-gastrorezistentna-farmacevtichna-kompoziciya-shho-mistit-rifaksimin.html" target="_blank" rel="follow" title="База патентів України">Гастрорезистентна фармацевтична композиція, що містить рифаксимін</a>
Попередній патент: Спосіб визначення моменту комутації електричного комутаційного апарата (варіанти) і пристрій для його здійснення
Наступний патент: Швидкорозчленовуваний електроз’єднувач
Випадковий патент: Пристрій для лікування трубчастих нориць товстої кишки