Фармацевтична композиція, придатна для перорального введення, яка містить no-вивільняючі нспзл, лікарська форма, фармацевтична комбінація та способи лікування
Формула / Реферат
1. Фармацевтична композиція, придатна для перорального введення, яка містить
(і) NO-вивільняючі НСПЗЛ формули (І):
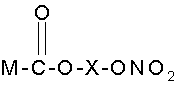 I,
I,
в якій спейсер X вибраний з лінійної, розгалуженої або циклічної алкіленової групи
-(СН2)n-, де n - ціле число від 2 до 10;
-(СН2)m-O-(CH2)p-, де m та р - цілі числа від 2 до 10;
та -СН2-pС6Н4-СН2-;
М вибраний з будь-якої наведеної нижче групи
 ,
,  ,
,
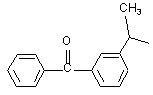 ,
,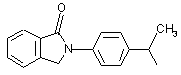 ,
,
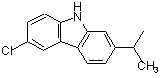 ,
,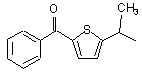 ,
,
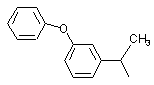 ,
,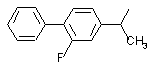 ,
,
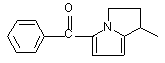 ,
,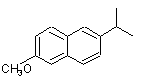 ,
,
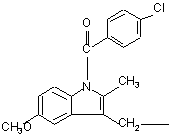 ,
,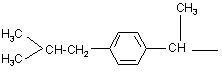 ,
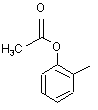
,
 ;
;
(іі) одну або більше поверхнево-активних речовин, у формі концентрату, здатного утворювати in-situ емульсію типу «масло-у-воді» при контакті з водними, зокрема шлунково-кишковими рідинами.
2. Фармацевтична композиція за п. 1, яка відрізняється тим, що містить олію або напівтвердий жир.
3. Фармацевтична композиція за п. 1, яка відрізняється тим, що містить один чи більше коротколанцюгових спиртів.
4. Фармацевтична композиція за будь-яким з попередніх пунктів, яка відрізняється тим, що NO-вивільняючі НСПЗЛ є будь-якою сполукою, вибраною з групи:
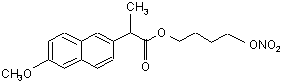 (Ia),
(Ia),
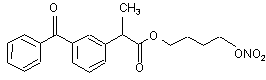 (Ib),
(Ib),
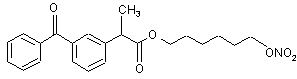 (Id),
(Id),
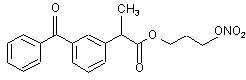 (Ic),
(Ic),
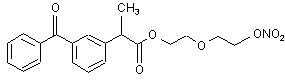 (Ie),
(Ie),
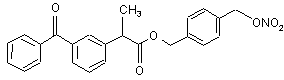 (If),
(If),
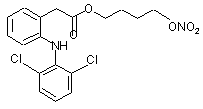 (Ig),
(Ig),
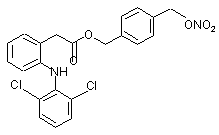 (Ii),
(Ii),
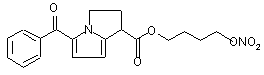 (Ij),
(Ij),
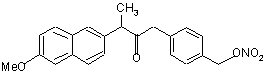 (Ik),
(Ik),
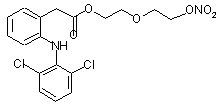 (IL),
(IL),
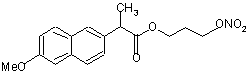 (Im),
(Im),
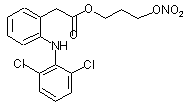 (In),
(In),
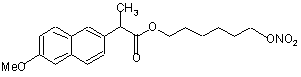 (Io),
(Io),
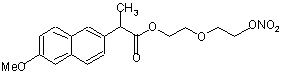 (Ip) та
(Ip) та
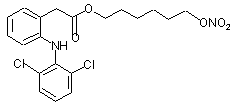 (Iq).
(Iq).
5. Фармацевтична композиція за будь-яким з попередніх пунктів, яка відрізняється тим, що містить лікарські форми чутливого до кислоти інгібітора протонних насосів або його фармацевтично прийнятної солі лужного металу, які вкриті індивідуальним ентеросолюбільним покриттям.
6. Фармацевтична композиція за п. 5, яка відрізняється тим, що чутливий до кислот інгібітор протонних насосів вибирають зі сполук загальної формули І або їх фармацевтично прийнятної солі лужного металу, або одного з їх одиничних енантіомерів або солі з лужним металом одиничного енантіомера:
![]() І,
І,
де Het1 є
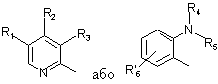 ,
,
Het2 є
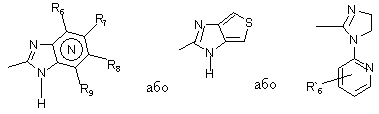 ,
,
Х є
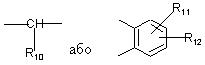 ,
,
де
N у бензімідазольній групі означає, що один з атомів карбону, заміщений замісниками R6-R9, необов’язково може замінювати атом нітрогену без будь-якого замісника;
R1, R2 та R3 є однаковими або відмінними і вибрані з атома гідрогену, алкілу, алкоксилу, необов’язково заміщеного атомом фтору, алкілтіогрупою, алкоксіалкоксилу, діалкіламіногрупою, піперидиногрупою, морфоліногрупою, атомом галогену, фенілом та фенілалкоксилом;
R4 та R5 є однаковими або відмінними і вибрані з атома гідрогену, алкілу та аралкілу;
R'6 є атомом гідрогену, атомом галогену, трифлуорметилом, алкілом та алкоксилом;
R6-R9 є однаковими або відмінними і вибрані з атома гідрогену, алкілу, алкоксилу, атома галогену, галогеналкоксилу, алкілкарбонілу, алкоксикарбонілу, оксазолілу, трифторалкілу, або сусідні групи R6-R9 утворюють кільцеві структури, які можуть бути крім того заміщеними;
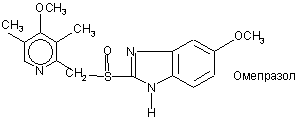
R10 є атомом гідрогену або разом з R3 утворює алкіленовий ланцюг, а
R11 та R12 є однаковими або відмінними і вибрані з атома гідрогену, атома галогену або алкілу; алкіли, алкоксили та їх частини, можуть мати лінійні чи розгалужені С1-С9-ланцюги або включати циклічні алкіли, як-то циклоалкілалкіл.
7. Фармацевтична композиція за п. 6, яка відрізняється тим, що чутливий до кислот інгібітор протонних насосів вибирають з будь-якої нижченаведеної сполуки:
 ,
,
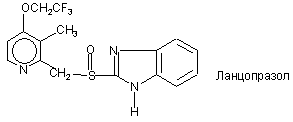 ,
,
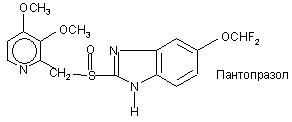 ,
,
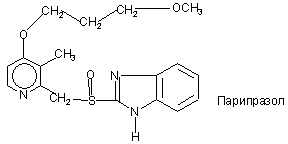 ,
,
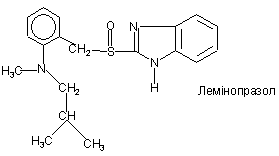 ,
,
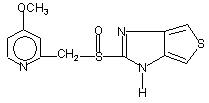 ,
,
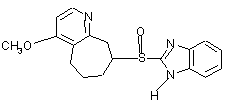 ,
,
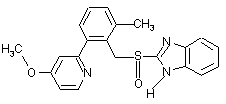 ,
,
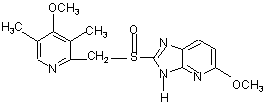 ,
,
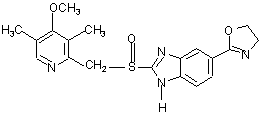 .
.
8. Фармацевтична композиція за п. 7, яка відрізняється тим, що чутливий до кислот інгібітор протонних насосів вибирають з омепразолу, солі лужного металу омепразолу, (S)-омепразолу та солі лужного металу (S)-омепразолу.
9. Фармацевтична композиція за п. 8, яка відрізняється тим, що сіль лужного металу омепразолу або (S)-омепразолу є сіллю магнію.
10. Фармацевтична композиція за п. 5, яка відрізняється тим, що NО-вивільняючі НСПЗЛ є сполукою формули Іа, а чутливий до кислот інгібітор протонних насосів вибирають з омепразолу, солі лужного металу омепразолу, (S)-омепразолу та солі лужного металу (S)-омепразолу.
11. Фармацевтична композиція за будь-яким з попередніх пунктів, яка відрізняється тим, що кількість NO-вивільняючих НСПЗЛ складає 50-1500 мг на одиничну дозу.
12. Фармацевтична композиція за п. 11, яка відрізняється тим, що кількість NO-вивільняючих НСПЗЛ складає 125-500 мг на одиничну дозу.
13. Фармацевтична композиція за будь-яким з попередніх пунктів, яка відрізняється тим, що сурфактантом є блок-кополімер.
14. Фармацевтична композиція за будь-яким з попередніх пунктів, яка відрізняється тим, що сурфактантом є неіоногенний сурфактант.
15. Фармацевтична композиція за п. 14, яка відрізняється тим, що неіоногенним сурфактантом є полоксамер.
16. Фармацевтична композиція за п. 14, яка відрізняється тим, що сурфактант вибирають з будь-якого одного з наступних продуктів:
Полоксамер 407; Полоксамер 401; Полоксамер 237; Полоксамер 338; Полоксамер 331; Полоксамер 231; Полоксамін 908; Полоксамін 1307; Полоксамін 1107; та поліоксіетиленполіоксибутиленовий блок-кополімер.
17. Фармацевтична композиція за будь-яким з попередніх пунктів, яка відрізняється тим, що загальна кількість сурфактанта(ів) складає 12,5-6000 мг.
18. Фармацевтична композиція за п. 17, яка відрізняється тим, що загальна кількість сурфактанта(ів) складає 100-500 мг.
19. Фармацевтична композиція за будь-яким з попередніх пунктів, яка відрізняється тим, що співвідношення NO-вивільняючі НСПЗЛ:сурфактант знаходиться у межах 1:0,1-1:10.
20. Фармацевтична композиція за п. 19, яка відрізняється тим, що співвідношення NO-вивільняючі НСПЗЛ:сурфактант знаходяться у межах 1:0,3-1:3.
21. Фармацевтична композиція за будь-яким з попередніх пунктів, яка відрізняється тим, що масло присутнє.
22. Фармацевтична композиція за п. 21, яка відрізняється тим, що маслом є рослинна олія.
23. Фармацевтична композиція за п. 22, яка відрізняється тим, що рослинну олію вибирають з олії кокоса, кукурудзяної олії, олії сої, олії рапсу, сафлорової олії та рицинової олії.
24. Фармацевтична композиція за п. 21, яка відрізняється тим, що маслом є тваринний жир.
25. Фармацевтична композиція за п. 24, яка відрізняється тим, що тваринним жиром є риб'ячий жир або один чи більше моно-, ди- або тригліцеридів.
26. Фармацевтична композиція за будь-яким з попередніх пунктів, яка відрізняється тим, що напівтвердий жир використовують як наповнювач.
27. Фармацевтична композиція за п. 26, яка відрізняється тим, що напівтвердий жир вибирають з моно-, ди- та тригліцеридів.
28. Фармацевтична композиція за п. 27, яка відрізняється тим, що моно-, ди- та тригліцериди вибирають з гліцерилпалмітостеарату або суміші моно-, ди- та триестерів гліцерину, моно- та діестерів поліетиленгліколю або вільного поліетиленгліколю.
29. Фармацевтична композиція за будь-яким з пп. 3-28, яка відрізняється тим, що коротколанцюговий спирт вибирають з етанолу, пропіленгліколю або гліцерину.
30. Фармацевтична композиція за будь-яким з попередніх пунктів, яка відрізняється тим, що містить косурфактант.
31. Лікарська форма, заповнена фармацевтичною композицією за будь-яким з попередніх пунктів.
32. Лікарська форма за п. 31, яка відрізняється тим, що вибрана з будь-чого з нижченаведеного: капсул, дозованих подушечок, м'яких пілюль для жування та коржів на жувальній основі.
33. Лікарська форма за п. 32, яка відрізняється тим, що має форму капсули.
34. Лікарська форма за п. 33, яка відрізняється тим, що зазначеною капсулою є тверда желатинова капсула.
35. Лікарська форма за п. 33, яка відрізняється тим, що зазначеною капсулою є м'яка желатинова капсула.
36. Фармацевтична комбінація, яка містить фармацевтичну композицію за п. 1 у формі одиночної дози в поєднанні з чутливим до кислоти інгібітором протонних насосів.
37. Фармацевтична комбінація за п. 36, яка відрізняється тим, що інгібітор протонних насосів має ентеросолюбільне покриття.
38. Фармацевтична комбінація за п. 37, яка відрізняється тим, що інгібітором протонних насосів є омепразол, що має ентеросолюбільне покриття.
39. Спосіб лікування болю, згідно з яким пацієнту, що потребує такого лікування, вводять фармацевтичну композицію за будь-яким одним з попередніх пунктів.
40. Спосіб лікування запалення, згідно з яким пацієнту, що потребує такого лікування, вводять фармацевтичну композицію за будь-яким одним з попередніх пунктів.
Текст
1. Фармацевтична композиція, придатна для перорального введення, яка містить (і) NO-вивільняючі НСПЗЛ формули (І): 3 82979 4 O O CH3 N C O ONO2 O (Id), O , CH3 , Cl O O O N O CH3 O O CH3 CH3 H3C O , (If), O H3C O NH O O ONO2 O Cl ; (іі) одну або більше поверхнево-активних речовин, у формі концентрату, здатного утворювати in-situ емульсію типу «масло-у-воді» при контакті з водними, зокрема шлунково-кишковими рідинами. 2. Фармацевтична композиція за п. 1, яка відрізняється тим, що містить олію або напівтвердий жир. 3. Фармацевтична композиція за п. 1, яка відрізняється тим, що містить один чи більше коротколанцюгових спиртів. 4. Фармацевтична композиція за будь-яким з попередніх пунктів, яка відрізняється тим, що NOвивільняючі НСПЗЛ є будь-якою сполукою, вибраною з групи: CH 3 Cl (Ig), O NH O Cl Cl (Ii), O N ONO2 (Ij), CH 3 O ONO2 NH Cl ONO2 O MeO (Ik), O O O O ONO 2 CH3 ONO2 O O CH 3O (Ia), (Ib), ONO2 O CH CH-CH2 H3C ONO2 O (Ie), CH2 CH3 O (Ic), CH3 C , ONO2 O CH3O O ONO2 O Cl (IL), 5 82979 Хє CH3 R 11 ONO2 O CH O MeO NH ONO2 O Cl Cl (In), CH 3 O ONO2 O MeO (Io), CH3 O ONO2 O O MeO (Ip) та O NH ONO2 O Cl Cl (Iq). 5. Фармацевтична композиція за будь-яким з попередніх пунктів, яка відрізняється тим, що містить лікарські форми чутливого до кислоти інгібітора протонних насосів або його фармацевтично прийнятної солі лужного металу, які вкриті індивідуальним ентеросолюбільним покриттям. 6. Фармацевтична композиція за п. 5, яка відрізняється тим, що чутливий до кислот інгібітор протонних насосів вибирають зі сполук загальної формули І або їх фармацевтично прийнятної солі лужного металу, або одного з їх одиничних енантіомерів або солі з лужним металом одиничного енантіомера: O Het 1 X S Het2 CH2 N R5 R'6 R7 , N R9 N S N N R8 або H N або CH2 S N N H , N N Омепразол H O Het2 є R6 N CH3 N або N S , R4 R3 H N OCH2CF 3 R2 N , де N у бензімідазольній групі означає, що один з атомів карбону, заміщений замісниками R6-R9, необов’язково може замінювати атом нітрогену без будь-якого замісника; R1, R2 та R3 є однаковими або відмінними і вибрані з атома гідрогену, алкілу, алкоксилу, необов’язково заміщеного атомом фтору, алкілтіогрупою, алкоксіалкоксилу, діалкіламіногрупою, піперидиногрупою, морфоліногрупою, атомом галогену, фенілом та фенілалкоксилом; R4 та R5 є однаковими або відмінними і вибрані з атома гідрогену, алкілу та аралкілу; R'6 є атомом гідрогену, атомом галогену, трифлуорметилом, алкілом та алкоксилом; R6-R9 є однаковими або відмінними і вибрані з атома гідрогену, алкілу, алкоксилу, атома галогену, галогеналкоксилу, алкілкарбонілу, алкоксикарбонілу, оксазолілу, трифторалкілу, або сусідні групи R6-R9 утворюють кільцеві структури, які можуть бути крім того заміщеними; R10 є атомом гідрогену або разом з R3 утворює алкіленовий ланцюг, а R11 та R12 є однаковими або відмінними і вибрані з атома гідрогену, атома галогену або алкілу; алкіли, алкоксили та їх частини, можуть мати лінійні чи розгалужені С1-С9-ланцюги або включати циклічні алкіли, як-то циклоалкілалкіл. 7. Фармацевтична композиція за п. 6, яка відрізняється тим, що чутливий до кислот інгібітор протонних насосів вибирають з будь-якої нижченаведеної сполуки: OCH3 CH3 CH3 OCH3 O N І, де Het1 є R1 R 12 або R10 (Im), O , 6 R`6 Ланцопразол 7 82979 OCH3 OCH3 OCH3 O N CH2 H 3C OCHF2 N S Пантопразол N , CH 2 O OCH3 CH2 CH 2 CH3 O CH2 N S Парипразол N H , O CH2 N S N N H 3C CH2 H Лемінопразол CH H 3C CH3 , OCH3 O N CH2 N S S N H , N O CH3O N S N H , CH3 N H3C S O N O N H , OCH3 H 3C CH3 N CH3 N CH2 O O N S O CH2 S N N H N OCH3 , N N H H N 8 . 8. Фармацевтична композиція за п. 7, яка відрізняється тим, що чутливий до кислот інгібітор протонних насосів вибирають з омепразолу, солі лужного металу омепразолу, (S)-омепразолу та солі лужного металу (S)-омепразолу. 9. Фармацевтична композиція за п. 8, яка відрізняється тим, що сіль лужного металу омепразолу або (S)-омепразолу є сіллю магнію. 10. Фармацевтична композиція за п. 5, яка відрізняється тим, що NО-вивільняючі НСПЗЛ є сполукою формули Іа, а чутливий до кислот інгібітор протонних насосів вибирають з омепразолу, солі лужного металу омепразолу, (S)-омепразолу та солі лужного металу (S)-омепразолу. 11. Фармацевтична композиція за будь-яким з попередніх пунктів, яка відрізняється тим, що кількість NO-вивільняючих НСПЗЛ складає 50-1500 мг на одиничну дозу. 12. Фармацевтична композиція за п. 11, яка відрізняється тим, що кількість NO-вивільняючих НСПЗЛ складає 125-500 мг на одиничну дозу. 13. Фармацевтична композиція за будь-яким з попередніх пунктів, яка відрізняється тим, що сурфактантом є блок-кополімер. 14. Фармацевтична композиція за будь-яким з попередніх пунктів, яка відрізняється тим, що сурфактантом є неіоногенний сурфактант. 15. Фармацевтична композиція за п. 14, яка відрізняється тим, що неіоногенним сурфактантом є полоксамер. 16. Фармацевтична композиція за п. 14, яка відрізняється тим, що сурфактант вибирають з будьякого одного з наступних продуктів: Полоксамер 407; Полоксамер 401; Полоксамер 237; Полоксамер 338; Полоксамер 331; Полоксамер 231; Полоксамін 908; Полоксамін 1307; Полоксамін 1107; та поліоксіетиленполіоксибутиленовий блок-кополімер. 17. Фармацевтична композиція за будь-яким з попередніх пунктів, яка відрізняється тим, що загальна кількість сурфактанта(ів) складає 12,5-6000 мг. 18. Фармацевтична композиція за п. 17, яка відрізняється тим, що загальна кількість сурфактанта(ів) складає 100-500 мг. 19. Фармацевтична композиція за будь-яким з попередніх пунктів, яка відрізняється тим, що співвідношення NO-вивільняючі НСПЗЛ:сурфактант знаходиться у межах 1:0,1-1:10. 20. Фармацевтична композиція за п. 19, яка відрізняється тим, що співвідношення NO-вивільняючі НСПЗЛ:сурфактант знаходяться у межах 1:0,3-1:3. 21. Фармацевтична композиція за будь-яким з попередніх пунктів, яка відрізняється тим, що масло присутнє. 9 82979 10 22. Фармацевтична композиція за п. 21, яка відрізняється тим, що маслом є рослинна олія. 23. Фармацевтична композиція за п. 22, яка відрізняється тим, що рослинну олію вибирають з олії кокоса, кукурудзяної олії, олії сої, олії рапсу, сафлорової олії та рицинової олії. 24. Фармацевтична композиція за п. 21, яка відрізняється тим, що маслом є тваринний жир. 25. Фармацевтична композиція за п. 24, яка відрізняється тим, що тваринним жиром є риб'ячий жир або один чи більше моно-, ди- або тригліцеридів. 26. Фармацевтична композиція за будь-яким з попередніх пунктів, яка відрізняється тим, що напівтвердий жир використовують як наповнювач. 27. Фармацевтична композиція за п. 26, яка відрізняється тим, що напівтвердий жир вибирають з моно-, ди- та тригліцеридів. 28. Фармацевтична композиція за п. 27, яка відрізняється тим, що моно-, ди- та тригліцериди вибирають з гліцерилпалмітостеарату або суміші моно-, ди- та триестерів гліцерину, моно- та діестерів поліетиленгліколю або вільного поліетиленгліколю. 29. Фармацевтична композиція за будь-яким з пп. 3-28, яка відрізняється тим, що коротколанцюговий спирт вибирають з етанолу, пропіленгліколю або гліцерину. 30. Фармацевтична композиція за будь-яким з попередніх пунктів, яка відрізняється тим, що містить косурфактант. 31. Лікарська форма, заповнена фармацевтичною композицією за будь-яким з попередніх пунктів. 32. Лікарська форма за п. 31, яка відрізняється тим, що вибрана з будь-чого з нижченаведеного: капсул, дозованих подушечок, м'яких пілюль для жування та коржів на жувальній основі. 33. Лікарська форма за п. 32, яка відрізняється тим, що має форму капсули. 34. Лікарська форма за п. 33, яка відрізняється тим, що зазначеною капсулою є тверда желатинова капсула. 35. Лікарська форма за п. 33, яка відрізняється тим, що зазначеною капсулою є м'яка желатинова капсула. 36. Фармацевтична комбінація, яка містить фармацевтичну композицію за п. 1 у формі одиночної дози в поєднанні з чутливим до кислоти інгібітором протонних насосів. 37. Фармацевтична комбінація за п. 36, яка відрізняється тим, що інгібітор протонних насосів має ентеросолюбільне покриття. 38. Фармацевтична комбінація за п. 37, яка відрізняється тим, що інгібітором протонних насосів є омепразол, що має ентеросолюбільне покриття. 39. Спосіб лікування болю, згідно з яким пацієнту, що потребує такого лікування, вводять фармацевтичну композицію за будь-яким одним з попередніх пунктів. 40. Спосіб лікування запалення, згідно з яким пацієнту, що потребує такого лікування, вводять фармацевтичну композицію за будь-яким одним з попередніх пунктів. Даний винахід стосується нової фармацевтичної композиції у формі пред-концентрату емульсії, лікарської форми, що містить зазначену композицію, її використання у терапії, а також способу її отримання. Нестероїдні проти-запальні ліки, що звичайно позначають як НСПЗЛ, є добре відомими ліками для лікування болю та запалення. Одним з головних недоліків НСПЗЛ є те, що вони мають сильну шлунково-кишкову побічну дію. Пацієнти, яких протягом подовженого періоду часу лікували НСПЗЛ, як-то напроксен, часто мають проблеми з побічною дією на шлунок як частину шлунковокишкового тракту. Сполуки НСПЗЛ, що вивільняють оксид нітрогену (далі позначені як NO-вивільняючі НСПЗЛ), як зараз виявлено, мають посилений профіль побічної дії, дивися наприклад, WO 94/04484, WO 94/12463, WO 95/09831 та WO 95/30641. NO-вивільняючі НСПЗЛ є ліпофільними сполуками з поганою водорозчинністю. їх можна віднести до класу 2 згідно з Системою біофармацевтичної класифікації, запропонованої Amidon et al. [Pharm. Res. 12 (1995) pp. 413-420]. Ліки цього класу характеризуються поганою водорозчинністю, але достатньо гарною проникністю. Біофармацевтичні проблем з цими сполуками полягають у тому, що їх поглинання з шлунково-кишкового тракту (ШКТ) може бути обмеженим швидкістю розчинен ня, призводячи до поганої біопридатності при пероральному уведенні. WO 95/08983 розкриває здатну до самоемульгування композицію для перорального використання, що при контакті з біологічними рідинами утворює мікроемульсію in situ. Цю композицію можна характеризувати як здатну до самомікроемульгування систему доставки ліків (СМЕСДЛ), вона включає щонайменше активну сполуку, ліпофільну фазу, що складається з суміші гліцеридів та естерів жирних кислот, поверхнево-активний засіб, косурфактанти, та гідрофільну фазу, яку отримують після поглинання фізіологічним розчином дигестивного середовища. Даний винахід відрізняється у кількох аспектах від СМЕСДЛ, даної у WO 95/08983, та інших. При тому, що композиції, які розкрито у WO 95/08983, утворюють мікроемульсію in situ, композиції даного винаходу утворюють емульсію. СМЕСДЛ. з WO 95/08983 потребує присутності ліпофільної фази для солюбілізації активної сполуки. Така ліпофільна солюбілізаційна фаза не є необхідною для даного винаходу оскільки активна сполука, NO-вивільняючий НСПЗЛ, здатна самостійно складати масляну фазу емульсії in situ. Композиції з WO 95/08983 включають серед іншого на додаток до поверхнево-активного засобу косурфактанти. Присутність косурфактантів не є необхідною для композиції даного винаходу, зме 11 ншуючи тим токсикологічні властивості до мінімуму. ЕР 274 870 розкриває фармацевтичну композицію, що містить нестероїдні проти-запальні ліки (НСПЗЛ) та сурфактант, композиція здатна до утворення міцел, що містять НСПЗЛ, при пероральному вживанні. Ці міцели, як виявлено, представляють особливо прийнятну форму для уведення НСПЗЛ перорально, зменшуючи їх шкідливу дію на шлунково-кишковий тракт (ШКТ). Міцели є агрегатами, в яких молекули сурфактанту у водному розчині звичайно знаходяться в межах сферичних структур з гідрофобним регіоном в екранованій оболонкою із зовнішніх гідрофільних регіонів від води серцевині. Ліки є звичайно солюбілізованими у сурфактанті. Міцели у термінах їх структури протилежні емульсіям, які утворюються композиціями даного винаходу. В той час як міцели є термодинамічно стабільними одно-фазовими системами (згідно з правилом фаз Гіббса), в яких агрегати звичайно мають діаметр приблизно у дві довжини молекули сурфактанту, що її утворює, тобто порядку від десяти до ста ангстрем (Å), емульсії утворені набагато більшими агрегатами, порядку від нанометрів до мікрометрів у діаметрі, що складаються з маслянистої серцевини, яка оточена одним або кількома шарами сурфактантів. Емульсії є звичайно дво-фазовими системами і є термодинамічно нестабільними (але можуть бути кінетично стабільними). Іншою головною відмінністю між композиціями з ЕР 274 870 та даним винаходом є природа активної сполуки, в той час як НСПЗЛ є за природою кристалічними порошками, NOвивільняючі НСПЗЛ або суміші NO-вивільняючих НСПЗЛ, використовуваних у даному винаході, знаходяться у формі масла або терморозм'якшуваних напівтвердих продуктів. Більш того, міцели звичайно потребують вищого співвідношення ліки : сурфактант порівняно зі співвідношенням масло : сурфактант, потрібним для утворення емульсії. Одною з унікальних особливостей NOвивільняючих НСПЗЛ є те, що багато цих сполук є маслами або терморозм'якшуваниими напівтвердими продуктами, які є практично нерозчинними у воді. З високими дозами NO-вивільняючих НСПЗЛ, наприклад, коли доза вище приблизно 350мг, важко створювати таблетку прийнятного розміру з великої кількості масла або напівтвердого продукту. Ліпофільні NO-вивільняючі НСПЗЛ можна, однак, сформувати як емульсії масло-у-воді, сполука складає або є частиною масляної фази, емульгованої у воді одним чи більше сурфактантами. У фармакокінетичному дослідженні тварин несподівано виявлено, що такі емульсії масло-у-воді NO-вивільняючих НСПЗЛ виявляють набагато кращу біопридатність порівняно з неемульгованою речовиною. Проблема з емульсіями полягає, однак, в тому, що вони термодинамічно нестабільні та мають малу тривалість збереження стабільності оскільки часто мають тенденцію до коалесценції, відстоювання/седиментації або розділення фаз. Більш того, вони не представляють зручної форми дозування для перорального використання, оскільки часто для уведення одної дози потрібні великі об'єми та головною проблемою може бути не 82979 12 приємний різкий чи мильний смак. Серед іншого неможливо заповнювати емульсіями масло-у-воді желатинові капсули внаслідок високого вмісту води в емульсії, що несумісно з оболонкою капсули внаслідок її розчинення. Згадані вище проблеми зараз вирішені запропонуванням нової здатної до самоемульгування системи доставки ліків, звичайно відомої як SEDDS, придатної для перорального уведення. Зокрема, даний винахід стосується фармацевтичної композиції, придатної для перорального уведення, у формі пред-концентрату емульсії, що містить (і) один чи більше NO-вивільняючих НСПЗЛ; (іі) один чи більше сурфактантів; (ііі) як варіант, масло або напівтвердий жир; зазначена композиція утворює in situ емульсію масло-у-воді після контакту з водними середовищами, як-то шлунково-кишкові рідини. Композиція згідно з даним винаходом може, як варіант, також містити один чи більше коротколанцюгових спиртів. Композиція утворюватиме in situ емульсію масло-у-воді з невеликих крапель розміром від нанометру до мікрону після контакту зі шлунковокишковими рідинами, краплі складаються з одного чи більше NO-вивільняючих НСПЗЛ, що утворюють серцевину краплі, яка покрита одним або кількома шарами сурфактанту. In situ утворена емульсія масло-у-воді забезпечуватиме гарну біопридатність NO-вивільняючих НСПЗЛ при пероральному уведенні. Збереження стабільності емульсії не є важливим, оскільки емульсія не утворюється, доки пред-концентрат не уводиться пацієнту, тобто раніше моменту уведення. Можливий неприємний смак пред-концентрату не є проблемою при заповненні у капсули. Фармацевтична композиція згідно з даним винаходом є пред-концентратом емульсії на час застосування до пацієнта. Пред-концентратом емульсії можна заповнювати одиничні елементи форм дозування, як-то капсули, ампули для пиття та дозовані пружні подушечки, або альтернативно він може бути сформованим як інші придатні форми дозування, як-то м'які пілюлі для жування та коржі на жувальній основі. Після контакту з водними середовищами, як-то шлунково-кишкові рідини, пред-концентрат емульсії перетворюється у емульсію масло-у-воді. Отже, композиція утворюватиме in-situ емульсію маслоу-воді у шлунково-кишкову тракті. Швидкість вивільнення ліків композиції визначають розмір крапель емульсії in-situ та полярність крапель емульсії, остання регулюється гідрофільно-ліпофільним балансом (ГЛБ) суміші ліки/сурфактант та концентрацією сурфактанту. Звичайно, невеликий розмір крапель та висока полярність підвищує швидкість вивільнення ліків [N.H. Shah et al. Int. J. Pharm. 106 (1994), pp. 15-23] Вираз "НСПЗЛ" визначають як нестероідні проти-запальні ліки, тобто будь-які ліки, що мають анти-запальну дію, але не належать до сполук класу "стероїди". Фахівці визначать, чи підпадає сполука під визначення НСПЗЛ. Прикладами певних НСПЗЛ є напроксен, дикпофенак, ацеклофе 13 нак, індометацин, кеторолак, силундак, мелоксикам, піроксикам, теноксикам, ібупрофен, кетопрофен, напроксен, азапропазон, набуметон, карпрофен, тіапрофенова кислота, супрофен, індопрофен, етодолак, фенопрофен, фенбуфен, флюрбіпрофен, бермопрофен, піразолак, залтопрофен, набумедон, бромфенак, ампіроксикам та лорноксикам. Цей перелік не слід сприймати як вичерпний у будь-якому сенсі. Вираз "NOвивільняючі НСПЗЛ" розглядають як будь-які нестероїдні анти-запальні ліки (НСПЗЛ), їх сіль або енантіомер, які мають здатність вивільняти оксид нітрогену. NO-вивільняючі НСПЗЛ є ліпофільними сполуками з поганою водорозчинністю. їх можна віднести до класу 2 згідно з Системою біофармацевтичної класифікації, запропонованої Амідол et al. [Pharm. Res. 12 (1995) 413-420]. Ліки цього класу характеризуються поганою водорозчинністю, але достатньо гарною проникністю. Біофармацевтичні проблем з цими сполуками полягають у тому, що їх поглинання з шлунково-кишкового тракту (ШКТ) може бути обмеженим швидкістю розчинення, призводячи до поганої біопридатності при пероральному вживанні. Кращими NO-вивільняючими НСПЗЛ згідно з даним винаходом, є сполуки формули І де X представляє спейсер, тобто сполуку, що утворює місток між групою, що передає оксид нітрогену, та НСПЗЛ, а Згідно з кращим втіленням винаходу спейсер X вибирають з лінійного, розгалуженого або циклічного алкілену -( СН2)n -, де n - ціле число від 2 до 10; -(СН2)m-О-(СН2)р-, де m та p - цілі числа від 2 до 10; та - СН2-пС6H4-СН2 -. Згідно з одним втіленням винаходу, розглянуті як активні сполуки у композиції СЕСДЛ згідно з даним винаходом NO-вивільняючі НСПЗЛ, є сполуками, розкритими та заявленими у WO 94/04484, WO 94/12463, WO 95/09831 та WO 95/30641, які дані як довідки. Певними NO-вивільняючими речовинами, корисними згідно з даним винаходом, є наступні 82979 14 15 HСАЗЛ за природою мають форму порошку, тоді як NO-вивільняючі НСПЗЛ в основному представляють сполуку у напівтвердій або маслоподібній формі як такій, внаслідок наявності спейсера. Ця неповторна особливість забезпечує перевагу тим, що до пред-концентрату емульсії не потрібно додавати додаткову матрицю з ліпофільних масел або напівтвердих продуктів, оскільки це є невід'ємною особливістю ліків. Крім того, фармакологічно інертне масло або напівтвердий жирний продукт можна додавати до фармацевтичної композиції в якості наповнювачу або регулятору в'язкості. Наповнюваний засіб може бути потрібним для збільшення точності дозування при низькій дозі сполуки. Регулятор в'язкості може бути потрібним для досягнення оптимальної в'язкості для заповнення композицією, наприклад, капсул. Зокрема висока швидкість заповнення рідиною капсул потребує обережного регулювання в'язкості у межах, що попереджують розбризкування в кінці при низький в'язкості та утворення в кінці при високій в'язкості нитки. Більш того, межі в'язкості треба вибирати так, щоб мати придатну для перекачки композицію. Межі в'язкості, звичайно потрібні для заповнення рідиною капсул знаходяться в межах від 0,1 до 25 Па. Загальна кількість NO-вивільняючих НСПЗЛ, використовуваних у композиції винаходу знаходиться переважно у межах 50-1500мг на одиничну дозу. Згідно з наступним кращим втіленням кількість NO-вивільняючих НСПЗЛ, використовуваних у композиції винаходу знаходиться переважно у межах 125-500мг на одиничну дозу. Вираз "одинична доза" визначають як кількість активної сполуки, застосовуваної у одній одиничній капсулі, або розчиненої у одному стакані води. Вираз "сурфактант" визначають як поверхнево-активну амфіфільну сполуку, як-то блоккополімери. Кращими сурфактантами згідно з даним винаходом є неіоногенні сурфактанти, наприклад ті, що містять поліетиленгліколеві (ПЕГ) ланцюги, особливо блок-кополімери, як-то полоксамери. Прикладами придатних полоксамерів є Полоксамер 407 (Pluronic F127®); Полоксамер 401 (Pluronic L121®): Полоксамер 237 (Pluronic F87®); Полоксамер 338 (Pluronic FI38®): Полоксамер 331 (Pluronic L101®): Полоксамер 231 (Pluronic LSI®); тетрафункціональний поліоксіетиленполіоксипропіленовий блок-кополімер етилендіаміну, відомий як Полоксамін 908 (тетронік 908®); Полоксамін 1307 (тетронік 1307®); Полоксамін 1107 поліоксіетилен-поліоксибутиленовий блоккополімер, відомий як Полігліколь ВМ45®. Цей перелік призначений тільки для ознайомлення з сурфактантами, які можна використовувати згідно з даним винаходом, але ніяк не обмежує рамок винаходу. Усі описані вище сурфактанти є комерційно доступними від, наприклад, таких фірм, як BASF, Dow Chemicals та Gattefosse. Загальна кількість сурфактанту згідно з винаходом можуть бути у межах 12,5-6000мг, переважно 100-500мг. 82979 16 Співвідношення NO-вивільняючі НСПЗЛ : сурфактант може змінюватися від 1:0,1 до 1:10, переважно від 1:0,3 до 1:3. Якщо до фармацевтичної композиції додають додаткове масло, ним може бути будь-яке масло, що є інертним та сумісним з матеріалом капсул, а також бути прийнятним для використання у фармацевтичній практиці. Фахівцям зрозуміло, яке масло треба вибирати для призначеної мети. Прикладами придатних масел, які можна використовувати згідно з даним винаходом, є рослинні олії, якто кокосове масло, кукурудзяна олія, олія сої, олія рапсу, сафлорова олія та рицинова олія. Також для досягнення мети даного винаходу є придатними тваринні жири, як-то риб'ячий жир та тригліцериди. Якщо як наповнювач для фармацевтичної композиції використовують напівтвердий жир, його можна переважно вибрати з моно-, ди- та тригліцеридів та жирно-кислотного спирту, як-то стеариловий спирт. GeluClres 33/01, 39/01, 43/01, гліцерил палмітостеарат, як-то PreClrol ATO5. GeluCIre є сумішшю, отриманою змішуванням моно-, ди-. та три-естерів гліцерину, моно- та ди-естерів ПЕГ або вільного ПЕГ. Згідно з одним аспектом даного винаходу як активний інгредієнт використовують маслоподібні (ліпофільні) або напівтверді NO-вивільняючі НСПЗЛ. Якщо у фармацевтичній композиції згідно з винаходом використовують додаткові масло або напівтвердий жир, він може слугувати як наповнювач або як регулятор в'язкості. Вираз "коротко-ланцюгові спирти", використовувані згідно з даним винаходом визначений тут як лінійні чи розгалужені моно-, ди- або триатомні спирти, що мають 1-6 атомів карбону. Прикладами таких спиртів з коротким ланцюгом, корисних згідно з винаходом, є етанол, пропіленгліколь та гліцерин. Якщо до фармацевтичної композиції згідно з винаходом додають спирт з коротким ланцюгом, розчинність поліпшується і потрібна менша кількість сурфактанту. Згідно з другим аспектом винаходу як активні інгредієнти використовують два або більш NOвивільняючих НСПЗЛ, де будь-які з зазначених ліків можуть бути даними як масло або як напівтвердий продукт, або де щонайменше одні зазначених ліків є маслом або як напівтвердим продуктом, а інші можуть бути твердими, які розчиняють чи суспендують у маслоподібній або як напівтвердій сполуці. Комбінації двох або більше NOвивільняючих НСПЗЛ можуть бути переважними у випадку, коли високе завантаження N0 високої дози NO-вивільняючих НСПЗЛ потрібне для доповнення низької дози NO-вивільняючих НСПЗЛ з високою потужністю. Наступним аспектом винаходу є комбінація одного чи більше NO-вивільняючих НСПЗЛ та чутливої до кислот сполуки інгібітору протонних насосів (ІПН). NO-НСПЗЛ слід формувати так, щоб вони емульгувалися у ротової порожнини, тобто як композицію СЕСДЛ, яку описано вище, в той час як чутливий до кислоти інгібітор протонних насосів 17 (ІПН) треба захищати від контакту з кислотою шлункового соку у випадку ентеросолюбільного покриття. Ентеросолюбільне покриття, нанесене на ІПН, залишається недоторканим до своєї реакції у кишківнику, де ІПН вивільняється. Окремо отримані покриті ентеросолюбільним покриттям гранули інгібітору протонних насосів (ІПН) можна перемішувати у розплаві СЕСДЛ. Альтернативно ІПН можна заповнювати капсулу з застиглою СЕСДЛ, де може бути потрібним захисний шар парафіну між СЕСДЛ та отриманими гранулами ІПН. Згідно з альтернативним втіленням отримані гранули ІПН можна вмішувати у рідку композицію СЕСДЛ. Комбінація може, отже, бути фіксованою комбінацією, тобто як композиція, де NO-вивільняючі НСПЗЛ та чутливий до кислот інгібітор протонних насосів перемішують, а далі заповнюють цим придатну одиницю дозування. Згідно з альтернативним втіленням винаходу чутливим до кислот інгібітором протонних насосів можна заповнювати капсулу з вже застиглою композицією СЕСДЛ одного чи більше NO-вивільняючих НСПЗЛ - у цьому випадку може бути потрібним захисний шар парафіну або іншого інертного матеріалу між композицією СЕСДЛ та чутливим до кислот інгібітором протонних насосів. Згідно з наступним альтернативним втіленням чутливий до кислот інгібітор протонних насосів перемішують у рідкій композиції СЕСДЛ NO-вивільняючих НСПЗЛ. Згідно з альтернативним втіленням винаходу, вивільняючі НСПЗЛ та ІПН можуть бути у формі комплекту, де NO-вивільняючі NSAE) та ІПН застосовують послідовно, тобто один після іншого. Порядок застосування не є критичним, тобто NOвивільняючі НСПЗЛ або ІПН можна уводити перед іншим компонентом. Отже, одне втілення винаходу включає комбінацію для лікування, де один чи більше NO-вивільняючих НСПЗЛ уводять пацієнту, що потребує лікування, а після цього уводять ІПН, або навпаки. Прикладом інгібіторів протонних насосів, придатних у комбінації з а NO-вивільняючими НСПЗЛ згідно з даним винаходом, які зазначені вище, є сполука загальної формули І або її фармацевтично прийнятна сіль з лужними металом, або один з її одиничних енантіомерів або сіль з лужним металом одиничного енантіомеру: 82979 18 N у бензимідазольній групі означає, що один з атомів карбону, заміщений замісниками R6-R9, як варіант, може замінювати атом нітрогену без будьякого заміснику; R1, R2 та R3 є однаковими або відмінними і вибрані з атому гідрогену, алкілу, алкоксилу, як варіант, заміщеного атомом флуору, алкілтіорупи, алкоксіалкоксилу, діалкіламіногрупи, піперидиногрупи, морфолінофупи. атому галогену, фенілу та фенілалкоксилу; R4 та R5 є однаковими або відмінними і вибрані з атому гідрогену, алкілу та аралкілу; R6' представляє атом гідрогену, атом галогену, трифлуорметил, алкіл та алкоксил; R6-R9 є однаковими або відмінними і вибрані з атому гідрогену, алкілу, алкоксилу, атому галогену, галоген-алкоксилу, алкілкарбонілу, алкоксикарбонілу, оксазолілу, трифлуоралкілу, або сусідні групи R6-R9 утворюють кільцеві структури, які можуть бути крім того заміщеними; R10 представляє атом гідрогену або разом з R3 утворює алкіленовий ланцюг, а R11 та R12 є однаковими або відмінними і вибрані з атому гідрогену, атому галогену або алкілу; алкіли, алкоксили та їх частини, можуть мати лінійні чи розгалужені С1-С9-ланцюги або включати циклічні алкіли, як-то циклоалкіл-алкіл. Прикладами конкретних інгібіторів протонних насосів, придатних згідно з даним винаходом є наступні: 19 Чутливі до кислот інгібітори протонних насосів, використовувані у формах дозування винаходу, можна використовувати у їх нейтральній формі або у формі солі лужного металу, як-то у випадку солей Mg2+, Са22*, Na+, К* або Li+, переважно Мg2+. Далі, де можливо, вищезазначені сполуки можна використовувати у рацемічній формі або у формі її по суті чистого енантіомеру, або солей з лужним металом одиничних енантіомерів. 82979 20 Придатні інгібітори протонних насосів наприклад, розкриті у ЕР-А1-0005129, ЕР-А1-174 726, ЕР-А1-166 287, GB 2 163 747 та WO 90/06925, а особливо придатні сполуки описані у WO 95/01977 та WO94/27988. Інгібітори протонних насосів, використовувані у комбінації згідно з даним винаходом, переважно представляють гранули з ентеросолюбільним покриттям, що містять чутливий до кислот інгібітор протонних насосів. Стосовно гранул з ентеросолюбільним покриттям та їх отримання, посилання наведені у WO 96/01623, який дано як довідку. Придатними комбінаціями згідно з даним винаходом є, наприклад, NO-вивільняючі НСПЗЛ формули Іа та омепразол або сіль лужного металу омепразолу, (S)-омепразол або сіль лужного металу (S)-омепразолу; або NO-вивільняючі НСПЗЛ формули Іі та омепразол або сіль лужного металу омепразолу, (S)-омепразол або сіль лужного металу (S)-омепразолу. Фармацевтичною композицією винаходу заповнюють лікарські форми, придатні для перорального уведення, як-то капсули, ампули для пиття та дозовані подушечки, або їх можна сформувати як інші придатні форми перорального дозування, якто м'які пілюлі для жування та коржу на жувальній основі. Згідно з кращим втіленням винаходу фармацевтичною композицією заповнюють тверді желатинові капсули, але капсули з альтернативних матеріалів, як-то з оболонками на основі метилцелюлози, а також можна використовувати м'які желатинові капсули. Згідно з альтернативним втіленням винаходу, фармацевтичну композицію можна розчиняти, наприклад, у стакані води, надаючи тим змоги пред-концентрату утворити емульсію, яку можна застосовувати як таку. Композиціями, призначеними для розчинення перед застосуванням, можна заповнювати, наприклад, м'які желатинові капсули, пластикові або алюмінієві подушечки, чи пластикові або скляні ампули. Ця особливість є особливо переважною для високодозових композицій, як потребують великої капсули, для пацієнтів, які мають труднощі при ковтанні капсул, та для дітей. Згідно з кращим втіленням винаходу фармацевтичними композиціями даного винаходу заповнюють капсули. Кращими капсулами є желатинові капсули, які можуть бути м'якими або твердими. Тверді желатинові капсули складаються з двох частин, кришки та корпусу, першу вставлено у іншу. Тверді желатинові капсули отримують пустими та заповнюють окремою операцією. М'які желатинові капсули є капсулами, які виробляють та заповнюють одною операцією. Як згадано вище, пред-концентрат емульсії перетворюється у емульсію масло-у-воді при контакті з шлунково-кишковими рідинами, при цьому вивільняються активні ліки. Отже, композиція утворюватиме in situ емульсію масло-у-воді у шлунково-кишковому тракті (ШК тракт). Фармацевтична композиція даного винаходу є особливо корисною у лікуванні болю та запалення. 21 Вираз "біль" включає, але без обмеження, ноцицептивний та невропатичний біль або їх комбінації; гострий, переривчастий та хронічний біль; біль при раку; мігрень та головні болі подібного походження. Вираз "запалення" включає, але без обмеження, ревматоїдний артрит: остеоартрит; та юнацький артрит. Способи отримання Фармацевтичну композицію даного винаходу можна отримувати переважно наступними альтернативними способами: І. Змішування а) Маслоподібні або напівтверді NOвивільняючі НСПЗЛ поміщають у посудину, додають твердий або напівтвердий сурфактант та твердий/маслоподібний жир (як варіант). Суміш гріють до температури, відповідній точці плавлення ексципієнтів, створюючи композиційну рідину, ретельно перемішують до гомогенності (візуальний контроль) та пред-концентратом заповнюють капсули, придатні для перорального уведення. b) Альтернативно, маслоподібні NOвивільняючі НСПЗЛ поміщають у посудину та додають рідкий сурфакгант. їх суміш ретельно перемішують до гомогенності (візуальний контроль) та пред-концентратом заповнюють капсули, придатні для перорального уведення. c) За наступним альтернативним способом маслоподібні NO-вивільняючі НСПЗЛ поміщають у посудину, дрібно розмелюють (розмір частинок менше 177мкм) додають твердий сурфактант. Рідку суміш перемішують ретельно до гомогенності (візуальний контроль) та пред-концентратом заповнюють капсули, придатні для перорального уведення. d) За ще одним альтернативним способом напівтвердий/твердий сурфактант поміщають у посудину та додають один чи більше спиртів. Суміш гріють до температури, відповідній точці плавлення ексципієнтів, створюючи композиційну рідину, ретельно перемішують до гомогенності (візуальний контроль), додають NO-НСПЗЛ та суміш ретельно перемішують до гомогенності (візуальний контроль). Пред-концентратом заповнюють капсули, придатні для перорального уведення. e) За ще одним альтернативним способом рідкий сурфактант поміщають у посудину та додають один чи більше спиртів. Суміш ретельно перемішують до гомогенності (візуальний контроль), додають NO-НСПЗЛ та суміш ретельно перемішують до гомогенності (візуальний контроль). Предконцентратом заповнюють капсули, придатні для перорального уведення. Для заповнення дво-частинних капсул або м'яких желатинових капсул рідиною композиція повинна мати в'язкість у деяких межах, які визначено виробником, при придатній для заповнення температурі процесу. Для дво-частинних капсул максимальна температура заповнення складає приблизно 70°С. В'язкість композиції нормально повинна бути у межах 50-1000 сПуаз ( = 0,05-1 Пуаз) при температурі процесу, вибраній для заповнення. Для заповнення композицією м'яких желатинових капсул, температура процесу не перевищує 30-40°С (точна температура залежить від 82979 22 виробника). Композиція повинна бути рідкою та мати в'язкість, що дозволяє її перекачку при температурі заповнення Для створення композиційної рідини з прийнятною в'язкістю, можна використовувати кілька добавок, наприклад, Cremophor EL®. II. Заповнення Для заповнення потрібно, щоб композиція була рідиною при температурі заповнення. Напівтвердими терморозм'якшуваними композиціями тому заповнюють при температурі вище температури зрідження. М'які желатинові капсули виробляють та заповнюють одною операцією, їх можна заповнювати при температурах до 40°С, тоді як тверді желатинові капсули можна заповнювати при температурах до 70°С. Тверді желатинові капсули заповнюють композиціями, що залишаються рідкими при збереженні температури, потрібній для закриття, наприклад, у бандажуванні желатину для попередження витоку. Процес заповнення рідиною твердих желатинових капсул та потрібні для цього продукти, наприклад, [описані у W.J. Bowtle, Pharmaceutical Technology Europe. October 1998: V.M. Young, Pharmaceutical Manufacturing and Packaging Sourcer, March 1999: ma E.T. Coole. Pharmaceutical Technology International. September/October 1989], використовуючи двочастинні капсули, дозволяє заповнення більше, ніж одної фази у одиничну капсулу, що може бути потрібним для дво- або багатофазного вивільнення ліків [W.J. Bowtle et al. Jnt. J. Pharm. 141 (1996). pp. 9-16]. Кілька фаз застигаючого матеріалу можна заповнювати на одиничних етапах. Кінцева фаза може бути рідкою, якщо потрібно. Число фаз обмежене тільки розміром капсул та об'ємом окремих фаз. Ці особливості можуть також дозволити контрольоване вивільнення або розділення різних ліків, сформованих в одній капсулі. Крім того, капсули можуть бути оброблені далі, наприклад, ентеросолюбільним покриттям. III. Комбінація з ІПН Маслоподібні або напів-тверді NO-вивільняючі НСПЗЛ поміщають у посудину, додають твердий або напівтвердий сурфактант та твердий/маслоподібний жир (як варіант). Суміш гріють до температури, відповідній точці плавлення ексципієнтів, створюючи композиційну рідину, перемішують ретельно до гомогенності (візуальний контроль) та додають до суміші отримані покриті шаром ентеросолюбільного покриття гранули, що містять чутливий до кислот інгібітор . протонних насосів. Пред-концентратом з суспендованими гранулами ІПН заповнюють придатні для перорального застосування капсули, де він твердне. Альтернативно маслоподібні або напівтверді NO-вивільняючі НСПЗЛ поміщають у посудину, додають твердий сурфактант та твердий/маслоподібний жир (як варіант). Суміш гріють до температури, відповідній точці плавлення ексципієнтів, створюючи композиційну рідину, перемішують ретельно до гомогенності (візуальний контроль). Пред-концентратом заповнюють капсули, придатні для перорального уведення, де він твердне. Захисний шар парафіну, або будь-якої іншої інертної терморозм'якшуваної основи, придатної для перорального уведення, додають та 23 дають застигнути. Зверху парафіну додають отримані гранули ІПН. За наступним альтернативним способом маслоподібні NO-вивільняючі НСПЗЛ поміщають у посудину та додають рідкий сурфактант. Суміш ретельно перемішують до гомогенності (візуальний контроль) та додають до суміші отримані гранули ІПН. Пред-концентратом з суспендованими гранулами ІПН заповнюють капсули, придатні для. перорального уведення. IV. Визначення параметрів композицій Для визначення параметрів композиції визначають час, потрібний для утворення композицією емульсії масло-у-воді при контакті з еквівалентом шлункової рідини, ЕШР, (без ферментів), та утворену емульсію характеризують. ЕШР включає 7мл концентрованої гідрохлоридної кислоти, 2г хлориду натрію та дистильовану воду до загального об'єму 1л. "Тест на утворення емульсії" проводять у тест-тубах (для струшування) при перемішуванні магнітною мішалкою. Тест-тубу, що містить невеликий магніт, заповнюють 12,5мл ЕШР без ферментів, що відповідає одній десятій середнього об'єму шлункової рідини у людини та додають композицію, що відповідає одній десятій дози активної сполуки. Якщо досліджувана композиція є комбінацією з ІПН, гранули ІПН візуально контролюють, чи не пошкоджуються вони ЕШР. Якщо ентеросолюбільне покриття гранул ІПН пошкоджується, ІПН може негативно впливати при рН = 1,2 і це можна спостерігати як помітну зміну кольору. Час утворення емульсії варіюватиме від 30 с до 15 хвилин, залежно вщ складу композиції. Якщо додають один чи більше коротко-ланцюгових спиртів, час утворення емульсії варіюватиме між 2-3 с та 3-4 хвилинами. Також досліджують середній розмір частинок утвореної емульсії за допомогою лазерної дифракції, ДЦ, або протонкореляційної спектроскопи, ПКС. Залежно від розміру частинок можна використовувати будь-який з двох способів. Детальний опис винаходу Винахід далі детальніше описаний наступними прикладами, які не обмежують його рамок. Отримували такі пред-концентрати емульсій. У прикладах 1-7 нижче, використовуваною у композиціях активною сполукою була сполука вищенаведеної формули (Іа). Напівтверду композицію отримували розтопленням 1кг Pluronic F127® (полоксамер 407) нагріванням до 62°С. Розплав ретельно перемішували для гарантування відсутності твердих частинок. 1кг сполуки формули (Іа) додавали до розтопленого Pluronic F127® та суміші давали досягти температури 62°С. Рідку композицію перемішували до гомогенності (візуальний контроль). Утвореною рідкою композицією далі заповнюють тверді желатинові капсули. Композиція стає напівтвердою при охолодженні (у капсулі). 82979 24 Визначення параметрів 150 міліграм композиції поміщали у 12,5мл ЕШР (без ферментів) при перемішуванні магнітною мішалкою. Отримано такі результати: Час до утворення емульсії: 13 хвилин Середній розмір частинок: 2-3мкм В'язкість вимірювали у конічному та тарілчатому вісеозиметрі Stress Tech, вимірювальна система С 40 4 PC, при швидкості зсуву 20с. Потік був більше або менше ньютонівського. Рідку композицію отримували змішуванням 1кг рідкого сурфактанту Полоксамер 401, з 1кг сполуки формули (Іа) при кімнатній температурі. Рідку композицію перемішували до гомогенності (візуальний контроль). Утвореною рідкою композицією далі заповнюють тверді желатинові капсули. Визначення параметрів 150 міліграм композиції поміщали у 12,5мл ЕШР (без ферментів) при перемішуванні магнітною мішалкою. Отримані такі результати: Час до утворення емульсії: 20с Середній розмір частинок: 11мкм (d) Композицю отримували змішуванням 1кг Полігліколю ВМ 45 (Полоксамін 1107). 40г додецилсульфату натрію, що діє як ко-сурфактант, та 1кг сполуки формули (Іа). Рідку композицію перемішували до гомогенності (візуальний контроль). Утвореною рідкою композицією далі заповнюють тверді желатинові капсули. Визначення параметрів 150 міліграм композиції поміщали у 12,5мл ЕШР (без ферментів) при перемішуванні магнітною мішалкою. Отримані такі результати: Час до утворення емульсії: 15 хвилин Середній розмір частинок: 0,7мкм Для можливості заповнення напівтвердою композицією м'яких желатинових капсул, температура процесу повинна бути нижче 30-40°С (конкретна температура залежить від виробника). Це означає, що композиція повинна бути рідиною та 25 здатною до перекачки нижче 30-40°С. Для отримання рідкої композиції при цій температурі деяку частину сурфактанту замінювали на Cremophor EL®. Розплав отримували як описано у прикладі 1, за винятком заміщення 0,5кг сурфактанту такою ж кількістю Cremophor EL®. Визначення параметрів 150 міліграм композиції поміщали у 12,5мл ЕШР (без ферментів) при перемішуванні магнітною мішалкою. Отримані такі результати: Час до утворення емульсії: 9 хвилин Середній розмір частинок: 4-5мкм Для гарантування, що при низькій дозі композиції матимуть гарну точність заповнення, та для заповнення капсул точним об'ємом для мінімізації кількості присутнього повітря, активною сполукою можна заповнювати об'єм з аліквотною частиною масла кокоса. Напівтверду композицію отримували розтопленням 1500кг Pluronic F127® (полоксамер 407) нагріванням до 62°С. Розплав ретельно перемішували для гарантування відсутності твердих частинок. 1,250кг сполуки формули (Іа) та 1880кг фракціонованого масла кокоса додавали до розтопленого Pluronic F127® та суміші давали досягти температури 62°С. Рідку композицію перемішували до гомогенності (візуальний контроль). Утвореною рідкою композицією далі заповнюють тверді желатинові капсули. Визначення параметрів Одну десяту композиції поміщали у 12,5мл ЕШР (без ферментів) при перемішуванні магнітною мішалкою. Отримані такі результати: Час для утворення емульсії: 10 хвилин Середній розмір частинок: 5мкм Композицію отримували, як описано у прикладі 5 вище. Визначення параметрів Визначення параметрів проводили, як описано у прикладі 5 вище. Отримані наступні результати: Час для утворення емульсії: 10 хвилин Середній розмір частинок: 36мкм 82979 26 Композицію отримували, як описано у прикладі 5 вище. Визначення параметрів Визначення параметрів проводили, як описано у прикладі 5 вище. Отримані наступні результати: Час для утворення емульсії: 10 хвилин Середній розмір частинок: 81мкм Приклад 8 Активну сполуку вищенаведеної формули (ІЬ) використовували у композиції даного прикладу 8. Композицію отримували таким чином як у попередніх прикладах. Визначення параметрів Час для утворення емульсії: 1,5 хвилини Середній розмір частинок: 5мкм Приклад 9 Активну сполуку вищенаведеної формули (Іс) використовували у композиції даного прикладу 9. Композицію отримували таким чином як у попередніх прикладах. Визначення параметрів Час для утворення емульсії: 3 хвилин Середній розмір частинок: 2мкм Приклад 10 Активну сполуку вищенаведеної формули (Id) використовували у композиції даного прикладу 10. Композицію отримували таким чином як у попередніх прикладах. Визначення параметрів Час для утворення емульсії: 0,5 хвилин Середній розмір частинок: 2мкм Приклад 11 Активну сполуку вищенаведеної формули (Іе) використовували у композиції даного прикладу 11. Композицію отримували таким чином як у попередніх прикладах. Визначення параметрів Час для утворення емульсії: 1 хвилина Середній розмір частинок: 4мкм Приклад 12 Активну сполуку вищенаведеної формули (If) використовували у композиції даного прикладу 12. 27 Композицію отримували таким чином як у попередніх прикладах. Визначення параметрів Час для утворення емульсії: 1 хвилин Середній розмір частинок: 2мкм Приклад 13 Активну сполуку вищенаведеної формули (Іg) використовували у композиції даного прикладу 13. Композицію отримували таким чином як у попередніх прикладах. Визначення параметрів Час для утворення емульсії: 3 хвилини Середній розмір частинок: 1мкм Приклад 14 Активні сполуки вищенаведених формул (Іа) та (Ik) використовували у композиції даного прикладу 14. Композицію отримували розчиненням сполуки формули (У) у сполуці формули (Іа), після чого додавали до цього Pluronic L121® (полоксамер 401). Рідку композицію перемішували до гомогенності (візуальний контроль). Визначення параметрів Композицію поміщали у 20мл ЕШР (без ферментів) при перемішуванні магнітною мішалкою. Визначали час для утворення емульсії. Отримані такі результати: Час для утворення емульсії: 5-10с Приклад 15 Активні сполуки вищенаведених формул (Іа) та (Іі) використовували у композиції даного прикладу 15. Композицію отримували, як описано у прикладі 14. Визначення параметрів Проводили як у попередньому прикладі 14. Час для утворення емульсії: 3 хвилин 82979 28 Напівтверду композицію отримували розтопленням 450г Pluronic F127® (полоксамер 407) нагріванням до 62°С. Розплав ретельно перемішували для гарантування відсутності твердих частинок. 750г сполуки формули (Іа) додавали до розтопленого Pluronic F127® та суміші давали досягти температури 62°С. Додавали 20г омепразолу у формі отриманих гранул з ентеросолюбільним покриттям, що містять сіль омепразолу з магнієм, отриману як описано у WO 96/01623, приклад 2. Рідку композицію перемішували до гомогенності (візуальний контроль) та заповнювали нею тверді желатинові капсули. Композиція стає напівтвердою при охолодженні (у капсулі). Визначення параметрів 120мг композиції поміщали у 12,5мл ЕШР (без ферментів) при 37°С, при перемішуванні магнітною мішалкою. СЕСДЛ утворювала емульсію при контакт з ЕШР, а гранули ІПН залишалися непошкодженими під дією СЕСДЛ та рΗ = 1,2, що бачили за відсутністю зміни кольору. Час для утворення емульсії складав 12 хвилин. Рідку композицію отримували змішуванням 450г рідкого сурфактанту Полоксамер 401, з 750г сполуки формули (Іа) при кімнатній температурі. 20г омепразолу у формі отриманих гранул з ентеросолюбільним покриттям, що містять сіль омепразолу з магнієм, отриману як описано у WO 96/01623, приклад 2. Рідку композицію перемішували до гомогенності (візуальний контроль) та заповнювали нею тверді желатинові капсули. Визначення параметрів 120мг композиції поміщали у 12,5мл ЕШР (без ферментів) при 37°С та при перемішуванні магнітною мішалкою. СЕСДЛ утворювала емульсію при контакт з ЕШР, а гранули ІПН залишалися непошкодженими під дією СЕСДЛ та рН = 1,2, що бачили за відсутністю зміни кольору. Час для утворення емульсії складав 0,5 хвилини. 29 82979 30 Час до утворення емульсії: в межах 20с Напівтверду композицію отримували розтопленням 0,843г Pluronic F127 (полоксамер 407), 0,282г монолаурату сорбіту та 0,375г гліцерину нагріванням до 62°С. Розплав ретельно перемішували для гарантування відсутності твердих частинок. 3г сполуки формули (Іа) додавали до суміші. Суміші давали досягти температури 62°С. Рідку композицію перемішували до гомогенності (візуальний контроль). Утвореній рідкій композиції давали охолонути до температури 30°С, а далі заповнювали нею м'які желатинові капсули. Композиція стає напівтвердою після охолодження (у капсулі). Визначення параметрів 112 міліграм композиції поміщали у 12,5мл ЕШР (без ферментів) під час перемішування магнітною мішалкою. Отримано наступний результат: Час до утворення емульсії: 2,5-3,5 хвилин Напівтверду композицію отримували розтопленням 0,843г Pluronic F127 (полоксамер 407), 0,282г монолаурату сорбіту та 0,375 г пропіленгліколю нагріванням до 62°С. Розплав ретельно перемішували для гарантування відсутності твердих частинок. 3г сполуки формули (Іа) додавали до суміші. Суміші давали досягти температури 62°С. Рідку композицію перемішували до гомогенності (візуальний контроль). Утвореній рідкій композиції давали охолонути до температури 30°С, а далі заповнювали нею м'які желатинові капсули. Композиція стає напівтвердою при охолодження (у капсулі). Визначення параметрів 112 міліграм композиції поміщали у 12,5мл ЕШР (без ферментів) при перемішуванні магнітною мішалкою. Отримано наступний результат: Комп’ютерна верстка Л. Купенко Отримували рідку композицію. Розчин 0,506г Pluronic L101® (полоксамер 331), 0,169г монолаурату сорбіту та 0,225г етанолу перемішували до гомогенності (візуальний контроль). 3г сполуки формули (Іа) додавали до суміші при кімнатній температурі. Утвореною рідкою композицією далі заповнюють м'які желатинові капсули. Визначення параметрів 97 міліграм композиції поміщали у 12,5мл ЕШР (без ферментів) при перемішуванні магнітною мішалкою. Отримано наступний результат Час до утворення емульсії: в межах 20с Дослідження композицій in vivo на міні свинях Дослідження на біопридатність композицій згідно з даним винаходом проводили після перорального застосування голодними міні свинями. У дослідженні використовували 6 самців міні свиней Gottingen SPF. У початковий період акліматизації тварини мали вік 4 місяці та масу від 7,7 до 10,1кг. Тварини були голодними протягом 12 годин перед обробкою та доки не були узяті зразки крові на 4 годину після обробки. Автоклавоване сіно давали кожної доби, а також, двічі на добу тваринам пропонували воду для пиття домашньої якості. Фармацевтичну композицію винаходу у придатній одиничній формі дозування згідно з винаходом застосовували до кожної тварини. Рівні доз були приблизно 15мкмоль/кг маси тіла. 10мл водопровідної води давали для полегшення ковтання капсули або відповідної одиничної дози. Усі видимі ознаки проблем зі здоров'ям та будь-які зміни поведінки реєстрували щодоби. Будь-які відхилення від норми реєстрували з огляду на час початку, тривалість та суворість. Включеними у добовий контроль стану здоров'я були спостереження консистентності фекалієв. Усіх тварин зважували після отримання та у першу добу кожної обробки. Зразки крові (5мл) брали з шийної вени у туби Вакутайнера, що містили гепарин. Зразки крові брали перед обробкою (0) та на 15, 30 та 45 хвилині; 1,1,5, 2,4, 7 та 24 годині після обробки. Підписне Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюPharmaceutical composition suitable for oral administration containing no-releasing nsaid, dosage form, pharmaceutical combination and methods of treatment
Автори англійськоюHolmberg Christina, Siekmann Britta
Назва патенту російськоюФармацевтическая композиция, пригодная для перорального введения, которая содержит no-высвобождающие нспвл, лекарственная форма, фармацевтическая комбинация и способы лечения
Автори російськоюГолмберг Кристина, Зикманн Бритта
МПК / Мітки
МПК: A61K 31/04, A61K 9/113, A61P 29/00, A61K 31/21
Мітки: придатна, лікування, композиція, лікарська, нспзл, способи, перорального, no-вивільняючі, яка, введення, фармацевтична, містить, комбінація, форма
Код посилання
<a href="https://ua.patents.su/15-82979-farmacevtichna-kompoziciya-pridatna-dlya-peroralnogo-vvedennya-yaka-mistit-no-vivilnyayuchi-nspzl-likarska-forma-farmacevtichna-kombinaciya-ta-sposobi-likuvannya.html" target="_blank" rel="follow" title="База патентів України">Фармацевтична композиція, придатна для перорального введення, яка містить no-вивільняючі нспзл, лікарська форма, фармацевтична комбінація та способи лікування</a>
Попередній патент: Похідні 5-b-сапогеніну і псевдосапогеніну та їх застосування у лікуванні деменції, фармацевтична композиція на їх основі, харчовий продукт або напій на їх основі
Наступний патент: Заміщені аміди бензойної кислоти та їх застосування для пригнічення ангіогенезу
Випадковий патент: Спосіб оцінки сполучного впливу на організм ссавців нітробензолу та позитивних низьких температур в експерименті