Модифікований генно-інженерний рекомбінантний білок, що імітує властивості поверхневого антигену cd34 людини
Номер патенту: 93432
Опубліковано: 10.02.2011
Автори: Фляк Андрій Ігорович, Ніколаєв Юліан Сергійович, Гільчук Павло Володимирович, Іродов Дмитро Михайлович, Горбатюк Оксана Борисівна, Гільчук Юлія Миколаївна, Кордюм Віталій Арнольдович
Формула / Реферат
1. Модифікований генно-інженерний рекомбінантний білок rExhCD34, продукований бактеріями E. coli, що імітує властивості поверхневого антигену CD34 людини, який містить 269 амінокислотних залишків, має молекулярну масу 28.8 кДа, ізоелектричну точку РІ 6.06 та відповідає загальній формулі H2N-rExhCD34-COOH
1 50
mmsldnngtatpelptqgtfsnvstnvsyqetttpstlgstslhpvsqhg
51 100
neattnitettvkftstsvitsvygntnssvqsqtsvistvfttpanvst
101 150
pettlkpslspgnvsdlsttstslatsptkpytssspilsdikaeikcsg
151 200
irevkltqgicleqnktsscaefkkdrgeglarvlcgeeqadadagaqvc
201 250
slllaqsevrpqclllvlanrteissklqlmkkhqsdlkklgildfteqd
251
vashqsysqktlehhhhhh.
2. Рекомбінантний білок rExhCD34 за п. 1, який відрізняється тим, що містить зовнішньоклітинну частину антигену CD34 людини, що відповідає амінокислотам 1-261.
3. Рекомбінантний білок rExhCD34 за п. 2, який відрізняється тим, що містить білкові антигенні детермінанти.
4. Рекомбінантний білок rExhCD34 за п. 1, який відрізняється тим, що містить послідовність олігогістидинового пептиду загальною формулою (His)n, де n складає від 6 до 10.
5. Молекула ДНК, яка кодує модифікований генно-інженерний рекомбінантний білок rExhCD34 за будь-яким з пп. 1-4, має розмір 810 п. н. та містить нуклеотидну послідовність
1 50
atgatgagtcttgacaacaacggtactgctaccccagagttacctaccca
51 100
gggaacattttcaaatgtttctacaaatgtatcctaccaagaaactacaa
101 150
cacctagtacccttggaagtaccagcctgcaccctgtgtctcaacatggc
151 200
aatgaggccacaacaaacatcacagaaacgacagtcaaattcacatctac
201 250
ctctgtgataacctcagtttatggaaacacaaactcttctgtccagtcac
251 300
agacctctgtaatcagcacagtgttcaccaccccagccaacgtttcaact
301 350
ccagagacaaccttgaagcctagcctgtcacctggaaatgtttcagacct
351 400
ttcaaccactagcactagccttgcaacatctcccactaaaccctatacat
401 450
catcttctcctatcctaagtgacatcaaggcagaaatcaaatgttcaggc
451 500
atcagagaagtgaaattgactcagggcatctgcctggagcaaaataagac
501 550
ctccagctgtgcggagtttaagaaggacaggggagagggcctggcccgag
551 600
tgctgtgtggggaggagcaggctgatgctgatgctggggcccaggtatgc
601 650
tccctgctccttgcccagtctgaggtgaggcctcagtgtctactgctggt
651 700
cttggccaacagaacagaaatttccagcaaactccaacttatgaaaaagc
701 750
accaatctgacctgaaaaagctggggatcctagatttcactgagcaagat
751 800
gttgcaagccaccagagctattcccaaaagaccctcgagcaccaccacca
801
сcaccactga.
6. Молекула ДНК за п. 5, яка відрізняється тим, що є вбудованою у плазмідний вектор для експресії модифікованого генно-інженерного рекомбінантного білка rExhCD34 в бактеріях E. coli.
7. Плазмідний експресуючий вектор, що містить послідовність ДНК, яка кодує модифікований генно-інженерний рекомбінантний білок rExhCD34 за будь-яким з пп. 1-4 шляхом експресії його в бактеріях E. сoli.
8. Штам E. coli hCD34 - продуцент модифікованого генно-інженерного рекомбінантного білка rExhCD34 за будь-яким з пп. 1-4, який містить ДНК за п. 5 та трансформований плазмідним експресуючим вектором за п. 7.
9. Спосіб одержання рекомбінантного білка rExhCD34 за п. 1, який включає культивування штаму E. coli hCD34 за п. 8 на середовищі, що містить лактозу і глюкозу.
10. Спосіб одержання рекомбінантного білка rExhCD34 за п. 1, який включає культивування штаму E. coli hCD34 за п. 8, осадження бактеріальних клітин після завершення біосинтезу центрифугуванням, руйнування бактеріальних клітин і хромосомної ДНК у присутності лізоциму та ДНК-ази, осадження фракції тілець включення центрифугуванням, промивання тілець включення розчинами, що містять неіонні детергенти, шляхом суспендування осаду з наступним осадженням центрифугуванням, солюбілізацію тілець включення у присутності сечовини або гуанідину гідрохлориду, очищення солюбілізованого білка металоафінною хроматографією на колонці у присутності сечовини або гуанідину гідрохлориду, ренатурацію білка на хроматографічній колонці шляхом контрольованого видалення сечовини або гуанідину гідрохлориду та елюцію з хроматографічної колонки з одержанням розчинного і очищеного рекомбінантного білка.
Текст
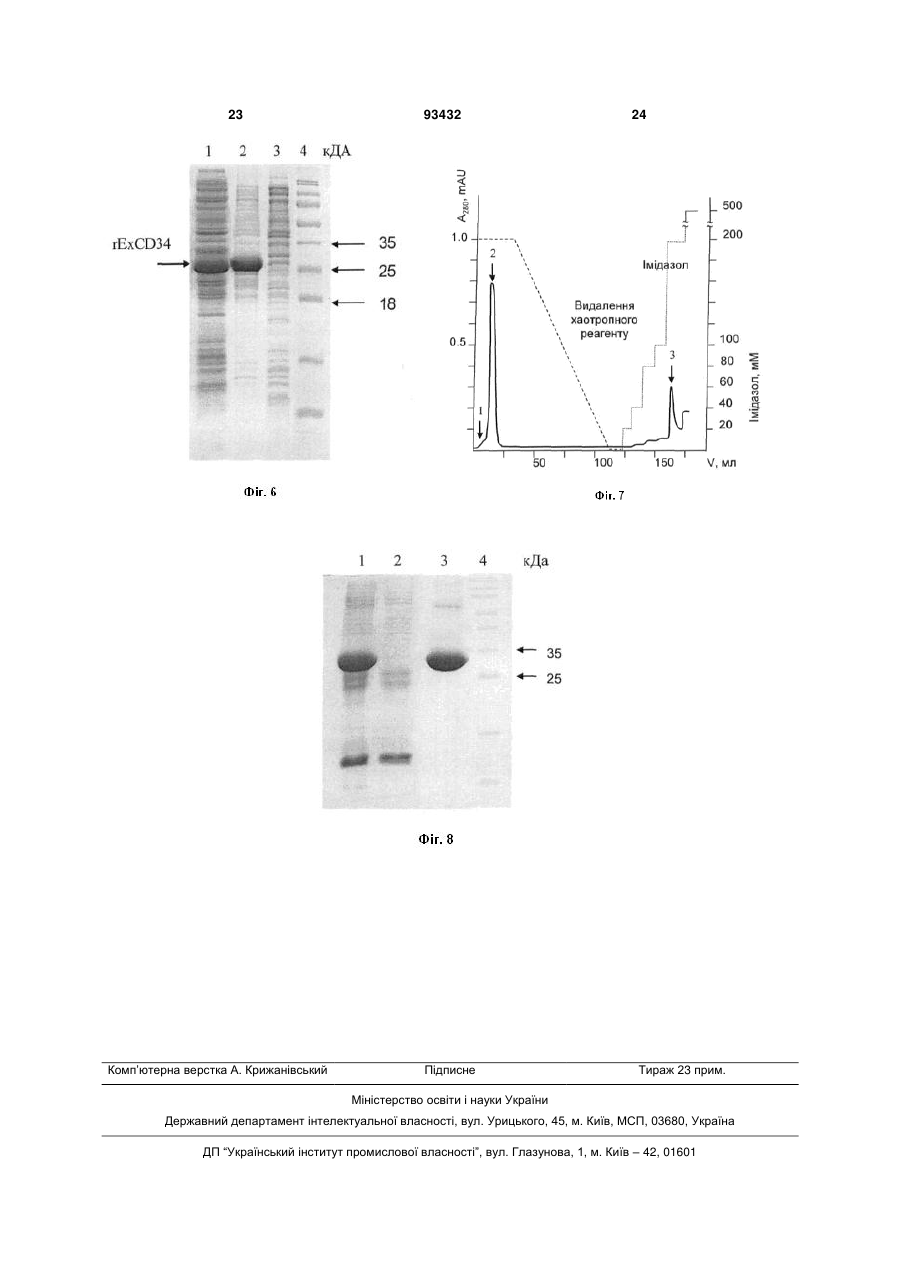
1. Модифікований генно-інженерний рекомбінантний білок rExhCD34, продукований бактеріями E. coli, що імітує властивості поверхневого антигену CD34 людини, який містить 269 амінокислотних залишків, має молекулярну масу 28.8 кДа, ізоелектричну точку РІ 6.06 та відповідає загальній формулі H2N-rExhCD34-COOH 150 200 250 3. Рекомбінантний білок rExhCD34 за п. 2, який відрізняється тим, що містить білкові антигенні детермінанти. 4. Рекомбінантний білок rExhCD34 за п. 1, який відрізняється тим, що містить послідовність олі UA (21) a200905799 (22) 05.06.2009 (24) 10.02.2011 (46) 10.02.2011, Бюл.№ 3, 2011 р. (72) КОРДЮМ ВІТАЛІЙ АРНОЛЬДОВИЧ, ГІЛЬЧУК ПАВЛО ВОЛОДИМИРОВИЧ, ІРОДОВ ДМИТРО МИХАЙЛОВИЧ, ФЛЯК АНДРІЙ ІГОРОВИЧ, ГОРБАТЮК ОКСАНА БОРИСІВНА, НІКОЛАЄВ ЮЛІАН СЕРГІЙОВИЧ, ГІЛЬЧУК ЮЛІЯ МИКОЛАЇВНА (73) КОРДЮМ ВІТАЛІЙ АРНОЛЬДОВИЧ (56) David L. Simmons et al.:”Molecular cloning of a cDNA encoding CD34, a sialomucin of human hematopoetic stem cells”, Journal of immunology, Vol. 148, 267-271, No. January 1, 1992. Yong Tang et al.: ”Expansion of hematopoietic stem cells from normal donors and bone marrow failure patients by recombinant hoxb4”, Br J Haematol. 2009 February; 144(4): 603-612. База даних UniProtKB/Swiss-Prot. Номер доступа: P28906 База даних UniProtKB/TrEMBL. Номер доступа: B4DUX4 База даних UniProtKB/TrEMBL. Номер доступа: A8KAG5 Sutherland DR et al.:”Structural and partial amino acid sequence analysis of the human hemopoietic progenitor cell antigen CD34”, Leukemia, 1988 Dec; 2(12):793-803 (ABSTRACT). C2 2 (19) 1 3 93432 гогістидинового пептиду загальною формулою (His)n, де n складає від 6 до 10. 5. Молекула ДНК, яка кодує модифікований генноінженерний рекомбінантний білок rExhCD34 за 4 будь-яким з пп. 1-4, має розмір 810 п. н. та містить нуклеотидну послідовність 1 50 atgatgagtcttgacaacaacggtactgctaccccagagttacctaccca 51 100 gggaacattttcaaatgtttctacaaatgtatcctaccaagaaactacaa 101 150 cacctagtacccttggaagtaccagcctgcaccctgtgtctcaacatggc 151 200 aatgaggccacaacaaacatcacagaaacgacagtcaaattcacatctac 201 250 ctctgtgataacctcagtttatggaaacacaaactcttctgtccagtcac 251 300 agacctctgtaatcagcacagtgttcaccaccccagccaacgtttcaact 301 350 ccagagacaaccttgaagcctagcctgtcacctggaaatgtttcagacct 351 400 ttcaaccactagcactagccttgcaacatctcccactaaaccctatacat 401 450 catcttctcctatcctaagtgacatcaaggcagaaatcaaatgttcaggc 451 500 atcagagaagtgaaattgactcagggcatctgcctggagcaaaataagac 501 550 ctccagctgtgcggagtttaagaaggacaggggagagggcctggcccgag 551 600 tgctgtgtggggaggagcaggctgatgctgatgctggggcccaggtatgc 601 650 tccctgctccttgcccagtctgaggtgaggcctcagtgtctactgctggt 651 700 cttggccaacagaacagaaatttccagcaaactccaacttatgaaaaagc 701 750 accaatctgacctgaaaaagctggggatcctagatttcactgagcaagat 751 800 gttgcaagccaccagagctattcccaaaagaccctcgagcaccaccacca 801 сcaccactga. 6. Молекула ДНК за п. 5, яка відрізняється тим, що є вбудованою у плазмідний вектор для експресії модифікованого генно-інженерного рекомбінантного білка rExhCD34 в бактеріях E. coli. 7. Плазмідний експресуючий вектор, що містить послідовність ДНК, яка кодує модифікований генно-інженерний рекомбінантний білок rExhCD34 за будь-яким з пп. 1-4 шляхом експресії його в бактеріях E. сoli. 8. Штам E. coli hCD34 - продуцент модифікованого генно-інженерного рекомбінантного білка rExhCD34 за будь-яким з пп. 1-4, який містить ДНК за п. 5 та трансформований плазмідним експресуючим вектором за п. 7. 9. Спосіб одержання рекомбінантного білка rExhCD34 за п. 1, який включає культивування штаму E. coli hCD34 за п. 8 на середовищі, що містить лактозу і глюкозу. 10. Спосіб одержання рекомбінантного білка rExhCD34 за п. 1, який включає культивування штаму E. coli hCD34 за п. 8, осадження бактеріальних клітин після завершення біосинтезу центрифугуванням, руйнування бактеріальних клітин і хромосомної ДНК у присутності лізоциму та ДНК-ази, осадження фракції тілець включення центрифугуванням, промивання тілець включення розчинами, що містять неіонні детергенти, шляхом суспендування осаду з наступним осадженням центрифугуванням, солюбілізацію тілець включення у присутності сечовини або гуанідину гідрохлориду, очищення солюбілізованого білка металоафінною хроматографією на колонці у присутності сечовини або гуанідину гідрохлориду, ренатурацію білка на хроматографічній колонці шляхом контрольованого видалення сечовини або гуанідину гідрохлориду та елюцію з хроматографічної колонки з одержанням розчинного і очищеного рекомбінантного білка. 5 Пропоновані винаходи відносяться до розділу молекулярної біології, генної інженерії, а саме - до модифікованого генно-інженерного рекомбінантного білка rExhCD34, способу його суперсинтезу бактеріями Е. coli та виділення в очищеному і розчинному стані, які можуть бути використані в біотехнології для одержання діагностичних поліклональних антитіл проти поверхневих маркерів клітин і науково-дослідницької роботи. Аналогами рекомбінантного білка rExhCD34 є поверхневий антиген CD34 людини, що синтезується різними типами клітин людини, а також лініями мієлобластоїдних клітин людини KG1 та KG1a у двох формах (385 та 328 амінокислотних залишків (а. з.)), і CD34, одержаний на основі Г.І. технології шляхом експресії клонованого гена в культурі клітин ссавців [Simmons, D.L., Satterthwaite, A.B., Tenen, D.G. and Seed В., Molecular cloning of a cDNA encoding CD34, a sialomucin of human hematopoietic stem cells. J Immunol, 1992. 148(1): p.267-71.; Mickey C.-T. Hu and Shu L. Chien, The Cytoplasmic Domain of Stem Cell Antigen CD34 Is Essential for Cytoadhesion Signaling But Not Sufficient for Proliferation Signaling. Blood, 1998. 91: 1152-1162.]. Рекомбінантних аналогів антигену CD34 людини, які одержують синтезом в бактеріях Е. coli, на сьогодні не створено. CD34 є поверхневим високоглікозильованим білком, який синтезується стромальними клітинами кісткового мозку, клітинами-попередниками гематопоезу, ендотеліальними клітинами, ембріональними фібробластами, нейронами. При патологічних станах CD34 синтезують різні типи гематопоетичних пухлин, а також деякі солідні пухлини [Lanza, F., L. Healy, and D.R. Sutherland, Structural and functional features of the CD34 antigen: an update. J Biol Regul Homeost Agents, 2001. 15(1): p.1-13.]. Продуктом експресії гена CD34 є білок з молекулярною масою 40кДа і електрофоретичною рухливістю близько 110кДа, що зумовлено наявністю численних вуглеводних залишків в його складі. Антиген локалізується в плазматичній мембрані і містить три домени - високоглікозильований зовнішньоклітинний (258а.м.к.), трансмембранний (23а.м.к.) і цитоплазматичний (73а.м.к.), що містить залишки серину для фосфорилювання. CD34 має велике діагностичне значення, а також є ключовим маркером за яким фракціонують клітинипопередники гематопоезу (гематопоетичні стовбурові клітини) для подальшої їх трансплантації реципієнту після опромінення [Gangenahalli GU, Singh VK, Verma YK, Gupta P, Sharma RK, Chandra R, Luthra PM, Hematopoietic stem cell antigen CD34: role in adhesion or homing. Stem Cells Dev, 2006 Jun; 15 (3): p.305-13.]. Вищезазначені маніпуляції можливі завдяки специфічним моноклональним антитілам, які одержують шляхом імунізації мишей екстрактами клітин, що містять CD34 антиген, і наступним злиттям плазматичних клітин імунізованих тварин з лінією мієлобластоїдних клітин для створення продуцентів моноклональних антитіл гібридом [Kohler G., Milstein C. Continuous cultures 93432 6 of fused cells secreting antibody of predefined specificity //Nature. - 1975. - Vol. 256, №5517. P.495-497]. Одержання і відбір гібридом, що синтезують моноклональні антитіла необхідної специфічності, є довготривалим процесом, а продукування та очищення моноклональних антитіл потребує високих затрат на середовища та реактиви. Альтернативним способом є одержання специфічних поліклональних антитіл шляхом імунізації тварин, який, у свою чергу, є значно дешевшим, однак потребує наявності великої кількості високо очищеного білка CD34, що є неможливим у разі використання екстрактів CD34+ клітин як єдиного джерела даного антигену. Відомий CD34-антиген людини Г.І. походження, продукований трансфікованою лінією клітин ссавців COS під контролем промотору плазміди CDM8. Плазміда для синтезу рекомбінантного CD34 містить в собі кДНК послідовність гена CD34 із лінії клітин KG1 розміром 2615.п.н. Білок CD34 синтезується культурою клітин еукаріотів на поверхні плазматичної мембрани у вигляді продукту 110кДа [Simmons, D.L., Satterthwaite, A.B., Tenen, D.G. and Seed В., Molecular cloning of a cDNA encoding CD34, a sialomucin of human hematopoietic stem cells. J Immunol, 1992. 148(1): p.267-71.]. Зазначений спосіб одержання антигену CD34 має суттєві недоліки, серед яких можна вказати низький рівень його синтезу клітинами еукаріотів, довготривалість культивування та нестабільність трансфікованої клітинної лінії, високу вартість поживних середовищ, неможливість одержання препаративної кількості антигену в умовах лабораторії і складність процедури його очищення. Також гетерогенний характер приєднання глікозильних залишків до поліпептидного ланцюгу CD34 у разі його синтезу трансфікованою лінією еукаріотичних клітин змінює антигенні властивості CD34, що, в свою чергу, ускладнює його використання у процедурах одержання універсальних специфічних полі- і моноклональних антитіл проти білкових детермінант. Авторами під час підготовки заявки не виявлені засоби створення зменшеного рекомбінантного аналога CD34-антигену людини з послідовністю олігогістидину для хроматографічного очищення, який би зберігав притаманні нативному білку антигенні детермінанти, тому в основу пропонованих винаходів поставлено задачу створення зменшеного рекомбінантного аналога CD34-антигену людини з послідовністю олігогістидину для хроматографічного очищення, який би зберігав притаманні нативному білку антигенні детермінанти, а також способу його суперсинтезу бактеріями Е. coli та виділення в очищеному і розчинному стані. В основу пропонованих винаходів поставлено задачу створення зменшеного рекомбінантного аналога CD34-антигену людини з послідовністю олігогістидину для хроматографічного очищення, який би зберігав притаманні нативному білку антигенні детермінанти, а також розробити спосіб його суперсинтезу бактеріями Е. coli та виділення в очищеному і розчинному стані. 7 93432 8 Поставлена задача вирішується пропонованим модифікованим генно-інженерним рекомбінантним білком rExhCD34, продукований бактеріями Е. coli, імітуючий поверхневий антиген CD34 лю дини, який містить 269 амінокислотних залишків, має молекулярну масу 28.8кДа, ізоелектричну точку РІ 6.06 і відповідає загальній формулі H2NrExhCD34-COOH Особливістю рекомбінантного білка rExhCD34 є те, що він містить зовнішньо клітинну частину антигену CD34 людини, що відповідає амінокислотам 1-261. Особливістю рекомбінантного білка rExhCD34 є також і те, що він містить лише білкові антигенні детермінанти. Ще однією особливістю рекомбінантного білка rExhCD34 є те, що він містить послідовність оліго гістидинового пептиду загальною загальною формулою загальною формулою (His)n де n складає від 3 до 10. Поставлена задача також вирішується пропонованою ДНК розміром 810п.н. рекомбінантного білка rExhCD34, яка відповідає модифікованому генно-інженерному рекомбінантному білку rExhCD34, 9 93432 10 Особливістю ДНК розміром 810п.н. рекомбінантного білка rExhCD34 є те, що вона вбудована у плазмідний вектор для експресії в бактеріях Е. соlі. Поставлена задача також вирішується пропонованим плазмідним експресуючим вектором з геном рекомбінантного білка pRExCD34, що містить послідовність ДНК, яка відповідає за експресію в бактеріях Е. coli модифікованого генноінженерного рекомбінантного білка rExhCD34. Поставлена задача також вирішується пропонованим продуцентом модифікованого генноінженерного рекомбінантного білка rExhCD34 штамом Е. coli BL21hCD34, який відповідно до пропонованого винаходу є трансформованим плазмідним експресуючим вектором з геном рекомбінантного білка pRExCD34. Поставлена задача також вирішується пропонованим способом суперсинтезу рекомбінантного білка rExhCD34 продуцентом штаму Е. coli BL21hCD34, який включає культивування продуценту на середовищі, що містить лактозу і глюкозу. Поставлена задача також вирішується пропонованим способом одержання очищеного і розчинного рекомбінантного білка rExhCD34, синтезованого штамом-продуцентом Е. coli BL21HCD34, що включає осадження бактеріальних клітин після завершення біосинтезу центрифугуванням, руйнування бактеріальних клітин і хромосомної ДНК у присутності лізоциму та ДНК-ази, осадження фракції тілець, включення центрифугуванням, промивання тілець включення розчинами, що містять неіонні детергенти шляхом суспендування осаду з наступним осадженням центрифугуванням, солюбілізацію тілець включення у присутності сечовини або гуанідин гідрохлориду, очищення солюбілізованого білка металафінною хроматографією на колонці у присутності сечовини або гуанідин гідрохлориду, ренатурацію білка на хроматографічній колонці шляхом контрольованого видалення сечовини або гуанідин гідрохлориду, елюції розчинного і очищеного рекомбінантного білка з хроматографічної колонки у нативних умовах. Пропонований винахід вирішує проблеми відомого рівня техніки і забезпечує джерело рекомбінантного білка, який зберігає притаманні нативному білку антигенні детермінанти, у разі використання технологій рекомбінантних ДНК. Послідовність ДНК поверхневого антигену CD34 людини є загальнодоступною з банку генів Національного Центру Біотехнологічної Інформації США [NCBI accessing number AB238231.1] і може бути клонована у плазмідному експресійному векторі. У відповідності до пропонованого винаходу для одержання ДНК модифікованого генноінженерного антигену CD34 використовується нова методика клонування ДНК, що передбачає: попередню ідентифікацію імунологічно значущої антигенної детермінанти CD34, яка відповідає модифікованому генно-інженерному рекомбінантному білку rExhCD34, розробку способу ампліфікації цільової ДНК і встроювання в плазмідний вектор для експресії в бактеріях. Як вихідний матеріал для одержання тотальної РНК людини використовують клітинну мієлобластоїдну лінію KG1, яка є загальнодоступною. Матричну РНК одержують із тотальної ДНК хроматографією на оліго-dTцелюлозі. У реакції зворотної транскрипції синтезують одноланцюгову комплементарну ДНК. Вищезазначені процедури детально описано у прикладах. Відповідно до теперішнього винаходу ампліфікацію дволанцюгової ДНК здійснюють методом полімеразної ланцюгової реакції з використанням спеціально розроблених для даної процедури ДНК-праймерів, що дозволяють клонувати не всю ДНК поверхневого антигену CD34 людини (986п.н.), а лише ту її частину (783п.н.), що кодує імунологічно значущий зовнішньоклітинний домен без N-кінцевої послідовності, яка відповідає сигнальному пептиду (амінокислотні залишки 31-291 з бази даних NCBI). Це може бути визначено з використанням стандартних методик, відомих спеціалістам даної галузі. Праймери для ампліфікації вводять до складу ДНК модифікованого рекомбінантного білка унікальні сайти ендонуклеаз рестрикції NdeI і XhoI для вбудовування в плазмідний експресуючий вектор, а також у разі експресії клонованого гена в бактеріях Е. соlі забезпечують 11 утворення рекомбінантного антигену, що містить генно-інженерно введену послідовність олігогістидину (6His-tag) на С-кінці. Це може бути визначено з використанням стандартних методик для аналізу послідовностей ДНК спеціалістами даної галузі. Послідовності праймерів наведено на Фіг.4. Одержані в результаті полімеразної ланцюгової реакції фрагменти дволанцюгової ДНК розділяють електрофорезом в агарозному гелі і оцінюють порівнюючи з маркером молекулярної маси ДНК. Синтезовані фрагменти ДНК при електрофорезі мають розмір близько 800 пар нуклеотидів і використовуються для клонування у плазмідний експресуючий вектор для одержання рекомбінантного антигену rExhCD34 в бактеріях Е. соlі. Способи одержання ДНК модифікованого генноінженерного рекомбінантного білка rExhCD34 будуть легко оцінені спеціалістами даної галузі на основі прикладів і наступного опису. На Фіг.1, 3 представлено послідовності ДНК і поліпептидного продукту rExhCD34 який вона кодує, відповідно до теперішнього винаходу. Пропонований плазмідний експресуючий вектор pRExCD34 має послідовність ДНК розміром 810п.н., відповідаючу за експресію в бактеріях Е. соlі модифікованого генно-інженерного рекомбінантного білка rExhCD34, який має 269 амінокислотних залишків, молекулярну масу 28.8кДа, ізоелектричну точку РІ 6.06 і відповідає загальній формулі H2N-rExhCD34-COOH. Пропонований винахід вирішує проблеми відомого рівня техніки і використовується для створення бактеріального штаму продуценту рекомбінантного антигену rExhCD34. Плазмідний експресуючий вектор pRExCD34 одержували шляхом молекулярного з'єднання (лігування) гідролізованого ендонуклеазами рестрикції NdeI і XhoI фрагмента ДНК, отриманого методом ПЛР за вищеописаною процедурою, з ДНК плазмідного вектора рЕТ, гідролізованого тими ж ендонуклеазами рестрикції. Оскільки вихідний вектор рЕТ є загальнодоступним, процедура депозитування не проводилась. Плазмідний експресуючий вектор pRExCD34 відрізняється тим, що містить клоновану ДНК розміром 810п.н., відповідаючу за експресію в бактеріях Е. соlі модифікованого генно-інженерного рекомбінантного білка rExhCD34. Молекулярно-генетична характеристика. Розмір вектора pRExCD34 становить 6017п.н. Вектор містить наступні елементи: клоновану ДНК розміром 810п.н., кодуючу рекомбінантний білок rExhCD34, промоторно-операторну ділянку, ген резистентності до канаміцину, сайт реплікації в бактеріях, сайти унікальних ендонуклеаз рестрикції NdeI і XhoI. Вектор pRExCD34 може бути виділений з описаного нижче штаму продуценту Е. соlі BL21hCD34 за стандартною методикою виділення плазмідної ДНК [Sambrook, Joseph Molecular cloning: a laboratory manual /E.F. Fitsch, T. Maniatis - 2-nd ed. Cold Spring Harbor Laboratory Press, Cold Spring Harbor, 1989 V.I p. 1.25-1.28]. Виділений вектор pRExCD34 після гідролізу рестриктазою XhoI і електрофорезу в 1% агарозному у присутності 0.001% броміду етидію гелі виявляється у вигляді дискретної полоси розміром близько 6000п.н. 93432 12 Способи одержання та виділення плазмідного експресуючого вектора pRExCD34 будуть легко оцінені спеціалістами даної галузі на основі прикладів і наступного опису. На Фіг.5 представлено рестрикційну карту вектора pRExCD34. Пропонований штам продуцент Е. соlі BL21HCD34, одержаний шляхом трансформації штаму прототипу BL21(DE3) плазмідним експресуючим вектором pRExCD34, що має нуклеотидну послідовність ДНК розміром 810п.н., яка відповідає модифікованому генно-інженерному рекомбінантному білку rExhCD34. Із застосуванням генноінженерних підходів штам Е. coli BL21(DE3) набув здатності продукувати рекомбінантний антиген rExhCD34, який по завершенню біосинтезу накопичується внутрішньоклітинно у фракції білків тілець включення. Культурально-морфологічна характеристика. Продуцент добре росте на рідких та агаризованих поживних середовищах на основі дріжджового екстракту та бактотриптону. На поживних середовищах за температури 37С час подвоєння бактеріальних клітин у логарифмічній фазі росту становить близько 20 хвилин. Фізіолого-біохімічна характеристика. Оптимальна для росту температура складає 30-37С та рН 7,2-7,8. Маркерні характеристики. Штам продуцент є резистентним до антибіотику канаміцину. Біотехнологічна характеристика. Нарощування клітин відбувається на середовищі що містить 12% глюкози та 50мкг/мл канаміцину. Суперсинтез рекомбінантного білка проходить за процедурою, що наведена нижче. Штам продукує модифікований генно-інженерний рекомбінантний білок rExhCD34, який по завершенню біосинтезу накопичується внутрішньклітинно у вигляді тілець включення і може бути очищений за процедурою, наведеною нижче. Глікозилювання рекомбінантного білка не відбувається. Вихід цільового продукту варіює у межах 200-500мг на 1л клітинної суспензії. Спосіб одержання штаму-продуценту буде легко оцінений спеціалістами даної галузі на основі прикладів і наступного опису. Штам-продуцент одержували шляхом трансформації вихідного штаму Е. coli BL21(DE3) плазмідним експресуючим вектором pRExCD34, що має послідовність ДНК, відповідаючу за експресію генно-інженерного рекомбінантного білка rExhCD34. Оскільки вихідний штам є загальнодоступним, процедура депозитування не проводилась. Білок rExhCD34 може бути синтезований і виділений з клітин продуценту відповідно до способів суперсинтезу та одержання очищеного і розчинного модифікованого генноінженерного рекомбінантного білка rExhCD34, які приведено нижче. Пропонований спосіб суперсинтезу модифікованого генно-інженерного рекомбінантного білка rExhCD34 штамом продуценту Е. coli BL21hCD34, в якому культивування продуценту проводять на середовищі, що містить лактозу і глюкозу. Продукування рекомбінантного білка rExhCD34 в бактеріальних клітинах може бути здійснено з використанням методик, відомих спеціалістам даної 13 галузі. Однак, як вказано, даний винахід забезпечує оптимальний спосіб продукування рекомбінантного білка rExhCD34, за допомогою якого досягається максимальне накопичення цільового білка штамом продуцентом у лабораторних умовах, а також використовується лактоза, яка є значно дешевшою ніж загальновживаний індуктор експресії ізопропіл-бета-D-галактопіранозид (ІПТГ). Відповідно до винаходу спосіб суперсинтезу модифікованого генно-інженерного рекомбінантного білка rExhCD34 штамом продуценту Е. coli BL21hCD34 полягає у інокуляції аліквоти бактеріальної культури із вихідного її стоку безпосередньо у поживне рідке середовище, що містить лактозу і глюкозу у кінцевих концентраціях, 0.2% і 0.05% відповідно. Культивування проводили при 30 або 37С і інтенсивній аерації протягом 20-24 год., кінцева оптична щільність культури продуценту індукованої у такий спосіб складала OD600=12-15. Вихід рекомбінантного білка rExhCD34, який становить до 500мг на 1л клітинної суспензії, визначали електрофоретичним розділенням сумарних білків продуценту в 12%-му поліакриламідному гелі з наступним денситометруванням електрофореграм і порівнянням цільового білка із білком відомої концентрації відповідно до стандартної методики денситометрії білків, відомої спеціалістам даної галузі. Синтезований білок rExhCD34 виявлявся в клітинних лізатах продуценту і у фракції нерозчинних білків після індукування експресії за вищенаведеним способом у вигляді домінуючої полоси розміром близько 30кДа (Фіг.6). Пропонований спосіб одержання очищеного і розчинного модифікованого генно-інженерного рекомбінантного білка rExhCD34, синтезованого штамом-продуцентом Е. coli BL21hCD34. Технології клонування ДНК дозволяють створювати рекомбінантні білки, які генетично злиті з послідовностями певних пептидів - афінних «міток», що значно спрощує виділення таких білків за допомогою методик очищення та фракціонування на колонках, відомих спеціалістам даної галузі. Однією з таких міток є послідовність олігогістидину, що дозволяє проводити очищення рекомбінантних білків методом металафінної хроматографії. Однак у низці випадків при експресії гетерологічних генів у клітинах Е. coli спостерігається агрегація синтезованих білків, що призводить до накопичення цільового білка у вигляді нерозчинних і неактивних цитоплазматичних агрегатів - тілець включення. Використання такого продуценту як джерела активного рекомбінантного білка створює певні складнощі, пов'язані з необхідністю застосовувати крім етапу очищення цільового білка, етап його виділення у функціональній і розчинній формі (ренатурація) для можливості подальшого практичного застосування. Методи ренатурації білків відомі і включають виділення бактеріальних тілець включення, їх солюбілізацію у розчинах, що містять хаотропні реагенти, і спосіб видалення зазначених реагентів для відновлення біологічно активної структури білкових молекул. У той же час, кожен індивідуальний білок потребує емпіричного пошуку адаптованих схем його одержання у розчинному, очищеному і функціональному стані. Ще однією 93432 14 проблемою одержання білків у такий спосіб є досягнення високого виходу розчинного і активного білка із фракції тілець включення а також технологічність схеми його одержання. У випадку складних білків, прикладом яких є антиген CD34, який містять декілька доменів і три дисульфідні містки, задача ренатурації ускладнюється також необхідністю відновлення нативної структури кожного домену та коректним паруванням SH-груп цистеїнових залишків. Авторами було показано, що при вищезазначених умовах культивування штамупродуценту і суперсинтезі рекомбінантний білок rExhCD34 накопичується у фракції тілець включення. В даному аспекті пропонований винахід вирішує проблеми відомого рівня техніки і забезпечує спосіб виділення рекомбінантного білка rExhCD34 з бактеріальних клітин, за допомогою якого останній може бути одержаний в одну стадію із збереженням властивих нативному білку антигенних детермінант, з високим ступенем чистоти і у розчинній формі. Відповідно до винаходу зазначений спосіб включає осадження бактеріальних клітин після завершення біосинтезу центрифугуванням, руйнування бактеріальних клітин і хромосомної ДНК у присутності лізоциму та ДНК-ази, осадження фракції тілець включення центрифугуванням, промивання тілець включення розчинами, що містять неіонні детергенти шляхом суспендування осаду з наступним осадженням центрифугуванням, солюбілізацію тілець включення у присутності сечовини або гуанідин гідрохлориду, очищення солюбілізованого білка металафінною хроматографією на колонці у присутності сечовини або гуанідин гідрохлориду, ренатурацію білка, який іммобілізовано на хроматографічній колонці, шляхом контрольованого видалення сечовини або гуанідин гідрохлориду, елюція розчинного і очищеного рекомбінантного білка з хроматографічної колонки у нативних умовах. Спосіб виділення рекомбінантного білка rExhCD34 з бактеріальних клітин буде легко оцінений спеціалістами даної галузі на основі опису і прикладів. Процес ренатурації і очищення автоматизується у разі використання хроматографічної системи, що програмується (Фіг.7). Відповідно до винаходу вихід розчинного білка rExhCD34 виділеного ренатурацією із тілець включення Е. соlі складав більше 85%, відсоток мономерної форми rExhCD34, визначений розділенням очищеного ренатурованого білка в поліакриламідному гелі за відсутності 2-меркаптотанолу, складав більше 50. При внесенні 5мкг і наступному розділені в 12%-му поліакриламідному гелі у присутності додецилсулфату натрію очищений і ренатурований білок виявлявся як дискретна полоса з молекулярною масою близько 30кДа (Фіг.8). Чистота розчинного продукту, розрахована методом денситометрії електрофореграм, складала більше 95%, концентрація у пробі після ренатурації - 0.8-1.5мг/мл. Ізоелектрична точка рекомбінантного білка РІ=6.06, коефіцієнт поглинання при 280нм - 1. Ренатурований білок був стабільним і не агрегував у разі зберігання у розчині на +4С протягом декількох міся 15 ців. Очищений білок rExhCD34, виділений ренатурацією з бактеріальних тілець включення, зберігав активні антигені детермінанти нативного поверхневого антигену CD34 людини, що проявляється у здатності рекомбінантного антигену індукувати при імунізації тварин вироблення специфічних поліклональних антитіл, що здатні розпізнавати нативний антиген на поверхні культури CD34+ клітин людини у разі використання стандартних імунохімічних методів аналізу. Суть винаходу пояснюється графічними матеріалами, де: на Фіг.1 показана амінокислотна послідовність рекомбінантного білка. rExhCD34, 269 амінокислот. Молекулярна маса рекомбінантного білка 28.8кДа. Ізоелектрична точка рекомбінантного білка РІ=6.06; на Фіг.2 - схема структури молекули поверхневого антигену CD34 людини (а) і модифікованого рекомбінантного антигену rExhCD34 (б); на Фіг.3 - послідовність ДНК рекомбінантного білка rExhCD34, 810п.н.; на Фіг.4 - послідовності олігонуклеотидних праймерів із сайтами унікальних рестриктаз для ампліфікації ДНК білка rExhCD34 із кДНК і клонування в плазмідному векторі; на Фіг.5 - рестрикційна карта плазмідного експресуючого вектора pRExCD34; на Фіг.6 - електрофоретичний аналіз експресії білка rExhCD34 створеним штамом продуцентом. 1 - сумарний лізат клітин продуценту після культивування протягом 20 год. у присутності індуктора експресії. 2 - фракція нерозчинних білків клітин (тільця включення). 3 - фракція розчинних білків клітин. 4 - маркер молекулярної маси білків. на Фіг.7 - хроматограма ренатурації і очищення білка rExhCD34 із тілець включення на металафінному сорбенті. 1 - солюбілізований із тілець включення білок, який наносився на колонку. 2 білки, які не зв'язалися із сорбентом. 3 - очищений і розчинний білок, одержаний елюцією з колонки у присутності імідазолу. на Фіг.8 - електрофоретичний аналіз фракцій білків. 1 - солюбілізований із тілець включення білок, який наносився на металафінний сорбент. 2 - білки, які не зв'язалися із сорбентом. 3 - очищений і розчинний білок, одержаний елюцією з колонки у присутності імідазолу. 4 - маркери молекулярної маси білків. Приклад 1. Одержання ДНК rExhCD34 Даний приклад описує одержання ДНК що кодує rExhCD34. Виділення тотальної РНК. Виділення тотальної РНК з клітинної лінії KG1 проводили за методом [Sambrook, Joseph Molecular cloning: a laboratory manual /E.F. Fitsch, T. Maniatis - 2-nd ed. Cold Spring Harbor Laboratory Press, Cold Spring Harbor, 1989 V.I, p.7.19-7.25]. До осаду клітин (107) додавали 1мл буферу GTB (4 М гуанідин тіоціонат; 25мМ цитрат натрію; 0,5% N-лаурилсаркозин; 0,1М 2-меркаптоетанол, рН 7,0), вносили 0,1 об'єму розчину 3М ацетату натрію, рН 5,0, розчин ретельно перемішували та декілька разів пропускали через шприц для руйнування хромосомальної ДНК. Отриманий лізат клітин двічі екстрагували 93432 16 рівним об'ємом суміші фенол/хлороформ/ізоаміловий спирт (1:1:0.02), центрифугували 10хв. 16000 g, РНК із супернатанту осаджували 96%-м етанолом. Виділену РНК аналізували електрофорезом у денатурувальних умовах за стандартною методикою [Sambrook, Joseph Molecular cloning: a laboratory manual /E.F. Fitsch, T. Maniatis - 2-nd ed. Cold Spring Harbor Laboratory Press, Cold Spring Harbor, 1989 V.I, p.7.43-7.45]. Виділення мРНК. Виділення фракції Poly-A(+) РНК проводили афінною хроматографію з використанням оліго-dT-целюлози і рекомендованих протоколів виробника відповідного набору реактивів, наприклад QuickPrep mRNA Purification Kit виробництва GE Helthcare. Концентрацію очищеної мРНК розраховували за значенням адсорбції А260. Одержання кДНК. З використанням методу зворотної транскрипції полімеразної ланцюгової реакції із матричної РНК, ізольованої із CD34+ клітин, синтезували кДНК за наступною методикою. В стерильну пробірку для ПЛР вносили: мРНК - 0.5мкг, гехсануклеотидний праймер з випадковою послідовністю (100uМ) - 1мкл, вода чиста від РНКаз - до загального об'єму 12мкл. Суміш прогрівали 6хв. при 65С і охолоджували на льоду. В охолоджену суміш вносили 5-ти кратний концентрат реакційного буферу для ЗТ-ПЛР - 4мкл, RiboLock™ RNase Inhibitor (20u/l) виробництва Fermentas 1мкл, 10mM dNTP mix - 2мкл, RevertAid™ M-MuLV Reverse Transcriptase (200u/l) виробництва Fermentas - 1мкл до загального об'єму 20мкл, і інкубували при 42С протягом 60хв. Одержання дволанцюгової ДНК. За допомогою полімеразної ланцюгової реакції (ПЛР) одержували дволанцюгову ДНК, що кодує рекомбінантний білок rExhCD34, який відповідає зовнішньоклітинному домену поверхневого антигену CD34 людини без послідовності N-кінцевого лідерного пептиду. Для цього використовували олігонуклеотидні праймери, послідовності яких приведено на Фіг.4, і готували наступну суміш: кДНК - 5мкл, 10-ти кратний концентрат буферу для ПЛР - 5мкл, праймер 1 (20uМ) - 1мкл, праймер 2 (20uМ) - 1мкл, (Pfu ДНКполімераза - 5 одиниць активності, 2мМ dNTP 5млк, 25 MgCl2 - 4мкл, стерильна деіонізована вода - до загального об'єму реакційної суміші 50мкл. Для ампліфікації ДНК проби використовували термоциклер, що програмується. ПЛР проводили за наступних умов: денатурація - 95С 30сек., віджиг праймерів - 55С 1хв., елонгація - 72С 1хв. загалом 30 циклів ампліфікації. По завершенню - інкубували 10хв. при 72С. Продукт ампліфікації виявлявся електрофорезом в 1%-му агарозному гелі з наступним фарбуванням бромідом етидію і візуалізацією при 312нм у вигляді дискретної полоси 810п.н. Приклад 2. Конструювання експресуючого вектора pRExCD34 Ампліфіковану ДНК клонували у плазмідному векторі для експресії в клітинах Е. соlі і секвенували для підтвердження ідентичності з ДНК зовнішньоклітинного домену поверхневого антигену CD34 людини. Першою стадією був гідроліз одержаної ДНК rExhCD34 ендонуклеазами рестрикції 17 NdeI і XhoI. Очищену за стандартною методикою ДНК (1мкг) вносили в стерильну мікроцентрифужну пробірку і додавали 10-ти кратний концентрат О-буфера виробництва Fermantas - 5мкл, рестриктази NdeI виробництва Fermantas - 2мкл, рестриктази XhoI виробництва Fermantas - 2мкл, стерильної деіонізованої води - до загального об'єму реакційної суміші 50мкл і інкубували на водяній бані 2 год. при 37С. Одержану ДНК осаджували додаванням 100мкл 96% етанолу і 5мкл 5М ацетату калію з наступним центрифугуванням 5хв. при 16000g, розчиняли в 10мкл стерильної деіонізованої води і використовували для лігування з ДНКвектором рЕТ-24, гідролізованого тими ж самими рестриктазами за вищенаведеною схемою. Очищені фрагменти ДНК rExhCD34 810п.н. (50нг) і вектора (150нг) об'єднували у реакції лігування: фрагмент ДНК - 5мкл, вектор - 10мкл, 10-ти кратний концентрат буфера для лігування ДНК виробництва Fermantas - 2мкл, Т4 ДНК-лігаза (5од/мкл) виробництва Fermantas - 1мкл, стерильна деіонізована вода - до загального об'єму реакційної суміші 20мкл, 1 год. при 20С. Суміш інактивували прогріванням 10хв. при 65С і використовували для трансформації Е. соlі штаму DH10B методом електропорації. Одержані колонії аналізували на наявність клонованого фрагменту ДНК 810п.н. шляхом виділення плазмідної ДНК, її гідролізом рестриктазами NdeI і XhoI і наступним аналізом одержаних фрагментів в 1%-му агарозному гелі відповідно до стандартної методики. Плазміди клонів, які містили клонований фрагмент ДНК rExhCD34 очікуваної молекулярної маси (810п.н.) використовували для одержання штаму продуценту рекомбінантного білка rExhCD34. Приклад 3. Створення штаму продуценту рекомбінантного білка rExhCD34 Компетентні клітини Е. соlі BL23(DE3) готували використовуючи хлор-кальцієвий метод відповідно до стандартного протоколу, описаного [Sambrook, Joseph Molecular cloning: a laboratory manual /E.F. Fitsch, T. Maniatis - 2-nd ed. Cold Spring Harbor Laboratory Press, Cold Spring Harbor, 1989 V.I, p.1.82-1.84]. До 50мкл суспензії компетентних клітин вносили 5мкл (10нг/мкл) експресуючого вектора pRExCD34 і інкубували 10хв. на льоду. По завершенню суміш інкубували на водяній бані при 42С протягом 2хв., додавали 1мл середовища 2YT (17г/л бактотриптону; 10г/л дріжджового екстракту; 5г/л NaCl), інкубували 1 год. при 37С на орбітальному шейкері і висівали на агаризоване середовище 2YT, що містило 1% глюкози і 50мкг/мл канаміцину (2YT-KG). Індивідуальні колонії нарощували на середовищі 2YT-KG і використовували для створення музею культури штаму продуценту рекомбінантного білка rExhCD34 відповідно до стандартного методу [Sambrook, Joseph Molecular cloning: a laboratory manual /E.F. Fitsch, T. Maniatis - 2-nd ed. Cold Spring Harbor Laboratory Press, Cold Spring Harbor, 1989, V.3, p.A5]. Приклад 4. Суперсинтез рекомбінантного білка rExhCD34 в бактеріях Е. соlі Для одержання rExhCD34 використовували штам Е. coli BL21(DE3), трансформований плазмі 93432 18 дою pRExCD34, яка має маркер селекції канаміцин-резистентності. Плазміда забезпечує індукований аналогами лактози синтез цільового білка, який нагромаджується в цитоплазмі клітин бактерій в ранній стаціонарній фазі росту культури у вигляді тілець включення. Культивування бактерій проводили у 4л колбах при 37С на середовищі 2xYT (17г/л бактотриптону; 10г/л дріжджового екстракту; 5г/л NaCl) з 50мкг/мл канаміцину, 25мМ (NH4)2SO4, 50мМ КН2РО4, 50мМ Na2HPO4, 1мМ MgSO4, 0.05% глюкозю, 0.2% -лактозою, 0.5% гліцеролом, протягом 16-24 годин на шейкеріінкубаторі за інтенсивної аерації (150-200об/хв.). Після закінчення культивування клітини осаджували центрифугуванням при 3000g 10 хвилин при 4С, надосадову рідину видаляли, а осад суспендували в 10мМ буфері Трис-НСl, рН 8 (10мл буферу на 1г клітинного осаду), який містив 1мг/мл лізоциму і 50мкг/мл ДНК-ази і інкубували 20 хвилин за кімнатної температури. Суспензію клітин обробляли ультразвуком на ультразвуковому дезинтеграторі і центрифугували 15 хвилин при 10000g. Супернатант видаляли, а осад суспендували в 10мМ буфері Трис-НСl, рН 8, який містив в собі 0,5% дезоксихолату натрію. Промивання здійснювали шляхом повного суспендування нерозчинного білка на ультразвуковому дезінтеграторі з наступним відділенням осаду центрифугуванням. Одержані тільця включення, які містили рекомбінантний білок rExhCD34, зберігали при – 70С. Одержання різних фракцій білків Е. coli, приготування проб для електрофоретичного розділення в поліакриламідному гелі проводили за стандартними методами [Sambrook, Joseph Molecular cloning: a laboratory manual /E.F. Fitsch, T. Maniatis - 2-nd ed. Cold Spring Harbor Laboratory Press, Cold Spring Harbor, 1989 V.3 p.18.49-18.57]. Для приготування проб білків використовували розведений у 6 разів концентрат буфер складу: 0,3 М трис-НСl; 25% гліцерин; 3,5% додецилсульфат натрію; 0,6М 2меркаптоетанол, 0,5% бром феноловий синій рН (6,8). Електрофорез білків проводили за методом U. Laemmli [Westermeier R. Electrophoresis in practice: a guide to methods and applications of DNA and protein separations. - Weinheim: VCH, 1997. - P. 331], використовуючи для їхнього розділення 1215%-й поліакриламідний гель з 0,1% додецилсульфату натрію. Кількість сумарного білка у різних фракціях клітин визначали методом М. Bradford [Дарбре А. Практическая химия белка: Пер. с англ. - М.: Мир, 1989. - 623с., С.297-298]. Рівень експресії rExhCD34 штамом продуцентом визначали за допомогою сканування і денситометрії електрофореграм використовуючи як стандарт БСА з відомою концентрацією для одержання калібрувальної кривої. Представлена на Фіг.6. електрофореграма показує суперсинтез рекомбінантного білка rExhCD34 бактеріальним штамом-продуцентом і його накопичення у нерозчинній фракції білків клітин - тільцях включення. Приклад 5. Виділення рекомбінантного білка rExhCD34 в очищеному та розчинному стані. Для одержання очищеного і розчинного білка осад тілець включення суспендували в фосфатносольовому буфері ФСБ (0,14М NaCl; 2,7мМ КСl; 19 10мМ Na2HPO4; 1,8мМ КН2РО4, рН 7,4), який містив 8М сечовину або 6М гуанідин-гідрохлорид та 10мМ 2-меркаптоетанол (1мл буферу на 10мг осаду тілець включення), фільтрували через 0.2мкм мембранний фільтр і наносили на хроматографічну колонку з Ni-NTA сефарозою об'ємом 520мл, що урівноважена тим самим буфером. Колонку промивали урівноважуючим буфером (5 об'ємів колонки) за допомогою перистальтичного насосу з наступною промивкою буфером ФСБ (10 об'ємів колонки). Очищений і ренатурований рекомбінантний білок одержували елюцією з колонки у присутності буферу ФСБ, який містив 0.3М імідазол. На Фіг.7 представлено типову хроматограму процесу рефолдінгу та очищення білка rExhCD34 у разі використання автоматизованої хроматографічної системи типу FPLC. Моніторинг фракцій, що містять білок, проводили спектрофотометрично при 280нм за допомогою UV-монітору. Одержані елюцією фракції білків аналізували електрофорезом. Електрофорез білків проводили за методом U. Laemmli [Westermeier R. Electrophoresis in practice: a guide to methods and applications of DNA 93432 20 and protein separations. - Weinheim: VCH, 1997. - P. 331], використовуючи для їхнього розділення 1215%-й поліакриламідний гель з 0,1%-м додецилсульфату натрію. Кількість сумарного білка у різних фракціях клітин визначали методом М. Bradford [Дарбре А. Практическая химия белка: Пер. с англ. - М.: Мир, 1989. - 623с., С.297-298]. Чистоту та концентрацію rExhCD34 визначали за допомогою сканування і денситометрії електрофореграм використовуючи як стандарт БСА з відомою концентрацією для одержання калібрувальної кривої. На Фіг.8. показано чистоту різних фракцій білків, одержаних при проведенні процесу рефолдінгу та очищення білка rExhCD34 методом металафінної хроматографії. Кінцевий продукт - рекомбінантний білок, мав молекулярну масу 28.8кДа, і був гомогенним при електрофорезі в ПААГ. При імунізації тварин білок rExhCD34 індукує вироблення поліклональних антитіл, які специфічно виявляють нативний антиген CD34 людини на поверхні клітин тестової культури KGl у разі використання стандартних імунохімічних методик. 21 93432 22 23 Комп’ютерна верстка А. Крижанівський 93432 Підписне 24 Тираж 23 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюModified genetically engineered recombinant protein, representing properties of human surface antigen cd34
Автори англійськоюKordium Vitalii Arnoldovych, Hilchyk Pavlo Volodymyrovych, Irodov Dmytro Mykhailovych, Fliak Andrii Ihorovych, Horbatiuk Oksana Borysivna, Nikolaiev Yulian Serhiiovych, Hilchuk Yuliia Mykolaivna
Назва патенту російськоюМодифицированный генно-инженерный рекомбинантный белок, который имитирует свойства поверхностного антигена cd34 человека
Автори російськоюКордюм Виталий Арнольдович, Гильчук Павел Владимирович, Иродов Дмитрий Михайлович, Фляк Андрей Игоревич, Горбатюк Оксана Борисовна, Николаев Юлиан Сергеевич, Гильчук Юлия Николаевна
МПК / Мітки
МПК: C12N 15/12
Мітки: властивості, генно-інженерний, рекомбінантний, антигену, імітує, людини, поверхневого, модифікований, білок
Код посилання
<a href="https://ua.patents.su/12-93432-modifikovanijj-genno-inzhenernijj-rekombinantnijj-bilok-shho-imitueh-vlastivosti-poverkhnevogo-antigenu-cd34-lyudini.html" target="_blank" rel="follow" title="База патентів України">Модифікований генно-інженерний рекомбінантний білок, що імітує властивості поверхневого антигену cd34 людини</a>
Попередній патент: Спосіб підвищення ефективності протипухлинної вакцини
Наступний патент: Пристрій для охолоджування ущільнення компресора газотурбінного двигуна
Випадковий патент: Звукопоглинаюча плита