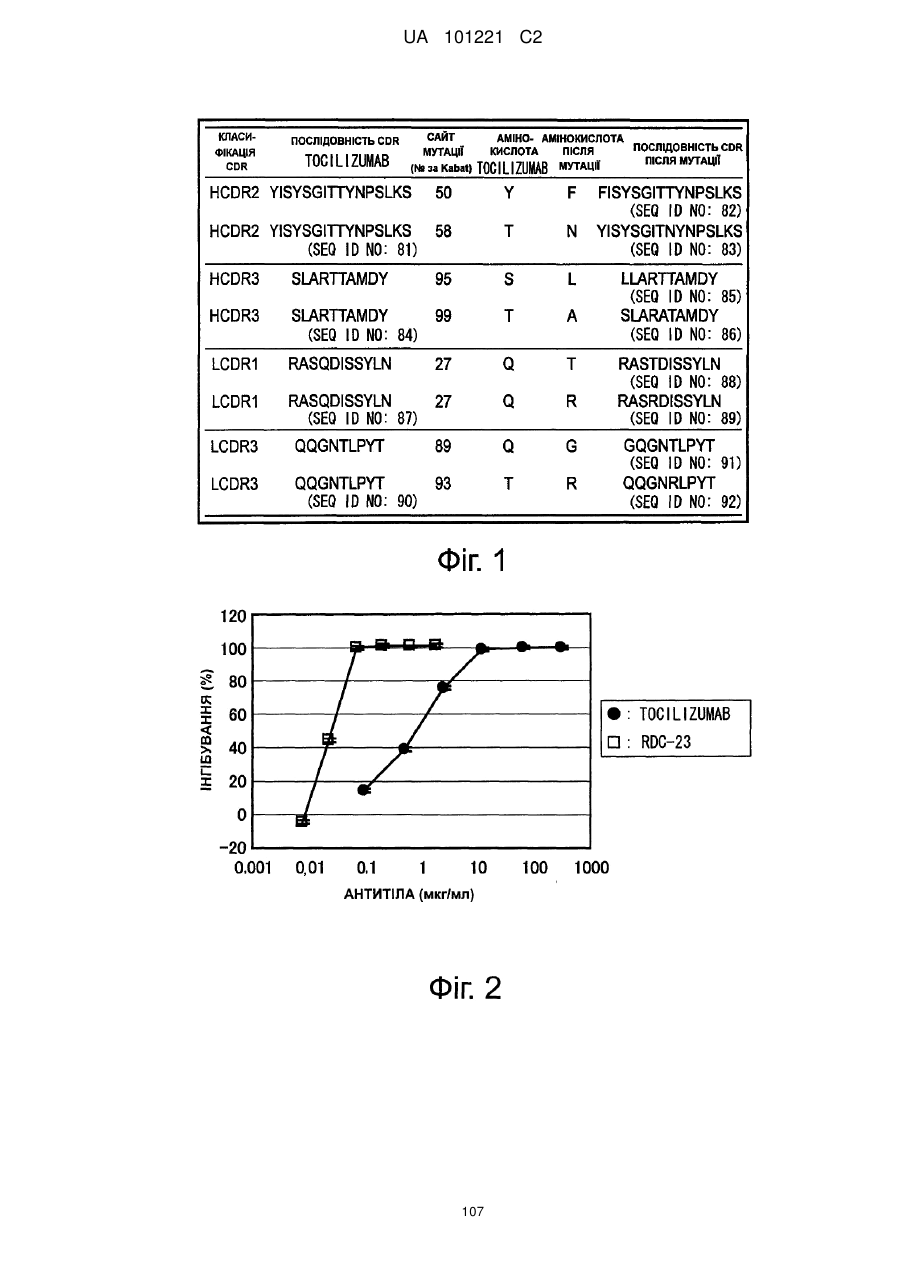
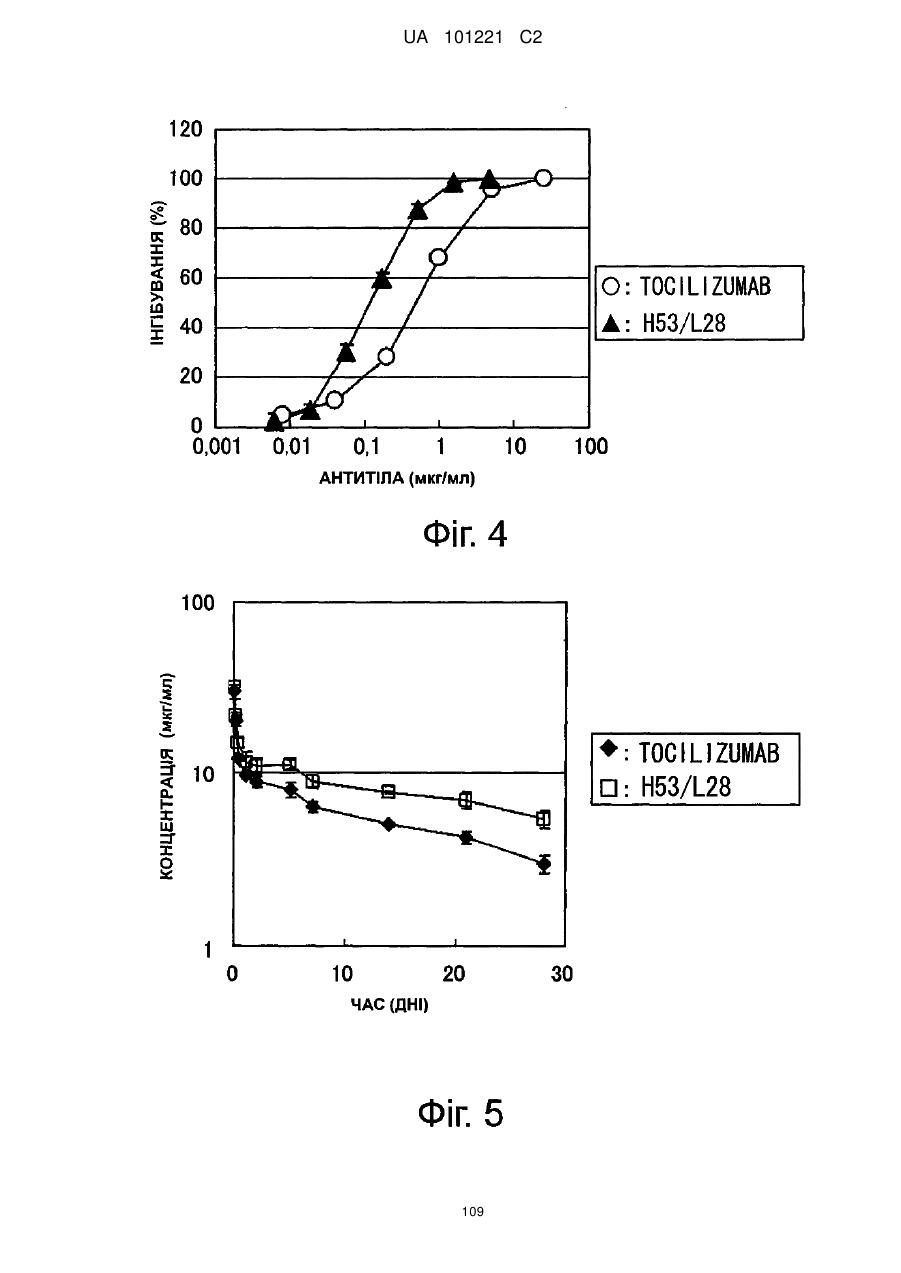
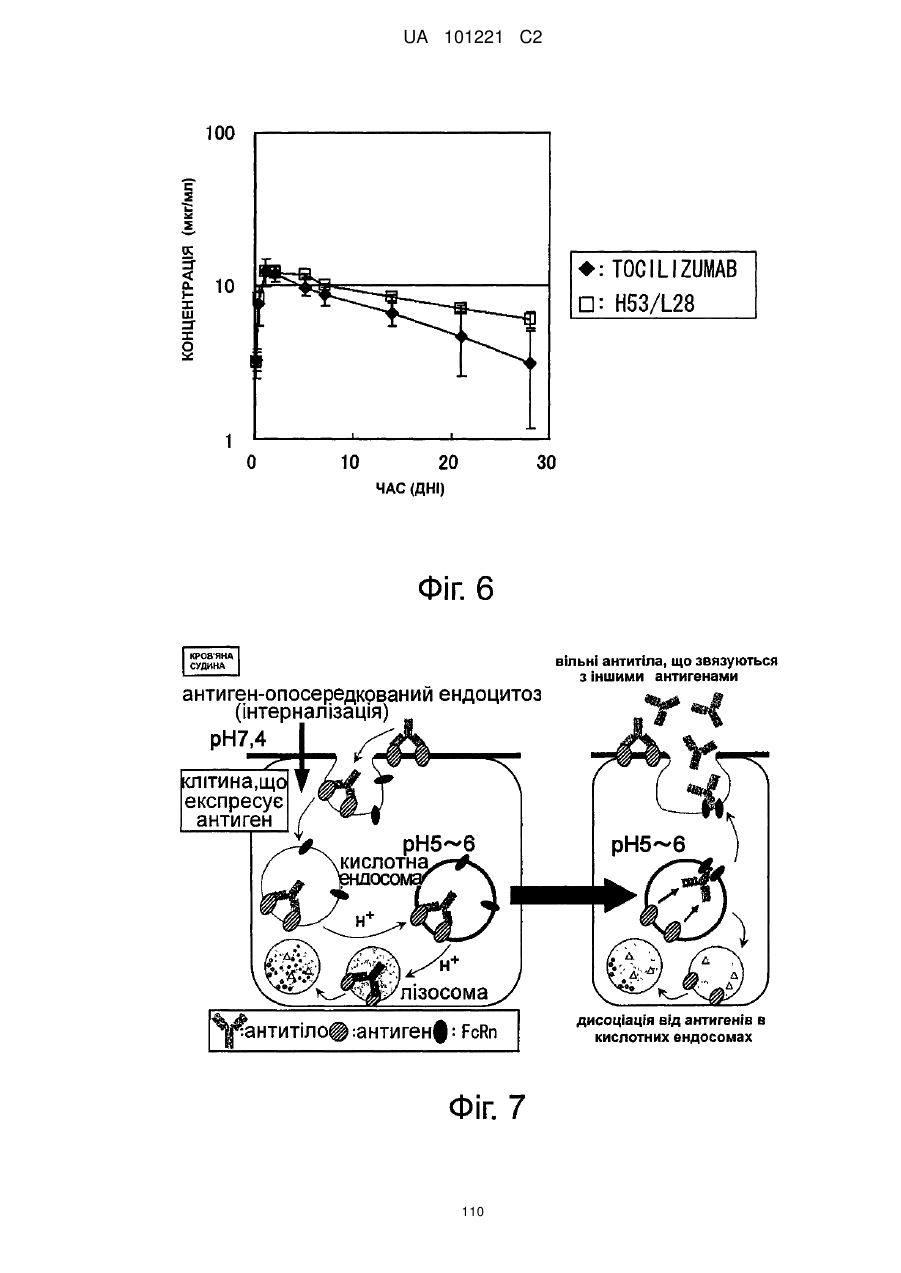
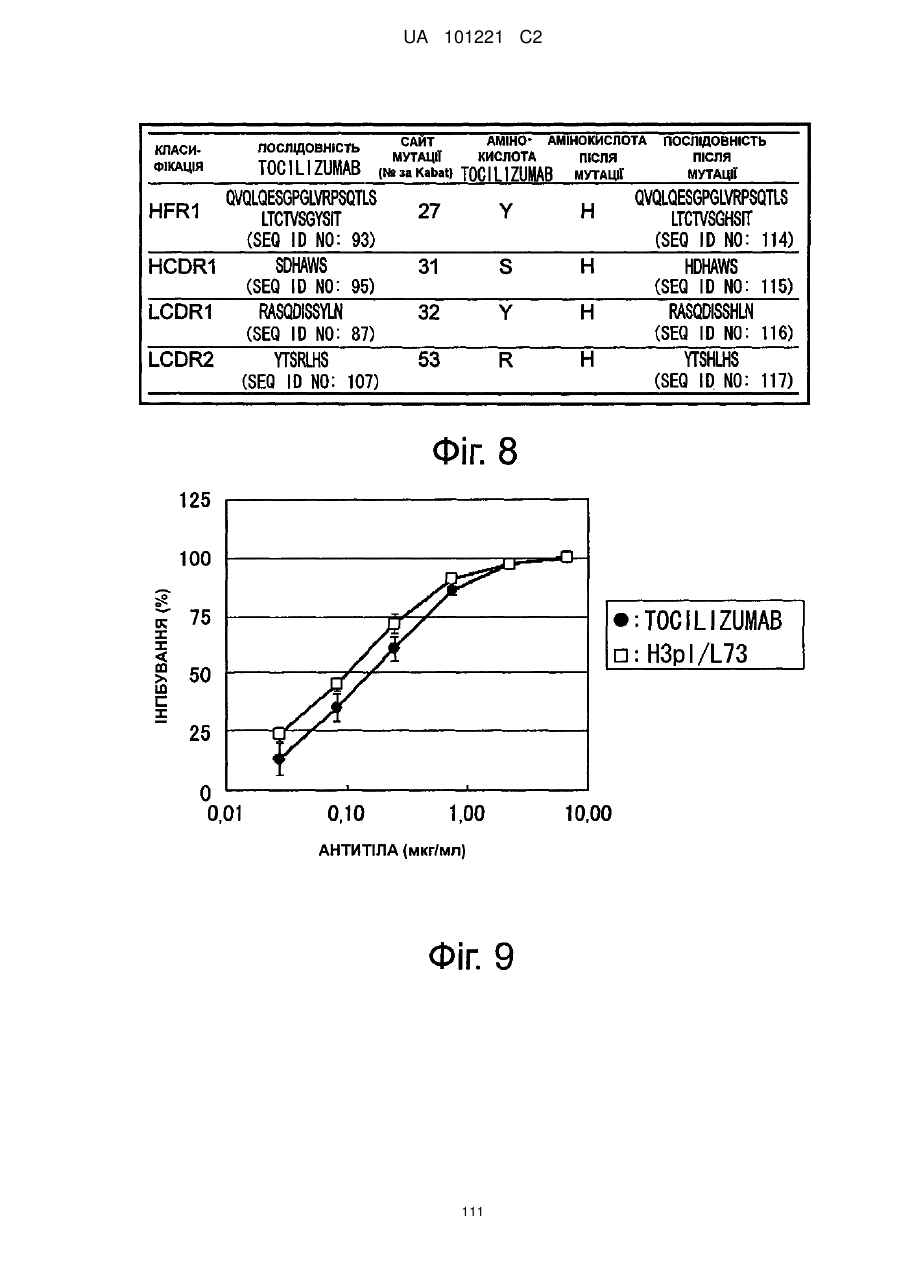
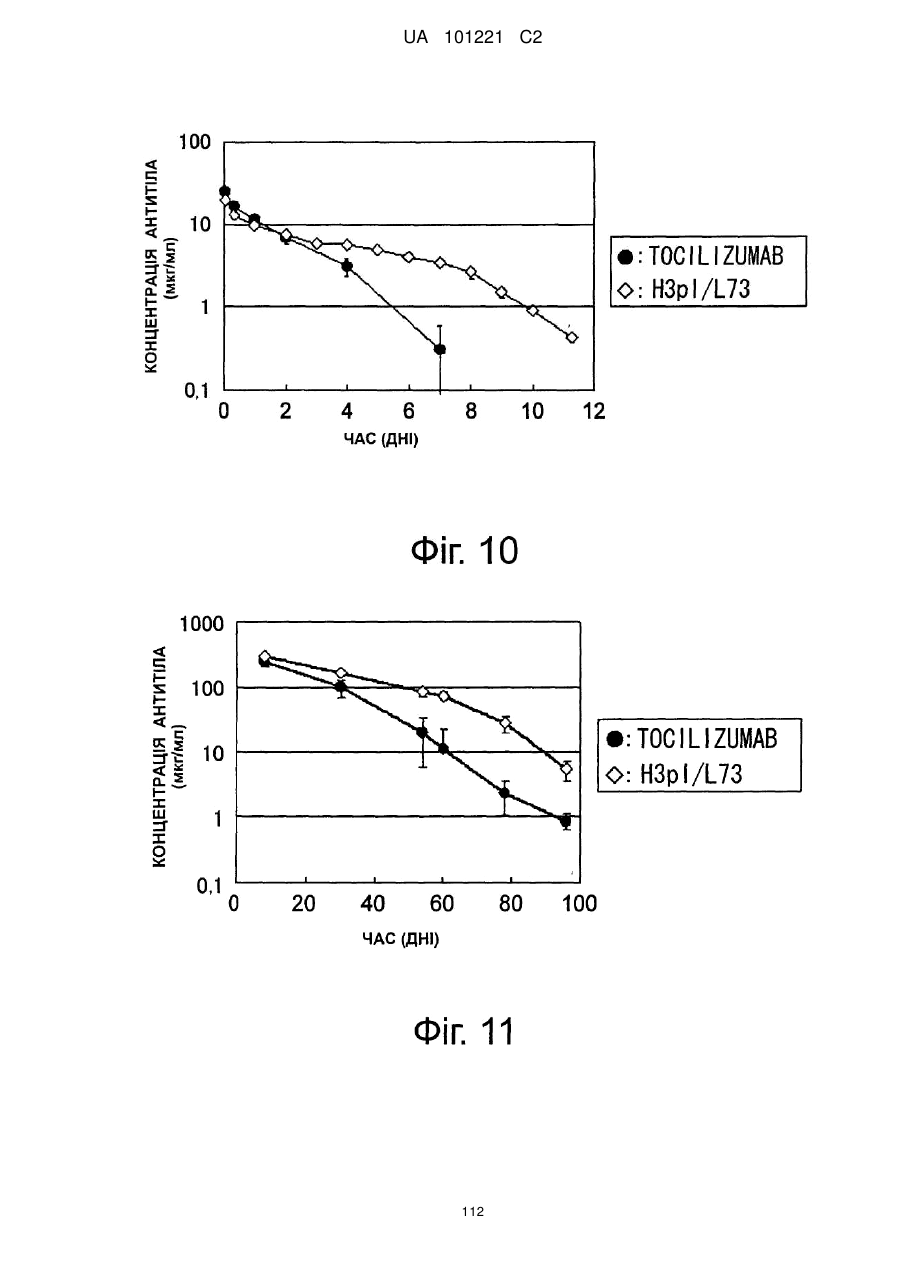
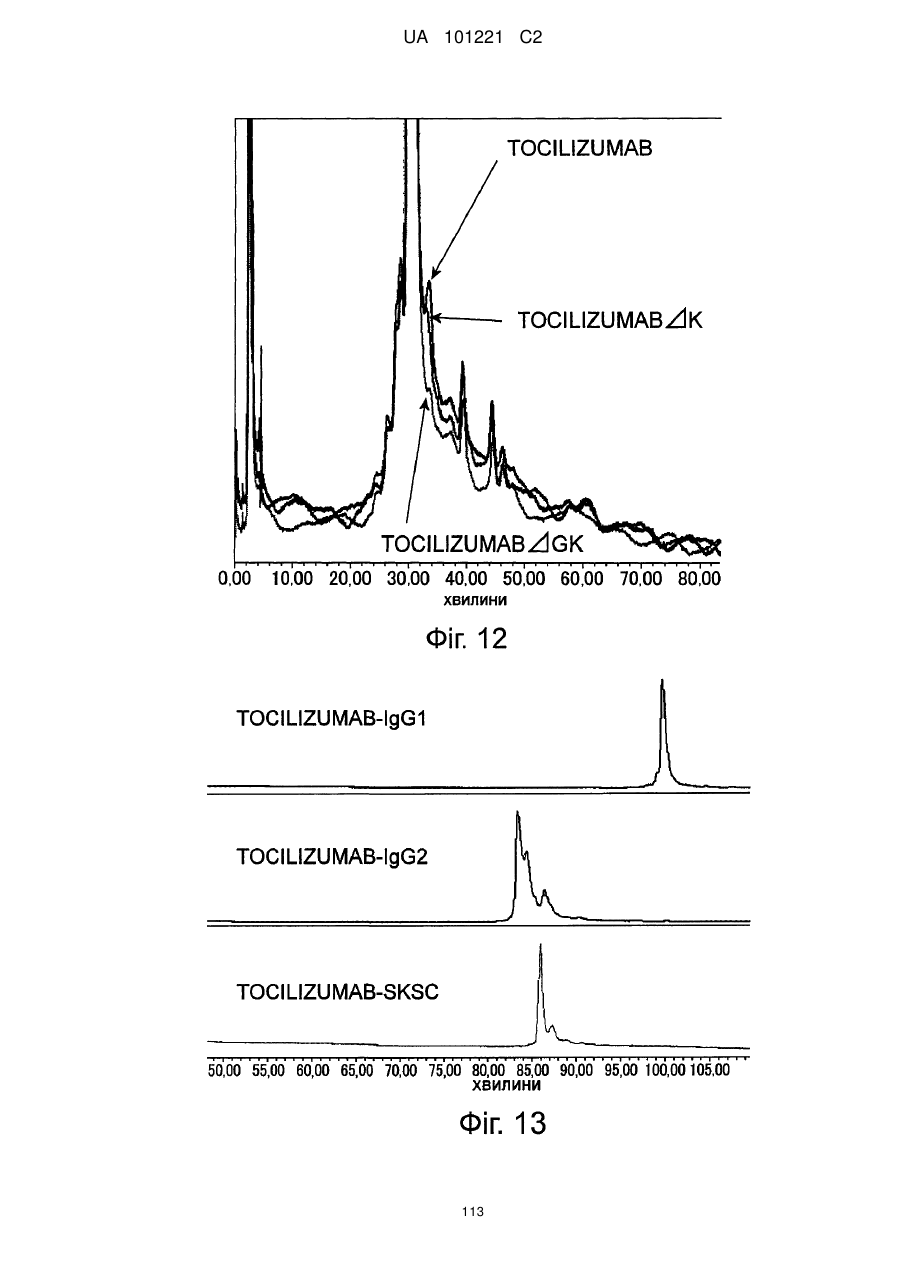
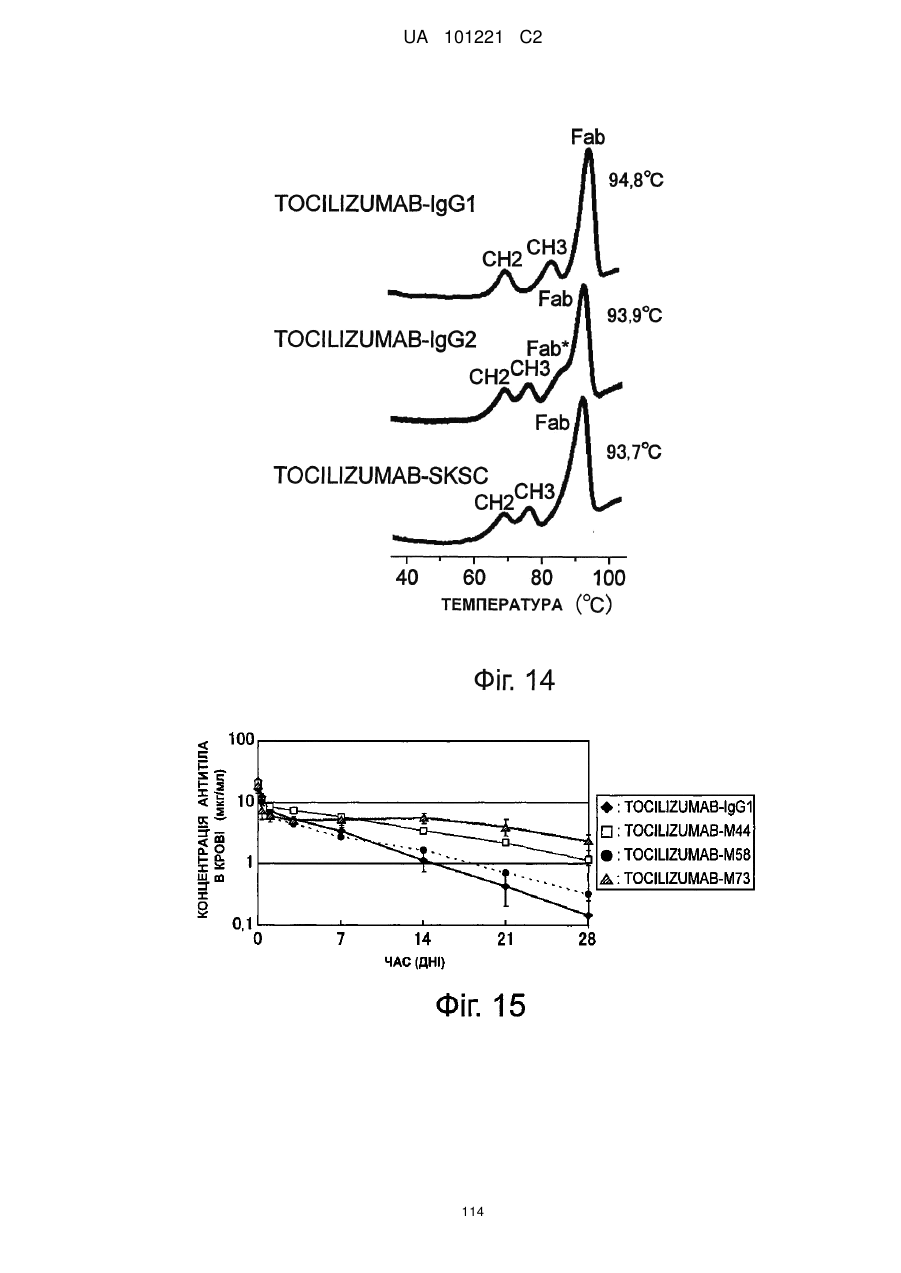
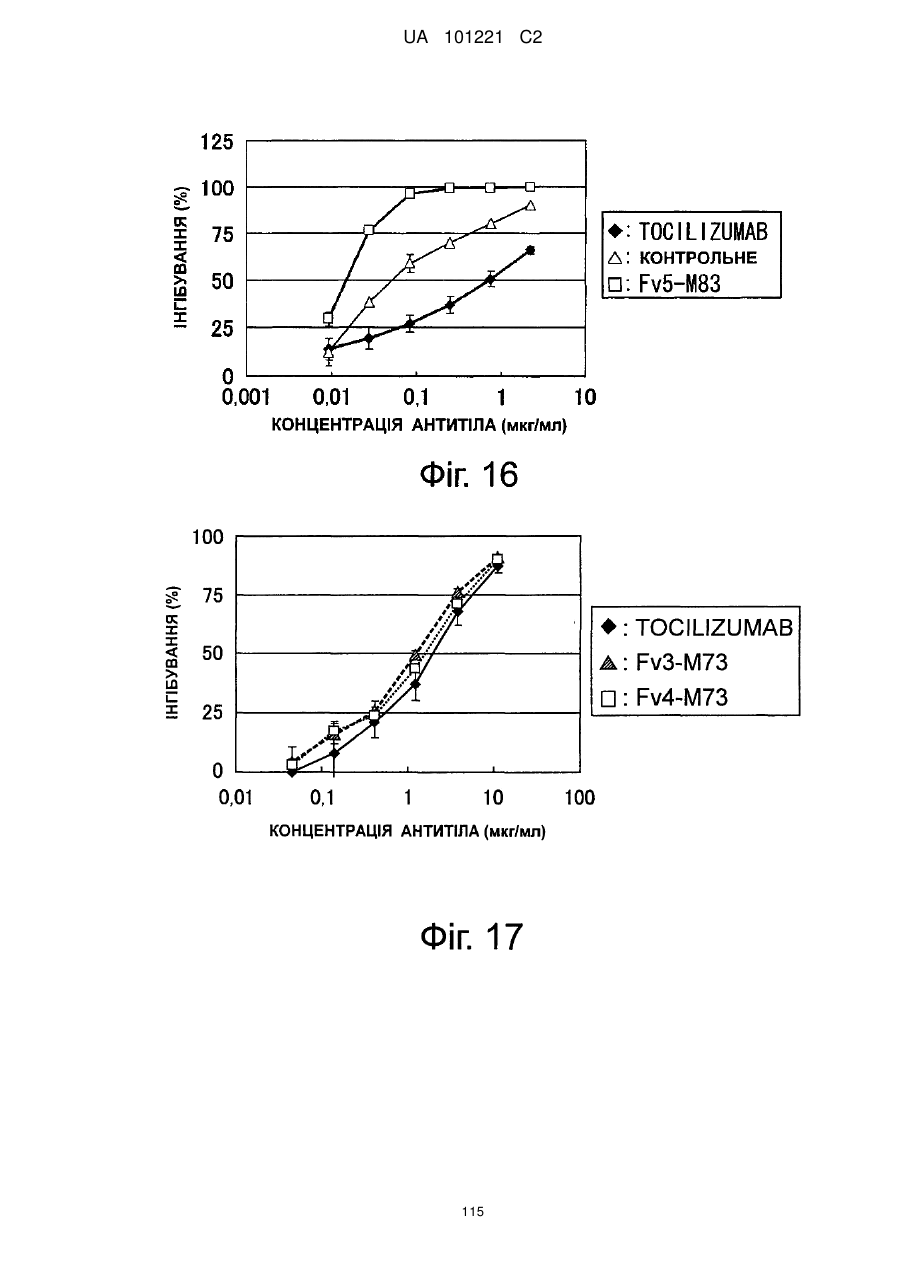
Молекули поліпшеного антитіла
Номер патенту: 101221
Опубліковано: 11.03.2013
Автори: Татібана Тацухіко, Цунода Хіроюкі, Сіраїва Хіротаке, Іґава Томоюкі, Кодзіма Тецуо, Ісіі Сінія, Сакурай Міка, Хіґуті Йосінобу, Маеда Ацухіко
Формула / Реферат
1. Антитіло, вибране з:
(a) антитіло, яке включає варіабельну ділянку важкого ланцюга, яка включає послідовність SEQ ID NO: 19 (варіабельна ділянка VH4-M73), та варіабельну ділянку легкого ланцюга, яка включає послідовність SEQ ID NO: 22 (варіабельна ділянка VL1);
(b) антитіло, яке включає варіабельну ділянку важкого ланцюга, яка включає послідовність SEQ ID NO: 20 (варіабельна ділянка VH3-M73), та варіабельну ділянку легкого ланцюга, яка включає послідовність SEQ ID NO: 23 (варіабельна ділянка VL3); та
(c) антитіло, яке включає варіабельну ділянку важкого ланцюга, яка включає послідовність SEQ ID NO: 21 (варіабельна ділянка VH5-M83), та варіабельну ділянку легкого ланцюга, яка включає послідовність SEQ ID NO: 24 (варіабельна ділянка VL5).
2. Антитіло, вибране з:
(a) антитіло, яке включає важкий ланцюг, який включає послідовність SEQ ID NO: 25 (VH4-M73), та легкий ланцюг, який включає послідовність SEQ ID NO: 28 (VL1);
(b) антитіло, яке включає важкий ланцюг, який включає послідовність SEQ ID NO: 26 (VH3-M73), та легкий ланцюг, який включає послідовність SEQ ID NO: 29 (VL3); та
(c) антитіло, яке включає важкий ланцюг, який включає послідовність SEQ ID NO: 27 (VH5-M83), та легкий ланцюг, який включає послідовність SEQ ID NO: 30 (VL5).
3. Ген, що кодує антитіло за будь-яким з пп. 1 або 2.
4. Вектор, що містить ген за п. 3.
5. Клітина-хазяїн, що містить вектор за п. 4.
6. Спосіб виробництва антитіла за будь-яким з пп. 1 або 2 шляхом культивування клітини-хазяїна за п. 5.
7. Фармацевтична композиція, яка містить антитіло за будь-яким з пп. 1 або 2 або антитіло, вироблене способом за п. 6.
Текст
Реферат: Винахід належить до антитіл, які є молекулами другого покоління із змінами у амінокислотних послідовностях варіабельної та константної ділянок TOCILIZUMAB, що є гуманізованим антитілом IgG1 проти рецептора IL-6, а також до фармацевтичної композиції, яка містить зазначені антитіла для підсилення антиген-зв'язувальної здатності та покращання фармакокінетики, так щоб терапевтичний ефект виникав при меншій частоті введення, з кращою імуногенністю, безпечністю та фізико-хімічними властивостями (стабільність та гомогенність). UA 101221 C2 5 10 15 20 25 30 35 40 45 50 55 60 Галузь техніки Цей винахід стосується фармацевтичних композицій, які містять антитіло проти рецептора IL-6 як активний інгредієнт, способів виробництва композицій та їм подібного. Попередній рівень техніки Антитіла привертають увагу як фармацевтичні засоби, оскільки вони є надзвичайно стабільними у плазмі та мають мало негативних ефектів. Серед них ряд фармацевтичних препаратів на основі антитіла типу IgG є доступними на ринку, та багато фармацевтичних препаратів на основі антитіл зараз знаходяться у розробці (непатентні документи 1 та 2). IL-6 це цитокін, залучений у різноманітні аутоімунні хвороби, запалювальні хвороби, злоякісні пухлини тощо (непатентний документ 3). TOCILIZUMAB, гуманізоване антитіло IgG1 проти рецептора IL-6, специфічно зв'язується з рецептором IL-6. Вважають, що TOCILIZUMAB можна застосовувати як терапевтичний агент для пов'язаних з IL-6 хвороб, таких як ревматоїдний артрит, оскільки воно нейтралізує біологічну активність IL-6 (патентні документи 1-3 та непатентний документ 4). TOCILIZUMAB ухвалили як терапевтичний агент для хвороби Каслмана та ревматоїдного артриту у Японії (непатентний документ 5). Гуманізовані антитіла, такі як TOCILIZUMAB, є фармацевтичними препаратами на основі антитіл першого покоління. Фармацевтичні препарати на основі антитіл другого покоління зараз розробляються з метою покращення ефективності, зручності застосування та вартості фармацевтичних препаратів на основі антитіл другого покоління. У розробці знаходяться різні технології, які можна застосовувати до фармацевтичних препаратів на основі антитіл другого покоління. Повідомлялося про технології підвищення ефекторної функції, антиген-зв'язувальної здатності, фармакокінетики та стабільності, а також про технології зниження ризику імуногенності. Як про способи підвищення ефективності ліків або зменшення дози повідомлялося про технології, які підсилюють залежну від антитіла, опосередковану клітинами цитотоксичну активність (активність ADCC) або комплемент-залежну цитотоксичну активність (активність CDC) внаслідок амінокислотного заміщення на ділянці Fc антитіла IgG (непатентний документ 6). Крім того, повідомлялося про формування афінності як про технологію підвищення антиген-зв'язувальної здатності або антиген-нейтралізуючої здатності (непатентний документ 7). Ця технологія дозволяє підвищити антиген-зв'язувальну активність шляхом введення амінокислотних мутацій в гіперваріабельну ділянку (CDR) варіабельної ділянки або подібне. Підвищення антиген-зв'язувальної здатності покращує біологічну активність in vitro або дозволяє знизити дозу та, крім того, покращує ефективність in vivo (непатентний документ 8). Зараз здійснюються клінічні випробування, щоб оцінити Motavizumab (виробляється внаслідок формування афінності), яке, як очікують, має вищу ефективність порівняно з Palivizumab, фармацевтичним препаратом на основі антитіла проти RSV першого покоління (непатентний документ 9). Повідомлялося про антитіло проти рецептора IL-6 з афінністю, яка становить приблизно 0,05 нМ (тобто, з більшою афінністю, ніж афінність TOCILIZUMAB) (патентний документ 4). Проте, нема жодного повідомлення, яке б описувало антитіло людини, гуманізоване антитіло або химерне антитіло, яке б мало афінність більшу, ніж 0,05 нМ). Проблема, з якою стикаються при розробці сучасних фармацевтичних препаратів на основі антитіл, полягає у високій вартості виробництва, яка пов'язана з введенням надзвичайно великої кількості білка. Наприклад, було підраховано, що доза TOCILIZUMAB, гуманізованого антитіла IgG1 проти рецептора IL-6, становить приблизно 8 мг/кг/місяць за умови внутрівенної ін'єкції (непатентний документ 4). Його переважна форма для введення - це склад для підшкірного введення при хронічних аутоімунних хворобах. Зазвичай необхідно, щоб склади для підшкірного введення були фармацевтичними складами з високою концентрацією. З точки зору стабільності або їй подібного, обмеження для складів на основі антитіл типу IgG зазвичай становить приблизно 100 мг/мл (непатентний документ 10). Недорогі зручні фармацевтичні препарати на основі антитіла другого покоління, які можна вводити підшкірно за більш тривалими інтервалами, можна отримати шляхом підвищення періоду напіврозпаду антитіла у плазмі, щоб подовжити його терапевтичний ефект та тим самим зменшити кількість білка, що вводиться, а також шляхом надання антитілу високої стабільності. FcRn безпосередньо залучається у фармакокінетику антитіла. З точки зору відмінності періоду напіврозпаду у плазмі ізотипів антитіла, IgG1 та IgG2, відомо, що вони мають більш тривалий період напіврозпаду у плазмі порівняно з IgG3 та IgG4 (непатентний документ 11). Як про спосіб подальшого підвищення періоду напіврозпаду у плазмі антитіл IgG1 та IgG2, які мають більший період напіврозпаду у плазмі, повідомлялося про заміщення амінокислот у константній ділянці, що підсилює зв'язування з FcRn (непатентні документи 12 та 13). З точки зору імуногенності подальше підвищення періоду напіврозпаду у плазмі здійснюється шляхом заміщення амінокислот переважно у варіабельній ділянці, а не у константній ділянці (патентний 1 UA 101221 C2 5 10 15 20 25 30 35 40 45 50 55 60 документ 5). Проте, на цей час нема жодного повідомлення стосовно підвищення періоду напіврозпаду у плазмі антитіл проти рецептора IL-6 шляхом внесення змін у варіабельну ділянку. Інша важлива проблема, з якою стикаються при розробці біофармацевтичних препаратів, це імуногенність. Зазвичай, імуногенність мишачих антитіл зменшують шляхом гуманізації антитіл. Передбачається, що ризик імуногенності можна далі знизити, застосовуючи каркасну послідовність зародкової лінії як матрицю при гуманізації антитіл (непатентний документ 14). Проте, навіть Adalimumab, що є повністю людським антитілом проти TNF, демонструвало імуногенність з високою частотою (13 % - 17 %), та було визначено, що терапевтичний ефект знижувався у пацієнтів, які демонстрували імуногенність (непатентні документи 15 та 16). Тклітинні епітопи можуть бути присутніми навіть у гіперваріабельній ділянці (CDR) антитіл людини, та ці Т-клітинні епітопи у гіперваріабельній ділянці можуть спричиняти імуногенність. Повідомлялося про способи передбачення Т-клітинних епітопів іn silico та in vitro (непатентні документи 17 та 18). Передбачається, що ризик імуногенності можна знизити шляхом видалення Т-клітинних епітопів, передбачених завдяки таким способам (непатентний документ 19). TOCILIZUMAB, гуманізоване антитіло IgG1 проти рецептора IL-6, - це антитіло IgG1, отримане шляхом гуманізації мишачого антитіла РМ1. Трансплантація гіперваріабельної ділянки здійснюється із застосуванням послідовностей людини NEW та REI як матричного каркасу для Н- та L-ланцюгів, відповідно; проте, 5 амінокислот мишачої послідовності зберігалися у каркасі як амінокислоти, необхідні для зберігання активності (непатентний документ 20). Не існує жодного попереднього повідомлення про повну гуманізацію мишачої послідовності, що залишилася, у рамці гуманізованого антитіла TOCILIZUMAB без зниження активності. Крім того, послідовність гіперваріабельної ділянки TOCILIZUMAB - це мишача послідовність, та, отже, подібно до Adalimumab, вона може мати Т-клітинні епітопи у гіперваріабельній ділянці, що може мати потенційний ризик імуногенності. При клінічних випробуваннях TOCILIZUMAB антитіла проти TOCILIZUMAB не виявлялися при ефективній дозі 8 мг/кг, проте їх спостерігали при дозі 2 мг/кг та 4 мг/кг (патентний документ 6). Це дозволяє припустити, що все ще залишається простір для удосконалення TOCILIZUMAB стосовно імуногенності. Проте, не було жодного повідомлення стосовно зниження ризику імуногенності TOCILIZUMAB заміщенням амінокислоти. Ізотип TOCILIZUMAB - це IgG1. Відмінність ізотипу стосується відмінності у послідовності константної ділянки. Оскільки передбачається, що послідовність константної ділянки має сильний вплив на ефекторну функцію, фармакокінетику, фізичні властивості тощо, то вибір послідовності константної ділянки є дуже важливим для розробки фармацевтичних препаратів на основі антитіл (непатентний документ 11). За останні роки безпечність фармацевтичних препаратів на основі антитіл набула великої важливості. Взаємодія між частиною антитіла Fc та рецептором Fcγ (ефекторна функція) могла спричиняти серйозні негативні ефекти у клінічних випробуваннях TGN1412 на фазі І (непатентний документ 21). Для фармацевтичних препаратів на основі антитіл, розроблених з метою нейтралізації біологічної активності антигену, зв'язування з рецептором Fcγ, що є важливим для ефекторної функції, такої як ADCC, не є обов'язковим. Зв'язування з рецептором Fcγ може бути навіть небажаним з точки зору негативних ефектів. Спосіб зниження зв'язування з рецептором Fcγ полягає у зміні ізотипу антитіла IgG з IgG1 на IgG2 або IgG4 (непатентний документ 22). IgG2 - є більш переважним ніж IgG4 з точки зору фармакокінетики та зв'язування з Fcγ-рецептором І (непатентний документ 11). TOCILIZUMAB - це антитіло, що нейтралізує рецептор IL-6, та його ізотип - це IgG1. Отже, з точки зору потенційних негативних ефектів, IgG2 може бути переважним ізотипом, оскільки ефекторні функції, такі як ADCC, не є обов'язковими. Між тим, коли розробляються фармацевтичні препарати на основі антитіл, тоді фізикохімічні властивості білків, зокрема, гомогенність та стабільність, є дуже вирішальними. Повідомлялося, що для ізотипу IgG2 існує суттєва гетерогенність, що походить від дисульфідних зв'язків у шарнірній ділянці (непатентний документ 23). Може бути нелегко та може бути більш дорого виробляти їх як фармацевтичні препарати у великих масштабах, при цьому зберігаючи пов'язану гетерогенність цільових речовин/споріднених речовин, яка походить від дисульфідних зв'язків між партіями продукції. Отже, однорідні речовини є якомога більш бажаними. Крім того, повідомлялося про досягнення гетерогенності Н-ланцюгових С-кінцевих послідовностей антитіла видаленням С-кінцевого амінокислотного залишку лізину та амідуванням С-кінцевої карбоксильної групи внаслідок видалення обох з двох С-кінцевих амінокислот, гліцину та лізину (непатентний документ 24). При розробці антитіл ізотипу IgG2 як фармацевтичних препаратів бажано зменшити таку гетерогенність та зберегти високу 2 UA 101221 C2 5 10 15 20 25 30 35 40 45 50 55 60 стабільність. Для того, щоб отримати зручні, стабільні, висококонцентровані фармацевтичні склади для підшкірного введення, переважно, щоб не тільки стабільність була високою, а також період напіврозпаду у плазмі був би довшим, ніж період напіврозпаду у плазмі IgG1, що є ізотипом TOCILIZUMAB. Проте, нема жодного попереднього повідомлення стосовно послідовностей константних ділянок для антитіл з константною ділянкою ізотипу IgG2, які б мали знижену гетерогенність, високу стабільність та подовжений період напіврозпаду у плазмі порівняно з антитілами з константною ділянкою ізотипу IgG1. Документи попереднього рівня техніки, які стосуються цього винаходу, наведено нижче: Документи попереднього рівня техніки Патентні документи Патентний документ 1: WO 92/19759. Патентний документ 2: WO 96/11020. Патентний документ 3: WO 96/12503. Патентний документ 4: WO 2007/143168. Патентний документ 5: WO 2007/114319. Патентний документ 6: WO 2004/096273. Непатентні документи Непатентний документ 1: Janice M Reichert, Clark J Rosensweig, Laura B Faden & Matthew C Dewitz, Monoclonal antibody successes in the clinic, Nature Biotechnology 23, 1073-1078 (2005). Непатентний документ 2: Pavlou AK, Belsey MJ., The therapeutic antibodies market to 2008., Eur J Pharm Biopharm. 2005 Apr; 59(3):389-96. Непатентний документ 3: Nishimoto N, Kishimoto T., Interleukin 6: from bench to bedside., Nat Clin Pract Rheumatol. 2006 Nov; 2(11):619-26. Непатентний документ 4: Maini RN, Taylor PC, Szechinski J, Pavelka K, Broll J, Balint G, Emery P, Raemen F, Petersen J, Smolen J, Thomson D, Kishimoto T; CHARISMA Study Group., Doubleblind randomized controlled clinical trial of the interleukin-6 receptor antagonist, Tocilizumab, in European patients with rheumatoid arthritis who had an incomplete response to methotrexate., Arthritis Rheum. 2006 Sep; 54(9):2817-29. Непатентний документ 5: Nishimoto N, Kanakura Y, Aozasa K, Johkoh T, Nakamura M, Nakano S, Nakano N, Ikeda Y, Sasaki T, Nishioka K, Hara M, Taguchi H, Kimura Y, Kato Y, Asaoku H, Kumagai S, Kodama F, Nakahara H, Hagihara K, Yoshizaki K, Kishimoto T. Humanized antiinterleukin-6 receptor antibody treatment of multicentric Castleman disease. Blood. 2005 Oct 15; 106(8):2627-32. Непатентний документ 6: Kim SJ, Park Y, Hong HJ., Antibody engineering for the development of therapeutic antibodies., Mol Cells. 2005 Aug 31; 20(1):17-29. Review. Непатентний документ 7: Rothe A, Hosse RJ, Power BE. Ribosome display for improved biotherapeutic molecules. Expert Opin Biol Ther. 2006 Feb; 6(2):177-87. Непатентний документ 8: Rajpal A, Beyaz N, Haber L, Cappuccilli G, Yee H, Bhatt RR, Takeuchi T, Lerner RA, Crea R., A general method for greatly improving the affinity of antibodies by using combinatorial libraries., Proc Natl Acad Sci U S A. 2005 Jun 14; 102(24):8466-71. Epub 2005 Jun 6. Непатентний документ 9: Wu H, Pfarr DS, Johnson S, Brewah YA, Woods RM, Patel NK, White WI, Young JF, Kiener PA. Development of Motavizumab, an Ultra-potent Antibody for the Prevention of Respiratory Syncytial Virus Infection in the Upper and Lower Respiratory Tract. J Mol Biol. 2007, 368, 652-665. Непатентний документ 10: Shire SJ, Shahrokh Z, Liu J. Challenges in the development of high protein concentration formulations. J Pharm Sci. 2004 Jun; 93(6):1390-402. Непатентний документ 11: Salfeld JG. Isotype selection in antibody engineering.Nat Biotechnol. 2007 Dec; 25(12):1369-72. Непатентний документ 12: Hinton PR, Xiong JM, Johlfs MG, Tang MT, Keller S, Tsurushita N., An engineered human IgG1 antibody with longer serum half-life., J Immunol. 2006 Jan 1; 176(1):34656. Непатентний документ 13: Ghetie V, Popov S, Borvak J, Radu C, Matesoi D, Medesan C, Ober RJ, Ward ES., Increasing the serum persistence of an IgG fragment by random mutagenesis., Nat Biotechnol. 1997 Jul; 15(7):637-40. Непатентний документ 14: Hwang WY, Almagro JC, Buss TN, Tan P, Foote J. Use of human germline genes in a CDR homology-based approach to antibody humanization.Methods. 2005 May; 36(1):35-42. Непатентний документ 15: Bartelds GM, Wijbrandts CA, Nurmohamed MT, Stapel S, Lems WF, Aarden L, Dijkmans BA, Tak P, Wolbink GJ. Clinical response to adalimumab: The relationship with anti-adalimumab antibodies and serum adalimumab concentrations in rheumatoid arthritis. Ann 3 UA 101221 C2 5 10 15 20 25 30 35 40 45 50 55 60 Rheum Dis. 2007 Mar 9; [Epub ahead of print]. Непатентний документ 16: Bender NK, Heilig CE, Droll B, Wohlgemuth J, Armbruster FP, Heilig B. Immunogenicity, efficacy and adverse events of adalimumab in RA patients. Rheumatol Int. 2007 Jan; 27(3):269-74. Непатентний документ 17: Van Walle I, Gansemans Y, Parren PW, Stas P, Lasters I. Immunogenicity screening in protein drug development.Expert Opin Biol Ther. 2007 Mar; 7(3):405-18. Непатентний документ 18: Jones TD, Phillips WJ, Smith BJ, Bamford CA, Nayee PD, Baglin TP, Gaston JS, Baker MP. Identification and removal of a promiscuous CD4+T cell epitope from the C1 domain of factor VIII. J Thromb Haemost. 2005 May; 3(5):991-1000. Непатентний документ 19: Chirino AJ, Ary ML, Marshall SA. Minimizing the immunogenicity of protein therapeutics. Drug Discov Today. 2004 Jan 15; 9(2):82-90. Непатентний документ 20: Sato K, Tsuchiya M, Saldanha J, Koishihara Y, Ohsugi Y, Kishimoto T, Bendig MM. Reshaping a human antibody to inhibit the interleukin 6-dependent tumor cell growth. Cancer Res. 1993 Feb 15; 53(4):851-6. Непатентний документ 21: Strand V, Kimberly R, Isaacs JD. Biologic therapies in rheumatology: lessons learned future directions. Nat Rev Drug Discov. 2007 Jan; 6(1):75-92. Непатентний документ 22: Gessner JE, Heiken H, Tamm A, Schmidt RE. The IgG Fc receptor family. Ann Hematol. 1998 Jun; 76(6):231-48. Непатентний документ 23: Dillon TM, Ricci MS, Vezina C, Flynn GC, Liu YD, Rehder DS, Plant M, Henkle B, Li Y, Deechongkit S, Varnum B, Wypych J, Balland A, Bondarenko PV. Structural and functional characterization of disulfide isoforms of the human IgG2 subclass. J Biol Chem. 2008 Jun 6; 283(23):16206-15. Непатентний документ 24: Johnson KA, Paisley-Flango K, Tangarone BS, Porter TJ, Rouse JC. Cation exchange-HPLC and mass spectrometry reveal C-terminal amidation of an IgG1 heavy chain. Anal Biochem. 2007 Jan 1; 360(1):75-83. Суть винаходу Задачі, які розв'язуються винаходом Цей винахід було здійснено з точки зору вищевказаних обставин. Мета цього винаходу отримати фармацевтичні композиції, які містять молекули другого покоління, які є переважними порівняно з гуманізованим антитілом IgG1 проти рецептора IL-6, TOCILIZUMAB, що є наслідком зміни амінокислотних послідовностей варіабельної та константної ділянок TOCILIZUMAB, з метою підвищення здатності нейтралізувати антиген та покращення фармакокінетики, так що пролонговані терапевтичні ефекти виникають при меншій частоті введення, а імуногенність, безпечність та фізико-хімічні властивості (стабільність та гомогенність) є покращеними (далі у цьому описі ці фармацевтичні композиції можуть називатися "агентами" або "складами"). Інша мета - розробити способи виробництва таких фармацевтичних композицій. Засоби розв'язання задач Автори цього винаходу здійснили цілеспрямовані дослідження, щоб отримати молекули другого покоління, які були б кращими порівняно з гуманізованим антитілом IgG1 першого покоління проти рецептора IL-6, TOCILIZUMAB, шляхом зміни амінокислотних послідовностей варіабельної та константної ділянок TOCILIZUMAB, з метою підвищення ефективності та покращення фармакокінетики, так що пролонгований терапевтичний ефект виникав би при меншій частоті введення, а імуногенність, безпечність та фізико-хімічні властивості (стабільність та гомогенність) були б покращеними. Внаслідок цього, автори цього винаходу встановили численні мутації CDR у варіабельних ділянках TOCILIZUMAB, які покращують зв'язувальну здатність (афінність) з антигеном. Автори цього винаходу, отже, успішно покращили афінність, застосовуючи комбінацію таких мутацій. Автори цього винаходу також досягли успіху в покращенні фармакокінетики шляхом введення модифікацій, які знижують ізоелектричну точку послідовності варіабельної ділянки. Автори цього винаходу досягли успіху в покращенні фармакокінетики внаслідок того, що зробили зв'язування з антигеном рецептора IL-6 залежним від рН, так що єдина молекула антитіла може нейтралізувати антиген багато разів. Крім того, автори цього винаходу досягли успіху у зниженні ризику імуногенності шляхом повної гуманізації послідовностей, які походять від мишей та які залишаються у рамці TOCILIZUMAB, та шляхом зниження кількості Т-клітинних епітопних пептидів у варіабельних ділянках, передбачених in silico. Крім того, автори цього винаходу також досягли успіху у визначенні нових послідовностей константної ділянки для константної ділянки TOCILIZUMAB, які знижують зв'язування з рецептором Fcγ порівняно з IgG1, щоб покращити безпечність, покращити фармакокінетику порівняно з IgG1 та зменшити гетерогенність, що є наслідком дисульфідних зв'язків у шарнірній ділянці IgG2, а також зменшити гетерогенність, що зумовлюється Сзакінченням Н-ланцюга, без зниження стабільності. Автори цього винаходу досягли успіху у 4 UA 101221 C2 5 10 15 20 25 30 35 40 45 50 55 60 виробництві молекул другого покоління, які є переважними порівняно з TOCILIZUMAB, завдяки доречному комбінуванню цих змін в амінокислотних послідовностях у CDR, варіабельних ділянках та константних ділянках. Цей винахід стосується фармацевтичних композицій, які містять гуманізоване антитіло IgG проти рецептора IL-6, яке має кращу здатність зв'язування з антигеном (рецептором IL-6), кращу фармакокінетику, кращу безпечність та фізичні властивості (стабільність та гомогенність), а також знижений ризик імуногенності, що є наслідком змін амінокислотних послідовностей варіабельної та константної ділянок гуманізованого антитіла IgG1 проти рецептора IL-6, TOCILIZUMAB; та способів виробництва таких фармацевтичних композицій. Більш специфічно, цим винаходом пропонується: [1] поліпептид за будь-яким з наступних: (а) поліпептид, що включає CDR1, яка включає послідовність SEQ ID NO: 1 (CDR1 VH4M73), CDR2, яка включає послідовність SEQ ID NO: 2 (CDR2 VH4-M73), та CDR3, яка включає послідовність SEQ ID NO: 3 (CDR3 VH4-M73); (b) поліпептид, що включає CDR1, яка включає послідовність SEQ ID NO: 4 (CDR1 VH3M73), CDR2, яка включає послідовність SEQ ID NO: 5 (CDR2 VH3-M73), та CDR3, яка включає послідовність SEQ ID NO: 6 (CDR3 VH3-M73); (c) поліпептид, що включає CDR1, яка включає послідовність SEQ ID NO: 7 (CDR1 VH5M83), CDR2, яка включає послідовність SEQ ID NO: 8 (CDR2 VH5-M83), та CDR3, яка включає послідовність SEQ ID NO: 9 (CDR3 VH5-M83); (d) поліпептид, що включає CDR1, яка включає послідовність SEQ ID NO: 10 (CDR1 VL1), CDR2, яка включає послідовність SEQ ID NO: 11 (CDR2 VL1), та CDR3, яка включає послідовність SEQ ID NO: 12 (CDR3 VL1); (e) поліпептид, що включає CDR1, яка включає послідовність SEQ ID NO: 13 (CDR1 VL3), CDR2, яка включає послідовність SEQ ID NO: 14 (CDR2 VL3), та CDR3, яка включає послідовність SEQ ID NO: 15 (CDR3 VL3); та (f) поліпептид, що включає CDR1, яка включає послідовність SEQ ID NO: 16 (CDR1 VL5), CDR2, яка включає послідовність SEQ ID NO: 17 (CDR2 VL5), та CDR3, яка включає послідовність SEQ ID NO: 18 (CDR3 VL5); [2] антитіло за будь-яким з наступних: (a) антитіло, яке включає варіабельну ділянку важкого ланцюга, яка включає CDR1, яка включає послідовність SEQ ID NO: 1 (CDR1 VH4-M73), CDR2, яка включає послідовність SEQ ID NO: 2 (CDR2 VH4-M73), та CDR3, яка включає послідовність SEQ ID NO: 3 (CDR3 VH4-M73), та варіабельну ділянку легкого ланцюга, яка включає CDR1, яка включає послідовність SEQ ID NO: 10 (CDR1 VL1), CDR2, яка включає послідовність SEQ ID NO: 11 (CDR2 VL1), та CDR3, яка включає послідовність SEQ ID NO: 12 (CDR3 VL1); (b) антитіло, яке включає варіабельну ділянку важкого ланцюга, яка включає CDR1, яка включає послідовність SEQ ID NO: 4 (CDR1 VH3-M73), CDR2, яка включає послідовність SEQ ID NO: 5 (CDR2 VH3-M73), та CDR3, яка включає послідовність SEQ ID NO: 6 (CDR3 VH3-M73), та варіабельну ділянку легкого ланцюга, яка включає CDR1, яка включає послідовність SEQ ID NO: 13 (CDR1 VL3), CDR2, яка включає послідовність SEQ ID NO: 14 (CDR2 VL3), та CDR3, яка включає послідовність SEQ ID NO: 15 (CDR3 VL3); та (c) антитіло, яке включає варіабельну ділянку важкого ланцюга, яка включає CDR1, яка включає послідовність SEQ ID NO: 7 (CDR1 VH5-M83), CDR2, яка включає послідовність SEQ ID NO: 8 (CDR2 VH5-M83), та CDR3, яка включає послідовність SEQ ID NO: 9 (CDR3 VH5-M83), та варіабельну ділянку легкого ланцюга, яка включає CDR1, яка включає послідовність SEQ ID NO: 16 (CDR1 VL5), CDR2, яка включає послідовність SEQ ID NO: 17 (CDR2 VL5), та CDR3, яка включає послідовність SEQ ID NO: 18 (CDR3 VL5); [3] варіабельну ділянку за будь-яким з наступних: (a) варіабельна ділянка важкого ланцюга, яка включає послідовність SEQ ID NO: 19 (варіабельна ділянка VH4-M73); (b) варіабельна ділянка важкого ланцюга, яка включає послідовність SEQ ID NO: 20 (варіабельна ділянка VH3-M73); (c) варіабельна ділянка важкого ланцюга, яка включає послідовність SEQ ID NO: 21 (варіабельна ділянка VH5-M83); (d) варіабельна ділянка легкого ланцюга, яка включає послідовність SEQ ID NO: 22 (варіабельна ділянка VL1); (e) варіабельна ділянка легкого ланцюга, яка включає послідовність SEQ ID NO: 23 (варіабельна ділянка VL3); та (f) варіабельна ділянка легкого ланцюга, яка включає послідовність SEQ ID NO: 24 5 UA 101221 C2 5 10 15 20 25 30 35 40 45 50 55 60 (варіабельна ділянка VL5); [4] антитіло за будь-яким з наступних: (a) антитіло, яке включає варіабельну ділянку важкого ланцюга, яка включає послідовність SEQ ID NO: 19 (варіабельна ділянка VH4-M73), та варіабельну ділянку легкого ланцюга, яка включає послідовність SEQ ID NO: 22 (варіабельна ділянка VL1); (b) антитіло, яке включає варіабельну ділянку важкого ланцюга, яка включає послідовність SEQ ID NO: 20 (варіабельна ділянка VH3-M73), та варіабельну ділянку легкого ланцюга, яка включає послідовність SEQ ID NO: 23 (варіабельна ділянка VL3); та (c) антитіло, яке включає варіабельну ділянку важкого ланцюга, яка включає послідовність SEQ ID NO: 21 (варіабельна ділянка VH5-M83), та варіабельну ділянку легкого ланцюга, яка включає послідовність SEQ ID NO: 24 (варіабельна ділянка VL5); [5] важкий ланцюг або легкий ланцюг за будь-яким з наступних: (a) важкий ланцюг, який включає послідовність SEQ ID NO: 25 (VH4-M73); (b) важкий ланцюг, який включає послідовність SEQ ID NO: 26 (VH3-M73); (c) важкий ланцюг, який включає послідовність SEQ ID NO: 27 (VH5-M83); (d) легкий ланцюг, який включає послідовність SEQ ID NO: 28 (VL1); (e) легкий ланцюг, який включає послідовність SEQ ID NO: 29 (VL3); та (f) легкий ланцюг, який включає послідовність SEQ ID NO: 30 (VL5); [6] антитіло забудь-яким з наступних: (a) антитіло, яке включає важкий ланцюг, який включає послідовність SEQ ID NO: 25 (VH4M73), та легкий ланцюг, який включає послідовність SEQ ID NO: 28 (VL1); (b) антитіло, яке включає важкий ланцюг, який включає послідовність SEQ ID NO: 26 (VH3M73), та легкий ланцюг, який включає послідовність SEQ ID NO: 29 (VL3); та (c) антитіло, яке включає важкий ланцюг, який включає послідовність SEQ ID NO: 27 (VH5M83) та легкий ланцюг, який включає послідовність SEQ ID NO: 30 (VL5); [7] ген, що кодує поліпептид за будь-яким від [1] до [6]; [8] вектор, що несе ген за [7]; [9] клітина-хазяїн, що несе вектор за [8]; [10] спосіб виробництва поліпептиду за будь-яким від [1] до [6] шляхом культивування клітини-хазяїна за [9]; та [11] фармацевтична композиція, яка містить поліпептид за будь-яким від [1] до [6] або поліпептид, що виробляється за способом [10]. Ефекти винаходу Гуманізовані антитіла IgG проти рецептора IL-6, отримані згідно з цим винаходом, мають підвищену ефективність та покращену фармакокінетику; отже, вони можуть викликати пролонгований терапевтичний ефект при меншій частоті введення. Стислий опис ілюстративного матеріалу Фіг. 1 - це перелік сайтів мутації, які покращують афінність TOCILIZUMAB до рецептора IL-6. Послідовність HCDR2 TOCILIZUMAB наведено у SEQ ID NO: 81; послідовність HCDR2 після мутації (верхній рядок) наведено у SEQ ID NO: 82; послідовність HCDR2 після мутації (нижній рядок) наведено у SEQ ID NO: 83; послідовність HCDR3 TOCILIZUMAB наведено у SEQ ID NO: 84; послідовність HCDR3 після мутації (верхній рядок) наведено у SEQ ID NO: 85; послідовність HCDR3 після мутації (нижній рядок) наведено у SEQ ID NO: 86; послідовність LCDR1 TOCILIZUMAB наведено у SEQ ID NO: 87; послідовність LCDR1 після мутації (верхній рядок) наведено у SEQ ID NO: 88; послідовність LCDR1 після мутації (нижній рядок) наведено у SEQ ID NO: 89; послідовність LCDR3 TOCILIZUMAB наведено у SEQ ID NO: 90; послідовність LCDR3 після мутації (верхній рядок) наведено у SEQ ID NO: 91; послідовність LCDR3 після мутації (нижній рядок) наведено у SEQ ID NO: 92. Фіг. 2 - це графік, на якому показана нейтралізуюча активність TOCILIZUMAB та RDC-23 у BaF/gp130. Фіг. 3 - перелік сайтів мутації, які можуть знизити ізоелектричну точку варіабельної ділянки без суттєвого зниження зв'язування TOCILIZUMAB з рецептором IL-6. Зірочка на ілюстрації представляє сайт, який не впливає на ізоелектричну точку, проте який було мутовано для перетворення у людську послідовність. Послідовність HFR1 TOCILIZUMAB наведено у SEQ ID NO: 93; послідовність HFR1 після мутації наведено у SEQ ID NO: 94; послідовність HCDR1 TOCILIZUMAB наведено у SEQ ID NO: 95; послідовність HCDR1 після мутації наведено у SEQ ID NO: 96; послідовність HFR2 TOCILIZUMAB наведено у SEQ ID NO: 97; послідовність HFR2 після мутації наведено у SEQ ID NO: 98; послідовність HCDR2 TOCILIZUMAB наведено у SEQ ID NO: 81; послідовність HCDR2 після мутації наведено у SEQ ID NO: 99; послідовність HFR4 TOCILIZUMAB наведено у SEQ ID NO: 100; послідовність HFR4 після мутації наведено у SEQ ID 6 UA 101221 C2 5 10 15 20 25 30 35 40 45 50 55 60 NO: 101; послідовність LFR1 TOCILIZUMAB наведено у SEQ ID NO: 102; послідовність LFR1 після мутації наведено у SEQ ID NO: 103; послідовність LCDR1 TOCILIZUMAB наведено у SEQ ID NO: 87; послідовність LCDR1 після мутації наведено у SEQ ID NO: 104; послідовність LFR2 TOCILIZUMAB наведено у SEQ ID NO: 105; послідовність LFR2 після мутації наведено у SEQ ID NO: 106; послідовність LCDR2 TOCILIZUMAB наведено у SEQ ID NO: 107; послідовності LCDR2 після мутації наведено у SEQ ID NOs: 108 та 109; послідовність LFR3 TOCILIZUMAB наведено у SEQ ID NO: 110; послідовність LFR3 після мутації наведено у SEQ ID NO: 111; послідовність LFR4 TOCILIZUMAB наведено у SEQ ID NO: 112; та послідовність LFR4 після мутації наведено у SEQ ID NO: 113. Фіг. 4 - це графік, на якому показана нейтралізуюча активність TOCILIZUMAB та H53/L28 у BaF/gp130. Фіг. 5 - це графік, на якому показана зміна за часом концентрації у плазмі для TOCILIZUMAB та H53/L28 у мишей після внутрішньовенного введення. Фіг. 6 - це графік, на якому показана зміна за часом концентрації у плазмі для TOCILIZUMAB та H53/L28 у мишей після підшкірного введення. Фіг. 7 - це схема, на якій проілюстровано, що молекула IgG може зв'язуватися знов з іншим антигеном шляхом дисоціації від антигену мембранного типу в ендосомі. Фіг. 8 - це перелік сайтів мутації, які надають рН-залежності зв'язуванню TOCILIZUMAB з рецептором IL-6 (зв'язування при рН 7,4 та дисоціація при рН 5,8). Послідовність HFR1 TOCILIZUMAB наведено у SEQ ID NO: 93; послідовність HFR1 після мутації наведено у SEQ ID NO: 114; послідовність HCDR1 TOCILIZUMAB наведено у SEQ ID NO: 95; послідовність HCDR1 після мутації наведено у SEQ ID NO: 115; послідовність LCDR1 TOCILIZUMAB наведено у SEQ ID NO: 87; послідовність LCDR1 після мутації наведено у SEQ ID NO: 116; послідовність LCDR2 TOCILIZUMAB наведено у SEQ ID NO: 107; та послідовність LCDR2 після мутації наведено у SEQ ID NO: 117. Фіг. 9 - це графік, на якому показана нейтралізуюча активність TOCILIZUMAB та H3pI/L73 у BaF/gp130. Фіг. 10 - це графік, на якому показана зміна за часом концентрації у плазмі для TOCILIZUMAB та H3pI/L73 у мавп cynomolgus після внутрівенного введення. Фіг. 11 - це графік, на якому показана зміна за часом концентрації у плазмі для TOCILIZUMAB та H3pI/L73 у трансгенних мишей з рецептором IL-6 людини після внутрішньовенного введення. Фіг. 12 - це діаграма, на якій показаний результат оцінки зумовленої С-закінченням гетерогенності TOCILIZUMAB, TOCILIZUMABΔK, та TOCILIZUMABΔGK, визначеної шляхом катіонообмінної хроматографії. Фіг. 13 - це діаграма, на якій показаний результат оцінки зумовленої дисульфідним зв'язком гетерогенності TOCILIZUMAB-IgG1, TOCILIZUMAB-IgG2 та TOCILIZUMAB-SKSC, визначеної шляхом катіонообмінної хроматографії. Фіг. 14 - це діаграма, на якій зображені криві денатурації для TOCILIZUMAB-IgG1, TOCILIZUMAB-IgG2 та TOCILIZUMAB-SKSC, отримані шляхом диференціальної скануючої калориметрії (DSC), та наведені значення Tm для кожного домену Fab. Фіг. 15 - це графік, на якому показана зміна за часом концентрації у плазмі для TOCILIZUMAB-IgG1, TOCILIZUMAB-M44, TOCILIZUMAB-M58 та TOCILIZUMAB-M73 у трансгенних мишей з FcRn людини після внутрішньовенного введення. Фіг. 16 - це графік, на якому показана нейтралізуюча активність TOCILIZUMAB, контрольних та Fv5-M83 у BaF/gp130. Фіг. 17 - це графік, на якому показана нейтралізуюча активність TOCILIZUMAB, Fv3-M73 та Fv4-M73 у BaF/gp130. Фіг. 18 - це графік, на якому показана зміна за часом концентрації у плазмі для TOCILIZUMAB, контрольних, Fv3-M73, Fv4-M73 та Fv5-M83 у мавп cynomolgus після внутрішньовенного введення. Фіг. 19 - це графік, на якому показана зміна за часом концентрації CRP для TOCILIZUMAB, контрольних, Fv3-M73, Fv4-M73 або Fv5-M83 у мавп cynomolgus після внутрішньовенного введення. Фіг. 20 - це графік, що демонструє зміну за часом у відсотках вільного розчинного рецептора IL-6 у мавп cynomolgus після внутрішньовенного введення TOCILIZUMAB, контрольних, Fv3M73, Fv4-M73 або Fv5-M83. Фіг. 21 - це графік, на якому показано інгібіторний вплив TOCILIZUMAB та Fv4-M73 на виробництво МСР-1 синовіальними клітинами, які походять від пацієнта-людини з ревматоїдним артритом (RA). 7 UA 101221 C2 5 10 15 20 25 30 35 40 45 50 55 60 Фіг. 22 - це графік, на якому показано інгібіторний вплив TOCILIZUMAB та Fv4-M73 на виробництво VEGF синовіальними клітинами, які походять від пацієнта-людини з ревматоїдним артритом (RA). Варіанти здійснення цього винаходу Цим винаходом пропонуються поліпептиди від (а) до (f), які перелічено нижче: (a) поліпептид, що включає CDR1, яка включає послідовність SEQ ID NO: 1 (CDR1 VH4M73), CDR2, яка включає послідовність SEQ ID NO: 2 (CDR2 VH4-M73), та CDR3, яка включає послідовність SEQ ID NO: 3 (CDR3 VH4-M73); (b) поліпептид, що включає CDR1, яка включає послідовність SEQ ID NO: 4 (CDR1 VH3M73), CDR2, яка включає послідовність SEQ ID NO: 5 (CDR2 VH3-M73), та CDR3, яка включає послідовність SEQ ID NO: 6 (CDR3 VH3-M73); (c) поліпептид, що включає CDR1, яка включає послідовність SEQ ID NO: 7 (CDR1 VH5M83), CDR2, яка включає послідовність SEQ ID NO: 8 (CDR2 VH5-M83), та CDR3, яка включає послідовність SEQ ID NO: 9 (CDR3 VH5-M83); (d) поліпептид, що включає CDR1, яка включає послідовність SEQ ID NO: 10 (CDR1 VL1), CDR2, яка включає послідовність SEQ ID NO: 11 (CDR2 VL1), та CDR3, яка включає послідовність SEQ ID NO: 12 (CDR3 VL1); (e) поліпептид, що включає CDR1, яка включає послідовність SEQ ID NO: 13 (CDR1 VL3), CDR2, яка включає послідовність SEQ ID NO: 14 (CDR2 VL3), та CDR3, яка включає послідовність SEQ ID NO: 15 (CDR3 VL3); та (f) поліпептид, що включає CDR1, яка включає послідовність SEQ ID NO: 16 (CDR1 VL5), CDR2, яка включає послідовність SEQ ID NO: 17 (CDR2 VL5), та CDR3, яка включає послідовність SEQ ID NO: 18 (CDR3 VL5). Поліпептиди цього винаходу особливо не обмежуються; проте, вони є переважно антигензв'язувальними речовинами, що мають активність зв'язуватися з рецептором IL-6 людини. Такі антиген-зв'язувальні речовини переважно включають, наприклад, варіабельні ділянки важкого ланцюга (VH) антитіла, варіабельні ділянки легкого ланцюга (VL) антитіла, важкі ланцюги антитіла, легкі ланцюги антитіла та антитіла. З вище перелічених поліпептидів від (а) до (f) поліпептиди від (а) до (c) є переважними прикладами варіабельних ділянок важкого ланцюга антитіл, тоді як поліпептиди від (d) до (f) є переважними прикладами варіабельних ділянок легкого ланцюга антитіла. Ці варіабельні ділянки можна застосовувати як частину антитіла проти рецептора IL-6 людини. Антитіла проти рецептора IL-6 людини, у яких така варіабельна ділянка застосовується, мають кращу зв'язувальну активність, відмінну фармакокінетику, відмінні показники безпечності, знижену імуногенність та/або кращі фізико-хімічні властивості. У цьому винаході термін "відмінна фармакокінетика" або "покращена фармакокінетика" означає будь-що з наступного: зменшення "кліренсу (CL)", підвищення "площі під кривою (AUC)", збільшення "часу перебування" та "подовження періоду напіврозпаду у плазмі (t ½)", які є параметрами фармакокінетики, розрахованими за зміною концентрації у плазмі за часом, коли антитіло вводиться в організм. У цьому описі термін "краща фізико-хімічна властивість" або "покращена фізико-хімічна властивість" означає, проте не обмежується тільки ними, покращену стабільність, знижену гетерогенність або їм подібне. Каркасні ділянки (FR) антитіла людини, які мусять з'єднатися з CDR, вибираються так, що CDR утворює сприятливий антиген-зв'язувальний сайт. FR, які повинні застосовуватися для варіабельних ділянок цього винаходу, особливо не обмежуються, та будь-яку FR можна застосовувати; проте, переважно застосовуються FR, що походять від людини. Можна застосовувати похідні від людини FR, які мають природну послідовність. Альтернативно, за необхідністю, заміщення, видалення та/або вставку або їм подібне однієї або більше амінокислот можна ввести у каркасну ділянку, яка має природну послідовність, так що CDR утворює адекватний антиген-зв'язувальний сайт. Мутантні послідовності FR, які мають бажану властивість, можна вибрати, наприклад, шляхом вимірювання та оцінювання зв'язувальної активності з антигеном для антитіла з FR з амінокислотними заміщеннями (Sato, K. et al., Cancer Res. (1993) 53, 851-856). Крім того, одну або більше амінокислот можна замістити, видалити, додати та/або вставити у послідовність CDR, описану вище. Переважно, щоб послідовність CDR після заміщення, видалення, додавання та/або вставки однієї або більше амінокислот мала еквівалентну активність з послідовністю CDR до початку змін стосовно зв'язувальної активності, нейтралізуючої активності, стабільності, імуногенності та/або фармакокінетики. Кількість амінокислот, які слід замістити, видалити, додати та/або вставити, особливо не обмежується; проте, це переважно три амінокислоти або менше, більш переважно дві амінокислоти або 8 UA 101221 C2 5 10 15 20 25 30 35 40 45 50 55 60 менше, та іще більш переважно одна амінокислота на CDR. Способи заміщення одного або більше амінокислотних залишків іншими амінокислотами, які представляють інтерес, включають, наприклад, сайт-спрямований мутагенез (Hashimoto-Gotoh, T, Mizuno, T, Ogasahara, Y, and Nakagawa, M. (1995) An oligodeoxyribonucleotide-directed dual amber method for site-directed mutagenesis. Gene 152, 271-275; Zoller, MJ, and Smith, M. (1983) Oligonucleotide-directed mutagenesis of DNA fragments cloned into M13 vectors. Methods Enzymol. 100, 468-500; Kramer, W, Drutsa, V, Jansen, HW, Kramer, B, Pflugfelder, M, and Fritz, HJ (1984) The gapped duplex DNA approach to oligonucleotide-directed mutation construction. Nucleic Acids Res. 12, 9441-9456; Kramer W, and Fritz HJ (1987) Oligonucleotide-directed construction of mutations via gapped duplex DNA Methods. Enzymol. 154, 350-367; Kunkel, TA (1985) Rapid and efficient sitespecific mutagenesis without phenotypic selection. Proc Natl Acad Sci U. S. A. 82, 488-492). Цей спосіб можна застосовувати для заміщення бажаних амінокислот в антитілі іншими амінокислотами, що представляють інтерес. Крім того, амінокислоти в каркасах та CDR можна заміщувати іншими відповідними амінокислотами, застосовуючи техніки з використанням бібліотеки, такі як каркасна перестановка (Mol. Immunol. 2007 Apr; 44(11): 3049-60) та виправлення CDR (US 2006/0122377). Цим винаходом також пропонуються антитіла від (а) до (c), перелічені нижче: (а) антитіло, яке включає варіабельну ділянку важкого ланцюга, яка включає CDR1, яка включає послідовність SEQ ID NO: 1 (CDR1 VH4-M73), CDR2, яка включає послідовність SEQ ID NO: 2 (CDR2 VH4-M73), та CDR3, яка включає послідовність SEQ ID NO: 3 (CDR3 VH4-M73), та варіабельну ділянку легкого ланцюга, яка включає CDR1, яка включає послідовність SEQ ID NO: 10 (CDR1 VL1), CDR2, яка включає послідовність SEQ ID NO: 11 (CDR2 VL1), та CDR3, яка включає послідовність SEQ ID NO: 12 (CDR3 VL1); (b) антитіло, яке включає варіабельну ділянку важкого ланцюга, яка включає CDR1, яка включає послідовність SEQ ID NO: 4 (CDR1 VH3-M73), CDR2, яка включає послідовність SEQ ID NO: 5 (CDR2 VH3-M73), та CDR3, яка включає послідовність SEQ ID NO: 6 (CDR3 VH3-M73), та варіабельну ділянку легкого ланцюга, яка включає CDR1, яка включає послідовність SEQ ID NO: 13 (CDR1 VL3), CDR2, яка включає послідовність SEQ ID NO: 14 (CDR2 VL3), та CDR3, яка включає послідовність SEQ ID NO: 15 (CDR3 VL3); та (c) антитіло, яке включає варіабельну ділянку важкого ланцюга, яка включає CDR1, яка включає послідовність SEQ ID NO: 7 (CDR1 VH5-M83), CDR2, яка включає послідовність SEQ ID NO: 8 (CDR2 VH5-M83), та CDR3, яка включає послідовність SEQ ID NO: 9 (CDR3 VH5-M83), та варіабельну ділянку легкого ланцюга, яка включає CDR1, яка включає послідовність SEQ ID NO: 16 (CDR1 VL5), CDR2, яка включає послідовність SEQ ID NO: 17 (CDR2 VL5), та CDR3, яка включає послідовність SEQ ID NO: 18 (CDR3 VL5). Антитіла, описані вище, можна застосовувати як антитіла проти рецептора IL-6 людини, які мають кращу зв'язувальну активність, відмінну фармакокінетику, відмінну безпечність, знижену імуногенність та/або кращі фізико-хімічні властивості. Каркасні ділянки антитіла людини, які слід з'єднувати з CDR цього винаходу, вибираються так, щоб CDR утворювала сприятливий антиген-зв'язувальний сайт. FR, які слід застосовувати для варіабельних ділянок цього винаходу, особливо не обмежуються, та можна застосовувати будь-яку FR; проте, застосовується переважно FR, що походить від людини. Можна використовувати FR, що походять від людини та мають природну послідовність. Альтернативно, за необхідністю, заміщення, видалення, додавання та/або вставку або їм подібне однієї або більше амінокислот можна ввести у каркасну ділянку, яка має природну послідовність, так що CDR утворює адекватний антиген-зв'язувальний сайт. Мутантні послідовності FR, які мають бажану властивість, можна вибрати, наприклад, шляхом вимірювання та оцінювання зв'язувальної активності з антигеном для антитіла з FR з амінокислотними заміщеннями (Sato, K. et al., Cancer Res. (1993) 53, 851-856). Між тим, константна ділянка, яку слід застосовувати для антитіла цього винаходу, особливо не обмежується, та можна застосовувати будь-яку константну ділянку. Переважні константні ділянки, які слід застосовувати для антитіл цього винаходу, включають, наприклад, похідні від людини константні ділянки (константні ділянки, що походять від IgG1, IgG2, IgG3, IgG4, Cκ, Cλ та їм подібного). Одну або більше амінокислот можна замістити, видалити, додати та/або вставити у похідні від людини константні ділянки. Переважні похідні від людини константні ділянки важкого ланцюга включають, наприклад, константні ділянки, які включають амінокислотну послідовність SEQ ID NO: 31 (константна ділянка VH4-M73), константні ділянки, які включають амінокислотну послідовність SEQ ID NO: 32 (константна ділянка VH3-M73), та константні ділянки, які включають амінокислотну послідовність SEQ ID NO: 33 (константна ділянка VH5-M83), тоді як переважні похідні від людини константні ділянки легкого ланцюга 9 UA 101221 C2 5 10 15 20 25 30 35 40 45 50 55 60 включають, наприклад, константні ділянки, які включають амінокислотну послідовність SEQ ID NO: 34 (VL1), константні ділянки, які включають амінокислотну послідовність SEQ ID NO: 35 (VL3), та константні ділянки, які включають амінокислотну послідовність SEQ ID NO: 36 (VL5). Крім того, одну або більше амінокислот можна замістити, видалити, додати та/або вставити у послідовність CDR, описану вище. Переважно, щоб послідовність CDR після заміщення, видалення, додавання та/або вставки однієї або більше амінокислот мала еквівалентну активність з послідовністю CDR до початку змін стосовно зв'язувальної активності, нейтралізуючої активності, стабільності, імуногенності та/або фармакокінетики. Кількість амінокислот, які слід замістити, видалити, додати та/або вставити, особливо не обмежується; проте, це переважно три амінокислоти або менше, більш переважно дві амінокислоти або менше, та іще більш переважно одна амінокислота на CDR. Амінокислоти можна також заміщувати, видаляти, додавати та/або вставляти, застосовуючи описані вище способи. Цим винаходом також пропонуються варіабельні ділянки від (а) до (f), які перелічено нижче: (a) варіабельна ділянка важкого ланцюга, яка включає послідовність SEQ ID NO: 19 (варіабельна ділянка VH4-M73); (b) варіабельна ділянка важкого ланцюга, яка включає послідовність SEQ ID NO: 20 (варіабельна ділянка VH3-M73); (c) варіабельна ділянка важкого ланцюга, яка включає послідовність SEQ ID NO: 21 (варіабельна ділянка VH5-M83); (d) варіабельна ділянка легкого ланцюга, яка включає послідовність SEQ ID NO: 22 (варіабельна ділянка VL1); (e) варіабельна ділянка легкого ланцюга, яка включає послідовність SEQ ID NO: 23 (варіабельна ділянка VL3); та (f) варіабельна ділянка легкого ланцюга, яка включає послідовність SEQ ID NO: 24 (варіабельна ділянка VL5). Варіабельні ділянки, описані вище, можна застосовувати як частину антитіла проти рецептора IL-6 людини. Антитіла проти рецептора IL-6 людини, у яких застосовуються такі варіабельні ділянки, мають кращу зв'язувальну активність, відмінну фармакокінетику, відмінну безпечність, знижену імуногенність та/або кращі фізико-хімічні властивості. Варіабельні ділянки, описані вище, можуть також включати заміщення, видалення, додавання та/або вставки однієї або більше амінокислот (наприклад, п'яти амінокислот або менше, переважно трьох амінокислот або менше). Способи заміщення одного або більше амінокислотних залишків іншими амінокислотами, які представляють інтерес, включають, наприклад, способи, описані вище. Цим винаходом також пропонуються поліпептиди, які включають варіабельні ділянки, описані вище. Крім того, цим винаходом пропонуються антитіла від (а) до (c), які перелічено нижче: (a) антитіло, яке включає варіабельну ділянку важкого ланцюга, яка включає послідовність SEQ ID NO: 19 (варіабельна ділянка VH4-M73), та варіабельну ділянку легкого ланцюга, яка включає послідовність SEQ ID NO: 22 (варіабельна ділянка VL1); (b) антитіло, яке включає варіабельну ділянку важкого ланцюга, яка включає послідовність SEQ ID NO: 20 (варіабельна ділянка VH3-M73), та варіабельну ділянку легкого ланцюга, яка включає послідовність SEQ ID NO: 23 (варіабельна ділянка VL3); та (c) антитіло, яке включає варіабельну ділянку важкого ланцюга, яка включає послідовність SEQ ID NO: 21 (варіабельна ділянка VH5-M83), та варіабельну ділянку легкого ланцюга, яка включає послідовність SEQ ID NO: 24 (варіабельна ділянка VL5). Варіабельні ділянки, описані вище, можна застосовувати як частину антитіла проти рецептора IL-6 людини. Антитіла проти рецептора IL-6 людини, у яких застосовуються такі варіабельні ділянки, мають кращу зв'язувальну активність, відмінну фармакокінетику, відмінну безпечність, знижену імуногенність та/або кращі фізико-хімічні властивості. Варіабельні ділянки, описані вище, можуть також включати заміщення, видалення, додавання та/або вставки однієї або більше амінокислот (наприклад, п'яти амінокислот або менше, переважно трьох амінокислот або менше). Способи заміщення одного або більше амінокислотних залишків іншими амінокислотами, які представляють інтерес, включають, наприклад, способи, описані вище. Між тим, константна ділянка, яку слід застосовувати для антитіла цього винаходу, особливо не обмежується, та можна застосовувати будь-яку константну ділянку. Переважні константні ділянки, які слід застосовувати для антитіл цього винаходу, включають, наприклад, похідні від людини константні ділянки (константні ділянки, що походять від IgG1, IgG2, IgG3, IgG4, ланцюг 10 UA 101221 C2 5 10 15 20 25 30 35 40 45 50 55 60 κ, ланцюг λ та їм подібного). Одну або більше амінокислот можна замістити, видалити, додати та/або вставити у похідні від людини константні ділянки. Переважні похідні від людини константні ділянки важкого ланцюга включають, наприклад, константні ділянки, які включають амінокислотну послідовність SEQ ID NO: 31 (константна ділянка VH4-M73), константні ділянки, які включають амінокислотну послідовність SEQ ID NO: 32 (константна ділянка VH3-M73), та константні ділянки, які включають амінокислотну послідовність SEQ ID NO: 33 (константна ділянка VH5-M83), тоді як переважні похідні від людини константні ділянки легкого ланцюга включають, наприклад, константні ділянки, які включають амінокислотну послідовність SEQ ID NO: 34 (VL1), константні ділянки, які включають амінокислотну послідовність SEQ ID NO: 35 (VL3), та константні ділянки, які включають амінокислотну послідовність SEQ ID NO: 36 (VL5). Цим винаходом також пропонуються важкі або легкі ланцюги від (а) до (f), які перелічено нижче: (a) важкий ланцюг, який включає послідовність SEQ ID NO: 25 (VH4-M73); (b) важкий ланцюг, який включає послідовність SEQ ID NO: 26 (VH3-M73); (c) важкий ланцюг, який включає послідовність SEQ ID NO: 27 (VH5-M83); (d) легкий ланцюг, який включає послідовність SEQ ID NO: 28 (VL1); (e) легкий ланцюг, який включає послідовність SEQ ID NO: 29 (VL3); та (f) легкий ланцюг, який включає послідовність SEQ ID NO: 30 (VL5). Важкі ланцюги та легкі ланцюги, описані вище, можна застосовувати як частину антитіла проти рецептора IL-6 людини. Антитіла проти рецептора IL-6 людини, у яких застосовуються ці важкі ланцюги та легкі ланцюги, мають кращу зв'язувальну активність, відмінну фармакокінетику, відмінну безпечність, знижену імуногенність та/або кращі фізико-хімічні властивості. Важкі ланцюги та легкі ланцюги, описані вище, можуть також включати заміщення, видалення, додавання та/або вставки однієї або більше амінокислот (наприклад, десяти амінокислот або менше, переважно п'яти амінокислот або менше, а більш переважно трьох амінокислот або менше). Способи заміщення одного або більше амінокислотних залишків іншими амінокислотами, які представляють інтерес, включають, наприклад, способи, описані вище. Заміщення, видалення, додавання та/або вставки однієї або більше амінокислот можна здійснювати для варіабельних ділянок, константних ділянок або для тих та інших. Цим винаходом також пропонуються антитіла від (а) до (c), які перелічено нижче: (a) антитіло, яке включає важкий ланцюг, який включає послідовність SEQ ID NO: 25 (VH4M73), та легкий ланцюг, який включає послідовність SEQ ID NO: 28 (VL1); (b) антитіло, яке включає важкий ланцюг, який включає послідовність SEQ ID NO: 26 (VH3M73), та легкий ланцюг, який включає послідовність SEQ ID NO: 29 (VL3); та (c) антитіло, яке включає важкий ланцюг, який включає послідовність SEQ ID NO: 27 (VH5M83), та легкий ланцюг, який включає послідовність SEQ ID NO: 30 (VL5). Антитіла, описані вище, - це антитіла проти рецептора IL-6 людини, які мають кращу зв'язувальну активність, відмінну фармакокінетику, відмінну безпечність, знижену імуногенність та/або кращі фізико-хімічні властивості. Антитіла, описані вище, можуть також включати заміщення, видалення, додавання та/або вставки однієї або більше амінокислот (наприклад, 20 амінокислот або менше, переважно десяти амінокислот або менше, а більш переважно п'яти амінокислот або менше). Способи заміщення одного або більше амінокислотних залишків іншими амінокислотами, які представляють інтерес, включають, наприклад, способи, описані вище. Заміщення, видалення, додавання та/або вставки однієї або більше амінокислот можна здійснювати для варіабельних ділянок, константних ділянок або для тих та інших. Антитіла цього винаходу - це переважно гуманізовані антитіла. Гуманізованими антитілами також називають антитіла людини зі зміненими формами. Таке гуманізоване антитіло отримують шляхом трансплантації гіперваріабельної ділянки (CDR), що походить від ссавця, який не є людиною, у CDR антитіла людини. Традиційні способи генетичної рекомбінації для отримання таких антитіл є також відомими (дивись європейську патентну заявку № EP 125023 та WO 96/02576). Специфічно, наприклад, послідовність ДНК, побудована так, щоб CDR, яка представляє інтерес, та каркасна ділянка (FR), яка представляє інтерес, з'єднувалися, синтезується шляхом ПЛР (PCR) із застосуванням декількох олігонуклеотидів, які приготовано так, щоб вони мали перекриваючі частини із кінцями як CDR, так і FR як праймери (дивись спосіб, описаний у WO 98/13388). Гуманізоване антитіло отримують шляхом: зшивання отриманої ДНК з ДНК, яка кодує константну ділянку антитіла людини або модифіковану константну ділянку антитіла людини; 11 UA 101221 C2 5 10 15 20 25 30 35 40 45 50 55 60 вставлення вищевказаного у вектор експресії та введення вищевказаного хазяїну, щоб отримати антитіло (дивись європейську патентну заявку № EP 239400 та публікацію міжнародної патентної заявки № WO 96/02576). Каркасні ділянки антитіла людини, які слід з'єднати з CDR, вибираються так, щоб CDR утворювала сприятливий антиген-зв'язувальний сайт. За необхідністю, амінокислотне заміщення, видалення, додавання та/або вставку можна вводити у каркасну ділянку варіабельної ділянки антитіла. Константну ділянку антитіла людини або змінену константну ділянку антитіла людини, у якій одну або більше амінокислот замістили, видалили, додали та/або вставили у константну ділянку антитіла людини, можна застосовувати як константну ділянку гуманізованого антитіла. Наприклад, Сγ1, Сγ2, Сγ3, Сγ4, Сμ, Сδ, Сα1, Сα2 та Сε можна застосовувати для Н-ланцюга, та Сκ та Сλ можна застосовувати для L-ланцюга. Амінокислотну послідовність Сκ наведено у SEQ ID NO: 38, та нуклеотидну послідовність, що кодує цю амінокислотну послідовність, наведено у SEQ ID NO: 37. Амінокислотну послідовність Сγ1 наведено у SEQ ID NO: 40, та нуклеотидну послідовність, що кодує цю амінокислотну послідовність, наведено у SEQ ID NO: 39. Амінокислотну послідовність Сγ2 наведено у SEQ ID NO: 42, та нуклеотидну послідовність, що кодує цю амінокислотну послідовність, наведено у SEQ ID NO: 41. Амінокислотну послідовність Сγ4 наведено у SEQ ID NO: 44, та нуклеотидну послідовність, що кодує цю амінокислотну послідовність, наведено у SEQ ID NO: 43. Крім того, С-ділянки антитіла людини можна модифікувати з метою покращення стабільності антитіла або стабільності виробництва антитіла. Антитіла людини будь-якого ізотипу, такого як IgG, IgM, IgA, IgE або IgD, можна застосовувати для гуманізації антитіла; проте, у цьому винаході переважно застосовується IgG. IgG1, IgG2, IgG3, IgG4 або їм подібні можна застосовувати як IgG. Амінокислоти у варіабельній ділянці (наприклад, CDR та FR) та константній ділянці гуманізованого антитіла можна видаляти, додавати, вставляти та/або заміщувати амінокислотами після приготування. Антитіла цього винаходу можуть також включати такі гуманізовані антитіла, які включають амінокислотні заміщення та їм подібне. Антитіла цього винаходу включають не тільки двовалентні антитіла, які представлені IgG, а також одновалентні антитіла та багатовалентні антитіла, які представлено IgM, доки вони мають активність зв'язування з рецептором IL-6 та/або нейтралізуючу активність. Багатовалентні антитіла цього винаходу включають багатовалентні антитіла, у яких усі антигензв'язувальні сайти є ідентичними, та багатовалентні антитіла, у яких усі або деякі антигензв'язувальні сайти є відмінними. Антитіла цього винаходу включають не тільки молекули суцільних антитіл, а також мінітіла та їх модифіковані продукти, доки вони зв'язуються з білком рецептора IL-6. Мінітіла - це антитіла, які включають фрагмент антитіла, у якому не вистачає частини суцільного антитіла (наприклад, суцільного IgG або йому подібного), та вони особливо не обмежуються, доки вони мають активність зв'язування з рецептором IL-6 та нейтралізуючу активність, та включають фрагмент антитіла, у якому не вистачає частини суцільного антитіла (наприклад, суцільного IgG або йому подібного). Мінітіла цього винаходу особливо не обмежуються, доки вони включають частину суцільного антитіла. Проте, мінітіла переважно включають VH або VL, та особливо переважно включають як VH, так і VL. Інші переважні мінітіла цього винаходу включають, наприклад, мінітіла, що включають CDR антитіла. Мінітіла можуть включати усі або деякі з шести CDR антитіла. Мінітіла цього винаходу переважно мають меншу молекулярну масу, ніж суцільні антитіла. Проте, мінітіла можуть утворювати мультимери, наприклад, димери, тримери або тетрамери, та, отже, їхня молекулярна маса іноді перебільшує молекулярну масу суцільних антитіл. Специфічно, фрагменти антитіл включають, наприклад, Fab, Fab", F(ab")2 та Fv. Між тим, мінітіла включають, наприклад, Fab, Fab", F(ab")2, Fv, scFv (одноланцюговий Fv), діатіла та sc(Fv)2 (одноланцюговий (Fv)2). Мультимери (наприклад, димери, тримери, тетрамери та полімери) цих антитіл також включено у мінітіла цього винаходу. Фрагменти антитіл можна отримати, наприклад, шляхом обробки антитіл ферментами, щоб отримати фрагменти антитіл. Ферменти, про які відомо, що вони генерують фрагменти антитіл, включають, наприклад, папаїн, пепсин та плазмін. Альтернативно, ген, що кодує такий фрагмент антитіла, можна побудувати, ввести у вектор експресії та експресувати у відповідних клітинах-хазяїнах (дивись, наприклад, Co, M.S. et al., J. Immunol. (1994) 152, 2968-2976; Better, M. & Horwitz, A. H. Methods in Enzymology (1989) 178, 476-496; Pluckthun, A. & Skerra, A. Methods in Enzymology (1989) 178, 476-496; Lamoyi, E., Methods in Enzymology (1989) 121, 652-663; Rousseaux, J. et al., Methods in Enzymology (1989) 121, 663-669; Bird, R. E. et al., TIBTECH (1991) 12 UA 101221 C2 5 10 15 20 25 30 35 40 45 50 55 60 9, 132-137). Перетравлювальні ферменти відщеплюють на специфічних сайтах фрагмент антитіла, утворюючи фрагменти антитіла зі специфічними структурами, наведеними далі. Для того, щоб видалити випадкову частину антитіла, до таких отриманих ферментативно фрагментів антитіла можна застосовувати способи генної інженерії. Фрагменти антитіл, отримані із застосуванням вищевказаних перетравлювальних ферментів, є наступними. Перетравлення папаїном: F(ab)2 або Fab. Перетравлення пепсином: F(ab")2 або Fab". Перетравлення плазміном: Facb. Мінітіла цього винаходу включають фрагменти антитіл, у яких не вистачає довільної ділянки, доки вони мають активність зв'язування з рецептором IL-6 та/або нейтралізуючу активність. "Діатіло" означає двовалентний фрагмент антитіла, побудований шляхом злиття генів (Holliger P et al., 1993, Proc. Natl. Acad. Sci. USA 90: 6444-6448; EP 404,097; WO 93/11161 тощо). Діатіла - це димери, що складаються з двох поліпептидних ланцюгів. У кожному поліпептидному ланцюгу, що утворює димер, VL та VH зазвичай з'єднані лінкером в одному й тому ж ланцюгу. Зазвичай, лінкер у діатілі є достатньо коротким, так що VL та VH не можуть зв'язуватися один з одним. Специфічно, кількість амінокислотних залишків, які складають лінкер, становить, наприклад, приблизно 5 залишків. Отже, VL та VH, що кодуються на одному й тому ж поліпептиді, не можуть утворювати одноланцюговий фрагмент варіабельної ділянки та будуть утворювати димер з іншим одноланцюговим фрагментом варіабельної ділянки. Внаслідок цього діатіло має два антиген-зв'язувальні сайти. Антитіла scFv - це одноланцюгові поліпептиди, отримані внаслідок з'єднання VH та VL за допомогою лінкера або йому подібного (Huston, J. S. et al., Proc. Natl. Acad. Sci. U.S.A. (1988) 85, 5879-5883; Pluckthun "The Pharmacology of Monoclonal Antibodies" Vol. 113, eds., Resenburg and Moore, Springer Verlag, New York, pp. 269-315, (1994)). V-ділянка Н-ланцюга та V-ділянка Lланцюга scFv можуть походити від будь-якого антитіла, описаного тут. Пептидний лінкер для з'єднання V-ділянок особливо не обмежується. Наприклад, як лінкер можна застосовувати довільний одноланцюговий пептид, що містить від 3 до 25 залишків. Специфічно, можна застосовувати пептидні лінкери, описані далі, або їм подібне. V-ділянки двох ланцюгів можна з'єднати, наприклад, шляхом ПЛР, як описано вище. Поперше, ДНК, що кодує повну амінокислотну послідовність або бажану часткову амінокислотну послідовність однієї з ДНК, наведених далі, застосовують як матрицю для з'єднання V-ділянок шляхом ПЛР: ДНК, що кодує Н-ланцюг або V-ділянку Н-ланцюга антитіла, та ДНК, що кодує L-ланцюг або V-ділянку L-ланцюга антитіла. ДНК, що кодують V-ділянку Н-ланцюга або L-ланцюга, ампліфікуються шляхом ПЛР із застосуванням пари праймерів, які містять відповідні послідовності двох кінців ДНК, яку слід ампліфікувати. Потім отримують ДНК, що кодує частину пептидного лінкера. ДНК, що кодує пептидний лінкер, можна також синтезувати шляхом ПЛР. Нуклеотидна послідовність, яку можна застосовувати для з'єднання окремо синтезованих продуктів ампліфікації V-ділянки, додається до 5’-закінчення праймерів, які слід застосовувати. Потім здійснюється ПЛР із застосуванням кожної з ДНК у [ДНК V-ділянки Н-ланцюга]-[ДНК пептидного лінкера]-[ДНК Vділянки L-ланцюга] та праймерів ПЛР-зборки. Праймери ПЛР-зборки містять комбінацію праймера, що відпалюється з 5’-закінченням [ДНК V-ділянки Н-ланцюга], та праймера, що відпалюється з 3’-закінченням [ДНК V-ділянки Lланцюга]. Іншими словами, праймери ПЛР-зборки - це набір праймерів, які можна застосовувати для ампліфікації ДНК, що кодують послідовність повної довжини scFv, що слід синтезувати. Між тим, нуклеїнові послідовності, які можна застосовувати для з'єднання кожної ДНК V-ділянки, додаються до [ДНК пептидного лінкера]. Потім ці ДНК з'єднуються, та потім суцільне scFv зрештою генерується як продукт ампліфікації із застосуванням праймерів ПЛРзборки. Коли генеруються ДНК, що кодують scFv, вектори експресії, що містять ці ДНК, та рекомбінантні клітини, трансформовані цими векторами експресії, можна отримати за традиційними способами. Крім того, scFv можна отримати внаслідок експресії ДНК, що кодують scFv, шляхом культивування отриманих рекомбінантних клітин. Порядок, у якому VH та VL мусять з'єднуватися, особливо не обмежується, та їх можна влаштувати у будь-якому порядку. Приклади порядку влаштування перелічено нижче. [VH] лінкер [VL] [VL] лінкер [VH] sc(Fv)2 - це одноланцюгове мінітіло, отримане шляхом з'єднання двох VH та двох VL із 13 UA 101221 C2 5 10 15 20 25 30 35 40 45 50 55 60 застосуванням лінкерів та їм подібного (Hudson et al., 1999, J Immunol. Methods 231:177-189). sc(Fv)2 можна отримати, наприклад, шляхом з'єднання scFv із застосуванням лінкера. Переважно, дві VH та дві VL антитіла влаштовуються у порядку VH, VL, VH та VL як ([VH] лінкер [VL] лінкер [VH] лінкер [VL]) від N-кінця одноланцюгового поліпептиду; проте, порядок двох VH та двох VL не обмежується вищевказаним порядком, та їх можна влаштувати у будьякому порядку. Приклади порядку влаштування перелічено нижче: [VL] лінкер [VH] лінкер [VH] лінкер [VL]; [VH] лінкер [VL] лінкер [VL] лінкер [VH]; [VH] лінкер [VH] лінкер [VL] лінкер [VL]; [VL] лінкер [VL] лінкер [VH] лінкер [VH]; [VL] лінкер [VH] лінкер [VL] лінкер [VH]. Амінокислотна послідовність VH або VL мінітіла може містити заміщення, видалення, додавання та/або вставки. Крім того, доки VH та VL мають антиген-зв'язувальну активність у зборці, доти частину можна видалити або інший поліпептид можна додати. Крім того, варіабельні ділянки можна химеризувати або гуманізувати. У цьому винаході лінкери, які можна застосовувати для з'єднання варіабельних ділянок антитіла, включають довільні пептидні лінкери, які можна ввести шляхом генної інженерії, та синтетичні лінкери, наприклад, лінкери, описані у Protein Engineering, (1996) 9(3), 299-305. Переважні лінкери в цьому винаході - це пептидні лінкери. Довжина пептидних лінкерів особливо не обмежується, та фахівці у галузі зможуть відповідним чином вибрати довжину залежно від мети. Звичайна довжина становить від 1 до 100 амінокислот, переважно від 3 до 50 амінокислот, більш переважно від 5 до 30 амінокислот та особливо переважно від 12 до 18 амінокислот (наприклад, 15 амінокислот). Наприклад, амінокислотні послідовності для пептидних лінкерів включають наступні послідовності: Ser; Gly·Ser; Gly·Gly·Ser; Ser·Gly·Gly; Gly·Gly·Gly·Ser (SEQ ID NO: 45); Ser·Gly·Gly·Gly (SEQ ID NO: 46); Gly·Gly·Gly·Gly·Ser (SEQ ID NO: 47); Ser·Gly·Gly·Gly·Gly (SEQ ID NO: 48); Gly·Gly·Gly·Gly·Gly·Ser (SEQ ID NO: 49); Ser·Gly·Gly·Gly·Gly·Gly (SEQ ID NO: 50); Gly·Gly·Gly·Gly·Gly·Gly·Ser (SEQ ID NO: 51); Ser·Gly·Gly·Gly·Gly·Gly·Gly (SEQ ID NO: 52); (Gly·Gly·Gly·Gly·Ser [SEQ ID NO: 47])n; (Ser·Gly·Gly·Gly·Gly [SEQ ID NO: 48])n, де n - це ціле число від 1 або більше. Амінокислотні послідовності пептидних лінкерів можуть відповідним чином вибрати фахівці у галузі згідно з метою. Наприклад, вищезгадане "n", яке визначає довжину пептидного лінкера, зазвичай становить від 1 до 5, переважно від 1 до 3, а більш переважно 1 або 2. Синтетичні лінкери (хімічні агенти перехресного зшивання) включають агенти перехресного зшивання, які зазвичай застосовуються для перехресного зшивання пептидів, наприклад, Nгідроксисукцинімід (NHS), дисукцинімідил суберат (DSS), біс(сульфосукцинімідил) суберат (BS3), дитіобіс(сукцинімідил пропіонат) (DSP), дитіобіс(сульфосукцинімідил пропіонат) (DTSSP), етиленгліколь біс(сукцинімідил сукцинат) (EGS), етиленгліколь біс(сульфосукцинімідил сукцинат) (сульфо-EGS), дисукцинімідил тартрат (DST), дисульфосукцинімідил тартрат (сульфо-DST), біс[2-(сукцинімідоксикарбонілокси)етил]сульфон (BSOCOES) та біс[2(сульфосукцинімідоксикарбонілокси)етил]сульфон (сульфо-BSOCOES). Ці агенти перехресного зшивання є комерційно доступними. Зазвичай, три лінкери є необхідними для того, щоб зшити чотири варіабельні ділянки антитіла. Ці множинні лінкери можуть бути однаковими або відмінними. Антитіла цього винаходу також включають антитіла, у яких один або більше амінокислотних залишків було додано до амінокислотної послідовності антитіла цього винаходу. Крім того, антитіла цього винаходу також включають злиті білки, у яких вищеописане антитіло злите з іншим пептидом або білком. Злитий білок можна приготувати шляхом зшивання полінуклеотиду, що кодує антитіло цього винаходу, та полінуклеотиду, що кодує інший пептид або поліпептид, у рамці, введення вищевказаного у вектор експресії та експресування вищевказаного у хазяїні. 14 UA 101221 C2 5 10 15 20 25 30 35 40 45 50 55 60 Можна застосовувати способи, відомі фахівцям у галузі. Пептид або поліпептид, який слід злити з антитілом цього винаходу, може бути відомим пептидом, наприклад, FLAG (Hopp, T. P. et al., BioTechnology 6, 1204-1210 (1988)), 6x His, що складається з шести залишків His (гістидину), 10хHis, гемаглутиніном грипу (НА), фрагментом c-myc людини, фрагментом VSV-GP, фрагментом p18HIV, T7-tag, HSV-tag, E-tag, фрагментом антигену SV40 T, lck tag, фрагментом α-тубуліну, B-tag та фрагментом білка С. Поліпептиди, які слід злити з антитілами цього винаходу, включають, наприклад, GST (глутатіон-S-трансферазу), НА (гемаглутинін грипу), константну ділянку імуноглобуліну, β-галактозидазу та МВР (білок, що зв'язує мальтозу). Комерційно доступні полінуклеотиди, які кодують ці пептиди або поліпептиди, можна злити з полінуклеотидом, який кодує антитіло цього винаходу. Злитий поліпептид можна приготувати шляхом експресії злитого полінуклеотиду, приготовленого таким чином. Крім того, антитіла цього винаходу можуть бути також кон'югованими антитілами, зшитими з різними молекулами, такими як полімери, включаючи поліетиленгліколь (ПЕГ) та гіалуронову кислоту; радіоактивні речовини; флуоресцентні речовини; люмінесцентні речовини; ферменти та токсини. Такі кон'юговані антитіла можна отримати шляхом хімічної модифікації отриманих антитіл. Способи модифікації антитіл вже розроблено у галузі (дивись, наприклад, US 5,057,313 та US 5,156,840). "Антитіла" цього винаходу також включають такі кон'юговані антитіла. Крім того, антитіла цього винаходу включають антитіла зі зміненими цукровими ланцюгами. Крім того, антитіла, що застосовуються у цьому винаході, можуть бути біспецифічними антитілами. "Біспецифічне антитіло" означає антитіло, яке має варіабельні ділянки, які розпізнають різні епітопи, в одній і тій же молекулі антитіла. Біспецифічне антитіло цього винаходу може бути біспецифічним антитілом, яке розпізнає різні епітопи на молекулі рецептора IL-6, або біспецифічним антитілом, у якому один з антиген-зв'язувальних сайтів розпізнає рецептор IL-6, а інший антиген-зв'язувальний сайт розпізнає іншу речовину. Приклади антигенів, що зв'язуються з іншим антиген-зв'язувальним сайтом біспецифічного антитіла, яке включає антитіло цього винаходу, яке розпізнає рецептор IL-6, включають IL-6, TNFα, TNFR1, TNFR2, CD80, CD86, CD28, CD20, CD19, IL-1α, IL-β, IL-1R, RANKL, RANK, IL-17, IL-17R, IL-23, IL23R, IL-15, IL-15R, BlyS, лімфотоксин α, лімфотоксин β, ліганд LIGHT, LIGHT, VLA-4, CD25, IL12, IL-12R, CD40, CD40L, BAFF, CD52, CD22, IL-32, IL-21, IL-21R, GM-CSF, GM-CSFR, M-CSF, MCSFR, IFN-α, VEGF, VEGFR, EGF, EGFR, CCR5, APRIL та APRILR. Способи отримання біспецифічних антитіл є відомими. Біспецифічні антитіла можна приготувати, наприклад, шляхом зшивання двох типів антитіл, що розпізнають різні антигени. Антитіла, які слід зшити, можуть бути половиною молекули, при цьому кожне містить Н-ланцюг та L-ланцюг, або чвертю молекули, що містить тільки один Н-ланцюг. Альтернативно, злиті клітини, що виробляють біспецифічні антитіла, можна отримати шляхом злиття гібридом, які виробляють різні моноклональні антитіла. Крім того, біспецифічні антитіла можна виробляти способами генної інженерії. Як описується далі, антитіла цього винаходу можуть різнитися за амінокислотною послідовністю, молекулярною масою, ізоелектричною точкою, присутністю/відсутністю цукрових ланцюгів та структурою, що зумовлюється способом очищення, або клітиною або хазяїном, які застосовуються для отримання антитіл. Проте, доки отримане антитіло залишається функціонально еквівалентним до антитіла цього винаходу, доти воно є включеним у цей винахід. Наприклад, коли антитіло цього винаходу експресується у прокаріотних клітинах, наприклад, Escherichia coli, тоді залишок метіоніну додається до N-закінчення амінокислотної послідовності оригінального антитіла. Такі антитіла також включено до антитілцього винаходу. Поліпептиди антитіл проти рецептора IL-6 та їм подібне цього винаходу можна отримати за способами, відомими фахівцям у галузі. Антитіло проти рецептора IL-6 можна отримати, наприклад, за способами генетичної рекомбінації, які є відомими фахівцям у галузі, на основі послідовності отриманого антитіла проти рецептора IL-6. Специфічно, антитіло проти рецептора IL-6 можна отримати шляхом побудови полінуклеотиду, що кодує антитіло, на основі послідовності антитіла, що розпізнає рецептор IL-6, вставлення полінуклеотиду у вектор експресії з наступним експресуванням його у відповідній клітині-хазяїні (дивись, наприклад, Co, M. S. et al., J. Immunol. (1994) 152, 2968-2976; Better, M. and Horwitz, A. H., Methods Enzymol. (1989) 178, 476-496; Pluckthun, A. and Skerra, A., Methods Enzymol. (1989) 178, 497-515; Lamoyi, E., Methods Enzymol. (1986) 121, 652-663; Rousseaux, J. et al., Methods Enzymol. (1986) 121, 663-669; Bird, R. E. and Walker, B. W., Trends Biotechnol. (1991) 9, 132-137). Отже, цим винаходом пропонуються способи виробництва (і) поліпептиду цього винаходу або (іі) поліпептиду, який кодується геном, який кодує поліпептид цього винаходу, де способи включають етап культивування клітини-хазяїна, яка містить вектор, у який введено 15 UA 101221 C2 5 10 15 20 25 30 35 40 45 50 55 60 полінуклеотид, який кодує поліпептид цього винаходу. Більш специфічно, цим винаходом пропонуються способи виробництва поліпептиду цього винаходу, які включають етапи: (а) культивування клітини-хазяїна, яка містить вектор, у який введено ген, що кодує поліпептид цього винаходу; та (b) отримання поліпептиду, що кодується цим геном. Приклади вектора включають вектори типу М13, вектори типу pUC, pBR322, pBluescript та pCR-Script. Альтернативно, коли метою є субклонувати та вирізати кДНК, тоді інші приклади векторів, окрім вищеописаних векторів, включають pGEM-T, pDIRECT та pT7. Вектори експресії є особливо важливими для виробництва антитіл цього винаходу. Наприклад, коли вектор експресії застосовують для експресії в E. coli, тоді цей вектор мусить мати ознаки, які дозволяють йому ампліфікуватися в E. coli. Крім того, коли хазяїн - це E. coli, така як JM109, DH5α, HB101 або XL1-Blue, тоді необхідно, щоб вектор був носієм промотора, який сприяє його ефективній експресії в E. coli, наприклад, промотор lacZ (Ward et al., Nature (1989) 341, 544-546; FASEB J. (1992) 6, 2422-2427), промотор araB (Better et al., Science (1988) 240, 1041-1043), промотор T7 або їм подібний. Такий вектор включає, окрім вищеописаного, pGEX-5X-1 (Pharmacia), "QIAexpress system" (Quiagen), pEGFP та pET (у цьому випадку хазяїн - це переважно BL21, що експресує РНК-полімеразу Т7). Крім того, плазмідні вектори експресії можуть містити сигнальні послідовності для секреції антитіла. Як сигнальну послідовність для секреції антитіла можна застосовувати сигнальну послідовність pelB (Lei, S. P. et al., J. Bacteriol. (1987) 169, 4379) для виробництва у периплазмі E. coli. Вектори можна вводити клітинам-хазяїнам, наприклад, шляхом способів з використанням хлориду кальцію або шляхом електропорації. Окрім векторів для E. coli, вектори для виробництва антитіл цього винаходу включають, наприклад, похідні від ссавців вектори експресії (наприклад, pcDNA3 (Invitrogen), pEF-BOS (Nucleic Acids. Res. (1990) 18(17), p5322), pEF та pCDM8), похідні від комах вектори експресії (наприклад, "система експресії бакуловірусу Bac-to-BAC " (Gibco-BRL) та pBacPAK8), похідні від рослин вектори експресії (наприклад, pMH1 та pMH2), похідні від тваринних вірусів вектори експресії (наприклад, pHSV, pMV та pAdexLcw), похідні від ретровірусів вектори експресії (наприклад, pZIPneo), похідні від дріжджів вектори експресії (наприклад, набір для експресії "Pichia Expression Kit" (Invitrogen), pNV11 та SP-Q01) та похідні від Bacillus subtilis вектори експресії (наприклад, pPL608 та pKTH50). Коли плазмідний вектор експресії застосовується для експресії у тваринних клітинах, таких як клітини CHO, COS та NIH3T3, тоді він мусить мати промотор, необхідний для експресії у таких клітинах, наприклад, промотор SV40 (Mulligan et al., Nature (1979) 277, 108), промотор MMLV-LTR, промотор EF1α (Mizushima et al., Nucleic Acids Res. (1990) 18, 5322) або промотор CMV. Навіть більш переважно, якщо вектор має ген для селекції трансформованих клітин (наприклад, ген резистентності до ліків, який дозволяє здійснити розрізнення за допомогою агента (неоміцину, G418 або їм подібного)). Вектори з такими характеристиками включають, наприклад, pMAM, pDR2, pBK-RSV, pBK-CMV, pOPRSV та pOP13. Крім того, коли метою є стабільно експресувати гени та ампліфікувати ряд генних копій у клітинах, тоді можна застосовувати спосіб, при якому у клітини СНО з дефіцитом шляху синтезу нуклеїнової кислоти вводять вектор, що має ген DHFR, який компенсує цей дефіцит (наприклад, pSV2-dhfr ("Molecular Cloning 2nd edition" Cold Spring Harbor Laboratory Press, (1989)), та цей вектор ампліфікується із використанням метотраксату (МТХ). Далі, коли метою є тимчасова генна експресія, тоді можна застосовувати спосіб, при якому клітини COS, що несуть ген, який експресує Т-антиген SV40 на їхній хромосомі, трансформуються вектором, що несе джерело реплікації SV40 (pcD та йому подібне). Можна застосовувати джерела реплікації, що походять від вірусу поліомієліту, аденовірусу, бичачого вірусу папіломи (BPV) та їм подібного. Крім того, для того щоб ампліфікувати певну кількість генних копій у клітинних лініях-хазяїнах, вектори експресії можуть включати як селективний маркер ген аміноглікозидтрансферази (АРН), ген тимідинкінази (ТК), ген ксантин-гуанін фосфорибозилтрансферази E. coli (Ecogpt), ген дигідрофолатредуктази (dhfr) та їм подібне. Отримані антитіла цього винаходу можна виділити з клітин-хазяїнів або ззовні клітин (з середовища або йому подібного) та очистити, так щоб вони були по суті чистими та гомогенними антитілами. Антитіла можна відокремити та очистити, застосовуючи традиційні способи відокремлення та очищення для очищення антитіл, при цьому ці способи не обмежуються. Наприклад, антитіла можна відокремити та очистити шляхом відповідним чином вибраних та комбінованих способів колоночної хроматографії, фільтрації, ультрафільтрації, знесолювання, осадження з розчинника, екстракції з розчинника, дистиляції, імунопреципітації, 16 UA 101221 C2 5 10 15 20 25 30 35 40 45 50 55 60 електрофорезу на поліакриламідному гелі з додецилсульфатом натрію, ізоелектрофокусування, діалізу, рекристалізації та їм подібного. Хроматографія включає, наприклад, афінну хроматографію, іонообмінну хроматографію, гідрофобну хроматографію, гель-хроматографію, хроматографію з оберненою фазою та адсорбційну хроматографію (Strategies for Protein Purification and Characterization: A Laboratory Course Manual. Ed Daniel R. Marshak et al., Cold Spring Harbor Laboratory Press, 1996). Ці види хроматографії можна здійснювати, застосовуючи рідинну хроматографію, наприклад, рідинну хроматографію високого розрізнення (HPLC) та рідинну хроматографію швидкого розрізнення (FPLC). Колонки, що застосовуються для афінної хроматографії, включають колонки білка А та колонки білка G. Приклади колонок, що застосовують білок А, включають Hyper D, POROS та Sepharose FF (GE Amersham Biosciences). Цей винахід також включає антитіла, які є високо очищеними завдяки застосуванню таких способів очищення. Активність зв'язування отриманих антитіл з рецептором IL-6 можна вимірити за способами, відомими фахівцям у цій галузі. Способи вимірювання антиген-зв'язувальної активності антитіла включають, наприклад, твердофазний імуноферментний аналіз (ELISA), імуноферментний аналіз (ЕІА), радіоімунний аналіз (RIA) та способи флуоресцюючих антитіл. Наприклад, коли застосовується імуноферментний аналіз, тоді зразки, що містять антитіло, такі як очищені антитіла та надосадові культуральні рідини клітин, що виробляють антитіла, додаються до планшетів, покритих антигеном. Додають вторинне антитіло, мічене ферментом, таким як лужна фосфатаза, та планшети інкубують. Після промивання додають ферментний субстрат, такий як р-нітрофенілу фосфат, та для оцінки антиген-зв'язувальної активності вимірюють поглинання. Фармацевтичні композиції Цим винаходом також пропонуються фармацевтичні композиції, які містять вищеописаний пептид як активний інгредієнт. Фармацевтичні композиції цього винаходу можна застосовувати для IL-6-пов'язаних хвороб, таких як ревматоїдний артрит. Отже, цим винаходом також пропонуються агенти для лікування хвороб, таких як ревматоїдний артрит, які містять вищеописане антитіло як активний інгредієнт. Переважні приклади цільових хвороб у цьому винаході включають, проте не обмежуються тільки ними, ревматоїдний артрит, ідіопатичний ювенільний артрит, системний ідіопатичний ювенільний артрит, хворобу Каслмана, системний червоний вовчак (SLE), люпус-нефрит, хворобу Крона, лімфому, виразковий коліт, анемію, васкуліт, хворобу Кавасакі, хворобу Стила, амілоїдоз, розсіяний склероз, трансплантацію, пов'язану з віком дегенерацію жовтої плями, анкілозуючий спондилоартрит, псоріаз, псоріатичний артрит, хронічну обструктивну легеневу хворобу (COPD), IgA-нефропатію, остеоартрит, астму, діабетичну нефропатію, GVHD, ендометріоз, гепатит (NASH), інфаркт міокарду, атеросклероз, сепсіс, остеопороз, діабет, множинну мієлому, рак простати, рак нирки, В-клітинну лімфому не Ходжкіна, рак підшлункової залози, рак легенів, рак стравоходу, рак товстої кишки, ракову кахексію, ракову нейроінвазію, інфаркт міокарду, міопічну хоріоїдальну реваскуляризацію, ідіопатичну хоріоїдальну реваскуляризацію, увеїт, хронічний тиреоїдит, уповільнену гіперчутливість, контактний дерматит, атопічний дерматит, мезотеліому, поліміозит, дерматоміозит, панувеїт, передній увеїт, проміжний увеїт, склерит, кератит, орбітальне запалення, неврит зорового нерва, діабетичну ретинопатію, проліферативну вітреоретинопатію, сухе око та післяопераційне запалення. Фраза "включає антитіло проти рецептора IL-6 як активний інгредієнт" означає включення антитіла проти рецептора IL-6 як принаймні одного з активних інгредієнтів, при цьому його вміст особливо не обмежується. Крім того, фармацевтичні композиції цього винаходу можуть містити інші активні інгредієнти у комбінації з поліпептидами, описаними вище. Фармацевтичні композиції цього винаходу можна застосовувати не тільки у терапевтичних цілях, а також з метою профілактики. Поліпептиди цього винаходу можна виготовляти у фармацевтичних складах згідно з традиційними способами (дивись, наприклад, Remington's Pharmaceutical Science, останнє видання, Mark Publishing Company, Easton, USA). За необхідністю, вони можуть містити фармацевтично прийнятні носії та/або добавки. Наприклад, вони можуть включати детергенти (наприклад, ПЕГ та Tween), ексципієнти, антиоксиданти (наприклад, аскорбінову кислоту), барвники, ароматизатори, консерванти, стабілізатори, буфери (наприклад, фосфорну кислоту, лимонну кислоту та інші органічні кислоти), хелатори (наприклад, EDTA), суспендуючі агенти, агенти ізотонічності, зв'язувальні агенти, агенти, що спричиняють дезінтеграцію, змащувальні агенти, агенти, що сприяють плинності, та коригувальні агенти. Проте, агенти цього винаходу для профілактики або лікування запалювальних хвороб не обмежуються вищевказаними, та вони можуть відповідним чином містити інші традиційні носії. Специфічно, приклади включають легку безводну кремнієву кислоту, лактозу, кристалічну целюлозу, маніт, крохмаль, кальцію 17 UA 101221 C2 5 10 15 20 25 30 35 40 45 50 55 60 кармелозу, натрію кармелозу, гідроксипропілцелюлозу, гідроксипропілметилцелюлозу, полівініл-ацетальдіетиламінацетат, полівінілпіролідон, желатин, тригліцерид жирної кислоти з середнім ланцюгом, поліоксіетиленову гідрогеновану касторову олію 60, цукрозу, карбоксиметилцелюлозу, кукурудзяний крохмаль та неорганічні солі. Вони можуть також містити інші поліпептиди з низькою молекулярною масою; білки, такі як сироватковий альбумін, желатин та імуноглобулін; та амінокислоти. Коли готують водні розчини для ін'єкцій, тоді антитіла проти рецептора IL-6 розчиняють, наприклад, в ізотонічних розчинах, що містять фізіологічний сольовий розчин, глюкозу або інші ал'юванти. Ад'юванти включають, наприклад, D-сорбіт, Dманозу, D-маніт та хлорид натрію. Крім того, можна поєднувати відповідні солюбілізуючі агенти, наприклад, спирт (етанол та йому подібне), поліспирт (пропіленгліколь, ПЕГ та їм подібне) та неіонні поверхнево-активні речовини (ПАР) (полісорбат 80 та НСО-50). За необхідністю поліпептиди можуть бути інкапсульованими у мікрокапсули (мікрокапсули, виготовлені з гідроксицелюлози, желатину, полі(метилметакрилату) та їм подібного), або вони можуть бути включеними у колоїдну систему доставки ліків (ліпосоми, мікросфери з альбуміну, мікроемульсії, наночастинки, нанокапсули тощо) (дивись, наприклад, "Remington's Pharmaceutical Science 16th edition", Oslo Ed. (1980)). Крім того, відомими є способи приготування агентів у вигляді агентів уповільненого вивільнення, та їх можна застосовувати до поліпептидів (Langer et al., J. Biomed. Mater. Res. (1981) 15: 167-277; Langer, Chem. Tech. (1982) 12: 98-105; патент США № 3773919; європейська патентна заявка (EP) № 58481; Sidman et al., Biopolymers (1983) 22:547-56; EP № 133988). Крім того, об'єм рідини для підшкірного введення можна збільшити шляхом додавання або підмішування гіалуронідази до агента (наприклад, дивись WO 2004/078140). Фармацевтичні композиції цього винаходу можна вводити як перорально, так і парентерально, проте переважний шлях введення - парентеральний. Специфічно, композиції вводяться пацієнтам шляхом ін'єкції або трансдермально. Ін'єкції включають, наприклад, системне та місцеве введення шляхом внутрішньовенної, внутрішньом'язової або підшкірної ін'єкції або їм подібними способами. Композиції можна вводити шляхом ін'єкції місцево на ділянці лікування або поблизу ділянки, зокрема шляхом внутрішньом'язової ін'єкції. Лікарські форми для трансдермального введення включають, наприклад, мазі, гель, крем, примочки та пластири, які можна вводити місцево або системно. Крім того, способи введення можна відповідним чином вибрати згідно з віком пацієнта та симптомами. Дозу, що вводиться, можна вибрати, наприклад, з діапазону від 0,0001 мг до 100 мг активного інгредієнта на кілограм маси тіла для кожного введення. Альтернативно, коли композиції вводяться пацієнтам-людям, наприклад, дозу активного інгредієнта можна вибрати у діапазоні від 0,001 до 1000 мг на кілограм маси тіла для кожного пацієнта. Єдина доза введення переважно містить, наприклад, антитіло цього винаходу від приблизно 0,01 до 50 мг/кг маси тіла. Проте, доза антитіла цього винаходу не обмежується цими дозами. Амінокислоти, що містяться в амінокислотних послідовностях цього винаходу, можна модифікувати після трансляції (наприклад, модифікація N-кінцевого глютаміну у піроглютамінову кислоту шляхом піроглютамілування є добре відомою фахівцям у цій галузі). Природно, такі модифіковані після трансляції амінокислоти включені в амінокислотні послідовності цього винаходу. Крім того, цукрові ланцюги, які зв'язуються з антитілами згідно з цим винаходом, можуть мати будь-яку структуру. Цукровий ланцюг на позиції 297 (нумерація за EU) може мати будь-яку структуру цукрового ланцюга (переважно, фукозилований цукровий ланцюг), або нема жодного зв'язаного цукрового ланцюга (наприклад, цього можна досягти внаслідок виробництва антитіл в Escherichia coli або внаслідок введення змін, так що жоден цукровий ланцюг не зв'язаний з позицією 297, нумерація за EU). Усі посилання на попередній рівень техніки, які процитовано тут, включено до цього опису винаходу шляхом посилання. Приклади Далі у цьому описі цей винахід буде специфічно описано з посиланням на Приклади, проте їх не слід розглядати як обмежувальні. Приклад 1. Ідентифікація сайтів мутації у варіабельних ділянках для підвищення афінності TOCILIZUMAB до рецептора IL-6. Бібліотеку послідовностей CDR, у які ввели мутації, побудували та проаналізували з метою покращити афінність TOCILIZUMAB (Н-ланцюг WT-IgG1/SEQ ID NO: 53; L ланцюг WT-капа/SEQ ID NO: 54) до рецептора IL-6. Внаслідок скринінгу бібліотеки мутацій CDR виявили мутації, які покращують афінність до рецептора IL-6. Мутації наведено на Фіг. 1. Внаслідок комбінації цих мутацій отримали високоафінний TOCILIZUMAB, такий як RDC-23 (H-ланцюг RDC23H-IgG1/SEQ 18 UA 101221 C2 5 ID NO: 55; L-ланцюг RDC-23L-капа/SEQ ID NO: 56). Афінність до розчинного рецептора IL-6 та біологічну активність, визначену із застосуванням BaF/gp130, порівняли між RDC-23 та TOCILIZUMAB (дивись "Контрольні приклади" для способу). Результат вимірювання афінності наведено у Таблиці 1. Результат визначення біологічної активності із застосуванням BaF/gp130 (кінцева концентрація IL-6 становила 30 нг/мл) наведено на Фіг. 2. Результати продемонстрували, що афінність RDC-23 була вищою приблизно у 60 разів, та активність, яка була представлена як концентрація для 100 % інгібування BaF/gp130, була приблизно у 100 разів вищою порівняно з TOCILIZUMAB. Таблиця 1 TOCILIZUMAB RDC-23 ka(1/Ms) 4,9E+05 6,4E+05 kd(1/s) 2,0E-03 4,3E-05 KD(M) 4,0E-09 6,7E-11 10 15 20 25 Приклад 2. Ідентифікація мутацій для покращення фармакокінетики TOCILIZUMAB шляхом зниження його ізоелектричної точки Для того, щоб покращити фармакокінетику TOCILIZUMAB, здійснювали дослідження для ідентифікації сайтів мутацій, які б знизили ізоелектричну точку варіабельних ділянок, при цьому суттєво не зменшуючи зв'язування з рецептором IL-6. Внаслідок скринінгу сайтів мутацій у варіабельних ділянках, які було передбачено на основі тривимірної структурної моделі TOCILIZUMAB, виявили сайти мутацій, які б знижували ізоелектричну точку варіабельних ділянок без суттєвого зменшення його зв'язування з рецептором IL-6. Результати наведено на Фіг. 3. Внаслідок комбінації цих мутацій отримали TOCILIZUMAB зі зниженою ізоелектричною точкою, включаючи, наприклад, H53/L28 (H-ланцюг H53-IgG1/SEQ ID NO: 57; L-ланцюг L28капа/SEQ ID NO: 58). Афінність до розчинного рецептора IL-6, ізоелектричну точку, фармакокінетику у мишей та біологічну активність, визначену із застосуванням BaF/gp130, порівнювали між H53/L28 та TOCILIZUMAB (дивись "Контрольні приклади" для способу). Результат вимірювання афінності наведено у Таблиці 2. Результат вимірювання біологічної активності, отриманий за допомогою BaF/gp130 (кінцева концентрація IL-6 становила 30 нг/мл), наведено на Фіг. 4. Результати продемонстрували, що афінність H53/L28 була вищою приблизно у 6 разів, та активність, яка була представлена як концентрація для 100 % інгібування BaF/gp130, була приблизно у декілька разів вищою порівняно з TOCILIZUMAB. Таблиця 2 TOCILIZUMAB H53/L28 ka(1/Ms) 4,9E+05 7,6E+05 kd(1/s) 2,0E-03 5,2E-04 KD(M) 4,0E-09 6,8E-10 30 35 40 45 50 Результат визначення ізоелектричної точки шляхом способу електрофорезу з ізоелектричною точкою, який є відомим фахівцям у галузі, продемонстрував, що ізоелектричні точки TOCILIZUMAB та H53/L28 становили приблизно 9,3 та від 6,5 до 6,7, відповідно. Отже, ізоелектрична точка H53/L28 знизилася приблизно на 2,7 порівняно з TOCILIZUMAB. Крім того, теоретичну ізоелектричну точку варіабельних ділянок VH/VL розрахували, застосовуючи GENETYX (GENETYX CORPORATION). Результат продемонстрував, що теоретичні ізоелектричні точки TOCILIZUMAB та H53/L28 становили 9,20 та 4,52, відповідно. Отже, ізоелектрична точка H53/L28 знизилася приблизно на 4,7 порівняно з TOCILIZUMAB. Для того, щоб оцінити фармакокінетику зміненого антитіла H53/L28, яке має знижену ізоелектричну точку, порівнювали фармакокінетику TOCILIZUMAB та H53/L28 у нормальних мишей. Єдину дозу 1 мг/кг TOCILIZUMAB або H53/L28 ввели внутрівенно (IV) або підшкірно (SC) мишам (C57BL/6J; Charles River Japan, Inc.), щоб визначити залежність концентрації у плазмі від часу. Ці залежності від часу концентрацій у плазмі для TOCILIZUMAB та H53/L28 після внутрівенного введення або підшкірного введення наведені на Фіг 5 та 6, відповідно. Фармакокінетичні параметри (кліренс (CL) та період напіврозпаду (Т1/2)), отримані із застосуванням WinNonlin (Pharsight), наведені у Таблиці 3. Період напіврозпаду у плазмі (Т1/2) H53/L28 після внутрівенного введення подовжився приблизно у 1,3 разу порівняно з TOCILIZUMAB, проте кліренс зменшився приблизно у 1,7 разу. T1/2 H53/L28 після підшкірного введення підвищився приблизно удвічі порівняно з TOCILIZUMAB, проте кліренс знизився приблизно у 2,1 разу. Отже, визначили, що фармакокінетику можна суттєво покращити шляхом 19 UA 101221 C2 зниження ізоелектричної точки TOCILIZUMAB за допомогою амінокислотного заміщення. Таблиця 3 IV TOCILIZUMAB H53/L28 5 10 15 20 25 30 35 40 45 50 CL мл/годину/кг 0,177 0,102 SC T1/2 день 18,5 23,5 CL/F мл/годину/кг 0,18 0,086 T1/2 день 14,7 29,7 Приклад 3. Ідентифікація сайтів мутації, які знижують імуногенність TOCILIZUMAB Ідентифікація мутацій, які знижують ризик імуногенності Т-клітинних епітопів, які є присутніми у варіабельних ділянках Т-клітинні епітопи, що є присутніми у послідовності варіабельної ділянки TOCILIZUMAB проаналізували, застосовуючи TEPITOPE (Methods. 2004 Dec; 34(4):468-75). В результаті було передбачено, що CDR2 L-ланцюга має багато Т-клітинних епітопів, які будуть зв'язуватися з HLA (тобто, мають послідовність з високим ризиком імуногенності). Отже, аналіз ТЕРІТОРЕ здійснювали для дослідження амінокислотних заміщень, які будуть знижувати ризик імуногенності CDR2 L-ланцюга без зниження стабільності, зв'язувальної активності або нейтралізуючої активності. Як описується далі, результат скринінгу продемонстрував, що ризик імуногенності можна знизити без зниження стабільності, зв'язувальної активності або нейтралізуючої активності шляхом заміщення треоніну на L51 (нумерація за Kabat: Kabat EA et al., (1991) Sequences of Proteins of Immunological Interest, NIH)) CDR2 L-ланцюга (SEQ ID NO: 59) TOCILIZUMAB гліцином та шляхом заміщення аргініну на L53 глютаміновою кислотою (SEQ ID NO: 60). CDR2 L-ланцюга TOCILIZUMAB (SEQ ID NO: 59). CDR2 L-ланцюга TOCILIZUMAB з видаленими Т-клітинними епітопами (SEQ ID NO: 60). Приклад 4. Зниження ризику імуногенності шляхом повної гуманізації каркасних послідовностей варіабельної ділянки TOCILIZUMAB У процесі гуманізації TOCILIZUMAB деякі мишачі послідовності залишаються у каркасній послідовності, щоб зберегти зв'язувальну активність (Cancer Res. 1993 Feb 15; 53(4):851-6). Ці послідовності - це H27, H28, H29 та H30 у FR1 Н-ланцюга та H71 у FR3 Н-ланцюга (нумерація за Kabat: Kabat EA et al., (1991) Sequences of Proteins of Immunological Interest, NIH)) послідовності варіабельної ділянки TOCILIZUMAB. Мишачі послідовності, що залишилися, є потенційною причиною підвищеного ризику імуногенності. Отже, визначили, чи можна повністю гуманізувати каркасну послідовність для того, щоб іще знизити ризик імуногенності TOCILIZUMAB. Результат продемонстрував, що увесь каркас TOCILIZUMAB можна повністю гуманізувати без зниження стабільності, зв'язувальної активності або нейтралізуючої активності - шляхом заміщення FR1 Н-ланцюга (SEQ ID NO: 61) TOCILIZUMAB гуманізованою FR1-A Н-ланцюга (SEQ ID NO: 62), наведеною нижче, та шляхом заміщення FR3 Н-ланцюга (SEQ ID NO: 63) гуманізованою FR3 Н-ланцюга (SEQ ID NO: 64), наведеною нижче. FR1 Н-ланцюга TOCILIZUMAB (SEQ ID NO: 61). Гуманізована FR1-A Н-ланцюга (SEQ ID NO: 62) (походить від зародкової лінії IMGT hVH_4). FR3 Н-ланцюга TOCILIZUMAB (SEQ ID NO: 63). Гуманізована FR3 Н-ланцюга (SEQ ID NO: 64) (походить від Mol. Immunol. 2007, 44(4):412422) Приклад 5. Ідентифікація сайтів мутації з метою покращення фармакокінетики на основі рНзалежного зв'язування TOCILIZUMAB з рецептором IL-6 Один із способів покращення фармакокінетики TOCILIZUMAB - це удосконалення молекули так, щоб єдина молекула TOCILIZUMAB неодноразово зв'язувалася б та нейтралізувати декілька молекул рецептора IL-6. Вважається, що після зв'язування з рецептором IL-6 мембранного типу TOCILIZUMAB захоплюється у внутрішньоклітинні ендосоми внаслідок інтерналізації, будучи зв'язаним з рецептором IL-6 мембранного типу, потім воно переноситься в лізосоми, будучи зв'язаним з рецептором IL-6 мембранного типу, та зрештою воно руйнується лізосомами. Специфічно, одна молекула TOCILIZUMAB зазвичай зв'язується з однією або двома молекулами рецептора IL-6 мембранного типу (одновалентним або двовалентним чином) та руйнується в лізосомах після інтерналізації. Отже, одна молекула TOCILIZUMAB може зв'язуватися та нейтралізувати тільки одну або дві молекули рецептора IL-6 мембранного типу. Отже, автори цього винаходу вважали, що якщо б було можливо створити TOCILIZUMAB, 20 UA 101221 C2 5 10 15 20 25 30 35 40 45 50 що зв'язується залежним від рН чином, при цьому зв'язування TOCILIZUMAB підтримувалось би за нейтральних умов, але суттєво знижувалося б при кислотних умовах, тоді б TOCILIZUMAB, що зв'язується залежним від рН чином, могло б дисоціюватися від рецептора IL-6 мембранного типу (антигену) в ендосомах та повертатися до плазми внаслідок зв'язування з FcRn, що є присутнім в ендосомах, як показано на Фіг. 7. Коли TOCILIZUMAB повертається до плазми, тоді TOCILIZUMAB, що зв'язується залежним від рН чином, міг би знов зв'язуватися з рецептором IL6 мембранного типу. Вважають, що внаслідок неодноразового зв'язування у плазмі та дисоціації в ендосомах, одна молекула TOCILIZUMAB може неодноразово зв'язуватися/нейтралізувати декілька молекул рецептора IL-6. Отже, передбачається, що TOCILIZUMAB, що зв'язується залежним від рН чином, має покращену фармакокінетику порівняно з TOCILIZUMAB. Для того, щоб TOCILIZUMAB дисоціювався від рецептора IL-6 у кислотних умовах в ендосомах, зв'язування мусить суттєво послаблюватися у кислотних умовах порівняно з нейтральними умовами. На клітинній поверхні для нейтралізації необхідне сильне зв'язування рецептора IL-6; отже, при рН 7,4, яке є рН клітинної поверхні, антитіло мусить зв'язуватися з рецептором IL-6 так само сильно або сильніше, ніж TOCILIZUMAB. Повідомлялося, що ендосомне рН зазвичай становить від 5,5 до 6,0 (Nat Rev Mol Cell Biol. 2004 Feb;5(2):121-32). Отже, якщо TOCILIZUMAB, що зв'язується залежним від рН чином, модифікувати так, щоб воно слабо зв'язувалося б з рецептором IL-6 при рН від 5 до 6,0, то можна передбачити, що воно дисоціюється від рецептора IL-6 у кислотних умовах в ендосомах. Специфічно, якщо TOCILIZUMAB, що зв'язується залежним від рН чином, удосконалити так, що воно сильно зв'язується з рецептором IL-6 при рН 7,4, яке є рН клітинної поверхні, та слабо зв'язується з рецептором IL-6 при рН від 5,5 до 6,0, яке є ендосомним рН, тоді одна молекула TOCILIZUMAB може зв'язуватися та нейтралізувати декілька молекул рецептора IL-6, та внаслідок цього фармакокінетика може покращуватися. Можливим способом надання залежності від рН при зв'язуванні TOCILIZUMAB з рецептором IL-6 є введення залишків гістидину у варіабельну ділянку TOCILIZUMAB, оскільки рКа залишку гістидину становить приблизно від 6,0 до 6,5, та його стан протонної дисоціації змінюється між нейтральними (рН 7,4) та кислотними (рН від 5,5 до 6,0) умовами. Отже, здійснювали скринінг з метою ідентифікувати сайти для введення гістидину у варіабельні ділянки на основі тривимірної структурної моделі TOCILIZUMAB. Крім того, вибрані послідовності варіабельної ділянки TOCILIZUMAB випадково заміщували гістидином, щоб побудувати бібліотеку для скринінгу. Скринінг здійснювали, застосовуючи зв'язування з рецептором IL-6 при рН 7,4 та дисоціацію від рецептора IL-6 або зниження афінності при рН від 5,5 до 5,8 які показника. Внаслідок цього автори цього винаходу визначили сайти мутації, які надають зв'язуванню TOCILIZUMAB з рецептором IL-6 залежності від рН (властивість зв'язуватися при рН 7,4 та дисоціюватися при рН 5,8). Ці результати наведено на Фіг. 8. На Фіг. 8 заміщення тирозину на Н27 гістидином - це мутація у FR1 Н-ланцюга, а не у CDR. Проте, як описано у Eur. J. Immunol. (1992) 22: 1719-1728, послідовність з гістидином на Н27 - це людська послідовність (SEQ ID NO: 65). Отже, антитіло можна повністю гуманізувати, застосовуючи наступну каркасну ділянку у комбінації з Прикладом 4. Гуманізована FR1-B Н-ланцюга (SEQ ID NO: 65). Внаслідок комбінації мутацій, включаючи, наприклад, H3pI/L73 (H-ланцюга H3pI-IgG1/SEQ ID NO: 66; L-ланцюга L73-капа/SEQ ID NO: 67), можна отримати TOCILIZUMAB з рН-залежними властивостями зв'язування. H3pI/L73 та TOCILIZUMAB порівняли стосовно їхньої афінності щодо розчинного рецептора IL-6 при рН 7,4, швидкості дисоціації від рецептора IL-6 мембранного типу при рН 7,4 та рН 5,8, біологічної активності із застосуванням BaF/gp130 та фармакокінетики у трансгенних мишей з рецептором IL-6 людини та у мавп cynomolgus (дивись "Контрольні приклади" для способу). Результат аналізу афінності для розчинного рецептора IL-6 при рН 7,4 наведено у Таблиці 4. Результат аналізу стосовно біологічної активності, який отримали із застосуванням BaF/gp130 (кінцева концентрація IL-6 становила 30 нг/мл), наведено на Фіг. 9. Ці результати продемонстрували, що H3pI/L73 є порівняльним з TOCILIZUMAB стосовно афінності до розчинного рецептора IL-6 при рН 7,4 та активності на BaF/gp130. Таблиця 4 TOCILIZUMAB H3pI/L73 ka(1/Ms) 5,1E+05 5,4E+05 kd(1/s) 1,0E-03 7,4E-04 55 21 KD(M) 2,1E-09 1,4E-09 UA 101221 C2 Результат вимірювання швидкості дисоціації TOCILIZUMAB або H3pI/L73 від рецептора IL-6 мембранного типу при рН 7,4 та рН 5,8 наведено у Таблиці 5. Порівняно з TOCILIZUMAB швидкість дисоціації H3pI/L73 при рН 5,8 була вищою, а рН-залежність швидкості дисоціації від рецептора IL-6 мембранного типу збільшилася приблизно у 2,6 разу. 5 Таблиця 5 TOCILIZUMAB H3pI/L73 10 15 20 25 30 35 40 45 50 рН 7,4 kd(1/s) 2,5E-04 2,6E-04 рН 5,8 kd(1/s) 2,5E-04 6,7E-04 kd(рН 5,8)/kd(рН 7,4) Залежність від рН 1,00 2,59 Єдину дозу у 1 мг/кг TOCILIZUMAB або H3pI/L73 внутрівенно вводили мавпам cynomolgus, щоб визначити зміну за часом концентрації у плазмі. Зміну за часом концентрації у плазмі TOCILIZUMAB або H3pI/L73 після внутрівенного введення наведено на Фіг. 10. Результат продемонстрував, що фармакокінетика H3pI/L73 у мавп сynomolgus суттєво покращилася порівняно з TOCILIZUMAB. Єдину дозу у 25 мг/кг TOCILIZUMAB або H3pI/L73 ввели внутрівенним шляхом трансгенним мишам з рецептором IL-6 людини (трансгенні миші hIL-6R; Proc Natl Acad Sci U S A. 1995 May 23; 92(11):4862-6), щоб визначити зміну за часом концентрації у плазмі. Зміну за часом концентрації у плазмі TOCILIZUMAB або H3pI/L73 після внутрівенного введення наведено на Фіг. 11. Результат продемонстрував, що фармакокінетика H3pI/L73 у трансгенних мишей з рецептором IL-6 людини суттєво покращилася порівняно з TOCILIZUMAB. H3pI/L73, яке є TOCILIZUMAB з рН-залежними зв'язувальними властивостями, продемонструвало суттєво покращену фармакокінетику на трансгенних мишах з рецептором IL6 людини та у мавп cynomolgus порівняно з TOCILIZUMAB. Це дозволяє припустити, що внаслідок надання властивості зв'язуватися з антигеном при рН 7,4 та властивості дисоціюватися від антигену при рН 5,8 можна зв'язуватися з та нейтралізувати декілька молекул рецептора IL-6 однією єдиною молекулою. Також вважали, що фармакокінетику можна далі покращувати внаслідок надання властивості зв'язуватися з рецептором IL-6 при більш суттєвій рН-залежності, ніж у H3pI/L73. Приклад 6. Оптимізація константної ділянки TOCILIZUMAB Зниження гетерогенності С-закінчення Н-ланцюга TOCILIZUMAB Стосовно гетерогенності С-кінцевих послідовностей Н-ланцюга антитіла IgG, повідомлялося про видалення С-кінцевого амінокислотного залишку лізину та амідування С-кінцевої карбоксильної групи шляхом видалення обох з двох С-кінцевих амінокислот, гліцину та лізину (Anal Biochem. 2007 Jan 1; 360(1):75-83). Також у TOCILIZUMAB, головний компонент - це послідовність, у якій С-кінцевий амінокислотний лізин у нуклеотидній послідовності видаляється внаслідок модифікації після трансляції; проте, субкомпоненти, у яких лізин залишається, та субкомпоненти, у яких С-кінцева карбоксильна група амідується внаслідок видалення гліцину та лізину, також існують як гетерогенність. Нелегко та більш дорого виробляти їх як фармацевтичні препарати у великих масштабах, при цьому підтримуючи між продуктами споріднену гетерогенність між цільовими речовинами/спорідненими речовинами. Якщо можливо, бажано щоб вони були однорідними речовинами та мали знижену гетерогенність, коли антитіла розробляють як фармацевтичні препарати. Отже, переважно, щоб С-кінцева гетерогенність Нланцюга була відсутньою, коли антитіла розробляють як фармацевтичні препарати. С-кінцеву амінокислоту змінили так, щоб знизити гетерогенність С-кінцевої амінокислоти. Результат продемонстрував, що похідну від С-закінчення гетерогенність можна попередити шляхом попереднього видалення з нуклеотидної послідовності залишків лізину та гліцину на Сзакінченні константної ділянки Н-ланцюга TOCILIZUMAB. TOCILIZUMAB, TOCILIZUMAB, у якому не вистачає залишку С-кінцевого лізину (TOCILIZUMABΔK: H-ланцюг WT-IgG1ΔK/SEQ ID NO: 68; L-ланцюг WT-капа/SEQ ID NO: 54), та TOCILIZUMAB, у якому не вистачає залишків Скінцевого лізину та гліцину (TOCILIZUMABΔGK: H-ланцюг WT-IgG1GK/SEQ ID NO: 69; L-ланцюг WT-капа/SEQ ID NO: 54), оцінювали с точки зору гетерогенності шляхом катіонообмінної хроматографії. Застосовували колонку ProPac WCX-10, 4 × 250 мм (Dionex); та рухома фаза А становила 25 ммоль/л MES/NaOH (pH 6,1), та рухома фаза В становила 25 ммоль/л MES/NaOH, 250 ммоль/л NaCl (pH 6,1). Застосовували відповідну витрату потоку та градієнт. Результат оцінювання, отриманий внаслідок катіонообмінної хроматографії, наведено на Фіг. 12. Результат продемонстрував, що С-кінцеву амінокислотну гетерогенність можна зменшити завдяки попередньому видаленню з нуклеотидної послідовності обох залишків, лізину та 22 UA 101221 C2 5 10 15 20 25 30 35 40 45 50 55 60 гліцину, на С-закінченні константної ділянки Н-ланцюга, але її не можна зменшити шляхом попереднього видалення тільки залишку лізину на С-закінченні константної ділянки Н-ланцюга. Усі С-кінцеві послідовності константної ділянки антитіл людини IgG1, IgG2 та IgG4 містять лізин та гліцин на позиціях 447 та 446, відповідно, згідно з нумерацією за EU (дивись Sequences of proteins of immunological interest, NIH Publication No.91-3242). Отже, очікується, що спосіб зменшення С-кінцевої амінокислотної гетерогенності, який винайшли у цьому дослідженні, можна буде також застосовувати до константних ділянок IgG2 та IgG4 та їх варіантів. Зменшення зумовленої дисульфідним зв'язком гетерогенності у TOCILIZUMAB ізотипу IgG2 Ізотип TOCILIZUMAB - це IgG1. Оскільки TOCILIZUMAB - це нейтралізуюче антитіло, то зв'язування з рецептором Fcγ може бути небажаним з точки зору імуногенності та негативних ефектів. Можливий спосіб зменшення зв'язування з рецептором Fcγ - це перетворення ізотипу антитіла IgG з IgG1 на IgG2 або IgG4 (Ann Hematol. 1998 Jun; 76(6):231-48). З точки зору фармакокінетики та зв'язування з рецептором І Fcγ, вважали, що IgG2 є більш бажаним порівняно з IgG4 (Nat Biotechnol. 2007 Dec; 25(12):1369-72). Між тим, фізико-хімічні властивості білків, зокрема, гомогенність та стабільність є дуже важливими, коли антитіла розробляються як фармацевтичні препарати. Повідомлялося, що ізотип IgG2 має дуже високу гетерогенність внаслідок дисульфідних зв'язків у шарнірній ділянці (J Biol Chem. 2008 Jun 6; 283(23):16206-15). Може бути нелегко та більш дорого виробляти їх як фармацевтичні препарати у великих масштабах, зберігаючи при цьому між продуктами споріднену гетерогенність цільових речовин/споріднених речовин, яка зумовлюється дисульфідними зв'язками. Отже, однорідні речовини є якомога бажаними. Отже, коли антитіла ізотипу IgG2 розробляються як фармацевтичні препарати, тоді бажано зменшити гетерогенність, що зумовлюється дисульфідними зв'язками, без зниження стабільності. З метою зменшення гетерогенності ізотипу IgG2, оцінювалися різні варіанти. Внаслідок цього визначили, що гетерогенність можна зменшити без зниження стабільності, застосовуючи при цьому константну ділянку WT-SKSC (SEQ ID NO: 70), у якій у послідовностях константної ділянки IgG2 залишок цистеїну на позиції 131 та залишок аргініну на позиції 133 (нумерація за EU) у домені СН1 Н-ланцюга замістили серином та лізином, відповідно, а залишок цистеїну на позиції 219 (нумерація за EU) у верхній шарнірній ділянці Н-ланцюга замістили серином. TOCILIZUMAB-IgG1 (Н-ланцюг WT-IgG1/SEQ ID NO: 53; L-ланцюг WT-капа/SEQ ID NO: 54), TOCILIZUMAB-IgG2 (H-ланцюг WT-IgG2/SEQ ID NO: 71; L-ланцюг WT-капа/SEQ ID NO: 54) та TOCILIZUMAB-SKSC (H-ланцюг WT-SKSC/SEQ ID NO: 70; L-ланцюг WT-капа/SEQ ID NO: 54) приготували та оцінили стосовно гетерогенності та стабільності. Гетерогенність оцінювали шляхом катіонообмінної хроматографії. Застосовували колонку ProPac WCX-10 (Dionex); та рухома фаза А була 20 мМ натрію ацетату (рН 5,0), та рухома фаза В була 20 мМ натрію ацетату, 1 М NaCl (pH 5,0). Застосовували відповідну витрату потоку та градієнт. Результат оцінювання, отриманий шляхом катіонообмінної хроматографії, наведено на Фіг. 13. Стабільність оцінювали на основі проміжної температури при тепловій денатурації (значення Tm), отриманій шляхом диференціальної скануючої калориметрії (DSC) (VP-DSC; Microcal). Результат вимірювання за DSC у 20 мМ ацетату натрію, 150 мМ NaCl, рН 6,0, та значення Tm домену Fab наведено на Фіг. 14. Результат продемонстрував, що гетерогенність помітно зростає у TOCILIZUMAB-IgG2 порівняно з TOCILIZUMAB-IgG1; проте, гетерогенність можна суттєво зменшити шляхом перетворення у TOCILIZUMAB-SKSC. Крім того, при порівнянні з TOCILIZUMAB-IgG1, DSC TOCILIZUMAB-IgG2 продемонстрував плечовий пік (Fab*) компонента з низькою стабільністю, тобто, низьким Tm, у піках теплової денатурації домену Fab, що, як передбачають, є наслідком гетерогенного компонента. Проте, при перетворенні у TOCILIZUMAB-SKSC плечовий пік (низьке Tm), що вважають наслідком гетерогенного компонента, зникає, та значення Tm становило приблизно 94 °C, яке дорівнювало значенню домену Fab TOCILIZUMAB-IgG1 та TOCILIZUMABIgG2. Отже, було визначено, що TOCILIZUMAB-SKSC має високу стабільність. Ідентифікація сайтів мутації, які покращують фармакокінетику, у константній ділянці TOCILIZUMAB Як описано вище, починаючи з IgG1, який є ізотипом TOCILIZUMAB, можна досягти зменшення С-кінцевої гетерогенності та зменшення гетерогенності антитіл з константними ділянками ізотипу IgG2, при цьому знижуючи зв'язування з рецептором Fcγ та зберігаючи високу стабільність. Крім того, переважно, щоб константна ділянка також мала кращу фармакокінетику порівняно з IgG1, який є ізотипом TOCILIZUMAB. Для того, щоб визначити константні ділянки, які мають кращий період напіврозпаду у плазмі, ніж антитіла з константними ділянками ізотипу IgG1, здійснювали скринінг, щоб ідентифікувати сайти мутації для покращення фармакокінетики TOCILIZUMAB-SKSC, що має високу 23 UA 101221 C2 5 10 15 20 стабільність та зменшену гетерогенність, по відношенню до антитіл з константними ділянками ізотипу IgG2, як згадувалося вище. Внаслідок цього відкрили WT-M58 (SEQ ID NO: 72 (амінокислотну послідовність)), де порівняно з WT-SKSC глютамінова кислота на позиції 137 (нумерація за EU) заміщена гліцином, серин на позиції 138 заміщений гліцином, гістидин на позиції 268 заміщений глютаміном, аргінін на позиції 355 заміщений глютаміном, глютамін на позиції 419 заміщений глютаміновою кислотою та де гліцин на позиції 446 та лізин на позиції 447 видалені, внаслідок чого зменшується гетерогенність С-закінчення Н-ланцюга. Крім того, WT-M44 (SEQ ID NO: 73 (амінокислотну послідовність)) приготували так, що вона мала заміщення аспарагіну на позиції 434 аланіном відносно IgG1. Крім того, WT-M83 (SEQ ID NO: 74 (амінокислотну послідовність)) отримали шляхом видалення гліцину на позиції 446 та лізину на позиції 447 з М44, щоб зменшити гетерогенність С-закінчення Н-ланцюга. Крім того, WT-M73 (SEQ ID NO: 75 (амінокислотну послідовність)) отримали шляхом заміщення аспарагіну на позиції 434 аланіном у WT-M58. TOCILIZUMAB-M44 (H-ланцюг WT-M44/SEQ ID NO: 73; L-ланцюг WT-капа/SEQ ID NO: 54), TOCILIZUMAB-M58 (H-ланцюг WT-M58/SEQ ID NO: 72; L-ланцюг WT-капа/SEQ ID NO: 54) та TOCILIZUMAB-M73 (H ланцюг WT-M73/SEQ ID NO: 75; L-ланцюг WT-капа/SEQ ID NO: 54) приготували та оцінили стосовно їхньої афінності до FcRn людини та фармакокінетики, застосовуючи трансгенних мишей з FcRn людини (дивись "Контрольні приклади" для способу). Зв'язування TOCILIZUMAB-IgG1, TOCILIZUMAB-M44, TOCILIZUMAB-M58 та TOCILIZUMABM73 з FcRn людини оцінили, застосовуючи Biacore. Як показано у Таблиці 6, зв'язування TOCILIZUMAB-M44, TOCILIZUMAB-M58 та TOCILIZUMAB-M73 перебільшувало у 2,7 разу, 1,4 разу та 3,8 разу зв'язування TOCILIZUMAB-IgG1, відповідно. Таблиця 6 TOCILIZUMAB-IgG1 TOCILIZUMAB-M44 TOCILIZUMAB-M58 TOCILIZUMAB-M73 25 30 35 40 45 50 KD (μ M) 1,62 0,59 1,17 0,42 TOCILIZUMAB-IgG1, TOCILIZUMAB-M44, TOCILIZUMAB-M58 та TOCILIZUMAB-M73 оцінили щодо їхньої фармакокінетики у трансгенних мишей з FcRn людини. Результат наведено на Фіг. 15. При порівнянні з TOCILIZUMAB-IgG1 визначили, що усі TOCILIZUMAB-M44, TOCILIZUMAB-M58 та TOCILIZUMAB-M73 демонструють покращену фармакокінетику, як показано на Фіг. 15. Ефект покращення фармакокінетики співвідноситься зі здатністю зв'язуватися з FcRn людини. Зокрема, концентрація TOCILIZUMAB-М73 у плазмі через 28 днів була кращою приблизно у 16 разів порівняно з TOCILIZUMAB-IgG1. Отже, також передбачали, що антитіла, які мають константну ділянку М73, мають суттєво покращену фармакокінетику у людей порівняно з антитілами, що мають константну ділянку IgG1. Приклад 7. Отримання повністю гуманізованих антитіл рецептора IL-6 з покращеними PK/PD Варіанти TOCILIZUMAB отримали шляхом поєднання множинних мутацій у варіабельній та константній ділянках TOCILIZUMAB, визначених у вищеописаних прикладах. Повністю гуманізованими антитілами рецептора IL-6, визначеними внаслідок скринінгу, були: Fv3-M73 (Hланцюг VH4-M73/SEQ ID NO: 25; L-ланцюг VL1-капа/SEQ ID NO: 28), Fv4-M73 (H-ланцюг VH3M73/SEQ ID NO: 26; L-ланцюг VL3-капа/SEQ ID NO: 29) та Fv5-M83 (H-ланцюг VH5-M83/SEQ ID NO: 27; L-ланцюг VL5-капа/SEQ ID NO: 30). Афінність отриманих Fv3-M73, Fv4-M73 та Fv5-M83 до рецептора IL-6 порівняли з афінністю TOCILIZUMAB (дивись "Контрольні приклади" для способу). Показники афінності цих антитіл для розчинного рецептора IL-6, визначені при рН 7,4, наведено у Таблиці 7. Крім того, їхню BaF/gp130-нейтралізуючу активність порівнювали з нейтралізуючою активністю TOCILIZUMAB та контрольного антитіла (відоме високоафінне антитіло проти рецептора IL-6, описане у "Контрольному прикладі", та VQ8F11-21 hIgG1, описане у US 2007/0280945) (дивись "Контрольний приклад" для способу). Результати, отримані внаслідок визначення біологічної активності цих антитіл із застосуванням BaF/gp130, наведено на Фіг. 16 (TOCILIZUMAB, контрольне та Fv5-M83 з кінцевою концентрацією IL-6 300 нг/мл) та Фіг. 17 (TOCILIZUMAB, Fv3M73 та Fv4-M73 з кінцевою концентрацією IL-6 30 нг/мл). Як показано у Таблиці 7, Fv3-M73 та Fv4-M73 мають приблизно у 2-3 рази більшу афінність порівняно з TOCILIZUMAB, тоді як Fv5M83 демонструє приблизно у 100 разів більшу афінність порівняно з TOCILIZUMAB (оскільки було важко вимірити афінність Fv5-M83, то замість цього визначили афінність, застосовуючи 24 UA 101221 C2 5 Fv5-IgG1 (H-ланцюг VH5-IgG1 /SEQ ID NO: 76; L-ланцюг VL5-капа /SEQ ID NO: 30), яке має константну ділянку ізотипу IgG1; зазвичай вважають, що константна ділянка не має ніякого впливу на афінність). Як показано на Фіг. 17, Fv3-M73 та Fv4-M73 демонструють несуттєво більш сильну активність порівняно з TOCILIZUMAB. Як показано на Фіг. 16, Fv5-M83 має дуже сильну активність, яка більш ніж у 100 разів перебільшує активність TOCILIZUMAB, виміряну як 50 % інгібіторну концентрацію. Fv5-M83 також демонструє приблизно у 10 разів вищу нейтралізуючу активність, виміряну як 50 % інгібіторну концентрацію, порівняно з контрольним антитілом (відомим високоафінним антитілом проти рецептора IL-6). Таблиця 7 TOCILIZUMAB Fv3-M73 Fv4-M73 Fv5-M83 ka(1/Ms) 4,0E+05 8,5Е+05 7,5Е+05 1,1E+06 kd(1/s) 1,1E-03 8,7Е-04 1,0Е-03 2,8E-05 KD(M) 2,7E-09 1,0E-09 1,4E-09 2,5Е-11 10 15 Визначили швидкість дисоціації TOCILIZUMAB, Fv3-M73 та Fv4-M73 від рецептора IL-6 мембранного типу при рН 7,4 та 5,8. Як продемонстровано результатом, наведеним у Таблиці 8 (дивись "Контрольний приклад" для способу), рН-залежність швидкості дисоціації Fv3-M73 та Fv4-M73 від рецептора IL-6 мембранного типу покращилася приблизно в 11 та 10 разів, відповідно, порівняно з TOCILIZUMAB. Суттєве покращення рН-залежності швидкості дисоціації стосовно H3pI/L73, описаного у Прикладі 5, дозволяє припустити, що, при порівнянні з H3pI/L73, фармакокінетика Fv3-M73 та Fv4-M73 буде суттєво покращеною. Таблиця 8 TOCILIZUMAB Fv3-M73 Fv4-M73 20 25 30 35 40 45 рН 7,4 kd(1/s) 2,5E-04 4,9Е-04 5,1E-04 рН 5,8 kd(1/s) 2,5E-04 5,3Е-03 5,1E-03 kd(рН 5,8)/kd(рН 7,4) Залежність від рН 1,00 10,88 10,06 Ізоелектричні точки TOCILIZUMAB, контрольного, Fv3-M73, Fv4-M73 та Fv5-M83 визначили шляхом електрофорезу з ізоелектричним фокусуванням, застосовуючи спосіб, відомий фахівцям у цій галузі. Результат продемонстрував, що ізоелектрична точка становила приблизно 9,3 для TOCILIZUMAB; приблизно від 8,4 до 8,5 для контрольного; приблизно від 5,7 до 5,8 для Fv3-M73; приблизно від 5,6 до 5,7 для Fv4-M73 та від 5,4 до 5,5 для Fv5-M83. Отже, кожне антитіло мало суттєво знижену ізоелектричну точку порівняно з TOCILIZUMAB та контрольним. Крім того, теоретичну ізоелектричну точку варіабельних ділянок VH/VL розрахували, використовуючи GENETYX (GENETYX CORPORATION). Цей результат продемонстрував, що теоретична ізоелектрична точка становила 9,20 для TOCILIZUMAB; 7,79 для контрольного; 5,49 для Fv3-M73; 5,01 для Fv4-M73 та 4,27 для Fv5-M83. Отже, кожне антитіло мало суттєво знижену ізоелектричну точку порівняно з TOCILIZUMAB та контрольним. Оскільки у Прикладі 2 було показано, що фармакокінетика покращується внаслідок зниження ізоелектричної точки, то вважали, що фармакокінетика Fv3-M73, Fv4-M73 та Fv5-M83 покращується порівняно з TOCILIZUMAB та контрольним. Т-клітинні епітопи у послідовності варіабельної ділянки TOCILIZUMAB, Fv3-M73, Fv4-M73 або Fv5-M83 проаналізували, застосовуючи TEPITOPE (Methods. 2004 Dec;34(4):468-75). Як наслідок, передбачили, що TOCILIZUMAB має Т-клітинні епітопи, багато з яких можуть зв'язуватися з HLA, як показано у Прикладі 3. Навпаки, як було передбачено, кількість послідовностей, що зв'язуються з Т-клітинними епітопами, суттєво зменшена у Fv3-M73, Fv4M73 та Fv5-M83. Крім того, каркасна ділянка Fv3-M73, Fv4-M73 або Fv5-M83 не має мишачої послідовності та, отже, є повністю гуманізованою. Все це дозволяє припустити можливість того, що ризик імуногенності суттєво зменшений у Fv3-M73, Fv4-M73 та Fv5-M83 при порівнянні з TOCILIZUMAB. Приклад 8. Тест PK/PD повністю гуманізованих антитіл рецептора IL-6 у мавп Кожне з TOCILIZUMAB, контрольного, Fv3-M73, Fv4-M73 та Fv5-M83 ввели внутрішньовенним способом один раз у дозі 1 мг/кг мавпам cynomolgus, щоб оцінити їхні показники зміни за часом концентрації у плазмі (дивись "Контрольний приклад" для способу). 25 UA 101221 C2 5 10 15 20 25 30 35 40 45 50 55 60 Зміни за часом концентрації у плазмі TOCILIZUMAB, Fv3-M73, Fv4-M73 та Fv5-M83 після внутрішньовенного введення наведено на Фіг. 18. Результат показав, що кожне з Fv3-M73, Fv4M73 та Fv5-M83 демонструвало суттєво покращену фармакокінетику у мавп cynomoglus порівняно з TOCILIZUMAB та контрольним. Серед них, Fv3-M73 та Fv4-M73 демонстрували дуже покращену фармакокінетику порівняно з TOCILIZUMAB. Оцінили ефективність кожного антитіла нейтралізувати рецептор IL-6 мембранного типу мавп cynomoglus. IL-6 мавп cynomoglus вводили підшкірно в нижню частину спини у дозі 5 мкг/кг кожного дня з 6-го дня до 18-го дня після введення антитіла (з 3-го дня до 10-го дня для TOCILIZUMAB), та концентрацію CRP у кожної тварини визначали 24 годинами пізніше (дивись "Контрольний приклад" для способу). Зміни за часом концентрації CRP після введення кожного антитіла наведено на Фіг. 19. Для того, щоб оцінити ефективність кожного антитіла стосовно нейтралізації розчинного рецептора IL-6 мавп cynomoglus, визначили концентрацію у плазмі вільного розчинного рецептора IL-6 мавп cynomoglus та розрахували відсоткове відношення вільного розчинного рецептора IL-6 (дивись "Контрольний приклад" для способу). Зміни за часом відсоткового відношення вільного розчинного рецептора IL-6 після введення кожного антитіла наведено на Фіг. 20. Кожне з Fv3-M73, Fv4-M73 та Fv5-M83 нейтралізувало рецептор IL-6 мембранного типу мавп cynomoglus довше та пригнічувало зростання CRP протягом більш тривалого періоду часу порівняно з TOCILIZUMAB та контрольним (відомим високоафінним антитілом проти рецептора IL-6). Крім того, кожне з Fv3-M73, Fv4-M73 та Fv5-M83 нейтралізувало розчинний рецептор IL-6 мавп cynomoglus довше та пригнічувало зростання вільного розчинного рецептора IL-6 мавп cynomoglus протягом більш тривалого періоду часу порівняно з TOCILIZUMAB та контрольним. Ці результати демонструють, що усі з Fv3-M73, Fv4-M73 та Fv5-M83 є кращими стосовно підтримання нейтралізації рецептора IL-6 мембранного типу та розчинного рецептора IL-6 порівняно з TOCILIZUMAB та контрольним. Серед них Fv3-M73 та Fv4-M73 є помітно кращими стосовно підтримання нейтралізації. Між тим, Fv5-M83 пригнічував CRP та вільний розчинний рецептор IL-6 мавп cynomoglus більш сильно порівняно з Fv3-M73, Fv4-M73. Отже, вважають, що Fv5-M83 є більш сильним, ніж Fv3-M73, Fv4-M73 та контрольне (відоме високоафінне антитіл проти рецептора IL-6) стосовно нейтралізації рецептора IL-6 мембранного типу та розчинного рецептора IL-6. Вважали, що результати in vivo мавп cynomoglus демонструють більш сильну афінність Fv5-M83 щодо рецептора IL-6 та більш сильну біологічну активність Fv5M83 в аналітичній системі BaF/gp130 відносно контрольного. Ці результати дозволяють припустити, що Fv3-M73 та Fv4-M73 є надзвичайно переважними щодо підтримання їхньої активності як нейтралізуючого антитіла проти рецептора IL-6, порівняно з TOCILIZUMAB та контрольним, та, отже, вони дозволяють суттєво знизити дозу та частоту введення. Крім того, було продемонстровано, що Fv5-M83 є помітно кращим відносно сили активності як нейтралізуюче антитіло проти рецептора IL-6, а також щодо зберігання своєї активності. Отже, очікується, що Fv3-M73, Fv4-M73 та Fv5-M83 будуть корисними як фармацевтичні антагоністи IL-6. Приклад 9 Відомо, що білок-хемоатрактант моноцитів (МСР) залучається у клітинну інвазію моноцитів, Т-клітин, NK-клітин та базофілів. Повідомлялося, що МСР-1 надзвичайно експресувався у синовіальних тканинах/синовіальній рідині пацієнтів з ревматоїдним артритом (RA) (J. Clin. Invest., Sep 1992, 90(3):772-779), та вважають, що він залучається у патологічний стан RA (Inflamm. Allergy Drug Targets, Mar 2008, 7(1):53-66). VEGF - це сильний ангіогенний фактор, та відомо, що він виробляється, наприклад, макрофагами, фібробластами та синовіальними клітинами у синовіальній мембрані пацієнтів з RA (J. Rheumatol., Sep 1995, 22(9):1624-1630). Крім того, рівень VEGF у сироватці пацієнтів з RA корелює з активністю хвороби та радіографічною прогресією (Arthritis Rheum., Jun 2003, 48(6):1521-1529; і Arthritis Rheum., Sep 2001, 44(9):2055-2064), та рівень VEGF у сироватці знижується внаслідок лікування пацієнтів з RA антитілом TOCILIZUMAB проти IL-6R; отже, також вважають, що VEGF відіграє важливу роль у патологічному стані RA (Mod. Rheumatol. 2009, 19(1):12-19; і Mediators Inflamm. 2008, 2008:129873). Отже, досліджували, чи можуть TOCILIZUMAB та Fv4-M73 інгібувати виробництво MCP-1 та VEGF синовіальними клітинами, які походять від пацієнта-людини з RA, що зумовлюється стимуляцією sIL-6R та IL-6. Синовіальні клітини, які походять від пацієнта-людини з RA (TOYOBO), помістили у 4 планшети з 96 комірками у середовище IMDM, що містило 5 % FCS, по 2 × 10 клітин/0,05 мл/комірку, та помістили на 90 хвилин в інкубатор з СО 2 (37C, 5 % CO2). Додали 0,05 мл TOCILIZUMAB та Fv4-M73, розведених до відповідної концентрації, планшети залишили іще на 26 UA 101221 C2 5 10 15 20 25 30 35 40 45 50 55 60 15 хвилин, потім додали 0,05 мл розчинного рецептора IL-6 (SR344: отримано за способом, описаним у "Контрольних прикладах"). Планшети залишили іще на 30 хвилин та додали іще 0,05 мл IL-6 (TORAY) (кінцеві концентрації розчинного рецептора IL-6 та IL-6 становили 50 нг/мл для кожного). Після двох днів культивування зібрали культуральні надосадові рідини та вимірили концентрації МСР-1 та VEGF у культуральних надосадових рідинах, застосовуючи набір ELISA (Biosource and Pierce Biotechnology). Результати наведено на Фіг. 21 та 22. TOCILIZUMAB та Fv4-M73 інгібували виробництво МСР-1 та VEGF синовіальними клітинами пацієнта-людини з RA після стимуляції розчинного рецептора IL-6 та IL-6 залежним від концентрації чином. Отже, стабільність дії Fv4-M73 як нейтралізуючого антитіла проти рецептора IL-6 (ефект зв'язування з рецептором IL-6 та блокування сигналів рецептора IL-6 мембранного типу та розчинного рецептора IL-6) була суттєво кращою порівняно з TOCILIZUMAB, частоту введення та дозу введення можна суттєво знизити порівняно з TOCILIZUMAB, та, крім того, Fv4-M73 інгібує виробництво МСР-1 та VEGF синовіальними клітинами, які походять від пацієнта-людини з RA. Отже, було продемонстровано, що Fv4-M73 є дуже ефективним терапевтичним агентом проти ревматоїдного артриту (RA). Контрольні приклади Отримання розчинного рекомбінантного рецептора IL-6 людини Розчинний рекомбінантний рецептор IL-6 людини рецептора IL-6 людини, який є антигеном, отримали, як описано далі. Генерували клітинну лінію СНО, яка суттєво експресує розчинний рецептор IL-6 людини, який містить послідовність з амінокислотами від 1-ї до 344-ї, починаючи від N-кінця, про що повідомлялося у J. Biochem. (1990) 108, 673-676 (Yamasaki et al., Science (1988) 241, 825-828 (GenBank #X12830)). Розчинний рецептор IL-6 людини очистили з культуральної надосадової рідини клітин СНО, що експресують SR344, шляхом колоночної хроматографії: колоночна хроматографія Blue Sepharose 6 FF, афінна хроматографія із застосуванням колонки із іммобілізованим антитілом, специфічним до SR344, та колоночна хроматографія з гель-фільтрацією. Фракцію, яка елюювалася як головний максимум, застосовували як кінцевий очищений зразок. Отримання розчинного рекомбінантного рецептора IL-6 мавп cynomoglus (cIL-6R) Праймери оліго-ДНК отримали на основі описаної генної послідовності для рецептора IL-6 макаки резус (Birney et al., Ensembl 2006, Nucleic Acids Res. 2006 Jan 1;34 (Database issue):D556-61). Фрагмент ДНК, що кодує суцільний ген рецептора IL-6 мавп cynomoglus, отримали шляхом ПЛР, застосовуючи ці праймери та кДНК, отриману з підшлункової залози мавп cynomoglus, як матрицю. Отриманий фрагмент ДНК вставили у вектор експресії клітин ссавців та отримали лінію СНО зі стабільною експресією (клітинну лінію СНО, що виробляє cyno.sIL-6R), застосовуючи цей вектор. Культуральне середовище клітин СНО, що виробляють cyno.sIL-6R, очистили, застосовуючи колонку HisTrap (GE Healthcare Bioscience), а потім концентрували за допомогою Amicon Ultra-15 Ultracel-10k (Millipore). Кінцевий очищений зразок розчинного рецептора IL-6 мавп cynomoglus (далі у цьому описі позначається cIL-6R) отримали шляхом подальшого очищення на гель-фільтраційній колонці Superdex200pg16/60 (GE Healthcare Bioscience). Отримання рекомбінантного IL-6 мавп cynomoglus (cIL-6) IL-6 мавп cynomoglus отримали згідно з процедурою, описаною далі. Нуклеотидну послідовність, що кодує 212 амінокислот, депоновану під номером доступу SWISSPROT P79341, отримали та клонували у вектор експресії клітин ссавців. Отриманий вектор ввели у клітини СНО, щоб отримати клітинну лінію зі стабільною експресією (клітинну лінію СНО, що виробляє cyno.IL-6). Культуральне середовище клітин СНО, що виробляють cyno.IL-6, очистили, застосовуючи колонку SP-Sepharose/FF (GE Healthcare Bioscience), а потім концентрували за допомогою Amicon Ultra-15 Ultracel-5k (Millipore). Кінцевий очищений зразок IL-6 мавп cynomoglus (далі у цьому описі позначається cIL-6) отримали шляхом подальшого очищення на гель-фільтраційній колонці Superdex75pg26/60 (GE Healthcare Bioscience) з наступним концентруванням за допомогою Amicon Ultra-15 Ultracel-5k (Millipore). Отримання відомого високоафінного антитіла проти рецептора IL-6 Вектор експресії клітин ссавців побудували, щоб експресувати VQ8F11-21 hIgG1, відоме високоафінне антитіло проти рецептора IL-6. VQ8F11-21 hIgG1 описано у US 2007/0280945 A1 (US 2007/0280945 A1; амінокислотні послідовності Н-ланцюга та L-ланцюга, які наведені у SEQ ID NO: 77 та 78, відповідно). Варіабельну ділянку антитіла побудували шляхом ПЛР, застосовуючи комбінацію синтетичних оліго-ДНК (ПЛР-зборку), а IgG1 застосовували для константної ділянки. Варіабельну ділянку та константну ділянку антитіла об'єднали шляхом ПЛР-зборки, а потім вставили у вектор експресії клітин ссавців, щоб побудувати вектори 27 UA 101221 C2 5 10 15 20 25 30 35 40 45 50 55 60 експресії для Н-ланцюга та L-ланцюга, що представляють інтерес. Нуклеотидні послідовності отриманих векторів експресії визначили за способом, відомим фахівцям у галузі. Високоафінне антитіло проти рецептора IL-6 (далі у цьому описі позначається як "контрольне") експресували та очистили, застосовуючи побудовані вектори експресії за способом, описаним у Прикладі 1. Приготування, експресія та очищення варіантів TOCILIZUMAB Варіанти TOCILIZUMAB отримали, застосовуючи набір для сайт-спрямованого мутагенезу QuikChange Site-Directed Mutagenesis Kit (Stratagene), згідно зі способом, описаним в інструкції, що додається. Отримані плазмідні фрагменти вставили у вектори експресії клітин ссавців, щоб побудувати вектори експресії для Н-ланцюгів та L-ланцюгів, які представляють інтерес. Нуклеотидні послідовності отриманих векторів експресії визначили за способом, відомим фахівцям у галузі. Антитіла експресували за способом, описаним далі. Клітинну лінію НЕК293Н, що походить від раку ембріональної нирки людини (Invitrogen), суспендували у DMEM (Invitrogen), до якого було додано 10 % зародкової бичачої сироватки (Invitrogen). Клітини помістили у чашки для прилиплих клітин (10 см у діаметрі; CORNING) по 10 мл на чашку з 5 щільністю клітин від 5 до 6 × 10 клітин/мл та культивували в інкубаторі з СО 2 (37C, 5 % CO2) протягом цілого дня та ночі. Потім середовище видалили шляхом відсмоктування та додали 6,9 мл середовища CHO-S-SFM-II (Invitrogen). Отриману плазміду ввели в клітини шляхом способу ліпофекції. Отримані культуральні надосадові рідини зібрали, центрифугували (приблизно 2000 g, 5 хвилин, кімнатна температура), щоб видалити клітини, та стерилізували шляхом фільтрування крізь 0,22-мкм фільтр MILLEX(R)-GV (Millipore), внаслідок чого отримали надосадові рідини. Антитіла очистили з отриманих культуральних надосадових рідин за TM способом, відомим фахівцям у галузі, застосовуючи rProtein A Sepharose Fast Flow (Amersham Biosciences). Щоб визначити концентрацію очищеного антитіла, вимірювали поглинання при 280 нм, застосовуючи спектрофотометр. Концентрацію антитіла розрахували з визначених значень, застосовуючи коефіцієнт поглинання, розрахований за способом РАСЕ (Protein Science 1995; 4:2411-2423). Отримання клітинної лінії BaF3, що експресує gp130 людини Клітинну лінію BaF3, що експресує gp130 людини, отримали згідно з процедурою, описаною нижче, щоб отримати клітинну лінію, яка проліферується залежним від IL-6 чином. кДНК gp130 людини повної довжини (Hibi et al., Cell (1990) 63:1149-1157 (GenBank #NM_002184)) ампліфікували шляхом ПЛР та клонували у вектор експресії pCOS2Zeo, щоб побудувати конструкт pCOS2Zeo/gp130. pCOS2Zeo - це вектор експресії, побудований шляхом видалення ділянки експресії гена DHFR з pCHOI (Hirata et al., FEBS Letter (1994) 356:244-248) та вставлення ділянки експресії гена резистентності до Zeocin. кДНК IL-6R людини повної довжини ампліфікували шляхом ПЛР та клонували у pcDNA3.1(+) (Invitrogen), щоб побудувати hIL6R/pcDNA3.1(+). 7 10 мкг pCOS2Zeo/gp130 змішали з клітинами BaF3 (0,8 × 10 клітин), суспендованими у сольовому розчині з фосфатним буфером (PBS), а потім їх піддали імпульсній обробці при 0,33 кВ та 950 мкФ, застосовуючи Gene Pulser (Bio-Rad). Клітини BaF3, які мали цей ген, введений шляхом електропорації, культивували протягом цілого дня та ночі у середовищі RPMI 1640 (Invitrogen), до якого було додано 0,2 нг/мл мишачого інтерлейкіну-3 (Peprotech) та 10 % зародкової бичачої сироватки (далі у цьому описі позначається як FBS, HyClone), та селектували шляхом додавання середовища RPMI1640, до якого було додано 100 нг/мл інтерлейкіну-6 людини (R&D systems), 100 нг/мл розчинного рецептора інтерлейкіну-6 людини (R&D systems) та 10 % FBS, внаслідок чого отримали клітинну лінію BaF3, що експресує gp130 людини (далі у цьому описі позначається як "BaF3/gp130"). Ця BaF/gp130 проліферується у присутності інтерлейкіну-6 людини (R&D systems) та розчинного рецептора IL-6 людини, та, отже, її можна застосовувати для оцінки підвищення інгібіторної активності антитіла проти рецептора IL-6 щодо зростання (або активності нейтралізувати рецептор IL-6). Оцінка стосовно біологічної активності клітин BaF3, що експресують gp130 людини (BaF/gp130) Нейтралізуючу активність рецептора IL-6 оцінювали, застосовуючи BaF3/gp130, яка проліферується залежним від IL-6/рецептора IL-6 чином. Після трьох промивань середовищем 4 RPMI 1640, до якого було додано 10 % FBS, клітини BaF3/gp130 суспендували при 5 × 10 клітин/мл у RPMI1640, до якого було додано 600 нг/мл або 60 нг/мл інтерлейкіну-6 людини (TORAY) (кінцева концентрація 300 нг/мл або 30 нг/мл), відповідну кількість розчинного рецептора IL-6 людини та 10 % FBS. Клітинні суспензії розподілили (50 мкл/комірку) у планшети з 96 комірками (CORNING). Після цього очищені антитіла розвели RPMI 1640, що містило 10 % FBS, та додали до кожної комірки (50 мкл/комірку). Клітини культивували при 37 °C в умовах 5 % СО2 протягом 3 днів. Реагент WST-8 Reagent (Cell Counting Kit-8; Dojindo Laboratories) 28
ДивитисяДодаткова інформація
Назва патенту англійськоюMolecules of improved antibody
Автори англійськоюIgawa, Tomoyuki, Ishii, Shinya, Maeda, Atsuhiko, Sakurai, Mika, Kojima, Tetsuo, Tachibana, Tatsuhiko, Shiraiwa, Hirotake, Tsunoda Hiroyuki, Higuchi, Yoshinobu
Назва патенту російськоюМолекулы улучшенного антитела
Автори російськоюИгава Томоюки, Исии Синия, Маеда Ацухико, Сакурай Мика, Кодзима Тецуо, Татибана Тацухико, Сираива Хиротаке, Цунода Хироюки, Хигути Йосинобу
МПК / Мітки
МПК: A61P 21/00, A61P 1/04, A61K 39/395, A61P 7/06, C12N 15/09, C07K 16/28, A61P 35/00, A61P 29/00, A61P 37/02, C12N 5/10, A61P 17/06, A61P 25/00, A61P 15/08, A61P 9/00, A61P 19/10, A61P 13/12, A61P 27/02, A61P 11/00, A61P 37/08, A61P 19/02, C12N 1/19, A61P 9/10, A61P 11/06, A61P 17/00, C12P 21/08, C12N 1/15, A61P 3/10, A61P 1/16, C12N 1/21
Мітки: молекули, антитіла, поліпшеного
Код посилання
<a href="https://ua.patents.su/120-101221-molekuli-polipshenogo-antitila.html" target="_blank" rel="follow" title="База патентів України">Молекули поліпшеного антитіла</a>
Попередній патент: Ведена зірочка нижньої опори демонстраційної установки
Наступний патент: Лінія для виробництва ігристого вина
Випадковий патент: Водний тренажер румілова "акватрек"