Спосіб прогнозування перебігу онкологічного захворювання прямої кишки після радикальної операції
Номер патенту: 103012
Опубліковано: 25.11.2015
Автори: Бих Анатолій Іванович, Висоцька Олена Володимирівна, Сідак Володимир Володимирович, Щукін Микола Олександрович
Формула / Реферат
1. Спосіб прогнозування перебігу онкологічного захворювання прямої кишки після радикальної операції, що включає визначення стадії пухлинного процесу, який відрізняється тим, що стадію пухлинного процесу визначають за допомогою аналізу показника відсотка електронегативних ядер клітин букального епітелію, для визначення цього показника у пацієнта неінвазивно беруть пробу клітин букального епітелію шпателем із внутрішньої поверхні щоки, отримані проби поміщають в краплю розчину натрій-фосфатного буфера з ![]() =7,4 і розташовують між двома покривними скельцями у спеціальній камері приладу для внутрішньоклітинного електрофорезу і прокладаються фільтрувальним папером, просоченого фосфатним буфером, камеру встановлюють під об'єктив мікроскопа, за допомогою якого при одночасному проведенні електрофорезу фіксують окремо клітини з рухомими і нерухомими ядрами, потім за значеннями цього показника для кожного пацієнта будують графіки залежності показника відсотка електронегативних ядер клітин букального епітелію від часу, за допомогою математичного апарату та інформаційних технологій з використанням обчислювальної техніки на основі отриманих кривих показника відсотка електронегативних ядер клітин букального епітелію проводять прогнозування перебігу онкологічного захворювання прямої кишки після радикальної операції, яке складається з попереднього аналізу та обробки даних, вибору моделі прогнозування, оцінки її адекватності, прогнозування стану онкологічних хворих за показниками відсотка електронегативних ядер на основі вибраної моделі та визначення її точності.
=7,4 і розташовують між двома покривними скельцями у спеціальній камері приладу для внутрішньоклітинного електрофорезу і прокладаються фільтрувальним папером, просоченого фосфатним буфером, камеру встановлюють під об'єктив мікроскопа, за допомогою якого при одночасному проведенні електрофорезу фіксують окремо клітини з рухомими і нерухомими ядрами, потім за значеннями цього показника для кожного пацієнта будують графіки залежності показника відсотка електронегативних ядер клітин букального епітелію від часу, за допомогою математичного апарату та інформаційних технологій з використанням обчислювальної техніки на основі отриманих кривих показника відсотка електронегативних ядер клітин букального епітелію проводять прогнозування перебігу онкологічного захворювання прямої кишки після радикальної операції, яке складається з попереднього аналізу та обробки даних, вибору моделі прогнозування, оцінки її адекватності, прогнозування стану онкологічних хворих за показниками відсотка електронегативних ядер на основі вибраної моделі та визначення її точності.
2. Спосіб за п. 2, який відрізняється тим, що скельця мають розмір 24×24 мм.
Текст
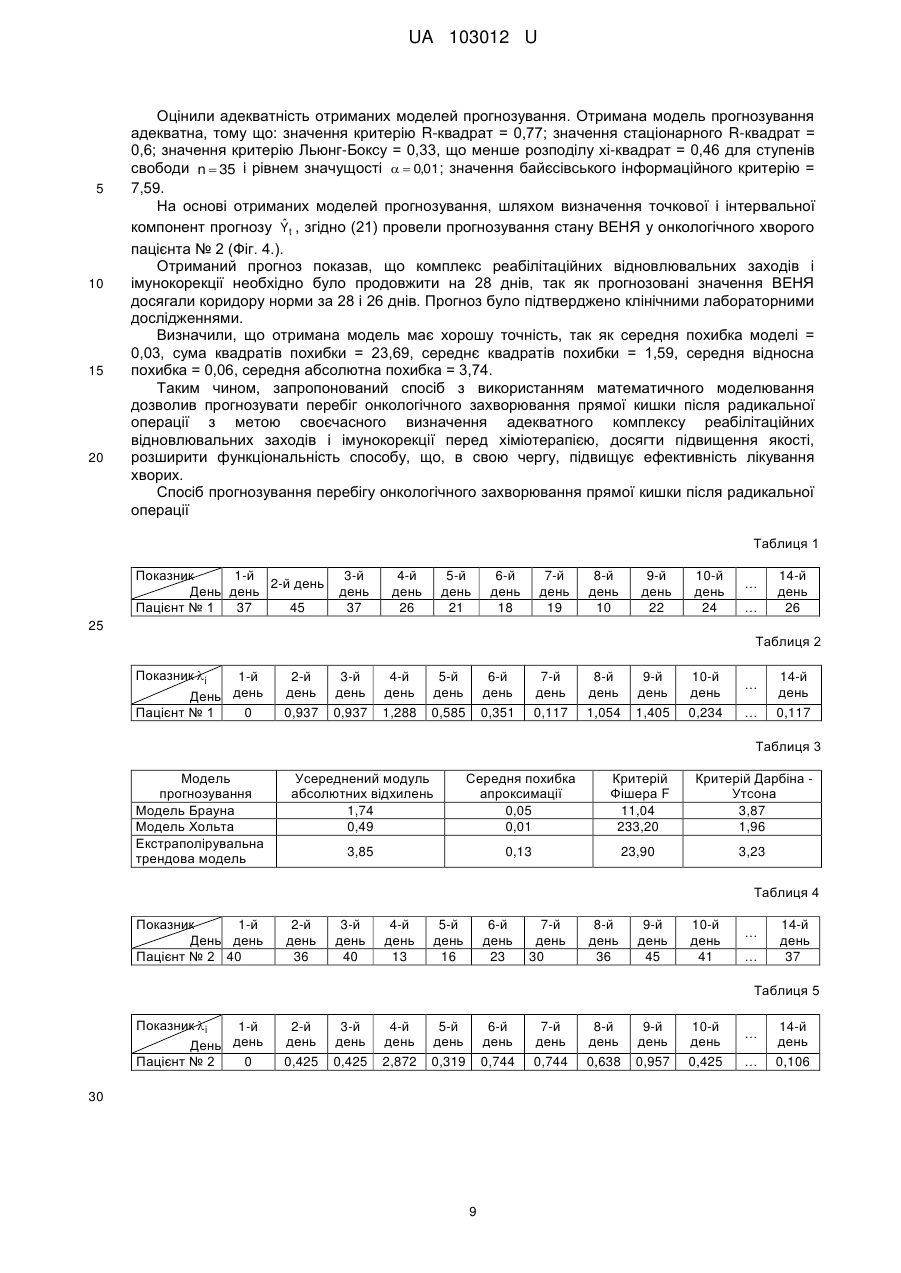
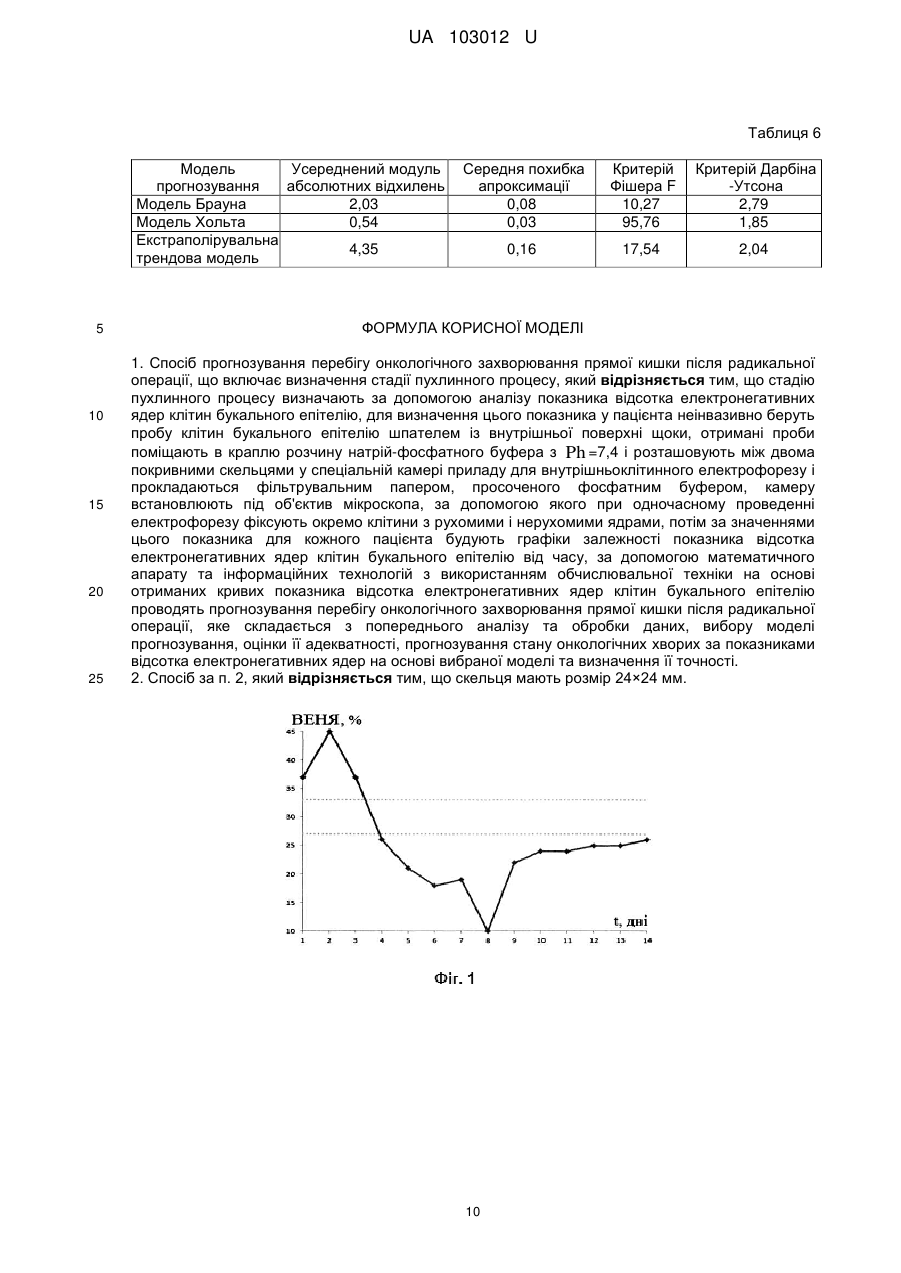
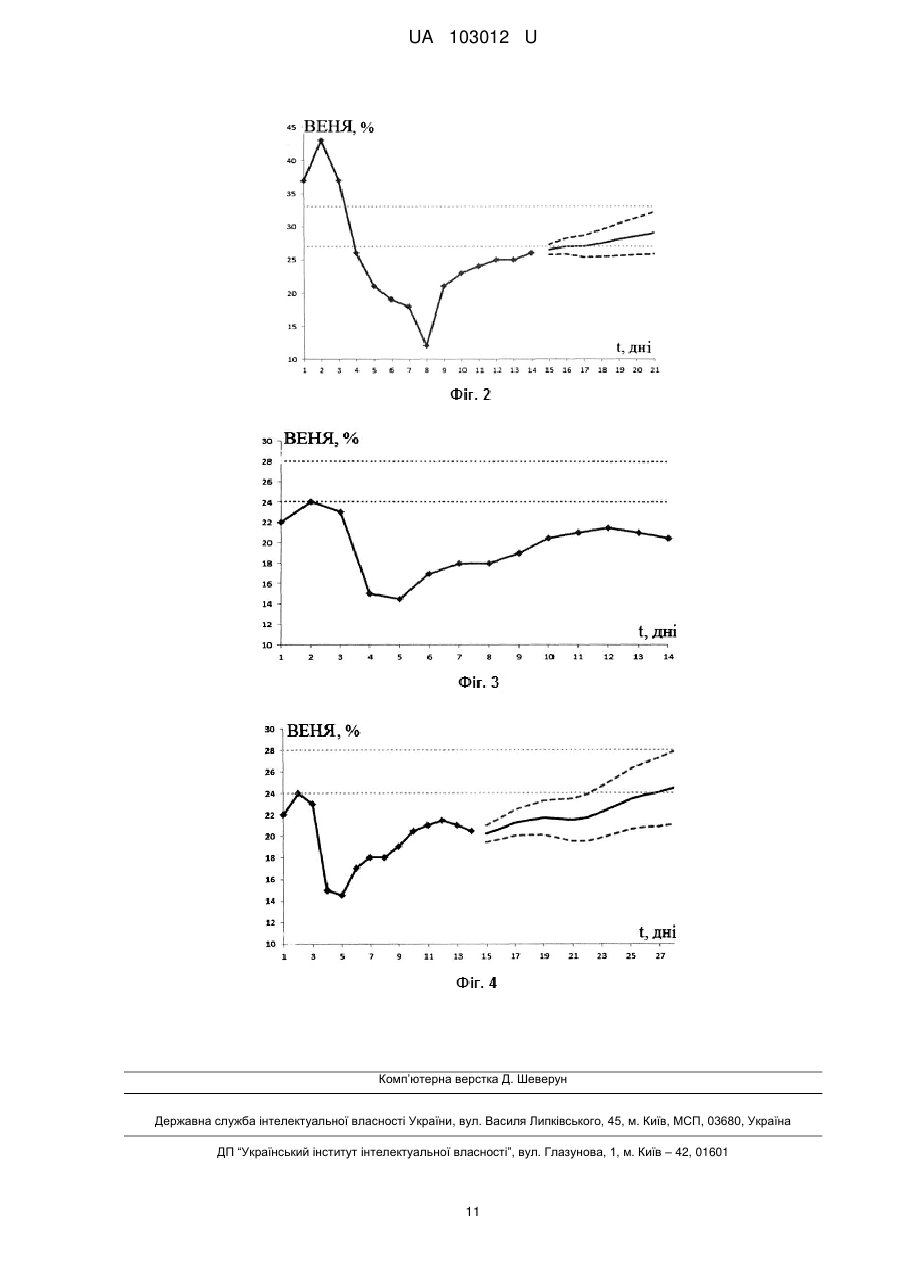
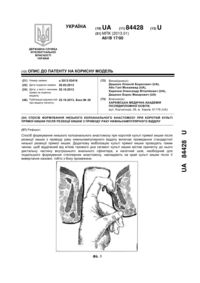
Реферат: Спосіб прогнозування перебігу онкологічного захворювання прямої кишки після радикальної операції включає визначення стадії пухлинного процесу. Стадію пухлинного процесу визначають за допомогою аналізу показника відсотка електронегативних ядер клітин букального епітелію. Для визначення цього показника у пацієнта неінвазивно беруть пробу клітин букального епітелію шпателем із внутрішньої поверхні щоки, отримані проби поміщають в краплю розчину натрій-фосфатного буфера з Ph =7,4 і розташовують між двома покривними скельцями у спеціальній камері приладу для внутрішньоклітинного електрофорезу і прокладаються фільтрувальним папером, просоченого фосфатним буфером. Камеру встановлюють під об'єктив мікроскопа, за допомогою якого при одночасному проведенні електрофорезу фіксують окремо клітини з рухомими і нерухомими ядрами. Потім за значеннями цього показника для кожного пацієнта будують графіки залежності показника відсотка електронегативних ядер клітин букального епітелію від часу. UA 103012 U (12) UA 103012 U UA 103012 U 5 10 15 20 25 30 35 40 45 50 55 60 Корисна модель належить до медицини, а саме до діагностики і прогнозування з врахуванням визначених властивостей біологічних матеріалів визначення інтегрального маркеру сукупності патологічних процесів в організмі в реальному часі - показнику відсотка електронегативних ядер (ВЕНЯ) клітин букального епітелію, що дозволяє прогнозувати перебіг онкологічного захворювання прямої кишки після радикальної операції. Україна на другому місці в Європі за темпами поширення раку. Щорічно в Україні більше 160 тис. чоловік дізнаються, що вони онкохворі. Кожен рік від раку помирають близько 90 тис. осіб, з них 35 % люди працездатного віку. Щодня в Україні захворюють раком 450 людей, з них гинуть 250. Щогодини реєструється понад 20 нових випадків захворювання, а 10 жителів України помирають від раку. Ризик розвитку онкологічних захворювань становить 27,7 % для чоловіків і 18,5 % для жінок. Злоякісні новоутворення вражають в Україні кожного четвертого чоловіка і кожну шосту жінку. За розрахунками фахівців, до 2020 року кількість вперше захворілих на рак в Україні перевищить 200 тис. Рак прямої кишки - одна з найбільш частих злоякісних пухлин, яка займає четверте місце в світі в структурі онкологічної захворюваності. Сьогодні у світі щорічно реєструється 510000 нових випадків раку товстої кишки, з яких рак прямої кишки становить не менше 30-40 %. За сучасними уявленнями, найбільш перспективними для більшості локалізацій злоякісних пухлин є комбіновані і комплексні способи лікування. Найбільш поширений комбінований метод лікування онкологічного захворювання прямої кишки - призначення хіміотерапії після радикальної операції для попередження розвитку метастазів (ад'ювантна хіміотерапія) або при наявності метастазів. Актуальним питанням є прогноз перебігу онкологічного захворювання прямої кишки після радикальної операції з метою своєчасного визначення адекватного комплексу реабілітаційних відновлювальних заходів і імунокорекції перед хіміотерапією. Є відомим спосіб прогнозування важкості перебігу меланоми шкіри (патент РФ RU2380037 С1, МПК G01N1/28, А61В5/145, опубліковано 27.01.2010), що включає використання загальноприйнятих показників дослідження пацієнтів, а саме стать, вік, стадію захворювання, групу крові, резус-фактор, наявність виразок, мітозів, лімфоїдної інфільтрації, гістологічний тип пухлини, товщина пухлини, рівень інвазії, за якими за допомогою математичної формули розраховують коефіцієнт прогнозу. Якщо розраховане значення не перевищує 2,2 - прогноз перебігу меланоми сприятливий, якщо коефіцієнт дорівнює або більше 2,2 - прогноз несприятливий. Також відомий спосіб прогнозування тривалості життя хворих при гранулезоклітинних пухлинах яєчників дорослого типу (патент РФ RU 2282402 С1, МПК А61В10/00, опубліковано 27.08.2006), який полягає у тому, що проводять імуногістохімчне та морфологічне дослідження пухлини, і при показниках рівня експресії антигену Кі-67 менше 10 %, мутованого генасупресора Р53 менше 10 % і мітотичної активності пухлини менше 10 мітозов на 10 полів зору припускають сприятливий прогноз захворювання, а при показниках Кі-67 більше 10 %, Р53 більше 10 % і мітотичної активності в пухлини більше 10 мітозів на 10 полів зору припускають несприятливий прогноз захворювання. Також відомий спосіб прогнозування тривалості безрецидивного періоду у хворих на рак прямої кишки (патент РФ, RU 2415429 С1, МПК G01N33/50, опубліковано 22.07.2009), що полягає у проведенні біохімічного дослідження з метою визначення змісту поліпептидного гормону пролактину після хірургічного видалення рецидиву в його навколопухлинній зоні і при його рівні 360,0-372,0 нг/г тканини констатують тривалість безрецидивного періоду протягом 7,511 місяців, а при рівні пролактину 512,0-540,0 нг/г тканини констатують тривалість безрецидивного періоду протягом 36-38 місяців. Також відомий спосіб прогнозування розвитку метастазів у хворих на рак прямої кишки (патент РФ, RU 2420742 С1, МПК G01N33/74, опубліковано 29.03.2007), що полягає у біохімічному дослідженні виділених зразків пухлинної тканини і тканини перифокальної зони видаленого під час операції препарату і в них радіоімунним методом визначають вміст гормонів пролактину і тестостерону, при рівні пролактину в пухлини, рівному 692,0 нг/г тканини, і рівні тестостерону в пухлини, рівному 48,0 нг/г тканини, а в перифокальній зоні при рівні тестостерону, рівному 42,0 нг/г тканини, прогнозують розвиток через 3 міс. метастазів в печінці, при рівнях пролактину в пухлини в межах 160-390 нг/г тканини і рівні тестостерону в пухлини в межах 20-40 нг/г тканини, а в перифокальній зоні при рівні тестостерону в межах 24-26 нг/г тканини прогнозують розвиток метастазів через 29-43 міс. Найбільш близьким до запропонованої корисної моделі є спосіб визначення післяопераційної виживаності хворих раком шлунка в залежності від критеріїв T , N , M (патент РФ, RU 2336805 С1, МПК А61В (2006.01) G01N 1/28 (2006.01), опубліковано 27.10.2008), що 1 UA 103012 U полягає у морфологічному дослідженні видаленого препарату, визначенні стадії пухлинного процесу ( pT , pN , pM ) та розрахунку післяопераційної виживаності з використанням формули St e ht , де ht h t e(b T T bNN bMM) ; h =-0,000044 t 2 +0,0110948 t , де t - час життя у 0 5 10 15 20 25 30 35 40 45 50 55 0( t ) місяцях від моменту операції; b T =0,236122; b N =0,248505; bM =0,392984. Спосіб дозволяє визначити довжину післяопераційної виживаності хворих раком шлунка. Недоліками вище перелічених способів є інвазивність та недостатня точність прогнозування внаслідок використання недосконалого математичного апарату. Задачею корисної моделі є підвищення точності прогнозу, за рахунок використання більш вдосконаленого математичного апарату, що застосовується для своєчасного визначення адекватного комплексу реабілітаційних відновлювальних заходів та імунокорекції перед хіміотерапією, а також використання неінвазивних методів діагностики. Поставлена задача вирішується у способі прогнозування перебігу онкологічного захворювання прямої кишки після радикальної операції, що включає визначення стадії пухлинного процесу, згідно з корисною моделлю, стадію пухлинного процесу визначають за допомогою аналізу показника відсотка електронегативних ядер клітин букального епітелію, для визначення цього показника у пацієнта неінвазивно беруть пробу клітин букального епітелію шпателем із внутрішньої поверхні щоки, отримані проби поміщають в краплю розчину натрійфосфатного буферу з Ph=7,4 і розташовують між двома покривними скельцями у спеціальній камері приладу для внутрішньоклітинного електрофорезу і прокладаються фільтрувальним папером, просоченого фосфатним буфером, камеру встановлюють під об'єктив мікроскопа, за допомогою якого при одночасному проведенні електрофорезу фіксують окремо клітини з рухомими і нерухомими ядрами, потім за значеннями цього показника для кожного пацієнта будують графіки залежності показника відсотка електронегативних ядер клітин букального епітелію від часу, за допомогою математичного апарату та інформаційних технологій з використанням обчислювальної техніки на основі отриманих кривих показника відсотка електронегативних ядер клітин букального епітелію проводять прогнозування перебігу онкологічного захворювання прямої кишки після радикальної операції, яке складається з попереднього аналізу та обробки даних, вибору моделі прогнозування, оцінки її адекватності, прогнозування стану онкологічних хворих за показниками відсотка електронегативних ядер на основі обраної моделі та визначення її точності. Скельця мають розмір 24 × 24 мм. Таблиця 1 - Масив значень ВЕНЯ для пацієнта № 1. Таблиця 2 - Масив значень i для пацієнта № 1. Таблиця 3 - Вибір моделі прогнозування для пацієнта № 1. Таблиця 4 - Масив значень ВЕНЯ для пацієнта № 2. Таблиця 5 - Масив значень i для пацієнта № 2. Таблиця 6 - Вибір моделі прогнозування для пацієнта № 2. На фіг. 1 зображена крива ВЕНЯ для пацієнта № 1, яка позначена безперервною лінією та коридор норми, який позначений пунктирною лінією. На фіг. 2 зображена отримана згладжена крива ВЕНЯ та прогноз для пацієнта № 1, які позначені безперервними лініями, також зображені коридор норми та межі допустимого інтервалу Y , які позначені пунктирними лініями. На фіг. 3 зображена крива ВЕНЯ для пацієнта № 2, яка позначена безперервною лінією та коридор норми, який позначений пунктирною лінією. На фіг. 4 зображена отримана згладжена крива ВЕНЯ та прогноз для пацієнта № 2, які позначені безперервними лініями, також зображені коридор норми та межі допустимого інтервалу Y , які позначені пунктирними лініями. При більш докладному розгляді запропонованого способу можна констатувати, що на сьогоднішній день існує інтегральний маркер сукупності патологічних процесів в організмі в реальному часі - ВЕНЯ клітин букального епітелію. На підставі показника ВЕНЯ можна не тільки контролювати, але й регулювати гомеостатичну активність організму і його систем в процесі лікування онкологічних захворювань. Проте способи, що використовують даний показник, слабо формалізовані і не вивчені до кінця. Прогнозування перебігу онкологічних захворювань без залучення сучасних інформаційних технологій є трудомістким завданням. Застосування математичного апарату та інформаційних технологій з використанням обчислювальної техніки дозволить додатково вивчити і формалізувати методи прогнозування, засновані на показнику ВЕНЯ, а також підвищити якість діагностики та прогнозування перебігу онкологічних захворювань. Спосіб реалізується в наступній послідовності. 2 UA 103012 U 5 10 15 У пацієнта неінвазивно беруть пробу клітин букального епітелію шпателем із внутрішньої поверхні щоки, отримані проби поміщають в краплю розчину натрій-фосфатного буфера з Ph =7,4 і розташовують між двома покривними скельцями (розміром 24 × 24 мм). Ці скельця переносяться у спеціальну камеру приладу для внутрішньоклітинного електрофорезу і прокладаються фільтрувальним папером, просоченою буфером. Камера встановлювалася під об'єктив мікроскопа, за допомогою якого лаборант-цитолог фіксує окремо клітини з рухомими і нерухомими ядрами в нативних клітинах при увімкненому приладі електрофорезу. В результаті визначався показник ВЕНЯ. Потім за значеннями ВЕНЯ для кожного пацієнта будуються графіки залежності ВЕНЯ від часу (криві ВЕНЯ) - Yt . На основі отриманих кривих ВЕНЯ проводять прогнозування перебігу онкологічного захворювання прямої кишки після радикальної операції, яке складається з наступних етапів. Визначення аномальних значень (викидів) ВЕНЯ відповідно до критеріїв Ірвіна й Райта та фільтрації дрібних випадкових коливань методом експоненціального згладжування. Згідно з критерієм Ірвіна, аномальною вважається точка Yt , що відстоїть від попередньої Yt 1 на величину, більшу за середньоквадратичне відхилення: Y Y n 2 t t 1 , (1) n 1 де n - кількість досліджень, t - день спостереження, Y - середнє арифметичне значення Yt . Критеріальне значення Ірвіна визначиться як: i 20 Yt Yt 1 . (2) Точка вважається аномальною Yi Yk , якщо i крит , де крит - табличне значення. Далі згідно з критерієм Райта, якщо Yk розподілена нормально, то абсолютна величина її відхилення від математичного очікування не повинна перевищувати потроєного середньоквадратичного відхилення. Результат, який задовольняє умові (3), вважається таким, що має грубу похибку і повинен видалитися або замінитися на середнє значення сусідніх рядів. 25 Yk Yнорм 3 , (3) де Yнорм - середнє значення вибірки без аномальних значень. Фільтрація дрібних випадкових коливань, методом експоненціального згладжування визначається як функція від поточної не згладженої точки і попередньої згладженої: ~ ~ Y Yt 1 Y t 1; 0 1 , (4) 30 35 де - параметр згладжування; (1 ) - коефіцієнт дисконтування. Чим більше , тим більше значення фільтрованого часового ряду наближаються до значень вихідного. Параметр вибирається виходячи з кількості аномальних точок (викидів) Yk (2), і дорівнює максимальному його значенню при мінімальній кількості викидів Yk . Далі визначається присутність тренда методом Фостера-Стьюарта, що складається з наступних кроків: 1) порівняння кожного рівня ряду з попереднім та визначення двох послідовностей: 1, якщо Yt, більше всіх попередніх рівнів ; kt (5) 0 в іншому разі; 1, якщо Yt , менше всіх попередніх рівнів ; lt (6) 0 в іншому разі; 40 t =2, 3, 4,…, n ; 2) обчислення величин s та d , що характеризують зміни часового ряду й дисперсії: n n t 2 s t 2 k t lt ; d . k t lt , (7) s - виявляє тенденцію дисперсій (приймає значення від 0 до n - 1), d - виявляє тенденцію середніх (приймає значення від n+1 до n-1); 3 UA 103012 U 3) перевірка гіпотези про випадковість відхилення величини s від її математичного очікування , і випадковості відхилення величини d від нуля за допомогою критерію Стьюдента: s ts 5 1 td d 0 2 ; 1 . 2 ln n 3,4253; (8) ; 2 . 2 ln n 0,8456; (9) де - математичне очікування величини s ; 1 - середньоквадратичне відхилення s ; 2 середньоквадратичне відхилення d . Якщо t d t крит , ( t крит - табличне значення) то тенденція лінійного тренда переважає, якщо t s , то переважає тенденція тренда дисперсії, і в зворотному випадку, якщо t d t крит або , ts , то тенденція лінійного тренда або тренда 10 15 дисперсії відповідно не істотні; На наступному етапі дані перевіряються на стаціонарність тестами, які дозволяють врахувати наявність або відсутність тренда [7]: 1) тест Дікі-Фуллера (DF-тест), де нульовою (альтернативною) H0 гіпотезою є той факт, що досліджуваний часовий ряд Yt не стаціонарний або стаціонарний та описується моделями авторегресії першого порядку з поправкою на лінійний тренд: якщо тимчасовий ряд Yt має лінійний тренд, то оцінюється модель Yt Yt 1 et ; якщо часовий ряд Yt не має лінійного тренда, то береться модель Yt Yt 1 et в даних моделях e t - незалежні випадкові величини, що мають однаковий нормальний розподіл з нульовим математичним очікуванням; , u - параметри, які оцінюються методом найменших квадратів. Після чого 20 обчислюється значення t - для перевірки нульової гіпотези 0 : t Yt (n L ), де n Yt Yt число спостережень, L - оператор лагів (затримки). Отримане значення порівнюється з критичним рівнем t крит . Гіпотеза про нестаціонарності часового ряду відкидається, якщо t t крит ; 25 30 2) тест Філліпса-Перрона (РР-тест), де перевірка нульової гіпотези про нестаціонарність, так само як і в DF тесті зводиться до перевірки гіпотези 0 на основі статистичної моделі: Yt Yt 1 ut , де t =2,… T . Але на відміну від тесту Дікі-Фуллера, випадкові складові тут можуть бути автокорельованими, мати різні дисперсії і не обов'язково нормальні розподіли. Тим самим, на відміну від критерію Дікі-Фулера, до розгляду допускається більш широкий клас часових рядів. PP - тест ґрунтується на т -статистиці, скоригованій на можливу автокорельованість і гетероскедастичність (неоднорідність спостережень, що виражається в неоднаковою, непостійною дисперсією) ut . При обчисленні статистики гетероскедастичності ut . При обчисленні статистики гетероскедастичності y t , необхідно оцінювати "довготривалу" дисперсію, яка визначається: 2 lim T 1E(ut ... uT )2 , (10) T 35 40 45 де E - математичне сподівання випадкової величини ut . Як оцінку для 2 (10) найбільш часто використовують оцінку Newey-West [7]; Далі виявляються сезонність (циклічні процеси) в часовому ряді за допомогою спектральної функції часового ряду, яка являє собою розкладання в ряд Фур'є автокореляційної функції. Якщо спектральна щільність на період, що дорівнює сезонній складовій, має високе (порівняно з сусідніми) значення, то це підтверджує припущення про наявність сезонної компоненти, яка повинна бути врахована при побудові моделі. На наступному етапі проводиться вибір моделі прогнозування стану онкологічних хворих за показниками ВЕНЯ із сукупності експоненційних методів і моделей (екстраполюються трендова модель, модель Брауна, модель Хольта), які найбільш частіше використовуються для довгострокового прогнозування. Дані моделі порівнюються між собою за такими критеріями: усереднений модуль абсолютних відхилень, середня похибка апроксимації, F критерій Фішера і критерій Дарбіна -Утсона. 4 UA 103012 U Усереднений модуль абсолютних відхилень: n ˆ Y Y t t t 1 , (11) n ˆ де Yt , - значення, отримані за допомогою прогностичної моделі. Середня похибка апроксимації: 5 A 1 n ˆ Yt Yt . (12) Yt n t 1 Критерій Дарбіна-Утсона: n (e e t d t 1 ) 2 t 2 , (13) n e2 t t 2 10 ˆ де e t Yt Yt . Потім за допомогою критеріїв R - квадрат, стаціонарний R - квадрат, Льюнг-Бокса і байєсівського інформаційного критерію оцінюється адекватність моделі прогнозування. Критерій R - квадрат є індикатором ступеня "підгонки" моделі до даних: R2 1 ˆ V( Y Y ) V( Y ) 1 2 2 Y ˆ ˆ де Y - аналізований часовий ряд, Y - прогнозований, V( Y Y) 2 - умовна дисперсія залежної 15 20 змінної або дисперсія випадкової помилки моделі, V( Y) 2 Y - дисперсія розглянутого часового ряду. Критерій R - квадрат для моделі приймає значення від 0 до 1. Чим ближче значення коефіцієнта до 1, тим сильніше залежність. Для прийнятних моделей передбачається, що коефіцієнт повинен бути хоча б не менше 50 %. Моделі з коефіцієнтом вище 80 % можна визнати достатньо хорошими, а його значення рівне 1 означає функціональну залежність між змінними. 2 Стаціонарний R-квадрат (R стац )() використовується для порівняння моделей часових рядів з різними факторами (параметрами моделі) так, щоб кількість цих факторів не впливала на статистику R-квадрат: (n 1) R 2 , (15) (n k ) 2 R стац 1 (1 R 2 ) 25 30 де n - кількість спостережень, k - кількість параметрів моделі. Стаціонарний R-квадрат передбачає штраф за додатково включені фактори (параметри моделі) і в нормі не має 2 перевищувати значення R . Критерій Льюнг-Боксу (Q-тест) призначений для знаходження автокореляції часових рядів і складається з наступних кроків: висуваються дві конкуруючі гіпотези: H0 : дані є випадковими (тобто являють собою білий шум); Ha : дані не є випадковими; проводиться статистичне випробування: m 2 rk n k , (16) ~ Q n(n 2) k 1 n ( Y Y)( Y t k t rk t k 1 , (17) n (Y Y) t Y) 2 t 1 35 де rk - автокореляція k -го порядку, n - кількість спостережень, Yt k - спостереження з ~ запізненням (лагом) у k періодів, m - кількість лагів, які перевіряються. Якщо Q 1 ,m 2 де 5 UA 103012 U 1 ,m2 5 - квантилі розподілу хі-квадрат с m ступенями свободи, то нульова гіпотеза відкидається і визнається наявність автокореляції до m -го порядку в часовому ряді. Байєсовський інформаційний критерій (Bayesian information criterion, BIC ) - критерій вибору моделі з класу параметризованих моделей, що залежать від різної кількості параметрів: ˆ BIC(k; n) 2 logLk (; Yt ) Mk logn; (18) ˆ оцінка максимальної правдоподібності параметра ; (p1,...,pk , Y1,..., Yk ), p t 0, p1 ... pk 1 - ваги компонент щільності розподілу t , часових рядів. де Mk - кількість незалежних параметрів моделі прогнозування, n - кількість спостережень, k ˆ кількість кроків, на які робиться прогноз, функція L (; Y ) - функція правдоподібності, яка k 10 t визначена співвідношенням: k pt t ( Yt ) . (19) t 1 i 1 Чим більше значення BIC(k;n) , тим більше правдоподібність моделі з відповідним k . Загальноприйнята шкала значень критерію BIC(k;n) : якщо BIC(k;n) 2 , то узгодженість моделі і даних погана; якщо 2 BIC(k;n) 6 , то узгодженість моделі і даних задовільна; якщо 6 BIC(k;n) 10 , то узгодженість моделі і даних добра; якщо BIC(k;n) 10 , то узгодженість моделі і даних відмінна. n Lk (; Yt ) 15 20 Далі відбувається прогнозування стану онкологічних хворих за показниками ВЕНЯ на основі ˆ моделі прогнозування шляхом визначення точкового Yt та інтервального Yt (інтервал, в якому зі ступенем ймовірності 0,95 очікується фактичне значення прогнозованого показника) компонент прогнозу: ˆ Y t Yt Yt , (20) де Y ( t ) - фактичне значення в майбутньому; Yt - інтервальна компонента прогнозу (довірчий інтервал). 25 Yt t S 1 1 3(n 2L 1) , (21) n n(n2 1) n ˆ (Y Y ) t S 30 40 45 t 1 nk 2 , (22) де k - кількість параметрів моделі прогнозування, L - період попередження, тобто число кроків, на які робиться прогноз; t - критерій Стьюдента для числа ступенів свободи n 2 . На останньому етапі визначаються параметри оцінки точності моделі: середня відносна похибка апроксимації середня похибка, середня абсолютна похибка, сума квадратів помилки, середня відносна похибка, середня відносна похибка. 35 t 1 n n i 1 t ˆ Yt 100% , (23) Якщо відносна похибка апроксимації менше 7 % -10 %, то підбір моделі до вихідних даних задовільний і точність моделі - хороша. При помилці більше 15 % слід вибрати інший тип моделі. Корисність запропонованого способу була перевірена на практиці при прогнозуванні перебігу онкологічного захворювання прямої кишки у пацієнтів Харківської міської клінічної лікарні № 2. Аналіз результатів прогнозування для досліджуваної групи зроблений вірно (коректно прогнозовано перебіг онкологічного захворювання прямої кишки після радикальної операції в цілому 89 % усіх хворих). Для прогнозування перебігу онкологічного захворювання прямої кишки після радикальної операції були проаналізовані дані 35 пацієнтів у віці 38-76 років з встановленими діагнозами раку прямої кишки другий і третин стадій. У пацієнтів щодня о 9-00 неінвазивно бралися гістологічні проби клітин букального епітелію шпателем із внутрішньої поверхні щоки. Проби бралися протягом 2-х днів до операції, в день операції і 11 днів після операції. В сумі проби ВЕНЯ бралися протягом 14 днів, що є середнім терміном перебування пацієнтів в Харківській 6 UA 103012 U 5 10 15 міській клінічній лікарні № 2 з цим діагнозом. По закінченні 21 дня після радикальної операції пацієнтам за курсом лікування необхідно було пройти хіміотерапію. Оскільки пацієнти знаходилися під спостереженням в стаціонарі 14 днів, а хіміотерапію необхідно зробити після 21-го дня, то необхідно було провести прогнозування стану організму пацієнта в період, коли спостереження за станом пацієнта були утруднені, тобто на 7 днів. Наведемо клінічні приклади. Приклад 1. Пацієнт № 1 у віці 59 років проходив лікування у Харківській міській клінічній лікарні № 2 з діагнозом раку прямої кишки другого ступеня. Протягом 14 днів о 9-00 у пацієнта неінвазивно брали проби клітин букального епітелію, які поміщали у розчин натрій-фосфатного буфера з Ph=7,4, та розташовували у камеру приладу для внутрішньоклітинного електрофорезу. Лаборантом-цитологом фіксувались клітини з рухомими і нерухомими ядрами (показник ВЕНЯ) в нативних клітинах при увімкненому приладі електрофорезу. Потім за значеннями ВЕНЯ для пацієнта № 1 (табл. 1) будувався графік залежності ВЕНЯ від часу (крива ВЕНЯ). Крива ВЕНЯ пацієнта № 1 зображена на фіг. 1. Провели попередню обробку даних: визначили аномальні показники ВЕНЯ з крит = 1,7, n = 14 та рівнем значущості = 0,01. Результати отриманих i для пацієнта № 1 наведені в табл. 2. За отриманими значеннями i на кривій ВЕНЯ пацієнта № 1 точка Y9 (9 1405) вважалися , аномально, так як її значення 9 більше крит (крит 1,4) . Але на основі критерію Райта 20 25 аномальну точку 9 кривої ВЕНЯ залишили без змін, так як згідно з умовою (2) 7,4482>8,8148. За допомогою (3) провели фільтрацію кривої ВЕНЯ від дрібних випадкових коливань. В результаті чого отримали загладжену криву зі значенням коефіцієнта згладжування = 0,27. Визначили присутність тренду кривої ВЕНЯ пацієнта № 1. За методом Фостера-Стьюарта для відфільтрованої кривої ВЕНЯ відповідно до формул (4) і (5) отримали значення коефіцієнтів t s 2,972 і t d 4,598 . Було виявлено, що відфільтрована крива ВЕНЯ має тенденцію лінійного тренду, тому що значення t s ( 5,493) , a tdtкрит ( t крит з рівнем значущост 0,01 2.976 ) . 30 35 40 45 Для кривої ВЕНЯ пацієнта № 1 тести на стаціонарність розраховувалися з урахуванням лінійного тренда і показали, що крива ВЕНЯ є нестаціонарною, так як отримані значення статистик тестів з рівнем значущості 0,01 не перевищували критичні значення: DF 3.80 при DFкрит 4.29 , PP 2.21 при PPкрит 4.25 . Для виявлення регулярних компонент коливального типу була проаналізована спектральна функція кривої ВЕНЯ. Для знаходження спектральної функції використовували одновимірний спектральний аналіз (Фур'є), як спектральне вікно застосовували вікно Хемминга. Результати проведеного спектрального аналізу кривої ВЕНЯ пацієнта № 1 показав, що сезонні компоненти відсутні, так як на періодограмі істотних піків виявлено не було, що в свою чергу свідчить про відсутність сезонної компоненти. З сукупності експоненційних моделей прогнозування за кривою ВЕНЯ пацієнта.№ 1 було зроблено вибір математичної моделі. Усі моделі порівнювалися між собою за такими критеріями: усереднений модуль абсолютних відхилень, середня похибка апроксимації, F і критерій Дарбіна-Утсона табл. 3. За отриманими даними для прогнозування перебігу онкологічних захворювань прямої кишки після радикальних операцій для пацієнта №1 була вибрана математична модель Хольта, так як за критерієм Фішера кращими апроксимуючими властивостями володіє модель Хольта, за якою критерій Дарбіна-Уотсона близький до свого оптимального значення 2, крім того, даній моделі властива найменша середня похибка за модулем. Модель Хольта для пацієнта № 1 має вигляд: St St 1 0,93 b t 1 0,001 t ; S Y 0,45 b ; 0 Y1 Y 0 1 b t 0,93 b t 1 0,01 t , b n 0,93 Y S 0,93 b 0 (n 1) ˆ t t t де t - незалежна змінна (час), 1,2,…. n ; Yt - фактичне значення показника ВЕНЯ у момент часу t ; S t - згладжене значення фактичного значення показника Yt ; 50 bt - - згладжене значення тренду у момент часу t ; ˆ t - значення залишків Yt Yt . 7 UA 103012 U 5 10 15 20 25 30 Оцінили адекватність отриманих моделей прогнозування. Отримана модель прогнозування адекватна, тому що: значення критерію R-квадрат = 0,77, що говорить про високий ступінь "підгонки" моделей до даних; значення стаціонарного R-квадрат = 0,6, що менше отриманого мінімального значення критерію R-квадрат, і говорить про хороший взаємозв'язок між підібраною кількістю спостережень і кількістю параметрів моделей; значення критерію ЛьюнгБоксу = 0,33, що менше розподілу хі-квадрат = 0,46 для ступенів свободи n = 35 і рівнем значущості = 0,01, що в свою чергу підтверджує гіпотезу про те, що дані, отримані за допомогою моделей, не є випадковими (тобто не являють собою білий шум); значення байєсівського інформаційного критерію = 7,59, що говорить про гарне узгодження моделей з даними. На основі отриманої моделі прогнозування, шляхом визначення точкової і інтервальної компонент прогнозу Yt , згідно з (21) провели прогнозування стану ВЕНЯ у онкологічного хворого пацієнта № 1 (Фіг. 2.). Отриманий прогноз показав, що у пацієнта спостерігалася позитивна динаміка лікувального процесу, що свідчило про коректний та адекватний комплекс реабілітаційних відновлювальних заходів та імунокорекції, який дозволить за 21 день зміцнити захисні сили і ресурси організму на достатньому рівні перед проведенням хіміотерапії. Прогноз було підтверджено клінічними лабораторними дослідженнями. Визначили, що отримані моделі мають хорошу точність, так як середня похибка моделі = 0,01, сума квадратів похибки = 21,20, середнє квадратів похибки = 0,60, середня відносна похибка = 0,02, середня абсолютна похибка = 1,22. Приклад 2. Пацієнт № 2 у віці 67 років проходив лікування у Харківській міській клінічній лікарні № 2 з діагнозом раку прямої кишки третього ступеня. Протягом 14 днів о 9-00 у пацієнта неінвазивно брали проби клітин букального епітелію, які поміщали у розчин натрій-фосфатного буферу з Ph 7,4 , та розташовували у камеру приладу для внутрішньоклітинного електрофорезу. Лаборантом-цитологом фіксувались клітини з рухомими і нерухомими ядрами (показник ВЕНЯ) в нативних клітинах при увімкненому приладі електрофорезу. Потім за значеннями ВЕНЯ для пацієнта № 1 (табл. 4) будувався графік залежності ВЕНЯ від часу (крива ВЕНЯ). Крива ВЕНЯ пацієнта № 1 зображена на фіг. 3. Провели попередню обробку даних: визначили аномальні показники ВЕНЯ з крит 1,7 , n 14 та рівнем значущості 0,01 . Результати отриманих i для пацієнта № 2 наведені в табл. 5. За отриманими значеннями i на кривій ВЕНЯ пацієнта № 2 точка Y4 ( 4 2,872) вважалися аномально, так як її значення 4 більше крит (крит 1,4) . Але на основі критерію Райта 35 40 аномальну точку 4 кривої ВЕНЯ залишили без змін, так як згідно з умовою (2) 2,872 > 8,8148. За допомогою (3) провели фільтрацію кривої ВЕНЯ від дрібних випадкових коливань. В результаті чого отримали загладжену криву зі значенням коефіцієнта згладжування = 0,31. Визначили присутність тренду кривої ВЕНЯ пацієнта № 2. За методом Фостера-Стьюарта для відфільтрованої кривої ВЕНЯ відповідно до формул (4) і (5) отримали значення коефіцієнтів t s 2,972 і t d 3,196 . Було виявлено, що відфільтрована крива ВЕНЯ має тенденцію лінійного тренду, тому що значення t s ( 5,493) , a (t крит з рівнем значущост 0,01 2.976 ) . Для кривої ВЕНЯ пацієнта № 2 тести на стаціонарність розраховувалися з урахуванням лінійного тренда і показали, що крива ВЕНЯ є нестаціонарною, так як отримані значення статистик тестів з рівнем значущості 0,01 не перевищували критичні значення: DF 3.26 при DFкрит 3.67 , PP 2.21 при PPкрит 3,63 . 45 50 Для виявлення регулярних компонент коливального типу були проаналізована спектральна функція кривої ВЕНЯ. Результати проведеного спектрального аналізу кривої ВЕНЯ пацієнта № 2 показав, що сезонні компоненти відсутні, так як на періодограми істотних піків виявлено не було, що в свою чергу свідчить про відсутність сезонної компоненти. З сукупності експоненційних моделей прогнозування за кривою ВЕНЯ пацієнта № 2 було зроблено вибір математичної моделі табл. 6. За отриманими даними для прогнозування перебігу онкологічних захворювань прямої кишки після радикальних операцій для пацієнта № 2 була вибрана математична модель Хольта. Модель Хольта для пацієнта № 2 має вигляд: S t S t 1 0,94 b t 1 0,001 t ; S Y 0,46b ; 0 0 Y1 Y 1 b t 0,94 b t 1 0,01 t , b n 0,94. Y S 0,94 b 0 ˆ (n 1) t t t 8 UA 103012 U 5 10 15 20 Оцінили адекватність отриманих моделей прогнозування. Отримана модель прогнозування адекватна, тому що: значення критерію R-квадрат = 0,77; значення стаціонарного R-квадрат = 0,6; значення критерію Льюнг-Боксу = 0,33, що менше розподілу хі-квадрат = 0,46 для ступенів свободи n 35 і рівнем значущості 0,01; значення байєсівського інформаційного критерію = 7,59. На основі отриманих моделей прогнозування, шляхом визначення точкової і інтервальної ˆ компонент прогнозу Yt , згідно (21) провели прогнозування стану ВЕНЯ у онкологічного хворого пацієнта № 2 (Фіг. 4.). Отриманий прогноз показав, що комплекс реабілітаційних відновлювальних заходів і імунокорекції необхідно було продовжити на 28 днів, так як прогнозовані значення ВЕНЯ досягали коридору норми за 28 і 26 днів. Прогноз було підтверджено клінічними лабораторнимидослідженнями. Визначили, що отримана модель має хорошу точність, так як середня похибка моделі = 0,03, сума квадратів похибки = 23,69, середнє квадратів похибки = 1,59, середня відносна похибка = 0,06, середня абсолютна похибка = 3,74. Таким чином, запропонований спосіб з використанням математичного моделювання дозволив прогнозувати перебіг онкологічного захворювання прямої кишки після радикальної операції з метою своєчасного визначення адекватного комплексу реабілітаційних відновлювальних заходів і імунокорекції перед хіміотерапією, досягти підвищення якості, розширити функціональність способу, що, в свою чергу, підвищує ефективність лікування хворих. Спосіб прогнозування перебігу онкологічного захворювання прямої кишки після радикальної операції Таблиця 1 Показник 1-й 2-й день День день Пацієнт № 1 37 45 3-й день 37 4-й день 26 5-й день 21 6-й день 18 7-й день 19 8-й день 10 9-й день 22 10-й день 24 … … 14-й день 26 25 Таблиця 2 Показник i 1-й День день Пацієнт № 1 0 2-й день 0,937 3-й день 0,937 4-й день 1,288 5-й день 0,585 6-й день 0,351 7-й день 0,117 8-й день 1,054 9-й день 1,405 10-й день 0,234 … … 14-й день 0,117 Таблиця 3 Модель прогнозування Модель Брауна Модель Хольта Екстраполірувальна трендова модель Усереднений модуль абсолютних відхилень 1,74 0,49 Середня похибка апроксимації 0,05 0,01 Критерій Фішера F 11,04 233,20 Критерій Дарбіна Утсона 3,87 1,96 3,85 0,13 23,90 3,23 Таблиця 4 Показник 1-й День день Пацієнт № 2 40 2-й день 36 3-й день 40 4-й день 13 5-й день 16 6-й день 23 7-й день 30 8-й день 36 9-й день 45 10-й день 41 … … 14-й день 37 Таблиця 5 Показник i 1-й День день Пацієнт № 2 0 2-й день 0,425 3-й день 0,425 4-й день 2,872 5-й день 0,319 6-й день 0,744 30 9 7-й день 0,744 8-й день 0,638 9-й день 0,957 10-й день 0,425 … … 14-й день 0,106 UA 103012 U Таблиця 6 Модель Усереднений модуль прогнозування абсолютних відхилень Модель Брауна 2,03 Модель Хольта 0,54 Екстраполірувальна 4,35 трендова модель 5 10 15 20 25 Середня похибка апроксимації 0,08 0,03 Критерій Фішера F 10,27 95,76 Критерій Дарбіна -Утсона 2,79 1,85 0,16 17,54 2,04 ФОРМУЛА КОРИСНОЇ МОДЕЛІ 1. Спосіб прогнозування перебігу онкологічного захворювання прямої кишки після радикальної операції, що включає визначення стадії пухлинного процесу, який відрізняється тим, що стадію пухлинного процесу визначають за допомогою аналізу показника відсотка електронегативних ядер клітин букального епітелію, для визначення цього показника у пацієнта неінвазивно беруть пробу клітин букального епітелію шпателем із внутрішньої поверхні щоки, отримані проби поміщають в краплю розчину натрій-фосфатного буфера з Ph =7,4 і розташовують між двома покривними скельцями у спеціальній камері приладу для внутрішньоклітинного електрофорезу і прокладаються фільтрувальним папером, просоченого фосфатним буфером, камеру встановлюють під об'єктив мікроскопа, за допомогою якого при одночасному проведенні електрофорезу фіксують окремо клітини з рухомими і нерухомими ядрами, потім за значеннями цього показника для кожного пацієнта будують графіки залежності показника відсотка електронегативних ядер клітин букального епітелію від часу, за допомогою математичного апарату та інформаційних технологій з використанням обчислювальної техніки на основі отриманих кривих показника відсотка електронегативних ядер клітин букального епітелію проводять прогнозування перебігу онкологічного захворювання прямої кишки після радикальної операції, яке складається з попереднього аналізу та обробки даних, вибору моделі прогнозування, оцінки її адекватності, прогнозування стану онкологічних хворих за показниками відсотка електронегативних ядер на основі вибраної моделі та визначення її точності. 2. Спосіб за п. 2, який відрізняється тим, що скельця мають розмір 24×24 мм. 10 UA 103012 U Комп’ютерна верстка Д. Шеверун Державна служба інтелектуальної власності України, вул. Василя Липківського, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 11
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod for the prognostication in rectal cancer after radical operation
Автори англійськоюBykh Anatolii Ivanovych, Vysotska Olena Volodymyrivna, Sidak Volodymyr Volodymyrovych, Shchukin Mykola Oleksandrovych
Назва патенту російськоюСпособ прогнозирования течения онкологического заболевания прямой кишки после радикальной операции
Автори російськоюБых Анатолий Иванович, Высоцкая Елена Владимировна, Сидак Владимир Владимирович, Щукин Николай Александрович
МПК / Мітки
МПК: G01N 1/28, A61B 10/00, G01N 33/50
Мітки: прямої, спосіб, кишки, операції, перебігу, радикальної, захворювання, онкологічного, прогнозування
Код посилання
<a href="https://ua.patents.su/13-103012-sposib-prognozuvannya-perebigu-onkologichnogo-zakhvoryuvannya-pryamo-kishki-pislya-radikalno-operaci.html" target="_blank" rel="follow" title="База патентів України">Спосіб прогнозування перебігу онкологічного захворювання прямої кишки після радикальної операції</a>
Попередній патент: Спосіб діагностики клінічних форм неалкогольної жирової хвороби печінки
Наступний патент: Спосіб очищення стічних вод від сульфатів в процесі вапнування
Випадковий патент: Спосіб видобутку залишкової нафти