Спосіб кількісного визначення рівня природних аутоантитіл в біологічних рідинах людини за допомогою імуноферментного аналізу
Номер патенту: 109893
Опубліковано: 26.10.2015
Автори: ван дер Мейде Петер Х., Тарасов Сєргєй Алєксандровіч, Тарасов Алєксандр Владіміровіч, Сєргєєва Свєтлана Алєксандровна
Формула / Реферат
1. Спосіб кількісного визначення рівня природних аутоантитіл в біологічних рідинах людини за допомогою імуноферментного аналізу, який включає обробку твердої фази фізичної сорбції антигеном, внесення досліджуваних біологічних зразків, обробку твердої фази розчином кон'югатів, розділення твердої і рідкої фаз, а також спектрофотометричний аналіз реакції за екстинкцією розчину хромагента, який відрізняється тим, що як тверду фазу фізичної сорбції використовують тверду фазу фізичної сорбції, покриту стрептавідином, а обробку твердої фази фізичної сорбції проводять попередньо біотинильованим антигеном і блокуючим агентом для закриття на твердій фазі фізичної сорбції місць неспецифічного зв'язування, для чого використовують біотинильовані за стандартною процедурою білки, причому як розчин кон'югатів використовують моноклональні або поліклональні антитіла, мічені ферментом, що реагують з одним або всіма ізотипами імуноглобулінів людини, а біологічну рідину, яка тестується, попередньо розводять у буфері, що містить білки, які забезпечують закриття на твердій фазі фізичної сорбції місць неспецифічного зв'язування, де як білки використовують бичачий сироватковий альбумін або людський сироватковий альбумін, а також містить речовини, які захищають природні аутоантитіла від руйнування при термічній обробці, де як речовини використовують консервант, тимеросал та поверхнево-активну речовину, Triton-X100, і піддають термічній обробці, для кожного досліджуваного зразка біологічної рідини використовують контрольну тверду фазу фізичної сорбції, на якій не іммобілізовано біотинильований антиген, а кількість природних аутоантитіл визначають за допомогою калібрувальної кривої, яка будується з використанням моноклональних або поліклональних антитіл до антигену.
2. Спосіб кількісного визначення рівня природних аутоантитіл в біологічних рідинах людини згідно з пунктом 1, який відрізняється тим, що перед термічною обробкою, досліджувану біологічну рідину, розведену у буфері, що містить бичачий сироватковий альбумін або людський сироватковий альбумін, які використовують для закриття на твердій фазі фізичної сорбції місць неспецифічного зв'язування, і тимеросал та Triton-X100, які захищають природні аутоантитіла від руйнування під час термічної обробки, додатково піддають впливу залізовмісним окислювачам.
Текст
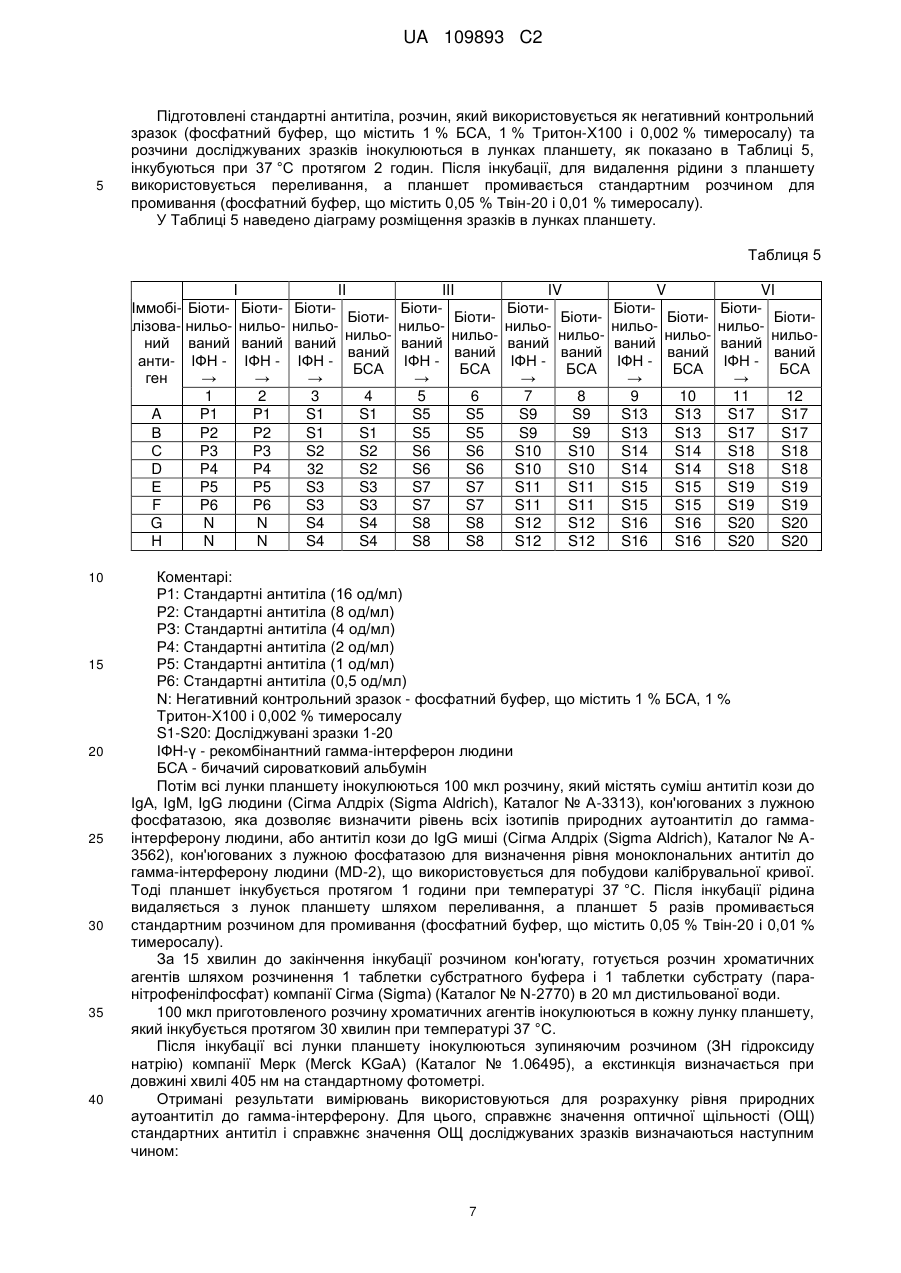
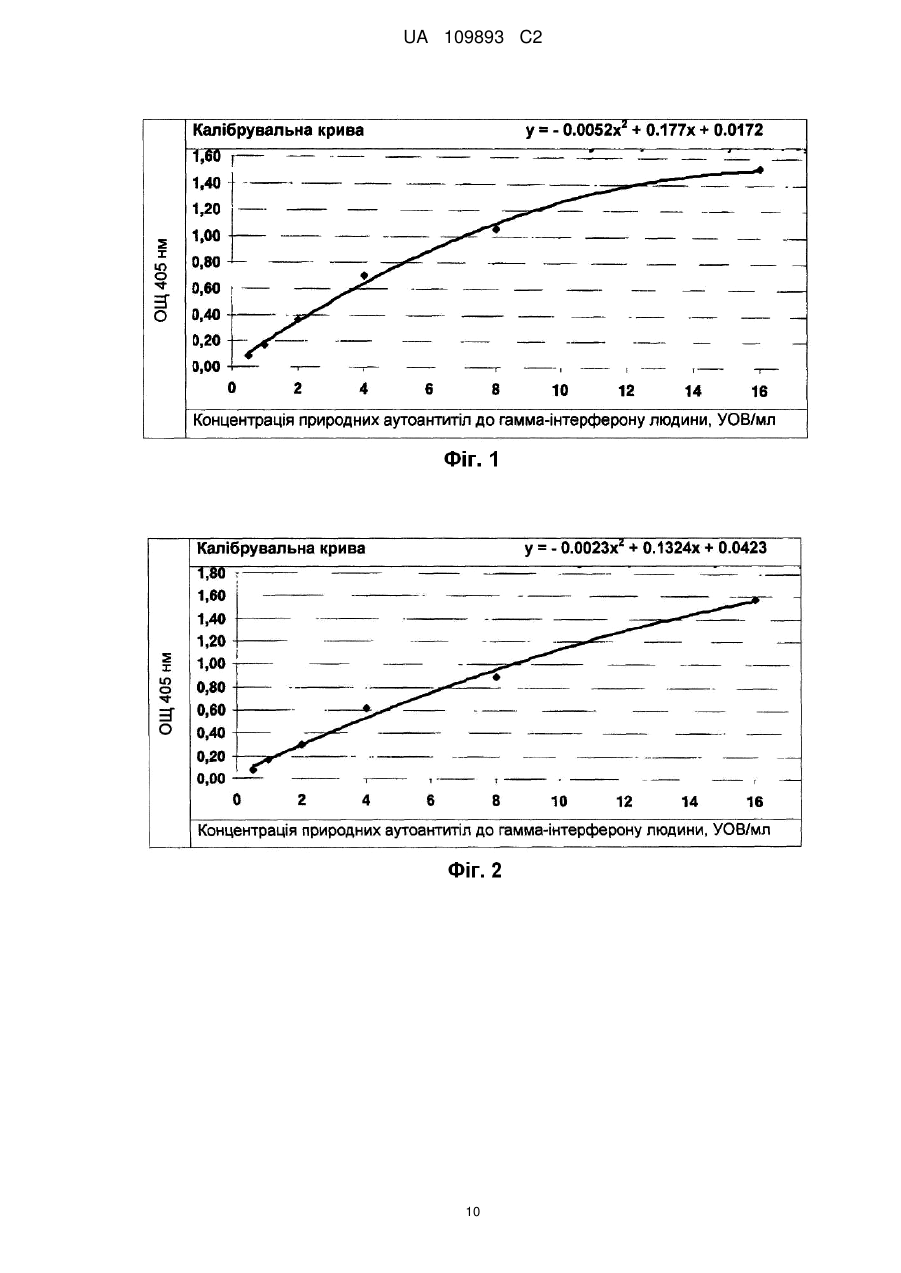
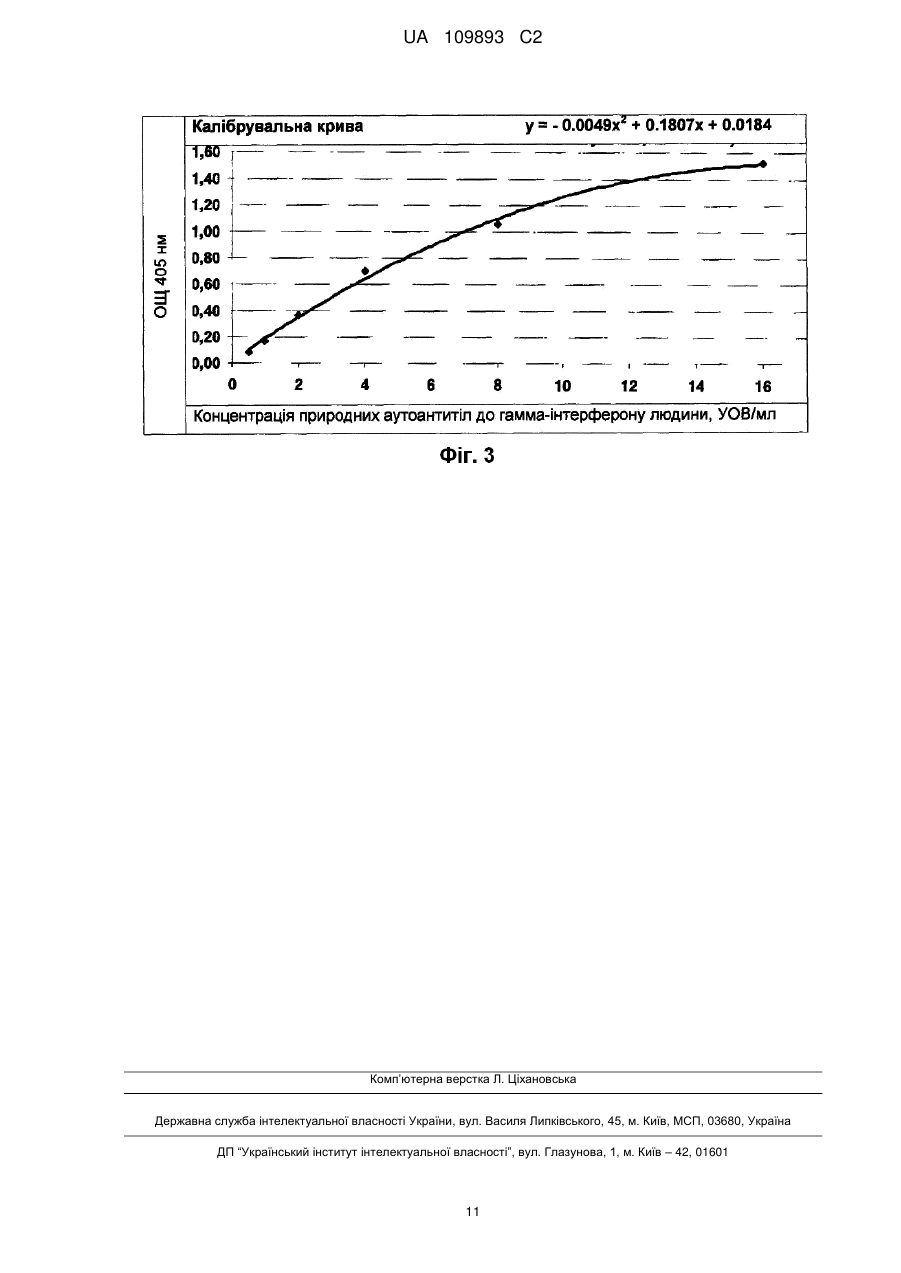
Реферат: Винахід стосується способу кількісного визначення рівня природних аутоантитіл в біологічних рідинах людини за допомогою імуноферментного аналізу, який включає обробку твердої фази фізичної сорбції антигеном, внесення досліджуваних біологічних зразків, обробку твердої фази розчином кон'югатів, розділення твердої і рідкої фаз, а також спектрофотометричний аналіз реакції за екстинкцією розчину хромагента, згідно з яким як тверду фазу фізичної сорбції використовують тверду фазу фізичної сорбції, покриту стрептавідином, а обробку твердої фази фізичної сорбції проводять попередньо біотинильованим антигеном і блокуючим агентом для закриття на твердій фазі фізичної сорбції місць неспецифічного зв'язування, для чого використовують біотинильовані за стандартною процедурою білки, причому як розчин кон'югатів використовують моноклональні або поліклональні антитіла, мічені ферментом, що реагують з одним або всіма ізотипами імуноглобулінів людини, а біологічну рідину, яка тестується, попередньо розводять у буфері, що містить білки, які забезпечують закриття на твердій фазі фізичної сорбції місць неспецифічного зв'язування, де як білки використовують UA 109893 C2 (12) UA 109893 C2 бичачий сироватковий альбумін або людський сироватковий альбумін, а також містить речовини, які захищають природні аутоантитіла від руйнування при термічній обробці, де як речовини використовують консервант, тимеросал та поверхнево-активну речовину, Triton-X100, і піддають термічній обробці, для кожного досліджуваного зразка біологічної рідини використовують контрольну тверду фазу фізичної сорбції, на якій не іммобілізовано біотинильований антиген, а кількість природних аутоантитіл визначають за допомогою калібрувальної кривої, яка будується з використанням моноклональних або поліклональних антитіл до антигену. UA 109893 C2 5 10 15 20 25 30 35 40 45 50 55 60 Область технічного застосування Винахід відноситься до галузі медицини, зокрема, до лабораторної діагностики, і може використовуватися для підвищення ефективності та надійності кількісного визначення концентрації природних аутоантитіл в біологічних рідинах людини. Попередній технічний рівень Існує відомий технічний метод для кількісного визначення рівня аутоантитіл до ендогенних білків в біологічних рідинах людини за допомогою твердофазного імуноферментного аналізу (ІФА) (RU 2137134 С1, G01 N33/53, 1999). Тим не менш, цей метод мало придатний для кількісного визначення рівня природних аутоантитіл в біологічних рідинах людини. Широко відомий метод імуноферментного аналізу, який включає адсорбцію антигенів на твердій фазі фізичної сорбції, інкубацію досліджуваних біологічних зразків, інкубацію розчину кон'югатів і спектрофотометричний аналіз реакції за зникнення хроматичного агента (RU 2014610 С1, G01 N33/535, 1994). Крім того, існує відомий метод імуноферментного аналізу для визначення рівня природних аутоантитіл, який включає адсорбцію антигенів на твердій фазі фізичної сорбції, інкубацію досліджуваних біологічних зразків, інкубацію розчину кон'югатів і спектрофотометрію реакції екстинкції хроматичного агента (BMS217TEN ІФА анти-ІФН-альфа людини, Бендер МедСистемс Гмбх Австрія (Bender MedSystems GmbH, Austria)). Незважаючи на достатню простоту, чутливість та специфічність цього рішення, отримані результати можуть бути помилково позитивними через неспецифічне низько-афінне зв'язування різних імуноглобулінів сироватки або плазми, з антигеном адсорбованим на пластині ІФА. Крім того, присутність у крові поліреактивних імуноглобулінів, які не належать до групи природних антитіл, може призвести до хибно-позитивних результатів, оскільки поліреактивні імуноглобуліни неспецифічно зв'язуються з компонентами пластини ІФА. Також, в ІФА виявляються лише фракції вільних природних антитіл, в той час як більша частина природних аутоантитіл представлена в крові в комплексах, зв'язаних з антигеном. Розкриття сутності винаходу Винахід призначений для розробки технологічно простого, чутливого і специфічного методу кількісного визначення рівня природних аутоантитіл в біологічних рідинах людини методом ІФА. Поставлене завдання вирішується за рахунок того, що метод кількісного визначення рівня природних аутоантитіл в біологічних рідинах людини здійснюється за допомогою імуноферментного аналізу, в тому числі обробки антигеном твердої фази фізичної сорбції, додавання досліджуваних біологічних зразків, обробки твердої фази розчином кон'югатів, розділення твердої і рідкої фаз, а також спектрофотометрії реакції екстинкції хроматичного агента в розчині, відповідно до винаходу, фізичної сорбції твердої фази покритої стрептавідином, що використовується в якості твердої фази фізичної сорбції, і тверда фаза фізична сорбція обробляється попередньо біотинильованим антигеном і блокуючим агентом для закриття місць неспецифічного зв'язування твердої фази фізичної сорбції, для чого, відповідно до стандартної процедури, використовуються біотинильовані білки. Як розчин кон'югатів використовуються моноклональні або поліклональні антитіла, мічені ферментом, що реагують з одним або всіма ізотипами імуноглобулінів людини. Крім того, досліджувана біологічна рідина попередньо розводиться в буфері, що містить білки, які використовуються для закриття місць неспецифічного зв'язування у твердій фазі фізичної сорбції, а також речовини, які захищають природні аутоантитіла від руйнування при термічній обробці, і піддають їх термічній обробці. Для кожного досліджуваного зразка біологічної рідини використовується відповідна контрольна тверда фаза фізичної сорбції, у випадку якої біотинильований антиген не іммобілізується (тобто для кожного досліджуваного зразка біологічної рідини для зв'язування з твердофазним стрептавідином використовується контрольний біотинильований білок, який схожий на білок, який використовується для закриття місць неспецифічного зв'язування у твердо фазній фізичній сорбції, що дозволяє вимірювати спектрофотометричний сигнал як специфічний, так і неспецифічний для природних антитіл), а кількість природних аутоантитіл визначається за допомогою калібрувальної кривої, яка стандартизована відповідно до моноклональних або поліклональних антитіл до антигену. Крім того, перед термообробкою, досліджувана біологічна рідина розводиться в буфері, що містить білки, які використовуються для закриття місць неспецифічного зв'язування у твердій фазі фізичної сорбції, і речовини, що захищають природні аутоантитіла від руйнування під час термічної обробки, які додатково обробляються залізовмісним окислювачем. Завдяки комбінованому застосуванню фізичної сорбції твердої фази, покритої стрептавідином, і біотинильованих агентів твердої фази фізичної сорбції, всі епітопи іммобілізованих антигенів залишаються вільними для зв'язування з природними 1 UA 109893 C2 5 10 15 20 25 30 35 40 45 50 55 60 аутоантитілами, тим самим збільшуючи чутливість заявленого методу, в той час як пряма іммобілізація антигену призводить до конформаційних змін і руйнування епітопів антигену, що знижує чутливість методу ФІА. Крім того, застосування антитіл, мічених ферментом, які реагують з одним або всіма ізотипами імуноглобулінів людини, дозволяє визначити рівень певного ізотипу або всіх ізотипів природних аутоантитіл і, відповідно, розширює функціональні можливості заявленого методу. Попереднє розведення досліджуваного зразка в буфері, що містить білки, які знаходяться в блокуючому буфері і використовуються для закриття місць неспецифічного зв'язування у твердій фазі фізичної сорбції, зводить до мінімуму можливість неспецифічного зв'язування антитіл досліджуваного зразка з твердою фазою, на якій іммобілізуються білки, що також підвищує чутливість та специфічність заявленого методу. Додавання залізовмісного окислювача і термічна обробка досліджуваного зразка дозволяє розірвати комплекс природних аутоантитіл з антигенами та антиідіотиповими антитілами, або забезпечити наявність паратопів антигену до епітопів антигену у зв'язку з різними ефектами демаскування, а попереднє розведення досліджуваного зразка в буфері захищає природні аутоантитіла від руйнування під час термічної обробки, що дозволяє визначити загальний рівень природних аутоантитіл (тобто як вільних аутоантитіл, так і форм природних аутоантитіл, пов'язаних з антигеном, або природних аутоантитіл із закритими паратопами), і таким чином зменшує можливість отримання хибно-негативних результатів, підвищує чутливість, ефективність і функціональні можливості заявленого методу. Використання для кожного досліджуваного зразка біологічної рідини окремої контрольної твердої фази фізичної сорбції з іммобілізованим біотинильованим блокуючим білком дозволяє оцінити специфічний і неспецифічний для природних аутоантитіл спектрофотометричний сигнал, який також зменшує можливість отримання хибно-позитивних результатів і підвищує чутливість заявленого методу. Крім того, заявлена комбінація основних функцій, які розширюють можливості кількісного визначення рівня природних аутоантитіл, збільшує діапазон технічних засобів для вирішення поставленого завдання. Короткий опис рисунків Рисунок 1 - калібрувальна крива для прикладу 1; Рисунок 2 - калібрувальна крива для прикладу 2; Рисунок 3 - калібрувальна крива для прикладу 3. Втілення винаходу Заявлений метод якісного визначення рівня природних аутоантитіл в біологічних рідинах людини був реалізований наступним чином: Тверда фаза фізичної сорбції (лунки) стандартного лункового планшету покривається стрептавідином або його аналогом (наприклад, авідін і т.д.), твердо фазова фізична сорбція блокується блокуючим агентом і інкубується з біотинильованим агентом, відносно якого необхідно визначити рівень природних аутоантитіл, або (контрольні лунки) біотинильованим блокувальним білком (наприклад, бичачий сироватковий альбумін, яєчний альбумін, сироватковий альбумін людини, сироватковий альбумін кролика, желатин і т.д.), що є контролем для неспецифічного зв'язування. Антигени біотинилюються мінімальною кількістю біотину (наприклад, О-біотиноіл-ε-амінокапроновий кислотно-N-гідроксисукцинімідовий ефір) (молярне відношення 1:2 антигену до біотину) для мінімізації руйнування епітопу. Біологічна рідина готується для аналізу (наприклад, сироватка крові, плазма крові, і т.д.) шляхом розбавлення (в межах від 50 разів до 200,000)!!!! в буферному розчині, який містить білки в складі блокуючого буфера (наприклад, бичачий сироватковий альбумін, яєчний альбумін, сироватковий альбумін людини, сироватковий альбумін кролика, желатин і т.д.), консерванти (наприклад, тимеросал і т.д.), поверхнево-активні речовини (наприклад, ТритонХ100 і т.д.), які захищають природні аутоантитіла від руйнування під час термічної обробки, і отриманий розчин біологічної рідини піддають тепловій обробці в діапазоні температур від 50 °C до 80 °C. Перед термічною обробкою рекомендується додаткова обробка досліджуваних біологічних рідин залізовмісним окислювачем (наприклад, хлоридом заліза (lll)[FeCI 3]). Після цього, розчин досліджуваної біологічної рідини, яка пройшла термічну обробку, поміщають в лунки так само, як специфічні антитіла, що використовуються для побудови калібрувальної кривої, для чого використовуються моноклональні або поліклональні антитіла до антигену з відомою концентрацією. Для виявлення утвореного імунного комплексу (антиген природні антитіла), використовується кон'югат поліклональних або моноклональних антитіл (наприклад, поліклональні антитіла кози, поліклональні антитіла вівці, моноклональні антитіла миші і т.д.) до легких ланцюгів визначених або всіх імуноглобулінів людини з ферментом (наприклад, лужна фосфатаза, пероксидаза хрону, і т.д.). Рівень природних аутоантитіл 2 UA 109893 C2 5 10 15 20 25 30 35 40 визначається за допомогою реакції екстинкції хроматичного агенту в розчині, який змінює свій колір залежно від кількості хроматичного агенту, виділених із субстрату після їх розщеплення ферментом (наприклад, лужною фосфатазою та ін.); субстрат виробляє розчинний продукт, колірні характеристики якого можна визначити спектрофотометрично при певній довжині хвилі. Приклад 1. Для підтвердження можливості отримання технічного результату при реалізації заявленого методу для кількісного визначення рівня природних аутоантитіл до гамма-інтерферону людини, були взяті зразки сироватки у двадцяти здорових донорів, які не піддавалися терапії інтерфероном. Отже, їх сироватка не містить аутоантитіла до гамма-інтерферону людини, однак, має природні антитіла до гамма-інтерферону людини. Частина лунок 96-луночного планшету, покритих стрептавідином компанії Грейнер Біо-Уан Гмбх (Greiner Bio-One GmbH) (Каталог № 655990), інокулюються 100 мкл рекомбінантного гамма-інтерферону людини компанії іБіосайнсіз (eBiosciences) (Каталог № 34-8319-85), а інша частина (контрольні лунки для досліджуваних зразків) інокулюються бичачим сироватковим альбуміном компанії Сігма Алдріх (Sigma Aldrich) (Каталог № А-3803), які біотинилюються за стандартною процедурою компанії Ю-СайТек Біосайнз (U-Cytech Bioscience) (стандартна операційна процедура № UCT-127) при 100 мкл/лунку при 100 % вологості (принцип маркування полягає в тому, що вільні аміногрупи білків взаємодіють з D-біотинол-ε-амінокапроновим кислотно-N-гідроксисукцинімідовим ефіром (NHS-біотин) (молярне відношення антигену до біотину становить 1:2), утворюючи стабільний амідний зв'язок (реакція протікає при кімнатній температурі протягом 2 годин інкубації при обережному перемішуванні); біотинильований білок потім діалізують у фосфатному буферному розчині для видалення NHS-біотину, який не прорегагував). Зразки сироватки крові розводять 1: 20 (100 мкл сироватки розводять в 1900 мкл фосфатного буфера, що містить 1 % Тритон-Х100 і 0,002 % тимеросалу) і інкубують протягом 20 хвилин при 75 °С. Потім розчин, який пройшов інкубацію, знову розводять 1: 5 (100 мкл розчину, який пройшов інкубацію, розбавляють в 400 мкл фосфатно-сольового буфера, що містить 1 % бичачого сироваткового альбуміну (БСА), 1 % Тритон-Х100 і 0,002 % тимеросалу), і надалі використовують для інокуляції в лунках планшету (100 мкл на лунку). Для того, щоб побудувати калібрувальну криву, готуються стандартні розчини антитіл (моноклональні антитіла мишей до гамма-інтерферону людини, клон MD-2) в діапазоні концентрацій від 16 од/мл до 0,5 од/мл. 100 пг/мл моноклональних антитіл приймається за 1 од/мл. Підготовлені стандартні антитіла, розчин, який використовується як негативний контрольний зразок (фосфатний буфер, що містить 1 % БСА, 1 % Тритон-Х100 і 0,002 % тимеросалу) та розчин досліджуваних зразків інокулюються в лунках планшету, як показано в Таблиці 1, та інкубуються при 37 °C протягом 2 годин. Після інкубації, для видалення рідини з планшету використовується переливання, а планшет промивається стандартним розчином для промивання (фосфатний буфер, що містить 0,05 % Твін-20 і 0,01 % тимеросалу). У таблиці 1 наведено діаграму інокуляції зразка в лунках планшету. Таблиця 1 ІммобіБіотилізованильоний ваний антиІФН ген → 1 А P1 В P2 С P3 D P4 Ε P5 F P6 G N Η N I Біотинильований ІФН → 2 P1 P2 P3 P4 P5 P6 N N II БіотиБіотинильонильований ваний ІФН БСА → 3 4 S1 S1 S1 S1 S2 S2 S2 S2 S3 S3 S3 S3 S4 S4 S4 S4 III БіотиБіотинильонильований ваний ІФН БСА → 5 6 S5 S5 S5 S5 S6 S6 S6 S6 S7 S7 S7 S7 S8 S8 S8 S8 3 IV БіотиБіотинильонильований ваний ІФН БСА → 7 8 S9 S9 S9 S9 S10 S10 S10 S10 S11 S11 S11 S11 S12 S12 S12 S12 V БіотиБіотинильонильований ваний ІФН БСА → 9 10 S13 S13 S13 S13 S14 S14 S14 S14 S15 S15 S15 S15 S16 S16 S16 S16 VI БіотиБіотинильонильований ваний ІФН БСА → 11 12 S17 S17 S17 S17 S18 S18 S18 S18 S19 S19 S19 S19 S20 S20 S20 S20 UA 109893 C2 5 10 15 20 25 30 35 40 Коментарі: Р1: Стандартні антитіла (16 од/мл) Р2: Стандартні антитіла (8 од/мл) РЗ: Стандартні антитіла (4 од/мл) Р4: Стандартні антитіла (2 од/мл) Р5: Стандартні антитіла (1 од/мл) Р6: Стандартні антитіла (0,5 од/мл) N: Негативний контрольний зразок - фосфатний буфер, що містить 1 % БСА, 1 % Тритон-Х100 і 0,002 % тимеросалу S1-S20: Досліджувані зразки 1-20 ІФН-→ - рекомбінантний гамма-інтерферон людини БСА - бичачий сироватковий альбумін Потім всі лунки планшету інокулюються 100 мкл кожна, які містять суміш антитіл кози до IgA, IgM, IgG людини (Сігма Алдріх (Sigma Aldrich), Каталог № А-3313), кон'югованих з лужною фосфатазою, яка дозволяє визначити рівень всіх ізотипів природних аутоантитіл до гаммаінтерферону людини, або антитіл кози до IgG миші (Сігма Алдріх (Sigma Aldrich), Каталог № А3562), кон'югованих з лужною фосфатазою для визначення рівня моноклональних антитіл до гамма-інтерферону людини (MD-2), що використовується для побудови калібрувальної кривої. Тоді планшет інкубується протягом 1 години при температурі 37 °C. Після інкубації рідина видаляється з лунок планшету шляхом переливання, а планшет 5 разів промивається стандартним розчином для промивання (фосфатний буфер, що містить 0,05 % Твін-20 і 0,01 % тимеросалу). За 15 хвилин до закінчення інкубації розчином кон'югату, готується розчин хроматичних агентів шляхом розчинення 1 таблетки субстратного буфера і 1 таблетки субстрату (паранітрофенілфосфат) компанії Сігма (Sigma) (Каталог № N-2770) в 20 мл дистильованої води. 100 мкл приготовленого розчину хроматичних агентів інокулюються в кожну лунку планшету, який інкубується протягом 30 хвилин при температурі 37 °C. Після інкубації всі лунки планшету інокулюються зупиняючим розчином (3Н гідроксиду натрію) компанії Мерк КгаА (Merck KgaA) (Каталог № 1.06495), а екстинкція визначається при довжині хвилі 405 нм на стандартному фотометрі. Отримані результати вимірювань використовуються для розрахунку рівня природних аутоантитіл до гамма-інтерферону. Для цього, справжнє значення оптичної щільності (ОЩ) стандартних антитіл і справжні значення досліджуваних зразків визначаються наступним чином: 1. Розраховується середнє значення ОЩ для негативного контрольного зразка (середнє арифметичне значення ОЩ в лунках 1G, 1Н, 2G, 2Н). 2. Розраховується середнє значення ОЩ для стандартних антитіл (середнє арифметичне значення ОЩ в лунках відповідного стандарту Р1-Р6). 3. Справжнє значення ОЩ стандартних антитіл розраховується як різниця середнього значення ОЩ стандартних антитіл і середнього значення ОЩ негативного контрольного зразка. Результати розрахунків наведено в таблиці 2. Таблиця 2 1 Р1 Р2 РЗ Р4 Р5 Р6 N N А В С D Ε F G Η 2 1.704 1.122 0.818 0.497 0.285 0.201 0.115 0.106 → Середні значення ОЩ: 1.554 1.202 0.801 0.453 0.266 0.188 0.108 0.102 1.629 1.162 0.810 0.475 0.276 0.195 0.108 → ОЩ стандартного антитіла мінус середнє значення ОЩ негативного контрольного зразка 1.521 1.054 0.702 0.367 0.168 0.087 4. Отримані значення справжньої ОЩ стандартних антитіл були використані для побудови калібрувальної кривої (див. Рисунок 1), де значення ОЩ вказані на осі ординат (у), а на осі 4 UA 109893 C2 5 10 15 абсцис (х) вказується концентрація антитіл до гамма-інтерферону. Побудовану калібрувальну 2 криву можна описати наступним рівнянням: у = - 0.0052х +0.177х + 0.0172 5. Розраховується середнє значення ОЩ для досліджуваних зразків в лунках планшету, в яких іммобілізується біотинильований ΙΦΗ-γ (ряд 3,5,7,9,11 у Таблиці 1), а також БСА (ряд 4,6,8,10,12 у Таблиці 1). Наприклад, для досліджуваного зразка S1, середнє значення ОЩ розраховується в лунках A3, ВЗ і А4, В4, відповідно. 6. Справжнє значення ОЩ розраховується для досліджуваних зразків як різниця середнього значення ОЩ для досліджуваних зразків, що вимірюється в лунках планшету, де іммобілізується біотинильований ІФН-γ, а середнє значення ОЩ для досліджуваних зразків вимірюється в лунках планшету, де іммобілізується біотинильований БСА. Наприклад, для досліджуваного зразка S1, від середнього значення ОЩ, що вимірюється в лунках планшету A3, ВЗ, віднімається середнє значення ОЩ, що вимірюється в лунках планшету А4, В4. 7. Калібрувальна крива (Рисунок 1) використовується для визначення концентрації розбавлених природних аутоантитіл до гамма-інтерферону людини у досліджуваних зразках. Для отримання справжніх значень концентрації природних аутоантитіл до гамма-інтерферону людини у досліджуваних зразках, отриманий результат множиться на ступінь розведення зразка (на 100). Результати наведено в Таблиці 3. Таблиця 3 Досліджуваний зразок S1 S2 S3 S4 S5 S6 S7 S8 S9 S10 S11 S12 S13 S14 S15 S16 S17 S18 S19 S20 Концентрація природних аутоантитіл до гаммаінтерферону людини, од/мл 780.1 774.6 288.3 977.1 509.0 688.1 794.5 572.4 453.5 753.1 527.9 298.8 345.6 443.5 621.8 575.2 758.9 857.5 656.2 753.5 20 25 Приклад 2. У двадцяти пацієнтів з інфекційним мононуклеозом, в яких збільшувався рівень природних аутоантитіл до гамма-інтерферону людини, взяли зразки сироватки. Всі етапи визначення рівня природних аутоантитіл до гамма-інтерферону людини були аналогічними з описаними в Прикладі 1, за винятком того, що досліджувані зразки розбавлялися в 1000 раз, людський сироватковий альбумін використовувався як блокуючий агент, а температура інкубації склала 56 °C. Калібрувальна крива наведена на Рисунку 2, а отримані результати наведено в Таблиці 4. 5 UA 109893 C2 Таблиця 4 Досліджуваний зразок S1 S2 S3 S4 S5 S6 S7 S8 S9 S10 S11 S12 S13 S14 S15 S16 S17 S18 S19 S20 5 10 15 20 25 30 Концентрація природних аутоантитіл до гаммаінтерферону людини, УОВ/мл 1675.9 1591.7 1897.5 1480.0 1924.4 1974.6 1537.4 1221.1 1624.5 1569.9 1874.6 1530.2 1870.8 1798.9 2151.8 1882.2 1505.0 1810.2 1526.6 1451.4 Приклад 3. Для підтвердження можливості отримання технічного результату при реалізації заявленого методу для кількісного визначення рівня природних аутоантитіл до гамма-інтерферону людини, для чого, до термообробки досліджувана біологічна рідина оброблялася залізовмісним окислювачем, у двадцяти здорових донорів, які не піддавалися терапії інтерфероном, були взяті зразки, і, хоча, вони не містили аутоантитіла до гамма-інтерферону людини, однак, мали природні антитіла до гамма-інтерферону людини. Частина лунок 96-луночного планшету, покритих стрептавідином компанії Грейнер Біо-Уан Гмбх (Greiner Bio-One GmbH) (Каталог № 655990), інокулюються 100 мкл рекомбінантного гамма-інтерферону людини компанії іБіосайнсіз (eBiosciences) (Каталог № 34-8319-85), а інша частина (контрольні лунки для досліджуваних зразків) інокулюються з бичачим сироватковим альбуміном компанії Сігма Алдріх (Sigma Aldrich) (Каталог № А-3803), які біотинилюються згідно зі стандартною процедурою компанії Ю-СайТек Біосайнз (U-Cytech Bioscience) (стандартна операційна процедура № UCT-127) в розмірі 100 мкл/лунку при 100 % вологості (принцип маркування полягає в тому, що вільні аміногрупи білків взаємодіють з D-біотинол-εамінокапроновим кислотно-N-гідроксисукцинімідовим ефіром (NHS-біотин), утворюючи стабільний амідний зв'язок (реакція протікає при кімнатній температурі протягом 2 годин інкубації при обережному перемішуванні); біотинильований білок потім діалізують у фосфатному буферному розчині для видалення NHS-біотину, який не прореагував). Зразки сироватки крові розводять 1: 10 (10 мкл сироватки розводять в 90 мкл фосфатного буфера, що містить 1 % Тритон-Х100 і 0,002 % тимеросалу), обробляють 2мМ FeCl3 і інкубують протягом 40 хвилин при 56 °С. Потім розчин, який пройшов інкубацію, знову розводять 1: 5 (100 мкл розчину, який пройшов інкубацію, розбавляють в 400 мкл фосфатного буфера, що містить 1 % бичачого сироваткового альбуміну (БСА), 1 % Тритон-Х100 і 0,002 % тимеросалу), і надалі використовують для інокуляції в лунках планшету (100 мкл на лунку). Для того, щоб побудувати калібрувальну криву, готуються стандартні розчини антитіл (моноклональні антитіла мишей до гамма-інтерферону людини, клон MD-2) в діапазоні концентрацій від 16 од/мл до 0,5 од/мл. 100 пг/мл моноклональних антитіл умовно приймається за 1 од/мл. 6 UA 109893 C2 5 Підготовлені стандартні антитіла, розчин, який використовується як негативний контрольний зразок (фосфатний буфер, що містить 1 % БСА, 1 % Тритон-Х100 і 0,002 % тимеросалу) та розчини досліджуваних зразків інокулюються в лунках планшету, як показано в Таблиці 5, інкубуються при 37 °C протягом 2 годин. Після інкубації, для видалення рідини з планшету використовується переливання, а планшет промивається стандартним розчином для промивання (фосфатний буфер, що містить 0,05 % Твін-20 і 0,01 % тимеросалу). У Таблиці 5 наведено діаграму розміщення зразків в лунках планшету. Таблиця 5 I Іммобі- Біотилізова- нильоний ваний анти- ІФН ген → 1 A P1 В P2 С P3 D P4 Ε P5 F P6 G N Η N 10 15 20 25 30 35 40 Біотинильований ІФН → 2 P1 P2 P3 P4 P5 P6 N N II БіотиБіотинильонильований ваний ІФН БСА → 3 4 S1 S1 S1 S1 S2 S2 32 S2 S3 S3 S3 S3 S4 S4 S4 S4 III БіотиБіотинильонильований ваний ІФН БСА → 5 6 S5 S5 S5 S5 S6 S6 S6 S6 S7 S7 S7 S7 S8 S8 S8 S8 IV БіотиБіотинильонильований ваний ІФН БСА → 7 8 S9 S9 S9 S9 S10 S10 S10 S10 S11 S11 S11 S11 S12 S12 S12 S12 V БіотиБіотинильонильований ваний ІФН БСА → 9 10 S13 S13 S13 S13 S14 S14 S14 S14 S15 S15 S15 S15 S16 S16 S16 S16 VI БіотиБіотинильонильований ваний ІФН БСА → 11 12 S17 S17 S17 S17 S18 S18 S18 S18 S19 S19 S19 S19 S20 S20 S20 S20 Коментарі: Р1: Стандартні антитіла (16 од/мл) Р2: Стандартні антитіла (8 од/мл) РЗ: Стандартні антитіла (4 од/мл) Р4: Стандартні антитіла (2 од/мл) Р5: Стандартні антитіла (1 од/мл) Р6: Стандартні антитіла (0,5 од/мл) Ν: Негативний контрольний зразок - фосфатний буфер, що містить 1 % БСА, 1 % Тритон-Х100 і 0,002 % тимеросалу S1-S20: Досліджувані зразки 1-20 ІФН-γ - рекомбінантний гамма-інтерферон людини БСА - бичачий сироватковий альбумін Потім всі лунки планшету інокулюються 100 мкл розчину, який містять суміш антитіл кози до IgA, IgM, IgG людини (Сігма Алдріх (Sigma Aldrich), Каталог № А-3313), кон'югованих з лужною фосфатазою, яка дозволяє визначити рівень всіх ізотипів природних аутоантитіл до гаммаінтерферону людини, або антитіл кози до IgG миші (Сігма Алдріх (Sigma Aldrich), Каталог № А3562), кон'югованих з лужною фосфатазою для визначення рівня моноклональних антитіл до гамма-інтерферону людини (MD-2), що використовується для побудови калібрувальної кривої. Тоді планшет інкубується протягом 1 години при температурі 37 °C. Після інкубації рідина видаляється з лунок планшету шляхом переливання, а планшет 5 разів промивається стандартним розчином для промивання (фосфатний буфер, що містить 0,05 % Твін-20 і 0,01 % тимеросалу). За 15 хвилин до закінчення інкубації розчином кон'югату, готується розчин хроматичних агентів шляхом розчинення 1 таблетки субстратного буфера і 1 таблетки субстрату (паранітрофенілфосфат) компанії Сігма (Sigma) (Каталог № N-2770) в 20 мл дистильованої води. 100 мкл приготовленого розчину хроматичних агентів інокулюються в кожну лунку планшету, який інкубується протягом 30 хвилин при температурі 37 °C. Після інкубації всі лунки планшету інокулюються зупиняючим розчином (ЗН гідроксиду натрію) компанії Мерк (Merck KGaA) (Каталог № 1.06495), а екстинкція визначається при довжині хвилі 405 нм на стандартному фотометрі. Отримані результати вимірювань використовуються для розрахунку рівня природних аутоантитіл до гамма-інтерферону. Для цього, справжнє значення оптичної щільності (ОЩ) стандартних антитіл і справжнє значення ОЩ досліджуваних зразків визначаються наступним чином: 7 UA 109893 C2 5 1. Розраховується середнє значення ОЩ для негативного контрольного зразка (середнє арифметичне значення ОЩ в лунках 1G, 1Н, 2G, 2Н). 2. Розраховується середнє значення ОЩ для стандартних антитіл (середнє арифметичне значення ОЩ в лунках відповідного стандарту Р1-Р6). 3. Справжнє значення ОЩ стандартних антитіл розраховується як різниця середнього значення ОЩ стандартних антитіл і середнього значення ОЩ негативного контрольного зразка. Результати розрахунків наведено в Таблиці 6. Таблиця 6 1 Р1 Р2 РЗ Р4 Р5 Р6 N N 10 15 20 25 А В С D Ε F G Η 2 1.798 1.253 0.806 0.509 0.284 0.219 0.138 0.139 Середні значення ОЩ: → 1.781 1.311 0.744 0.577 0.338 0.235 0.125 0.129 1.790 1.282 0.775 0.543 0.311 0.227 0.133 ОЩ стандартного антитіла мінус середнє → значення ОЩ негативного контрольного зразка 1.657 1.149 0.642 0.410 0.178 0.094 4. Отримані значення справжньої ОЩ стандартних антитіл були використані для побудови калібрувальної кривої (див. Рисунок 3), де значення ОЩ вказані на осі ординат (у), а на осі абсцис (х) вказується концентрація антитіл до гамма-інтерферону. Побудовану калібрувальну 2 криву можна описати наступним рівнянням: у = - 0.0049x +0.1807х + 0.0184 5. Розраховується середнє значення ОЩ для досліджуваних зразків в лунках планшету, в яких іммобілізується біотинильований ІФН-→ (ряд 3,5,7,9,11 у Таблиці 5), а також БСА (ряд 4,6,8,10,12 у Таблиці 5). Наприклад, для досліджуваного зразка S1, середнє значення ОЩ розраховується в лунках A3, ВЗ і А4, В4, відповідно. 6. Справжнє значення ОЩ розраховується для досліджуваних зразків як різниця середнього значення ОЩ для досліджуваних зразків, що вимірюється в лунках планшету, де іммобілізується біотинильований ІФН-→, а середнє значення ОЩ для досліджуваних зразків вимірюється в лунках планшету, де іммобілізується біотинильований БСА. Наприклад, для досліджуваного зразка S1, середнє значення ОЩ, що вимірюється в лунках планшету А4, В4, віднімається від середнього значення ОЩ, що вимірюється в лунках планшету A3, ВЗ. 7. Калібрувальна крива (Рисунок 3) використовується для визначення концентрації розбавлених природних аутоантитіл до гамма-інтерферону людини у досліджуваних зразках. Для отримання справжніх значень концентрації природних аутоантитіл до гамма-інтерферону людини у досліджуваних зразках, отриманий результат множиться на ступінь розведення зразка (на 100). Результати наведено в Таблиці 7. 30 Таблиця 7 Досліджуваний зразок S1 S2 S3 S4 S5 S6 S7 S8 S9 Концентрація природних аутоантитіл до гаммаінтерферону людини, УОВ/мл 744.4 935.6 876.8 563.9 1001.1 957.6 1019.1 794.7 592.5 8 UA 109893 C2 Таблиця 7 Досліджуваний зразок S10 S11 S12 S13 S14 S15 S16 S17 S18 S19 S20 5 Концентрація природних аутоантитіл до гаммаінтерферону людини, УОВ/мл 1088.8 1116.4 1006.8 1036.6 428.0 422.2 1433.9 1042.9 1354.5 702.5 1344.2 Таким чином, наведені приклади застосування сироватки крові, що містить природні аутоантитіла до гамма-інтерферону людини, доводять ефективність і надійність кількісного визначення рівня природних аутоантитіл до гамма-інтерферону людини при реалізації заявленої сукупності ознак. Крім того, додаткова обробка досліджуваної біологічної рідини підвищує ефективність заявленого методу, що випливає з Прикладу 3. ФОРМУЛА ВИНАХОДУ 10 15 20 25 30 35 1. Спосіб кількісного визначення рівня природних аутоантитіл в біологічних рідинах людини за допомогою імуноферментного аналізу, який включає обробку твердої фази фізичної сорбції антигеном, внесення досліджуваних біологічних зразків, обробку твердої фази розчином кон'югатів, розділення твердої і рідкої фаз, а також спектрофотометричний аналіз реакції за екстинкцією розчину хромагента, який відрізняється тим, що як тверду фазу фізичної сорбції використовують тверду фазу фізичної сорбції, покриту стрептавідином, а обробку твердої фази фізичної сорбції проводять попередньо біотинильованим антигеном і блокуючим агентом для закриття на твердій фазі фізичної сорбції місць неспецифічного зв'язування, для чого використовують біотинильовані за стандартною процедурою білки, причому як розчин кон'югатів використовують моноклональні або поліклональні антитіла, мічені ферментом, що реагують з одним або всіма ізотипами імуноглобулінів людини, а біологічну рідину, яка тестується, попередньо розводять у буфері, що містить білки, які забезпечують закриття на твердій фазі фізичної сорбції місць неспецифічного зв'язування, де як білки використовують бичачий сироватковий альбумін або людський сироватковий альбумін, а також містить речовини, які захищають природні аутоантитіла від руйнування при термічній обробці, де як речовини використовують консервант, тимеросал та поверхнево-активну речовину, Triton-X100, і піддають термічній обробці, для кожного досліджуваного зразка біологічної рідини використовують контрольну тверду фазу фізичної сорбції, на якій не іммобілізовано біотинильований антиген, а кількість природних аутоантитіл визначають за допомогою калібрувальної кривої, яка будується з використанням моноклональних або поліклональних антитіл до антигену. 2. Спосіб кількісного визначення рівня природних аутоантитіл в біологічних рідинах людини згідно з пунктом 1, який відрізняється тим, що перед термічною обробкою, досліджувану біологічну рідину, розведену у буфері, що містить бичачий сироватковий альбумін або людський сироватковий альбумін, які використовують для закриття на твердій фазі фізичної сорбції місць неспецифічного зв'язування, і тимеросал та Triton-X100, які захищають природні аутоантитіла від руйнування під час термічної обробки, додатково піддають впливу залізовмісним окислювачам. 9 UA 109893 C2 10 UA 109893 C2 Комп’ютерна верстка Л. Ціхановська Державна служба інтелектуальної власності України, вул. Василя Липківського, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 11
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod for quantitative determination of the level of natural autoantibodies in human biological fluids by enzymoimmunoassay
Автори англійськоюSergeeva, Svetlana Alexandrovna, Tarasov, Sergei Alexandrovich, Tarasov, Alexander Vladimirovich, van der Meide, Peter H.
Назва патенту російськоюСпособ количественного определения уровня естественных аутоантител в биологических жидкостях человека с помощью иммуноферментного анализа
Автори російськоюСергеева Светлана Александровна, Тарасов Сергей Александрович, Тарасов Александр Владимирович, ван дер Мейде Петер Х.
МПК / Мітки
МПК: G01N 1/44, G01N 33/573, G01N 1/38
Мітки: рівня, кількісного, людини, аналізу, аутоантитіл, імуноферментного, природних, рідинах, визначення, спосіб, біологічних, допомогою
Код посилання
<a href="https://ua.patents.su/13-109893-sposib-kilkisnogo-viznachennya-rivnya-prirodnikh-autoantitil-v-biologichnikh-ridinakh-lyudini-za-dopomogoyu-imunofermentnogo-analizu.html" target="_blank" rel="follow" title="База патентів України">Спосіб кількісного визначення рівня природних аутоантитіл в біологічних рідинах людини за допомогою імуноферментного аналізу</a>
Попередній патент: Спосіб термомеханічної обробки титанового сплаву (варіанти)
Наступний патент: Застосування інгібітора сукцинатдегідрогенази в обробці видів рослин сімейства злаки
Випадковий патент: Труба теплообмінника