Кристалічний безводний мікофенолят мофетилу, фармацевтичний склад та набір, які придатні для одержання внутрішньовенної композиції
Номер патенту: 49797
Опубліковано: 15.10.2002
Автори: Ріццоліо Мікелє К., Леунг Ді-Мей, Флітмен Джеффрі С., Фу Роджер Чернг
Формула / Реферат
1. Кристаллический безводный микофенолят мофетила формулы
,
причем указанное соединение образует комплекс в виде соли, где анион выбран из группы, включающей хлорид, сульфат, фосфат и ацетат.
2. Микофенолят мофетила по п. 1, в котором анион является хлоридом.
3. Микофенолят мофетила по п. 2, характеризующийся температурой плавления от приблизительно 145° до приблизительно 155° С.
4. Микофенолят мофетила по п. 1, представляющий собой гидрохлорид 2-(4-морфолино)-этил-Е-6-(1,3-дигидро-4-гидрокси-6-метокси-7-метил-3-оксо-5-изобензофуранил)-4-метил-4-гексеноата.
5. Фармацевтический состав, пригодный для получения водной внутривенной композиции, включающий кристаллический безводный микофенолят мофетила формулы
,
где указанное соединение образует комплекс в виде соли, где анион выбран из группы, включающей хлорид, сульфат, фосфат и ацетат, а указанная соль представлена в кристаллической безводной форме, и фармацевтически приемлемые эксципиенты.
6. Фармацевтический состав по п. 5, в котором единственным фармацевтически приемлемым эксципиентом является полисорбат 80.
7. Фармацевтический состав по п. 5, в котором фармацевтически приемлемыми эксципиентами являются полисорбат 80 и лимонная кислота.
8. Набор, пригодный для получения внутривенной композиции, включающий
а) кристаллический безводный микофенолят мофетила формулы
,
где указанное соединение образует комплекс в виде соли, где анион выбран из группы, включающей хлорид, сульфат, фосфат и ацетат, а указанная соль представлена в кристаллической безводной форме, и фармацевтически приемлемые эксципиенты, и
б) необходимое количество жидкой среды.
Текст
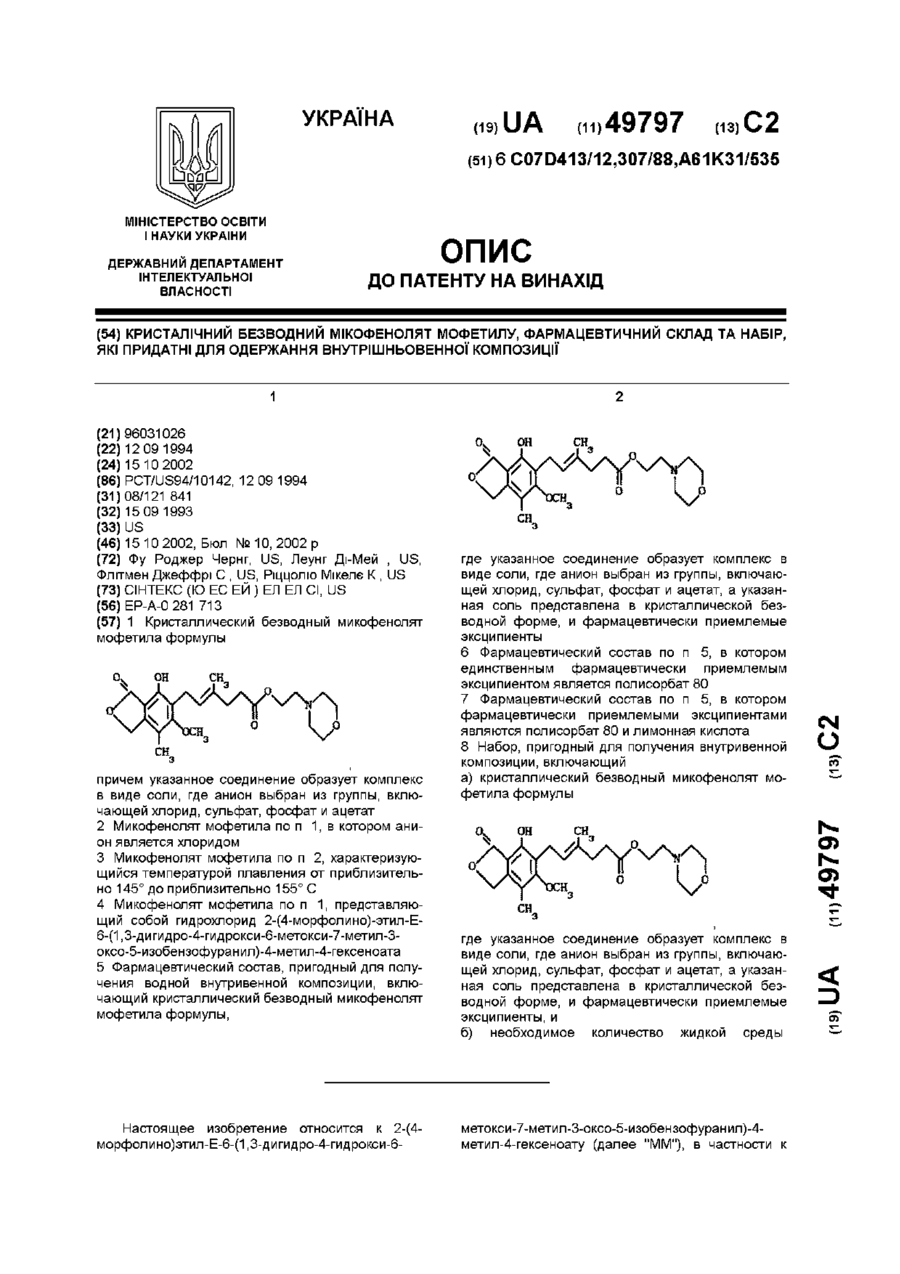
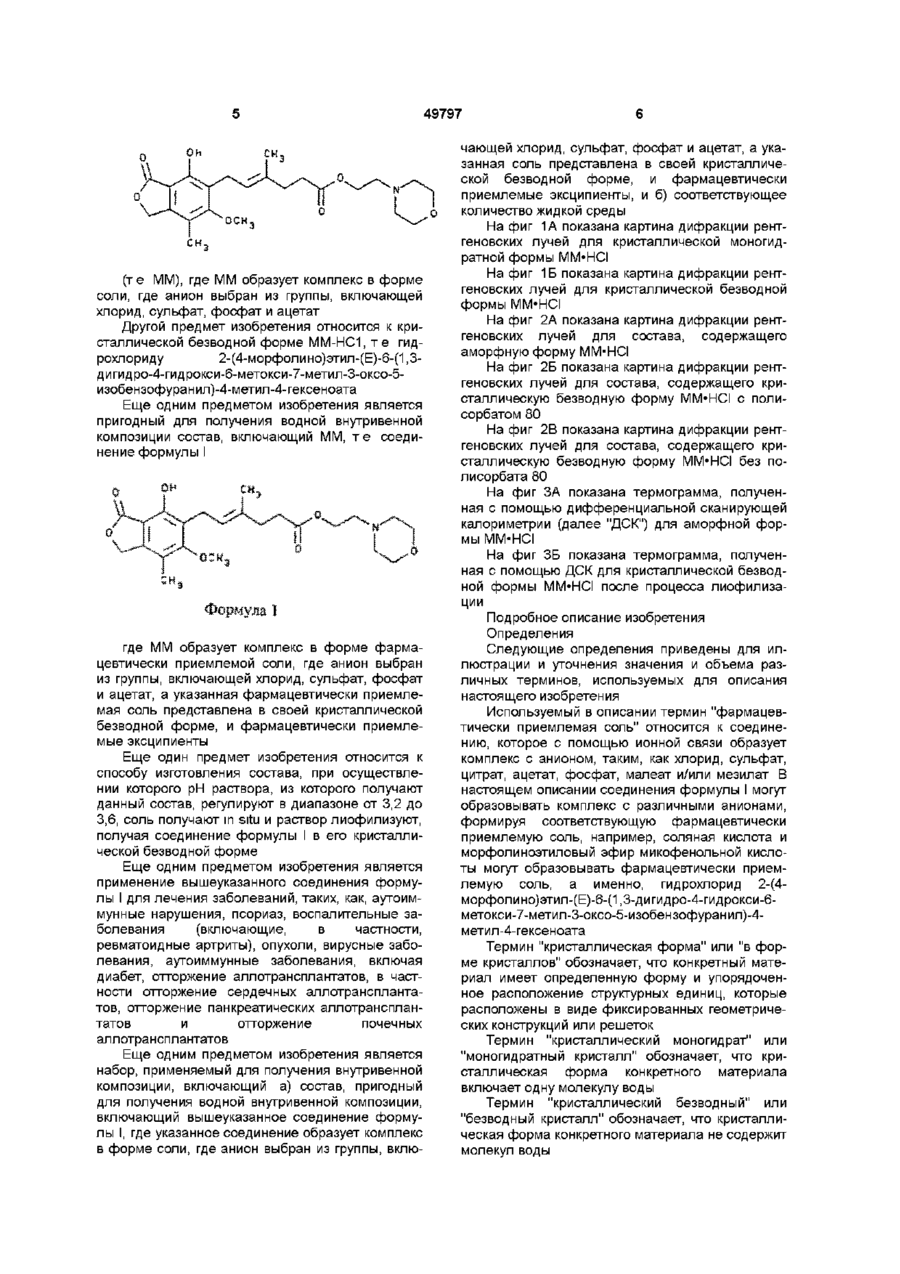
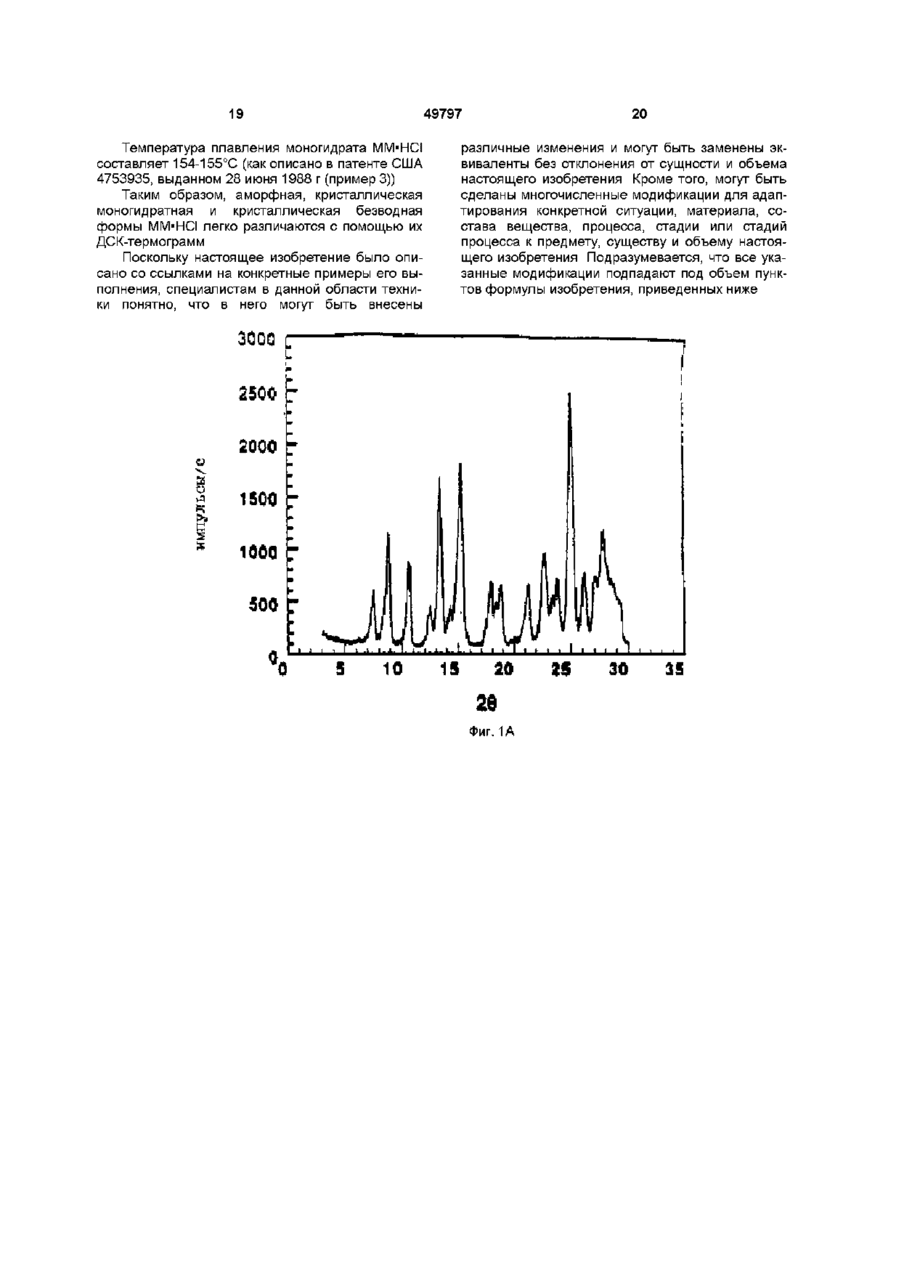
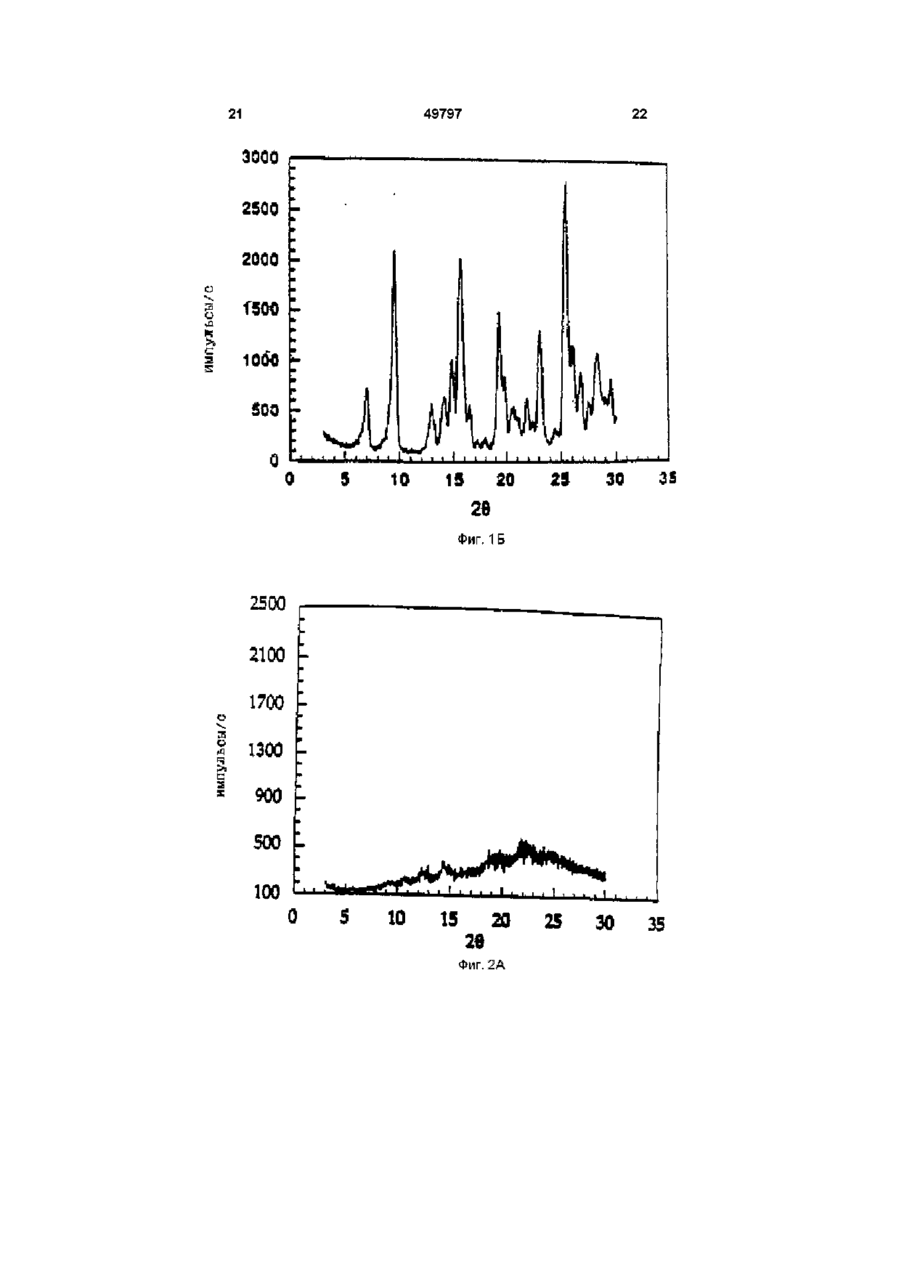
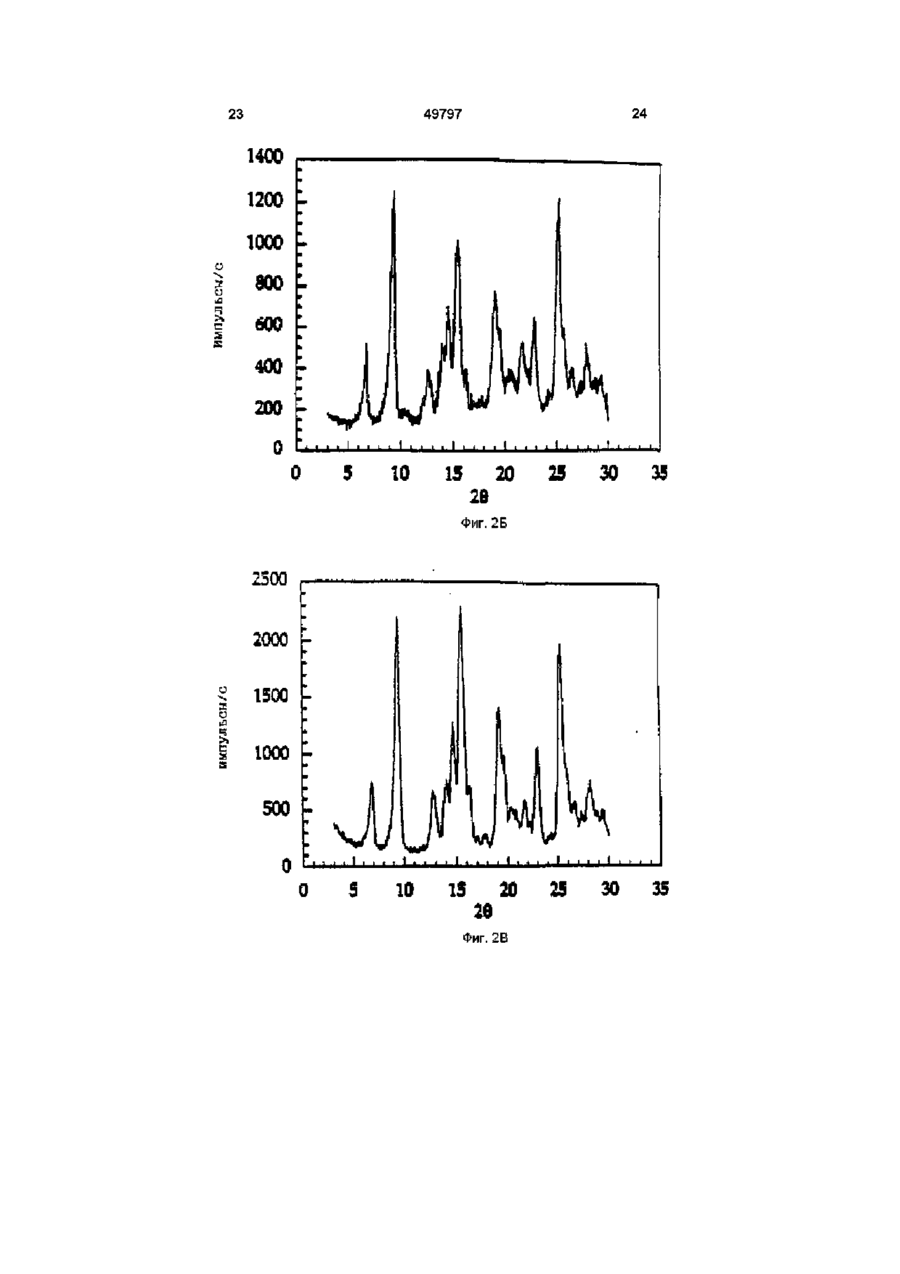
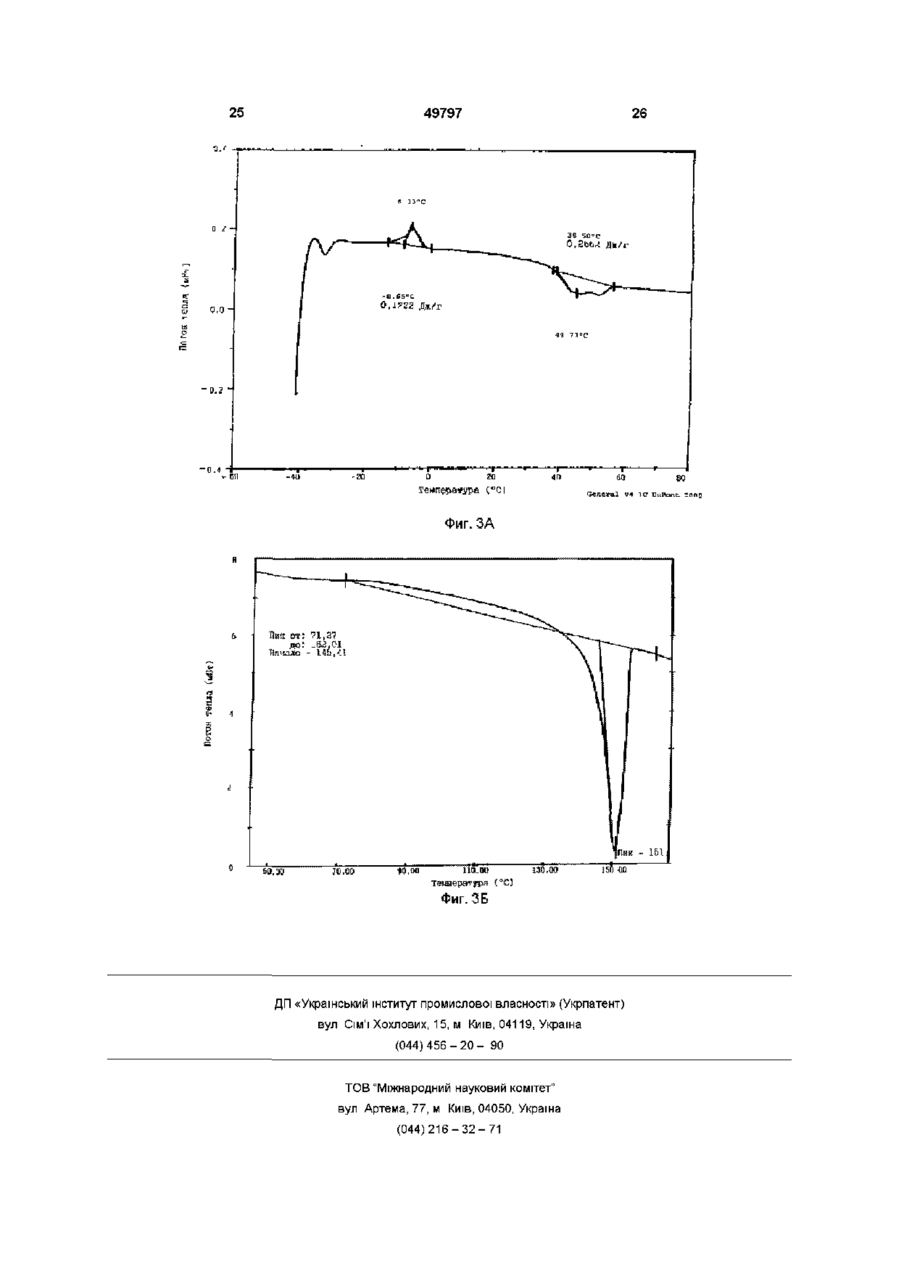
1 Кристаллический безводный микофенолят мофетила формулы ov он причем указанное соединение образует комплекс в виде соли, где анион выбран из группы, включающей хлорид, сульфат, фосфат и ацетат 2 Микофенолят мофетила по п 1, в котором анион является хлоридом 3 Микофенолят мофетила по п 2, характеризующийся температурой плавления от приблизительно 145° до приблизительно 155° С 4 Микофенолят мофетила по п 1, представляющий собой гидрохлорид 2-(4-морфолино)-этил-Е6-(1,3-дигидро-4-гидрокси-6-метокси-7-метил-3оксо-5-изобензофуранил)-4-метил-4-гексеноата 5 Фармацевтический состав, пригодный для получения водной внутривенной композиции, включающий кристаллический безводный микофенолят мофетила формулы, Настоящее изобретение относится к 2-(4морфолино)этил-Е-6-(1,3-дигидро-4-гидрокси-6 он где указанное соединение образует комплекс в виде соли, где анион выбран из группы, включающей хлорид, сульфат, фосфат и ацетат, а указанная соль представлена в кристаллической безводной форме, и фармацевтически приемлемые эксципиенты 6 Фармацевтический состав по п 5, в котором единственным фармацевтически приемлемым эксципиентом является полисорбат 80 7 Фармацевтический состав по п 5, в котором фармацевтически приемлемыми эксципиентами являются полисорбат 80 и лимонная кислота 8 Набор, пригодный для получения внутривенной композиции, включающий а) кристаллический безводный микофенолят мофетила формулы о 1 где указанное соединение образует комплекс в виде соли, где анион выбран из группы, включающей хлорид, сульфат, фосфат и ацетат, а указанная соль представлена в кристаллической безводной форме, и фармацевтически приемлемые эксципиенты, и б) необходимое количество жидкой среды метокси-7-метил-3-оксо-5-изобензофуранил)-4метил-4-гексеноату (далее "ММ"), в частности к 49797 ММ в форме его безводной кристаллической соли Изобретение также относится к внутривенным композициям для введения ММ и способу получения внутривенных композиций с использованием соли ММ в ее кристаллической безводной форме, где соль получают in situ и лиофилизуют Изобретение также относится к применению таких композиций для лечения аутоиммунных нарушений, псориаза, воспалительных заболеваний (включающих, в частности, ревматоидные артриты), опухолей и вирусных заболеваний и для иммуносупрессии, в частности для лечения отторжения аллотрансплантатов, прежде всего отторжения сердечных аллотрансплантатов, отторжения панкреатических аллотрансплантатов и отторжения почечных аллотрансплантатов, а также для лечения аутоиммунных заболеваний, включая диабет В патенте США 4753935, выданном 28 июня 1988 г, озаглавленном "Morphohnoethyl Esters of Mycophenohc Acid and Pharmaceutical Compositions", описан мофетил микофенолята, т е морфолиноэтиловый эфир микофенольнои кислоты, и некоторые представители ее эфирных производных В патенте США 4808592, выданном 28 февраля 1989 г, озаглавленном "Method of Treating Diseases by Administering Morphohnoethyl Ester of Mycophenohc Acid and Derivatives Thereof", описан способ лечения воспалительных болезней и псориазов у млекопитающих путем введения терапевтически эффективного количества мофетила микофенолята, т е морфолиноэтилового эфира микофенольнои кислоты, или некоторого представителя ее эфирного производного В патенте США 4952579, выданном 28 августа 1990 г, озаглавленном "Method of Treating Diseases by Administering Morphohnoethyl Ester of Mycophenohc Acid and Derivatives Thereof", описан способ лечения злокачественных заболеваний у млекопитающих с помощью применения терапевтически эффективного количества мофетила микофенолята, т е морфолиноэтилового эфира микофенольнои кислоты, или некоторых представителей ее эфирных производных В патенте США 4786637, выданном 22 ноября 1988 г, озаглавленном "Treatment of Allograft Rejection with Mycophenohc Acid Morphohnoethyl Ester and Derivatives Thereof", описан способ лечения отторжения аллотрансплантатов у млекопитающих путем введения терапевтически эффективного количества мофетила микофенолята, т е морфолиноэтилового эфира микофенольнои кислоты, или некоторых представителей ее эфирных производных В патенте США 4948793, выданном 14 августа 1990 г, озаглавленном "Treatment of Autoimmune Diseases with the Morphohnoethyl Ester of Mycophenohc Acid and Derivatives Thereof", описан способ лечения аутоиммунных заболеваний путем введения терапевтически эффективного количества мофетила микофенолята, т е морфолиноэтилового эфира микофенольнои кислоты, или некоторых представителей ее эфирных производных В патенте США 4992467, выданном 12 февраля 1991 г, озаглавленном "Treatment of Autoim mune Diseases with Mycophenohc Acid and Derivatives and Formulations Thereof", описан способ лечения аутоиммунных заболеваний у млекопитающих путем введения терапевтически эффективного количества некоторых представителей фенольных эфиров микофенольнои кислоты Все вышеуказанные патенты США включены в настоящее описание в качестве ссылок Микофенольная кислота представляет собой слабый антибиотик, найденный в ферментативном бульоне Penicilhum brevi-compactum Было обнаружено, что производные микофенольнои кислоты, в частности ее морфолиноэтиловый эфир [те гидрохлорид 2-(4-морфолино)этил-(Е)6-(1,3-дигидро-4-гидрокси-6-метокси-7-метил-3оксо-5-изобензофуранил)-4-метил-4-гексеноата] и некоторые представители эфирных производных фенольной гидроксильной группы, эффективны при лечении аутоиммунных нарушений, псориаза, воспалительных заболеваний (включающих, в частности, ревматоидные артриты), опухолей, вирусных заболеваний, отторжения аллотрансплантатов, прежде всего отторжения сердечных аллотрансплантатов, отторжения панкреатических аллотрансплантатов и отторжения почечных аллотрансплантатов, а также аутоиммунных заболеваний, включая диабет По сравнению с микофенольнои кислотой эти эфирные производные проявляют улучшенные фармакокинетические свойства, которые усиливают системное введение микофенольнои кислоты, например, растворимость в месте поступления лекарства (например, в желудке), пик концентрации в плазме, максимум концентрации в плазме и улучшенную активность, например, противовоспалительную активность Введение терапевтических агентов с помощью внутривенной композиции хорошо известно в фармацевтической практике Внутривенная композиция должна обладать определенными качествами, а не являться только композицией, в которой растворим терапевтический агент Например, композиция должна обеспечивать общую стабильность действующего вещества (в), изготовление композиции должно быть эффективным сточки зрения стоимости Все эти факторы, в конечном счете, и определяют общую эффективность и полезность внутривенной композиции ММ в форме его моногидратной соли более стабилен, чем ММ в форме его аморфной соли, однако аморфная соль обладает лучшими характеристиками растворимости Неожиданно обнаружено, что впервые открытая безводная кристаллическая форма соли ММ обладает примерно в два раза большей растворимостью по сравнению с моногидратной формой соли, обладая при этом такими же характеристиками стабильности, что и моногидратная форма соли Один предмет изобретения относится к кристаллическому безводному соединению формулы 49797 (те ММ), где ММ образует комплекс в форме соли, где анион выбран из группы, включающей хлорид, сульфат, фосфат и ацетат Другой предмет изобретения относится к кристаллической безводной форме ММ-НС1, т е гидрохлориду 2-(4-морфолино)этил-(Е)-6-(1,3дигидро-4-гидрокси-6-метокси-7-метил-3-оксо-5изобензофуранил)-4-метил-4-гексеноата Еще одним предметом изобретения является пригодный для получения водной внутривенной композиции состав, включающий ММ, т е соединение формулы I где ММ образует комплекс в форме фармацевтически приемлемой соли, где анион выбран из группы, включающей хлорид, сульфат, фосфат и ацетат, а указанная фармацевтически приемлемая соль представлена в своей кристаллической безводной форме, и фармацевтически приемлемые эксципиенты Еще один предмет изобретения относится к способу изготовления состава, при осуществлении которого рН раствора, из которого получают данный состав, регулируют в диапазоне от 3,2 до 3,6, соль получают in situ и раствор лиофилизуют, получая соединение формулы І в его кристаллической безводной форме Еще одним предметом изобретения является применение вышеуказанного соединения формулы I для лечения заболеваний, таких, как, аутоиммунные нарушения, псориаз, воспалительные заболевания (включающие, в частности, ревматоидные артриты), опухоли, вирусные заболевания, аутоиммунные заболевания, включая диабет, отторжение аллотрансплантатов, в частности отторжение сердечных аллотрансплантатов, отторжение панкреатических аллотрансплантатов и отторжение почечных аллотрансплантатов Еще одним предметом изобретения является набор, применяемый для получения внутривенной композиции, включающий а) состав, пригодный для получения водной внутривенной композиции, включающий вышеуказанное соединение формулы I, где указанное соединение образует комплекс в форме соли, где анион выбран из группы, вклю чающей хлорид, сульфат, фосфат и ацетат, а указанная соль представлена в своей кристаллической безводной форме, и фармацевтически приемлемые эксципиенты, и б) соответствующее количество жидкой среды На фиг 1А показана картина дифракции рентгеновских лучей для кристаллической моногидратной формы MM'HCI На фиг 1Б показана картина дифракции рентгеновских лучей для кристаллической безводной формы ММ-НСІ На фиг 2А показана картина дифракции рентгеновских лучей для состава, содержащего аморфную форму ММ'НСІ На фиг 2Б показана картина дифракции рентгеновских лучей для состава, содержащего кристаллическую безводную форму ММ'НСІ с полисорбатом 80 На фиг 2В показана картина дифракции рентгеновских лучей для состава, содержащего кристаллическую безводную форму ММ'НСІ без полисорбата 80 На фиг ЗА показана термограмма, полученная с помощью дифференциальной сканирующей калориметрии (далее "ДСК") для аморфной формы ММ-НСІ На фиг ЗБ показана термограмма, полученная с помощью ДСК для кристаллической безводной формы ММ'НСІ после процесса лиофилизации Подробное описание изобретения Определения Следующие определения приведены для иллюстрации и уточнения значения и объема различных терминов, используемых для описания настоящего изобретения Используемый в описании термин "фармацевтически приемлемая соль" относится к соединению, которое с помощью ионной связи образует комплекс с анионом, таким, как хлорид, сульфат, цитрат, ацетат, фосфат, малеат и/или мезилат В настоящем описании соединения формулы I могут образовывать комплекс с различными анионами, формируя соответствующую фармацевтически приемлемую соль, например, соляная кислота и морфолиноэтиловый эфир микофенольной кислоты могут образовывать фармацевтически приемлемую соль, а именно, гидрохлорид 2-(4морфолино)этил-(Е)-6-(1,3-дигидро-4-гидрокси-6метокси-7-метил-3-оксо-5-изобензофуранил)-4метил-4-гексеноата Термин "кристаллическая форма" или "в форме кристаллов" обозначает, что конкретный материал имеет определенную форму и упорядоченное расположение структурных единиц, которые расположены в виде фиксированных геометрических конструкций или решеток Термин "кристаллический моногидрат" или "моногидратный кристалл" обозначает, что кристаллическая форма конкретного материала включает одну молекулу воды Термин "кристаллический безводный" или "безводный кристалл" обозначает, что кристаллическая форма конкретного материала не содержит молекул воды 49797 Термин "аморфная форма" обозначает, что конкретный материал не имеет ни определенной формы, ни упорядоченного расположения структурных единиц Термин "фармацевтически приемлемые эксципиенты" относится к таким материалам, которые пригодны для использования в фармацевтических композициях и которые добавляют к композиции для обеспечения стабильности и долговечности данной композиции (например, наполнители, осветляющие агенты и забуферивающие агенты) Термин "наполнитель" относится к таким веществам, как декстроза, маннит и/или сахароза, которые применяют для придания объема, обеспечивая структурную основу, и для стабилизации композиции, т е для замедления или предотвращения разложения терапевтического агента Термин "осветляющий агент" относится к соединениям типа поверхностно-активных веществ, таким, как полисорбат 80, которые используют для снижения помутнения раствора Термин "забуферивающий агент" относится к соединениям, которые препятствуют изменению значения рН при добавлении Н+ или ОН Забуферивающий агент в наибольшей степени препятствует изменению рН в точной средней точке кривой титрования, т е когда концентрация протонного акцептора равна таковой протонного донора и значение рН равно рК' (показателю кислотности) Забуферивающий агент может быть индивидуальным соединением, например, лимонной кислотой, или комбинацией соединений Термин "д к" обозначает добавление количества, достаточного для достижения определенного состояния (например, объема, т е доведение раствора до требуемого объема) Термин "д к до рН" обозначает добавление кислоты или основания в количестве, достаточном для доведения раствора до требуемого рН (например, д к до рН 3,4 обозначает добавление кислоты или основания для доведения раствора до рН 3,4) Термин "ВИ" относится к воде для инъекций, которая удовлетворяет требованиям, изложенным в Фармакопее США (U S Р ) Термин "градиент скорости" обозначает скорость, с которой изменяется температура (например, увеличивается или уменьшается) в некотором диапазоне температур Термин "восстановление" относится к способу, при котором состав объединяют с соответствующей жидкой средой, например, водой (ВИ), 5%ным раствором декстрозы или физиологическим раствором, для получения внутривенного раствора Термин "лечение" или "лечить" обозначает любое лечение болезни у млекопитающего и включает (I) предотвращение болезни, т е остановку развития клинических симптомов болезни, (II) ингибирование болезни, т е задержку развития клинических симптомов, и/или (III) облегчение болезни, т е обеспечение регрессии клинических симптомов 8 Термин "терапевтически эффективное количество" относится к такому количеству ММ, которое при введении млекопитающему при необходимости такого введения достаточно для осуществления назначенного лечения Количество, которое составляет "терапевтически эффективное количество", варьируется в зависимости от конкретного соединения, состояния или болезни и ее серьезности и млекопитающего, подвергающегося лечению, и может быть определено стандартным образом обычным специалистом в данной области техники на основе современного уровня знаний и настоящего описания Термин "% (вес/объем)" обозначает процентное соотношение веса (г) одного ингредиента к общему объему всей композиции, например, 500мг ингредиента в общем объеме 8мл составляет 6,25% (вес/об) или 500мг ингредиента в общем объеме 5мл составляет 10% (вес/об ) Термин "об %" обозначает процентное соотношение объема одного ингредиента к общему объему всей композиции, например, 1,17мл ингредиента в общем объеме 8мл составляет 14,боб % или 1,17мл ингредиента в общем объеме 5мл составляет 23,4об % Номенклатура Структура и принятая нумерация для мофетила микофенолята "ММ", также известного как морфолиноэтиловый эфир микофенольной кислоты [т е 2-(4-морфолино)этил-Е-6-(1,3-дигидро-4гидрокси-6-метокси-7-метил-3-оксо-5изобензофуранил)-4-метил-4-гексеноат], следующие Исходные материалы Морфолиноэтиловый эфир микофенольной кислоты и некоторых представителей ее эфирных производных получают в соответствии с патентом США 4753935, выданным 28 июня 1988 г, озаглавленным "Morphohnoethyl Esters of Mycophenolic Acid and Pharmaceutical Compositions", ранее включенным в настоящее описание в качестве ссылки, или в соответствии с описанием, изложенным в находившейся в процессе одновременного рассмотрения заявке, зарегистрированной под порядковым номером 07/993146 и поданной 18 декабря 1992 г, ныне в патенте США 5247083, включенном в настоящее описание в качестве ссылки Полисорбат 80 поставляется на рынок под товарным знаком "Tween 80®" (русское название "Твин 80") фирмой ICI Americas, Inc , Wilmington, Delaware 49797 Лимонная кислота, гидроксид натрия (NaOH) и соляная кислота (HCI) требуемой чистоты поставляется фирмой Aldnch Chemical Company Вода для инъекции (ВИ) обозначает воду, удовлетворяемую стандартам чистоты для инъецируемых растворов, изложенным в Фармакопее США Обзор способов получения композиций В результате процесса, с помощью которого объединяют ингредиенты композиции, известного как "смешение", получают раствор с увеличенным объемом Раствор с увеличенным объемом подвергают лиофилизации [те процессу, при котором при пониженном давлении и изменяемых температурных условиях удаляют воду и/или растворитель (например, метанол, этанол или изопропанол)], получая "состав" Внутривенную композицию восстанавливают непосредственно перед использованием из данного состава с помощью пригодной жидкой среды Затем осуществляют введение внутривенной композиции Получение состава, в котором ММ'НСІ находится в своей кристаллической безводной форме Процесс смешения Приблизительно 23-25,3% (вес/об) кислоты, предпочтительно приблизительно 24,4% (вес/об) 1Н НСІ (если используют концентрированную НСІ, то используют пропорционально меньший ее процент) и приблизительно 0,05-0,5% (вес/об), предпочтительно примерно 0,1% (вес/об) лимонной кислоты добавляют к объему воды, пригодной для инъекции (ВИ), приблизительно соответствующему 50% конечного объема раствора с увеличенным объемом [например, для приготовления конечного раствора с увеличенным объемом, имеющего объем Юл, используют 5,0л воды (ВИ)] В этом растворе растворяют приблизительно 0,012,0%(вес/об), предпочтительно приблизительно 0,5%(вес/об) осветляющего агента, такого, как полисорбат 80, и приблизительно 10%(вес/об )ММ и приблизительно 0,10-10,0об %, предпочтительно приблизительно 3,2об % этанола Значение рН раствора регулируют до рН, равного приблизительно 3,4, с использованием 1Н НСІ или 2Н NaOH соответственно Добавляют достаточное количество пригодной для инъекции воды (ВИ), доводя объем раствора с придающими объем наполнителями до требуемого конечного объема (например, для партии из 2000 пузырьков объемом 20куб см, содержащих по 5куб см раствора на пузырек, конечный объем раствора с увеличенным объемом составляет 10 литров) Значение рН данного раствора вновь регулируют до рН, равного приблизительно 3,4 Раствор фильтруют в стерильных условиях (например, с использованием мембранного фильтра с размером ячеек 0,2мкм) Раствор с увеличенным объемом разливают в отдельные пузырьки, причем объем налитого раствора составляет приблизительно 25% от объема пузырька (т е в пузырек объемом 20куб см наливают приблизительно 5мл раствора с увеличенным объемом) и пузырьки частично закрывают с помощью лиофилизационной пробки (те пробки, пригодной для лиофилизации) для проведения лиофилизации раствора 10 Цикл лиофилизации для кристаллической безводной формы Пузырьки, закупоренные лиофилизационной пробкой, содержащие раствор с увеличенным объемом, лиофилизуют в соответствии со следующей процедурой (температуру измеряют на полке, где расположены пузырьки внутри камеры для лиофилизации) а Перед размещением пузырьков температуру устанавливают в диапазоне от примерно 22°С до примерно 28°С, предпочтительно на уровне примерно 25°С Указанную температуру поддерживают во время наполнения пузырьков После завершения наполнения указанную температуру поддерживают в течение приблизительно 10-30 минут, предпочтительно приблизительно 20 минут б Температуру понижают до уровня, находящегося в диапазоне приблизительно от 5°С до 15°С, предпочтительно до приблизительно -10°С, в течение приблизительно 1-3 часов, предпочтительно в течение приблизительно 2 часов 20 минут ( т е с градиентом скорости приблизительно 0,25°С/мин) в Температуру поддерживают в диапазоне приблизительно от 5°С до -15°С, предпочтительно на уровне приблизительно -10°С, в течение приблизительно 1,5-3,5ч, предпочтительно в течение приблизительно 2 часов 30 минут г Температуру понижают до уровня, находящегося в диапазоне приблизительно от -37°С до 43°С, предпочтительно до приблизительно -40°С, в течение 1-3,5 часов, предпочтительно в течение приблизительно 2 часов ( т е с градиентом скорости приблизительно -0,25°С/мин) д Температуру поддерживают в диапазоне приблизительно от -37°С до -43°С, предпочтительно на уровне приблизительно -40°С, в течение приблизительно 3-7 часов, предпочтительно в течение приблизительно 5 часов е Давление в камере для лиофилизации снижают до уровня, находящегося в диапазоне приблизительно от 70 до 130мторр, предпочтительно до приблизительно ЮОмторр ж После достижения требуемого давления в камере для лиофилизации температуру поддерживают в диапазоне приблизительно от -20°С до 60°С, предпочтительно на уровне приблизительно -40°С, в течение приблизительно 3-7 часов, предпочтительно в течение приблизительно 5 часов з Температуру повышают до уровня, находящегося в диапазоне приблизительно от -13°С до 19°С, предпочтительно до приблизительно -16°С, в течение приблизительно 6-10 часов, предпочтительно в течение приблизительно 8 часов ( т е с градиентом скорости приблизительно 0,05°С/мин) и поддерживают эту температуру дополнительно в течение 8-12, предпочтительно в течение приблизительно 10 часов и Температуру повышают до уровня, находящегося в диапазоне приблизительно от 50°С до 78°С, предпочтительно до приблизительно 70°С, в течение приблизительно 5-9 часов, предпочтительно в течение приблизительно 7 часов 10 минут (те с градиентом скорости приблизительно 11 0,20°С/мин) и поддерживают эту температуру до завершения стадии л к Температуру поддерживают до тех пор, пока все термопары, контролирующие продукт (т е датчики температуры, прикрепленные к пузырькам), не будут находиться в диапазоне температур приблизительно от 57°С до 63°С в течение по крайней мере 7-13 часов л Температуру понижают до уровня, находящегося в диапазоне приблизительно от 22°С до 28°С, предпочтительно до приблизительно 25°С, в течение приблизительно 2-4 часов, предпочтительно в течение приблизительно 3 часов ( т е с градиентом скорости приблизительно -0,25°С/мин) и поддерживают эту температуру в течение приблизительно 1-3 часов, предпочтительно в течение приблизительно 2 часов м Давление в камере для лиофилизации медленно повышают до давления, находящегося в диапазоне приблизительно от 3 до 12 фунт/кв дюйм, предпочтительно до давления приблизительно от 4 до 8 фунт/кв дюйм, более предпочтительно до приблизительно 4 фунт/кв дюйм, с использованием азота (NF) в течение периода времени, составляющим не менее приблизительно 15 минут Пузырьки закупоривают при парциальном давлении н Давление в камере для лиофилизации повышают до атмосферного давления Если нет необходимости в разгрузке камеры после закупоривания, пузырьки можно выдерживать при температуре, находящейся в диапазоне от 23 до 27°С, предпочтительно при приблизительно 25°С, максимум до 24 часов Пузырьки герметично запечатывают обжимом Состав хранят в запечатанных пузырьках до восстановления непосредственно перед применением Получение внутривенной композиции для введения Внутривенную композицию готовят путем восстановления описанного выше состава с помощью подходящей жидкой среды, такой, как вода для инъекции (ВИ) или 5%-ный раствор декстрозы Требуемая концентрация внутривенной композиции может быть получена путем восстановления соответствующего количества состава соответствующим объемом жидкой среды Требуемая концентрация внутривенной композиции обеспечивает терапевтически эффективное количество ММ для животного при необходимости использования указанной внутривенной фармацевтической композиции по изобретению и поддерживает терапевтически эффективный уровень действующего вещества в животном Доза, которая является терапевтически эффективной, зависит от скорости, с которой внутривенная композиция вводится животному, и от концентрации внутривенной композиции Например, два пузырька, содержащие состав [например, 500мг ММ на пузырек (что эквивалентно 542мг ММ'НСІ)] восстанавливают 5%ным раствором декстрозы (14мл 5%-ного раствора декстрозы на пузырек), получая в целом 28мл раствора Этот восстановленный раствор вводят в растворе декстрозы в емкость для вливания и 49797 12 доводят до объема 166мл, получая раствор, содержащий бмг/мл ММ, пригодный для введения путем внутривенного вливания Предпочтительная концентрация ММ в жидкой среде в емкости для вливания составляет от приблизительно 3 до приблизительно 10мг/мл, предпочтительно от приблизительно 5 до приблизительно бмг/мл В растворах не происходит существенной потери указанной в маркировке концентрации (% ЭК) в течение 24 часов после приготовления и хранения при 25°С Следует отметить, что согласно существующей фармацевтической практике восстановленные растворы должны быть введены сразу после восстановления, хотя стабильность восстановленного раствора такова, что она не оказывает нежелательных эффектов, если введение задерживается Состав по изобретению может поставляться специалисту по приготовлению лекарства, например, в аптеке или больнице, в пузырьке, содержащем данный состав, или в виде набора, включающего пузырек или пузырьки, содержащие данный состав и соответствующее количество жидкой среды Предпочтительные варианты выполнения изобретения Наиболее предпочтительной является кристаллическая безводная форма гидрохлоридной соли морфолиноэтилового эфира микофенольнои кислоты, т е гидрохлорид 2-(4-морфолино)этил-Е6-(1,3-дигидро-4-гидрокси-6-метокси-7-метил-3оксо-5-изобензофуранил) -4-метил-4-гексеноата Также наиболее предпочтительным является состав, содержащий ММ'НСІ в кристаллической безводной форме, и фармацевтически приемлемые эксципиенты Предпочтительные способы Предпочтительным способом смешения (те получение раствора с увеличенным объемом) является таковой, при котором температуру поддерживают на уровне приблизительно от 21 °С до 33°С Наиболее предпочтительным способом смешения является таковой, при котором температуру поддерживают на уровне приблизительно 25°С±2°С Предпочтительным способом смешения является таковой, при котором рН раствора с увеличенным объемом регулируют на уровне 3,4±0,5 Наиболее предпочтительным способом смешения является таковой, при котором рН раствора с увеличенным объемом регулируют на уровне 3,4±0,2 Для получения фармацевтического состава с кристаллической безводной формой ММ'НСН предпочтительным является цикл лиофилизации, при котором температуру понижают от 25°С до температуры, находящейся в диапазоне от 5°С до -15°С с градиентом скорости, равным 0,25°С/мин±0,1°С Наиболее предпочтительным диапазоном температур является диапазон от 25°С до -10°С с градиентом скорости, равным -0,25°С/мин±0,05°С Для получения фармацевтического состава с кристаллической безводной формой 13 49797 MM'HCI предпочтительным является цикл лиофилизации, при котором температуру понижают от температуры, находящейся на уровне 5°С, до температуры, находящейся в диапазоне от 15°С до -40°С, с градиентом скорости, равным 0,25°С/мин±0,1°С Наиболее предпочтительным диапазоном температур является диапазон от -10°С до -40°С с градиентом скорости, равным -0,25°С/мин±0,05°С Для получения фармацевтического состава с кристаллической безводной формой ММ'НСІ, предпочтительным является цикл лиофилизации, при котором температуру повышают в диапазоне от -16°С до 70°С с градиентом скорости, равным 0,20°С/мин±0,1°С Наиболее предпочтительным диапазоном температур является диапазон от -16°С до 70°С с градиентом скорости, равным 0,20°С/мин±0,05°С Применимость Настоящее изобретение пригодно для лечения заболеваний, таких, как, аутоиммунные нарушения, псориаз, воспалительные заболевания (включающие, в частности, ревматоидные артриты), опухоли, вирусные заболевания, аутоиммунные заболевания, включая диабет, отторжение аллотрансплантатов, в частности, отторжение сердечных аллотрансплантатов, отторжение панкреатических аллотрансплантатов и отторжение почечных аллотрансплантатов Примеры Следующие примеры приведены для более ясного понимания специалистами в данной области техники настоящего изобретения и его осуществления Они не должны рассматриваться как ограничивающие объем изобретения, а только как иллюстрирующие и характеризующие его Пример 1 Получение гидрохлорида мофетила микофенолята в его кристаллической безводной форме 1А Получение кристаллического безводного ММ в виде комплекса с хлоридом Гидрохлорид мофетила микофенолята получали аналогично описанному в патенте США 4753935 Е-6-(1,3-дигадро-4-гадрокси-6-метокси-7метил-3-оксо-5-изобензофуранил)-4-метил-4гексеноат (38, Ог) растворяли в изопропаноле (200мл) и этот раствор добавляли к раствору хлористого водорода (10,Ог) в изопропаноле (150мл) Гидрохлоридную соль отфильтровывали и сушили в вакууме (температура плавления 154-155°С) Кристаллическую безводную форму гидрохлорида мофетила микофенолята получали путем нагревания кристаллической моногидратной гидрохлоридной формы ММ'НСІ при 60°С в течение 30 минут Кристаллическая безводная форма указанного соединения была подтверждена с помощью рентгеновской кристаллографии, как показано на фиг 1Б Было обнаружено, что кристаллическая безводная форма гидрохлорида мофетила микофенолята имеет растворимость (при оценке в течение 3 дней) приблизительно 84мг/мл в типичных растворах для внутривенных композиций (например, в 5%-ном растворе декстрозы или в воде, пригодной для инъекций), в то время как кристал 14 лическая моногидратная форма имеет растворимость 40мг/мл 1Б Получение кристаллической безводной соли ММ с различными анионами Аналогично процедуре, описанной в примере 1А, но заменяя анион исходного материала следующими соединениями, а именно кристаллической моногидратной формой сульфата мофетила микофенолята, кристаллической моногидратной формой фосфата мофетила микофенолята и кристаллической моногидратной формой ацетата мофетила микофенолята, получали следующие соединения кристаллическую безводную форму сульфата мофетила микофенолята, кристаллическую безводную форму фосфата мофетила микофенолята и кристаллическую безводную форму ацетата мофетила микофенолята Пример 2 Получение производственной партии состава гидрохлорида мофетила микофенолята в его кристаллической безводной форме 2А Получение производственной партии, состоящей из 2000 пузырьков объемом 20куб см, с использованием 1Н НСІ .. Количество/ Ингредиент пузырек Мофетил микофенолята 500,0мг 1ННСІ 1220,0мг Безводная лимонная кислота 5,0мг Полисорбат 80 25,0мг Этанол (95%)* 0,16мл ВИ*д к 5,0мл 1Н HCI/NaOH д к до рН 3,4 *Удаляется во время лиофилизации Готовили партию (производственный масштаб, 2000 пузырьков объемом 20куб см) состава, содержащего 542мг на пузырек ММ'НСІ (т є 500мг ММ) в его кристаллической безводной форме Ингредиенты объединяли в соответствии со следующей процедурой 1 Объединяли 2440г 1Н НСІ и Юг лимонной кислоты с достаточным количеством воды, пригодной для инъекции (ВИ), получая объем 7,5 литров 2 Растворяли 50г Твин 80 в растворе, полученном на стадии 1 3 Растворяли ЮООг ММ в растворе, полученном на стадии 2 4 Добавляли 320мл этилового спирта к раствору, полученному на стадии 3 5 Регулировали значение рН раствора, полученного на стадии 4, до рН 3,4 (±0,2) 6 Добавляли достаточное количество воды (ВИ) для доведения объема раствора до Юл 7 В стерильных условиях раствор фильтровали, используя два фильтра 10" Milhpore Durapore с размером ячеек 0,2мкм (CVGL) 8 Разливали по 5мл фильтрата, полученного на стадии 7, в 2000 пузырьков для многократной дозы объемом 20куб см (т е по 5мл фильтрата на пузырек объемом 20куб см) и частично закрывали с помощью лиофилизационных пробок 9 Пузырьки загружали в лиофилизатор, в ко 49797 15 тором температура была стабилизирована на уровне 25°С (сушилка типа Dura-Stop MP Freeze Dryer, система FTS) 10 Цикл лиофизации а Измеряли температуру на полке с размещенными на ней наполненными пузырьками и оснащали термопарами различные пузырьки для измерения их температуры б Температуру в камере для лиофилизации устанавливали на уровне 25°С Заполненные пузырьки помещали в камеру для лиофилизации и температуру поддерживали на уровне 25°С в течение 20 минут в Температуру на полке понижали от 25°С до -10°С в течение 2 часов 20 минут (градиент скорости -0,25°С/мин) г Температуру поддерживали на уровне -10°С в течение 2,5 часов д Температуру понижали до -40° С в течение 2 часов (градиент скорости -0,25°С/мин) е Температуру поддерживали на уровне 40°С в течение 5,0 часов ж Давление в камере для лиофилизации снижали до ЮОмторр з После достижения давления 1ООмторр (приблизительно в течение 30 минут) температуру поддерживали на уровне -40°С в течение дополнительных 5 часов и Температуру повышали до -16°С в течение 8 часов (градиент скорости 0,05°С/мин) и поддерживали на уровне -16°С в течение дополнительных 10 часов к Температуру повышали до 70°С в течение 7 часов 10 минут (градиент скорости 0,20°С/мин) и поддерживали на уровне 65°С до тех пор, пока все термопары не показывали температуру 60°С в течение по крайней мере 7 часов (общее время приблизительно 11 часов) л Температуру понижали до 25°С в течение 3 часов (градиент скорости -0,25°С/мин) и поддерживали на уровне 25°С в течение 2 часов м Давление в камере для лиофилизации постепенно повышали до 7,5фунт/кв дюйм с использованием азота (NF) в течение периода времени не менее 15 минут н Пузырьки закупоривали при парциальном давлении о Давление в камере для лиофилизации повышали до атмосферного давления с использованием фильтруемого воздуха 11 Затем пузырьки герметично запечатывали Характеристические аналитические данные подтверждают, что полученный состав содержит ММ'НСІ в кристаллической безводной форме (в соответствии с данными рентгеновской кристаллографии, показанными на фиг 2Б) 2Б Получение производственной партии, состоящей из 2000 пузырьков объемом 20куб см с использованием концентрированной НСІ Количество Ингредиент /пузыре Мофетил микофенолята Концентрированная НСІ 500,0мг 119,25м 16 Безводная лимонная кислота 5,0мг Полисорбат 80 25,0мг Этанол (95%)* 0,16мл ВИ* д к 5,0мл 1Н HCI/NaOH д к до рН 3,4 *Удаляется во время лиофилизации Готовили партию (производственный масштаб, 2000 пузырьков объемом 20куб см) состава, содержащего 542мг на пузырек ММ'НСІ (т є 500мг ММ) в его кристаллической безводной форме Ингредиенты объединяли в соответствии со следующей процедурой 1 Объединяли 119,25г концентрированной НСІ с достаточным количеством воды, пригодной для инъекции (ВИ), получая объем 7,2 литров Растворяли Юг лимонной кислоты в указанном растворе НСІ 2 Растворяли 50г Твин 80 в растворе, полученном на стадии 1 3 Растворяли ЮООгмм в растворе, полученном на стадии 2 4 Добавляли 320мл этилового спирта к раствору, полученному на стадии 3 5 Регулировали значение рН раствора, полученного на стадии 4, до рН 3,4 (±0,2) 6 Добавляли достаточное количество воды (ВИ) для доведения объема раствора до Юл 7 В стерильных условиях раствор фильтровали, используя два фильтра 10" Milhpore Durapore с размером ячеек 0,2мкм (CVGL) 8 Разливали по 5мл фильтрата, полученного на стадии 7, в 2000 пузырьков для многократной дозы объемом 20куб см (т е по 5мл фильтрата на пузырек объемом 20куб см) и частично закрывали с помощью лиофилизационных пробок 9 Пузырьки помещали в лиофилизатор, в котором температура была стабилизирована на уровне 25°С (сушилка типа Dura-Stop MP Freeze Dryer, система FTS) 10 Цикл лиофизации а Измеряли температуру на полке с размещенными на ней наполненными пузырьками и оснащали термопарами различные пузырьки для измерения их температуры б Температуру в камере для лиофилизации устанавливали на уровне 25°С Заполненные пузырьки помещали в камеру для лиофилизации и температуру поддерживали на уровне 25°С в течение 20 минут в Температуру на полке понижали от 25°С до -10°С в течение 2 часов 20 минут (градиент скорости -0,25°С/мин) г Температуру поддерживали на уровне -Ю°С в течение 2,5 часов д Температуру понижали до -40° С в течение 2 часов (градиент скорости -0,25°С/мин) е Температуру поддерживали на уровне 40°С в течение 5,0 часов ж Давление в камере для лиофилизации снижали до ЮОмторр з После достижения давления 1ООмторр (приблизительно в течение 30 минут) температуру поддерживали на уровне -40°С в течение дополнительных 5 часов 17 49797 и Температуру повышали до -16°С в течение 8 часов (градиент скорости 0,05°С/мин) и поддерживали на уровне -16°С в течение дополнительных 10 часов к Температуру повышали до 70°С в течение 7 часов 10 минут (градиент скорости 0,20°С/мин) и поддерживали на уровне 65°С до тех пор, пока все термопары не показывали температуру 60°С в течение по крайней мере 10 часов л Температуру понижали до 25°С в течение 3 часов (градиент скорости -0,25°С/мин) и поддерживали на уровне 25°С в течение 2 часов м Давление в камере для лиофилизации постепенно повышали до 4 фунт/кв дюйм с использованием азота (NF) в течение периода времени не менее 15 минут н Пузырьки закупоривали при парциальном давлении о Давление в камере для лиофилизации повышали до атмосферного давления с использованием фильтруемого воздуха 11 Затем пузырьки герметично запечатывали Характеристические аналитические данные подтверждают, что полученный состав содержит ММ'НСІ в кристаллической безводной форме (в соответствии с данными рентгеновской кристаллографии, показанными на фиг 2Б) 2В Другие размеры партий внутривенной композиции Аналогичным образом путем пропорционального увеличения количества ингредиентов могут быть изготовлены партии композиций, описанных в примерах 2А или 2Б, состоящие из 4000 пузырьков объемом 20куб см, 6000 пузырьков объемом 20куб см или 8000 пузырьков объемом 20куб см 2Г Другие внутривенные композиции с различными кристаллическими безводными солями ММ Аналогично примерам 2А или 2Б путем замены кристаллической безводной формы гидрохлорида мофетила микофенолята другими кристаллическими безводными формами мофетила микофенолята (например, сульфатной, фосфатной и ацетатной солями, полученными в соответствии с примером 1Б) получают соответствующие внутривенные композиции Пример 3 Другая композиция гидрохлорида мофетила микофенолята Аналогично примеру 2 могут быть получены производственные партии следующих композиций, содержащих ММ'НСІ в его кристаллических безводных формах Количество ингредиента на Компоненты пузырек композиции КомпозиКомпозиция А ция Б Мофетил микофенлята (г) 0,5 0,5 1Н НСІ (г) 1,22 1,22 Полисорбат 80 (мг) 0,07 Этанол, 95% (мл)а 0,16 18 ВИа, д к до объема 5 4 1Н НСІ/1Н NaOH6 до рН 3,4 до рН 3,4 а Удаляется во время лиофилизации Добавляется для регулирования рН Пример 4 Определение формы гидрохлорида мофетила микофенолята с помощью рентгеновской дифракции на порошке Кристаллическую форму MM'HCI определяли с помощью рентгеновской кристаллографии Результаты рентгеновской кристаллографии получали с помощью рентгеновского дифрактометра Nicolet, оборудованного трубкой тонкой фокусировки и монохроматором дифрагированного луча Получали картины рентгеновской дифракции на порошке соединения ММ'НСІ в его кристаллической моногидратной и кристаллической безводной формах, которые представлены на фиг 1А и 1Б соответственно Получали картины рентгеновской дифракции на порошке составов, содержащих ММ'НСІ, в его аморфной форме, ММ'НСІ в его кристаллической безводной форме (с полисорбатом 80, пример 3, композиция А) и ММ'НСІ в его кристаллической безводной форме (без полисорбата 80, пример 3, композиция Б), которые представлены на фиг 2А, 2Б и 2В соответственно Результаты рентгеновской кристаллографии, приведенные на фиг 2Б и 2В, показывают, что образование кристаллической формы ММ'НСІ в обоих составах не зависит от присутствия полисорбата 80, т е образование кристаллического безводного ММ'НСІ не ухудшается за счет полисорбата 80 Результаты рентгеновской кристаллографии, приведенные на фиг 2Б, 2В и 1Б, показывают, что ММ'НСІ в составах с и без полисорбата 80 находится в его кристаллической безводной форме Пример 5 Определение аморфной и кристаллической безводной форм гидрохлорида мофетила микофенолята с помощью дифференциальной сканирующей калориметрии В данном примере описан способ распознавания различных кристаллических форм ММ'НСІ (например, аморфной, моногидратной и безводной) с помощью дифференциальной сканирующей калориметрии (ДСК) ДСК-термограммы регистрировали с помощью системы Perkins Elmer DSC-7 System ДСК-термограмма представляет собой поток тепла в виде функции температуры, позволяя таким образом измерять температуру плавления соединения ДСК-термограмма для аморфной формы MM'HCI (фиг ЗА) показывает, что экзотерма начинается при -8,65°С, а эндотерма плавления начинается при 38,5°С и выходит на горизонтальный уровень при 44,77°С С другой стороны, ДСК-термограмма для кристаллической безводной формы ММ'НСІ после процесса лиофилизации (фиг ЗБ) показывает отсутствие фазовых переходов до плавления при температуре от 145,41 до 155,0°С 19 49797 Температура плавления моногидрата MM'HCI составляет 154-155°С (как описано в патенте США 4753935, выданном 28 июня 1988 г (пример 3)) Таким образом, аморфная, кристаллическая моногид ратная и кристаллическая безводная формы ММ'НСІ легко различаются с помощью их ДСК-термограмм Поскольку настоящее изобретение было описано со ссылками на конкретные примеры его выполнения, специалистам в данной области техники понятно, что в него могут быть внесены 20 различные изменения и могут быть заменены эквиваленты без отклонения от сущности и объема настоящего изобретения Кроме того, могут быть сделаны многочисленные модификации для адаптирования конкретной ситуации, материала, состава вещества, процесса, стадии или стадий процесса к предмету, существу и объему настоящего изобретения Подразумевается, что все указанные модификации подпадают под объем пунктов формулы изобретения, приведенных ниже 3QQQ 2500 Г 2000 Г 1S0O Е1000 500 10 1S 20 ге ФИГ. 1А зо 21 49797 22 3000 2500 2100 170O 1300 900 500 С 30 35 23 24 49797 10 15 20 2Й Фиг. 2Б 2300 25 30 35 25 26 49797 Фиг. ЗА Яки от; 71,37 Чачадо - L4b, # ,M Ot i пп.ші температуря
ДивитисяДодаткова інформація
Назва патенту англійськоюCrystalline anhydrous microphenolate mofethyl, pharmaceutical content and set applicable for intra-vein composition production
Назва патенту російськоюКристаллический безводный микофенолят мофетила, фармацевтический состав и набор, которые пригодны для получения внутривенной композиции
МПК / Мітки
МПК: C07D 307/83, A61P 37/06, A61P 35/00, C07D 307/88, A61K 31/535, A61P 31/12
Мітки: склад, композиції, фармацевтичний, мофетилу, безводний, набір, кристалічний, придатні, внутрішньовенної, мікофенолят, одержання
Код посилання
<a href="https://ua.patents.su/13-49797-kristalichnijj-bezvodnijj-mikofenolyat-mofetilu-farmacevtichnijj-sklad-ta-nabir-yaki-pridatni-dlya-oderzhannya-vnutrishnovenno-kompozici.html" target="_blank" rel="follow" title="База патентів України">Кристалічний безводний мікофенолят мофетилу, фармацевтичний склад та набір, які придатні для одержання внутрішньовенної композиції</a>