Моноклональні антитіла проти білка rgм а і їх застосування
Номер патенту: 99343
Опубліковано: 10.08.2012
Автори: Шмідт Мартін, Мюллер Бернхард Ж., Бардуелл Філіп Д., Хсієх Чунг-мінг, Барлоу Ів Х., Ледді Мері Р.
Формула / Реферат
1. Виділене моноклональне антитіло, що містить антигензв'язувальний домен, де вказане антитіло здатне зв'язувати епітоп молекули RGM, вказаний антигензв'язуючий домен містить щонайменше два набори CDR варіабельного домену, де вказані щонайменше два набори CDR варіабельного домену вибрані з групи, яка складається з:
набір VH 5F9 і набір VL 5F9; і
набір VH 8D1 і набір VL 8D1,
де набори CDR варіабельного домену складаються з:
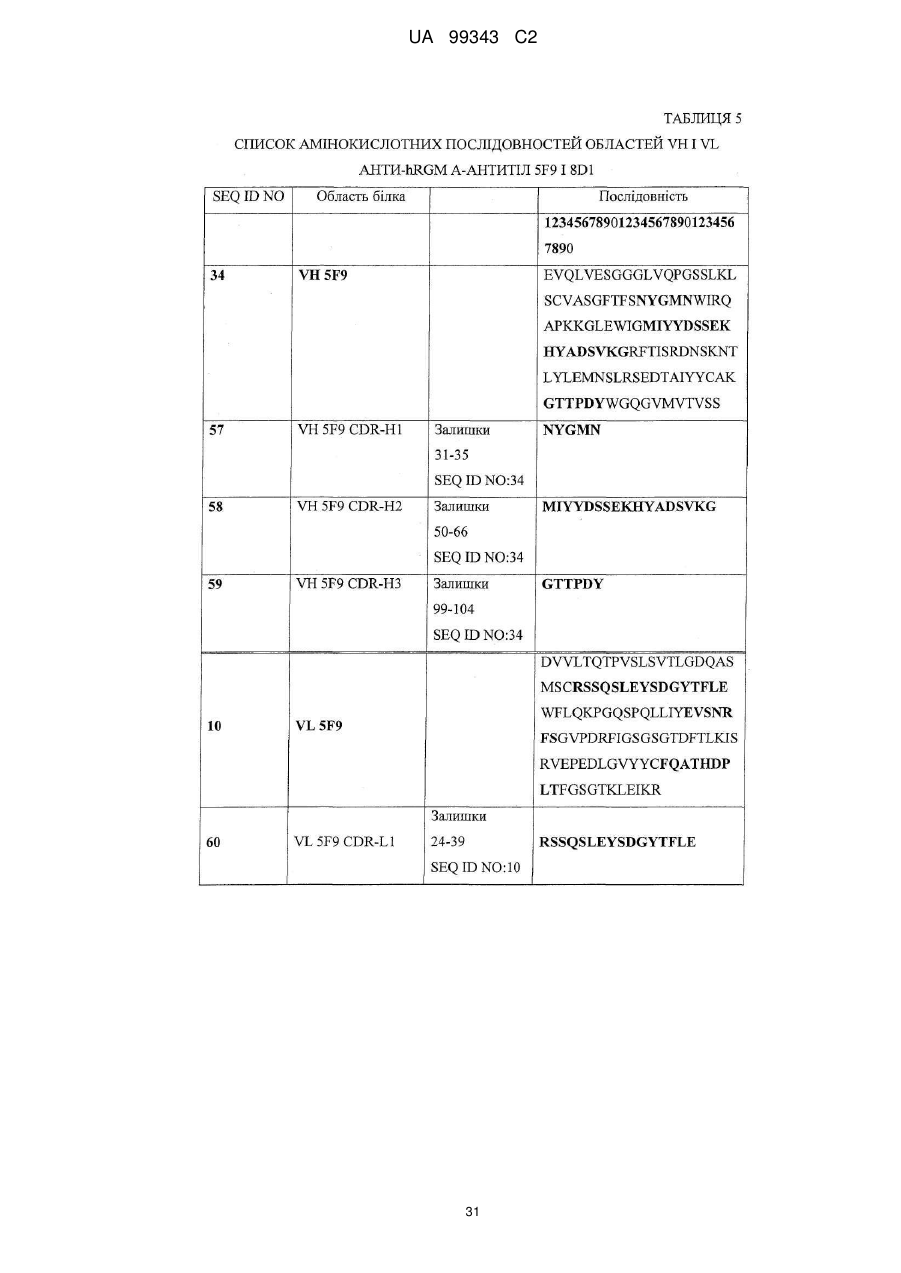
Набір VH 5F9
VH 5F9 CDR-H1
Залишки 31-35 SEQ ID NO: 34
SEQ ID NO: 57
VH 5F9 CDR-H2
Залишки 50-66 SEQ ID NO: 34
SEQ ID NO: 58
VH 5F9 CDR-H3
Залишки 99-104 SEQ ID NO: 34
SEQ ID NO: 59
Набір VL 5F9
VL 5F9 CDR-L1
Залишки 24-39 SEQ ID NO: 10
SEQ ID NO: 60
VL 5F9 CDR-L2
Залишки 55-61 SEQ ID NO: 10
SEQ ID NO: 61
VL 5F9 CDR-L3
Залишки 94-102 SEQ ID NO: 10
SEQ ID NO: 62
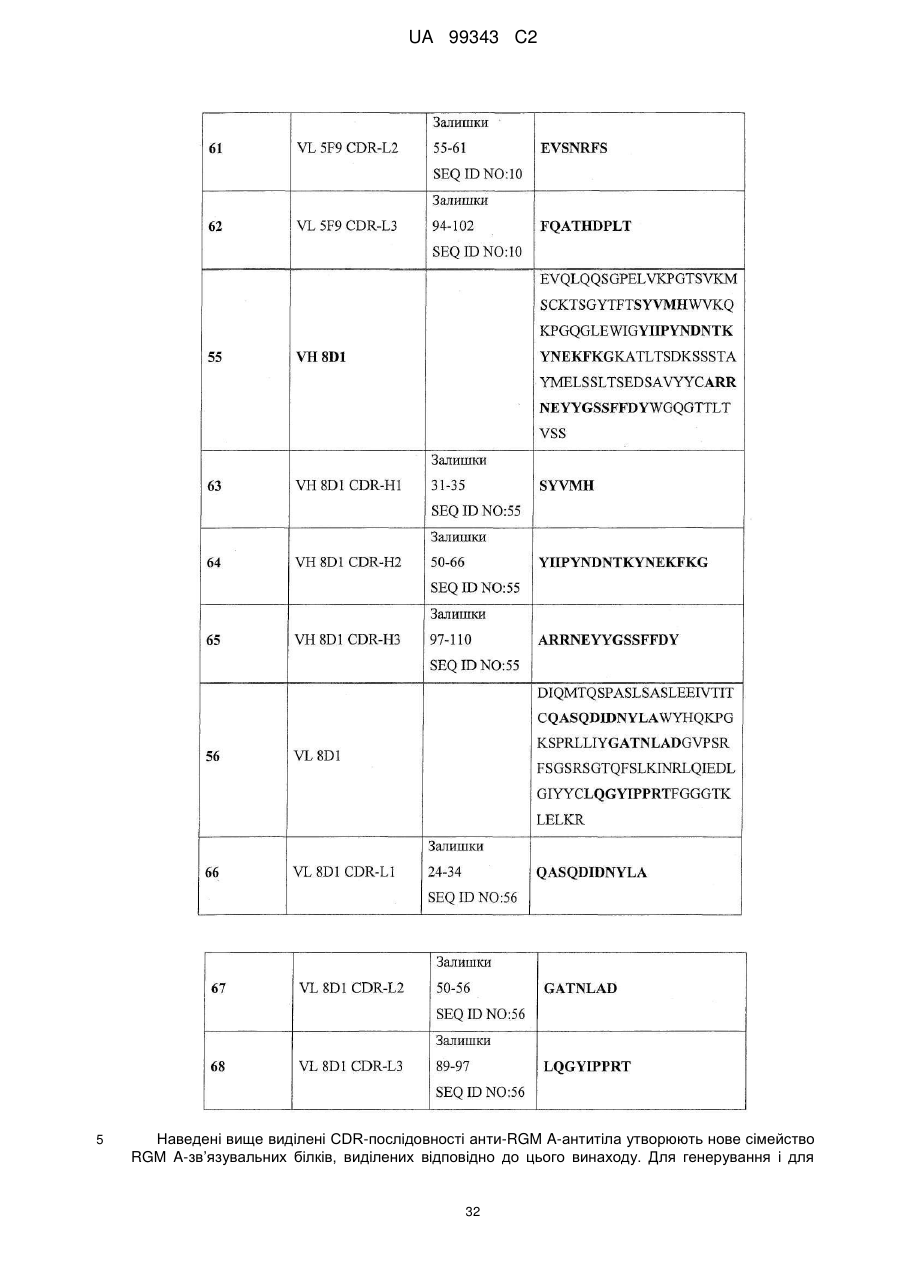
Набір VH 8D1
VH 8D1 CDR-H1
Залишки 31-35 SEQ ID NO: 55
SEQ ID NO: 63
VH 8D1 CDR-H2
Залишки 50-66 SEQ ID NO: 55
SEQ ID NO: 64
VH 8D1 CDR-H3
Залишки 97-110 SEQ ID NO:55
SEQ ID NO: 65
Набір VL 8D1
VL 8D1 CDR-L1
Залишки 24-34 SEQ ID NO: 56
SEQ ID NO: 66
VL 8D1 CDR-L2
Залишки 50-56 SEQ ID NO: 56
SEQ ID NO: 67
VL 8D1 CDR-L3
Залишки 89-97 SEQ ID NO: 57
SEQ ID NO: 68
2. Антитіло за п. 1, що містить набір варіабельного домену, де щонайменше один із вказаних трьох CDR є модифікованою амінокислотною послідовністю CDR, послідовність якого щонайменше на 50 % ідентична вихідній послідовності, де вказане антитіло здатне зв'язуватися з епітопом молекули RGM.
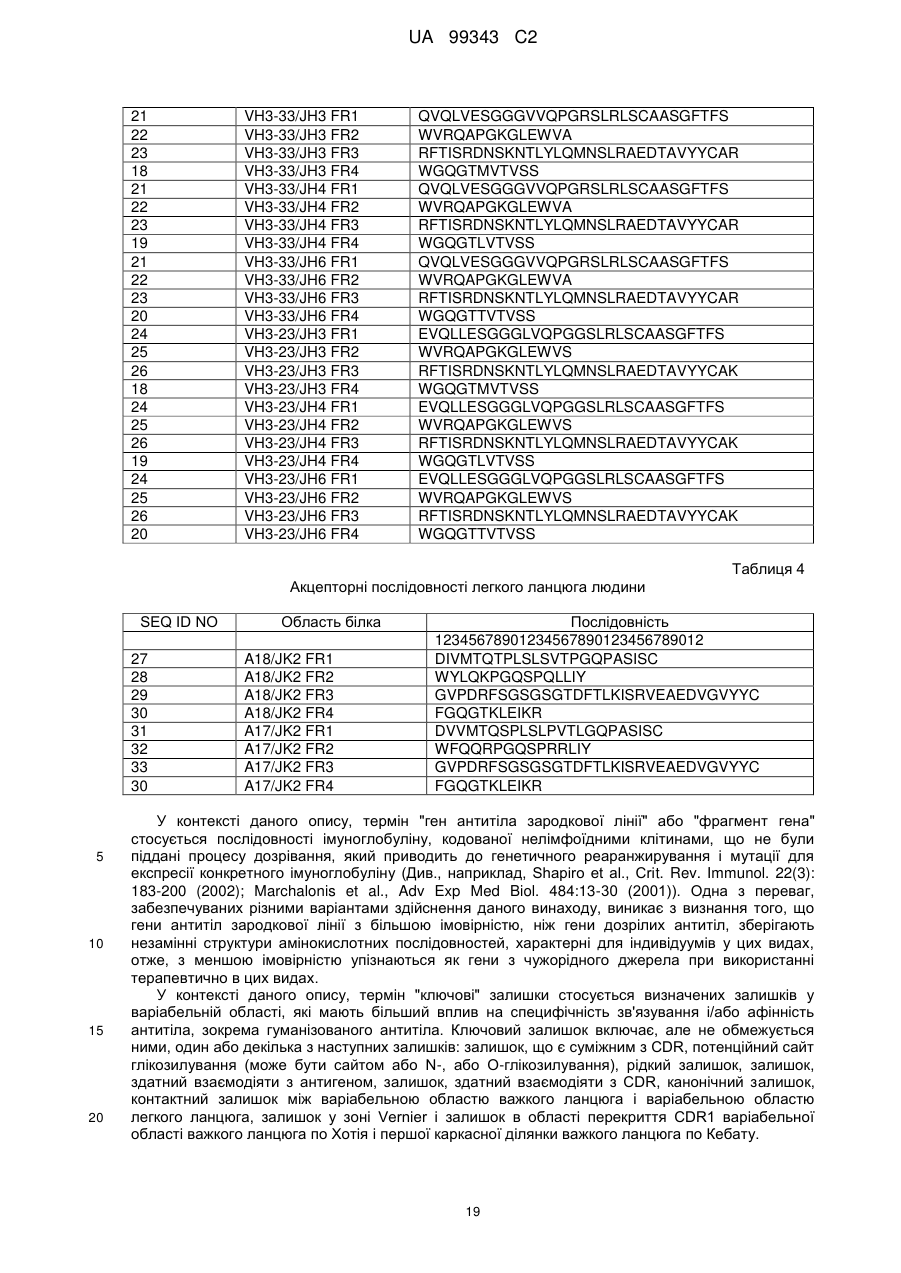
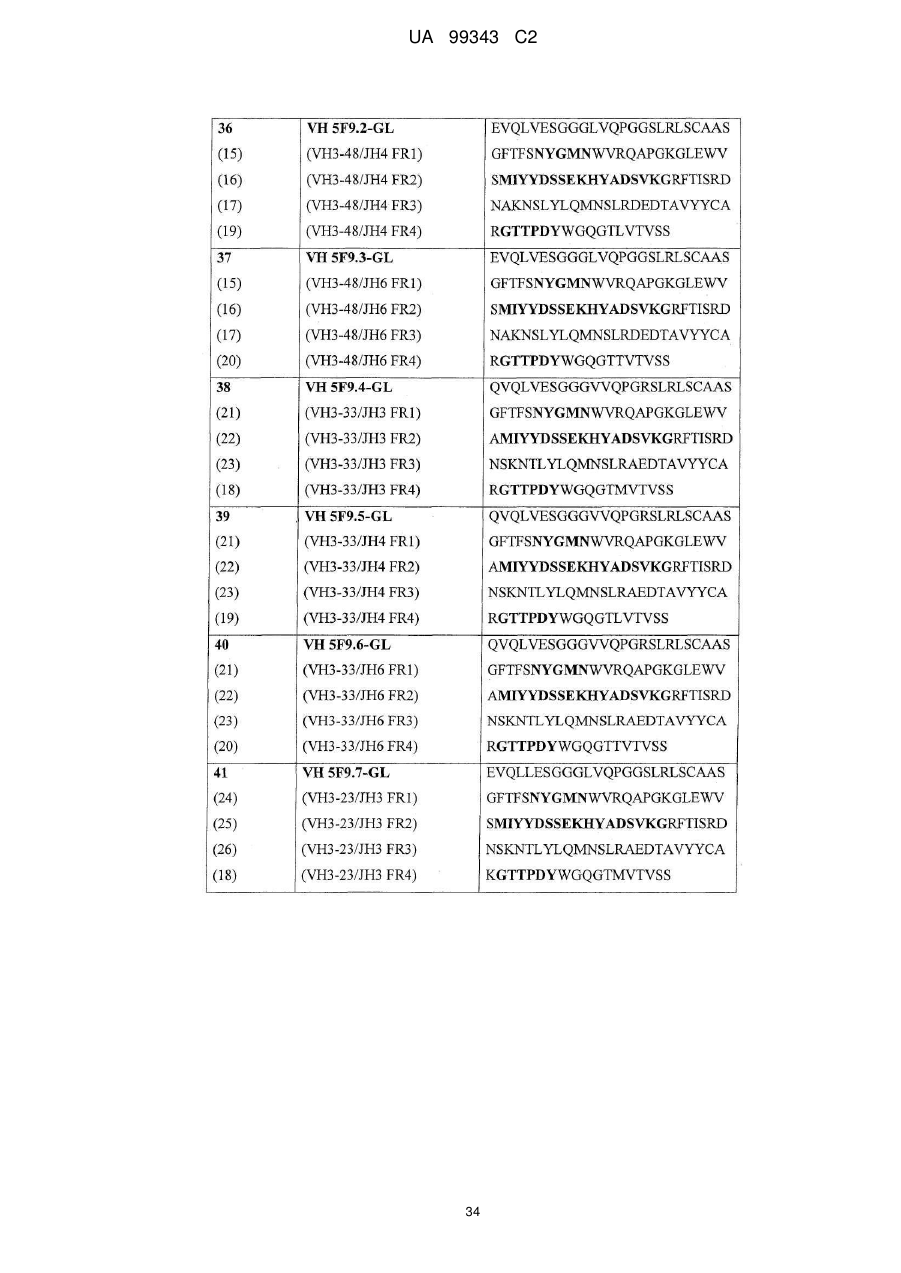
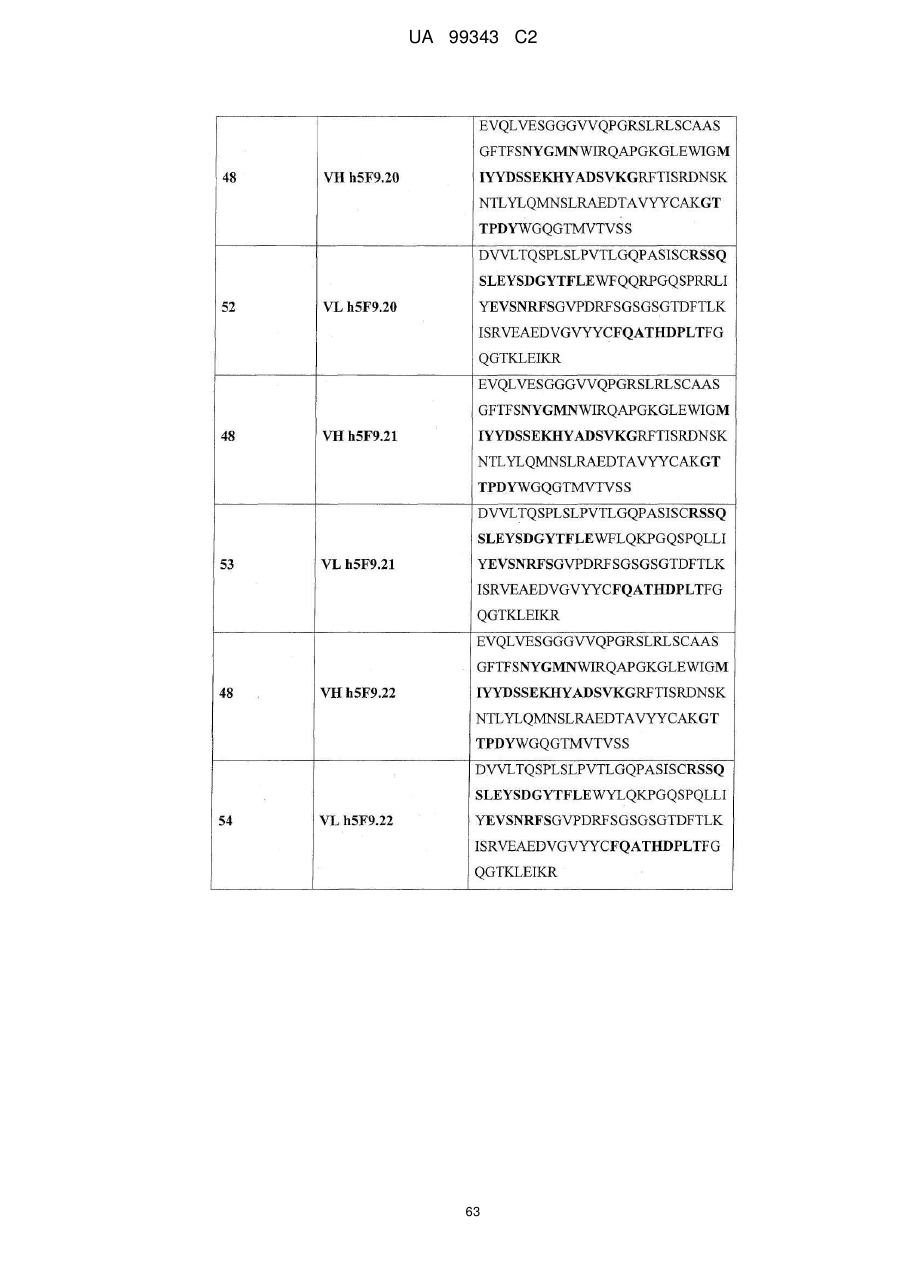
3. Антитіло за будь-яким з попередніх пунктів, що додатково містить акцепторну каркасну ділянку людини, де вказана акцепторна каркасна ділянка людини містить щонайменше одну амінокислотну послідовність, вибрану з групи, що складається з SEQ ID NO: 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32 і 33.
4. Антитіло за будь-яким з попередніх пунктів, що містить щонайменше один варіабельний домен важкого ланцюга, вибраний з SEQ ID NO: 35, 36, 37, 38, 39, 40, 41, 42 і 43; і/або щонайменше один варіабельний домен легкого ланцюга, вибраний з SEQ ID NO: 44, 45 і 46, або
де вказане антитіло містить щонайменше один (з мутацією в каркасній ділянці) варіабельний домен з амінокислотною послідовністю, що вибрана з групи, яка складається з:
SEQ ID NO: 47, 48, 49, 50; і
SEQ ID NO: 51, 52, 53 і 54.
5. Антитіло за будь-яким з попередніх пунктів, яке являє собою антитіло 5F9.
6. Антитіло за будь-яким з попередніх пунктів, яке являє собою антитіло 8D1.
7. Антигензв'язувальний фрагмент виділеного моноклонального антитіла за будь-яким з пп. 1-6.
8. Виділена нуклеїнова кислота, яка кодує молекулу антитіла за будь-яким з пп. 1-7.
9. Вектор, який містить виділену нуклеїнову кислоту за п. 8.
10. Клітина-хазяїн, яка містить вектор за п. 9.
11. Спосіб одержання білка, який здатний зв'язуватися з RGM, що включає культивування клітини-хазяїна за п. 10 в культуральному середовищі в умовах, прийнятних для одержання зв'язувального білка, здатного зв'язуватися з RGM.
12. Фармацевтична композиція, яка містить антитіло за будь-яким з пп. 1-7 і фармацевтично прийнятний носій.
13. Застосування антитіла за будь-яким з пп. 1-6 або антигензв’язувального фрагмента за п. 7 для одержання лікарського засобу, що використовується для: а) зниження зв'язування hRGM А з рецептором Neogenin хворого; або b) для зниження зв'язування hRGM А з кістковим морфогенетичним білком-2 і кістковим морфогенетичним білком-4 (ВМР-2 і ВМР-4) у хворого.
14. Застосування антитіла за будь-яким з пп. 1-6 або антигензв’язувального фрагмента за п. 7 для одержання лікарського засобу для зниження активності RGM А у хворого, що страждає захворюванням, при якому активність RGM А є патологічною.
15. Застосування за п. 14, де захворювання включає неврологічні захворювання, вибрані з групи, що включає бічний аміотрофічний склероз, ушкодження плечового сплетіння, ушкодження головного мозку, у тому числі травматичне ушкодження головного мозку, церебральний параліч, хворобу Гійєна-Барре, лейкодистрофію, розсіяний склероз, поствакцинальний поліомієліт, щілину хребта, ушкодження спинного мозку, спінально-м'язову атрофію, спінальні пухлини, інсульт, поперечний мієліт; деменцію, сенільну деменцію, когнітивні порушення помірного ступеня, деменцію, пов'язану з хворобою Альцгеймера, хорею Хантінгтона, пізню дискінезію, гіперкінезії, манії, хворобу Паркінсона, синдром Стіла-Річардсона, синдром Дауна, важку псевдопаралітичну міастенію, травму нерва, судинний амілоїдоз, крововилив у головний мозок І ступеня з амілоїдозом, запалення головного мозку, гостре порушення зі сплутаністю свідомості, бічний аміотрофічний склероз, глаукому і хворобу Альцгеймера.
Текст
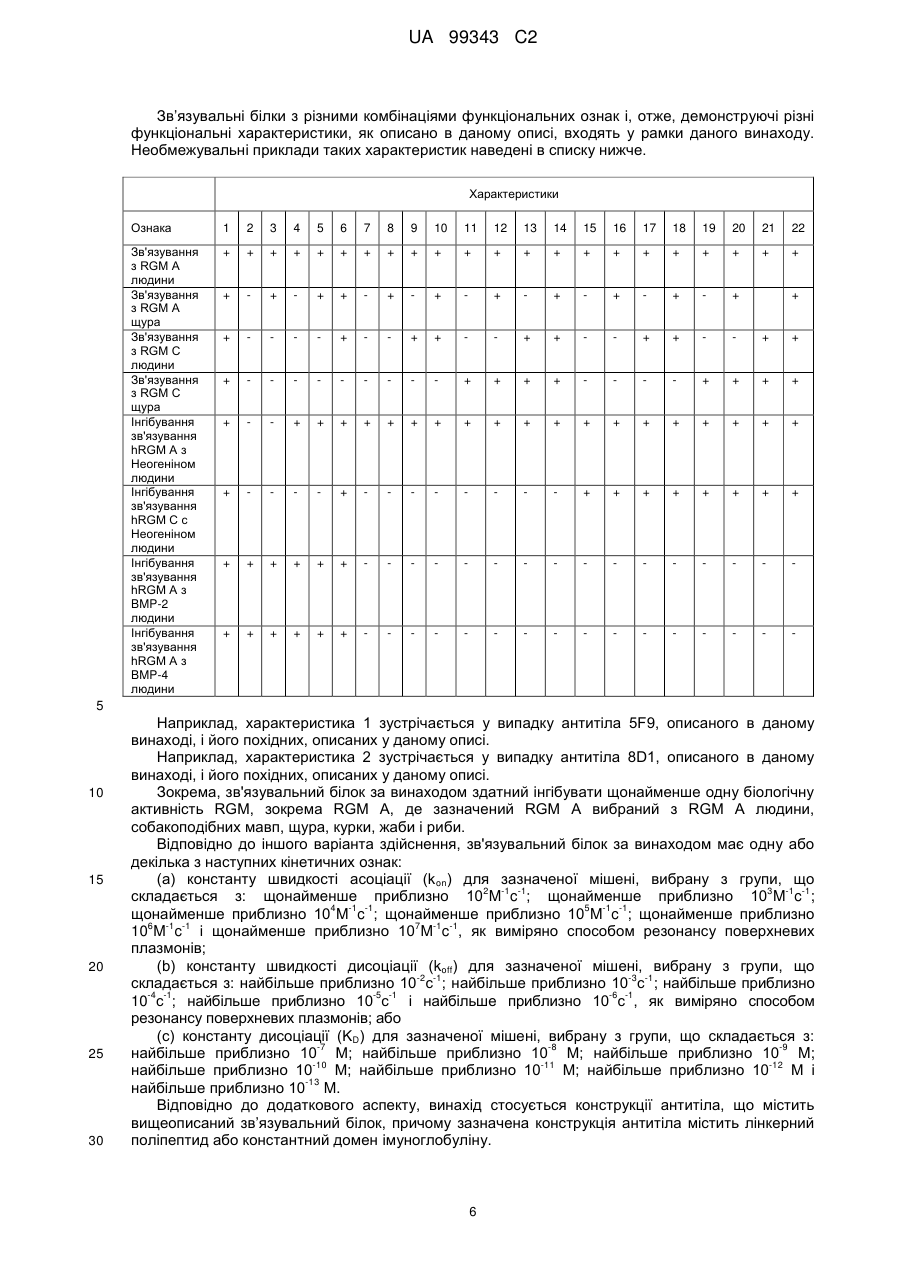
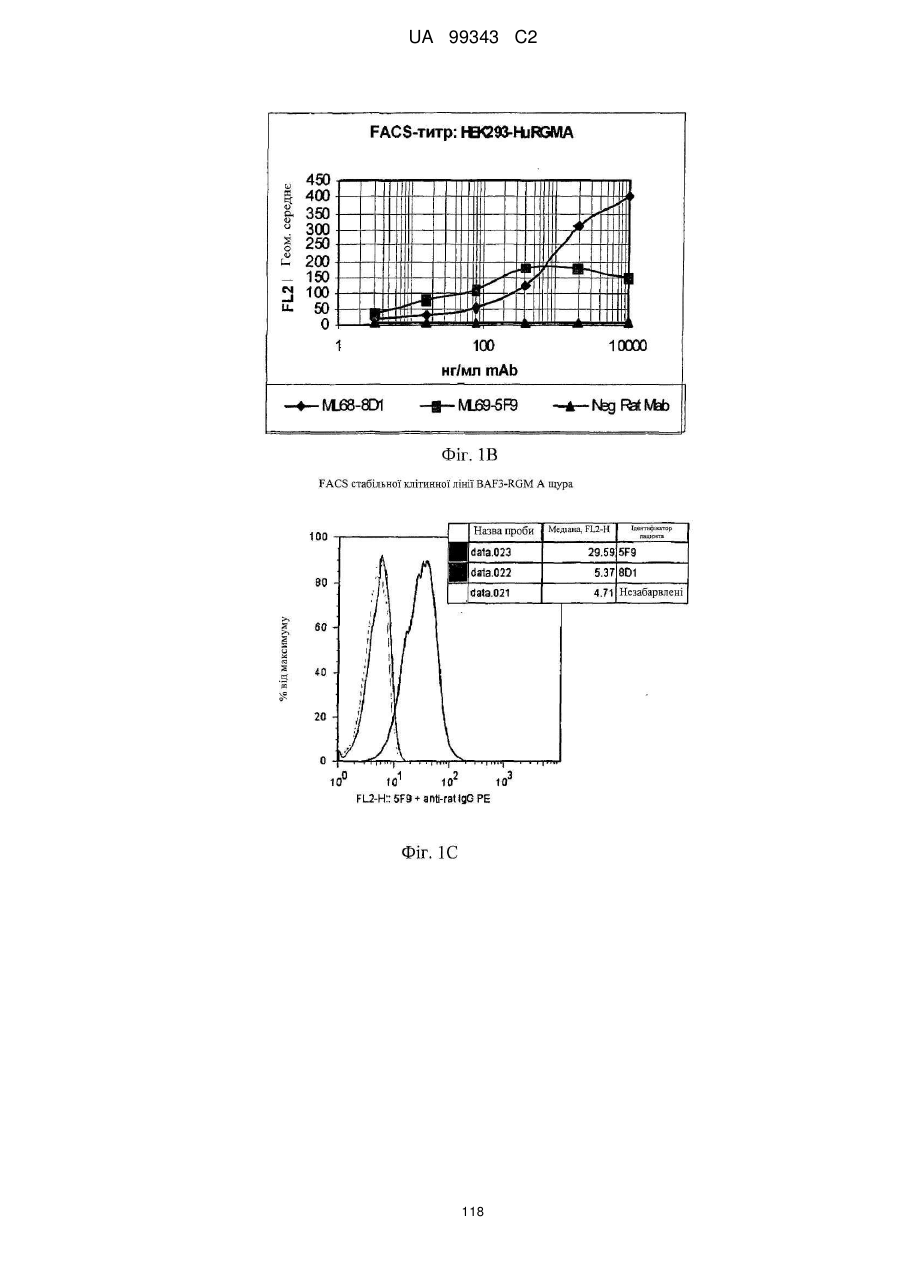
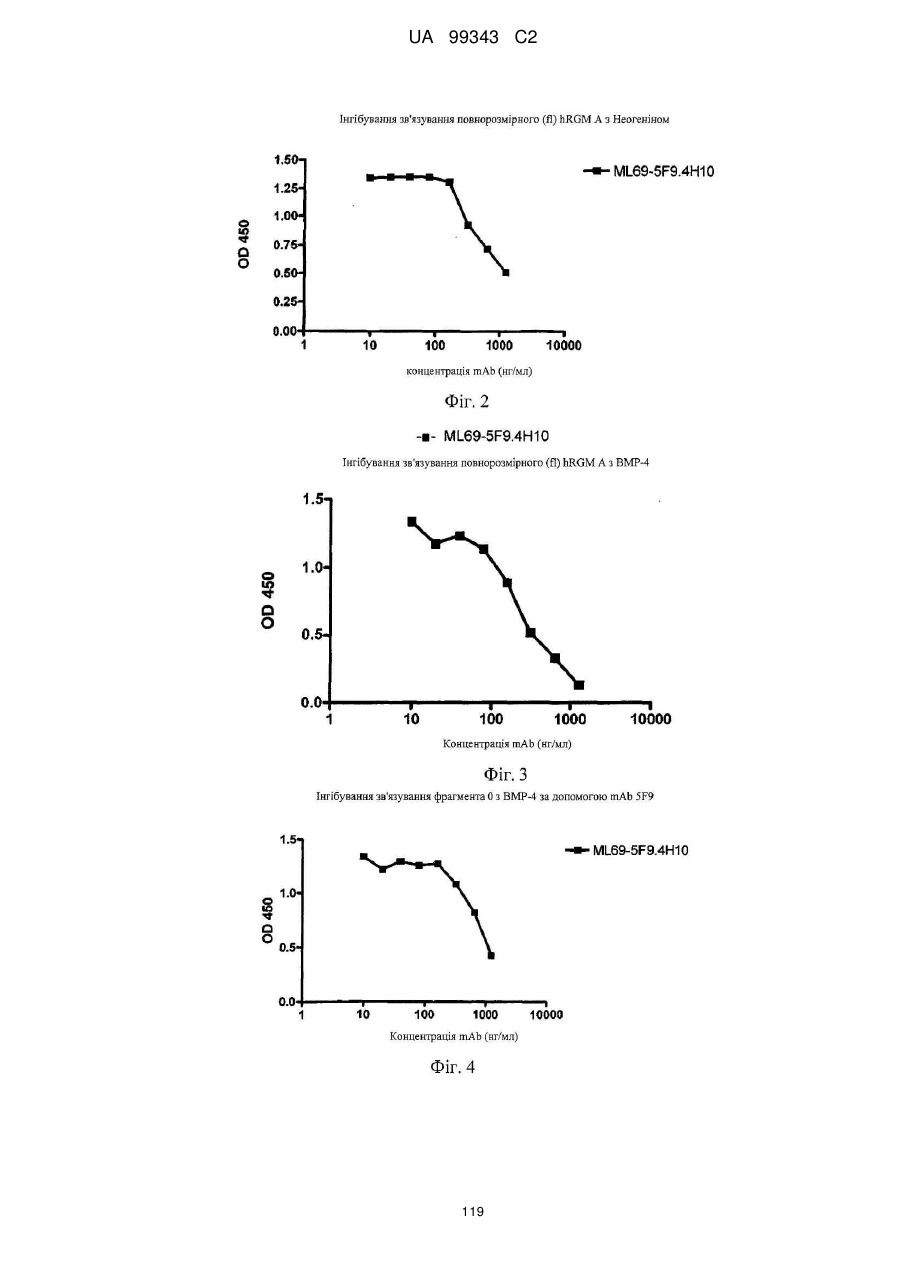
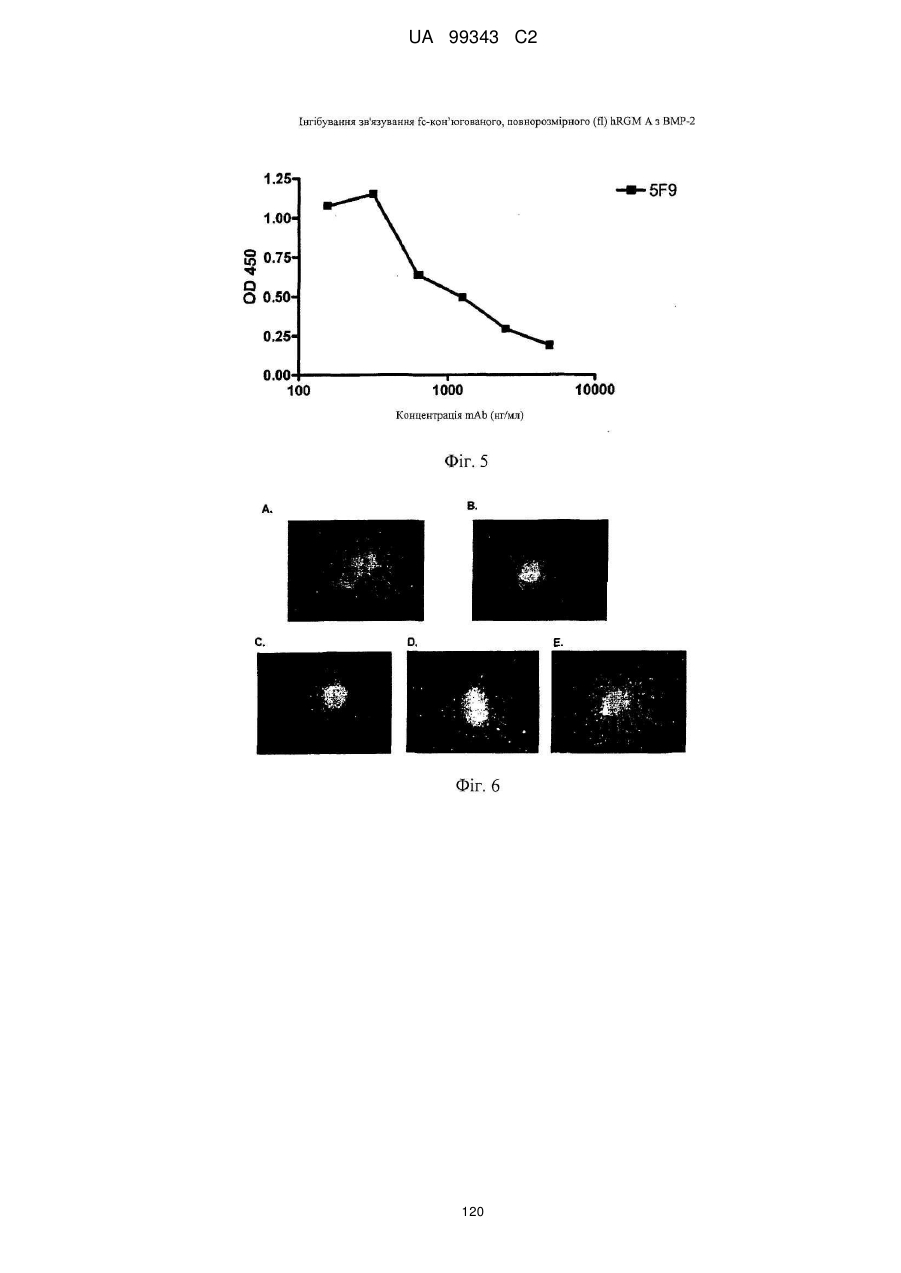
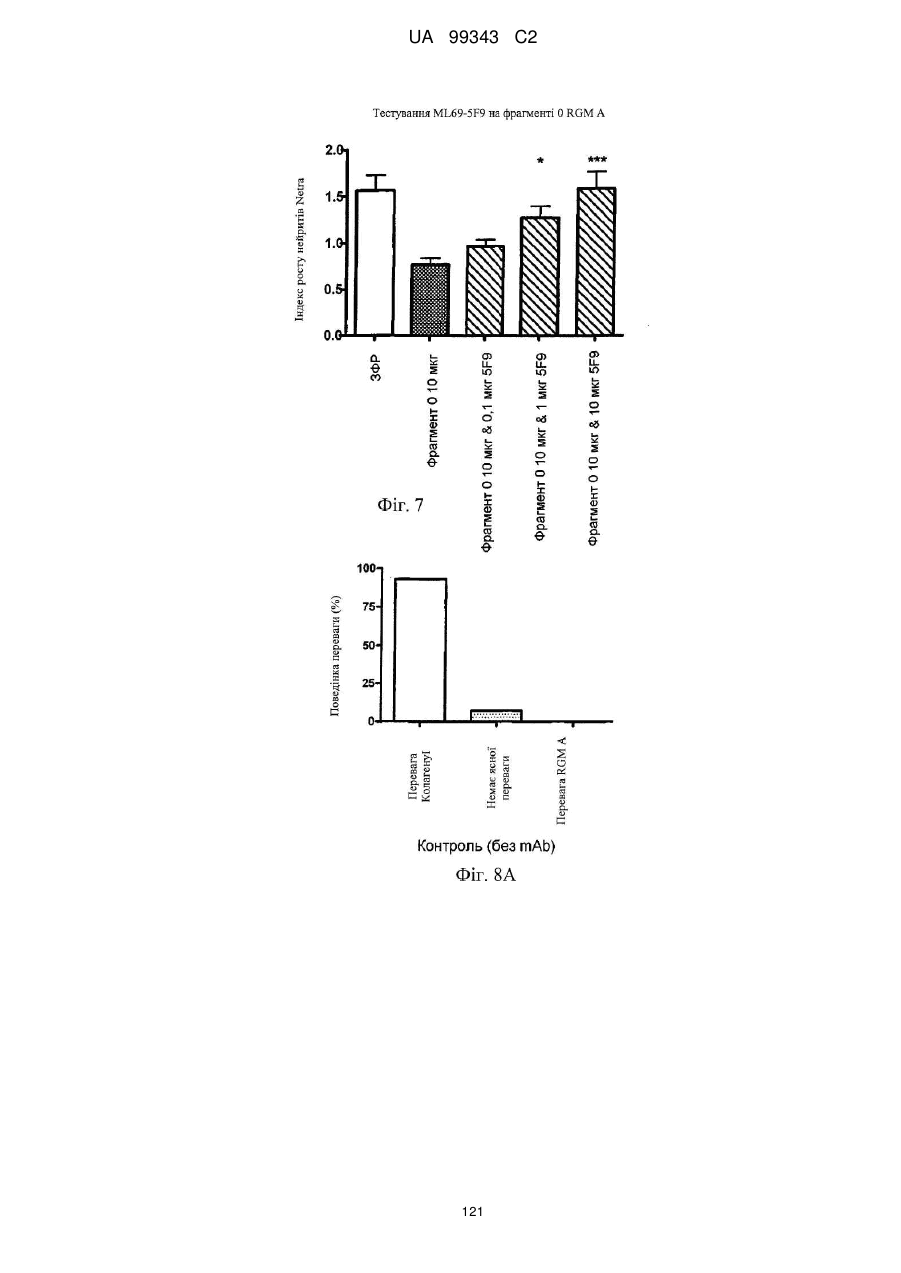
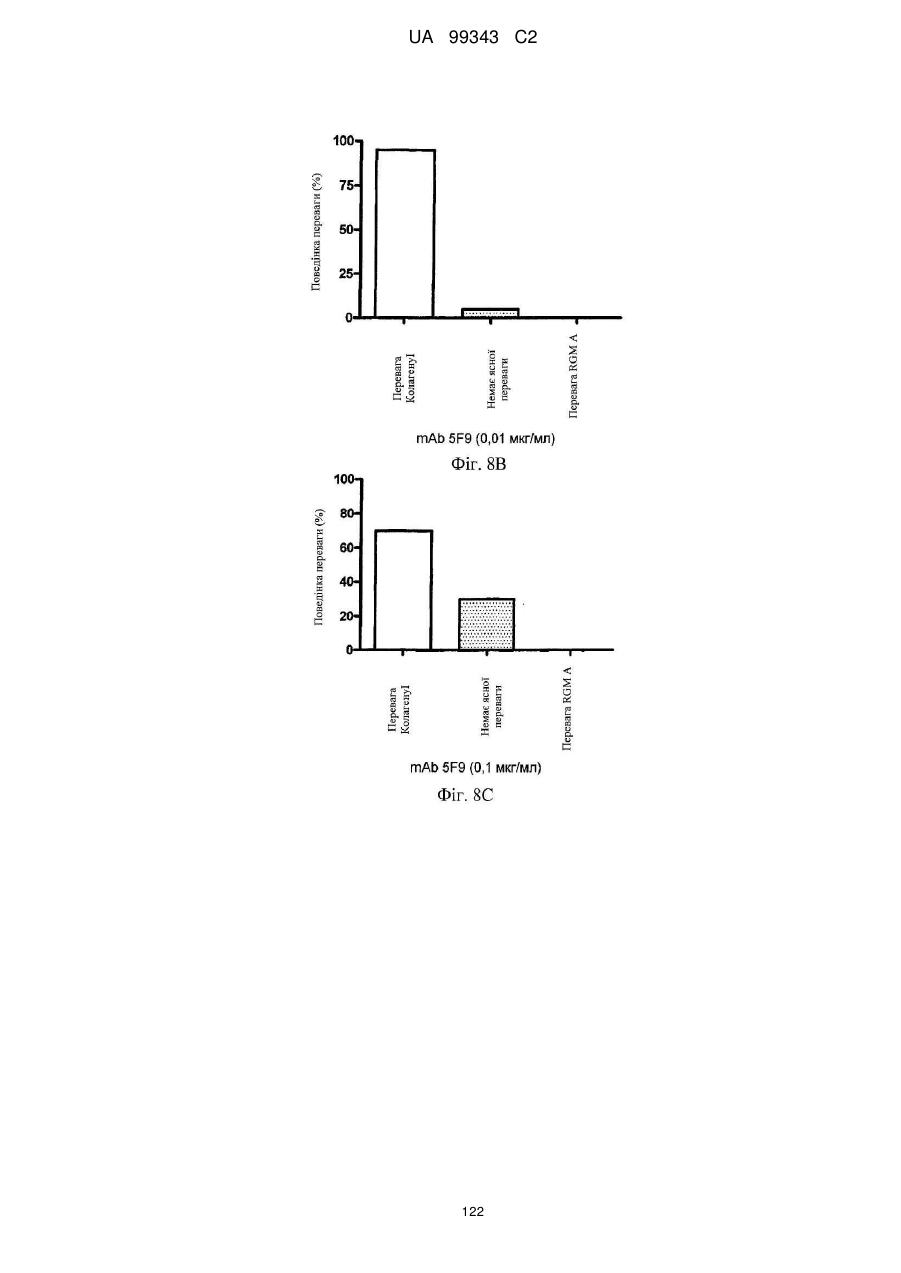
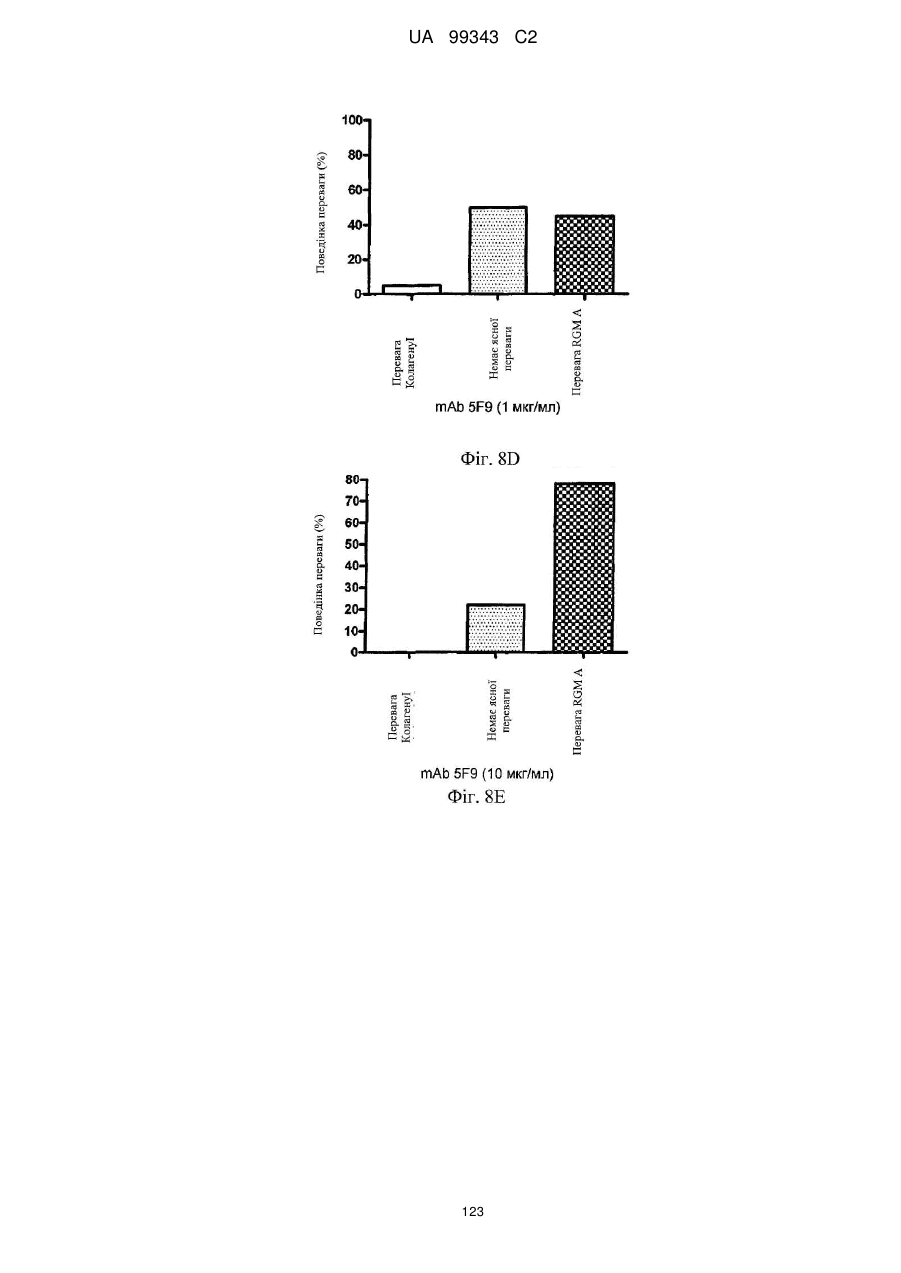
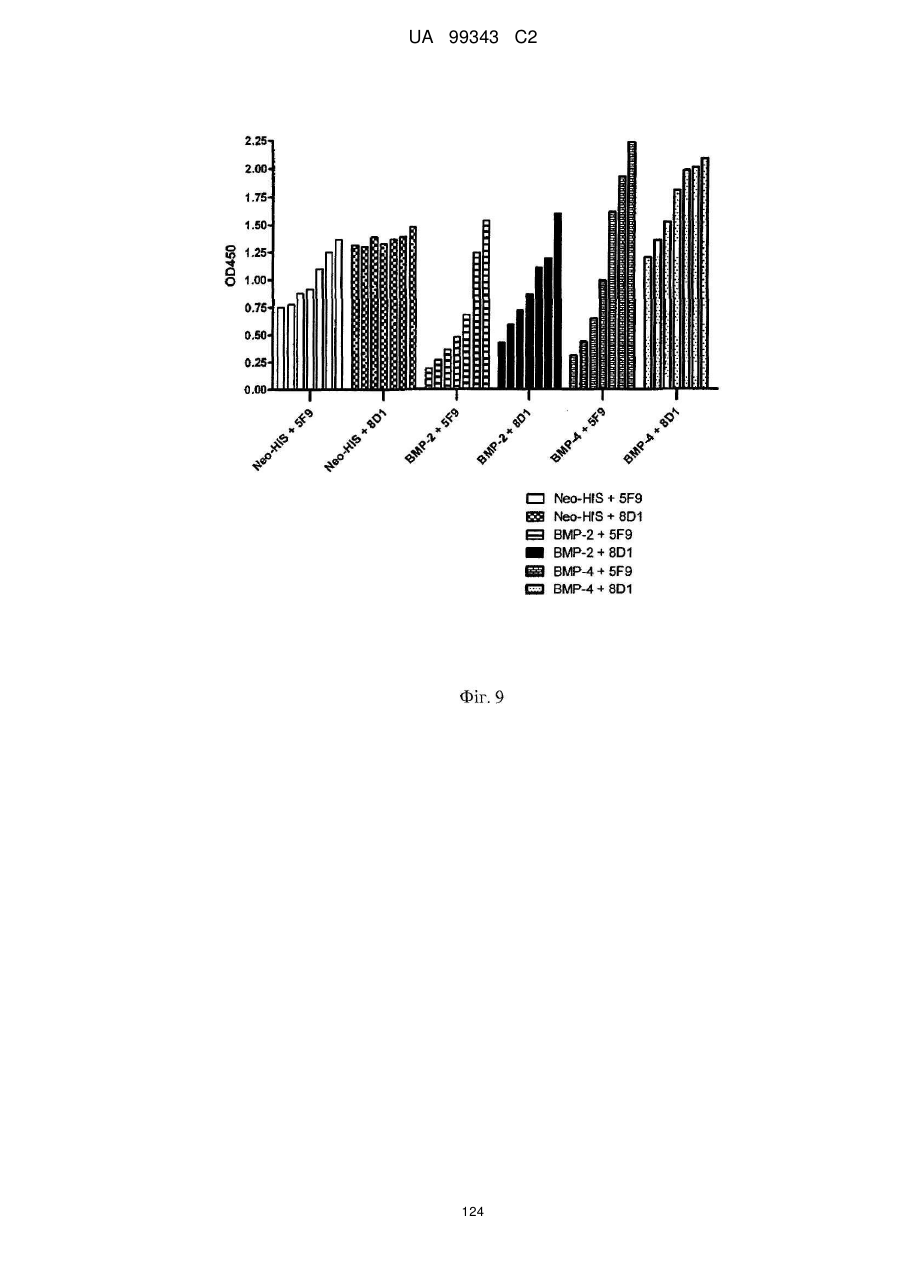
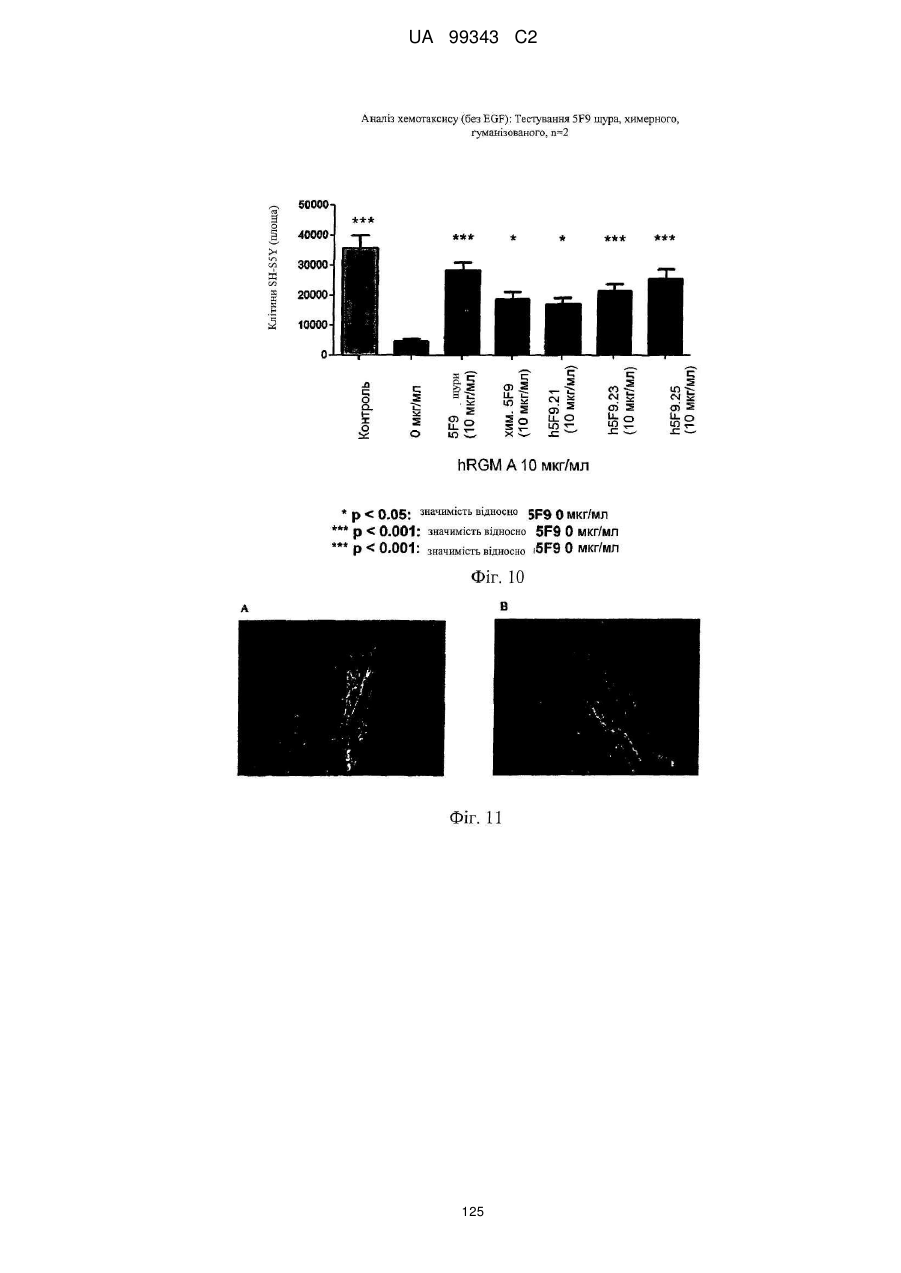
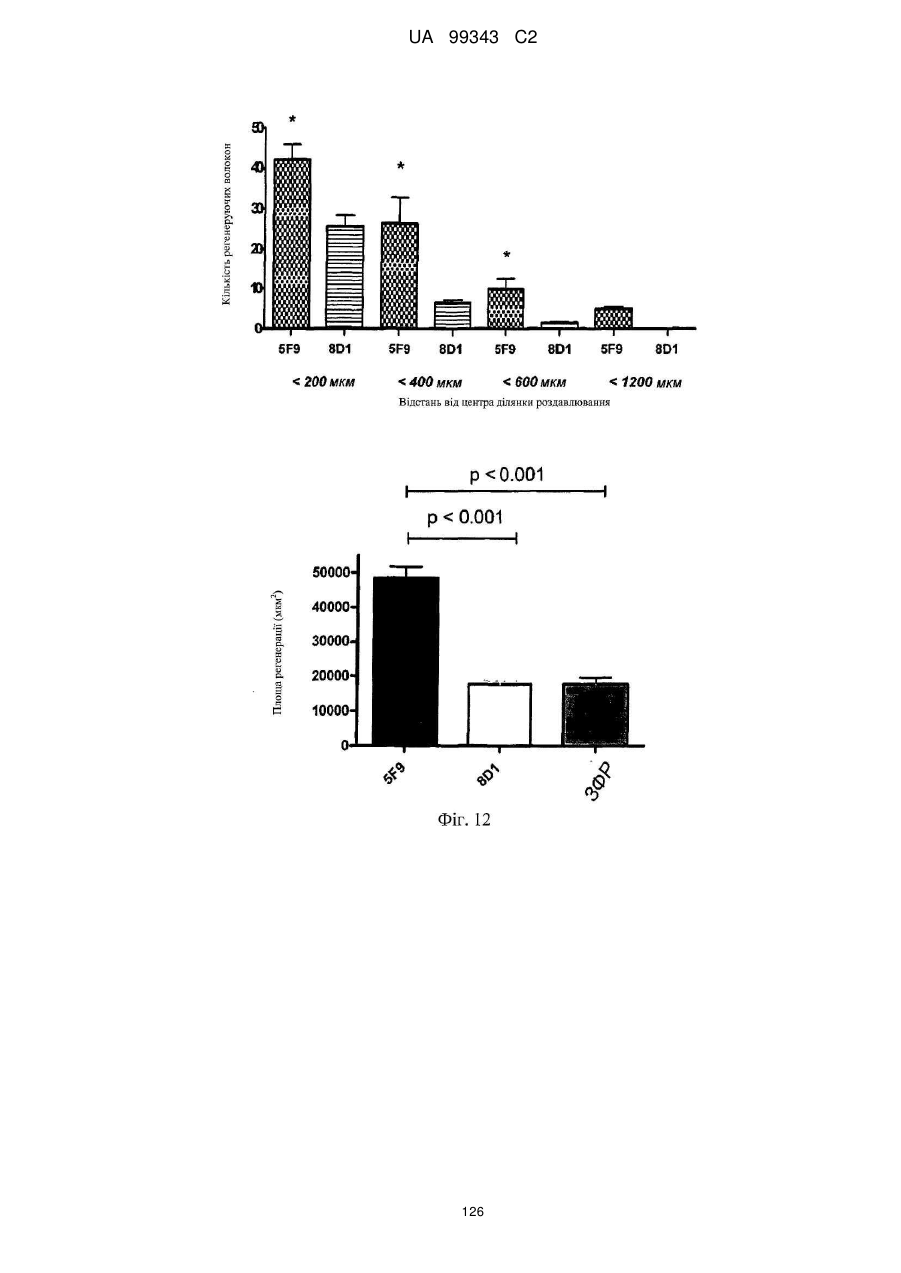
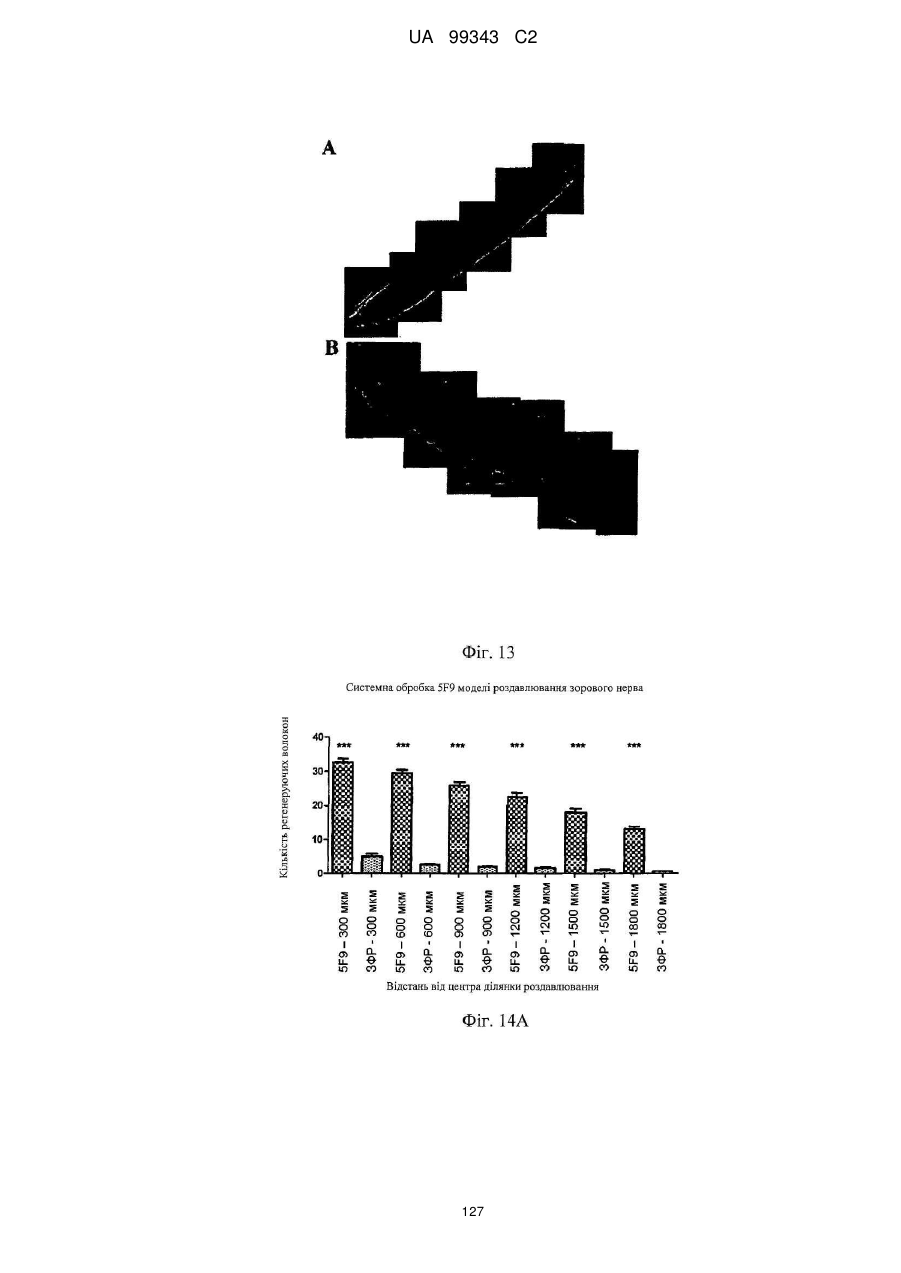
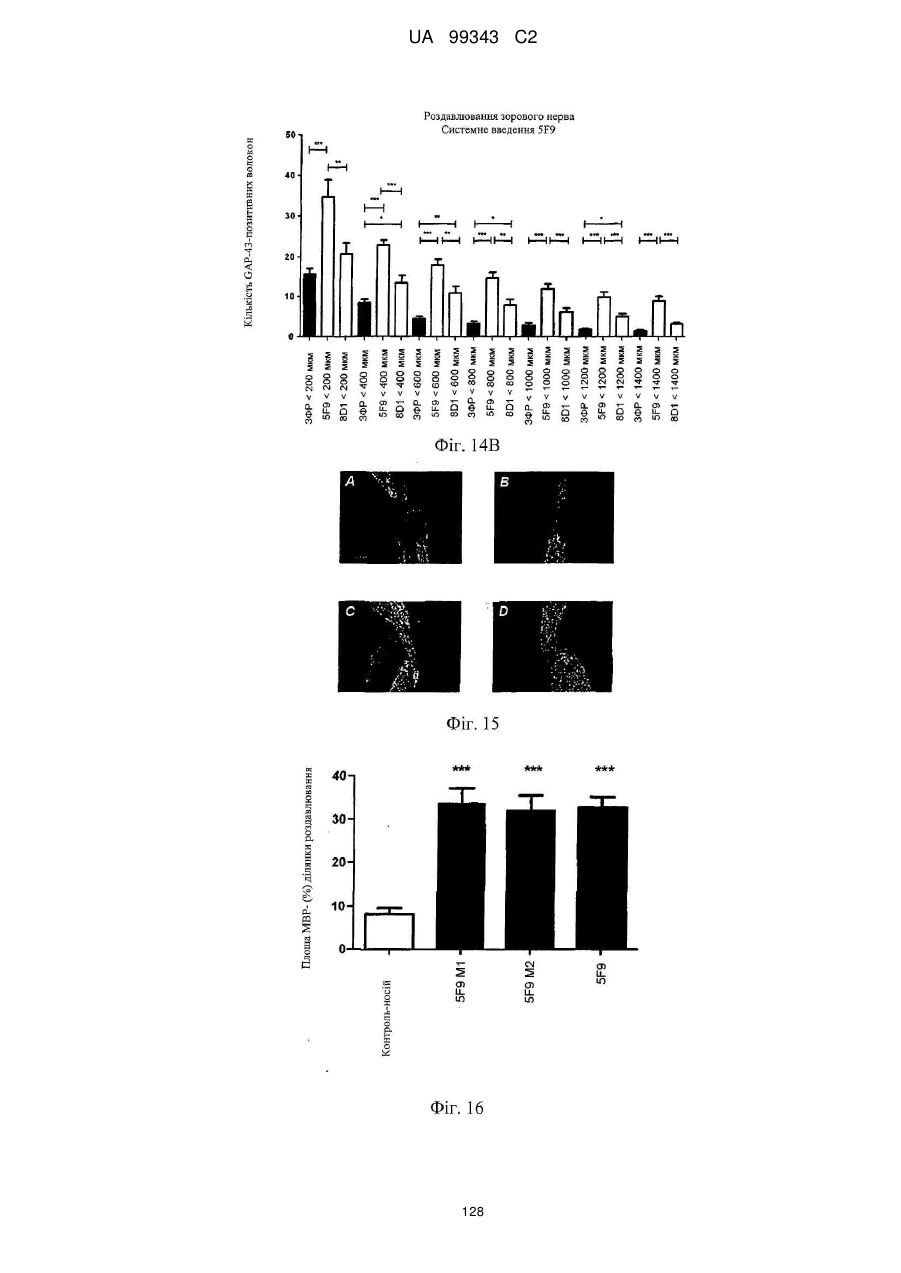
Реферат: Винахід належить до моноклональних антитіл, які мають здатність детектувати та інгібувати активності RGM, наприклад, у людей, що страждають від порушення, що включає, але не обмежується ними, розсіяний склероз, травму головного мозку ссавців, ушкодження спинного мозку, інсульт, нейродегенеративні захворювання і шизофренію. UA 99343 C2 5 10 15 20 25 30 35 40 45 50 55 60 Галузь техніки, до якої належить винахід У даній заявці описані RGM A-зв’язувальні білки, зокрема, моноклональні антитіла, і, зокрема, їх CDR-щеплені, гуманізовані варіанти, що здатні зв'язуватися з RGM A і запобігати зв'язуванню білків RGM з рецептором RGM A і іншими RGM A-зв’язувальними білками і, отже, нейтралізувати функцію RGM A. Ці антитіла можуть використовуватися для лікування деяких станів, включаючи, але ними не обмежуючись, розсіяний склероз, травму головного мозку ссавців, ушкодження спинного мозку, інсульт, нейродегенеративні захворювання і шизофренію. Рівень техніки Регенерація аксонів після ушкодження або після запальних уражень, або після нейродегенеративних захворювань центральної нервової системи ссавців (ЦНС) практично завжди є неможливою; результат залежить від балансу між вродженою здатністю нервових волокон ЦНС до відновлення росту і інгібувальними факторами ЦНС, розташованими в сайті ураження або ушкодження, що активно перешкоджають відновленню росту і, отже, регенерації ушкоджених шляхів нервових волокон. Було встановлено, що мієлін ЦНС, вироблюваний олігодендроцитами, і рубцева тканина ушкодження є найбільш значимими гальмуючими структурами для росту аксонів на ранній фазі ушкодження, унаслідок колапсу конуса росту і інгібування росту нейритів in vitro, а також in vivo, що приводить до безпосереднього інгібування росту аксонів. Були ідентифіковані білки RGM, головні інгібувальні фактори мієліну ЦНС і рубцевої тканини (Monnier et al., Nature 419: 392-395, 2002; Schwab et al., Arch. Neurol.62: 1561-8, 2005a; Schwab et al. Eur. J. Neurosci. 21: 1569-76, 2005 b; Hata et al. J. Cell Biol. 173:47-58, 2006; відносно оглядів див.: Mueller et al., Philos. Trans. R. Soc. Lond. B Biol. Sci. 361: 1513-29, 2006; Yamashita et al. Curr. Opin. Neurobiol. 17: 29-34, 2007). Білки RGM стимульовані в ділянках ураження або ушкодження у людей, померлих від травми головного мозку або ішемічного інсульту (Schwab et al., Arch. Neurol. 62: 1561-8, 2005a) і стимульовані у щурів з ушкодженням спинного мозку (Schwab et al. Eur. J. Neurosci. 21: 1569-76, 2005 b; Hata et al. J. Cell Biol. 173:47-58, 2006, відносно огляду див.: Mueller et al., Philos. Trans. R. Soc. Lond. B Biol. Sci. 361: 1513-29, 2006; Yamashita et al. Curr. Opin. Neurobiol. 17: 29-34, 2007). Крім того, перші результати з використанням клінічних зразків пацієнтів з розсіяним склерозом і здоровими осіб зробили можливість припустити, що RGM A людини стимульований у цереброспінальній рідині пацієнтів, що страждають МS (дані не показані). Для оцінки стимулюючого регенерацію ефекту RGM A-специфічного поліклонального антитіла, ці антитіла вводили в помірну-важку модель ушкодження спинного мозку, де приблизно 60% спинного мозку на торакальному рівні 9/10 були розсічені. Гістологічне дослідження виявило, що таке ушкодження приводило до розриву всіх дорсальних і латеральних волокон кортикоспінального шляху. RGM A-специфічне поліклональне антитіло, що вводиться місцево за допомогою насоса протягом двох тижнів, індукувало віддалену регенерацію ушкоджених нервових волокон (Hata et al., J. Cell Biol. 173:47-58, 2006). Сотні нервових волокон, розташованих за межами ділянки ушкодження, і найдовші волокна регенерували більше ніж на 10 мм за межами цього ушкодження, тоді як регенеруючі волокна не були виявлені дистально відносно цього ушкодження у оброблених контрольним антитілом тварин. Функціональне відновлення анти-RGM A-оброблених щурів значно поліпшувалося в порівнянні з обробленими контрольним антитілом щурами зі спинномозковим ушкодженням, підтверджуючи тим самим, що RGM A є потужним інгібітором нейрорегенерації і цінною мішенню для стимуляції відновлення в показаннях, що характеризуються ушкодженням аксонів або ушкодженням нервових волокон (Hata et al., J. Cell Biol. 173:47-58, 2006; Kyoto et al. Brain Res. 1186: 74-86, 2007). Крім того, нейтралізація білка RGM A блокуючим функцію поліклональним антитілом не тільки стимулювала ріст ушкоджених нервових волокон у щурах зі спинномозковим ушкодженням, але і підсилювала утворення їх синапсу, тим самим роблячи можливими корекцію або відновлення ушкоджених нейронних ланцюгів. (Kyoto et al. Brain Res. 1186: 74-86, 2007). Сімейство rgm-генів включає три різних гени, два з яких, rgm a і b, експресуються в ЦНС ссавців, даючи початок білкам RGM A і RGM B, тоді як третій член, rgm c, експресується на периферії (Mueller et al., Philos. Trans. R. Soc. Lond. B Biol. Sci. 361: 1513-29, 2006), де RGM C відіграє важливу роль у метаболізмі заліза. In vitro, RGM A інгібує ріст нейритів зв'язуванням з Неогеніном, який був ідентифікований як рецептор RGM (Rajagopalan et al. Nat Cell Biol.: 6(8), 756-62, 2004). Неогенін уперше був описаний як нетринзв’язувальний білок (Keino-Masu et al. Cell, 87(2):175-85, 1996). Це відкриття є важливим, оскільки повідомлялося, що зв'язування Нетрину-1 і Неогеніну або його близькоспорідненого рецептора DCC (делетований у колоректальному раку) скоріше стимулює, а не інгібує ріст нейритів (Braisted et al. J. Neurosci. 20: 5792-801, 2000). Таким чином, блокування RGM A запускає RGM-опосередковане 1 UA 99343 C2 5 10 15 20 25 30 35 40 45 50 55 60 інгібування росту, забезпечуючи зв'язування неогеніну з його стимулюючим ріст нейритів лігандом Нетрином. На основі цих спостережень, можна зробити припущення, що нейтралізація RGM A перевершує нейтралізацію неогеніну на моделях ушкодження спинного мозку людини. Крім зв'язування RGM A з Неогеніном і індукції інгібування росту нейритів, зв'язування RGM A або B з морфогенетичними білками кістки BMP-2 і BMP-4 може перешкоджати успішній нейрорегенерації і функціональному відновленню (Mueller et al., Philos. Trans. R. Soc. Lond. B. Biol. Sci. 361: 1513-29, 2006). У даній галузі існує необхідність у поліпшених антитілах, здатних зв'язувати RGM A, переважно, у моноклональному антитілі, яке блокує RGM A і перешкоджає взаємодії RGM A і його рецептора, і/або зв’язувальних білків, тобто Неогеніну і BMP-2, BMP-4. Дана заявка стосується (a) одержання нейтралізуючого моноклонального антитіла проти RGM A, яке селективно інгібує зв'язування RGM A і рецептора, Неогеніну і морфогенетичних білків кістки 2 і 4 (BMP-2, BMP-4), і (b) одержання нейтралізуючого моноклонального антитіла проти RGM A, яке селективно інгібує зв'язування RGM A з морфогенетичними білками кістки 2 і 4 (BMP-2, BMP-4). Вважають, що ці нейтралізуючі моноклональні антитіла за даним винаходом стимулюють ріст уражених або ушкоджених нервових волокон і формування функціональних синапсів регенеруючих нервових волокон, оскільки одне з нейтралізуючих моноклональних антитіл за даним винаходом, очевидно, перетворює інгібіторну природу RGM A у стан, при якому нервові клітини віддають перевагу мігруванню і росту на RGM А-субстраті, а не на пермісивному субстраті, такому як Колаген I. Крім того, антитіло здатне індукувати віддалену регенерацію на моделі in vivo ушкодження зорового нерва щурів, а також підсилює мієлінізацію ушкоджених і регенеруючих нервових волокон. Таким чином, було зроблене припущення, що нейтралізуючі моноклональні антитіла за даним винаходом стимулюють регенерацію нейронів і ріст ушкоджених або зруйнованих нейронних сполук в ушкодженій або запаленій ЦНС людини, наприклад, при розсіяному склерозі, після гострого ушкодження спинного мозку, травми головного мозку або при нейродегенеративних захворюваннях, таких як, наприклад, хорея Хантінгтона, хвороба Паркінсона, хвороба Альцгеймера. Суть винаходу Відповідно до одного з аспектів даний винахід стосується зв’язувального білка, який -7 дисоціює з RGM A людини (hRGM A) зі значенням KD, що дорівнює 1×10 M або менше, і -2 -1 константою швидкості дисоціації koff, що дорівнює 1×10 с або менше, причому обидві константи визначають способом резонансу поверхневих плазмонів. Відповідно до іншого аспекту винахід стосується зв’язувального білка, наприклад зв’язувального білка, що має вищевказані кінетичні властивості, який зв'язується з RGM A людини і нейтралізує активність, що інгібує розростання нейритів RGM A людини, як визначено стандартним аналізом in vitro, наприклад аналізом нейронного росту Ntera, наведеним як приклад 3 нижче. Даний винахід також стосується зв’язувального білка, як визначено вище, який має щонайменше одну з наступних додаткових функціональних характеристик: здатності зв'язувати RGM A щура, здатності зв'язувати RGM C людини, і здатності зв'язувати RGM C щура. Зокрема, описаний у даному документі зв’язувальний білок модулює здатність RGM зв'язуватися щонайменше з одним з його рецепторів. Такий зв’язувальний білок, зокрема, зв'язується з рецепторзв’язувальним доменом RGM A людини. Були ідентифіковані N- і C-кінцеві рецепторзв’язувальні домени. Конкретні варіанти зв’язувальних білків за винаходом здатні зв'язуватися з N-кінцевим рецепторзв’язувальним доменом RGM A, як показано за допомогою інгібування зв'язування N-кінцевого фрагмента hRGM A, наприклад, 47-168, і молекул рецептора, таких як Неогенін і BMP-4. Зазначений Nкінцевий фрагмент hRGM A може мати загальну довжину від приблизно 30 до приблизно 150 амінокислотних залишків або від приблизно 30 до приблизно 122 амінокислотних залишків. Як необмежувальний приклад, можна указати Фрагмент 0 (відповідний N-кінцевим залишкам 47168) hRGM A, як описано в даному документі, або будь-який більш короткий рецепторзв’язувальний фрагмент. Зокрема, зазначений зв’язувальний білок модулює, переважно інгібує, щонайменше одну з наступних взаємодій: зв'язування RGM A людини з BMP-4 людини, зв'язування hRGM A з Неогеніном людини, зв'язування hRGM C з Неогеніном людини, 2 UA 99343 C2 5 зв'язування RGM A людини з BMP-2 людини. Відповідно до одного з конкретних варіантів здійснення, зв'язувальний білок, визначений у даному документі, є гуманізованим антитілом. Описаний вище зв’язувальний білок може мати антигензв’язувальний домен, причому зазначений антигензв’язувальний домен здатний зв'язувати епітоп молекули RGM і зазначений антигензв’язувальний домен містить щонайменше один CDR, що місти амінокислотну послідовність, вибрану з групи, що складається з GTTPDY FQATHDPLT ARRNEYYGSSFFDY LQGYIPPRT 10 15 модифікованих амінокислотних послідовностей CDR, послідовність яких щонайменше на 50% ідентична одній з зазначених послідовностей. В іншому варіанті здійснення винахід стосується зв’язувального білка, що містить антигензв’язувальний домен, причому зазначений зв’язувальний домен здатний зв'язувати епітоп молекули RGM, причому зазначений антигензв’язувальний домен містить щонайменше один CDR, що містить амінокислотну послідовність, вибрану з групи, що складається з: GTTPDY FQATHDPLT ARRNEYYGSSFFDY LQGYIPPRT 20 25 30 (SEQ ID NO: 59), (SEQ ID NO: 62), (SEQ ID NO: 65), (SEQ ID NO: 68), і (SEQ ID NO: 59), (SEQ ID NO: 62), (SEQ ID NO: 65), (SEQ ID NO: 68), і модифікованих амінокислотних послідовностей CDR, послідовність яких щонайменше на 50% ідентична, наприклад, щонайменше на 55, 60, 65, 70, 75, 80, 85, 90, 95% ідентична одній з зазначених послідовностей. Наприклад, зазначений зв’язувальний білок може містити два з зазначених CDR, наприклад SEQ ID NO: 59 і 62 або SEQ ID NO: 65 і 68; де щонайменше один із зазначених CDR може бути модифікованим і мати послідовність, що щонайменше на 50%, наприклад, щонайменше на 55, 60, 65, 70, 75, 80, 85, 90, 95% ідентична одній з зазначених послідовностей. Зазначений зв’язувальний білок може також містити щонайменше один CDR, що містить амінокислотну послідовність, вибрану з групи, яка складається з SEQ ID NO: 57, 58, 60, 61, 63, 64, 66, 67 і модифікованих амінокислотних послідовностей CDR, що щонайменше на 50%, наприклад, щонайменше на 55, 60, 65, 70, 75, 80, 85, 90, 95% ідентичні одній з зазначених послідовностей. Інший варіант здійснення стосується зв’язувального білка, у якому зазначений щонайменше один CDR містить амінокислотну послідовність, вибрану з групи, що складається з: SEQ ID NO:57 SEQ ID NO:58 SEQ ID NO:59 SEQ ID NO:60 SEQ ID NO:61 SEQ ID NO:62 Залишки 24-39 SEQ ID NO:10 Залишки 55-61 SEQ ID NO:10 Залишки 94-102 SEQ ID NO:10 SEQ ID NO:63 SEQ ID NO:64 SEQ ID NO:65 Залишки 31-35 SEQ ID NO:55 Залишки 50-66 SEQ ID NO:55 Залишки 97-110 SEQ ID NO:55 SEQ ID NO:66 SEQ ID NO:67 SEQ ID NO:68 35 Залишки 31-35 SEQ ID NO:34 Залишки 50-66 SEQ ID NO:34 Залишки 99-104 SEQ ID NO:34 Залишки 24-34 SEQ ID NO:56 Залишки 50-56 SEQ ID NO:56 Залишки 89-97 SEQ ID NO:56 В одному з конкретних варіантів здійснення, зазначений зв’язувальний білок містить щонайменше 3 CDR, які вибрані з набору CDR варіабельних доменів, що складається з:a 3 UA 99343 C2 Набору VH 5F9 VH 5F9 CDR-H1 VH 5F9 CDR-H2 VH 5F9 CDR-H3 Набору VL 5F9 VL 5F9 CDR-L1 VL 5F9 CDR-L2 VL 5F9 CDR-L3 Набору VH 8D1 VH 8D1 CDR-H1 VH 8D1 CDR-H2 VH 8D1 CDR-H3 Набору VL 8D1 VL 8D1 CDR-L1 VL 8D1 CDR-L2 VL 8D1 CDR-L3 5 10 15 Залишки 31-35 SEQ ID NO:34 Залишки 50-66 SEQ ID NO:34 Залишки 99-104 SEQ ID NO:34 SEQ ID NO:57 SEQ ID NO:58 SEQ ID NO:59 Залишки 24-39 SEQ ID NO:10 Залишки 55-61 SEQ ID NO:10 Залишки 94-102 SEQ ID NO:10 SEQ ID NO:60 SEQ ID NO:61 SEQ ID NO:62 Залишки 31-35 SEQ ID NO:55 Залишки 50-66 SEQ ID NO:55 Залишки 97-110 SEQ ID NO:55 SEQ ID NO:63 SEQ ID NO:64 SEQ ID NO:65 Залишки 24-34 SEQ ID NO:56 Залишки 50-56 SEQ ID NO:56 Залишки 89-97 SEQ ID NO:57 SEQ ID NO:66 SEQ ID NO:67 SEQ ID NO:68 або набору варіабельних доменів, у яких щонайменше один із зазначених 3 CDR є модифікованою амінокислотною послідовністю CDR, що щонайменше на 50%, наприклад, щонайменше на 55, 60, 65, 70, 75, 80, 85, 90, 95% ідентична вихідній послідовності. Зокрема, кожна з вищевказаних модифікацій може бути одержана додаванням, делецією або, зокрема, заміною однієї амінокислоти або декількох амінокислот або їх комбінаціями. В іншому з варіантів здійснення, зв'язувальний білок містить щонайменше два набори CDR варіабельних доменів. Зокрема, зазначені щонайменше два набори CDR вибрані з групи, що складається з: VH 5F9-набору і VL 5F9-набору; і VH 8D1-набору і VL 8D1-набору. Зв’язувальний білок за даним винаходом додатково містить акцепторну каркасну ділянку людини. Зазначена акцепторна каркасна ділянка людини може містити щонайменше одну амінокислотну послідовність, вибрану з групи, що складається з SEQ ID NO: 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32 і 33. Зв’язувальний білок за винаходом може, зокрема, містити щонайменше один з наборів каркасних послідовностей, вибраних із групи, що складається з наборів: (1) Набір VH3-48 (SEQ ID NO:15, 16 і 17), Набір VH3-33 (SEQ ID NO:21, 22 і 23), Набір VH3-23 (SEQ ID NO:24, 25 і 26), 20 25 кожний з який комбінований з додатковою каркасною послідовністю, вибраною з JH3 (SEQ ID NO:18), JH4 (SEQ ID NO:19), JH6 (SEQ ID NO:20); Або (2) 30 35 вибраних із групи, що складається з наборів A18-набір: (SEQ ID NO: 27, 28 і 29), A17-набір: (SEQ ID NO: 31, 32 і 33), кожний з який об'єднаний з додатковою каркасною послідовністю, вибраною з групи, що складається з JK2 (SEQ ID NO:2). Відповідно до конкретних варіантів здійснення, зв'язувальний білок будь-якого варіанта, описаного вище, містить щонайменше один CDR-щеплений варіабельний домен важкого ланцюга, вибраний з SEQ ID NO: 35, 36, 37, 38, 39, 40, 41, 42 і 43; і/або щонайменше один CDRщеплений варіабельний домен легкого ланцюга, вибраний з SEQ ID NO: 44, 45 і 46. Більш конкретно, зв'язувальний білок за винаходом містить комбінацію двох варіабельних доменів, де зазначені два варіабельні домени мають амінокислотні послідовності, вибрані з: SEQ ID NO: 35 і 44; 36 і 44; 37 і 44; 38 і 44; 39 і 44; 40 і 44; 41 і 44; 42 і 44; 43 і 44; SEQ ID NO: 35 і 45; 36 і 45; 37 і 45; 38 і 45; 39 і 45; 40 і 45; 41 і 45; 42 і 45; 43 і 45; SEQ ID NO: 35 і 46; 36 і 46; 37 і 46; 38 і 46; 39 і 46; 40 і 46; 41 і 46; 42 і 46; 43 і 46; 4 UA 99343 C2 5 10 15 20 25 30 35 40 45 50 55 60 В іншому варіанті здійснення за винаходом, зазначена акцепторна каркасна ділянка людини зв’язувального білка містить щонайменше одну амінокислотну заміну каркасної ділянки в ключовому залишку, причому зазначений ключовий залишок вибраний із групи, що складається з: залишку, суміжного з CDR; залишку сайта глікозилування; рідкого залишку; залишку, здатного взаємодіяти з епітопом RGM; залишку, здатного взаємодіяти з CDR; канонічного залишку; контактного залишку між варіабельною областю важкого ланцюга і варіабельною областю легкого ланцюга; залишку в зоні Vernier; N-кінцевого залишку, здатного утворювати параглутамат, і залишку в області перекриття CDR1 варіабельної області важкого ланцюга по Хотія і першою каркасною ділянкою важкого ланцюга по Кебату. Зокрема, зазначені ключові залишки вибрані з групи, що складається з (положення в послідовності важкого ланцюга) 1, 5, 37, 48, 49, 88, 98, (положення в послідовності легкого ланцюга): 2, 4, 41, 51. В одному з конкретних варіантів здійснення зв’язувальний білок за винаходом є консенсусним варіабельним доменом людини або містить консенсусний варіабельний домен людини. Відповідно до іншого варіанта здійснення зв’язувальний білок за винаходом, зазначена акцепторна каркасна ділянка людини містить щонайменше одну амінокислотну заміну каркасної області, де амінокислотна послідовність каркасної ділянки щонайменше на 65%, наприклад, щонайменше на 70, 75, 80, 85, 90, 95, 96, 97, 98 або 99% ідентична послідовності зазначеної акцепторної каркасної ділянки людини і містить щонайменше 70 амінокислотних залишків, наприклад, щонайменше 75, 80 або 85 залишків, ідентичних зазначеній акцепторній каркасній ділянці людини. Відповідно до конкретного варіанта здійснення, зв'язувальний білок за винаходом містить щонайменше один варіабельний домен з мутованою каркасною ділянкою, що має амінокислотну послідовність, вибрану з групи, яка складається з: SEQ ID NO: 47, 48, 49, 50 (VH-домен), і/або вибрану з групи, що складається з: SEQ ID NO: 51, 52, 53 і 54 (VL-домен). Зокрема, зазначений зв’язувальний білок містить два необов'язково мутовані у каркасній ділянці варіабельні домени, де зазначені два варіабельні домени мають амінокислотні послідовності, вибрані з груп, що складаються з: SEQ ID NO: 47 і 44; 47 і 45; 47 і 46; 47 і 51; 47 і 52; 47 і 53; 47 і 54; SEQ ID NO: 48 і 44; 48 і 45; 48 і 46; 48 і 51; 48 і 52; 48 і 53; 48 і 54; SEQ ID NO: 49 і 44; 49 і 45; 49 і 46; 49 і 51; 49 і 52; 49 і 53; 49 і 54; SEQ ID NO: 50 і 44; 50 і 45; 50 і 46; 50 і 51; 50 і 52; 50 і 53; 50 і 54; Зв’язувальні білки за винаходом, описані в даному описі, здатні зв'язувати щонайменше одну мішень, вибрану з молекул RGM. Зокрема, білки здатні зв'язувати RGM A людини і, необов'язково, одну додаткову молекулу RGM людини або собакоподібних мавп, щура, курки, жаби і риби. Наприклад, білки можуть додатково зв'язуватися з RGM A щура, RGM C людини і/або RGM C щура. Зокрема, зв'язувальний білок за винаходом здатний модулювати, зокрема, здатний нейтралізувати або інгібувати біологічну функцію мішені, вибраної з молекул RGM, визначених вище. Зокрема, зв'язувальний білок за винаходом модулює, зокрема, інгібує здатність RGM зв'язуватися щонайменше з одним з його рецепторів, наприклад Неогеніном і ВМР, таким як BMP-2 і BMP-4. Наприклад, зазначений зв’язувальний білок модулює, зокрема, зменшує і, переважно, інгібує щонайменше одну з наступних взаємодій: зв'язування RGM A людини з BMP-4 людини, зв'язування hRGM A з Неогеніном людини, зв'язування hRGM C з Неогеніном людини, зв'язування RGM A людини з BMP-2 людини. 5 UA 99343 C2 Зв’язувальні білки з різними комбінаціями функціональних ознак і, отже, демонструючі різні функціональні характеристики, як описано в даному описі, входять у рамки даного винаходу. Необмежувальні приклади таких характеристик наведені в списку нижче. Характеристики Ознака 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 Зв'язування з RGM A людини Зв'язування з RGM A щура Зв'язування з RGM С людини Зв'язування з RGM С щура Інгібування зв'язування hRGM A з Неогеніном людини Інгібування зв'язування hRGM С с Неогеніном людини Інгібування зв'язування hRGM A з BMP-2 людини Інгібування зв'язування hRGM A з BMP-4 людини + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + 5 10 15 20 25 30 Наприклад, характеристика 1 зустрічається у випадку антитіла 5F9, описаного в даному винаході, і його похідних, описаних у даному описі. Наприклад, характеристика 2 зустрічається у випадку антитіла 8D1, описаного в даному винаході, і його похідних, описаних у даному описі. Зокрема, зв'язувальний білок за винаходом здатний інгібувати щонайменше одну біологічну активність RGM, зокрема RGM A, де зазначений RGM A вибраний з RGM A людини, собакоподібних мавп, щура, курки, жаби і риби. Відповідно до іншого варіанта здійснення, зв'язувальний білок за винаходом має одну або декілька з наступних кінетичних ознак: (a) константу швидкості асоціації (k on) для зазначеної мішені, вибрану з групи, що 2 -1 -1 3 -1 -1 складається з: щонайменше приблизно 10 M c ; щонайменше приблизно 10 M c ; 4 -1 -1 5 -1 -1 щонайменше приблизно 10 M c ; щонайменше приблизно 10 M c ; щонайменше приблизно 6 -1 -1 7 -1 -1 10 M c і щонайменше приблизно 10 M c , як виміряно способом резонансу поверхневих плазмонів; (b) константу швидкості дисоціації (koff) для зазначеної мішені, вибрану з групи, що -2 -1 -3 -1 складається з: найбільше приблизно 10 с ; найбільше приблизно 10 с ; найбільше приблизно -4 -1 -5 -1 -6 -1 10 с ; найбільше приблизно 10 с і найбільше приблизно 10 с , як виміряно способом резонансу поверхневих плазмонів; або (c) константу дисоціації (KD) для зазначеної мішені, вибрану з групи, що складається з: -7 -8 -9 найбільше приблизно 10 M; найбільше приблизно 10 M; найбільше приблизно 10 M; -10 -11 -12 найбільше приблизно 10 M; найбільше приблизно 10 M; найбільше приблизно 10 M і -13 найбільше приблизно 10 M. Відповідно до додаткового аспекту, винахід стосується конструкції антитіла, що містить вищеописаний зв’язувальний білок, причому зазначена конструкція антитіла містить лінкерний поліпептид або константний домен імуноглобуліну. 6 UA 99343 C2 5 10 15 20 25 30 35 40 45 50 55 Зазначена конструкція антитіла або зв’язувальний білок за винаходом можуть бути вибрані з групи, що складається з: молекули імуноглобуліну, моноклонального антитіла, химерного антитіла, CDR-щепленого антитіла, гуманізованого антитіла, Fab, Fab', F(ab')2, Fv, дисульфідзв’язаного Fv, scFv, однодоменного антитіла, діатіла, мультиспецифічного антитіла, антитіла з подвійною специфічністю, імуноглобуліну з двома варіабельними доменами і біспецифічного антитіла. У конструкції антитіла за винаходом зазначений зв’язувальний білок містить константний домен важкого ланцюга імуноглобуліну, вибраний із групи, що складається з: константного домену ІgМ людини, константного домену IgG1 людини, константного домену IgG2 людини, константного домену IgG3 людини, константного домену IgG4 людини, константного домену ІgЕ людини, константного домену IgD людини, константного домену ІgА1 людини, константного домену ІgА2 людини, константного домену IgY людини і відповідних мутованих константних доменів. Зокрема, конструкція антитіла за винаходом містить константний домен імуноглобуліну з амінокислотною послідовністю, вибраною з групи, що складається з SEQ ID NO: 11, 12, 13 і 14. Відповідно до іншого аспекту даний винахід стосується кон’югата антитіла, що містить описану в даному документі конструкцію антитіла, причому зазначене антитіло додатково містить засіб, вибраний із групи, що складається з: молекули імуноадгезії, засобу візуалізації, терапевтичного засобу і цитотоксичного засобу, причому кожен засіб є кон’югованим, наприклад ковалентно зв'язаним, із зазначеним зв’язувальним білком. Наприклад, зазначеним засобом є засіб візуалізації, вибраний із групи, що складається з радіоактивної мітки, ферменту, флуоресцентної мітки, люмінесцентної мітки, біолюмінесцентної мітки, магнітної мітки і біотину. Зокрема, зазначеним засобом візуалізації є радіоактивна мітка, 3 14 35 90 99 111 125 131 177 166 153 вибрана з групи, що складається з: H, C, S, Y, Tc, In, I, I, Lu, Ho і Sm. Наприклад, зазначений засіб є терапевтичним або цитотоксичним засобом, вибраним із групи, що складається з: антиметаболіту, алкілувального засобу, антибіотика, фактора росту, цитокіну, антиангіогенного засобу, антимітотичного засобу, антрацикліну, токсину й апоптотичного засобу. Відповідно до іншого варіанта здійснення, зазначений зв’язувальний білок за винаходом, як визначено в даному описі, має характер глікозилування, характерний для людини. Крім того, зв'язувальні білки, конструкції антитіл і кон’югат антитіла за винаходом можуть знаходитися у вигляді кристала (у кристалічній формі), переважно, зі збереженням біологічної активності. Зокрема, зазначений кристал являє собою фармацевтичний кристал, який не містить носія з контрольованим вивільненням. Завдяки зазначеній кристалічній формі зв’язувальний білок, конструкція антитіла або кон’югат антитіла може мати більший час напівжиття in vivo, ніж відповідна розчинна копія. В іншому аспекті винахід стосується виділеної нуклеїнової кислоти, що кодує амінокислотну послідовність зв’язувального білка, амінокислотну послідовність конструкції антитіла й амінокислотну послідовність кон’югата антитіла, як визначено в даному описі. Даний винахід також стосується вектора, що містить виділену нуклеїнову кислоту, описану в даному розкритті. Зокрема, вектор вибраний із групи, що складається з pcDNA, pTT, pTT3, pEFBOS, pBV, pJV і pBJ. Винахід також стосується клітини-хазяїна, що містить такий вектор. Зокрема, зазначена клітина-хазяїн є прокаріотичною клітиною, наприклад E.coli, або еукаріотичною клітиною і може бути вибрана з групи, що складається з клітини одноклітинного організму, клітини тварини, клітини рослини і грибної клітини. Зокрема, зазначеною еукаріотичною клітиною є клітина тварини, вибрана з групи, що складається з: клітини ссавця, клітини птаха і клітини комахи. Переважно, зазначена клітина-хазяїн вибрана із клітин HEK, клітин CHO, клітин COS і клітин дріжджів. Клітиною дріжджів може бути Saccharomyces cerevisiae, а клітиною комахи може бути клітина Sf9. Винахід також стосується способу одержання білка, здатного зв'язувати RGM, який передбачає культивування клітини-хазяїна, визначеної в даному описі, у культуральному 7 UA 99343 C2 5 10 15 20 25 30 35 40 45 50 55 60 середовищі при умовах, достатніх для одержання зв’язувального білка, здатного зв'язувати RGM. Винахід також стосується білка, одержуваного відповідно до зазначеного способу. Винахід також стосується композиції для вивільнення зв’язувального білка, причому зазначена композиція містить (a) композицію, де зазначена композиція містить кристалізований продукт-білок, визначений у даному описі, і інгредієнт; і (b) щонайменше один полімерний носій. Зазначеним полімерним носієм може бути полімер, вибраний із групи, що складається з: полі(акрилової кислоти), полі(ціаноакрилатів), полі(амінокислот), полі(ангідридів), полі(депсипептиду), полі(ефірів), полі(молочної кислоти), полі(співполімеру молочної і гліколевої кислот) або PLGA, полі(b-гідроксибутирату), полі(капролактону), полі(діоксанону); полі(етиленгліколю), полі(гідроксипропіл)метакрилату, полі[(органо)фосфазену], полі(ортоефірів), полі(вінілового спирту), полі(вінілпіролідону), співполімерів малеїнового ангідриду й алкілвінілового ефіру, плюронікових поліолів, альбуміну, альгінату, целюлози і похідних целюлози, колагену, фібрину, желатину, гіалуронової кислоти, олігосахаридів, глікаміногліканів, сульфатованих полісахаридів, їх сумішей і співполімерів. Зазначений інгредієнт може бути вибраний із групи, що складається з альбуміну, сахарози, трегалози, лактиту, желатину, гідроксипропіл-β-циклодекстрину, метоксиполіетиленгліколю і поліетиленгліколю. Відповідно до іншого аспекту, винахід стосується способу лікування ссавця, який передбачає стадію введення ссавцю ефективної кількості композиції, визначеної в даному описі. Відповідно до іншого аспекту, винахід стосується фармацевтичної композиції, що містить продукт (зокрема зв'язувальний білок, конструкцію або кон’югат, описані вище) і фармацевтично прийнятний носій. Зазначений фармацевтично прийнятний носій може функціонувати як ад’ювант, який можна використовувати для збільшення абсорбції або дисперсії зазначеного зв’язувального білка. Наприклад, зазначеним ад’ювантом є гіалуронідаза. Відповідно до іншого варіанта здійснення, зазначений фармацевтичний препарат додатково містить щонайменше один додатковий терапевтичний засіб для лікування порушення, у якому активність RGM діє негативно. Наприклад, зазначений засіб вибраний із групи, що складається з терапевтичного засобу, засобу візуалізації, цитотоксичного засобу, інгібіторів ангіогенезу; інгібіторів кінази; блокаторів молекул костимуляції; блокаторів молекул адгезії; анти-цитокінантитіла або його функціонального фрагмента; метотрексату; циклоспорину; рапаміцину; FK506; детектованої мітки або репортера; антагоніста TNF; протиревматичного засобу; міорелаксанту, наркотичного засобу, нестероїдного протизапального лікарського засобу (NSAID), аналгезуючого засобу, анестетичного засобу, седативного засобу, місцевого анестетика, нейром’язового блокатора, протимікробного засобу, антипсоріатичного засобу, кортикостероїду, анаболічного стероїду, еритропоетину, імунізуючого засобу, імуноглобуліну, імуносупресивного засобу, гормону росту, засобу замісної гормональної терапії, радіофармацевтичного препарату, антидепресанту, антипсихотичного засобу, стимулятора, протиастматичного засобу, бета-агоніста, інгальовного стероїду, епінефрину або його аналога, цитокіну й антагоніста цитокіну. Даний винахід також стосується способу зменшення активності RGM A людини, який передбачає контактування RGM A людини щонайменше з одним продуктом (зокрема зв'язувальним білком, конструкцією або кон’югатом, описаними в даному описі вище) так, що зменшується щонайменше одна активність RGM A людини. Даний винахід також стосується способу зменшення зв'язування hRGM A з рецептором Неогеніном у індивіда, за необхідності, який передбачає стадію введення індивіду продукту за винаходом (зокрема зв'язувального білка, конструкції або кон’югата, описаних у даному описі вище). Даний винахід також стосується способу зменшення зв'язування hRGM A з морфогенетичним білком кістки 2 і/або морфогенетичним білком кістки 4 (BMP-2 і BMP-4) у індивіда, за необхідності, який передбачає стадію введення індивіду продукту за винаходом (зокрема зв'язувального білка, конструкції або кон’югата, описаних у даному описі вище). Даний винахід також стосується способу лікування порушення, пов'язаного з активністю RGM A у індивіда, який передбачає стадію введення одного або в комбінації з іншими терапевтичними засобами продукту за винаходом (зокрема зв'язувального білка, конструкції або кон’югата, описаних у даному описі вище). 8 UA 99343 C2 5 10 15 20 25 30 35 40 45 50 55 Даний винахід також стосується способу зменшення активності RGM A у індивіда, що страждає порушенням, при якому активність RGM A здійснює негативний вплив, який передбачає введення індивіду продукту за винаходом (зокрема зв'язувального білка, конструкції або кон’югата, описаних у даному описі вище), одного або в комбінації з іншими терапевтичними засобами. Зазначене порушення переважно включає неврологічні захворювання, вибрані з групи, що складається з бічного аміотрофічного склерозу, ушкодження плечового сплетіння, ушкодження головного мозку, у тому числі травматичного ушкодження головного мозку, церебрального паралічу, хвороби Гійєна-Барре, лейкодистрофій, розсіяного склерозу, поствакцинального поліомієліту, spina bifida (щілини хребта), ушкодження спинного мозку, спінально-м’язової атрофії, спінальних пухлин, інсульту, поперечного мієліту; деменції, сенільної деменції, легкого когнітивного порушення, пов'язаної з хворобою Альцгеймера деменції, хореї Хантінгтона, пізньої дискінезії, гіперкінезій, маній, хвороби Паркінсона, синдрому Стіла-Річардсона, синдрому Дауна, важкої псевдопаралітичної міастенії, травми нерва, судинного амілоїдозу, крововиливу I у головний мозок з амілоїдозом, запалення головного мозку, гострого порушення зі сплутаністю свідомості, бічного аміотрофічного склерозу, глаукоми і хвороби Альцгеймера. Інші конкретні варіанти за винаходом визначені нижче: виділений зв’язувальний білок, який специфічно взаємодіє щонайменше з одним епітопом білка hRGM A; зазначений виділений білок, який є моноклональним нейтралізуючим антитілом або його антигензв’язувальним фрагментом; зазначений антигензв’язувальний фрагмент, що містить домен VH і VL; зазначене нейтралізуюче антитіло, яке зменшує здатність hRGM A зв'язуватися з його рецептором; зазначене нейтралізуюче антитіло, здатне інгібувати біологічну активність hRGM A; зазначене антитіло, яке розпізнає рецептор RGM A, вибраний з рецептора RGM A людини, собакоподібних мавп, щура, курки, жаби і риби; зазначене антитіло, яке розпізнає білок RGM A, амінокислотна послідовність якого на 90% гомологічна амінокислотній послідовності SEQ ID NO:2; зазначене антитіло, де білок RGM A кодує нуклеїнова кислота, яка на 90% гомологічна послідовності нуклеїнової кислоти SEQ ID NO:1; зазначене антитіло, яке щонайменше на 90% ідентичне амінокислотній послідовності з послідовністю, яка містить варіабельну область важкого ланцюга (область VH), що містить послідовність SEQ ID NO:9 або 34, або гуманізовану, необов'язково, додатково мутовану версію зазначеної області VH; зазначене антитіло, яке щонайменше на 90% ідентичне амінокислотній послідовності з послідовністю, яка містить варіабельну область легкого ланцюга (область VL), що містить послідовність SEQ ID NO:10, або гуманізовану, необов'язково, додатково мутовану версію зазначеної області VL, зазначене антитіло, яке зв'язується з hRGM A, де це антитіло є глікозилованим; зазначене антитіло або антигензв’язувальний фрагмент, де зазначене антитіло або антигензв’язувальний фрагмент є мишачим антитілом, гуманізованим антитілом, повністю людським антитілом, химерним антитілом, антигензв'язувальним фрагментом гуманізованого антитіла або антигензв'язувальним фрагментом химерного антитіла; зазначене антитіло або антигензв’язувальний фрагмент, де зазначене антитіло або антигензв’язувальний фрагмент є антигензв’язувальним фрагментом, вибраним із групи, що складається з Fab-фрагмента, Fab'-фрагмента, F(ab’)2-фрагмента і Fv-фрагмента; зазначене моноклональне антитіло, яке специфічно зв'язується щонайменше з одним епітопом hRGM A, де зазначене моноклональне антитіло є моноклональним антитілом, секретованим гібридомною клітинною лінією, описаною в даному документі; зазначене моноклональне антитіло, зв'язування з яким приводить до інактивації взаємодії hRGM А з його рецептором; зазначена гібридомна клітинна лінія, яка продукує моноклональне антитіло, що специфічно зв'язується щонайменше з одним епітопом hRGM A; зазначена гібридомна клітинна лінія, де гібридома вибрана з групи, що складається з гібридоми людини, миші, щура, вівці, свині, великої рогатої худоби, кози і коня; зазначене моноклональне антитіло, зв'язування з яким приводить до інактивації hRGM A; зазначена гібридомна клітинна лінія, яка продукує моноклональне антитіло, що специфічно зв'язується щонайменше з одним епітопом hRGM A; 9 UA 99343 C2 5 10 15 20 25 30 35 40 45 50 55 60 зазначена гібридомна клітинна лінія, де гібридома вибрана з групи, що складається з гібридоми людини, миші, щура, вівці, свині, великої рогатої худоби, кози і коня; зазначене моноклональне нейтралізуюче антитіло або його антигензв’язувальний фрагмент, що має щонайменше одну характеристику, вибрану з групи, яка складається з: a) зв'язування з RGM A ссавця з афінністю в діапазоні нМ або менше; b) функціональної протидії активності RGM A in vitro в аналізі росту нейритів з ефективністю мкМ, нМ або меншою; c) індукції in vivo спрутингу (росту нервових волокон) у моделі роздавлювання зорового нерва; d) індукції in vivo спрутингу в моделі ушкодження спинного мозку; e) полегшення in vivo експериментального ушкодження спинного мозку посиленням регенеративного росту ушкоджених нервових волокон, або f) полегшення in vivo експериментального ушкодження спинного мозку посиленням утворення синапсів; виділена нуклеїнова кислота, що кодує зазначене моноклональне нейтралізуюче антитіло або антигензв’язувальний фрагмент; вектор, що містить зазначену виділену нуклеїнову кислоту; зазначений вектор, вибраний із групи, що складається з pcDNA; pTT; pTT3; pEFBOS; pBV; pJV; pHybЕ і pBJ; клітина-хазяїн, трансформована зазначеним вектором, де клітина-хазяїн вибрана із групи, що складається з клітини одноклітинного організму, клітини тварини, клітини рослини і грибної клітини; зазначена клітина-хазяїн, де клітиною тварини є клітина ссавця, вибрана з групи, що складається з HEK293, CHO і COS; клітина-хазяїн, трансформована вектором, де клітиною-хазяїном є еукаріотична клітина; спосіб одержання зв’язувального білка, що зв'язує hRGM A, який передбачає культивування клітини-хазяїна в культуральному середовищі при умовах, достатніх для одержання зв’язувального білка, що зв'язує hRGM A; фармацевтична композиція, яка містить зазначене моноклональне антитіло або антигензв’язувальну частину і фармацевтично прийнятний носій; спосіб зменшення зв'язування hRGM A з рецептором Неогеніном у індивіда, за необхідності, який передбачає стадію введення індивіду зазначеного антитіла; спосіб зменшення зв'язування hRGM A з морфогенетичним білком кістки 2 і морфогенетичним білком кістки 4 (BMP-2 і BMP-4) у індивіда, за необхідності, який передбачає стадію введення індивіду зазначеного антитіла; спосіб лікування порушення, пов'язаного з активністю RGM A індивіда, який передбачає стадію введення зазначеного антитіла, одного або в комбінації з іншими терапевтичними засобами; спосіб зменшення активності RGM A у індивіда, що страждає порушенням, при якому активність RGM A здійснює негативний вплив, який передбачає введення індивіду зазначеного антитіла, одного або в комбінації з іншими терапевтичними засобами; зазначене антитіло, яке містить щонайменше одну область VH, що містить амінокислотну послідовність, вибрану з SEQ ID NO: 35, 36, 37, 38, 39, 40, 41, 42 і 43; зазначене антитіло, яке містить щонайменше одну область VL, що містить амінокислотну послідовність, вибрану з SEQ ID NO: 44, 45 і 46; зазначене антитіло, додатково модифіковане 1-5 мутаціями в послідовності VH або VL; зазначене антитіло, де ці мутації вибрані зі зворотних мутацій каркасної ділянки і мутацій Vernier і VH/VL-суміжних залишків. Будь-яке указання на SEQ ID NO: 34 або будь-яке посилання на SEQ ID NO: 34, описане в даному документі, також стосується SEQ ID NO:9. Короткий опис креслень На фігурі 1A показане зв'язування моноклональних антитіл з hRGM A в аналізі ELISA. На фігурі 1В зображене зв'язування моноклональних антитіл з hRGM A, експресованим у клітинах HEK 293. На фігурі 1C зображене зв'язування моноклональних антитіл з RGM A щура, експресованим у клітинах HEK 293. На фігурі 2 показане зв'язування повнорозмірного RGM A з Неогеніном. MAB 5F9 інгібує зв'язування повнорозмірного fc-зв'язаного hRGM A з Неогеніном. На фігурі 3 зображене зв'язування повнорозмірного RGM A з BMP-4. MAB 5F9 інгібує зв'язування fc-зв'язаного фрагмента (47-422) повнорозмірного hRGM A з BMP-4. 10 UA 99343 C2 5 10 15 20 25 30 35 40 45 50 55 На фігурі 4 зображене зв'язування фрагмента 0 RGM A з BMP-4. MAB 5F9 інгібує зв'язування fc-зв'язаного фрагмента 0 (47-168) з BMP-4. На фігурі 5 показане зв'язування повнорозмірного RGM A з BMP-2. MAB 5F9 інгібує зв'язування fc-зв'язаного фрагмента повнорозмірного hRGM A (47-422) з BMP-2. На фігурі 6 представлене об'єднання мікрофотографій, що показують mAb5F9нейтралізацію фрагмента RGM A в аналізі росту нейритів клітин Ntera. MAB 5F9 нейтралізує інгібуючу ріст активність fc-кон’югованого, сильного інгібувального фрагмента hRGM A в аналізах росту нейритів з агрегатами Ntera людини. A. Контрольна культура, ріст нейронів Ntera на ламініні B, на субстраті ламінін-фрагмент hRGM A (47-168), C-E, на субстраті ламінінфрагмент hRGM A (47-168) у присутності 0,1 мкг/мл MAB 5F9 (C), 1 мкг/мл MAB 5F9 (D), 10 мкг/мл MAB 5F9 (E). На фігурі 7 показаний кількісний аналіз результатів аналізу Ntera-2. MAB 5F9 нейтралізує залежним від дози чином інгібуючу ріст активність fc-кон’югованого, сильного інгібувального фрагмента hRGM A (фрагмента 0, 47-168) в аналізах росту нейритів з агрегатами Ntera людини. На фігурі 8 показаний кількісний аналіз тесту зі смугами SH-SY5Y. MAB 5F9 нейтралізує відштовхування, індуковане смугами, що складаються з повнорозмірного RGM A людини нейронних клітин SH-SY5Y людини в смугастих покриттях мембран. За відсутності MAB 5F9 (A) або в присутності низьких концентрацій MAB нейрони SH-SY5Y віддають перевагу уникненню RGM A-смуг. Ця поведінка приводить до збільшення концентрацій MAB 5F9. (B-D). При найвищій концентрації MAB (10 мкг/мл) (E), нейрони SH-SY5Y виявляють сильну перевагу відносно смуг RGM А в порівнянні зі смугами Колагену I. На фігурі 9 підсумований кількісний аналіз характеристик зв'язування mABs 5F9 і 8D1. MAB 5F9 і 8D1 оцінювали в аналізах зв'язування hRGM A - неогенін, hRGM A - BMP-2 і hRGM A BMP-4 при різних концентраціях. На фігурі 10 показана нейтралізуюча активність відносно хемовідштовхувальної активності гуманізованих антитіл 5F9 (h5F9.21, h5F9.23, h5F9.25) в аналізі хемотаксису SH-SY5Y. На фігурі 11 показана in vivo нейрорегенеративна активність локального нанесення 5F9 на моделі ушкодження зорового нерва тварини. Локальне нанесення MAB 5F9 нейтралізує RGM A і стимулює регенеративний ріст аксонів ушкодженого зорового нерва в моделі роздавлювання зорового нерва тварини (щура). В оброблених 5F9 тваринах (A), багато які GAP-43-позитивні волокна подовжуються за межі ділянки роздавлювання на відміну від контрольного MAB 8D1 (B), що не зв'язується з RGM A щура. Фігури 12A і 12B показаний кількісний аналіз локального нанесення 5F9 у моделі ушкодження зорового нерва тварини. (A) 5F9, але не контрольне MAB 8D1, значно збільшувало кількість GAP-43-позитивних волокон, що регенеруються. Значимо більше волокон (p
ДивитисяДодаткова інформація
Назва патенту англійськоюMonoclonal antibodies against the rgm a protein and uses thereof
Автори англійськоюMuller, Bernhard, K., Schmidt, Martin, Barlow, Eve, H., Leddy, Mary, R., Hsieh, Chung-ming, Bardwell, Phillip, D.
Назва патенту російськоюМоноклональные антитела против белка rgm а и их применение
Автори російськоюМюллер Бернхард Ж., Шмидт Мартин, Барлоу Ив Х., Ледди Мери Р., Хсиех Чунг-минг, Бардуелл Филип Д.
МПК / Мітки
МПК: C07K 16/22, A61K 39/395
Мітки: моноклональні, білка, антитіла, застосування
Код посилання
<a href="https://ua.patents.su/131-99343-monoklonalni-antitila-proti-bilka-rgm-a-i-kh-zastosuvannya.html" target="_blank" rel="follow" title="База патентів України">Моноклональні антитіла проти білка rgм а і їх застосування</a>
Попередній патент: Ґрунтоущільнювальна машина
Наступний патент: Пристрій газифікації з обладнанням для видалення шлаку
Випадковий патент: Спосіб відстроювання від впливу зазору у вихрострумовій дефектоскопії феромагнітних виробів