Антибіотичні мікрочастинки для інгаляції
Формула / Реферат
1. Препарат у вигляді сухого порошку для легеневого введення, що містить мікрочастинки, що складаються з частинок антибіотика, що належить до родини аміноглюкозидів, у кількості, що становить 98-99,9 % у ваговому співвідношенні та стеарату магнію у кількості, що становить 0,1-2 % у ваговому співвідношенні, де стеарат магнію вкриває всю поверхню частинок ліків на щонайменше 50 %, де щонайменше 90 % вказаних мікрочастинок мають діаметр об'єму менший ніж приблизно 10 мікрон, та вказані мікрочастинки отримані за допомогою способу механічного cплавлення.
2. Препарат за п. 1, де антибіотик вибраний з групи, що охоплює тобраміцин, канаміцин А, дибекацин, амікацин та арбекацин.
3. Препарат за п. 2, де антибіотик є тобраміцином.
4. Препарат за п. 3, де кількість тобраміцину становить 99-99,5 % та кількість стеарату магнію може також становити 0,5-1,0 % у ваговому співвідношенні.
5. Препарат за будь-яким з пп. 1-4, де мікрочастинки мають кількість залишкової води менше ніж 5 % у ваговому співвідношенні.
6. Препарат за будь-яким з попередніх пунктів, що додатково містить фізіологічно прийнятний фармакологічно інертний носій.
7. Мікрочастинки, що складаються з частинок антибіотика, що належить до родини аміноглюкозидів, у кількості, що становить 98-99,9 % у ваговому співвідношенні та стеарату магнію у кількості, що становить 0,1-2 % у ваговому співвідношенні, де стеарат магнію вкриває всю поверхню частинок ліків на щонайменше 50 %, де щонайменше 90 % вказаних мікрочастинок мають діаметр об'єму менший ніж приблизно 10 мікрон, та вказані мікрочастинки отримані за допомогою способу механічного cплавлення.
8. Мікрочастинки за п. 7, де антибіотик є тобраміцином.
9. Мікрочастинки за п. 8, де кількість тобраміцину становить 99-99,5 % та кількість стеарату магнію може також становити 0,5-1,0 % у ваговому співвідношенні.
10. Капсула для застосування з інгалятором сухого порошку, наповнена препаратом у вигляді сухого порошку за п. 1.
11. Спосіб отримання мікрочастинок за п. 7, що полягає у:
і) навантаженні частинок антибіотика та стеарату магнію у рухомий резервуар приладу для механічного сплавлення;
іі) обробці частинок протягом часу у щонайменше 5 хвилин, та
ііі) збиранні отриманих мікрочастинок.
12. Спосіб за п. 11, де антибіотиком є тобраміцин.
13. Спосіб за п. 11 або 12, з обробкою частинок протягом часу у щонайменше 5 хвилин.
14. Мікрочастинки за п. 7 або 8 для застосування у лікуванні ендобронхіальної бактеріальної інфекції, пов'язаної з легеневим захворюванням.
15. Мікрочастинки за п. 14, де захворювання вибране з групи, що охоплює муковісцидоз (КФ), не пов'язаний з КФ бронхоектаз, пневмонію, ХОЗЛ та туберкульоз.
16. Мікрочастинки за п. 15, де захворювання є муковісцидозом.
Текст
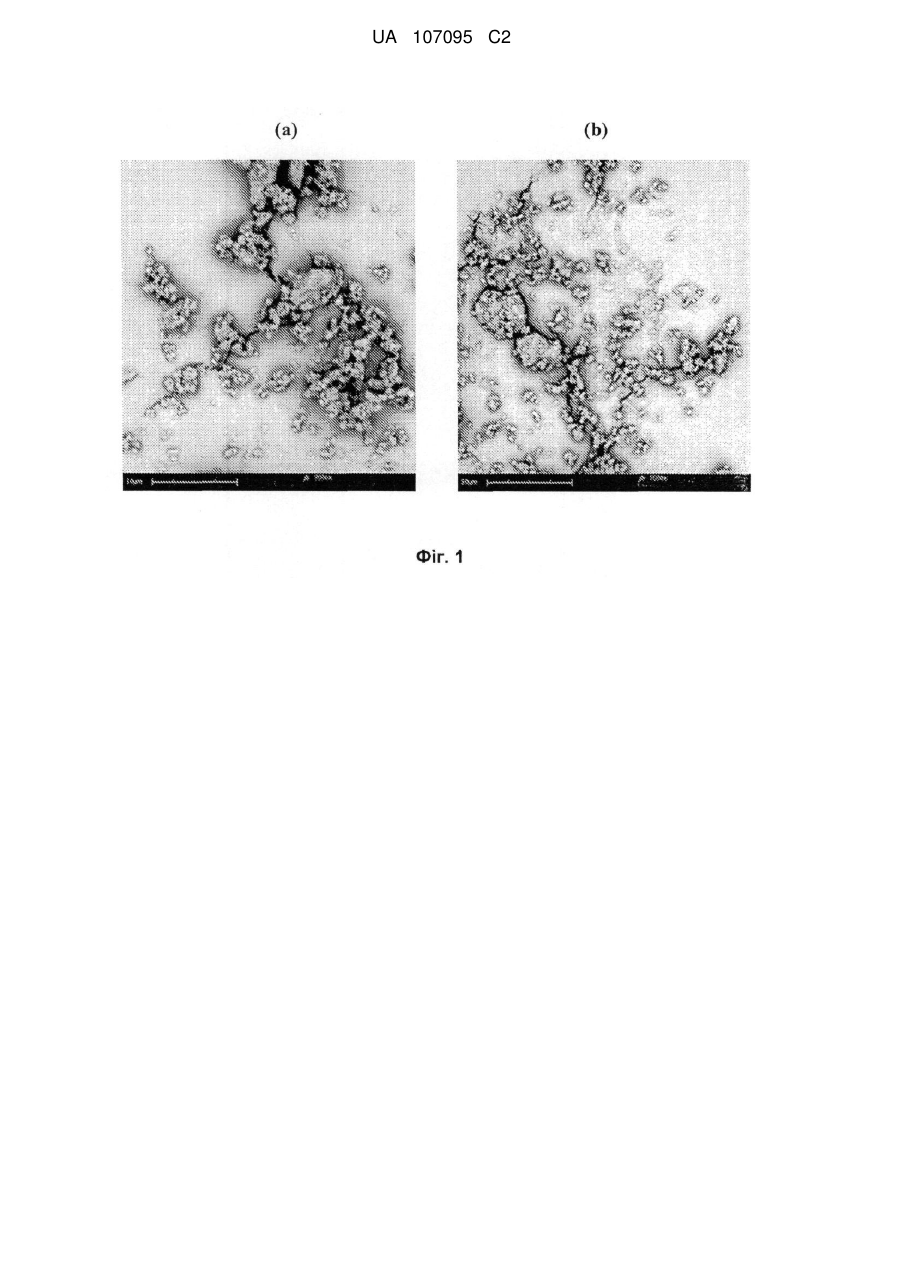
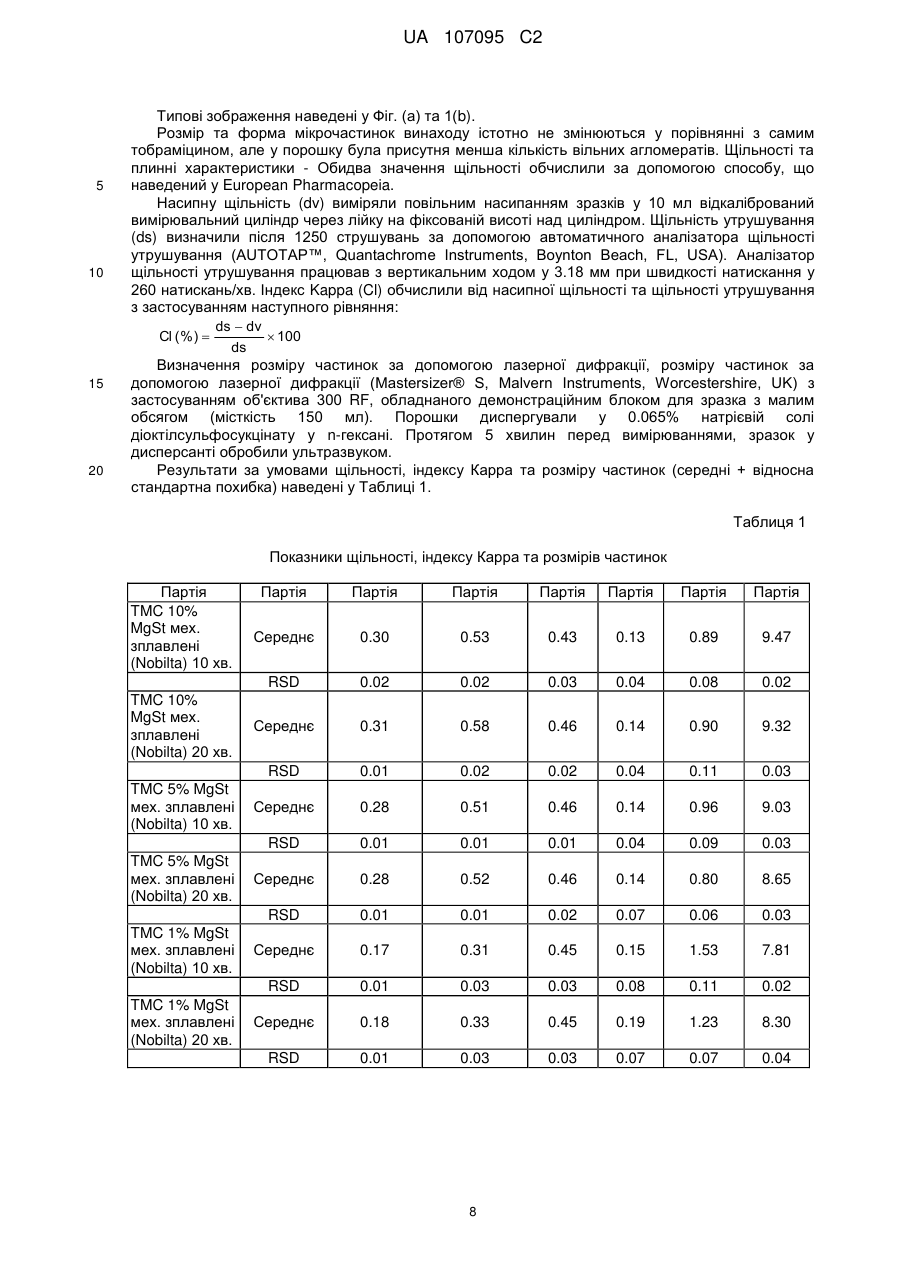
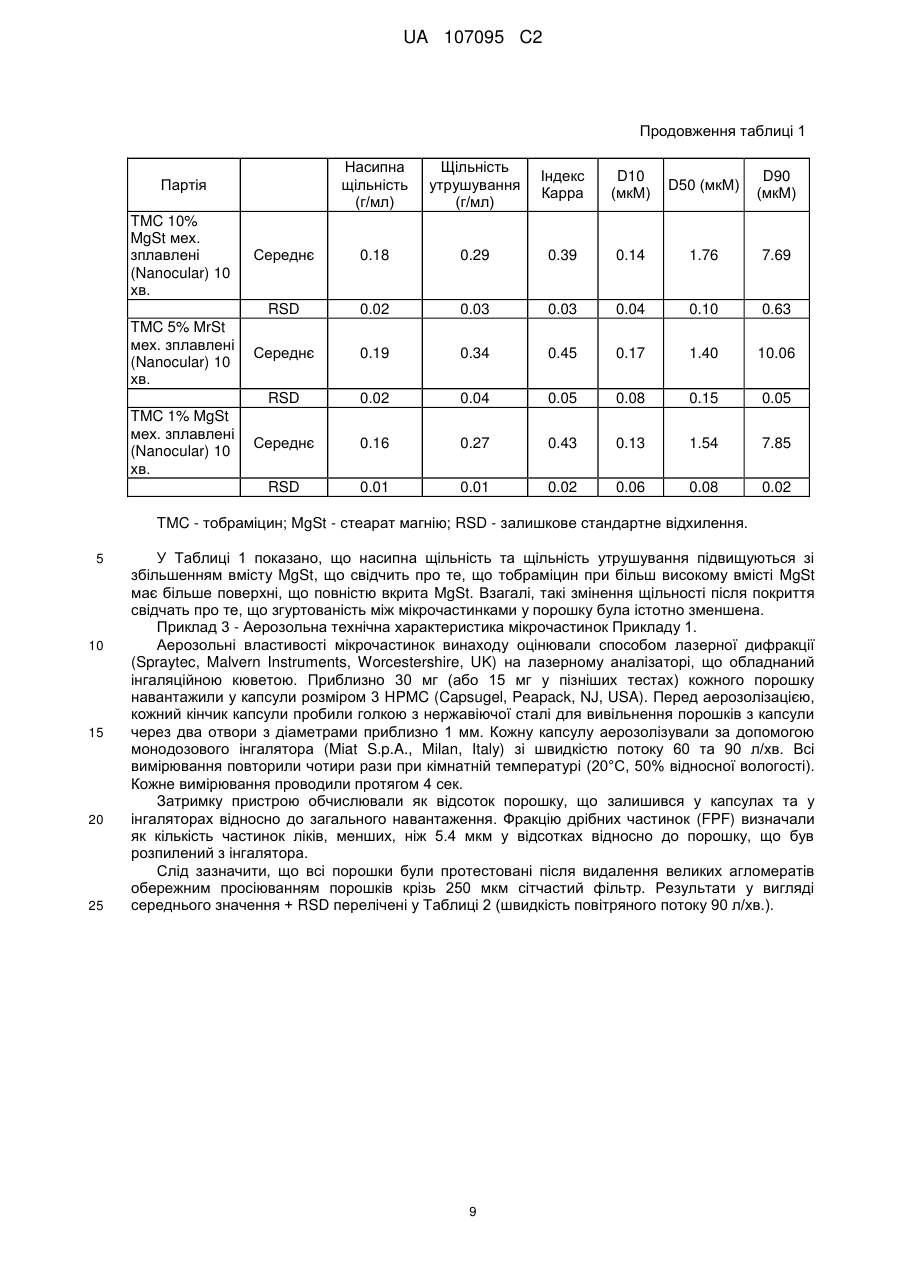
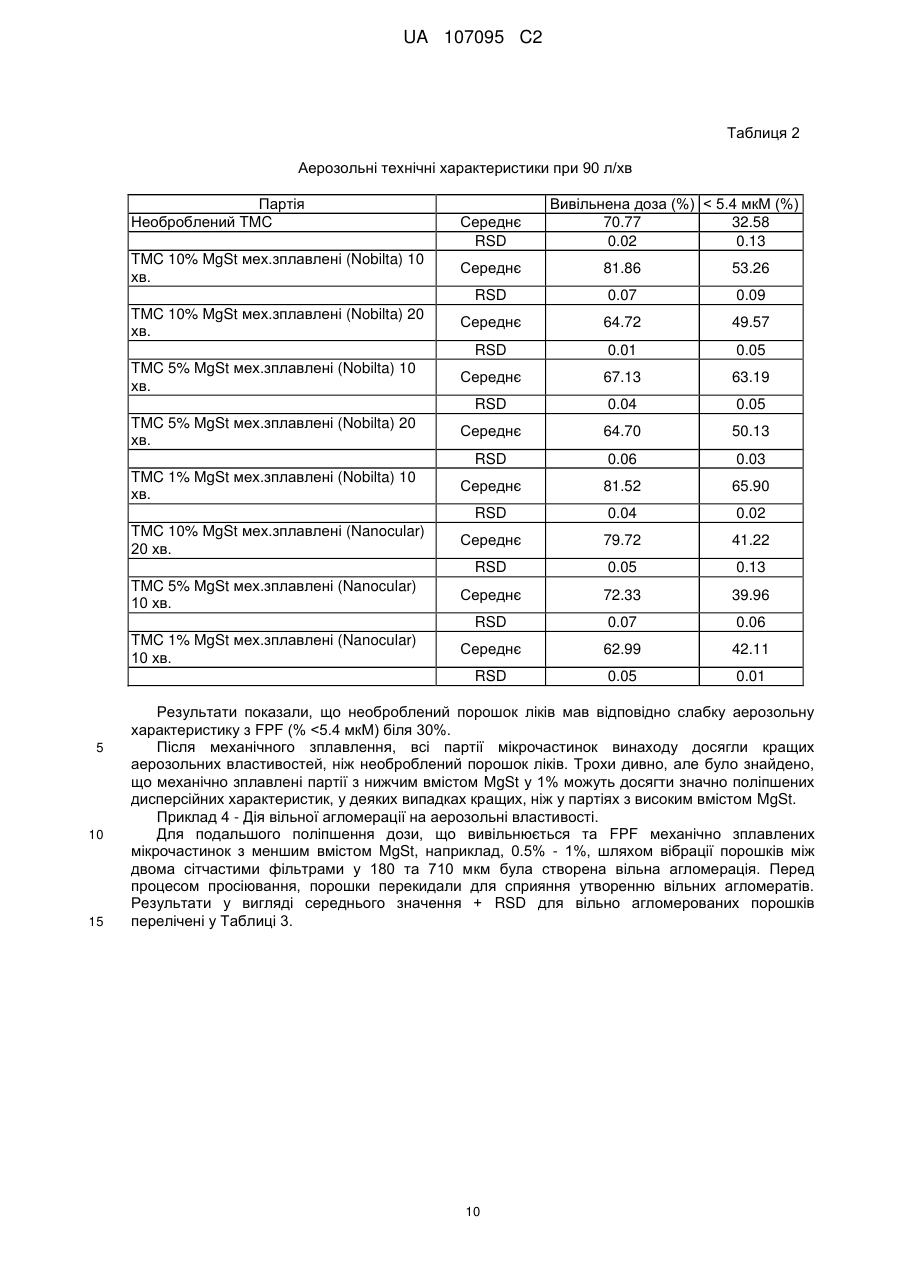
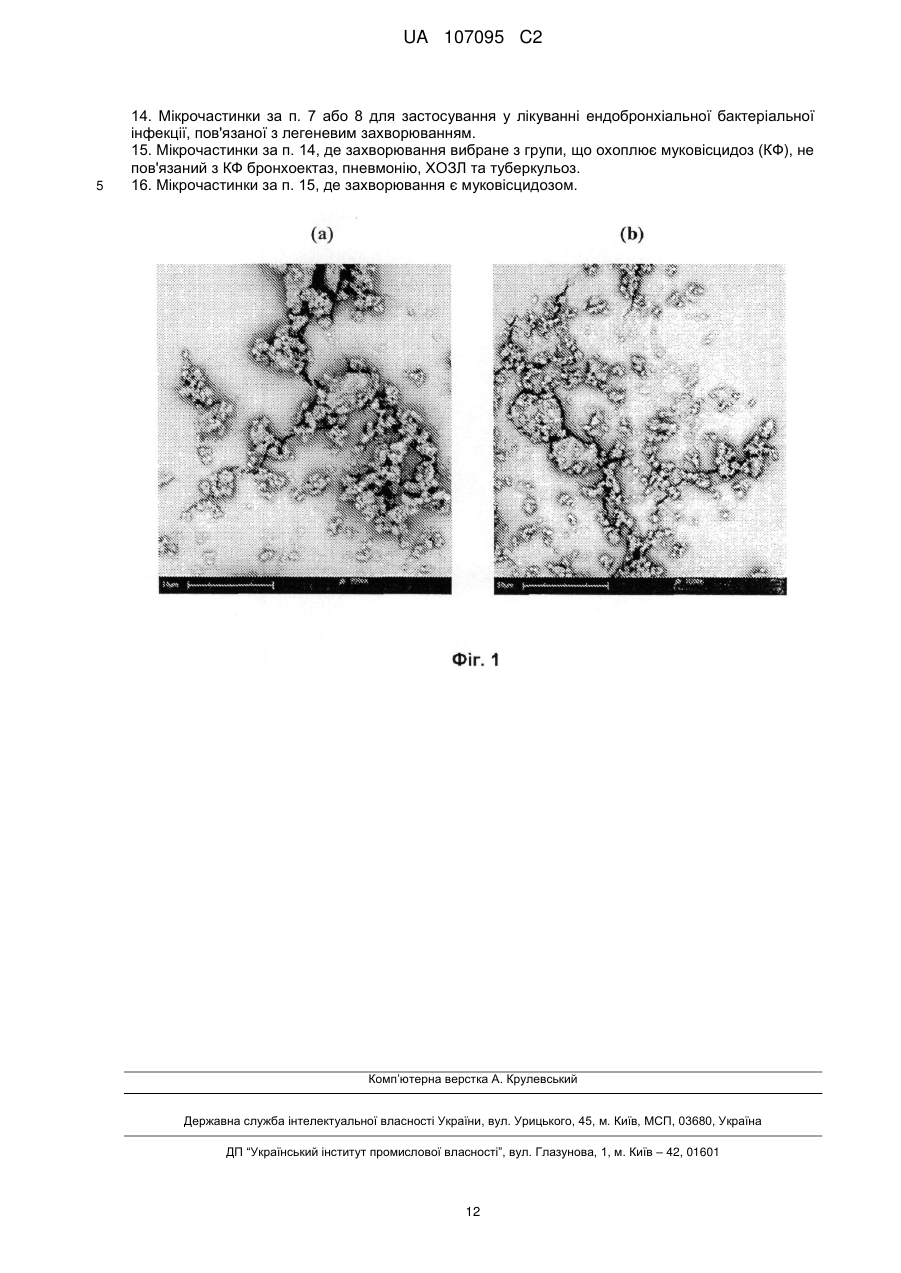
Реферат: Винахід стосується препарату у вигляді порошку для інгаляції, що містить мікрочастинки, що складаються з антибіотика, що належить до родини аміноглюкозидів, та стеарату магнію, спосіб отримання вказаних мікрочастинок та їх застосування у лікуванні бактеріальних інфекцій, пов'язаних з певними легеневими захворюваннями. UA 107095 C2 (12) UA 107095 C2 UA 107095 C2 5 10 15 20 25 30 35 40 45 50 55 Заявлений винахід стосується препарату для інгаляції, що містить мікрочастинки, що складаються з антибіотика та стеарату магнію. Винахід також охоплює спосіб отримання вказаних мікрочастинок та їх застосування у лікуванні бактеріальних ендобронхіальних інфекцій, пов'язаних з певними легеневими захворюваннями. Кістозний фіброз, також відомий, як КФ (CF), муковоїдоз або муковісцидоз, є фатальним генетичним розладом. Хоча формально муковісцидоз вважається рідкісним захворюванням, він визнаний одним з найбільш поширених генетичних захворювань, що скорочують життя та уражує у світі більш, ніж 60,000 людей. Він пов'язаний з порушенням транспорту хлорид-іонів через епітеліальні мембрани екзокринних залоз, що веде до зниження водного вмісту їх секреції. Морфологічні змінення дилатації та гіпертрофія бронхіальних залоз ведуть до слизового закупорювання. Накопичування в'язкого слизу у дихальних шляхах сприяє виникненню бактеріальної колонізації з подальшою інфекцією дихальних шляхів, що сприяє постійному пошкодженню тканин. Haemophilus influenzae τa Staphylococcus aureus є першими патогенами, що оселяються у дихальних шляхах у дитинстві. Якщо легеневе захворювання прогресує, то далі слідуватиме колонізація патогеном Pseudomonas aeruginosa. Після періоду переривчастої колонізації з Pseudomonas aeruginosa, колонізація стає хронічною у більшості пацієнтів з КФ та її стає практично неможливо усунути. Поміж інших, для парентерального введення, зараз застосовують антибіотики, що належать до родини аміногліцидів, та, зокрема, тобраміцин. Вказані антибіотики протидіють розвитку КФ шляхом зниження розладу та поліпшення функції легень. Проте, аміноглюкозиди недостатньо глибоко чіпають ендобронхіальні виділення (мокроту) та потребують великих внутрішньовенних доз для досягнення ефективної концентрації в місці інфекції. Ці високі дози ведуть до ризику виникнення у пацієнта нефротоксичних та ототоксичних побічних ефектів. Ці проблеми можуть бути вирішені шляхом аерозольного введення ліків до легень, оскільки, при застосуванні цього шляху введення, вказані антибіотики погано поглинаються легеневими епітеліальними поверхнями, залишаючись хімічно стійкими. Зокрема, водні препарати для введення тобраміцину [(2S,3R,4S,5S,6R)-4-аміно-2{[(1S,2S,3R,4S,6R)-4,6-діаміно-3-{[(2R,3R,5S,6R)-3-аміно-6-(амінометил)-5-гідроксиоксан-2іл]окси}-2-гідроксициклогексил]окси}-6-(гідроксиметил)оксан-3,5-діол] за допомогою різних типів небулайзерів зараз є у продажу під торгівельними марками TOBI® (Novartis Pharm Corp) та BRAMITOB® (Chiesi Farmaceutici SpA). Проте, застосування небулайзерів не повністю задовольняє дотримати необхідний режим терапії, якщо пацієнти потребують засоби доставки ліків у лікарняних або хатніх умовах. Більш того, у багатьох повідомленнях вказано на випадки бактеріального забруднення небулайзерів, застосованих пацієнтами з КФ, що створює необхідність їх регулярного чищення та знезараження. Іншим недоліком небулайзерів може бути їх низька ефективність. Препарати у вигляді порошку для введення за допомогою прийнятних засобів, відомих, як інгалятори сухого порошку (DPI) можуть вважатися прийнятною альтернативою препаратам для небулайзерів на основі тобраміцину, оскільки ці системи можуть надати більш легке та швидке введення ліків. Зокрема, завдяки своєї підвищеній терапевтичній дозі, у якості прийнятних пристроїв слід розглядати інгалятори сухого порошку. Деякі з проблем, які необхідно вирішити для отримання ефективного тобраміцинового препарату у вигляді сухого порошку зазвичай виникають при виробництві подібних препаратів, як-то, цей препарат повинен перед застосуванням демонструвати прийнятні плинність, хімічну та фізичну стабільність у пристрої та давати добру респірабельну фракцію (масову частку вдихувальних частинок, що потрапляють у нижні дихальні шляхи) а також бути прийнятним для доставки точної терапевтично активної дози активного інгредієнта. Зокрема, завдяки великій дозі та великому вмісту порошку у кожній капсулі (що дорівнює або вище, ніж 15 мг), необхідно, щоб цей препарат мав прийнятні плинні властивості для забезпечення ефективного спорожнення капсули при приведенні інгалятора в дію, отже, здатної до відтворення дози, що виділяється. Більш того, добре відомо, що тобраміцин має гігроскопічні властивості. 1 UA 107095 C2 5 10 15 20 25 30 35 40 45 50 55 Крім впливу хімічної стабільності, на плинність також впливає ступінь вологості, де особлива увага повинна бути приділена зниженню обсягу залишкової води, а також поглинанню води після зберігання. Ці завдання для отримання тобраміцинового препарату для інгаляторів сухого порошку вважається не так просто вирішити, тому в даний час відповідного продукту на ринку поки немає. WO 03/053411 та WO 2006/066367 стосуються тобраміцинових препаратів, що містять фосфоліпіди. Проте, їх застосування веде до проблем, пов'язаних з їх фізико-хімічною стабільністю. Останнім часом Parlati et al (Pharm Res 2009, 26(5), 1084-1092) наводять дані про порошок тобраміцину, що містить стеарат натрію, отриманий шляхом висушування розпиленням. Проте, зараз все ще залишається необхідність у отриманні порошку, що містить антибіотики, що належать до родини аміноглюкозидів, як-то тобраміцин, прийнятного для введення за допомогою інгаляторів сухого порошку. Зокрема, також було б дуже бажано отримати препарат, легкий у виробництві без застосування розчинників, та, зокрема, без застосування водних розчинників, тому що залишкова вода може впливати на хімічну стабільність та/або плинність порошку. Проблеми та недоліки попередніх дослідників вирішуються за допомогою препарату заявленого винаходу. Винахід стосується препарату у вигляді сухого порошку для легеневого введення, що містить механічно зплавлені мікрочастинки, що складаються з частинок антибіотика, що належить до родини аміноглюкозидів у кількості, що дорівнює або вища, ніж 90% у ваговому співвідношенні та стеарату магнію у кількості, що дорівнює або нижча, ніж 10% у ваговому співвідношенні, де стеарат магнію вкриває всю поверхню частинок ліків на щонайменш 50%, та, вибірково, фізіологічно прийнятного фармакологічно інертного носія. Переважно, антибіотик є тобраміцином. У іншому аспекті, винахід стосується механічно зплавлених мікрочастинок. Винахід також стосується капсул для застосування з інгалятором сухого порошку, наповненого препаратом винаходу у вигляді сухого порошку. У іншому аспекті, винахід стосується способу отримання мікрочастинок винаходу механічним зплавленням. У іншому аспекті, винахід стосується мікрочастинок, що отримані механічним зплавленням, що складаються з частинок антибіотика, що належить до родини аміноглюкозидів у кількості, що дорівнює або вища, ніж 90% у ваговому співвідношенні та стеарату магнію у кількості, що дорівнює або нижча, ніж 10% у ваговому співвідношенні, де стеарат магнію вкриває всю поверхню частинок ліків на щонайменш 50%. Винахід також спрямований до механічно зплавлених мікрочастинок винаходу стосовно їх застосування у лікуванні ендобронхіальної бактеріальної інфекції, пов'язаної з легеневим захворюванням. Винахід також охоплює застосування механічно зплавлених мікрочастинок винаходу у виробництві ліків для лікування ендобронхіальної бактеріальної інфекції, пов'язаної з легеневим захворюванням. Також, у іншому аспекті, винахід охоплює застосування механічно зплавлених мікрочастинок винаходу у лікуванні ендобронхіальної бактеріальної інфекції, пов'язаної з легеневим захворюванням. У іншому аспекті, винахід надає спосіб лікування ендобронхіальної бактеріальної інфекції, пов'язаної з легеневим захворюванням у пацієнта, що полягає у введенні терапевтично ефективної кількості механічно зплавлених мікрочастинок винаходу. Терміни "активні ліки", "активний інгредієнт", "активний", "активна субстанція", "активна сполука" та "терапевтичний агент" застосовано тут у якості синонімів. Інгалятори сухого порошку можна розділити на два основних типи: і) Однодозові інгалятори для введення одиничної розподіленої дози активної сполуки; кожна одинична доза звичайно розміщена у капсулі; іі) Багатодозові інгалятори сухого порошку, попередньо завантажені певними кількостями активних складових, достатніх для довших курсів лікування. Під термін "покриття" мається на увазі мастило стеарат магнію, що утворює плівку навколо активної частини. Покриття оболонкою є частковим, коли кількості стеарату магнію є недостатньо для утворення плівки навколо всієї поверхні всієї частини активного інгредієнта. 2 UA 107095 C2 5 10 15 20 25 30 35 40 45 50 55 Під терміном "істотно чистий" мається на увазі активний інгредієнт, що має хімічну чистоту, вищу, ніж 90% у ваговому співвідношенні, переважно таку, що дорівнює або вища, ніж 93% у ваговому співвідношенні. У загальних рисах, розмір частинок підраховують вимірюванням характерного діаметру еквівалентної сфери, відомого, як об'ємний діаметр, за допомогою лазерної дифракції. Розміри частинки також можна обчислити вимірюванням масового діаметру за допомогою прийнятних та добре відомих фахівцям інструментів. Об'ємний діаметр (VD) пов'язаний з масовим діаметром (MD) через щільність частинок (припускаючи для частинок щільність, незалежну від розміру). Термін "механічно зплавлений" стосується мікрочастинок, що складені з двох різних матеріалів, де один матеріал механічно зплавлений сухим способом з другим. Розмір частинки виражений в одиницях об'єму діаметра та розподіл розміру частинки виражений в залежності від і) об'ємного медіанного діаметра (VMD), що відповідає 50 відсотковому діаметру частинок за вагою або обсягом, відповідно, та іі) об'ємного діаметра (VD) у мікронах 10% та 90% частинок, відповідно. Термін "агломерований" застосовано тут у двох різних значеннях. Термін "агломеровані мікрочастинки" має відношення до частинок, що складаються з більш, ніж однієї мікрочастинки, де ці мікрочастинки приліплені одна до одної. Наприклад, агломерована мікрочастинка з [d(v,0.5)] у 1.5 мікрон може складатися з великої кількості приліплених одна до одної мікрочастинок, кожна з яких має менший діаметр. Альтернативно, термін "вільно агломеровані мікрочастинки" має відношення до частинок у вигляді м'яких агломератів, що можуть легко розпадатися на одиничні мікрочастинки. Термін "прийнятні властивості плинності" має відношення до препарату, що можна легко обробити в процесі виробництва та що може забезпечити точну та здатну до відтворення доставку терапевтично ефективної дози. Вираз "точна терапевтично ефективна доза активного інгредієнта" має відношення до препарату, де, при спрацьовуванні, середня доза, що вивільнюється, дорівнює або вища, ніж 60% від номінальної дози та, переважно, вища, ніж 65% або, що ще переважніше, вища, ніж 70%. Вираз "хімічно стійкий" має відношення до препарату, що, при зберіганні, відповідає вимогам EMEA Guideline CPMP/QWP/122/02, з посиланням на "Stability Testing of Existing Active Substances and Related Finished Products" (тестування стійкості існуючих активних речовин та пов'язаних готових продуктів). Вираз "фізично стійкий" має відношення до препарату, що не змінює свій фізичний стан у пристрої перед застосуванням та при зберіганні. Вираз "фракція, що вдихується" має відношення до показника відсотка активних частинок, що можуть потрапити глибоко у легені пацієнта. Фракцію, що вдихується, також позначену, як фракція дрібних частинок (FPF), оцінюють з застосуванням прийнятних приладів in vitro, звичайно за допомогою багатоступеневого каскадного імпактора або багатоступеневого рідкісного імпрингера (MLSI) відповідно до процедур, відомих в загальній фармакопеї. Проте, можна також успішно застосувати інші прилади, як-то Twin Stage Apparatus або SprayTec instrument, як наведено у Прикладах. Її обчислюють як співвідношення між дозою, що вдихується, відповідно до частинок, що мають діаметр, менший ніж приблизно 5 мікрон та дозою, що постачається (виповільнюється). Фракція, що вдихується (FPF), що є значно вищою, ніж 30%, є показником гарної аерозольної дії. Термін "терапевтично ефективна кількість" має відношення до кількості антибіотика, що належить до родини аміноглюкозидів, що, при доставці до легень як препарат у вигляді сухого порошку як тут описано, забезпечує бажану біологічну дію. У Фіг.1 показано отримані за допомогою SEM (скануючої електронної мікроскопії) малюнки механічно зплавлених мікрочастинок винаходу, що складаються з (а) 99% тобраміцину та 1% стеарату магнію; (b) 95% тобраміцину та 5% стеарату магнію. Винахід частково побудовано на відкритті того, що сухе покриття активних частинок антибіотика, що належить до родини аміноглюкозидів, як-то тобраміцину зі стеаратом магнію шляхом механічного зплавлення підвищує аерозольні властивості вказаних частинок. Отже, у першому аспекті, винахід стосується препарату у вигляді сухого порошку для легеневого введення, що містить механічно зплавлені мікрочастинки, що складаються з частинок антибіотика, що належить до родини аміноглюкозидів у кількості, що дорівнює або вища, ніж 90% у ваговому співвідношенні та стеарату магнію у кількості, що дорівнює або нижча, ніж 10% у ваговому співвідношенні. 3 UA 107095 C2 5 10 15 20 25 30 35 40 45 50 55 Антибіотик, що належить до родини аміноглюкозидів може бути відібраний від групи, що охоплює тобраміцин, канаміцин А, дибекацин, амікацин та арбекацин. Вказані аміноглюкозиди у мікрочастинках винаходу можуть бути застосовані у якості основи або її фармацевтично прийнятної солі, як-то сульфату, нітрату, хлориду та броміду. Бажаним антибіотиком є тобраміцин, який переважно застосовують у вигляді основи. При застосуванні у вигляді солі, бажаним є сульфат тобраміцину у стехіометрічному співвідношенні 2:5. Альтернативно, можуть бути застосовані інші солі тобраміцину, як-то нітрати. Стеарат магнію у мікрочастинках винаходу присутній у кількості, що дорівнює або нижча, ніж 10% у ваговому співвідношенні. Переважно, стеарат магнію присутній у кількості 0.1 - 10%, більш переважно 0.5 - 5% у ваговому співвідношенні. У одному втіленні, кількість може дорівнювати 0.5 - 2% у ваговому співвідношенні. У інших втіленнях, кількість може сягати 5 - 10% у ваговому співвідношенні або 2 - 5% у ваговому співвідношенні. Зокрема, у бажаному втіленні, кількість знаходиться у діапазоні 0.5 - 1.0% у ваговому співвідношенні. Частина антибіотика, що залишилася, також може бут відповідно обчислена. Для мікрочастинок винаходу необхідно, щоб стеарат магнію вкривав всю поверхню частинок ліків на щонайменш 50%, бажано на щонайменш 60%, переважно на щонайменш 75%, більш бажано на щонайменш 80%. Наявність покриття може бути якісно виявлена за допомогою візуальних способів, як-то скануючої електронної мікроскопії (SEM). Альтернативно, ступінь покриття може бути визначена, відповідно, іншими відомими способами. Наприклад ступінь покриття мікрочастинок винаходу може бути визначена за допомогою ретгеноелектронної спектроскопії (PEC), добре відомого інструменту для визначення ступеня, а також рівномірністі розподілу окремих елементів на поверхні інших речовин. У PEC, для збудження електронних станів атомів під поверхнею зразка застосовують фотони певної енергії. Електрони, вибиті з поверхні енергетично фільтруються напівсферичним аналізатором (HSA), перш ніж інтенсивність визначеної енергії записують за допомогою детектора. Оскільки базовий рівень електронів в твердотільних атомах є квантованим, отриманий спектр енергії показує резонансні піки, що характерні для електронній структурі атомів зразка поверхні. Звичайно, вимірювання XPS проводили за допомогою приладу Axis-Ultra від Kratos Analytical (Manchester, UK), що застосовує монохроматичне Al K випромінювання (1486.6 еВ), що працює при струму емісії у 15 мА та потенціалі анода (150 Вт) у 10 кВ. Для компенсації заряду ізолятора застосували низькоенергетичну електронну гармату (зчитуючий електронний прожектор). Оглядові результати сканування, з яких отримали кількісну характеристику виявлених елементів отримали з енергією проходження аналізатора у 160 еВ та з кроком у 1 еВ. Результати сканування ділянок C 1s, O 1s, Mr 2s, N 1s та Cl 2p високої роздільної здатності отримали з енергією проходження аналізатора у 40 еВ та з кроком у 0.1 еВ. Досліджена площина сягала приблизно 700 мкм x 300 мкм для оглядових результатів сканування та діаметр плями результатів сканування високої роздільної здатності дорівнював 110 мкм. Звичайно, для проведення XPS експериментів прийнятною є точність у 10%. Альтернативно, ступінь покриття стеаратом магнію поверхні антибіотика може бути визначена спочатку вимірюванням кута контакту мікрочастинок з водою та потім застосуванням рівняння, відомого в літературі, як Cassie and Baxter, що надруковано на стор. 338 у Colombo I et al // Farmaco 1984, 39(10), 328-341. Вимірювання кута водного контакту може бути здійснено, як зазначено на стор. 332 у Colombo et al, i.e. з застосуванням фіксованого або статичного крапельного способу, що передбачає внесення краплі рідини на поверхню порошку у вигляді диску, отриманого стисненням (компресійний порошковий дисковий спосіб). Також може бути застосований тестер змочуваності від Lorentzen Wettre (Sweden). Іншими способами, що можна успішно застосувати для вимірювання ступеню покриття стеаратом магнію поверхні антибіотика є інфрачервона спектроскопія та спектроскопія комбінаційного розсіювання світла разом зі скануючою електронною мікроскопією (SEM) або час-пролітною мас-спектроскопією вторинних іонів (TOF-SIMS). Вказані інструменти добре відомі досвідченим фахівцям та оперативні процедури для їх застосування знаходяться в межах їх загальних знань. 4 UA 107095 C2 5 10 15 20 25 30 35 40 45 50 55 На відміну від мікрочастинок, отриманих з розчинів, як-то мікрочастинок, висушених розпиленням, що будуть мати сферичну форму, див. Фіг., також слід зазначити, що форма механічно зплавлених мікрочастинок винаходу є неоднаковою та несферичною. Для якісної оцінки характеристик мікрочастинок винаходу, як-то їх форми та поверхневої морфології може бути застосована скануюча електронна мікроскопія (SEM) або оптична мікроскопія. Отримані згладжені та змощені поверхні, ймовірно, зменшують міжчасткові сили (внутрішньомолекулярні поверхневі сили та сили тертя) в порошку, що породжує кращу дію дисперсії під час аерозолізаціі. Механічно зплавлені мікрочастинки винаходу можуть бути кристалічними або аморфними. Проте, відсоток аморфності, виражений як відсоток ваги по відношенню до загальної ваги мікрочастинки, може значно відрізнятися та може дорівнювати або бути вищим, ніж 50%, бажано сягати щонайменш 70%, ще більш бажано - щонайменш 90%. Вказаний відсоток аморфності може бути визначений застосуванням рентгенівської порошкової дифракції або застосуванням інших відомих досвідченим фахівцям способів, як-то диференціальної скануючої калориметрії (ДСК) або мікрокалориметрії. Розмір мікрочастинок винаходу є меншим, ніж 15 мікрон. Переважно, щонайменш 90% частинок мають діаметр об'єму менший, ніж приблизно 10 мікрон. Більш переважно, не більш, ніж 10% мікрочастинок мають діаметр об'єму [d(v,0.1)] менший, ніж 0.1 мікрон. Переважно, не більш, ніж 50% частинок мають діаметр об'єму [d(v,0.5)], менший, ніж 0.6, та, переважно, [d(v,0.5)] дорівнює 0.7 - 2.0 мікрон, більш переважно, 0.8 - 1.5 мікрон. Розмір частинок можна виміряти шляхом лазерної дифракції відповідно з відомими способами. Механічно зплавлені мікрочастинки винаходу можуть бути присутні у вигляді неагломерованих, наприклад, окремих або стійких агломерованих мікрочастинок, де ці стійкі агломеровані мікрочастинки мають розмір часток, що належить до одного з діапазонів, описаних вище. Мікрочастинки винаходу мають дуже низьку кількість залишкової води, наприклад, меншу, ніж 5.0% у ваговому співвідношенні, що переважно дорівнює 4.8% та 4.5% у ваговому співвідношенні, як, відповідно, визначено відомими способами, як-то способом Карл-Фішера. Дійсно, було знайдено, що кількість залишкової води у мікрочастинках винаходу значно не підвищується у порівнянні з антибіотиком в даній якості. Також було знайдено, що стеарат магнію, коли він хоча б частково покриває поверхню активного інгредієнта частинки, здатен захистити мікрочастинки від вологості навколишнього середовища. Як зазначено вище, оскільки, крім порушення хімічної стійкості, вологість також може мати згубні наслідки для плинності, ці властивості стеарату магнію слід вважати ще одною перевагою. Стосовно плинності, мікрочастинки винаходу також показують наступні характеристики: - насипну щільність, що дорівнює 0.16 - 0.35 г/мл; - щільність утруски, що дорівнює 0.25 - 0.60 г/мл; - індекс Карра, менший, ніж 50%, що переважно дорівнює або нижчий, ніж 46%, більш переважно, нижчий, ніж 40%. Вказані технологічні характеристики роблять відповідні препарати прийнятними для легеневого введення за допомогою капсульного інгалятора сухого порошку. Вказаний препарат може містити тільки мікрочастинки винаходу або може містити фізіологічно прийнятний фармакологічно інертний носій. Такий носій може бути задіяний у якості наповнювача, коли потрібно зменшити концентрацію активної речовини в порошку, що доставляється до пацієнта або може бути застосований для покращення дисперсності порошку у пристрої для порошкової дисперсії для того, щоб забезпечити більш ефективну та здатну до відтворення доставку активного агента та для покращення технологічних характеристик активного агента (наприклад, плинності та однорідності) для полегшення виробництва та завантаження порошку. Носій може складатися з будь-якого аморфного або кристалічного фізіологічно прийнятного інертного матеріалу тваринного або рослинного походження або бути їх комбінацією. Бажаними матеріалами є кристалічні цукрі та, наприклад, моносахариди, як-то глюкоза або арабіноза або дисахариди, як-то мальтоза, цукроза, декстроза або лактоза. Також можуть бути застосовані поліспирти, як-то маніт, сорбіт, мальтіт, лактит. Найбільш бажаним матеріалом є моногідрат Cлактози. 5 UA 107095 C2 5 10 15 20 25 30 35 40 45 50 55 60 Препарат може також містити один або більше активних інгредієнтів, переважно іншого антибіотика для лікування бактеріальної інфекції шляхом інгаляції або інші прийнятні домішки, як-то барвники та смакові агенти. Препарат винаходу, що містить мікрочастинки винаходу надає, при аерозолізації, відмінну респірабельну фракцію, бажано більшу, ніж 30%, ще більш бажано більшу, ніж 35%, бажано більшу, ніж 40%, найбільш бажано більшу, ніж 50%. Доза, що вивільнюється, бажано може бути вищою, ніж 60%, переважно вищою, ніж 70%. У деяких окремих втіленнях, коли кількість стеарату магнію дорівнює 0.5 - 1.0%, для додаткового посилення дози, що вивільнюється та респірабельної фракції, мікрочастинки винаходу можуть бути піддані вільній агломерації для отримання вільно агломерованих мікрочастинок, переважно за допомогою вібрації порошку між двох сітчастих фільтрів 180 та 710 мкм. У іншому аспекті, винахід стосується способу отримання мікрочастинок винаходу механічним зплавленням. Механічне зплавлення є простим, сухим механічним процесом, що розроблений для застосування тонких шарів мастил на поверхнях частинок. Дрібні активні частинки та частинки стеарату магнію завантажують у контейнер для механічного зплавлення, де їх піддають центрифужній силі та притискують до внутрішній стінці контейнера. Порошок стискується між фіксованим отвором стінки барабана та вигнутим внутрішнім елементом з високою відносною швидкістю між барабаном та елементом. Внутрішня стінка та вигнутий елемент разом утворюють отвір або щілину, де здійснюється пресування частинок. В результаті, коли частки попадають у простір між внутрішньою стінкою та вигнутим барабаном (що має більшу кривизну, ніж внутрішня стінка барабана), їх піддають дії дуже сильних сил зсуву та дуже сильних стискувальних навантажень. Частинки сильно стикаються одна з іншою з достатньою енергією для локального нагріву та пом'якшення, розбивання, деформації, сплющування та обгортання частинок гідрофобного матеріалу навколо частки ядра, з утворенням покриття. Енергії, як правило, достатньо, щоб розбити агломерати, в той час як розміри частинок активного інгредієнта істотно не змінюються. Для забезпечення відповідного руху може обертатися або зовнішній контейнер або внутрішній елемент. Отвір між цими поверхнями, відповідно, є малим, звичайно меншим, ніж 10 мм та переважно меншим, ніж 5 мм, більш бажано, щоб він був меншим, ніж 3 мм. Він є фіксованим, отже забезпечує кращий контроль енергії стискування, ніж у інших типах млинів, якто кульові млини. Також бажано забезпечити відсутність зіткнення підрібнюючих поверхонь млина, щоб мінімізувати знос та забруднення. Для розбивання будь-якого затверділого матеріалу на поверхні контейнера також може бути встановлений скребок. Це є особливо корисним при застосуванні сильно згуртованих початкових матеріалів. Місцеву температуру можна контролювати застосуванням нагрівальної/охолодної сорочки, вбудованої у стінки барабана. Порошок може бути підданий повторній циркуляції через контейнер. Переважно застосовують прилади, як-то процесори механічного зплавлення Nobilta® та (Nanocular) ® (Hosokawa Micron Corporation, Japan). Обидві системи містять циліндричний резервуар з обертовим осьовим валом. У процесорі Nobilta®, уздовж осьового валу знаходяться лопаті та вони простягаються до відстані приблизно 1 мм від стінки контейнера. Отже, при обертанні вала, леза безперервно проходять близько до стінки контейнера, спонукаючи весь порошок знаходитися у постійному та енергійному русі. Завдяки високій обертовій швидкості лопатей, порошок рухається до стіни та, в результаті, за допомогою лопатей, суміш піддають дії дуже великої сили зсуву та стискаючих напружень між стінкою та лопаттю. Подібний рух також є у процесорі (Nanocular) ®, але з меншою ударною силою, завдяки відсутності лопатей та більш високого ступеню стискаючих напружень між стіною та головкою пресу. Час процесу буде залежати від певного процесора та може бути відповідно встановлений фахівцем в залежності від розмірів партії. У деяких втіленнях, процес може сягати щонайменш дві хвилини, переважно щонайменш 5 хвилин, більш переважно щонайменш десять хвилин. У деяких втіленнях винаходу, час процесу може дорівнювати 10 та 20 хвилин. Швидкість обертання також буде залежати від конкретного процесору механічного зплавлення та від розмірів партії. Звичайно може бути застосована швидкість обертання, що не перевищує 10000 об/хв, переважно не перевищує 6000 об/хв., переважно дорівнює 1000-5000 об/хв., більш переважно 2000-3000 об/хв. 6 UA 107095 C2 5 10 15 20 25 30 35 40 45 50 55 60 Альтернативно, швидкість обертання може бути визначена як обводова швидкість у м/сек, а не у об/хв. Обводова швидкість залежить від діаметру ротора. Якщо обрати ротор з діаметром близько 9.2 см, то може бути застосована обводова швидкість, вища, ніж 5 м/сек, переважно вища, ніж 10 м/сек, більш переважно вища, ніж 25 м/сек. Також можуть бути успішно застосовані інші прилади, як-то Cyclomix® (Hosokawa) та Hybridiser (Nara) . При отриманні мікрочастинок вищезазначеним способом, антибіотик у мікрочастинках залишається істотно хімічно чистим. Дозування антибіотика у мікрочастинках винаходу може змінюватися в широких межах в залежності від характеру бактеріальної інфекції, типу захворювання, що підлягає лікуванню та типу пацієнта. Досвідчений фахівець може визначити терапевтично ефективну кількість для кожного пацієнта, отже, визначити відповідне дозування. При застосуванні тобраміцину, типова одинична уніфікована доза для лікування шляхом інгаляції пов'язаної з муковісцидозом ендобронхіальної інфекції, спричиненої Pseudomonas aeruginosa для введення пацієнту у строк від одного разу до трьох разів на день може знаходитись у діапазоні 20-160 мг (обчислена як вільна основа), переважно у діапазоні 30-90 мг. В залежності від приладу DPI (інгалятор сухого порошку), одинична уніфікована доза може бути введена з одиничного контейнера, або, переважно, вона може бути розділена на декілька контейнерів, як-то у капсули для послідовного введення, або у більш, ніж один контейнер, з розташуванням у приладі DPI. Таким чином, по окремості, кожна капсула наповнена менш, ніж одиничною уніфікованою дозою. Наприклад, одинична уніфікована доза може бути поділена на 2-6 капсул, переважно з утворенням 3-5 капсул. При застосуванні тобраміцину, звичайно, кожну капсулу наповнюють 12-40 мг (виражено у вигляді вільної основи), переважно 15-30 мг. У одному з бажаних втілень, для покращення респірабельної фракції, кількість завантаженого у кожну капсулу порошку дорівнює 15 мг. Для застосування у фармацевтичних цілях може бути застосована будь-яка капсула, наприклад, капсула розміру 3 HPMC або желатинова капсула. Препарат заявленого винаходу може бути застосовано для лікування будь-якої ендобронхіальної бактеріальної інфекції, пов'язаної з захворюванням легень, як-то муковісцидоз (КФ), не пов'язаний з КФ бронхоектаз, пневмонія, ХОЗЛ та туберкульоз. Переважно, його можна буде застосувати у лікуванні інфекцій, спричинених грам-негативними бактеріями, як-то Pseudomonas aeruginosa. Зокрема, препарат винаходу може бути застосовано для лікування пацієнтів з муковісцидозом, що інфіковані Pseudomonas aeruginosa. Таким чином, переваги мікрочастинок заявленого винаходу полягають у тому, що відповідний препарат є фізично та хімічно стійким, менш схильний до поглинання води, забезпечує високу респірабельну фракцію, забезпечує точну та здатну до відтворення доставку терапевтично ефективної дози та є більш зручним та економічно прийнятним у виробництві, ніж відомі препарати. Винахід докладно ілюструється наступними прикладами. Приклад 1 - отримання мікрочастинок відповідно до винаходу. Мікронізований тобраміцин та різні кількості стеарату магнію у 0.5%, 1%, 5%, та 10% у ваговому співвідношенні завантажено у рухомий контейнер (Nanocular) ® від Nobilta®. Процес здійснювали протягом 10 та 20 хв. з розміром партії близько 40 мл та зі швидкістю обертання 5000 об/хв. Отримані механічно зплавлені мікрочастинки зібрали та дослідили їх технологічні та аерозольні характеристики. Так само можуть бути отримані мікрочастинки з іншими антибіотиками, що належать до класу аміноглюкозидів. Приклад 2 - Технологічна характеристика мікрочастинок Прикладу 1. Мікрочастинки, отримані у Прикладі 1 піддали наступному аналізу. Скануюча електронна мікроскопія (SEM) - дослідження морфологічних властивостей з застосуванням скануючого електронного мікроскопу (Phenom™, FEІ Company, Hillsboro, OR). Кожний зразок обережно розмістили у тримач для зразків для створення типових зображень та піддали напиленню золотом. Мікрофотографії SEM отримали за допомогою вбудованого програмного забезпечення захоплення зображень. 7 UA 107095 C2 5 10 15 20 Типові зображення наведені у Фіг. (а) та 1(b). Розмір та форма мікрочастинок винаходу істотно не змінюються у порівнянні з самим тобраміцином, але у порошку була присутня менша кількість вільних агломератів. Щільності та плинні характеристики - Обидва значення щільності обчислили за допомогою способу, що наведений у European Pharmacopeia. Насипну щільність (dv) виміряли повільним насипанням зразків у 10 мл відкалібрований вимірювальний циліндр через лійку на фіксованій висоті над циліндром. Щільність утрушування (ds) визначили після 1250 струшувань за допомогою автоматичного аналізатора щільності утрушування (AUTOTAP™, Quantachrome Instruments, Boynton Beach, FL, USA). Аналізатор щільності утрушування працював з вертикальним ходом у 3.18 мм при швидкості натискання у 260 натискань/хв. Індекс Kappa (Cl) обчислили від насипної щільності та щільності утрушування з застосуванням наступного рівняння: ds dv Cl (%) 100 ds Визначення розміру частинок за допомогою лазерної дифракції, розміру частинок за допомогою лазерної дифракції (Mastersizer® S, Malvern Instruments, Worcestershire, UK) з застосуванням об'єктива 300 RF, обладнаного демонстраційним блоком для зразка з малим обсягом (місткість 150 мл). Порошки диспергували у 0.065% натрієвій солі діоктілсульфосукцінату у n-гексані. Протягом 5 хвилин перед вимірюваннями, зразок у дисперсанті обробили ультразвуком. Результати за умовами щільності, індексу Карра та розміру частинок (середні + відносна стандартна похибка) наведені у Таблиці 1. Таблиця 1 Показники щільності, індексу Карра та розмірів частинок Партія TMC 10% MgSt мех. зплавлені (Nobilta) 10 хв. Партія Партія Середнє 0.30 0.53 0.43 0.13 0.89 9.47 0.02 0.02 0.03 0.04 0.08 0.02 Середнє 0.31 0.58 0.46 0.14 0.90 9.32 0.01 0.02 0.02 0.04 0.11 0.03 Середнє 0.28 0.51 0.46 0.14 0.96 9.03 0.01 0.01 0.01 0.04 0.09 0.03 Середнє 0.28 0.52 0.46 0.14 0.80 8.65 0.01 0.01 0.02 0.07 0.06 0.03 Середнє 0.17 0.31 0.45 0.15 1.53 7.81 RSD TMC 1% MgSt мех. зплавлені (Nobilta) 20 хв. Партія RSD TMC 1% MgSt мех. зплавлені (Nobilta) 10 хв. Партія RSD TMC 5% MgSt мех. зплавлені (Nobilta) 20 хв. Партія RSD TMC 5% MgSt мех. зплавлені (Nobilta) 10 хв. Партія RSD TMC 10% MgSt мех. зплавлені (Nobilta) 20 хв. Партія 0.01 0.03 0.03 0.08 0.11 0.02 Середнє 0.18 0.33 0.45 0.19 1.23 8.30 RSD 0.01 0.03 0.03 0.07 0.07 0.04 8 UA 107095 C2 Продовження таблиці 1 Насипна щільність (г/мл) Щільність утрушування (г/мл) Індекс Карра D10 (мкМ) D50 (мкМ) D90 (мкМ) Середнє 0.18 0.29 0.39 0.14 1.76 7.69 RSD 0.02 0.03 0.03 0.04 0.10 0.63 Середнє 0.19 0.34 0.45 0.17 1.40 10.06 RSD 0.02 0.04 0.05 0.08 0.15 0.05 Середнє 0.16 0.27 0.43 0.13 1.54 7.85 RSD 0.01 0.01 0.02 0.06 0.08 0.02 Партія TMC 10% MgSt мех. зплавлені (Nanocular) 10 хв. TMC 5% MrSt мех. зплавлені (Nanocular) 10 хв. TMC 1% MgSt мех. зплавлені (Nanocular) 10 хв. TMC - тобраміцин; MgSt - стеарат магнію; RSD - залишкове стандартне відхилення. 5 10 15 20 25 У Таблиці 1 показано, що насипна щільність та щільність утрушування підвищуються зі збільшенням вмісту MgSt, що свідчить про те, що тобраміцин при більш високому вмісті MgSt має більше поверхні, що повністю вкрита MgSt. Взагалі, такі змінення щільності після покриття свідчать про те, що згуртованість між мікрочастинками у порошку була істотно зменшена. Приклад 3 - Аерозольна технічна характеристика мікрочастинок Прикладу 1. Аерозольні властивості мікрочастинок винаходу оцінювали способом лазерної дифракції (Spraytec, Malvern Instruments, Worcestershire, UK) на лазерному аналізаторі, що обладнаний інгаляційною кюветою. Приблизно 30 мг (або 15 мг у пізніших тестах) кожного порошку навантажили у капсули розміром 3 HPMC (Capsugel, Peapack, NJ, USA). Перед аерозолізацією, кожний кінчик капсули пробили голкою з нержавіючої сталі для вивільнення порошків з капсули через два отвори з діаметрами приблизно 1 мм. Кожну капсулу аерозолізували за допомогою монодозового інгалятора (Miat S.p.A., Milan, Italy) зі швидкістю потоку 60 та 90 л/хв. Всі вимірювання повторили чотири рази при кімнатній температурі (20°C, 50% відносної вологості). Кожне вимірювання проводили протягом 4 сек. Затримку пристрою обчислювали як відсоток порошку, що залишився у капсулах та у інгаляторах відносно до загального навантаження. Фракцію дрібних частинок (FPF) визначали як кількість частинок ліків, менших, ніж 5.4 мкм у відсотках відносно до порошку, що був розпилений з інгалятора. Слід зазначити, що всі порошки були протестовані після видалення великих агломератів обережним просіюванням порошків крізь 250 мкм сітчастий фільтр. Результати у вигляді середнього значення + RSD перелічені у Таблиці 2 (швидкість повітряного потоку 90 л/хв.). 9 UA 107095 C2 Таблиця 2 Аерозольні технічні характеристики при 90 л/хв Партія Необроблений TMC TMC 10% MgSt мех.зплавлені (Nobilta) 10 хв. Середнє RSD Вивільнена доза (%) < 5.4 мкМ (%) 70.77 32.58 0.02 0.13 10 15 0.01 0.05 Середнє 67.13 63.19 0.04 0.05 Середнє 64.70 50.13 0.06 0.03 Середнє 81.52 65.90 0.04 0.02 Середнє 79.72 41.22 0.05 0.13 Середнє 72.33 39.96 0.07 0.06 Середнє 62.99 42.11 RSD 5 49.57 RSD TMC 1% MgSt мех.зплавлені (Nanocular) 10 хв. 64.72 RSD TMC 5% MgSt мех.зплавлені (Nanocular) 10 хв. Середнє RSD TMC 10% MgSt мех.зплавлені (Nanocular) 20 хв. 0.09 RSD TMC 1% MgSt мех.зплавлені (Nobilta) 10 хв. 0.07 RSD TMC 5% MgSt мех.зплавлені (Nobilta) 20 хв. 53.26 RSD TMC 5% MgSt мех.зплавлені (Nobilta) 10 хв. 81.86 RSD TMC 10% MgSt мех.зплавлені (Nobilta) 20 хв. Середнє 0.05 0.01 Результати показали, що необроблений порошок ліків мав відповідно слабку аерозольну характеристику з FPF (%
ДивитисяДодаткова інформація
Назва патенту англійськоюAntibiotic microparticles for inhalation
Автори англійськоюMorton, David, Qi Shou, Tony, Musa, Rossella
Автори російськоюМортон Дэвид, Ци Чжоу Тони, Муза Росселла
МПК / Мітки
МПК: A61K 31/7036, A61P 11/00, A61K 9/14
Мітки: антибіотичні, мікрочастинки, інгаляції
Код посилання
<a href="https://ua.patents.su/14-107095-antibiotichni-mikrochastinki-dlya-ingalyaci.html" target="_blank" rel="follow" title="База патентів України">Антибіотичні мікрочастинки для інгаляції</a>
Попередній патент: Відцентровий стельовий вентилятор
Наступний патент: Розпилювач
Випадковий патент: Профіль для кріплення натягнутого полотна і декоративна перегородка, що містить його, така як декоративна стеля або декоративна стінка