Спосіб визначення ранньої сероконверсії у ссавця-хазяїна до вірусу гепатиту с і набір для використання в способі
Формула / Реферат
1. Способ определения ранней сероконверсии у млекопитающего-хозяина к вирусу гепатита С (HCV), включающий стадии получения из компонента тела хозяина, подозреваемого в наличии антител к HCV, контактирования упомянутого компонента тела с (1) антигеном HCV или (2) стандартным контрольным реактивом в условиях, которые обеспечивают проявление иммунологической реакции, определения присутствия иммунного комплекса указанных антигена и антител, причем отсутствие указанных иммунных комплексов, содержащих стандартный реактив, и присутствие указанных иммунных комплексов, содержащих указанный антиген HCV, указывает на сероконверсию к HCV, отличающийся тем, что указанное контактирование (1) проводят с антигеном HCV, выбранным из группы, состоящей из антигена, кодированного в домене Е1 генома HCV, антигена, кодированного в домене Е2 генома HCV или их агрегатов, причем указанный антиген HCV очищают в условиях, не допускающих денатурацию.
2. Способ по п. 1, отличающийся тем, что указанный антиген HCV кодируется в домене Е1 генома HCV.
3. Способ по п. 1 или 2, отличающийся тем, что указанный антиген HCV представляет собой Е1.
4. Способ по п. 1, отличающийся тем, что указанный антиген HCV кодируется в домене Е2 генома HCV.
5. Способ по п. 1 или 4, отличающийся тем, что указанный антиген HCV представляет собой Е2.
6. Способ по п. 1, отличающийся тем, что указанный антиген HCV представляет собой агрегат Е1/Е2.
7. Способ по п. 1, отличающийся тем, что указанный антиген HCV представляет собой агрегат Е1/Е1.
8. Способ по п. 1, отличающийся тем, что указанный антиген HCV представляет собой агрегат Е2/Е2.
9. Способ по любому из пп. 1-8, отличающийся тем, что указанный антиген HCV или агрегат экспрессируют при помощи рекомбинантного вируса осповакцины.
10. Способ по любому из пп. 1-8, отличающийся тем, что указанный антиген HCV или агрегат экспрессируют в клетках яичника китайского хомячка.
11. Набор для использования в способе по любому из пп. 1-10, отличающийся тем, что указанный набор содержит антиген HCV и стандартный контрольный реактив, упакованные в подходящие коробки, и инструкцию по использованию компонентов набора.
Текст
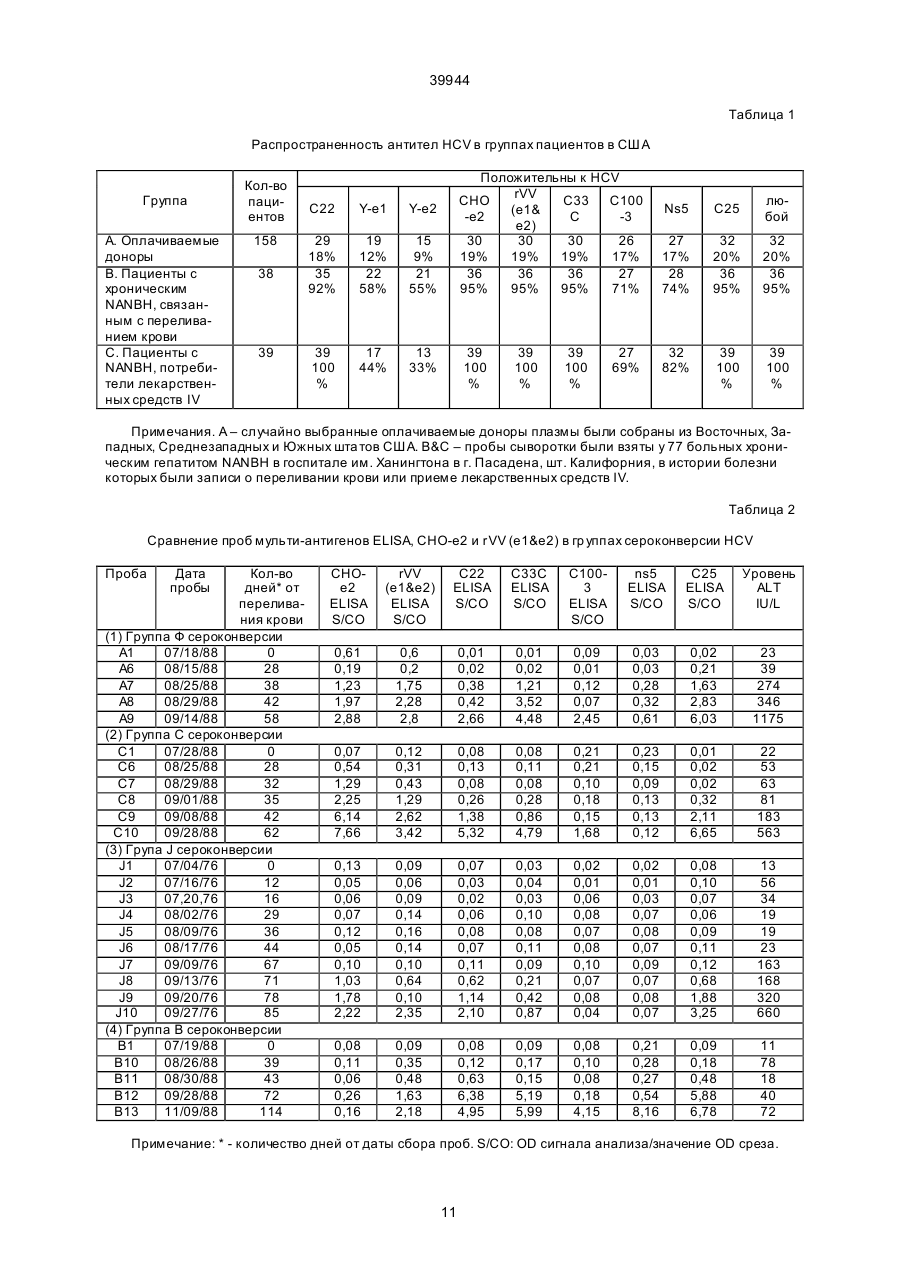
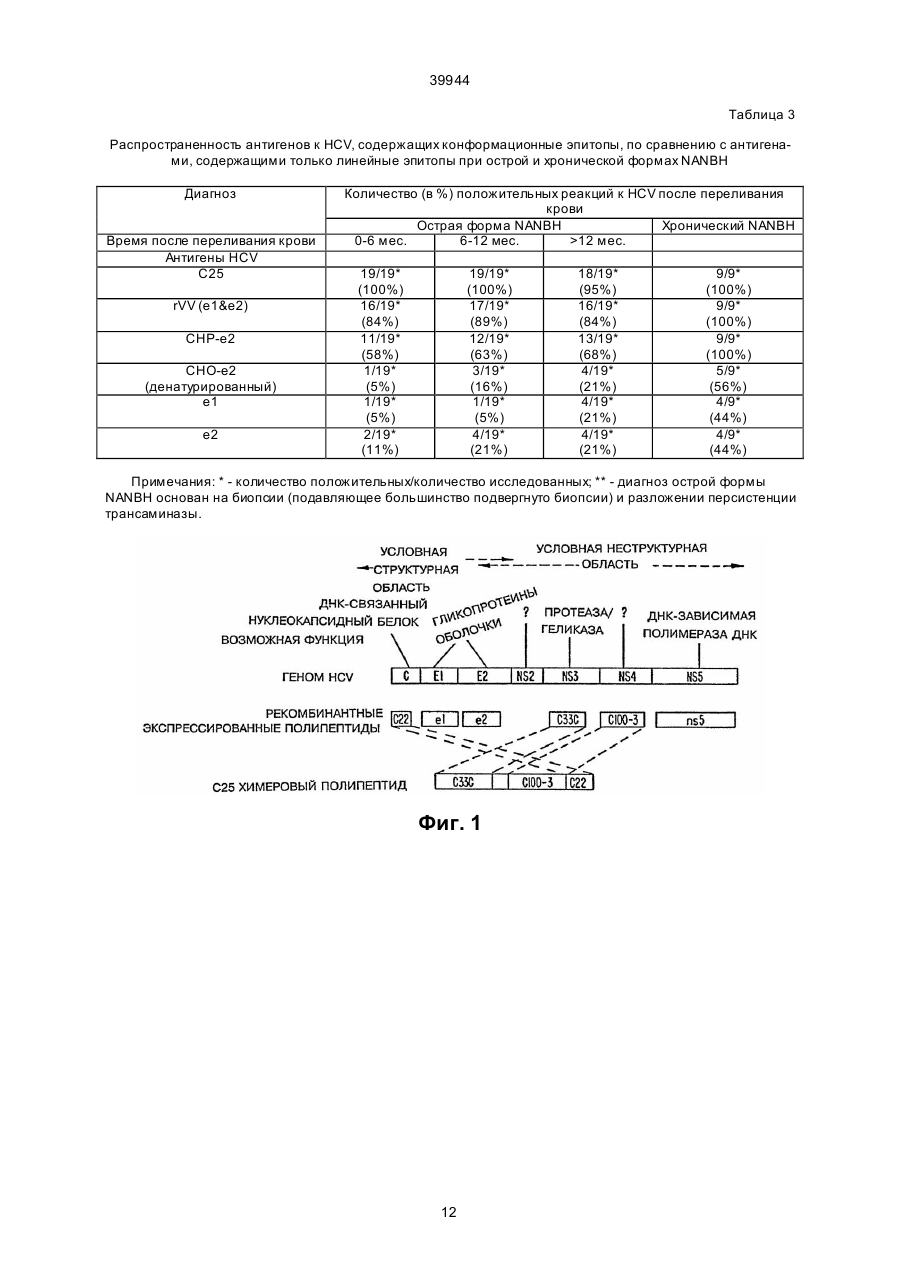
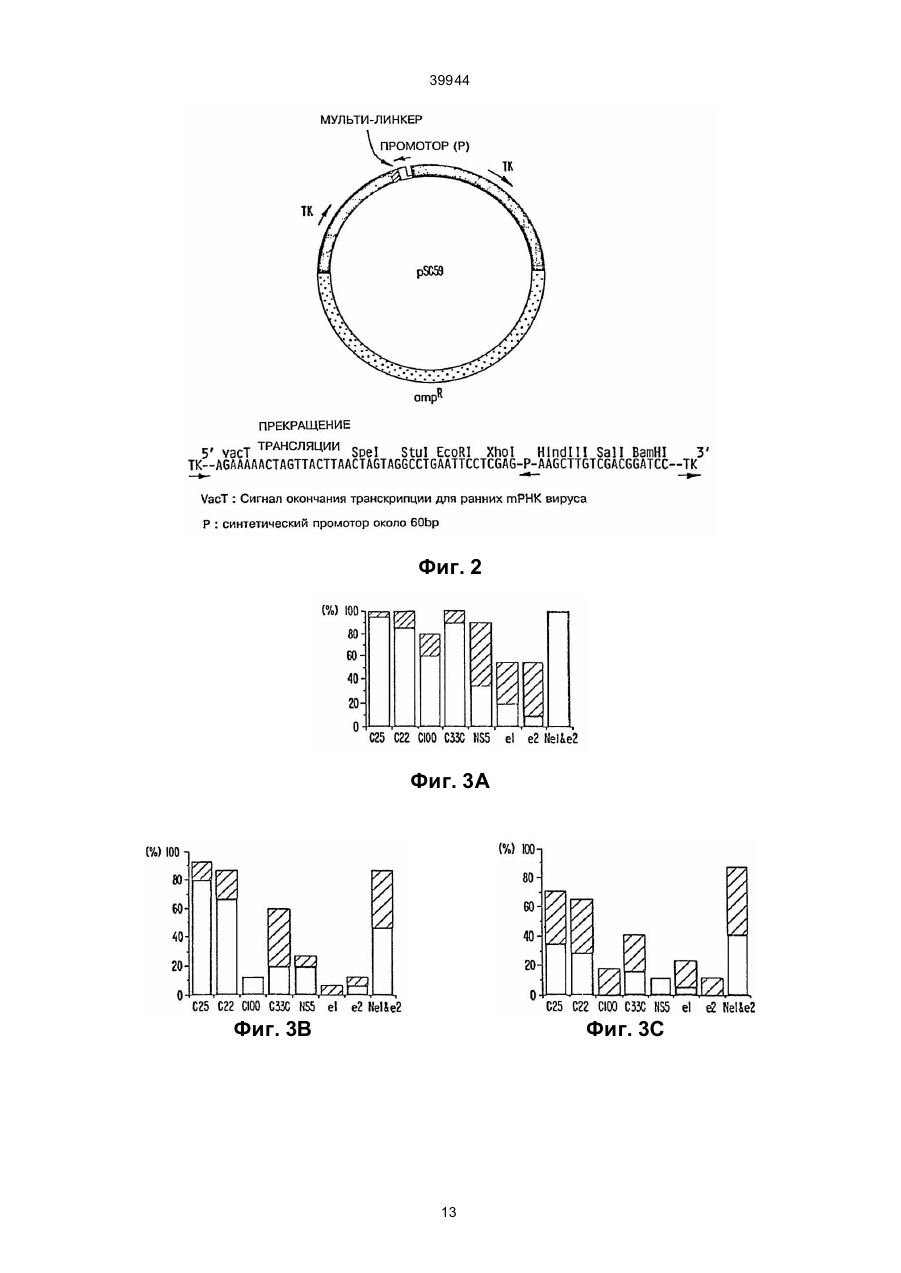
1. Способ определения ранней сероконверсии у млекопитающего-хозяина к вирусу гепатита С (HCV), включающий стадии получения из компонента тела хозяина, подозреваемого в наличии антител к HCV, контактирования упомянутого компонента тела с (1) антигеном HCV или (2) стандартным контрольным реактивом в условиях, которые обеспечивают проявление иммунологической реакции, определения присутствия иммунного комплекса указанных антигена и антител, причем отсутствие указанных иммунных комплексов, содержащих стандартный реактив, и присутствие указанных иммунных комплексов, содержащих указанный антиген HCV, указывает на сероконверсию к HCV, отличающийся тем, что указанное контактирование (1) проводят с антигеном HCV, выбранным из группы, состоящей из антигена, кодированного в домене Е1 генома HCV, антигена, кодированного в домене Е2 генома HCV или их агрегатов, причем указанный антиген HCV очищают в условиях, не допускающих денатурацию. C2 (54) СПОСІБ ВИЗНАЧЕННЯ РАННЬОЇ СЕРОКОНВЕРСІЇ У ССАВЦЯ-ХАЗЯЇНА ДО ВІРУСУ ГЕПАТИТУ С І НАБІР ДЛЯ ВИКОРИСТАННЯ В СПОСОБІ 39944 Sci. USA, 1990, 87:6547-6549; Choo et al., Proc. Natl. Acad. Sci. USA, 1991, 88:2451-2455; Nan et al., Proc. Natl. Acad. Sci. USA 88:1711-1715; Houghton et al., Hepatology, 1991, 14:381-388; Weiner et al., Proc. Natl. Acad. Sci. USA, 1992, 89:3468-3472. В этих п убликациях приведен известный уровень развития техники с углубленным рассмотрением проблем HCV в целом, а также вопросов изготовления и использования иммунологических реагентов на основе полипептидов HCV. Поэтому для краткости изложения указанные публикации в описании используются, в частности, в качестве ссылок. Другие исследователи использовали и развивали работу Houghton et al. См., например, патенты Highfield et al., UK Pat App. 2239245 (The Welcome Foundation Ltd); Wang, ЕРО Pub. No. 442394 (United Biomedical Inc); Leung et al., ЕРО Pub. No. 445423 (Abbott Laboratories); Habits et al., ЕРО Pub. No. 451891 (Akzo N.V.); Reyes et al., PCT Pub No. WO 91/15516 (Genelabs Inc.); Maki et al., ЕРО Pub. No. 468657 (Tonen Corp.); и Kamada et al., ЕРО Pub. No. 469348 (Shionogi Seiyaku K.K.). См. также работы Matsuura et al., 1992, J.Virology 66:1425; Kato et al., Proc. Natl. Acad. Sci. USA, 1990, 87:9524-9528; Takamizawa et al., J. Virol, 1991, 65:1105-1113; Chiba et al., Рroc. Nаtl. Асаd.Sci. USA, 1991, 88 4641-4645; Harada et al., J. Virol, 1990, 65:3015-3021; Hijikata et al., Proc. Natl. Acad. Sci. USA, 1991, 88:5547-5551; Okamoto et al., Jpn. J. Exp. Med., 1990, 60:167-177; Yuasa et al., J.Gen. Virol., 1991, 72:2021-2024; Watanabe et al., Int. J. Cancer, 1991, 48:340-343. Создание чувствительных специфических методов скрининга и идентификации носителей HCV и содержащих HCV крови или компонентов крови имеет важное значение в медицине. Наблюдаемые после переливания крови гепатиты (РТН) имеют место примерно у 10% пациентов, подвергнуты х этой операции, а HCV отмечался почти в 90% таких случаев. Основной проблемой при данной болезни является часто встречающееся развитие хронического повреждения печени (25-55%) по сравнению с другими гепатитами, например, гепатитом В. Лечение пациентов, а также предупреждение передачи HCV кровью и компонентами крови или при близком личном контакте требуют надежных средств диагностики и прогноза для обнаружения антител, связанных с HCV, таких, например, как полипептиды HCV. Такие полипептиды используются также как вакцины и иммунотерапевтические терапевтические агенты для предупреждения и/или лечения болезни. Поскольку HCV является относительно новым агентом, то имеется насущная необходимость определения дополнительных иммунологических реагентов, что позволит провести дальнейшее исследование клинического курса болезни и эпидемиологии HCV у населения. Авторы выполнили дополнительные серологические исследования антигенов HCV и открыли, что иммуноанализы, в которых используются антигены оболочки HCV, содержащие конформационные эпитопы, являются более эффективными при обнаружении антител к HCV, чем иммуноанализы, использующие такие же антигены с линейными эпитопами. В соответствии с изложенным, целью данного изобретения является способ обнаружения антител к вирусу гепатита С (HCV) в компонентах тела млекопитающего, в котором предполагается наличие упомянутых антител, содержащих находящийся в контакте с упомянутым компонентом тела антиген, HCV, содержащий конформационный эпитоп от домена Е1 или Е2 HCV при условиях, позволяющих иммунологическое взаимодействие между антителами (если они имеются) и антигеном, а также способ обнаружения наличия иммунных комплексов (если таковые имеются) упомянутых антител и упомянутых антигенов. В других осуществлениях этого метода антигены являются закодированными в доменах Е1 и/или Е2 или представляют собой антигены Е1 и/или Е2. В некоторых вариантах осуществления метода антигены могут экспрессироваться от векторов Vaccinia или быть экспрессированными в ячейки СНО. Кроме того, в некоторых вариантах осуществления изобретения включен второй антиген, содержащий другой конформационный эпитоп. Другим аспектом изобретения является метод скрининга компонентов крови или крови на HCV перед использованием такой крови или компонентов крови при приготовлении препаратов крови, включающий: а) воздействие на компонент тела потенциального донора антигеном HCV, содержащим конформационный эпитоп от доменов Е1 или Е2 HCV при условиях, позволяющих иммунологическое взаимодействие между антителами в компоненте тела (если имеются) и антигеном; b) обнаружение комплексов, образованных между антигеном и антителами, если они имеются; и с) отбраковка крови или препаратов крови, взятых у указанного донора в случае обнаружения упомянутых комплексов по п. b. Еще одним аспектом этого изобретения является набор для выявления антител HCV, который содержит антиген HCV с конформационным эпитопоп из доменов Е1 или Е2 HCV, а также контрольные стандартные реактивы, упакованные в подходящие сосуды и инструкции по использованию компонентов набора. На фиг. 1 схематически показаны условные домены полипротеина HCV. На фиг. 2 схематически показаны некоторые особенности вектора рSС59. На фиг. 3А, 3В и 3С показано процентное содержание пациентов групп I, II и III, прошедших анализы ELISA на индивидуальные антигены HCV. Термин "антиген HCV" относится к полипептидам или аналогам полипептида (например, минитопам), содержащим последовательность аминокислот (и/или аналогов аминокислот), определяющую по крайней мере один эпитоп HCV. Обычно определяющие эпитоп последовательности соответствуют последовательности аминокислот белка HCV (либо идентично, либо замещением аналогов природного остатка аминокислот, которые не разрушают эпитоп). В общем случае определяющая эпитоп последовательность будет иметь размер 5 или более аминокислот, более типично - 8 или более аминокислот и даже еще бо 2 39944 лее типично - 10 или более аминокислот. По отношению к конформационным эпитопам размер определяющей эпитоп последовательности может подвергаться большим изменениям, поскольку известно, что эти эпитопы образуются трехмерной формой антигена (например, складной). Таким образом, определяющих эпитоп аминокислот может быть немного по количеству, но они широко рассеяны вдоль длины молекулы (или даже вдоль различных молекул в случае димеров и т.п.), причем вводятся в правильную конформацию эпитопа путем складывания. Части антигена между определяющими эпитоп остатками не могут быть критичными к конформационной структуре эпитопа. Например, процессы удаления или замещения этих воздействующих последовательностей не могут влиять на конформационный эпитоп при условии поддержания последовательностей, критичных к конформации эпитопа (например, цистеины, включенные в дисульфидные связи, участки гликосилации и т.п.). Антигены HCV в соответствии с настоящим изобретением содержат конформационные эпитопы из доменов (оболочки) Е1 и/или Е2 HCV. Домен Е1, который соответствует вирусному белку оболочки, по современным оценкам охватывает аминокислоты 192-383 полипротеина HCV (РСТ Pub. Nо. WО 91/15771, фиг. 1). При экспрессии в систему СНО (гликосилатид) полагают, что он имеет приблизительную молекулярную массу 35 Kd, определенную с помощью SDS-PAGE. Белок Е2, ранее называемый NS1, охватывает аминокислоты 384-800 полипротеина и также является белком оболочки. При экспрессии в систему СНО (гликосилатид) он имеет среднюю молекулярную массу геля, равную примерно 72 Kd. Понятно, что эти концы белка являются приближениями (например, карбокси окончание Е2 может лежать где-то в области 750-820 аминокислот). Понятно также, что выделенная в прототипе последовательность HCV1 в вышеупомянутой заявке РСТ, приводится исключительно с иллюстративной целью и что любое выделение HCV (см., например, ссылки, приведенные выше) является подходящим источником последовательности Е1 и/или Е2 при использовании настоящего изобретения. Используемые в настоящем изобретении антигены Е1 и Е2 могут быть полноразмерными вирусными белками, в основном полноразмерными их вариантами или их функциональными фрагментами (например, фрагментами, которые не теряют последовательность, существенную для образования или сохранения конформационного эпитопа). Более того, антигены HCV в соответствии с настоящим изобретением могут также содержать другие последовательности, которые не препятствуют или предупреждают образование рассматриваемого конформационного эпитопа. Наличие или отсутствие конформационного эпитопа может быть легко выявлено путем скрининга рассматриваемого антигена с антителом (поликлональная сыворотка или моноклональная по отношению к конформационному эпитопу) и сравнения его реактивности с реактивностью денатурированного варианта антигена, который удерживает только линейные эпитопы (если они имеются). При таком скрининге с использованием поликло нальных антител, возможно, выгодно в начале адсорбировать поликлональную сыворотку с денатурированным антителом, а затем анализировать сохранение антител к рассматриваемому антигену. Антигены HCV в соответствии с настоящим изобретением могут быть изготовлены любым удобным способом, который предусматривает наличие рассматриваемого конформационного эпитопа. Например, рекомбинантная экспрессия в клетки млекопитающего или насекомого является предпочтительным способом, обеспечивающим выделенные гликосилатидные антигены Е1 и/или Е2 в "природной" конформации. Однако имеется также возможность, как это известно для белков, экспрессировать антигены в другие рекомбинантные системы хозяев и ренатурировать белок после восстановления. Понятно, также, что мимитопы с конформационным антигеном можно создавать и с помощью химического синтеза, причем они перекрестно реагируют с конформационным эпитопом "природного" антигена. Комплексы Е1 и/или Е2 (называемые также совокупностями), содержащие более одного Е1 или Е2 мономера, являются также предпочтительными антигенами. Димеры Е1:Е1, димеры Е2:Е2 и гетеродимеры Е1:Е2 все являются антигенами в объеме этого изобретения. Совокупности могут содержать и большие формы и могут иметь молекулярные массы, превышающие 800 kD. Термин "гибридный полипептид" относится к полипептиду, в котором антигены HCV являются частью одной непрерывной цепочки аминокислот, причем эта цепочка в природе не встречается. Антигены HCV могут соединяться непосредственно друг с другом пептидными связями или разделяться воздействующими аминокислотными последовательностями. Гибридные полипептиды могут также содержать аминокислотные последовательности, экзогенные к HCV. Термин "общая твердая матрица" относится к твердому телу, с которым отдельные антигены HCV или содержащие антигены HCV гибридные полипептиды связаны ковалентными или нековалентными средствами, такими, например, как гидрофобная адсорбция. Термин "компонент тела" относится к жидкости или ткани индивидуума млекопитающего (например, антропоида, человека), которые в общем случае содержат антитела, вырабатываемые этим индивидуумом. Такие компоненты известны специалистам в данной области и включают, но не ограничиваются этим, кровь, плазму, сыворотку, спиномозговую жидкость, лимфатическую жидкость, секреции дыхательных путей, кишечника или мочеполового тракта, слезы, слюну, молоко, белые кровяные клетки и миеломы. Компоненты тела содержат биологические жидкости. Термин "биологические жидкости" относится к жидкостям, получаемым из организма. Некоторые биологические жидкости используются в качестве источника други х препаратов, таких, например, как коагулирующие факторы (например, Фактор VIII:C), сывороточный альбумин, гормон роста и им подобные. В таких случаях важно, чтобы источник биологической жидкости не был заражен вирусом, таким как HCV. 3 39944 Термин "иммунологически реактивный" означает, что рассматриваемый антиген взаимодействовал, в частности, с антителами к HCV, имеющимися в компоненте тела от индивидуума, инфицированного HCV. Термин "иммунный комплекс" относится к комбинации, образованной в момент привязки антитела к эпитопу на антигене. Используемое в настоящем изобретении обозначение "Е1" относится к белку или полипептиду, экспрессированному в пределах первых 400 аминокислот полипротеина HCV, иногда называемому белком Е или S. В своей природной форме он представляет собой гликопротеин с молекулярной массой 35 kD, который находится в сильной связи с мембраной. В большинстве природных штаммов HCV белок Е1 кодируется в вирусном полипротеине после белка С (ядро). Белок Е1 находится на участке приблизительно от 192 аминокислоты (аа) до аа 383 полноразмерного полипротеина. Используемый в данном изобретении термин "Е1" относится также к аналогам и усеченным формам, которые иммунологически являются перекрестно реактивными с природным Е1. Используемый в данном изобретении термин "Е2" относится к белку или полипептиду, экспрессированному в пределах первых 900 аминокислот полипротеина HCV, и иногда называется белком NS1. В своей природной форме он представляет собой гликопротеин с молекулярной массой 72 kD, который находится в сильной связи с мембраной. В большинстве природных штаммов HCV белок Е2 кодируется в вирусном полипротеине после белка Е1. Белок Е2 находится приблизительно на участке от аа 384 до аа 820. Используемый в данном изобретении термин "Е2" относится также к аналогам и усеченным формам, которые иммунологически являются перекрестно реактивными с природным Е2. Используемый в данном изобретении термин "множество" относится к комплексу Е1 и/или Е2, содержащему более одного мономера Е1 или Е2. Димеры Е1:Е1, димеры Е2:Е2 и гетеродимеры Е1:Е2 все являются множеством в пределах этого определения. Множества могут также включать еще большие формы и могут иметь молекулярные массы более 800 kD. Используемый в данном изобретении применительно к белкам термин "очищенный" относится к композиции, в которой требуемый белок находится в количестве по крайней мере 35% от общего состава белка в композиции. От общего состава белка требуемый белок предпочтительно составляет 40%, более предпочтительно по крайней мере 50%, более предпочтительно по крайней мере 60%, еще более предпочтительно по крайней мере 70%, даже еще более предпочтительно по крайней мере 80%, даже более предпочтительно по крайней мере 90%, и более всего предпочтительно по крайней мере 95%. Такая композиция может содержать другие соединения, такие, например, как карбогидраты, соли, липиды, растворы и им подобные, неоказывающие влияния на определение процентной чистоты, как это используется в этом описании. Термин "выделенный" белок HCV относится к композиции белка HCV с по крайней мере 35% чистотой. Термин "выделенный полипептид" относится к полипептиду, существенно свободному от других вирусных компонентов HCV, в частности, от геномного полинуклеотида HCV. Композиция полипептидов является "существенно свободной" от други х компонентов в том случае, если масса этого полипептида в композиции составляет по крайней мере 70% массы полипептида и других компонентов вместе, более предпочтительно по крайней мере 89%, еще более предпочтительно 90% и более всего предпочтительно 95% или больше. В способах выполнения иммуноанализа в соответствии с изобретением используются антигены HCV из доменов Е1 и Е2, которые поддерживают конформационные эпитопы, выявляемые антителами в сыворотке инфицированных HCV индивидуумов. Каждый такой антиген имеет по крайней мере один конформационный эпитоп, который существует во встречающейся в природе частице HCV или инфицированном ею препарате, что подтверждается иммунореактивностью антигена с антителами в компоненте тела от инфицированного HCV индивидуума, а также потерей иммунореактивности эпитопа при денатурации антигена. Длина антигена достаточна для того, чтобы поддержать иммунореактивный конформационный эпитоп, связанный с этим эпитопом. Объем данного изобретения предусматривает наличие более одного конформационного эпитопа на антиген. Используемые при иммуноанализах природные антигены оболочки могут иметь почти полную длину, но могут быть и усеченными для того, например, чтобы увеличить растворимость или улучшить секрецию (например, удаление доменов связывания мембраны). Объемом данного изобретения предусматривается использование одних антигенов или комбинаций или совокупности антигенов. Таким образом, в иммуноанализах могут использоваться эпитопы Е1, эпитопы Е2, множества или совокупности природных Е1 и Е2. В объеме данного изобретения предполагается использовать антигены с линейными эпитопами в сочетании с капсульным конформационным эпитопом HCV. Способы обнаружения наличия конформационных эпитопов известны специалистам и некоторые из них проиллюстрированы в приведенных примерах. Исходя из данных об условных аминокислотах, закодированных в нуклеотидной последовательности HCV1 и други х данных, ниже представлены возможные белковые домены закодированного полипротеина HCV, а также приблизительные границы: Условный домен С (нуклеокапсидный белок) Е1 (белок оболочки вириона) E2/NS1 (оболочка?) NS2 NS3 (протеаза?) NS4 NS5 (полимераза) 4 Приблизительная граница (номера аминокислот) 1-191 192-383 384-800 800-1050 1050-1650 1651-2100 2100-3011 (конец) 39944 Эти домены, однако, являются предполагаемыми. Например, граница между E1-NS2 возможно находится в районе 750-810, а граница NS3NS4 лежит вблизи 1640-1650. Имеются также данные, что версия С аа 191 является предшественником, который впоследствии превращается в зрелый белок (например, приблизительно 170 аа в длину) и что каждый из белков NS2, NS4 и NS5 в дальнейшем превращается в два зрелых белка. Взаимосвязь доменов показана на фиг. 1. Способы приготовления антигенов Е1 и Е2, включая антигены с природными структурами, описаны в работе Spaete R., et al., Virology, 1992, 188:819-830, и в патенте WО 92/08734, которые приведены здесь в виде ссылок. В общем случае выбраны клетки-хозяева, что обеспечивает образование природных конформационных эпитопов в экспрессированных белках оболочки; такие клетки-хозяева могут иметь вид, например, клеток животных, клеток насекомых, клеток дрожжей и им подобных. Еукариотические системы хозяев содержат клетки дрожжей и млекопитающих в культуральных системах. Saccharomyces cerevisiae и Saccharomyces carlsbergensis являются наиболее часто используемыми дрожжевыми хозяевами и удобными грибковыми хозяевами. Совместимые с дрожжами векторы несут метки, которые позволяют осуществи ть выбор успешно трансформированных клеток с помощью сопоставления прототропии с ауксотрофическими мутантами или резистентностью к тяжелым металлам у штаммов "дикого типа". Совместимые с дрожжами векторы могут применять источник репликации величиной 2 мк (Broach et al., 1983, Meth. Enz. 101:307.), сочетание CEN3 и ARS1 или другие средства для гарантии репликации, такие, например, как последовательности, которые приведут к включению подходящего фрагмента в геном клетки-хозяина. Регулярные последовательности для дрожжевых векторов известны специалистам в данной области и содержат промоторы для синтеза гликолитических ферментов (Hess et al., 1968, J. Adv. Enzyme Reg 7:149: Holland et al., 1978, Biochemistry 17:4900), включая промотор для киназы 3 фосфоглицерата (Hitzeman, 1980, J. Biol. Chem. 255:2073). Могут включаться также окончания, например, выделяемые из гена энолазы (Holland, 1981, J. Biol. Chem. 256:1385). Особенно полезными являются такие регулярные системы, которые содержат промотор на основе фосфатной дегидразы глицеринового альдегида-3 (GAPDH) или контролируемый промотор алкогольной дегидразы (ADH), концы которого также выводятся из GAPDH, а, если требуется выделение, то и лидирующая последовательность из альфа фактора дрожжей. Кроме того, операбельно связанные участок регулирования транскрипции и участок стимуляции транскрипции могут не быть естественно связанными в организме дикого типа. Эти системы подробно описаны в патенте ЕРО 120551, опубликованном 3 октября 1984 г.; патенте ЕРО 116201, опубликованном 22 августа 1984 г.; и патенте ЕРО 164556, опубликованном 18 декабря 1985 г., причем все они переданы этому преемнику и здесь используются в качестве ссылок. Используемые для экспрессии в качестве хозяев клеточные линии млекопитающих известны специалистам и содержат многие долговечные клеточные линии, получаемые от American Type Culture Collection (АТСС), в том числе клетки HeLa, клетки яичника китайского хомяка (СНО), клетки почки детеныша хомяка (ВНК) и ряд других клеточных линий. Подходящие промоторы для клеток млекопитающих также известны специалистам и включают такие вирусные промоторы, как промотор от вакуолизирующего обезьяньего вируса 40 (SV40) (Fiers (1978) Nature 273:113), вируса саркомы Роуза (RSV), аденовируса (ADV) и вируса бычей папилломы (BPV). Кроме того, клетки млекопитающих могут потребовать использования последовательности терминатора и поли А последовательности присоединения; могут также использоваться последовательности энхансера, которые увеличивают экспрессию и последовательности, которые вызывают амплификацию гена. Все эти последовательности известны специалистам. Подходящие для репликации в клетки млекопитающих векторы известны специалистам и могут включать вирусные репликоны или последовательности, которые могут обеспечить интеграцию соответствующи х последовательностей, кодирующих эпитопы NANBV в геном клеток-хозяев. Вектором, используемым для экспрессии инородных ДНК, и который может использоваться при приготовлении вакцин, является вирус коровьей оспы (Vaccinia). В этом случае ксеногенная ДНК вводится в геном Vaccinia. Способы введения инородной ДНК в геном вируса Vaccinia известны специалистам и используют, например, гомологическую рекомбинацию. Вставка ксеногенной ДНК в общем случае осуществляется в тот ген, который в природе не является основным, например, ген киназы тимидина (tk), который также предусматривает способную селектировать метку. В литературе описаны плазмидные векторы, которые в основном упрощают построение рекомбинантных вирусов (см., например, работы Mackett et al., 1984, J. Virol. 49:857., Chakrabarti et al., 1985, Моl. Cell Biol. 5:3403; Moss, 1987, Векторы переноса генов для клеток млекопитающих / Miller and Calos eds., Cold Spring Harbor Laboratory, Cold Spring Harbor, N.Y., p. 10). После этого происходит экспрессия полипептида HCV в клетки или индивидуумы, которые иммунизированы с помощью живого рекомбинантного вируса Vaccinia. Сегмент HCV CDNA, кодирующий требуемую последовательность, вводится в вектор Vaccinia. Кодирующий последовательность полипептид может быть присоединен к начальной последовательности. Начальная последовательность может быть таковой для активатора тканевого плазминогена (ТРА) или для другого источника, например, для бета-глобулина. Ксеногенный полинуклеотид может вводиться в вектор Vaccinia, который представляет собой измененный вариант pSC11 благодаря добавлению полилинкерной последовательности, которая содержит клонирующий участок. Для того чтобы выяснить, действительно ли полипептид HСV экспрессирован из вектора Vaccinia, можно инфицировать рекомбинантным вектором 1 клетку BSC и вырастить ее на пред 5 39944 метных стеклах при условиях, позволяющих экспрессию. После этого клетки фиксируются ацетоном и выполняется анализ иммунофлюоресценции с использованием сыворотки, которая достоверно содержит антитела к HCV к полипептиду(ам), закодированным на участке генома HCV, из которого был выделен сегмент HCV в рекомбинантном векторе экспрессии. К другим системам для экспрессии еукариотических или вирусных геномов относятся клетки насекомых и векторы, подходящие для использования в этих клетках. Такие системы известны специалистам и включают, например, векторы переноса экспрессии насекомого, выделенные из вируса ядерного полигедрозиза baculovirus Autografa californica (AcNPV), который является независимым помощником, вектором вирусной экспрессии. Выделенные из этой системы векторы экспрессии обычно используют сильный вирусный промотор гена полихедрина для выделения экспрессии ксеногенных генов. В настоящее время наиболее часто используемым вектором переноса для введения инородных генов в AcNPV является рАс373. Для улучшения экспрессии предназначаются также многие другие векторы, известные специалистам в этой области. К ним относится, например, pVL985 (который изменяет положение кодона начала полихедрина из ATG в AТТ, и который вводит участок клонирования BamHI на 32 комплементарные пары оснований нуклеиновых кислот ниже по отношению к АТТ; см. работу Luckow и Summers, 1989, Virology 17:31). Хорошая экспрессия негибридных инородных белков обычно требует наличия инородных генов, которые в идеале имеют короткую начальную последовательность, содержащую подходящие сигналы инициации трансляции, предшествующие сигналу начала ATG. Плазмид также содержит сигнал полиадениляции полихедрина и устойчивый к ампициллину (amp) ген, а начало репликации при селекции и воспроизводстве в Е. coli. Специалистам известны способы введения ксеногенной ДНК в требуемый участок вируса baculovirus (см. работы Summer и Smith, Texas Agricultural Experiment Station Bulletin No. 1555; Ju et al., 1987; Smith et al., 1983, Моl. & Cell Biol. 3:2156-2165; и Luckow и Summers, 1989, Virology 17:31). Например, вставка может выполняться в ген, такой как ген полихедрина путем гомогенной рекомбинации; вставка может также выполняться и в участок фермента ограничения, встроенный в требуемый ген baculovirus. Могут вставляться такие последовательности, которые кодируют все или только изменяющиеся сегменты полипротеина, или другие орфы, которые кодируют вирусные полипептиды. Сигналы при посттрансляционных изменениях, такие как сигнал деления пептида, протеолитического расщепления и фосфорилации, повидимому распознаются клетками насекомых. Сигналы, требуемые при накоплении секрета и ядра также, по-видимому, консервируются между клетками беспозвоночных животных и клетками позвоночных животных. Примеры сигнальных последовательностей от клеток позвоночных животных, которые являются эффективными в клетках беспозвоночных животных, известны специали стам, например, сигнал от интерлейцина-2 человека (IL-2S), который представляет собой сигнал при выводе клетки, распознается и должным образом устраняется в клетках насекомых. Типы иммунологических анализов Антигены Е1 и Е2 HCV, созданные в соответствии с настоящим изобретением, могут фактически использоваться в любом из анализов, в которых для обнаружения антител применяется известный антиген. Безусловно, те виды анализа, в которых денатурируется рассматриваемый конформационный эпитоп HCV, следует избегать или изменять. Общей особенностью всех таких анализов является контакт антигена с тем компонентом тела, в котором предполагается наличие антител HCV, при условиях, которые позволяют антигену связываться с любым таким антителом, имеющимся в этом компоненте. Подобными условиями обычно считаются физиологическая температура, рН или ионная активность, использующие избыток антигенов. После обнаружения иммунных комплексов, содержащих антиген, выполняется инкубация антигена с образцом. Планирование иммуноанализов предполагает значительное количество вариантов, многие из которых известны специалистам в данной области. Схемы проведения иммуноанализов могут основываться, например, на использовании твердых носителей или иммунопреципитации. В большинстве анализов используются меченые антитела или полипептиды; метки могут быть, например, ферментативными, флуоресцентными, хемилюминесцентными, радиоактивными, представлять собой окрашенные молекулы. Известны также анализы, в ходе которых сигналы от иммунного комплекса усиливаются; примерами таких анализов являются анализы, в которых используются биотин или авидин, а также ферментомеченые и промежуточные иммуноанализы, такие как анализы ELISA. Иммунологический анализ может носить (без ограничений) гетерогенный или гомогенный характер и быть стандартного или конкурентного типа. При гетерогенном характере анализа полипептид обычно связан с твердой основой или носителем для облегчения отделения пробы от полипептида после инкубирования. Примерами твердых носителей, которые могут использоваться, являются нитроцеллюлоза (например, в виде мембраны или ячейки микротитра), хлорид поливинила (например, в форме пластин или ячеек микротитра), латекс полистирола (например, в форме гранул или пластин микротитра), поливинилидинфлуорид (известный как Immunlon™), диазотированная бумага, нейлоновые мембраны, активированные гранулы и гранулы белка А. Например, при гетерогенном характере анализа могут использоваться пластины микротитра Dynatech Immunlon™1 или Immunlon™2 или же полистирольные гранулы размером 6,3 мм (прецизионный пластиковый шарик). Содержащий антигенные полипептиды твердый носитель обычно промывается после отделения его от исследуемого образца и перед выявлением связанных антител. Специалистам известны как стандартные, так и конкурентные типы анализов. 6 39944 При гомогенном характере анализа исследуемый образец инкубируется вместе с антигеном в растворе. Например, это может выполняться при условиях выпадения в осадок любых образующи хся комплексов антиген-антитело. Специалистам в данной области известны как стандартные, так и конкурентные типы таких анализов. При анализе стандартного типа непосредственно регистрируется количество антител HCV в комплексах антитело-антиген. Это может осуществляться путем определения факта связывания меченых антиксеногенных антител (например, к человеку), которые распознают эпитоп на антителах к HCV благодаря образованию комплекса. При анализе конкурентного типа количество антител HCV в образце устанавливается путем регистрации эффекта конкуренции на связывание известного количества меченых антител (или другого конкурирующего лиганда) в комплексе. Образующиеся комплексы, содержащие антитело к HCV (или, в случае анализа конкурентного типа, количество конкурирующи х антител) обнаруживаются с помощью любого из ряда известных способов в зависимости от типа анализа. Например, немеченые антитела HCV в комплексе могут быть обнаружены с помощью конъюгата антиксеногенного иммуноглобулина, скомбинированного с меткой (например, с ферментной меткой). При анализах с использованием иммунопреципитации или агглютинации в ходе реакции между антигенами HCV и антителами образуется ячеистая структура, которая выпадает в осадок из раствора или суспензии и образует видимый слой или пленку осадка. При отсутствии в исследуемом образце антитела к HCV видимый осадой не образуется. В настоящее время существуют три специфических типа анализов с использованием агглютинации частиц (РА). Эти анализы используются для обнаружения антител к различным антигенам, покрывающим носитель. Одним из таких анализов является анализ с гемагглютинацией, при котором используются эритроциты (RВC), обладающие способностью повышать чувстви тельность при пассивной адсорбции антигена (или антитела) к RBC. Добавление специфических антигенов к антителам, присутствующим в компоненте тела, если они имеются, вызывает агглютинацию покрытых очи щенными антигенами RBC. Для устранения потенциальных неспецифических реакций при проведении анализа с использованием гемагглютинации вместо RBC при РА могут применяться два искусственных носителя. Наиболее часто применяются латексные частицы. Могут, тем не менее, использоваться и желатиновые частицы. Использующий любой из этих носителей анализ основывается на пассивной агглютинации частиц, покрытых очищенными антигенами. Для использования в таких иммунологических анализах содержащие конформационные эпитопы антигены HCV Е1 и Е2 обычно должны быть упакованы в виде набора. Такой набор обычно содержит в отдельных контейнерах природный антиген HCV, контрольные составы антител (положительные и/или отрицательные), меченые антитела в случае, когда они предусмотрены схемой прове дения анализа, и реагенты, генерирующие сигнал (например, ферментный субстрат), если метка не генерирует сигнал непосредственно. Природный антиген HCV может быть уже связан с твердой основой или отделен от нее с помощью реагентов, используемых для связывания его с основой. Обычно в набор включаются также инструкции, необходимые для выполнения анализа (например, в письменном виде, на магнитной ленте, CD-ПЗУ и т.п.). Иммуноанализы, в которых используется природный антиген HCV, применяются при скрининге крови с целью приготовления запасов, в которых отсутствует потенциально инфекционный HCV. Способ приготовления запасов крови содержит следующие этапы. Взаимодействие компонента тела, предпочтительно крови или компонента крови, полученного от конкретного забора крови, с природным антигеном HCV E1 или природным антигеном HCV E2 обеспечивает иммунологическую реакцию между антителами HCV, если таковые имеются, и антигеном HCV. В результате этого взаимодействия обнаруживается факт образования комлексов антитело к HCV - антиген HCV. Вводимая в состав запаса кровь берется от доноров, которые не проявляют антитела к природным антигенам HCV, E1 или E2. В случае положительной реактивности к антигену HCV, следуе т повторить иммуноанализ с целью снижения вероятности ложноположительных результатов. Например, в процессе крупномасштабного скрининга крови при изготовлении продуктов крови (например, кровь для переливания, плазма, Фактор VIII, иммуноглобулин и т.п.) обычно предусматриваются скрининг – тесты для увеличения чувствительности (для гарантии того, что зараженная кровь не пропускается) за счет специфичности; то есть, увеличивается степень ложноположительных результатов. Таким образом, обычно откладываются для дальнейшего тестирования только те доноры, которые являются "повторно реактивными"; например, положительные в двух или более сериях иммуноанализа на данном образце. Нижеследующие примеры служат только для иллюстрации настоящего изобретения и ни в коей мере не ограничивают объем изобретения. Пример 1 Построение вектора поли PSC59 Используемая при построении последовательность HCV была выделена из плазмида рС5Р1 как фрагмент частичный Stul/BgIII. Этот фрагмент простирается от первого метионина полипротеина HCV-1 до аспарагиновой кислоты в позиции 966. Включенными сюда доменами являются нуклеокапсид, С, условные гликопротеины оболочки E1 и E2 и усеченная форма NS2 соответственно. Кроме того, фрагмент содержит также около 60 bp, соответствующих этой части 5' – нетранслируемой зоны генома HCV. Этот фрагмент обрабатывался полимеразой Klenow для создания тупых концов, а затем клонировался в область Stul вектора vaсcinia, PSC59 (полученного от Dr. В. Moss в Национальном институте здравоохранения, г. Bethesda, Md). Этот вектор показан на фиг. 2. В результате лигирования в полилинкерную последовательность вектора 7 39944 С'-конец участка NS2 содержит дополнительную последовательность Рго-Туг. Пример 2 Приготовление штаммов вируса Vaccinia, кодирующего фрагмент полипротеина HCV, включая Е1 и Е2 Скрининг рекомбинантного вируса Vaccinia выполнялся, в основном, по методу, описанному Mackett et al. в работе DNA Cloning, v. II (под ред. D.M. Glover, IRL Press, Oxford, England, 1985, p. 191-211). Более точно, слившийся монослой (сосуд 6 см) клеток почки африканской зеленой мартышки, BSC40, был инфицирован вирусом Vaccinia дикого типа (штамм WR) с многократностью инфекции (МОI) 0,05. После инкубации в течении 2 часов при температуре 37°С клетки были подвергнуты трансфекции с 25 мкг поли ДНК PSC59 по способу с применением фосфата кальция. После 4 часов инкубации эта питательная среда была заменена нормальной средой и клетки были инкубированы еще на 48 часов при температуре 37°С. Клетки выделялись путем их соскабливания с сосуда, вирус выделялся с помощью 3 циклов замораживания-оттаивания, а выделенный вирус в клеточном лизате хранился при температуре -80°С. При проведении скрининга для рекомбинантного вируса слившийся монослой клеток 143 ТК человека был инфицирован в течении 2 часов клеточным лизатом в 10-кратном последовательном разведении. После удаления инокулята в сывороточный субстрат, содержащий 25 мкг/мл 5бромодеоксиуридин, добавили 1%-ю агарозу и клетки инкубировались на 72 часа при температуре 37°С. Бляшки визуализовались путем аппликации клеточного слоя к 1%-ной агарозе плюс 0,01% нейтрального красного и инкубации клеток на всю ночь при температуре 37°С. После этого агарозовая аппликация осторожно удалялась, а клеточный слой блотировался с помощью мастер-нитрофильтра (Schleir and Schuell, BA85, 0,45 мкм). Выполнялась перепечатка мастер-фильтра и с помощью 32Р-меченой пробы гибридизации проводилось исследование последовательности HCV. Положительные бляшки выделялись из мастерфильтра, помещались в 0,5 мл бессывороточной питательной среды и дважды на 30 секунд подвергались разрушению ультразвуком. Процесс скрининга повторялся дважды для того, чтобы бляшка очистила вирус. Для распространения рекомбинантного вируса Vaсcinia десять сосудов (150 кв. см) с клетками BSC40 инфицировались вирусным штаммом при МOI=0,5. Инфицирование выполнялось на протяжении 2 часов при температуре 37°С, а вирусный штамм заменялся свежим субстратом. Через 72 часа клетки были собраны, высушены в 10 Mm Tris HCL, Ph 9,0, и гомогенизированы в гомогенизаторе ткани типа Wheaton dounce. Продукты распада клеток удалялись с помощью центрифугирования, супернатанты были обработаны трипсином и подвергнуты ультразвуковой обработке, а целые части вирусных суспензий хранились при температуре -80°С. Пример 3 Приготовление антигенов Е1/Е2 Один литр обработанных на центрифуге Hela S3 клеток выращивался в центифужной колбе до плотности 106 клеток на миллилитр. Клетки инфицировались рекомбинантным вирусом Vaccinia, кодирующим фрагмент полипротеина HCV, с использованием МOI=1,0, инкубировались в течении ночи, были собраны и хранились как осадок клеток в колбе при температуре -80°С. Продукт экспрессии Е1/Е2 очищался путем растворения клеток в гипотоническом буфере с последующим экстрагированием в буфере, содержащем неионогенный детергент. Клеточный экстракт подвергался хроматографии с помощью колонки агарозы лектина (GNA). Требуемые белки элюировали из колонки с помощью метил-a-Dманопираносайда (Sigma Corp.). Элюированные фракции регистрировались на Е1 и Е2 вестернблотами с помощью особой антисыворотки, выращенной против Е1 или Е2. Содержащие антигены фракции отстаивались и концентрировались в колонке S – Сефарозы (Pharmacia). Чистота конечного продукта составляла около 70%. Пример 4 Использование Е1/Е2 для иммуноанализов Пациенты Образцы сыворотки были получены от случайно выбранных оплачиваемых доноров плазмы из Восточных, Западных, Среднезападных и Южных штатов Соединенных Штатов Америки и приобретены у фирмы Uniglobe Research Corporation (Reseda, ICA). Предоставленные H.Tong (Huntington Memorial Hospital в г. Пасадена, штат Калифорния) образцы сыворотки получены у группы из 38 больных хроническим NANBH, связанным с переливанием крови, и другой группы из 39 больных хроническим NANBH, применявших лекарственные средства IV. У этих 77 больных отсутствовали другие болезни печени, они были нереактивны к NAV и Hbsag, а антитела к ядру (AN A) были нормальными. Три группы сероконверсии HCV, связанной с переливанием крови, были получены от Н. Alter (Национальный институт здравоохранения в г. Бетесда, штат Мэриленд) и фирмы Serologicals Incorporation в г. Кларкстоун, штат Джорджия. Образцы острого протекания HCV были предоставлены Max von Petlenkofer-Institute, университета в г. Мюнхен, Германия. 19 случаев острого протекания NANBH диагнозировались на основе биопсии печени и нормальных уровней аланин амино трансферазы (ALT) на протяжении долговременных последовательных исследований (2-11 лет). Экспрессия и очищение рекомбинантных антигенов НСV Антигены С22 (119аа), Е1 (130аа), Е2 (251 аа), NS5 (942аа) и химеровый С25 (называемый также с200/с22)(858аа) экспрессировались как внутренние антигены в дрожжах, S. cerevisiae, как слияния С-концов с человеческой дисмутазой перекиси (SOD), используя способы описанные ранее Kuo, G. et al., Science, 1989, 244:362-364, и Cousens L., et al., Gene, 1987, 61:265-272. Антиген С33С (266аа) экспрессировался как внутренний полипептид слияния SOD в Е. coli, используя способы, описанные ранее для синтеза антигена 5-1-1 (см. РСТ WО 89/046699; ЕРО Pub. № 318216; и Houghton et al., Science 244:359, 1989), которые приве 8 39944 дены здесь в качестве ссылок. После разрыва клетки и центрифугирования нерастворимые гибридные полипептиды SOD экстрагировались из клеточного осадка, используя 5 М мочевины или 1% SDS, и очищались с помощью гель-фильтрации, или сочетания ионообменной хроматографии (Q-S-сефарозы) и гель-хроматографии (Сефакрил S-300 HR). Природные антигены HCV Е1 и Е2 [называемые также rVV (е1&е2)] были очищены от эндоплазматической сети клеток, (rvv)-инфицированных рекомбинантным вирусом Vaccinia, которые содержат полноразмерные гены HCV Е1 и Е2. Очищение выполнялось с помощью афинной хроматографии с последующей ионообменной хроматографией при неденатурирующи х условия х. Эти способы были описаны в патенте WО 92/08734, который приведен здесь в качестве ссылки. Природный антиген HCV Е2, СНО-е2, был приготовлен в основном в соответствии с работой Spaete et al., Virology, 1992, 188:819-830. В частности, клеточная линия млекопитающего СНО, давшая антиген СНО-е2 была получена из плазмида, содержащего последовательность HCV-1, кодирующую А1а383 в Glu661. Затем плазмид был подвергнут трансфекции в клетки СНО для создания стабильной линии, экспрессирующей полноразмерный антиген е2 (называемый также e2/ns1). Клоны, показавшие высокую степень экспрессии, были отобраны и размножены во вращающихся колбах путем выращивания в DME/H21 с 10% диализированной сывороткой, полученной из задней части голени эмбриона, и обычными добавлениями плюс 1,6 мкМ Methotrexate. Культуральная среда надосадочной жидкости была собрана и использовалась для очищения антигена CНО-e2. Схема очищения предусматривала афинную и ионообменную хроматографии при отсутствии денатурирующи х условий. Для возмущения условных конформационных эпитопов с природным е2 приготавливался денатурированный СНО-е2 путем добавления DLдитиотреитола (DTT) до окончательной концентрации 10 Mm, 0,2% додецилсульфата натрия (SDS) и кипячения при температуре 100°С в течение 5 минут. Проведенный анализ по SDS полиакриламидной пробе-гель и окрашивание в Coomassie синий показали, что все очищенные рекомбинантные антигены HCV имели чистоту по крайней мере 90%. Анализ ELISA Антигены RVV (е1&е2), СНО-е2 и денатурированный СНО-е2 были разбавлены до оптимальной концентрации в фосфатно-солевом буферном растворе (PBS) (рН 7,4) и нанесены на пластины Immunlon™1 (Dynatech, Chantilly, FA). Анализ ELISA выполнялся следующим образом. Исследуемые образцы на пластине были разбавлены 40-кратно пробным разбавителем и инкубированы на 1 час при температуре 37°С, а затем промывались промывочным буфером. В каждую ячейку добавлялось поликлональное антитело козлиной антисыворотки к иммуноглобулину G (H+L) человека, слившиеся с пероксидазой хрена обыкновенного (HRPO). Пластины инкубировались на 1 час при температуре 37°С, а затем промывались. Для улучшения цвета HRP добавлялись о фенилэнедиамин 2НСІ (OPD) и перекись водорода. Считывание результатов осуществлялось с помощью устройства считывания пластин размером 492/620 нм. Значения оптической плотности (O.D.) среза по анализу ELISA для антигенов RVV (е1&е2), SOD, С25, С22, С33С и ns-5 составляли 0,4 плюс O.D. от среднего значения отрицательной контрольной группы. Значения среза для СНО-е2 и денатурированного СНО-е2 составили 0,3 O.D. плюс O.D. от соответствующей отрицательной контрольной группы антигенов. Величина среза анти-С100-3 составила 0,45 O.D. плюс среднее значение O.D. отрицательной контрольной группы. Результаты иммунологического анализа Результаты анализов ELISA с использованием описанных вы ше антигенов для обнаружения антител к HCV в компонентах крови, взятых у различных групп больных в Соединенных Штатах Америки, приведены в табл. 1. Представленные в табл. 1 результаты показывают, что воспроизведенные в дрожжах антигены е1 и е2 оболочки HCV являются значительно менее иммунореактивными по сравнению с рекомбинантными антигенами, воспроизведенными в вир усе Vaccinia, RVV(e1&е2), и в клетках СНО, СНО-е2. В каждой исследованной группе реактивность антигенов, воспроизведенных в дрожжах, е1 и е2, составляла только 2/3 или менее от реактивности антигенов, воспроизведенных в клетках животных. Следует отметить тот факт, что антигены е1 и е2 в дрожжах были воспроизведены в дрожжевых клетках и очищены при денатурирующих условиях. Таким образом, по-видимому, в эти х антигенах существуют только линейные эпитопы. И наоборот, природные антигены HCV, R VV(e1&е2) и СНО-е2 были выделены из клеток-хозяев животных при отсутствии денатурир ующи х условий, допускающих существование природных конформационных эпитопов. Рекомбинантные природные антигены HCV, экспрессированные из генов Е1 и Е2 в клетках, повидимому, имеют такую же иммунореактивность, как и С33С, и, возможно, С25, и большую иммунореактивность, чем любой из остальных исследованных антигенов HCV. C25 является химеровым полипротеином, содержащим слившиеся, как показано на фиг. 1, части полипептидов NS3, NS4 и С. Роль конформационных эпитопов в стимулировании ранней реакции иммунной системы клеток-хозяев оценивалась с помощью иммуноанализа различных групп сероконверсии HCV. Представленные на фиг. 2 результаты показывают иммунореактивность природных антигенов оболочки HCV, R VV (е1&е2) и СНО-е2 в образцах трех групп сероконверсии. Эти образцы в каждой группе представляют последовательный ряд проб крови у индивидуумов с постпарентеральным NANBH. Как следует из приведенных в табл. 2 результатов, природные антигены оболочки HCV, то есть антигены с природными конформационными эпитопами, выявляют антитела, которые появляются относительно раньше в ходе течения инфекции, по сравнению с антителами, которые выявлялись другими исследованными антигенами HCV. Таким образом, эти антигены могут иметь особое ис 9 39944 пользование при иммуноанализе для диагностики инфекции HCV. В табл. 3 представлены результаты сравнения природных антигенов HCV, экспрессированных из генов Е1 и Е2, со сравнимыми денатурированными антигенами. В этой таблице иммунореактивность сыворотки, полученной от больных с острым течением NANBH, прослежена во времени и сравнивается с иммунореактивностью сыворотки от больных хроническим NANBH. Как следует из табл. 3, природные антигены оболочки HСV, которые содержат и конформационные и линейные эпитопы, RVV (е1&е2) и СНО-е2, являются более иммунореактивными, чем антигены, содержащие только линейные эпитопы, е1 и е2 (воспроизведенные в дрожжах), и денатурированный СНО-е2. Общий вывод выражается в том, что иммунореактивность природных антигенов оболочки HCV увеличивается от 8 до 9 раз у больных с острым протеканием болезни и около 2 раз у больных хроническим NANBH. Таким образом, по-видимому, большинство иммунологических реакций у больных с острой формой NANBH обусловлено конформационными эпитопами, тогда как при хронической форме оно примерно делится поровну, между конформационными и линейными эпитопами. Эти исследования впервые показывают, что конформационные эпитопы могут во влекаться в иммунологическую реакцию клеток-хозяев на HCV. Пример 5 Иммуноанализ Е1/Е2: сравнение иммунокомпетентных и иммунодепрессивных больных Пациенты Подвергались исследованию три группы больных. Все они имели отрицательную реакцию в отношении антител к вирусу иммунологической недостаточности человека (HIV). Группа I состояла из 20 иммунокомпетентных больных с инфекцией хронического HCV, связанного с переливанием крови, которые в други х отношениях были здоровыми. Все эти больные имели положительную реакцию к HCV и РНК HCV. В группу II были включены 15 больных с поддержкой гемодиализом. Одиннадцать больных имели положительную реакцию к HCV при описании, один получил почечную трансплантацию в период наблюдения. Четыре пациента в период наблюдения стали положительными к HCV. В гр уппу III включены 17 больных с почечным трансплантатом. Семеро больных при описании были положительными к HCV и РНК HCV. Семеро стали положительными к HCV в период наблюдения, причем только двое из них были вначале положительными к РНК HCV. Два пациента были положительными к РНК HCV только при описании, причем оба остались положительными к РНК HCV, но отрицательными к HCV в период наблюдения. Только один пациент остался положительным к РНК HCV в период наблюдения. Сыворотка Сыворотка была собрана в период между июлем 1989 и апрелем 1992 г., и до проведения испытаний хранилась в аликвотах при температуре -70°С. По два-четыре образца, собранные в период 6-12 месяцев, были исследованы для больных группы I. По два образца, собранные в период 1,52 года, были исследованы для всех больных в группах II и III; дополнительные образцы в этом интервале времени и последующие образцы были также исследованы для тех больных, которые во второй пробе имели изменения в состоянии реакций на HCV и/или РНК HCV. Анализ ELISA Антигены HCV были приготовлены так, как это было указано в Примере 4, и использовались при выполнении анализа ELISA, как это было описано в Примере 4. При анализе N е1&е2 ложноположительность, связанная с белком Vaccinia, была уменьшена за счет, во-первых, добавления в качестве конкурирующего антигена лизата клетки Vaccinia в разбавитель образца и, во-вторых, путем использования в качестве отрицательных контрольных гр упп реактивных образцов Vaccinia. Эти результаты приведены на фиг. 3А-3С. Только 55% иммунокомпетентных больных группы І реагировали против антигенов е1 или е2, экспрессированных в дрожжах; но все больные реагировали против природных гликосилатидных антигенов е1&е2, экспрессированных в вирусе Vaccinia. Как и иммунокомпетентные больные, большинство больных с гемодиализом из группы II реагировали с антигенами С25, С22, N е1&е2. Существенно меньшая часть больных реагировала с С100-3, С33С, NS-5, е1 и е2. По сравнению с иммунокомпетентными больными существенно меньшая часть реципиентов с почечным трансплантатом в группе III реагировали против всех исследуемых антигенов HCV. Все иммунокомпетентные больные реагировали с С25, С22 и С33С; 90% - реагировали с NS-5 и 80% - с С100-3. Только 55% реагировали против воспроизведенных в дрожжах антигенов е1&е2, но все реагировали против экспрессированных Vaccinia антигенов N е1&е2, свидетельствуя о том, что эпитопы оболочки являются конформационными и гликосилатидными. 65%-90% больных с диализом и почечным трансплантатом реагировали с С25, С22 и N е1&е2, но только 12%-60% реагировали с С100-3, С33С и NS-5. Уменьшение или потеря реактивности к антигенам вируса гепатита С наблюдалось подле трансплантации почки или костного мозга, причем отмечалось меньшее влияние С25 и N е1&е2. Это дает основание предположить, что эпитопы е1&е2 являются конформационными и на реактивность к этим эпитопам минимально влияет подавление иммунитета в отношении других антигенов HCV. 10 39944 Таблица 1 Распространенность антител HCV в группах пациентов в США Группа А. Оплачиваемые доноры В. Пациенты с хроническим NANBH, связанным с переливанием крови С. Пациенты с NANBH, потребители лекарственных средств IV Кол-во пациентов 158 38 39 C22 Y-e1 Y-e2 29 18% 35 92% 19 12% 22 58% 15 9% 21 55% 39 100 % 17 44% Положительны к HCV rVV C33 C100 (e1& C -3 e2) 30 30 30 26 19% 19% 19% 17% 36 36 36 27 95% 95% 95% 71% CHO -e2 13 33% 39 100 % 39 100 % 39 100 % 27 69% Ns5 C25 любой 27 17% 28 74% 32 20% 36 95% 32 20% 36 95% 32 82% 39 100 % 39 100 % Примечания. А – случайно выбранные оплачиваемые доноры плазмы были собраны из Восточных, Западных, Среднезападных и Южных шта тов США. В&С – пробы сыворотки были взяты у 77 больных хроническим гепатитом NANBH в госпитале им. Ханингтона в г. Пасадена, шт. Калифорния, в истории болезни которых были записи о переливании крови или приеме лекарственных средств IV. Таблица 2 Сравнение проб мульти-антигенов ELISA, CHO-e2 и rVV (e1&e2) в гр уппах сероконверсии HCV Проба Дата пробы Кол-во дней* от переливания крови (1) Группа Ф сероконверсии А1 07/18/88 0 А6 08/15/88 28 А7 08/25/88 38 А8 08/29/88 42 А9 09/14/88 58 (2) Группа С сероконверсии С1 07/28/88 0 С6 08/25/88 28 С7 08/29/88 32 С8 09/01/88 35 С9 09/08/88 42 С10 09/28/88 62 (3) Група J сероконверсии J1 07/04/76 0 J2 07/16/76 12 J3 07,20,76 16 J4 08/02/76 29 J5 08/09/76 36 J6 08/17/76 44 J7 09/09/76 67 J8 09/13/76 71 J9 09/20/76 78 J10 09/27/76 85 (4) Группа В сероконверсии В1 07/19/88 0 В10 08/26/88 39 В11 08/30/88 43 В12 09/28/88 72 В13 11/09/88 114 CHOe2 ELISA S/CO rVV (e1&e2) ELISA S/CO C22 ELISA S/CO C33C ELISA S/CO C1003 ELISA S/CO ns5 ELISA S/CO C25 ELISA S/CO Уровень ALT IU/L 0,61 0,19 1,23 1,97 2,88 0,6 0,2 1,75 2,28 2,8 0,01 0,02 0,38 0,42 2,66 0,01 0,02 1,21 3,52 4,48 0,09 0,01 0,12 0,07 2,45 0,03 0,03 0,28 0,32 0,61 0,02 0,21 1,63 2,83 6,03 23 39 274 346 1175 0,07 0,54 1,29 2,25 6,14 7,66 0,12 0,31 0,43 1,29 2,62 3,42 0,08 0,13 0,08 0,26 1,38 5,32 0,08 0,11 0,08 0,28 0,86 4,79 0,21 0,21 0,10 0,18 0,15 1,68 0,23 0,15 0,09 0,13 0,13 0,12 0,01 0,02 0,02 0,32 2,11 6,65 22 53 63 81 183 563 0,13 0,05 0,06 0,07 0,12 0,05 0,10 1,03 1,78 2,22 0,09 0,06 0,09 0,14 0,16 0,14 0,10 0,64 0,10 2,35 0,07 0,03 0,02 0,06 0,08 0,07 0,11 0,62 1,14 2,10 0,03 0,04 0,03 0,10 0,08 0,11 0,09 0,21 0,42 0,87 0,02 0,01 0,06 0,08 0,07 0,08 0,10 0,07 0,08 0,04 0,02 0,01 0,03 0,07 0,08 0,07 0,09 0,07 0,08 0,07 0,08 0,10 0,07 0,06 0,09 0,11 0,12 0,68 1,88 3,25 13 56 34 19 19 23 163 168 320 660 0,08 0,11 0,06 0,26 0,16 0,09 0,35 0,48 1,63 2,18 0,08 0,12 0,63 6,38 4,95 0,09 0,17 0,15 5,19 5,99 0,08 0,10 0,08 0,18 4,15 0,21 0,28 0,27 0,54 8,16 0,09 0,18 0,48 5,88 6,78 11 78 18 40 72 Примечание: * - количество дней от даты сбора проб. S/CO: OD сигнала анализа/значение OD среза. 11 39944 Таблица 3 Распространенность антигенов к HCV, содержащих конформационные эпитопы, по сравнению с антигенами, содержащими только линейные эпитопы при острой и хронической формах NANBH Диагноз Время после переливания крови Антигены HCV С25 rVV (e1&e2) СНР-е2 СНО-е2 (денатурированный) е1 е2 Количество (в %) положительных реакций к HCV после переливания крови Острая форма NANBH Хронический NANBH 0-6 мес. 6-12 мес. >12 мес. 19/19* (100%) 16/19* (84%) 11/19* (58%) 1/19* (5%) 1/19* (5%) 2/19* (11%) 19/19* (100%) 17/19* (89%) 12/19* (63%) 3/19* (16%) 1/19* (5%) 4/19* (21%) 18/19* (95%) 16/19* (84%) 13/19* (68%) 4/19* (21%) 4/19* (21%) 4/19* (21%) 9/9* (100%) 9/9* (100%) 9/9* (100%) 5/9* (56%) 4/9* (44%) 4/9* (44%) Примечания: * - количество положительных/количество исследованных; ** - диагноз острой формы NANBH основан на биопсии (подавляющее большинство подвергнуто биопсии) и разложении персистенции трансаминазы. Фиг. 1 12 39944 Фиг. 2 Фиг. 3А Фиг. 3В Фиг. 3С 13 39944 __________________________________________________________ ДП "Український інститут промислової власності" (Укрпатент) Україна, 01133, Київ-133, бульв. Лесі Українки, 26 (044) 295-81-42, 295-61-97 __________________________________________________________ Підписано до друку ________ 2001 р. Формат 60х84 1/8. Обсяг ______ обл.-вид. арк. Тираж 50 прим. Зам._______ ____________________________________________________________ УкрІНТЕІ, 03680, Київ-39 МСП, вул. Горького, 180. (044) 268-25-22 ___________________________________________________________ 14
ДивитисяДодаткова інформація
МПК / Мітки
МПК: G01N 33/569, G01N 33/576, C12N 15/09
Мітки: способи, спосіб, визначення, ссавця-хазяїна, використання, вірусу, сероконверсії, гепатиту, набір, ранньої
Код посилання
<a href="https://ua.patents.su/14-39944-sposib-viznachennya-ranno-serokonversi-u-ssavcya-khazyana-do-virusu-gepatitu-s-i-nabir-dlya-vikoristannya-v-sposobi.html" target="_blank" rel="follow" title="База патентів України">Спосіб визначення ранньої сероконверсії у ссавця-хазяїна до вірусу гепатиту с і набір для використання в способі</a>
Попередній патент: Комплектний розподільний пристрій типу камер збірних одностороннього обслуговування
Наступний патент: Гербіцидний засіб
Випадковий патент: Парасоль