Спосіб переінсталяції системи контролю антигенного гомеостазу організму ссавця за кухарчуком-радченком-сірманом
Номер патенту: 72310
Опубліковано: 15.02.2005
Автори: Сірман Віктор Мірчович, Кухарчук Олександр Леонідович, Радченко Віктор Володимирович
Формула / Реферат
Спосіб переінсталяції системи контролю антигенного гомеостазу організму дорослого ссавця, який відрізняється тим, що зазначеному ссавцю вводять ефективну кількість ембріональних плюріпотентних прогеніторних клітин (ЕППК).
Текст
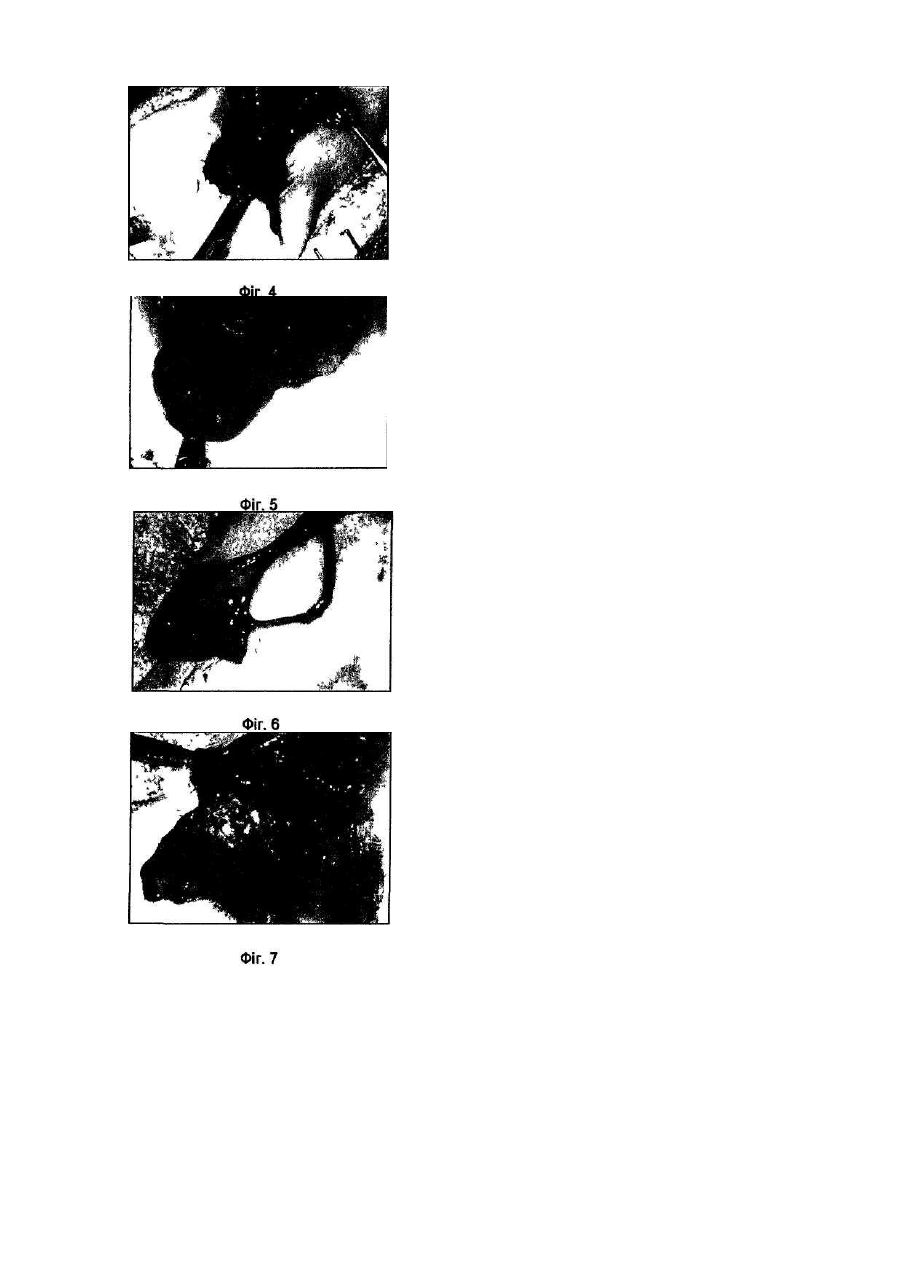
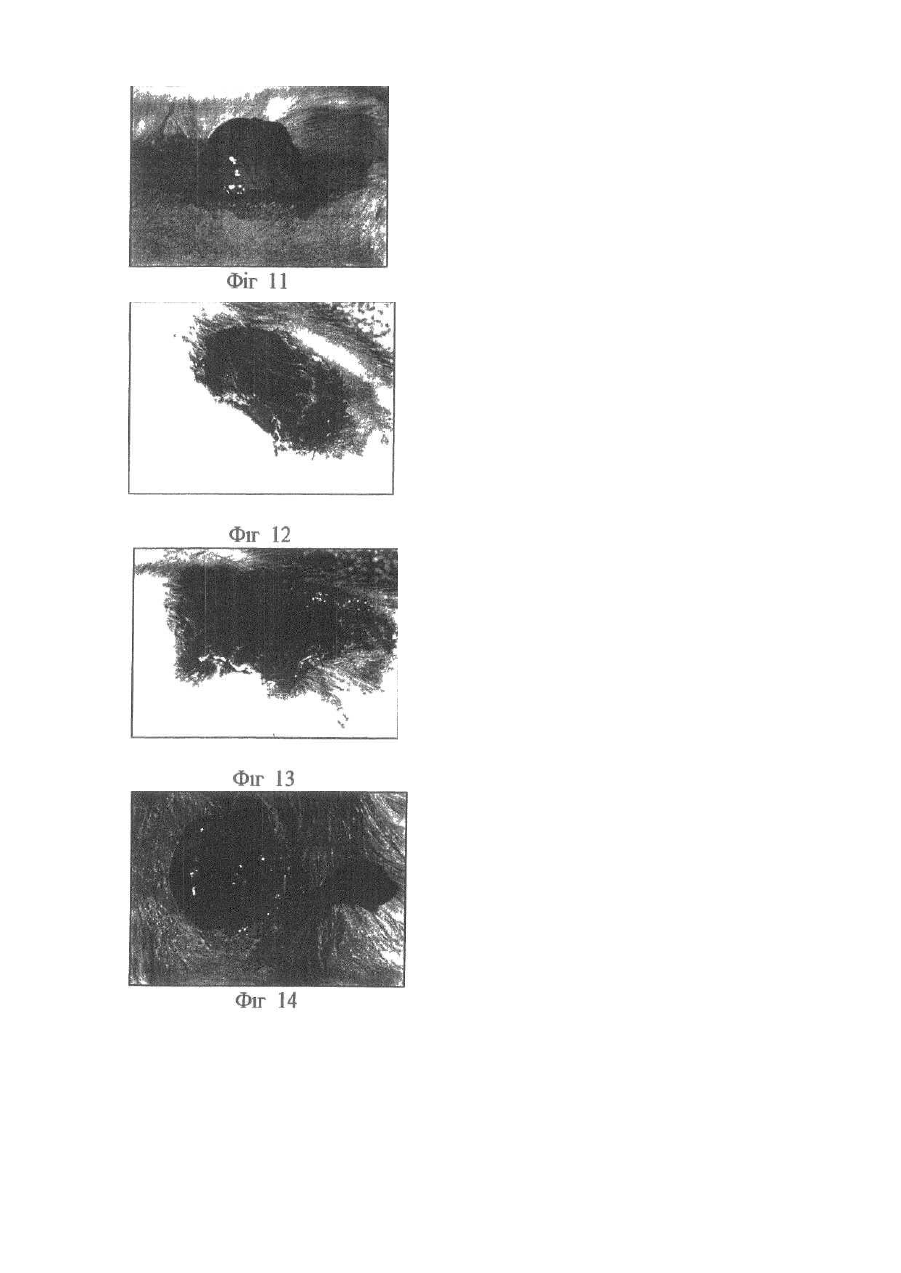
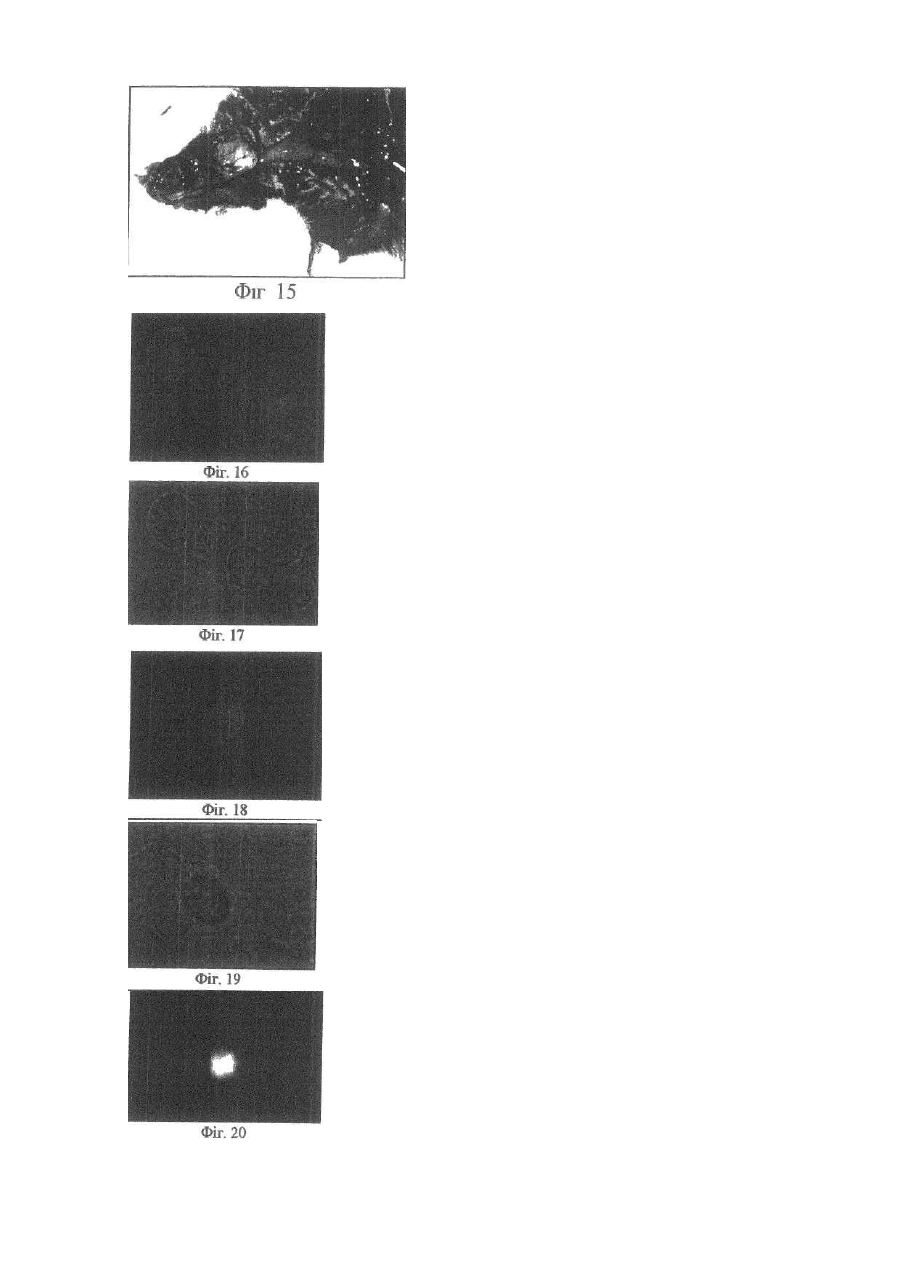
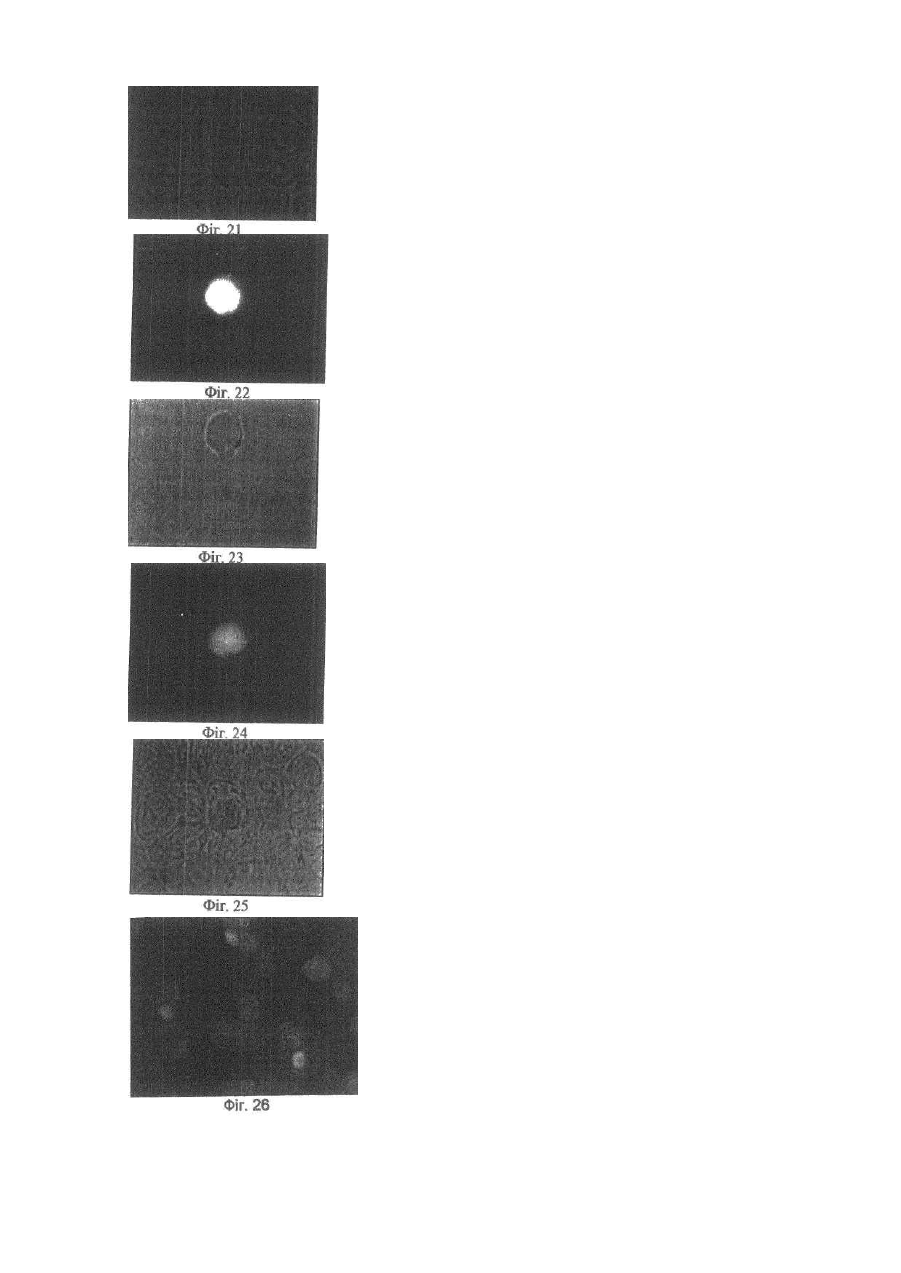
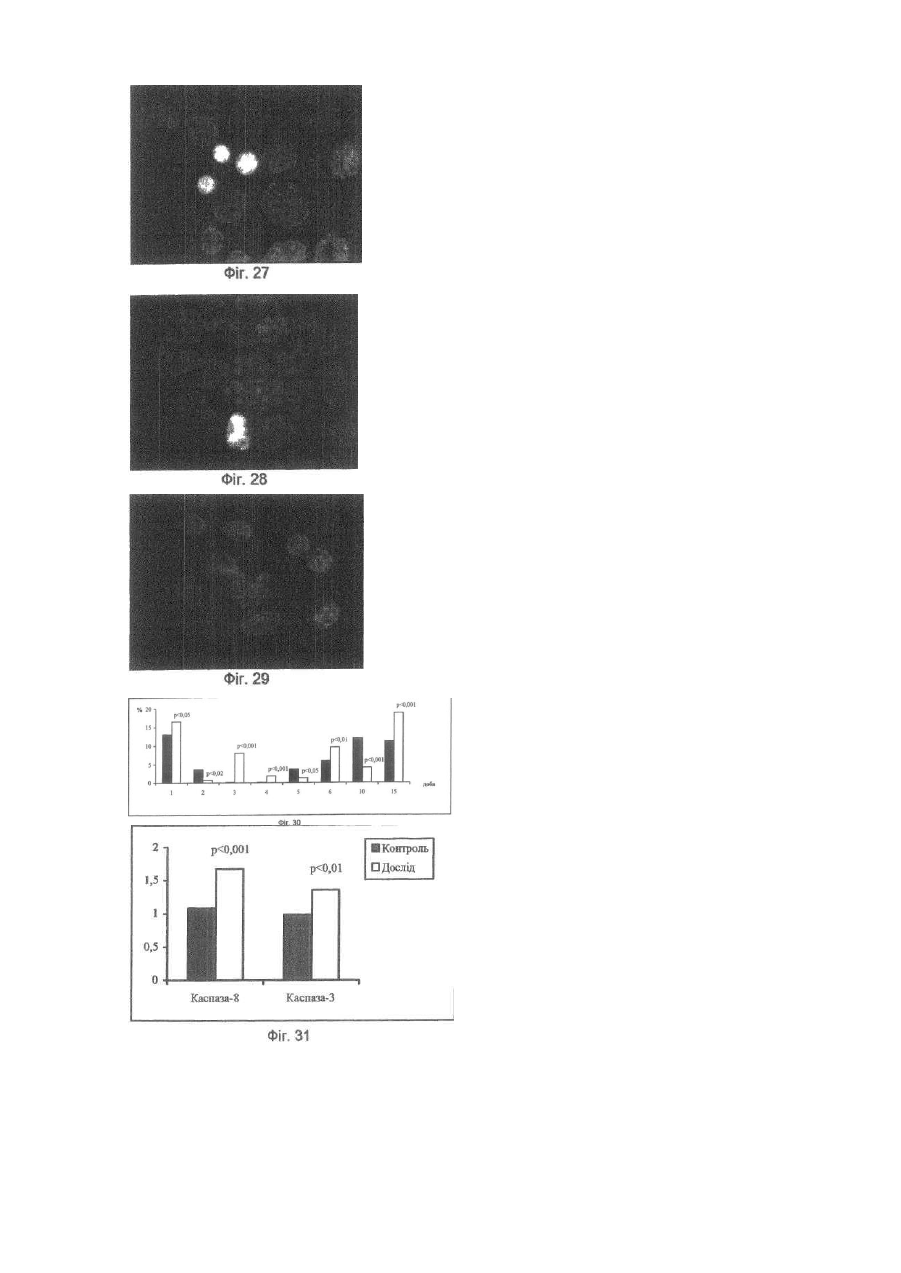
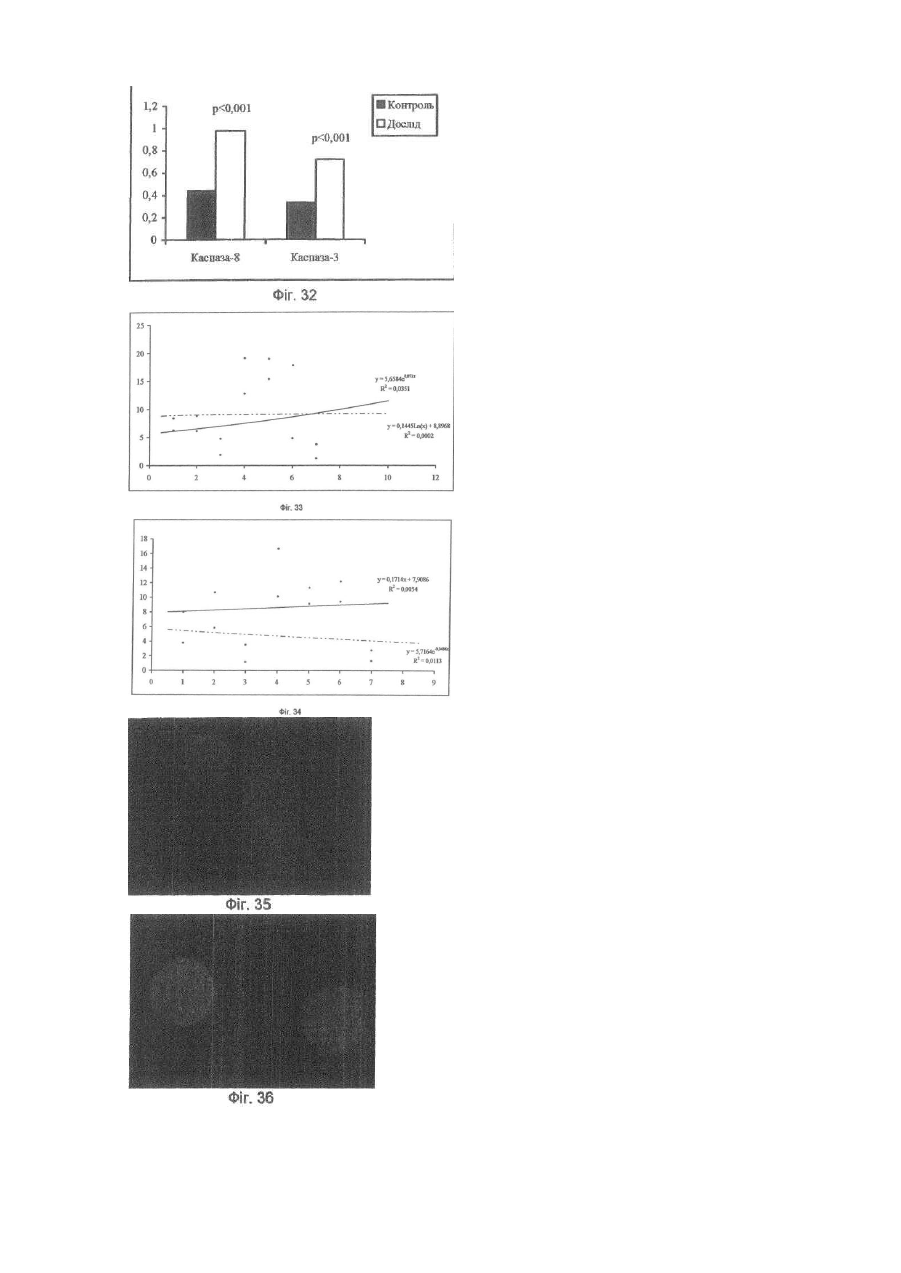
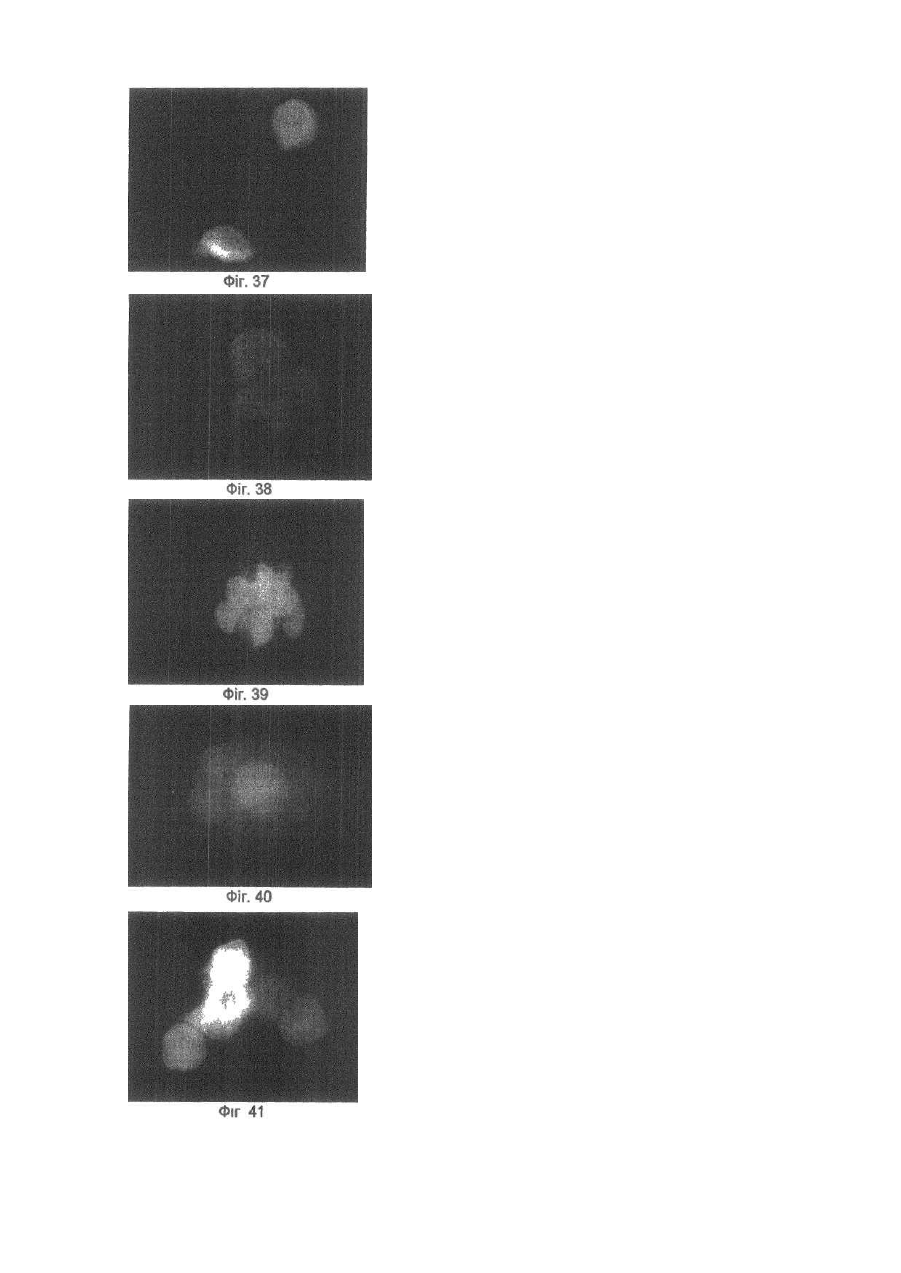
Винахід відноситься до галузі медицини та біології і може бути використаним при ало- і ксенотрансплантації органів і тканин, в лікуванні автоімунних хвороб (гломерулонефрит, ревматоїдний артрит, хронічний активний гепатит та ін.); дегенеративних нервових хвороб, де автоімунний процес відіграє роль основної патогенетичної ланки (хвороба Альцгеймера, розсіяний склероз, АЛС та ін.); імунного безпліддя; інфаркту міокарда; інсульту; хвороби Паркінсона; гіпо- та апластичних анемій; імунного невиношування вагітності; ендокринних захворювань, пов'язаних з гіпофункцією залоз внутрішньої секреції, в тому числі й цукрового діабету; різних форм остеопорозу; клімаксу жіночого і чоловічого; променевої хвороби та інших захворювань різної етіології. Закони трансплантації, які засновані на сучасних уявленнях про імунну систему організму ссавців, наголошують, що відторгнення алогенного трансплантата відбувається внаслідок того, що він несе антигени, які не відповідають головному комплексу гістосумісності реципієнта (МНС, HLA). При цьому унікальність імунної відповіді при алотрансплантації визначається тим, що чужорідні молекули МНС (HLA) безпосередньо активують Т-клітини реципієнта, тобто молекулярною основою реакції відторгнення алотрансплантата є взаємодія між рецепторами Т-лімфоцитів і молекулами МНС (HLA), переважно HLA-DR (Ройт Α., Бростофф Дж., Мейл Д. Иммунология./Пер. с англ. В.И.Кандрора, А.Н.Маца, Л.А.Певницкого, М.А.Серовой. - М.: Мир, 2000. - 592с). Тому в теперішній час (цілком обґрунтовано, але з різною мірою ефективності) в практичній трансплантології застосовуються такі способи попередження відторгнення трансплантата, як неспецифічна і специфічна імуносупресія, індукція ареактивності до трансплантата шляхом спрямованого впливу на цитокінову регуляцію імунної відповіді, моделювання співвідношення між Th-лімфоцитами 1 і 2 типів, використання антитіл проти CD3+-outhh та ін (WO9930730А1. Tremblay, Jacques, P. Способы и композиции для трансплантации клеток хозяину. - Изобретения стран мира. - 2000. - Вып.8, №12. - С.70; US5914314A. Falk, Rudolf Edgar, Asculai, Samuel S. Форма гиалуроновой кислоты и лекарственное средство, применяемые для уменьшения реакции отторжения трансплантированных органов у млекопитающих. - Изобретения стран мира. -2000. - Вып.8, №12. - С.50; US5916559A. Strom, Terry В. Применение агентов, специфичных в о тношении рецептора интерлейкина-2, для лечения отторжения трансплантата. - Изобретения стран мира. - 2000. Вып.8, №12. - С.54; 6А61К39/385. Карпов И.А., Копыльцов В.Н., Скалецкий Н.Н. Способ трансплантации органов и тканей. - 1998. - RU БИ №32. - С.340; WO6А61К31/70. Simon, Paul Μ.; Mequire, Edward, J. Способы и олигосахариды для ослабления отторжения трансплантата. - Изобретения стран мира. - 2000. - Вып.8, №1. С.71). Останніми роками у науковій літературі з'явилась величезна кількість нових повідомлень щодо біології ембріональних стовбурових клітин (ЕСК) і перспектив використання останніх в практичній медицині. Основним напрямком більшості досліджень є трансформація ЕСК, які знаходяться на етапах тоті-, плюрі- або поліпотентності, в спеціалізовані клітини в зоні ушкодження тканин різних органів (Civin C.I. Human pluripotent stem cells: science fiction poses no immediate dangers//Stem Cells. - 2000. - Vol.18. - P.4-5.; Takatsugu Y., Masahide Y., Seiji K., Yoko K., Yoshiyuki N., Shigeaki I., Yukio T. In vitro differentiation of embryonic stem cells into hepatocyte-like cells identified by cellular uptake of indocyanine green // Stem Cells. - 2002. - Vol.20. - P.146-154.). Доведено, що ЕСК і прогеніторні клітини на рівні плюріпотентності здатні перетворюватися в спеціалізовані клітини, тип і вид яких залежать від мікрооточення (Fandrich F., Lin X., Chai G.X. Preimplantation-stage stem cells induce long-term allogeneic graft acceptance without supplementary host conditioning/ Nat. Med. - 2002. - Vol.8. P.171-178.; Hawley R.G., Sobieski D.A. New feature: stem cells in the news // Stem Cells. - 2002. - Vol.20. - P.103104.). Цей факт є предметом серйозної уваги провідних вчених світу (Stem Cells in the news: Robert G.Hawley, Donna A.Sobiesky, 2002) і аналізується з різних позицій і точок зору, однак жодна з них не передбачає можливість заміни контролюючої антигенний гомеостаз частини імунної системи організму на нову при введенні дорослим ссавцям ЕСК або прогеніторних клітин ембріону. Розробити спосіб індукції мегадозами ембріональних плюріпотентних прогеніторних клітин (ЕППК) імунологічної толерантності шляхом створення нової бази імунокомпетентних клітин з одночасною інсталяцією de novo системи контролю антигенного гомеостазу організму ссавців (ефект Кухарчука-Радченка-Сірмана). Відомо, що тотіпотентні ембріональні стовбурові і плюріпотентні прогеніторні клітини під впливом певного спектру факторів росту і цитокінів здатні диференціюватися в клітини будь-якої тканини, у тому числі в клітини імунної і кровотворної систем (Schuldiner Μ., Yanuka О., Itskovitz-Elder J. Effects of 8 grown factors on the differentiation of human embryonic stem cells // Proc. Nat. Acad. Sci. USA. - 2000. - Vol.97. - P.111307-11312.). Особливістю структурно-функціональної побудови останніх є те, що вони уявляють собою динамічну сукупність клітин-попередників, фіксованих на стромальних елементах, і диференційованих клітин-ефекторів, які виконують свої функції за межами спеціалізованих органів. Зокрема, така особливість структурнофункціональної побудови системи крові призводить до виникнення так званого "кров'яного хімерізму", коли в організмі імунологічно послабленого реципієнта після трансплантації кісткового мозку одночасно існують еритроцити, антигени яких належать до різних груп. Тривалість кров'яного хімерізму досягає 90-420 днів, а динаміка змін груп крові характеризується поступовим зменшенням кількості еритроцитів донора на тлі перманентного зростання еритроцитів, які мають групові антигени реципієнта (Зотиков Е.А. Карл Ландштейнер и его наследие//Гематология и трансфузиология. - 2001. - Т.46, №5. - С.25-27.), що є яскравим проявом законів збереження клітинної маси, стромальної сингенної преференції і алогенної інгібіції (Вершигора А.Е. Общая иммунология. - К.: Вища школа, 1989. - 736с; Шевченко Ю.Л., Жибурт Е.Б. Безопасное переливание крови. - СПб, Питер, 2002. - 320с; Kikuya S., Hirroko Η., Junji I., Yasushi Α., Shigeru Т., Shinryu L., Takashi N., Susumu I. Major histocompatibility complex restriction between hematopoietic stem cells and stromal cells in vitro//Stem Cells. - 2001. - Vol.19. - P.46-58.). Загальновизнано, що строма органів є не лише їх просторовим каркасом, а уявляє собою сукупність біологічно активних елементів, які забезпечують всі аспекти функціонування паренхіматозних клітин. В ембріогенезі людини і ссавців утворення поряд 350 типів спеціалізованих клітин відбувається за рахунок клітинного пула зародкових листків (екто-, енто- і мезодерми), а також мезенхіми, яка виконує численні метаболічні, сигнальні, механічні і морфогенетичні функції. Клоногенна проліферація стовбурових і прогеніторних мезенхімальних клітин, їх міграція та синтез біологічно активних речовин регулюють органогенез, забезпечують випереджуючий розвиток кровоносних і лімфатичних судин та формування строми майбутніх органів. Впродовж ембріогенезу мезенхімальні клітини виробляють ростові фактори (HGF, TGF-a, EGF, KGF), до яких на мембранах паренхіматозних прогеніторних клітин експресуються рецептори, а в диференційованій дорослій тканині стромальна сітка генерує сигнали для підтримки життєздатності і проліферації прогеніторних клітин (SCF, HGF, IL-6, IL-7, IL-8, IL-11, IL-12, IL-14, IL15, М-CSF, LIF та ін.). Більше 20% мезенхімальних стовбурових і прогеніторних клітин після введення в кров у дорослої людини захоплюється стромою кровотворної тканини і паренхіматозних органів, що в теперішній час використовується для підвищення ефективності реколонізації кісткового мозку в онкологічних хворих після радіаційного опромінення, коли незрілі мезенхімальні клітини вводять у кров разом з гемопоетичними стовбуровими/прогеніторними клітинами (Dennis J.E., Charbord P. Origin and differentiation of human and murine stroma//Stem Cells. - 2002. - Vol.20. - P.205-214.; Huss R. Isolation of primary and immortalized CD34hematopoietic and mesenchymal stem cells from various sources//Stem Cells. - 2000. - Vol.18. - P.1-9.; Taketoshi K., Muneo I., Hiroko H., Naoya L, Takashi E., Ryokei O., Hirokazu I., Susumu I. Crucial role of donor-derived stromal cells in successful treatment for intractable autoimmune diseases in MRL/lpr mice by BMT via portal vein//Stem Cells. - 2001. - Vol.19. - P.226-235.; Tian-Xue F, Hiroko H, Tie-Nan J., Cheng-Ze Y., Zhe-Xiong L., Shu-Bin G., Yun-Ze C, Biao F., Guo-Xiang Y., Qing L., Susumu I. Successful allogeneic bone marrow transplantation (BMT) b y injection of bone marrow cells via portal vein: stromal cells as BMT-facilitating cells//Stem Cells. - 2001. - Vol.19. - P.144-150.). Враховуючи зазначене вище, гіпотеза про можливість інсталяції de novo системи контролю антигенного гомеостазу організму за допомогою ЕППК набуває наукової реальності. Поставлена мета досягається тим, що для переінсталяції системи контролю антигенного гомеостазу організму ссавців застосовуються мегадози ЕППК, що індукує імунологічну толерантність до алотрансплантатів шкіри і селезінки у стате возрілих щурів. Для виділення ЕППК вагітних самок щурів (сертифікат розпліднику Інституту фізіології ім. О.О.Богомольця НАН України) вводили в наркоз (натрію етамінал - 40мг на кг маси тіла) на 11-13 стадіях розвитку ембріонів за Астауровим (Объекты биологии развития/Под ред. Б.Л.Аста урова. - М.: Наука, 1975. - 580с). Після асептичної обробки операційного поля (96° етиловий спирт, йод) виконували серединну лапаротомію по linea alba. Обидва роги матки виводили в операційну рану і розрізали стерильними ножицями поперек (біля ембріонів). Останні вилущували в стерильну чашку Петрі з охолодженим до 4°С середовищем Хенкса з гентаміціном (кінцева концентрація - 0,001%). Після потрійної промивки з ембріонів виділяли ЕППК за розробленою нами методикою (заявка на патент України № 20022097445). Суспензію ЕППК профільтровували через капроновий фільтр (200мкм). До фільтрату додавали рівний об'єм 5%-го розчину димексиду (попередньо профільтрованого через клітинний фільтр з розміром пор 0,20мкм). Після трансплантації шкіри дослідним щурам внутрішньовенно вводили суспензію ЕППК (контроль життєздатності здійснювали шляхом світлової мікроскопії при забарвленні клітин трипановим синим) у мегадозі. Поняття "мегадоза" передбачає наявність в 1мл клітинної суспензії декількох мільйонів життєздатних ядровмістних клітин. За розробленою нами методикою вихід ЕППК становив 80*109/л. Розрахунки свідчать, що, наприклад, максимальна доза гемопоетичних клітин ембріональної печінки людини при внутрішньовенному введенні 4,0мл суспензії, що містить 2,5*108/мл ядровмістних клітин, забезпечує концентрацію останніх у крові (без врахування тканинного пулу), яка складає 0,2 клітини на 1мкл. Доза, яка застосовувалась у наши х дослідженнях (80-109/л ЕППК в об'ємі 15мл/кг маси тіла тварини), дозволяє досягнути концентрації ЕППК у 16000 клітин на 1мкл крові, що вдвічі вище верхньої межи норми кількості лейкоцитів у крові людини і в 80000 разів більше, ніж після введення тієї дози клітин, що застосовується в клініці у теперішній час (Снігир Н.В. Застосування гемопоетичних клітин ембріональної печінки людини в лікуванні цитостатичної мієлодепресії у онкологічних хворих: Автореф. дис. ... канд. мед. наук/14.01.07 - онкологія. - Київ, 2001. - 20а). Контрольним тваринам вводили відповідний об'єм 5%-го розчину димексиду в середовищі Хенкса. Всього в роботі використано 376 білих щурів. Протокол операції попарної алотрансплантації шкіри. По дві тварини одночасно вводили в наркоз (натрію етамінал - 40мг на кг маси тіла). Ножицями ретельно видаляли шерсть на шкірі спіни. Шкіру обробляли 96° спиртом та спиртовим розчином йоду. По шаблону (діаметр - 5см) концентрованим йодом відмічали межі шкірних лоскутів. Лоскути шкіри відсепаровували і проводили попарну (одна тварина з пари щурів входила до гр упи контролю, інша отримувала ЕППК) алотрансплантацію шкіри з уши ванням шкірних країв вузловими однорядними швами. Протокол операції попарної алотрансплантації селезінки. По дві тварини одночасно вводили в наркоз (натрію етамінал - 40мг на кг маси тіла). Ножицями ретельно видаляли шерсть на шкірі живота. Шкіру обробляли 96° спиртом та спиртовим розчином йоду. Після серединної лапаротомії у обох щурів видаляли 1/2 селезінки, декапсулювали її і виконували попарну (одна тварина з пари щурів входила до групи контролю, інша отримувала ЕППК) алотрансплантацію селезінки в чіпець. Шкіру і м'язи ушивали вузловими однорядними швами. Виділення клітин. На першу, другу, третю, четверту, п'яту, шосту, сьому, десяту і п'ятнадцяту доби після операції у тварин під нембуталовим наркозом видаляли тімус, кістковий мозок, брижові лімфовузли і селезінку. Органи роздрібняли і виділяли клітини за допомогою м'ягкого піпетування тканин у забуференому фосфа тами 0,9%-ному розчині натрію хлориду (ЗФНХ) з наступним фільтруванням отриманої суспензії через капроновий фільтр (200мкм). Активність каспази-8 і каспази-3 у лізатах клітин, виділених із тимуса, кісткового мозку, селезінки і лімфатичних вузлів визначали за допомогою реактивів і рекомендацій фірми BioVision (США) з реєстрацією показників на мультіскані «Уніплан-М» (Росія). Концентрацію білка в суспензії клітин визначали за методом Лоурі. Для визначення тканинної локалізації ЕППК після їх внутрішньовенного або внутрішньочеревного введення проводили забарвлення мембран ЕППК лінкорним флюоресцентним барвником "РКН 67" згідно інструкції фірми-виробника (Sigma). Для дослідження апоптозу клітини забарвлювали за методикою Shimizu S. et al. (Shimizu S., Eguchi Y., Kamiike W. Involvement of ICE family proteases in apoptosis induced by reoxygenation of hypo xic hepatocytes//Amer. J. Ph ysiol. - 1996. - Vol.271. - P.G949-G958.). У суспензію клітин вносили розчин ядерних барвників "Хехст 33342" і пропідіум йодид (кінцева концентрація 15мкмоль/л) та інкубували впродовж 15хв при кімнатній температурі, в темряві. Для відмивання барвників до суспензії клітин додавали (8:1) розчин ЗФНХ і центрифугували при 900g протягом 7хв. Приготування препаратів. Суспензію забарвлених клітин наносили на предметне скло і після висушування фіксували в парах формаліну впродовж 10хв, промивали, висушували і заключали в Polymount. Підрахунок клітин. Препарати досліджували в люмінесцентному мікроскопі "МЛ-2" (імерсійний об'єктив, збільшення - в 100 разів). Підраховували кількість апоптотичних клітин і тілець, а також клітин з вираженою конденсацією ядерного хроматину за апоптотичним типом (у кожному препараті оцінювали на наявність ознак апоптозу по 400 клітин). Мікрофотографування. Використовували кольорову негативну плівку "Kodak Gold 100" (ISO 100/21) з витримкою при фотографуванні люмінесценції від 30 до 120с, фазово-контрастного зображення - від 4 до 15с. Отримані результати статистично оброблені на PC IBM Pentium III за програмою "BioStat" (Гланц С. Медико-биологическая статистика. - М.: Практика, 1999. - 459с). Перелік фігур, що демонструють результати дослідження. Фіг.1-Фіг.8 - вплив ембріональних плюріпотентних прогеніторних клітин (ЕППК) на приживлення алотрансплантатів селезінки у щурів. Фіг.1 - фото контрольної тварини, яка не отримувала ЕППК. Через 1міс. після операції під нембуталовим наркозом проведена серединна лапаротомія. В операційну рану вивернуто чіпець, в який вшивалась алоселезінка. Остання осумкована чіпцем. Фіг.2 - за тих самих умов проведена серединна лапаротомія щур у, який отримував ЕППК. Алоселезінка знаходиться у товщі не запаленого чіпця. До неї підходять судини. Фіг.3 - на фото наведені результати розтину запальної кишені чіпця у контрольного щура через 1міс. після алотрансплантації селезінки. Всередині детритних мас знаходиться алоселезінка блідо-коричневого кольору, яка вільно лежить на сполучнотканинній капсулі, не має судин, що відходять від чіпця. Фіг.4 - на фото наведені результати спроби виділити алоселезінку з чіпця. Навколо травмованого при цьому чіпця вогнища кровотечі. Алоселезінка звичайного кольору, щільно контактує з чіпцем через васкуляризацію його судинами. Фіг.5 - фото контрольної тварини, яка не отримувала ЕППК. Через 2міс. після операції під нембуталовим наркозом проведена серединна лапаротомія. В операційну рану вивернуто чіпець, в який вшивалась алоселезінка. Остання знаходиться в запальний кишені, утвореної чіпцем. Фіг.6 - через 2міс. після операції проведена серединна лапаротомія щур у, який отримував ЕППК. Алоселезінка знаходиться у товщі нормального чіпця, васкуляризована. Фіг.7 - на фото наведені результати розтину запальної кишені чіпця у контрольного щура через 2міс. після алотрансплантації селезінки. Всередині кишені знаходяться лише детритні маси, алоселезінки немає. Стінки запальної кишені утворені грубою сполучною тканиною. Фіг.8 - фото алоселезінки тварини, яка отримувала ЕППК. 2міс. після операції. Селезінка васкуляризована, звичайного кольору. Чіпець не має запальних змін. Фіг.9 - Загальна схема досліду по індукції ембріональними плюріпотентними прогеніторними клітинами (ЕПГПС) імунологічної толерантності до алотрансплантатів селезінки. А - виділені з ембріонів самки щура ЕППК внутрішньовенно введено щуру-реципінту. Контрольна тварина отримує відповідний об'єм розчину Хенкса. Виконується попарна алотрансплантація: половина селезінки контрольного щура трансплантується в чіпець щура-реципієнта ЕППК, а половина селезінки останнього - в чіпець контрольної тварини. В - через 2міс. після операції виконується серединна лапаротомія, яка виявляє приживлення алоселезінки у щура-реципієнта ЕППК і відторгнення алоселезінки у контрольного щура. Відразу виконується етап С. С - половину селезінки контрольного щура, що залишилася після першої операції (див. етап А), трансплантовано в чіпець тварини-реципієнта ЕППК, а залишок селезінки щура-реципієнта ЕППК вшито в чіпець контрольної тварини. Ділянка шкіри щура-реципієнта трансплантована контрольній тварині та, навпаки, ділянка шкіри контрольної тварини трансплантована дослідному щур у, який отримував ЕППК. D - через 2 тижні після алотрансплантації другої половини селезінок контрольної і дослідної тварин, які отримували ЕППК відторгається алошкіра, але приживлюється алоселезінка, тоді як у щурів контрольної групи спостерігається відторгнення як алотрансплантатів як шкіри, так і селезінки. Фіг.10-Фіг.15 - результати досліду по індукції ембріональними плюріпотентними прогеніторними клітинами (ЕППК) імунологічної толерантності до алотрансплантатів селезінки. Фіг.10 - 11 - фотографії демонструють етап В загальної схеми досліду, наведеної на Фіг.9: у щура, який отримував ЕППК, відбувається приживлення алоселезінки, а у тварини контрольної групи - її відторгнення. (Фіг.10 - введення ЕППК, Фіг.11 - контроль). Фіг.12-13 - фотографії демонструють етап D загальної схеми досліду, наведеної на Фіг.9: алотрансплантати шкіри відторгаються як у контрольної, так й у дослідної тварини. (Фіг.12 - введення ЕППК, Фіг.13 - контроль). Фіг.14-15 - фотографії демонструють етап D загальної схеми досліду, наведеної на Фіг.9: повторна алотрансплантація другої половини алоселезінки у щура, який отримував ЕППК, завершується її приживленням, тоді як у контрольної тварини відбувається відторгнення алоселезінки. (Фіг.14 - введення ЕППК, Фіг.15 - контроль). Фіг.16-25 - РКН 67 - позитивні клітини в тимусі щурів. Фіг.16 - люмінесцентна мікроскопія базальної суспензії ембріональних плюріпотентних прогеніторних клітин, перед її введенням щурам-реципієнтам. Фіг.17 - фазово контрастна мікроскопія базальної суспензії ембріональних плюріпотентних прогеніторних клітин, перед її введенням щурам-реципієнтам. Фіг.18, 20, 22, 24 - люмінесцентна мікроскопія тімуса, яка виявляє РКН 67 - позитивні клітини у вилочковій залозі. Фіг.19, 21, 23, 25 - фазово контрастна мікроскопія тімуса, яка виявляє РКН 67 -позитивні клітини у вилочковій залозі. Фіг.26-32 - апоптоз і активність каспаз в органах імунної системи щурів з алотрансплантацією селезінки, які отримували ембріональні плюріпотентні прогеніторні клітини ембріону (ЕППК). Фіг.26 - апоптоз у тимусі щурів, які отримували ЕППК. Фіг.27 - апоптоз у кістковому мозку щурів, які отримували ЕППК. Фіг.28 - апоптоз у селезінці щурів, які отримували ЕППК. Фіг.29 - апоптоз у лімфатичних вузлах щурів, які отримували ЕППК. Фіг.30 - динаміка апоптозу (%) клітин тімуса контрольних тварин (темні стовпчики) і щурів, які отримували ЕППК (світлі стовпчики). Фіг.31 - активність каспази-8 (а) і каспази-3 (б) в тімусі контрольних тварин (темні стовпчики) і щурів, які отримували ЕППК (світлі стовпчики) (одиниця виміру - UE/1мг білка). Фіг.32 - активність каспази-8 (а) і каспази-3 (б) в кітковому мозку контрольних тварин (темні стовпчики) і щурів, які отримували ЕППК (світлі стовпчики) (Одиниця виміру - UE/1мг білка). Фіг.33 - 34 - лінії тренда інтенсивності апоптозу клітин тімуса і кісткового мозку контрольних тварин і щурів, які отримували ембріональні плюріпотентні прогеніторні клітини ембріону (ЕГШК) при алотрансплантації селезінки. Фіг.33 - лінії тренду відсотку апоптотичних клітин у тимусі контрольних щурів (пунктирна лінія) і тварин, які отримували ЕППК (безперервна лінія). Фіг.34 - лінії тренду відсотку апоптотичних клітин у тимусі контрольних щурів (пунктирна лінія) і тварин, які отримували ЕППК (безперервна лінія). Фіг.35-41 - апоптоз ембріональних плюріпотентних прогеніторних клітин (ЕППК) у змішаній суспензії (від двох різних ембріонів). Фіг.35 - суспензія А. ЕППК забарвлені РКН 67. Фіг.36 - суспензія В. ЕППК забарвлені пропідія йодидом. Фіг.37 - суспензія А. ЕППК забарвлені РКН 67 і пропідія йодидом. Фіг.38 - змішана суспензія ЕППК "А+В". Класичний апоптоз клітини В. Фіг.39 - змішана суспензія ЕППК "А+В". Клітини А: конденсація хроматину. Blebs. Фіг.40 - змішана суспензія ЕППК "А+В". Апоптотичний розпад ядра клітини В. Фіг.41 - змішана суспензія ЕППК "А+В" через 18год інкубації: накопичення апоптотичних клітин і тілець. У щурів, які отримували ЕППК, впродовж експерименту відторгнення алотрансплантатів шкіри не відбувалося, тоді як у групі контрольних тварин алотрансплантати шкіри відторгнулись на третю (5% тварин), сьому (75% випадків) і девяту (20% щурів) доби спостереження. Контрольна лапаротомія, що була проведена у щурів через 1 і 2 місяці після алотрансплантації селезінки, виявила приживлення останньої тільки у тварин, яким вводили ЕППК (Фіг.1-8). Для виключення імовірного імунодепресивного ефекту ЕППК і підтвердження розвитку під їх впливом імунологічної толерантності (тобто ареактивності імунної системи до конкретного антигену, яка була індукована саме цим антигеном), проведено серію дослідів, загальна схема яких наведена на Фіг.9. На етапі А експериментальним тваринам першої групи вводили ЕППК (реципієнти ЕППК), щурам другої гр упи - розчин Хенкса (контрольні щури). Під нембуталовим наркозом проводили попарну алотрансплантацію 1/2 селезінки (див. протокол операції). Через 2 місяця при лапаротомії встановлено приживлення алоселезінки у тварин, яким вводили ЕППК, та відторгнення алотрансплантатів селезінки у щурів контрольної групи (Фіг.9, В, Фіг.10-11). У тих самих пар щурів на наступному етапі досліду одночасно проведено алотрансплантацію шкіри і другої половини селезінки (Фіг.9, С). Через 2 тижні встановлено приживлення другої половини алоселезінки у тварин першої групи та інтенсивну реакцію відторгнення алоселезінки у контрольних щурів (Фіг.14-15). Важливим є те, що відторгнення алотрансплантатів шкіри спостерігалося у всі х тварин обох гр уп (Фіг.9, D, Фіг.14-15), тобто результати експерименту свідча ть, що внутрішньовенне введення ЕППК викликає не імуносупресію, а формує стійку імунологічну толерантність до того алоантигену, який знаходився в організмі під час введення ЕППК. Відомо, що імунологічна толерантність до власних антигенів організму не є генетично детермінованою, а встановлюється в процесі онтогенезу за механізмами позитивної і негативної селекції Т-лімфоцитів у вилочковій залозі. Для індукції імунологічної толерантності необхідною умовою є не тільки наявність у тимоцитів певного ступеня спорідненості рецепторів до молекул головного комплексу гістосумісності, але й контакт Т-лімфоцитів, що дозрівають, з пептидним матеріалом власних тканин, експресованим на епітеліальних, дендрітних та інтердігітатних клітинах тімуса (Ройт Α., Бростофф Дж., Мейл Д. Иммунология./Пер. с англ. В.И.Кандрора, А.Н.Маца, Л.А.Певницкого, М.А.Серовой. - М.: Мир, 2000. - 592с). "Завантаження" тімуса власним антигенним матеріалом відбувається в процесі ембріогенезу, після чого утворюються структури гематотімічного бар'єру (Хлыстова З.С. Становление системы иммуногенеза плода человека/АМН СССР. - Μ.: Медицина, 1987. - 256с). У людини гематотімічний бар'єр утворюється ще внутрішньоутробно, у гризунів - через 5 днів після народження. Варто зазначити, що у щурів імунологічну толерантність можна індукувати шляхом введення чужерідного антигену впродовж перших 5-ти днів неонатального періоду (Вершигора А.Е. Общая иммунология. - К.: Ви ща школа, 1989. - 736с; Anderssen С, Stocker E., Klinz F.J. et al. Nestin-specific green fluorescent protein expression in embryonic stem cell-derived neural precursor cells used for transplantation//Stem Cells. - 2001. - Vol.19. - Р.419-424.). Отже, для реалізації початкових етапів механізму переінсталяції системи контролю антигенного гомеостазу дорослого організму потрібна інтеграція ЕППК не тільки з клітинами кісткового мозку, але й з клітинами тімуса, які розташовані забар'єрно. Іншою необхідною умовою є підвищення проникності гематотімічного бар'єру для алогенного пептидного матеріалу. Результати наших досліджень свідчать, що вже через 1 годину після внутрішньовенного і через 1,5 години після внутрішньочеревного введення ЕППК, мембрани яких були забарвлені РКН 67, мічені клітини виявляються серед клітин тімуса (Фіг.16-25). Окрім того, РКН 67 - позитивні клітини локалізувалися в лімфовузлах, селезінці і кістковому мозку. В останньому їх наявність доведена у подібних експериментах на інших видах тварин (Askenasy N., Zorina Т., Farkas D.L., Shalit I. Transplanted hemotopoietic cells seed in clusters in recipient bone marrow in vivo//Stem Cells. - 2002. - Vol.20. - P.301-310.). Варто зазначити, що РКН 67 є лінкорним барвником, який не змінює природних властивостей клітинної мембрани (Askenasy N., Farkas D.L. Antigen barriers or available space do not restrict in situ adhesion of hemopoietic cells to bone marrow stroma//Stem Cells. - 2002. - Vol.20. - P.301-310.). Важливість отриманого факту полягає в тому, що наявність ЕППК в тімусі вже через 1 годину після внутрішньовенного введення свідчить про їх здатність підвищувати проникність гематотімічного бар'єру. Надалі диференціювання ЕППК, як це було встановлено іншими авторами (Takatsugu Y., Masahide Y., Seiji Κ., Yoko К., Yoshiyuki N., Shigeaki I., Yukio Т. In vitro differentiation of embryonic stem cells into hepatocyte-like cells identified by cellular uptake of indocyanine green//Stem Cells. - 2002. - Vol.20. - P.146154.), визначається виключно їх мікрооточенням, у першу чергу, стромальним (Bianco P., Riminucci Μ., Gronthos S., Robey P.G. Bone marrow stromal stem cells: nature, biology and potential applications//Stem Cells. 2001. - Vol.19. - P.180-192.). У вилочковій залозі диференціювання ЕППК в епітеліальні, інтердігітатні і дендритні клітини на тлі алоантигенного завантаження тімуса призводить до експресії алоантигенів (в наших дослідах - шкіри і селезінки), які включаються до процесу негативної селекції Т-лімфоцитів. Водночас на утворених de novo клітинах тімуса експресуються молекули головного комплексу гістосумісності І і II класів, які генетично детерміновані в ЕППК. Складається ситуація, що подібна імунологічної толерантності тетраплоїдних гермафродитів до антигенів обох їх батьків - в організмі реципієнта ЕППК встановлюється подвійний стандарт гістосумісності. На різних експериментальних лініях тварин показано, що тетрапарентальні алофенні миши-хімери мають антигени гістосумісності обох батьківських ліній і не відторгають їх трансплантатів (Вершигора А.Е. Общая иммунология. - К.: Ви ща школа, 1989. - 736с). З іншого боку, в кістковому мозку ЕППК за дії стромального мікрооточення зазнають диференціації в гемопоетичні клітини-попередники, в тому числі і попередники лімфопоезу. За таких умов ключовим питанням переінсталяції системи контролю антигенного гомеостазу організму при введенні ЕППК є проблема конфлікту двох одночасно існуючих в організмі груп зрілих імунокомпетентних ефекторних клітин. Відсутність локальних і системних проявів імунного запалення при наявності короткочасного позитивного клінічного ефекту після введення малих доз гемопоетичних стовбурових клітин ембріональної печінки людини (Новицька А.В. Лікування хворих на цукровий діабет з імунними та гематологічними порушеннями гемопоетичними клітинами ембріональної печінки людини: Автореф. дис. ... канд. мед. наук/14.01.14 - ендокринологія. - Київ, 2000. - 20с.) вказує на те, що конфлікт між двома різними групами зрілих лімфоцитів може реалізуватись через апоптоз. Важливо, що кровотворні попередники завжди знаходяться у стані готовності до розвитку апоптозу і потребують для захисту від реалізації програми загибелі протекторної дії цитокінів. Саме тому в патології системи крові суттєву роль відіграє апоптоз, зокрема, з його підсиленням зв'язаний патогенез цілого ряду цитопеній та панцитопенії (Владимирская Е.Б. Механизмы апоптотической смерти клеток//Гематология и трансфузиология. - 2002. - Т.47, №2. - С .35-40.). За результатами наших досліджень, у препаратах тканин тімуса, кісткового мозку, селезінки і лімфовузлів після попарної алотрансплантації шкіри і селезінки у всіх тварин вивлялись клітини на різних стадіях загибелі за механізмом апоптозу (Фіг.26-32). Аналіз динаміки змін відносної кількості апоптотичних клітин в центральних і периферичних органах імунної системи щурів показав, що в тімусі тварин, які отримували ЕППК, інтенсивність апоптозу значно перевищувала контрольні показники на першу, третю, шосту і п'ятнадцяту доби спостереження (Фіг.ЗО) при наявності експоненціального тренду апроксимації отриманих результатів, тоді як динаміка апоптозу в тімусі контрольних щурів характеризувалася трендом логарифмічним (Фіг.33). Кількість апоптотичних клітин у кістковому мозку також різко зростала у тварин, які отримували ЕПГЖ, виявляючи при цьому лінійний тренд зростаючої динаміки, на відміну від контролю, де апроксимація динаміки змін кількості апоптотичних клітин виявляла експоненціальний тренд з вектором спрямованого зниження (Фіг.34). Водночас як у тімусі, так і в кітковому мозку зростала активність каспази-8 і каспази-3 (Фіг.26-41). Роль апоптозу в де термінації структури клітинних популяцій особливо важлива для клітин імунної системи. В основі селекції клонів тимоцитів лежить здатність їх мембранних рецепторів розпізнавати ліганди, які присутні на поверхні клітин строми тімуса. В юних клітинах фенотипу CD4+CD8+ у зв'язку зі слабкістю системи репарації накопичуються численні розриви ДНК, що призводить до реалізації програми загибелі, якщо вони не отримають сигналу від епітеліальних клітин строми, який викликає підсилення експресії захисного фактора Всl-2. Такий сигнал отримують тільки ті клони тимоцитів, які здатні розпізнавати автологічні молекули гістосумісності (позитивна селекція). Інші клітини отримають сигнал до апоптозу, коли роспізнають автологичні пептиди, що вбудовані в автологічні молекули гістосумісності (негативна селекція). У результаті структура першопочаткової популяції тимоцитів, які володіють величезною різноманітністю антигенрозпізнаючих рецепторів, у тому числі й потенційно небезпечних, корегується і зрілі Т-клітини реагирують лише на чужерідні пептиди, які презентуються разом з автологічними молекулами гістосумісності (Ройт Α., Бростофф Дж., Мейл Д. Иммунология./Пер. с англ. В.И.Кандрора, А.Н.Маца, Л.А.Певницкого, М.А.Серовой. - М.: Мир, 2000. - 592с). Таким чином, у разі інтеграції ЕППК в тімус і кістковий мозок та їх диференціювання у спеціалізовані клітини, тип яких визначається стромальним мікрооточенням, жоден із зазначених ви ще механізмів дозрівання Т-лімфоцитів в процесі індукції природної імунологічної толерантності не порушується, а включення до утворених de novo антигенпрезентуючих клітин вилочкової залози алоантигенів трансплантованих органів розширює спектр "власних" антигенів, що забезпечує специфічну ареактивність до алотрансплантатів. Для відповіді на запитання, чи дійсно відбувається заміна імунокомпетентних клітин на нові, чи має місце лише оновлення системи контролю антигенного гомеостазу організму внаслідок створення в тімусі подвійного МНС (НLА)-стандарту, потрібно було визначити як поводяться ЕППК з різними гаплотипами за умов існування в одній клітинній суспензії. Дослідження динаміки апоптозу виявило його різке збільшення при чотирнадцятигодинній інкубації змішаної суспензії ЕППК з різними гаплотипами (ЕППК, що були виділені з різних ембріонів), відносно показників, отриманих при ізольованій інкубації гомогенних суспензій ЕППК (Фіг.3541). Отриманий факт свідчить про те, що ЕППК мають системи для розпізнавання подібних клітин з іншим гаплотипом і здатні реалізувати програму клітинної загибелі, що є основою для заміни стовбурового пулу клітин кісткового мозку на новий за умов введення в організм мегадоз ЕППК. Результати біологічних експериментів підтверджують відкриття нового явища в біології і медицині, що полягає в індукції мегадозами ембріональних плюріпотентних прогеніторних клітин імунологічної толерантності шляхом створення нової бази імунокомпетентних клітин з одночасною інсталяцією de novo системи контролю головного комплексу гістосумісності (ефект Кухарчука-Радченка-Сірмана). Відповідність критерію "новизна" даного способу забезпечує те, що в біології і експериментальній медицині відкрито невідоме раніше явище, яке полягає в індукції мегадозами ембріональних плюріпотентних прогеніторних клітин імунологічної толерантності до алогенних трансплантатів (ефект Кухарчука-РадченкаСірмана). Відповідність критерію "суттєві відмінності" даного способу забезпечує те, що, на відміну від відомих раніше способів попередження реакції відторгнення трансплантату, імунологічна толерантність досягається шляхом створення нової бази імунокомпетентних клітин системи контролю антигенного гомеостазу організму. Відповідність даного винаходу критерію "позитивний ефект" забезпечує те, що розроблений спосіб дозволяє принципово змінити підходи до лікування хвороб людини і створити новий напрямок в терапії невиліковних на сьогоднішній день захворювань - біологічну інформаційно-інтегративну медицину.
ДивитисяДодаткова інформація
Назва патенту англійськоюKukharchuk-radchenko-sirman method for reinstallation of system controlling antigenic homeostasis of the body
Автори англійськоюKukharchuk Oleksandr Leonidovych
Назва патенту російськоюСпособ переинсталляции системы контроля антигенного гомеостаза организма млекопитающих по кухарчуку-радченко-сирману
Автори російськоюКухарчук Александр Леонидович
МПК / Мітки
МПК: C12N 5/06, A61K 35/54, A61K 38/18
Мітки: кухарчуком-радченком-сірманом, організму, гомеостазу, контролю, антигенного, спосіб, системі, ссавця, переінсталяції
Код посилання
<a href="https://ua.patents.su/14-72310-sposib-pereinstalyaci-sistemi-kontrolyu-antigennogo-gomeostazu-organizmu-ssavcya-za-kukharchukom-radchenkom-sirmanom.html" target="_blank" rel="follow" title="База патентів України">Спосіб переінсталяції системи контролю антигенного гомеостазу організму ссавця за кухарчуком-радченком-сірманом</a>
Попередній патент: Спосіб подрібнення зерна сталі, сплав для подрібнення зерна сталі і спосіб отримання сплаву для подрібнення зерна
Наступний патент: Мезилат 4-аміно-6,7-диметокси-2-(5-метансульфонамідо-1,2,3,4-тетрагідроізохінол-2-іл)-5-(2-піридил)хіназоліну та поліморфні форми
Випадковий патент: Клітка для навісного утримання дрібних тварин і птиці