Спосіб одержання протипухлинної вакцини
Номер патенту: 77647
Опубліковано: 25.02.2013
Автори: Черемшенко Надія Леонідівна, Лісовенко Галина Степанівна, Діденко Геннадій Васильович, Потебня Григорій Платонович, Симчич Тетяна Василівна, Чехун Василь Федорович, Кузьменко Олександр Петрович, Шпак Євгеній Григорович
Формула / Реферат
1. Спосіб одержання протипухлинної вакцини, що здійснюють шляхом обробки пухлинних клітин продуктами метаболізму штаму В. subtilis IMB В-7025 та інкубації суміші, який відрізняється тим, що як пухлинні антигени використовують курячі ембріональні білки.
2. Спосіб за п. 1, який відрізняється тим, що як продукти метаболізму використовують білоквмісні метаболіти культуральної рідини В. subtilis IMB В-7025 з молекулярною масою 18,5 та 70 кДа в дозі 0,3 мг/мл метаболіту на 0,3 мг/мл ембріонального білка курки.
Текст
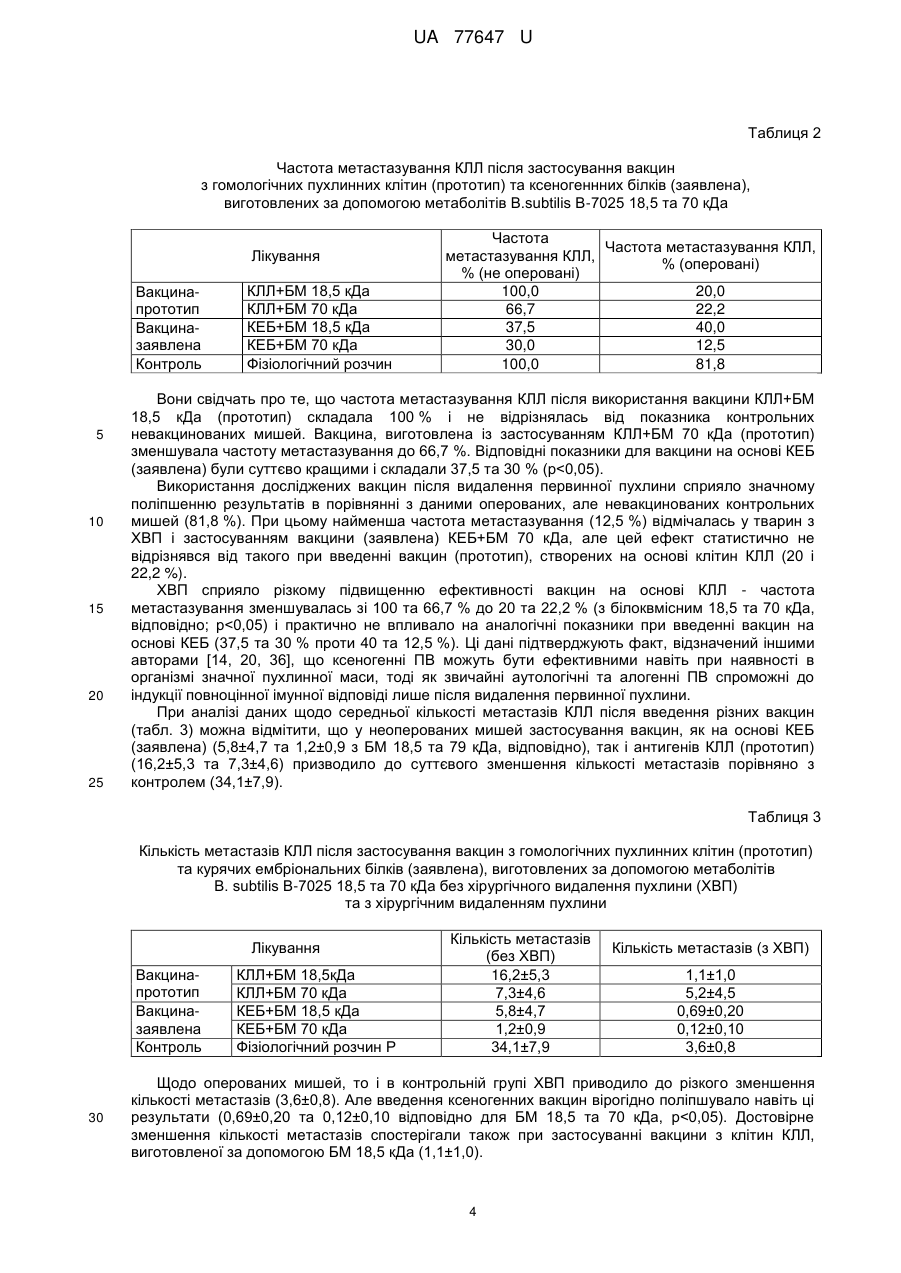
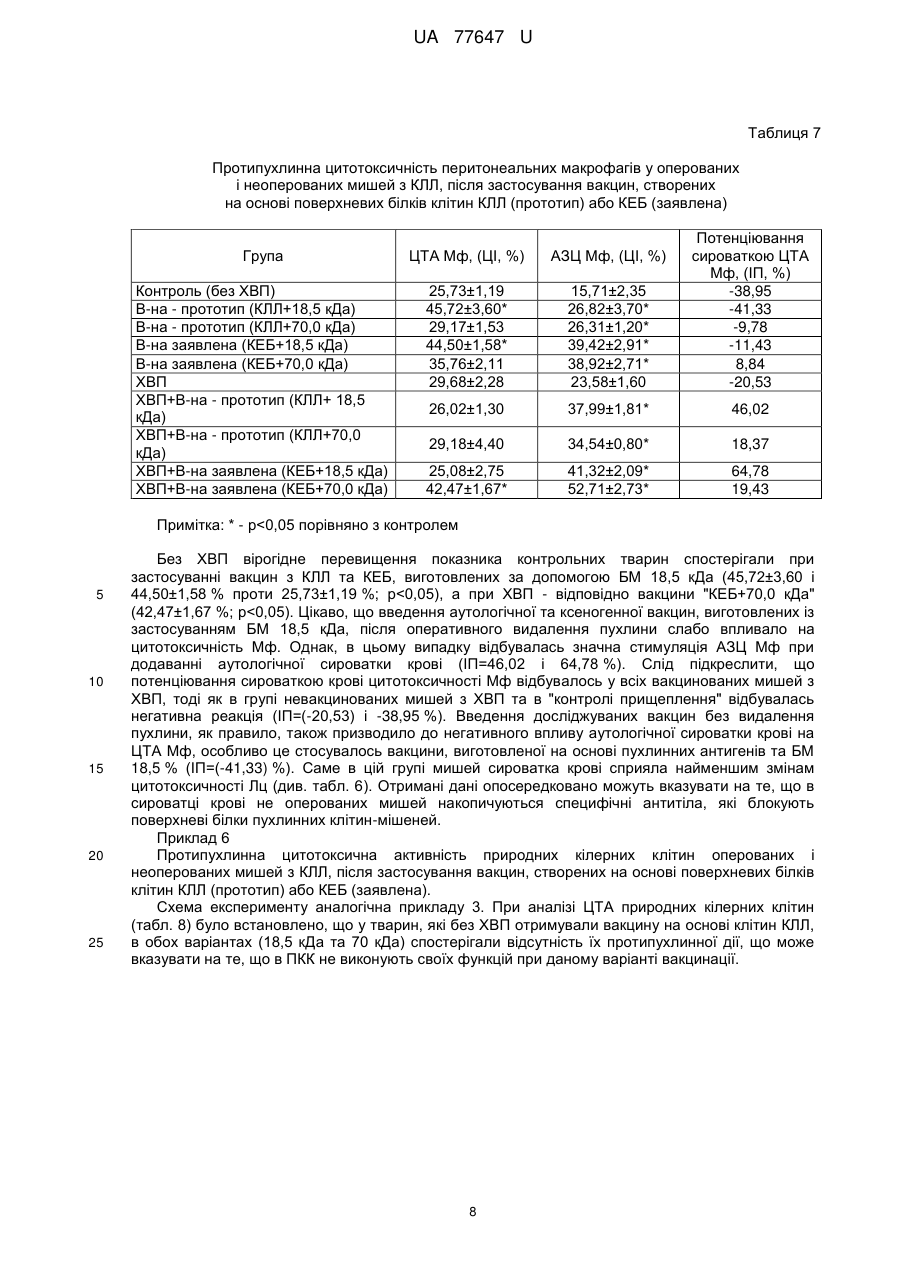
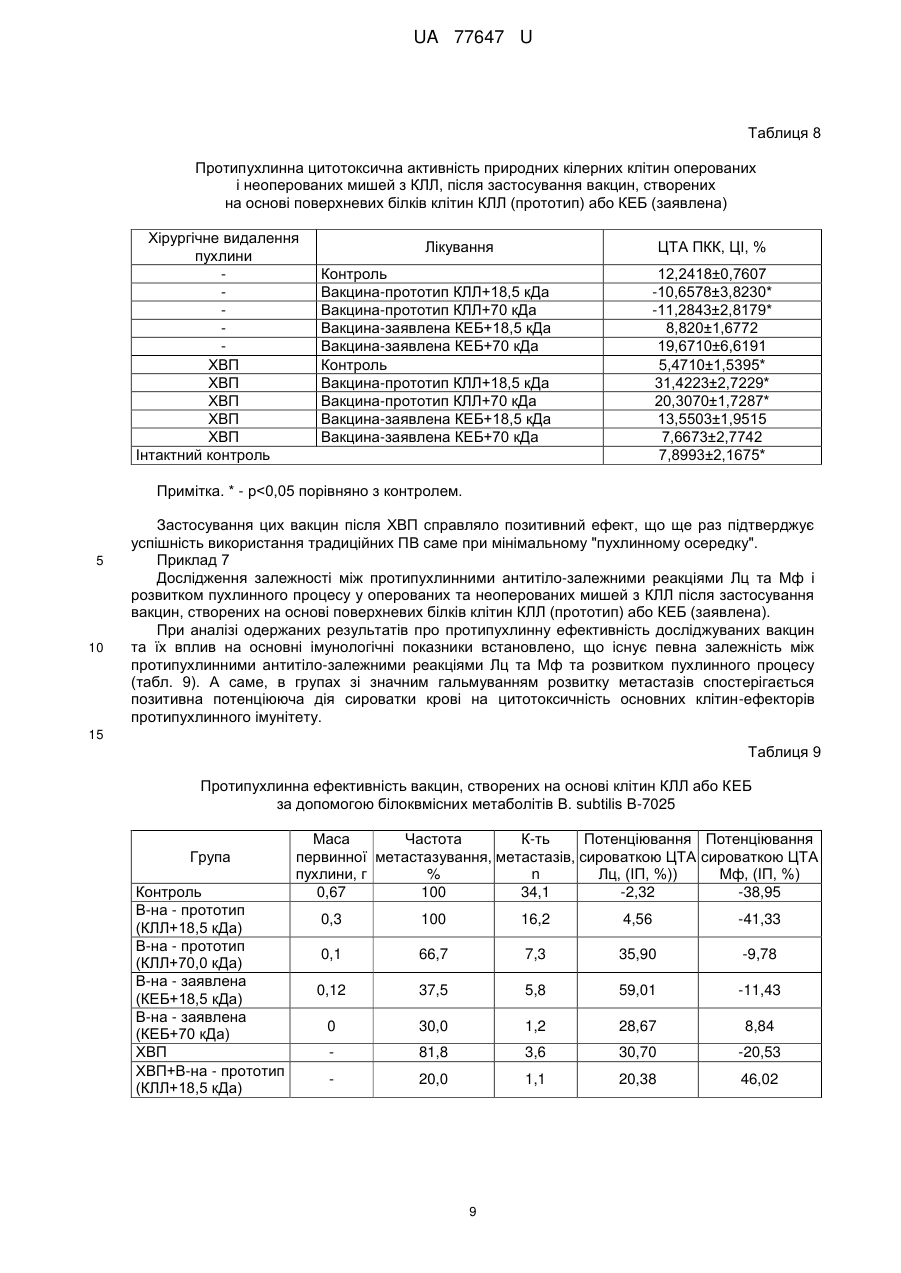
Реферат: Спосіб одержання протипухлинної вакцини шляхом обробки пухлинних клітин продуктами метаболізму штаму В. subtilis IMB В-7025 та інкубації суміші. Як пухлинні антигени використовують курячі ембріональні білки. UA 77647 U (12) UA 77647 U UA 77647 U 5 10 15 20 25 30 35 40 45 50 55 60 Корисна модель, що заявляється, належить до медицини, а саме до онкології, і стосується технології одержання протипухлинних засобів. Підвищення ефективності лікування хворих на злоякісні новоутворення - центральна проблема і мета експериментальної та клінічної онкології. Найбільш інтенсивно розробляються методи імунотерапії пухлин, які ґрунтуються на специфічній індукції протипухлинної резистентності організму шляхом імунізації протипухлинними вакцинами (ПВ), що містять пухлиноасоційовані антигени (ПАА). Розроблено цілий ряд ПВ, серед яких аутологічні та алогенні цільноклітинні (генетично модифіковані) вакцини, пептидні та ДНК вакцини, вакцини на основі дендритних клітин; метою їх застосування є індукція специфічної протипухлинної імунної відповіді [1-3]. Проблемою є те, що антигенний спектр та інтенсивність експресії того чи іншого антигену може відрізнятися у пацієнтів навіть з однаковими за походженням пухлинами. Крім того, пухлинні клітини здатні уникати імунної відповіді завдяки імунологічному редагуванню зменшенню чи відсутності експресії ПАА, проти яких спрямована імунна відповідь [3-5]. Спільною проблемою для усіх ПВ є те, що ПАА - це (за винятком вірусних антигенів) власні немутовані білки організму хворого, а тому - слабоімуногенні для його імунної системи [2, 4, 6]. Саме тому подолання імунологічної толерантності до ПАА є ключовою задачею імунотерапії пухлинної хвороби. Використання чужорідного аналога ПАА дозволяє досягнути цієї мети введення ксеногенних гомологічних протеїнів (організмів іншого виду) здатне подолати імунологічну толерантність і викликати імунну відповідь проти власних ендогенних протеїнів [610]. Більш того, за здатністю індукувати протипухлинну імунну відповідь, ксеногенні гомологи виявилися ефективнішими за сингенні білки [11-13]. Оскільки більшість ПАА чи білків-учасників канцерогенезу (фактори росту та ангіогенезу) представлена еволюційно консервативними молекулами, то наслідком цього є високий ступінь гомології між цими білками людини і тварин. З іншого боку, саме ці невеликі міжвидові структурні відмінності можна успішно використовувати при конструюванні ПВ. Вважають, що ксеновакцинотерапія має суттєві переваги перед використанням аутологічних або алогенних клітинних вакцин та пептидних пухлинних антигенів [6, 14, 15]. Ксеногенні ПАА здатні залучати в протипухлинний процес природній імунітет, а структурні відмінності ксеногенних ПАА від їх людських аналогів робить їх високо імуногенними та здатними індукувати специфічні протипухлинні реакції не тільки на ранніх, але й на пізніх стадіях захворювання, коли організм хворого знаходиться під імуносупресивним впливом пухлини і власної імунної системи. Тому, в порівнянні з гомологічними аналогами, ксеногенні ПАА можуть стати більш ефективними як для профілактики розвитку рецидивів та метастазів, так і генерації процесів, що призводять до руйнування вже розвинутої пухлини. Для конструювання ксеногенних ПВ використовують ті ж самі методичні підходи, що й для створення аутологічних ПВ: введення девіталізованих пухлинних клітин або їх фрагментів [1416], чи рекомбінантного протеїну [17], використання ДНК-послідовностей [6, 18, 19], навантаження антигеном дендритних клітин [20, 21] тощо. Результати розробки протипухлинної ксеновакцини на моделі мишачої меланоми В-16 представлені в роботі Москалевої Е.Ю. з співавт. [22]. Після ксеновакцинації мишей клітинами меланоми людини (лінія SK-MEL-1), цитотоксична активність спленоцитів імунізованих мишей відносно клітин-мішеней меланоми В-16 сягала максимального рівня вже через тиждень після імунізації та зберігалась протягом наступних 8 тижнів. Показано, що ксеновакцинація сприяла значному протипухлинному ефекту: вірогідному гальмуванню росту сингенної меланоми В-16 [23], при цьому практично не впливала на основні гематологічні показники. Hawkins WG et al. [24] показали, що імунізація мишей ДНК, яка кодує людський gp100, призводить до формування стійкого антимеланомного імунітету, тоді як введення ДНК, що кодує гомологічний мишачий gp100, було неефективним. При оцінці ефективності проведення ксеновакцинотерапії встановлено, що вакцинація мишей ДНК, яка кодує людський TRP-2, після видалення первинної пухлини попереджує розвиток місцевих рецидивів, а також метастазування меланоми у легені [19]. Імунізація мишей ДНК-послідовністю, що кодує ген матриксної металопротеїнази 2 (ММР-2), курчати, індукувала появу антитіл, специфічних до ММР-2. При цьому ріст модельних пухлин (карцинома легені Льюїс, фібросаркома Meth А, гепатома Н22) був загальмований як при профілактичній, так і терапевтичній схемах вакцинації [25]. Застосування алогенної вакцини на основі ДНК ММР-2 миші було не ефективним. Завдяки використанню ксеногенного білка Luo Y., et al. [11] вдалося подолати імунологічну толерантність до одного з ключових ферментів ангіогенезу - тирозинкінази Тіе-2. Вакцина на 1 UA 77647 U 5 10 15 20 25 30 35 40 45 50 55 60 основі Тіе-2 курки гальмувала ріст гепатоми Н22 та ріст й інтенсивність метастазування меланоми В-16 у мишей, імунізованих як за профілактичною, так і за терапевтичною схемами. В сироватці крові мишей, імунізованих Тіе-2 курки, були виявлені антитіла, що реагували з Тіе-2 миші. Знову ж таки, застосування алогенного білка виявилось неефективним. Таким чином, перші позитивні результати використання ксеногенних ПВ вдалось отримати як в експериментальних, так і клінічних дослідженнях [26, 27]. Отже, продовження роботи у напрямку удосконалення ксеногенних ПВ виглядає дуже перспективним. Одним з підходів може бути заміна в їх складі пухлинних антигенів на більш універсальні - ембріональні. Вважають, що пухлинні та ембріональні клітини подібні між собою за рахунок експресії цілого ряду білків - онкофетальних антигенів, ростових факторів, факторів ангіогенезу та ін. [28]. Тому, використання антигенної подібності пухлинних та ембріональних клітин може бути перспективним направленням розробки ефективних підходів в імунотерапії онкохворих. Раніше було показано, що вакцини, виготовлені при використанні ембріональної тканини людини і глікопротеїдів В. subtilis B-7025, проявляли протипухлинну активність відносно саркоми 37 у мишей [29]. За даними літератури відомо, що ембріональні клітини курки експресують білки, гомологічні до пухлинних антигенів людини та миші [11, 30, 31]. Раніше нами було показано [32], що сироватки крові мишей-пухлиноносіїв перехресно реагують з ембріональними протеїнами курки. Було припущено, що застосування ембріональних білків курки у ксеногенній системі буде здатне подолати імунологічну толерантність до антигенів пухлини, що виражатиметься у протипухлинній активності. Найбільш близьким способом одержання ПВ до способу, що заявляється, є спосіб приготування вакцини шляхом обробки пухлинних клітин продуктами метаболізму штаму В.subtilis IMBB-7025 з молекулярною масою 18,5 та 70 кДа, в дозі 0,3 мг/мл препарату на 6 30,010 пухлинних клітин в 1 мл вакцини [Діденко Г.В. Розробка протипухлинних аутовакцин на основі білоквмісних метаболітів В. subtilis B-7025 та їх вплив на окремі реакції протипухлинного імунітету (експериментальне дослідження): Автореф. дис. канд. біол. наук: 14.01.07 / НАНУ; Ін-т експериментальної патології, онкології і радіобіології ім. Р.Є. Кавецького. - К., 2008.-19 с.]. Одержану суміш струшують на шейкері 15 хв. та інкубують в термостаті при 38 °C протягом 1 години. Після закінчення інкубації вакцину перевіряють на стерильність та життєздатність пухлинних клітин і зберігають при -20 °C. Однак, одержані таким чином ПВ не забезпечують високу профілактичну і терапевтичну ефективність в зв'язку з імунологічною толерантністю до антигенів пухлини (ПАА). Використання чужорідного аналога ПАА дозволяє досягнути цієї мети - введення ксеногенних гомологічних протеїнів здатне викликати достатню імунну відповідь проти власних ендогенних протеїнів [7, 8]. Суть корисної моделі, що заявляється. В основу способу одержання ПВ, що заявляється, поставлено задачу одержати ПВ, здатну подолати імунологічну толерантність до власних білків організму. Поставлена задача вирішується тим, що в способі одержання ПВ використовують ксеногенні ембріональні білки курки. Білки з клітин 7-добового курячого ембріона одержували методом ЕДТА-екстракції [33]. До 1 г ембріональної тканини, гомогенізованої в гомогенізаторі Поттера, додають 10 мл 0,1 % розчину етилендіамінтетраоцтової кислоти (ЕДТА). Суміш струшують протягом 60 хв. В подальшому суспензію центрифугують протягом 15 хв. при 8000 об./хв. Осад видаляють, а в надосадовій рідині визначають концентрацію білка та оцінюють білковий склад в SDS-електрофорезі [34]. Білкові екстракти зберігають при t -20 °C. Спосіб одержання протипухлинної вакцини, що заявляється, здійснюють таким чином. У стерильний флакон вносять 1 мл курячих ембріональних білків (КЕБ) в концентрації 0,3 мг/мл по білку та додають 1 мл білоквмісного метаболіту B.subtilis B-7025 18,5 або 70 кДа у концентрації 0,3 мг/мл по білку. Після цього одержану суміш струшують на шейкері 15 хв. та проводять інкубацію в термостаті при 38 °C протягом 1 години. Після закінчення інкубації вакцину перевіряють на стерильність та зберігають при t -20 °C. Ефективність та механізми дії ПВ досліджували на експериментальних тваринах - мишах лінії С57В1/6, віком 2 місяці, масою 18-20 г розведення експериментальної бази ІЕПОР ім. Р.Є. Кавецького НАН України. При цьому застосовували терапевтичну модель використання ПВ, тобто вакцинацію тварин проводили після прищеплення пухлин або після хірургічного видалення первинної пухлини. Досліджували протипухлинну активність вакцин, створених на основі курячих ембріональних білків (КЕБ) 7 доби гестації та білоквмісних метаболітів (БМ) B.subtilis B-7025 з молекулярною масою 18,5 та 70 кДа як ад'ювантів - (вакцина-заявлена). Їх ефективність порівнювали з такою у традиційних ПВ, виготовлених за допомогою даних ад'ювантів на основі клітин гомологічної 2 UA 77647 U 5 10 15 20 25 пухлини (вакцина-прототип). Як модельну пухлину використовували метастазуючу карциному легені Льюїс (КЛЛ) [35]. Вакцини застосовували як самостійно, так і в комбінації з хірургічним видаленням пухлини (ХВП). Було проведено порівняльне вивчення впливу ПВ на перебіг пухлинного процесу та основні реакції протипухлинного захисту. Зокрема, досліджували ефективність цитотоксичних Тлімфоцитів (ЦТЛ), макрофагів (Мф) та природних кілерів (ПКК). Для характеристики перебігу пухлинного процесу визначали частоту прищеплюваності та гальмування росту пухлин, середню тривалість життя мишей, розміри (об'єми) первинної пухлини та кількість і розміри метастазів. Розраховували індекси гальмування росту пухлин (ІГ) та індекси інгібування метастазування (ІІМ) в порівнянні з відповідним контролем. Приклади практичного застосування корисної моделі. Приклад 1 Протипухлинна активність вакцин на основі гомологічних пухлинних клітин (прототип) та ксеногенних білків (заявлена), виготовлених за допомогою метаболітів В. subtilis B-7025 18,5 та 70 кДа. 6 Пухлинні клітини (КЛЛ) перещеплювали в стопу тварин із розрахунку 10 клітин/тварину по стандартній методиці. Вакцини починали вводити на 15 добу після перещеплення, коли первинна пухлина добре візуалізовувалась, повторні введення проводили на 17 і 21 добу. Вакцини, виготовлені на основі КЕБ (заявлена), вводили підшкірно (концентрація по білку 0,3 мг/мл, по 0,3 мл/тварину на 1 ін'єкцію). Вакцини на основі клітин КЛЛ (прототип) готували із 6 розрахунку 30,010 клітин на 0,3 мг/мл розчину відповідного метаболіту В.subtilis B-7025 і вводили підшкірно по 0,3 мл/тварину. Протипухлинний ефект досліджуваних вакцин оцінювали на 36 добу після перещеплення пухлини за індексом гальмування маси первинної пухлини (ІГП). В табл. 1 представлені дані про вплив застосованих вакцин на масу первинної пухлини КЛЛ. Таблиця 1 Маса первинної пухлини та індекс гальмування росту КЛЛ при застосуванні ПВ (прототип) з гомологічних пухлинних клітин і ксеногенних білків (ПВ-заявлена), виготовлених за допомогою метаболітів В. subtilis B-7025 18,5 та 70 кДа Лікування Вакцинапрототип Вакциназаявлена Контроль 30 35 40 КЛЛ+БМ 18,5 кДа КЛЛ+БМ 70 кДа КЕБ+БМ 18,5 кДа КЕБ+БМ 70 кДа Фізіологічний розчин Маса первинної пухлини, г 0,3 0,1 0,12 0 0,67 Індекс гальмування росту пухлини, % 55,2 85,1 82,1 100,0 Використання всіх досліджуваних вакцин супроводжувався вірогідним гальмуванням пухлинного росту в порівнянні з контрольними мишами (р
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod for producing antitumor vaccine
Автори англійськоюPotebnia Hryhorii Platonovych, Didenko Hennadii Vasyliovych, Kuzmenko Oleksandr Petrovych, Shpak Yevhenii Hryhorovych, Lisovenko Halyna Stepanivna, Charemshenko Nadia Leonidivna, Symchych Tetiana Vasylivna, Chekhun Vasyl Fedorovych
Назва патенту російськоюСпособ получения противоопухолевой вакцины
Автори російськоюПотебня Григорий Платонович, Диденко Геннадий Васильевич, Кузьменко Александр Петрович, Шпак Евгений Григорьевич, Лисовенко Галина Степановна, Черемшенко Надежда Леонидовна, Симчич Татьяна Васильевна, Чехун Василий Федорович
МПК / Мітки
МПК: A61K 35/66, A61K 35/12, A61K 35/74
Мітки: вакцини, спосіб, одержання, протипухлинної
Код посилання
<a href="https://ua.patents.su/14-77647-sposib-oderzhannya-protipukhlinno-vakcini.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання протипухлинної вакцини</a>
Попередній патент: Спосіб одержання харчового концентрату поліфенолів винограду
Наступний патент: Будівельна суміш
Випадковий патент: Пристрій для вимивання фотополімерних флексографічних друкарських форм