Піперазинбензотіазоли як засоби для лікування ішемічних розладів головного мозку або розладів цнс
Номер патенту: 78035
Опубліковано: 15.02.2007
Автори: Готтлан Жан-П'єр, Гейяр Паскаль, Віт П'єр-Ален
Формула / Реферат
1. Похідне піперазинбензотіазолу формули І
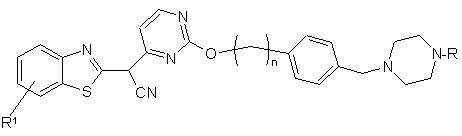 , (І)
, (І)
а також його таутомери, його геометричні ізомери, його оптично активні форми, наприклад, енантіомери, діастереомери, та його рацемічні форми, а також фармацевтично прийнятні солі згаданої сполуки, де
R вибраний з групи, яку складають або до якої входять водень, C1-C6-алкіл, C1-C6-алкіларил, гетероарил, C1-C6-алкілгетероарил, С2-С6-алкеніл, С2-С6-алкеніларил, С2-С6-алкенілгетероарил, С2-С6-алкініл, С2-С6-алкініларил, С2-С6-алкінілгетероарил, С3-С8-циклоалкіл, гетероциклоалкіл, C1-C6-алкілциклоалкіл, C1-C6-алкілгетероциклоалкіл, C1-C6-алкілкарбоксил, ацил, C1-C6-алкілацил, ацилоксигрупа, C1-C6-алкілацилоксигрупа, C1-C6-алкілалкоксигрупа, алкоксикарбоніл, C1-C6-алкілалкоксикарбоніл, амінокарбоніл, C1-C6-алкіламінокарбоніл, ациламіногрупа, C1-C6-алкілациламіногрупа, уреїдогрупа, C1-C6-алкілуреїдогрупа, аміногрупа, C1-C6-алкіламіногрупа, сульфонілоксигрупа, C1-C6-алкілсульфонілоксигрупа, сульфоніл, C1-C6-алкілсульфоніл, сульфініл, C1-C6-алкілсульфініл, сульфаніл, C1-C6-алкілсульфаніл, сульфоніламіногрупа, C1-C6-алкілсульфоніламіногрупа;
R1 вибраний з групи, яку складають або до якої входять Н, галоген, ціано-, нітро-, аміногрупа, C1-C6-алкіл, С2-С6-алкеніл, С2-С6-алкініл, C1-C6-алкіларил, арил або гетероарил, C1-C6-алкілгетероарил, -C(О)-OR2, -C(О)-R2, -C(О)-NR2R2', -(SО2)R2, де
R2 та R2' незалежно один від одного вибрані з групи, яку складають або до якої входять водень, C1-C6-алкіл, С2-С6-алкеніл, С2-С6-алкініл, арил, гетероарил, C1-C6-алкіларил, C1-C6-алкілгетероарил;
n є ціле число від 0 до 3.
2. Похідне піперазинбензотіазолу за п. 1, де R1 є водень.
3. Похідне піперазинбензотіазолу за п. 1 або п. 2, де R вибраний з групи, яку складають водень, С1-С3-алкіл, амінокарбоніл, C1-C6-алкілалкоксикарбоніл, C1-C6-алкілалкоксигрупа, C1-C6-алкілацилоксигрупа, алкоксикарбоніл, C1-C6-алкіламінокарбоніл.
4. Похідне піперазинбензотіазолу за п. 3, де R є Н або С1-С3-алкіл, зокрема, метил або етил, або C1-C6-алкілалкоксигрупа.
5. Похідне піперазинбензотіазолу за будь-яким із попередніх пунктів, де n=1.
6. Похідне піперазинбензотіазолу за будь-яким із попередніх пунктів, вибране з групи, до якої входять такі сполуки:
1,3-бензотіазол-2-іл[2-({4-[(4-метилпіперазин-1-іл)метил]бензил}окси)піримідин-4-іл]етонітрил,
1,3-бензотіазол-2-іл[2-({4-[(4-бензилпіперазин-1-іл)метил]бензил}окси)піримідин-4-іл]ацетонітрил,
1,3-бензотіазол-2-іл(2-{[4-(піперазин-1-ілметил)бензил]окси}піримідин-4-іл)ацетонітрил,
1,3-бензотіазол-2-іл[2-({4-[(4-формілпіперазин-1-іл)метил]бензил}окси)піримідин-4-іл]ацетонітрил,
[2-({4-[(4-ацетилпіперазин-1-іл)метил]бензил}окси)піримідин-4-іл]-(1,3-бензотіазол-2-іл)ацетонітрил,
(3Н-бензотіазол-2-іліден)-{2-[4-(4-[1,2,4]оксадіазол-3-ілметилпіперазин-1-ілметил)бензилокси]піримідин-4-іл}ацетонітрил,
метиловий складний ефір 4-(4-{4-[(3Н-бензотіазол-2-іліден)ціанометил]піримідин-2-ілоксиметил}бензил)піперазин-1-карбонової кислоти,
2-[4-(4-{4-[(3Н-бензотіазол-2-іліден)ціанометил]піримідин-2-ілоксиметил}бензил)піперазин-1-іл]ацетамід,
(2-{4-[4-(2-аміноацетил)піперазин-1-ілметил]бензилокси}піримідин-4-іл)-(3Н-бензотіазол-2-іліден)ацетонітрил,
метиловий складний ефір [4-(4-{4-[(3Н-бензотіазол-2-іліден)ціанометил]піримідин-2-ілоксиметил}бензил)піперазин-1-іл]оцтової кислоти,
(3Н-бензотіазол-2-іліден)-(2-{4-[4-(2-метоксіетил)піперазин-1-ілметил]бензилокси}піримідин-4-іл)ацетонітрил,
диметиламід 4-(4-{4-[(3Н-бензотіазол-2-іліден)ціанометил]піримідин-2-ілоксиметил}бензил)піперазин-1-карбонової кислоти,
(3Н-бензотіазол-2-іліден)-{2-[4-(4-етилпіперазин-1-ілметил)бензилокси]піримідин-4-іл}ацетонітрил,
(3Н-бензотіазол-2-іліден)-(2-{4-[4-(2-гідроксіетил)піперазин-1-ілметил]бензилокси}піримідин-4-іл)ацетонітрил.
7. Похідне піперазинбензотіазолу за будь-яким із попередніх пунктів для застосування як лікарський засіб.
8. Застосування похідного піперазинбензотіазолу за будь-яким із пп. 1-7 для виготовлення лікарського засобу для лікування церебральних ішемічних розладів або розладів ЦНС.
9. Спосіб одержання похідного піперазинбензотіазолу за будь-яким із пп. 1-7, який включає таку стадію:
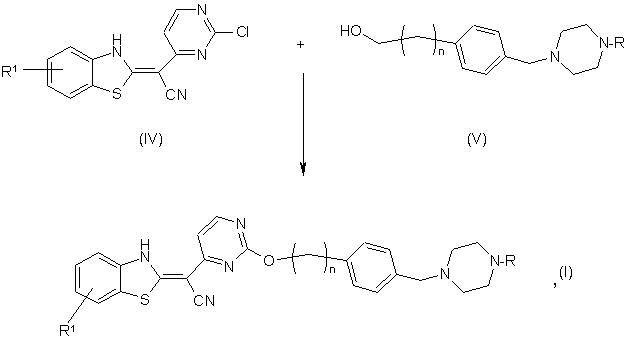
де R, R1 та n відповідають поданим вище визначенням.
Текст
1. Похідне піперазинбензотіазолу формули І C2 2 (19) 1 3 78035 4 2-[4-(4-{4-[(3Н-бензотіазол-27. Похідне піперазинбензотіазолу за будь-яким із іліден)ціанометил]піримідин-2попередніх пунктів для застосування як лікарський ілоксиметил}бензил)піперазин-1-іл]ацетамід, засіб. (2-{4-[4-(2-аміноацетил)піперазин-18. Застосування похідного піперазинбензотіазолу ілметил]бензилокси}піримідин-4-іл)-(3Нза будь-яким із пп.1-7 для виготовлення лікарськобензотіазол-2-іліден)ацетонітрил, го засобу для лікування церебральних ішемічних метиловий складний ефір [4-(4-{4-[(3Нрозладів або розладів ЦНС. бензотіазол-2-іліден)ціанометил]піримідин-29. Спосіб одержання похідного піперазинбензотіаілоксиметил}бензил)піперазин-1-іл]оцтової кисзолу за будь-яким із пп.1-7, який включає таку сталоти, дію: N (3Н-бензотіазол-2-іліден)-(2-{4-[4-(2HO Cl H N-R + метоксіетил)піперазин-1n N N N R ілметил]бензилокси}піримідин-4-іл)ацетонітрил, S CN диметиламід 4-(4-{4-[(3Н-бензотіазол-2іліден)ціанометил]піримідин-2( IV) (V) ілоксиметил}бензил)піперазин-1-карбонової кислоти, N (3Н-бензотіазол-2-іліден)-{2-[4-(4-етилпіперазин-1H ілметил)бензилокси]піримідин-4-іл}ацетонітрил, N O N-R N n N , (I) (3Н-бензотіазол-2-іліден)-(2-{4-[4-(2S CN гідроксіетил)піперазин-1R ілметил]бензилокси}піримідин-4-іл)ацетонітрил. де R, R1 та n відповідають поданим вище визначенням. 1 1 Цей винахід стосується похідних піперазинбензотіазолу, особливо похідних, призначених для застосування при лікуванні та/або профілактиці церебральних ішемічних розладів або розладів центральної нервової системи (ЦНС). Крім того, цей винахід стосується способів одержання вищезгаданих сполук. Клітини організму ссавців реагують на деякі позаклітинні подразники активуванням сигнальних каскадів, які опосередковуються різноманітними протеїнкіназами, що активуються мітогенами (МАРК). Незважаючи на відмінності в реакціях на подразники, що діють на попередніх стадіях шляху передачі сигналів, каскади МАР-кіназ організовані аналогічно один одному і включають кінази кіназ МАР-кіназ (МАРККК або МЕКК), кінази МАР-кіназ (МАРКК або МКК) та МАР-кінази (МАРК). МАРкінази являють собою широку груп у кіназ, до якої належать c-Jun N-кінцеві кінази (JNK), відомі також як "протеїнкінази, що активуються стресом" (SAPK), а також кінази, що регулюються позаклітинними сигналами (ERK), та р38 МАР-кінази. Кожна з цих трьох підгруп МАР-кіназ бере участь щонайменше у трьох різних, але паралельних шляха х передачі інформації, які активуються позаклітинними подразниками. Сигнальний шлях JNK активується при впливі на клітини чинників навколишнього середовища (наприклад, хімічних токсинів, радіації, гіпоксії та осмотичного шоку), а також при дії на клітини факторами росту або запальними цитокінами, наприклад, α-фактором некрозу пухлин (TNF-α) або β-інтерлейкіном-1 (IL-1β). Дві кінази МАР-кіназ (відомі як МКК або МАРКК), а саме МКК4 (відома також як JNKK1) та МКК7, активують JNK шля хом подвійного фосфорилування специфічних залишків треоніну та тирозину, розташованих у межах послідовності Thr-ProTyr у контурі активації ферменту, під впливом цитокінів та сигналів стресу. Відомо, що на ще вищих стадіях сигнального каскаду МКК4 активується також під впливом кінази кінази МАР-кінази МЕКК1 шляхом фосфорилування у залишках серину та треоніну. Будучи активованою, JNK зв'язується з Nкінцевою ділянкою мішеней транскрипційного фактора та фосфорилує домени транскрипційної активації, що призводить до підвищеної експресії різних генних продуктів, які можуть викликати апоптоз, запальні реакції або онкогенні процеси [1]. До деяких транскрипційних факторів, відомих як субстрати JNK, належать Jun-протеїни (c-Jun, JunB та JunD), аналогічні транскрипційні фактори ATF2 та ATFα, Ets-транскрипційні фактори, наприклад, Elk-1 та Sap-1, пригнічувач пухлин р53 та протеїн домену смерті клітин (DENN). Три різних ферменти JNK ідентифіковано як продукти генів JNK1, JNK2 та JNK3; ідентифіковано десять різних ізоформ JNK(2). JNK1 та JNK2 повсюдно експресуються в тканинах організму людини, в той час як JNK3 селективно експресується у мозку, серці та тестикула х [2]. Кожна ізоформа зв'язується із субстратами з різними значеннями спорідненості, що вказує на специфічне залежне від субстратів регулювання шляхів передачі сигналів in vivo різними ізоформами JNK. Активацію провідного шляху JNK виявлено при численних хворобливих процесах, що вказує на доцільність розглядання цього шляху як мішені при створенні лікарських засобів. Крім того, молекулярно-генетичні підходи підтверджують патогенну роль цього шляху при різних захворюваннях. Наприклад, автоімунні та запальні захворювання виникають внаслідок неадекватної активації імунної системи. Активовані імунні клітини експресують численні гени, які кодують молекули чинників запалення, в тому числі цитокіни, фактори росту, поверхневі клітинні рецептори, молекули адгезії клітин та ферменти розкладу. Відомо, що багато таких генів регулюються провідним шляхом JNK через посередництво активації транскрипцій 5 78035 6 них факторів c-Jun та ATF-2. наприклад, героїну та інших психотропних засобів, Інгібування активації JNK у макрофагах, стиводорозчинні матеріали, наприклад, глюкоза, промульованих бактеріальними ліпополісахаридами теши та амінокислоти, не проходять через ВВВ. ефективно модулює продукування основного заІснують опосередковані транспортні механізми, які пального цитокіну TNFα [3]. Інгібування активації забезпечують проходження глюкози та незамінних JNK послаблює активацію транскрипційного факамінокислот через ВВВ. Активні транспортні мехатора, який спричиняє індуковану експресію матринізми забезпечують видалення з мозку молекул, чних металопротеаз (ММР) [4], які, як відомо, віднаявних у надлишковій кількості, наприклад, калію. повідають за посилення ерозії хрящових та Загальний огляд проблеми подано [в роботах Гокісткових тканин при ревматоїдному артриті та за льдштейна та Бетца (Goldstein and Betz, 1986) та генералізоване руйнування тканин при інших автоБетца та ін. (1994)], включених до цього опису в імунних захворюваннях. повному обсязі шляхом посилання [14; 15]. Каскад JNK активується також у Т-клітинах під Цей винахід стосується похідних піперазинбевпливом антигенної стимуляції та сумісної стимунзотіазолу, особливо похідних, призначених для ляції рецептора CD28 [5] і регулює продук ування застосування при лікуванні та/або профілактиці промотора IL-2 [6]. Неадекватна активація Тцеребральних ішемічних розладів або розладів лімфоцитів ініціює та підтримує численні автоімуЦНС. Крім того, цей винахід стосується способів нні захворювання, в тому числі астму, синдром одержання вищезгаданих сполук. подразненої кишки та розсіяний склероз. Протеїн JNK3 сильно експресується у схиль(l) них до пошкодження нейронах при хворобі Альцгеймера, та в нейронах СА1 у пацієнтів, що страждають на гостру гіпоксію [7]. З'ясовано, що ген Нижче подано визначення термінів, що ознаJNK3 експресується у пошкоджених ділянках мозчають різноманітні хімічні фрагменти та групи, з ку хворих на хворобу Альцгеймера [8]. Крім того, яких складаються сполуки за цим винаходом; ці з'ясовано, що нейрони мишей лінії JNK3 KО статерміни призначені для однозначного застосуванють більш резистентними до нейронного апоптозу, ня в тексті опису та у пунктах формули винаходу, індукованого каїновою кислотою, у порівнянні з якщо інше подане в явному вигляді визначення не, нейронами мишей дикого типу. передбачає більш широкого значення. На основі цієї інформації вважається, що сигТермін "С1-С6-алкіл" означає одновалентну нальний шлях JNK, особливо шлях JNK2 та JNK3, алкільну гр упу, що містить від 1 атому до 6 атомів відіграє певну роль у нейродегенеративних захвовуглецю. Прикладами значень цього терміну є такі рюваннях, що регулюються апоптозом, наприклад, групи, як метил, етил, w-пропіл, ізопропіл, н-бутил, у хворобі Альцгеймера, хворобі Паркінсона, епілеізобутил, трет-бутш, н-гексил тощо. псії та епілептичних нападах, хореї Гантінгтона, Термін "арил" означає ненасичену ароматичну розладах ЦНС, травматичних пошкодженнях мозкарбоциклічну групу, що містить від 6 атомів до 14 ку, а також в ішемічних розладах та геморагічних атомів вуглецю і включає один цикл (наприклад, нападах. феніл) або кілька конденсованих циклів (наприЯк модулятори провідного шляху JNK запроклад, нафтил). До арилів, яким віддається перевапоновано кілька типів низькомолекулярних сполук га, належать феніл, нафтил, фенантрил тощо. [дивись WO 00/35909; WO 00/35906; WO 00/3592; Термін "С1-С6-алкіларил" означає С1-С6-алкіл, WO 00/64872; WO 01/12609; WO 00/75118; WO які має арильний замісник, в тому числі бензил, 01/12621]. фенетил тощо. [У WO 01/47920] описано як інгібітори JNK поТермін "гетероарил" означає моноциклічну гехідні бензотіазолу формули (А). тероароматичну гр упу або біциклічну чи трициклічну гетероароматичну гр упу, що містить конденсовані цикли. До конкретних прикладів (A) гетероароматичних гр уп належать факультативно заміщені піридил, піроліл, фурил, тієніл, імідазоЗагальною проблемою при лікуванні розладів ліл, оксазоліл, ізоксазоліл, тіазоліл, ізотіазоліл, ЦНС, наприклад, церебральних розладів, є транспіразоліл, 1,2,3-триазоліл, 1,2,4-триазоліл, 1,2,3портування терапевтичних сполук у центральну оксадіазоліл, 1,2,4-оксадіазоліл, 1,2,5нервову систему, тобто у мозок. Добре відомо, що оксадіазоліл, 1,3,4-оксадіазоліл, 1,3,4-триазиніл, транспорту лікарських засобів у ЦНС заважає ге1,2,3-триазиніл, бензофурил, [2,3матоенцефалічний бар'єр (ВВВ). дигідро]бензофурил, ізобензофурил, бензотієніл, Гематоенцефалічний бар'єр (ВВВ) є бар'єр, бензотриазоліл, ізобензотієніл, індоліл, ізоіндоліл, що складається зі стінок капілярів та оточуючих 3Н-індоліл, бензимідазоліл, імідазо[1,2-а]піридил, нейроглій, який обмежує рух речовин між кров'ю та бензотіазоліл, бензоксазоліл, хінолізиніл, хіназолімозковою тканиною. ніл, фталазиніл, хіноксалініл, цинолініл, нафтириГематоенцефалічний бар'єр (ВВВ) підтримує диніл, піридо[3,4-b]піридил, піридо[3,2-b]піридил, гомеостатичне середовище у центральній нервопіридо[4,3-b]піридил, хіноліл, ізохіноліл, тетразовій системі (ЦНС). Капіляри, по яких кров надхоліл, 5,6,7,8-тетрагідрохіноліл, 5,6,7,8дить у мозок, мають щільні з'єднання, які блокують тетрагідроізохіноліл, пуриніл, птеридиніл, карбапроходження більшості молекул через мембрани золіл, ксантеніл та бензохіноліл. ендотелію капілярів. В той час як ці мембрани доТермін "С1-С6-алкілгетероарил" означає С1-С6пускають проходження жиророзчинних матеріалів, 7 78035 8 алкіл, який має гетероарильний замісник, в тому тому числі 2-(ацетилокси)етил тощо. числі 2-фурилметил, 2-тієнілметил, 2-(1Н-індол-3Термін "алкокси(група)" означає групу -O-R, де іл)етил тощо. R є "C1-С6-алкіл", "арил", "гетероарил", "C1-С6Термін "С2-С6-алкеніл" означає алкенільну алкіларил" або "C1-С6-алкілгетероарил". До алкокгруп у, яка містить переважно від 2 атомів до 6 сигруп, яким віддається перевага, належать, наатомів вуглецю і включає щонайменше 1 ділянку приклад, метокси-, етокси-, феноксигрупа тощо. або 2 ділянки алкенільної ненасиченості. До алкеТермін "C1-С6-алкілалкокси(група)" означає C1нільних груп, яким віддається перевага, належать С6-алкіл, який має алкоксигрупу як замісник, в тоетеніл (-СНН 2-), = С w-2-пропеніл (аліл, му числі 2-етоксіетил тощо. СН2СН СН2-) тощо. = Термін "алкоксикарбоніл" означає групу Термін "С2-С6-алкеніларил" означає С2-С6C(O)OR, де R є "C1-С6-алкіл", "арил", "гетероарил", алкенільну груп у, яка має арильний замісник, в "C1-С6-алкіларил" або "C1-С6-алкілгетероарил". тому числі 2-фенілвініл тощо. Термін "C1-С6-алкілалкоксикарбоніл" означає Термін "С2-С6-алкенілгетероарил" означає С2C1-С6-алкіл, який має алкоксикарбоніл як замісник, С6-алкенільну групу, яка має гетероарильний замів тому числі 2-(бензилоксикарбоніл)етил тощо. сник, в тому числі 2-(3-піридиніл)вініл тощо. Термін "амінокарбоніл" означає групу Термін "С2-С6-алкініл" означає алкінільну груC(O)NRR', де кожний з R, R' незалежно від іншого пу, яка має переважно від 2 атомів до 6 атомів є водень або "C1-С6-алкіл", "арил", "ге тероарил", вуглецю і включає щонайменше 1 ділянку або 2 "C1-С6-алкіларил" або "C1-С6-алкілгетероарил". ділянки алкінільної ненасиченості. До алкінільних Термін "C1-С6-алкіламінокарбоніл" означає C1груп, яким віддається перевага, належать етиніл (С6-алкіл, який має амінокарбоніл як замісник, в тому числі 2-(диметиламінокарбоніл)етил тощо. CºСН-), пропаргіл (-СН2СºСН-) тощо. Термін "С2-С6-алкініларил" означає С2-С6Термін "ациламіно(група)" означає групу NRC(O)R', де кожний з R, R' незалежно від іншого алкінільну груп у, яка має арильний замісник, в тоє водень або "C1-С6-алкіл", "арил", "ге тероарил", му числі 2-фенілетиніл тощо. "C1-С6-алкіларил" або "C1-С6-алкілгетероарил". Термін "С2-С6-алкінілгетероарил" означає С2Термін "С1-С6-алкілациламіно(група)" означає С6-алкінільну групу, яка має гетероарильний замісник, в тому числі 2-тієнілетиніл тощо. C1-С6-алкіл, який має ациламіногрупу як замісник, в тому числі 2-(пропіоніламіно)етил тощо. Термін "С3-С8-циклоалкіл" означає насичену Термін "уреїдо(група)" означає групу карбоциклічну групу, яка містить від 3 атомів до 8 NRC(O)NR'R", де кожний з R, R' та R" незалежно атомів вуглецю і включає один цикл (наприклад, від інших є водень або "C1-С6-алкіл", "арил", "гетециклогексил) або кілька конденсованих циклів (наприклад, норборніл). До циклоалкілів, яким віддароарил", "C1-С6-алкіларил" або "C1-С6алкілгетероарил", "циклоалкіл" або "гетероциклоається перевага, належать циклопентил, циклогеклкіл", і де R' та R" спільно з атомом азоту, до якого сил, норборніл тощо. вони приєднані, можуть факультативно утворюваТермін "гетероциклоалкіл" означає С3-С8ти 3-8-членний гетероциклоалкіл. циклоалкільну груп у згідно з поданим вище визначенням, в якій вуглецеві атоми в кількості до 3 заТермін "C1-С6-алкілуреїдо(група)" означає C1С6-алкіл, який має уреїдогрупу як замісник, в тому мінені гетероатомами, вибраними з групи, до якої числі 2-(N'-метилуреїдо)етил тощо. входять О, S, NR, причому R є водень або метил. Термін "аміно(група)" означає групу -NRR', де До гетероциклоалкілів, яким віддається перевага, кожний з R, R' незалежно від іншого є водень або належать піролідин, піперидин, піперазин, 1метилпіперазин, морфолін тощо. "C1-С6-алкіл", "арил", "гетероарил", "C1-С6алкіларил" або "C1-С6-алкілгетероарил", або "цикТермін "C1-С6-алкілциклоалкіл" означає C1-С6лоалкіл" або "гетероциклоалкіл", і де R та R' спільалкіл, який має циклоалкільний замісник, в тому но з атомом азоту, до якого вони приєднані, мочислі циклогексилметил, циклопентилпропіл тощо. жуть факультативно утворювати 3-8-членний Термін "C1-С6-алкілгетероциклоалкіл" означає C1-С6-алкіл, який має гетероциклоалкільний замісгетероциклоалкіл. Термін "С1-С6-алкіламіно(група)" означає C1ник, в тому числі 2-(1-піролідиніл)етилу, 4С6-алкіл, який має аміногрупу як замісник, в тому морфолінілметил, (1-метил-4-піперидиніл)метил числі 2-(1-піролідиніл)етил тощо. тощо. Термін "амоній" означає позитивно заряджену Термін "карбокси(л)" означає групу С(О)ОН. Термін "C1-С6-алкілкарбокси(л)" означає C1-С6груп у -N+RR'R", де кожний з R, R' та R" незалежно від інших є "C1-С6-алкіл", "C1-С6-алкіларил" або алкіл, який має карбоксильний замісник, в тому "C1-С6-алкілгетероарил", "циклоалкіл" або "гетерочислі 2-карбоксіетил тощо. циклоалкіл", і де R та R' спільно з атомом азоту, до Термін "ацил" означає групу -C(O)R, де R є " якого вони приєднані, можуть факультативно C1-С6-алкіл", "арил", "гетероарил", " C1-С6алкіларил" або "C1-С6-алкілгетероарил". утворювати 3-8-членний гетероциклоалкіл. Термін "галоген" означає атом фтору, хлору, Термін "C1-С6-алкілацил" означає C1-С6-алкіл, брому або йоду. який має ацильний замісник, в тому числі 2Термін "сульфонілокси(група)" означає групу ацетилетил тощо. OSO2-R, де R вибраний з групи, до якої входять Н, Термін "ацилокси(група)" означає групу OC(O)R, де R є "C1-С6-алкіл", "арил", "гетероарил", "C1-С6-алкіл", "C1-С6-алкіл", заміщений галогенами, наприклад, група -OSO2-CF 3, "арил", "ге тероарил", "C1-С6-алкіларил" або "C1-С6-алкілгетероарил". "C1-С6-алкіларил" та "C1-С6-алкілгетероарил". Термін "С1-С6-алкілацилокси(група)" означає Термін "C1-С6-алкілсульфонілокси(група)" C1-С6-алкіл, який має ацилоксигрупу як замісник, в 9 78035 10 означає C1-С6-алкіл, який має сульфонілоксигрупу клад, із хлористоводневою, бромистоводневою, як замісник, в тому числі 2сірчаною, фосфорною, азотною кислотами тощо) (метилсульфонілокси)етил тощо. та солі, утворені з органічними кислотами, наприТермін "сульфоніл" означає групу -SO2-R, де R клад, з оцтовою, щавлевою, винною, бурштиновибраний з групи, до якої входять Н, "арил", "гетевою, яблучною, фумаровою, малеїновою, аскорбіроарил", "C1-С6-алкіл", "C1-С6-алкіл", заміщений новою, бензойною, дубильною, памовою, галогенами, наприклад, група -SO2-CF3, "C1-С6альгіновою, поліглутаміновою, нафталінсульфоалкіларил" та "C1-С6-алкілгетероарил". новою, нафталіндисульфоновою та полігалактуТермін "C1-С6-алкілсульфоніл" означає C1-С6роновою кислотами. Вищезгадані сполуки можна алкіл, який має сульфоніл як замісник, в тому числі застосовувати також у формі фармацевтично при2-(метилсульфоніл)етил тощо. йнятних четвертинних солей, відомих фахівцям; Термін "сульфініл" означає групу -S(O)-R, де R до яких, зокрема, належать четвертинні амонієві вибраний з групи, до якої входять Н, "C1-С6-алкіл", солі формули -NRR'R"+Z', де кожний з R, R' та R" "C1-С6-алкіл", заміщений галогенами, наприклад, незалежно від інших є водень, алкіл або бензил, група -SO2-CF3, "арил", "гетероарил", "C1-С6С1-С6-алкіл, С2-С6-алкеніл, С2-С6-алкініл, С1-С6алкіларил" та "C1-С6-алкілгетероарил". алкіларил, С1-С6-алкілгетероарил, циклоалкіл, геТермін "C1-С6-алкілсульфініл" означає C1-С6тероциклоалкіл, a Z є протиіон, в тому числі хлоалкіл, який має сульфініл як замісник, в тому числі рид, бромід, йодид, -О-алкіл, толуолсуль фонат, 2-(метилсульфініл)етил тощо. метилсульфонат, сульфонат, фосфат або карбокТермін "сульфаніл" означає групу -S-R, де R є силат (наприклад, бензоат, сукцинат, ацетат, глі"C1-С6-алкіл", "арил", "гетероарил", "C1-С6колят, малеат, малат, фумарат, цитрат, тартрат, алкіларил" та "C1-С6-алкілгетероарил". До сульфааскорбат, цинамоат, манделоат та дифеніл аценільних груп, яким віддається перевага, належать тат). метилсульфаніл, етилсульфаніл тощо. Термін "фармацевтично активна похідна" Термін "C1-С6-алкілсульфаніл" означає C1-С6означає будь-яку сполуку, яка при введенні в оралкіл, який має сульфаніл як замісник, в тому числі ганізм здатна забезпечити прямим або непрямим 2-(етилсульфаніл)етил тощо. шляхом дію, описану в цьому документі. Термін "сульфоніламіно(група)" означає групу Термін "енантіомерний надлишок (ее)" стосу-NRSO2-R', де кожний з R, R' незалежно від іншого ється продуктів, одержаних шляхом асиметричноє водень або "C1-С6-алкіл", "арил", "ге тероарил", го синтезу, тобто синтезу із застосуванням нера"C1-С6-алкіларил" або "C1-С6-алкілгетероарил". цемічних ви хідних матеріалів та/або реагентів або Термін "C1-С6-алкілсульфоніламіно(група)" синтезу, який включає щонайменше одну енатнтіозначає C1-С6-алкіл, який має сульфоніламіногруоселективну стадію, причому одержують надлипу як замісник, в тому числі 2шок одного енантіомеру порядку щонайменше (етилсульфоніламіно)етил тощо. 52% ее. Термін "заміщений або незаміщений": якщо Вищезгадана формула охоплює також таутовизначення індивідуального замісника не обмежемери, геометричні ізомери, оптично активні форне іншим чином, то вищезазначені групи, наприми, наприклад, енантіомери, діастереомери, та клад, "алкіл", "алкеніл", "алкініл", "арил", "гетерорацемічні форми, а також фармацевтично прийняарил" тощо можуть бути факультативно заміщені тні солі згаданої сполуки. Серед фармацевтично замісниками в кількості від 1 до 5, вибраними з прийнятних солей формули (І) перевага віддаєтьгрупи, до якої входять "C1-С6-алкіл", "С2-С6ся солям із фармацевтично прийнятними кислотаалкеніл", "C2-С6-алкініл", "циклоалкіл", "гетероцикми, наприклад, гідрохлориду, гідроброміду, сульлоалкіл", "C1-С6-алкіларил", "C1-С6фату або бісульфату, фосфату або гідрофосфату, алкілгетероарил", "C1-С6-алкілциклоалкіл", "C1-С6ацетату, бензоату, сукцинату, фумарату, малеату, алкілгетероциклоалкіл", "аміно(група)", "амоній", лактату, цитрату, тартрату, глюконату, метансу"ацил", "ацилокси(група)", "ациламіно(група)", льфонату, бензолсульфонату та ияря"амінокарбоніл", "алкоксикарбоніл", "уреїтолуолсульфонату. до(група)", "арил", "гетероарил", "сульфініл", "суСполуками за цим винаходом є сполуки форльфоніл", "алкокси(група)", "сульфаніл", "галоген", мули І "карбокси(л)", тригалогенметил, ціаногрупа, гідроксил, меркаптогрупа, нітрогрупа тощо. В альтерна(l) тивних варіантах таке заміщення може охоплювати також випадки, коли сусідні замісники можуть бути піддані замиканню циклу, особливо коли сусіУ формулі (І) R вибраний з групи, яку склададні функціональні замісники введені в реакцію з ють або до якої входять водень, заміщений або утворенням, наприклад, лактамів, лактонів, циклінезаміщений С1-С6-алкіл, заміщений або незамічних ангідридів, але також і ацеталів, тіоацеталів, щений С1-С6-алкіларил, заміщений або незаміщеаміналів, що утворюються шляхом замикання цикний гетероарил, заміщений або незаміщений С 1лу, наприклад, із метою утворення захисної групи. С6-алкілгетероарил, заміщений або незаміщений Термін "фармацевтично прийнятні солі або C2-C6-алкеніл, заміщений або незаміщений С 2-С6комплекси" означає солі або комплекси визначеалкеніларил, заміщений або незаміщений С 2-С6них нижче сполук формули (І) та формули (II), які алкенілгетероарил, заміщений або незаміщений зберігають бажану біологічну активність. НеобмеC2-C6-алкініл, заміщений або незаміщений С 2-С6жувальними прикладами таких солей є солі кисалкініларил, заміщений або незаміщений С 2-С6лот, утворені з неорганічними кислотами (наприалкінілгетероарил, заміщений або незаміщений 11 78035 12 С3-С8-циклоалкіл, заміщений або незаміщений 1-іл)метил]бензил}окси)-піримідин-4-іл]ацетонітрил гетероциклоалкіл, заміщений або незаміщений С 11,3-бензотіазол-2-іл(2-{[4-(піперазин-1С6-алісілциклоалкіл, заміщений або незаміщений ілметил)бензил]окси}-піримідин-4-іл)ацетонітрил С1-С6-алкілгетероциклоалкіл, заміщений або не1,3-бензотіазол-2-іл[2-({4-[(4-формілпіперазинзаміщений С1-С6-алкілкарбоксил, ацил, заміщений 1-іл)метил]бензил}окси)-піримідин-4-іл]ацетонітрил або незаміщений С 1-С6-алкілацил, ацилоксигрупа, [2-({4-[(4-ацетилпіперазин-1заміщена або незаміщена С 1-С6іл)метил]бензил}окси)піримідин-4-іл](1,3алкілацилоксигрупа, заміщена або незаміщена С 1бензотіазол-2-іл)ацетонітрил С6-алкілалкоксигрупа, алкоксикарбоніл, заміщений (3Н-бензотіазол-2-іліден)-{2-[4-(4або незаміщений С 1-С6-алкілалкоксикарбоніл, амі[1,2,4]оксадіазол-3-ілметил-піперазин-1-ілметил)нокарбоніл, заміщений або незаміщений С 1-С6бензилокси]-піримідин-4-іл}-ацетонітрил алкіламінокарбоніл, ациламіногрупа, заміщена або Метиловий складний ефір 4-(4-{4-[(3Ннезаміщена С1-С6-алкілациламіногрупа, уреїдогбензотіазол-2-іліден)-ціанометил]-піримідин-2рупа, заміщена або незаміщена С 1-С6ілоксиметил}-бензил)-піперазин-1-карбонової кисалкілуреїдогрупа, аміногрупа, заміщена або незалоти міщена С1-С6-алкіламіногрупа, сульфонілоксигру2-[4-(4-{4-[(3Н-бензотіазол-2-іліден)па, заміщена або незаміщена С 1-С6ціанометил]-піримідин-2-ілоксиметил}-бензил)алкілсульфонілоксигрупа, сульфоніл, заміщений піперазин-1-іл]-ацетамід або незаміщений С 1-С6-алкілсульфоніл, сульфініл, (2-{4-[4-(2-аміноацетил)-піперазин-1-ілметил]заміщений або незаміщений С 1-С6-алкілсульфініл, бензилокси}-піримідин-4-іл)-(3Н-бензотіазол-2сульфаніл, заміщений або незаміщений С 1-С6іліден)-ацетонітрил алкілсульфаніл, сульфоніламіногрупа, заміщена Метиловий складний ефір [4-(4-{4-[(3Набо незаміщена С1-С6-алкілсульфоніламіногрупа. бензотіазол-2-іліден)-ціанометил]-піримідин-2R1 вибраний з групи, яку складають або до ілоксиметил}-бензил)-піперазин-1-іл]-оцтової кисякої входять Н, галоген, ціано-, нітро-, аміногрупа, лоти заміщений або незаміщений С 1-С6-алкіл, зокрема, (3Н-бензотіазол-2-іліден)-(2-{4-[4-(2C1-С3-алкіл, наприклад, метил, етил або -CF3, заметоксіетил)-піперазин-1-ілметил]-бензилокси}міщений або незаміщений С 2-С6-алкеніл, заміщепіримідин-4-іл)-ацетонітрил ний або незаміщений С 1-С6-алкініл, заміщений або Диметиламід 4-(4-{4-[(3Н-бензотіазол-2незаміщений С1-С6-алкіларил, заміщений або неіліден)-ціано-метил]-піримідин-2-ілоксиметил}заміщений арил або заміщений або незаміщений бензил)-піперазин-1-карбонової кислоти гетероарил, заміщений або незаміщений С1-С6(3Н-бензотіазол-2-іліден)-{2-[4-(4-етилалкілгетероарил, -C(O)-OR2, -C(O)-R2, -C(O)пшеразин-1-ілметил)-бензилокси]-піримідин-4-іл}NR2R2', -(SO 2)R2, де ацетонітрил R2 та R2' незалежно один від одного вибрані з (3Н-бензотіазол-2-іліден)-(2-{4-[4-(2групи, яку складають або до якої входять водень, гідроксіетил)-піперазин-1-ілметил]-бензилокси}незаміщений або заміщений С1-С6-алкіл, незаміпіримідин-4-іл)-ацетонітрил щений або заміщений С 2-С6-алкеніл, незаміщений Цей винахід охоплює також геометричні ізоабо заміщений С 2-С6-алкініл, незаміщений або мери, оптично активні форми, енантіомери, діасзаміщений арил, незаміщений або заміщений гетереомери сполук формули І, а також їхні рацемітероарил, незаміщений або заміщений С 1-С6чні форми, а також фармацевтично прийнятні солі, алкіларил, незаміщений або заміщений С 1-С6а також фармацевтично активні похідні піперазиналкінгетероарил. За варіантом, якому віддається бензотіазолу формули І. перевага, R1 є Н. Сполуки за цим винаходом є інгібіторами JNK, n є ціле число від 1 до 3, за варіантом, якому зокрема, JNK3, і тому можуть бути застосовані при віддається більша перевага, 1. лікування розладів, опосередкованих JNK. СполуЗа варіантом, якому віддається більша переки за цим винаходом виявляють неочікувано висовага, похідними піперазинбензотіазолу за цим вику здатність до проходження через гематоенценаходом є сполуки, де R є водень, С1-С3-алкіл, фалічний бар'єр (ВВВ) і тому є корисними, амінокарбоніл, С1-С6-алкілалкоксикарбоніл, С1-С6зокрема, при лікуванні церебральних ішемічних алкілалкоксигрупа, С1-С6-алкілацилоксигрупа, алрозладів або розладів ЦНС. Отже, подальший аскоксикарбоніл, С1-С6-алкіламінокарбоніл. Більш пект цього винаходу полягає в застосуванні похідконкретно, R є Η або С 1-С3-алкіл, зокрема, метил них піперазинбензотіазолу за цим винаходом при або етил, або С1-С6-алкілалкоксигрупа. лікуванні та/або профілактиці церебральних ішеЦей винахід охоплює також відповідні таутомічних розладів або розладів ЦНС. мери, які мають формулу Ще один аспект цього винаходу стосується застосування похідних піперазинбензотіазолу формули І або формули II для виготовлення лікарсь(ll) ких засобів для лікування церебральних ішемічних розладів або розладів ЦНС. Конкретні похідні піперазинбензотіазолу за Ще одним предметом цього винаходу є спосіб цим винаходом вибрані з групи, до якої входять одержання нових похідних бензотіазолу формули І такі сполуки: або формули II. Загальний шлях синтезу сполук 1,3-бензотіазол-2-іл[2-({4-[(4-метилпіперазинформули І показано на. 1-іл)метил]бензил}окси)-піримідин-4-іл]ацетонітрил 1,3-бензотіазол-2-іл[2-({4-[(4-бензилпіперазин 13 78035 Схема І Як показано на Схемі І, вихідні сполуки формули III вводять у реакцію з відповідно заміщеними (активованими) піримідинами, наприклад, із галогенпіримідинами, наприклад, з 2,4дихлорпіримідином формули VI, і одержують піримідинбензотіазоли IV. Ці реакції за варіантом, якому віддається перевага, виконують у присутності придатних основ, наприклад, гідриду натрію, гідриду калію тощо, в безводній інертній атмосфері, за варіантом, якому віддається перевага, в полярному розчиннику, наприклад, DMF, DMA, MeCN або THF, при температурі в межах від приблизно 78°С до 100°С. Бензотіазоли формули III або є наявними на ринку, як, наприклад, продукти фірми Maybridge Chem. Co. Ltd., або можуть бути одержані з наявних на ринку сполук відомими способами. Галогеновані піримідини, наприклад, 2,4дихлорпіримідин формули VI, також або є наявними на ринку, як, наприклад, продукти фірм Aldrich, Fluka, Sigma тощо, або можуть бути одержані відомими способами. Для одержання кінцевих продуктів - піперазинбензотіазолів формули (І) проміжні сполуки формули (IV) за варіантом, якому віддається перевага, вводять в реакцію з придатними спиртами формули (V), як показано на Схемі II. Схема ІІ Цю реакцію проводять за варіантом, якому віддається перевага, у присутності розчинників, наприклад, DMF, DMA, N MP, DMSO або ACN, за варіантом, якому віддається більша перевага, в DMA або MeCN, у присутності придатної основи, наприклад, трет-ВuОК, CS2CO3 (карбонату цезію), у присутності або у відсутності Cul, NaH тощо, за варіантом, якому віддається найбільша перевага, NaH, при температурі в межах від приблизно 25°С до 120°С. За способом, якому віддається перевага, ви хідні сполуки нагрівають при 25-100°С у розчині в DMA у присутності NaH. 14 Проміжні сполуки формули (V) можна одержати шля хом синтезу, показаного на Схемі III. Згідно зі Схемою III, вихідним матеріалом для одержання бензилового спирту є метиловий складний ефір nтолуїлової кислоти. У випадку синтезу фенетилового спирту або фенілпропілового спирту метиловий складний ефір n-толуїлової кислоти можна замінити придатними вихідними матеріалами, наявними на ринку або одержаними за відомими способами. Схема ІІІ У значенні, вживаному в цьому описі, термін "лікування" означає пригнічення або припинення розвитку захворювання, розладу або стану, та/або спричинення послаблення, ремісії або зворотного розвитку симптомів захворювання, розладу або стану. Для фахівців зрозуміло, що для оцінювання розвитку захворювання, розладу або стану можуть бути застосовані різноманітні методологічні підходи та випробування і що, аналогічно, для оцінювання послаблення, ремісії або зворотного розвитку симптомів захворювання, розладу або стану можуть бути застосовані різноманітні методологічні підходи та випробування. При застосуванні сполук за цим винаходом як лікарські засоби їх, як правило, вводять в організм у формі фармацевтичних композицій. Отже, фармацевтичні композиції, що містять сполуки формули І та фармацевтично прийнятні носії, розріджувачі або наповнювачі, також охоплюються цим винаходом. Фахівцю зрозуміло все різноманіття таких носіїв, розріджувачів або наповнювачів, придатних для виготовлення фармацевтичних композицій. Цей винахід пропонує також сполуки для застосування як лікарські засоби. Сполуки за цим винаходом спільно зі звичайно застосовуваними допоміжними речовинами, носіями, розріджувачами або наповнювачами можуть бути введені до складу фармацевтичних композицій та їхніх дозованих одиниць і в цих випадках можуть застосовуватися у ви гляді твердих форм, наприклад, таблеток або заповнених капсул, або у вигляді рідких форм, наприклад, розчинів, суспензій, емульсій, еліксирів або капсул, заповнених такими формами, для перорального застосування, або у формі стерильних ін'єкційних розчинів для парентерального (в тому числі підшкірного) введення. Такі фармацевтичні композиції та їхні дозовані одиниці можуть містити інгредієнти у звичайних співвідношеннях, спільно з додатковими активними сполуками або діючими речовинами 15 78035 16 або без них, причому такі дозовані одиниці лікарВищезазначені компоненти композицій для ських форм можуть містити будь-яку придатну перорального застосування та для ін'єкцій згадані ефективну кількість активного інгредієнта, співмірлише як типові приклади. Подальші матеріали, а ну з очікуваним діапазоном призначених для затакож способи виготовлення тощо подано [у Часстосування добових доз. тині 8 монографії Remington's Pharmaceutical SciФармацевтичні композиції за цим винаходом ences, 17 th Edition, 1985, Marck Publishing Co., можна вводити в організм різноманітними шляхаEaston, Pennsylvania], яка включена до цього опими, в тому числі пероральним, ректальним, чересу шляхом посилання. зшкірним, підшкірним, внутрішньовенним, внутріСполуки за цим винаходом можна застосовушньом'язовим, внутрішньооболонковим, вати також у формах із модифікованим вивільненвнутрішньоочеревинним та назальним. Залежно ням або у терапевтичних системах із модифіковавід передбачуваного шляху введення, згадані споним вивільненням. Опис типових матеріалів із луки вводять за варіантом, якому віддається перемодифікованим вивільненням також можна знайти вага, в композиції для ін'єкцій, для місцевого або в монографії Remington's Pharmaceutical Sciences, перорального застосування. Композиції для перовключеній до цього опису шляхом посилання. рального застосування можуть мати форму нефаЦей винахід буде ілюстровано нижче кількома сованих рідких розчинів або суспензій, або нефаприкладами, які не слід розглядати як такі, що обсованих порошків. Більш широким, однак, є межують обсяг винаходу. застосування композицій у формі дозованих одиДані високоефективної рідинної хроматографії ниць із метою спрощення точного дозування. Тер(HPLC), ядерно-магнітного резонансу (ЯМР) та мін "дозовані одиниці" означає фізично дискретні мас-спектроскопії (MS), подані нижче, одержано в одиниці, придатні як одиничні дози для людей та таких умовах: інших ссавців, причому кожна одиниця містить HPLC: колонка Waters Symmetry C8 50´4,6мм, заздалегідь визначену кількість активного матеріумови елюювання: a) MeCN/H2O+0,09% TFA, 0алу, розраховану на досягнення бажаного терапе100% (10хв.); b) MeCN/H2O, 5-100% (8хв.); максивтичного ефекту, в комбінації з придатним фармамальна чутливість на довжині хвилі 230-400нм. цевтичним наповнювачем. До типових дозованих Мас-спектри: прилад PE-SCIEX АРІ 150 ЕХ одиниць належать заздалегідь заповнені ампули (АРСІ - хімічна іонізація під атмосферним тиском або шприци з відміряною кількістю рідкої композита ESI - іонізація електронним ударом). ції або пілюлі, таблетки, капсули тощо у випадку LC/MS (рідинна хроматографія в комбінації з твердої композиції. В таких композиціях похідна мас-спектроскопією): колонка Waters ZMD (ESI). 1 піперазинбензотіазолу є звичайно неосновним H-ЯМР: прилад Bruker DPX-300МГц. компонентом (від приблизно 0,1% (мас.) до приОчищення сполук здійснювали в таких умовах: близно 50% (мас), або за варіантом, якому віддапрепаративна рідинно-хроматографічна система ється більша перевага, від приблизно 1% (мас.) до Waters Prep LC 4000, обладнана колонками Prep приблизно 40% (мас.)), а решту складають різні Nova-Pak®PK С18, 6мкм, 60Å, 40´30мм (до 100мг) середовища або носії та технологічні допоміжні або 40´300мм (до 1г). Усі операції очищення викоречовини, які сприяють виготовленню бажаної нували при градієнтному елююванні дозованої форми. MeCN/H2O+0,09% TFA. Рідкі форми, придатні для перорального заПриклад А: Одержання проміжної сполуки (IV) стосування, можуть містити придатний водний або (дивись Схему 1) 1,3-бензотіазол-2-іл(2-хлор-4неводний носій з буферними сполуками, суспензапіримідиніл)-ацетонітрил торами та диспергаторами, барвниками, ароматиДо суспензії NaH (60% у маслі, 9,2г, 0,23моль) заторами тощо. Тверді форми можуть містити, у безводному THF (200мл) додавали краплями при наприклад, будь-які з перелічених нижче інгредієнперемішуванні в інертній атмосфері розчин 1,3тів або сполук аналогічної природи: в'яжучі, наприбензотіазол-2-іл-ацетонітрилу (20г, 0,15моль) у клад, мікрокристалічну целюлозу, трагантову кабезводному THF (200мл). Після перемішування медь або желатин; наповнювачі, наприклад, протягом 1год. 30хв. при кімнатній температурі крохмаль або лактозу; дезінтегратори, наприклад, додавшій краплями розчин 2,4-дихлорпіримідину альгінову кислоту, Primogel або кукурудзяний кро(17,1г, 0,15моль) у безводному THF (200мл). Пехмаль; змащувальні агенти, наприклад, стеарат ремішували реакційну суміш в інертній атмосфері магнію; ковзні агенти, наприклад, колоїдний діокпри кімнатній температурі до повного зникнення сид кремнію; підсолоджувачі, наприклад, сахарозу вихідного матеріалу. Гасили реакцію доданням або сахарин; або смакоароматичні домішки, наводи і випарювали THF. Додавали воду, і злегка приклад, м'яту, метилсаліцилат або апельсиновий підкислювали суспензію водним розчином НСl ароматизатор. (1М). Одержаний осад відділяли фільтруванням і Композиції для ін'єкцій звичайно виготовляретельно промивали водою до нейтральної реакються на основі стерильного сольового розчину ції, а потім гексаном для видалення масла. Неабо сольового розчину з фосфатним буфером, очищений твердий продукт сушили у вакуумі при або інших носіїв для ін'єкцій, відомих у галузі. Як 40°С, і одержували 28г (84%) вказаної в заголовку вказано вище, похідні піперазинбензотіазолу форсполуки у вигляді світло-коричневого порошку. мули І у таких композиціях є, як правило, неосновТ.пл. 246°С із розкладом. MS: 286,8 (М+1); HPLC ними компонентами, вміст яких часто лежить у (умови а, 268нм) 97%, час витримування 5,66хв.; 1 межах від 0,05% (мас.) до 10% (мас), а решту H ЯМΡ (DMSO-d6) δ 13,25 (br s, 1H, взаємозамінскладає згаданий носій для ін'єкцій та аналогічні ний), 8,09 (d, J=4,14Гц, 1Н), 7,90 (d, J=7,53Гц, 1H), допоміжні речовини. 7,61 (d, J=7,92Гц, 1H), 7,39-7,34 (m, 1H), 7,20-7,15 17 78035 18 (m, 1H), 6,96 (br d, 1H). Елементний аналіз: 3,39-2,20 (m, 8H), 2,12 (s, 3Н). C13H7CIN4S: Обчислено: С, 54,19%, Η 2,48%, Ν Аналогічним способом можна одержати пере19,45%; знайдено: С 53,35%, Η 2,77%, Ν 17,62% лічені нижче проміжні сполуки. Приклад В: Одержання проміжної сполуки (Vа) (3-(4-метилпіперазин-1-ілметил-феніл)(дивись Схему 3) (4-(4-метилпіперазин-1-ілметилметанол 1 феніл)-метанол H ЯМР (DMSO-d6) δ 7,27-7,11 (m, 4Н), 5,17Стадія 1: Метил-n-толуа т 5,13 (m, 1Н), 4,48-4,46 (m, 2H), 3,41 (s, 2H), 2,41До розчину n-толуїлової кислоти (175г, 2,21 (m, 8H), 2,13 (s, 3Н). 1,28моль) у метанолі (2л) додавали краплями при Трет-бутиловий складний ефір 4-(4перемішуванні тіонілхлорид (612г, 5,14моль) при гідроксиметилбензил)-піперазин-1-карбонової кис5°С. Суміш нагрівали зі зворотним холодильником лоти протягом ночі, після чого випарювали розчинник. M+(ES): 307,2. 1 Одержаний залишок обробляли 10% водним розН ЯМР (D MSO-d 6) δ 7,27-7,21 (m, 4H), 5,12 (t, ~ чином NаНСО3 (рН 8). Продукт екстрагували етиJ=5,65Гц, 1Н), 4,46 (d, J=5,65Гц, 2H), 3,43 (s, 2H), лацетатом, промивали водою і сушили. Видаляли 3,28 (br t, 4H), 2,27 (t, J=4,9Гц, 4H), 1,40 (s, 9H). розчинник, неочищений продукт очищали хрома{4-[(4-етилпіперазин-1-іл)метил] фетографією на колонці (елюент суміш петролейного ніл}метанол ефіру з етилацетатом) і одержували метил-nВихід=78%, M+(ES): 235,3; 1 толуат у вигляді безбарвної рідини (180г, 93%). H ЯМР (D MSO-d 6) δ 7,26-7,19 (m, 4Н), 5,12 (t, Стадія 2: 4-метоксикарбонілбензилбромід J=5,6Гц, 1Н), 4,46 (br d, 2H), 3,33 (s, 2H), 2,44-2,20 До суміші метил-n-толуату (180г, 1,2моль) та (m, 8H), 2,27 (q, J=7,2Гц, 2Н), 0,95 (t, J=7,2Гц, 3Н). N-бромсукциніміду (235г, 1,32моль) у ССІ4 (2л) (4-{[4-(2-метоксіетил)піперазин-1додавали порцією при 50°С пероксид бензоїлу іл]метил}феніл)метанол (18г). Суміш нагрівали зі зворотним холодильниВихід=66%, M+(ES): 265; 1 ком протягом 5год. Потім давали суміші охолодиH ЯМР (D MSO-d 6) δ 7,23-7,22 (m, 4Н), 5,11 (t, тися до 40°С, і відфільтровували тверду речовину. J=5,7Гц, 1Н), 4,45 (br d, 2H), 3,40 (s, 2H), 3,38 (t, Фільтрат концентрували, і одержували 4J=5,9Гц, 2H), 3,20 (s, 3H), 2,42 (t, J=5,9Гц, 2Н), метоксикарбонілбензилбромід (252г, 91%) у ви2,48-2,25 (m, 8H). гляді рідини світло-жовтого кольору. (4-{[4-бензилпіперазин-1Стадія 3: N-метил(4іл]метил}феніл)метанол метоксикарбонілбензил)піперазин Вихід=78%, M+(ES): 297. До розчину N-метилпіперазину (80г, 0,91моль) Приклад 1: Одержання 1,3-бензотіазол-2-іл[2та триетиламіну (232г, 2,29моль) в абсолютному ({4-[(4-метилпіперазин-1-іл)метил]бензил}окси)спирті (1750мл) додавали краплями при 0°С розпіримідин-4-іл]ацетонітрилу (тримезилату) (дивись чин 4-метоксикарбонілбензилброміду (252г, Схему 2) 1,1034моль) в абсолютному спирті (250мл). ПереДо суспензії NaH (60% у маслі, 1,68г, мішували суміш протягом ночі при кімнатній тем69,75ммоль) у безводному DMA (80мл) додавали пературі. Потім суміш концентрували, одержаний розчин (4-(4-метилпіперазин-1-ілметил-феніл)залишок розчиняли в 1,5-н. НСl (3л), промивали метанолу (сполука формули V у С хемі 2) (7,68г, діетиловим ефіром (тричі) і етилацетатом. Розчин 34,88ммоль) у безводному DMA (80мл). Одержану нейтралізували 10% водним розчином NaOH і підсуспензію перемішували протягом 1год. при кімналуговували до рН=8 за допомогою 10% водного тній температурі в інертній атмосфері. Додавали розчину NaHCO3. Продукт екстрагували СНСІ3, краплями розчин IV (5г, 17,44ммоль) у DMA промивали водою і розсолом і сушили над Na2SO4. (80мл), і суспензію перемішували при 100°С в інеВидаляли розчинник, і неочищений продукт очиртній атмосфері. Через 4год. реакційну суміш о хощали хроматографією на колонці (елюент лоджували і гасили доданням води. Випарювали СНСІ3/МеОН), одержуючи N-метил(4розчинники, і залишок розчиняли у воді (100мл). метоксикарбонілбензил)піперазин (150г, 70%) у Додавали 10мл EtOAc та циклогексан для вловвигляді рідини коричневого кольору. лювання залишкового масла від NaH, і витримуСтадія 4: (4-(4-метилпіперазин-1вали розчин при 4°С протягом дня. Осад, що утвоілметилфеніл)-метанол рювався, відфільтровували і промивали водою до До суміші LAH (36г, 0,957моль) у безводному нейтрального значення рН, а потім циклогексаном, THF (1750мл) додавали краплями при 0°С розчин одержуючи 6,17г неочищеної основи. N-метил(4-метоксикарбонілбензил)-піперазин 3,5г цієї неочищеної основи розчиняли у воді (150г, 0,638моль) у безводному THF (250мл). Пе(125мл), і додавали 1,25мл метансульфонової ремішували суміш протягом ночі при кімнатній кислоти. Одержаний розчин ліофілізували, одертемпературі в атмосфері N2, після чого гасили 10% жуючи оранжево-жовту тверду речовину, яку проводним розчином NaOH. Тверду фазу відділяли мивали ACN і сушили у вакуумі при 30°С; одержуфільтруванням, а фільтрат концентрували. Заливали 4,99г (вихід 66%) вказаної в заголовку шок розчиняли в DCM (1л) і промивали водою. сполуки у вигляді порошку жовтого кольору. Випарювали розчинник, і одержували (4-(4M-(ESI): 469.1; M+(ESI): 471.16; HPLC (умови b, метилпіперазин-1-ілметил-феніл)-метанол) (96г, максимальна чутливість) %, час витримування 73%) у вигляді рідини світло-жовтого кольору. 2,01хв. 1 M+(ES):221,2 Н ЯМР (DMSO-d6) δ 10,30 (дуже широкий s, 1 H ЯМР (D MSO-d 6) δ 7,26-7,19 (m, 4H), 5,11 (t, 1H), 8,06-8,03 (m, 2H), 7,82 (d, J=8,3Гц, 1Н), 7,76 (d, J=5,65Гц, 1Н), 4,45 (d, J=5,65Гц, 2H), 3,40 (s, 2H), J=7,9Гц, 2H), 7,69 (d, J=7,9Гц, 2Н), 7,56-7,51 (m, 19 78035 20 1Н), 7,40-7,35 (m, 1Н), 6,88 (br d, 1Н), 5,82 (s, 2H), вказаної в заголовку сполуки у вигляді порошку 4,52 (s, 2H), 3,85-3,57 (m, 4Н), 3,48-3,26 (m, 4Н), жовтого кольору. 2,95 (s, 3H), 2,48 (s, 9H). Вихід=34%; M-(ES) 455,2; M+(ES) 457,4; HPLC Приклад 2: Одержання 1,3-бензотіазол-2-іл[2(умови b, максимальна чутливість) 99,7%, час ви({4-[(4-бензилпіперазин-1-іл)метил1бензил}окси)тримування 1,98хв.; 1 піримідин-4-іл]ацетонітрилу (димезилату) H ЯМР (DMSO-d6) δ 9,00 (br s, 1H), 7,93 (d, Вказану в заголовку сполуку одержували за J=7,6Гц, 1Н), 7,87 (br d, 1H), 7,74 (d, J=7,9Гц, 1Н), методикою, описаною вище у Прикладі 1, із засто7,63 (d, J=7,9Гц, 2Н), 7,51 (d, J=7,9Гц, 2Н), 7,45суванням (4-(4-бензилпіперазин-1-ілметил-феніл)7,39 (m, 1H), 7,28-7,23 (m, 1H), 6,72 (d, J=6,4Гц, метанолу замість (4-(4-метилпіперазин-1-ілметил1H), 5,71 (s, 2H), 4Д0 (s, 2H), 3,32-3,18 (m, 4H), феніл)-метанолу. 3,13-2,92 (m, 4H). 1 H ЯМР (DMSO-d6) δ 7,95-7,93 (m, 2H), 7,73 (d, Приклад 6: Одержання 1,3-бензотіазол-2-іл[2J=7,9Гц, 1Н), 7,67-7,64 (m, 2H), 7,56-7,40 (m, 8H), ({4-[(4-формілпіперазин-1-іл)метил]бензил}окси)7,29-7,24 (m, 1H), 6,75 (br d, 1H), 5,73 (s, 2H), 4,45піримідин-4-іл]ацетонітрилу (ди-TFA) 4,15 (m, 4H), 3,60-3,30 (m, 4H), 3,25, 2,90 (m, 4H). Неочищену основу, одержану в Прикладі 3 Приклад 3: Одержання (3Н-бензотіазол-2(0,6г, 1,31ммоль) суспендували в 15мл метилфоріліден)-{2-[4-(4-етил-піперазин-1-ілметил)міату в закритій посудині. Реакційну суміш перебензилокси]-піримідин-4-іл}-ацетонітрилу мішували при 40°С протягом 15 діб, після чого Вказану в заголовку сполуку одержували за охолоджували до кімнатної температури. Осад, що методикою, описаною вище у Прикладі 1, із застоутворювався, відділяли фільтруванням і промивасуванням {4-[(4-етилпіперазин-1-іл)метил]феніл}ли водою, і неочищений продукт очищали препаметанолу замість (4- (4-метилпіперазин-1-ілметилративною HPLC. Чисті фракції об'єднували та ліофеніл)-метанолу. філізували, одержуючи 0,26г вказаної в заголовку Вихід=83%, M+(ES): 485,18; HPLC (умови b, сполуки у вигляді порошку жовтого кольору. максимальна чутливість) 97,8%, час витримування Вихід=28%; M-(ES) 483,3; M+(ES) 485,5; HPLC 2,06хв. (умови b, максимальна чутливість) 99,7%, час ви1 H ЯМР (DMSO-d6) δ 7,95 (d, J=7,9Гц, 1Н), 7,90 тримування 2,18хв. 1 (br d, 1H), 7,74 (d, J=7,9Гц, 1H), 7,67 (d, J=7,9Гц, Н ЯМР (DMSO-d 6) δ 9,95 (br s, 1Н), 8,03 (s, 2H), 7,58 (d, J=7,9Гц, 1H), 7,45-7,40 (m, 1H), 7,301H), 7,93 (d, J=7,9Гц, 1Н), 7,96-7,84 (дуже широкий 7,24 (m, 1H), 6,73 (br d, 1H), 5,73 (s, 2H), 4,32 (s, d, 1Н), 7,73 (d, J=7,9Гц, 1Н), 7,68 (d, J=7,9Гц, 2Н), 2H), 4,42-4,23 (m, 2H), 3,76-3,38 (m, 4H), 3,32-2,89 7,54 (d, J=7,9Гц, 2H), 7,47-7,40 (m, 1H), 1,29-1,24 (m, 4H), 1,21 (t, J=7,1Гц, 3Н). (m, 1H), 6,73 (br d, 1H), 5,73 (s, 2H), 4,36 (s, 2H), Приклад 4: Одержання (3Н-бензотіазол-24,05-2,80 (m, 8H). іліден)-(2-{4-[4-(2-метоксіетил)-піперазин-1Приклад 7: Одержання (2-{4-[4-(2ілметил]-бензилокси}-піримідин-4-іл)-ацетонітрилу аміноацетил)-піперазин-1-ілметил]-бензилокси}(три-TFA) піримідин-4-іл)-(3Н-бензотіазол-2-іліден)Вказану в заголовку сполуку одержували за ацетонітрилу (димезилат) (три-TFA) методикою, описаною вище у Прикладі 1, із застоДо розчину неочищеного продукту з відщеплесуванням (4-{[4-(2-метоксіетил)піперазин-1ною групою Вос, одержаного у Прикладі 5 (2,9г, іл]метил}-феніл)-метанолу замість (4-(43,65ммоль), в DMA (40мл) додавали смолу метилпіперазин-1-ілметил-феніл)-метанолу. Amberlyst A21 (0,7г, 3,76ммоль), і розчин переміВихід=33%, M+(ES): 515,06; HPLC (умови b, шували при кімнатній температурі протягом 20хв. максимальна чутливість) 99,5%, час витримування Відділяли смолу фільтруванням, а до фільтрату 2,10хв. додавали розчин Вос-гліцину (0,74г, 4ммоль), 1 H ЯМР (DMSO-d6) δ 7,93 (d, J=7,9Гц, 1Н), 7,87 HOBt (0,73г, 5,47ммоль), EDC (1,05г, 5,47ммоль) (br d, 1H),7,74 (d, J=8,3Гц, 1H), 7,63 (d, J=7,9Гц, та DIPEA (1,9г, 14,6ммоль) у DMA (30мл). Одер2H), 7,50 (d, J=7,9Гц, 2H), 7,44-7,39 (m, 1H), 7,28жаний розчин перемішували при кімнатній темпе7,23 (m, 1H), 6,70 (br d, 1H), 5,71 (s, 2H), 4,10 (s, ратурі протягом ночі. Після випарювання розчин2H), 3,63-3,60 (m, 2H), 3,50-2,90 (m, 13H). ника під зниженим тиском одержаний залишок Приклад 5: Одержання 1,3-бензотіазол-2-іл(2суспендували в суміші МеОН та EtOAc і залишали {[4-(піперазин-1-ілметил)бензил]оксиІ-піримідин-4на ніч при 4°С. Залишок відфільтровували, промиіл)ацетонітрилу (три-TFA) вали EtOAc і сушили у вакуумі при 40°С, одержуюВказану в заголовку сполуку одержували за чи 1,04г вказаної в заголовку сполуки у вигляді методикою, описаною вище у Прикладі 1, із застотвердої речовини жовтого кольору. суванням 4-(4-Вос-піперазин-1-ілметил-феніл)Вихід=10%, M+(ES): 514,06; HPLC (умови b, метанолу замість (4-(4-метилпіперазин-1-ілметилмаксимальна чутливість) 99,9%, час витримування феніл)-метанолу. Таким чином, одержано неочи2,00хв. 1 щену основу, захищен у Вос. H ЯМР (DMSO-d6) δ 8,13-8,02 (m, 2H), 7,94Неочищену основу, захищену Вос, розчиняли 7,91 (m, 2H), 7,73 (br d, 1Н), 7,67 (d, J=7,9Гц, 2Н), в суміші DCM/TFA (9:1) і перемішували протягом 7,54 (d, J=7,9Гц, 2Н), 7,45-7,40 (m, 1Н), 7,29-7,24 2год. при кімнатній температурі. Випарювали DCΜ (га, 1H), 6,74 (br d, 1H), 5,74 (s, 2H), 4,34 (s, 2H), при кімнатній температурі. Залишок розтирали в 3,89 (s, 2H), 3,73-3,10 (m, 8H). діетиловому ефірі, фільтрували і сушили у вакуумі Приклад 8: Одержання [2-({4-[(4при кімнатній температурі протягом ночі. Після ацетилпіперазин-1-іл)метил]бензил}очищення препаративною HPLC чисті фракції об'окси)піримідин-4-іл](1,3-бензотіазол-2єднували та ліофілізували, одержуючи 3,03г (34%) іл)ацетонітрилу (ди-TFA) 21 78035 22 До розчину неочищеного продукту з відщеплепіперазин-1-ілметил)-бензилокси]-піримідин-4-іл}ною групою Вос, одержаного у Прикладі 5 (0,3г, ацетонітрилу (три-TFA) 0,66ммоль), в DMA (6мл) додавали триетиламін До розчину неочищеного продукту з відщепле(0,09мл, 0,66ммоль) та ацетилхлорид (0,09мл, ною групою Вос, одержаного у Прикладі 5 (0,5г, 1,31ммоль), і розчин перемішували при кімнатній 0,63ммоль), в DMA (10мл) додавали смолу температурі 5хв. Реакційну суміш концентрували Amberlyst A21 (0,7г, 3,76ммоль), і розчин перемімайже досуха, і одержаний залишок очищали прешували при кімнатній температурі протягом 20хв. паративною HPLC. Чисті фракції об'єднували та Відділяли смолу фільтруванням, а до фільтрату ліофілізували, одержуючи 0,1г (21%) вказаної в додавали 3-(хлорметил)-1,2,4-оксадіазол та карзаголовку сполуки у вигляді порошку жовтого кобонат калію. Одержану суспензію перемішували льору. при кімнатній температурі протягом 48год. Повне M-(ES) 496,9; M+(ES) 499,1; HPLC (умови b, вичерпання вихідного матеріалу досягалося після максимальна чутли вість) 99%, час витримування 3 діб перемішування при кімнатній температурі та 2,19хв. додання 2,4екв. 3-(хлорметил)-1,2,4-оксадіазолу. 1 H ЯМР (DMSO-d6) δ 10,05 (br s, 1H), 7,93 (d, Після фільтрування та видалення розчинника під J=7,9Гц, 1Н), 7,93-7,84 (дуже широкий d, 1H), 7,74 зниженим тиском одержаний залишок очищали (d, J=7,9Гц, 1Н), 7,67 (d, J=8Гц, 2Н), 7,54 (d, препаративною HPLC. Чисті фракції об'єднували J=7,9Гц, 2H), 7,45-7,39 (m, 1H), 7,29-7,24 (m, 1H), та ліофілізували, одержуючи 110мг вказаної в за6,72 (br d, 1H), 5,73 (s, 2H), 4,36 (s, 2H), 4,02-3,87 головку сполуки у вигляді твердої речовини жовто(m, 1H), 3,42-2,75 (m, 7H), 2,01 (s, 3H). го кольору. Приклад 9: Одержання диметиламіду 4-(4-{4Вихід=20%, M+(ES): 538,94; HPLC (умови b, [(3Н-бензотіазол-2-іліден)-ціано-метил]-піримідинмаксимальна чутли вість) 97%, час витримування 2-ілоксиметил}-бензил)-піперазин-1-карбонової 2,31хв. 1 кислоти (ди-TFA) H ЯМР (DMSO-d6) δ 9,62 (s, 1Н), 7,93-7,91 (m, До розчину неочищеного продукту з відщепле2H), 7,73 (d, J=7,9Гц, 1H), 7,65 (d, J=7,9Гц, 2Н), ною групою Вос, одержаного у Прикладі 5 (0,5г, 7,53 (d, J=7,9Гц, 2Н), 7,44-7,39 (m, 1H), 7,27-7,22 0,63ммоль), в DMA (12мл) додавали смолу (m, 1H), 6,72 (br d, 1H), 5,72 (s, 2H), 4,32 (s, 2H), Amberlyst A21 (1,12г, 5,35ммоль) та диметилкар3,85 (s, 2H), 3,34-3,17 (m, 2H), 3,12-2,88 (m, 4H), бамоїлхлорид (0,12мл, 1,31ммоль), і розчин пере2,58-2,41 (m, 2H). мішували при 0°С протягом 1год. Оскільки продукт Аналогічним чином можна одержати вказані не утворювався, то розчин нагрівали до кімнатної нижче сполуки. температури і витримували протягом 12 діб до (3Н-бензотіазол-2-іліден)-(2-{4-[4-(2повного вичерпання вихідного матеріалу. Відділягідроксіетил)-піперазин-1-ілметил]-бензилокси}ли фільтруванням смолу Amberlyst, а до фільтрату піримідин-4-іл}-ацетонітрил (три-TFA) додавали воду. Оскільки осад не утворювався, Вихід=22%, M+(ES): 500,92; HPLC (умови b, розчинники випарювали під зниженим тиском, і максимальна чутливість) 99,3%, час витримування залишок розчиняли у воді та ліофілізували. Одер2,03хв. 1 жаний залишок очищали препаративною HPLC. H ЯМР (DMSO-d6) δ 7,93 (d, J=7,9Гц, 1Н), 7,86 Чисті фракції об'єднували та ліофілізували, одер(дуже широкий d, 1Н), 7,74 (br d, 1H), 7,58 (br d, жуючи 85мг вказаної в заголовку сполуки у вигляді 2H), 7,43-7,36 (m, 3H), 7,28-7,23 (m, 1H), 6,71 (br d, твердої речовини жовтого кольору. 1H), 5,69 (s, 2H), 4,20-3,60 (m, 4H), 3,70-3,67 (m, Вихід=18%, M+(ES): 528,09; HPLC (умови b, 2H), 3,52-3,34 (m, 2H), 3,20-2,92 (m, 4H). максимальна чутливість) 98,9%, час витримування Метиловий складний ефір 4-(4-{4-[(3Н2,32хв. бензотіазол-2-іліден)-ціано-метил]-піримідин-21 Н ЯМР (DMSO-d6) δ 9,82 (дуже широкий s, ілоксиметил}-бензил)-піперазин-1-карбонової кис1H), 7,94-7,86 (m, 2H), 7,73 (d, J=7,9Гц, 1Н), 7,67 (d, лоти (три-TFA) J=7,9Гц, 2H), 7,55 (d, J=7,9Гц, 2Н), 7,44-7,39 (m, Вихід=14%, M+(ES): 528,85; HPLC (умови b, 1Н), 7,28-7,23 (m, 1Н), 6,72 (br d, 1H), 5,73 (s, 2H), максимальна чутли вість) 98%, час витримування 4,37 (s, 2H), 3,65-3,48 (m, 2Н), 3,32-3,18 (m, 2Н), 2,38хв. 1 3,11-2,90 (m, 4Н), 2,74 (s, 6H). H ЯМР (DMSO-d 6) δ 7,94-7,91 (m, 2Н), 7,73 (br Аналогічним чином можна одержати вказану d, 1Н), 7,65 (d, J=7,9Гц, 2H), 7,53 (d, J=7,9Гц, 2H), нижче сполуку. 7,44-7,39 (m, 1Н), 7,28-7,23 (m, 2H), 6,71 (br d, 1H), Метиловий складний ефір 4-(4-{4-[(3Н5,72 (s, 2H), 4,30 (br s, 2H), 3,62 (s, 3H), 3,49-3,36 бензотіазол-2-іліден)-ціано-метил]-піримідин-2(m, 2H), 3,30-3,15 (m, 2H), 3,10-2,85 (m, 4H),2,73ілоксиметил}-бензил)-піперазин-1-карбонової кис2,54 (m, 2H). лоти (ди-TFA) 2-[4-(4-{4-[(3Н-бензотіазол-2-іліден)-ціаноВихід=32%, M+(ES): 514,85; HPLC (умови b, метил]-піримідин-2-ілоксиметил}-бензил)максимальна чутли вість) 99%, час витримування піперазин-1-іл]-ацетамід (три-TFA) 2,36хв. Вихід=16%, M+(ES): 513,95; HPLC (умови b, 1 Н ЯМР (DMSO-d 6) δ 7,94-7,91 (m, 2Н), 7,73 (br максимальна чутли вість) 93%, час витримування d, 1Н), 7,66 (d, J=7,9Гц, 2H), 7,53 (d, J=7,9Гц, 2H), 2,08хв. 1 7,46-7,40 (m, 1Н), 7,29-7,24 (m, 2H), 6,73 (br d, 1H), H ЯМР (DMSO-d6) δ 7,93 (d, J=7,9Гц, 1Н), 7,88 5,73 (s, 2H), 4,34 (s, 2H), 4,13-3,92 (m, 2H), 3,63 (s, (br d, 1H), 7,73 (d, J=7,9Гц, 1H), 7,61 (d, J=7,9Гц, 3H), 3,60-2,94 (m, 6H). 2H), 7,46 (br d, 2H), 7,45-7,40 (m, 1H), 7,28-7,23 (m, Приклад 10: Одержання (3Н-бензотіазол-21H), 6,72 (br d, 1H), 5,71 (s, 2H), 4,30-2,65 (m, 12H). іліден)-{2-[4-(4-[1,2,4]-оксадіазол-3-ілметил 23 78035 24 33 Приклад 11: Приготування фармацевтичних γ-ΑΤΡ (2нКі/мкл) у присутності або у відсутності композицій сполук формули І в реакційному об'ємі 50мкл, який Подані нижче приклади приготування лікарсьмістить 50мМ Трис-НСІ, рН8,0; 10мМ MgCl2; 1мМ ких форм ілюструють типові фармацевтичні комдитіотреїтолу та 100мкМ NaVO 4. Інкубування випозиції за цим винаходом, не обмежуючи обсяг конують протягом 120хв. при кімнатній температувинаходу. рі і припиняють доданням 200мкл розчину, що місЛікарська форма 1 - Таблетки тить 250мкг покритих стрептавідином гранул SPA Похідну піперазинбензотіазолу формули І у (Amersham, Inc.), 5мМ EDTA, 0,1% Triton X-100 та вигляді сухого порошку змішують із сухим желати50мкМ ATP у сольовому розчині з фосфатним буновим в'яжучим у масовому співвідношенні прифером. близно 1:2. Додають незначну кількість стеарату Після інкубування протягом 60хв. при кімнатмагнію як змащувального агента. Суміш формують ній температурі гранули осаджують центрифугуна таблетувальному пресі в таблетки масою 240ванням при 1500g протягом 5хв., знов суспенду270мг (80-90мг активної похідної піперазинбензоють у 200мкл сольового розчину з фосфатним тіазолу на таблетку). буфером, який містить 5мМ EDTA, 0,1% Triton ХЛікарська форма 2 - Капсули 100 та 50мкМ АТР, і вимірюють радіоактивність у Похідну піперазинбензотіазолу формули І у сцинтиляційному β-лічильнику після осадження вигляді сухого порошку змішують із крохмалем як гранул, як описано вище. розріджувачем у масовому співвідношенні приблиВипробовувані сполуки формули І виявляють зно 1:1. Суміш фасують у капсули місткістю 250мг інгібування (ІС50) стосовно до JNK3 менше за (125мг активної похідної піперазинбензотіазолу на 10мкМ, за варіантом, якому віддається більша капсулу). перевага, менше за 1мкМ і за варіантом, якому Лікарська форма 3 - Рідина віддається ще більша перевага, менше за Похідну піперазинбензотіазолу формули І 0,25мкМ. (1250мг), сахарозу (1,75г) та ксантанову камедь b) Випробування при глобальній ішемії хом'я(4мг) змішують, пропускають через сито 10 меш за ків стандартом США (розмір отворів 2,0мм), після Здатність інгібіторів JNK формули І захи щати чого змішують із заздалегідь приготованим розчиклітини від загибелі під час ішемічного нападу моном мікрокристалічної целюлози та натрієвої солі жна оцінити за описаною нижче методикою. карбоксиметилцелюлози (11:89, 50мг) у воді. БенДвостороння оклюзія сонних артерій у хом'яків зоат натрію (10мг), ароматизатор та барвник розє добре описаною тваринною моделлю гострого водять водою і додають до вищезгаданої суміші ішемічного нападу і потребує відносно простих при перемішуванні. Потім додають воду в кількосхірургічни х операцій. ті, достатній для одержання кінцевого об'єму 5мл. Нейронна дегенерація в гіпокампі розвиваєтьЛікарська форма 4 - Таблетки ся протягом кількох діб і часто описується як "відПохідну піперазинбензотіазолу формули І у кладена нейронна смерть". Крім того, нейродегевигляді сухого порошку змішують із сухим желатинерація легко виявляється при гістологічних новим в'яжучим у масовому співвідношенні придослідженнях і легко оцінюється кількісно [11]. близно 1:2. Додають незначну кількість стеарату Далі, гістопатологія, що спостерігається у хом'яків, магнію як змащувального агента. Суміш формують аналогічна патології ділянки СА1 гіпокампу мозку на таблетувальному пресі в таблетки масою 450людини після зупинки серця. На хомяках можна 900мг (150-300мг активної похідної піперазинбенспостерігати навіть зміни поведінки, наприклад, зотіазолу на таблетку). виконувати тестування пам'яті. Цей тип тестів для Лікарська форма 5 - Розчин для ін'єкцій оцінки ступеня видужання складніше виконувати Похідну піперазинбензотіазолу формули І розна інших піддослідних тваринах, наприклад, на чиняють у стерильному сольовому розчині з фоспацюках, які мають значно нижчі здатності до нафатним буфером для ін'єкцій у концентрації привчання [12]. близно 5мг/мл. Нейропротекторний ефект сполук формули І Приклад 12: Біологічні випробування можна оцінювати, застосовуючи модель глобальСполуки за цим винаходом можна піддавати ної ішемії у хом'яків і подану нижче методику. таким випробуванням: -1- МЕТОД a) Проба на інгібування JNK2 та -3 in vitro: *Хірургічні процедури Сполуки за цим винаходом є інгібіторами JNK, - Анестезія ізофлураном (0,5-4%). зокрема, JNK2 та JNK3. Фосфорилування c-Jun під - Вивільнення сонних артерій (лівої та правої) впливом JNK2 або JNK3 можна визначити шляхом з тканини. спостереження за інкорпоруванням 33Р у c-Jun, - Оклюзія згаданих артерій із застосуванням застосовуючи подану нижче методику. Пригнічумікрозатискачів "Бульдог" протягом 5хв. вальну активність сполук формули І відносно фо- Зняття затискачів (реперфузія). сфорилування c-Jun під впливом JNK визначають - Витримування тварин під нагрівальною ламшляхом обчислення активності фосфорилування у пою до пробудження. присутності та за відсутності сполук формули ї. - Витримування тварин у віварії в індивідуальВипробування пригнічення JNK3 та/або JNK2 них клітках. виконують у 96-лункових планшетах МTT шляхом *Умертвлення тварин інкубування 0,5мкг рекомбінантної попередньо - Через 7 діб після ішемії (обезголовлювання активованої GST-JNK3 або GST-JNK2 з 1мкг рекоабо передозування фенобарбіталу). мбінантного біотинільованого GST-c-Jun та 2мкМ - Відбирання проб крові. "Гістологічні па 25 78035 26 раметри тезії діетиловим ефіром. Кров для відповідних - Заморожування мозку в ізопентані (-20°С). проб відбирали в гепаринізовані пробірки і - Одержання зрізів гіпокампу із застосуванням центрифугували для видалення клітин крові, одекріо-мікротому (20мкм). ржуючи плазму. Проби плазми, одержані в кожний - Забарвлення крезиловим фіолетовим. момент відбирання (тобто при t=0,25год., 0,5год., - Оцінювання пошкоджень (у підполях 1год.) від пацюків кожної групи після введення виСА1/СА2 гіпокампу) із застосуванням модифіковапробовуваної сполуки формули І об'єднували для ного методу підрахунку за Герхардом та Бостом одержання однієї загальної проби з кожної групи у (Gerhard & Boast). кожний момент відбирання. Потім пацюків умертв-2- ЛІКУВАННЯ ляли шляхом знекровлювання. - Введення (внутрішньоочеревинно) сполуки Для відбирання проб мозку у мертвих пацюків формули І або носія: через 15хв., 24год. та 48год. видаляли весь мозок (мозок та мозочок). Мозки після реперфузії (через 5-10хв. після виходу з анедвох тварин із кожного моменту відбирання (тобто стезії). при t=0,25год., 0,5год., 1год. після введення ви- Стандартна методика. пробовуваної сполуки) об'єднували для одержанЗагальна кількість тварин у досліді 40; ці тваня однієї загальної проби для кожного моменту рини розділені на 5 груп по 8 тварин. відбирання. Кожну загальну пробу гомогенізували Група А: Контроль (сольовий розчин). у суміші розчинників (ацетонітГрупи B-D: Введення випробовуваної сполуки рил/метанол/диметилсульфоксид, 50:48:2 за об'у трьох різних дозах (10мг/кг; 20мг/кг; 40мг/кг). ємом), центрифугували і аналізували надосадову Група Е: Сполука порівняння (оротова кислорідину на вміст випробовуваної сполуки. Концентрації у пробах плазми та гомогенізату та, 3´300мг/кг, внутрішньоочеревинно). Для випробовуваної сполуки, описаної в Примозку кількісно визначали методом HPLC/MS-MS, індивідуально розробленим для даної сполуки. кладі 1 (тобто 1,3-бензотіазол-2-іл[2-({4-[(4У цьому випробуванні застосовували сполуку, метилпіперазин-1-іл)метил]бензил}окси)описану в Прикладі 1 (тобто 1,3-бензотіазол-2-іл[2піримідин-4-іл]ацетонітрилу), при застосуванні в ({4-[(4-метилпіперазин-1-іл)метил]бензил}окси)описаному ви ще випробуванні в концентрації 40мг/кг визначено інгібування нейронної смерті піримідин-4-іл] ацетонітрил). Концентрації випробовуваної сполуки у пробах приблизно на 60%. плазми та гомогенізату мозку, визначені методом с) Оцінка проходження через ВВВ: відбирання HPLC/MS-MS, подано в Таблиці 1. проб мозку та плазми Сполуки за цим винаходом є корисними при Таблиця 1 лікуванні та/або профілактиці церебральних ішемічних розладів або розладів ЦНС. Конкретно, Концентрації в ипробовув аної сполуки за цим винаходом виявляють добру здатсполуки (у формі три-TFA) у плазмі та у мозку, ність до проходження через гематоенцефалічний в изначені після внутрішньов енного введення в дозі бар'єр (ВВВ). Здатність сполук формули І або фо10мг/кг рмули II до проходження через ВВВ можна оцінити, застосовуючи описані нижче методики. Метою Загальні про- Плазма, Мозок, Відношення цих випробувань є кількісне визначення випробоби (n=2) нг/мл нг/г мозок/плазма вуваних сполук формул І або II у мозку пацюків Час., год. 0,25 2835 919 0,32 після внутрішньовенного введення. 0,5 2158 657 0,30 Шість самців лінії Crl:CD(SD)Br Sprague 1 1983 679 0,34 Dawley (вік приблизно 8 тижнів, маса тіла приблизно 300г) були розділені на 3 нижчезазначених Дані Таблиці 1 посвідчують значний та тривагрупи: лий ступінь проходження випробовуваної сполуки Група 1 в мозок. 2 тварини для внутрішньовенного введення Посилання: (10мг/кг сполуки формули І у 0,9% NaCl для ін'єк1. Davis Roger J. Signal Transduction by the JNK цій). Випробовувану сполук у вводили одиничною Group of MAP Kinases. Cell, 2000, 103: 239-252. дозою (в режимі дозування). Відбирання проб ви2. Gupta S. et al. Selective interaction of JNK конували через 0,25год. після омертвляння. protein kinase isoforms with transcription factors. The Група 2 EMBO Journal, 1996, 158(11): 2760-2770. 2 тварини для внутрішньовенного введення 3. Dumitru Calin D. et al. TNF-alpha induction by (10мг/кг сполуки формули І у 0,9% NaCl для ін'єкLPS is regulated posttranscriptionally via a Tpl2/ERKцій). Випробовувану сполук у вводили одиничною dependent pathway. Cell 2000, 103: 1071-1083. дозою (в режимі дозування). Відбирання проб ви4. Han Z. et al. C-Jun N-terminal kinase is конували через 0,5год. після омертвляння. required for metalloproteinase expression and joint Група 3 destruction in inflammatory arthritis. The Journal of 2 тварини для внутрішньовенного введення Clinical Investigation 2001, 108 (1):73-81. (10мг/кг сполуки формули І у 0,9% NaCl для ін'єк5. Nishina H., et al. Impaired CD28-mediated inцій). Випробовувану сполук у вводили одиничною terleukin 2 production and proliferation in stress дозою (в режимі дозування). Відбирання проб виkinase SAPK/ERK1 kinase (SEKl)/mitogen-activated конували через 1год. після омертвляння. protein kinase kinase 4 (MKK4)-deficient Τ lymphoВ кожний призначений момент омертвляння cytes. Journal of Experimental Medicine 1997, 186(6): тварин відповідної групи піддавали глибокій анес 27 78035 28 941-953. gene expression in human monocytes, Cellular Sig6. Kempiak Stephan J. et al. The Jun Kinase nalling 2001, 13: 85-94. Cascade is responsible for activating the CD28 Re11. Hunter J.L. et al., Animal models of acute sponse element of the IL-2 Promoter: proof of crossischemic stroke: can they predict clinically successful talk with the IKB Kinase Cascade, The Journal of neuroprotective drugs? TIPS 1995, 16:123-128. Immunology, 1999, 162: 3176-3187. 12. Block F. Global Ischemia And Behavioural 7. De la Monte S.M. et al. Oxygen free radical Deficits, Progress in Neurobiology 1999, 58: 279-295. injury is sufficient to cause some Alzheimer-type mo13. Gerhard S.C. and Boast C.A. Behavioral Neulecular abnormalities in human CNS neuronal cells. /. roscience 1988, 102: 301-303. Al zheimer's Dis. 2000, 2(3-4): 261-281. 14. Betz et al., 1994. Blood-Brain-Cerebrospinal 8. Zhu X. Activation and redistribution of c-Jun NFluid Barriers. Chapter 32 in Basic Neurochemistry terminal kinase/stress activated protein kinase in de(5th Edition, Eds Siegel, Albers, Agranoff, Molinoff), generating neurons in Alzheimer's disease. Journal of pp. 681-701. Neurochemistry 2001, 76: 435-441. 15. Goldstein and Betz, 1986. The Blood-Brain 9. Xu L. et al. Assess the in vivo activation of sigBarrier. Scientific American, September, 1986, pp. nal transduction pathways with Pathdetect® reporting 74-83. systems, Strategies 2001, 14 (1): 17-19. 16. WO 01/47920. 10. Guha M. and Mackman N. LPS induction of Комп’ютерна в ерстка Т.Чепелева Підписне Тираж 26 прим. Міністерство осв іт и і науки України Держав ний департамент інтелектуальної в ласності, вул. Урицького, 45, м. Київ , МСП, 03680, Україна ДП “Український інститут промислов ої в ласності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюPiperazine benzothiazole for treatment of cerebral ischemic disorders or cns disorders
Автори англійськоюGaillard Pascale, Gotteland Jean-Pierre, Vitte Pierre-Alain
Назва патенту російськоюПиперазинбензотиазолы для лечения церебральных ишемических поражений головного мозга или расстройств цнс
Автори російськоюГейяр Паскаль, Готтлан Жан-Пьер, Вит Пьер-Ален
МПК / Мітки
МПК: C07D 417/06, A61P 25/28
Мітки: засоби, цнс, розладів, мозку, піперазинбензотіазоли, лікування, ішемічних, головного
Код посилання
<a href="https://ua.patents.su/14-78035-piperazinbenzotiazoli-yak-zasobi-dlya-likuvannya-ishemichnikh-rozladiv-golovnogo-mozku-abo-rozladiv-cns.html" target="_blank" rel="follow" title="База патентів України">Піперазинбензотіазоли як засоби для лікування ішемічних розладів головного мозку або розладів цнс</a>
Попередній патент: Пристрій для вимірювання коєфіцієнта незалежності відліків випадкових процесів
Наступний патент: Спосіб вибору схеми лікування хворих на неходжкінські лімфоми
Випадковий патент: Вібратор


















