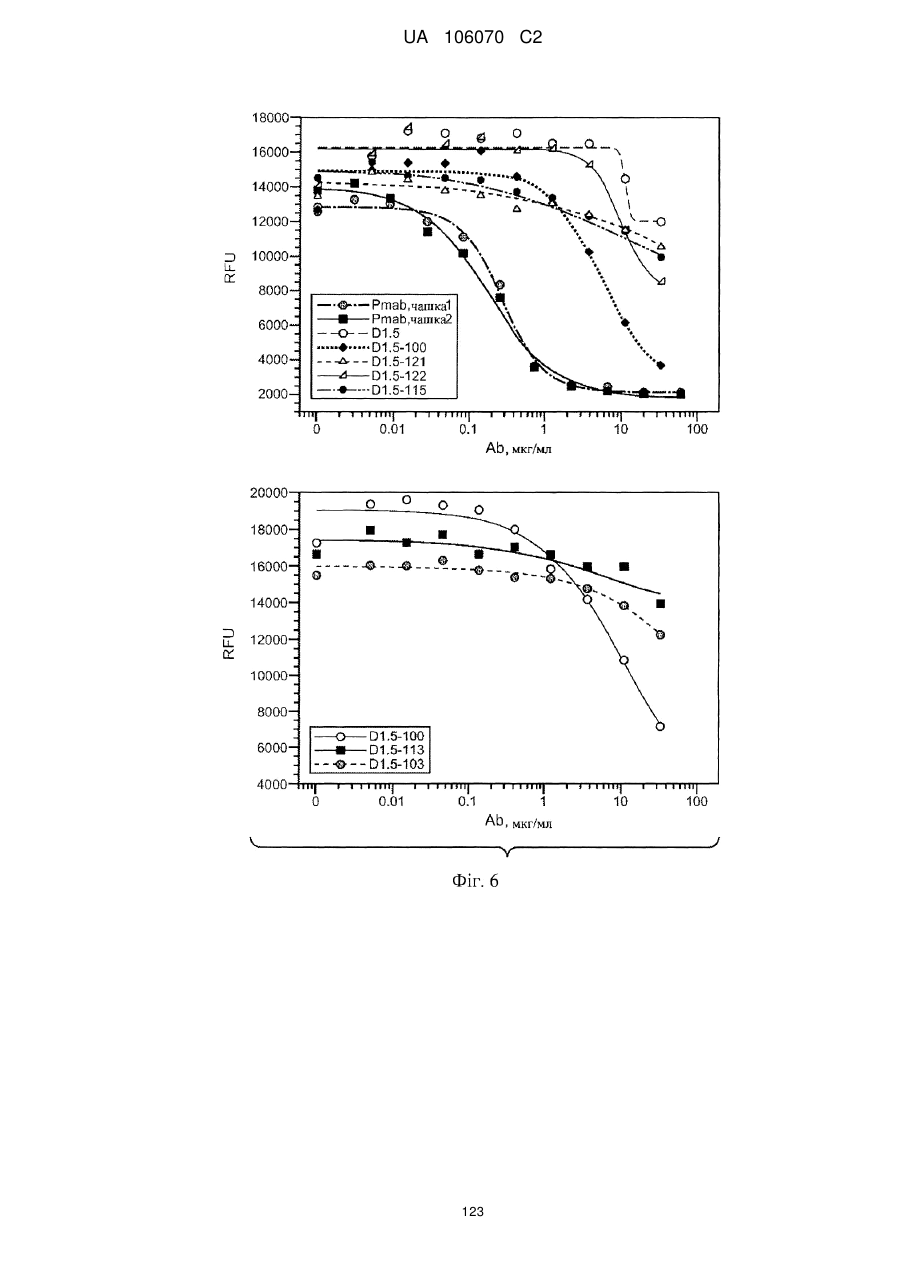
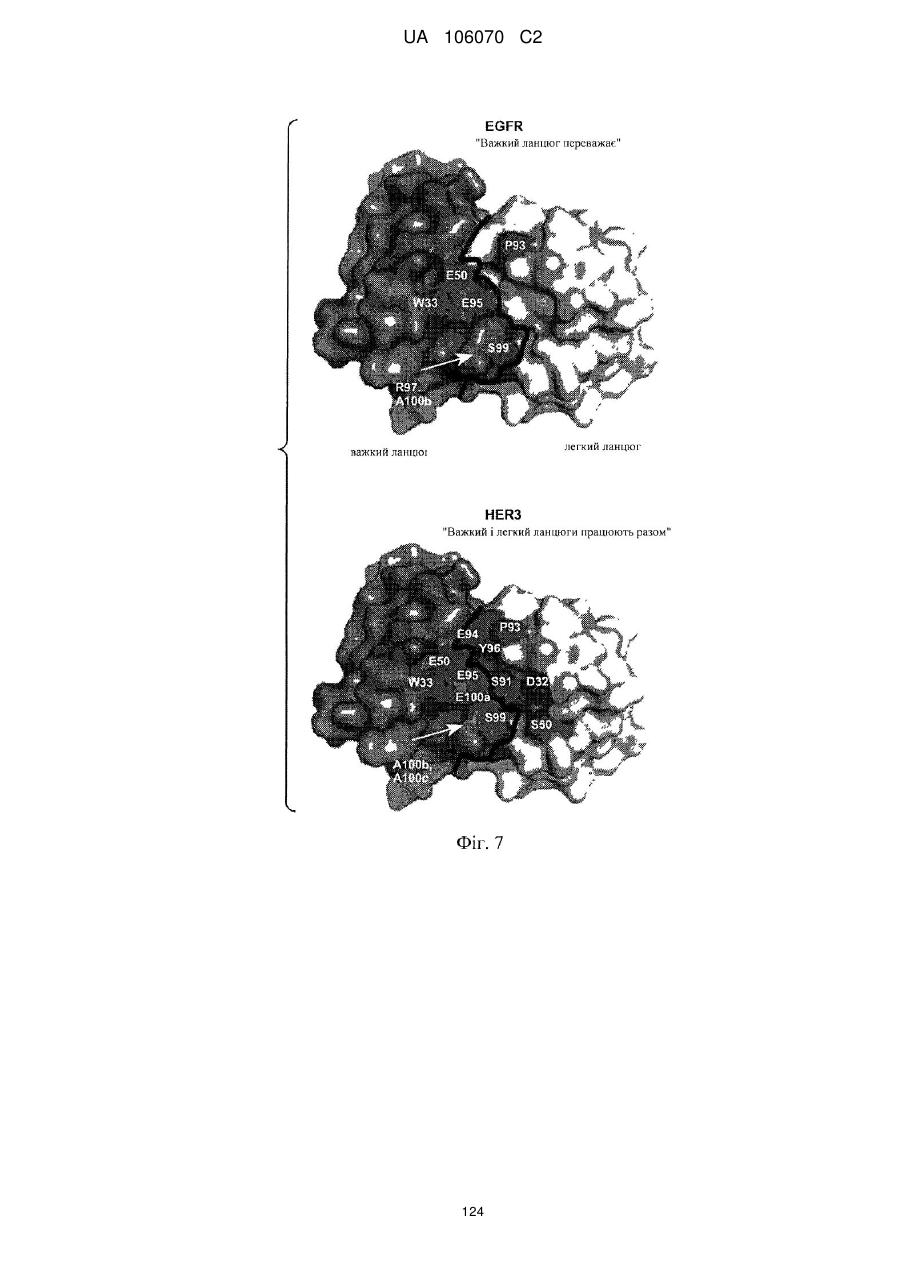
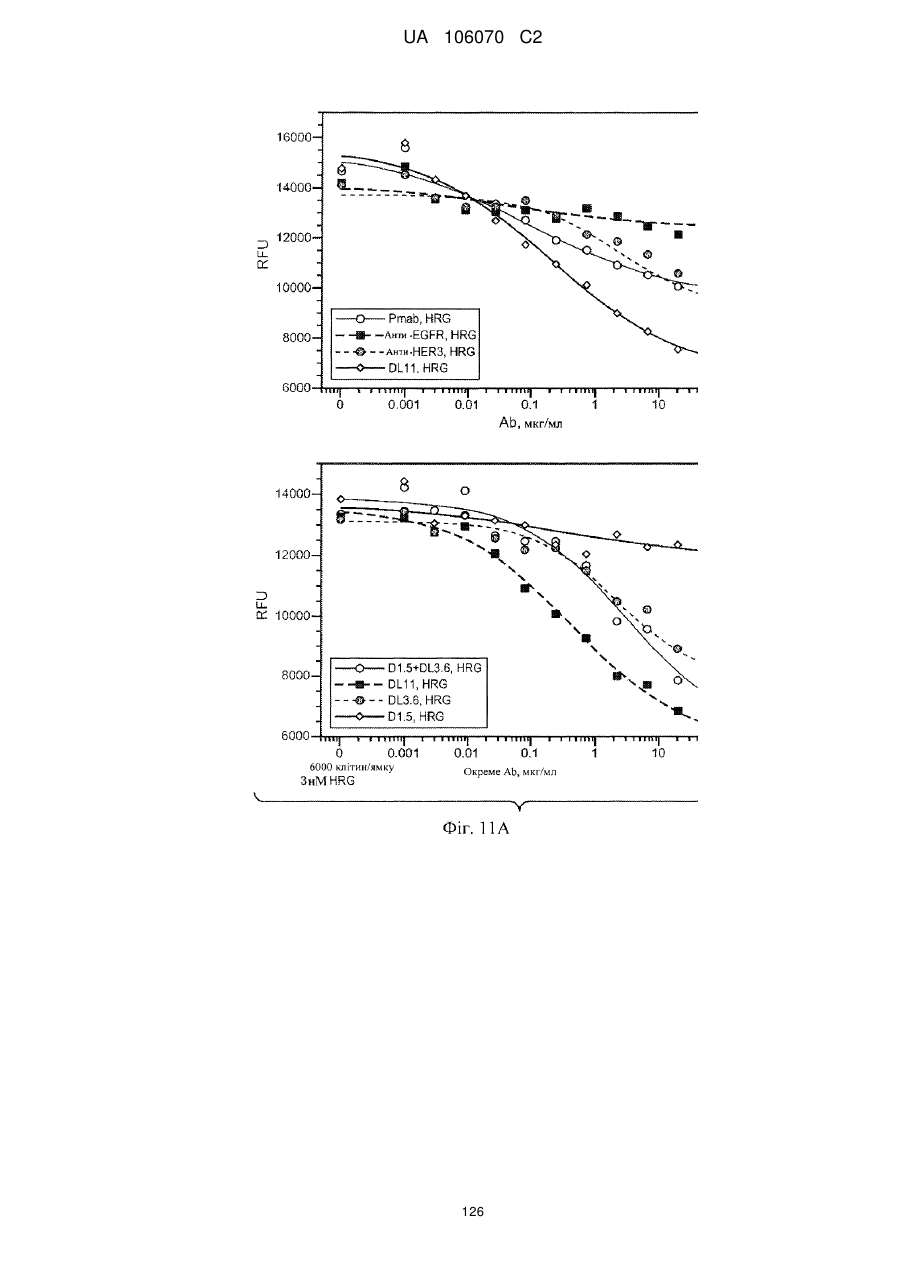
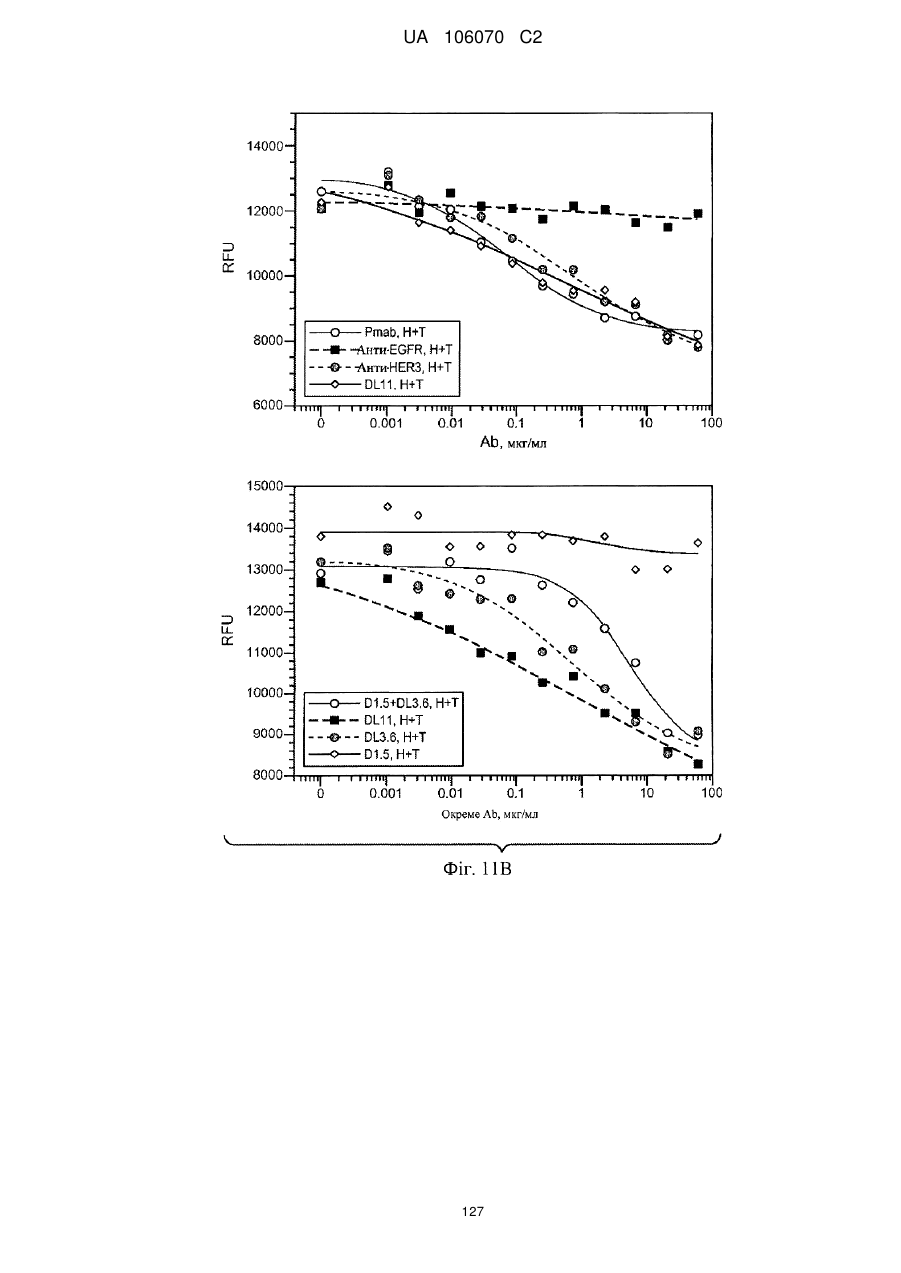
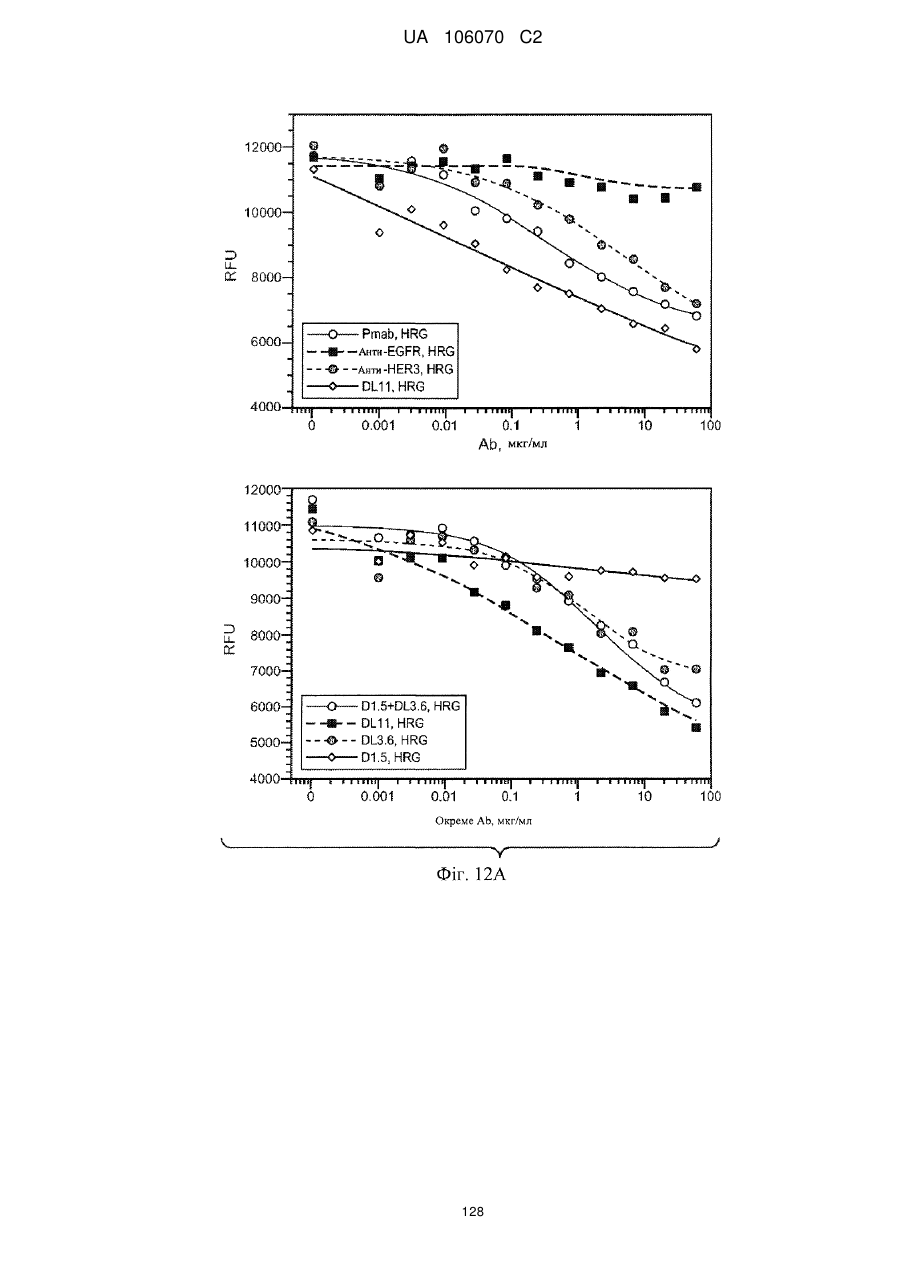
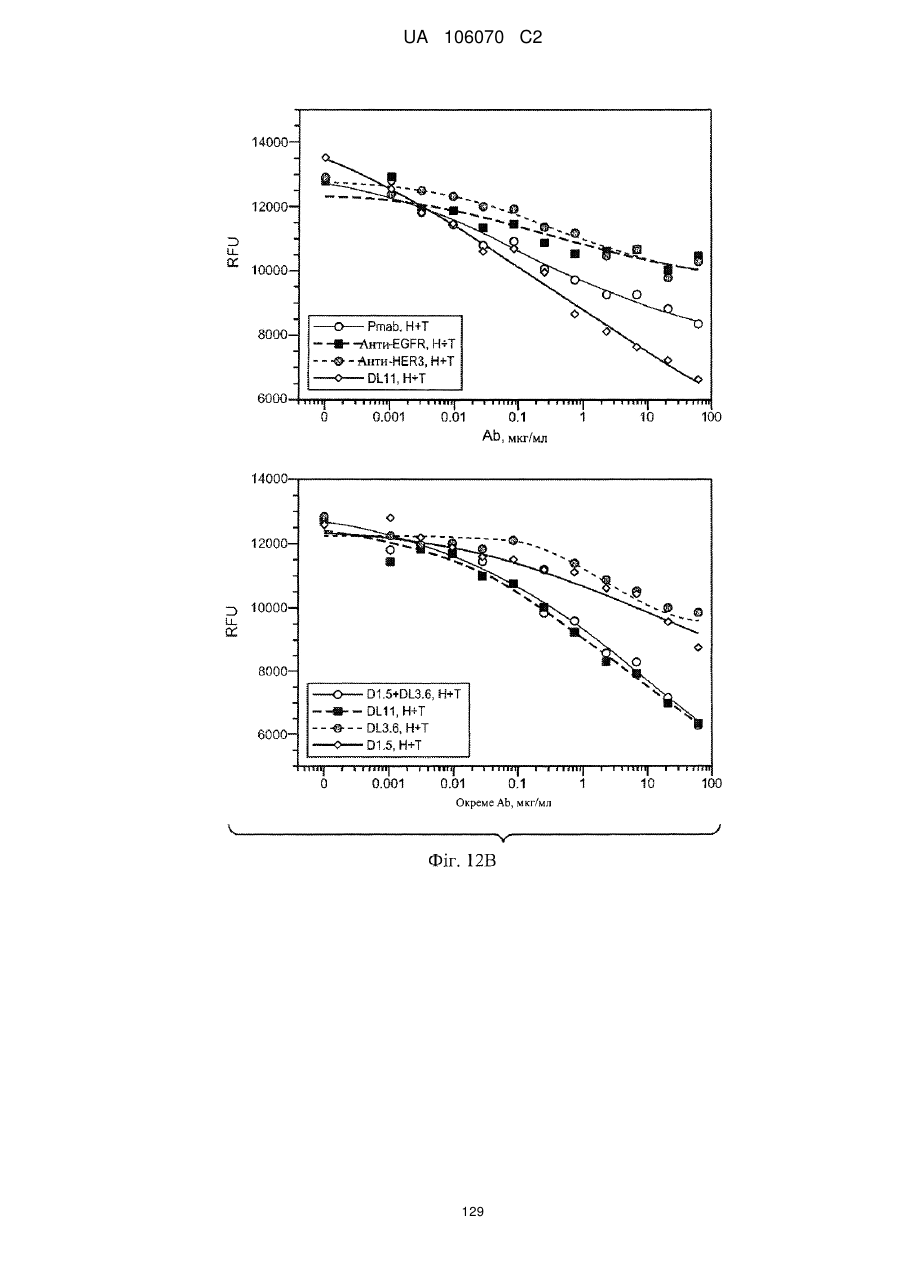
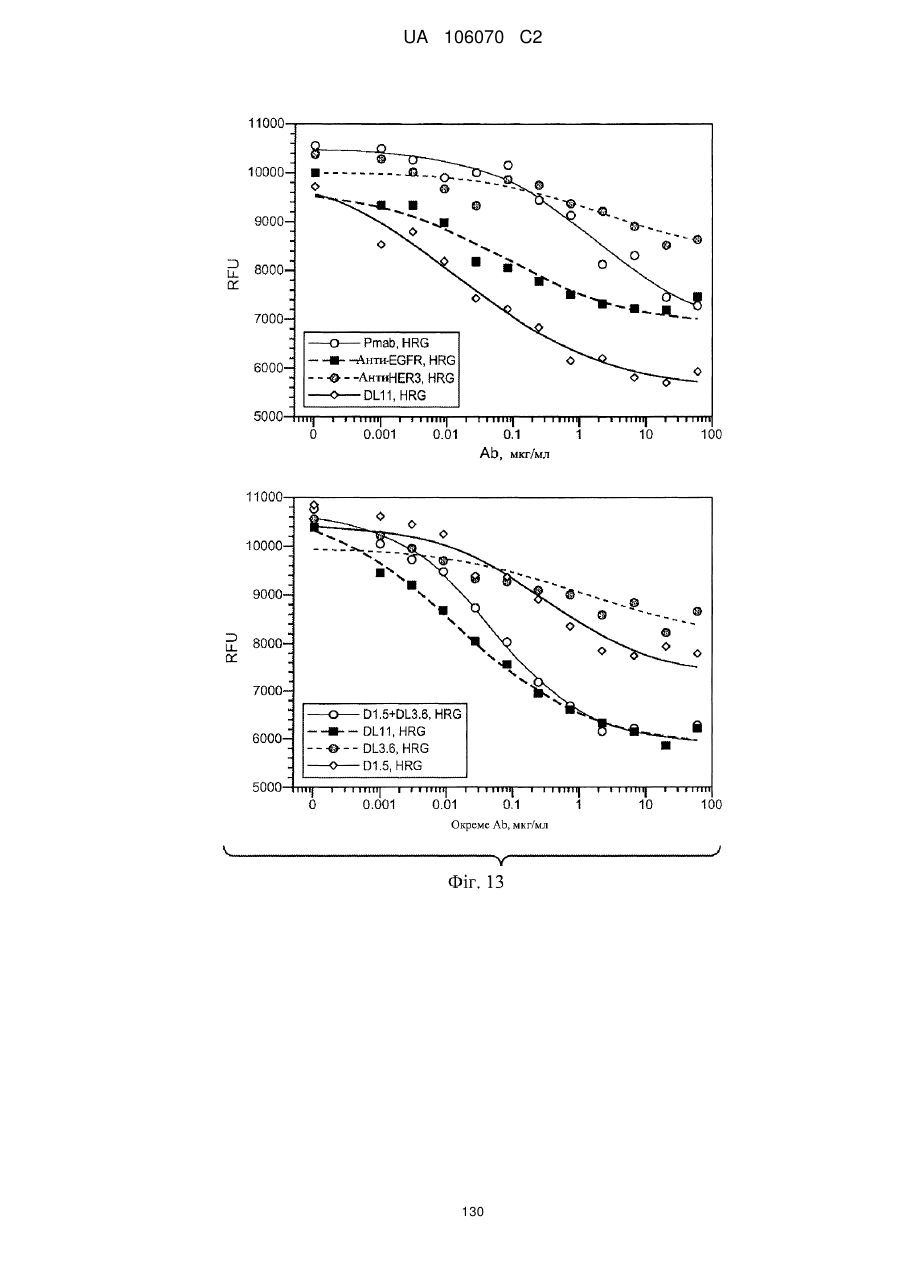
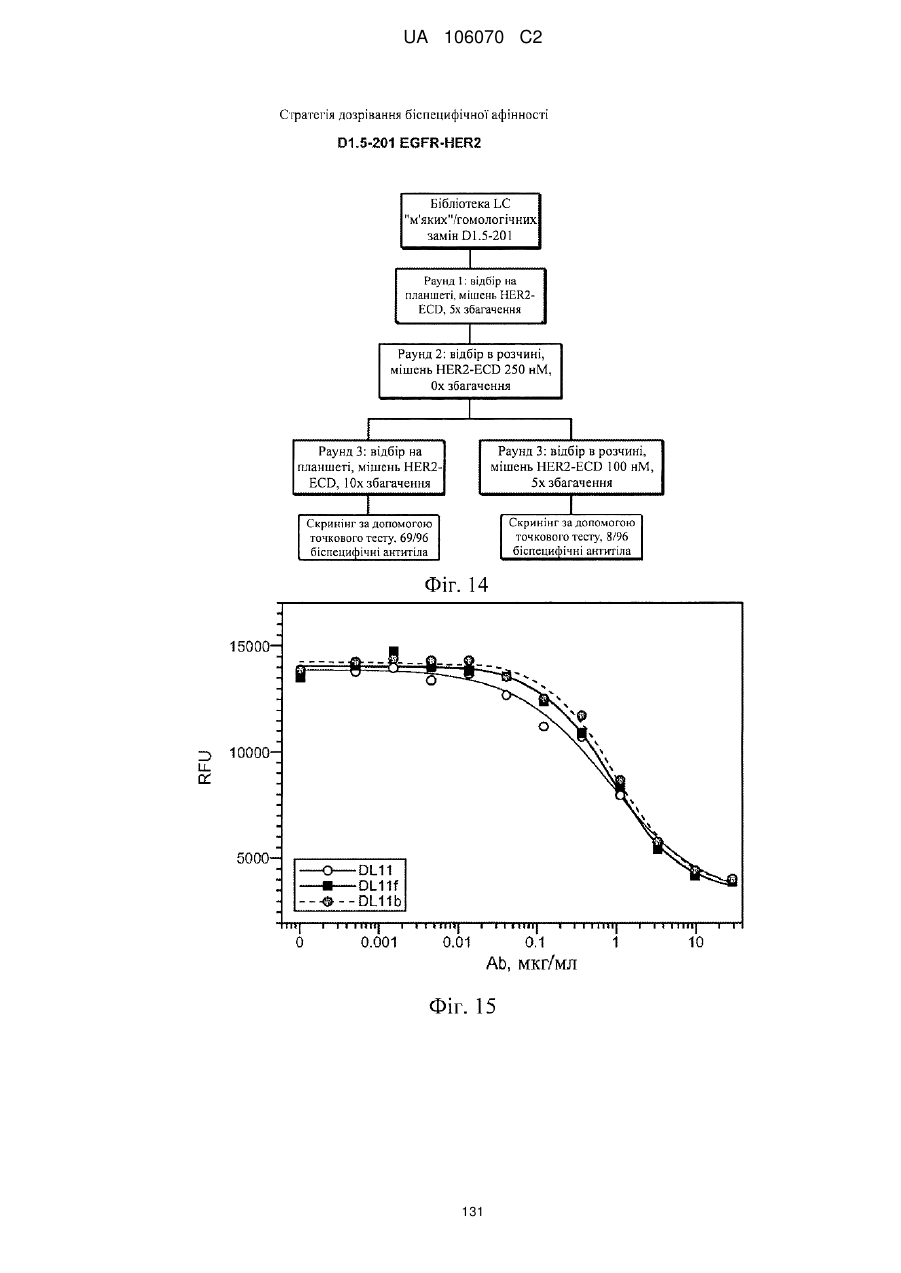
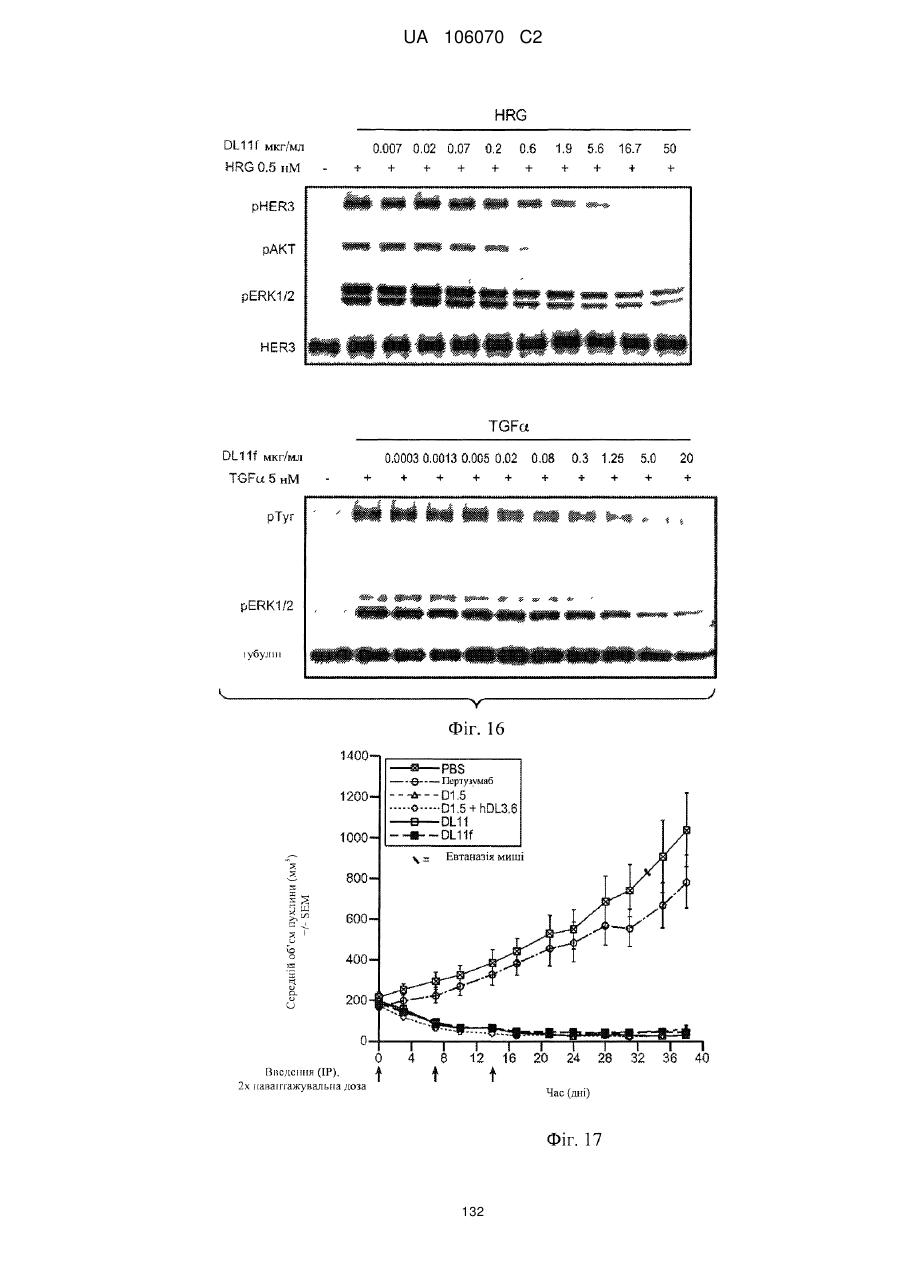
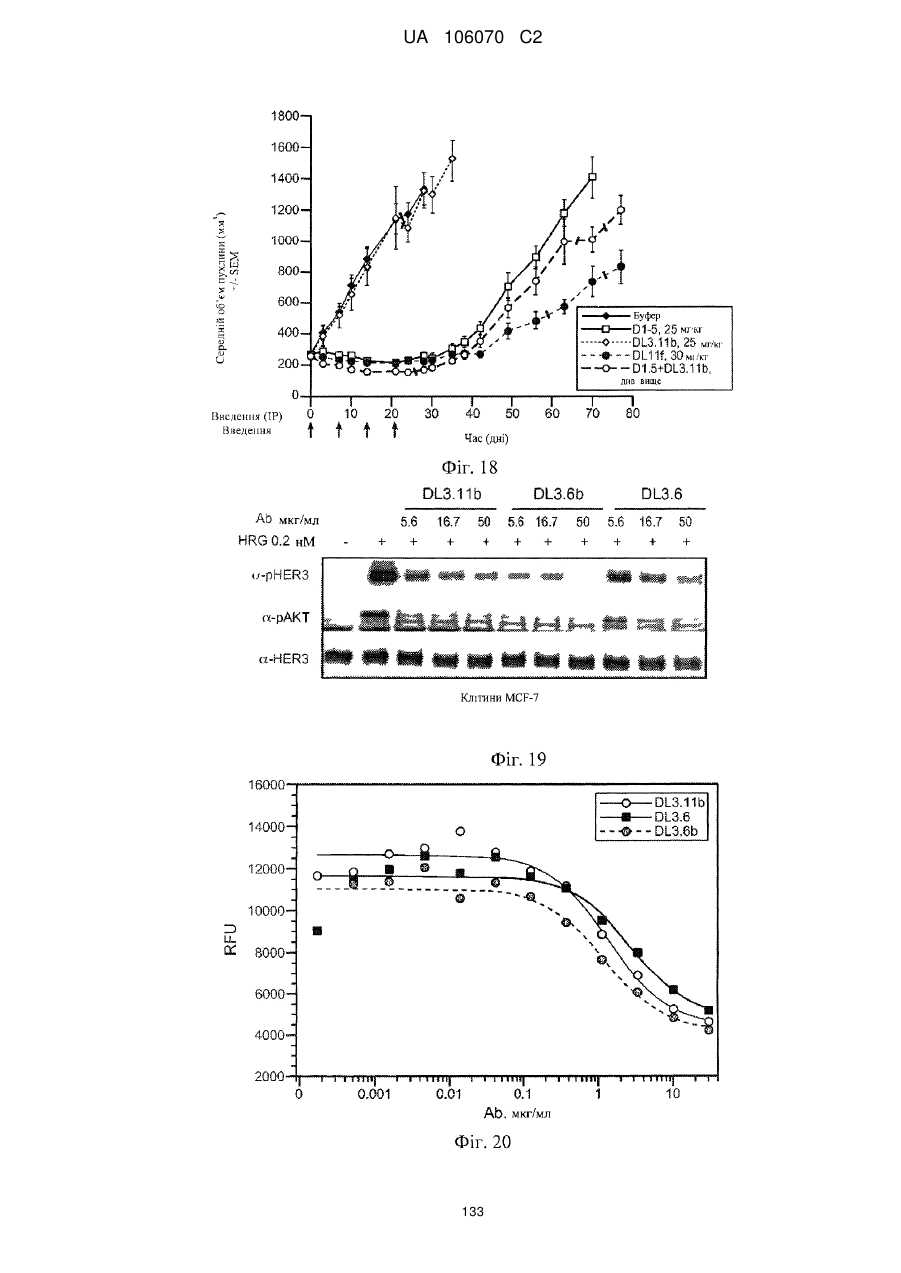
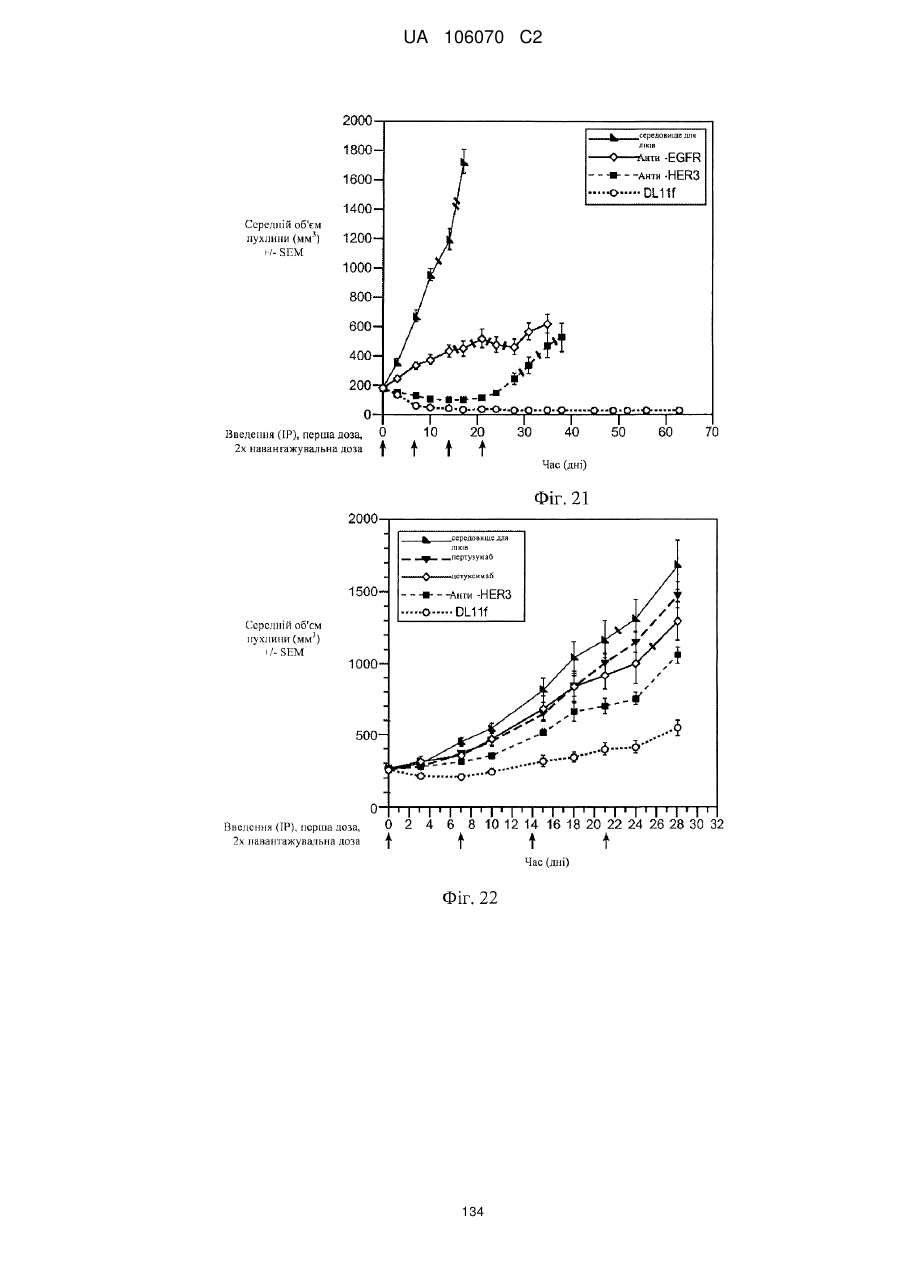
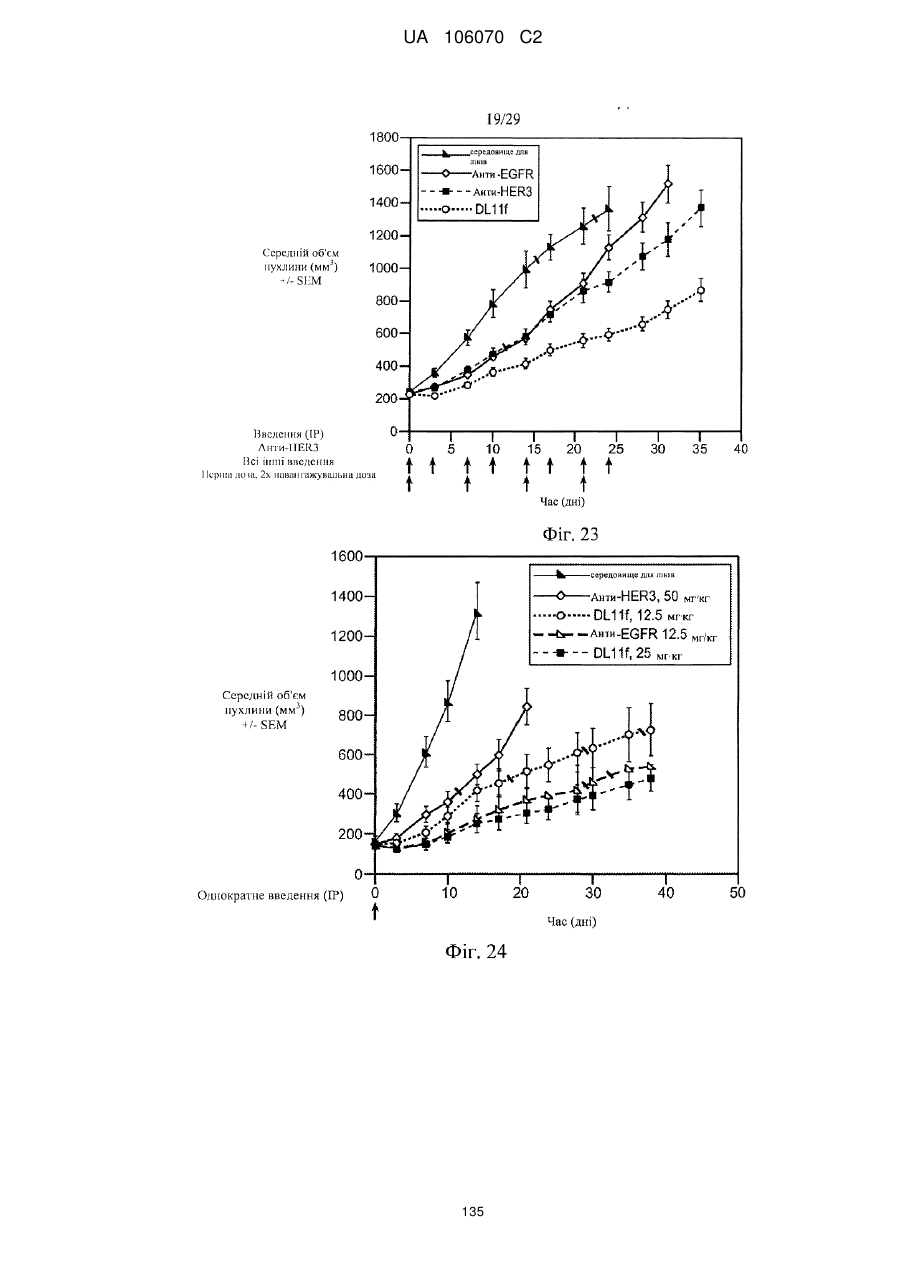
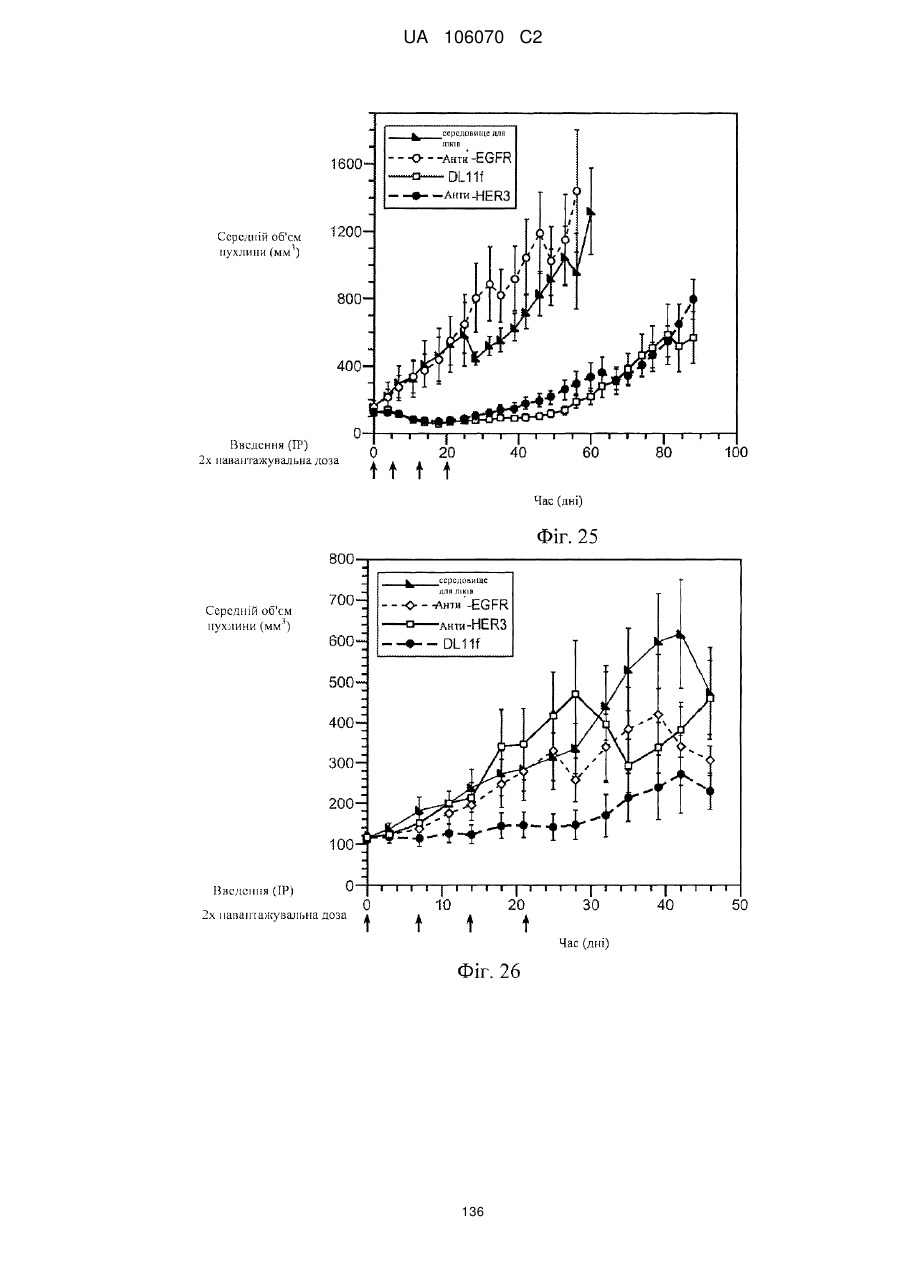
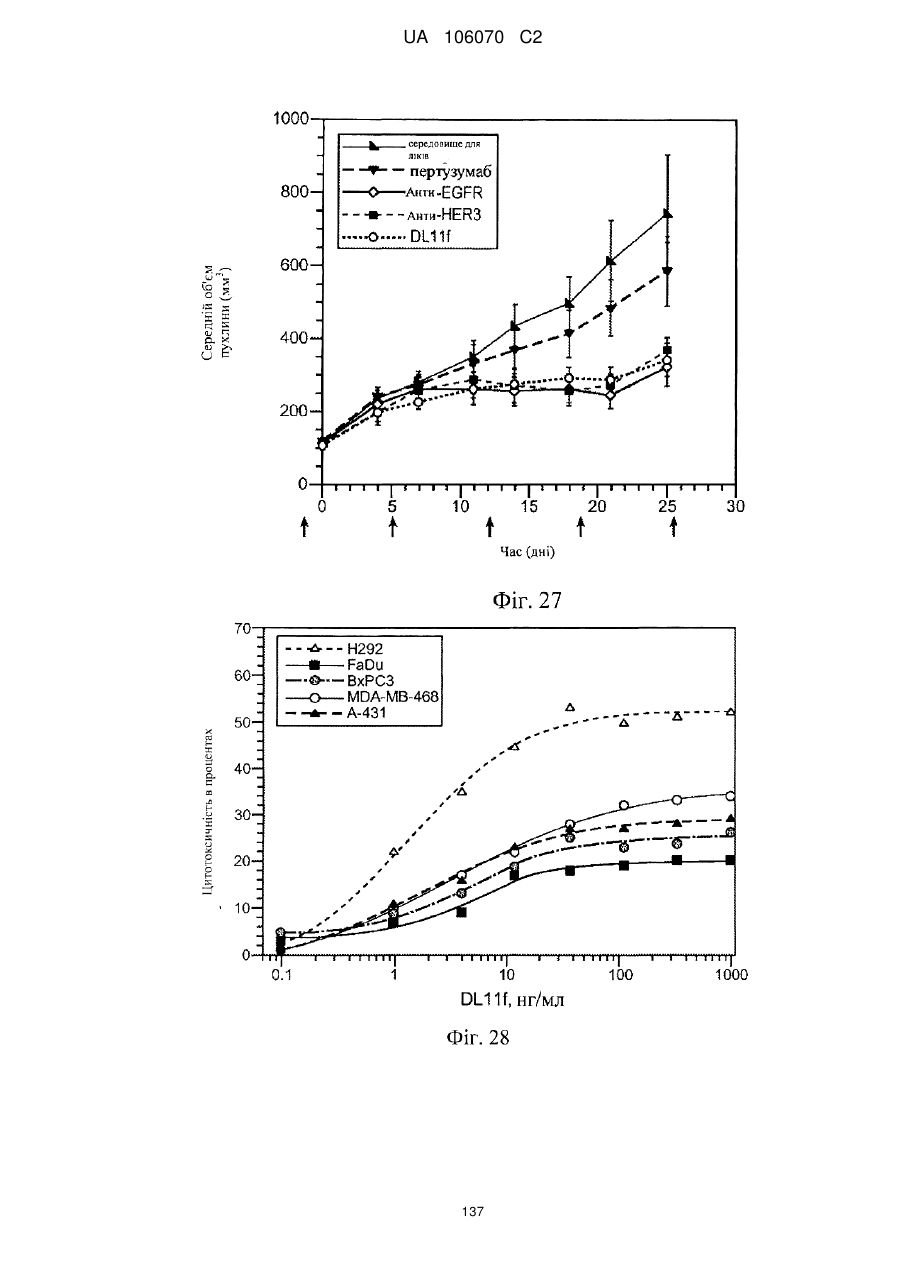
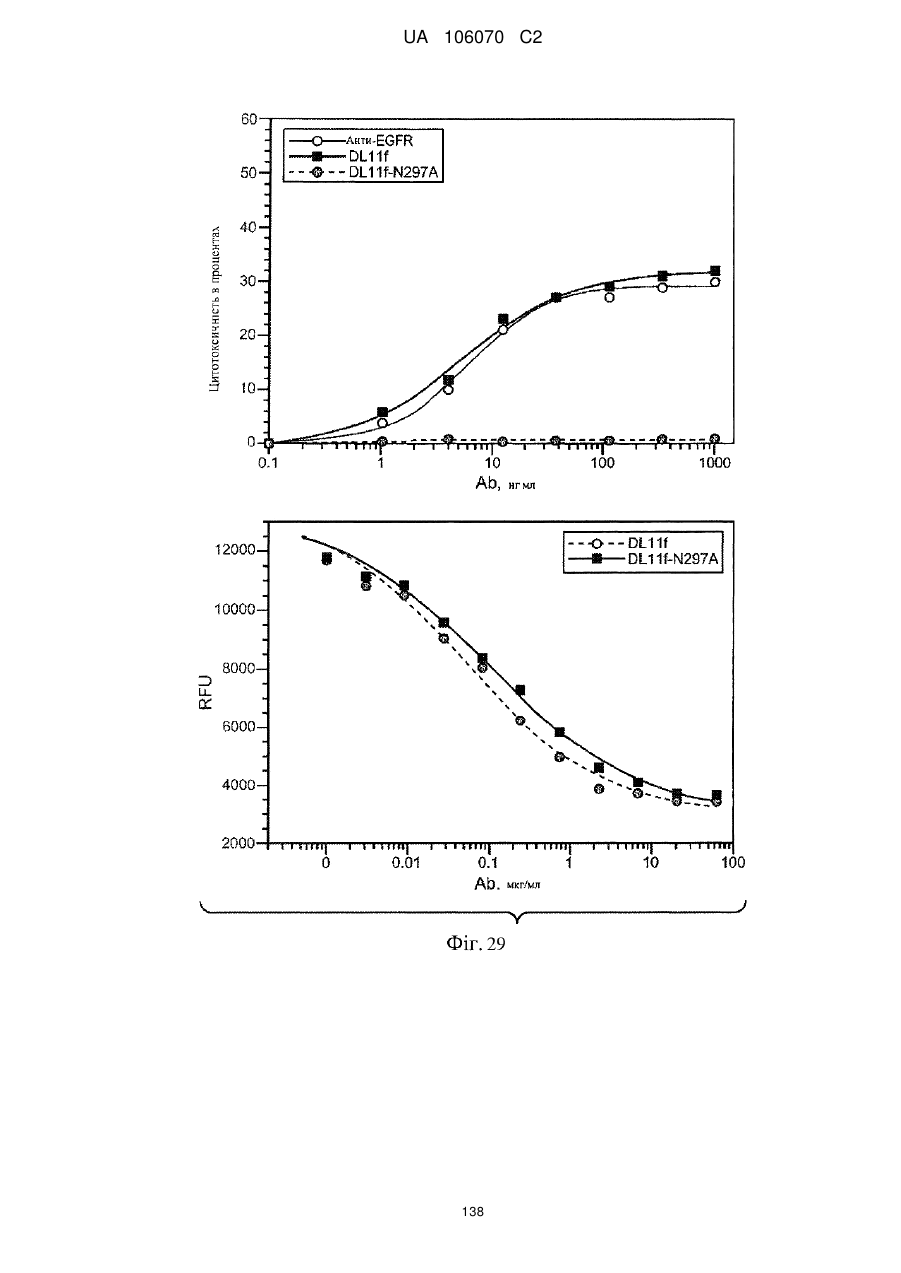
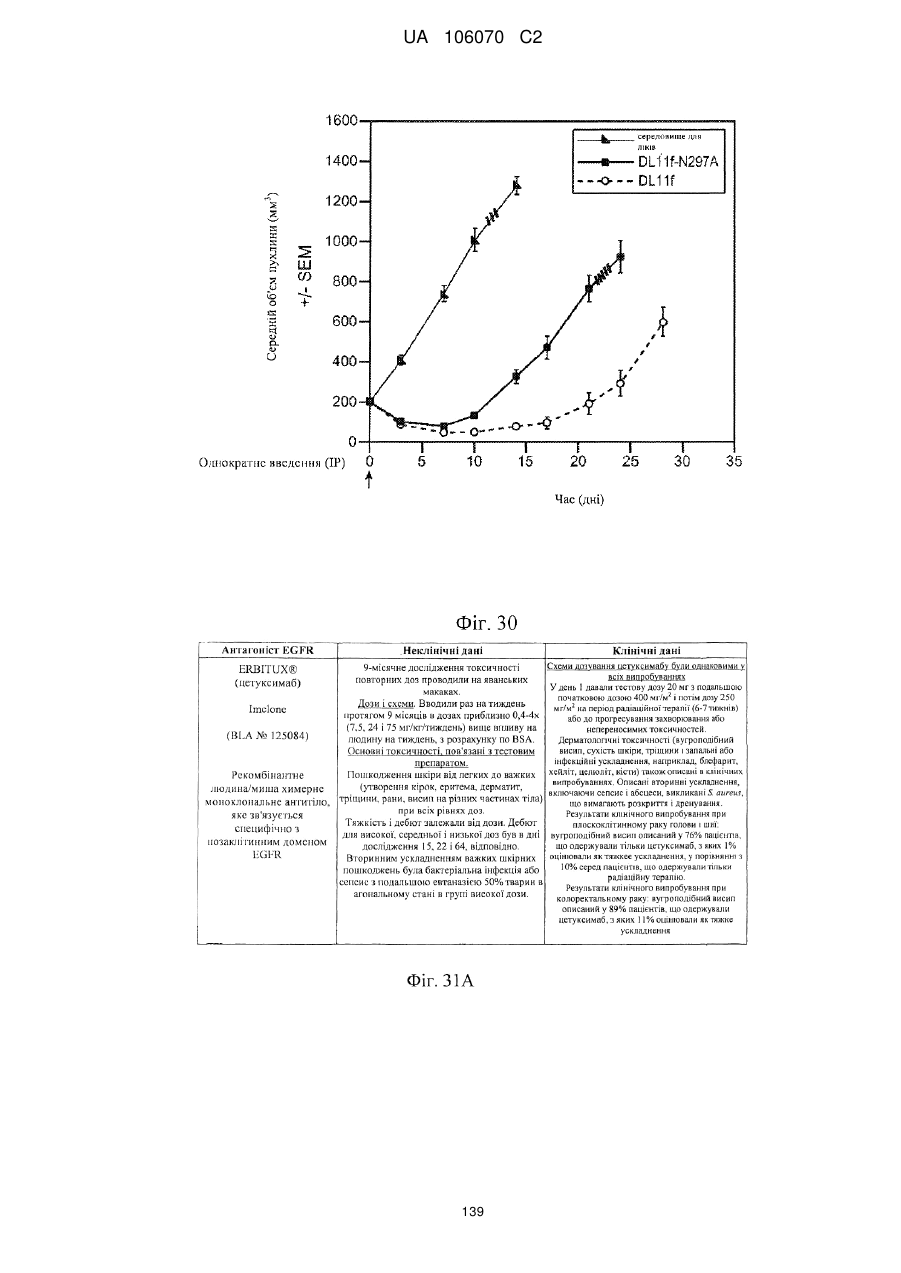
Антитіло, що специфічно зв’язується з egfr і her3
Номер патенту: 106070
Опубліковано: 25.07.2014
Автори: Фу Жермен, Слівковскі Марк К., Шефер Габріеле, Абер Лорік
Формула / Реферат
1. Виділене біспецифічне антитіло, яке містить послідовність варіабельного домену важкого ланцюга SEQ ID NO:30 і послідовність варіабельного домену легкого ланцюга SEQ ID NO:29, де антитіло специфічно зв′язується з EGFR і HER3.
2. Виділене біспецифічне антитіло, яке включає антигензв′язувальний домен, що специфічно зв′язується з EGFR і HER3, де антитіло включає:
(a) HVR-H1, що містить амінокислотну послідовність LSGDWIH (SEQ ID NO:48);
(b) HVR-H2, що містить амінокислотну послідовність VGEISAAGGYTD (SEQ ID NO:51); i
(c) IIVR-H3, що містить амінокислотну послідовність ARESRVSFEAAMDY (SEQ ID NO:53); і
(d) FIVR-L1, що містить амінокислотну послідовність NIATDVA (SEQ ID NO:55);
(e) HVR-L2, що містить амінокислотну послідовність SASF (SEQ ID NO:56); і
(f) FIVR-L3, що містить амінокислотну послідовність SEPEPYT (SEQ ID NO:57).
3. Виділене біспецифічне антитіло, яке включає антигензв′язувальний домен, що специфічно зв′язується з EGFR і HER3, де антитіло включає:
(a) HVR-H1, що містить амінокислотну послідовність LSGDWIH (SEQ ID NO:48);
(b) HVR-H2, що містить амінокислотну послідовність LGEISAAGGYTD (SEQ ID NO:50); i
(c) HVR-H3, що містить амінокислотну послідовність ARESRVSFEAAMDY (SEQ ID NO:53); і
(d) HVR-L1, що містить амінокислотну послідовність DLATDVA (SEQ ID NO:54);
(e) HVR-L2, що містить амінокислотну послідовність SASF (SEQ ID NO:56); і
(f) HVR-L3, що містить амінокислотну послідовність SEPEPYT (SEQ ID NO:57).
4. Виділене біспецифічне антитіло, яке включає антигензв′язувальний домен, що специфічно зв′язується з EGFR і HER3, де антитіло включає:
(a) HVR-H1, що містить амінокислотну послідовність LSGDWIH (SEQ ID NO:48);
(b) HVR-H2, що містить амінокислотну послідовність LGEISAAGGYTD (SEQ ID NO:50); i
(c) HVR-H3, що містить амінокислотну послідовність ARESRVSFEAAMDY (SEQ ID NO:53); і
(d) HVR-L1, що містить амінокислотну послідовність NIATDVA (SEQ ID NO:55);
(e) HVR-L2, що містить амінокислотну послідовність SASF (SEQ ID NO:56); і
(f) HVR-L3, що містить амінокислотну послідовність SEPEPYT (SEQ ID NO:57).
5. Виділене біспецифічне антитіло, що містить послідовність варіабельного домену важкого ланцюга SEQ ID NO:28 і послідовність варіабельного домену легкого ланцюга SEQ ID NO:27, де антитіло специфічно зв’язується з EGFR і HER3.
6. Виділене біспецифічне антитіло, що містить послідовність варіабельного домену важкого ланцюга SEQ ID NO:28 і послідовність варіабельного домену легкого ланцюга SEQ ID NO:29, де антитіло специфічно зв’язується з EGFR і HER3.
7. Антитіло за будь-яким з пунктів 1-6, де антитіло являє собою повнорозмірне антитіло IgG1.
8. Антитіло за п. 7, де антитіло проявляє активність ADDC.
9. Антитіло за будь-яким з пунктів 1-8 для застосування як ліків для лікування раку, де рак включає в себе клітини, які експресують EGFR і HER3.
10. Антитіло за будь-яким з пунктів 1-8 для використання при лікуванні раку, де рак включає в себе клітини, які експресують EGFR і HER3.
11. Антитіло за п. 9 або 10, де рак вибраний з групи, що складається з раку молочної залози, колоректального раку, раку підшлункової залози, раку голови і шиї, меланоми, раку яєчника, раку передміхурової залози і недрібноклітинного раку легені.
12. Виділена нуклеїнова кислота, що кодує антитіло за будь-яким з пунктів 1-8.
13. Клітина-хазяїн, що містить нуклеїнову кислоту за п. 12, де клітина здатна експресувати екзогенний генетичний матеріал.
14. Спосіб отримання антитіла, що включає культивування клітини-хазяїна за п. 13 таким чином, що виробляється антитіло.
15. Імунокон′югат, що містить антитіло за будь-яким з пунктів 1-8 та цитотоксичний агент, для використання при лікуванні раку, де рак включає в себе клітини, які експресують EGFR і HER3.
16. Фармацевтична композиція, яка містить ефективну кількість антитіла за будь-яким з пунктів 1-8 та фармацевтично прийнятий носій, для використання при лікуванні раку, де рак включає в себе клітини, які експресують EGFR і HER3.
17. Спосіб лікування суб′єкта, який страждає на рак, що включає введення суб′єкту ефективної кількості антитіла за будь-яким з пунктів 1-8, де рак включає в себе клітини, які експресують EGFR і HER3.
18. Спосіб за п. 17, де рак вибраний з групи, яка складається з раку молочної залози, колоректального раку, раку підшлункової залози, раку голови та шиї, меланоми, раку яєчника, раку передміхурової залози і недрібноклітинного раку легені.
19. Спосіб інгібування біологічної активності EGFR і/або HER3 у суб′єкта, що включає введення суб′єкту ефективної кількості антитіла за будь-яким з пунктів 1-8 для інгібування біологічної активності EGFR і/або HER3.
20. Антитіло за будь-яким з пунктів 1-8 для застосування в інгібуванні біологічної активності EGFR і/або HER3.
21. Застосування антитіла за будь-яким з пунктів 1-8 у виробництві ліків для лікування раку, де рак включає в себе клітини, які експресують EGFR і/або HER3.
22. Застосування за п. 21, де рак вибраний з групи, яка складається з раку молочної залози, колоректального раку, раку підшлункової залози, раку голови та шиї, меланоми, раку яєчника, раку передміхурової залози і недрібноклітинного раку печінки.
Текст
Реферат: Винахід належить до антитіла анти-HER, включаючи виділені біспецифічні антитіла, які специфічно зв′язуються з EGFR і HER3, композиції, що містить вказане антитіло, і способу застосування вказаних антитіл. UA 106070 C2 (12) UA 106070 C2 UA 106070 C2 5 10 15 20 25 30 35 40 45 50 55 60 Споріднені заявки Дана заявка вимагає перевагу пріоритету згідно з 35 USC § 119(е) США попередньої заявки №61/210562, зареєстрованої 20 березня 2009 р., розкриття якої включене тут за допомогою посилання у всій повноті. Галузь техніки, до якої належить винахід Даний винахід стосується антитіл анти-HER, включаючи мультиспецифічні антитіла антиHER зі специфічністю зв'язування щонайменше з двома різними рецепторами HER, і застосування антитіл для лікування захворювань або порушень. Рівень техніки винаходу Сімейство рецепторів HER тирозинкіназ являє собою важливі модулятори росту, диференціації і виживання клітин. Сімейство рецепторів включає чотири різних представники, включаючи рецептор епідермального фактора росту (EGFR, ErbBl або HER1), HER2 (ErbB2 або neu p185 ), HER3 (ErbB3) і HER4 (ErbB4 або tyro2). EGFR, кодований геном erbB1, залучається до процесу злоякісного росту у людини. Зокрема, підвищену експресію EGFR спостерігали при раку молочної залози, сечового міхура, легенів, голови, шиї і при раку шлунка, а також при гліобластомах. Підвищена експресія рецептора EGFR часто асоційована з підвищеною продукцією ліганду EGFR, трансформуючого фактора росту альфа (TNF-α), тими ж самими пухлинними клітинами, що приводить в результаті до активації рецепторів через шлях аутокринної стимуляції. Baselga and Mendelsohn Pharmac. Ther. 64:127-154 (1994). Моноклональні антитіла проти EGFR або його лігандів, TNF-α і EGF, розглядаються як терапевтичні засоби при лікуванні вказаних злоякісних новоутворень. Див., наприклад, Baselga and Mendelsohn., вище; Masui et al. Cancer Research 44:1002-1007 (1984); і Wu et al. J. Clin. Invest. 95:1897-1905 (1995). neu Другий представник сімейства HER, HER2 (p185 ), спочатку був ідентифікований як продукт трансформуючого гена, виділеного з нейробластом щурів, яким вводили хімічний препарат. Активована форма протоонкогена neu виникає внаслідок точкової мутації (заміна валіну на глутамінову кислоту) в трансмембранній ділянці кодованого білка. Ампліфікація людського гомолога neu спостерігається при раку молочної залози і яєчника, і вона корелює з несприятливим прогнозом (Slamon et al. Science, 235:177-182 (1987); Slamon et al. Science, 244:707-712 (1989); і патент США № 4968603). Підвищена експресія HER2 (часто, але не завжди, внаслідок ампліфікації гена) також спостерігалася при інших карциномах, включаючи карциноми шлунка, ендометрія, слинної залози, легенів, нирок, товстої кишки, щитовидної залози, підшлункової залози і сечової міхура. Див., нарівні з іншим, King et al. Science, 229:974 (1985); Yokota et al. Lancet: 1:765-767 (1986); Fukushige et al. Mol. Cell Biol, 6:955-958 (1986); Guerin et al. Oncogene Res., 3:21-31 (1988); Cohen et al. Oncogene, 4:81-88 (1989); Yonemura et al. Cancer Res., 51:1034 (1991); Borst et al. Gynecol. Oncol., 38:364 (1990); Weiner et al. Cancer Res., 50:421-425 (1990); Kern et al. Cancer Res., 50:5184 (1990); Park et al. Cancer Res., 49:6605 (1989); Zhau et al. Mol. Carcinog., 3:254-257 (1990); Aasland et al. Br. J. Cancer 57:358-363 (1988); Williams et al. Pathobiology 59:46-52 (1991); і McCann et al. Cancer, 65:88-92 (1990). HER2 може суперекспресуватися при раку передміхурової залози (Gu et al. Cancer Lett. 99: 185-9 (1996); Ross et al. Hum. Pathol. 28:827-33 (1997); Ross et al. Cancer 79:2162-70 (1997); і Sadasivan et al. J. Urol. 150:126-31 (1993)). neu Описані антитіла проти білкових продуктів p185 щура і HER2 людини. Drebin і колеги neu одержали антитіла проти продукту гена neu щурів, p185 . Див., наприклад, Drebin et al. Cell 41:695-706 (1985); Myers et al. Meth. Enzym. 198:277-290 (1991); і міжнародний патент WО 94/22478. Drebin et al. Oncogene 2:273-277 (1988) показали, що суміші антитіл, реагуючі з двома окремими ділянками p185neu, приводять до синергічних протипухлинних ефектів на neuтрансформованих клітинах NIH-3T3, імплантованих мишам nude. Див. також патент США № 5824311, опублікований 20 жовтня 1998 р. Hudziak et al. Mol. Cell. Biol. 9(3):1165-1172 (1989) описують створення панелі антитіл HER2, які були охарактеризовані із застосуванням клітинної лінії раку молочної залози людини SK-BR3. Відносну проліферацію клітин SK-BR-3 після експозиції з антитілами визначали по забарвленню моношарів кристалічним фіолетовим через 72 години. При використанні вказаного тесту, максимальне інгібування одержували з антитілом, названим 4D5, яке інгібувало клітинну проліферацію на 56 %. Інші антитіла в панелі вказаного тесту зменшували клітинну проліферацію в меншій мірі. Було також показано, що антитіло 4D5 підвищує чутливість клітинних ліній раку молочної залози з надпродукцією HER2 до цитотоксичних ефектів TNF-α. Див. також патент США № 5677171, опублікований 14 жовтня 1997. Антитіла HER2, описані Hudziak et al., крім того охарактеризовані Fendly et al. Cancer Research 50:1550-1558 (1990); Kotts et al. In Vitro 26(3):59A (1990); Sarup et al. Growth Regulation 1:72-82 (1991); Shepard et al. J. 1 UA 106070 C2 5 10 15 20 25 30 35 40 45 5055 60 Clin. Immunol. 11(3):117-127 (1991); Kumar et al. Mol. Cell. Biol. 11(2):979-986 (1991); Lewis et al. Cancer Immunol. Immunother. 37:255-263 (1993); Pietras et al. Oncogene 9:1829-1838 (1994); Vitetta et al. Cancer Research 54:5301-5309 (1994); Sliwkowski et al. J. Biol. Chem. 269(20):1466114665 (1994); Scott et al. J. Biol. Chem. 266:14300-5 (1991); D'souza et al. Proc. Natl. Acad. Sci. 91:7202-7206 (1994); Lewis et al. Cancer Research 56:1457-1465 (1996); і Schaefer et al. Oncogene 15:1385-1394 (1997). Рекомбінантна гуманізована версія мишачого HER2-антитіла 4D5 (huMAb4D5-8, rhuMAb HER2, трастузумаб або HERCEPTEST®; патент США № 5821337) клінічно активна у пацієнтів з метастазуючими раковими пухлинами молочної залози з надпродукцією HER2, яким проводилася попередня велика протиракова терапія (Baselga et al., J. Clin. Oncol. 14:737-744 (1996)). Трастузумаб був схвалений Агентством по контролю за лікарськими і харчовими продуктами США 25 вересня 1998 року для лікування пацієнтів з метастазуючими раковими пухлинами молочної залози, у випадках, коли вказані пухлини експресують в підвищених кількостях білок HER2. У літературі також описані інші антитіла до HER2 з різними властивостями Tagliabue et al. Int. J. Cancer 47:933-937 (1991); McKenzie et al. Oncogene 4:543-548 (1989); Maier et al. Cancer Res. 51:5361-5369 (1991); Bacus et al. Molecular Carcinogenesis 3:350-362 (1990); Stancovski et al. PNAS (USA) 88:8691-8695 (1991); Bacus et al. Cancer Research 52:2580-2589 (1992); Xu et al. Int. J. Cancer 53:401-408 (1993); в міжнародному патенті WO 94/00136; Kasprzyk et al. Cancer Research 52:2771-2776 (1992); Hancock et al. Cancer Res. 51:4575-4580 (1991); Shawver et al. Cancer Res. 54:1367-1373 (1994); Arteaga et al. Cancer Res. 54:3758-3765 (1994); Harwerth et al. J. Biol. Chem. 267:15160-15167 (1992); в патенті США № 5783186; і Klapper et al. Oncogene 14:2099-2109 (1997). Скринінг з метою виявлення гомологів привів до ідентифікації двох інших членів сімейства рецепторів HER; HER3 (патенти США №№ 5968511, 5183884 і 5480968, а також Kraus et al. PNAS (USA) 86:9193-9197 (1989)) і HER4 (EP Pat Appln № 599,274; Plowman et al. Proc. Natl. Acad. Sci. USA, 90:1746-1750 (1993); і Plowman et al. Nature, 366:473-475 (1993)). Обидва вказаних рецептори виявляють підвищену експресію щонайменше в деяких клітинних лініях раку молочної залози. Рецептори HER в основному знайдені в різних сполученнях в клітинах і вважається, що гетеродимеризація підвищує різноманітність клітинних відповідей на множину лігандів HER (Earp et al. Breast Cancer Research and Treatment 35: 115-132 (1995)). EGFR зв'язується з шістьма різними лігандами: епідермальний фактор росту (EGF), трансформуючий фактор росту альфа (TGF-α), амфірегулін, гепаринзв'язувальний епідермальний фактор росту (HB-EGF), бетацелюлін і епірегулін (Groenen et al. Growth Factors 11:235-257 (1994)). Сімейство білків херегулінів, одержуваних при альтернативному сплайсингу одного гена, надає ліганди для HER3 і HER4. Сімейство херегуліну включає в себе херегуліни альфа, бета і гамма (Holmes et al. Science, 256: 1205-1210 (1992); патент США № 5641869; і Schaefer et al. Oncogene 15:13851394 (1997)); фактори диференціації neu (NDFs), гліальні фактори росту (GGFs); фактор, індукуючий активність ацетилхолінового рецептора (ARIA); і фактор, утворюваний з сенсорних і рухових нейронів (SMDF). Для огляду див. Groenen et al. Growth Factors 11:235-257 (1994); Lemke, G. Molec. & Cell. Neurosci. 7:247-262 (1996); і Lee et al. Pharm. Rev. 47:51-85 (1995). Ідентифіковані три додаткових ліганди HER: нейрегулін-2 (NRG-2), який, як повідомляється, зв'язується або з HER3, або з HER4 (Chang et al. Nature 387 509-512 (1997); і Carraway et al Nature 387:512-516 (1997)); нейрегулін-3, який зв'язується з HER4 (Zhang et al. PNAS (USA) 94(18):9562-7 (1997)); і нейрегулін-4, який зв'язується з HER4 (Harari et al. Oncogene 18:2681-89 (1999)), HB-EGF, бетацелюлін і епірегулін також зв'язуються з HER4. У той час як EGF і TGF-α не зв'язуються з HER2, EGF стимулює EGFR і HER2 до утворення гетеродимеру, який активує EGFR, що приводить до трансфосфорилування HER2 в гетеродимері. Димеризація і/або трансфосфорилування, мабуть, активують тирозинкіназу HER2 (див. Earp et al. вище). Аналогічним чином, в тому випадку, коли HER3 експресується спільно з HER2, формується активний сигнальний комплекс, і антитіла, направлені проти HER2, здатні руйнувати вказаний комплекс (Sliwkowski et al. J. Biol. Chem., 269(20): 14661-14665 (1994)). Крім того, афінність HER3 до херегуліну (HRG) зростає до вищого рівня афінності, у випадку спільної експресії HER3 і HER2 (див. також Levi et. al. Journal of Neuroscience 15: 1329-1340 (1995); Morrissey et al. Proc. Natl. Acad. Sci. USA 92: 1431-1435 (1995); і Lewis et al. Cancer Res., 56:14571465 (1996) в тому, що стосується білкового комплексу HER2-HER3. HER4, подібно HER3, утворює сигнальний комплекс з HER2 (Carraway and Cantley, Cell 78:5-8 (1994)). Ліки, які впливають на сигнальну систему HER, на даний час застосовуються в лікуванні захворювань, таких як рак молочної залози, недрібноклітинний рак легені, колоректальний рак, 2 UA 106070 C2 5 10 15 20 25 30 35 40 45 50 55 60 рак голови і шиї і рак підшлункової залози. У той час як застосування вказаних ліків мало деякий успіх, залишаються проблеми, пов'язані з нативною і викликаною стійкістю і токсичністю. Arteaga C. L. J Clin Oncol 21:289-91 (2003); Hoshi S. et al., Gan To Kagaku Ryoho 31:1209-13 (2004); Viloria-Petit A. M. and Kerbel R. S. Int J Radiat Oncol Biol Phys 58:914-26 (2004); Bianco R. et al. Endocr Relat Cancer 12:S159-71 (2005); Engelman J. A. and Janne P. A. Clin Cancer Res 14:2895-9 (2008); Davoli А. et al. Cancer Chemother Pharmacol. 65(4):611-23 (2010); Pohlmann P. R. et al. Clin Cancer Res. 15(24):7479-7491 (2009). Зокрема, ліки, які впливають наHER1 (EGFR), часто асоційовані з небажаними побічними ефектами, такими як значні рівні шкірної токсичності (Robert et al. Lancet Oncology 6:491-500 (2005)). Таким чином, існує потреба в створенні поліпшених ліків, які впливають на сигнальну систему HER. Суть винаходу Винахід надає мультиспецифічні антитіла, що містять антигензв'язувальний домен, який специфічно зв'язується щонайменше з двома рецепторами HER, вибраними з групи, що складається з (a) EGFR і HER2, (b) EGFR і HER3, і (с) EGFR і HER4. Антитіло інгібує біологічну активність щонайменше одного з рецепторів HER. У конкретних варіантах здійснення мультиспецифічне антитіло специфічно зв'язується зі своїми мішенями, HER-рецепторами, і не зв'язується специфічно з HER-рецепторами, що не є мішенями. Таким чином, в одному варіанті здійснення антитіло специфічно зв'язується з EGFR і HER3, але не зв'язується специфічно з HER2 або HER4. У іншому варіанті здійснення антитіло специфічно зв'язується з EGFR і HER2, але не зв'язується специфічно з HER3 або HER4. У іншому варіанті здійснення антитіло специфічно зв'язується з EGFR і HER4, але не зв'язується специфічно з HER2 або HER3. Винахід також передбачає моноспецифічні антитіла, які специфічно зв'язуються з HERрецептором-мішенню. Один аспект винаходу передбачає мультиспецифічні антитіла, які здатні до специфічного зв'язування з EGFR і іншим HER-рецептором, які є менш токсичними, ніж загальноприйняті антагоністи EGFR, такі як цетуксимаб. У одному варіанті здійснення токсичність являє собою дерматологічну токсичність. У одному варіанті здійснення мультиспецифічне HER-антитіло включає в себе антигензв'язувальний домен, який специфічно зв'язується з EGFR і HER3. У одному аспекті винахід надає мультиспецифічне антитіло, що містить антигензв'язувальний домен, який специфічно зв'язується з EGFR і HER3. У одному варіанті здійснення мультиспецифічне антитіло є менш токсичним, ніж антагоністи EGFR. У одному варіанті здійснення мультиспецифічне антитіло інгібує біологічну активність щонайменше одного з EGFR і HER3. У одному варіанті здійснення антитіло інгібує зв'язування EGF з EGFR. У іншому варіанті здійснення антитіло інгібує фосфорилування EGFR, індуковане TGF-α. У деяких варіантах здійснення антитіло інгібує ріст пухлинних клітин. У одному варіанті здійснення мультиспецифічне антитіло специфічно зв'язується з EGFR і HER3, але не зв'язується специфічно з HER2 або HER4. У одному варіанті здійснення мультиспецифічне антитіло включає в себе -6 антигензв'язувальний домен, який специфічно зв'язується з EGFR і HER3 з Kd менше 10 M. У одному варіанті здійснення мультиспецифічне антитіло включає в себе антигензв'язувальний -6 домен, який специфічно зв'язується з EGFR з Kd менше ніж 10 M і специфічно зв'язується з -7 HER3 з Kd менше ніж 10 M. У одному варіанті здійснення мультиспецифічне антитіло, що містить антигензв'язувальний домен, який специфічно зв'язується з EGFR і HER3, включає в себе (a) HVR-H1, що містить амінокислотну послідовність LSGDWIH (SEQ ID NO: 48); (b) HVR-H2, що містить амінокислотну послідовність VGEISAAGGYTD (SEQ ID NO: 51); і (с) HVR-H3, що містить амінокислотну послідовність ARESRVSFEAAMDY (SEQ ID NO: 53); і (d) HVR-L1, що містить амінокислотну послідовність NIATDVA (SEQ ID NO: 55); (е) HVR-L2, що містить амінокислотну послідовність SASF (SEQ ID NO: 56); і (f) HVR-L3, що містить амінокислотну послідовність SEPEPYT (SEQ ID NO: 57). У одному варіанті здійснення мультиспецифічне антитіло, що містить антигензв'язувальний домен, який специфічно зв'язується з EGFR і HER3, включає в себе (a) варіабельний домен важкого ланцюга, що характеризується щонайменше 95 % ідентичністю послідовності з амінокислотною послідовністю SEQ ID NO: 30; (b) варіабельний домен легкого ланцюга, що характеризується щонайменше 95 % ідентичністю послідовності з амінокислотною послідовністю SEQ ID NO: 29; або (с) послідовність варіабельного домену важкого ланцюга, як в (a), і послідовність варіабельного домену легкого ланцюга, як в (b). У одному варіанті здійснення мультиспецифічне антитіло, що містить антигензв'язувальний домен, який специфічно зв'язується з EGFR і HER3, включає в себе послідовність варіабельного домену 3 UA 106070 C2 5 10 15 20 25 30 35 40 45 50 55 60 важкого ланцюга SEQ ID NO: 30. У одному варіанті здійснення мультиспецифічне антитіло, що містить антигензв'язувальний домен, який специфічно зв'язується з EGFR і HER3, включає в себе послідовність варіабельного домену легкого ланцюга SEQ ID NO: 29. У іншому варіанті здійснення мультиспецифічне антитіло, що містить антигензв'язувальний домен, який специфічно зв'язується з EGFR і HER3, включає в себе послідовність варіабельного домену важкого ланцюга SEQ ID NO: 30 і послідовність варіабельного домену легкого ланцюга SEQ ID NO: 29. У деяких варіантах здійснення мультиспецифічне антитіло, що містить антигензв'язувальний домен, який специфічно зв'язується з EGFR і HER3, являє собою повнорозмірне антитіло IgG1. Один аспект винаходу передбачає виділену нуклеїнову кислоту, що кодує мультиспецифічні HER-антитіла. Інший аспект передбачає клітину-хазяїна, що містить нуклеїнову кислоту, кодуючу мультиспецифічні HER-антитіла. Ще один аспект передбачає спосіб одержання мультиспецифічного HER-антитіла, який включає в себе культивування клітини-хазяїна, що містить нуклеїнову кислоту, кодуючу мультиспецифічне HER-антитіло, так, що виробляється антитіло. Один аспект винаходу передбачає імунокон'югат, що містить мультиспецифічне HERантитіло і цитотоксичний агент. Інший аспект передбачає фармацевтичну композицію, що містить мультиспецифічне HER-антитіло і фармацевтично прийнятний носій. Один аспект винаходу передбачає спосіб лікування суб'єкта, що страждає від раку, який включає в себе введення суб'єкту ефективної кількості мультиспецифічного HER-антитіла. У одному варіанті здійснення, мультиспецифічне HER-антитіло включає в себе антигензв'язувальний домен, який специфічно зв'язується з EGFR і HER3. У одному варіанті здійснення рак, який лікують за допомогою мультиспецифічного HER-антитіла, включає в себе клітини, які експресують EGFR і HER3. У одному варіанті здійснення рак, який лікують за допомогою мультиспецифічного HER-антитіла, являє собою рак молочної залози, колоректальний рак, рак підшлункової залози, рак голови і шиї, меланому, рак яєчника, рак передміхурової залози або недрібноклітинний рак легені. Інший аспект винаходу передбачає спосіб інгібування біологічної активності рецептора HER у суб'єкта, який включає в себе введення суб'єкту ефективної кількості мультиспецифічного HER-антитіла. У одному варіанті здійснення мультиспецифічне HER-антитіло включає в себе антигензв'язувальний домен, який специфічно зв'язується з EGFR і HER3. Один аспект винаходу передбачає мультиспецифічне HER-антитіло для застосування як ліків. Інший аспект передбачає мультиспецифічне HER-антитіло для застосування в лікуванні раку, такого як рак молочної залози, колоректальний рак, рак підшлункової залози, рак голови і шиї, меланома, рак яєчника, рак передміхурової залози або недрібноклітинний рак легені. Інший аспект передбачає мультиспецифічне HER-антитіло для застосування в інгібуванні біологічній активності рецептора HER. У одному варіанті здійснення мультиспецифічне HER-антитіло включає в себе антигензв'язувальний домен, який специфічно зв'язується з EGFR і HER3. Інший аспект винаходу передбачає мультиспецифічне HER-антитіло для застосування у виробництві ліків. Ліки можуть бути використані, в одному варіанті здійснення, для лікування раку, такого як рак молочної залози, колоректальний рак, рак підшлункової залози, рак голови і шиї, меланома, рак яєчника, рак передміхурової залози або недрібноклітинний рак легені. У одному варіанті здійснення ліки використовуються для інгібування біологічної активності HERрецептора. У одному варіанті здійснення мультиспецифічне HER-антитіло включає в себе антигензв'язувальний домен, який специфічно зв'язується з EGFR і HER3. У одному варіанті здійснення мультиспецифічне HER-антитіло є менш токсичним, ніж загальноприйняті антагоністи EGFR, такі як цетуксимаб. Короткий опис креслень На фігурі 1 показане інгібування пухлинного росту за допомогою антитіла анти-EGFR D1.5 в моделі ксенотрансплантата A431. На фігурі 2 показана специфічність зв'язування клонів з подвійною специфічністю. На фігурі 3 показане інгібування TGF-α-індукованого фосфорилування EGFR із застосуванням вибраних антитіл, що мають подвійну специфічність (антитіла анти-EGFR/HER3 і анти-EGFR/HER2). На фігурі 4 показано, що антитіла анти-EGFR/HER3 блокують зв'язування херегуліну з HER3-ECD-Fc. На фігурі 5 показане інгібування HRG-індукованого фосфорилування рецептора в клітинах MCF7 за допомогою анти-EGFR/HER3 біспецифічних антитіл. На фігурі 6 показане інгібування клітинної проліферації клітин MDA-175 за допомогою антитіл анти-EGFR/HER3. 4 UA 106070 C2 5 10 15 20 25 30 35 40 45 50 55 Фігура 7 являє собою зображення, що показує "гарячі" точки D1.5-100, картовані на структурі 4D5-Fv. Фігура 8 описує стратегію дозрівання афінності антитіла D1.5-100 EGFR-HER3, із застосуванням бібліотек, одержаних методом "дробовика". На фігурі 9 показано, що два вибраних антитіла зі зрілою афінністю (DL7 і DL11) є специфічними як для EGFR, так і для HER3. Фігура 10: A) Представлене порівняння інгібіторної функції антитіл DL7 і DL11 і батьківського антитіла D1.5 відносно EGFR. B) Представлене порівняння інгібіторної функції афіннозрілих антитіл DL7 і DL11 і моноспецифічного антитіла анти-HER3 DL3.6 відносно трансактивації HER3. Фігура 11: А) Представлені графіки, що демонструють порівняння функції інгібування росту DL11 в порівнянні з пертузумабом, антитілом анти-EGFR і антитілом анти-HER3 або DL3.6, D1.5, або комбінацією D1.5 плюс DL3.6 на клітинах H1666, клітинній лінії NSCLC, яка експресує HER2, HER3, EGFR і ліганди EGFR, ріст стимулювали за допомогою HRG. B) Представлені графіки, що демонструють порівняння функції інгібування росту DL11 в порівнянні з пертузумабом, антитілом анти-EGFR і антитілом анти-HER3 або DL3.6, D1.5, або комбінацією D1.5 плюс DL3.6 на клітинній лінії H1666 HSCLC, ріст стимулювали за допомогою HRG і TGF-α. Фігура 12: A) Представлені графіки, що демонструють інгібування проліферації клітин HCA7, клітинної лінії колоректального раку, яка експресує HER2, HER3 і EGFR, за допомогою DL11 в порівнянні з pMab, антитілом анти-EGFR і антитілом анти-HER3. Клітинний ріст стимулювали HRG. B) Представлені графіки, що демонструють інгібування клітинного росту HCA-7, як на фігурі 12A, за винятком того, що клітинний ріст стимулювали за допомогою HRG плюс TGF-α. На фігурі 13 представлене інгібування проліферації клітин Calu-3, лінії NSCLC, яка продукує в підвищеній кількості HER2 і має нормальні рівні HER3 і EGFR. Клітинний ріст стимулювали за допомогою HRG і антитіла тестували дозозалежним чином. На фігурі 14 зображена стратегія відбору для дозрівання афінності D1.5-201. На фігурі 15 представлене інгібування проліферації клітин MDA-175 за допомогою DL11, DL11b і DL11f. На фігурі 16 показано, що DL11f інгібує індуковане херегуліном фосфорилування HER3 і TGF-α-індуковане фосфорилування EGFR. Фігура 17 являє собою графік, що демонструє інгібування пухлинного росту в моделі пухлинного трансплантата HCA-7 за допомогою DL11 і DL11f. Фігура 18 являє собою графік, що демонструє інгібування пухлинного росту в моделі ксенотрансплантата H358 NSCLC за допомогою DL11f. На фігурі 19 представлене інгібування HRG-індукованого фосфорилування HER3 за допомогою DL3-11b, DL3.6b і DL3.6. Фігура 20: інгібування проліферації клітин MDA-175 за допомогою DL3-11b, DL3.6b і DL3.6 Фігура 21 являє собою графік, що демонструє інгібування пухлинного росту в моделі раку FaDu за допомогою DL11f. Фігура 22 являє собою графік, що демонструє інгібування пухлинного росту в моделі раку підшлункової залози BxPC3 за допомогою DL11f. Фігура 23 являє собою графік, що демонструє інгібування пухлинного росту в моделі недрібноклітинного раку легені Calu-3 за допомогою DL11f. Фігура 24 являє собою графік, що демонструє інгібування пухлинного росту в моделі епідермального раку A431 за допомогою DL11f. Фігура 25 являє собою графік, що демонструє інгібування пухлинного росту в моделі раку молочної залози MAXF44 за допомогою DL11f. Фігура 26 являє собою графік, що демонструє інгібування пухлинного росту в моделі раку передміхурової залози DU145 за допомогою DL11f. Фігура 27 являє собою графік, що демонструє інгібування пухлинного росту в моделі раку яєчника OVXF550 за допомогою DL11f. На фігурі 28 показано, що DL11f індукує ADCC в декількох клітинних лініях. На фігурі 29 показано, що DL11f-N297A не має активності ADCC. На фігурі 30 показане інгібування пухлинного росту в моделі раку H292 NSCLC за допомогою DL11f і DL11f-N297A. Фігура 31A-C являє собою таблицю, в якій надана інформація про спостережувані неклінічні і клінічні види токсичності для методів лікування антагоністами EGFR. Фігура 32 являє собою таблицю, що надає інформацію по оцінці висипу/лущення і акне/вугроподібного висипу. 5 UA 106070 C2 5 10 15 20 25 30 35 40 45 50 55 На фігурі 33 надається вирівнювання амінокислотної послідовності варіабельного домену важкого ланцюга і варіабельного домену легкого ланцюга декількох антитіл анти-HER при використанні нумерації по Кебату. На фігурі 33A показаний варіабельний домен легкого ланцюга наступних антитіл: D1 (SEQ ID NO: 58); D1.5 (SEQ ID NO: 24); D1.5-100 (SEQ ID NO: 40); DL11 (SEQ ID NO: 27); DL11b (SEQ ID NO: 29); DL11f (SEQ ID NO: 29). На фігурі 33B показаний варіабельний домен важкого ланцюга наступних антитіл: D1 (SEQ ID NO: 25); D1.5 (SEQ ID NO: 25); D1.5-100 (SEQ ID NO: 25); DL11 (SEQ ID NO: 28); DL11b (SEQ ID NO: 28); DL11f (SEQ ID NO: 30). Докладний опис винаходу I. Визначення Якщо не указано інакше, мається на увазі, що всі терміни галузі техніки, позначення і інша наукова термінологія, застосовувані в цьому документі, мають значення, що звичайно розуміються фахівцями в галузі техніки, до якої вказаний винахід належить. У деяких випадках, в цьому документі надаються визначення термінам із значеннями, що звичайно розуміються, для ясності і/або як довідковий матеріал, включення вказаних визначень в цей документ не треба тлумачити обов'язково як такі, що представляють суттєву відмінність, в порівнянні зі значенням, що звичайно розуміється в даній галузі техніки. Технічні прийоми і процедури, описані або згадувані в цьому документі, як правило, добре вивчені і широко використовуються із застосуванням загальноприйнятої методології фахівцями в даній галузі техніки, такі як, наприклад, широко застосовувані методи молекулярного клонування, описані Sambrook et al. Molecular Cloning: А Laboratory Manual 2nd. Edition (1989) Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N. Y. У відповідних випадках методи, які включають в себе застосування комерційно доступних наборів і реагентів, здійснюють відповідно до протоколів і/або параметрів, що задаються виробником, якщо не указано інакше. Перед тим, як відповідно описуються дані способи, набори і застосування, потрібно розуміти, що даний винахід не обмежується конкретною методологією, протоколами, клітинними лініями, видами і родами тварин, описаними конструкціями і реагентами, як такими, і вони можуть змінюватися. Також потрібно розуміти, що термінологія, використовувана в цьому документі, застосовується тільки з метою опису конкретних варіантів здійснення і не призначена для обмеження обсягу даного винаходу, який обмежений тільки прикладеною формулою винаходу. Потрібно зазначити, що використовувані в цьому документі і в прикладеній формулі винаходу форми однини включають в себе множинні об'єкти посилання, якщо з контексту ясно не зрозуміло інше. У даному описі і в формулі винаходу слово "включати в себе", або варіанти, такі як "включає в себе" або "який включає в себе", як слід розуміти, мають на увазі включення заявленого цілого або групи цілих, але не виключення будь-якого іншого цілого або групи цілих. Термін "антитіло" в цьому документі використовується в найширшому розумінні і охоплює, зокрема, моноклональні антитіла, поліклональні антитіла, мультиспецифічні антитіла і фрагменти антитіла, за умови, що вони демонструють бажану біологічну активність. Термін "мультиспецифічне антитіло" використовується в найширшому розумінні і, зокрема, охоплює антитіло, що містить антигензв'язувальний домен, який має поліепітопну специфічність (тобто здатний до специфічного зв'язування з двома або більше різними епітопами на одній біологічній молекулі або здатний до специфічного зв'язування з епітопами на двох або більше різних біологічних молекулах). Один конкретний приклад антигензв'язувального домену являє собою одиницю VHVL, що містить варіабельний домен важкого ланцюга (VH) і варіабельний домен легкого ланцюга (VL). Такі мультиспецифічні антитіла включають в себе, але без обмеження, повнорозмірні антитіла, антитіла, що мають два або більше доменів VL і VH, фрагменти антитіла, такі як Fab, Fv, dsFv, scFv, діатіла, біспецифічні діатіла і триатіла, фрагменти антитіла, які сполучені ковалентно або нековалентно. "Біспецифічне антитіло" являє собою мультиспецифічне антитіло, що містить антигензв'язувальний домен, який здатний до специфічного зв'язування з двома різними епітопами на одній біологічній молекулі або здатний до специфічного зв'язування з епітопами на двох різних біологічних молекулах. Біспецифічне антитіло також згадується в цьому документі як таке, що має "подвійну специфічність", або як таке, що є антитілом з "подвійною специфічністю". У певних варіантах здійснення антитіло винаходу характеризується константою дисоціації -8 M (Kd) ≤1мкM, ≤ 100 нM, ≤ 10 нМ, ≤ 1 нM, ≤ 0,1 нМ, ≤ 0,01 нМ або ≤ 0,001 нМ (наприклад, 10 або -8 -13 -9 -13 менше, наприклад, від 10 M до 10 M, наприклад, від 10 M до 10 M) для їх мішені HER або HERs. 6 UA 106070 C2 5 10 15 20 25 30 35 40 45 50 55 60 Основна 4-ланцюжкова одиниця антитіла являє собою гетеротетрамерний глікопротеїн, що складається з двох ідентичних легких (L) ланцюгів і двох ідентичних важких (Н) ланцюгів (антитіло IgM складається з 5 основних гетеротетрамерних одиниць поряд з додатковим поліпептидом, що називається ланцюг J, і відповідно містить 10 антигензв'язувальних ділянок, в той час як секретовані антитіла IgA можуть полімеризуватися з утворенням полівалентних комплексів, що містять 2-5 основних 4-ланцюжкових одиниць нарівні з ланцюгом J). У випадку IgG, 4-ланцюжкова одиниця складає звичайно приблизно 150000 Дальтон. Кожний ланцюг L сполучений з ланцюгом Н одним ковалентним дисульфідним зв'язком, крім того два ланцюги Н сполучені один з одним одним або більше дисульфідними зв'язками залежно від ізотипу ланцюга H. Кожний ланцюг Н і L також має регулярно розташовані внутрішньоланцюжкові дисульфідні містки. Кожний ланцюг Н має на N-кінці варіабельний домен (VH), за яким ідуть три константних домени (CH) для кожного з ланцюгів α і γ, і чотири домени CH для ізотипів μ і ε. Кожний ланцюг L має на N-кінці варіабельний домен (VL), за яким іде константний домен (CL) на іншому кінці. VL відповідає VH і CL відповідає першому константному домену важкого ланцюга (CH1). Вважають, що певні амінокислотні залишки формують поверхню між варіабельними доменами легкого ланцюга і важкого ланцюга. Спарювання одного з одним V H і VL утворює одну антигензв'язувальну ділянку. Для структури і властивостей різних класів антитіл, див., наприклад, Basic and Clinical Immunology, 8th edition, Daniel Р. Stites, Abba I. Terr and Tristram G. Parslow (eds.), Appleton & Lange, Norwalk, CT, 1994, page 71 and Chapter 6. Ланцюг L, одержаний з якого-небудь типу хребетних, може бути віднесений до одного з двох ясно відмінних типів, які називаються каппа і лямбда, виходячи з амінокислотних послідовностей їх константних доменів. Залежно від амінокислотної послідовності константного домену їх важких ланцюгів (CH), імуноглобуліни можуть бути віднесені до різних класів або ізотипів. Існує п'ять класів імуноглобулінів: IgA, IgD, IgE, IgG, і IgM, що мають важкі ланцюги, позначувані як α, δ, γ, ε і μ, відповідно. Класи γ і α потім поділяються на підкласи на основі відносно невеликих відмінностей в послідовності C H і функції, наприклад, людина експресує наступні підкласи: IgG1, IgG2, IgG3, IgG4, IgA1 і IgA2. Термін "варіабельний" стосується того факту, що певні сегменти варіабельних доменів широко відрізняються в послідовності серед антитіл. Домен V опосередковує зв'язування антигену і визначає специфічність певного антитіла до певного антигену. Однак варіабельність розподілена нерівномірно в 110-амінокислотному інтервалі варіабельних доменів. Навпаки, Vділянки складаються з відносно інваріантних проміжків, званих каркасними областями (FR) довжиною 15-30 амінокислот, розділених більш короткими ділянками з дуже високою варіабельністю, званих "гіперваріабельними областями" або HVR. Варіабельні домени нативних важких і легких ланцюгів містять чотири FR, що приймають головним чином конфігурацію беталиста, сполучених трьома гіперваріабельними областями, які утворюють петлі, що з'єднують і в деяких випадках формують частину структури бета-листа. Гіперваріабельні області в кожному ланцюгу утримуються разом в безпосередній близькості за допомогою FR і з гіперваріабельними областями з іншого ланцюга і надають внесок в утворення антигензв'язувальної ділянки антитіл (див. Kabat et al. Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD (1991)). Константні домени не беруть участь безпосередньо в зв'язуванні антитіла з антигеном, але вони демонструють різні ефекторні функції, такі як участь антитіла в антитілозалежній клітинній цитотоксичності (ADCC). Термін "гіперваріабельна область", "HVR" або "HV", коли він використовується в цьому документі, означає оласті варіабельного домену антитіла, які є гіперваріабельними по послідовності і/або формують структурно визначувані петлі. Як правило, антитіла включають в себе шість HVR; три в VH (HVR-H1, HVR-H2, HVR-H3), і три в VL (HVR-L1, HVR-L2, HVR-L3). У нативних антитілах H3 і L3 демонтструють найбільшу різноманітність шести HVR, і, зокрема, вважають, що H3 грає унікальну роль в наданні антитілам тонкої специфічності. Див., наприклад, Xu et al. Immunity 13:37-45 (2000); Johnson and Wu, in Methods in Molecular Biology 248:1-25 (Lo, ed., Human Press, Totowa, NJ, 2003). Насправді, антитіла, що зустрічаються в природі у тварин сімейства Camelidae, які складаються тільки з важкого ланцюга, є функціональними і стабільними за відсутності легкого ланцюга. Див., наприклад, HamersCasterman et al. Nature 363:446-448 (1993); Sheriff et al. Nature Struct. Biol. 3:733-736 (1996). Як правило, HVR включають в себе амінокислотні залишки гіперваріабельних петель і/або "гіперваріабельних областей" (CDR), останні характеризуються найвищою варіабельністю послідовності і/або беруть участь в розпізнаванні антигену. Ряд трансдиференціювань HVR використовується і охоплюється цим документом. Гіперваріабельні області (області, що визначають комплементарность (CDR)), по Кебату мають високий ступінь варіабельності 7 UA 106070 C2 5 послідовності і мають найбільш часте застосування (Kabat et al. Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD (1991)). Замість визначення гіперваріабельних областей по Кебату, Чотія запропонував визначати гіперваріабельні області по локалізації структурних петель (Chothia and Lesk J. Mol. Biol. 196:901-917 (1987)). Визначення гіперваріабельних областей AbМ являє собою компроміс між CDR по Кебату і структурними петлями по Чотія, і такі визначення використовуються в комп'ютерній програмі по моделюванню антитіл Oxford Molecular's AbМ. Контактні гіперваріабельні області визначають, виходячи з аналізу наявних складних кристалічних структур. Амінокислотні залишки кожної з вказаних HVR наводяться нижче. 10 Петля L1 L2 L3 H1 H1 20 25 30 35 40 45 50 H31-H35 H2 H3 15 По Кебату L24-L34 L50-L56 L89-L97 H31-H35B H50-H65 H95-H102 AbM По Чотія L24-L34 L26-L32 L50-L56 L50-L52 L89-L97 L91-L96 H26-H35B H26-H32 (Нумерація по Кебату) H26-H35 H26-H32 (Нумерація по Чотія) H50-H58 H53-H55 H95-H102 H96-H101 Контактні області L30-L36 L46-L55 L89-L96 H30-H35B H30-H35 H47-H58 H93-H101 HVR можуть включати в себе "подовжені HVR", як указано далі: 24-36 або 24-34 (L1), 46-56 або 50-56 (L2) і 89-97 або 89-96 (L3) в VL, і 26-35 (H1), 50-65 або 47-65 (H2) і 93-102, 94-102 або 95-102 (H3) в VH. Амінокислотні залишки варіабельних доменів для кожного з вказаних визначень пронумеровані по Кебату і ін., див. вище. "Каркасними" або "FR" залишками є залишки варіабельних доменів, за винятком HVR, визначених вище. Термін "залишок варіабельного домену, пронумерований по Кебату", або "амінокислотне положення, пронумероване по Кебату", і їх варіанти означають систему, використовувану для нумерації варіабельних доменів важкого ланцюга або варіабельних доменів легкого ланцюга антитіл, що описується в монографії Кебата і ін., вище. Відповідно до цієї системи нумерації фактична первинна амінокислотна послідовність може містити менше число або додаткове число амінокислот, відповідне укороченій або подовженій FR- або CDR-області варіабельного домену. Так, наприклад, варіабельний домен важкого ланцюга може включати інсерцію однієї амінокислоти (залишку 52а відповідно до нумерації Кебата) після залишку 52 Н2 і залишки (наприклад, залишки 82а, 82b і 82с і т. п., відповідно до нумерації Кебата), вбудовані після залишку 82 FR важкого ланцюга. Нумерація залишків даного антитіла по Кебату може бути здійснена після вирівнювання його послідовності в областях гомології зі стандартною послідовністю, пронумерованою по Кебату. Система нумерації по Кебату звичайно використовується у випадку, коли мається на увазі залишок у варіабельному домені (приблизно залишки 1-107 легкого ланцюга і залишки 1-113 важкого ланцюга) (наприклад, Kabat et al. Sequences of Immunological Interest. 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md. (1991)). "Система нумерації EU" або "індекс EU" звичайно використовується для позначення залишку в константній області важкого ланцюга імуноглобуліну (наприклад, індекс EU, описаний в Kabat et al., вище). "Індекс EU по Кебату" означає Європейську систему нумерації залишків людського антитіла. Якщо не указано інакше, в цьому документі посилання на номери залишків у варіабельному домені антитіл мають на увазі нумерацію залишків за системою Кебата. Якщо не указано інакше, в цьому документі посилання на номери залишків в константному домені антитіл мають на увазі нумерацію залишків за системою EU (наприклад, див. міжнародний патент WO 2006/073941). "Афінність" означає силу сумарних нековалентних взаємодій одного сайта зв'язування молекули (наприклад, антитіла) з його партнером по зв'язуванню (наприклад, з антигеном). Якщо це не обумовлене особливо, то використовуваний тут термін "афінність зв'язування" означає природну афінність зв'язування, при якій відбувається взаємодія 1:1 між членами пар зв'язування (наприклад, антитіла з антигеном). Афінність зв'язування молекули Х з її партнером Y, в загальних рисах, може називатися константою дисоціації (Kd). Афінність може бути визначена стандартними методами, відомими фахівцям, включаючи описані тут методи. "Афіннозріле" антитіло являє собою антитіло, що має одну або декілька модифікацій в одній або декількох HVR або їх каркасній області, що дозволяє підвищувати афінність даного антитіла відносно антигену, в порівнянні з батьківським антитілом, що не має такої(их) модифікації(й). У 8 UA 106070 C2 5 10 15 20 25 30 35 40 45 50 55 60 одному варіанті здійснення афіннозріле антитіло має наномолярні або навіть пікомолярні афінності відносно антигену-мішені. Афіннозрілі антитіла одержують відомими методами. Наприклад, в публікації Marks et al. Bio/Technology 10:779-783 (1992) описане дозрівання афінності в результаті перестановки доменів VH і VL. Неспецифічний мутагенез HVR і/або каркасних залишків описаний в публікаціях, наприклад, Barbas et al. Proc Nat. Acad. Sci. USA 91: 3809-3813 (1994); Schier et al. Gene 169:147-155 (1995); Yelton et al. J. Immunol. 155: 1994-2004 (1995); Jackson et al. J. Immunol. 154(7):3310-9 (1995); і Hawkins et al. J. Mol. Biol. 226:889-896 (1992). "Клас" антитіла стосується типу константного домену або константної області, що належить до важкого ланцюга. Існує п'ять основних класів антитіл: IgA, IgD, IgE, IgG і IgM, і деякі з них можуть бути далі розділені на підкласи (ізотипи), наприклад, IgG1, IgG2, IgG3, IgG4, IgA1 і IgA2. Константні домени важкого ланцюга, які відповідають різним класам імуноглобулінів, називають α, δ, ε, γ і μ, відповідно. Термін "моноклональне антитіло", в тому розумінні, в якому він тут використовується, стосується антитіла, одержаного з популяції в основному гомогенних антитіл, тобто окремі антитіла, що складають популяцію, є по суті ідентичними і зв'язуються з однаковим епітопом (епітопами), за винятком можливих варіантів, які можуть виникнути під час одержання моноклонального антитіла, такі варіанти звичайно представлені в незначних кількостях. Вказане моноклональне антитіло звичайно включає в себе антитіло, що містить варіабельну ділянку, яка зв'язується з мішенню, де антитіло одержане за допомогою процесу, який включає в себе відбір антитіла з множини антитіл. Наприклад, процес відбору може являти собою відбір унікального клону з множини клонів, таких як пул гібридомних клонів, фагових клонів або клонів рекомбінантної ДНК. Потрібно розуміти, що вибране антитіло може бути далі змінене, наприклад, для збільшення афінності до мішені, для гуманізації антитіла, для поліпшення його продукції в клітинній культурі, для зменшення його імуногенності in vivo, для створення мультиспецифічного антитіла і т. д., і що антитіло, що містить змінену послідовність варіабельної ділянки, також являє собою моноклональне антитіло даного винаходу. Крім специфічності, препарати моноклональних антитіл мають ту перевагу, що вони звичайно не мають домішок інших імуноглобулінів. Визначення "моноклональне" вказує на характер антитіла, що одержане, по суті, з гомогенної популяції антитіл, і не зводиться до необхідної продукції антитіла будь-яким конкретним методом. Наприклад, моноклональні антитіла для застосування за даним винаходом можуть бути одержані за допомогою ряду технологій, включаючи метод гібридом (наприклад, Kohler et al. Nature, 256:495 (1975); Harlow et al. Antibodies: А Laboratory Manual (Cold Spring Harbor Laboratory Press, 2nd ed. 1988); Hammerling et al. Monoclonal Antibodies and T-Cell Hybridomas 563-681, (Elsevier, N. Y., 1981), методи рекомбінантної ДНК (див., наприклад, патент США № 4816567), технології фагового дисплея (див., наприклад, Clackson et al. Nature, 352:624-628 (1991); Marks et al. J. Mol. Biol., 222:581-597 (1991); Sidhu et al. J. Mol. Biol. 338(2):299-310 (2004); Lee et al. J. Mol. Biol. 340(5):1073-1093 (2004); Fellouse, Proc. Nat. Acad. Sci. USA 101(34):12467-12472 (2004); і Lee et al. J. Immunol. Methods 284(1-2):119-132 (2004) і технології одержання людських або подібних до людських антитіл тварин, які містять частини або включають в себе повністю локуси імуноглобулінів людини або гени, що кодують послідовності імуноглобуліну людини (див., наприклад, міжнародні патенти WO 98/24893, WO/9634096, WO/9633735 і WO/9110741, Jakobovits et al. Proc. Natl. Acad. Sci. USA, 90:2551 (1993); Jakobovits et al. Nature, 362:255-258 (1993); Bruggemann et al. Year in Immuno, 7:33 (1993); патенти США №№ 5545806, 5569825, 5591669 (всі GenPharm); 5545807; міжнародний патент WO 97/17852, патенти США №№ 5545807; 5545806; 5569825; 5625126; 5633425 і 5661016, і Marks et al. Bio/Technology, 10: 779-783 (1992); Lonberg et al. Nature, 368: 856-859 (1994); Morrison, Nature, 368: 812-813 (1994); Fishwild et al. Nature Biotechnology, 14: 845-851 (1996); Neuberger, Nature Biotechnology, 14: 826 (1996); і Lonberg and Huszar, Intern. Rev. Immunol., 13: 65-93 (1995). "Інтактне" антитіло являє собою антитіло, яке включає в себе антигензв'язувальну ділянку, а також CL і щонайменше константні домени важкого ланцюга CH1, CH2 і CH3. Константні домени можуть являти собою константні домени з нативною послідовністю (наприклад, людські константні домени з нативною послідовністю) або їх варіанти амінокислотної послідовності. Переважно, інтактне антитіло має одну або більше ефекторних функцій. "Фрагменти антитіла" включають в себе ділянку інтактного антитіла, що переважно містить антигензв'язувальну або варіабельну ділянку інтактного антитіла. Приклади фрагментів антитіла включають в себе Fv, Fab, Fab', F(ab') 2, Fab'-SH; діантитіла; лінійні антитіла (див. патент США № 5641870, Приклад 2; Zapata et al. Protein Eng. 8(10): 1057-1062 (1995)); одноланцюжкові молекули антитіл (наприклад, scFv). Коли в даному описі і у всій специфікації 9 UA 106070 C2 5 10 15 20 25 30 35 40 45 50 55 робиться посилання на антитіла і різні властивості антитіл, аналогічне розкриття також поширюється на функціональні фрагменти антитіла, наприклад, на подвійну дію Fabфрагментів. Вираз "лінійні антитіла" звичайно стосується антитіл, описаних Zapata et al. Protein Eng. 8(10): 1057-1062 (1995). Вказані антитіла включають в себе пару тандемних Fd-сегментів (VHCH1-VH-CH1), які разом з комплементарними поліпептидами легкого ланцюга формують пару антигензв'язувальних ділянок. У переважному варіанті здійснення фрагмент є "функціональним", тобто якісно зберігає здатність відповідного інтактного антитіла зв'язуватися з мішенню рецептором HER і, якщо інтактне антитіло також інгібує активацію або функцію HER, також якісно зберігає таку властивість. Якісне збереження означає, що активність в натуральному вираженні зберігається, але ступінь афінності зв'язування і/або активності може відрізнятися. Розщеплення папаїном антитіл дає два ідентичних антигензв'язувальних фрагменти, що називаються "Fab"-фрагментами, і залишковий "Fc"-фрагмент, позначення, що відображає здатність кристалізуватися без великих зусиль. Fab-фрагмент складається з повного L-ланцюга разом з доменом варіабельної ділянки Н-ланцюга (VH) і першим константним доменом одного важкого ланцюга (CH1). Обробка пепсином антитіла дає один великий фрагмент F(ab') 2, який приблизно відповідає сполученим дисульфідним зв'язком Fab-фрагментам, що мають дивалентну антигензв'язувальну активність, і здатний як і раніше до перехресного зв'язування антигену. Fab'-фрагменти відрізняються від Fab-фрагментів наявністю додаткових декількох залишків на карбоксильному кінці домену CH1, включаючи один або більше цистеїнів шарнірної області антитіла. У цьому документі Fab'-SH являє собою позначення Fab', в якому цистеїновий залишок (залишки) константних доменів несе вільну тіольну групу. F(ab') 2 фрагменти антитіла початково одержували у вигляді пар Fab'-фрагментів, які містять між собою цистеїни шарнірної області. Також відомі інші хімічні з'єднання пар фрагментів антитіла. Fc-фрагмент включає в себе карбоксикінцеві частини обох Н-ланцюгів, утримувані разом дисульфідними зв'язками. Ефекторні функції антитіл визначаються послідовностями в Fcобласті; вказана область також є частиною, розпізнаваною Fc-рецепторами (FcR), виявленими на певних типах клітин. "Fv" складається з димеру, що включає один варіабельний домен важкого ланцюга і один варіабельний домен легкого ланцюга, в жорсткій, нековалентній асоціації. В результаті згортання вказаних двох доменів утворюється шість гіперваріабельних петель (3 петлі, кожна з Н- і L-ланцюга), які надають амінокислотні залишки для антигензв'язування і надають антигензв'язувальну специфічність антитілу. Однак навіть один варіабельний домен (або половина Fv, що містить тільки три HVR, специфічних до антигену) має здатність розпізнавати і зв'язувати антиген, хоч часто з нижчою афінністю, ніж ціла ділянка зв'язування. "Одноланцюжковий Fv", також позначуваний скорочено як "sFv" або "scFv", являє собою фрагменти антитіла, які включають в себе домени антитіла VH і VL, сполучені в одному поліпептидному ланцюгу. Переважно, поліпептид sFv далі включає в себе поліпептидний лінкер між доменами VH і VL, які дозволяють sFv формувати бажану структуру для зв'язування антигену. Для огляду sFv див. Pluckthun в The Pharmacology of Monoclonal Antibodies, vol. 113, Rosenburg and Moore eds., Springer-Verlag, New York, pp. 269-315 (1994); Borrebaeck 1995. Термін "діатіла" стосується невеликих фрагментів антитіла, одержаних за допомогою побудови sFv-фрагментів (див. попередній параграф) за допомогою коротких лінкерів (приблизно 5-10 залишків) між доменами VH і VL, так що досягається міжланцюжкове, але не внутрішньоланцюжкове спарювання V-доменів, що дає в результаті бівалентний фрагмент, тобто фрагмент, який має дві антигензв'язувальні ділянки. Діатіла описані більш повно, наприклад, в європейському патенті EP 404097; в міжнародному патенті WO 93/11161; і Hollinger et al. Proc. Natl. Acad. Sci. USA, 90:6444-6448 (1993). "Антитіло, яке зв'язується з аналогічним епітопом" як референсне антитіло, стосується антитіла, яке блокує зв'язування референсного антитіла з його антигеном в аналізі конкурентного зв'язування на 50 % або більше, і навпаки, референсне антитіло блокує зв'язування антитіла з його антигеном в аналізі конкурентного зв'язування на 50 % або більше. Термін "химерне" антитіло стосується антитіла, в якому частина важкого і/або легкого ланцюга одержана з певного джерела або виду, в той час як частина важкого і/або легкого ланцюга, що залишилася, одержана з іншого джерела або виду. "Людське антитіло" являє собою антитіло, яке має амінокислотну послідовність, що відповідає послідовності антитіла, виробленого людиною або клітиною людини або одержаного з нелюдського джерела, яке використовує репертуари антитіла людини або інші послідовності, 10 UA 106070 C2 5 10 15 20 25 30 35 40 45 50 55 60 кодуючі антитіло людини. Це визначення антитіла людини спеціально виключає гуманізоване антитіло, що містить нелюдські антигензв'язувальні залишки. "Людська консенсусна каркасна область" являє собою каркасну область, яка включає амінокислотні залишки, що найчастіше зустрічаються у вибраних послідовностях каркасних областей VL або VH людського імуноглобуліну. У загальних рисах V L- або VH-послідовності людського імуноглобуліну вибирають з підгрупи послідовностей варіабельних доменів. Звичайно така підгрупа послідовностей являє собою підгрупу, визначену Кебатом і ін. Sequences of Proteins of Immunological Interest, Fifth Edition, NIH Publication 91-3242, Bethesda MD (1991), vols. 1-3. В одному з варіантів здійснення підгрупою для VL є підгрупа каппа I, по Кебатуі ін., див. вище. У одному з варіантів здійснення підгрупа для V H являє собою підгрупу III, по Кебату і ін. "Гуманізовані" форми антитіл, що не належать до людських (наприклад, гризунів), є химерними антитілами, які містять мінімальну послідовність, одержану з нелюдського імуноглобуліну. В основному гуманізовані антитіла представляють людські імуноглобуліни (реципієнтне антитіло), де залишки гіперваріабельної області реципієнта замінені на залишки з гіперваріабельної області видів, що не належать до людини (донорне антитіло), таких як миша, щур, кролик або примат, що не належить до людини, які мають бажану специфічність, афінність і ефективність. У деяких випадках залишки ділянки каркасної області (FR) людського імуноглобуліну замінюють на відповідні нелюдські залишки. Крім того, гуманізовані антитіла можуть містити залишки, які не виявляють в реципієнтному антитілі або в донорному антитілі. Дані модифікації проводять для додаткового підвищення ефективність антитіла. Як правило, гуманізоване антитіло буде містити в основному щонайменше один і, як правило, два варіабельних домени, в яких всі або в основному всі гіперваріабельні петлі відповідають таким в нелюдському імуноглобуліні або всі або в основному всі FR, які входять в людську послідовність імуноглобуліну. Гуманізоване антитіло також необов'язково буде містити щонайменше ділянку константної області імуноглобуліну (Fc), як правило людського імуноглобуліну. Детальніше див. у Jones et al. Nature 321:522-525 (1986); Riechmann et al., Nature 332:323-329 (1988); і Presta, Curr. Op. Struct. Biol. 2:593-596 (1992). Антитіло даного винаходу, "яке зв'язується з" антигеном, що представляє інтерес, являє собою антитіло, яке зв'язується з антигеном з достатньою афінністю, так що антитіло є корисним як діагностичний і/або терапевтичний агент для направленого впливу на білок, клітину або тканину, експресуючі антиген. Що стосується зв'язування антитіла з молекулою-мішенню, термін "специфічне зв'язування" або "специфічно зв'язується з", або є "специфічним відносно" певного поліпептиду або епітопа на визначеному поліпептиді-мішені має на увазі зв'язування, яке вимірювано відрізняється від неспецифічної взаємодії. Специфічне зв'язування може бути виміряне, наприклад, за допомогою визначення зв'язування молекули в порівнянні зі зв'язуванням контрольної молекули. Наприклад, специфічне зв'язування може бути визначене за допомогою конкуренції з контрольною молекулою, яка є схожою з мішенню, наприклад, з неміченою мішенню, в надмірній кількості. У такому випадку специфічне зв'язування визначається, якщо зв'язування міченої мішені із зондом конкурентно інгібується надмірною кількістю неміченої мішені. У конкретному варіанті здійснення "специфічно зв'язується" стосується зв'язування антитіла з його специфічними мішенями-рецепторами HER, але не з іншими специфічними нецільовими HER-рецепторами. Наприклад, антитіло специфічно зв'язується з EGFR і HER3, але не зв'язується специфічно з HER2 або HER4, або антитіло специфічно зв'язується з EGFR і HER2, але не зв'язується специфічно з HER3 або HER4, або антитіло специфічно зв'язується з EGFR і HER4, але не зв'язується специфічно з HER2 або HER3. "Рецептор HER" являє собою рецепторну білкову тирозинкіназу, яка належить до сімейства рецептора HER і включає в себе рецептори EGFR (ErbB1, HER1), HER2 (ErbB2), HER3 (ErbB3) і HER4 (ErbB4). Рецептор HER, як правило, включає в себе позаклітинний домен, який може зв'язувати ліганд HER і/або димеризуватися з іншою молекулою рецептора HER; або ліпофільний трансмембранний домен; консервативний внутрішньоклітинний домен тирозинкінази; і карбоксилкінцевий сигнальний домен, що містить декілька залишків тирозину, які можуть бути фосфориловані. Рецептор HER може бути рецептором HER з "нативною послідовністю" або з "варіантом його амінокислотної послідовності". Переважно, рецептор HER являє собою рецептор HER людини з нативною послідовністю. "Каскад реакцій HER" стосується сигнальної системи, опосередковуваної сімейством рецептора HER. Терміни "ErbB1", "HER1", "рецептор епідермального фактора росту" і "EGFR" використовуються в цьому документі взаємозамінно і стосуються EGFR, як розкрито, 11 UA 106070 C2 5 10 15 20 25 30 35 40 45 50 55 наприклад, в Carpenter et al. Ann. Rev. Biochem. 56:881-914 (1987), включаючи його мутантні форми, що зустрічаються в природі (наприклад, делеційний мутант EGFR, як в Ullrich et al. Nature (1984) 309:418425 і Humphrey et al. PNAS (USA) 87:4207-4211 (1990)), а також його варіанти, такі як EGFRvIII. Варіанти EGFR також включають в себе делеційні, замісні і інсерційні варіанти, наприклад, описані Lynch et al. (New England Journal of Medicine 2004, 350:2129), Paez et al. (Science 2004, 304:1497), і Pao et al. (PNAS 2004, 101:13306). У цьому документі"позаклітинний домен EGFR" або "EGFR ECD" стосується домену EGFR, який знаходиться поза клітиною, або прикріплений до клітинної мембрани, або в циркуляції, включаючи його фрагменти. У одному варіанті здійснення позаклітинний домен EGFR може включати в себе чотири домени: "домен I" (амінокислотні залишки приблизно з 1-158, "домен II" (амінокислотні залишки 159-336), "домен III" (амінокислотні залишки 337-470) і "домен IV" (амінокислотні залишки 471-645), де границі є приблизними і можуть варіювати приблизно на 13 амінокислоти. Вирази "ErbB2" і "HER2" використовують в цьому документі взаємозамінно і вони стосуються білка людини HER2, описаного, наприклад, Semba et al. PNAS (USA) 82:6497-6501 (1985), і Yamamoto et al. Nature 319:230-234 (1986) (GenBank accession number X03363). Термін "erbB2" neu стосується гена, кодуючого HER2 людини, і "neu" стосується гена, кодуючого p185 щура. Переважний HER2 являє собою HER2 людини з нативною послідовністю. У цьому документі "позаклітинний домен HER2" або "HER2 ECD" стосується домену HER2, який знаходиться поза клітиною, або прикріплений до клітинної мембрани, або в циркуляції, включаючи його фрагменти. У одному варіанті здійснення позаклітинний домен HER2 може включати в себе чотири домени: "домен I" (амінокислотні залишки приблизно з 1-195, "домен II" (амінокислотні залишки приблизно з 196-319), "домен III" (амінокислотні залишки приблизно з 320-488) і "домен IV" (амінокислотні залишки приблизно з 489-630) (нумерація залишків без сигнального пептиду). Див. Garrett et al. Mol. Cell. 11:495-505 (2003), Cho et al. Nature 421:756760 (2003), Franklin et al. Cancer Cell 5:317-328 (2004), і Plowman et al. Proc. Natl. Acad. Sci. 90:1746-1750 (1993). "ErbB3" і "HER3" стосуються рецепторного поліпептиду, який розкритий, наприклад, в патентах США №№ 5183884 і 5480968, а також Kraus et al. PNAS (USA) 86:9193-9197 (1989). У цьому документі "позаклітинний домен HER3" або "HER3 ECD" стосується домену HER3, який знаходиться поза клітиною, або прикріплений до клітинної мембрани, або в циркуляції, включаючи його фрагменти. У одному варіанті здійснення позаклітинний домен HER3 може включати в себе чотири домени: домен I, домен II, домен III і домен IV. У одному варіанті здійснення HER3 ECD включає в себе амінокислоти 1-636 (нумерація, що включає в себе сигнальний пептид). У одному варіанті здійснення HER3 домен III включає в себе амінокислоти 328-532 (нумерація, що включає в себе сигнальний пептид). Терміни "ErbB4" і "HER4" в цьому документі стосуються рецепторного поліпептиду, який розкритий, наприклад, в європейській патентній заявці № 599274; Plowman et al. Proc. Natl. Acad. Sci. USA, 90:1746-1750 (1993); і Plowman et al. Nature, 366:473-475 (1993), включаючи його ізоформи, наприклад, розкриті в міжнародному патенті WO 99/19488, опублікованому 22 квітня 1999 р. За допомогою "ліганду HER" позначають поліпептид, який зв'язується і/або активує рецептор HER. Ліганд HER, що представляє особливий інтерес, в цьому документі являє собою людський ліганд HER з нативною послідовністю, такий як епідермальний фактор росту (EGF) (Savage et al. J. Biol Chem. 247:7612-7621 (1972)); трансформуючий фактор росту альфа (TGFα) (Marquardt et al. Science 223:1079-1082 (1984)); амфірегулін, також відомий як аутокринний фактор росту шваноми або кератиноцитів (Shoyab et al. Science 243:1074-1076 (1989); Kimura et al. Nature 348:257-260 (1990); і Cook et al. Mol. Cell Biol. 11:2547-2557 (1991)); бетацелюлін (Shing et al. Science 259:1604-1607 (1993); і Sasada et al. Biochem. Biophys. Res. Commun. 190:1173 (1993)); гепаринзв'язувальний епідермальний фактор росту (HB-EGF) (Higashiyama et al. Science 251:936-939 (1991)); епірегулін (Toyoda et al. J. Biol. Chem. 270:7495-7500 (1995); і Komurasaki et al. Oncogene 15:2841-2848 (1997)); херегулін (див. нижче); нейрегулін-2 (NRG-2) (Carraway et al. Nature 387:512-516 (1997)); нейрегулін-3 (NRG-3) (Zhang et al. Proc. Natl. Acad. Sci. 94:9562-9567 (1997)); нейрегулін-4 (NRG-4) (Harari et al. Oncogene 18:2681-89 (1999)); і крипто (CR-1) (Kannan et al. J. Biol. Chem. 272(6):3330-3335 (1997)). Ліганди HER, які зв'язують EGFR, включають в себе EGF, TGF-α, амфірегулін, бетацелюлін, HB-EGF і епірегулін. Ліганди HER, які зв'язують HER3, включають в себе херегуліни і NRG-2. Ліганди HER, здатні до зв'язування HER4, включають в себе бетацелюлін, епірегулін, HB-EGF, NRG-2, NRG-3, NRG-4 і херегуліни. 12 UA 106070 C2 5 10 15 20 25 30 35 40 45 50 55 60 Термін "херегулін" (HRG), коли він застосовується в цьому документі, стосується поліпептиду, кодованого продуктом гена херегуліну, як розкрито в патенті США № 5641869 або Marchionni et al. Nature, 362:312-318 (1993). Приклади херегулінів включають в себе херегулін-α, херегулін-β1, херегулін-β2 і херегулін-β3 (Holmes et al. Science, 256:1205-1210 (1992); і патент США № 5641869); фактор диференціювання neu (NDF) (Peles et al. Cell 69: 205-216 (1992)); фактор, що індукує активність ацетилхолінового рецептора (ARIA) (Falls et al. Cell 72:801-815 (1993)); гліальні фактори росту (GGFs) (Marchionni et al. Nature, 362:312-318 (1993)); фактор, утворюваний з сенсорних і рухових нейронів (SMDF) (Ho et al. J. Biol. Chem. 270:14523-14532 (1995)); γ-херегулін (Schaefer et al. Oncogene 15:1385-1394 (1997)). "Димер HER" в цьому документі являє собою нековалентно асоційований димер, що містить щонайменше два рецептори HER. Вказані комплекси можуть формуватися,якщо клітина, експресуюча два або більше рецепторів HER, піддається впливу HER-ліганду і може бути виділена за допомогою імунопреципітації і піддана аналізу за допомогою SDS-PAGE, як описано Sliwkowski et al. J. Biol. Chem., 269(20):14661-14665 (1994), наприклад. Інші білки, такі як субодиниця рецептора цитокіну (наприклад, gp130) можуть бути асоційовані з димером. "Гетеродимер HER" в цьому документі являє собою нековалентно асоційований гетеродимер, що містить щонайменше два різних рецептори HER, такий як гетеродимери EGFR-HER2, EGFR-HER3, EGFR-HER4, HER2-HER3 або HER2-HER4. "Інгібітор HER" являє собою агент, який перешкоджає активації або функції HER. Приклади інгібіторів HER включають в себе HER-антитіла (наприклад, антитіла до EGFR, HER2, HER3 або HER4); EGFR-таргентні ліки; малі молекули антагоністів HER; інгібітори HER-тирозинкінази; HER2 і EGFR подвійні інгібітори тирозинкінази, такі як лапатиніб/GW572016; антисмислові молекули (див., наприклад, міжнародний патент WO2004/87207) і/або агенти, які зв'язуються з або перешкоджають функції молекул, що передають сигнали в низхідному напрямі, таких як MAPK або Akt. Переважно, інгібітор HER являє собою антитіло, яке зв'язується з рецептором HER. "Інгібітор димеризації HER" або "HDI" являє собою агент, який інгібує утворення гомодимеру HER або гетеродимеру HER. Переважно, інгібітор димеризації HER являє собою антитіло. Однак інгібітори димеризації HER також включають в себе пептидні і непептидні низькомолекулярні молекули і інші хімічні об'єкти, які інгібують утворення гомо- або гетеродимерів HER. Антитіло, яке "інгібує димеризацію HER" являє собою антитіло, яке інгібує або перешкоджає утворенню димеру HER, незалежно від механізму, що лежить в основі. У одному варіанті здійснення вказане антитіло зв'язується з HER2 в його гетородимерній ділянці зв'язування. Один конкретний приклад антитіла, інгібуючого димеризацію, являє собою пертузумаб (Pmab), або MAb 2C4. Інші приклади інгібіторів димеризації HER включають в себе антитіла, які зв'язуються з EGFR і інгібують його димеризацію з одним або більше іншими рецепторами HER (наприклад, EGFR моноклональне антитіло 806, MAb 806, яке зв'язується з активованим або "незв'язаним" EGFR; див. Johns et al. J. Biol. Chem. 279(29):30375-30384 (2004)); антитіла, які зв'язуються з HER3 і інгібують його димеризацію з одним або більше іншими рецепторами HER; антитіла, які зв'язуються з HER4 і інгібують його димеризацію з одним або більше іншими рецепторами HER; пептидні інгібітори димеризації (патент США № 6417168); антисмислові інгібітори димеризації і т. д. Використовуваний в цьому документі термін "антагоніст EGFR" або "інгібітор EGFR" стосується сполук, які специфічно зв'язуються з EGFR і запобігають або зменшують його сигнальну активність, і не зв'язуються специфічно з HER2, HER3 або HER4. Приклади таких агентів включають в себе антитіла і малі молекули, які зв'язуються з EGFR. Приклади антитіл, які зв'язуються з EGFR, включають в себе MAb 579 (ATCC CRL HB8506), MAb 455 (ATCC CRL HB8507), MAb 225 (ATCC CRL 8508), MAb 528 (ATCC CRL 8509) (див. патент США № 4943533, Mendelsohn et al.) і їх варіанти, такі як химеризований 225 (C225 або Цетуксимаб; ERBITUX®) і видозмінений людський 225 (H225) (див., міжнародний патент WO 96/40210, Imclone Systems Inc.); IMC-11F8, повністю людське EGFR-таргентне антитіло (Imclone); антитіла, які зв'язують мутантний EGFR типу II (патент США № 5212290); гуманізовані і химерні антитіла, які зв'язують EGFR, як описано в патенті США № 5891996; і людські антитіла, які зв'язують EGFR, такі як ABX-EGF або Панітумумаб (див. WO98/50433, Abgenix/Amgen); EMD 55900 (Stragliotto et al. Eur. J. Cancer 32A:636-640 (1996)); EMD7200 (матузумаб) гуманізоване EGFR-антитіло, направлене проти EGFR, яке конкурує з EGF і TGF-α за зв'язування EGFR (EMD/Merck); EGFR-антитіло людини, HuMax-EGFR (GenMab); повністю людські антитіла, відомі як E1.1, E2.4, E2.5, E6.2, E6.4, E2.11, E6.3 і E7.6.3 і описані в патенті США № 6235883; MDX-447 (Medarex Inc); і mAb 806 або гуманізоване mAb 806 (Johns et al., J. Biol. Chem. 279(29):30375-30384 (2004)). Антитіло 13 UA 106070 C2 5 10 15 20 25 30 35 40 45 50 55 60 анти-EGFR може бути кон'юговане з цитотоксичним агентом, з утворенням, таким чином, імунокон'югата (див., наприклад, європейську патентну заявку EP 659439A2, патент Merck GmbH). Антагоністи EGFR включають в себе малі молекули, такі як сполуки, описані в патентах США №№ 5616582, 5457105, 5475001, 5654307, 5679683, 6084095, 6265410, 6455534, 6521620, 6596726, 6713484, 5770599, 6,140,332, 5,866,572, 6,399,602, 6344459, 6602863, 6391874, 6344455, 5760041, 6002008 і 5747498, а також в наступних публікаціях PCT: WO 98/14451, WO 98/50038, WO 99/09016 і WO 99/24037. Конкретні низькомолекулярні антагоністи EGFR включають в себе OSI-774 (CP-358774, ерлотиніб, ТАРЦЕВА® Genentech/OSI Pharmaceuticals); PD 183805 (CI 1033, 2-пропенамід, N-[4-[(3-хлор-4-фторфеніл)аміно]-7-[3-(4морфолініл)пропокси]-6-хіназолініл]-, дигідрохлорид, Pfizer Inc.); ZD1839, гефітиніб (ІРЕССА® 4(3'-хлор-4'-фтораніліно)-7-метокси-6-(3-морфолінпропокси)хіназолін, AstraZeneca); ZM 105180 (6-аміно-4-(3-метилфеніламіно)хіназолін, Zeneca); BIBX-1382 (N8-(3-хлор-4-фторфеніл)-N2-(1метилпіперидин-4-іл)піримідо[5,4-d]піримидин-2,8-діамін (Boehringer Ingelheim)); PKI-166 ((R)-4[4-[(1-фенілетил)аміно]-1H-піроло[2,3-d]піримідин-6-іл]фенол, (R)-6-(4-гідроксифеніл)-4-[(1фенілетил)аміно]-7H-піроло[2,3-d]піримідин); CL-387785 (N-[4-[(3-бромфеніл)аміно]-6хіназолініл]-2-бутинамід); EKB-569 (N-[4-[(3-хлор-4-фторфеніл)аміно]-3-ціано-7-етокси-6хінолініл]-4-(диметиламіно)-2-бутенамід (Wyeth)); AG1478 (Sugen) і AG1571 (SU 5271; Sugen). "HER-антитіло" являє собою антитіло, яке зв'язується з рецептором HER. Додатково, HERантитіло далі перешкоджає активації або функціїї HER. Конкретні HER2-антитіла включають в себе пертузумаб і трастузумаб. Приклади конкретних EGFR-антитіл включають в себе цетуксимаб і панітумумаб. Патентні публікації, пов'язані з HER-антитілами, включають в себе: патенти США US 5677171, US 5720937, US 5720954, US 5725856, US 5770195, US 5772997, US 6165464, US 6387371, US 6399063, US 2002/0192211A1, US 6015567, US 6333169, US 4968603, US 5821337, US 6054297, US 6407213, US 6719971, US 6800738, US 2004/0236078A1, US 5648237, US 6267958, US 6685940, US 6821515, міжнародний патент WO 98/17797, патенти США US 6333398, US 6797814, US 6339142, US 6417335, US 6489447, міжнародний патент WO 99/31140, патенти США US 2003/0147884A1, US 2003/0170234A1, US 2005/0002928A1, US 6573043, US 2003/0152987A1, міжнародний патент WO 99/48527, US 2002/0141993A1, міжнародний патент WO 01/00245, патенти США US 2003/0086924, US 2004/0013667A1, міжнародні патенти WO 00/69460, WO 01/00238, WO 01/15730, патенти США US 6627196Bl, US 6632979B1, міжнародний патент WO 01/00244, US 2002/0090662A1, міжнародний патент WO 01/89566, патенти США US 2002/0064785, US 2003/0134344, міжнародний патент WO 04/24866, патенти США US 2004/0082047, US 2003/0175845A1, міжнародний патент WO 03/087131, патент США US 2003/0228663, міжнародний патент WO 2004/008099A2, патент США US 2004/0106161, міжнародний патент WO 2004/048525, патенти США US 2004/0258685A1, US 5985553, US 5747261, US 4935341, US 5401638, US 5604107, міжнародні патенти WO 87/07646, WO 89/10412, WO 91/05264, європейські патенти EP 412116B1, EP 494135B1, патент США US 5824311, європейські патенти EP 444181B1, EP 1006194A2, патент США US 2002/0155527A1, міжнародний патент WO 91/02062, патенти США US 5571894, US 5939531, EP 502812B1, міжнародний патент WO 93/03741, EP 554441B1, європейський патент EP 656367A1, патенти США US 5288477, US 5514554, US 5587458, міжнародні патенти WO 93/12220, WO 93/16185, патент США US 5877305, міжнародні патенти WO 93/21319, WO 93/21232, патент США US 5856089, міжнародний патент WO 94/22478, патенти США US 5910486, US 6028059, міжнародний патент WO 96/07321, патенти США US 5804396, US 5846749, європейський патент EP 711565, міжнародний патент WO 96/16673, патенти США US 5783404, US 5977322, US 6512097, міжнародний патент WO 97/00271, патенти США US 6270765, патенти США US 6395272, US 5837243, міжнародний патент WO 96/40789, патенти США US 5783186, US 6458356, міжнародні патенти WO 97/20858, WO 97/38731, патенти США US 6214388, US 5925519, міжнародний патент WO 98/02463, патенти США US 5922845, міжнародні патенти WO 98/18489, WO 98/33914, патент США US 5994071, міжнародний патент WO 98/45479, патенти США US 6358682B1, US 2003/0059790, міжнародні патенти WO 99/55367, WO 01/20033, патент США US 2002/0076695A1, міжнародні патенти WO 00/78347, WO 01/09187, WO 01/21192, WO 01/32155, WO 01/53354, WO 01/56604, WO 01/76630, WO02/05791, WO 02/11677, патенти США US 6582919, US 2002/0192652A1, US 2003/0211530A1, міжнародний патент WO 02/44413, US 2002/0142328, US 6602670B2, міжнародні патенти WO 02/45653, WO 02/055106, патенти США US 2003/0152572, US 2003/0165840, міжнародні патенти WO 02/087619, WO 03/006509, WO 03/012072, WO 03/028638, патент США US 2003/0068318, міжнародний патент WO 03/041736, європейський патент EP 1357132, патенти США US 2003/0202973, US 2004/0138160, US 5705157, US 6123939, європейський патент EP 616812B1, US 2003/0103973, US 2003/0108545, 14 UA 106070 C2 5 10 15 20 25 30 35 40 45 50 55 60 US 6403630B1, міжнародні патенти WO 00/61145, WO 00/61185, патент США US 6333348B1, міжнародні патенти WO 01/05425, WO 01/64246, патенти США US 2003/0022918, US 2002/0051785 A1, US 6767541, міжнародний патент WO 01/76586, патент США US 2003/0144252, міжнародний патент WO 01/87336, патент США US 2002/0031515 A1, міжнародні патенти WO 01/87334, WO 02/05791, WO 02/09754, патенти США US 2003/0157097, US 2002/0076408, міжнародні патенти WO 02/055106, WO 02/070008, WO 02/089842 і WO 03/86467. "Активація HER" стосується активації або фосфорилування будь-якого одного або більше рецепторів HER. Загалом активація HER приводить до сигнальної трансдукції (наприклад, яка викликана внутрішньоклітинним кіназним доменом рецептора HER, фосфорилуючим тирозинові залишки в рецепторі HER або субстратному поліпептиді). Активація HER може бути опосередкована лігандом HER, зв'язуванням ліганду з димером HER, який містить рецептор HER, що представляє інтерес. Зв'язування ліганду HER з димером HER може активувати кіназний домен одного або більше рецепторів HER в димері і внаслідок цього приводить до фосфорилування залишків тирозину в одному або більше рецепторах HER і/або до фосфорилування залишків тирозину в додаткових субстратних поліпептидах, таких як внутрішньоклітинні кінази Akt або MAPK. "Фосфорилування" означає додавання однієї або більше фосфатних груп до білка, такого як рецептор HER, або його субстрату. "Гетеродимерна ділянка зв'язування" на HER2 стосується ділянки позаклітинного домену HER2, яка контактує або сполучається з ділянкою позаклітинного домену EGFR, HER3 або HER4 при формуванні з ним димеру. Ділянка виявлена в доменіII HER2. Franklin et al. Cancer Cell 5:317-328 (2004). HER2-антитіло, яке "зв'язується з гетеродимерною ділянкою зв'язування" HER2, зв'язується із залишками в домені II (і додатково також зв'язується із залишками інших доменів крім позаклітинного домену HER2, таких як домени I і III), і може стерично перешкоджати, щонайменше до деякої міри, формуванню гетеродимеру HER2-EGFR, HER2-HER3 або HER2HER4. Franklin et al. Cancer Cell 5:317-328 (2004) описує кристалічну структуру HER2пертузумаб, депоновану в базі даних білкових структур RCSB (ідентифікаційний код IS78), що ілюструє типове антитіло, яке зв'язується з гетеродимерною ділянкою зв'язування HER2. Антитіло, яке "зв'язується з доменом II" HER2, зв'язується із залишками в домені II і додатково із залишками в іншому домені (доменах) HER2, такому як домени I і III. Термін "ізольований", коли він використовується для опису різних антитіл, розкритих в цьому документі, означає антитіло, яке ідентифіковане і відділене і/або витягнуте з клітини або з клітинної культури, в якій воно експресоване. Забруднюючі компоненти його природного оточення являють собою речовини, які будуть заважати діагностичному або терапевтичному застосуванням поліпептиду, і вони можуть включати в себе ферменти, гормони і інші білкові або небілкові розчинені речовини. У переважних варіантах здійснення антитіло буде очищене (1) до міри, достатньої для одержання щонайменше 15 залишків N-кінцевої або внутрішньої амінокислотної послідовності при застосуванні спінінгового чашкового секвенатора, або (2) до гомогенності при постановці SDS-PAGE у відновних або невідновних умовах з використанням Кумасі синього або переважно при забарвленні сріблом. Виділене антитіло включає антитіло in situ в рекомбінантних клітинах, оскільки щонайменше один компонент з природного середовища антитіла буде відсутній. Як правило, однак, виділене антитіло буде приготоване щонайменше за допомогою однієї стадії очищення. У деяких варіантах здійснення мультиспецифічне анти-HER антитіло являє собою виділене антитіло. Термін "регулюючі послідовності" стосується послідовностей ДНК, необхідних для експресії функціонально зв'язаної кодуючої послідовності в конкретному організмі-хазяїні. Регулюючі послідовності, які придатні для прокаріотів, наприклад, включають в себе промотор, необов'язково операторну послідовність і сайт зв'язування з рибосомами. Відомо, що еукаріотичні клітини використовують промотори, сигнали поліаденілювання і енхансери. Нуклеїнова кислота "функціонально зв'язана", коли її поміщають в функціональний зв'язок з іншою нуклеїновокислотною послідовністю. Наприклад, ДНК для препослідовності або секреторного лідера функціонально зв'язана з ДНК для поліпептиду, якщо він експресується у вигляді препротеїну, який бере участь в секреції поліпептиду; промотор або енхансер функціонально зв'язаний з кодуючою послідовністю, якщо він впливає на транскрипцію послідовності; сайт зв'язування з рибосомами функціонально зв'язаний з кодуючою послідовністю, якщо він розташований таким чином, щоб полегшити трансляцію. Як правило, "функціонально зв'язаний" означає, що зв'язані послідовності ДНК є суміжними і у випадку секреторного лідера є суміжними і знаходяться в фазі зчитування. Однак енхансери необов'язково є суміжними. Зв'язування відбувається за допомогою лігування у відповідних 15 UA 106070 C2 5 10 15 20 25 30 35 40 45 50 55 60 сайтах рестрикції. Якщо такі сайти відсутні, то застосовують синтетичні адаптери або лінкери згідно із звичайною практикою. "Процент (%) ідентичності амінокислотної послідовності" відносно референсної поліпептидної послідовності визначається як процентна частка амінокислотних залишків в кандидатній послідовності, які ідентичні амінокислотним залишкам в референсній поліпептидній послідовності, після вирівнювання послідовностей і, за необхідності, введення гепів для досягнення максимальної процентної ідентичності послідовності, при цьому не розглядаються які-небудь консервативні заміни як частина ідентичності послідовності. Вирівнювання з метою визначення ступеня ідентичності амінокислотної послідовності може бути проведене різними способами, які відомі фахівцю в даній галузі техніки, наприклад, із застосуванням загальнодоступного програмного забезпечення, такого як програмне забезпечення BLAST, BLAST-2, ALIGN або Megalign (DNASTAR). Фахівці в даній галузі можуть визначити придатні параметри для вирівнювання послідовностей, включаючи будь-які алгоритми, необхідні для досягнення максимального вирівнювання по всій довжині порівнюваних послідовностей. У рамках цього документа, однак, значення % ідентичності амінокислотної послідовності одержують із застосуванням комп'ютерної програми порівняння послідовностей ALIGN-2. Комп'ютерна програма порівняння послідовностей ALIGN-2 була затверджена Genentech, Inc., і вихідний код був зареєстрований з документацією користувача в Бюро реєстрації авторських прав США, Washington D.C., 20559, де він зареєстрований під номером реєстрації авторського права США № TXU510087. Програма ALIGN-2 є загальнодоступною через компанію Genentech, Inc., South San Francisco, California, або може бути відкомпільована з вихідного коду. Програму ALIGN-2 потрібно відкомпілювати для використання в операційній системі UNIX, включаючи digital UNIX V4.0D. Всі параметри порівняння послідовностей встановлюються програмою ALIGN-2 і не повинні змінюватися. У ситуаціях, де ALIGN-2 використовується для порівнянь амінокислотних послідовностей, % ідентичності амінокислотної послідовності даної амінокислотної послідовності А відносно, з або проти даної амінокислотної послідовності В (яка альтернативно може бути охарактеризована як дана амінокислотна послідовність А, яка має або включає в себе певний % ідентичності амінокислотної послідовності відносно, з або проти амінокислотної послідовності В) розраховують таким чином: 100 × фракція X/Y, де X означає кількість амінокислотних залишків, оцінених як ідентичні збіги програмою вирівнювання послідовностей ALIGN-2 при вирівнюванні вказаною програмою А і В, і де Y означає загальну кількість амінокислотних залишків в B. Буде зрозуміло, що в тому випадку, коли довжина амінокислотної послідовності А не дорівнює довжині амінокислотної послідовності В, ідентичність амінокислотної послідовності А в порівнянні з В в % не буде дорівнювати ідентичності амінокислотної послідовності В в порівнянні з А в %. Якщо не указано інакше, всі значення % ідентичності амінокислотної послідовності, використовувані в цьому документі, одержують, як описано в попередньому параграфі, із застосуванням комп'ютерної програми ALIGN-2. "Жорсткість" реакцій гібридизації легко визначається фахівцями в даній галузі і, як правило, емпірично обчислюється залежно від довжини зонда, температури відмивання і концентрацій солей. Загалом, більш довгі зонди вимагають вищих температур для належного відпалу, тоді як для більш коротких зондів потрібні нижчі температури. Гібридизація загалом залежить від здатності денатурованої ДНК до повторного відпалу, коли комплементарні ланцюги представлені в середовищі при температурі нижче їх температури плавлення. Чим вищий ступінь бажаної гомології між зондом і гібридизованою послідовністю, тим вища відносна температура, яку потрібно застосовувати. У результаті, з цього випливає, що вищі значення відносних температур будуть мати тенденцію робити умови реакції більш жорсткими, тоді як нижчі температури менш жорсткими. Для додаткових деталей і пояснень відносно жорсткості реакцій гібридизації див. Ausubel et al. Current Protocols in Molecular Biology, Wiley Interscience Publishers (1995). "Жорсткі умови" або "умови високої жорсткості" за цим документом можуть бути визначені як умови при яких: (1) використовують низьку іонну силу і високу температуру при відмиванні, наприклад, 0,015 M хлорид натрію/0,0015 M цитрат натрію/0,1 % додецилсульфат натрію при 50 °C; (2) застосовують під час гібридизації денатуруючий агент, такий як формамід, наприклад, 50 % (об./об.) формамід з 0,1 % бичачого сироваткового альбуміну/0,1 % Фікол/0,1 % полівінілпіролідон/50 мМ буфер фосфату натрію при pH 6,5 з 750 мМ хлоридом натрію, 75 мМ цитратом натрію при 42 °C; або (3) гібридизація протягом ночі в розчині, який містить 50 % формамід, 5× SSC (0,75 M NaCl, 0,075 M цитрат натрію), 50 мМ фосфат натрію (pH 6,8), 0,1 % 16 UA 106070 C2 5 10 15 20 25 30 35 40 45 50 55 60 пірофосфат натрію, 5× розчин Денхардта, ДНК сперми лосося, оброблену ультрозвуком (50 мкг/мл), 0,1 % SDS і 10 % сульфат декстрану при 42 °C, з відмиванням протягом 10 хвилин при 42 °C в 0,2× SSC (хлорид натрію/цитрат натрію), за яким іде відмивання в умовах високої жорсткості протягом 10 хвилин, що включає в себе 0,1× SSC, що містить EDTA, при 55 °C. "Умови помірної жорсткості" можуть бути визначені, як описано Sambrook et al. Molecular Cloning: А Laboratory Manual. New York: Cold Spring Harbor Press, 1989, і включають в себе застосування мийного розчину і умов гібридизації (наприклад, температура, іонна сила і % SDS) менш жорстких, ніж умови, описані вище. Приклад умов помірної жорсткості являє собою інкубацію протягом ночі при 37 °C в розчині, що містить: 20 % формамід, 5× SSC (150 мМ NaCl, 15 мМ тринатрієвий цитрат), 50 мМ фосфат натрію (pH 7,6), 5× розчин Денхардта, 10 % сульфат декстрану і 20 мг/мл денатурованої розщепленої ДНК сперми лосося, з подальшим відмиванням фільтрів в 1× SSC при 37-50 °C. Фахівець в даній галузі техніки буде визначати, як підібрати температуру, іонну силу і т. д. в необхідних випадках, щоб привести у відповідність з факторами, такими як розмір зонда і т. п. "Ефекторні функції" антитіла стосуються таких біологічних активностей, які властиві області Fc (область Fc нативної послідовності або варіантної області Fc амінокислотної послідовності) антитіла, і вони варіюють залежно від ізотипу антитіла. Приклади ефекторних функцій антитіла включають зв'язування C1q; комплементзалежну цитотоксичність; зв'язування рецептора Fc; антитілозалежну опосередковувану клітинами цитотоксичність (ADCC); фагоцитоз; понижувальну регуляцію клітинних поверхневих рецепторів (наприклад, рецептора В-клітин) і Вклітинну активацію. "Антитілозалежна клітинно-опосередкована цитотоксичність" або "ADCC" стосується форми цитотоксичності, при якій секреторний Ig, зв'язаний на Fc-рецепторах (FcRs), представлених на певних цитотоксичних клітинах (наприклад, натуральні кілерні клітини (NK), нейтрофіли і макрофаги), дозволяє вказаним цитотоксичним ефекторним клітинам специфічно зв'язуватися з клітиною-мішенню, що несе антиген, і потім знищувати клітину-мішень за допомогою цитотоксинів. Антитіла "озброюють" цитотоксичні клітини і є абсолютно необхідними для такого знищення. Основні клітини для опосередковування ADCC, клітини NK, експресують тільки FcγRIII, в той час як моноцити експресують FcγRI, FcγRII і FcγRIII. Експресія FcR на гематопоетичних клітинах в узагальненому вигляді представлена в таблиці 3 на сторінці 464 Ravetch and Kinet, Annu. Rev. Immunol., 9: 457-92 (1991). Для оцінки активності ADCC для молекули, що представляє інтерес, може бути здійснений тест ADCC in vitro, такий як тест, описаний в патенті США № 5500362 або 5821337. Придатні ефекторні клітини для постановки таких тестів включають в себе мононуклеарні клітини периферичної крові (PBMC) і клітининатуральні кілери (NK). Альтернативно або додатково, активність ADCC молекул, що представляють інтерес, можна оцінити в умовах in vivo, наприклад, на моделі на тваринах, такій як розкрита Clynes et al. (Proc. Natl. Acad. Sci. USA, 95:652-656 (1998)). "Fc-рецептор" або "FcR" описує рецептор, який зв'язується з областю Fc антитіла. Переважний FcR являє собою людський FcR з нативною послідовністю. Крім того, переважний FcR представляє такий, який зв'язується з IgG антитілом (гамма-рецептор) і включає в себе рецептори підкласів FcγRI, FcγRII FcR і FcγRIII, включаючи алельні варіанти і альтернативно сплайсовані форми даних рецепторів. Рецептори FcγRII включають в себе FcγRIIA ("активуючий рецептор") і FcγRIIB ("інгібуючий рецептор"), які мають схожі амінокислотні послідовності, які в основному розрізнюються по їх цитоплазматичних доменах. Активуючий рецептор FcγRIIA містить мотив активації на основі тирозину імунорецептора (ITAM) в своєму цитоплазматичному домені. Інгібуючий рецептор FcγRIIB містить мотив інгібування на основі тирозину імунорецептора (ITIM) в його цитоплазматичному домені (див. огляд Daeron, Annu. Rev. Immunol. 15:203-234 (1997)). FcRs розглядаються в Ravetch and Kinet, Annu. Rev. Immunol. 9:457-492 (1991); Capel et al. Immunomethods 4:25-34 (1994); і de Haas et al. J. Lab. Clin. Med. 126:330-41 (1995). Інші FcR, включаючи такі, які будуть відкриті в майбутньому, об'єднуються тут терміном "FcR". Термін також включає неонатальний рецептор, FcRn, який відповідальний за перенесення материнських IgG плоду (Guyer et al. J. Immunol. 117:587 (1976), і Kim et al. J. Immunol. 24:249 (1994)). "Людські ефекторні клітини" являють собою лейкоцити, які експресують один або більше FcR і здійснюють ефекторні функції. Переважно клітини експресують щонайменше FcγRIII і здійснюють ефекторну функцію ADCC. Приклади людських лейкоцитів, які опосередковують ADCC, включають в себе мононуклеарні клітини периферичної крові (PBMC), клітини-натуральні кілери (NK), моноцити, цитотоксичні Т-клітини і нейтрофіли, при цьому PBMC і NK-клітини є переважними. Ефекторні клітини можуть бути виділені з їх природного джерела, наприклад, з крові. 17 UA 106070 C2 5 10 15 20 25 30 35 40 45 50 55 60 "Комплементзалежна цитотоксичність" або "CDC" стосується лізису клітини-мішені в присутності комплементу. Класичний шлях активації комплементу починається зі зв'язування першого компонента системи комплементу (C1q) з антитілами (відповідного підкласу), які зв'язуються зі своїм упізнаваним антигеном. Для оцінки активації комплементу може бути здійснений тест CDC, наприклад, як описано Gazzano-Santoro et al. J. Immunol. Methods 202:163 (1996). Застосовуваний в цьому документі термін "лікування" (і його граматичні варіанти, такі як "лікувати" або "проводити лікування") стосується клінічного втручання в спробі змінити природний перебіг захворювання у суб'єкта, якого лікують, і може здійснюватися або для профілактики, або в ході клінічної патології. Бажані ефекти лікування включають в себе, але без обмеження, запобігання появі або рецидиву захворювання, полегшення симптомів, зменшення яких-небудь прямих або непрямих патологічних наслідків захворювання, запобігання метастазуванню, зниження процента випадків прогресування захворювання, поліпшення стану або тимчасове ослаблення хворобливого стану і ремісію або поліпшення прогнозу. У деяких варіантах здійснення антитіла винаходу застосовують, щоб відкласти розвиток захворювання або уповільнити прогресування захворювання. Термін "терапевтично ефективна кількість" стосується кількості антитіла або фрагмента антитіла для лікування захворювання або порушення у суб'єкта. У випадку пухлини (наприклад, злоякісної пухлини), терапевтично ефективна кількість антитіла або фрагмента антитіла може зменшити число ракових клітин; зменшити розмір первинної пухлини; інгібувати (тобто сповільнити до деякої міри і переважно зупинити) інфільтрацію ракових клітин до периферичних органів; інгібувати (тобто сповільнити до деякої міри і переважно зупинити) метастазування пухлини; інгібувати до деякої міри пухлинний ріст і/або зменшити до деякої міри один або більше симптомів, асоційованих з порушенням. У тих випадках, коли антитіло або фрагмент антитіла може запобігти росту і/або убити існуючі ракові клітини, воно може бути цитостатичним і/або цитотоксичним. При раковій терапії, ефективність in vivo може бути виміряна, наприклад, за допомогою оцінки тривалості виживаності, часу до прогресування захворювання (TTP), процента пацієнтів, що відповіли на лікування (RR), тривалості відповіді і/або якості життя. Під "зменшити або інгібувати" мають на увазі здатність викликати загальне зниження переважно на 20 % або більше, більш переважно на 50 % або більше і найбільш переважно на 75, 85, 90, 95 % або більше. "Зменшити або інгібувати" може стосуватися симптомів порушення, яке лікують, присутності або розмірів метастазів, розміру первинної пухлини або розміру або кількості кровоносних судин при ангіогенних порушеннях. Терміни "рак" і "раковий" стосуються або описують фізіологічний стан у ссавців, який звичайно характеризується нерегульованим клітинним ростом. Дане визначення включає в себе пухлини зі сприятливим і злоякісним перебігом. Під "ранньою стадією раку" мають на увазі рак, який не є інвазивним або метастатичним або класифікується як рак в стадії 0, I або II. Термін "передраковий" стосується стану або росту, який звичайно передує або розвивається в рак. Під "неметастатичним" розуміють рак, який має сприятливий перебіг або залишається в первинному осередку і не проникає в лімфатичну або кровоносну систему або в тканини, інші ніж первинний осередок. Як правило, неметастатичний рак являє собою який-небудь рак в стадії 0, I або II і іноді рак в стадії III. "Фармацевтично прийнятний носій" стосується інгредієнта в фармацевтичній композиції, іншого, ніж активний інгредієнт, який є нетоксичним для суб'єкта. Фармацевтично прийнятний носій включає в себе, але без обмеження, буфер, середовище для ліків, стабілізатор або консервант. Термін "протиракова терапія" стосується терапії, застосовуваної в лікуванні раку. Приклади протиракових терапевтичних агентів включають в себе, але без обмеження, наприклад, хіміотерапевтичні агенти, агенти, інгібуючі ріст, цитотоксичні агенти, агенти, застосовувані в радіаційній терапії, агенти, перешкоджаючі ангіогенезу, апоптотичні агенти, антитубулінові агенти і інші агенти для лікування раку, анти-CD20 антитіла, інгібітори тромбоцитарного TM фактора росту (наприклад, Gleevec (іматинібу мезилат)), інгібітор COX-2 (наприклад, целекоксиб), інтерферони, цитокіни, антагоністи (наприклад, нейтралізуючі антитіла), які зв'язуються з однією або більше з наступних мішеней EGFR, ErbB2, ErbB3, ErbB4, PDGFR-бета, BIyS, APRIL, BCMA або рецептор (рецептори) VEGF, TRAIL/Apo2, і інші біоактивні і органічні хімічні агенти і т. п. Їх комбінації також включені у винахід. "Хіміотерапевтичний агент" являє собою хімічну сполуку, застосовувану в лікуванні раку. Приклади хіміотерапевтичних засобів включають алкілувальні агенти, такі як тіотепа і TM циклофосфамід (CYTOXAN ); алкілсульфонати, такі як бусульфан, імпросульфан і 18 UA 106070 C2 5 10 15 20 25 30 35 40 45 50 55 60 піпосульфан; азиридини, такі як бензодопа, карбоквон, метуредопа і уредопа; етиленіміни і метиламеламіни, включаючи альтретамін, триетиленмеламін, триетиленфосфорамід, триетилентіофосфорамід і триметилмеламін; ацетогеніни (особливо булатацин і булатацинон); дельта-9-тетрагідроканабінол (дронабінол, MARINOL®); бета-лапахол; колхіцини; бетулінову кислоту; камптотецин (включаючи синтетичний аналог топотекан (HYCAMTIN®), CPT-11 (іринотекан, CAMPTOSAR®), ацетилкамптотецин, скополектин і 9-амінокамптотецин); бріостатин; калістатин; CC-1065 (включаючи його синтетичні аналоги адозелезин, карзелезин і бізелезин); подофілотоксин; подофілінову кислоту; теніпозид; криптофіцини (зокрема криптофіцин 1 і криптофіцин 8); доластатин; дуокарміцин (включаючи синтетичні аналоги KW2189 і CB1-TM1); елеутеробін; панкратистатин; саркодиктиїн; спонгістатин; азотистий іприт, такий як хлорамбуцил, хлорнафазин, хлорфосфамід, естрамустин, іфосфамід, мехлоретамін, гідрохлорид оксиду мехлоретаміну, мелфалан, новембіхін, фенестерин, преднімустин, трофосфамід, урацилмустин; нітрозосечовини, такі як кармустин, хлорозотоцин, фотемустин, ломустин, німустин і ранімустин; антибіотики, такі як енедіїнові антибіотики (наприклад, каліхеаміцин, зокрема каліхеаміцин-гамма II і каліхеаміцин-омега II (див., наприклад, Nicolaou et al. Angew. Chem Intl. Ed. Engl, 33: 183-186 (1994)); CDP323, пероральний інгібітор альфа-4 інтегрину; динеміцин, включаючи динеміцин А; еспераміцин; а також хромофор неокарциностатину і споріднені хромофори хромопротеїнів - енедіїнові антибіотики, аклациномізини, актиноміцин, аутраміцин, азасерин, блеоміцини, кактиноміцин, каліхеаміцин, карабіцин, карміноміцин, карзинофілін, хромоміцини, дактиноміцин, аунорубіцин, деторубіцин, 6-діазо-5-оксо-L-норлейцин, доксорубіцин (включаючи ADRIAMYCIN®, морфолін-доксорубіцин, ціаноморфолін-доксорубіцин, 2-піролін-доксорубіцин, ліпосомальна ін'єкція доксорубіцин HCl (DOXIL®), ліпосомальний доксорубіцин TLC D-99 (MYOCET®), пегильований ліпосомальний доксорубіцин (CAELYX®) і деоксидоксорубіцин), епірубіцин, езорубіцин, ідарубіцин, марцеломіцин, мітоміцини, такі як мітоміцин С, мікофенольна кислота, ногаламіцин, оливоміцини, пепломіцин, потфіроміцин, пуроміцин, квуламіцин, родорубіцин, стрептонігрин, стрептозоцин, туберцидин, убенімекс, зиностатин, зорубіцин; антиметаболічні агенти, такі як метотрексат, гемцитабін (GEMZAR®), тегафур (UFTORAL®), Капецитабін (XELODA®), епотилон і 5-фторурацил (5-FU); аналоги фолієвої кислоти, такі як деноптерин, метотрексат, птероптерин, триметрексат; аналоги пуринів, такі як флударабін, 6-меркаптопурин, тіаміприн, тіогуанін; аналоги піримідинів, такі як анцитабін, азацитидин, 6-азауридин, кармофур, цитарабін, дидезоксіуридин, доксифлуридин, еноцитабін, флоксуридин; андрогени, такі як калустерон, дромостанолону пропіонат, епітіостанол, мепітіостан, тестолактон; препарати антагоністи гормонів надниркових залоз, такі як аміноглутетимід, мітотан, трилостан; заповнювач фолієвої кислоти, такий як фролінікова кислота; ацеглатон; альдофосфаміду глікозид; амінолевулінова кислота; енілурацил; амсакрин; бестрабуцил; бізантрен; едатраксат; дефофамін; демекольцин; діазиквон; елфорнітин; ацетат еліптинію; етоглуцид; нітрат галію; гідроксисечовину; лентинан; лонідамін; майтанзиноїди, такі як майтазин і ансамітоцини; мітогуазон; мітоксантрон; мопіданмол; нітраерин; пентостатин; фенамет; пірарубіцин; лозоксантрон; подофілінову кислоту; 2-етилгідразид; прокарбазин; PSK® полісахаридний комплекс (JHS Natural Products, Eugene, OR); разоксан; ризоксин; сизофіран; спірогерманій; тенуазонову кислоту; триазиквон; 2,2',2''-трихлортриетиламін; трихотецени (зокрема токсин Т-2, веракурин А, роридин А і ангуїдин); уретан; віндезин; (ELDISINE®, FILDESIN®); дакарбазин; маномустин; мітобронітол; мітолактол; піпоброман; гацитозин; арабінозид ("Ara-C"); тіотепу; таксоїди, наприклад, паклітаксел (TAXOL®), альбумінсконструйована композиція наночастинок паклітакселу TM (ABRAXANE ) і доксетаксел (TAXOTERE®); хлоранбуцил; 6-тіогуанін; меркаптопурин; метотрексат; агенти платини, такі як цисплатин, оксаліплатін (наприклад, ELOXATIN®) і карбоплатин; вінкас, який запобігає полімеризації тубуліну з утворенням мікротрубочок, включаючи вінбластин (VELBAN®), вінкристин (ONCOVIN®), віндезин (ELDISINE®, FILDESIN®) і вінорелбін (NAVELBINE®); етопозид (VP-16); іфосфамід; мітоксантрон; лейковорин; новантрон; едатрексат; дауноміцин; аміноптерин; ібандронат; інгібітор топоізомерази RFS 2000; дифторметилорнітин (DMFO); ретиноїди, такі як ретиноєва кислота, включаючи бексаротен (TARGRETIN®); бісфосфонати, такі як клодронат (наприклад, BONEFOS® або OSTAC®), етидронат (DIDROCAL®), NE-58095, золедронова кислота/золедронат (ZOMETA®), алендронат (FOSAMAX®), памідронат (AREDIA®), тилудронат (SKELID®) або ризедронат (ACTONEL®); троксацитабін (1,3-діоксолановий нуклеозидний аналог цитозину); антисмислові олігонуклеотиди, зокрема олігонуклеотиди, які інгібують експресію генів в шляхах передачі сигналів, залучених в проліферацію аберантних клітин, таких як, наприклад, PKC-альфа, Raf, HRas і рецептор епідермального фактора росту (EGF-R); вакцини, такі як вакцина THERATOPE® і вакцини для генної терапії, наприклад, вакцина ALLOVECTIN®, вакцина LEUVECTIN® і вакцина 19 UA 106070 C2 5 10 15 20 25 30 35 40 45 50 55 60 VAXID®; інгібітор топоізомерази 1 (наприклад, LURTOTECAN®); rmRH (наприклад, ABARELIX®); BAY439006 (сорафеніб; Bayer); SU-11248 (Сунітиніб, SUTENT®, Pfizer); перифосин, інгібітор COX-2 (наприклад, целекоксиб або еторикоксиб), інгібітор протеосом (наприклад, PS341); бортезоміб (VELCADE®); CCI-779; типіфаніб (Rl1577); орафеніб, ABT510; інгібітор Bcl-2, такий як облімерсен натрію (GENASENSE®); піксантрон; інгібітори EGFR (див. визначення нижче); інгібітори тирозинкінази (див. визначення нижче); інгібітори серин-треонін кінази, такі як рапаміцин (сиролімус, RAPAMUNE®); інгібітори фарнезилтрансферази, такі як TM лонафарніб (SCH 6636, SARASAR ); і фармацевтично прийнятні солі, кислоти і похідні будьякого з вищезгаданого; а також комбінації двох або більше з вищезгаданого, такі як CHOP, абревіатура комбінованої терапії циклофосфамідом, доксорубіцином, вінкристином і TM преднізолоном; і FOLFOX, абревіатура схеми лікування оксаліплатином (ELOXATIN ) в комбінації з 5-FU і лейковорином. Хіміотерапевтичні агенти, як визначено в цьому документі, включають в себе "антигормональні агенти" або "ендокринні ліки", які функціонують для регуляції, зменшення, блокування або інгібування ефектів гормонів, які можуть посилювати ріст злоякісної пухлини. Вони можуть бути гормонами самі по собі, включаючи, але без обмеження: антиестрогени зі змішаним профілем агоніст/антагоніст, включаючи тамоксифен (NOLVADEX®), 4гідрокситамоксифен, тореміфен (FARESTON®), ідоксифен, дролоксифен, ралоксифен (EVISTA®), триоксифен, кеоксифен, і селективні модулятори рецепторів естргенів (SERM), такі як SERM3; чисті антиестрогени без властивостей агоністів, такі як фулвестрант (FASLODEX®) і EM800 (такі агенти можуть блокувати димеризацію рецептора естрогену (ER), інгібувати зв'язування ДНК, збільшувати обмін ER і/або пригнічувати рівні ER); інгібітори ароматази, включаючи стероїдні інгібітори ароматази, такі як форместан і екземестан (AROMASIN®), і нестероїдні інгібітори ароматази, такі як анастрозол (ARIMIDEX®), летрозол (FEMARA®) і аміноглютетіамід, і інші інгібітори ароматази включають в себе ворозол (RIVISOR®), мегестролу ацетат (MEGASE®), фадрозол і 4(5)-імідазоли; агоністи гонадотропін-рилізинг гормону, включаючи леупролід (LUPRON® і ELIGARD®), гозерелін, бусерелін і триптерелін; статеві стероїди, включаючи прогестини, такі як мегестролу ацетат і медроксипрогестерону ацетат, естрогени, такі як діетилстильбестрол і премарин, і андрогени/ретиноїди, такі як флуоксиместерон, повністю трансретиноєва кислота і фенретинід; онапристон; антипрогестерони; понижувальні регулятори рецепторів естрогенів (ERDs); антиандрогени, такі як флутамід, нілутамід, бікалутамід; і фармацевтично прийнятні солі, кислоти і похідні будьякого з вищезгаданого; а також комбінації двох або більше з вищезгаданого. "Суб'єкт" являє собою хребетне, переважно ссавця, більш переважно людину. Ссавці включають в себе, але без обмеження, людину, вищих приматів, крім людини, приматів, сільськогосподарських тварин (таких як корови), спортивних тварин, домашніх тварин (таких як кішки, собаки і коні) і лабораторних тварин (таких як миші і щури). II. Докладний опис Даний винахід надає антитіла і функціональні фрагменти антитіла, що містять щонайменше один антигензв'язувальний домен, який має специфічність зв'язування відносно щонайменше двох різних HER-рецепторів, зокрема EGFR і HER2, EGFR і HER3 або EGFR і HER4. Вказані мультиспецифічні антитіла відрізняються від традиційних мультиспецифічних антитіл, які мають антигензв'язувальні домени (звичайно два) з різною специфічністю зв'язування. У певних варіантах здійснення мультиспецифічні антитіла, описані в цьому документі, мають молекулярну структуру IgG (або Fab) і, таким чином, зберігають сприятливі властивості IgG для терапевтичного конструктивного поліпшення, такі як передбачувані фармакокінетичні властивості, встановлені протоколи одержання, вибір Fc-опосередкованих ефекторних функцій і бі- або моновалентності. Вказані сприятливі властивості часто є недостатніми в традиційних мультиспецифічних антитілах, які одержують об'єднанням двох різних фрагментів антитіл в одній молекулі. Мультиспецифічні антитіла, описані в цьому документі, і їх функціональні фрагменти є корисними в лікуванні захворювань або станів, таких як злоякісні пухлини, які асоційовані з метаболічним шляхом HER-рецептора. У конкретному варіанті здійснення антигензв'язувальний домен мультиспецифічного антитіла специфічно зв'язується з EGFR і HER3. У іншому варіанті здійснення антигензв'язувальний домен специфічно зв'язується з EGFR і HER2. У іншому варіанті здійснення антигензв'язувальний домен специфічно зв'язується з EGFR і HER4. Один конкретний аспект винаходу надає антитіла, що містять два (або більше) антигензв'язувальних домени, кожний з яких має однакову специфічність зв'язування. У одному варіанті здійснення надається мультиспецифічне антитіло, що містить два антигензв'язувальних домени, де кожний антигензв'язувальний домен має таку ж специфічність 20 UA 106070 C2 5 10 15 20 25 30 35 40 45 50 55 і специфічно зв'язується з двома різними HER-рецепторами. У конкретному варіанті здійснення кожний антигензв'язувальний домен специфічно зв'язується з EGFR і HER3. У іншому варіанті здійснення кожний антигензв'язувальний домен специфічно зв'язується з EGFR і HER2. У іншому варіанті здійснення кожний антигензв'язувальний домен специфічно зв'язується з EGFR і HER4. У ще одному варіанті здійснення кожний антигензв'язувальний домен специфічно зв'язується з доменом III EGFR. У іншому варіанті здійснення кожний антигензв'язувальний домен специфічно зв'язується з доменом III HER3. У ще одному варіанті здійснення кожний антигензв'язувальний домен здатний до зв'язування з доменом III EGFR і доменом III HER3. У конкретних варіантах здійснення мультиспецифічне антитіло специфічно зв'язується зі своїм цільовим HER-рецептором або HER-рецепторами і не зв'язується специфічно з нецільовими HER-рецепторами. Відповідно, в одному варіанті здійснення мультиспецифічне антитіло специфічно зв'язується з EGFR і HER3, але не зв'язується специфічно з HER2 або HER4. У іншому варіанті здійснення мультиспецифічне антитіло специфічно зв'язується з EGFR і HER2, але не зв'язується специфічно з HER3 або HER4. У іншому варіанті здійснення мультиспецифічне антитіло специфічно зв'язується з EGFR і HER4, але не зв'язується специфічно з HER2 або HER3. У певних варіантах здійснення кожний антигензв'язувальний домен включає в себе варіабельний домен важкого ланцюга (VH) і варіабельний домен легкого ланцюга (VL). У одному варіанті здійснення одиниця VHVL специфічно зв'язується з двома різними HER-рецепторами. У конкретному варіанті здійснення одиниця VHVL специфічно зв'язується з EGFR і HER3. У іншому варіанті здійснення одиниця VHVL специфічно зв'язується з EGFR і HER2. У іншому варіанті здійснення одиниця VHVL специфічно зв'язується з EGFR і HER4. У конкретних варіантах здійснення афінність мультиспецифічного антитіла відносно його -5 цільового HER-рецептора або рецепторів визначається за допомогою Kd менше ніж 10 M, -6 -7 -8 -9 -10 менше ніж 10 M, менше ніж 10 M, менше ніж 10 M, менше ніж 10 M, менше ніж 10 M, -11 -12 менше ніж 10 M або менше ніж 10 M. У одному варіанті здійснення Kd антитіла відносно -7 -8 -9 одного з його цільових рецепторів складає менше ніж 10 M, менше ніж 10 M, менше ніж 10 M, -10 -11 -12 менше ніж 10 M, менше ніж 10 M або менше ніж 10 M. У іншому варіанті здійснення Kd -7 мультиспецифічного антитіла відносно всіх його цільових рецепторів складає менше ніж 10 M, -8 -9 -10 -11 -12 менше ніж 10 M, менше ніж 10 M, менше ніж 10 M, менше ніж 10 M або менше ніж 10 M. У деяких варіантах здійснення афінність мультиспецифічного антитіла відносно одного з його цільових HER-рецепторів є більше, ніж відносно його іншого цільового HER-рецептора або рецепторів. У одному варіанті здійснення афінність мультиспецифічного антитіла відносно одного цільового HER-рецептора є щонайменше в 2, 3, 4, 5, 8, 10, 12, 15, 18, 20, 22, 25, 30, 35, 40, 50, 100 разів більше, ніж його афінність відносно іншого цільового HER-рецептора. У одному варіанті здійснення мультиспецифічне антитіло специфічно зв'язується з EGFR і іншим HERрецептором і афінність його зв'язування з іншим HER-рецептором є щонайменше в 2, 3, 4, 5, 8, 10, 12, 15, 18, 20, 22, 25, 30, 35, 40, 50 або 100 разів більше, ніж афінність його зв'язування з EGFR. У одному варіанті здійснення мультиспецифічне антитіло специфічно зв'язується з EGFR і HER3, і афінність його зв'язування з HER3 є щонайменше в 2, 3, 4, 5, 8, 10, 12, 15, 18, 20, 22, 25, 30, 35, 40, 50 або 100 разів більше, ніж афінність його зв'язування з EGFR. У іншому варіанті здійснення мультиспецифічне антитіло специфічно зв'язується з EGFR і HER2, і афінність його зв'язування з HER2 є щонайменше в 2, 3, 4, 5, 8, 10, 12, 15, 18, 20, 22, 25, 30, 35, 40, 50 або 100 разів більше, ніж афінність його зв'язування з EGFR. У іншому варіанті здійснення мультиспецифічне антитіло специфічно зв'язується з EGFR і HER4, і афінність його зв'язування з HER4 є щонайменше в 2, 3, 4, 5, 8, 10, 12, 15, 18, 20, 22, 25, 30, 35, 40, 50 або 100 разів більше, ніж його афінність відносно EGFR. У деяких варіантах здійснення мультиспецифічні антитіла даного винаходу інгібують біологічну активність щонайменше одного з HER-рецепторів, з якими вони специфічно зв'язуються. У деяких варіантах здійснення мультиспецифічні антитіла даного винаходу інгібують біологічну активність обох HER-рецепторів, з якими вони зв'язуються. Таким чином, наприклад, мультиспецифічне антитіло винаходу інгібує біологічну активність EGFR і/або рецептора HER2 і/або HER3, і/або HER4. У одному варіанті здійснення мультиспецифічне антитіло специфічно зв'язується з EGFR людини і HER3 людини і інгібує біологічну активність щонайменше EGFR. У іншому варіанті здійснення мультиспецифічне антитіло специфічно зв'язується з EGFR людини і HER3 людини і щонайменше інгібує біологічну активність HER3. У іншому варіанті здійснення мультиспецифічне антитіло специфічно зв'язується з EGFR людини і HER3 людини і інгібує біологічну активність обох, EGFR і HER3. 21 UA 106070 C2 5 10 15 20 25 30 35 40 45 50 55 60 У іншому варіанті здійснення мультиспецифічне антитіло специфічно зв'язується з EGFR людини і HER3 людини і щонайменше інгібує біологічну активність EGFR. У ще одному варіанті здійснення, антитіло специфічно зв'язується з EGFR людини і HER3 людини і щонайменше інгібує біологічну активність HER2. У ще одному варіанті здійснення антитіло специфічно зв'язується з EGFR людини і HER3 людини і інгібує біологічну активність обох, EGFR і HER2. У іншому варіанті здійснення антитіло специфічно зв'язується з EGFR людини і HER3 людини і інгібує біологічну активність щонайменше EGFR. У іншому варіанті здійснення антитіло специфічно зв'язується з EGFR людини і HER4 людини і інгібує щонайменше біологічну активність HER4. У іншому варіанті здійснення антитіло специфічно зв'язується з EGFR людини і HER4 людини і інгібує біологічну активність обох, EGFR і HER4. У певних варіантах здійснення антитіла в цьому документі інгібують біологічну активність, що запускається, щонайменше частково, HER-рецептором, з яким вони не зв'язуються. Наприклад, антитіла, які зв'язуються з EGFR і HER3, ще можуть бути здатні інгібувати біологічну активність, що запускається HER2. Інгібування біологічної активності може бути виміряне в тестах, добре відомих в даній галузі техніки. Таким чином, наприклад, антитіла в цьому документі можуть інгібувати фосфорилування одного або більше HER-рецепторів і/або можуть інгібувати зв'язування ліганду HER з його рецептором, і/або можуть інгібувати індуковану лігандом проліферацію клітин, експресуючих HER-рецептор, і/або можуть інгібувати низхідні сигнальні шляхи, які активуються через HER-рецептор. Два головних низхідних сигнальних шляхи, які активуються у відповідь на фосфорилування EGFR, являють собою шляхи Ras/MAPK і фосфатидилінозитол-3-кінази (PI3K)/Akt. Відповідно, здатність антитіла в цьому документі інгібувати біологічну активність HER-рецептора може бути виміряна шляхом оцінки, чи може воно блокувати активацію вказаних шляхів, наприклад, в клітинах NR6. Таким чином, здатність антитіл блокувати індуковане лігандом фосфорилування p44/42MAPK, pAKT або інших молекул низхідного сигнального шляху може бути виміряна. Передача сигналу HER3 також залучена в декілька інших шляхів, включаючи c-met і FGFR. Здатність антитіла в цьому документі інгібувати біологічну активність HER-рецептора може бути виміряна шляхом оцінки, чи може воно блокувати активацію вказаних шляхів. Один аспект винаходу надає мультиспецифічні антитіла, які створюються диверсифікацією антитіла зі специфічністю до одного HER-рецептора, так що воно одержує специфічність до другого HER-рецептора, в той же час зберігаючи специфічність відносно першого HERрецептора. У генетичних термінах даний спосіб включає в себе стадії (1) диверсифікації амінокислотної послідовності варіабельного домену легкого ланцюга (V L) антитіла, де перед диверсифікацією антитіло включало в себе VL і варіабельний домен важкого ланцюга (VH), здатний до зв'язування з епітопом на першому HER-рецепторі, і (2) відбору диверсифікованого антитіла, здатного до зв'язування епітопа на першому HER-рецепторі і епітопа на другому HERрецепторі. Вказані стадії можуть бути проведені повторно, щоб створити мультиспецифічні антитіла. Докладний опис даного способу надається в патентній публікації США № 20080069820, повне розкриття якої в явній формі включене за допомогою посилання в цьому документі. Даний спосіб далі проілюстрований в Прикладах. У способі, описаному в Прикладах, антитіло анти-EGFR використовується як матриця для одержання різноманітності і, таким чином, для одержання мультиспецифічного анти-HER антитіла, хоч інші анти-HER антитіла, такі як анти-HER2, анти-HER3 або анти-HER4 антитіла, також могли б служити як матриця. Винахід далі надає моноспецифічні антитіла, які здатні до специфічного зв'язування з одним HER-рецептором і не зв'язуються специфічно з іншими HER-рецепторами. У одному варіанті здійснення антитіло специфічно зв'язується з EGFR. У одному варіанті здійснення антитіло специфічно зв'язується з доменом III EGFR. У деяких варіантах здійснення антитіло специфічно зв'язується з EGFR і інгібує біологічну активність EGFR. У іншому варіанті здійснення антитіло специфічно зв'язується з HER3. У одному варіанті здійснення антитіло специфічно зв'язується з доменом III HER3. У деяких варіантах здійснення антитіло специфічно зв'язується з HER3 і інгібує біологічну активність HER3. Моноспецифічні антитіла можуть бути використані як антитіло-матриця для подальшої різноманітності для додавання специфічності зв'язування відносно інших HER-рецепторів або інших антигенів-мішеней. Токсичність Токсичність антагоністів EGFR добре описана в преклінічних і клінічних дослідженнях. Наприклад, антитіло анти-EGFR цетуксимаб демонструє різні форми токсичності при використанні в терапевтично ефективних концентраціях. Найпоширеніші небажані реакції у випадку цетуксимабу (ERBITUX®, Imclone) (число випадків >25 %) являють собою шкірні 22 UA 106070 C2 5 10 15 20 25 30 35 40 45 50 55 небажані реакції (включаючи висип, свербіж і зміни нігтів), головний біль, діарею і інфекцію. Найбільш серйозні небажані реакції, асоційовані з лікуванням цетуксимабом, включають в себе інфузійні реакції, кардіопульмональний шок, дерматологічну токсичність і променевий дерматит, сепсис, ниркову недостатність, інтерстиціальний легеневий процес і легеневу емболію. Див. Biologies License Agreement (BLA) для цетуксимабу (Application № 125084) (включено за допомогою посилання в цей документ). Схожі токсичні проблеми спостерігаються при прийомі панітумумабу (VECTIBIX®, Amgen), де дерматологічна токсичність мала місце у 89 % пацієнтів, що одержували вказане антитіло. Вказані токсичності мали важку форму, ступінь по CTC 3 і вище (VECTIBIX®, індексація FDA.) Анти-EGFR хіміотерапевтичний агент ерлотиніб, як повідомлялося, викликав, в ряді випадків, гостру ниркову недостатність або ниркову недостатність, печінкову недостатність і/або гепаторенальний синдром, прориви шлунково-кишкового тракту, бульозні і ексфоліативні шкірні порушення і укривання виразками і перфорацію рогівки. Див. FDA Warnings and Precautions safety labeling для ерлотинібу (TARCEVA®, Genentech, OSI Pharmaceuticals (2009)). "Токсичний" або "токсичність" стосується будь-якого небажаного ефекту, викликаного агентом при його введенні суб'єкту. Вимірювання токсичності включають в себе, але без обмеження, летальність, втрату ваги тіла, органну недостатність, змінену функцію органів, токсичність відносно центральної нервової системи, шлунково-кишкову токсичність (яку визначають, наприклад, по діареї), дерматологічну токсичність (яку визначають, наприклад, по появі висипу, пошкодження шкіри, лущення або свербежу), кардіотоксичність, інфекцію, сепсис і цитотоксичність. Токсичність може бути визначена за допомогою методів, відомих в даній галузі техніки, таких як моніторинг клінічних спостережень за піддослідними тваринами в клітці, вага тіла, споживання їжі, частота дихання, вимірювання пульсової оксиметрії, фізикальний огляд, офтальметричні оцінки, неврологічні оцінки, метаболічні параметри, серцево-судинні параметри, лабораторна діагностика (включаючи клінічну біохімію, гематологію, аналіз сечі і параметри згортання крові) і макроскопічна і мікроскопічна патологія. Критерії оцінки ступеня тяжкості найбільш частих небажаних явищ v3.0 (CTCAE), підготовлені Національним інститутом раку (включено за допомогою посилання у всій повноті в цьому документі), надають інформацію відносно конкретних прийнятих показників токсичності у людини. На фігурі 31 надана інформація відносно спостережуваних неклінічних і клінічних токсичностей при терапіях антагоністом EGFR. Токсичність може бути виміряна в термінах загальних токсичних явищ або вираженості токсичного явища (явищ). Тяжкість явищ може бути описана за допомогою системи класифікації, встановленої в CTCAE. Кожному небажаному явищу надають ступінь тяжкості, застосовуючи однозначні клінічні описи, виходячи з рекомендацій загального порядку, що ступінь 1 означає легке явище, ступінь 2 стосується явища середньої тяжкості, ступінь 3 означає важке явище, ступінь 4 стосується явища, що загрожує життю або позбавляє працездатності, і ступінь 5 означає загибель, пов'язану з явищем. CTCAE надає конкретні клінічні описи токсичних явищ. Ознаки дерматологічної токсичності надаються, починаючи зі стор. 14 CTCAE, v.3. Як приклад, на фігурі 32 показана класифікація висипу/лущення і акне/вугроподібного висипу (CTCAE, v.3). Існує ряд моделей, відомих в даній галузі техніки, які використовуються для моніторингу потенційних показників токсичності, включаючи, але без обмеження, клітинні моделі in vitro і нелюдські тваринні моделі in vivo. Токсичність також вивчали у суб'єктів-людей в дослідженнях клінічних випробувань. У конкретному варіанті здійснення токсичність вимірюється у яванської макаки. Токсичний ефект антагоніста EGFR детально описаний у яванських макак. Як указано в Biologies License Agreement (BLA) відносно цетуксимабу (Application № 125084) (включено за допомогою посилання в цей документ), всі мавпи, що одержували цетуксимаб, демонстрували пошкодження шкіри, від середніх до важких, що включали в себе утворення лусочок, почервоніння, еритему, дерматит, утворення тріщин, ран і екзантеми і/або стоншення або випадання волосся. Дерматологічна токсичність була дозозалежною по вираженості і по часу появи, причому вираженість для високої, середньої і низької доз була важкою, помірною і слабкою, і час появи мав місце в дні дослідження 15, 22 і 64, відповідно. Повторні ускладнення важких пошкоджень шкіри включали в себе бактеріальну інфекцію або сепсис з подальшою загибеллю або евтаназією 50 % тварин в групі високої дози. Інші токсичності, що залежать від дози, включали в себе зміни певних параметрів клінічної патології, асоційованих з макроскопічним і мікроскопічним явищем пошкодження клітин і тканин печінки, кісткового мозку, селезінки і лімфоїдних органів. 23 UA 106070 C2 5 10 15 20 25 30 35 40 45 50 55 Як указано в Прикладах, яванські макаки, що одержували біспецифічне антитіло, яке специфічно зв'язується з EGFR і HER3, демонстрували менше число випадків токсичності, яку визначали по пошкодженнях шкіри, в порівнянні з яванськими макаками, що одержували еквівалентну кількість антагоніста EGFR цетуксимабу. Пошкодження шкіри розвивалися у однієї з трьох яванських макак, що одержували 25 мг/кг біспецифічного антитіла, тоді як пошкодження шкіри розвивалися у 3 з 3 яванських макак, що одержували 25 мг/кг цетуксимабу. Пошкодження, яке мало місце у мавп, що одержували біспецифічне антитіло, було менш важким, ніж пошкодження у мавп, що одержували цетуксимаб, і поява пошкодження була відстроченою. У тварини, що одержувала біспецифічне антитіло, пошкодження шкіри розвивалося через один тиждень після введення останньої (шостої) дози, в порівнянні з мавпами, що одержували цетуксимаб, де виникнення пошкодження шкіри спостерігалося після введення третьої дози у всіх тварин. У клінічних дослідженнях цетуксимабу спостерігали дерматологічні токсичності, включаючи вугроподібний висип, сухість шкіри і утворення тріщин, і запальні і інфекційні ускладнення. Описане число випадків дерматологічної токсичності складало до 89 % (для пацієнтів з пізньою стадією колоректального раку). Моделі шкірної токсичності відомі і можуть бути використані для визначення дерматологічної токсичності антитіл. Приклади таких моделей включають в себе людські епідермальні кератоцити NHEK (Clonetics, San Diego, CA; Lonza Bioscience, Walkersville, MD); HEKa (Cascade TM Biologies, Portland, OR; Invitrogen, Carlsbad, CA) і відновлений людський епідерміс (EpiDerm cultures (MatTek, Ashland, MA). Вказані моделі можуть бути використані для перевірки дії антитіл на клітинну проліферацію, експресію генів, експресію білків, фосфорилування рецепторів, життєздатність клітин і на зміни в гістопатології. Lacouture M. E., Nature Rev. Cancer, 6:803-812 (2006). Бажано створити менш токсичне антитіло, яке впливає на каскад реакцій EGFR. Дозування антагоніста EGFR, такого як цетуксимаб, обмежується токсичністю (головним чином дерматологічною токсичністю і інфузійними реакціями). Менш токсичне антитіло може бути введене в вищій дозі, ніж більш токсичний антагоніст EGFR, що може привести до зростання протипухлинних ефектів. Таким чином, один аспект винаходу надає мультиспецифічне антитіло, яке специфічно зв'язується з EGFR і щонайменше з одним іншим HER-рецептором (HER2, HER3 і/або HER4), де антитіло є менш токсичним, ніж антагоніст EGFR, коли антитіло і антагоніст EGFR вводять в еквівалентних дозах. У одному варіанті здійснення антитіло специфічно зв'язується з EGFR і HER3. У іншому варіанті здійснення антитіло специфічно зв'язується з EGFR і HER2. У ще одному варіанті здійснення антитіло специфічно зв'язується з EGFR і HER4. У деяких варіантах здійснення мультиспецифічне антитіло викликає менше число випадків токсичностей, менш важкі токсичності або відкладене настання токсичностей в моделі in vivo, в порівнянні з антагоністом EGFR. Один аспект винаходу передбачає мультиспецифічне антитіло, яке специфічно зв'язується з EGFR і щонайменше з одним іншим HER-рецептором (HER2, HER3 і/або HER4), де антитіло викликає менше число випадків токсичності у суб'єктів, які одержували антитіло, в порівнянні з числом випадків токсичності у суб'єктів, які одержували антагоніст EGFR. У конкретних варіантах здійснення число випадків токсичності у суб'єктів, які одержували антитіло, складає щонайменше на 10, 20, 30, 40, 50, 60, 70, 80 або 90 % менше, ніж число випадків токсичності у суб'єктів, які одержували антагоніст EGFR. У інших варіантах здійснення число випадків токсичності у суб'єктів, які одержували антитіло, складає менше ніж 80, 70, 60, 50, 40, 30, 20, 10, 5, 2 або 1 %. У конкретних варіантах здійснення мультиспецифічне антитіло викликає менше чисто випадків дерматологічних токсичностей, менш важкі дерматологічні токсичності або відкладене настання дерматологічних токсичностей в моделі in vivo, в порівнянні з антагоністом EGFR. Один аспект винаходу передбачає мультиспецифічне антитіло, яке специфічно зв'язується з EGFR і щонайменше одним іншим HER-рецептором (HER2, HER3 і/або HER4), де антитіло викликає менше число випадків загальної дерматологічної токсичності у суб'єктів, які одержували антитіло, в порівнянні із загальним числом випадків дерматологічної токсичності у суб'єктів, які одержували антагоніст EGFR. У конкретних варіантах здійснення число випадків загальної дерматологічної токсичності у суб'єктів, які одержували антитіло, є щонайменше на 10, 20, 30, 40, 50, 60, 70, 80 або 90 % менше, ніж число випадків загальної дерматологічної токсичності у суб'єктів, які одержували антагоніст EGFR. У інших варіантах здійснення процент випадків загальної дерматологічної токсичності у суб'єктів, які одержували антитіло, складає менше ніж 80, 70, 60, 50, 40, 30, 20, 10, 5, 2 або 1 %. 24 UA 106070 C2 5 10 15 20 25 30 35 40 45 50 55 Інший аспект винаходу передбачає мультиспецифічне антитіло, яке специфічно зв'язується з EGFR і щонайменше з одним іншим HER-рецептором (HER2, HER3 і/або HER4), де антитіло викликає менше випадків токсичності ступеня 3 або вище у суб'єктів, які одержували антитіло, в порівнянні з числом випадків токсичності ступеня 3 або вище у суб'єктів, які одержували антагоніст EGFR. У конкретних варіантах здійснення число випадків токсичності ступеня 3 або вище у суб'єктів, які одержували антитіло, є щонайменше на 10, 20, 30, 40, 50, 60, 70, 80 або 90 % менше, ніж число випадків токсичності ступеня 3 або вище у суб'єктів, які одержували антагоніст EGFR. У інших варіантах здійснення процент випадків токсичності ступеня 3 або вище у суб'єктів, які одержували мультиспецифічне антитіло, складає менше 70, 60, 50, 40, 30, 20, 15, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2 або 1 %. У конкретних варіантах здійснення мультиспецифічне антитіло викликає менше випадків дерматологічної токсичності ступеня 3 або вище у суб'єктів, які одержували біспецифічне антитіло, в порівнянні з випадками дерматологічної токсичності ступеня 3 або вище у суб'єктів, що одержували антагоніст EGFR. У конкретних варіантах здійснення число випадків дерматологічної токсичності ступеня 3 або вище у суб'єктів, які одержували мультиспецифічне антитіло, є щонайменше на 10, 20, 30, 40, 50, 60, 70, 80 або 90 % менше, ніж число випадків дерматологічної токсичності ступеня 3 або вище у суб'єктів, які одержували антагоніст EGFR. У інших варіантах здійснення число випадків дерматологічної токсичності ступеня 3 або вище у суб'єктів, які одержували мультиспецифічне антитіло, складає менше 70, 60, 50, 40, 30, 20, 15, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2 або 1 %. У інших варіантах здійснення антитіло викликає менше число випадків зміни функції органів в моделі in vivo в порівнянні з антагоністом EGFR. У інших варіантах здійснення антитіло викликає менш важкі або легкі явища шлунково-кишкової токсичності в моделі in vivo в порівнянні з антагоністом EGFR. У будь-якому варіанті здійснення антагоніст EGFR являє собою антитіло анти-EGFR. У одному варіанті здійснення антагоніст EGFR являє собою цетуксимаб. У іншому варіанті здійснення антагоніст EGFR являє собою панітумумаб. У інших варіантах здійснення антагоніст EGFR являє собою малу молекулу. У одному варіанті здійснення антагоніст EGFR являє собою ерлотиніб. У одному варіанті здійснення модель in vivo являє собою мавпу, таку як яванська макака. У іншому варіанті здійснення моделлю in vivo є людина. Антитіло і варіанти антитіла У деяких варіантах здійснення винахід надає мультиспецифічне антитіло, що містить антигензв'язувальний домен, який специфічно зв'язується з EGFR і HER3. У деяких варіантах здійснення антигензв'язувальний домен не зв'язується специфічно з іншими мішенями, включаючи інші рецептори HER. У одному варіанті здійснення мультиспецифічне антитіло включає в себе антигензв'язувальний домен, який специфічно зв'язується з EGFR і HER3, де антитіло включає в себе VH (варіабельний домен важкого ланцюга), що містить амінокислотну послідовність SEQ ID NO: 25. У одному варіанті здійснення мультиспецифічне антитіло включає в себе антигензв'язувальний домен, який специфічно зв'язується з EGFR і HER3, де антитіло включає в себе VL (варіабельний домен легкого ланцюга), що містить амінокислотну послідовність SEQ ID NO: 40. У одному варіанті здійснення мультиспецифічне антитіло включає в себе антигензв'язувальний домен, який специфічно зв'язується з EGFR і HER3, де антитіло включає в себе VH, що містить амінокислотну послідовність SEQ ID NO: 25, і V L, що містить амінокислотну послідовність SEQ ID NO: 40. У одному варіанті здійснення мультиспецифічне антитіло включає в себе антигензв'язувальний домен, який специфічно зв'язується з EGFR і HER3, де антитіло включає в себе VH, що містить один, два і/або три HVR амінокислотної послідовності SEQ ID NO: 25. У одному варіанті здійснення мультиспецифічне антитіло включає в себе антигензв'язувальний домен, який специфічно зв'язується з EGFR і HER3, де антитіло включає в себе V L, що містить один, два і/або три HVR амінокислотної послідовності SEQ ID NO: 40. У одному варіанті здійснення мультиспецифічне антитіло включає в себе антигензв'язувальний домен, який специфічно зв'язується з EGFR і HER3, де антитіло включає в себе V H, що містить один, два і/або три HVR амінокислотної послідовності SEQ ID NO: 25, і V L, що містить один, два і/або три HVR амінокислотної послідовності SEQ ID NO: 40. У одному варіанті здійснення мультиспецифічне антитіло включає в себе антигензв'язувальний домен, який специфічно зв'язується з EGFR і HER3, де антитіло включає в себе VH, що містить всі три HVR амінокислотної послідовності SEQ ID NO: 25, і V L, що містить всі три HVR амінокислотної 25 UA 106070 C2 5 10 15 20 25 30 35 40 45 50 55 послідовності SEQ ID NO: 40. У деяких варіантах здійснення HVR являють собою подовжені HVRs. У одному варіанті здійснення мультиспецифічне антитіло включає в себе антигензв'язувальний домен, який специфічно зв'язується з EGFR і HER3, де антитіло включає в себе VH, що містить амінокислотну послідовність SEQ ID NO: 64. У одному варіанті здійснення мультиспецифічне антитіло включає в себе антигензв'язувальний домен, який специфічно зв'язується з EGFR і HER3, де антитіло включає в себе VL, що містить амінокислотну послідовність SEQ ID NO: 26. У одному варіанті здійснення мультиспецифічне антитіло включає в себе антигензв'язувальний домен, який специфічно зв'язується з EGFR і HER3, де антитіло включає в себе VH, що містить амінокислотну послідовність SEQ ID NO: 64, і VL, що містить амінокислотну послідовність SEQ ID NO: 26. У одному варіанті здійснення мультиспецифічне антитіло включає в себе антигензв'язувальний домен, який специфічно зв'язується з EGFR і HER3, де антитіло включає в себе VH, що містить один, два і/або три HVR амінокислотної послідовності SEQ ID NO: 64. У одному варіанті здійснення мультиспецифічне антитіло включає в себе антигензв'язувальний домен, який специфічно зв'язується з EGFR і HER3, де антитіло включає в себе V L, що містить один, два і/або три HVR амінокислотної послідовності SEQ ID NO: 26. У одному варіанті здійснення мультиспецифічне антитіло включає в себе антигензв'язувальний домен, який специфічно зв'язується з EGFR і HER3, де антитіло включає в себе VH, що містить один, два і/або три HVR амінокислотної послідовності SEQ ID NO: 64, і V L, що містить один, два і/або три HVR амінокислотної послідовності SEQ ID NO: 26. У одному варіанті здійснення мультиспецифічне антитіло включає в себе антигензв'язувальний домен, який специфічно зв'язується з EGFR і HER3, де антитіло включає в себе VH, що містить всі три HVR амінокислотної послідовності SEQ ID NO: 64, і V L, що містить всі три HVR амінокислотної послідовності SEQ ID NO: 26. У деяких варіантах здійснення HVR являють собою подовжені HVR. У одному варіанті здійснення мультиспецифічне антитіло включає в себе антигензв'язувальний домен, який специфічно зв'язується з EGFR і HER3, де антитіло включає в себе VH, що містить амінокислотну послідовність SEQ ID NO: 28. У одному варіанті здійснення мультиспецифічне антитіло включає в себе антигензв'язувальний домен, який специфічно зв'язується з EGFR і HER3, де антитіло включає в себе VL, що містить амінокислотну послідовність SEQ ID NO: 27. У одному варіанті здійснення мультиспецифічне антитіло включає в себе антигензв'язувальний домен, який специфічно зв'язується з EGFR і HER3, де антитіло включає в себеVH, що містить амінокислотну послідовність SEQ ID NO: 28, і VL, що містить амінокислотну послідовність SEQ ID NO: 27. У одному варіанті здійснення мультиспецифічне антитіло включає в себе антигензв'язувальний домен, який специфічно зв'язується з EGFR і HER3, де антитіло включає в себе VH, що містить один, два і/або три HVR амінокислотної послідовності SEQ ID NO: 28. У одному варіанті здійснення мультиспецифічне антитіло включає в себе антигензв'язувальний домен, який специфічно зв'язується з EGFR і HER3, де антитіло включає в себе V L, що містить один, два і/або три HVR амінокислотної послідовності SEQ ID NO: 27. У одному варіанті здійснення мультиспецифічне антитіло включає в себе антигензв'язувальний домен, який специфічно зв'язується з EGFR і HER3, де антитіло включає в себе V H, що містить один, два і/або три HVR амінокислотної послідовності SEQ ID NO: 28, і VL, що містить один, два і/або три HVR амінокислотної послідовності SEQ ID NO: 27. У одному варіанті здійснення мультиспецифічне антитіло включає в себе антигензв'язувальний домен, який специфічно зв'язується з EGFR і HER3, де антитіло включає в себе VH, що містить всі три HVR амінокислотної послідовності SEQ ID NO: 28, і V L, що містить всі три HVR амінокислотної послідовності SEQ ID NO: 27. У деяких варіантах здійснення HVR являють собою подовжені HVR. У одному конкретному варіанті здійснення HVR-H1 включає в себе амінокислотну послідовність LSGDWIH (SEQ ID NO: 48), HVR-H2 включає в себе амінокислотну послідовність LGEISAAGGYTD (SEQ ID NO: 50), HVR-H3 включає в себе амінокислотну послідовність ARESRVSFEAAMDY (SEQ ID NO: 53), HVR-L1 включає в себе амінокислотну послідовність DLATDVA (SEQ ID NO: 54), HVR-L2 включає в себе амінокислотну послідовність SASF (SEQ ID NO: 56) і HVR-L3 включає в себе амінокислотну послідовність SEPEPYT (SEQ ID NO: 57). У одному варіанті здійснення мультиспецифічне антитіло включає в себе антигензв'язувальний домен, який специфічно зв'язується з EGFR і HER3, де антитіло включає в себе VL, що містить амінокислотну послідовність SEQ ID NO: 29. У одному варіанті здійснення мультиспецифічне антитіло включає в себе антигензв'язувальний домен, який специфічно 26 UA 106070 C2 5 10 15 20 25 30 35 40 45 50 55 зв'язується з EGFR і HER3, де антитіло включає в себе VH, що містить амінокислотну послідовність SEQ ID NO: 28, і VL, що містить амінокислотну послідовність SEQ ID NO: 29. У одному варіанті здійснення мультиспецифічне антитіло включає в себе антигензв'язувальний домен, який специфічно зв'язується з EGFR і HER3, де антитіло включає в себе VL, що містить один, два і/або три HVR амінокислотної послідовності SEQ ID NO: 29. У одному варіанті здійснення мультиспецифічне антитіло включає в себе антигензв'язувальний домен, який специфічно зв'язується з EGFR і HER3, де антитіло включає в себе V H, що містить один, два і/або три HVR амінокислотної послідовності SEQ ID NO: 28, і V L, що містить один, два і/або три HVR амінокислотної послідовності SEQ ID NO: 29. У одному варіанті здійснення мультиспецифічне антитіло включає в себе антигензв'язувальний домен, який специфічно зв'язується з EGFR і HER3, де антитіло включає в себе VH, що містить всі три HVR амінокислотної послідовності SEQ ID NO: 28, і V L, що містить всі три HVR амінокислотної послідовності SEQ ID NO: 29. У деяких варіантах здійснення, HVR являють собою подовжені HVR. У одному конкретному варіанті здійснення HVR-H1 включає в себе амінокислотну послідовність LSGDWIH (SEQ ID NO: 48), HVR-H2 включає в себе амінокислотну послідовність LGEISAAGGYTD (SEQ ID NO: 50), HVR-H3 включає в себе амінокислотну послідовність ARESRVSFEAAMDY (SEQ ID NO: 53), HVR-L1 включає в себе амінокислотну послідовність NIATDVA (SEQ ID NO: 55), HVR-L2 включає в себе амінокислотну послідовність SASF (SEQ ID NO: 56) і HVR-L3 включає в себе амінокислотну послідовність SEPEPYT (SEQ ID NO: 57). У одному варіанті здійснення мультиспецифічне антитіло включає в себе антигензв'язувальний домен, який специфічно зв'язується з EGFR і HER3, де антитіло включає в себе VH, що містить амінокислотну послідовність SEQ ID NO: 30. У одному варіанті здійснення мультиспецифічне антитіло включає в себе антигензв'язувальний домен, який специфічно зв'язується з EGFR і HER3, де антитіло включає в себе VH, що містить амінокислотну послідовність SEQ ID NO: 30, і VL, що містить амінокислотну послідовність SEQ ID NO: 29. У одному варіанті здійснення мультиспецифічне антитіло включає в себе антигензв'язувальний домен, який специфічно зв'язується з EGFR і HER3, де антитіло включає в себе VH, що містить один, два і/або три HVR амінокислотної послідовності SEQ ID NO: 30. У одному варіанті здійснення мультиспецифічне антитіло включає в себе антигензв'язувальний домен, який специфічно зв'язується з EGFR і HER3, де антитіло включає в себе V H, що містить один, два і/або три HVR амінокислотної послідовності SEQ ID NO: 30, і V L, що містить один, два і/або три HVR амінокислотної послідовності SEQ ID NO: 29. У одному варіанті здійснення мультиспецифічне антитіло включає в себе антигензв'язувальний домен, який специфічно зв'язується з EGFR і HER3, де антитіло включає в себе VH, що містить всі три HVR амінокислотної послідовності SEQ ID NO: 30, і V L, що містить всі три HVR амінокислотної послідовності SEQ ID NO: 29. У деяких варіантах здійснення HVR являють собою подовжені HVR. У одному конкретному варіанті здійснення HVR-H1 включає в себе амінокислотну послідовність LSGDWIH (SEQ ID NO: 48), HVR-H2 включає в себе амінокислотну послідовність VGEISAAGGYTD (SEQ ID NO: 51), HVR-H3 включає в себе амінокислотну послідовність ARESRVSFEAAMDY (SEQ ID NO: 53), HVR-L1 включає в себе амінокислотну послідовність NIATDVA (SEQ ID NO: 55), HVR-L2 включає в себе амінокислотну послідовність SASF (SEQ ID NO: 56) і HVR-L3 включає в себе амінокислотну послідовність SEPEPYT (SEQ ID NO: 57). У одному варіанті здійснення мультиспецифічне антитіло включає в себе антигензв'язувальний домен, який специфічно зв'язується з EGFR і HER3, де антитіло включає в себе VL, що містить амінокислотні послідовності SEQ ID NO: 40, 41, 42, 43, 44, 45 або 46. У одному варіанті здійснення мультиспецифічне антитіло включає в себе антигензв'язувальний домен, який специфічно зв'язується з EGFR і HER3, де антитіло включає в себе V H, що містить амінокислотну послідовність SEQ ID NO: 25, і VL, що містить амінокислотну послідовність SEQ ID NO: 40, 41, 42, 43, 44, 45 або 46. У одному варіанті здійснення мультиспецифічне антитіло включає в себе антигензв'язувальний домен, який специфічно зв'язується з EGFR і HER3, де антитіло включає в себе VL, що містить один, два і/або три HVR амінокислотної послідовності SEQ ID NO: 40, 41, 42, 43, 44, 45 або 46. У одному варіанті здійснення мультиспецифічне антитіло включає в себе антигензв'язувальний домен, який специфічно зв'язується з EGFR і HER3, де антитіло включає в себе VH, що містить один, два і/або три HVR амінокислотної послідовності SEQ ID NO: 25, і V L, що містить один, два і/або три HVR амінокислотної послідовності SEQ ID NO: 40, 41, 42, 43, 44, 45 або 46. У одному варіанті здійснення мультиспецифічне антитіло включає в себе антигензв'язувальний домен, який специфічно зв'язується з EGFR і HER3, де антитіло включає в себе VH, що містить всі три HVR амінокислотної послідовності SEQ ID NO: 25, і V L, що містить 27 UA 106070 C2 5 10 15 20 25 30 35 40 45 50 55 60 всі три HVR амінокислотної послідовності SEQ ID NO: 40, 41, 42, 43, 44, 45 або 46. У деяких варіантах здійснення HVR являють собою подовжені HVR. У одному варіанті здійснення мультиспецифічне антитіло включає в себе антигензв'язувальний домен, який специфічно зв'язується з EGFR і HER2, де антитіло включає в себе варіабельний домен легкого ланцюга, що містить амінокислотні послідовності SEQ ID NO: 36, 37 або 38. У одному варіанті здійснення мультиспецифічне антитіло включає в себе антигензв'язувальний домен, який специфічно зв'язується з EGFR і HER2, де антитіло включає в себе варіабельний домен важкого ланцюга, що містить амінокислотну послідовність SEQ ID NO: 25, і варіабельний домен легкого ланцюга, що містить амінокислотну послідовність SEQ ID NO: 36, 37 або 38. У одному варіанті здійснення мультиспецифічне антитіло включає в себе антигензв'язувальний домен, який специфічно зв'язується з EGFR і HER2, де антитіло включає в себе VH, що містить один, два і/або три HVR амінокислотної послідовності SEQ ID NO: 25. У одному варіанті здійснення мультиспецифічне антитіло включає в себе антигензв'язувальний домен, який специфічно зв'язується з EGFR і HER2, де антитіло включає в себе V L, що містить один, два і/або три HVR амінокислотної послідовності SEQ ID NO: 36, 37 або 38. У одному варіанті здійснення мультиспецифічне антитіло включає в себе антигензв'язувальний домен, який специфічно зв'язується з EGFR і HER2, де антитіло включає в себе V H, що містить один, два і/або три HVR амінокислотної послідовності SEQ ID NO: 25, і VL, що містить один, два і/або три HVR амінокислотної послідовності SEQ ID NO: 36, 37 або 38. У одному варіанті здійснення мультиспецифічне антитіло включає в себе антигензв'язувальний домен, який специфічно зв'язується з EGFR і HER2, де антитіло включає в себе VH, що містить всі три HVR амінокислотної послідовності SEQ ID NO: 25, і V L, що містить всі три HVR амінокислотної послідовності SEQ ID NO: 36, 37 або 38. У деяких варіантах здійснення HVR являють собою подовжені HVR. У одному варіанті здійснення мультиспецифічне антитіло включає в себе антигензв'язувальний домен, який специфічно зв'язується з EGFR і HER4, де антитіло включає в себе VH, що містить амінокислотну послідовність SEQ ID NO: 25. У одному варіанті здійснення мультиспецифічне антитіло включає в себе антигензв'язувальний домен, який специфічно зв'язується з EGFR і HER4, де антитіло включає в себе VL, що містить амінокислотну послідовність SEQ ID NO: 39. У одному варіанті здійснення мультиспецифічне антитіло включає в себе антигензв'язувальний домен, який специфічно зв'язується з EGFR і HER4, де антитіло включає в себе варіабельний домен важкого ланцюга, що містить амінокислотну послідовність SEQ ID NO: 25, і варіабельний домен легкого ланцюга, що містить амінокислотну послідовність SEQ ID NO: 39. У одному варіанті здійснення мультиспецифічне антитіло включає в себе антигензв'язувальний домен, який специфічно зв'язується з EGFR і HER4, де антитіло включає в себе VL, що містить один, два і/або три HVR амінокислотної послідовності SEQ ID NO: 39. У одному варіанті здійснення мультиспецифічне антитіло включає в себе антигензв'язувальний домен, який специфічно зв'язується з EGFR і HER4, де антитіло включає в себе V H, що містить один, два і/або три HVR амінокислотної послідовності SEQ ID NO: 25, і VL, що містить один, два і/або три HVR амінокислотної послідовності SEQ ID NO: 39. У одному варіанті здійснення мультиспецифічне антитіло включає в себе антигензв'язувальний домен, який специфічно зв'язується з EGFR і HER4, де антитіло включає в себе VH, що містить всі три HVR амінокислотної послідовності SEQ ID NO: 25, і V L, що містить всі три HVR амінокислотної послідовності SEQ ID NO: 39. У деяких варіантах здійснення HVR являють собою подовжені HVR. У одному варіанті здійснення винахід надає моноспецифічне антитіло, що містить антигензв'язувальний домен, який специфічно зв'язується з EGFR, де антитіло включає в себе VH, що містить амінокислотну послідовність SEQ ID NO: 25. У одному варіанті здійснення моноспецифічне антитіло включає в себе антигензв'язувальний домен, який специфічно зв'язується з EGFR, де антитіло включає в себе VL, що містить амінокислотну послідовність SEQ ID NO: 58 або SEQ ID NO: 24. У одному варіанті здійснення моноспецифічне антитіло включає в себе антигензв'язувальний домен, який специфічно зв'язується з EGFR, де антитіло включає в себе VH, що містить амінокислотну послідовність SEQ ID NO: 25, і VL, що містить амінокислотну послідовність SEQ ID NO: 58 або SEQ ID NO: 24. У одному варіанті здійснення винахід надає моноспецифічне антитіло, що містить антигензв'язувальний домен, який специфічно зв'язується з EGFR, де антитіло включає в себе VH, що містить один, два і/або три HVR амінокислотної послідовності SEQ ID NO: 25. У одному варіанті здійснення моноспецифічне антитіло включає в себе антигензв'язувальний домен, який 28
ДивитисяДодаткова інформація
Назва патенту англійськоюBispecific anti-her antibodies
Автори англійськоюFuh, Germaine, Schaefer, Gabriele, Haber, Lauric, Sliwkowski, Mark, X.
Автори російськоюФу Жермен, Шефер Габриеле, Абер Лорик, Сливковски Марк К.
МПК / Мітки
МПК: C07K 16/32, C07K 16/28
Мітки: специфічно, антитіло, зв'язується
Код посилання
<a href="https://ua.patents.su/143-106070-antitilo-shho-specifichno-zvyazuehtsya-z-egfr-i-her3.html" target="_blank" rel="follow" title="База патентів України">Антитіло, що специфічно зв’язується з egfr і her3</a>
Попередній патент: Основа, продукти, які її містять, способи її приготування та застосування основи
Наступний патент: Спосіб зміцнення гірських порід в процесі підтримання виробки
Випадковий патент: Спосіб оцінки тяжкості хронічного атрофічного метапластичного гастриту