Композиції та способи для посилення м’язового росту
Номер патенту: 102437
Опубліковано: 10.07.2013
Автори: Шеппард Келлі-Енн, Урлінгер Стефані, Херрманн Таня, Бергер Катрін, Тріфільєфф Естель, Лу Кріс
Формула / Реферат
1. Антитіло анти-ActRIIB або його фрагмент, що включає антигензв'язуючу частину зазначеного антитіла, що зв'язується SEQ ID NO: 182.
2. Антитіло анти-ActRIIB або його фрагмент, що включає антигензв'язуючу частину зазначеного антитіла, за п. 1, зв'язування якого з ActRIIB характеризується значенням KD 1 нМ або менше, переважно 100 пМ або менше.
3. Антитіло анти-ActRIIB за будь-яким з попередніх пунктів, де антитіло інгібує зв'язування міостатину з ActRIIB.
4. Антитіло анти-ActRIIB за будь-яким з попередніх пунктів, де антитіло інгібує передачу сигналів, що індукується міостатином, яку оцінюють за допомогою аналізу Smad-залежного репортерного гену.
5. Антитіло анти-ActRIIB за будь-яким з попередніх пунктів, де зв'язування антитіла з ActRIIB характеризується у 10 разів більш високою афінністю, ніж його зв'язування з ActRIIA.
6. Антитіло або його фрагмент, що включає антигензв'язуючу частину зазначеного антитіла, за будь-яким з попередніх пунктів, де антитіло або його фрагмент містить щонайменше одну гіперваріабельну ділянку, ідентичну щонайменше на 95 % щонайменше одній з CDR, представлених у SEQ ID NO: 9, 18-28, 37, 51, 65, 71-75 та 79.
7. Антитіло або його фрагмент, що включає антигензв'язуючу частину зазначеного антитіла, за будь-яким з попередніх пунктів 1-5, де антитіло містить щонайменше одну гіперваріабельну ділянку, ідентичну щонайменше на 95 % CDR3, представленій у SEQ ID NO: 37.
8. Антитіло або його фрагмент, що включає антигензв'язуючу частину зазначеного антитіла, за будь-яким з попередніх пунктів 1-5, де антитіло містить поліпептидну послідовність VH, яка ідентична щонайменше на 95 % щонайменше одній з послідовностей, представлених SEQ ID NO: 99-112.
9. Антитіло або його фрагмент, що включає антигензв'язуючу частину зазначеного антитіла, за будь-яким з попередніх пунктів 1-5, де антитіло містить поліпептидну послідовність VL, яка ідентична щонайменше на 95 % щонайменше одній з послідовностей, представлених SEQ ID NO: 85-98.
10. Антитіло або його фрагмент, що включає антигензв'язуючу частину зазначеного антитіла, за будь-яким з попередніх пунктів 1-5, де антитіло містить поліпептидну послідовність VH, яка ідентична щонайменше на 95 % щонайменше одній з послідовностей, представлених SEQ ID NO: 99-112, та поліпептидну послідовність VL, яка ідентична щонайменше на 95 % щонайменше одній з послідовностей, представлених SEQ ID NO: 85-98.
11. Антитіло або його фрагмент, що включає антигензв'язуючу частину зазначеного антитіла, за будь-яким з попередніх пунктів 1-5, де антитіло містить CDR1 варіабельної області важкого ланцюга, яка має амінокислотну послідовність, представлену у SEQ ID NO: 9; CDR2 варіабельної області важкого ланцюга, яка має амінокислотну послідовність, вибрану з групи, що включає SEQ ID NO: 18-28; CDR3 варіабельної області важкого ланцюга, яка має амінокислотну послідовність, представлену у SEQ ID NO: 37; CDR1 варіабельної області легкого ланцюга, яка має амінокислотну послідовність, представлену у SEQ ID NO: 51; CDR2 варіабельної області легкого ланцюга, яка має амінокислотну послідовність, представлену у SEQ ID NO: 65; та CDR3 варіабельної області легкого ланцюга, яка має амінокислотну послідовність, вибрану з групи, що включає SEQ ID NO: 71-79.
12. Антитіло або його фрагмент, що включає антигензв'язуючу частину зазначеного антитіла, за будь-яким з попередніх пунктів 1-5, що містить:
(a) CDR1 варіабельної області важкого ланцюга, що має послідовність, представлену у SEQ ID NO: 1; CDR2 варіабельної області важкого ланцюга, що має послідовність, представлену у SEQ ID NO: 15; CDR3 варіабельної області важкого ланцюга, що має послідовність, представлену у SEQ ID NO: 29; CDR1 варіабельної області легкого ланцюга, що має послідовність, представлену у SEQ ID NO: 43; CDR2 варіабельної області легкого ланцюга, що має послідовність, представлену у SEQ ID NO: 57; та CDR3 варіабельної області легкого ланцюга, що має послідовність, представлену у SEQ ID NO:71,
(b) CDR1 варіабельної області важкого ланцюга, що має послідовність, представлену у SEQ ID NO: 2; CDR2 варіабельної області важкого ланцюга, що має послідовність, представлену у SEQ ID NO: 16; CDR3 варіабельної області важкого ланцюга, що має послідовність, представлену у SEQ ID NO: 30; CDR1 варіабельної області легкого ланцюга, що має послідовність, представлену у SEQ ID NO: 44; CDR2 варіабельної області легкого ланцюга, що має послідовність, представлену у SEQ ID NO: 58; та CDR3 варіабельної області легкого ланцюга, що має послідовність, представлену у SEQ ID NO: 72,
(c) CDR1 варіабельної області важкого ланцюга, що має послідовність, представлену у SEQ ID NO: 3; CDR2 варіабельної області важкого ланцюга, що має послідовність, представлену у SEQ ID NO: 17; CDR3 варіабельної області важкого ланцюга, що має послідовність, представлену у SEQ ID NО: 31; CDR1 варіабельної області легкого ланцюга, що має послідовність, представлену у SEQ ID NO: 45; CDR2 варіабельної області легкого ланцюга, що має послідовність, представлену у SEQ ID NO: 59; та CDR3 варіабельної області легкого ланцюга, що має послідовність, представлену у SEQ ID NO: 73,
(d) CDR1 варіабельної області важкого ланцюга, що має послідовність, представлену у SEQ ID NO: 4; CDR2 варіабельної області важкого ланцюга, що має послідовність, представлену у SEQ ID NO: 18; CDR3 варіабельної області важкого ланцюга, що має послідовність, представлену у SEQ ID NO: 32; CDR1 варіабельної області легкого ланцюга, що має послідовність, представлену у SEQ ID NO: 46; CDR2 варіабельної області легкого ланцюга, що має послідовність, представлену у SEQ ID NO: 60; та CDR3 варіабельної області легкого ланцюга, що має послідовність, представлену у SEQ ID NO: 74,
(e) CDR1 варіабельної області важкого ланцюга, що має послідовність, представлену у SEQ ID NO: 5; CDR2 варіабельної області важкого ланцюга, що має послідовність, представлену у SEQ ID NO: 19; CDR3 варіабельної області важкого ланцюга, що має послідовність, представлену у SEQ ID NO: 33; CDR1 варіабельної області легкого ланцюга, що має послідовність, представлену у SEQ ID NO: 47; CDR2 варіабельної області легкого ланцюга, що має послідовність, представлену у SEQ ID NO: 61; та CDR3 варіабельної області легкого ланцюга, що має послідовність, представлену у SEQ ID NO: 75,
(f) CDR1 варіабельної області важкого ланцюга, що має послідовність, представлену у SEQ ID NO: 6; CDR2 варіабельної області важкого ланцюга, що має послідовність, представлену у SEQ ID NO: 20; CDR3 варіабельної області важкого ланцюга, що має послідовність, представлену у SEQ ID NO: 34; CDR1 варіабельної області легкого ланцюга, що має послідовність, представлену у SEQ ID NO: 48; CDR2 варіабельної області легкого ланцюга, що має послідовність, представлену у SEQ ID NO: 62; та CDR3 варіабельної області легкого ланцюга, що має послідовність, представлену у SEQ ID NO: 76,
(g) CDR1 варіабельної області важкого ланцюга, що має послідовність, представлену у SEQ ID NO: 7; CDR2 варіабельної області важкого ланцюга, що має послідовність, представлену у SEQ ID NO: 21; CDR3 варіабельної області важкого ланцюга, що має послідовність, представлену у SEQ ID NO: 35; CDR1 варіабельної області легкого ланцюга, що має послідовність, представлену у SEQ ID NO: 49; CDR2 варіабельної області легкого ланцюга, що має послідовність, представлену у SEQ ID NO: 63; та CDR3 варіабельної області легкого ланцюга, що має послідовність, представлену у SEQ ID NO: 77,
(h) CDR1 варіабельної області важкого ланцюга, що має послідовність, представлену у SEQ ID NO: 8; CDR2 варіабельної області важкого ланцюга, що має послідовність, представлену у SEQ ID NO: 22; CDR3 варіабельної області важкого ланцюга, що має послідовність, представлену у SEQ ID NO: 36; CDR1 варіабельної області легкого ланцюга, що має послідовність, представлену у SEQ ID NO: 50; CDR2 варіабельної області легкого ланцюга, що має послідовність, представлену у SEQ ID NO: 64; та CDR3 варіабельної області легкого ланцюга, що має послідовність, представлену у SEQ ID NO: 78,
(і) CDR1 варіабельної області важкого ланцюга, що має послідовність, представлену у SEQ ID NO: 9; CDR2 варіабельної області важкого ланцюга, що має послідовність, представлену у SEQ ID NO: 23; CDR3 варіабельної області важкого ланцюга, що має послідовність, представлену у SEQ ID NO: 37; CDR1 варіабельної області легкого ланцюга, що має послідовність, представлену у SEQ ID NO:51; CDR2 варіабельної області легкого ланцюга, що має послідовність, представлену у SEQ ID NO: 65; та CDR3 варіабельної області легкого ланцюга, що має послідовність, представлену у SEQ ID NO: 79,
(j) CDR1 варіабельної області важкого ланцюга, що має послідовність, представлену у SEQ ID NO: 10; CDR2 варіабельної області важкого ланцюга, що має послідовність, представлену у SEQ ID NO: 24; CDR3 варіабельної області важкого ланцюга, що має послідовність, представлену у SEQ ID NO: 38; CDR1 варіабельної області легкого ланцюга, що має послідовність, представлену у SEQ ID NO: 52; CDR2 варіабельної області легкого ланцюга, що має послідовність, представлену у SEQ ID NO: 66; та CDR3 варіабельної області легкого ланцюга, що має послідовність, представлену у SEQ ID NO: 80,
(k) CDR1 варіабельної області важкого ланцюга, що має послідовність, представлену у SEQ ID NO: 11; CDR2 варіабельної області важкого ланцюга, що має послідовність, представлену у SEQ ID NO: 25; CDR3 варіабельної області важкого ланцюга, що має послідовність, представлену у SEQ ID NO: 39; CDR1 варіабельної області легкого ланцюга, що має послідовність, представлену у SEQ ID NO: 53; CDR2 варіабельної області легкого ланцюга, що має послідовність, представлену у SEQ ID NO: 67; та CDR3 варіабельної області легкого ланцюга, що має послідовність, представлену у SEQ ID NO: 81,
(l) CDR1 варіабельної області важкого ланцюга, що має послідовність, представлену у SEQ ID NO: 12; CDR2 варіабельної області важкого ланцюга, що має послідовність, представлену у SEQ ID NO: 26; CDR3 варіабельної області важкого ланцюга, що має послідовність, представлену у SEQ ID NO: 40; CDR1 варіабельної області легкого ланцюга, що має послідовність, представлену у SEQ ID NO: 54; CDR2 варіабельної області легкого ланцюга, що має послідовність, представлену у SEQ ID NO: 68; та CDR3 варіабельної області легкого ланцюга, що має послідовність, представлену у SEQ ID NO: 82,
(m) CDR1 варіабельної області важкого ланцюга, що має послідовність, представлену у SEQ ID NO: 13; CDR2 варіабельної області важкого ланцюга, що має послідовність, представлену у SEQ ID NO: 27; CDR3 варіабельної області важкого ланцюга, що має послідовність, представлену у SEQ ID NO:41; CDR1 варіабельної області легкого ланцюга, що має послідовність, представлену у SEQ ID NO: 55; CDR2 варіабельної області легкого ланцюга, що має послідовність, представлену у SEQ ID NO: 69; та CDR3 варіабельної області легкого ланцюга, що має послідовність, представлену у SEQ ID NO: 83, або
(n) CDR1 варіабельної області важкого ланцюга, що має послідовність, представлену у SEQ ID NO: 14; CDR2 варіабельної області важкого ланцюга, що має послідовність, представлену у SEQ ID NO: 28; CDR3 варіабельної області важкого ланцюга, що має послідовність, представлену у SEQ ID NO: 42; CDR1 варіабельної області легкого ланцюга, що має послідовність, представлену у SEQ ID NO: 56; CDR2 варіабельної області легкого ланцюга, що має послідовність, представлену у SEQ ID NO: 70; та CDR3 варіабельної області легкого ланцюга, що має послідовність, представлену у SEQ ID NO: 84.
13. Антитіло або його фрагмент, що включає антигензв'язуючу частину зазначеного антитіла, за будь-яким з попередніх пунктів 1-5, де антитіло містить повнорозмірну амінокислотну послідовність важкого ланцюга, яка ідентична щонайменше на 95 % щонайменше одній послідовності, вибраній з групи, що включає SEQ ID NО: 146-150 та 156-160.
14. Антитіло або його фрагмент, що включає антигензв'язуючу частину зазначеного антитіла, за будь-яким з попередніх пунктів 1-5, де антитіло містить повнорозмірну амінокислотну послідовність легкого ланцюга, яка ідентична щонайменше на 95 % щонайменше одній послідовності, вибраній з групи, що включає SEQ ID NO: 141-145 та 151-155.
15. ActRIIB антитіло, що містить:
(a) варіабельну область легкого ланцюга, послідовність якої представлена у SEQ ID NO: 85, та варіабельну область важкого ланцюга, послідовність якої представлена у SEQ ID NO: 99;
(b) варіабельну область легкого ланцюга, послідовність якої представлена у SEQ ID NO: 86, та варіабельну область важкого ланцюга, послідовність якої представлена y SEQ ID NO: 100;
(c) варіабельну область легкого ланцюга, послідовність якої представлена у SEQ ID NO: 87, та варіабельну область важкого ланцюга, послідовність якої представлена y SEQ ID NO: 101;
(d) варіабельну область легкого ланцюга, послідовність якої представлена у SEQ ID NO: 88, та варіабельну область важкого ланцюга, послідовність якої представлена у SEQ ID NO: 102;
(e) варіабельну область легкого ланцюга, послідовність якої представлена у SEQ ID NO: 89, та варіабельну область важкого ланцюга, послідовність якої представлена y SEQ ID NO: 103;
(f) варіабельну область легкого ланцюга, послідовність якої представлена у SEQ ID NO: 90, та варіабельну область важкого ланцюга, послідовність якої представлена y SEQ ID NO: 104;
(g) варіабельну область легкого ланцюга, послідовність якої представлена у SEQ ID NO: 91, та варіабельну область важкого ланцюга, послідовність якої представлена y SEQ ID NO: 105;
(h) варіабельну область легкого ланцюга, послідовність якої представлена у SEQ ID NO: 92, та варіабельну область важкого ланцюга, послідовність якої представлена у SEQ ID NO: 106;
(і) варіабельну область легкого ланцюга, послідовність якої представлена у SEQ ID NO: 93, та варіабельну область важкого ланцюга, послідовність якої представлена у SEQ ID NO: 107;
(j) варіабельну область легкого ланцюга, послідовність якої представлена у SEQ ID NO: 94, та варіабельну область важкого ланцюга, послідовність якої представлена у SEQ ID NO: 108;
(k) варіабельну область легкого ланцюга, послідовність якої представлена у SEQ ID NO: 95, та варіабельну область важкого ланцюга, послідовність якої представлена у SEQ ID NO: 109;
(l) варіабельну область легкого ланцюга, послідовність якої представлена у SEQ ID NO: 96, та варіабельну область важкого ланцюга, послідовність якої представлена у SEQ ID NO: 110;
(m) варіабельну область легкого ланцюга, послідовність якої представлена у SEQ ID NO: 97, та варіабельну область важкого ланцюга, послідовність якої представлена у SEQ ID NO: 111; або
(n) варіабельну область легкого ланцюга, послідовність якої представлена у SEQ ID NO: 98, та варіабельну область важкого ланцюга, послідовність якої представлена у SEQ ID NO: 112.
16. ActRIIB антитіло, що містить:
(a) послідовність важкого ланцюга, представлену у SEQ ID NO: 146, та послідовність легкого ланцюга, представлену у SEQ ID NO: 141;
(b) послідовність важкого ланцюга, представлену у SEQ ID NO: 147, та послідовність легкого ланцюга, представлену у SEQ ID NO: 142;
(c) послідовність важкого ланцюга, представлену у SEQ ID NO: 148, та послідовність легкого ланцюга, представлену у SEQ ID NO: 143;
(d) послідовність важкого ланцюга, представлену у SEQ ID NO: 149, та послідовність легкого ланцюга, представлену у SEQ ID NO: 144;
(e) послідовність важкого ланцюга, представлену у SEQ ID NO: 150, та послідовність легкого ланцюга, представлену у SEQ ID NO: 145;
(f) послідовність важкого ланцюга, представлену у SEQ ID NO: 156, та послідовність легкого ланцюга, представлену у SEQ ID NO: 151;
(g) послідовність важкого ланцюга, представлену у SEQ ID NO: 157, та послідовність легкого ланцюга, представлену у SEQ ID NO: 152;
(h) послідовність важкого ланцюга, представлену у SEQ ID NO: 158, та послідовність легкого ланцюга, представлену у SEQ ID NO: 153;
(і) послідовність важкого ланцюга, представлену у SEQ ID NO: 159, та послідовність легкого ланцюга, представлену у SEQ ID NO: 154; або
(j) послідовність важкого ланцюга, представлену у SEQ ID NO: 160, та послідовність легкого ланцюга, представлену у SEQ ID NO: 155.
17. Антитіло або його фрагмент, що включає антигензв'язуючу частину зазначеного антитіла, яке перехресно блокує зв'язування з ActRIIB або зв'язування якого з ActRIIB перехресно блокується щонайменше одним антитілом за п. 16.
18. Антитіло або його фрагмент, що включає антигензв'язуючу частину зазначеного антитіла, за будь-яким з попередніх пунктів 1-15, що перехресно блокує зв'язування з ActRIIB або зв'язування якого з ActRIIB перехресно блокується щонайменше одним антитілом за п. 17.
19. Антитіло за будь-яким з попередніх пунктів 1-15, яке зв'язується з епітопом, який містить або складається з:
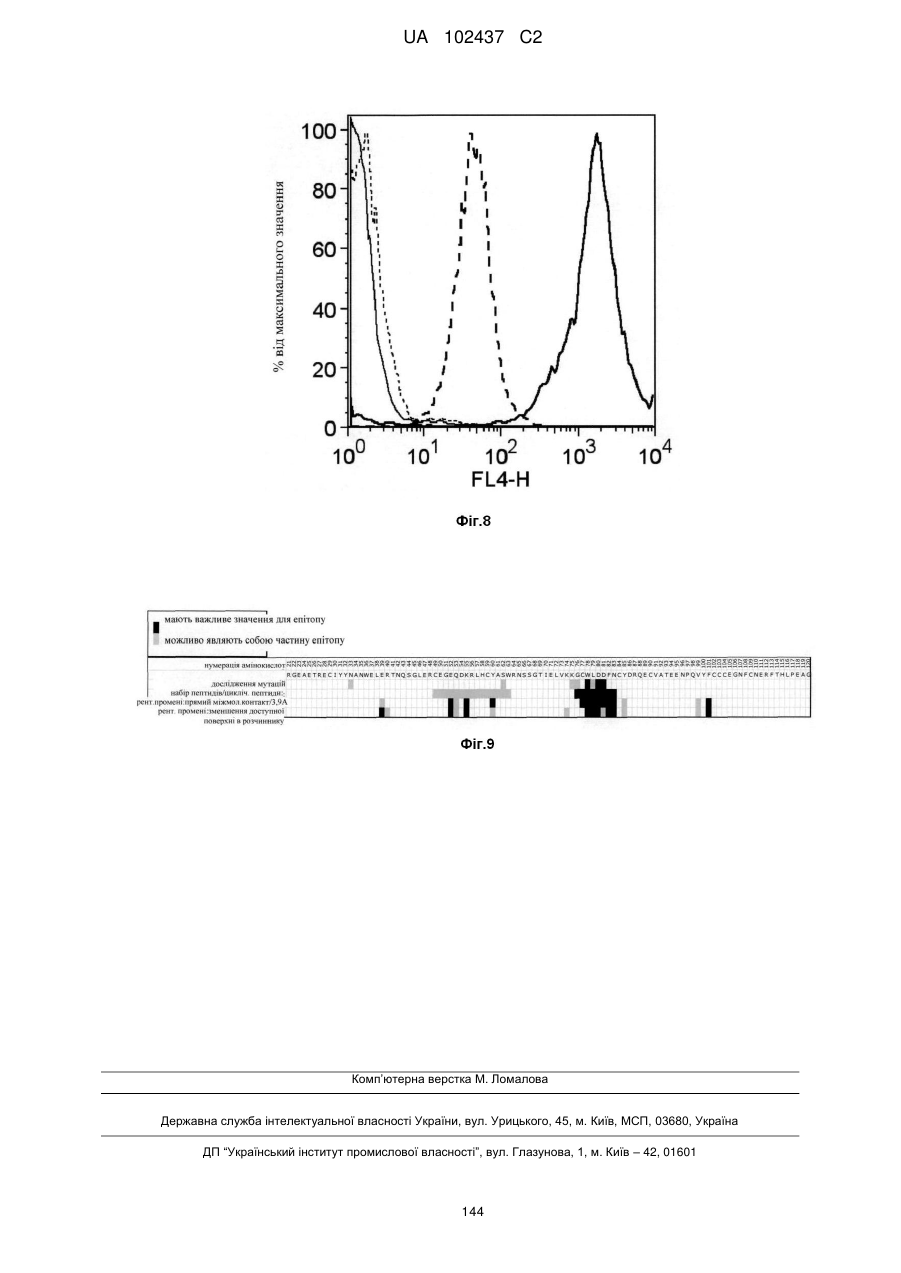
(a) амінокислот 78-83 SEQ ID NO: 181 (WLDDFN-SEQ ID NO: 188);
(b) амінокислот 76-84 SEQ ID NO: 181 (GCWLDDFNC-SEQ ID NO: 186);
(c) амінокислот 75-85 SEQ ID NO: 181 (KGCWLDDFNCY-SEQ ID NO: 190);
(d) амінокислот 52-56 SEQ ID NO: 181 (EQDKR-SEQ ID NO: 189);
(e) амінокислот 49-63 SEQ ID NO: 181 (CEGEQDKRLHCYASW-SEQ ID NO: 187); або
(f) амінокислот 78-83 SEQ ID NO: 181 (WLDDFN) та амінокислот 52-56 SEQ ID NO: 181 (EQDKR).
20. Антитіло або його фрагмент, що включає антигензв'язуючу частину зазначеного антитіла, за будь-яким з попередніх пунктів 17-19, де перехресну блокаду або зв'язування з одним і тим же епітопом визначають за допомогою BIAcore-аналізу або ELISA.
21. Антитіло анти-ActRIIB за будь-яким з попередніх пунктів, де антитіло належить до IgG1-ізотипу.
22. Антитіло анти-ActRIIB за будь-яким з попередніх пунктів, яке має змінену в результаті мутації Fc-області ефекторну функцію.
23. Виділена полінуклеотидна послідовність, що кодує антитіло або його фрагмент, що включає антигензв'язуючу частину зазначеного антитіла, за будь-яким з попередніх пунктів.
24. Виділена полінуклеотидна послідовність за п. 23, що містить одну або декілька SEQ ID NO: 113-140 або 161-180.
25. Вектор клонування або експресії, що містить одну або декілька виділених полінуклеотидних послідовностей за п. 23 або п. 24.
26. Вектор за п. 25, де вектор містить одну або декілька SEQ ID NO: 113-140 або 161-180 або їх фрагмент, що кодує щонайменше одну CDR-ділянку.
27. Виділена клітина-хазяїн, що містить один або декілька векторів за п. 25 або п. 26.
28. Спосіб одержання антитіла або його фрагменту, що включає антигензв'язуючу частину зазначеного антитіла, за будь-яким з попередніх пунктів 1-22, у якому культивують клітину-хазяїна за п. 27 та виділяють антитіло або його фрагмент, що включає антигензв'язуючу частину зазначеного антитіла.
29. Фармацевтична композиція, що містить антитіло або його фрагмент, що включає антигензв'язуючу частину зазначеного антитіла, за будь-яким з попередніх пунктів 1-22 або полінуклеотидну послідовність за п. 23 або п. 24.
30. Фармацевтична композиція за п. 29, яка додатково містить фармацевтично прийнятний розріджувач або носій.
31. Фармацевтична композиція за п. 29 або п. 30, яка додатково містить одну або декілька додаткових активних речовин.
32. Фармацевтична композиція за п. 31, у якій додаткову активну речовину вибрано з IGF-1, IGF-2 або варіантів IGF-1 або IGF-2, антитіла до міостатину, пропептиду міостатину, білку, що являє собою "манок" для міостатину, який зв'язується з ActRIIB, але не активує його, агоністу бета 2, агоністу греліну, SARM, агоністів/міметиків GH або фолістатину.
33. Антитіло або його фрагмент, що включає антигензв'язуючу частину зазначеного антитіла, за будь-яким з попередніх пунктів 1-22, полінуклеотидна послідовність за п. 23 або п. 24 або фармацевтична композиція за будь-яким з попередніх пунктів 29-32, призначені для застосування як лікарського засобу.
34. Антитіло або його фрагмент, що включає антигензв'язуючу частину зазначеного антитіла, за будь-яким з попередніх пунктів 1-22, полінуклеотидна послідовність за п. 23 або п. 24 або фармацевтична композиція за будь-яким з попередніх пунктів 29-32, призначені для застосування при лікуванні м'язово-скелетного захворювання або порушення; гострого та/або хронічного захворювання нирок або ниркової недостатності; фіброзу або цирозу печінки; раку, такого як рак молочної залози; хвороби Паркінсона; станів, асоційованих із загибеллю нейронів, таких як ALS, атрофія головного мозку або деменція та анемія; фіброзу печінки, нирки або легені; пов'язаних з віком станів; та різних видів раку, таких, наприклад, як (але не обмежуючись тільки ними) рабдоміосаркоми, рак, що викликає втрату кісткової тканини, гепатоклітинні карциноми, різні види шлунково-кишкового раку.
35. Антитіло або його фрагмент, що включає антигензв'язуючу частину зазначеного антитіла, за п. 34, у якому м'язово-скелетне захворювання або порушення являє собою м'язову атрофію, наприклад, що є результатом міопатії, такої як міотонія, вроджена міопатія, включаючи немалинову міопатію, мульти/міні-міопатію центральних стрижнів та міотубулярну (центронуклеарну) міопатію; мітохондріальна міопатія; періодичний сімейний параліч (параксизмальна сімейна міопленія); запальна міопатія; метаболічна міопатія, наприклад, викликувана хворобою накопичення глікогену або ліпідів, дерматоміозит, поліміозит, міозит із включенням тілець, осифікуючий міозит, гострий некроз скелетних м'язів та міоглобінурія; дистрофії, наприклад, дистрофії Дюшена, Беккера, міотонічної, фасціальної лопатково-плечової, Емері-Дрейфуса, окулофарінгеальної, лопатково-плечової, поясу кінцівок, Фукуями, вродженої м'язової дистрофії або спадкової дистальної міопатії; остеопорозу; перелому кістки; низького зросту; карликовості; пролонгованого перебування у ліжку, добровільної пасивності або примусової пасивності.
36. Антитіло або його фрагмент, що включає антигензв'язуючу частину зазначеного антитіла, за п. 35, у якому пацієнта, якого необхідно лікувати, попередньо лікували 1GF-1, IGF-2 або варіантами IGF-1 або IGF-2, антитілом до міостатину, пропептидом міостатину, білком, що являє собою "манок" для міостатину, який зв'язується з ActRIIB, але не активує його, агоністом бета 2, агоністом греліну, SARM, агоністами/міметиками GH або фолістатином.
37. Антитіло або його фрагмент, що включає антигензв'язуючу частину зазначеного антитіла, за п. 35, у якому у пацієнта, якого необхідно лікувати, раніше виявлена стійкість до лікування IGF-1, IGF-2 або варіантами IGF-1 або IGF-2, антитілом до міостатину, пропептидом міостатину, білком, що являє собою "манок" для міостатину, який зв'язується з ActRIIB, але не активує його, агоністом бета-2, агоністом греліну, SARM, агоністами/міметиками GH або фолістатином.
38. Антитіло або його фрагмент, що включає антигензв'язуючу частину зазначеного антитіла, за п. 35, у якому пацієнт, якого необхідно лікувати, має похилий вік, перебував впродовж деякого періоду часу в умовах невагомості або знаходився впродовж тривалого періоду в пасивному стані.
39. Антитіло або його фрагмент, що включає антигензв'язуючу частину зазначеного антитіла, за п. 35, у якому пацієнт, якого необхідно лікувати, має перелом кінцівки (тобто нижньої або верхньої кінцівки) або суглобу (тобто колінного або тазостегнового суглобу).
40. Антитіло або його фрагмент, що включає антигензв'язуючу частину зазначеного антитіла, за п. 35, у якому пацієнт піддавався або повинен піддаватися замісній хірургії на тазостегновому суглобі або колінному суглобі.
41. Застосування антитіла або його фрагмент, що включає антигензв'язуючу частину зазначеного антитіла, за будь-яким з попередніх пунктів 1-22, полінуклеотидної послідовності за п. 23 або п. 24 або фармацевтичної композиції за будь-яким з попередніх пунктів 29-32 для приготування лікарського засобу, призначеного для лікування м'язово-скелетного захворювання або порушення; гострого та/або хронічного захворювання нирок або ниркової недостатності; фіброзу або цирозу печінки; раку, такого як рак молочної залози; хвороби Паркінсона; станів, асоційованих із загибеллю нейронів, таких як ALS, атрофія головного мозку або деменція та анемія; фіброзу печінки, нирки або легені; пов'язаних з віком станів; та різних видів раку, таких, наприклад, як (але не обмежуючись тільки ними) рабдоміосаркоми, рак, що викликає втрату кісткової тканини, гепатоклітинні карциноми, різні види шлунково-кишкового раку.
42. Застосування за п. 41, у якому м'язово-скелетне захворювання або порушення являє собою м'язову атрофію, наприклад, що є результатом міопатії, такої як міотонія, вроджена міопатія, включаючи немалинову міопатію, мульти/міні-міопатію центральних стрижнів та міотубулярну (центронуклеарну) міопатію; мітохондріальна міопатія; періодичний сімейний параліч (параксизмальна сімейна міопленія); запальна міопатія; метаболічна міопатія, наприклад, викликувана хворобою накопичення глікогену або ліпідів, дерматоміозит, поліміозит, міозит із включенням тілець, осифікуючий міозит, гострий некроз скелетних м'язів та міоглобінурія; дистрофії, наприклад, дистрофії Дюшена, Беккера, міотонічної, фасціальної лопатково-плечової, Емері-Дрейфуса, окулофарингеальної, лопатково-плечової, поясу кінцівок, Фукуями, вродженої м'язової дистрофії або спадкової дистальної міопатії; остеопорозу; перелому кістки; низького зросту; карликовості; пролонгованого перебування у ліжку, добровільної пасивності або примусової пасивності.
43. Застосування за п. 42, у якому пацієнта, якого необхідно лікувати, попередньо лікували 1GF-1, IGF-2 або варіантами IGF-1 або IGF-2, антитілом до міостатину, пропептидом міостатину, білком, що являє собою "манок" для міостатину, який зв'язується з ActRIIB, але не активує його, агоністом бета-2, агоністом греліну, SARM, агоністами/міметиками GH або фолістатином.
44. Застосування за п. 42, у якому у пацієнта, якого необхідно лікувати, раніше виявлена стійкість до лікування IGF-1, IGF-2 або варіантами IGF-1 або IGF-2, антитілом до міостатину, пропептидом міостатину, білком, що являє собою "манок" для міостатину, який зв'язується з ActRIIB, але не активує його, агоністом бета-2, агоністом греліну, SARM, агоністами/міметиками GH або фолістатином.
45. Застосування за п. 42, у якому пацієнт, якого необхідно лікувати, має похилий вік, перебував впродовж деякого періоду часу в умовах невагомості або знаходився впродовж тривалого періоду в пасивному стані.
46. Застосування за п. 42, у якому пацієнт, якого необхідно лікувати, має перелом кінцівки (тобто нижньої або верхньої кінцівки) або суглоба (тобто колінного або тазостегнового суглоба).
47. Застосування за п. 42, у якому пацієнт піддавався або повинен піддаватися замісній хірургії на тазостегновому суглобі або колінному суглобі.
48. Спосіб полегшення м'язового виснаження, викликаного примусовою пасивністю або часом, проведеним в умовах невагомості, у якому вводять у ефективній дозі антитіло або або його фрагмент, що включає антигензв'язуючу частину зазначеного антитіла, за будь-яким з попередніх пунктів 1-22 до початку періоду примусової пасивності або часу перебування в умовах невагомості.
49. Антитіло, що кодується pBW522 (DSM22873) або pBW524 (DSM22874).
Текст
Реферат: В заявці описані антитіла до рецептора активіну ІІВ (ActRIIB). Зокрема, в заявці описано застосування антитіл для лікування м'язових порушень, таких як м'язове виснаження через хворобу або невживання. UA 102437 C2 (12) UA 102437 C2 UA 102437 C2 5 10 15 20 25 30 35 40 45 50 55 60 Галузь техніки, до якої відноситься винахід Даний винахід відноситься до антитіл до рецептору активіну типу IIB (ActRIIB). Зокрема він відноситься до застосування зазначених антитіл для лікування м'язових порушень, таких як м'язове виснаження внаслідок хвороби або невживання. Передумови створення винаходу Активіни являють собою димерні фактори росту та диференціювання, які належать до суперсімейства трансформуючого фактору росту бета (TGF-бета), що включає структурно споріднені білки, що приймають участь у передачі сигналів. Активіни передають сигнал через гетеродимерний комплекс рецепторних серінових кіназ, який включає щонайменше два типи I (I та IB) та два типи II (II та IIB, aka ACVR2A та ACVR2B) рецепторів. Всі ці рецептори являють собою трансмембранні білки, що складаються з лігандзв'язуючого позаклітинного домену з багатою цистеїном областю, трансмембранного домену та цитоплазматичного домену з передбачуваною серін/треоніновою специфічністю. Рецептори типу I відіграють вирішальне значення для передачі сигналів, а рецептори типу II необхідні для зв'язування лігандів та для експресії рецепторів типу I. Рецептори типу I та II утворюють стабільний комплекс після зв'язування з лігандом, що приводить до фосфорилювання рецепторів типу I рецепторами типу II. Активіновий рецептор II B (ActRIIB) є рецептором міостатину. Взаємодія між міостатином та цим рецептором регулює інгібування диференціювання скелетного м'язу через Smad-залежний шлях. Таким чином, шляхом інгібування або попередження зв'язування міостатину з ActRIIB можна індукувати утворення скелетного м'язу. Це питання було вивчено різними групами дослідників. Bogdanovich зі співавторами (Nature, 420, 2002, стор. 418-421) описали, що антитіла до міостатину мають здатність блокувати міостатин, що приводить до приросту м'язової маси на мишачій моделі м'язової дистрофії Дюшенна. Bradley зі співавторами (Cell Mol. Life Sci., 65, 2008, стор. 2119-2124) узагальнили відомості про різні відомі підходи до модуляції взаємодії міостатин/ActRIIB, включаючи застосування вищевказаних антитіл до міостатину, інгібування вивільнення зрілого міостатину шляхом введення пропептиду міостатину, введення фолістатину для блокади рецептору міостатину, введення інгібіторів HDAC (гістондеацетилази) для індукції виробництва фолістатину, введення зміненого пептиду міостатину, який перешкоджає зв'язуванню міостатину з рецептором, та введення розчинного рецептору - "манка", "відволікаючого" міостатин. Незважаючи на можливість застосування таких підходів у терапії, у цей час не є жодного продукту, який можна було б застосовувати для лікування пацієнтів. Так, у цей час одна компанія припинила здійснення свого проекту, пов'язаного із застосуванням антитіла до міостатину. Таким чином, існує необхідність у розробці методу збільшення м'язової маси та сили м'язів у пацієнта. Опис винаходу Встановлено, що антитіла анти-ActRIIB-рецептору можуть перешкоджати зв'язуванню міостатину з рецептором, попереджаючи тим самим інгібування диференціювання м'язових клітин за допомогою Smad-залежного шляху. Це приводить до збільшення м'язової маси та сили м'язів у пацієнта. Таким чином, одним з об'єктів винаходу є антитіло анти-ActRIIB або функціональний білок, що містить антигензв'язуючу ділянку зазначеного антитіла. В одному з варіантів здійснення винаходу ActRIIB являє собою людський ActRIIB. Поліпептидна послідовність людського ActRIIB представлена у SEQ ID NO: 181 (AAC64515.1, GI:3769443). В одному з варіантів здійснення винаходу антитіло або функціональний білок отримане/отриманий з організму ссавця, такого як людина або представники верблюжих. Так, антитіло може являти собою химерне, людське або гуманізоване антитіло. У конкретному варіанті здійснення винаходу антитіло анти-ActRIIB характеризується наявністю антигензв'язуючої ділянки, специфічної для білку-мішені ActRIIB, та зв'язується з ActRIIB або фрагментом ActRIIB. Переважно антитіло придатне для застосування в терапії. В одному з варіантів здійснення винаходу антитіла, запропоновані у винаході, є антагоністами ActRIIB та не мають агоністичної активності або мають слабку агоністичну активність. В іншому варіанті здійснення винаходу антитіло або його функціональний фрагмент зв'язується з білком-мішенню ActRIIB та зменшує зв'язування міостатину з ActRIIB до основного рівня. В одному з аспектів цього варіанту здійснення винаходу антитіло або його функціональний фрагмент знижує кількість міостатину, що зв'язується з ActRIIB. В іншому аспекті цього варіанту здійснення винаходу антитіло або його функціональний фрагмент 1 UA 102437 C2 5 10 15 20 25 30 35 40 45 50 55 60 повністю перешкоджає зв'язуванню міостатину з ActRIIB. В іншому варіанті здійснення винаходу антитіло або його функціональний фрагмент інгібує активацію Smad. В іншому варіанті здійснення винаходу антитіло або його функціональний фрагмент інгібує опосередковуване рецептором активіну типу IIB індукуєме міостатином інгібування диференціювання клітин скелетних м'язів за допомогою Smad-залежного шляху. Зв'язування можна визначати за допомогою одного або декількох аналізів, які можна застосовувати для оцінки активності, такої як антагоністична або агоністична активність антитіла. Переважно аналізи дозволяють оцінювати щонайменше один з видів активності антитіла у відношенні ActRIIB, що включають: інгібування зв'язування міостатину з ActRIIB за допомогою ELISA, інгібування індукуємої міостатином передачі сигналів (наприклад, за допомогою аналізу Smad-залежного репортерного гену), інгібування індукуємого міостатином Smad-фосфорилювання (P-Smad-ELISA) та інгібування індукуємого міостатином інгібування диференціювання клітин скелетних м'язів (наприклад, за допомогою аналізу креатинкінази). Одним з варіантів здійснення винаходу є антитіла, які специфічно зв'язуються з міостатинзв'язуючою ділянкою (тобто лігандзв'язуючим доменом) ActRIIB. Зазначений лігандзв'язуючий домен складається з амінокислот 19-134 SEQ ID NO: 181 та його послідовність позначена в контексті даного опису як SEQ ID NO: 182. В одному з варіантів здійснення винаходу зв'язування антитіл з ActRIIB характеризується значенням KD, що становить 100 нМ або менше, 10 нМ або менше, 1 нМ або менше. Переважно зв'язування антитіл, запропонованих у винаході, з ActRIIB характеризується афінністю, що становить 100 пМ або менше (тобто 100, 50, 10, 1 пМ або менше). В одному з варіантів здійснення винаходу зв'язування антитіл з ActRIIB характеризується афінністю, що становить від 10 до 20 пМ. В одному з варіантів здійснення винаходу антитіла, запропоновані у винаході, не дають перехресної реакції із спорідненим ActRIIB білком та більш переважно не дають перехресної реакції з людським ActRIIA (NP_001607.1, GI:4501897). В одному з варіантів здійснення винаходу антитіла, запропоновані у винаході, зв'язуються переважно з ActRIIB, а не з ActRIIA. В одному з варіантів здійснення винаходу зв'язування антитіл, запропонованих у винаході, з ActRIIB характеризується у 5 разів більш високою афінністю, ніж зв'язування з ActRIIA, більш переважно у 10 разів більш високою, ще більш переважно у 50 разів більш високою, ще більш переважно у 100 разів більш високою афінністю. В одному з варіантів здійснення винаходу зв'язування антитіл з ActRIIA характеризується афінністю 100 пМ або більше (тобто 250 пМ, 500 пМ, 1 нМ, 5 нМ або більше). В одному з варіантів здійснення винаходу антитіла, запропоновані у винаході, відносяться до IgG2-ізотипу. В іншому варіанті здійснення винаходу антитіла, запропоновані у винаході, відносяться до IgG1-ізотипу. В іншому варіанті здійснення винаходу антитіла, запропоновані у винаході, відносяться до IgG1-ізотипу та мають змінену ефекторну функцію в результаті дозрівання Fcобласті. В одному з варіантів здійснення винаходу зазначена змінена ефекторна функція являє собою знижену ADCC- та CDC-активність. В одному з варіантів здійснення винаходу зазначена змінена ефекторна функція являє собою "мовчання" ADCC- та CDC-активності. В іншому спорідненому варіанті здійснення винаходу антитіла, запропоновані у винаході, являють собою повністю людські або гуманізовані антитіла IgG1-ізотипу, які не мають ні антитіло-обумовленої клітинозалежної цитотоксичності (ADCC), ні CDC–активності (комплементзалежна цитоксичність) та зв'язуються з областю ActRIIB, яка складається з амінокислот 19-134 SEQ ID NO:181. В іншому спорідненому варіанті здійснення винаходу антитіла, запропоновані у винаході, являють собою повністю людські або гуманізовані антитіла IgG1-ізотипу, які мають знижену антитіло-обумовлену клітинозалежну цитотоксичність (ADCC) або CDC-активність та зв'язуються з областю ActRIIB, яка складається з амінокислот 19-134 SEQ ID NO:181. Даний винахід відноситься до виділених антитіл, насамперед людських або гуманізованих антитіл, які інгібують зв'язування міостатину з ActRIIB та активують диференціювання клітин скелетних м'язів in vitro та in vivo. У конкретних варіантах здійснення винаходу антитіла, запропоновані у винаході, одержують із конкретних послідовностей важких та легких ланцюгів, та/або вони містять конкретні структурні особливості, такі як CDR-ділянки, які містять конкретні амінокислотні послідовності. Винахід відноситься до виділених антитіл, способів одержання зазначених антитіл, імунокон'югатів та мультивалентних або мультиспецифічних молекул, які містять зазначені антитіла, та до фармацевтичних композицій, які містять антитіла, імунокон'югати або біспецифічні молекули, запропоновані у винаході. Винахід відноситься також до способів застосування антитіл для інгібування, тобто антагоністичного впливу на функцію 2 UA 102437 C2 5 10 15 20 25 30 35 40 45 50 55 60 ActRIIB, для того, щоб інгібувати активацію Smad та тим самим індукувати диференціювання клітин скелетних м'язів, наприклад, з метою лікування патологічного порушення. Патологічне порушення можна вибирати з м'язово-скелетного захворювання або порушення, такого як м'язова атрофія. Відомо багато причин м'язової атрофії, зокрема, вона може виникати в результаті лікування глюкокортикоїдом, таким як кортизол, дексаметазон, бетаметазон, преднізон, метилпреднізолон або преднізолон. М'язова атрофія може бути також результатом денервації внаслідок травми нерву або виникати в результаті дегенеративної, метаболічної або запальної невропатії (наприклад, синдром Гійєна-Барре, периферична невропатія або екзогенний вплив токсинів або лікарських засобів). Крім того, м'язова атрофія може бути результатом міопатії, такої як міотонія; вроджена міопатія, включаючи немалинову міопатію, мульти/міні-міопатію центральних стрижнів та міотубулярну (центронуклеарну) міопатію; мітохондріальна міопатія; періодичний сімейний параліч (параксизмальна сімейна міопленія); запальна міопатія; метаболічна міопатія, наприклад, викликуване хворобою накопичення глікогену або ліпідів; дерматоміозиту; поліміозиту; міозиту із включенням тілець; осифікуючого міозиту; рабдоміолізу (гострий некроз скелетних м'язів) та міоглобінурії. Міопатія може викликатися синдромом м'язової дистрофії, наприклад, таким як дистрофія Дюшенна, Беккера, міотонічна, фасціальна лопатково-плечова, Емері-Дрейфуса, окулофарінгеальна, лопатково-плечова, поясу кінцівок, Фукуями, вроджена м'язова дистрофія або спадкова дистальна (пізня) міопатія. М'язово-скелетне захворювання може являти собою також остеопороз, перелом кістки, низький зріст або карликовість. Крім того, м'язова атрофія може бути результатом таких захворювань, як хвороба моторних нейронів у дорослих, спінальна м'язова атрофія у дітей, аміотрофічний бічний склероз (ALS), юнацька спінальна м'язова атрофія, аутоімунна моторна мультифокальна невропатія із блокадою провідності, параліч у результаті удару або ушкодження спинного мозку, іммобілізація скелету внаслідок травми, пролонговане перебування в ліжку, добровільна пасивність, примусова пасивність, метаболічний стрес або недостатність живильних речовин, рак, СНІД, голодування, порушення щитовидної залози, діабет, доброякісна вроджена гіпотонія, хвороба центрального стрижня, пов'язане з опіком ушкодження, хронічне обструктивне легеневе захворювання, хвороби печінки (такі, наприклад, як фіброз, цироз), сепсис, ниркова недостатність, застійна серцева недостатність, старіння, політ у космос або перебування протягом деякого періоду часу в умовах невагомості. Прикладами пов'язаних з віком станів, які можна лікувати, є саркопенія, атрофія шкіри, м'язове виснаження, атрофія головного мозку, атеросклероз, артеріосклероз, емфізема легені, остеопороз, остеоартрит, імунологічна недостатність, високий кров'яний тиск, деменції, хвороба Гентінгтона, хвороба Альцгеймера, катаракти, вікова дегенерація жовтої плями, рак передміхурової залози, інсульт, знижена ймовірність виживання, моральна нестійкість, втрата пам'яті, зморшки, порушена функція нирок та вікова втрата слуху; метаболічні порушення, включаючи діабет типу II, метаболічний синдром, гіпергліцемію та ожиріння. Іншими станами, які можна лікувати за допомогою антитіл, запропонованих у винаході, є гостре та/або хронічне захворювання нирок або ниркова недостатність, фіброз або цироз печінки, рак, такий як рак молочної залози, хвороба Паркінсона; стани, асоційовані із загибеллю нейронів, такі як ALS, атрофія головного мозку або деменція та анемія. Інші стани являють собою кахексію, кахексію, асоційовану з ревматоїдним артритом, та кахексію, асоційовану з раком. У цей час відома дуже невелика кількість надійних або ефективних терапій, розроблених для лікування зазначених порушень. З урахуванням відомих даних про участь активінів, що зв'язуються серед інших рецепторів також і з ActRIIB, (Werner та Alzheimer, Cytokine Growth Factors Rev, 17(3), 2006, стор. 157-171), у розвитку фіброзу печінки, нирки та легені та про роль міостатину, активінів або ActRIIB при різних видах раку (Tsuchida та ін., Endo J, 55(1), 2008, стор. 11-21) антитіла, запропоновані у винаході, можна застосовувати для лікування фіброзу печінки, нирки та легені та різних видів раку, таких, наприклад, як (але не обмежуючись тільки ними) рабдоміосаркома, рак, що викликає втрату кісткової тканини, гепатоклітинні карциноми, різні види шлунково-кишкового раку. Попередження може бути повним, наприклад, можна досягати повної відсутності пов'язаного з віком стану або метаболічного порушення. Попередження може бути частковим, у результаті чого ймовірність появи пов'язаного з віком стану або метаболічного порушення у індивідуума зменшується у порівнянні з імовірністю його появи у індивідуума, який не одержував антитіла, запропонованого в даному винаході. 3 UA 102437 C2 5 10 15 20 25 30 35 40 45 50 55 60 З метою кращого розуміння даного винаходу попередньо представлене визначення деяких понять. Додаткові поняття представлені в докладному описі винаходу. Поняття "імунна відповідь" відноситься до дії (активності), наприклад, лімфоцитів, антигенпрезентуючих клітин, фагоцитів, гранулоцитів та розчинних макромолекул, яку мають описані вище клітини або печінка (включаючи активність антитіл, цитокінів та комплементу), що приводить до вибіркового ушкодження, деструкції або елімінації з організму людини прониклих патогенів, клітин або тканин, заражених патогенами, ракових клітин або у випадку аутоімунного або патологічного запалення, здорових людських клітин або тканин. Поняття "шлях трансдукції сигналу" або "сигнальна активність" відноситься до біохімічного причинного взаємозв'язку, що, як правило, ініціюється білок-білковою взаємодією, такою як зв'язування фактору росту з рецептором, що приводить у передачі сигналу від однієї частини клітини до іншої частини клітини. У цілому, передача сигналу включає специфічне фосфорилювання одного або декількох залишків тирозину, серіну або треоніну в одному або декількох білках, що брали участь у каскаді реакцій, що обумовлюють трансдукцію сигналу. Передостанній процес, як правило, включає пов'язані з ядром події, які приводять до зміни генної експресії. Поняття рецептор ActRIIB або Act IIB відноситься до людського ActRIIB, послідовність якого представлена у SEQ ID NO: 181 (AAC64515.1, GI:3769443). Застосовувані в дослідницьких цілях поліклональні та моноклональні антитіла анти-ActRIIB відомі в даній галузі, наприклад, антитіла, створені на фірмі R&D Systems®, шт. Міннесота, США. Терапевтичні антитіла анти-ActRIIB раніше не описані. Природно, можна одержувати антитіла анти-ActRIIB з інших видів та застосовувати їх для лікування патологічних станів у цих видів. Поняття "антитіло" у контексті даного опису включає повні антитіла та будь-який антигензв'язуючий фрагмент (тобто "антигензв'язуючу ділянку") або їх одноланцюгові варіанти. "Антитіло", що зустрічається в природніх умовах, являє собою глікопротеїн, який містить щонайменше два важкі (H) ланцюги та два легкі (L) ланцюги, зв'язані між собою дисульфідними містками. Кожен важкий ланцюг складається з варіабельної області важкого ланцюгу (скорочено позначена в контексті даного опису як VH) та константної області важкого ланцюгу. Константна область важкого ланцюгу складається із трьох доменів, тобто CH1, CH2 та CH3. Кожен легкий ланцюг складається з варіабельної області легкого ланцюгу (скорочено позначена в контексті даного опису як VL) та константної області легкого ланцюгу. Константна область легкого ланцюгу складається з одного домену, тобто C L. VH- та VL-області можна додатково підрозділяти на області гіперваріабельності, які називають гіперваріабельними ділянками (CDR), які перемежовуються з більш консервативними ділянками, які називають каркасними ділянками (FR). Кожна VH та VL складається із трьох CDR та чотирьох FR, які розташовані в напрямку від амінокінця до карбоксильного кінця в наступному порядку: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4. Варіабельні області важких та легких ланцюгів містять зв'язуючий домен, який взаємодіє з антигеном. Константні області антитіл можуть опосередковувати зв'язування імуноглобуліну із тканинами або факторами хазяїна, у тому числі з різними клітинами імунної системи (наприклад, ефекторними клітинами) та першим компонентом (Clq) класичної системи комплементу. Поняття "антигензв'язуюча ділянка" антитіла (або просто "антигенний центр" ("область детермінанти") у контексті даного опису відноситься до повнорозмірного антитіла або одного або декількох фрагментів антитіла, які зберігають здатність специфічно зв'язуватися з антигеном (наприклад, ділянкою ActRIIB). Було встановлено, що антигензв'язуючу функцію антитіла можна здійснюватися за допомогою фрагментів повнорозмірного антитіла. Прикладами зв'язуючого фрагменту, що підпадає під поняття "антигензв'язуюча ділянка" антитіл, є Fab-Фрагмент, одновалентний фрагмент, що складається з V L-, VH-, CL- та CH1доменів; F(ab)2-фрагмент, двовалентний фрагмент, що складається з двох Fab-Фрагментів, зв'язаних дисульфідним містком в шарнірній області; Fd-Фрагмент, що складається з VH- та CH1-доменів; Fv-Фрагмент, що складається з VL- та VН-доменів одного плеча антитіла; dAbфрагмент (Ward та інш., Nature 341, 1989, стор. 544-546), який складається з VH-домену; та виділена гіперваріабельна ділянка (CDR). Крім того, незважаючи на те, що два домени Fv-фрагменту, тобто VL та VH, кодуються різними генами, їх можна з'єднувати за допомогою методів рекомбінації синтетичним лінкером, який дозволяє створювати з них один білковий ланцюг, у якому пара V L- та VН-областей формує одновалентні молекули (відомі під назвою одноланцюговий Fv-фрагмент (scFv); див., наприклад, Bird та ін., Science 242, 1988, стор. 423-426; та Huston та ін., Proc. Natl. Acad. Sci. 85, 1988, стор. 5879-5883). Такі одноланцюгові антитіла також підпадають під поняття "антигензв'язуюча ділянка" антитіла. Зазначені фрагменти антитіла одержують за допомогою 4 UA 102437 C2 5 10 15 20 25 30 35 40 45 50 55 60 загальноприйнятих методів, відомих фахівцям у даній галузі, та фрагменти піддають скринінгу відносно можливості їх застосування, аналогічного застосуванню інтактних антитіл. Поняття "виділене антитіло" у контексті даного опису відноситься до антитіла, яке практично вільне від інших антитіл з іншою антигенною специфічністю (наприклад, виділене антитіло, яке специфічно зв'язується з ActRIIB, практично вільне від антитіл, які специфічно зв'язуються з антигенами, відмінними від ActRIIB). Однак виділене антитіло, яке специфічно зв'язується з ActRIIB, може давати перехресну реакцію з іншими антигенами, такими як молекули ActRIIB з інших видів. Крім того, виділене антитіло може бути практично вільним від іншого клітинного матеріалу та/або хімічних речовин. Поняття "моноклональне антитіло" або "композиція моноклонального антитіла" у контексті даного опису відносяться до препарату молекул антитіл однакового молекулярного складу. Композиція моноклональних антитіл має одну специфічність зв'язування та афінність у відношенні конкретного епітопу. Поняття "людське антитіло" у контексті даного опису відноситься до антитіл, що несуть варіабельні області, у яких як каркасні, так і CDR-ділянки виводять із послідовностей, що мають людське походження. Крім того, якщо антитіло містить константну область, то константну область також виводять із таких людських послідовностей, наприклад, послідовностей людської зародкової лінії, або мутантних версій послідовностей людської зародкової лінії або послідовностей консенсусних каркасних ділянок, що входять у антитіло, отриманих шляхом аналізу послідовностей людських каркасних ділянок, наприклад, згідно з методом, описаним у Knappik та ін., J Mol Biol 296, 2000, стор. 57-86. Людські антитіла, запропоновані у винаході, можуть включати також амінокислотні залишки, які не кодуються людськими послідовностями (наприклад, у результаті мутацій, інтродукованих шляхом випадкового або сайтнаправленого мутагенезу in vitro або соматичної мутації in vivo). Однак у контексті даного опису не мається на увазі, що під поняття "людське антитіло" підпадають антитіла, у яких послідовності CDR, виведені із зародкової лінії інших видів ссавців, таких як миші, трансплантовані в послідовності людських каркасних ділянок. Поняття "людське моноклональное антитіло" відноситься до антитіл, що мають одну специфічність зв'язування, які мають варіабельні області, у яких як каркасні, так та CDR-ділянки виводять із людських послідовностей. В одному з варіантів здійснення винаходу людські моноклональні антитіла одержують за допомогою гібридоми, яка включає B-клітину, отриману із трансгенної тварини крім людини, наприклад, трансгенної миші, у геномі якої міститься трансген людського важкого ланцюгу та трансген людського легкого ланцюгу, злитий з іморталізованою клітиною. Поняття "рекомбінантне людське антитіло" у контексті даного опису відноситься до всіх людських антитіл, які одержують, експресують, створюють або виділяють за допомогою методів рекомбінації, наприклад, до антитіл, виділених із тварини (наприклад, миші), яка є трансгенною або трансхромосомною завдяки інтродукції генів людського імуноглобуліну, або які отримані з гібридоми, до антитіл, виділених із клітини-хазяїна, трансформованої з метою експресії людського антитіла, наприклад, з використанням трансфектоми, до антитіл, виділених з рекомбінантної комбінаторної бібліотеки людських антитіл, та до антитіл, отриманих, експресованих, створених або виділених будь-якими іншими шляхами, які включають сплайсинг послідовностей всього гену людського імуноглобуліну або його частини з іншими послідовностями ДНК. Зазначені рекомбінантні людські антитіла несуть варіабельні області, у яких каркасні та CDR-ділянки виводять із послідовностей імуноглобуліну людської зародкової лінії. Однак у деяких варіантах здійснення винаходу зазначені рекомбінантні людські антитіла можна піддавати мутагенезу in vitro (або, коли для одержання людських послідовностей Ig використовують трансгенних тварин, тоді соматичному мутагенезу in vivo), та в результаті амінокислотні послідовності VH- та VL-областей рекомбінантних антитіл являють собою послідовності, які хоча і виведені та є спорідненими з послідовностями V H та VL людської зародкової лінії, можуть не зустрічатися в природніх умовах у популяції антитіл людської зародкової лінії in vivo. У контексті даного опису поняття "ізотип" відноситься до класу антитіл (наприклад, IgM, IgE, IgG, такому як IgG1 або IgG2), який кодується генами константної області важкого ланцюгу. Фрази "антитіло, що розпізнає антиген" та "антитіло, специфічне відносно антигену" у контексті даного опису застосовують взаємозамінно з поняттям "антитіло, яке зв'язується специфічно з антигеном". У контексті даного опису мається на увазі, що антитіло, яке "специфічно зв'язується з поліпептидом ActRIIB", являє собою антитіло, зв'язування якого з поліпептидом людського ActRIIB характеризується значенням KD, що становить 100нМ або менше, 10нМ або менше, 1нМ 5 UA 102437 C2 5 10 15 20 25 30 35 40 45 50 55 60 або менше. Антитіло, яке "дає перехресну реакцію з антигеном, відмінним від ActRIIB", означає -9 антитіло, зв'язування якого з антигеном характеризується значенням K D, що становить 10×10 M -9 -9 або менше, 5×10 M або менше або 2×10 M або менше. Антитіло, яке "не дає перехресну реакцію з конкретним антигеном", являє собою антитіло, зв'язування якого з зазначеним -8 антигеном характеризується значенням KD, що становить 1,5×10 M або більше або значенням -8 -7 KD, що становить 5-10×10 M або 1×10 M або більше. У конкретних варіантах здійснення винаходу ті антитіла, які не дають перехресної реакції з антигеном, характеризуються практично невизначуваним зв'язуванням із цими білками при оцінці за допомогою стандартних аналізів зв'язування. KD можна визначати за допомогою біосенсорної системи, такої як система Biacore®, або за допомогою врівноважуючого титрування розчинів. У контексті даного опису мається на увазі, що поняття "антагоністичне антитіло" відноситься до антитіла, яке інгібує індукуєму ActRIIB сигнальну активність у присутності міостатину. Приклади аналізу, призначеного для виявлення цього, включають аналіз інгібування індукуємої міостатином передачі сигналів (наприклад, за допомогою аналізу Smad-залежного репортерного гену), інгібування індукуємого міостатином Smad-фосфорилювання (P-SmadELISA) та інгібування індукуємого міостатином інгібування диференціювання клітин скелетних м'язів (наприклад, за допомогою аналізу креатинкінази). У деяких варіантах здійснення винаходу антитіла інгібують індукуєму міостатином передачу сигналів, оцінювану за допомогою аналізу Smad-залежного репортерного гену, що характеризується значенням IC50, що становить 10нM або менше, 1нM або менше або 100пМ або менше. У контексті даного опису мається на увазі, що поняття антитіло, "що не має агоністичної активності" відноситься до антитіла, яке не має здатності значно підвищувати опосередковувану ActRIIB сигнальну активність за відсутності міостатину в основаному на застосуванні клітин аналізі, такому як аналіз інгібування індукованої міостатином передачі сигналів (наприклад, за допомогою аналізу Smad-залежного репортерного гену), інгібування індукованого міостатином Smad-фосфорилювання (P-Smad-ELISA) та інгібування індукованого міостатином інгібування диференціювання клітин скелетних м'язів (наприклад, за допомогою аналізу креатинкінази). Зазначені аналізи описані більш докладно нижче у прикладах. Поняття "Kassoc" або "Ka" у контексті даного опису відноситься до швидкості асоціації взаємодії конкретних антитіла-антигену, а поняття "Kdis" або "Kd" у контексті даного опису відноситься до швидкості дисоціації взаємодії конкретних антитіла-антигену. У контексті даного опису мається на увазі, що поняття "KD" відноситься до константи дисоціації, яку одержують зі співвідношення Kd до Ka (тобто Kd/Ka) та виражають у молярній концентрації (M). Значення KD для антитіл можна визначати за допомогою методів, добре відомих у даній галузі. Метод визначення значення KD антитіла являє собою метод, оснований на резонансі поверхневого плазмону, такий як метод, оснований на застосуванні біосенсорної системи, такої як система Biacore®, або метод врівноважуючого титрування розчинів (SET) (див. Friguet B. та ін., J. Immunol Methods; 77(2), 1985, стор. 305-319 та Hanel C. та ін., Anal Biochem; 339(1), 2005, стор. 182-184). У контексті даного опису поняття "афінність" відноситься до сили взаємодії (ступеня спорідненості) між антитілом та антигеном в одному з антигензв'язуючих центрів антитіла. У кожному антигензв'язуючому центрі варіабельна область "плеча" антитіла взаємодіє за допомогою слабких нековалентних сил з антигеном у численних сайтах; чим більше взаємодій, тим сильніше афінність. У контексті даного опису поняття "авідність" відноситься до інформативного критерію загальної стабільності або сили комплексу антитіло-антиген. Вона контролюється трьома основними факторами: афінність антитіла до епітопy; валентність і антигену, і антитіла; та структурна організація взаємодіючих ділянок. Ці три фактори визначають, зрештою, специфічність антитіла, тобто ймовірність того, що конкретне антитіло буде зв'язуватися саме з конкретним антигенним епітопом. У контексті даного опису поняття "ADCC-активність" або "антитіло- обумовлена клітинозалежна цитотоксичність" відноситься до здатності виснажувати людські В-клітини. ADCC-активність можна вимірювати за допомогою аналізів виснаження людських В-клітин, відомих у даній галузі. Для одержання зонду, що має велику авідність, можна конструювати димерний кон'югат (дві молекули білку антитіла зшиті з FACS-маркером), створюючи тим самим взаємодії, що мають низьку афінність (такі, які мають місце у випадку антитіла зародкової лінії), що більш легко виявляти за допомогою FACS. Крім того, іншим засобом підвищення авідності зв'язування антигену є створення димерів, тримерів або мультимерів кожної із представлених у даному 6 UA 102437 C2 5 10 15 20 25 30 35 40 45 50 55 60 описі конструкцій антитіл анти-ActRIIB. Зазначені мультимери можна створювати шляхом ковалентного зв'язування індивідуальних молекул, наприклад, шляхом імітації зв'язування, що зустрічається в природніх умовах, C-кінця з N-кінцем або шляхом імітації димерів антитіл, які утримуються разом їхніми константними областями. Зв'язки, сконструйовані на границі поділу Fc/Fc, можуть бути ковалентними або нековалентними. Крім того, у гібридах ActRIIB можна використовувати в якості партнерів димеризуючі або мультимеризуючі компоненти, відмінні від Fc, для створення таких структур більш високого порядку. Наприклад, можна застосовувати мультимеризуючі домени, такі як тримеризуючий домен, описаний в WO 2004/039841, або пентамеризуючий домен, описаний в WO 98/18943. У контексті даного опису поняття "вибіркове, селективне" відносно антитіла відноситься до антитіла, яке зв'язується з певним поліпептидом-мішенню, але не зв'язується з близькоспорідненими поліпептидами. У контексті даного опису поняття "висока афінність" відносно антитіла відноситься до антитіла, для якого значення KD відносно антигену-мішені становить 1нМ або менше. У контексті даного опису поняття "індивідуум" відноситься до будь-якої людини або тварини крім людини. Поняття "тварина крім людини" включає всіх хребетних тварин, наприклад, ссавців та тварин, що не відносяться до ссавців, таких як примати крім людини, вівці, собаки, кішки, коні, корови, кури, амфібії, рептилії тощо. У контексті даного опису поняття "оптимізована" означає, що нуклеотидна послідовність змінена з позицій кодування амінокислотної послідовності за допомогою кодонів, кращих для продуктивної клітини або організму, як правило, еукаріотичної клітини, наприклад, клітини Pichia, клітини Trichoderma, клітини яєчника китайського хом'ячка (CHO) або клітини людини. Оптимізовану нуклеотидну послідовність створюють таким чином, щоб вона кодувала амінокислотну послідовність, ідентичну або практично ідентичну амінокислотній послідовності, що кодується вихідною нуклеотидною послідовністю, яку називають також "батьківською" послідовністю. Оптимізовані послідовності, представлені в даному описі, створювали таким чином, щоб вони мали кодони, кращі для клітин ссавця, таких як CHO; однак під обсяг винаходу підпадає також оптимізована експресія цих послідовностей в інших еукаріотичних клітинах. Амінокислотні послідовності, що кодуються оптимізованими нуклеотидними послідовностями, також розглядаються як оптимізовані. Різні об'єкти винаходу описані більш докладно в наведених нижче підрозділах. Стандартні аналізи, призначені для оцінки здатності до зв'язування антитіл з ActRIIB різних видів, відомі в даній галузі та включають, наприклад, ELISA, вестерн-блоттинг та РІА. Прийнятні аналізи описані докладно в прикладах. Афінність до зв'язування антитіл можна визначати також за допомогою стандартних аналізів, відомих у даній галузі, таких як Biacore-аналіз або метод врівноважуючого титрування розчинів. Методи, основані на резонансі поверхневого плазмону, наприклад, Biacore, дозволяють визначати кінетичні характеристики зв'язування, що дає можливість розраховувати афінність зв'язування. Аналізи, призначені для оцінки впливів антитіл на функціональну активність ActRIIB (наприклад, зв'язування з рецептором, попередження або індукція проліферації людських клітин B-клітин або виробництво IgG) описані більш докладно в прикладах. Таким чином, слід розуміти, що антитіло, яке "інгібує" одну або декілька з видів активності ActRIIB (наприклад, біохімічну, імунохімічну, клітинну, фізіологічну або інші види біологічної активності або т.п.), що визначають на основі методик, відомих у даній галузі та представлених у даному описі, статистично значимо знижує конкретний вид активності у порівнянні з варіантом без антитіла (або, наприклад, коли є присутнім контрольне антитіло з невідповідною специфічністю). Антитіло, яке інгібує активність ActRIIB, викликає статистично значиме зниження оцінюваного параметру щонайменше на 10 %, на 50 %, 80 % або 90 %, та в конкретних варіантах здійснення винаходу антитіло, запропоноване у винаході, може інгібувати більше ніж на 95 %, 98 % або 99 % функціональну активність ActRIIB. Поняття "перехресно блокує", "перехресно блокований" або "перехресна блокада" у контексті даного опису використовують взаємозамінно для позначення здатності антитіла або іншого зв'язуючого агенту виявляти інтерферуючий вплив на зв'язування інших антитіл або зв'язуючих агентів з ActRIIB, насамперед з лігандзв'язуючим доменом, при оцінці за допомогою стандартного аналізу конкурентного зв'язування. Здатність або ступінь, з яким антитіло або інший зв'язуючий агент може виявляти інтерферуючий вплив на зв'язування іншого антитіла або зв'язуючої молекули з ActRIIB, та отже, чи можуть вони розглядатися як перехресно блокувальні згідно з винаходом, можна визначати за допомогою стандартних аналізів конкурентного зв'язування. Один із прийнятних 7 UA 102437 C2 5 10 15 20 25 30 35 40 45 50 55 60 аналізів передбачає застосування Biacore-технології (наприклад, з використанням обладнання Biacore (фірма Biacore, Уппсала, Швеція)), за допомогою якого можна визначати ступінь взаємодій з використанням методу на основі резонансу поверхневого плазмону. Іншим аналізом, який можна застосовувати для оцінки перехресної блокади, є підхід на основі ELISA. Іншим застосовуваним аналізом є FACS-аналіз, за допомогою якого визначають конкуренцію різних антитіл за зв'язування з експресуючими ActRIIB клітинами (що докладно описане в прикладах). Згідно з винаходом перехресно блокуюче антитіло або інший зв'язуючий агент, запропонований у винаході, зв'язується з ActRIIB при оцінці за допомогою описаного Biacoreаналізу перехресного зв'язування таким чином, що вимірюване зв'язування комбінації (суміші) антитіл або зв'язуючих агентів становить від 80 до 0,1 % (наприклад, від 80 до 4 %) від максимального теоретичного зв'язування, зокрема від 75 до 0,1 % (наприклад, від 75 до 4 %) від максимального теоретичного зв'язування, та більш конкретно від 70 до 0,1 % (наприклад, від 70 до 4 %), та більш конкретно від 65 до 0,1 % (наприклад, від 65 до 4 %) від максимального теоретичного зв'язування (як описано вище) двох антитіл або зв'язуючих агентів у комбінації. Антитіло розглядається як перехресно блокувальне при оцінці за допомогою ELISA-аналізу, якщо антитіло, що тестують, має здатність викликати зниження зв'язування антитіла антиActRIIB з ActRIIB на 60-100 %, зокрема на 70-100 %, та більш конкретно на 80-100 %, у порівнянні із застосовуваними в якості позитивного контролю лунками (тобто, що включають таке ж антитіло анти-ActRIIB та ActRIIB, але без "тестуємого" перехресно блокувального антитіла). Прикладами перехресно блокувальних антитіл є антитіла, позначені в контексті даного опису як MOR08159 та MOR08213. Таким чином, у винаході описані антитіла, які перехресно блокують MOR08159 або MOR08213 за зв'язування з ActRIIB. Рекомбінантні антитіла Антитіла, запропоновані у винаході, являють собою людські рекомбінантні антитіла, виділені та структурно охарактеризовані згідно з методами, описаними в прикладах. Амінокислотні послідовності VH виділених антитіл, запропонованих у винаході, представлені в SEQ ID NO: 99112. Амінокислотні послідовності VL виділених антитіл, запропонованих у винаході, представлені у SEQ ID NO: 85-98 відповідно. Приклади кращих амінокислотних послідовностей важких ланцюгів повнорозмірних антитіл, запропонованих у винаході, представлені в SEQ ID NO: 146-150 та 156-160. Приклади кращих амінокислотних послідовностей легких ланцюгів повнорозмірних антитіл, запропонованих у винаході, представлені у SEQ ID NO: 141145 та 151-155 відповідно. Інші антитіла, запропоновані у винаході, містять амінокислоти, змінені в результаті мутацій, таких як делеція, інсерція або заміна амінокислот, при цьому їх CDR-ділянки усе ще ідентичні щонайменше на 60, 70, 80, 90, 95, 97 або 99 % CDR-ділянкам, представленим у зазначених вище послідовностях. Деякі варіанти здійснення винаходу включають мутантні амінокислотні послідовності, у яких не більше 1, 2, 3, 4 або 5 амінокислот змінені в результаті мутацій, таких як делеція, інсерція або заміна амінокислот, в CDR-ділянках у порівнянні з CDR-ділянками, представленими в зазначених вище послідовностях. Крім того, батьківські нуклеотидні послідовності варіабельної області важкого ланцюгу представлені у SEQ ID NO: 127-140. Батьківські нуклеотидні послідовності варіабельної області легені ланцюгу представлені у SEQ ID NO: 161-165 та 71-175. Повнорозмірні нуклеотидні послідовності легких ланцюгів, оптимізовані для експресії в клітині ссавця, представлені у SEQ ID NO: 161-165 та 171-175. Повнорозмірні нуклеотидні послідовності важких ланцюгів, оптимізовані для експресії в клітині ссавця, представлені у SEQ ID NO: 166-170 та 176-180. Інші антитіла, запропоновані у винаході, включають мутантні амінокислотні або нуклеотидні послідовності, які ще ідентичні щонайменше на 60 або більше (тобто на 80, 90, 95, 97, 99 % або більше) описаним вище послідовностям. Деякі варіанти здійснення винаходу включають мутантні амінокислотні послідовності, у яких не більше 1, 2, 3, 4 або 5 амінокислот змінені в результаті мутацій, таких як делеція, інсерція або заміна амінокислот, у варіабельних областях у порівнянні з варіабельними областями, представленими в зазначених вище послідовностях. Оскільки кожне із зазначених антитіл зв'язується з одним та тим же епітопом та вони є нащадками одного та того ж батьківського антитіла, то послідовності V H, VL, послідовності повнорозмірного легкого ланцюгу та повнорозмірного важкого ланцюгу (нуклеотидні послідовності та амінокислотні послідовності) можна "змішувати та сполучати" для створення інших анти- ActRIIB зв'язуючих молекул, запропонованих у винаході. Зв'язування з ActRIIB зазначених отриманих у результаті "змішання та сполучення" антитіл можна оцінювати за допомогою описаних вище та в прикладах аналізів зв'язування (наприклад, ELISA). Коли ці ланцюги змішують та сполучають, то послідовність V H з конкретної пари VH/VL слід заміщати структурно подібною послідовністю VH. Аналогічно цьому, повнорозмірну послідовність важкого 8 UA 102437 C2 5 10 15 20 25 30 35 40 45 50 55 60 ланцюгу з конкретної пари повнорозмірна послідовність важкого ланцюгу/повнорозмірна послідовність легкого ланцюгу слід заміщати структурно подібною повнорозмірною послідовністю важкого ланцюгу. Аналогічно цьому, послідовність VL з конкретної пари VH/VL слід заміщати структурно подібною послідовністю VL. Аналогічно цьому, повнорозмірну послідовність легкого ланцюгу з конкретної пари повнорозмірна послідовність важкого ланцюгу /повнорозмірна послідовність легкого ланцюгу слід заміщати структурно подібною повнорозмірною послідовністю легкого ланцюгу. Таким чином, одним з об'єктів винаходу є виділене рекомбінантне антитіло анти-ActRIIB або його антигензв'язуюча ділянка, яке/яка має: варіабельну область важкого ланцюгу, яка містить амінокислотну послідовність, вибрану з групи, що включає SEQ ID NO: 99-112; та варіабельну область легкого ланцюгу, яка містить амінокислотну послідовність, вибрану з групи, що включає SEQ ID NO: 85-98. Іншим об'єктом винаходу є: I) виділене рекомбінантне антитіло анти-ActRIIB, яке має: повнорозмірну послідовність важкого ланцюгу, яка містить амінокислотну послідовність, вибрану з групи, що включає SEQ ID NO: 99-112; та повнорозмірну послідовність легкого ланцюгу, яка містить амінокислотну послідовність, вибрану з групи, що включає SEQ ID NO: 85-98, або (II) функціональний білок, що містить його антигензв'язуючу ділянку. Іншим об'єктом винаходу є: (I) виділене рекомбінантне антитіло анти-ActRIIB, яке має повнорозмірну послідовність важкого ланцюгу, що кодується нуклеотидною послідовністю, яка була оптимізована з метою експресії в клітині ссавця, вибрану з групи, що включає SEQ ID NO: 127-140; та повнорозмірну послідовність легкого ланцюгу, що кодується нуклеотидною послідовністю, яка була оптимізована з метою експресії в клітині ссавця, вибрану з групи, що включає SEQ ID NO: 113126, або (II) функціональний білок, що містить його антигензв'язуючу ділянку. Амінокислотні послідовності CDR1 VH антитіл представлені у SEQ ID NO: 1-14. Амінокислотні послідовності CDR2 VH антитіл представлені у SEQ ID NO: 15-28. Амінокислотні послідовності CDR3 VH антитіл представлені у SEQ ID NO: 29-42. Амінокислотні послідовності CDR1 VL антитіл представлені у SEQ ID NO: 43-56. Амінокислотні послідовності CDR2 VL антитіл представлені у SEQ ID NO: 57-70. Амінокислотні послідовності CDR3 VL антитіл представлені у SEQ ID NO: 71-84. CDR-ділянки описують за допомогою системи Кебота (Kabat E. A. та ін., Sequences of Proteins of Immunological Interest, 5-е вид., вид-во U.S. Department of Health and Human Services, NIH Publication No. 91-3242, 1991). Альтернативний метод визначення CDR-ділянок оснований на іншому підході, розробленому Chothia (Chothia та ін., Nature, 342, 1998, стор. 877-883). Визначення Chothia базується на локалізації петель структурних областей. Однак через зміни системи нумерації, що застосовувалася у Chothia (див., наприклад, http://www.biochem.ucl.ac.uk/~martin/abs/GeneralInfo.html та http://www.bioinf.org.uk/abs/), ця система в даний час менш широко використовується. Існують інші системи визначення CDR, та вони також згадуються у зазначених двох сайтах в мережі Інтернет. З урахуванням того, що кожне із зазначених антитіл може зв'язуватися з ActRIIB та що специфічність зв'язування з антигеном забезпечується насамперед ділянками CDR1, 2 та 3, послідовності CDR1, 2 та 3 VH та послідовності CDR1, 2 та 3 VL можна "змішувати та сполучати" (тобто можна змішувати та сполучати CDR з різних антитіл), при цьому з кожного антитіла, що містить CDR1, 2 та 3 VH та CDR1, 2 та 3 VL, створюють інші молекули, що зв'язуються з ActRIIB, запропоновані у винаході. Зв'язування з ActRIIB таких отриманих у результаті "змішання та сполучення" антитіл можна оцінювати за допомогою описаних вище та в прикладах аналізів зв'язування (наприклад, ELISA). Коли змішують та сполучають CDR-послідовності VH, те послідовність CDR1, CDR2 та/або CDR3 з конкретної послідовності V H слід заміняти структурно подібною(ими) послідовністю(ями) CDR. Аналогічно цьому, коли змішують та сполучають CDRпослідовності VL, то послідовність CDR1, CDR2 та/або CDR3 з конкретної послідовності V L слід заміняти структурно подібною(ими) послідовністю(ями) CDR. Звичайному фахівцеві в даній галузі повинно бути очевидно, що нові послідовності VH та VL можна створювати шляхом заміни однієї або декількох послідовностей CDR-ділянок VH та/або VL на структурно подібні послідовності CDR, зазначені в даному описі для моноклональних антитіл, запропонованих у даному винаході. Виділене рекомбінантне антитіло анти-ActRIIB або його антигензв'язуюча ділянка містить: CDR1 варіабельної області важкого ланцюгу, яка має амінокислотну послідовність, вибрану з групи, що включає SEQ ID NO: 1-14; CDR2 варіабельної області важкого ланцюгу, яка має 9 UA 102437 C2 5 10 15 20 25 30 35 40 45 50 55 60 амінокислотну послідовність, вибрану з групи, що включає SEQ ID NO: 15-28; CDR3 варіабельної області важкого ланцюгу, яка має амінокислотну послідовність, вибрану з групи, що включає SEQ ID NO: 29-42; CDR1 варіабельної області легкого ланцюгу, яка має амінокислотну послідовність, вибрану з групи, що включає SEQ ID NO: 43-56; CDR2 варіабельної області легкого ланцюгу, яка має амінокислотну послідовність, вибрану з групи, що включає SEQ ID NO: 57-70; та CDR3 варіабельної області легкого ланцюгу, яка має амінокислотну послідовність, вибрану з групи, що включає SEQ ID NO: 71-84. В одному з варіантів здійснення винаходу антитіло містить: CDR1 варіабельної області важкого ланцюгу, що має послідовність, представлену у SEQ ID NO: 1; CDR2 варіабельної області важкого ланцюгу, що має послідовність, представлену у SEQ ID NO: 15; CDR3 варіабельної області важкого ланцюгу, що має послідовність, представлену у SEQ ID NO: 29; CDR1 варіабельної області легкого ланцюгу, що має послідовність, представлену у SEQ ID NO: 43; CDR2 варіабельної області легкого ланцюгу, що має послідовність, представлену у SEQ ID NO: 57; та CDR3 варіабельної області легкого ланцюгу, що має послідовність, представлену у SEQ ID NO: 71. В одному з варіантів здійснення винаходу антитіло містить: CDR1 варіабельної області важкого ланцюгу, що має послідовність, представлену у SEQ ID NO: 2; CDR2 варіабельної області важкого ланцюгу, що має послідовність, представлену у SEQ ID NO: 16; CDR3 варіабельної області важкого ланцюгу, що має послідовність, представлену у SEQ ID NO: 30; CDR1 варіабельної області легкого ланцюгу, що має послідовність, представлену у SEQ ID NO: 44; CDR2 варіабельної області легкого ланцюгу, що має послідовність, представлену у SEQ ID NO: 58; та CDR3 варіабельної області легкого ланцюгу, що має послідовність, представлену у SEQ ID NO: 72. В одному з варіантів здійснення винаходу антитіло містить: CDR1 варіабельної області важкого ланцюгу, що має послідовність, представлену у SEQ ID NO: 3; CDR2 варіабельної області важкого ланцюгу, що має послідовність, представлену у SEQ ID NO: 17; CDR3 варіабельної області важкого ланцюгу, що має послідовність, представлену у SEQ ID NO: 31; CDR1 варіабельної області легкого ланцюгу, що має послідовність, представлену у SEQ ID NO: 45; CDR2 варіабельної області легкого ланцюгу, що має послідовність, представлену у SEQ ID NO: 59; та CDR3 варіабельної області легкого ланцюгу, що має послідовність, представлену у SEQ ID NO: 73. В одному з варіантів здійснення винаходу антитіло містить: CDR1 варіабельної області важкого ланцюгу, що має послідовність, представлену у SEQ ID NO: 4; CDR2 варіабельної області важкого ланцюгу, що має послідовність, представлену у SEQ ID NO: 18; CDR3 варіабельної області важкого ланцюгу, що має послідовність, представлену у SEQ ID NO: 32; CDR1 варіабельної області легкого ланцюгу, що має послідовність, представлену у SEQ ID NO: 46; CDR2 варіабельної області легкого ланцюгу, що має послідовність, представлену у SEQ ID NO: 60; та CDR3 варіабельної області легкого ланцюгу, що має послідовність, представлену у SEQ ID NO: 74. В одному з варіантів здійснення винаходу антитіло містить: CDR1 варіабельної області важкого ланцюгу, що має послідовність, представлену у SEQ ID NO: 5; CDR2 варіабельної області важкого ланцюгу, що має послідовність, представлену у SEQ ID NO: 19; CDR3 варіабельної області важкого ланцюгу, що має послідовність, представлену у SEQ ID NO: 33; CDR1 варіабельної області легкого ланцюгу, що має послідовність, представлену у SEQ ID NO: 47; CDR2 варіабельної області легкого ланцюгу, що має послідовність, представлену у SEQ ID NO: 61; та CDR3 варіабельної області легкого ланцюгу, що має послідовність, представлену у SEQ ID NO: 75. В одному з варіантів здійснення винаходу антитіло містить: CDR1 варіабельної області важкого ланцюгу, що має послідовність, представлену у SEQ ID NO: 6; CDR2 варіабельної області важкого ланцюгу, що має послідовність, представлену у SEQ ID NO: 20; CDR3 варіабельної області важкого ланцюгу, що має послідовність, представлену у SEQ ID NO: 34; CDR1 варіабельної області легкого ланцюгу, що має послідовність, представлену у SEQ ID NO: 48; CDR2 варіабельної області легкого ланцюгу, що має послідовність, представлену у SEQ ID NO: 62; та CDR3 варіабельної області легкого ланцюгу, що має послідовність, представлену у SEQ ID NO: 76. В одному з варіантів здійснення винаходу антитіло містить: CDR1 варіабельної області важкого ланцюгу, що має послідовність, представлену у SEQ ID NO: 7; CDR2 варіабельної області важкого ланцюгу, що має послідовність, представлену у SEQ ID NO: 21; CDR3 варіабельної області важкого ланцюгу, що має послідовність, представлену у SEQ ID NO: 35; CDR1 варіабельної області легкого ланцюгу, що має послідовність, представлену у 10 UA 102437 C2 5 10 15 20 25 30 35 40 45 50 55 60 SEQ ID NO: 49; CDR2 варіабельної області легкого ланцюгу, що має послідовність, представлену у SEQ ID NO: 63; та CDR3 варіабельної області легкого ланцюгу, що має послідовність, представлену у SEQ ID NO: 77. В одному з варіантів здійснення винаходу антитіло містить: CDR1 варіабельної області важкого ланцюгу, що має послідовність, представлену у SEQ ID NO: 8; CDR2 варіабельної області важкого ланцюгу, що має послідовність, представлену у SEQ ID NO: 22; CDR3 варіабельної області важкого ланцюгу, що має послідовність, представлену у SEQ ID NO: 36; CDR1 варіабельної області легкого ланцюгу, що має послідовність, представлену у SEQ ID NO: 50; CDR2 варіабельної області легкого ланцюгу, що має послідовність, представлену у SEQ ID NO: 64; та CDR3 варіабельної області легкого ланцюгу, що має послідовність, представлену у SEQ ID NO: 78. В одному з варіантів здійснення винаходу антитіло містить: CDR1 варіабельної області важкого ланцюгу, що має послідовність, представлену у SEQ ID NO: 9; CDR2 варіабельної області важкого ланцюгу, що має послідовність, представлену у SEQ ID NO: 23; CDR3 варіабельної області важкого ланцюгу, що має послідовність, представлену у SEQ ID NO: 37; CDR1 варіабельної області легкого ланцюгу, що має послідовність, представлену у SEQ ID NO: 51; CDR2 варіабельної області легкого ланцюгу, що має послідовність, представлену у SEQ ID NO: 65; та CDR3 варіабельної області легкого ланцюгу, що має послідовність, представлену у SEQ ID NO: 79. В одному з варіантів здійснення винаходу антитіло містить: CDR1 варіабельної області важкого ланцюгу, що має послідовність, представлену у SEQ ID NO: 10; CDR2 варіабельної області важкого ланцюгу, що має послідовність, представлену у SEQ ID NO: 24; CDR3 варіабельної області важкого ланцюгу, що має послідовність, представлену у SEQ ID NO: 38; CDR1 варіабельної області легкого ланцюгу, що має послідовність, представлену у SEQ ID NO: 52; CDR2 варіабельної області легкого ланцюгу, що має послідовність, представлену у SEQ ID NO: 66; та CDR3 варіабельної області легкого ланцюгу, що має послідовність, представлену у SEQ ID NO: 80. В одному з варіантів здійснення винаходу антитіло містить: CDR1 варіабельної області важкого ланцюгу, що має послідовність, представлену у SEQ ID NO: 11; CDR2 варіабельної області важкого ланцюгу, що має послідовність, представлену у SEQ ID NO: 25; CDR3 варіабельної області важкого ланцюгу, що має послідовність, представлену у SEQ ID NO: 39; CDR1 варіабельної області легкого ланцюгу, що має послідовність, представлену у SEQ ID NO: 53; CDR2 варіабельної області легкого ланцюгу, що має послідовність, представлену у SEQ ID NO: 67; та CDR3 варіабельної області легкого ланцюгу, що має послідовність, представлену у SEQ ID NO: 81. В одному з варіантів здійснення винаходу антитіло містить: CDR1 варіабельної області важкого ланцюгу, що має послідовність, представлену у SEQ ID NO: 12; CDR2 варіабельної області важкого ланцюгу, що має послідовність, представлену у SEQ ID NO: 26; CDR3 варіабельної області важкого ланцюгу, що має послідовність, представлену у SEQ ID NO: 40; CDR1 варіабельної області легкого ланцюгу, що має послідовність, представлену у SEQ ID NO: 54; CDR2 варіабельної області легкого ланцюгу, що має послідовність, представлену у SEQ ID NO: 68; та CDR3 варіабельної області легкого ланцюгу, що має послідовність, представлену у SEQ ID NO: 82. В одному з варіантів здійснення винаходу антитіло містить: CDR1 варіабельної області важкого ланцюгу, що має послідовність, представлену у SEQ ID NO: 13; CDR2 варіабельної області важкого ланцюгу, що має послідовність, представлену у SEQ ID NO: 27; CDR3 варіабельної області важкого ланцюгу, що має послідовність, представлену у SEQ ID NO: 41; CDR1 варіабельної області легкого ланцюгу, що має послідовність, представлену у SEQ ID NO: 55; CDR2 варіабельної області легкого ланцюгу, що має послідовність, представлену у SEQ ID NO: 69; та CDR3 варіабельної області легкого ланцюгу, що має послідовність, представлену у SEQ ID NO: 83. В одному з варіантів здійснення винаходу антитіло містить: CDR1 варіабельної області важкого ланцюгу, що має послідовність, представлену у SEQ ID NO: 14; CDR2 варіабельної області важкого ланцюгу, що має послідовність, представлену у SEQ ID NO: 28; CDR3 варіабельної області важкого ланцюгу, що має послідовність, представлену у SEQ ID NO: 42; CDR1 варіабельної області легкого ланцюгу, що має послідовність, представлену у SEQ ID NO: 56; CDR2 варіабельної області легкого ланцюгу, що має послідовність, представлену у SEQ ID NO: 70; та CDR3 варіабельної області легкого ланцюгу, що має послідовність, представлену у SEQ ID NO: 84. В одному з варіантів здійснення винаходу антитіло містить: (a) варіабельну область важкого 11 UA 102437 C2 5 10 15 20 25 30 35 40 45 50 55 60 ланцюгу, послідовність якої представлена у SEQ ID NO: 85, та варіабельну область легкого ланцюгу, послідовність якої представлена у SEQ ID NO: 99; (б) варіабельну область важкого ланцюгу, послідовність якої представлена у SEQ ID NO: 86, та варіабельну область легкого ланцюгу, послідовність якої представлена у SEQ ID NO: 100; (в) варіабельну область важкого ланцюгу, послідовність якої представлена у SEQ ID NO: 87, та варіабельну область легкого ланцюгу, послідовність якої представлена у SEQ ID NO: 101; (г) варіабельну область важкого ланцюгу, послідовність якої представлена у SEQ ID NO: 88, та варіабельну область легкого ланцюгу, послідовність якої представлена у SEQ ID NO: 102; (д) варіабельну область важкого ланцюгу, послідовність якої представлена у SEQ ID NO: 89, та варіабельну область легкого ланцюгу, послідовність якої представлена у SEQ ID NO: 103; (е) варіабельну область важкого ланцюгу, послідовність якої представлена у SEQ ID NO: 90, та варіабельну область легкого ланцюгу, послідовність якої представлена у SEQ ID NO: 104; (ж) варіабельну область важкого ланцюгу, послідовність якої представлена у SEQ ID NO: 91, та варіабельну область легкого ланцюгу, послідовність якої представлена у SEQ ID NO: 105; (з) варіабельну область важкого ланцюгу, послідовність якої представлена у SEQ ID NO: 92, та варіабельну область легкого ланцюгу, послідовність якої представлена у SEQ ID NO: 106; (і) варіабельну область важкого ланцюгу, послідовність якої представлена у SEQ ID NO: 93, та варіабельну область легкого ланцюгу, послідовність якої представлена у SEQ ID NO: 107; (к) варіабельну область важкого ланцюгу, послідовність якої представлена у SEQ ID NO: 94, та варіабельну область легкого ланцюгу, послідовність якої представлена у SEQ ID NO: 108; (л) варіабельну область важкого ланцюгу, послідовність якої представлена у SEQ ID NO: 95, та варіабельну область легкого ланцюгу, послідовність якої представлена у SEQ ID NO: 109; (м) варіабельну область важкого ланцюгу, послідовність якої представлена у SEQ ID NO: 96, та варіабельну область легкого ланцюгу, послідовність якої представлена у SEQ ID NO: 110; (н) варіабельну область важкого ланцюгу, послідовність якої представлена у SEQ ID NO: 97, та варіабельну область легкого ланцюгу, послідовність якої представлена у SEQ ID NO: 111; або (о) варіабельну область важкого ланцюгу, послідовність якої представлена у SEQ ID NO: 98, та варіабельну область легкого ланцюгу, послідовність якої представлена у SEQ ID NO: 112. Одним з варіантів здійснення винаходу є антитіло, яке містить: (a) послідовність варіабельної області важкого ланцюгу, представлену у SEQ ID NO: 146, та послідовність варіабельної області легкого ланцюгу, представлену у SEQ ID NO: 141; (б) послідовність варіабельної області важкого ланцюгу, представлену у SEQ ID NO: 147, та послідовність варіабельної області легкого ланцюгу, представлену у SEQ ID NO: 142; (в) послідовність варіабельної області важкого ланцюгу, представлену у SEQ ID NO: 148, та послідовність варіабельної області легкого ланцюгу, представлену у SEQ ID NO: 143; (г) послідовність варіабельної області важкого ланцюгу, представлену у SEQ ID NO: 149, та послідовність варіабельної області легкого ланцюгу, представлену у SEQ ID NO: 144; (д) послідовність варіабельної області важкого ланцюгу, представлену у SEQ ID NO: 150, та послідовність варіабельної області легкого ланцюгу, представлену у SEQ ID NO: 145; (е) послідовність варіабельної області важкого ланцюгу, представлену у SEQ ID NO: 156, та послідовність варіабельної області легкого ланцюгу, представлену у SEQ ID NO: 151; (ж) послідовність варіабельної області важкого ланцюгу, представлену у SEQ ID NO: 157, та послідовність варіабельної області легкого ланцюгу, представлену у SEQ ID NO: 152; (з) послідовність варіабельної області важкого ланцюгу, представлену у SEQ ID NO: 158, та послідовність варіабельної області легкого ланцюгу, представлену у SEQ ID NO: 153; (і) послідовність варіабельної області важкого ланцюгу, представлену у SEQ ID NO: 159, та послідовність варіабельної області легкого ланцюгу, представлену у SEQ ID NO: 154; або (к) послідовність варіабельної області важкого ланцюгу, представлену у SEQ ID NO: 160, та послідовність варіабельної області легкого ланцюгу, представлену у SEQ ID NO: 155. Згідно із даним описом людське антитіло містить варіабельні області важкого або легкого ланцюгу або повнорозмірні важкі або легкі ланцюги, які "є продуктом" або "виведені з" послідовності конкретної зародкової лінії, якщо варіабельні області або повнорозмірні ланцюги антитіла одержують із системи, основаної на застосуванні генів імуноглобуліну людської зародкової лінії. Для створення таких систем здійснюють імунізацію трансгенної миші, що несе людські гени імуноглобулінів, з використанням антигену, що представляє інтерес, або здійснюють скринінг фагової дисплейної бібліотеки людських генів імуноглобулінів з використанням антигену, що представляє інтерес. Людське антитіло, яке "є продуктом" або "виведене з" послідовності імуноглобуліну людської зародкової лінії, можна ідентифікувати індивідуально шляхом порівняння амінокислотної послідовності людського антитіла та амінокислотних послідовностей імуноглобулінів людської зародкової лінії та добору 12 UA 102437 C2 5 10 15 20 25 30 35 40 45 50 55 60 послідовності імуноглобуліну людської зародкової лінії, яка є найбільш близькою по послідовності (тобто має найвищий % ідентичності) з послідовністю людського антитіла. Людське антитіло, яке "є продуктом" або "виведене з" конкретної послідовності імуноглобуліну людської зародкової лінії, може мати відмінності в амінокислотах у порівнянні з послідовністю зародкової лінії, наприклад, у результаті соматичних мутацій, що зустрічаються в природних умовах, або навмисної інтродукції сайтнаправленої мутації. Однак амінокислотна послідовність вибраного людського антитіла, як правило, щонайменше на 90 % ідентична амінокислотній послідовності, що кодується геном людського імуноглобуліну зародкової лінії, та містить амінокислотні залишки, які свідчать про те, що людське антитіло є людським, при порівнянні з амінокислотними послідовностями імуноглобулінів зародкових ліній інших видів (наприклад, послідовності мишачої зародкової лінії). У певних випадках амінокислотна послідовність людського антитіла може бути щонайменше на 80 %, 90 % або навіть щонайменше на 95 %, або навіть щонайменше на 96 %, 97 %, 98 % або 99 % ідентична амінокислотній послідовності, що кодується геном імуноглобуліну зародкової лінії. Як правило, людське антитіло, виведене з конкретної послідовності людської зародкової лінії, повинне мати не більше 10 амінокислотних відмінностей у порівнянні з амінокислотною послідовністю, що кодується геном імуноглобуліну людської зародкової лінії. У певних випадках людське антитіло може мати не більше 5 або навіть не більше 4, 3, 2 або 1 амінокислотної відмінності в порівнянні з амінокислотною послідовністю, що кодується геном імуноглобуліну зародкової лінії. В одному з варіантів здійснення винаходу антитіло, запропоноване у винаході, являє собою антитіло, що кодується pBW522 або pBW524 (депоноване в DSMZ, Inhoffenstr. 7B, D-38124 Брауншвейг, Німеччина 18 серпня 2009 р. під реєстраційними номерами DSM22873 та DSM22874 відповідно). Гомологічні антитіла Згідно з ще одним варіантом здійснення винаходу антитіло, запропоноване у винаході, має амінокислотні послідовності повнорозмірних важких та легких ланцюгів; нуклеотидні послідовності повнорозмірних важких та легких ланцюгів; нуклеотидні послідовності варіабельних областей важких та легких ланцюгів або амінокислотні послідовності варіабельних областей важких та легких ланцюгів, які гомологічні амінокислотним та нуклеотидним послідовностям представлених у даному описі антитіл, та при цьому антитіла зберігають необхідні функціональні властивості антитіл анти-ActRIIB, запропонованих у винаході. Наприклад, у винаході запропоноване виділене рекомбінантне антитіло анти-ActRIIB (або функціональний білок, що містить його антигензв'язуючу ділянку), яке містить варіабельну область важкого ланцюгу та варіабельну область легкого ланцюгу, де: варіабельна область важкого ланцюгу містить амінокислотну послідовність, яка щонайменше на 80 % або щонайменше на 90 % (переважно щонайменше на 95, 97 або 99 %) ідентична амінокислотній послідовності, вибраній з групи, що включає SEQ ID NO: 99-112; варіабельна область легкого ланцюгу містить амінокислотну послідовність, яка щонайменше на 80 % або щонайменше на 90 % (переважно щонайменше на 95, 97 або 99 %) ідентична амінокислотній послідовності, вибраній з групи, що включає SEQ ID NO: 85-98, та антитіло має щонайменше одним з наступних функціональних властивостей: (I) воно інгібує зв'язування міостатину in vitro або in vivo та/або (II) знижує інгібування м'язового диференціювання за допомогою Smad-залежного шляху. В іншому прикладі у винаході запропоноване виділене рекомбінантне антитіло анти-ActRIIB (або функціональний білок, що містить його антигензв'язуючу ділянку), яке містить повнорозмірний важкий ланцюг та повнорозмірний легкий ланцюг, де: повнорозмірний важкий ланцюг містить амінокислотну послідовність, яка щонайменше на 80 % або щонайменше на 90 % (переважно щонайменше на 95, 97 або 99 %) ідентична амінокислотній послідовності, вибраній з групи, що включає SEQ ID NO: 146-150 та 156-160; повнорозмірний легкий ланцюг містить амінокислотну послідовність, яка щонайменше на 80 % або щонайменше на 90 % (переважно щонайменше на 95, 97 або 99 %) ідентична амінокислотній послідовності, вибраній з групи, що включає SEQ ID NO: 141-145 та 151-155; та антитіло має щонайменше одну з наступних функціональних властивостей: (I) воно інгібує зв'язування міостатину in vitro або in vivo та/або (II) знижує інгібування м'язового диференціювання за допомогою Smad-залежного шляху. Переважно зазначене антитіло зв'язується з лігандзв'язуючим доменом ActRIIB. В іншому прикладі у винаході запропоноване виділене рекомбінантне антитіло анти-ActRIIB (або функціональний білок, що містить його антигензв'язуючу ділянку), яке містить повнорозмірний важкий ланцюг та повнорозмірний легкий ланцюг, де: повнорозмірний важкий ланцюг кодується нуклеотидною послідовністю, яка щонайменше на 80 % або щонайменше на 13 UA 102437 C2 5 10 15 20 25 30 35 40 45 50 55 60 90 % (переважно щонайменше на 95, 97 або 99 %) ідентична нуклеотидній послідовності, вибраній з групи, що включає SEQ ID NO: 166-170 та 176-180; повнорозмірний легкий ланцюг кодується нуклеотидною послідовністю, яка щонайменше на 80 % або щонайменше на 90 % (переважно щонайменше на 95, 97 або 99 %) ідентична нуклеотидній послідовності, вибраній з групи, що включає SEQ ID NO: 161-165 та 171-175; та антитіло має щонайменше одну з наступних функціональних властивостей: (I) воно інгібує зв'язування міостатину in vitro або in vivo та/або (II) знижує інгібування м'язового диференціювання за допомогою Smad-залежного шляху. Переважно зазначене антитіло зв'язується з лігандзв'язуючим доменом ActRIIB. У різних варіантах здійснення винаходу антитіло може мати одну або декілька, дві або більше або три з описаних вище функціональних властивостей. Антитіло може являти собою, наприклад, людське антитіло, гуманізоване антитіло або химерне антитіло. Переважно антитіло являє собою повністю людське антитіло IgG1-ізотипу. У інших варіантах здійснення винаходу амінокислотні послідовності V H та/або VL можуть бути на 80 %, 90 %, 95 %, 96 %, 97 %, 98 % або 99 % ідентичні зазначеним вище послідовностям. У інших варіантах здійснення винаходу амінокислотні послідовності V H та/або VL можуть бути ідентичні за виключенням амінокислотної заміни, що защіпає не більше 1, 2, 3, 4 або 5 амінокислотних положень. Антитіло, у якого V H- та VL-області мають високий рівень (тобто 80 % або вище) ідентичності з VH- та VL-областями, представленими в SEQ ID NO: 99-112 та SEQ ID NO: 85-98 відповідно, можна отримувати шляхом мутагенезу (наприклад, сайтнаправленого або опосередкованого ПЛР мутагенезу) молекул нуклеїнових кислот, представлених у SEQ ID NO: 127-140 та 113-126 відповідно, з наступним тестуванням кодуємого зміненого антитіла у відношенні збереження функції (тобто перерахованих вище функцій) за допомогою приведених в даному описі функціональних аналізів. У інших варіантах здійснення винаходу амінокислотні послідовності повнорозмірного важкого ланцюгу та/або повнорозмірного легкого ланцюгу можуть бути на 80 %, 90 %, 95 %, 96 %, 97 %, 98 % або 99 % ідентичні зазначеним вище послідовностям. Антитіло, у якого повнорозмірний важкий ланцюг та повнорозмірний легкий ланцюг мають високий рівень (тобто 80 % або вище) гомології з повнорозмірними важкими ланцюгами, представленими в будь-якій з SEQ ID NO: 146-150 та 156-160, та з повнорозмірними легкими ланцюгами, представленими у будь-якій з SEQ ID NO: 141-145 та 151-155 відповідно, можна отримувати шляхом мутагенезу (наприклад, сайтнаправленого або опосередкованого ПЛР мутагенезу) молекул нуклеїнових кислот, представлених у SEQ ID NO: 166-170 та 176-180 та SEQ ID NO: 161-165 та 171-175 відповідно, з наступним тестуванням кодуємого зміненого антитіла у відношенні збереження функції (тобто перерахованих вище функцій) за допомогою приведених в даному описі функціональних аналізів. У інших варіантах здійснення винаходу нуклеотидні послідовності повнорозмірного важкого ланцюгу та/або повнорозмірного легкого ланцюгу можуть бути ідентичні на 80 %, 90 %, 95 %, 96 %, 97 %, 98 % або 99 % представленим вище послідовностям. У інших варіантах здійснення винаходу нуклеотидні послідовності варіабельних областей важкого ланцюгу та/або легкого ланцюгу можуть бути ідентичні на 80 %, 90 %, 95 %, 96 %, 97 %, 98 % або 99 % представленим вище послідовностям. Згідно з даним описом відсоток ідентичності двох послідовностей є функцією кількості ідентичних положень в послідовностях (тобто % ідентичності = кількість ідентичних положень/загальна кількість положень × 100), приймаючи до уваги кількість проломів та довжину кожному пролому, який необхідно інтродукувати для оптимального вирівнювання двох послідовностей. Порівняння послідовностей та визначення відсотку ідентичності двох послідовностей можна здійснювати за допомогою описаного нижче математичного алгоритму. Відсоток ідентичності двох амінокислотних послідовностей можна визначати за допомогою алгоритму, розробленого E. Meyers та W. Miller (Comput. Appl. Biosci., 4, 1988, стор. 11-17), який включений у програму ALIGN (версія 2.0), з використанням таблиці зважених залишків PAM120, штрафу за довжину пролому 12 та штрафу за пролом 4. Крім того, відсоток ідентичності двох амінокислотних послідовностей можна визначати за допомогою алгоритму Needleman та Wunsch (J. Mol, Biol. 48, 1970, стор. 444-453), який включений у програму GAP, що входить у пакет програм GCG (яка доступна на сайті http://www.gcg.com), з використанням матриці Blossom 62 або матриці PAM250 та ваги пролому 16, 14, 12, 10, 8, 6 або 4 та ваги довжини 1, 2, 3, 4, 5 або 6. Антитіла з консервативними модифікаціями У конкретних варіантах здійснення винаходу антитіло, запропоноване у винаході, має варіабельну область важкого ланцюгу, яка містить послідовності CDR1, CDR2 та CDR3, та варіабельну область легкого ланцюгу, яка містить послідовності CDR1, CDR2 та CDR3, де одна 14 UA 102437 C2 5 10 15 20 25 30 35 40 45 50 55 60 або декілька зазначених послідовностей CDR являє собою специфічні амінокислотні послідовності, характерні для антитіл, запропонованих у даному винаході, або їх консервативні модифікації, та де антитіла зберігають необхідні функціональні властивості антитіл антиActRIIB, запропонованих у винаході. Таким чином, у винаході запропоноване виділене рекомбінантне антитіло анти-ActRIIB або функціональний білок, що містить його антигензв'язуючу ділянку, які містять варіабельну область важкого ланцюгу, яка містить послідовності CDR1, CDR2 та CDR3, та варіабельну область легкого ланцюгу, яка містить послідовності CDR1, CDR2 та CDR3, де: послідовності CDR1 варіабельної області важкого ланцюгу містять амінокислотні послідовності, вибрані із групи, яка включає амінокислотні послідовності, представлені у SEQ ID NO: 1-14, та їх консервативні модифікації; послідовності CDR2 варіабельної області важкого ланцюгу містять амінокислотні послідовності, вибрані із групи, яка включає амінокислотні послідовності, представлені у SEQ ID NO: 15-28, та їх консервативні модифікації; послідовності CDR3 варіабельної області важкого ланцюгу містять амінокислотні послідовності, вибрані із групи, яка включає амінокислотні послідовності, представлені у SEQ ID NO: 29-42, та їх консервативні модифікації; послідовності CDR1 варіабельної області легкого ланцюгу містять амінокислотні послідовності, вибрані із групи, яка включає амінокислотні послідовності, представлені у SEQ ID NO: 43-56, та їх консервативні модифікації; послідовності CDR2 варіабельної області легкого ланцюгу містять амінокислотні послідовності, вибрані із групи, яка включає амінокислотні послідовності, представлені у SEQ ID NO: 57-70, та їх консервативні модифікації; послідовності CDR3 варіабельної області легкого ланцюгу містять амінокислотні послідовності, вибрані із групи, яка включає амінокислотні послідовності, представлені у SEQ ID NO: 71-84, та їх консервативні модифікації. Переважно антитіло має щонайменше одну з наступних функціональних властивостей: (I) воно інгібує зв'язування міостатину in vitro або in vivo та/або (II) знижує інгібування м'язового диференціювання за допомогою Smad-залежного шляху. В різних варіантах здійснення винаходу антитіло може мати одну або обидві описані вище функціональні властивості. Зазначені антитіла можуть являти собою, наприклад, людські антитіла, гуманізовані антитіла або химерні антитіла. В інших варіантах здійснення винаходу антитіло, запропоноване у винаході, оптимізоване з метою експресії в клітині ссавця, має повнорозмірну послідовність важкого ланцюгу та повнорозмірну послідовність легкого ланцюгу, при цьому одна або декілька із цих послідовностей має амінокислотні послідовності, специфічні для антитіл, представлених у даному описі, або їх консервативні модифікації, та при цьому антитіла зберігають необхідні функціональні властивості антитіл анти-ActRIIB, запропонованих у винаході. Таким чином, винахід відноситься до виділеного моноклонального антитіла анти-ActRIIB, оптимізованого з метою експресії в клітині ссавця, який має повнорозмірну послідовність важкого ланцюгу та повнорозмірну послідовність легкого ланцюгу, де: повнорозмірний важкий ланцюг має амінокислотні послідовності, вибрані із групи, яка включає амінокислотні послідовності, представлені у SEQ ID NO: 146-150 та 156-160, та їх консервативні модифікації; а повнорозмірний легкий ланцюг має амінокислотні послідовності, вибрані із групи, яка включає амінокислотні послідовності, представлені у SEQ ID NO: 141-145 та 151-155, та їх консервативні модифікації; та антитіло має щонайменше одну з наступних функціональних властивостей: (I) воно інгібує зв'язування міостатину in vitro або in vivo та/або (II) знижує інгібування м'язового диференціювання за допомогою Smad-залежного шляху. В різних варіантах здійснення винаходу антитіло може мати одну або обидві описані вище функціональні властивості. Зазначені антитіла можуть являти собою, наприклад, людські антитіла, гуманізовані антитіла або химерні антитіла. У контексті даного опису поняття "консервативні модифікації послідовностей" відноситься до амінокислотних модифікацій, які не виявляють істотного впливу або не суттєво змінюють характеристики зв'язування антитіла, яке містить зазначену амінокислотну послідовність. Зазначені консервативні модифікації включають амінокислотні заміни, додавання та делеції. Модифікації можна інтродукувати в антитіло, запропоноване у винаході, за допомогою стандартних методів, відомих у даній галузі, таких як сайтнаправлений мутагенез та ПЛРопосередковуваний мутагенез. Консервативні амінокислотні заміни являють собою заміни, при яких амінокислотний залишок заміщають амінокислотним залишком, який має східний бічний ланцюг. Сімейства амінокислотних залишків із східними бічними ланцюгами відомі в даній галузі. Ці сімейства включають амінокислотні залишки з оснόвними бічними ланцюгами (наприклад, лізин, аргінін, гістидин), кислотними бічними ланцюгами (наприклад, аспарагінова кислота, глутамінова кислота), незарядженими полярними бічними ланцюгами (наприклад, гліцин, аспарагін, 15 UA 102437 C2 5 10 15 20 25 30 35 40 45 50 55 60 глутамін, серін, треонін, тирозин, цистеїн, триптофан), неполярними бічними ланцюгами (наприклад, аланін, валін, лейцин, ізолейцин, пролін, фенілаланін, метіонін), бетарозгалуженими бічними ланцюгами (наприклад, треонін, валін, ізолейцин) та ароматичними бічними ланцюгами (наприклад, тирозин, фенілаланін, триптофан, гістидин). Таким чином, один або декілька амінокислотних залишків у CDR-ділянках антитіла, запропонованого у винаході, можна заміняти на інші амінокислотні залишки з одного і того ж сімейства бічних ланцюгів, та змінене антитіло можна оцінювати у відношенні збереження їм функції за допомогою представлених в даному описі функціональних аналізів. Антитіла, які зв'язуються з тим же епітопом, що і антитіла анти-ActRIIB, запропоновані у винаході Іншим варіантом здійснення винаходу є антитіла, які зв'язуються з тим же епітопом, що і різні специфічні антитіла анти-ActRIIB, запропоновані у винаході. Всі антитіла, описані в прикладах, які мають здатність блокувати зв'язування міостатину з ActRIIB, зв'язуються з високою афінністю з одним і тим же епітопом в ActRIIB, зазначений епітоп розташований між амінокислотами 19-134 SEQ ID NO: 181. Таким чином, додаткові антитіла можна ідентифікувати за їх здатністю до перехресної конкуренції (наприклад, до статистично значимого конкурентного інгібування зв'язування) з іншими антитілами, запропонованими у винаході, при використанні стандартних аналізів зв'язування ActRIIB. Здатність тестуємого антитіла інгібувати зв'язування антитіл, запропонованих в даному винаході, з людським ActRIIB свідчить про те, що тестуєме антитіло може конкурувати з антитілом за зв'язування з людським ActRIIB; згідно з однією з можливих теорій таке антитіло може зв'язуватися з тим же або спорідненим (наприклад, із структурно подібним або що знаходиться в просторовій близькості) епітопом на людському ActRIIB, що і антитіло, з яким воно конкурує. В конкретному варіанті здійснення винаходу антитіло, яке зв'язується з тим же епітопом на людському ActRIIB, що і антитіла, запропоновані в даному винаході, являє собою людське рекомбінантне антитіло. Зазначені людські рекомбінантні антитіла можна отримувати та виділяти згідно з описаними у прикладах методами. Таким чином, у винаході запропоноване антитіло, яке зв'язується з епітопом, що розпізнається антитілом, яке має послідовність варіабельної області важкого ланцюгу, представлену у SEQ ID NO: 85, та послідовність варіабельної області легкого ланцюгу, представлену у SEQ ID NO: 99. Таким чином, у винаході запропоноване антитіло, яке зв'язується з епітопом, що розпізнається антитілом, яке має послідовність варіабельної області важкого ланцюгу, представлену у SEQ ID NO: 86, та послідовність варіабельної області легкого ланцюгу, представлену у SEQ ID NO: 100. Таким чином, у винаході запропоноване антитіло, яке зв'язується з епітопом, що розпізнається антитілом, яке має послідовність варіабельної області важкого ланцюгу, представлену у SEQ ID NO: 87, та послідовність варіабельної області легкого ланцюгу, представлену у SEQ ID NO: 101. Таким чином, у винаході запропоноване антитіло, яке зв'язується з епітопом, що розпізнається антитілом, яке має послідовність варіабельної області важкого ланцюгу, представлену у SEQ ID NO: 88, та послідовність варіабельної області легкого ланцюгу, представлену у SEQ ID NO: 102. Таким чином, у винаході запропоноване антитіло, яке зв'язується з епітопом, що розпізнається антитілом, яке має послідовність варіабельної області важкого ланцюгу, представлену у SEQ ID NO: 89, та послідовність варіабельної області легкого ланцюгу, представлену у SEQ ID NO: 103. Таким чином, у винаході запропоноване антитіло, яке зв'язується з епітопом, що розпізнається антитілом, яке має послідовність варіабельної області важкого ланцюгу, представлену у SEQ ID NO: 90, та послідовність варіабельної області легкого ланцюгу, представлену у SEQ ID NO: 104. Таким чином, у винаході запропоноване антитіло, яке зв'язується з епітопом, що розпізнається антитілом, яке має послідовність варіабельної області важкого ланцюгу, представлену у SEQ ID NO: 91, та послідовність варіабельної області легкого ланцюгу, представлену у SEQ ID NO: 105. Таким чином, у винаході запропоноване антитіло, яке зв'язується з епітопом, що розпізнається антитілом, яке має послідовність варіабельної області важкого ланцюгу, представлену у SEQ ID NO: 92, та послідовність варіабельної області легкого ланцюгу, представлену у SEQ ID NO: 106. Таким чином, у винаході запропоноване антитіло, яке зв'язується з епітопом, що 16 UA 102437 C2 5 10 15 20 25 30 35 40 45 50 55 60 розпізнається антитілом, яке має послідовність варіабельної області важкого ланцюгу, представлену у SEQ ID NO: 93, та послідовність варіабельної області легкого ланцюгу, представлену у SEQ ID NO: 107. Таким чином, у винаході запропоноване антитіло, яке зв'язується з епітопом, що розпізнається антитілом, яке має послідовність варіабельної області важкого ланцюгу, представлену у SEQ ID NO: 94, та послідовність варіабельної області легкого ланцюгу, представлену у SEQ ID NO: 108. Таким чином, у винаході запропоноване антитіло, яке зв'язується з епітопом, що розпізнається антитілом, яке має послідовність варіабельної області важкого ланцюгу, представлену у SEQ ID NO: 95, та послідовність варіабельної області легкого ланцюгу, представлену у SEQ ID NO: 109. Таким чином, у винаході запропоноване антитіло, яке зв'язується з епітопом, що розпізнається антитілом, яке має послідовність варіабельної області важкого ланцюгу, представлену у SEQ ID NO: 96, та послідовність варіабельної області легкого ланцюгу, представлену у SEQ ID NO: 110. Таким чином, у винаході запропоноване антитіло, яке зв'язується з епітопом, що розпізнається антитілом, яке має послідовність варіабельної області важкого ланцюгу, представлену у SEQ ID NO: 97, та послідовність варіабельної області легкого ланцюгу, представлену у SEQ ID NO: 111. Таким чином, у винаході запропоноване антитіло, яке зв'язується з епітопом, що розпізнається антитілом, яке має послідовність варіабельної області важкого ланцюгу, представлену у SEQ ID NO: 98, та послідовність варіабельної області легкого ланцюгу, представлену у SEQ ID NO: 112. За допомогою експериментів по більш детальному картуванню епітопів зв'язуючі області кращих антитіл, запропонованих у винаході, визначені більш точно. Таким чином, у винаході запропоноване антитіло, яке зв'язується з епітопом, що містить амінокислоти 78-83 SEQ ID NO: 181 (WLDDFN – SEQ ID NO:188). У винаході запропоноване також антитіло, яке зв'язується з епітопом, що містить амінокислоти 76-84 SEQ ID NO: 181 (GCWLDDFNC – SEQ ID NO:186). У винаході запропоноване також антитіло, яке зв'язується з епітопом, що містить амінокислоти 75-85 SEQ ID NO: 181 (KGCWLDDFNCY – SEQ ID NO:190). У винаході запропоноване також антитіло, яке зв'язується з епітопом, що містить амінокислоти 52-56 SEQ ID NO: 181 (EQDKR – SEQ ID NO:189). У винаході запропоноване також антитіло, яке зв'язується з епітопом, що містить амінокислоти 49-63 SEQ ID NO: 181 (CEGEQDKRLHCYASW – SEQ ID NO:187). У винаході запропоновані також антитіла, які зв'язуються з епітопами, що складаються з цих послідовностей, або епітопами, що складаються з комбінацій цих областей епітопів. Таким чином, у винаході запропоноване також антитіло, яке зв'язується з епітопом, що містить або що складається з амінокислот 78-83 SEQ ID NO: 181 (WLDDFN) та амінокислот 5256 SEQ ID NO: 181 (EQDKR). Сконструйовані та модифіковані антитіла Антитіло, запропоноване у винаході, можна отримувати також з використанням антитіла, яке має одну або декілька зазначених в даному описі послідовностей V H та/або VL, як вихідний матеріал для створення модифікованого антитіла, де модифіковане антитіло може мати змінені властивості у порівнянні з вихідним антитілом. Антитіло можна створювати шляхом модифікації одного або декількох залишків в одній або обох варіабельних областях (тобто V H та/або VL), наприклад, в одній або декількох CDR-ділянках та/або в одній або декількох каркасних ділянках. В додатковому або альтернативному варіанті антитіло можна створювати шляхом модифікації залишків в константній(их) області(ях), наприклад, для зміни ефекторної(их) функції(ій) антитіла. Для здійснення одного з типів конструювання варіабельної області можна застосовувати трансплатацію CDR. Антитіла взаємодіють із антигенами-мішенями в основному за допомогою амінокислотних залишків, локалізованих у шести гіперваріабельних ділянках (CDR) важкого та легкого ланцюгу. Із цієї причини між амінокислотними залишками в CDR індивідуальних антитіл існують більш значні відмінності, ніж в послідовностях поза CDR. Оскільки послідовності CDR відповідальні за більшу частину взаємодій антитіло-антиген, можна експресувати рекомбінантні антитіла, які імітують властивості конкретних антитіл, що зустрічаються в природних умовах, шляхом конструювання експресійних векторів, які містять послідовності CDR з конкретного антитіла, що зустрічається в природних умовах, отримані шляхом трансплантації в послідовності каркасних ділянок з інших антитіл з іншими властивостями (див., наприклад, 17 UA 102437 C2 5 10 15 20 25 30 35 40 45 50 55 60 Riechmann L. та ін., Nature 332, 1998, стор. 323-327; Jones P. та ін., Nature, 321, 1986, стор. 522525; Queen C. та ін., Proc. Natl. Acad. See. U.S.A. 86, 1989, стор. 10029-10033; US 5225539 на ім'я Winter та US 5530101; 5585089; 5693762 та 6180370 на ім'я Queen зі співавторами). Таким чином, наступним об'єктом винаходу є виділене моноклональне антитіло анти-ActRIIB або функціональний білок, що містить його антигензв'язуючу ділянку, що має послідовності CDR1 варіабельної області важкого ланцюгу, які містять амінокислотні послідовності, вибрані з групи, що включає SEQ ID NO: 1-14; послідовності CDR2, які містять амінокислотні послідовності, вибрані з групи, що включає SEQ ID NO: 15-28; послідовності CDR3, які містять амінокислотні послідовності, вибрані з групи, що включає SEQ ID NO: 29-42 відповідно; та послідовності CDR1 варіабельної області легкого ланцюгу, які містять амінокислотні послідовності, вибрані з групи, що включає SEQ ID NO: 43-56; послідовності CDR2, які містять амінокислотні послідовності, вибрані з групи, що включає SEQ ID NO: 57-70; та послідовності CDR3, які містять амінокислотні послідовності, вибрані з групи, що включає SEQ ID NO: 71-84 відповідно. Таким чином, зазначені антитіла містять послідовності CDR V H та VL моноклональних антитіл, крім того, вони можуть містити різні послідовності каркасних ділянок цих антитіл. Зазначені послідовності каркасних ділянок можна одержувати з публічних баз даних ДНК або опублікованих посилань, які містять послідовності генів зародкової лінії антитіл. Наприклад, послідовності ДНК генів зародкової лінії варіабельних областей людських важких та легких ланцюгів можна знайти в базі даних послідовностей людської зародкової лінії "Vbase" (доступній в Інтернеті на сайті www.mrc-cpe.cam.ac.uk/vbase), а також у Kabat E. A. та ін., вище; Tomlinson I. M. та ін., J. fol. Biol. 227, 1992, стор. 776-798; та Cox J. P. L. та ін., Eur. J Immunol. 24, 1994, стор. 827-836. Прикладом послідовностей каркасних ділянок, призначених для застосування в антитілах, запропонованих у винаході, є послідовності, структурно подібні послідовностям каркасних ділянок, які входять у відібрані антитіла, запропоновані у винаході, наприклад, консенсусні послідовності та/або послідовності каркасних ділянок, які входять у моноклональні антитіла, запропоновані у винаході. Послідовності CDR1, 2 та 3 VH та послідовності CDR1, 2 та 3 VL можна трансплантувати у каркасні ділянки, які мають послідовність, ідентичну з послідовністю гену імуноглобуліну зародкової лінії, з якого виведена послідовність каркасної ділянки, або послідовності CDR можна трансплантувати у каркасні ділянки, які містять одну або декілька мутацій у порівнянні з послідовностями зародкової лінії. Наприклад, було встановлено, що в певних випадках доцільно змінювати за допомогою мутації залишки в каркасних ділянках для підтримки або підвищення здатності антитіла зв'язуватися з антигеном (див., наприклад, US 5530101; 5585089; 5693762 та 6180370 на ім'я Queen зі співавторами). Другим типом модифікації варіабельної області є мутація амінокислотних залишків в CDR1, CDR2 та/або CDR3 VH- та/або VL-областей, яка підвищує тим самим одну або декілька здатностей до зв'язування (наприклад, афінність) антитіла, що представляє інтерес, що називають "дозріванням афінності". Для інтродукції мутації(й) та впливу на зв'язування антитіла або на іншу функціональну властивість, що представляє інтерес, можна застосовувати сайтнаправлений мутагенез або ПЛР-опосередковуваний мутагенез, що можна оцінювати за допомогою аналізів in vitro або in vivo, представлених у даному описі та описаних нижче в прикладах. Можна інтродукувати консервативні модифікації (зазначені вище). Мутації можуть являти собою амінокислотні заміни, додавання або делеції. Крім того, як правило, змінюють не більше 1, 2, 3, 4 або 5 залишків в CDR-ділянці. Таким чином, іншим варіантом здійснення винаходу є виділені моноклональні антитіла антиActRIIB або функціональний білок, що містить їх антигензв'язуючі ділянки, які включають варіабельну область важкого ланцюгу, що містить: CDR1-ділянку VH-області, яка має амінокислотну послідовність, вибрану з групи, що включає SEQ ID NO: 1-14, або амінокислотну послідовність з 1, 2, 3, 4 або 5 амінокислотними замінами, делеціями або додаваннями у порівнянні з SEQ ID NO: 1-14; CDR2-ділянку VH-області, яка має амінокислотну послідовність, вибрану з групи, що включає SEQ ID NO: 15-28, або амінокислотну послідовність з 1, 2, 3, 4 або 5 амінокислотними замінами, делеціями або додаваннями у порівнянні з SEQ ID NO: 15-28; CDR3-ділянку VH-області, яка має амінокислотну послідовність, вибрану з групи, що включає SEQ ID NO: 29-42, або амінокислотну послідовність з 1, 2, 3, 4 або 5 амінокислотними замінами, делеціями або додаваннями у порівнянні з SEQ ID NO: 29-42; CDR1-ділянку VL-області, яка має амінокислотну послідовність, вибрану з групи, що включає SEQ ID NO: 43-56, або амінокислотну послідовність з 1, 2, 3, 4 або 5 амінокислотними замінами, делеціями або додаваннями у порівнянні з SEQ ID NO: 43-56; CDR2-ділянку VL-області, яка має амінокислотну послідовність, вибрану з групи, що включає SEQ ID NO: 52-70, або амінокислотну послідовність з 1, 2, 3, 4 або 18 UA 102437 C2 5 10 15 20 25 30 35 40 45 50 55 60 5 амінокислотними замінами, делеціями або додаваннями у порівнянні з SEQ ID NO: 52-70; та CDR3-ділянку VL-області, яка має амінокислотну послідовність, вибрану з групи, що включає SEQ ID NO: 71-84, або амінокислотну послідовність з 1, 2, 3, 4 або 5 амінокислотними замінами, делеціями або додаваннями у порівнянні з SEQ ID NO: 71-84. Трансплантація антигензв'язуючих доменів в альтернативні каркасні ділянки або остови Можна застосовувати широку різноманітність остовів або каркасів антитіла/імуноглобуліну за умови, що поліпептид, що утворюється, включає щонайменше одну зв'язуючу ділянку, яка специфічно зв'язується з ActRIIB. Такі остови або каркаси включають п'ять основних ідіотипів людських імуноглобулінів або їх фрагментів (наприклад, які представлені в даному описі), та включають імуноглобуліни інших видів тварин, які переважно мають гуманізовані компоненти. У цьому плані особливо цікавими є антитіла, що складаються тільки з важких ланцюгів, які ідентифіковані у представників верблюжих. Фахівці в даній галузі продовжують виявляти та створювати нові остови, каркаси та фрагменти. Одним з об'єктів винаходу є створення антитіл, що не відносяться до імуноглобулінів, з використанням неімуноглобулінових каркасів, у які можна трансплантувати CDR, запропоновані у винаході. Можна застосовувати відомі неімуноглобулінові остови або каркаси або ті, які будуть створені в майбутньому, за умови, що вони містять зв'язуючу ділянку, специфічну для білку білку-мішені, послідовність якого представлена у SEQ ID NO: 181 (переважно для його лігандзв'язуючого домену, послідовність якого представлена у SEQ ID NO: 182). Такі сполуки позначені в контексті даного опису як "поліпептиди, що містять специфічну для мішені зв'язуючу ділянку". Приклади неімуноглобулінових каркасів додатково описані нижче у відповідних розділах (верблюжі антитіла та каркаси, відмінні від характерних для антитіл каркасів). Верблюжі антитіла Білки антитіл, отримані із представників сімейства двогорбих та одногорбих верблюдів (Camelus bactrianus та Calelus dromaderius), включаючи представників тварин Нового Світу, таких як різні види лам (Lama paccos, Lama glama та Lama vicugna), охарактеризовані у відношенні їх розміру, структурної комплексності та антигенності відносно людини. Встановлене, що деякі антитіла типу IgG із цього сімейства ссавців у природних умовах позбавлені легких ланцюгів та тому відрізняються за структурою від типової четвертинної структури, що складається із чотирьох ланцюгів, із двома важкими та двома легкими ланцюгами, характерної для антитіл з організму інших тварин (див. WO 94/04678). Ділянку верблюжого антитіла, що представляє собою невелику індивідуальну варіабельну область, позначену як VHH, можна створювати за допомогою генної інженерії з одержанням невеликого білку, що має високу афінність до мішені, що приводить до одержання низькомолекулярного виведеного з антитіла білку, який позначають як "верблюже нанотіло" (див. US 5759808; Stijlemans B. та ін., J Biol Chem 279, 2004, стор. 1256-1261; Dumoulin M. та ін., Nature 424, 2003, стор. 783-788; Pleschberger M. та ін., Bioconjugate Chem 14, 2003, стор. 440448; Cortez-Retamozo V. та ін., Int J Cancer 89, 2002, стор. 456-462; та Lauwereys M. та ін., EMBO J 17, 1998, стор. 3512-3520). Створені бібліотеки верблюжих антитіл та фрагментів антитіл доступні на комерційній основі, наприклад, від фірми Ablynx, Гент, Бельгія. Аналогічно іншим антитілам, отриманим з видів крім людини, амінокислотну послідовність верблюжого антитіла можна змінювати рекомбінантно з одержанням послідовності, що більшою мірою нагадує людську послідовність, тобто нанотіло можна "гуманізувати". Таким шляхом можна додатково знижувати природну низьку антигенність верблюжих антитіл для людей. Верблюже нанотіло має молекулярну масу, що становить приблизно 1/10 від молекулярної маси людського IgG, а фізичний діаметр білку становить лише кілька нанометрів. Однією з пов'язаних з малим розміром особливостей є здатність верблюжих нанотіл зв'язуватися з антигенними сайтами, які є функціонально непомітними для великих білкових антитіл, тобто верблюжі нанотіла можна застосовувати як реагенти, що виявляють антигени, які залишаються схованими при використанні класичних імунологічних методів, та можливо як терапевтичні агенти. Таким чином, іншою особливістю верблюжого нанотіла, пов'язаною з його малим розміром, є здатність інгібувати зв'язування зі специфічним сайтом у борозенці або вузькій ущелині білку-мішені, та тому їх можна застосовувати як субстанцію, що більш нагадує по своїй функції класичний низькомолекулярний лікарський засіб, ніж класичне антитіло. Невелика молекулярна маса та компактний розмір обумовлює також дуже високу термостабільність, стабільність при екстремальних значеннях рН та стабільність до протеолітичного розщеплення та низьку антигенність верблюжих нанотіл. Ще одним наслідком зазначених особливостей є те, що верблюжі нанотіла легко проникають із кровоносної системи в тканини та навіть проникають через гематоенцефалічний бар'єр та їх можна застосовувати для лікування захворювань, що уражають нервову тканину. Нанотитіла можуть полегшувати 19 UA 102437 C2 5 10 15 20 25 30 35 40 45 50 55 60 також транспорт лікарських засобів через гематоенцефалічний бар'єр (див. US 2004/0161738). Ці особливості в комбінації з низькою антигенністю у відношенні людей свідчать про їх великий терапевтичний потенціал. Крім того, ці молекули можна повністю експресувати у прокаріотичних клітинах, таких як E. сoli, та експресувати у вигляді злитих білків з бактеріофагом, та вони є функціонально активними. Таким чином, відмітною ознакою даного винаходу є верблюже антитіло або нанотіло, що має високу афінність анти-ActRIIB. У конкретних варіантах здійснення винаходу верблюже антитіло або нанотіло одержують у природних умовах у тварині із сімейства верблюжих, тобто воно продукується в організмі представника верблюжих після імунізації ActRIIB або його пептидним фрагментом при застосуванні методів, описаних для інших антитіл. В іншому варіанті верблюже нанотіло анти-ActRIIB конструюють, тобто одержують шляхом добору, наприклад, з фагових дисплейних бібліотек відповідним чином мутованих білком верблюжих нанотіл, за допомогою методу пеннінгу з використанням як мішень ActRIIB, як описано в наведених в даному описі прикладах. Сконструйовані нанотіла можна додатково вдосконалити за допомогою генної інженерії таким чином, щоб час їх напівжиття в реципієнтові становив від 45 хвил. до 2 тижнів. У конкретному варіанті здійснення винаходу верблюже антитіло або нанотіло одержують шляхом трансплантації послідовностей CDR важкого або легкого ланцюгу людських антитіл, запропонованих у винаході, у нанотіло або в послідовності каркасних ділянок, що має один домен антитіла згідно з методами, описаними, наприклад, у WO 94/04678. Нехарактерні для антитіл каркаси Відомі неімуноглобулінові остови або каркаси включають (але не обмежуючись тільки ними) аднектини (фібронектин) (фірма Compound Therapeutics, Inc., Уолтем, шт. Массачусетс), анкірин (фірма Molecular Partners AG, Цюрих, Швейцарія), домени антитіл (фірма Domantis, Ltd (Кембридж, шт. Массачусетс) та фірма Ablynx nv (Цвінаарде, Бельгія)), ліпокалін (антикалін) (фірма Pieris Proteolab AG, Фрейзинг, Німеччина), невеликі модульні імунологічні фармацевтичні агенти (фірма Trubion Pharmaceuticals Inc., Сіетл, шт. Вашингтон), макситіла (фірма Avidia, Inc. (Маунтін-Вью, шт. Каліфорнія), білок A (фірма Affibody AG, Швеція) та афілін (гама-кристалін або убіквітин) (фірма Scil Proteins GmbH, Галле, Німеччина), міметики білкових епітопів (фірма Polyphor Ltd, Аллшвіль, Швейцарія). (I) Фібронектинові каркаси Основою фібронектинових каркасів є переважно домен фібронектину типу III (наприклад, десятий модуль фібронектину типу III (домен 10 Fn3). Домен фібронектину типу III несе 7 або 8 бета-ланцюгів, які розподілені між двома бета-складками, які самі упаковані одна навпроти іншої з утворенням ядра білку, та додатково містять петлі (аналоги CDR), які з'єднують беталанцюги один з іншим та є доступними для розчинника. Відомо щонайменше три такі петлі на кожному краї бета-складчастого "сендвіча", при цьому край є границею білку, перпендикулярною до напрямку бета-ланцюгів (US 6818418). Ці каркаси, основою яких є фібронектин, не являють собою імуноглобулін, хоча загальне укладання дуже схоже на укладання найменшого фрагменту антитіла, що має функціональну активність, тобто варіабельної області важкого ланцюгу, який містить повний розпізнаючий антиген компонент у IgG представників верблюжих та лам. Завдяки зазначеній структурі антитіло, що не представляє собою імуноглобулін, імітує антигензв'язуючі властивості, які нагадують по природі та афінності властивості антитіл. Ці каркаси можна застосовувати для стратегії рандомізації петель та перестановки in vitro, що подібно процесу дозрівання афінності антитіл in vivo. Такі молекули, основою яких є фібронектин, можна застосовувати як каркаси, у яких області петель молекули можна заміняти на CDR, запропоновані у винаході, за допомогою стандартних методів клонування. (II) Анкірин – фірма Molecular Partners Технологія основана на застосуванні білків, що несуть виведені з анкірину модулі, що повторюються, як каркаси для варіабельних областей, які можна використовувати для зв'язування з різними мішенями. Повторюваний анкіриновий модуль являє собою поліпептид, що складається з 33 амінокислот, який містить дві антипаралельні α-спіралі та β-петлі. Зв'язування варіабельних областей максимально оптимізують на основі доступності для рибосом. (III) Макситіла/авімери – фірма Avidia Авімери отримують з білку, що зустрічається у природних умовах, який містить A-домен, такого як LRP-1. Ці домени використовуються у природніх умовах для взаємодій типу білокбілок, та у людини структурною основою більше ніж 250 білків є A-домени. Авімери складаються з декількох різних мономерів "A-домену" (2-10), зчеплених за допомогою амінокислотних лінкерів. Можна створювати авімери, які можуть зв'язуватися з антигеном-мішенню, з 20 UA 102437 C2 5 10 15 20 25 30 35 40 45 50 55 60 використанням методології, описаної, наприклад, у US 2004/0175756; US 2005/0053973; US 2005/0048512 та US 2006/0008844. (VI) Білок A – фірма Affibody Ліганди Affibody®, що мають афінність, являють собою невеликі прості білки, що складаються з триспірального пучку, основою якого є каркас одного з IgG-зв'язуючих доменів білку A. Білок A являє собою поверхневий білок бактерії Staphylococcus aureus. Цей каркасний домен складається з 58 амінокислот, 13 з яких довільно використовували для створення бібліотек Affibody® з великою кількістю варіантів ліганду (див., наприклад, US 5831012). Молекули Affibody® нагадують антитіла, їх молекулярна маса становить 6 кДа, для порівняння молекулярна маса антитіл становить 150 кДа. Незважаючи на невеликий розмір, сайт зв'язування молекул Affibody® подібний сайту зв'язування антитіла. (V) Антикаліни (Anticalins®) – фірма Pieris Антикаліни (Anticalins®) являють собою продукти, розроблені компанією Pieris ProteoLab AG. Їх отримують з ліпокалінів, широко розповсюдженої групи невеликих та ефективних білків, які, як правило, приймають участь у фізіологічному транспорті або зберіганні чутливих до хімічних агентів або нерозчинних сполук. Декілька ліпокалінів, що зустрічаються у природніх умовах, виявлено в тканинах або загальній воді організму людини. Їх білкова архітектура нагадує структуру імуноглобулінів з гіперваріабельними петлями на вершині жорсткого остова. Однак на відміну від антитіл або їх рекомбінантних фрагментів ліпокаліни складаються з одного поліпептидного ланцюгу, що містить 160-180 амінокислотних залишків, тобто дещо більш великого, ніж один домен імуноглобуліну. Набір з чотирьох петель, які утворюють зв'язуючу кишеню, має виражену структурну пластичність та допускає широке розмаїття бічних ланцюгів. Таким чином, при використанні відповідного процесу сайту зв'язування можна надавати нову форму, призначену для розпізнавання з високою афінністю та специфічністю раніше визначених молекул-мішеней різної форми. Один з білків сімейства ліпокалінів, а саме зв'язуючий білін білок (BBP) з Pieris brassicae (капустяний білан), використовували для створення антикалінів шляхом мутагенезу, що зачіпає чотири петлі. Однією із заявок на патент, в яких описані "антикаліни", приведеною як приклад, є WO 1999/16873. (VI) Афілін (Affilin) – фірма Scil Proteins Молекули Affilin™ являють собою невеликі неімуноглобулінові білки, які розроблені з метою досягнення специфічних афінностей до білків та невеликих молекул. Нові молекули Affilin™ можна дуже швидко відбирати з двох бібліотек, основою кожної з яких є різні отримані з людського організму білки-каркаси. Молекули Affilin™ не мають якої-небудь структурної гомології з білками імуноглобулінів. На фірмі Scil Proteins застосовують два Affilin™-каркаси, одним з яких є гама-кристалін, людський структурний білок кришталика ока, а іншим є білки суперсімейства "убіквітину". Обидва людських каркаси мають дуже малий розмір, характеризуються високою теплостійкістю та практично стійкі до змін значень pH та дії денатуруючих агентів. Вказана висока стабільність головним чином є результатом розширеної бета-складчастої конформації білків. Приклади виведених з гама-кристаліну білків описані в WO 2001/04144, а приклади "убіквітиноподібних" білків описані у WO 2004/106368. (VII) Міметики білкових епітопів (PEM) PEM являють собою середнього розміру, циклічні, нагадуючі пептиди молекули (ММ 1-2 кДа), які імітують вторинні структури білків типу бета-«шпильок", тобто основну вторинну структуру, що приймає участь в білок-білкових взаємодіях. Конструювання каркасних ділянок або Fc До сконструйованих антитіл, запропонованих у винаході, відносяться антитіла, у яких зроблені модифікації в залишках каркасних ділянок в VH та/або VL, наприклад, з метою поліпшення властивостей антитіла. Як правило, такі модифікації каркасних ділянок здійснюють для зниження імуногенності антитіла. Наприклад, один з підходів являє собою "зворотне мутування" одного або декількох залишків каркасної ділянки з одержанням відповідної послідовності зародкової лінії. Більш конкретно, антитіло, яке було піддано соматичній мутації, може містити залишки каркасної ділянки, що відрізняються від послідовності зародкової лінії, з якої виведено антитіло. Такі залишки можна ідентифікувати шляхом порівняння послідовностей каркасних ділянок антитіла з послідовностями зародкової лінії, з якої виведено антитіло. Для повернення послідовностей каркасної ділянки до вихідної конфігурації зародків лінії соматичні мутації можна піддавати "зворотному мутуванню" з одержанням послідовності зародкової лінії, наприклад, за допомогою сайтнаправленого мутагенезу або ПЛР-опосередковуваного 21 UA 102437 C2 5 10 15 20 25 30 35 40 45 50 55 60 мутагенезу. Такі антитіла із "зворотними мутаціями" підпадають також під обсяг даного винаходу. Інший тип модифікації каркасної ділянки включає зміну шляхом мутації одного або декількох залишків у каркасній ділянці або навіть в одній або декількох CDR-ділянках для видалення Tклітинних епітопів з метою зниження потенційної імуногенності антитіла. Цей підхід позначають також як "деімунізація", та він описаний більш докладно у US 2003/0153043. У додатковому або альтернативному варіанті крім модифікацій у каркасних ділянках або CDR антитіла, запропоновані у винаході, можуть включати модифікації в Fc-фрагменті, як правило, для зміни однієї або декількох функціональних властивостей антитіла, таких як час напівжиття в сироватці, фіксація комплементу, зв'язування Fc-рецептору та/або антитілообумовлена клітинозалежна цитотоксичність. Крім того, антитіло, запропоноване у винаході, можна модифікувати хімічно (наприклад, до антитіла можна приєднувати один або кілька хімічних фрагментів) або можна модифікувати для зміни його глікозилювання, та в цьому випадку з метою зміни однієї або декількох функціональних властивостей антитіла. Кожний із зазначених варіантів здійснення винаходу буде більш докладно описаний нижче. Нумерація залишків в Fc-фрагменті відповідає нумерації EU по Кеботу. В одному з варіантів здійснення винаходу модифікують шарнірну область CH1 таким чином, щоб змінювати, наприклад, збільшувати або знижувати, кількість цистеїнових залишків у шарнірній області. Цей підхід описаний також в US 5677425. Кількість цистеїнових залишків у шарнірній області CH1 змінюють, наприклад, для полегшення складання легких та важких ланцюгів або для підвищення або зниження стабільності антитіла. В іншому варіанті здійснення винаходу шарнірну область Fc-фрагменту антитіла можна змінювати за допомогою мутації для зниження біологічного часу напівжиття антитіла. Більш конкретно, інтродукують одну або декілька амінокислотних мутацій в область контакту CH2CH3-доменів шарнірної області Fc-фрагменту для погіршення зв'язування антитіла з білком А золотистого стафілококу Staphylococcyl (SpA) у порівнянні зі зв'язуванням нативної шарнірної області Fc-фрагменту з SpA. Цей підхід описаний більш докладно у US 6165745. В іншому варіанті здійснення винаходу антитіло модифікують для подовження біологічного часу напівжиття. При цьому можливо застосування різних підходів. Наприклад, можна інтродукувати одну або декілька з наступних мутацій: T252L, T254S, T256F, описаних в US 6277375. В іншому варіанті для подовження біологічного часу напівжиття можна змінювати антитіло в CH1- або CL-області шляхом інтродукції епітопу, що зв'язується з рецептором«рятувальником", отриманого із двох петель CH2-домену Fc-фрагменту IgG, як описано у US 5869046 та US 6121022. В інших варіантах здійснення винаходу Fc-фрагмент змінюють шляхом заміни щонайменше одного амінокислотного залишку на інший амінокислотний залишок для зміни ефекторних функцій антитіла. Наприклад, один або декілька амінокислотних залишків можна заміняти на інший амінокислотний залишок таким чином, щоб у такого антитіла змінювалася афінність до ефекторного ліганду, але зберігалася антигензв'язуюча здатність батьківського антитіла. Ефекторний ліганд, афінність до якого змінюють, може являти собою, наприклад, Fc-рецептор або C1-компонент системи комплементу. Цей підхід описаний більш докладно у US 5624821 та US 5648260, обидва на ім'я Winter зі співавторами. Зокрема, можна змінювати в результаті мутації залишки 234 та 235. Зокрема, ці мутації можуть являти собою заміну на аланін. Таким чином, в одному з варіантів здійснення винаходу антитіло, запропоноване у винаході, має мутацію у Fc-фрагменті, що зачіпає одну або обидві амінокислоти в положеннях 234 та 235. В іншому варіанті здійснення винаходу одна або обидві амінокислоти в положеннях 234 та 235 можна заміняти на аланін. Заміна обох амінокислот у положеннях 234 та 235 на аланін приводить до зниженої ADCC-активності. В іншому варіанті здійснення винаходу один або декілька амінокислотних залишків амінокислотної послідовності можна заміняти іншим амінокислотним залишком таким чином, щоб антитіло мало змінену здатність до C1q-зв'язування та/або знижену комплементзалежну цитотоксичність (CDC) або щоб у нього була відсутня CDC. Цей підхід описаний більш докладно у US 6194551. В іншому варіанті здійснення винаходу один або декілька амінокислотних залишків модифікують, змінюючи тим самим здатність антитіла до фіксації комплементу. Цей підхід описаний також у WO 94/29351. Ще в одному варіанті здійснення винаходу Fc-фрагмент модифікують для підвищення здатності антитіла викликати антитіло-обумовлену клітинозалежну цитотоксичність (ADCC) та/або для підвищення афінності антитіла до Fcγ-рецептору за допомогою модифікації однієї або декількох амінокислот. Цей підхід описаний більш докладно у WO 00/42072. Крім того, були 22 UA 102437 C2 5 10 15 20 25 30 35 40 45 50 55 60 картовані сайти зв'язування людського IgG1 з FcγRl, FcγRII, FcγRIII та FcRn, та описані варіанти з поліпшеною здатністю до зв'язування (див. Shields R.L. та ін., J. Biol. Chen. 276, 2001, стор. 6591-6604). У наступному варіанті здійснення винаходу модифікують глікозилювання антитіла. Наприклад, можна створювати аглікозильоване антитіло (тобто антитіло, у якому відсутнє глікозилювання). Глікозилювання можна змінювати, наприклад, для підвищення афінності антитіла до антигену. Такі вуглеводні модифікації можна здійснювати шляхом, наприклад, зміни одного або декількох сайтів глікозилювання в послідовності антитіла. Наприклад, можна здійснювати одну або декілька амінокислотних замін, які приводять до елімінації одного або декількох сайтів глікозилювання каркасної ділянки варіабельної області, усуваючи тим самим глікозилювання в цьому сайті. Зазначене аглікозилювання може підвищувати афінність антитіла до антигену. Цей підхід описаний більш докладно у US 5714350 та US 6350861 на ім'я Co зі співавторами. У додатковому або альтернативному варіанті можна створювати антитіло зі зміненим типом глікозилювання, наприклад, гіпофукозильоване антитіло, яке має знижену кількість фукозильних залишків, або антитіло з підвищеним вмістом поділяючих навпіл GlcNac-структур. Було продемонстровано, що такі змінені схеми глікозилювання підвищують ADCC-активність антитіл. Зазначені вуглеводні модифікації можна здійснювати, наприклад, шляхом експресії антитіла в клітині-хазяїні зі зміненим механізмом глікозилювання. Клітини зі зміненим механізмом глікозилювання відомі в даній галузі, та їх можна застосовувати як клітини-хазяїва, у яких експресують рекомбінантні антитіла, запропоновані у винаході, для одержання тим самим антитіл зі зміненим глікозилюванням. Наприклад, у EP 1176195 на ім'я Hang зі співавторами описана лінія клітин з функціонально порушеним геном FUT8, який кодує фукозилтрансферазу, у результаті чого експресовані в такій клітинній лінії антитіла характеризуються гіпофукозилюванням. Таким чином, відповідно до одного з варіантів здійснення винаходу, антитіла, запропоновані у винаході, одержують шляхом рекомбінантної експресії в клітинній лінії, яка відрізняється схемою гіпофукозилювання, наприклад, у клітинній лінії ссавця з дефіцитом експресії гену FUT8, який кодує фукозилтрансферазу. У WO 03/035835 на ім'я Presta описаний варіант лінії CHO-клітин, Lecl3-клітини, зі зниженою здатністю приєднувати фукозу до пов'язаних з Asn(297) вуглеводам, що приводить також до гіпофукозилювання антитіл, що експресуються у цій клітині-хазяїні (див. також Shields R.L. та ін., J. Biol. Chem. 277, 2002, стор. 26733-26740). У WO 99/54342 описані лінії клітин, сконструйовані для експресії, що модифікують глікопротеїн глікозилтрансфераз (наприклад, бета(1,4)-N-ацетилглюкозамінілтрансферази III (GnTIII)), у результаті чого антитіла, які експресуються в сконструйованих лініях клітин, характеризуються підвищеним вмістом поділяючих навпіл GlcNac-структур, що приводить до підвищеної ADCC-активності антитіл (див. також Umana та ін., Nat. Biotech. 17, 1999, стор. 176180). В альтернативному варіанті антитіла, запропоновані у винаході, можна одержувати в дріжджах або нитчастих грибах, сконструйованих для створення глікозилювання, що нагадує характерну для ссавців схему, та які мають здатність продукувати антитіла з відсутністю фукози як компонента схеми глікозилювання (див., наприклад, EP 1297172B1). Іншою модифікацією антитіл, що підпадає під обсяг винаходу, є пегілювання. Антитіло можна пегілювати, наприклад, для подовження біологічного (наприклад, у сироватці) часу напівжиття антитіла. Для пегілювання антитіла, як правило, антитіло або його фрагмент піддають взаємодії з поліетиленгліколем (ПЕГ), таким як реакційноздатний складний ефір або альдегідна похідна ПЕГ, в умовах, при яких одна або декілька ПЕГ-груп приєднується до антитіла або фрагмента антитіла. Пегілювання можна здійснювати за допомогою реакції ацилювання або реакції алкілювання з реакційноздатною молекулою ПЕГ (або аналогічним реакційноздатним водорозчинним полімером). У контексті даного опису мається на увазі, що поняття "поліетиленгліколь" відноситься до будь-яких форм ПЕГ, які використовують для дериватизації інших білків, таких як моно(C1-C10)алкокси- або арилоксиполіетиленгліколь або поліетиленглікольмалеімід. У конкретних варіантах здійснення винаходу антитіло, що підлягає пегілюванню, являє собою агліколизьоване антитіло. Методи пегілювання білків відомі в даній галузі, та їх можна застосовувати до антитіл, запропонованих у винаході (див., наприклад, EP 0154316 та EP 0401384). Іншою модифікацією антитіл, що підпадає під обсяг винаходу, є кон'югат або злитий білок, що містить щонайменше антигензв'язуючу ділянку антитіла, запропонованого у винаході, із сироватковим білком, таким як людський сироватковий альбумін або його фрагмент, з метою подовження часу напівжиття молекули, що утворилася (див., наприклад, EP 0322094). Іншим можливим варіантом є злиття щонайменше однієї антигензв'язуючої ділянки антитіла, запропонованої у винаході, з білками, які можуть зв'язуватися із сироватковими білками, такими 23 UA 102437 C2 5 10 15 20 25 30 35 40 45 50 55 60 як людський сироватковий альбумін, подовжуючи час напівжиття молекули, що утворилася (див., наприклад, EP 0486525). Методи створення змінених антитіл Як зазначено вище, антитіла анти-ActRIIB, які мають послідовності VH та VL або послідовності повнорозмірного важкого та легкого ланцюгу, представлені в даному описі, можна застосовувати для створення нових антитіл анти-ActRIIB шляхом модифікації послідовностей повнорозмірного важкого ланцюгу та/або легкого ланцюгу, послідовностей VH та/або VL або приєднаної(их) до них константної(их) області(ей). Таким чином, згідно з іншим об'єктом винаходу структурні особливості антитіла анти-ActRIIB, запропонованого у винаході, використовують для створення структурно споріднених антитіл анти-ActRIIB, які зберігають щонайменше одну з функціональних властивостей антитіл, запропонованих у винаході, таких як зв'язування з людським ActRIIB, а також інгібування однієї або декількох функціональних властивостей ActRIIB (наприклад, інгібування активації Smad). Наприклад, одну або декілька CDR-ділянок антитіл, запропонованих в даному винаході, або їх мутантів можна об'єднувати рекомбінантно з відомими каркасними ділянками та/або іншими CDR для одержання додаткових, створених з використанням рекомбінантної ДНК антитіл антиActRIIB, запропонованих у винаході, за допомогою зазначених вище методів. Інші типи модифікацій включають модифікації, описані в попередньому розділі. Вихідним матеріалом для конструювання є одна або декілька послідовностей VH та/або VL, представлених в даному описі, або одна або декілька з їх CDR-ділянок. Для створення сконструйованого антитіла не є необхідним фактичне одержання (тобто експресія у вигляді білку) антитіла, яке має одну або декілька з послідовностей VH та/або VL, представлених в даному описі, або однієї або декількох їх CDR-ділянок. Переважно інформацію, що міститься в послідовності(ях), використовують як вихідний матеріал для створення послідовності(ей) "другого покоління", виведеної(их) з вихідної(их) послідовності(ей), та потім отримують послідовність(і) другого покоління та експресують у вигляді білку. Таким чином, ще одним варіантом здійснення винаходу є спосіб одержання антитіла антиActRIIB, що складається з: послідовності варіабельної області важкого ланцюгу антитіла, яка містить послідовність CDR1, вибрану з групи, що включає SEQ ID NO: 1-14, послідовність CDR2, вибрану з групи, що включає SEQ ID NO: 15-28, та/або послідовність CDR3, вибрану з групи, що включає SEQ ID NO: 29-42; та послідовності варіабельної області легкого ланцюгу антитіла, яка містить послідовність CDR1, вибрану з групи, що включає SEQ ID NO: 43-56, послідовність CDR2, вибрану з групи, що включає SEQ NO: 57-70, та/або послідовність CDR3, вибрану з групи, що включає SEQ ID NO: 71-84; що полягає в тому, що змінюють щонайменше один амінокислотний залишок в послідовності варіабельної області важкого ланцюгу антитіла та/або варіабельної області легкого ланцюгу антитіла для створення щонайменше однієї зміненої послідовності антитіла; та експресують змінену послідовність антитіла у вигляді білку. Таким чином, іншим варіантом здійснення винаходу є спосіб одержання антитіла антиActRIIB, оптимізованого для експресії в клітині ссавця, яке складається з: повнорозмірної послідовності важкого ланцюгу антитіла, яка має послідовність, вибрану з групи, що включає SEQ ID NO: 146-150 та 156-160; повнорозмірної послідовності легкого ланцюгу антитіла, яка має послідовність, вибрану з групи, що включає SEQ ID NO: 141-145 та 151-155; що полягає в тому, що змінюють щонайменше один амінокислотний залишок в повнорозмірній послідовності важкого ланцюгу антитіла та/або в повнорозмірній послідовності легкого ланцюгу антитіла для створення щонайменше однієї зміненої послідовності антитіла; та експресують змінену послідовність антитіла у вигляді білку. Змінену послідовність антитіла можна створювати також шляхом скринінгу бібліотек антитіл, які мають фіксовані послідовності CDR3, вибрані з групи, що включає SEQ ID NO: 29-42 та SEQ ID NO: 71-84, або мінімальні зв'язуючі детермінанти, що мають вирішальне значення, описані у US 2005/0255552, та різноманітні послідовності CDR1 та CDR2. Скринінг можна здійснювати з використанням будь-якого методу скринінгу, придатного для скринінгу антитіл з бібліотек антитіл, такого як технологія фагового дисплея. Для одержання та експресії зміненої послідовності антитіла можна застосовувати стандартні методи молекулярної біології. Антитіло, що кодується зміненою(ими) послідовністю(ями), являє собою антитіло, яке зберігає одну, декілька або всі функціональні властивості антитіл антиActRIIB, представлених в даному описі, де функціональні властивості включають (але не обмежуючись тільки ними) специфічність зв'язування з людським ActRIIB та інгібування активації Smad. Змінене антитіло може мати одну або декілька, дві або більше або три або більше із зазначених вище функціональних властивостей. 24 UA 102437 C2 5 10 15 20 25 30 35 40 45 50 55 60 Функціональні властивості змінених антитіл можна оцінювати за допомогою стандартних аналізів, відомих в даній галузі та/або представлених в даному описі, таких як описані в прикладах аналізи (наприклад, ELISA). В конкретних варіантах способів створення антитіл, запропонованих у винаході, мутації можна інтродукувати довільно або вибірково у всю або в частину кодуючої послідовності антитіла анти-ActRIIB та отримані у результаті модифіковані антитіла анти-ActRIIB можна піддавати скринінгу у відношенні зв'язуючої активності та/або інших описаних вище функціональних властивостей. Методи інтродукції мутацій відомі в даній галузі. Наприклад, у WO 02/092780 описані методи створення та скринінгу мутацій антитіл за допомогою насичуючого мутагенезу, синтетичної зборки лігуванням або за допомогою комбінації цих методів. Крім того, у WO 03/074679 описані альтернативні методи, основані на обчислювальному скринінгу для оптимізації фізико-хімічних властивостей антитіл. Молекули нуклеїнових кислот, що кодують антитіла, запропоновані у винаході Наступним об'єктом винаходу є молекули нуклеїнових кислот, які кодують антитіла, запропоновані у винаході. Прикладами нуклеотидних послідовностей повнорозмірного легкого ланцюгу, оптимізованих для експресії в клітині ссавця, є послідовності, представлені у SEQ ID NO: 161-165 та 171-175. Прикладами нуклеотидних послідовностей повнорозмірного важкого ланцюгу, оптимізованих для експресії в клітині ссавця, є послідовності, представлені у SEQ ID NO: 166-170 та 176-180. Нуклеїнові кислоти можуть бути присутніми в цілих клітинах, в клітинних лізатах або можуть являти собою нуклеїнові кислоти в частково очищеній або практично чистій формі. Нуклеїнову кислоту "виділяють" або "отримують її в практично очищеному вигляді", коли її очищують від інших клітинних компонентів або інших забруднювачів, наприклад, інших присутніх в клітині нуклеїнових кислот або білків, за допомогою стандартних методів, включаючи обробку лугом/ДСН, CsCl-бендінг, хроматографію на колонках, електрофорез в агарозному гелі та інших методів, добре відомих в даній галузі (див. Current Protocols in Molecular Biology, під ред. F. Ausubel та ін., вид-во Greene Publishing and Wiley Interscience, New York, 1987). Нуклеїнова кислота, запропонована у винаході, може являти собою, наприклад, ДНК або РНК, та може містити інтронні послідовності або не містити їх. В одному з варіантів здійснення винаходу нуклеїнова кислота являє собою молекулу кДНК. Нуклеїнова кислота може бути присутньою у векторі, такому як фаговий дисплейний вектор або рекомбінантний плазмідний вектор. Винахід відноситься також до векторів, позначених як pBW522 та pBW524 (депоновані у DSMZ, Inhoffenstr. 7B, D-38124 Брауншвейг, Німеччина 18 серпня 2009 р. під реєстраційними номерами DSM22873 та DSM22874 відповідно). Нуклеїнові кислоти, запропоновані у винаході, можна отримувати за допомогою стандартних методів молекулярної біології. Для антитіл, що експресуються гібридомами (наприклад, гібридомами, отриманими із трансгенних мишей, які несуть гени людських імуноглобулінів, що буде описано нижче), кДНК, які кодують легкі та важкі ланцюги антитіла, створені з використанням гібридоми, можна отримувати за допомогою стандартних методів ПЛРампліфікації або клонування кДНК. Для антитіл, які отримують з бібліотеки генів імуноглобулінів (наприклад, за допомогою методу фагового дисплея), нуклеїнову кислоту, що кодує антитіло, можна виділяти з різних фагових клонів, які є компонентами бібліотеки. Під обсяг даного винаходу підпадають також варіанти нуклеотидних послідовностей, які несуть одну або декілька делецій, додавань або замін. Одним з варіантів здійснення винаходу є одна або декілька з SEQ ID NO: 113-140 або 161-180, яка(і) містить(ять) консервативну нуклеотидну заміну. У результаті виродженості генетичного коду амінокислота може кодуватися декількома кодонами. Таким чином, можна внести зміни в нуклеотидну послідовність, але при цьому амінокислотна послідовність, що транслюється, залишиться такою ж. Після одержання ДНК-фрагментів, що кодують VH- та VL-області, ці ДНК-фрагменти можна піддавати додатковій обробці за допомогою стандартних методів рекомбінантної ДНК, наприклад, для перетворення генів варіабельної області в гени повнорозмірного ланцюгу антитіла, в гени Fab-фрагменту або в ген scFv-фрагменту. При здійсненні цього процесу ДНК-фрагмент, що кодує VL або VH, функціонально зв'язують з іншою молекулою ДНК або фрагментом, що кодує інший білок, такий як константна область антитіла або гнучкий лінкер. Поняття "функціонально зв'язаний" в контексті даного опису означає, що два ДНК-фрагменти з'єднують функціональним чином, у результаті чого амінокислотні послідовності, що кодуються двома ДНК-фрагментами, зберігаються в рамці зчитування, або у результаті чого білок експресується під контролем потрібного промотору. Виділену ДНК, що кодує VH-область, можна перетворювати в ген повнорозмірного важкого ланцюгу шляхом функціонального зв'язування ДНК, яка кодує V H, з іншою молекулою ДНК, яка 25 UA 102437 C2 5 10 15 20 25 30 35 40 45 50 55 60 кодує константні області важкого ланцюгу (CH1, CH2 та CH3). Послідовності генів константної області важкого ланцюгу відомі в даній галузі (див., наприклад, Kabat E.A. та ін., вище), та ДНКфрагменти, що включають ці області, можна отримувати за допомогою стандартної ПЛРампліфікації. Константна область важкого ланцюгу може являти собою константну область IgG1, IgG2, IgG3, IgG4, IgA, IgE, IgM або IgD. Переважно константну область важкого ланцюгу вибирають серед IgG1-ізотипів. У випадку гену Fab-фрагменту важкого ланцюгу ДНК, що кодує VH, можна функціонально зв'язувати з іншою молекулою ДНК, яка кодує тільки константну область CH1 важкого ланцюгу. Виділену ДНК, що кодує VL-область, можна перетворювати в ген повнорозмірного легкого ланцюгу (а також в ген легкого ланцюгу Fab-фрагменту) шляхом функціонального зв'язування ДНК, що кодує VL, з іншою молекулою ДНК, яка кодує константну область легкого ланцюгу, тобто CL. Послідовності людських генів константної області легкого ланцюгу відомі в даній галузі (див., наприклад, Kabat E.A. та ін., вище), та ДНК-фрагменти, що включають ці області, можна отримувати за допомогою стандартної ПЛР-ампліфікації. Константна область легкого ланцюгу може являти собою константну область капа- або лямбда-ланцюгу. Для створення гену scFv ДНК-фрагменти, які кодують VH та VL, функціонально зв'язують з іншим фрагментом, який кодує гнучкий лінкер, наприклад, який кодує амінокислотну послідовність (Gly4-Ser)3, у результаті чого послідовності VH та VL можна експресувати у вигляді суміжного одноланцюгового білку, у якому V L- та VH-області з'єднані гнучким лінкером (див., наприклад, Bird та ін., Science 242, 1988, стор. 423-426; Huston та ін., Proc. Natl. Acad. Sci. USA 85, 1988, стор. 5879-5883; McCafferty та ін., Nature 348, 1990, стор. 552-554). Нуклеїнові кислоти, запропоновані у винаході, можна застосовувати для введення гену. Це означає, що нуклеїнову кислоту, яка кодує поліпептиди (антитіла або функціональні білки), запропоновані у винаході, можна вводити безпосередньо пацієнту з метою трансляції в організмі пацієнта. Нуклеїнову кислоту, як правило, "упаковують" для введення пацієнту. Носії, застосовувані для введення генів, можуть бути невірусними, наприклад, ліпосоми, або являти собою віруси з дефектом реплікації, такі як вектори на основі аденовірусу, описані у Berkner K.L., Curr. Top. Microbiol. Immunol., 158, 1992, стор. 39-66, або аденоасоційованого вірусу (AAV), описані у Muzyczka N., Curr. Top. Microbiol. Immunol., 158, 1992, стор. 97-129 та US 5252479. В іншому варіанті можна застосовувати ретровірус, такий як лентивірус. Наприклад, молекулу нуклеїнової кислоти, яка кодує поліпептид, запропонований у винаході, можна створювати для експресії вектору на основі ретровірусу з дефектом реплікації. цю експресійну конструкцію потім можна виділяти та інтродукувати в упаковуючу клітину, трансдуковану ретровірусним плазмідним вектором, який містить РНК, що кодує поліпептид, зазначена упаковуюча клітина у результаті продукує інфекційні вірусні частинки, які містять ген, що представляє інтерес. Ці клітинипродуценти можна вводити індивідууму для конструювання клітин in vivo та експресії поліпептиду in vivo (див. розділ 20, в Gene Therapy and other Molecular Genetic-based Therapeutic Approaches (та процитовані у зазначеній публікації посилання) у: Human Molecular Genetics, T. Strachan та A.P. Read, 1996, вид-во BIOS Scientific Publishers Ltd). Інший підхід передбачає введення "голої ДНК", за допомогою якої терапевтичний ген безпосередньо ін'єцирують в кровоток або м'язову тканину. Створення моноклональних антитіл, запропонованих у винаході Моноклональні антитіла (МАт) можна отримувати за допомогою різних методів, включаючи загальноприйняті методи одержання моноклональних антитіл, наприклад, за допомогою стандартного методу гібридизації соматичних клітин, описаного у Kohler та Milstein, Nature 256, 1975, стор. 495. Для одержання моноклональних антитіл можна застосовувати численні методики, наприклад, трансформацію В-лімфоцитів вірусами або онкогенами. Застосовувана для одержання гібридом система тваринного походження являє собою систему, основану на використанні мишей. Створення гібридоми в миші є добре відомою процедурою. Протоколи імунізації та методи виділення імунізованих спленоцитів, призначених для злиття, добре відомі в даній галузі. Компоненти, що приймають участь у злитті (наприклад, клітини мишачої мієломи), та процедури злиття також добре відомі. Химерні або гуманізовані антитіла, запропоновані в даному винаході, можна створювати на основі послідовності мишачого моноклонального антитіла, отриманого згідно з описаним вище методом. ДНК, що кодує важкі та легкі ланцюги імуноглобулінів, можна отримувати з мишачої гібридоми, що представляє інтерес, та створювати таким чином, щоб вона містила немишачі (наприклад, людські) послідовності імуноглобулінів, за допомогою стандартних методів молекулярної біології. Наприклад, для створення химерного антитіла мишачі варіабельні області можна зв'язувати з людськими константними областями з використанням відомих в 26 UA 102437 C2 5 10 15 20 25 30 35 40 45 50 55 60 даній галузі методів (див., наприклад, US 4816567). Для створення гуманізованого антитіла мишачі CDR-ділянки можна вбудовувати в людську каркасну ділянку за допомогою відомих в даній області методів (див., наприклад, US 5225539; US 5530101; 5585089; 5693762 та 6180370). В конкретному варіанті здійснення винаходу антитіла, запропоновані у винаході, являють собою людські моноклональні антитіла. Такі людські моноклональні антитіла анти-ActRIIB можна створювати з використанням трансгенних або трансхромосомних мишей, що несуть фрагменти людської, а не мишачої імунної системи. До цих трансгенних та трансхромосомних мишей відносяться миші, позначені в контексті даного опису як HuMAb-миші та KM-миші відповідно, та мишей обох зазначених ліній позначають в контексті даного опису як "миші, що несуть людський Ig". ® Миші лінії HuMAb (HuMAb mouse , фірма Medarex, Inc.) містять мінілокуси гену людського імуноглобуліну, який кодує неперегруповані послідовності людського важкого (µ та γ) та легкого κ-ланцюгу імуноглобуліну, у поєднанні з цільовими мутаціями, які інактивують ендогенні локуси µ- та κ-ланцюгу (див., наприклад, Lonberg та ін., Nature 368(6474), 1994, стор. 856-859). Таким чином, у миші знижена здатність експресувати мишачий IgM або κ-ланцюг, та у відповідь на імунізацію інтродуковані трансгени людського важкого та легкого ланцюгу піддаються переключенню класу та соматичній мутації з утворенням капа-ланцюгу людського моноклонального IgG (IgGκ), що має високу афінність (Lonberg N. та ін., 1994, вище; оглядова стаття Lonberg N., Handbook of Experimental Pharmacology 113, 1994, стор. 49-101; Lonberg N. та Huszar D., Intern. Rev. Immunol. 13, 1995, стор. 65-93 та Harding F. та Lonberg N., Ann. N. Y. Acad. Sci. 764, 1995, стор. 536-546). Одержання та застосування мишей лінії HuMAb та геномні модифікації, які несуть такі миші, описані також у Taylor L. та ін., Nucleic Acids Research 20, 1992, стор. 6287-6295; Chen J. та ін., International Immunology 5, 1993, стор. 647-656; Tuaillon та ін., Proc. Natl. Acad. Sci. USA 94, 1993, стор. 3720-3724; Choi та ін., Nature Genetics 4, 1993, стор. 117-123; Chen J. та ін., EMBO J. 12, 1993, стор. 821-830; Tuaillon та ін., J. Immunol. 152, 1994, стор. 2912-2920; Taylor L. та ін., International Immunology, 1994, стор. 579-591; та Fishwild D. та ін., Nature Biotechnology 14, 1996, стор. 845-851 (див. також US 5545806; 5569825; 5625126; 5633425; 5789650; 5877397; 5661016; 5814318; 5874299; 5770429 та 5545807; а також WO 92/103918, WO 93/12227, WO 94/25585, WO 97/113852, WO 98/24884; WO 99/45962 та WO 01/14424). В іншому варіанті здійснення винаходу людські антитіла, запропоновані у винаході, можна отримувати з використанням миші, яка несе послідовності людського імуноглобуліну на трансгенах та трансхромосомах, наприклад, миші, яка несе трансген людського важкого ланцюгу та трансхромосому людського легкого ланцюгу. Такі миші, позначені в контексті даного опису як "KM-миші", описані детально у WO 02/43478. В даній галузі відомі також і інші альтернативні системи на основі трансгенних тварин, що експресують гени людського імуноглобуліну, та їх можна застосовувати для одержання антитіл анти-ActRIIB, запропонованих у винаході. Наприклад, можна використовувати іншу трансгенну систему, позначену як Xenomouse (фірма Abgenix, Inc.); такі миші описані, наприклад, у US 5939598; 6075181; 6114598; 6150584 та 6162963. Крім того, в даній галузі відомі також інші трансхромосомні системи, створені на основі тварин, для експресії генів людського імуноглобуліну, та їх можна застосовувати для одержання антитіл анти-ActRIIB, запропонованих у винаході. Наприклад, можна використовувати мишей, що несуть як трансхромосому людського важкого ланцюгу, так і трансхромосому людського легкого ланцюгу, які позначені як "TC-миші"; такі миші описані, наприклад, у Tomizuka та ін. Proc. Natl. Acad. Sci. USA 97, 2000, стор. 722-727. Крім того, у даній галузі відомі корови, що несуть трансхромосоми людського важкого та легкого ланцюгу (Kuroiwa та ін., Nature Biotechnology 20, 2002, стор. 889-894) та їх можна застосовувати для одержання антитіл антиActRIIB, запропонованих у винаході. Людські рекомбінантні антитіла, запропоновані у винаході, можна отримувати також з використанням методів фагового дисплея для скринінгу бібліотек генів людських імуноглобулінів. У даній галузі розроблені такі методи фагового дисплея для виділення людських антитіл (див., наприклад: US 5223409; 5403484; 5571698; 5427908; 5580717; 5969108; 6172197; 5885793; 6521404; 6544731; 6555313; 6582915 та 6593081). Людські моноклональні антитіла, запропоновані у винаході, можна отримувати також з використанням SCID-мишей (миші з важким комбінованим імунодефіцитом), у яких відновлювали людські імуноцити з тим, щоб при імунізації можна було отримувати людську гуморальну імунну відповідь. Такі миші описані, наприклад, у US 5476996 та 5698767. Створення гібридом, що продукують людські моноклональні антитіла 27 UA 102437 C2 5 10 15 20 25 30 35 40 45 50 55 60 Для створення гібридом, які продукують людські моноклональні антитіла, запропоновані у винаході, можна виділяти спленоцити та/або клітини лімфатичних вузлів з імунізованих мишей та зливати з відповідною іморталізованою лінією клітин, такою як лінія клітин мишачої мієломи. Утворені гібридоми можна піддавати скринінгу у відношенні виробництва специфічних для антигену антитіл. Наприклад, суспензії індивідуальних клітин селезінкових лімфоцитів з імунізованих мишей можна зливати в кількості, що становить одну шосту частину від кількості клітин мишачої мієломи лінії P3 × 63-Ag8.653 (ATCC, CRL 1580), що не секретується, за 5 допомогою 50 % ПЕГ. Клітини висіюють приблизно з розрахунку 2×10 /лунку в плоскодонні титраційні мікропланшети, потім інкубують впродовж 2 тижнів в середовищі для селекції, що містить 20 % фетальної сироватки (Clone), кондиціонованого середовища "653", 5 % оригену (фірма IGEN), 4мМ L-глутамін, 1мМ піруват натрію, 5мМ HEPES, 0,055мМ 2-меркаптоетанол, 50 од./мл пеніциліну, 50 мкг/мл стрептоміцину, 50 мкг/мл гентаміцину та 1×ГАТ (фірма Sigma; ГАТ додають через 24 год. після злиття). Приблизно через 2 тижні клітини можна культивувати в середовищі, у якому ГАТ замінений на ГТ. Потім індивідуальні лунки можна піддавати скринінгу за допомогою ELISA у відношенні людських моноклональних антитіл у вигляді IgM та IgG. Після досягнення інтенсивного росту гібридом здійснюють моніторинг середовища, як правило, через 10-14 днів. Гібридоми, що секретують антитіла, можна пересівати, знову піддавати скринінгу та, якщо все ще зберігається позитивна реакція у відношенні людського IgG, тоді моноклональні антитіла можна субклонувати щонайменше двічі з використанням кінцевого розведення. Потім стабільні субклони можна культивувати in vitro для одержання невеликих кількостей антитіл в середовищі для культури тканини з метою подальшої характеризації. Для очищення людських моноклональних антитіл відібрані гібридоми можна вирощувати в 2-літрових колбах, що обертаються, з метою очищення моноклональних антитіл. Супернатанти можна фільтрувати та концентрувати перед здійсненням афінної хроматографії з використанням білку A-сефарози (фірма Pharmacia, Піскатавей, шт. Нью-Джерсі). Елюйований IgG можна перевіряти за допомогою гель-електрофорезу та рідинної хроматографії високого розділення для гарантії чистоти. Буферний розчин можна замінювати на ЗФР та концентрацію визначати на основі ОП280 з використанням коефіцієнта екстинкції 1,43. Моноклональні антитіла можна розділяти на аліквоти та зберігати при -80 °C. Створення трансфектом, що продукують моноклональні антитіла Антитіла, запропоновані у винаході, можна отримувати також в трансфектомі клітинихазяїна з використанням, наприклад, комбінації методів рекомбінантної ДНК та методів генної трансфекції, які добре відомі в даній галузі (див., наприклад, Morrison S., Science 229, 1985, стор. 1202). Наприклад, для експресії антитіл або фрагментів антитіл можна одержувати ДНК, які кодують часткові або повнорозмірні легкі та важкі ланцюги, за допомогою стандартних методів молекулярної біології (наприклад, за допомогою ПЛР-ампліфікації або клонування кДНК із використанням гібридом, які експресують антитіло, що представляє інтерес), та ДНК можна вбудовувати в експресійні вектори таким чином, щоб гени були функціонально пов'язані з контролюючими транскрипцію та трансляцію послідовностями. У цьому контексті мається на увазі, що поняття "функціонально зв'язаний" означає, що ген антитіла вбудовують шляхом лігування у вектор таким чином, щоб присутні у векторі контролюючі транскрипцію та трансляцію послідовності виконували властиві їм функції регуляції транскрипції та трансляції гену антитіла. Вибрані експресійний вектор та контролюючі експресію послідовності повинні бути сумісні із застосовуваною для експресії клітиною-хазяїном. Ген легкого ланцюгу антитіла та ген важкого ланцюгу антитіла можна вбудовувати в різні вектори або, як правило, обидва гени вбудовують в один і той же експресійний вектор. Гени антитіла вбудовують в експресійний вектор стандартними методами (наприклад, вбудовують шляхом лігування комплементарних сайтів рестрикції на фрагменті гену антитіла та вектору, або шляхом лігування "затуплених" кінців, якщо відсутні які-небудь сайти рестрикції). Варіабельні області легких та важких ланцюгів антитіл, запропонованих у винаході, можна використовувати для створення повнорозмірних генів антитіл будь-яких ізотипів шляхом вбудовування їх в експресійні вектори, які вже кодують константні області важкого ланцюгу та константні області легкого ланцюгу необхідного ізотипу, таким чином, щоб VH-область була функціонально пов'язана з CH-сегментом(ами) у векторі, а VL-область функціонально пов'язана з CL-сегментом у векторі. В іншому або додатковому варіанті здійснення винаходу рекомбінантний експресійний вектор може кодувати сигнальний пептид, який полегшує секрецію ланцюгу антитіла із клітини-хазяїна. Ген ланцюгу антитіла можна клонувати у векторі таким чином, щоб сигнальний пептид був зв'язаний у рамці зчитування з N-кінцем гену ланцюгу антитіла. Сигнальний пептид може являти собою сигнальний пептид імуноглобуліну або гетерологічний сигнальний пептид (тобто сигнальний 28
ДивитисяДодаткова інформація
Назва патенту англійськоюCompositions and methods for increasing muscle growth
Автори англійськоюBerger, Catrin, Herrmann, Tanja, Lu, Chris, Sheppard, Killy-Ann, Trifilieff, Estelle, Urlinger, Stefanie
Назва патенту російськоюКомпозиции и способы для усиления мышечного роста
Автори російськоюБергер Катрин, Херманн Таня, Лу Крис, Шеппард Келли-Энн, Трифильефф Эстель, Урлингер Стефани
МПК / Мітки
МПК: A61K 39/395, A61P 21/00, C07K 16/28
Мітки: композиції, росту, посилення, способи, м'язового
Код посилання
<a href="https://ua.patents.su/146-102437-kompozici-ta-sposobi-dlya-posilennya-myazovogo-rostu.html" target="_blank" rel="follow" title="База патентів України">Композиції та способи для посилення м’язового росту</a>
Попередній патент: Спосіб комплексної обробки навігаційної інформації
Наступний патент: Спосіб механізованого зварювання з імпульсною подачею плавкого електрода
Випадковий патент: Спосіб виготовлення виробів з цементу або бетону