Спосіб грануляції і одержаний з його допомогою гранулят
Номер патенту: 105395
Опубліковано: 12.05.2014
Автори: Левентісне Хусар Магдолна, Жигмонд Жольт, Уйфалушші Дьйордь, Адьягош Моніка, Тьолдьяші Золтан, Тонка-Надь Петер
Формула / Реферат
1. Спосіб одержання грануляту, що містить мікрокристалічний езетиміб, де:
a) езетиміб розчиняють;
b) розчинений езетиміб осаджують водою, яка необов'язково може містити фармацевтичні ексципієнти, переважно похідні лаурилсульфату, і
c) гранули утворюють з одержаної таким чином суспензії за допомогою розпилення суспензії на поверхню фармацевтичних ексципієнтів.
2. Спосіб виробництва суспензії, яка містить мікрокристалічний езетиміб, де:
a) езетиміб розчиняють;
b) розчинений езетиміб осаджують водою, яка необов'язково може містити фармацевтичні ексципієнти, переважно похідні лаурилсульфату.
3. Спосіб за будь-яким з пп. 1, 2, який відрізняється тим, що розчинник, прийнятний для розчинення езетимібу у високій концентрації, є С1-4аліфатичним спиртом, переважно 2-пропанолом, етанолом, ізопропанолом, метанолом, більш переважно етанолом, ізопропанолом; С1-4кетоном, переважно ацетоном, або ДМСО.
4. Спосіб за будь-яким з пп. 1, 2, який відрізняється тим, що розчинений езетиміб осаджують за допомогою швидкого і однорідного змішування розчину протягом 5-300 секунд, що містить езетиміб і воду, що містить фармацевтичні ексципієнти, та фільтрують через сито з розміром отворів 0,4-0,6 мм.
5. Спосіб за п. 4, який відрізняється тим, що змішування виконують переважно протягом 15-120 секунд, більш переважно 30-60 секунд.
6. Фармацевтична композиція, яка відрізняється тим, що містить гранулят, приготований за способом за п. 1, і необов'язково один або кілька інших активних інгредієнтів, і необов'язково один або кілька фармацевтичних ексципієнтів.
7. Фармацевтична композиція за п. 6, яка відрізняється тим, що додатковий активний інгредієнт є інгібітором ГМГ-КоА, переважно статином, більш переважно симвастатином, аторвастатином або розувастатином.
8. Застосування суспензії, яка відрізняється тим, що містить мікрокристалічний езетиміб за п. 2 для виробництва фармацевтичних композицій, що містять езетиміб.
Текст
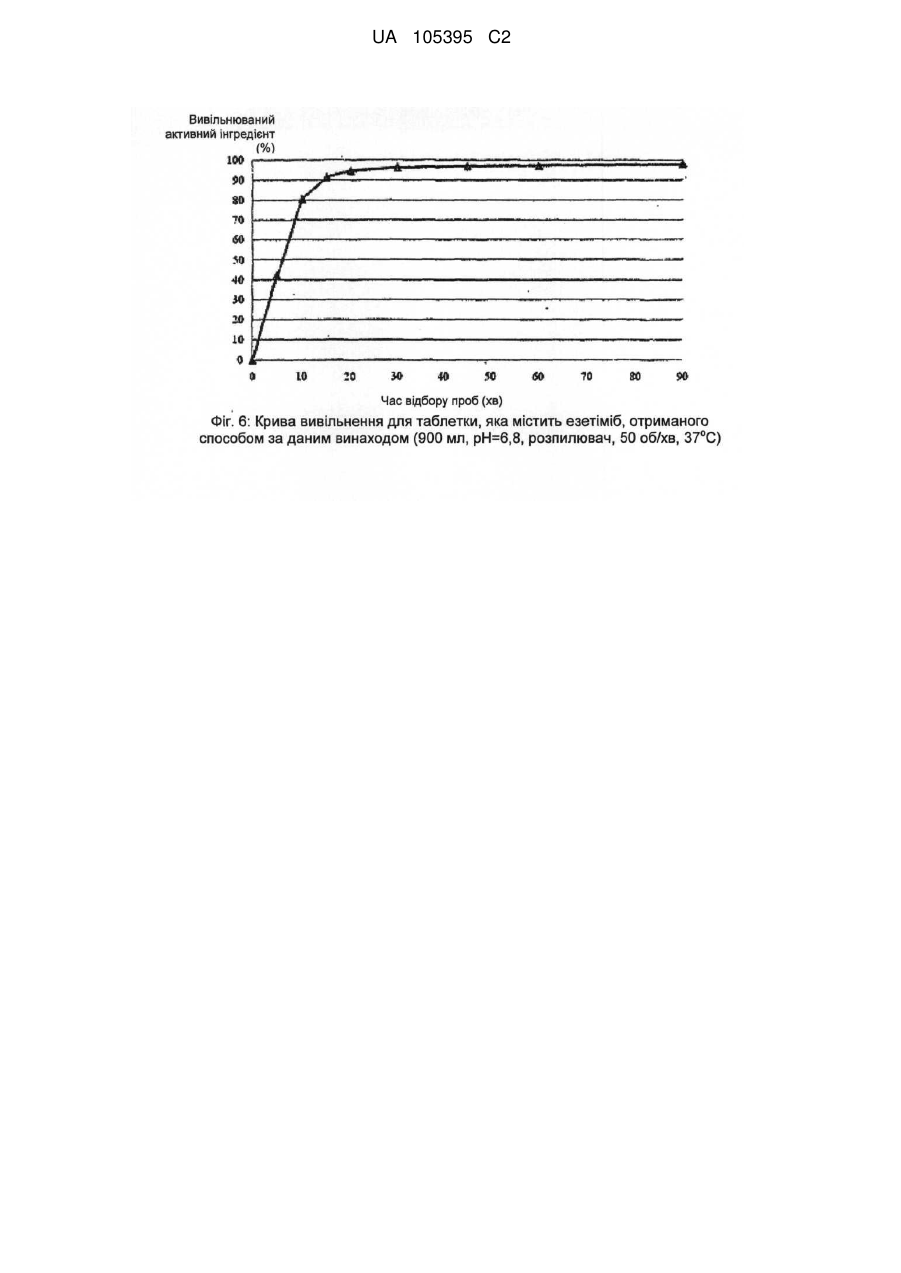
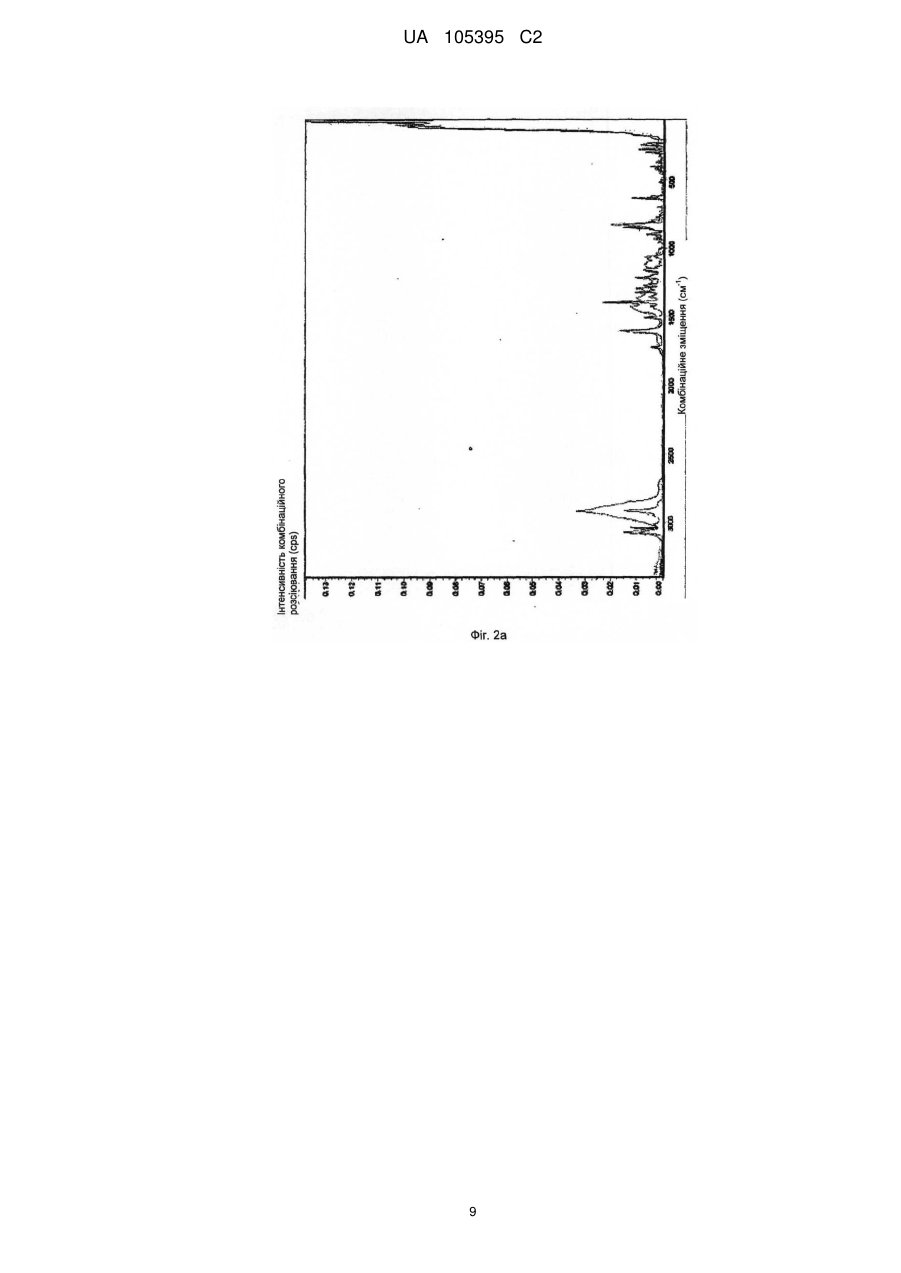
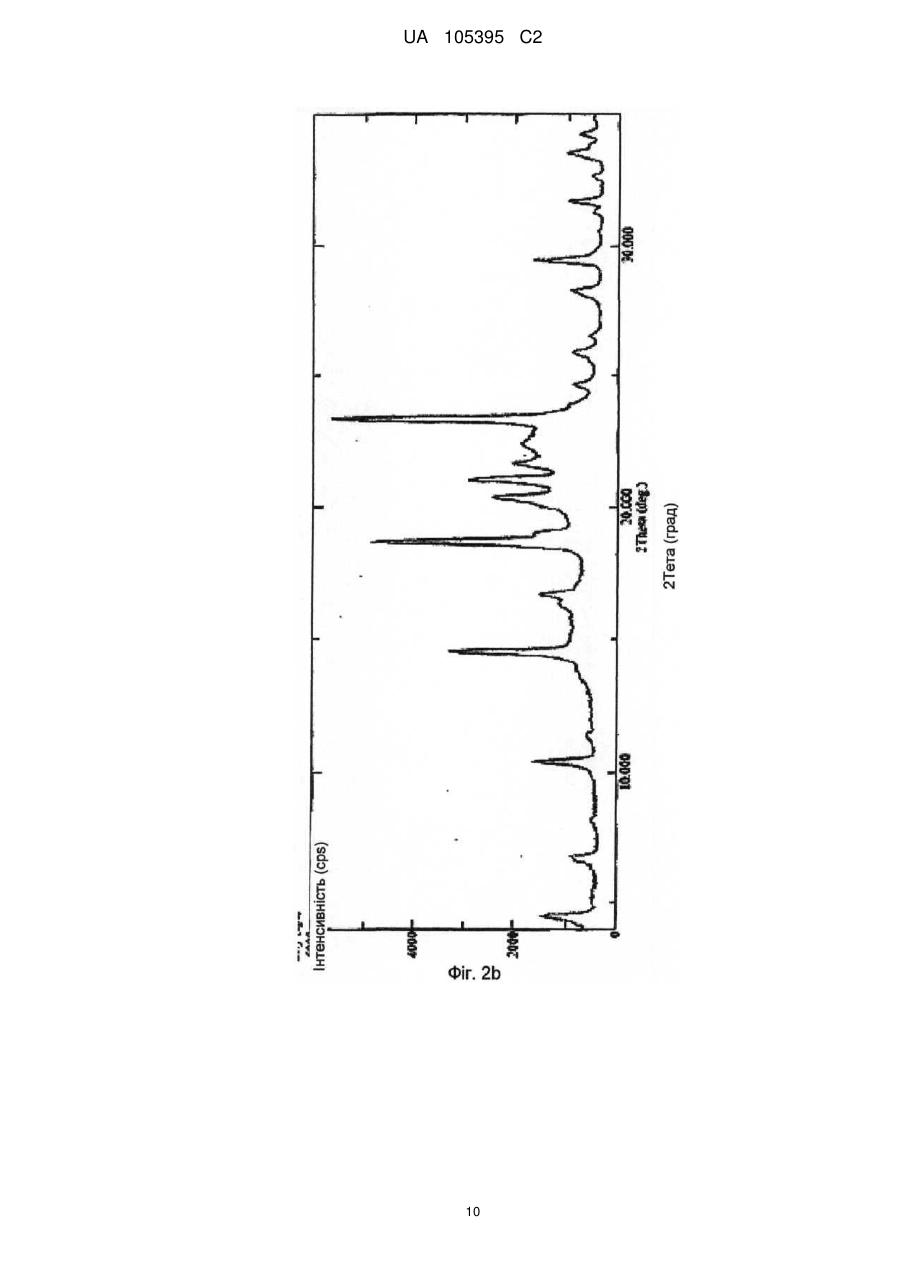
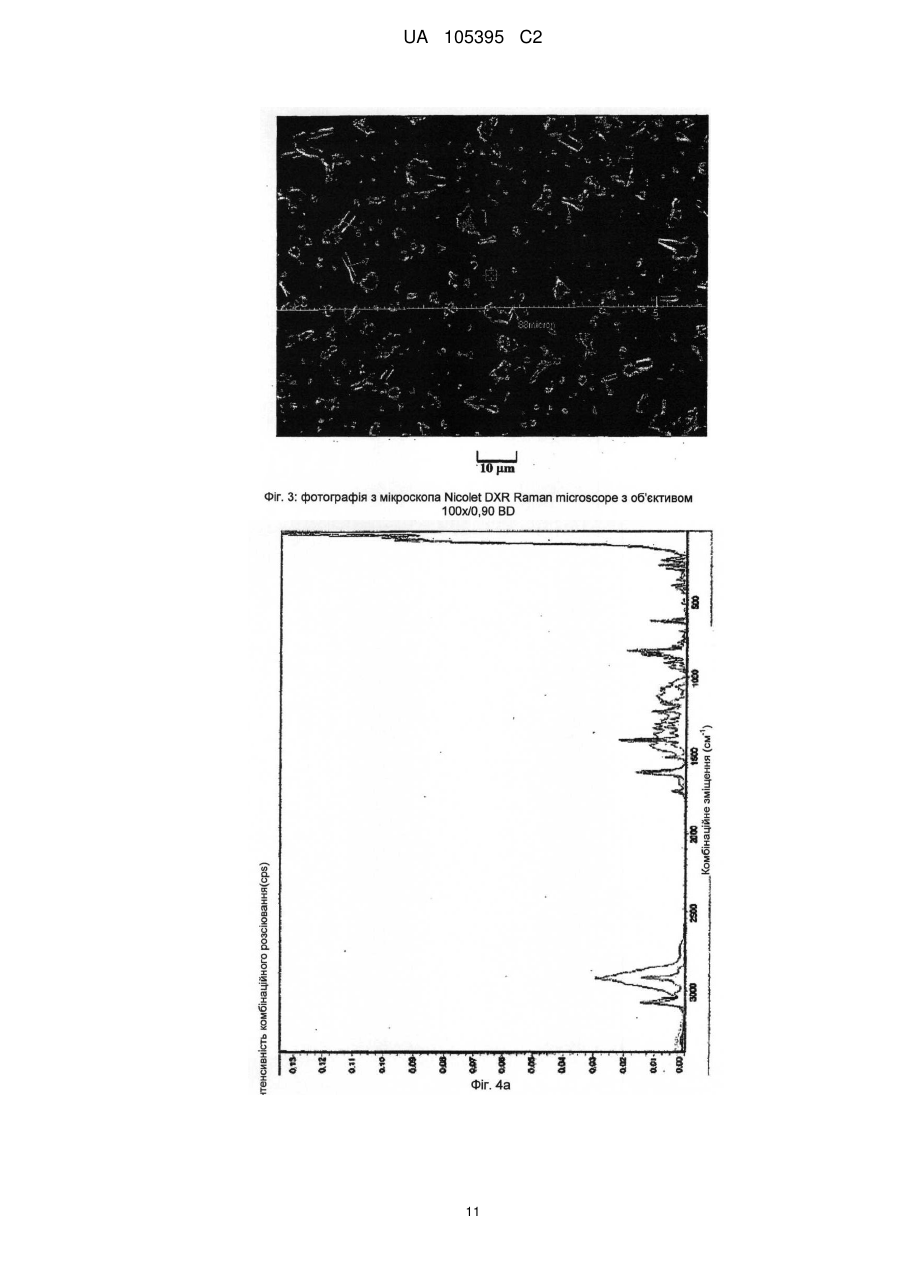
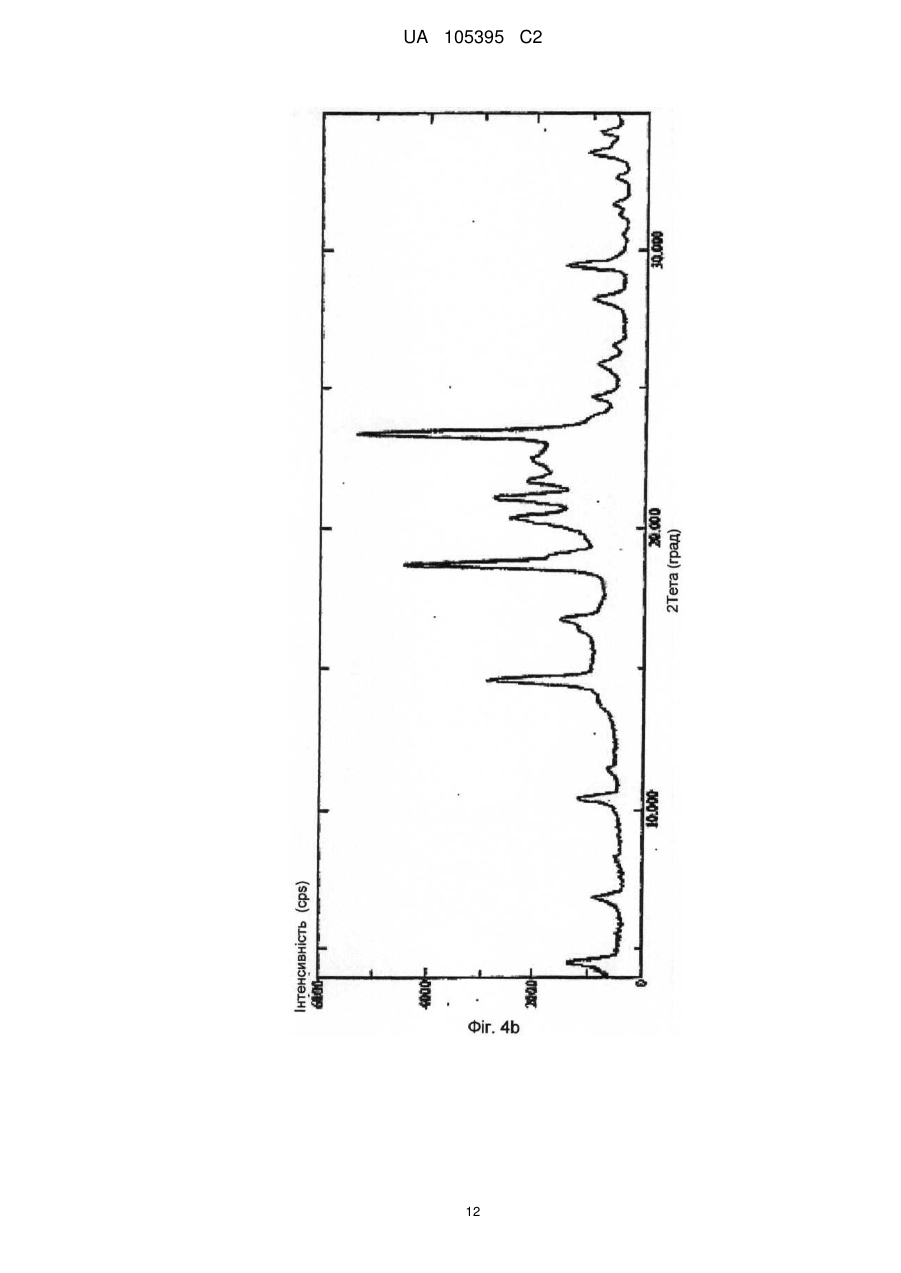
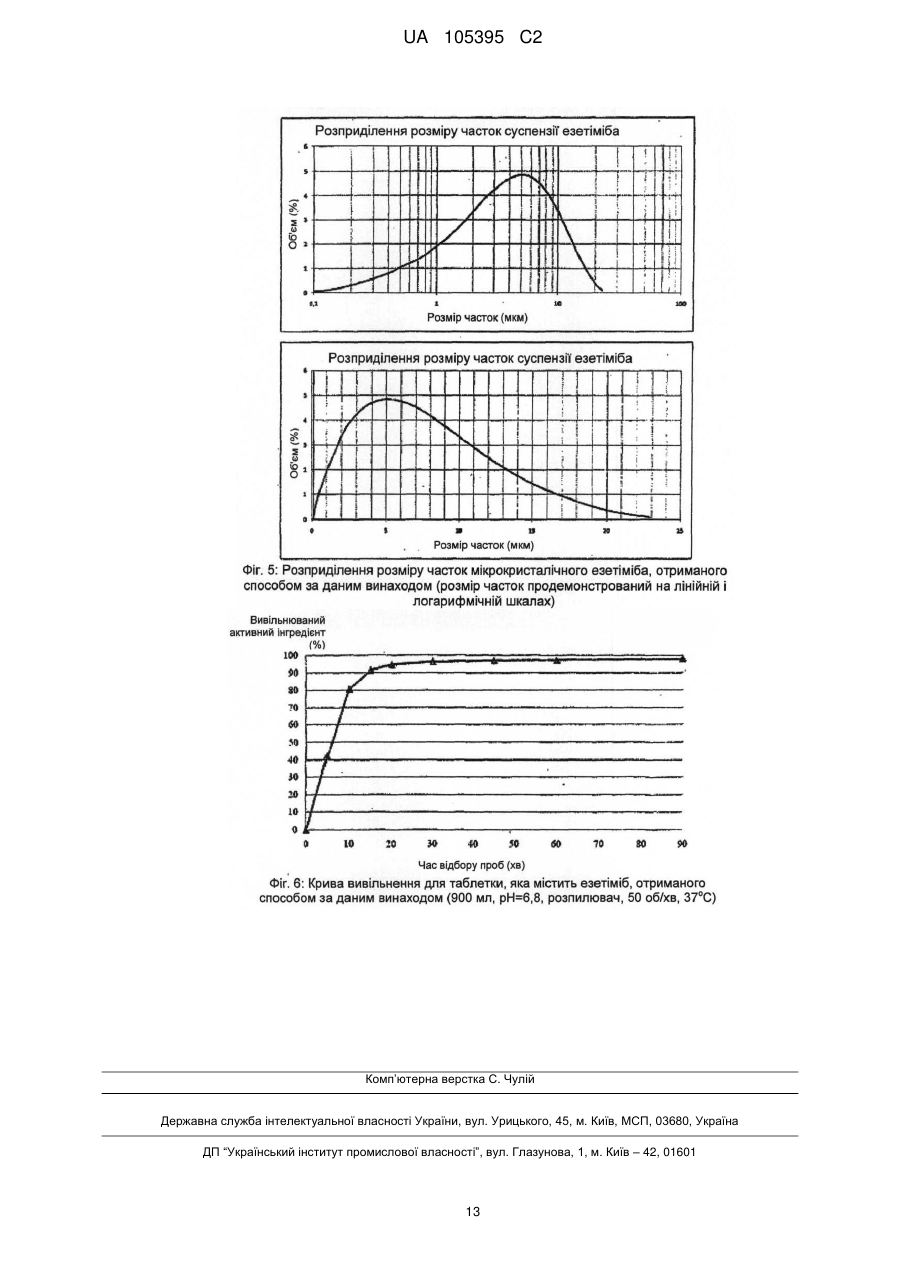
Реферат: Винахід стосується способу одержання грануляту, що містить мікрокристалічний езетиміб, де: a) езетиміб розчиняють, b) розчинений езетиміб осаджують водою, яка при необхідності містить фармацевтичні ексципієнти, переважно похідні лаурилсульфату, і c) грануляти утворюють з одержаної суспензії за допомогою розпилення суспензії на фармацевтичні ексципієнти. UA 105395 C2 (12) UA 105395 C2 UA 105395 C2 Область техніки Об'єктом даного винаходу є промисловий спосіб одержання гранул, що містять сполуки формули (I) 5 10 15 20 25 30 35 40 45 50 , (Езетиміб), причому гранули містять активний інгредієнт в мікрокристалічній формі; а також гранули, одержані за допомогою цього способу і композиції, що містять згадані гранули. Грануляти за даним винаходом містять активний інгредієнт в однорідній фізичній формі і корисні для застосування в фармацевтичних композиціях за рахунок їх профілів вивільнення активної речовини. Езетиміб є селективним інгібітором абсорбції холестеролу, який застосовується в ад'ювантній терапії первинної (гетерозиготної сімейної та несімейної) гіперхолестеринемії в поєднанні з інгібітором ГМГ-КоА-редуктази (гідроксиметилглутарил-коензим А-редуктази) (статин) і додержанням дієти, у разі, якщо однієї статинової монотерапії недостатньо. Відносно фізико-хімічних властивостей, езетиміб є білий кристалічний порошок, нерозчинний у воді і травному соці, але розчинним в органічних розчинниках. Езетиміб є типом активної речовини класу II згідно біофармацевтичної системи класифікації, біодоступність якого залежить від швидкості розчинення активної речовини. Для прояву терапевтичного ефекту необхідно досягти належної біодоступності незважаючи на нерозчинність у воді. Відомі деякі способи, які поліпшують розчинність, які дозволяють домогтися достатньої біодоступності. Рівень техніки Згідно європейської патентної заявки ЕР1799648, аморфний езетиміб адсорбують на полімерному субстраті або одержують в цьому полімері як тверду аморфну дисперсію. Міжнародна заявка на патент WO2008/063766 описує композицію, що містить тверду дисперсію аморфного езетимібу і щонайменше один полімер, що підвищує швидкість розчинення. Згідно одного з аспектів даного винаходу, езетиміб і полімер, що підвищує швидкість розчинення, розчиняють разом в загальному розчиннику або суміші розчинників, і потім суміш випарюють або висушують розпиленням. Згідно іншого аспекту даного винаходу езетиміб диспергують в розплавленому полімері, що підвищує швидкість розчинення, і розплавлену суміш піддають охолодженню туманом. Згідно ще одного аспекту даного винаходу езетиміб і полімер розчиняють в суміші розчинників, де розчинність полімеру менша в менш летучому розчиннику, ніж в іншому розчиннику, тому полімер осідає раніше з розчину протягом випарювання або сушіння розпиленням. Європейська заявка на патент 1849459 описує фармацевтичну композицію, де езетиміб подрібнена спільно щонайменше з одним гідрофільним ексципієнтом, наприклад сахаридом, полісахаридом, крохмалем, прежелатинізованим крохмалем. Після подрібнення розмір часток езетимібу d (0,5) становить менше 25 мкм. Згідно міжнародної заявки на патент WO 2007/011349 біодоступність недостатньо розчинних у воді активних інгредієнтів, наприклад, езетиміб, підвищують за допомогою тісного контактування згаданого інгредієнта з фармацевтично прийнятним цукром. В одному аспекті згадане тісне контактування виконують за допомогою розчинення цукру і гранулювання активного інгредієнта з розчиненим цукром. Заявка на патент США 2007/0275052 описує фармацевтичну композицію, де розмір часток езетимібу d (90) становить менше 25 мкм для досягнення достатньої розчинності. Міжнародна заявка на патент WO 2008/101723 описує фармацевтичну композицію, що містить аморфний езетиміб, рівномірно розподілений в гідрофільному полімері. Міжнародна заявка на патент WO 2009/077573 стосується суспензії, яка містить мікрочастки езетимібу, що має маленькі розміри частинок і велику питому поверхню, причому згадані мікрочастинки езетимібу одержують без процесу мікронізації. Суспензію одержують за допомогою розчинення езетимібу в розчиннику, осадження езетимібу за допомогою антирозчинника, відновлення одержаного осаду, висушування згаданого осаду, потім ресуспендування висушеного осаду в розчиннику і гомогенізації одержаної суспензії. Способи згідно рівня техніки підвищують біодоступність езетимібу за допомогою застосування аморфізації і мікронізації. Згадані способи мають ряд недоліків. 1 UA 105395 C2 5 10 15 20 25 30 3540 45 50 55 60 Аморфна форма через високу вільну енергію схильна, з одного боку, до трансформації в кристалічну форму, що призводить до невідтворюваності і погіршення швидкості розчинення і біодоступності, з іншого боку, хімічна стабільність аморфної форми нижча. Тому для підтримки аморфної форми зазвичай необхідні певні ексципієнти і обробка. Мікронізація, часто застосовується для підвищення швидкості розчинення езетимібу, істотно підвищує вільну енергію активного інгредієнта, приводячи до погіршення хімічної стабільності, що викликає пилоутворення, значну втрату продукту і, внаслідок цього, забруднення навколишнього середовища. Крім того, електростатичний заряд накопичується в мікронізованому активному інгредієнті, і через електростатичне відштовхування між частинками одержують продукт з низькою масовою щільністю, менш прийнятний для подальшої обробки. Швидкість розчинення і біодоступність, прийнятні для одержання фармацевтичних композицій, можуть бути досягнуті в випадку кристалічного езетимібу без процесу мікронізації. Таким чином, можна уникнути підвищення вільної енергії, погіршення хімічної стабільності, накопичення електростатичного заряду в частинках та заподіяння шкоди здоров'ю під дією навколишнього середовища та промислових факторів. Такий спосіб описаний в міжнародній заявці на патент WO2009/077573, елімінує вищезгадані недоліки, але цей важкий багатостадійний спосіб неприйнятний для промислового одержання суспензії, яка містить мікрокристалічний езетиміб, без застосування процесу мікронізації. Крім того, в суспензії розмір часток езетимібу варіює в широких межах при застосуванні способу, розкритого в WO2009/077573, і розподіл розміру часток може бути надзвичайно гетерогенним. Короткий опис винаходу Даний винахід стосується способу одержання грануляту, що містить мікрокристалічний езетиміб, де: а) езетиміб розчиняють; b) розчинений езетиміб осаджують за допомогою води, яка додатково може містити фармацевтичні ексципієнти, переважно похідні лаурилсульфату, і с) гранули утворюють з одержаної суспензії за допомогою розпилення на фармацевтичні ексципієнти. Ще одним аспектом даного винаходу є спосіб одержання суспензії, яка містить мікрокристалічний езетиміб, де а) езетиміб розчиняють; b) розчинений езетиміб осаджують за допомогою води, яка додатково може містити фармацевтичні ексципієнти, переважно похідні лаурилсульфату. Детальний опис винаходу Мета цього винаходу - запропонувати швидкий і простий промисловий спосіб, що підвищує відому незадовільну швидкість розчинення і біодоступність кристалічного езетимібу, і позбавлений розкритих раніше недоліків процесів аморфізації і мікронізації. Цілей винаходу досягають за допомогою способу за цим винаходом. Даний винахід стосується швидкого трьохстадійного способу, прийнятного для промислового одержання; забезпечує вузький діапазон розміру часток, гомогенний розподіл і в результаті, - необхідну швидкість розчинення і біодоступність езетимібу без застосування процесів аморфізації і мікронізації. Даний винахід стосується способу одержання грануляту, що містить мікрокристалічний езетиміб, де а) езетиміб розчиняють; b) розчинений езетиміб осаджують за допомогою води, яка додатково може містити фармацевтичні ексципієнти, переважно похідні лаурилсульфату, і с) грануляти утворюють з одержаної суспензії за допомогою розпилення суспензії на фармацевтичні ексципієнти. У випадку цього винаходу немає необхідності у виділенні, висушуванні або ресуспендуванні езетиміби. Суспензія, одержана за допомогою змішування розчинника, що містить езетиміб, і води, що містить ексципієнти, може бути прямо перетворена в грануляти, що містять мікрокристалічний езетиміб. Несподівано виявилося, що грануляти, які містять мікрокристалічний езетиміб одержують за допомогою розчинення езетимібу в розчиннику, прийнятному для розчинення езетимібу у високій концентрації, потім осадження езетимібу при відповідних умовах за допомогою води, що містить правильно вибрані ексципієнти, і подальшого розпорошення одержаної суспензії безпосередньо на ексципієнти. Одержаний таким чином гранулят забезпечує вивільнення активного інгредієнта з необхідною швидкістю або в чистому вигляді, або у вигляді прийнятного фармацевтичного 2 UA 105395 C2 5 10 препарату, наприклад, таблетки, капсули. Згідно цього винаходу немає необхідності у виділенні езетимібу з суспензії, висушування і ресуспендування на відміну від способу, розкритого в WO2009/077573. Під час виділення та висушування часто утворюються агрегати, при цьому мікрокристалічно активний інгредієнт формує агрегати більшого розміру, знижуючи, таким чином, швидкість розчинення активного інгредієнта і відтворюваність у вивільненні активного інгредієнта. Термін "мікрокристалічний езетиміб" стосується кристалічного езетимібу, який має розмір частинок менше 75 мкм, переважно менше 50 мкм і найпереважніше менше 25 мкм. Стабільність гранулятів, що містять мікрокристалічний езетиміб, дуже хороша і частка домішок підвищується незначно навіть протягом піврічного зберігання. Таблиця 1 показує результати піврічної стабільності. Таблиця 1 Результати по стабільності (езетиміб 10 мг в таблетках) Початковий зразок Зразок 1, 3 місяці Зразок 2, 3 місяці Зразок 3, 3 місяці Зразок 1, 6 місяців Зразок 2, 6 місяців Зразок 3, 6 місяців 15 20 25 30 35 40 45 Загальна домішка (%) 0,13 0,14 0,14 0,18 0,14 0,14 0,19 Вміст (%) 99,4 97,9 98,1 98,2 99,7 99,6 99,5 Несподівано виявилося, що вода сама по собі може бути застосована в способі за даним винаходом. В WO2009/077573 в прикладах 1 і 2 для осадження застосовують нейтральну воду, і домішка у частці езетимібу занадто висока для задоволення фармацевтичних вимог, і не відповідає критеріям для застосування у фармацевтичних композиціях (див. WO2009/077573, таблиця 1). Вищезазначена висока швидкість гідролізу не спостерігається в способі за даним винаходом. Несподівано виявилося, що вміст домішки мікрокристалічного езетимібу, одержаної за допомогою цього трьохстадійного способу із застосуванням нейтральної води, значно нижче допустимого рівня і не підвищується істотно навіть протягом тривалого зберігання (таблиця 1). Розчинники, прийнятні для розчинення езетимібу у високій концентрації, є переважно С 1-4 аліфатичні спирти, переважно 2-пропанол, етанол, ізопропанол, метанол; С1-4 кетони, переважно ацетон, або ДМСО. Розчинники з низькою точкою кипіння легко випаровуються і є особливо прийнятними, особливо етанол і ізопропанол. Водорозчинні ексципієнти відомі фахівцям в галузі техніки інгредієнтами, що збільшують розчинність, поліпшують препарат і підвищують стабільність. Інгредієнти, що підвищують розчинність є такими, без обмеження обсягу цього винаходу: наприклад, в якості поверхнево-активних інгредієнтів можуть бути застосовані наступні: лаурилсульфат натрію, триетаноламінлаурилсульфат, лауреат натрію, цетилсульфат натрію, діоктилсульфосукцинат натрію, полісорбат, водорозчинні гідрофільні полімери, такі як полівінілпіролідон, гідроксипропілметилцелюлоза, гідроксилпропілцелюлоза, полівініловий спирт; сахариди, такі як сахароза, лактоза, манітол, декстроза, сорбіт; полісахариди, такі як альгінат, трагакант, декстрин, мальтодекстрин; полігліколі, такі як поліетиленгліколі, пропіленгліколь. Застосовують такі інгредієнти, що поліпшують препарат, без обмеження обсягу цього винаходу: гідрофільні зв'язуючі речовини, такі як PVP (полівінілпіролідон), HPMC (гідроксипропілметилцелюлоза), HPC (гідроксипропілцелюлоза), HMC (гідроксиметилцелюлоза), PVA (полівініловий спирт), желатинова ксантанова смола, желатинізований крохмаль, прежелатинізований крохмаль, CMC-Na (Na-карбоксиметилцелюлоза). У випадку, коли фармацевтичний препарат на додаток до езетимібу містить активні інгредієнти, схильні до розпаду, такі як активні інгредієнти, чутливі до окислення, та інгредієнти, що підвищують стабільність можуть бути наступними, без обмеження обсягу цього винаходу: регулятори рН, антиокислювачі, такі як сульфіт натрію, аскорбінова кислота, бутилгідроксіанізол, бутилгідрокситолуол, хелатор, такий як лимонна кислота, ЕДТА. Несподівано виявилося, що швидке змішування розчину езетимібу і води, що містить ексципієнти, дає суспензію, що містить мікрокристалічний езетиміб, який не піддається 3 UA 105395 C2 5 10 15 20 25 30 35 40 45 50 55 утворенню агрегатів. З іншого боку спосіб, розкритий в WO2009/077573, що забезпечує частки подібного розміру, займає кілька годин і одержана суспензія чутлива до утворення агрегатів, тому необхідні додаткові стадії. Згідно цього способу два розчини швидко змішують до однорідності за допомогою інтенсивного механічного перемішування. Змішування займає 5-300 секунд, переважно 15-120 секунд, переважніше 30-60 секунд. При необхідності, перемішування виконують протягом подальшої обробки суспензії, і також виявилося, що фільтрування суспензії корисне для подальшої обробки з метою видалення грудочок. Несподівано виявилося, що за допомогою: 1. розчинення езетимібу в розчиннику, переважно в етанолі або ізопропанолі; 2. осадження розчиненого езетимібу за допомогою однієї води; 3. швидкого і однорідного змішування розчину, що містить езетиміб, з водою, яка містить ексципієнти, одержують частинки мікрокристалічного езетимібу з відповідним розподілом розміру часток і діапазоном розміру часток (див. фіг. 5) у порівнянні з такими за способом, розкритим в WO2009/077573 (див. Фіг. 5, 5а, 7 і 8 в WO2009/077573). Крім того, суспензія, одержана згідно даного винаходу, не містить агломератів, і рівень домішок у езетимібу є прийнятним для застосування у фармацевтичних композиціях порівняно з частками езетимібу, розкритими в WO2009/077573. Діапазон розміру часток суспензії не перевищує 5 мкм (d (50)) і 17 мкм (d (90)). Вимірювання виконували на Malvern Mastersizer 2000 після гомогенізації ультразвуком. Згідно іншого аспекту цього винаходу запропоновано спосіб одержання суспензії, яка містить мікрокристалічний езетиміб, де а) езетиміб розчиняють, b) розчинений езетиміб осаджують за допомогою води, яка може додатково містити фармацевтичні ексципієнти, переважно похідні лаурилсульфату. У способі за даним винаходом основне значення мають стадії випарювання розчинника і розпилення одержаної суспензії на тверді фармацевтичні ексципієнти або їх суміші. Суспензія може бути розпорошена на киплячий шар, в якому плавають фармацевтичні ексципієнти. В даному втіленні розпорошення виконують переважно під флюідізаційним гранулятором, де розпорошені розчинники випарюють за допомогою потоку теплого повітря, що вводиться в протитоці зі швидкістю, пропорційною швидкості впуску. Гранули висушують. Суспензія може бути розпорошена за допомогою рідинноструйного млина, де фармацевтичні ексципієнти знаходяться в сильному русі. В даному випадку розпорошення виконують у вакуумному процесорі, обладнаному вакуумним сушінням і додатково засобами індукційної сушки, де розчинники, введені за допомогою розпилення, випарюють з силою пропорційною швидкості потоку введення спрею, з наступним кінцевим висушуванням гранул. В результаті розпорошення і грануляції суспензії кристали езетимібу адгезують на поверхні плаваючих та інтенсивно перемішаних ексципієнтах, і розчинені ексципієнти випадають в осад; в цей час маса є вологою. Розпилення супроводжується висушуванням, де сушильна здатність є оптимальною для підтримки відповідної вологості шару. Після завершення розпилення залишкові розчинники видаляють за допомогою підтримки висушування. Одержаний таким чином висушений гранулят може бути регранульований за допомогою сита з відповідним розміром отворів або перфорованої панелі. Фармацевтичні ексципієнти, на які розпорошують суспензію і згодом випарюють, як описано раніше є інгредієнтами, які підвищують розчинність і швидкість вивільнення езетимібу в травному соці (1), і з іншого боку покращують подальшу обробку одержаного і висушеного грануляту (2). (1) допоміжні речовини, що підвищують розчинність і швидкість вивільнення езетимібу в травних соках, є гідрофільними, розчинними або нерозчинними ексципієнтами, відомі фахівцям в галузі техніки, такі як гідрофільні наповнювачі або розпушувачі. Ці ексципієнти, без обмеження обсягу винаходу, можуть бути наступними: сахариди, такі як сахароза, лактоза, манітол; полісахариди, такі як альгінат, трагакант, крохмаль, похідні крохмалю; целюлоза і похідні целюлози, такі як мікрокристалічна целюлоза, кристалічна целюлоза, гідроксипропілцелюлоза з низьким ступенем заміщення, поперечнозшита карбоксиметилцелюлоза та їх натрієві або калієві солі; інші розпушувачі або суперрозрихлювачі, такі як кросповідон, силікати. (2) Агенти, які покращують подальшу обробку, вибирають з ексципієнтів з кращими фізикохімічними властивостями на стадіях обробки, наступних за грануляцією. Згідно подальшого аспекту цього винаходу запропоновані грануляти, одержані за допомогою цього способу. 4 UA 105395 C2 5 10 15 20 25 30 35 В іншому аспекті цього винаходу запропоновані фармацевтичні препарати, що містять грануляти езетимібу, одержані за допомогою цього способу, і при необхідності один або кілька інших активних інгредієнтів в терапевтично ефективній кількості і при необхідності один або більше фармацевтичних ексципієнтів. Подальша обробка одержаних гранулятів езетимібу може полягати в пресуванні таблеток, інкапсулюванні або гомогенізації з однієї або більше порошкоподібної суміші (сумішей) або гранулятом, за бажанням містить один або більше додатковий інгредієнт (і), і потім пресування в таблетки, інкапсуляції або безпосереднього доопрацювання, наприклад, в саше. Подальша обробка одержаного грануляту езетимібу може бути пресуванням в таблетки з однієї або більше порошкоподібної суміші (сумішей) або гранулятом, що містять додаткові активні інгредієнти, таким чином, що в різних шарах таблетки присутні різні грануляти, і так одержують шаруваті або так звані "сендвіч" - таблетки. Ці способи одержання вимагають застосування різних відомих фармацевтичних ексципієнтів або фармацевтичних технологічних способів. Відомі ексципієнти для пресування в одно або багатошарові таблетки можуть бути різні ексципієнти для таблеток, такі як наповнювачі, розпушувачі, що зв'язують речовини, поверхнево активні речовини, змащувальні речовини, антиадгезивні речовини, речовини, які ковзають, барвники, стабілізатори, наприклад регулятори рН, антиоксиданти, хелатори і т.д. Відомі ексципієнти для інкапсуляції можуть бути наповнювачами, розпушувачами, поверхнево активними речовинами, змащувальними речовинами, антиадгезивними речовинами, стабілізаторами, наприклад, регуляторами рН, антиоксидантами, хелаторами і т.д. Відомі ексципієнти для прямої упаковки порошкоподібної суміші грануляту езетимібу і при необхідності порошкоподібної суміші (сумішей) або гранулятів (наприклад саше), що містять один або кілька активних інгредієнтів, можуть бути поверхнево-активними речовинами, речовинами, що поліпшують смак, стабілізаторами, наприклад регуляторами рН, антиоксидантами, хелаторами і т.д. Ці ексципієнти гомогенізують на одній або декількох стадіях з одержанням таким чином грануляту езетимібу і при необхідності, з порошкоподібною сумішшю (сумішами) або грануляту, що містять один або кілька активних інгредієнтів. Композиція, що містить гранулят езетимібу, може включати додаткові активні інгредієнти, наприклад, інгібітори ГМГ-КоА-редуктази, переважно статини, наприклад ловастатин, симвастатин, правастатин, флувастатин, аторвастатин, пітавастатин, розувастатин. Винахід в подальшому роз'яснено за допомогою наступних прикладів без обмеження обсягу правової охорони до обсягу прикладів. Приклади Приклад 1 Одержання гранулятів і таблеток, що містять езетиміб Композиція з розрахунку на 20000 штук таблеток мг на табл. 10,00 5,00 10,00 35,30 35,30 4,40 Езетиміб Повідон К25 Кроскармелоза натрієва (AcDiSol) Мікрокристалічна целюлоза 102 D-маніт (Perlitol 160C) Лаурилсульфат натрію 96 % етиловий спирт Очищена вода кількість 200,0 г 100,0 г 200,0 г 706,0 г 706,0 г 88,0 г 400 г 1500 г 40 Зовнішня фаза мг на табл 9,00 г 1,00 г Кроскармелоза натрієва (AcDiSol) Стеарат магнію 45 кількість 180,0 г 20,0 г Одержання: езетиміб розчиняють в 96 мас. %, 30-40 °C етанолі, повідон і лаурилсульфат натрію розчиняють у воді. Два розчини змішують протягом 30-60 секунд під дією інтенсивного механічного перемішування і при необхідності, осаджену суспензію фільтрують через сито з розміром отворів 0,4-0,6 мм. Суспензію безперервно перемішують до подальшої обробки. 5 UA 105395 C2 5 10 15 20 Мікрокристалічну целюлозу, D-маніт і кроскармелозу натрію додають в флюідізаційний гранулятор Glatt GPCG 3.1 і попередньо нагрівають за допомогою введення 75 °C повітря з відповідною об'ємною швидкістю потоку протягом 5 хвилин і потім гомогенізують. Вільну від грудочок суспензію розпилюють на фармацевтичні ексципієнти, плаваючі у флюідізаціойному грануляторі, в той час як дисперсію безперервно перемішують за допомогою лабораторної мішалки. Подавальна здатність: 30-50 г/хв, тиск розпилення: 2,5 бар. Одержані гранули висушують за допомогою 75-85 °C вхідного повітря з відповідною об'ємною швидкістю потоку. Висушені гранули регранулюють на перфорованій панелі з розміром отворів 0,63 мм. Гранули змішують в барабанному змішувачі з AcDiSol (гомогенізація займає 5 хвилин) і потім зі стеаратом магнію (гомогенізація займає 2 хвилини). Одержаний гомогенат пресують за допомогою простого таблеткового преса з діаметром 7 мм в таблетки масою 110 мг. Результати тестування продуктів різних фаз: - Розмір часток осадженого кристалічного езетимібу в суспензії становить менше 10 мкм, звичайно від 3 до 6 мкм, виміряних за допомогою каліброваного оптичного мікроскопа (фіг. 1). - Згідно спектроскопії комбінаційного розсіювання і спектрів рентгенівської дифрактограми, кристалічний езетиміб в таблетках в значній мірі вільний від аморфної форми (фіг. 2a, 2b). Профіль розчинення, виміряний за допомогою US Paddle method, можна побачити на Фіг. 6. Приклад 2 Грануляти і таблетки, що містять езетиміб Композиція в розрахунку на 20000 штук таблеток. мг на табл. 10,00 5,00 10,00 35,30 35,30 4,40 Езетиміб Гідроксипропілметилцелюлоза 6ср Кроскармелоза натрієва (AcDiSol) Мікрокристалічна целюлоза 102 D-маніт (Perlitol 160C) Лаурилсульфат натрію 96 % етиловий спирт Очищена вода 25 Зовнішня фаза мг на табл 9,00 1,00 Кроскармелоза натрієва (AcDiSol) Стеарат магнію 30 35 40 45 кількість 200,0 г 100,0 г 200,0 г 706,0 г 706,0 г 88,0 г 400 г 300 г кількість 180,0 г 20,0 г Одержання: езетиміб розчиняють в 96 мас. % етанолу, гідроксипропілметилцелюлозу і лаурилсульфат натрію розчиняють у воді. Два розчини змішують протягом 30-60 секунд під дією інтенсивного механічного перемішування і при необхідності, осаджену суспензію фільтрують через сито з розміром отворів 0,4-0,6 мм. Суспензію безперервно перемішують до подальшої обробки. Мікрокристалічну целюлозу, D-маніт і кроскармелозу натрію додають у вакуумний процесор Zachetta P10-type і гомогенізують протягом 5 хвилин зі швидкістю змішувача 50 об/хв. Безперервно перемішуємо вільну від грудочок суспензію, що зберігається в вакуумі, розпилюємо на порошкоподібну суміш. Подавальна здатність: 200 мл/хв, вакуум: 50 мбар, швидкість змішувача: 100 об/хв, швидкість млина: 700 об/хв, температура сорочки: 75-85 °C. Одержаний гранулят висушують у вакуумному процесорі або флюідізаційній сушці. Висушений гранулят регранулюють на перфорованій панелі з розміром отворів 0,63 мм. Гранулят змішують в барабанному змішувачі з AcDiSol (гомогенізація займає 5 хвилин), а потім зі стеаратом магнію (гомогенізація займає 2 хвилини). Одержаний гомогенат пресують за допомогою простого таблеткового преса з діаметром 7 мм в таблетки масою 110 мг. Результати тестування продуктів різних фаз: - Розмір часток осадженого кристалічного езетимібу в суспензії становить менше 10 мкм, звичайно варіює від 3 до 6 мкм, виміряних за допомогою каліброваного оптичного мікроскопа (фіг. 3). 6 UA 105395 C2 5 - Згідно спектроскопії комбінаційного розсіювання і спектрів рентгенівської дифрактограми кристалічний езетиміб в таблетках в значній мірі вільний від аморфної форми (фіг. 4a, 4b). Приклад 3 Таблетки, що містять езетиміб і симвастатин Композиція в розрахунку на 1000 штук таблеток Комбінація, що містить езетиміб і симвастатин (таблетки 10 і 20 мг) Одержання: композиція грануляту, що містить езетиміб мг на табл. 10,00 5,00 10,00 35,30 35,30 4,40 Езетиміб Гідроксипропілметилцелюлоза 6ср Кроскармелоза натрієва (AcDiSol) Мікрокристалічна целюлоза 102 D-маніт (Perlitol 160C) Лаурилсульфат натрію 96 % етиловий спирт Очищена вода 10 Гранулят, що містить езетиміб, одержують за прикладом 1. Композиція грануляту, що містить симвастатин Симвастатин (+0,02 % БГА(бутилгідроксианізол)) Лимонна кислота Аскорбінова кислота Мікрокристалічна целюлоза Лактоза Кросповідон Прежелатинізований крохмаль Стеарат магнію Лактоза Тальк 15 20 25 30 35 кількість 10,00 г 5,00 г 10,00 г 35,30 г 35,30 г 4,40 г 20 г 75 г мг на табл. 20,00 1,00 1,00 10,00 105,50 10,00 20,00 1,00 28,50 2,00 кількість 20,00 г 1,00 г 1,00 г 10,00 г 105,50 г 10,00 г 20,00 г 1,00 г 28,5 г 2,00 г Симвастатин, що містить 0,02 % бутилгідроксианізол, лимонну кислоту, аскорбінову кислоту, мікрокристалічну целюлозу, лактозу, кросповідон, крохмаль і стеарат магнію гомогенізують і пресують в пластини за допомогою Fitzpatric-компактор із застосуванням тиску 20-100 бар і гранулюють за допомогою подрібнювача Fitzmill (барабан з розміром отворів 1,5 мм, ніж у прямому положенні, 1500 об/хв). Грануляти, що містять езетиміб і симвастатин, AcDiSol (9 мг/табл), стеарат магнію (2 мг/ табл) змішують в барабанному змішувачі і пресують в таблетки-сочевиці по 310 мг за допомогою сочевидновидних прес форм діаметром 10 мм. Ядро таблеток покривають гідроксипропілметилцелюлозою або покривають суспензією, на основі полівінілового спирту, до тих пір, поки маса не збільшиться на 10 мг. Результати тестування продуктів різних фаз: - Розмір часток осадженого кристалічного езетимібу в суспензії становить менше 10 мкм, переважно від 3 до 6 мкм, виміряних за допомогою каліброваного оптичного мікроскопа (фіг. 1). - Згідно спектроскопії комбінаційного розсіювання і спектрами рентгенівських дифрактограм кристалічний езетиміб в таблетках в значній мірі вільний від аморфної форми (фіг. 2a, 2b). ФОРМУЛА ВИНАХОДУ 1. Спосіб одержання грануляту, що містить мікрокристалічний езетиміб, де: a) езетиміб розчиняють; b) розчинений езетиміб осаджують водою, яка необов'язково може містити фармацевтичні ексципієнти, переважно похідні лаурилсульфату, і c) гранули утворюють з одержаної таким чином суспензії за допомогою розпилення суспензії на поверхню фармацевтичних ексципієнтів. 2. Спосіб виробництва суспензії, яка містить мікрокристалічний езетиміб, де: a) езетиміб розчиняють; 7 UA 105395 C2 5 10 15 20 b) розчинений езетиміб осаджують водою, яка необов'язково може містити фармацевтичні ексципієнти, переважно похідні лаурилсульфату. 3. Спосіб за будь-яким з пп. 1, 2, який відрізняється тим, що розчинник, прийнятний для розчинення езетимібу у високій концентрації, є С1-4аліфатичним спиртом, переважно 2пропанолом, етанолом, ізопропанолом, метанолом, більш переважно етанолом, ізопропанолом; С1-4кетоном, переважно ацетоном, або ДМСО. 4. Спосіб за будь-яким з пп. 1, 2, який відрізняється тим, що розчинений езетиміб осаджують за допомогою швидкого і однорідного змішування розчину протягом 5-300 секунд, що містить езетиміб і воду, що містить фармацевтичні ексципієнти, та фільтрують через сито з розміром отворів 0,4-0,6 мм. 5. Спосіб за п. 4, який відрізняється тим, що змішування виконують переважно протягом 15120 секунд, більш переважно 30-60 секунд. 6. Фармацевтична композиція, яка відрізняється тим, що містить гранулят, приготований за способом за п. 1, і необов'язково один або кілька інших активних інгредієнтів, і необов'язково один або кілька фармацевтичних ексципієнтів. 7. Фармацевтична композиція за п. 6, яка відрізняється тим, що додатковий активний інгредієнт є інгібітором ГМГ-КоА, переважно статином, більш переважно симвастатином, аторвастатином або розувастатином. 8. Застосування суспензії, яка відрізняється тим, що містить мікрокристалічний езетиміб за п. 2 для виробництва фармацевтичних композицій, що містять езетиміб. 8 UA 105395 C2 9 UA 105395 C2 10 UA 105395 C2 11 UA 105395 C2 12 UA 105395 C2 Комп’ютерна верстка С. Чулій Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 13
ДивитисяДодаткова інформація
Назва патенту англійськоюNew granulating process and thus prepared granulate
Автори англійськоюTolgyesi, Zoltan, Zsigmond, Zsolt, Ujfalyssy, Gyorgy, Leventiszne Huszar, Magdolna, Tonka-Nagy, Peter, Agyagos, Monika
Автори російськоюТёлдьяши Золтан, Жигмонд Жолт, Уйфалушши Дьйордь, Левентисне Хусар Магдолна, Тонка-Надь Петер, Адьягош Моника
МПК / Мітки
МПК: A61K 9/16, A61P 3/06, A61K 31/397
Мітки: гранулят, допомогою, грануляції, одержаний, спосіб
Код посилання
<a href="https://ua.patents.su/15-105395-sposib-granulyaci-i-oderzhanijj-z-jjogo-dopomogoyu-granulyat.html" target="_blank" rel="follow" title="База патентів України">Спосіб грануляції і одержаний з його допомогою гранулят</a>
Попередній патент: Дорожнє захисне огородження
Наступний патент: Термостійке покриття
Випадковий патент: Пускова муфта