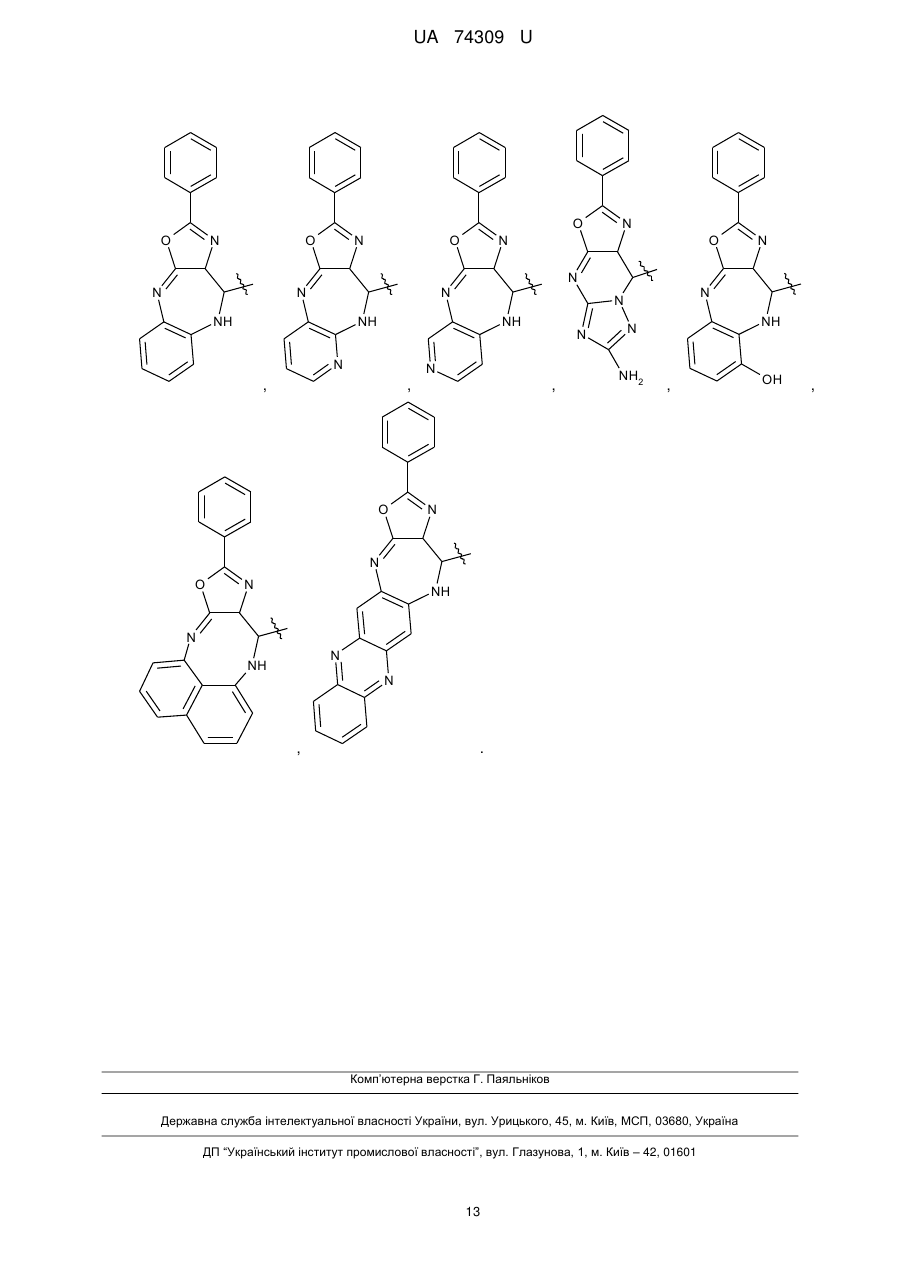
Органічні люмінофори
Номер патенту: 74309
Опубліковано: 25.10.2012
Автори: Лисова Інна Вікторівна, Дистанов Віталій Баламирович, Петров Сергій Олександрович
Формула / Реферат
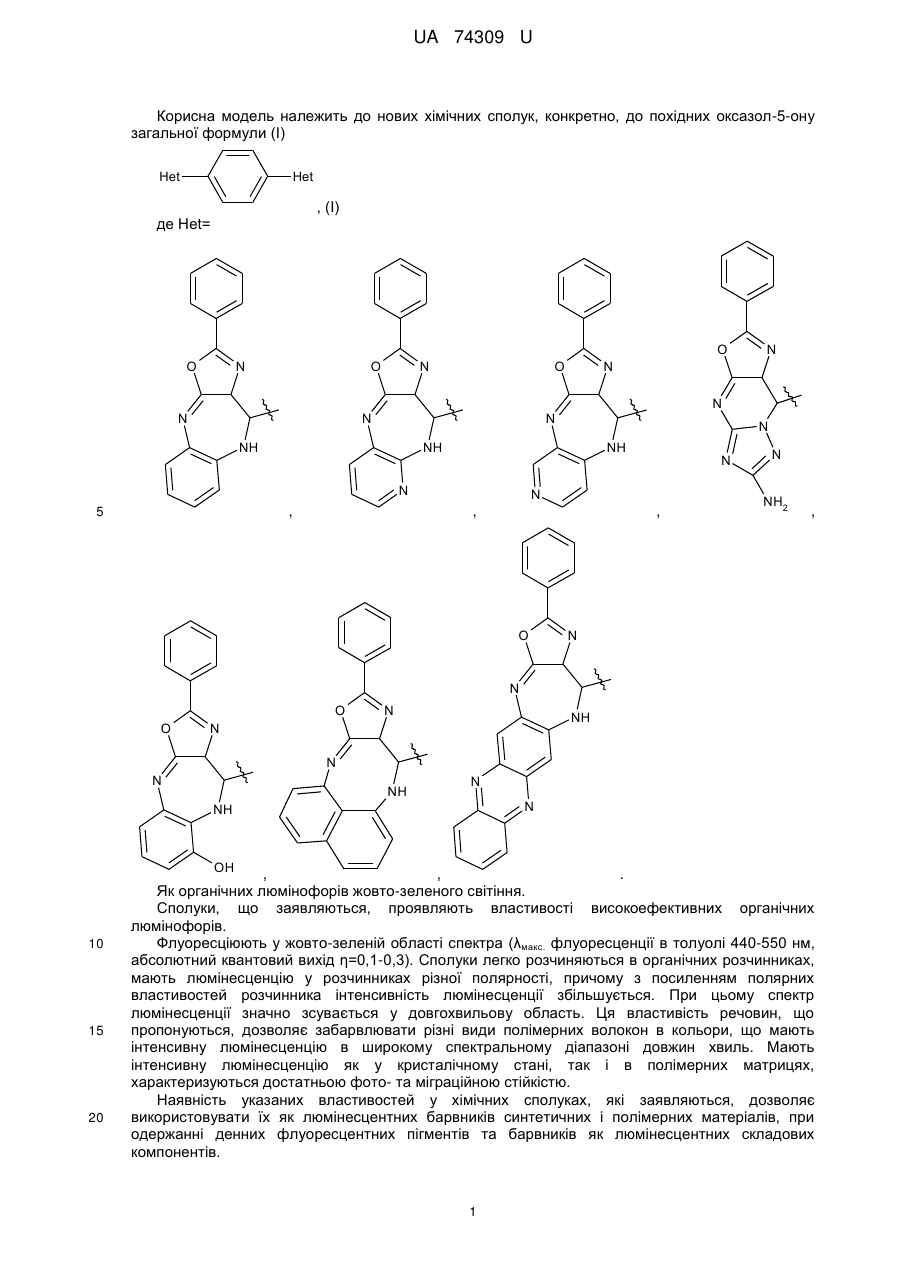
Органічні люмінофори, які належать до класу оксазол-5-онів, жовто-зеленого світіння, стійкі до УФ-випромінювання, які відрізняються тим, що вони є похідними 1,4-біс-2-фенілциннамоїліденоксазол-5-ону загальної формули (І) та містять додаткові ароматичні або гетероциклічні структури.
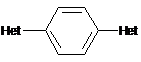 , (І)
, (І)
де Het=
 ,
,  ,
,  ,
, 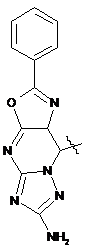 ,
,  ,
, 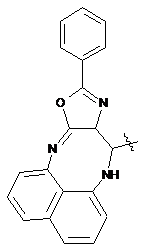 ,
, 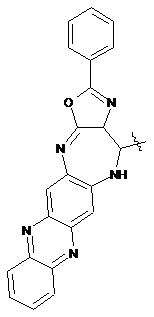 .
.
Текст
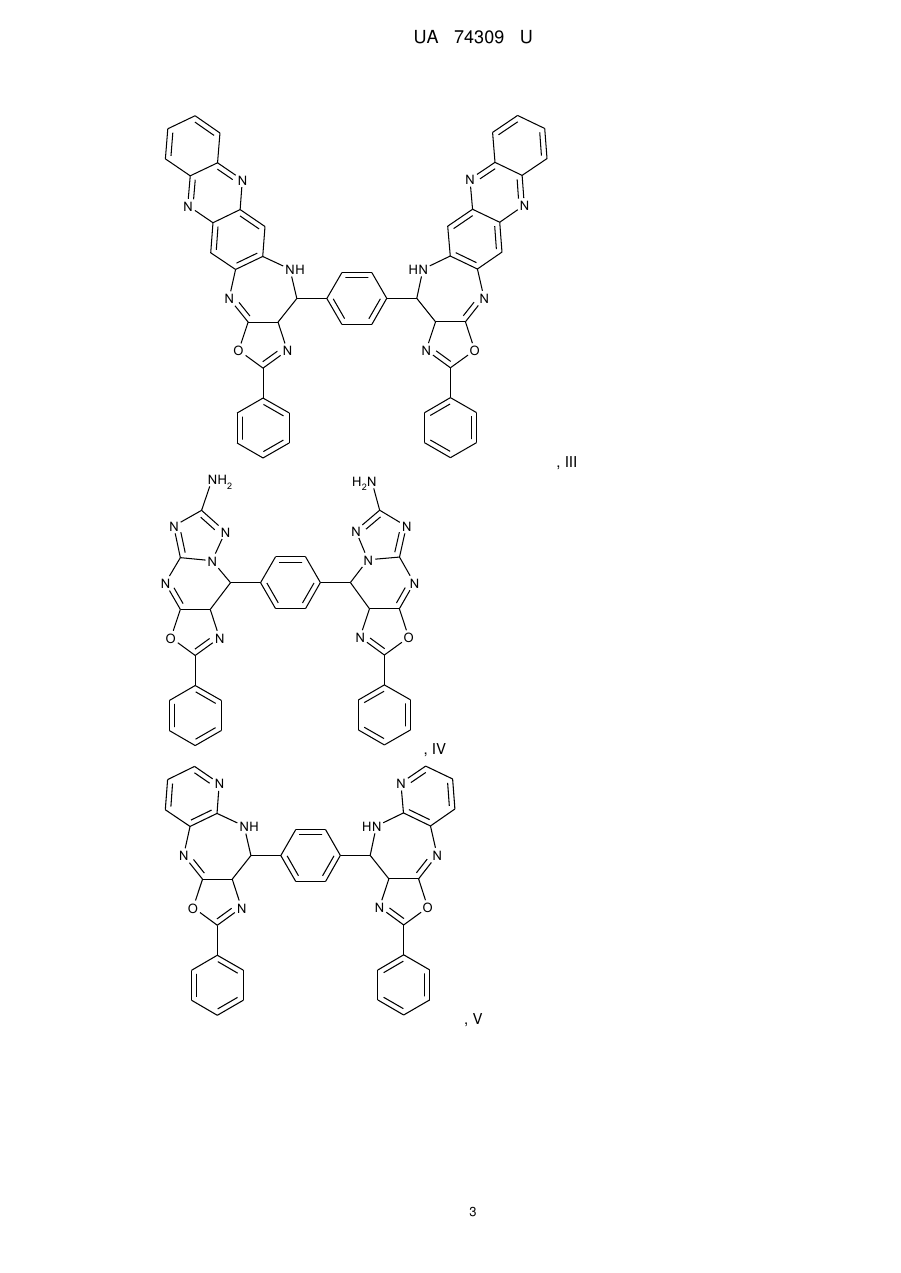
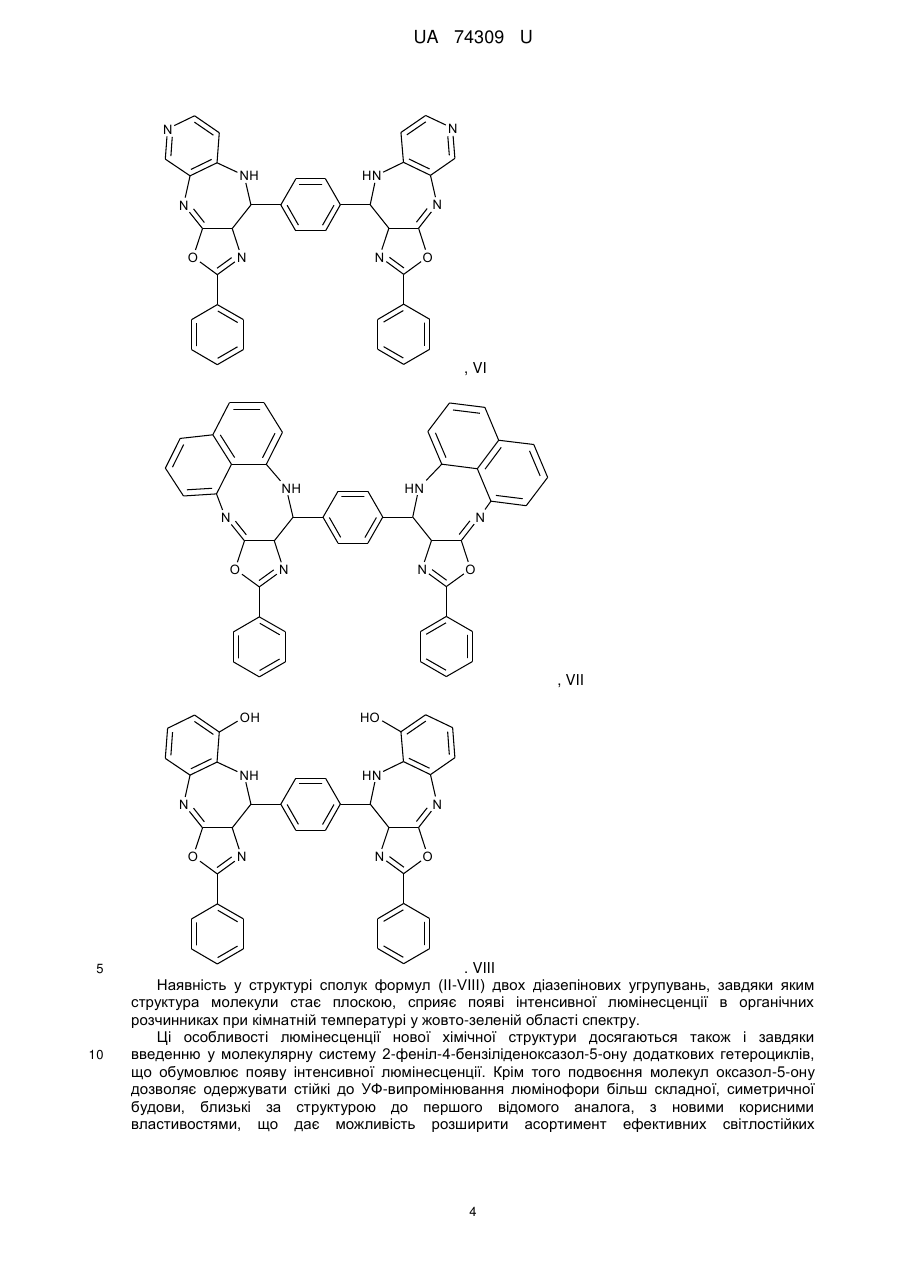
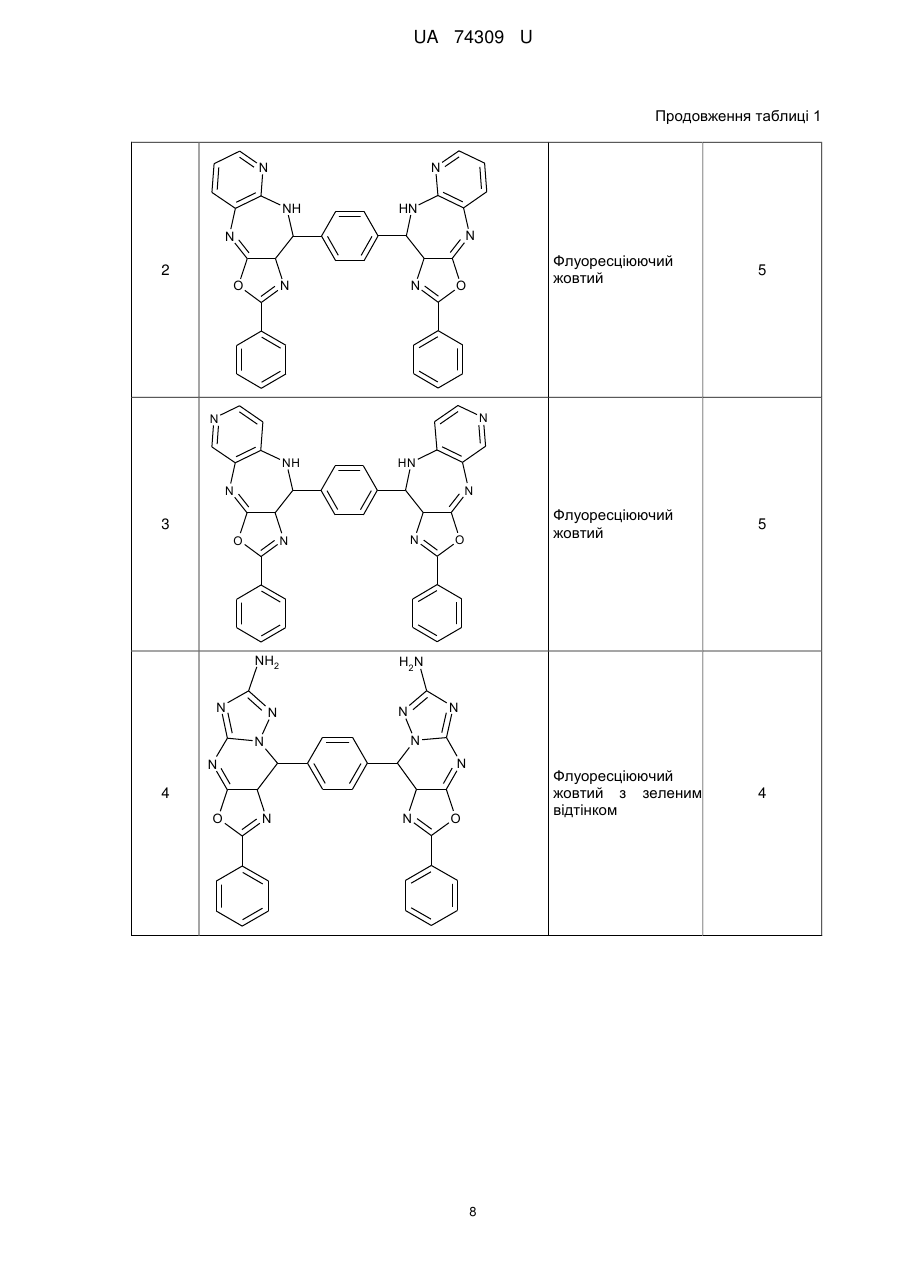
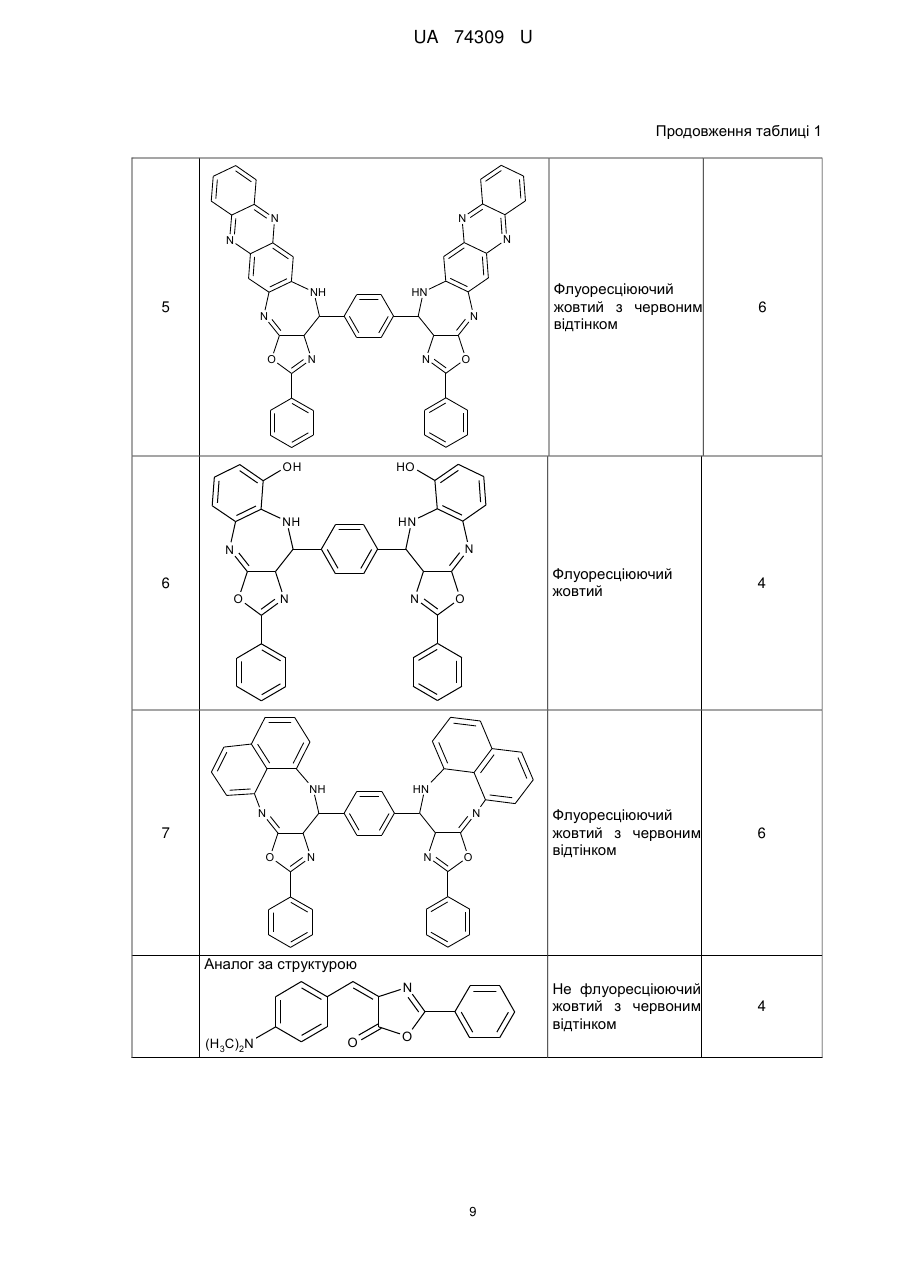
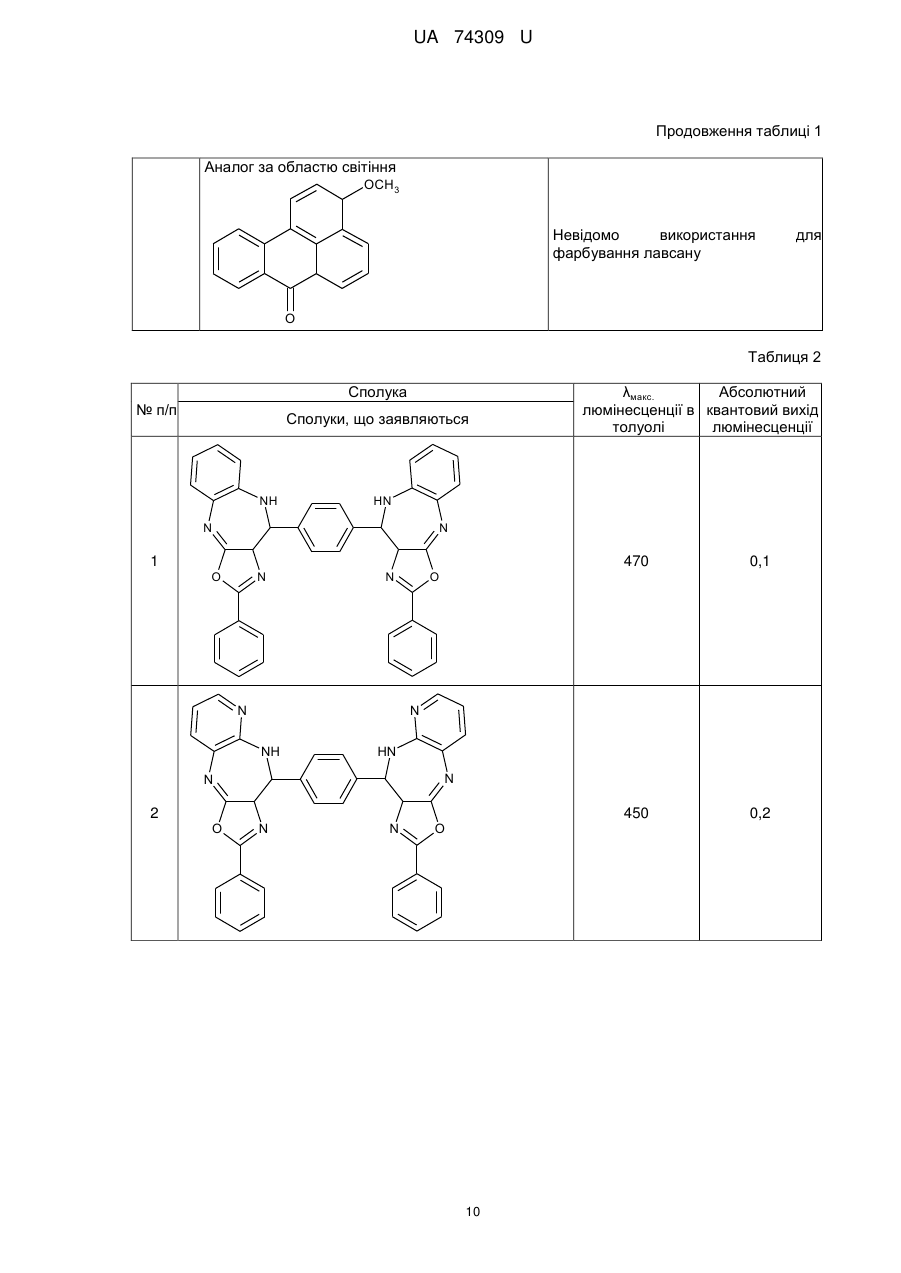
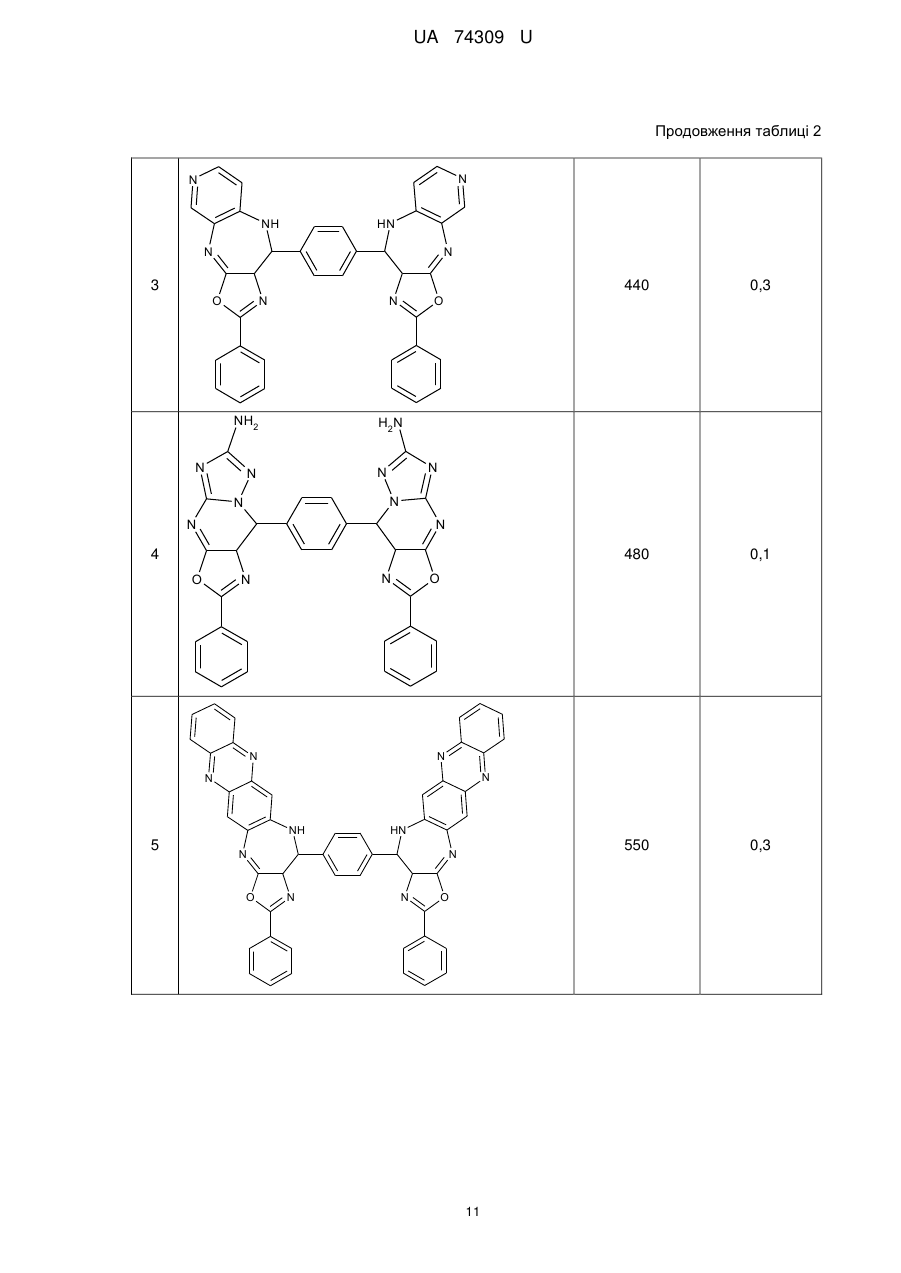
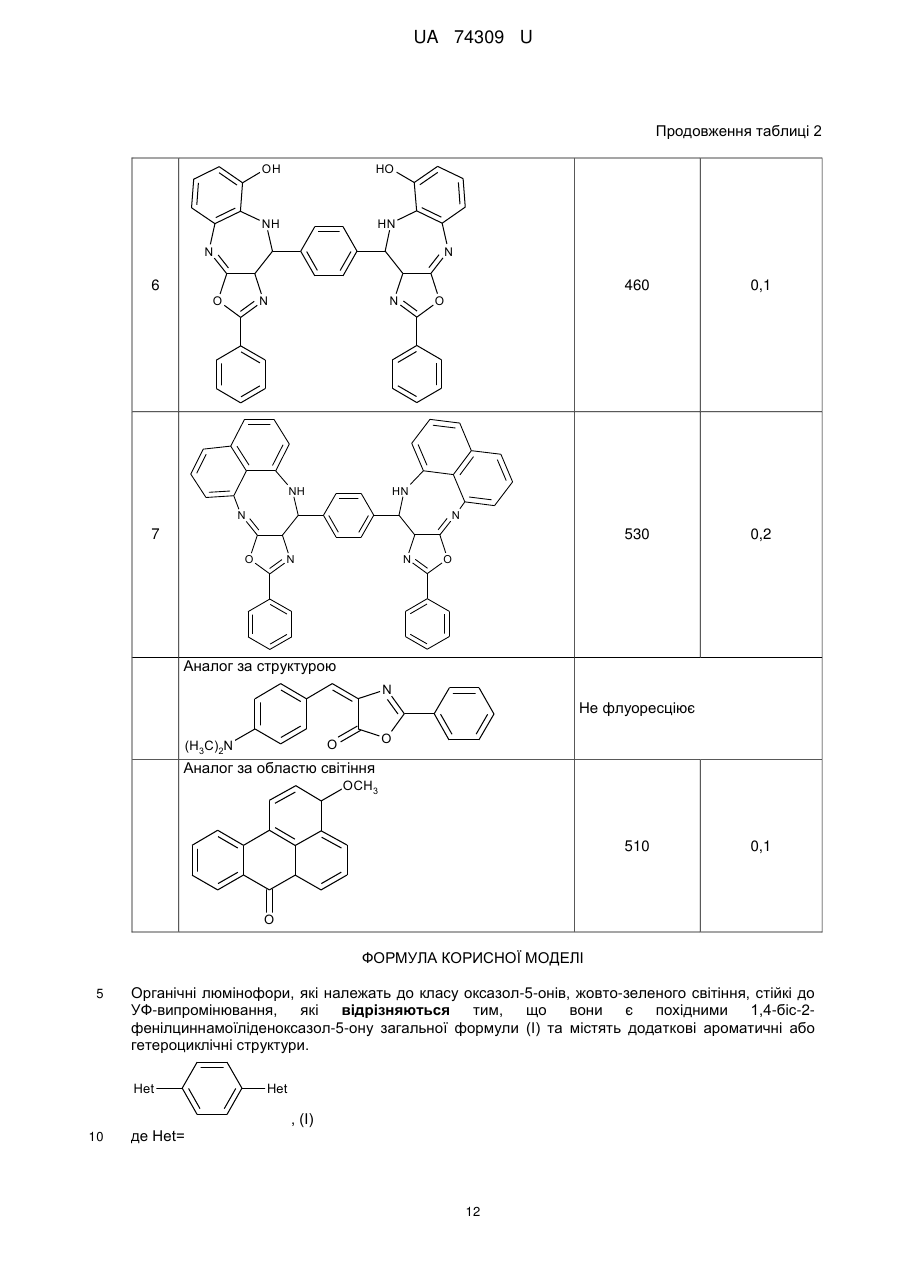
Реферат: Органічні люмінофори належать до класу оксазол-5-онів, жовто-зеленого світіння, стійкі до УФвипромінювання. Вони є похідними 1,4-біс-2-фенілциннамоїліденоксазол-5-ону загальної формули (І) та містять додаткові ароматичні або гетероциклічні структури. UA 74309 U (54) ОРГАНІЧНІ ЛЮМІНОФОРИ UA 74309 U UA 74309 U Корисна модель належить до нових хімічних сполук, конкретно, до похідних оксазол-5-ону загальної формули (І) Het Het , (І) де Het= O O N O N N O N N NH NH N , 5 N N NH N N , , O N N N NH2 , N N O O N NH N N N NH N N NH OH 10 15 20 , , . Як органічних люмінофорів жовто-зеленого світіння. Сполуки, що заявляються, проявляють властивості високоефективних органічних люмінофорів. Флуоресціюють у жовто-зеленій області спектра (λмакс. флуоресценції в толуолі 440-550 нм, абсолютний квантовий вихід η=0,1-0,3). Сполуки легко розчиняються в органічних розчинниках, мають люмінесценцію у розчинниках різної полярності, причому з посиленням полярних властивостей розчинника інтенсивність люмінесценції збільшується. При цьому спектр люмінесценції значно зсувається у довгохвильову область. Ця властивість речовин, що пропонуються, дозволяє забарвлювати різні види полімерних волокон в кольори, що мають інтенсивну люмінесценцію в широкому спектральному діапазоні довжин хвиль. Мають інтенсивну люмінесценцію як у кристалічному стані, так і в полімерних матрицях, характеризуються достатньою фото- та міграційною стійкістю. Наявність указаних властивостей у хімічних сполуках, які заявляються, дозволяє використовувати їх як люмінесцентних барвників синтетичних і полімерних матеріалів, при одержанні денних флуоресцентних пігментів та барвників як люмінесцентних складових компонентів. 1 UA 74309 U 5 10 15 20 25 30 35 Сполуки загальної формули (І), що заявляються, та їх люмінесцентні властивості у літературі не виявлені. Відомий люмінофор жовто-зеленого світіння - 3-метоксибензантрон [1], який випускається промисловістю (люмінор жовтий 2З 495РТ). Максимум люмінесценції люмінофора у толуолі 495 нм, у діоксані – 510 нм і дуже близький за своїм положенням (за областю світіння) до максимумів сполук, що заявляються. Цей люмінофор широко використовується при одержанні денних флуоресцентних пігментів, при забарвлені пластичних мас та шовку 3-метоксибензантрон взято нами як кращий флуоресцентний аналог за областю світіння. Недоліком цього люмінофору являється невисокий квантовий вихід люмінесценції в толуолі (всього лише η≈0,1), що значно обмежує використання цього люмінофору в тих областях, де потрібна наявність інтенсивної люмінесценції у розчинах, наприклад, у спектрозміщуючих композиціях органічних сцинтиляторів, у магнітно-люмінесцентній дефектоскопії і т.п. Серед 2-арил-4-ариліденоксазол-5-онів відомий люмінофор жовтогарячого світіння - 4-(4диметиламінобензиліден)2-фенілоксазол-5-он [2], є найбільш близьким до запропонованого. Максимум люмінесценції цієї сполуки у кристалічному стані складає 630 нм. В органічних розчинниках при кімнатній температурі люмінесценція відсутня. Раніше довгий час цей люмінофор вважався кращим люмінофором жовтогарячого світіння у твердому стані, що дозволяло використовувати його як люмінесцентної складової компоненти денних флуоресцентних пігментів. Крім того, він знайшов використання в люмінесцентній дефектоскопії електровакуумних приладів, при одержанні люмінесцентних мічених пісків. Люмінофор одержують конденсацією гіпурової кислоти та 4-диметиамінобензальдепду в оцтовому ангідриді в присутності безводного оцтовокислого натрію в атмосфері вуглекислого газу. Недоліком цього люмінофору являється світіння тільки у твердому стані і відсутність люмінесценції при кімнатній температурі в органічних розчинниках, що обмежує області використання цієї сполуки як люмінофора. Слід відзначити, що навіть у твердому стані інтенсивність люмінесценції відомого люмінофора порівняно невелика, що також зменшує можливості його практичного використання. Задача корисної моделі, що пропонується, складається у пошуку серед похідних оксазол-5ону нових сполук з більш високою інтенсивністю світіння у органічних розчинах при кімнатній температурі і з більшою світлостійкістю (стійкістю до ультрафіолетового світла). Задача, що поставлена, досягається органічними люмінофорами, які відносяться до класу оксазол-5-онів, жовто-зеленого світіння, стійкими до УФ-випромінювання, що є похідними 1,4біс-2-фенілциннамоїліденоксазол-5-ону та містять додаткові ароматичні або гетероциклічні структури (II-VIII). NH HN N N O N N O , II 2 UA 74309 U N N N N HN NH N N O N N O , III NH2 N H2N N N N N N N N O N N O , IV N N NH HN N N O N N O ,V 3 UA 74309 U N N HN NH N N O N N O , VI HN NH N N O N N O , VII OH HO NH HN N N O 5 10 N N O . VIII Наявність у структурі сполук формул (II-VIII) двох діазепінових угрупувань, завдяки яким структура молекули стає плоскою, сприяє появі інтенсивної люмінесценції в органічних розчинниках при кімнатній температурі у жовто-зеленій області спектру. Ці особливості люмінесценції нової хімічної структури досягаються також і завдяки введенню у молекулярну систему 2-феніл-4-бензіліденоксазол-5-ону додаткових гетероциклів, що обумовлює появу інтенсивної люмінесценції. Крім того подвоєння молекул оксазол-5-ону дозволяє одержувати стійкі до УФ-випромінювання люмінофори більш складної, симетричної будови, близькі за структурою до першого відомого аналога, з новими корисними властивостями, що дає можливість розширити асортимент ефективних світлостійких 4 UA 74309 U 5 10 15 20 25 30 35 40 45 50 55 60 люмінофорів жовто-зеленого світіння, а також області використання люмінофорів оксазолонового ряду. Сполуки, що пропонуються, не мають недоліків, що притаманні першому відомому аналогу (аналогу за структурою) і, на відміну від останнього, можуть бути використані як ефективні люмінофори жовто-зеленого світіння в органічних розчинниках при кімнатній температурі. Наявність у нових сполук інтенсивної люмінесценції у розчинах, разом з яскравим забарвленням при денному світлі, дозволяє використовувати їх для люмінесцентного забарвлення полімерних матеріалів, зокрема поліефірних волокон (лавсану). Для цього застосування може бути використаний порівняно вузький круг барвників, що мають поруч з великою яскравістю, значну термостійкість. Це важливо тому що забарвлення ведеться при порівняно високій температурі. Асортимент флуоресцентних барвників для поліефірних матеріалів дуже обмежений. У зв'язку з цим пошук нових люмінофорів для забарвлення лавсану є дуже актуальним. Люмінофори бісоксазолонового ряду, що заявляються, можуть бути використані при забарвленні лавсану в умовах високотемпературного забарвлення (тобто ці речовини мають необхідну термостійкість). Люмінесцентні барвники вводяться в кількості 1,5 % від маси лавсану, Колористичні характеристики забарвлених волокон лавсану наведено у таблиці 1. Показники стійкості забарвлення волокон лавсану до світла виражено в балах за відношенням до загальноприйнятої 8-бальної оцінки барвників. Сполуки загальної формули І одержують конденсацією бензен-1,4-біс-2-феніл-4циннамоіліденоксазол-5-ону і відповідних о-діамінів в диметилформаміді. Корисна модель пояснюється наступними прикладами. Приклад 1. Одержання біс-2-феніл-10-[(Е)-2-фенілетенил]-9Н-оксазоло[5,4-b][1,5]бензодіазепіну Суміш бензен-1,4-біс-2-феніл-4-циннамоіліденоксазол-5-ону 3 (0.007 моль), о-фенілендіаміну (0.02 моль), 30 см ДМФА кип'ятять 17 годин. Охолоджують 3 до кімнатної температури та виливають в 200 см води. Осад відфільтровують, промивають водою, сушать. Отриманий продукт очищують перекристалізацією з дихлоретану, після цього хроматографують на колонці безперервної дії (Адсорбент - Аl2О3, елюент - діоксан). Осад, який випав, сушать в сушильній шафі. Вихідні дані: вихід 3,2 г (80 %). Т. пл. 311 °C. Знайдено, %: С 76.43, Н 4.1, N 14.02. C38H24N6O2 Обчислено, %: С 76.51, Н 4.03, N 14.09. λмакс. люмінесценції у толуолі - 470 нм Абсолютний квантових вихід люмінесценції - 0,1 Приклад 2. Одержання біс-2-феніл-10-[(Е)-2-фенілетенил]-9Н-оксазоло[5,4-е]піридо-[3,2b][1,4]діазепіну Суміш бензен-1,4-біс-2-феніл-4-циннамоіліденоксазол-5-ону (0.004 моль), 2,33 діамінопіридину (0.01 моль), 30 см ДМФА кип'ятять 17 годин. Охолоджують до кімнатної 3 температури та виливають в 200 см води. Осад відфільтровують, промивають водою, сушать. Отриманий продукт очищують перекристалізацією з дихлоретану, після цього хроматографують на колонці безперервної дії (Адсорбент - Аl2О3, елюент-діоксан). Осад, який випав, сушать в сушильній шафі. Вихідні дані: вихід 3,0 г (75 %). Т. пл. 346 °C. Знайдено, %: С 73.36, Н 3.50, N 17.95. C38H22N8O2 Обчислено, %: С 73.31, Н 3.54, N 18.01. λмакс. люмінесценції у толуолі - 450 нм Абсолютний квантових вихід люмінесценції - 0,2 Приклад 3. Одержання 2-феніл-10-[(Е)-2-фенілетенил]-9Н-оксазоло[5,4-е]піридо[4,3b][1,4]діазепину Суміш бензен-1,4-біс-2-феніл-4-циннамоіліденоксазол-5-ону (0.004 моль), 3,43 діамамінопіридину (0.01 моль), 30 см ДМФА кип'ятять 17 годин. Охолоджують до кімнатної 3 температури та виливають в 200 см води. Осад відфільтровують, промивають водою, сушать. Отриманий продукт очищують перекристалізацією з дихлоретану, після цього хроматографують на колонці безперервної дії (Адсорбент - Аl2О3, елюент - діоксан). Осад, який випав, сушать в сушильній шафі. Вихідні дані: вихід 2,9 г (73 %). Т. пл. 342 °C. Знайдено, %: С 73.42, Н 3.61, N 18.09. C38H22N8O2 Обчислено, %: С 73.31, Н 3.54, N18.01. λмакс. люмінесценції у толуолі - 440 нм 5 UA 74309 U 5 10 15 20 25 30 35 40 45 50 55 60 Абсолютний квантових вихід люмінесценції - 0,3 Приклад 4. Одержання біс-6-аміно-4,9-дигідро-2-феніл-9-[(Е)-2-фенілетенил]-оксазоло[5,4d][1,2,4]тріазоло[1,5-а]піримідину Суміш бензен-1,4-біс-2-феніл-4-циннамоіліденоксазол-5-ону (0.0033 моль), 3,5-діаміно-1,2,43 тріазолу (0.08 моль), 30 см ДМФА кип'ятять 17 годин. Охолоджують до кімнатної температури 3 та виливають в 200 см води. Осад відфільтровують, промивають водою, сушать. Отриманий продукт очищують перекристалізацією з дихлоретану, після цього хроматографують на колонці безперервної дії (Адсорбент - Аl2О3, елюент-діоксан). Осад, який випав, сушать в сушильній шафі. Вихідні дані: вихід 2,7 г (69 %). Т. пл. 351 °C. Знайдено, %: С 62.33, Н 4.10, N 29.11. C30H18N12O2 Обчислено, %: С 62.28, Н 3.11, N 29.07. λмакс. люмінесценції у толуолі - 480 нм Абсолютний квантових вихід люмінесценції - 0,1 Приклад 5. Одержання біс-2-феніл-14-[(Е)-2-фенілетенил]-13Н-оксазоло[4',5':6,7] [1,4]діазепіно[2,3-b]феназину Суміш бензен-1,4-біс-2-феніл-4-циннамоіліденоксазол-5-ону (0.006 моль), 2,33 діамінофеназину (0.014 моль), 30 см ДМФА кип'ятять 17 годин. Охолоджують до кімнатної 3 температури та виливають в 200 см води. Осад відфільтровують, промивають водою, сушать. Отриманий продукт очищують перекристалізацією з дихлоретану, після цього хроматографують на колонці безперервної дії (Адсорбент - Аl2О3, елюент - діоксан). Осад, який випав, сушать в сушильній шафі. Вихідні дані: вихід 3,6 г (64 %). Т. пл. 371 °C. Знайдено, %: С75.09, Н 3.47, N 17.53. C50H28N10O2 Обчислено, %: С 75.00, Н 3.50, N 17.50. λмакс., люмінесценції у толуолі - 550 нм Абсолютний квантових вихід люмінесценції - 0,3 Приклад 6. Одержання біс-2-феніл-14-[(Е)-2-фенілетенил]-13Н-оксазоло[4',5':6,7] [1,4]діазепіно[2,3]толуолу Суміш бензен-1,4-біс-2-феніл-4-циннамоіліденоксазол-5-ону (0.006 моль), 2,33 діамінотолуолу (0.014 моль), 30 см ДМФА кип'ятять 17 годин. Охолоджують до кімнатної температури та виливають в 200 см води. Осад відфільтровують, промивають водою, сушать. Отриманий продукт очищують перекристалізацією з дихлоретану, після цього хроматографують на колонці безперервної дії (Адсорбент - Аl2О3, елюент- діоксан). Осад, який випав, сушать в сушильній шафі. Вихідні дані: вихід 3,1 г (79 %). Т. пл. 332 °C. Знайдено, %: С 72.65, Н 3.85, N 13.36. C38H24N6O4 Обчислено, %: С 72.61, Н 3.82, N 13.38. λмакс. люмінесценції у толуолі - 460 нм Абсолютний квантових вихід люмінесценції - 0,2 Приклад 7. Одержання біс-2-феніл-14-[(Е)-2-фенілетенил]-13Н-оксазоло[4',5':6,7] [1,4]діазепіно[1,8]нафталіну Суміш бензен-1,4-біс-2-феніл-4-циннамоіліденоксазол-5-ону (0.006 моль), 2,33 діамінонафталіну (0.014 моль), 30 см ДМФА кип'ятять 17 годин. Охолоджують до кімнатної 3 температури та виливають в 200 см води. Осад відфільтровують, промивають водою, сушать. Отриманий продукт очищують перекристалізацією з дихлоретану, після цього хроматографують на колонці безперервної дії (Адсорбент - Аl2О3, елюент - діоксан). Осад, який випав, сушать в сушильній шафі. Вихідні дані: вихід 3,7 г (74 %). Т. пл. 385 °C. Знайдено, %: С 79.33, Н 4.07, N 12.11. C46H28N6O2 Обчислено, %: С 79.31, Н 4.02, N 12.07. λмакс. люмінесценції у толуолі - 530 нм Абсолютний квантових вихід люмінесценції - 0,2 Структури сполук І ідентифіковано також і їх ІЧ-спектрами. Полосу поглинання (γ С=С=1770 -1 см ) можна віднести до валентних коливань екзоциклічного зв'язку С=С. Достатньо інтенсивне 1 поглинання в області 1650-іббОсм" обумовлено валентними поглинаннями зв'язку C=N (γ -1 С=N=1650-1660 см ). -1 ІЧ-спектри знято на спектрофотометрі UR-20 у таблетках KBr в області 700-1900 см . В таблиці 1 наведені дані з яких видно, що заявлені сполуки інтенсивно фарбують волокна лавсану у флуоресцентні кольори від яскравого жовто-зеленого до жовтого, мають добру 6 UA 74309 U 5 10 15 20 25 30 35 стійкість до світла. На відміну від сполук, що заявляються, аналог за структурою хоч і фарбує лавсан у яскравий жовтий з червоним відтінком колір, але цей барвник не дає лавсану флуоресціюючий колір. Застосування аналога за областю світіння для фарбування лавсану невідомо [16]. За колористичними властивостями найбільш інтенсивний є барвник біс-2-феніл-14-[(Е)-2фенілетенил]-13Н-оксазоло[4',5':6,7] [1,4]-діазепіно[2,3-b]феназин (барвник № 5 у таблиці 1). Барвник подібного кольору у вітчизняному асортименті відсутній. Це дає можливість розширити асортимент люмінесцентних барвників для поліефірних волокон і органічних люмінофорів. На відміну від аналога за структурою, що не має флуоресценції в органічних розчинниках при кімнатній температурі, сполуки, що заявляються, інтенсивно флуоресціюють у жовтозеленій області спектру (див. таблицю 2), тобто одержано люмінофори, що мають незакономірні для даної структури властивості. Структура, що заявляється, породжує нові корисні властивості. Випробування сполук (І) як органічних люмінофорів. Було виміряно спектри флуоресценції, визначено квантові виходи люмінесценції. Спектри флуоресценції вимірювали на установці, яка складається з дзеркального монохроматора ЗМР-3, фотоелектронного помножувача ФЕП-18, мікроамперметра М-94, джерелом збудження служила лампа СВДТ-500, з спектра якої виділяли лінію збудження 365 нм. Абсолютний квантовий вихід вимірювали методом рівного поглинання. Порівняльні результати люмінесцентних характеристик сполук (І) з аналогом за структурою та аналогом за областю світіння представлено в таблиці 2. Зіставлення люмінесцентних характеристик люмінофорів, що заявляються, і аналога за областю світіння (аналог за структурою не має флуоресценції) показало, що інтенсивність люмінесценції сполук, які заявляються, перебільшує інтенсивність світіння другого аналога в 36,5 разів (див. таблицю 2). В той же час колір світіння (λмакс. люмінесценції в толуолі у сполуках, що заявляються, 440-550 нм, у другого аналога - 510 нм) у них майже однаковий. Застосування сполук, що заявляються, завдяки їх підвищеній інтенсивності люмінесценції і високій стійкості до світла дозволить підвищити чутливість і ефективність методів контролю у тих областях техніки, де використовуються люмінесцентні властивості сполук. Таким чином, указані переваги сполук, що заявляються, дозволяють широко використовувати сполуки (І) для одержання цілої низки люмінесцентних матеріалів. Джерела інформації: 1. Красовицкий Б.М., Болотин Б.М. Органические люминофоры. М. Химия, 1984. с. 129-130. 2. Журнал Химия гетероциклических соединений, 1980, № 7, с. 909-911 Таблиця 1 Сполука № п/п Колір забарвленого лавсану Сполуки, що заявляються NH HN N N Флуоресціюючий жовтий з зеленим відтінком 1 O Показники стійкості кольору до світла (ксенотест) N N O 7 5 UA 74309 U Продовження таблиці 1 N N NH HN N N Флуоресціюючий жовтий O N N 4 N N NH HN N N 3 O N N NH2 N N N O H2N N N N N N 4 O 5 Флуоресціюючий жовтий з зеленим відтінком O 5 Флуоресціюючий жовтий 2 N N O 8 UA 74309 U Продовження таблиці 1 N N N N O N N OH 4 Флуоресціюючий жовтий з червоним відтінком 6 4 O HO NH 6 Не флуоресціюючий жовтий з червоним відтінком N N Флуоресціюючий жовтий з червоним відтінком Флуоресціюючий жовтий HN NH 5 HN N N 6 O N N O HN NH N N 7 O N N O Аналог за структурою N (H3C)2N O O 9 UA 74309 U Продовження таблиці 1 Аналог за областю світіння OCH3 Невідомо використання фарбування лавсану для O Таблиця 2 Сполука № п/п Сполуки, що заявляються NH λмакс. Абсолютний люмінесценції в квантовий вихід толуолі люмінесценції HN N N 1 470 N N 0,2 O N N NH HN N N 2 O 0,1 450 O N N O 10 UA 74309 U Продовження таблиці 2 N N HN NH N N 3 440 N N NH2 N 0,1 550 0,3 O H2N N N N N N N N 4 O N N O N N N N NH 5 0,3 480 O HN N N O N N O 11 UA 74309 U Продовження таблиці 2 OH HO NH HN N N 6 460 N N 0,1 530 O 0,2 O HN NH N N 7 O N N O Аналог за структурою N Не флуоресціює O O (H3C)2N Аналог за областю світіння OCH3 510 0,1 O ФОРМУЛА КОРИСНОЇ МОДЕЛІ 5 Органічні люмінофори, які належать до класу оксазол-5-онів, жовто-зеленого світіння, стійкі до УФ-випромінювання, які відрізняються тим, що вони є похідними 1,4-біс-2фенілциннамоїліденоксазол-5-ону загальної формули (І) та містять додаткові ароматичні або гетероциклічні структури. Het Het , (І) 10 де Het= 12 UA 74309 U O O N O N N O N O N N NH NH N N N , O , NH N NH2 , N N O N NH N N NH N , . Комп’ютерна верстка Г. Паяльніков Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 13 N N N NH , N N OH ,
ДивитисяДодаткова інформація
Назва патенту англійськоюOrganic luminophores
Автори англійськоюPetrov Serhii Oleksandrovych, Distanov Vitalii Balamirovych, Lysova Inna Viktorivna
Назва патенту російськоюОрганические люминофоры
Автори російськоюПетров Сергей Александрович, Дистанов Виталий Баламирович, Лисова Инна Викторовна
МПК / Мітки
МПК: C07D 413/10, C09K 11/06
Мітки: органічні, люмінофори
Код посилання
<a href="https://ua.patents.su/15-74309-organichni-lyuminofori.html" target="_blank" rel="follow" title="База патентів України">Органічні люмінофори</a>
Попередній патент: Поршнева машина
Наступний патент: Канал вимірювання радіальної швидкості літальних апаратів з мспм та можливістю розпізнавання ла для лівс полігонного випробувального комплексу
Випадковий патент: Тонкошаровий відстійник