Спосіб радіоактивного мічення кон’югованого з комплексоном антитіла або фрагмента антитіла радіоактивним ізотопом ітрій-90 та комплект для здійснення способу
Формула / Реферат
1. Спосіб радіоактивного мічення кон'югованого з комплексоном антитіла або фрагмента антитіла з 90Y для введення пацієнту, у якому:
і) змішують антитіло або фрагмент антитіла, що кон'юговане з біфункціональним комплексоном, вибраним із групи, яка включає MX-DTPA, феніл-DTPA, бензил-DTPA, CHX-DTPA, DOTA та їх похідні, з розчином, що містить 90Y або його сіль у прийнятному буфері, та
іі) інкубують цю суміш протягом достатнього, відносно короткого періоду часу за умов прийнятної температури і рівня рН, при цьому утворюється радіоактивно мічене антитіло або фрагмент атитіла, що має радіоактивне включення більше ніж 95%, достатню питому активність і специфічність зв'язування принаймні 50%, так що радіоактивно мічене антитіло або фрагмент антитіла може бути безпосередньо введене пацієнту без додаткового очищення, спрямованого на відділення радіоактивно міченого антитіла або фрагмента антитіла від невключеного 90Y.
2. Спосіб за п. 1, який відрізняється тим, що зазначений достатній час інкубування є меншим ніж вісім хвилин.
3. Спосіб за п. 2, який відрізняється тим, що зазначений достатній час інкубування становить від двох до п'яти хвилин.
4. Спосіб за п. 1, який відрізняється тим, що зазначений комплексон являє собою MX-DTPA.
5. Спосіб за п. 1, який відрізняється тим, що зазначена прийнятна температура становить від 25°С до 43°С.
6. Спосіб за п. 1, який відрізняється тим, що зазначений прийнятний рівень pH становить від 3,0 до 6,0.
7. Спосіб за п. 1, який відрізняється тим, що зазначений прийнятний буфер являє собою ацетатний буфер.
8. Спосіб за п. 7, який відрізняється тим, що в зазначеному ацетатному буфері концентрація ацетату натрію складає від 10 до 1000 мМ.
9. Спосіб за п. 1, який відрізняється тим, що зазначений прийнятний буфер містить м’який радіопротектор.
10. Спосіб за п. 9, який відрізняється тим, що зазначений м’який радіопротектор являє собою аскорбат.
11. Спосіб за п.1, який відрізняється тим, що зазначена специфічність зв'язування становить принаймні 70%.
12. Спосіб за п.1, який відрізняється тим, що антитіло або фрагмент антитіла мітять до питомої активності принаймні 5 мКі/мг.
13. Спосіб за п. 1, який відрізняється тим, що антитіло або фрагмент антитіла специфічно зв’язують СD20.
14. Спосіб за п. 13, який відрізняється тим, що антитіло являє собою 2В8.
15. Спосіб за п. 14, який відрізняється тим, що комплексон являє собою МХ-DТРА.
16. Спосіб за п. 15, який відрізняється тим, що досягають рівня радіоактивного включення більше ніж 96%.
17. Спосіб за п. 15, який відрізняється тим, що досягають рівня радіоактивного включення від 96,3 до 99,5%.
18. Спосіб за п. 1, який відрізняється тим, що фрагмент антитіла вибраний із групи, яка включає фрагменти Fab, F(ab’)2 і Fv.
19. Спосіб за п. 1, який відрізняється тим, що співвідношення комплексону і антитіла або фрагмента антитіла коливається від 1,5 до 1.
20. Комплект для радіоактивного мічення кон'югованого з комплексоном антитіла або фрагмента антитіла за допомогою 90Y для введення пацієнту, що включає
і) флакон, який містить антитіло або фрагмент антитіла, що кон'юговане з біфункціональним комплексоном, вибраним із групи, яка включає MX-DTPA, феніл-DTPA, бензил-DTPA, CHX-DTPA, DOTA та їх похідні, у прийнятному буфері,
іі) флакон, який містить буферну композицію для стабілізації і введення радіоактивно міченого антитіла або фрагмента антитіла пацієнту, та
ііі) інструкції для виконання процедури радіоактивного мічення, відповідно до якої кон'юговане з комплексоном антитіло або фрагмент антитіла експонується 90Y або його сіллю протягом достатнього, відносно короткого періоду часу за умов прийнятної температури і рівня рН, рекомендованих у зазначених інструкціях, з одержанням радіоактивно міченого антитіла або фрагмента антитіла, що має радіоактивне включення більше ніж 95 %, достатню питому активність і специфічність зв’язування принаймні 50 %, так що радіоактивно мічене антитіло або фрагмент антитіла може бути розбавлене до придатної концентрації у зазначеній буферній композиції і безпосередньо введене пацієнту без додаткового очищення, спрямованого на відділення радіоактивного антитіла або фрагмента антитіла від невключеного 90Y.
21. Комплект за п. 20, який відрізняється тим, що зазначений достатній час інкубування є меншим ніж вісім хвилин.
22. Комплект за п. 21, який відрізняється тим, що зазначений достатній час інкубування становить від двох двох до п'яти хвилин.
23. Комплект за п. 20, який відрізняється тим, що зазначений комплексон являє собою MX-DTPA.
24. Комплект за п. 20, який відрізняється тим, що зазначена прийнятна температура становить від 25 °С до 43 °С.
25. Комплект за п. 20, який відрізняється тим, що зазначений прийнятний рівень pH становить від 3,0 до 6,0.
26. Комплект за п. 20, який відрізняється тим, що зазначений прийнятний буфер являє собою ацетатний буфер.
27. Комплект за п. 26, який відрізняється тим, що в зазначеному ацетатному буфері концентрація ацетату натрію складає від 10 до 1000 мМ.
28. Комплект за п. 20, який відрізняється тим, що зазначений прийнятний буфер містить м’який радіопротектор.
29. Комплект за п. 28, який відрізняється тим, що зазначений м’який радіопротектор являє собою аскорбат.
30. Комплект за п. 20, який відрізняється тим, що зазначена специфічність зв'язування становить принаймні 70 %.
31. Комплект за п. 20, який відрізняється тим, що антитіло або фрагмент антитіла мітять до питомої активності принаймні 5 мКі/мг.
32. Комплект за п. 20, який відрізняється тим, що додатково містить флакон стерильного буфера для коригування рівня pH радіоізотопу.
33. Комплект за п. 32, який відрізняється тим, що зазначений флакон містить ацетатний буфер.
34. Комплект за п. 20, який відрізняється тим, що зазначена буферна композиція містить фізіологічний сольовий розчин, радіопротектор та некон'югований комплексон.
35. Комплект за п. 34, який відрізняється тим, що радіопротектор вибирають з групи, яка включає альбумін сироватки людини (HSA), аскорбат, аскорбінову кислоту, фенол, сульфіти, глутатіон, цистеїн, гентизинову кислоту, нікотинову кислоту, аскорбілпальмітат, НОР(:О)Н2, гліцерин, формальдегідсульфоксилат натрію, Na2S2О5, Nа2S2O3 та SO2.
36. Комплект за п. 35, який відрізняється тим, що радіопротектор являє собою аскорбат.
37. Комплект за п. 36, який відрізняється тим, що концентрація аскорбату становить від 1 до 100 мг/мл.
38. Комплект за п. 35, який відрізняється тим, що некон'югований комплексон являє собою DTPA.
39. Комплект за п. 38, який відрізняється тим, що концентрація DTPA становить 1 мМ.
40. Комплект за п. 20, який відрізняється тим, що додатково містить реакційний флакон.
41. Комплект за п. 20, який відрізняється тим, що додатково містить флакон з радіоізотопом.
42. Комплект за п. 20, який відрізняється тим, що антитіло або фрагмент антитіла специфічно зв’язують СD20.
43. Комплект за п. 20, який відрізняється тим, що антитіло являє собою 2В8.
44. Комплект за п. 43, який відрізняється тим, що комплексон являє собою МХ-DТРА.
45. Комплект за п. 44, який відрізняється тим, що досягають рівня радіоактивного включення більше ніж 96%.
46. Комплект за п. 44, який відрізняється тим, що досягають рівня радіоактивного включення від 96,3 до 99,5%.
47. Комплект за п. 20, який відрізняється тим, що фрагмент антитіла вибраний із групи, яка включає фрагменти Fab, F(ab’)2 і Fv.
48. Комплект за п. 20, який відрізняється тим, що співвідношення комплексону і антитіла або фрагмента антитіла коливається від 1,5 до 1.
Текст
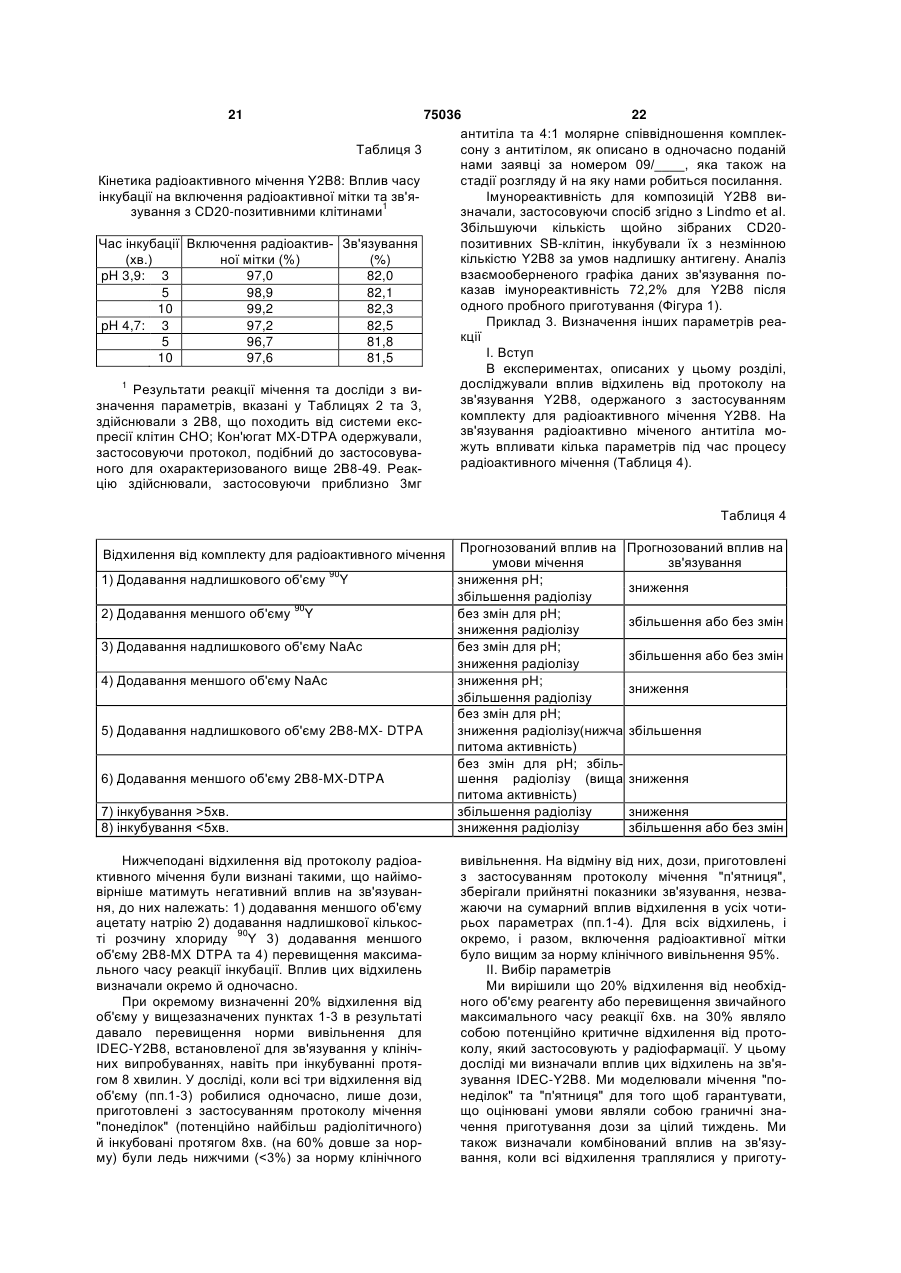
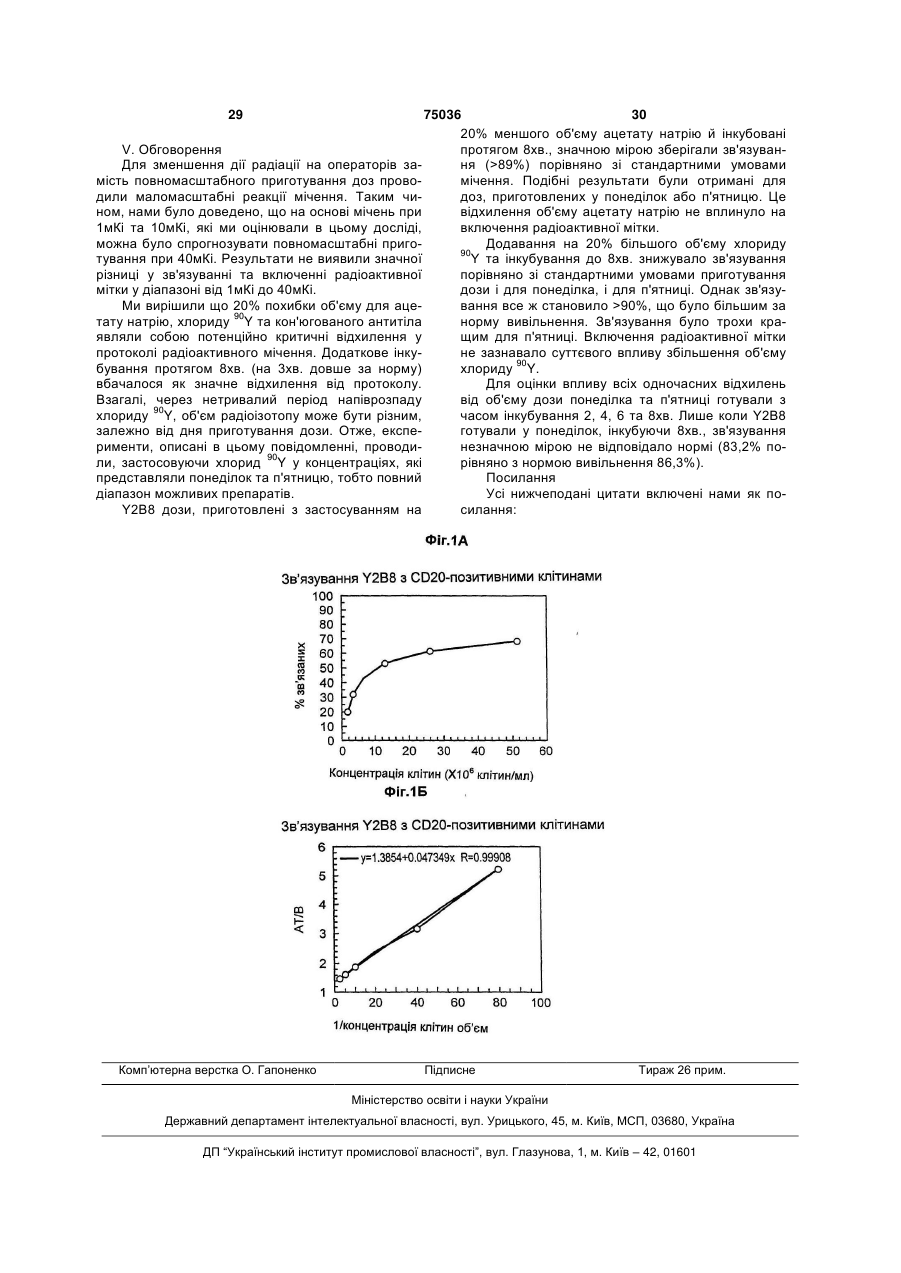
1. Спосіб радіоактивного мічення кон'югованого з комплексоном антитіла або фрагмента антитіла з 90Y для введення пацієнту, у якому: і) змішують антитіло або фрагмент антитіла, що кон'юговане з біфункціональним комплексоном, вибраним із групи, яка включає MX-DTPA, фенілDTPA, бензил-DTPA, CHX-DTPA, DOTA та їх похідні, з розчином, що містить 90Y або його сіль у прийнятному буфері, та іі) інкубують цю суміш протягом достатнього, відносно короткого періоду часу за умов прийнятної температури і рівня рН, при цьому утворюється радіоактивно мічене антитіло або фрагмент атитіла, що має радіоактивне включення більше ніж 95%, достатню питому активність і специфічність зв'язування принаймні 50%, так що радіоактивно мічене антитіло або фрагмент антитіла може бути безпосередньо введене пацієнту без додаткового очищення, спрямованого на відділення радіоактивно міченого антитіла або фрагмента антитіла від невключеного 90Y. 2. Спосіб за п. 1, який відрізняється тим, що зазначений достатній час інкубування є меншим ніж вісім хвилин. 3. Спосіб за п. 2, який відрізняється тим, що зазначений достатній час інкубування становить від двох до п'яти хвилин. 2 (19) 1 3 75036 4 19. Спосіб за п. 1, який відрізняється тим, що 30. Комплект за п. 20, який відрізняється тим, що співвідношення комплексону і антитіла або фрагзазначена специфічність зв'язування становить мента антитіла коливається від 1,5 до 1. принаймні 70 %. 31. Комплект за п. 20, який відрізняється тим, що 20. Комплект для радіоактивного мічення кон'югованого з комплексоном антитіла або фрагмента антитіло або фрагмент антитіла мітять до питомої 90 антитіла за допомогою Y для введення пацієнту, активності принаймні 5 мКі/мг. 32. Комплект за п. 20, який відрізняється тим, що що включає і) флакон, який містить антитіло або фрагмент додатково містить флакон стерильного буфера антитіла, що кон'юговане з біфункціональним комдля коригування рівня pH радіоізотопу. 33. Комплект за п. 32, який відрізняється тим, що плексоном, вибраним із групи, яка включає MXDTPA, феніл-DTPA, бензил-DTPA, CHX-DTPA, зазначений флакон містить ацетатний буфер. 34. Комплект за п. 20, який відрізняється тим, що DOTA та їх похідні, у прийнятному буфері, іі) флакон, який містить буферну композицію для зазначена буферна композиція містить фізіологічстабілізації і введення радіоактивно міченого анний сольовий розчин, радіопротектор та некон'ютитіла або фрагмента антитіла пацієнту, та гований комплексон. 35. Комплект за п. 34, який відрізняється тим, що ііі) інструкції для виконання процедури радіоактивного мічення, відповідно до якої кон'юговане з радіопротектор вибирають з групи, яка включає комплексоном антитіло або фрагмент антитіла альбумін сироватки людини (HSA), аскорбат, асекспонується 90Y або його сіллю протягом достаткорбінову кислоту, фенол, сульфіти, глутатіон, нього, відносно короткого періоду часу за умов цистеїн, гентизинову кислоту, нікотинову кислоту, прийнятної температури і рівня рН, рекомендовааскорбілпальмітат, НОР(:О)Н2, гліцерин, форманих у зазначених інструкціях, з одержанням радіольдегідсульфоксилат натрію, Na2S2О5, Nа2S2O3 та активно міченого антитіла або фрагмента антитіSO2. 36. Комплект за п. 35, який відрізняється тим, що ла, що має радіоактивне включення більше ніж 95 %, достатню питому активність і специфічність радіопротектор являє собою аскорбат. 37. Комплект за п. 36, який відрізняється тим, що зв’язування принаймні 50 %, так що радіоактивно мічене антитіло або фрагмент антитіла може бути концентрація аскорбату становить від 1 до 100 розбавлене до придатної концентрації у зазначемг/мл. 38. Комплект за п. 35, який відрізняється тим, що ній буферній композиції і безпосередньо введене пацієнту без додаткового очищення, спрямованого некон'югований комплексон являє собою DTPA. 39. Комплект за п. 38, який відрізняється тим, що на відділення радіоактивного антитіла або фрагмента антитіла від невключеного 90Y. концентрація DTPA становить 1 мМ. 21. Комплект за п. 20, який відрізняється тим, що 40. Комплект за п. 20, який відрізняється тим, що зазначений достатній час інкубування є меншим додатково містить реакційний флакон. 41. Комплект за п. 20, який відрізняється тим, що ніж вісім хвилин. 22. Комплект за п. 21, який відрізняється тим, що додатково містить флакон з радіоізотопом. 42. Комплект за п. 20, який відрізняється тим, що зазначений достатній час інкубування становить від двох двох до п'яти хвилин. антитіло або фрагмент антитіла специфічно 23. Комплект за п. 20, який відрізняється тим, що зв’язують СD20. 43. Комплект за п. 20, який відрізняється тим, що зазначений комплексон являє собою MX-DTPA. 24. Комплект за п. 20, який відрізняється тим, що антитіло являє собою 2В8. 44. Комплект за п. 43, який відрізняється тим, що зазначена прийнятна температура становить від 25 °С до 43 °С. комплексон являє собою МХ-DТРА. 25. Комплект за п. 20, який відрізняється тим, що 45. Комплект за п. 44, який відрізняється тим, що зазначений прийнятний рівень pH становить від досягають рівня радіоактивного включення більше 3,0 до 6,0. ніж 96%. 26. Комплект за п. 20, який відрізняється тим, що 46. Комплект за п. 44, який відрізняється тим, що зазначений прийнятний буфер являє собою ацедосягають рівня радіоактивного включення від татний буфер. 96,3 до 99,5%. 27. Комплект за п. 26, який відрізняється тим, що 47. Комплект за п. 20, який відрізняється тим, що в зазначеному ацетатному буфері концентрація фрагмент антитіла вибраний із групи, яка включає ацетату натрію складає від 10 до 1000 мМ. фрагменти Fab, F(ab’)2 і Fv. 28. Комплект за п. 20, який відрізняється тим, що 48. Комплект за п. 20, який відрізняється тим, що зазначений прийнятний буфер містить м’який распіввідношення комплексону і антитіла або фрагдіопротектор. мента антитіла коливається від 1,5 до 1. 29. Комплект за п. 28, який відрізняється тим, що зазначений м’який радіопротектор являє собою аскорбат. Даний винахід стосується комплектів та способів для радіоактивного мічення білків та пептидів терапевтичними радіоізотопами таким чином, щоб ці радіоактивно мічені білки могли бути введені безпосередньо пацієнтам без додаткового очищення. Такі комплекти та способи зокрема за 5 75036 6 стосовуються для мічення білків та пептидів ітрівання. Зокрема, описано кон'югат Y2B8, який місєм-90 (90Y). Завдяки оптимізації протоколу радіоатить антилюдське CD20 мишаче моноклональне ктивного мічення, при якому не вимагається подаантитіло 2В8, приєднане до, 90Y через біфункціольшого очищення радіоактивно міченого білка, нальний комплексон MX-DTPA. даний винахід вирішує основну потребу галузі Патенти, які стосуються комплексонів та кон'юмічені ітрієм ліки забезпечуються прийнятною для гатів комплексонів, відомі фахівцям галузі. Наприкористувача формою таким чином, щоб ці ліки клад, патент США №4,831,175, Gansow стосується можна було легко виготовляти та приймати пацієполізаміщених комплексонів діетилентріамінпеннтам в умовах стаціонару та амбулаторно. таоцтової кислоти та білкових кон'югатів, які їх На всі публікації та патентні заявки нами ромістять, та способів їх одержання. Патенти США биться посилання таким чином, якби кожна публі№№ 5,099,069, 5,246,692, 5,286,850 та 5,124,471 кація або патентна заявка була окремо наведеним Gansow також стосуються полізаміщених комплекпосиланням. сонів DTPA. У роботі Kozak et аl. описано кілька Радіоактивно мічені білки, зокрема антитіла, комплексонів DTPA, включаючи MX-DTPA, які вибагато років оцінюються як потенційні діагностичні явили себе придатними до радіоімунотерапії з та терапевтичні реагенти. Тепер, коли дослідники застосуванням мічених ітрієм моноклональних починають розрізняти специфічні пухлинні антигеантитіл [1989. Nature of the bifunctional chelating ни та споріднені ліганди або антитіла, які зв'язуagent used for radioimmunotherapy with yttrium-90 ються з такими антигенами, ці реагенти вважаютьmonoclonal antibodies: Critical facfors in determining ся особливо дієвими терапевтичними засобами in vivo survival and organ tохiciti. Cancer Res. 49; проти раку. Шляхом введення радіоактивно міче2639-2644]. Ці посилання наведено тут в їх повноного ліганду або антитіла, що зв'язаний зі специму обсязі. фічним пухлинним антигеном, сполученого з раlтрій-90 найефективніший в радіоімунотерапії діоізотопом, який має короткодіюче, та радіопептидній терапії з кількох причин. 64високоенергетичне й інтенсивне корпускулярне годинний період напіврозпаду 90Y є достатньо доввипромінювання, летальну дозу радіації можна гим для накопичення антитіла пухлиною і на відміспрямовувати безпосередньо до клітин пухлини. ну від, наприклад, 131l, він є чистим бетаЗалежно від діапазону частинок конкретного випромінювачем високої енергії (Е max 2,27МеВ) ізотопу, мітки вибирають залежно від очікуваного без паралельного гамма-випромінювання під час результату їх дії на конкретний вид клітин. Наприйого розпаду. Його діапазон корпускулярного виклад, гамма-випромінювачі, як правило, застосопромінювання становить від 100 до 1000 діаметрів вуються з метою діагностики, тобто для візуалізаклітини, що є практично мінімальною кількістю ції пухлин, але зазвичай вони неефективні як проникної радіації, можливою для введення амбузнищувальні агенти. На відміну від них альфа- та латорному пацієнтові. Крім того, для знищення бета-випромінювачі можуть використовуватися клітин не потрібно засвоєння мічених антитіл, і для знищення клітин. Альфа-випромінювачі момісцеве випромінювання іонізуючої радіації має жуть бути особливо дієвими при хворобах крові бути летальним для сусідніх клітин пухлин, яким або пухлинах судин, завдяки своїй здатності проможе не вистачити антигену-мішені. никності; однак у деяких випадках для знищення Однак, незважаючи на визнання ефективності клітин може бути достатньо тільки корпускулярномічених ітрієм антитіл та непогані клінічні резульго випромінювання, як правило, альфатати, отримані з деякими міченими ітрієм терапеввипромінювач має бути розташований прямо на тичними засобами, багато пацієнтів не може скоповерхні клітини. На відміну від нього бетаристатися перевагами, які дають ці терапевтичні випромінювачі, тобто 90Y, є особливо придатними засоби через характерні труднощі як при здійснендля великих, більш локалізованих хвороб, оскільки ні радіоактивного мічення, так і при введенні у вивони, як правило, мають довший діапазон випрозначене місце. Ця проблема є причиною майже мінювання. повної відсутності комплектів та продуктів, які доМічені ітріем-90 антитіла та пептиди, зокрема, зволяють здійснювати локальне мічення реагентів виявили непогані результати у протоколах клінічальфа- та бета-випромінюючими радіоізотопами і ної терапії [Thomas et аl. 7995. Gamma-inteferon за інших умов могли демонструвати комерційне administration аfter 90Y radiolabeled аntibodу therapy; застосування цієї технології. survival and hematopoietic foxicitу studies. Int. J. Проблема з забезпеченням комплектів для Radiat. Оnсоl. Вiоl. Phys. 37. 529-534; DeNardo et радіоактивного мічення та наступного введення аl. 7995. Yttrium-90/lndium-lll DОTA peptide сhimeric терапевтичних засобів, мічених деструктивними L6. pharmacokinetics, dosimetry and initial ізотопами, існує в галузі вже давно, оскільки перед therapeutic studies in patients with breast cancer., J. введенням таких терапевтичних засобів пацієнт Nucl. Med. 36: 97P]. Такі кон'югати зазвичай одерповинен пройти процес очищення для видалення жують шляхом приєднання біфункціонального незв'язаної мітки, щоб не піддавати пацієнта дії комплексону до білка або антитіла, а потім об'єдвільного радіоізотопу, який може накопичуватися в нання радіоактивної мітки з білковою послідовніскістках та інших органах, не призначених для лікутю через біфункціональний комплексон. Напривання. Навіть комплекти, нині доступні для мічення клад, у заявках 08/475,813, 08/475,815 та антитіл ітрієм, потребують складного очищення, 08/478,967, які перебувають на стадії розгляду і на перш ніж терапевтичний засіб буде готовий до які ми посилаємося, описано радіоактивно мічені введення. терапевтичні антитіла для спрямування на лімфоНаприклад, Antisoma пропонує комплект для ми B-клітин та клітини пухлин з метою їх руйнурадіоактивного мічення моноклонального антитіла 7 75036 8 таких як 90Y, тим більше шансів, що білок збереже HMFG! (Theragyn ) Y для наступного введення структурну цілісність та специфічність зв'язування, пацієнтам при раку яєчника. Тривалі дослідження, які потрібні для взаємодії з антигеном-мішенню до які включали l-ll фази, показали, що це лікування часу його введення та після досягнення ним потріможе бути особливо дієвим, якщо його застосовубного місця дії. вати як додатковий захід до традиційних хірургіч90 Радіолітичний характер Y відомий фахівцям них заходів та хіміотерапії (Hird et аl. 7993. уже багато років, і чимало з них намагалися виріAdjuvant therару of оуаriаn cancer with radioactive шити проблему, яку являє 90Y для комерційного mоnосlоnаl antibody. Br. J. Cancer 68: 403-406]. застосування цих терапевтичних засобів. НаприОднак спосіб мічення за Antisoma вимагає видаклад, у роботах Satako et аl., та Chakrabarti et аl. лення незв'язаної мітки шляхом Sephadex G50 дається оцінка застосуванню засобів захисту від гель-фільтрації, що є значною перешкодою у досярадіоактивного опромінення у мічених 90Y компогненні комерційного успіху комплекту мічення зиціях антитіла як засобів зменшення пошкоджень Тhеrаgyn , а також недоступність цієї терапії для антитіла. SaIako et аl. зокрема повідомляють, що всіх пацієнтів з раком яєчника, яким вона могла альбумін сироватки людини дозволяє підтримувадопомогти. ти імунореакгивність міченого 90Y антитіла до 72 Той факт, що ці реагенти нині вимагають когодин. Однак питома активність, яку виявляють лонкового очищення перѐд введенням, є й заликомпозиції Salako, є досить низькою (менше ніж шається головною перешкодою їх доступності для 2мКі/мл). Крім того, ні у Salako, ні у Chakrabarti не пацієнтів, які могли скористатися цією технологією, повідомляється про спроби утриматися від довгого за умови спрощеного способу, що дозволяє лікапроцесу очищення, який вимагається після міченрям швидко, ефективно й безпечно вводити такі ня антитіла. Мічення у Satako et аl. триває від 45 реагенти. Наприклад, лікар, який працює амбулахвилин до години, потім вони очищують антитіло торно з пацієнтами, не має часу або обладнання шляхом хроматографії на молекулярних ситах, а для очищення реагенту шляхом HPLC або гельChakrabarti здійснює мічення протягом майже фільтраційної хроматографії перед введенням трьох годин і очищення шляхом гельреагенту пацієнтові. Це означає, що мають бути фільтраційної хроматографії. Жоден з цих спосопередбачені додаткові можливості для паралельбів не сприяє застосуванню мічених 90Y терапевного одержання реагенту та безпосередньої достичних засобів пацієнтам амбулаторно. Chinol та тавки його лікарю, що значно збільшує витрати на Hnatowich вдалося досягти 90% радіохімічного терапію і в деяких випадках може вимагати від очищення для мічених 90Y білків з питомою активпацієнта поїздок на значні відстані для лікування. ністю від 1-3мКі/мг без очищення після мічення, В альтернативному варіанті ліки можуть бути мі90 застосовуючи власний генерований Y [1987. чені не на місці, що вимагає попереднього пригоGenerator-produced yttrium-90 for тування та принаймні короткотермінового зберіrаdiоimmunotherapy. J. Nuсl. Med 28(9): 1465-1470]. гання терапевтичних засобів. Це не тільки Однак розробки цих авторів не можна вважати послаблює радіоізотоп через радіоактивний розідеальними, бо їх композиції мають менш ніж 95% пад під час зберігання, але також призводить до очищення, і вони вказують, що важливим і "можзначного пошкодження структурної цілісності білка ливо, необхідним" етапом може бути HPLC (рідинвнаслідок надмірного впливу радіоізотопу. на хроматографія високої роздільної здатності). У багатьох повідомленнях обговорюється раТі, хто вважали, що HPLC та інші типи очидіолітичний характер 90Y та подібних радіоізотопів щення для амбулаторних та стаціонарних пацієн[наприклад, Salako et аl., 1993. Fffects of radiolysis тів повинні бути виключені, не змогли розробити on yttrium-90-labeled Lum-1 antibody preparations. J. достатній протокол мічення для 90Y, при якому Nucl. Med. 39: 667-670; Chakrabarti et аl. 1996. досягається високий рівень включення мітки та Prevention of radiolysis of monoclonal antibody прийнятний рівень підтримання стабільності антиduring labeling. J. Nucl. Med. 37; 1384-1386]. Як затіла. Якщо не досягнуто високого рівня включення значено у роботі Chakrabarti et аl., радіонукліди, радіоактивної мітки, пацієнт зазнає дії надвисокого такі як 90Y, дають велике радіаційне випромінення рівня вільної незв'язаної радіоактивної мітки, якщо антитілу під час мічення, а також під час зберіганця мітка не є очищеною від реагенту. До того ж, ня. Відомо що радіація може призвести до значноякщо структурну цілісність антитіла пошкоджено го пошкодження антитіла, воно буде спрямовуватаким чином що це антитіло втрачає спрямовану тися не на клітини пухлини, а піддавати інші специфічність, такі реагенти не мають специфічнотканини дії токсичності. го зв'язування з їхніми спорідненими лігандами. Механізм радіаційного пошкодження пояснюMather з колегами брали за мету мічення спеється утворенням вільних радикалів [Pizzarello. цифічних до пухлин антитіл 90Y таким чином, щоб 1975. Direct and lndirect асtiоn. ln; Pizzarello and можна було уникнути очищення після мічення Witcofski, eds. Basic Rаdiаtiоn Βiοlοgy. 2nd ed. [1989. Labeling monoclonal antibodies with yttriumPhiladelphia; Lea & Febger, pp.20-29]. Але, як за90. Εur. J. Nuсl. Med. 15. 307-312]. Однак Mather значено у роботі Satako et аl., при 2,2МеВ бета90 виявив, що висока ефективність мічення (понад частинки, що випромінюються з Υ, можуть легко 95%) може бути досягнута лише при низькій питорозірвати більшість хімічних зв'язків, включаючи мій активності (1мКі/мг). Крім того, у роботі Mather дисульфідні антитіла, які мають міцність зв'язку et al. повідомляється, що їхні композиції антитіла лише 4,4еВ [Skoog. 1985. Principles of lnstrumental виявляють ознаки руйнування (внаслідок радіоліAnalysis. 3"1 edition. San Francisco; Saunders]. Тазу) через лічені години. Причиною цього може бути ким чином, чим менше білок, який потрібно поміте, що Mather et аl., як і багато інших фахівців гатити, піддається дії деструктивних радіоізотопів, 90 9 75036 10 лузі, здійснювали реакцію мічення протягом однієї радіоактивно міченого антитіла пацієнтові та (ііі) години. інструкцію з виконання процедури радіоактивного Наприклад, було запропоновано способи мімічення, щоб кон'югований комплексон білка або чення білкових реагентів менш деструктивними пептиду під час дії радіоізотопу або його солі промітками, такими як 111ln, які пройшли додаткові тягом певного періоду за сприятливих умов, як етапи очищення. У роботі Richardson et аl, пропорекомендує вищезгадана інструкція, можна було нується процедура мічення антитіла 111ln, щоб одержати радіоактивно мічений білок або пептид, утворити комплект для діагностичного застосуванякий має достатню чистоту, питому активність та ня [Richardson et аl., 1987. Optimization аnd bаtch специфічне зв'язування, щоб радіоактивно мічене produсtiоn of DTPA-labeled antibody kits for routine антитіло могло бути розведене до відповідної конuse in 111ln immunoscriptography. Nuсl. Med Соmm. центрації у вищезгаданому буфері й введене без8: 347-356]. Однак спосіб мічення, запропонований посередньо пацієнтові без подальшого очищення. у роботі Richardson et аl., здійснюють протягом Фігура 1. А) SB-клітини промивали й ресуспеноднієї години, що є можливим з 111ln, який не надто дували до 90 X 106 клітин/мл з розріджувальним радіолітичний, але він непридатний для мічення буфером (1Х PBS, pH 7,4, що містив 1% (ма90 Y, про що свідчать труднощі, про які повідомляса/об'єм) альбуміну сироватки великої рогатої хується у роботі Mather et аl. доби. Зростаючу концентрацію клітин інкубували Це дає нам несподівані переваги даного винапротягом 3 годин з 2нг/мл Y2B8, одержаного з заходу, що дозволяє глибше дослідити процес растосуванням 2В8-MX-DTPA, партія # 0165А. В) діоактивного мічення білків 90Y, чого ще ніхто не Взаємообернений графік залежності концентрації робив у даній галузі. Нами було виявлено, що клітин від зв'язаної радіоактивності/загальної рапроцеси HPLC або інші етапи очищення, які довгий діоактивності (В/АТ). імунореактивність розраховучас вважалися необхідними для одержання чистовали як 1/у-відрізок х 100. Значення імунореактивго реагенту, та тривалий період інкубації, який заності та коефіцієнта кореляції (R) становили стосовувався з метою збільшення питомої активвідповідно 72,2% та 0,999. ності їхніх реагентів, насправді заважають процесу Якщо спеціально не вказано іншого, всі застоодержання мічених 90Y реагентів. Ці тривалі просовані нами технічні та наукові терміни мають знацеси лише пошкоджують білок внаслідок дії радіочення, загальноприйнятих у галузі, до якої налелізу, що призводить до зниження специфічності та жить цей винахід. Хоча у дослідах та під час посилює розщеплення білка ще до готовності рапрактичного застосування даного винаходу можуть діоактивно міченого білка для ін'єкції. Нами було бути використані будь-які способи та матеріали, виявлено, що ефективне мічення 90Y (>95% вклюподібні або до описаних нами або їх еквіваленти, чення та питома активність принаймні 15мКі/мг) нами описуються оптимальні способи та матеріаздійснюється протягом від двох до п'яти хвилин, і ли. таке мічення фактично втрачає свою ефективДаний винахід включає в себе спосіб радіоакність, якщо час реакції перевищує вісім хвилин. тивного мічення кон'югованого комплексону білка Той факт, що мічення 90Y тепер можна провесабо пептиду з терапевтичним радіоізотопом для ти згідно зі способами даного винаходу лише за введення пацієнтові й охоплює (і) змішування дві хвилин, вже не дає підстав для скептицизму кон'югованого комплексону білка або пептиду з щодо придатності до застосування комплектів для розчином, який містить радіоізотоп або його сіль, радіоактивного мічення ітрієм в амбулаторних та та (іі) інкубування суміші протягом певного періоду стаціонарних умовах. Комплекти згідно з даним за сприятливих умов, щоб одержати радіоактивно винаходом, можуть задовольняти потребу, яка мічений білок або пептид, який має достатнє очиіснувала протягом багатьох років для онкологічних щення, тобто рівень включення радіоактивної мітхворих та лікарів-онкологів, комерційної придатноки, питому активність та специфічність зв'язувансті та доступності терапевтичних засобів проти ня, щоб радіоактивно мічене антитіло могло бути раку на основі радіоактивного мічення білків. введене безпосередньо пацієнтові без подальшоДаний винахід стосується способів та комплего очищення. "Подальше очищення" включає в ктів для радіоактивного мічення кон'югованого себе HPLC, гель-фільтрацію, інші типи колонкової комплексону білка або пептиду з терапевтичним хроматографії та будь-яку іншу технологію відорадіоізотопом для введення пацієнтові. Способи кремлення, яку застосовують з метою видалення згідно з даним винаходом головним чином вклювільної або зв'язаної некон'югованої радіоактивної чають (і) змішування кон'югованого комплексону мітки. білка або пептиду з розчином, який містить радіоіСпособи даного винаходу можуть бути застозотоп або його сіль, та (іі) інкубування суміші просовані зокрема до терапевтичних радіоізотопів, тягом певного періоду за сприятливих умов таким які, як правило, є радіолітичними, а отже, становчином, щоб одержати радіаційно мічений білок або лять потенційну загрозу для структурної цілісності пептид, що має достатню чистоту, тобто рівень білка. Такі терапевтичні радіоізотопи, як правило, включення радіоактивної мітки, питому активність, вибирають з групи, яка включає в себе альфа- та специфічність зв'язування, щоб радіаційно мічене бета-випромінювачі. До оптимальних терапевтичантитіло можна було безпосередньо ввести пацієних радіонуклідів належать 203Pb, 212Pb 212Bi 109Pd 64 нтові без подальшого очищення. Сu, 67Сu, 90Y, 77Br, 211At, 97Ru, 105Rh, 195Au та 199Ag Комплекти згідно з даним винаходом, головабо 177Lu. Iнші радіонукліди, що мають терапевтиним чином, мають (і) флакон, що містить кон'югочне застосування, описано у патенті США ваний комплексон білок або пептид, (іі) флакон, 5,541,287, на який нами робиться посилання. Найщо містить буфер для стабілізації та введення кращими радіонуклідами є сильні випромінювачі 11 75036 12 бета-променів, які можуть викликати внутрішньолом фактично може бути збільшене, але це немолекулярне розщеплення, такі як 90Y, 67Cu, 131I, обов'язково потрібно, оскільки відповідний рівень 186 Re та 188Re. Хоча термін "терапевтичний" радіоівключення радіоактивної мітки та питомої активзотоп здебільшого стосується таких радіоізотопів, ності досягається за нетривалий період мічення. як бета- та гамма-випромінювачі, які мають цитоЗважаючи на це відкриття, такі параметри, як контоксичний вплив, але такі радіоізотопи також моцентрація комплексону в білку, фахівці можуть жуть бути застосовані для діагностичних цілей, легко визначити емпірично й для інших білків та отже такі цілі не виключають ці ізотопи з обсягу пептидів, залежно від вибору терапевтичної мітки, даного винаходу, оскільки саме радіолітичних хавід вибору комплексону кількість сайтів, доступних рактер цих ізотопів робить їх придатними для опидля приєднання комплексону, сприйнятливості саних способів та комплектів. білка до радіолізу, потрібного рівня ефективності Способи даного винаходу можуть бути користощо. ним для мічення білків або пептидів, зокрема, коли Будь-який біфункціональний комплексен може структурна цілісність має бути збереженою для бути використаний для втілення способу даного заданої специфічності. Оптимальними білками є винаходу, якщо він має здатність зв'язуватись і з антитіла або фрагменти антитіл, такі як Fab, (Fab)2 відповідним білком, і з відповідним радіоізотопом. та фрагменти Fv, які розпізнають пухлин або асоОптимальні комплексони вибирають з групи MXційовані з пухлинами антигени. Оптимальні пептиDTPA, феніл-DTPA, бензил-DTPA, CHX-DTPA, ди містять соматостатин, вазоінтестинальний пепDOTA та їх похідних. Найкращим комплексоном є тид (VIP), речовину Ρ та інші, які зв'язуються з MX-DTPA. клітинними рецепторами. Такі пептиди та кон'югоДо "сприятливих умов" згідно з представлениваний комплексон похідні таких пептидів описано у ми способами належать прийнятна температура, патенті США №5,830,431, на який нами робиться pH та буферні умови. Фахівцеві має бути зрозуміпосилання. ло, що умови реакції мають бути такими, щоб не "Достатній час інкубації" згідно зі способами уповільнювати або якимось іншим чином не вплиданого винаходу, це певний проміжок часу протявати на реакцію мічення. У роботі Lewis et aI. обгогом якого досягається достатній рівень включення ворюються умови реакції, які мають братися до радіоактивної мітки та радіохімічного очищення, уваги при радіоактивному міченні імунокон'югатів, і щоб реагент міг бути введений безпосередньо на цю роботу нами робиться посилання [1994. A пацієнтові без необхідності подальшого очищення. facile, wafer-soluble method for mоdification of Достатнім включенням та очищенням радіоактивproteins with DOTA. Use of eIevated femperature and ної мітки фахівці, як правило, вважають таке, що optimized pH tо асhieve high specifiс асtivity and high становить принаймні 95%, але ці показники мосhеlate stability in radiolabeled immunoconjugates. жуть бути різними залежно від токсичності мітки. Bioconjugate Chem. 5: 565-576]. Фахівцям також має бути зрозуміло, що рівень Прийнятна температура для реакції може бути включення радіоактивної мітки, який вважається різною, залежно від білка, який має бути мічений, достатнім, також залежить від потрібного рівня але, як правило, становить приблизно від 25°С до ефективності. Для 90Y, зокрема мічених 90Y антитіл 43°С . Lewis et аl., виявили, що підвищення темпеданого винаходу, такий достатній час, як правило, ратури реакції радіоактивного мічення від 25°С до становить приблизно менше ніж вісім хвилин, 43°С сприяє як ефективності включення радіомекраще - приблизно від двох до п'яти хвилин, залеталу, так і кінетичній стабільності досліджуваних жно від молярного співвідношення комплексону з DOTA радіокон'югатів. білком у кон'югованому комплексоному білку, який Прийнятний рівень pH може бути різним у домає бути мічений. сить широкому діапазоні, залежно від застосовуФахівцеві має бути зрозуміло, що оптимальваної радіоактивної мітки. Рекомендований рівень ний час, який потрібен для мічення конкретного pH для мічення різними радіонуклідами, як правибілка, може бути різним: залежно від білка, конкло, відомий, і його вибирають з огляду на той чи ретної радіоактивної мітки та конкретного кон'югаінший радіоізотоп. Наприклад, для 90Y прийнятний та. Основним чинником оптимізації часу, відведерівень pH може становити приблизно від 3 до 6, ного на радіоактивне мічення, є співвідношення але оптимальним є рівень приблизно 4,2. комплексону з білком у реагенті, який має бути Прийнятні буфери також можуть бути різними, міченим. Наприклад, співвідношення комплексону залежно від конкретної радіоактивної мітки. Наз білком має бути достатньо високим для досягприклад, Lewis et аl., а також інші автори виявили, нення терапевтично придатного рівня включення, що присутність цитрату затримує реакцію мічення 90 тобто 95%, але й не повинно бути надто високим, Y. Таким чином, цитратний буфер не може бути щоб це не шкодило структурній цілісності або імуприйнятним, якщо за радіоактивну мітку взяти 90Y. нореактивності білка. Це потребує процесу врівноПри міченні 90Y оптимальним буфером є ацетатваження, що у деяких випадках може призводити ний буфер, точніше, натрієвоацетатний буфер у до зниження рівня кон'югованого комплексону та концентрації приблизно від 10 до 1000мМ. подовження часу мічення. Якщо це не затримує і якимось іншим чином Наприклад, нами було виявлено, що мічення не перешкоджає реакції мічення, також можна 90 Y до потрібного рівня очищення може бути здійсвключити у реакційний буфер м’який (нешкідлинене менше ніж за п'ять хвилин при застосуванні вий) радіопротектор. Згідно з Chakrabarti, одним з MX-DTPA як комплексону й при молярному співтаких радіопротекторів є аскорбінова кислота, яка відношенні комплексону з антитілом лише від 1½ не заважає процесу мічення. Однак, слід бути до 1. Хоча співвідношення комплексону з антитіобережними при застосуванні альбуміну сироват 13 75036 14 ки людини в реакції мічення через присутність мебез подальшого очищення. Вищезгаданий кон'юталів, які можуть втрутитись у процес мічення. гований з комплексоном білок або пептид може Оскільки даний винахід стосується радіоактипостачатися у ліофілізованій формі. вного мічення білків конкретними радіолітичними Слід розуміти, що комплекти згідно з даним ізотопами, може існувати певний баланс між спевинаходом призначено для здійснення описаних цифічністю зв'язування та питомою активністю, нами способів і, таким чином, можуть бути застоякий фахівці можуть спостерігати при практичному совані з цією метою. Відповідним чином, після застосуванні способів даного винаходу. Наприознайомлення з винаходом фахівцеві має бути клад, якщо питома активність є дуже високою зрозуміло, що інструкцію до комплекту складено (тобто, відповідно понад 5мКі/мг, краще - понад на основі описаних вище способів, і що вищевка10мКі/мг, ще краще - понад 15мКі/мг), білкова посзані міркування мають враховуватися з огляду на лідовність, яка має потрібну специфічність зв'язувтілення комплекту. Крім того, після ознайомлення вання, має значну знищувальну здатність на діляз описом в цілому фахівцеві має бути зрозуміло, нці пухлини. Однак частина білків у популяції, яка що даний винахід охоплює також альтернативні в цілому зберігає свою імунореактивність, може варіанти комплекту, які можуть включати в себе бути нижчою ніж в популяції, що має нижчу питому такі компоненти, як ацетатний буфер для регулюактивність, внаслідок радіолізу радіоактивної мітвання рівня pH радіоактивної мітки, як описано ки. Залежно від потрібного рівня питомої активновище. сті, фахівець може визначати відповідний рівень Особливо важливим компонентом комплекту є імунореактивності. буфер для стабілізації від впливу радіолізу та ввеНаприклад, нами було виявлено, що при 90Y, дення радіоактивно міченого кон'югованого антиколи антитіло є міченим до питомої активності тіла пацієнтові. Цей буфер є фармацевтично приприблизно 15мКі/мг, питомість зв'язування або йнятним носієм, який служить і як розріджувач для імунореактивність білка, як правило, становить міченого антитіла, і як буфер для введення. Хоча приблизно не менше ніж 70%. Зазвичай вона, модля введення терапевтичного або діагностичного же бути різною, залежно від чутливості антитіла та антитіла пацієнтові може застосовуватися будьрадіолітичного характеру застосовуваного радіоіякий фармацевтично прийнятний розріджувач, зотопу, і може змінюватися досвідченим фахівцем, буфер даного винаходу є особливо придатним для якщо потрібен більш високий рівень імунореактиввведення радіоактивно міченого антитіла. ності або питомої активності. Нами було досягнуто Наприклад, буфер даного винаходу має рапитомої активності для 90Y приблизно 20мКі/мг. діопротектор, такий як альбумін сироватки людини Специфічність зв'язування для терапевтичного (HSA) або аскорбат, який мінімізує радіоліз через застосування потрібна не менше ніж 50%. ітрій та інші сильні радіонукліди, інші засоби захиУ заявках, які ще на стадії розгляду, 09/____ сту від радіоактивного опромінення фахівцям тата 09/____, і які подавалися нами разом з даною кож відомі й можуть бути застосовані у буфері дазаявкою, описано аналізи зв'язування, які можуть ного винаходу, наприклад, поглиначі вільних бути корисними у разі необхідності для визначенрадикалів (фенол, сульфіти, глутатіон, цистеїн, ня відсотка зв'язувальної спорідненості та імуногентизинова кислота, нікотинова кислота, аскорбіреактивності кон'югатів після мічення. Слід зазналпальмітат, НОР(:О)Н2, гліцерин, формальдегідчити, що хоча після мічення за способом даного сульфоксилат натрію, Na2S2O5, Na2S2O3 та SO2 винаходу подальше очищення необов'язкове, але тощо). завжди має робитися аналіз на основі TLC для Буфер даного винаходу також має надлишкоперевірки рівня включення радіоактивної мітки, вий некон'югований комплексон. Включення некощоб не піддавати ризику здоров'я пацієнта. Такий н'югованого комплексону служить для захоплення аналіз здійснюють приблизно за 3-4 хвилини, і він будь-якої незв'язаної з білком радіоактивної мітки не має значного впливу на стабільність ефективв організмі пацієнта та виділення радіоактивної ності радіотерапевтичного засобу. мітки, таким чином зменшуючи поглинання "докістДаний винахід також включає в себе комплеккових" ізотопів, тобто 90Y, кістками пацієнта. Нати для радіоактивного мічення кон'югованого комприклад, коли антитіло комплекту є кон'югованим плексону білка або пептиду з терапевтичним радо комплексону DTPА, надлишковий DTPA або діоізотопом для введення пацієнтові, які мають (і) будь-який інший комплексон може бути включений флакон, що містить кон'югований комплексон білка у буфер. Буфер також в оптимальному варіанти або пептиду, (іі) флакон, що містить буфер для пропонується в такому об'ємі, щоб увесь вміст стабілізації та введення радіоактивно міченого можна було перелити в реакційний флакон. Як антитіла пацієнтові, та (ііі) інструкцію щодо викобуло вказано вище, це полегшує застосування та нання процедури радіоактивного мічення, за якою здатність до відтворювання: не потрібно вимірюкон'югований комплексон білка або пептиду зазнавати й переливати точний об'єм. вав дії радіоізотопу або його солі протягом достатОптимальний буфер має фосфатний буфернього часу за сприятливих умов, рекомендованих ний або фізіологічний розчин, альбумін сироватки у вищезгаданій інструкції й докладніше описаних людини та DTPA. Альбумін сироватки людини в вище, можна було б одержати радіоактивно мічеоптимальному варіанті має концентрацію приблиний білок або пептид, який має достатнє очищензно від 5 до 25% (маса/об'єм), краще - приблизно ня, питому активність та специфічність зв'язуван7,5% (маса/об'єм). Концентрація DTPA в оптиманя, щоб радіоактивно мічене антитіло могло бути льному варіанті становить приблизно 1мМ. Аскоррозведене у відповідній концентрації у вищезгадабат можна застосовувати як альтернативу альбуному буфері і введене безпосередньо пацієнтові міну сироватки людини, і його, як правило, 15 75036 16 застосовують у концентрації приблизно від 1 до го комплекту для радіоактивного мічення, який є 100мг/мл. Втім концентрацію можна змінювати в легким у користуванні і який забезпечує вихід раширокому діапазоні без ризику для пацієнта. діоактивно мічених антитіл при 95% включення Комплект може пропонуватися в інших альтерадіоактивної мітки та прийнятному збереженні рнативних варіантах втілення, залежно від побазв'язування з антигенопозитивними клітинами. жань замовника. Наприклад, цей комплект може Проводили також оцінку параметрів експерименту, також мати стерильний реакційний флакон, у якоякі впливають на зв'язування та включення радіоаму можна здійснювати і реакцію мічення, і розвективної мітки. дення в буфері. Можливі й інші варіанти втілення, Приклад 1. Комплект для радіоактивного міу яких буфер для регулювання рівня pH радіоакчення та спосіб мічення 2В8 90Y тивної мітки з міркувань економії пропонується A. Реагенти у комплекті для радіоактивного розташовувати у самому реакційному флаконі. До мічення того ж, можуть передбачатися комплекти, які та1. 2B8-MX-DTPA, !DEC; партія №082395RM2 кож мають флакон радіоізотопу, хоча зручніше 2. 50мМ ацетату натрію, з низьким вмістом мебуло б замовляти комплект для мічення заздалеталів, IDЕС; партія №082395RM3 гідь і окремо замовляти радіоізотоп пізніше, перед 3. Буфер (IХ PBS, pH 7,4, містить 7,5% (масамим введенням. Також можуть передбачатися са/об'єм) альбуміну сироватки людини та 1мМ комплекти, які містять флакон вторинного білка DTPA), IDЕС, партія №082395RM1 або пептиду, що служить для контролю за визна4. Реакційний флакон, 10мл, IDЕС ченням зв'язувальної спорідненості радіоактивно B. Матеріали та обладнання міченого продукту або у деяких випадках застосо1. BiodexTec-ControI, комплект для включення вується у комбінованому терапевтичному режимі з радіоактивної мітки, кат. №151-770 радіоактивно міченим білком або пептидом. 2. Рукавички: без порошку Мічене 90Y мишаче моноклональне антитіло 3. Стерильні поліпропіленові шприці анти-СD20 (Υ2Β8) нині проходить клінічні випробу4. Стерильні голки для шприців вання на лікування рецидивів лімфоми B-клітин. 5. Маленькі пробірки з кришками; 1,5мл С Антитіло 2В8 є мишаче антитіло, яке розпізнає Способи CD20 людини. Дикий варіант цього антитіла 1. Одержання Y2B8 з застосуванням комплек(Rituxan ) нещодавно було ухвалено Управлінням ту для радіоактивного мічення з контролю за продуктами та ліками (FDA) для Реагенти комплекту одержували й поміщали у лікування лімфоми, яка не є лімфомою Ходжкіна. скляні флакони з мембранами. Боросилікатні флаУ заявці США №08/475,813, на яку нами робиться кони типу I (2 або 10мл) промивали стерильною водою для ін'єкцій (WFI) і перед заповненням авпосилання, описано послідовне введення Rituxan токлавували. Бутилкаучукові мембрани промивали з міченим ітрієм мишачим моноклональним антистерильною WFI і перед використанням автоклатілом у комбінованому терапевтичному режимі, вували. Реагент заливали вручну, ущільнювали у при якому введення міченого ітрієм антитіла антикамері CIass 100 і випробували на пірогенність та СD20 після введення Rituxan є достатнім для (а) стерильність, застосовуючи способи USP. відокремлення всіх периферійних B-клітин крові, Додаткові реагенти: не відокремлених диким антитілом анти-CD20; (б) 1. Iтрій-[90]: хлоридна сіль, без носія, в HCI. початку очищення B-клітин від лімфатичних вузлів; Заходи безпеки: або (в) початку очищення B-клітин від інших тка1. Усі етапи мають здійснюватися з застосунин. ванням асептичних технологій. Таким чином, після доведення ефективності 2. Компоненти комплекту для радіоактивного антитіла анти-СD20 у лікуванні лімфоми, яка не є мічення перед застосуванням повинні бути кімнатлімфомою Ходжкіна, і при відомій чутливості лімної температури. фоцитів до радіоактивності потрібно, щоб такі теПротокол радіоактивного мічення рапевтичні антитіла були запущені у промислове 1. Об'єм 90YСI3 для додавання у реакційний виробництво у формі комплектів, завдяки чому флакон розраховували так: вони можуть бути легко модифіковані радіоактива. Концентрація радіоактивності на час радіоаною міткою і введені безпосередньо пацієнтові у ктивного мічення: клінічних умовах. C0 = Концентрація радіоактивності на час граКомплект для радіоактивного мічення для андуювання (див. Свідоцтво про проведення аналізу титіла 2В8 в оптимальному варіанті складається з від виробника). чотирьох компонентів: 1) 2B8-MX-DTPA у нормаt = Зміна у часі (додатне число - після градульному соляному розчині з низьким вмістом метаювання, від'ємне число - перед градуюванням). лів при 2мг/мл, 2) 50мМ ацетату натрію, який застосовують для доведення розчину радіоізотопу С0 до прийнятного для мічення pH, 3) буфер (IХ PBS, Концентрац ія радіоактивності на час мічення pH 7,4, який містить 7,5% альбуміну сироватки е 0,0108 t 90 людини та 1мМ DTPА), і необов'язково, 4) порожб. Об'єм YСl3 для додавання у реакційний ній 10мл скляний флакон (реакційний флакон) флакон: ("10мл" реакційний флакон насправді легко вміщує 45 мКі 10мл, і його технічна місткість становить дещо Об' єм, доданий у реакційний флакон Концентрац ія радіоактивності на час мічення більше ніж "10мл"). Усі компоненти перевірено на стерильність та відсутність пірогенів. 2. Об'єм 50мМ ацетату натрію для додавання У цьому розділі подано дані випробувань цьо 17 75036 18 у реакційний флакон розраховували так: 6. Гамма-лічильник або сцинтиляційний лічиа. Для 90YCl3 у 0,040Μ HCL (Amersham): льник 7. Піпетка Об'єм 90YCl3 (Етап 1б) (0,8)=об'єм ацетату наПроцедура: трію, який має додаватися 1. Спочатку слід повністю прочитати Посібник б. Для 90YCI3 у 0,050Μ НСI (Nordion): 90 Biodex. Об'єм YCl3 (Етап 1б) (1,0)=об'єм ацетату на2. Кожен радіоактивно мічений зразок у трьох трію, який має додаватися примірниках випробували згідно з вказівками до 3. Мембрани реакційного флакона та флакона комплекту; передбачено одну смужку на флакон. з ацетатом натрію протирали спиртом. Застосову3. Для нанесення радіоактивно міченого зразючи 1см3 шприц, розрахований об'єм (Етап 1а або ка на хроматографічну смужку застосовували піпе1б) 50мМ ацетату натрію (Етап 2) переносили до тку, щоб нанести 1мкл на джерело. В альтернатиреакційного флакона. Вміст флакона перемішувавному варіанті наносять невеличку краплю через ли, перевертаючи його кілька разів. 26G голку стерильного 1см3 шприца. Антитіло за4. Мембрану флакона з 90YCl3 протирали лишається у джерелі, і невключений 90Y-DTPA спиртом. Флакон з голкою оснащали стерильним 3 рухається разом з розчинником. 0,2мкм фільтром. Застосовуючи 1см шприц, не4. Для кожної ділянки визначали активність, обхідний об'єм (Етап 1б) 90YCl3 переносили до застосовуючи відповідний лічильник, тобто сцинреакційного флакона. Вміст флакона перемішуватиляційний лічильник для 90Y, з регулюванням за ли, перевертаючи його кілька разів. фоном. 5. Мембрану 2B8-MX-DTPA флакона протира5. Виконували вказівки Biodex для розрахунку ли спиртом, застосовуючи 3см3 стерильний відсотка радіоактивно міченого антитіла. шприц, 1,5мл 2B8-MX-DTPA переносили до реак3. Аналіз зв'язування ційного флакона. Вміст флакона перемішували, Додаткові реагенти перевертаючи його кілька разів. 1. 90Y2B8-MX-DTPA 6. Загальний об'єм реакційної суміші розрахо2. Ліофілізовані клітини вували шляхом додавання кількості доданого Υ-90 Лінії клітин людини SB (СD20-позитивні) та хлориду (Етап 4) до кількості 50мМ доданого ацеHSB (СD20-негативні) отримували від Американтату натрію (Етап 3) та кількості доданого 2B8-MXського зібрання типових культур і культивували у DTPA (Етап 5). Т-подібних колбах, застосовуючи ОБ./ХВ.-1640, що 7. Об'єм буфера для додавання до реакційномістить 10% сироватки ембріона великої рогатої го флакона до остаточного об'єму 10мл розрахохудоби з 2% глутаміну. Культури тримали при 37°С вували шляхом віднімання загального реакційного у середовищі 5% СО2. Співвідношення клітини, як об'єму, розрахованого на етапах з 6 по 10. правило, доводили до 1:2 кожен другий день і зби8. Флакон для буфера протирали спиртом і з рали при 0,5-2,5 106клітин/мл та життєздатності флакона відводили повітря. Через в'язкість буфе>80%. Концентрацію клітин визначали, застосовура реакційний флакон з голкою оснащали 0,20мкм ючи гемацитометр, а життєздатність визначали фільтром. Застосовуючи 10см3 стерильний шприц, шляхом виключення трипанового синього. оснащений голкою відповідного розміру, об'єм Клітини збирали при навколишній температурі буфера, розрахований на Етапі 7, переносили до реакційного флакона. Голку для відведення повітй густині клітин 0,5-2 106клітин/мл шляхом ря забирали з реакційного флакона і вміст флакоцентрифугування (1300об./хв. у центрифузі на перемішували, перевертаючи його кілька разів SorvaII) і двічі промивали у IХ HBSS. Гранульовані (кінцевий продукт). Флакон інкубували принаймні 5 клітини ресуспендували до 50 106клітин/мл у IХ хвилин перед "аналізом включення радіоактивної HBSS, що містить 1% (маса/об'єм) альбуміну симітки". Колір розчину був бурштиновий, реакційний роватки великої рогатої худоби (BSA) та 10% (мафлакон був повний, що підтверджувало додавання са/об'єм) маніту (ліофілізуючий буфер), по 0,5мл буфера. розподіляли у 1,5мл поліпропіленові мікроцентри9. Загальна радіоактивність флакона для кінфугувальні пробірки з кільцевими прокладками, цевого продукту вимірювали, застосовуючи відпозберігали при - 70°С і ліофілізували протягом ночі 90 відний набір інструментів для вимірювання Y. при 30-60 miIIitorr. Пробірки з ліофілізованими клі10. Кінцевий продукт безпосередньо зберігали тинами зберігали у сухому вигляді при 2-8°С і відпри 2-8°С, доки не застосовували для введення новлювали вологовміст у стерильній воді для анапацієнтові. лізів; пробірки з клітинами, ліофілізованими у 2. Аналіз включення радіоактивної мітки мікроцентрифугувальних пробірках, зберігали з Відсоток включення радіоактивної мітки видесикантом. значали шляхом моментальної тонкошарової хро3. Стерильна вода для промивання або стериматографії (ІTLC), застосовуючи радіохроматогльна вода для ін'єкцій рафічний комплект Biodex Tec-ControІ згідно з 4. Розріджувальний буфер (IХ PBS, pH 7,2-7,4, таким протоколом: містить 1% альбуміну сироватки великої рогатої Додаткові матеріали та обладнання: худоби (BSA) та 0,02% азиду натрію) 1. 90Y-радіоактивно мічений 2B8-MX-DTPA Процедура: 2. Пробірки для підрахунку радіоактивних TLC Одержання зразка радіоактивно міченого ансмужок титіла 3. Ножиці 1. Отримували радіоактивно мічене антитіло, 4. Стерильний шприц, 1см3 яке зберігали при 2-8°С. 5. Стерильні голки, 26G 2. Об'єм 10мкл забирали за допомогою Р20 і 19 75036 20 додавали у 1,5мл мікроцентрифугувальну пробірТаблиця 1 ку, що містила 990мкл розріджувального буфера (розведення 1:100). Кінчик промивали і пробірку Результати реліз-аналізу для перевірки Y2B8 злегка струшували. 3. Брали 50мл стерильну поліпропіленову Номер % включення радіоа% зв'язування пробірку з кришкою і 10мл розріджувального бупартії ктивної мітки фера поміщали у пробірку, застосовуючи 10мл 1 99,5 78,6 серологічну піпетку. 2 99,3 87,0 4. Об'єм 35мкл забирали за допомогою Р200 з 3 99,4 85,9 пробірки для 1:100 розведення й додавали у коні4 99,2 81,8 чну пробірку, що містила 10мл розріджувального 5 99,2 79,6 буфера. Ретельно перемішували. 6 96,3 80,8 Одержання ліофілізованих клітин Середн.=98,8 Середн.=82,3 1. Брали три пробірки з ліофілізованими SBСтандартне відхи- Стандартне відхиклітинами. лення=1,24 лення=3,4 2. Об'єм 0,5мл SWFI додавали у кожну пробір%CV=1,25% CV = 4,2% ку, і пробірки струшували, доки не отримували суспензію однорідних клітин. Для шести підготовлених партій відсоток зв'я3. Брали три порожні 1,5мл мікроцентрифугузування був у межах від 78,6% до 87,0% при серевальні пробірки; у три пробірки додавали 0,5мл дньому 82,3%. Середнє значення включення рарозріджувального буфера, який являв собою контдіоактивної мітки для Y2B8 становило 98,8% (від роль, що не містив клітин. 96,3% до 99,5%). Разом ці результати підтверПротокол аналізу джують здатність до відтворювання та стійкість 1. У кожну пробірку додавали 0,5мл розведеспособів застосування комплекту для радіоактивного 90Y2B8-MX-DTPA. ного мічення для препаратів Y2B8, а також пока2. Пробірки поміщали на 45 хвилин у міксер зі зують, що Y2B8, одержані з застосуванням цього щільно закритими кришками. комплекту для радіоактивного мічення, є придат3. Через 45 хвилин інкубації при навколишній ними для використання у клінічних умовах. температурі клітини гранулювали шляхом мікроПриклад 2. Попередня оцінка параметрів реацентрифугування протягом 5 хвилин. кції - pH та часу реакції 4. Об'єм 0,8мл спливаючого шару переносили Кінетичні досліди спочатку здійснювали для до сцинтиляційних флаконів. оцінки включення радіоактивної мітки та зв'язу5. Сцинтиляційний коктейль додавали у кожен вання міченого 90Y антитіла (Υ2Β8) після реакцій флакон. мічення, здійснених за різних умов pH та часу реа6. Кількість радіоактивності у кожному флаконі кції. Для реакцій радіоактивного мічення у межах визначали, застосовуючи сцинтиляційний лічильрівня pH від 3,9 до 4,7 з часом інкубації 5 хвилин ник з регулюванням за фоном. включення радіоактивної мітки становило >96% D. Результати при >80% збереженні зв'язування з CD20Здатність до відтворювання та стійкість протопозитивними клітинами (Таблиця 2). Подібні реколів радіоактивного мічення для Y2B8 визначали, зультати отримували для часу інкубації 3, 5 та 10 здійснюючи кілька етапів перевірок, застосовуючи хвилин у межах рівня pH від 2,9 до 4,6 (Таблиця різні партії кожного радіоізотопу. Шість партій для 3). перевірки, кожна з Y2B8, одержували п'ять операторів. Ці партії мали позначення, вказані нижче, Таблиця 2 випробування здійснювали на такому обладнанні: №1: IDEC Pharmaceutical Кінетика радіоактивного мічення Υ2Β8: Вплив pH №2: IDEC Pharmaceutical на включення радіоактивної мітки та зв'язування з №3: IDEC Pharmaceuticats СD20-позитивними клітинами1 №4: MD Anderson Heaith Center №5: Mayo CІinic pH реак- Включення радіоактивної Зв’язування №6: City of Hope ція мітки (%) (%) Результати випробувань кожної партії наведе3,9 98,4 80,7 ні у Таблиці 1. 4,2 97,8 81,0 4,4 96,1 80,0 4,6 97,0 80,2 4,7 97,4 80,6 21 75036 22 антитіла та 4:1 молярне співвідношення комплекТаблиця 3 сону з антитілом, як описано в одночасно поданій нами заявці за номером 09/____, яка також на Кінетика радіоактивного мічення Y2B8: Вплив часу стадії розгляду й на яку нами робиться посилання. інкубації на включення радіоактивної мітки та зв'яIмунореактивність для композицій Y2B8 ви1 зування з СD20-позитивними клітинами значали, застосовуючи спосіб згідно з Lindmo et aI. Збільшуючи кількість щойно зібраних СD20позитивних SB-клітин, інкубували їх з незмінною Час інкубації Включення радіоактив- Зв'язування кількістю Y2B8 за умов надлишку антигену. Аналіз (хв.) ної мітки (%) (%) взаємооберненого графіка даних зв'язування поpH 3,9: 3 97,0 82,0 казав імунореактивність 72,2% для Y2B8 після 5 98,9 82,1 одного пробного приготування (Фігура 1). 10 99,2 82,3 Приклад 3. Визначення інших параметрів реаpH 4,7: 3 97,2 82,5 кції 5 96,7 81,8 I. Вступ 10 97,6 81,5 В експериментах, описаних у цьому розділі, 1 досліджували вплив відхилень від протоколу на Результати реакції мічення та досліди з визв'язування Y2B8, одержаного з застосуванням значення параметрів, вказані у Таблицях 2 та 3, комплекту для радіоактивного мічення Y2B8. На здійснювали з 2В8, що походить від системи ексзв'язування радіоактивно міченого антитіла мопресії клітин СНО; Кон'югат MX-DTPA одержували, жуть впливати кілька параметрів під час процесу застосовуючи протокол, подібний до застосовуварадіоактивного мічення (Таблиця 4). ного для охарактеризованого вище 2В8-49. Реакцію здійснювали, застосовуючи приблизно 3мг Таблиця 4 Відхилення від комплекту для радіоактивного мічення 1) Додавання надлишкового об'єму 90Y 2) Додавання меншого об'єму 90Y 3) Додавання надлишкового об'єму NaAc 4) Додавання меншого об'єму NaAc 5) Додавання надлишкового об'єму 2В8-МХ- DTPA 6) Додавання меншого об'єму 2В8-МХ-DTPA 7) інкубування >5хв. 8) інкубування
ДивитисяДодаткова інформація
Назва патенту англійськоюA method for radioactive marking the antibody conjugated with complexon or fragment of antibody with radioactive isotope yttrium- 90 and a set for realizing the same
Назва патенту російськоюСпособ радиоактивного мечения коньюгированного с комплексоном антитела или фрагмента антитела радиоактивным изотопом иттрий-90 и комплект для осуществления способа
МПК / Мітки
МПК: G01N 33/534, A61K 51/10, A61K 51/08
Мітки: мічення, радіоактивним, комплект, способу, антитіла, ізотопом, ітрій-90, кон'югованого, фрагмента, комплексоном, радіоактивного, здійснення, спосіб
Код посилання
<a href="https://ua.patents.su/15-75036-sposib-radioaktivnogo-michennya-konyugovanogo-z-kompleksonom-antitila-abo-fragmenta-antitila-radioaktivnim-izotopom-itrijj-90-ta-komplekt-dlya-zdijjsnennya-sposobu.html" target="_blank" rel="follow" title="База патентів України">Спосіб радіоактивного мічення кон’югованого з комплексоном антитіла або фрагмента антитіла радіоактивним ізотопом ітрій-90 та комплект для здійснення способу</a>
Наступний патент: Інгібітори для використання при гемостазі і модуляції імунної функції
Випадковий патент: Зонд для інтубації кишки