Спосіб одержання амідів з використанням мікроорганізмів видів rhodococcus
Формула / Реферат
1. Спосіб одержання амідів, який відрізняється тим, що нітрил, який застосовують як субстрат, перетворюють на відповідний амід з використанням мікроорганізмів видів Rhodococcus GF270 і Rhodococcus GF376, які депоновані під реєстраційними номерами DSM 12211 і DSM 12175 відповідно, а також їх функціонально еквівалентних мутантів, які мають здатність перетворювати нітрил на амід, екстрактів ферментів із цих мікроорганізмів.
2. Спосіб за п. 1, який відрізняється тим, що як нітрил застосовують необов'язково заміщений аліфатичний нітрил, який містить від 1 до 10 атомів вуглецю.
3. Спосіб за п. 1, який відрізняється тим, що як нітрил застосовують необов'язково заміщений аліфатичний нітрил, який містить від 4 до 10 атомів вуглецю в ароматичній кільцевій системі.
4. Спосіб за п. 3, який відрізняється тим, що ароматичний нітрил вибирають із сполук загальних формул:
 (І)
(І)
або
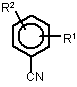 (ІІ),
(ІІ),
де R1 і R2 позначають атом водню, атом галогену або С1-С4алкіл.
5. Спосіб за будь-яким із пп. 1-4, який відрізняється тим, що перетворення здійснюють при температурі від 0 до 50°С і при значенні pH від 4,5 до 10.
6. Штам мікроорганізму Rhodococcus GF270, депонований під реєстраційним номером DSM 12211, його функціонально еквівалентні мутанти, а також екстракт їх ферментів, що мають здатність перетворювати нітрил на амід.
7. Штам мікроорганізму Rhodococcus GF376, депонований під реєстраційним номером DSM 12175, його функціонально еквівалентні мутанти, а також екстракт їх ферментів, що мають здатність перетворювати нітрил на амід.
Текст
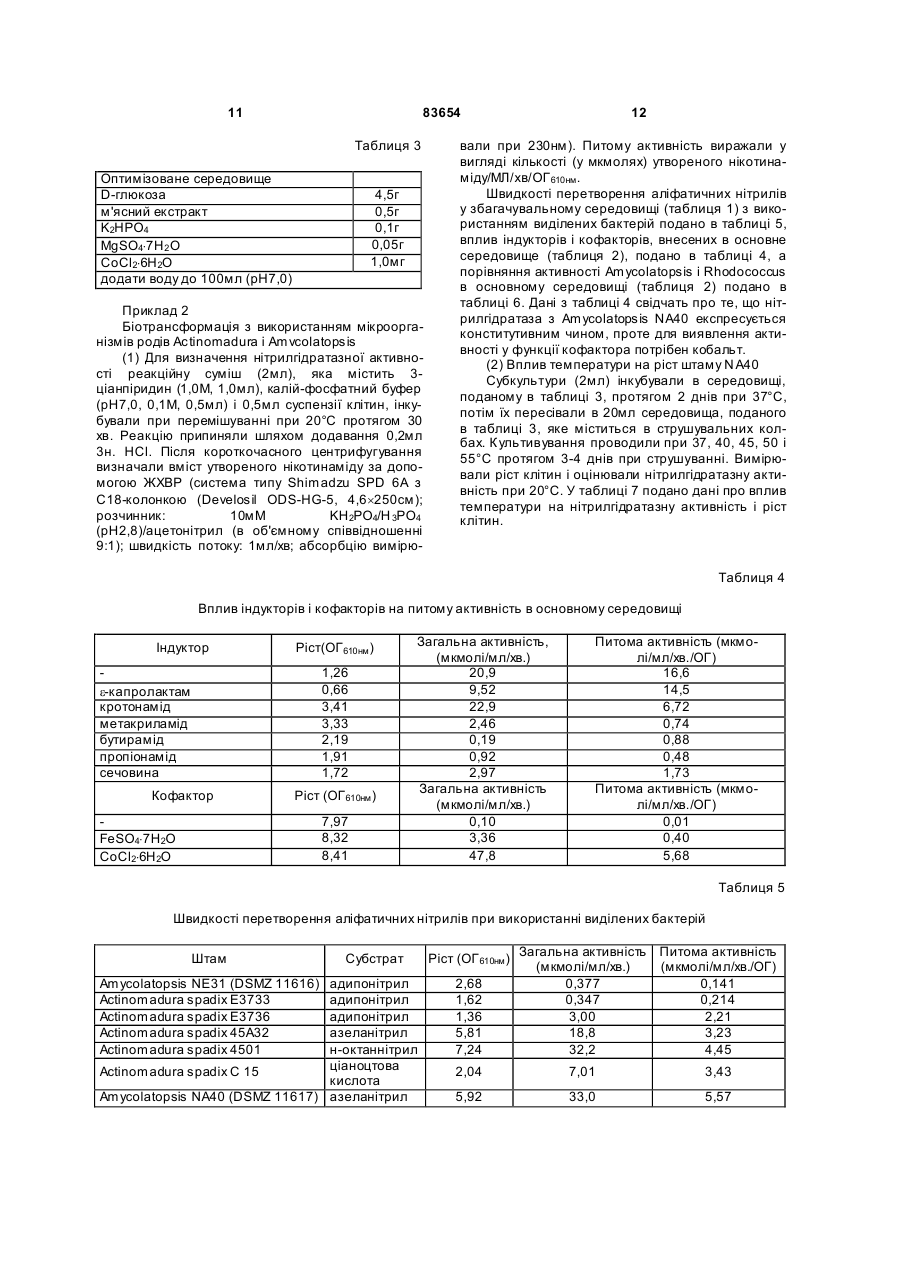
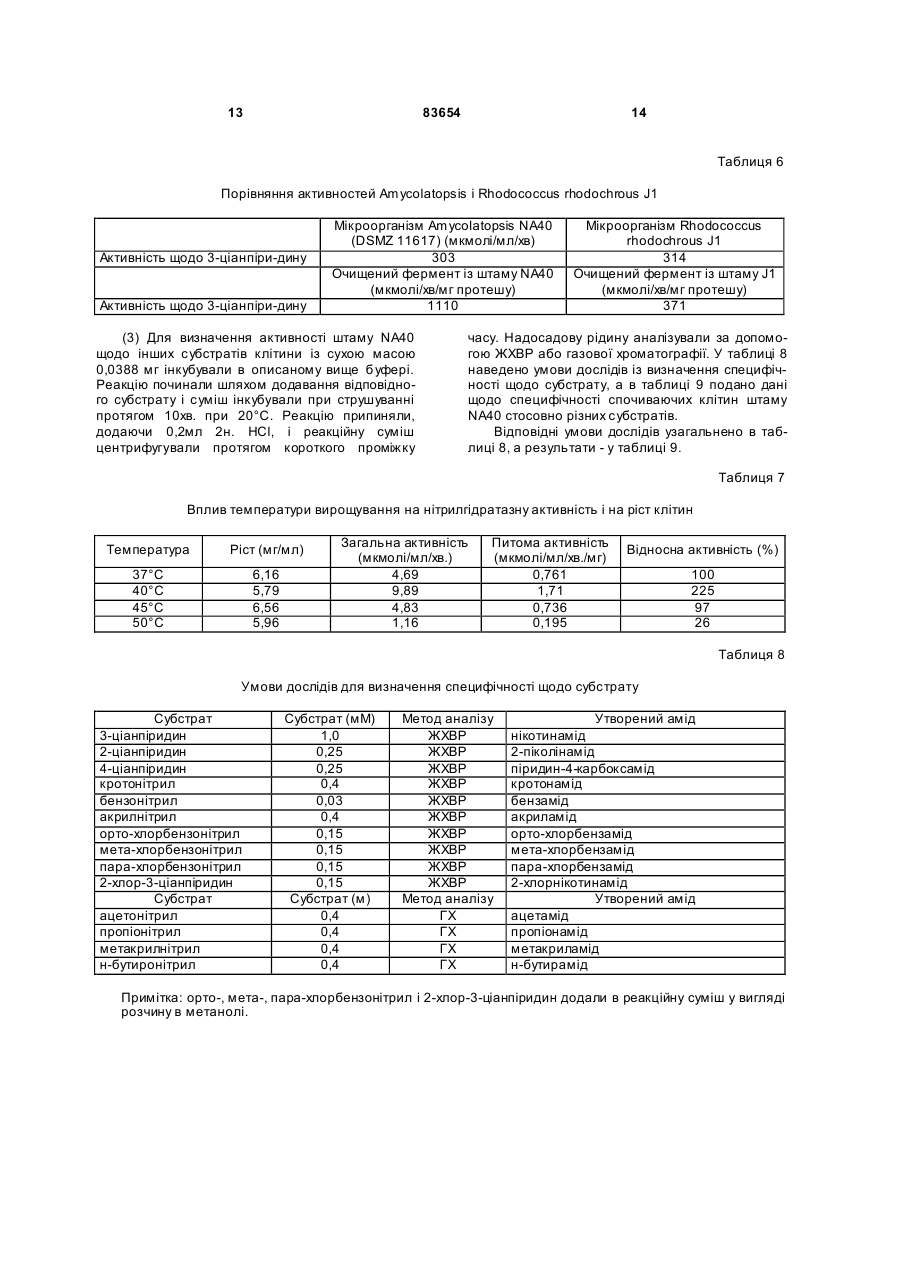
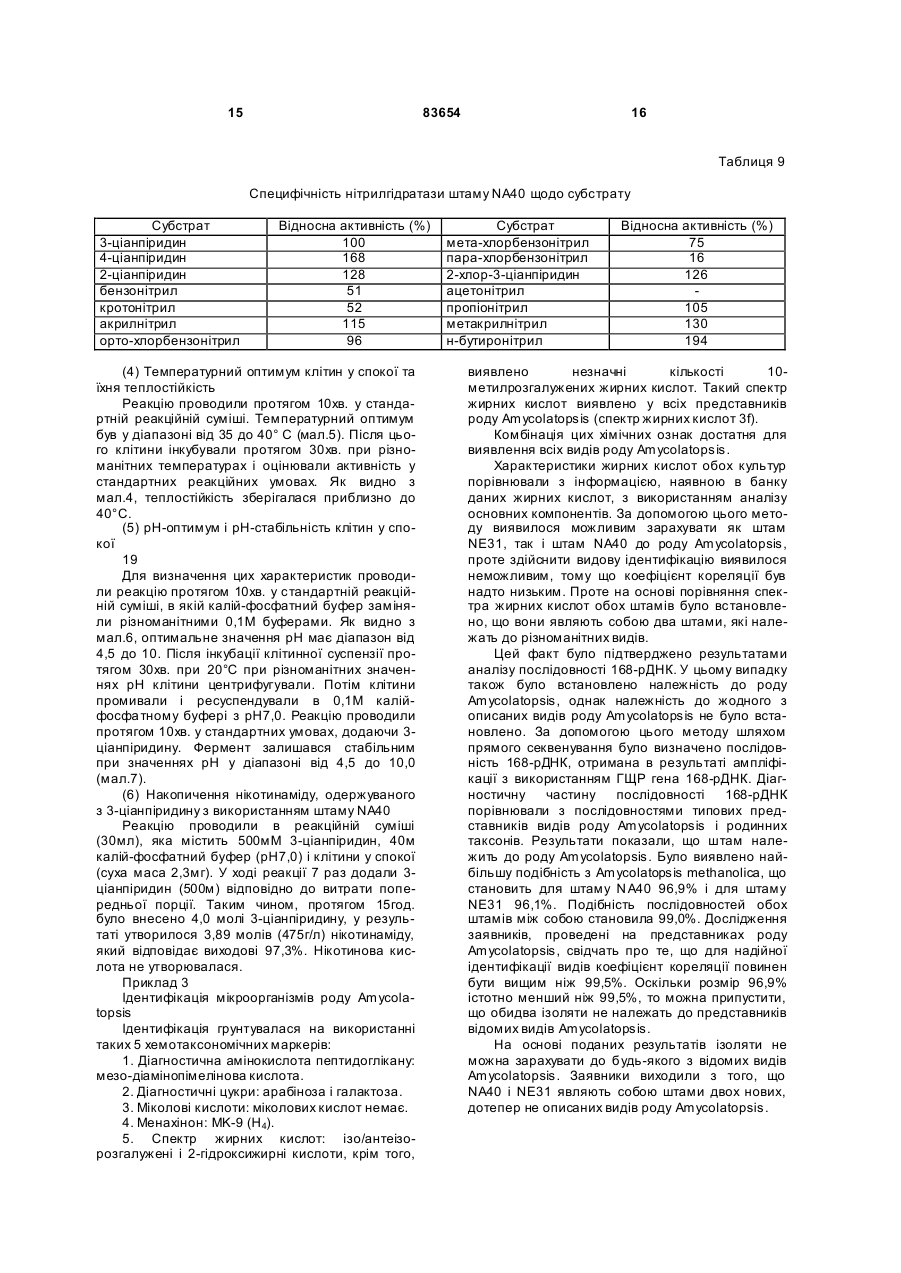
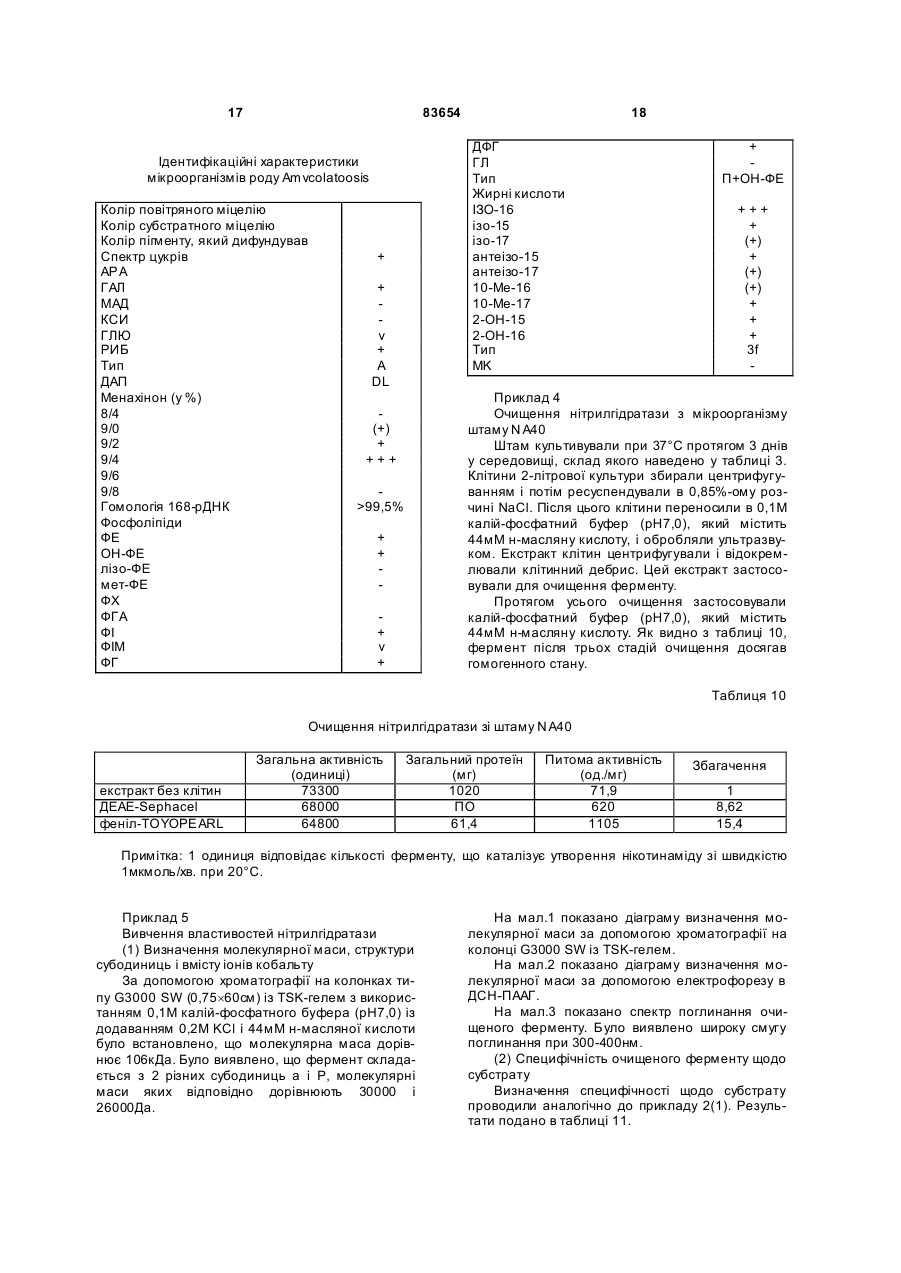
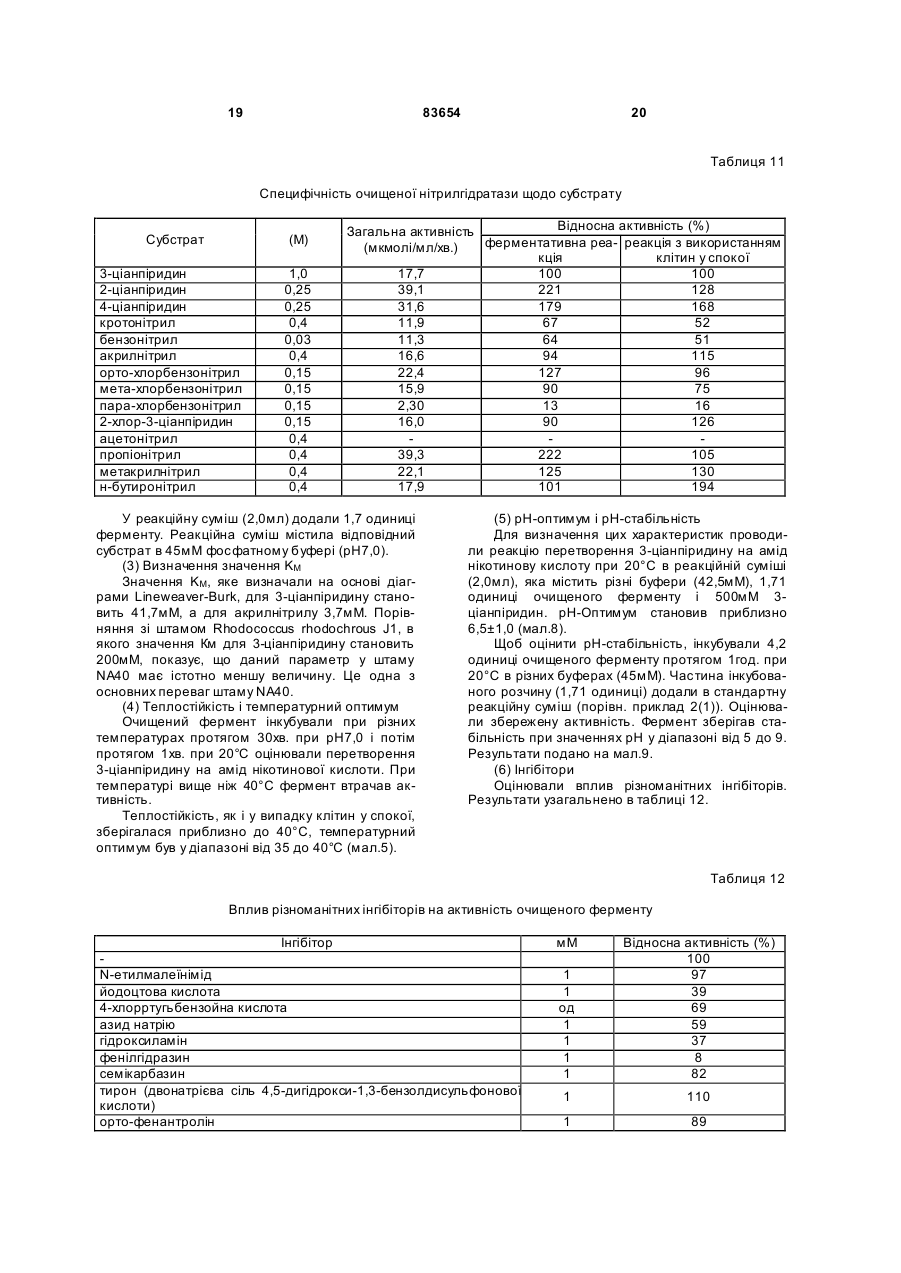
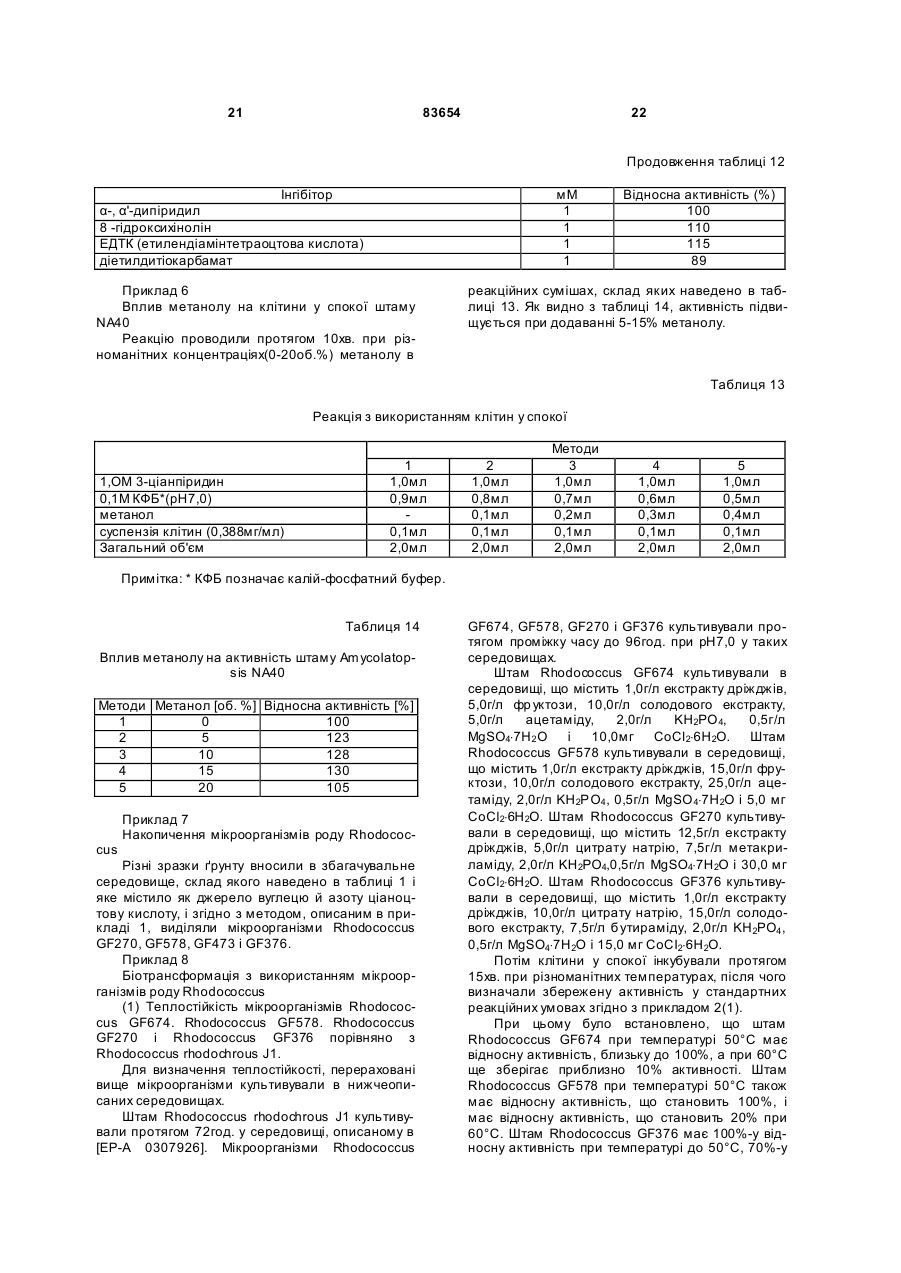
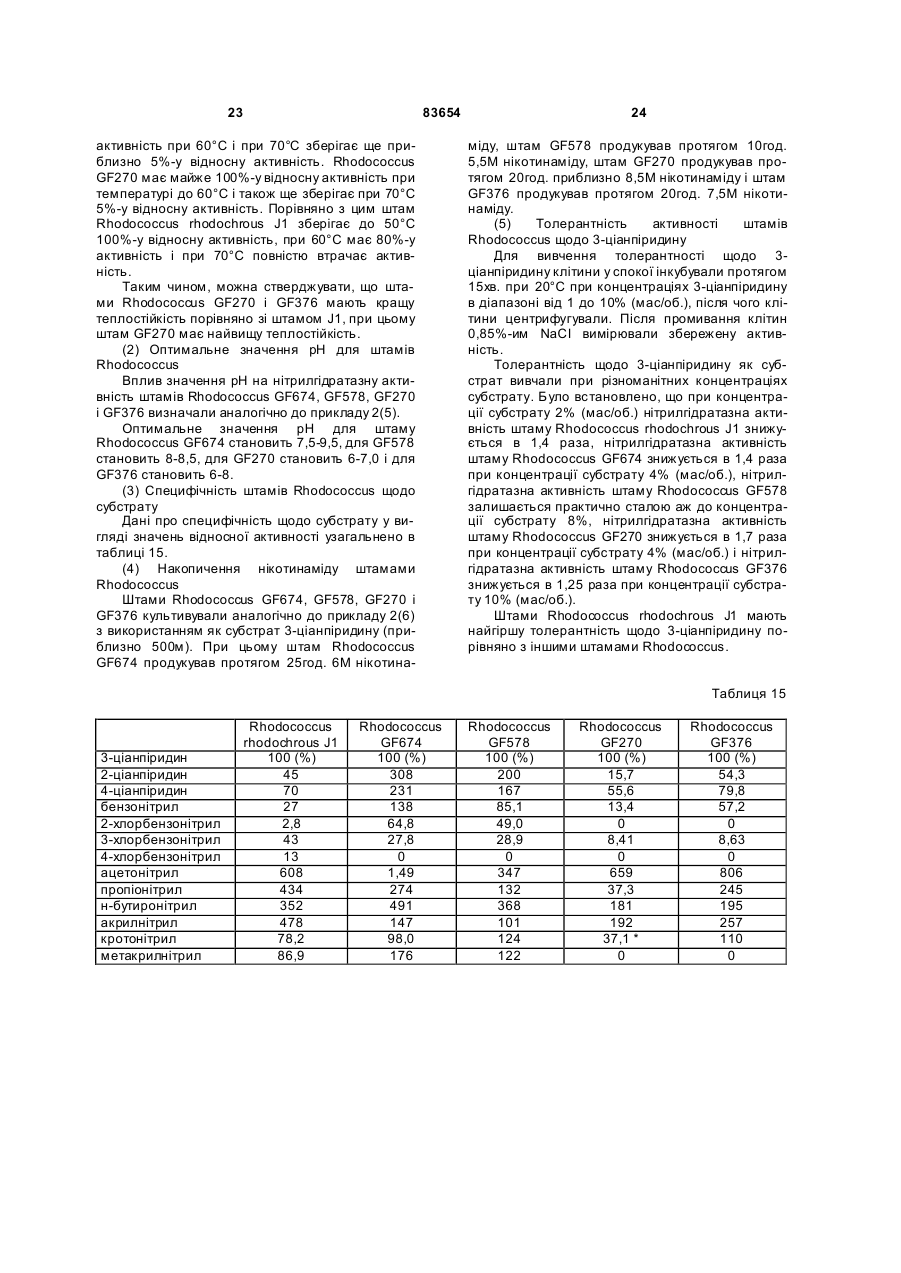
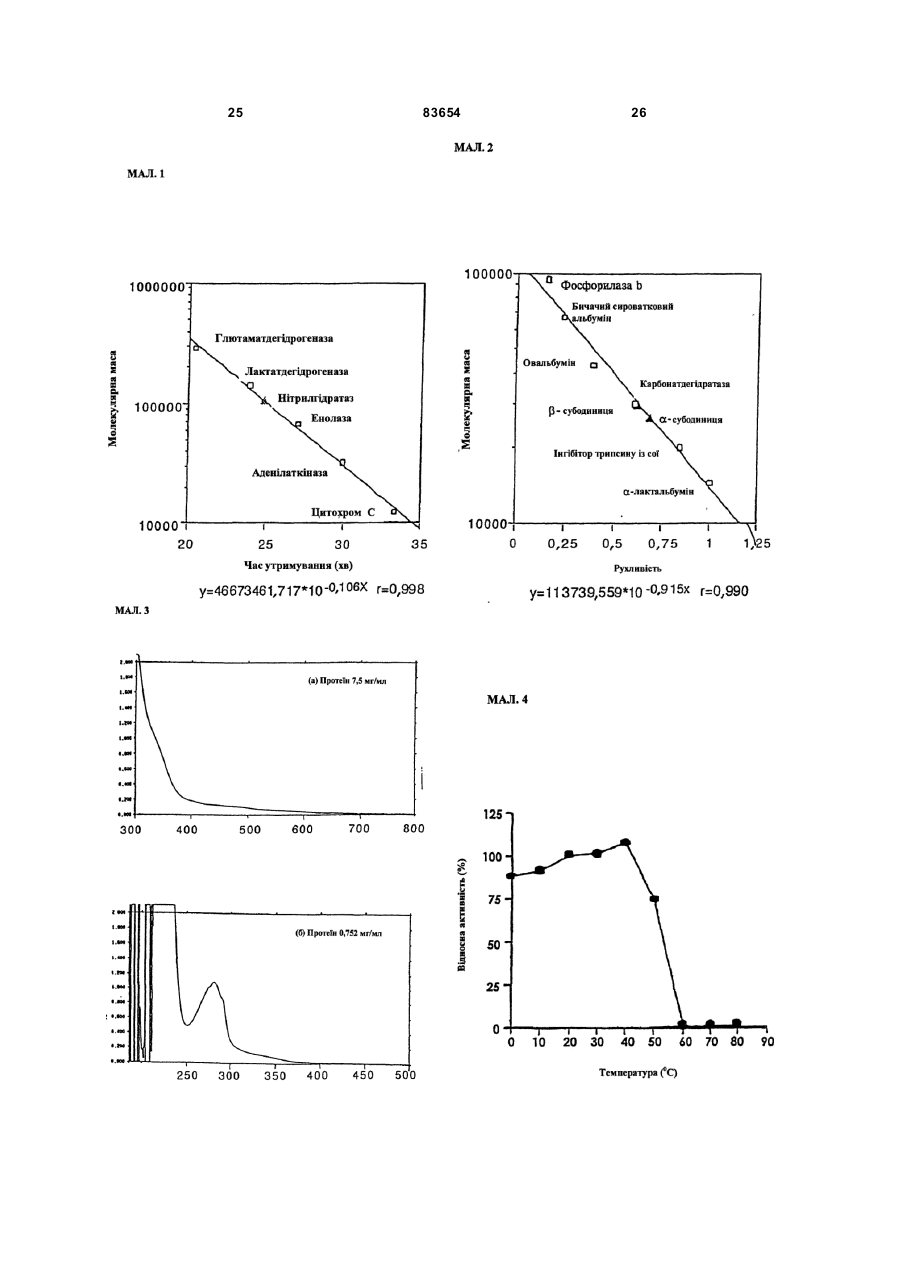
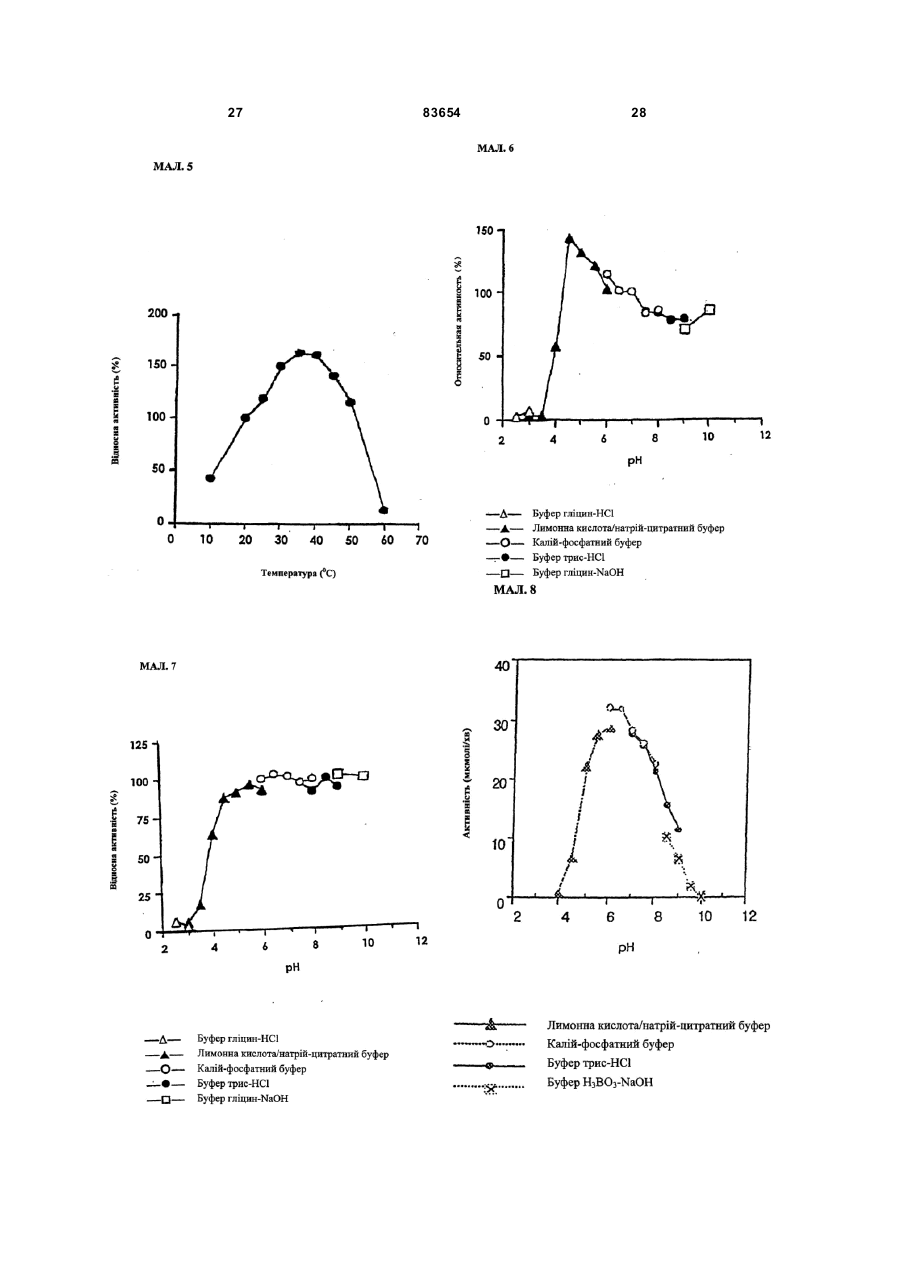
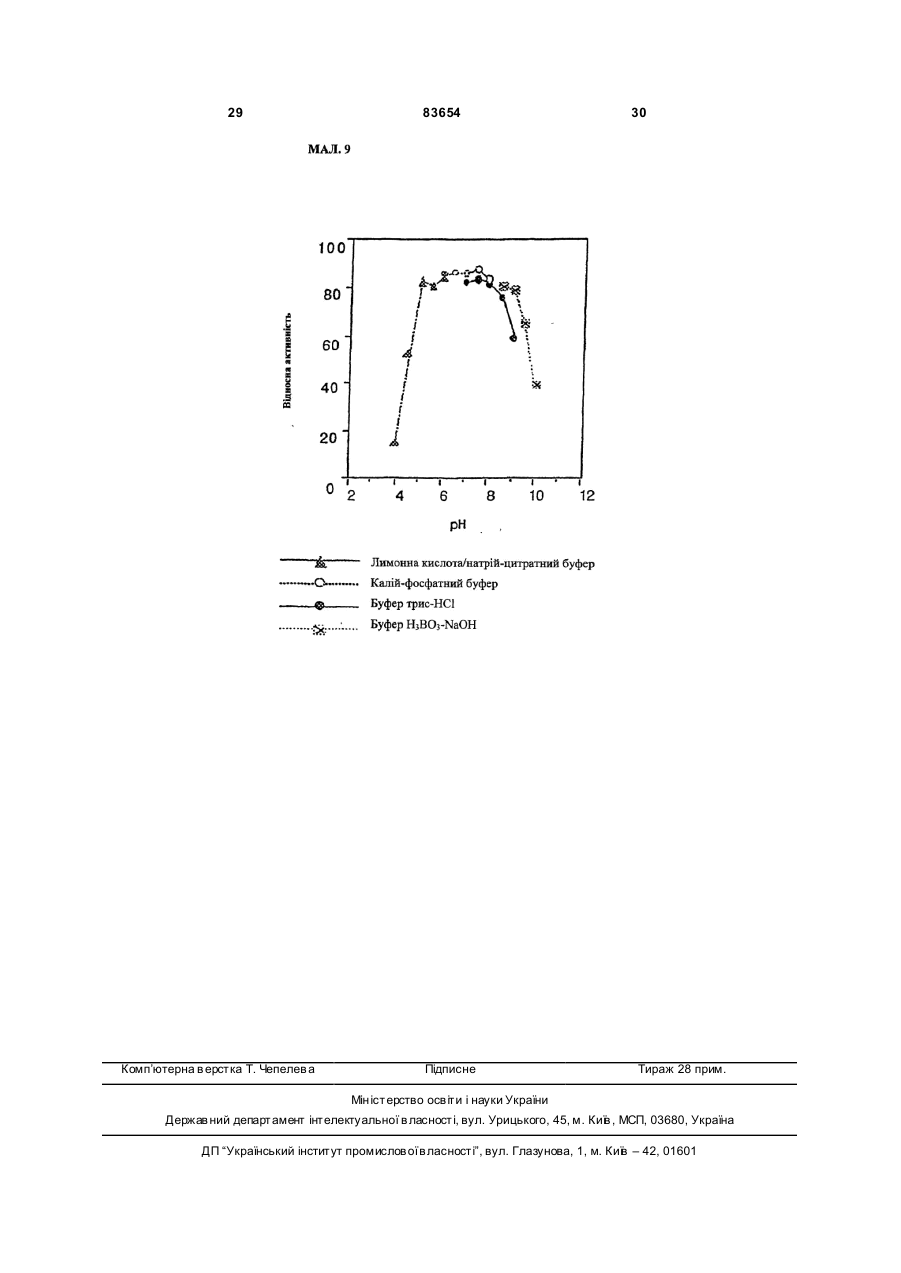
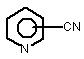
1. Спосіб одержання амідів, який відрізняється тим, що нітрил, який застосовують як субстрат, перетворюють на відповідний амід з використанням мікроорганізмів видів Rhodococcus GF270 і Rhodococcus GF376, які депоновані під реєстраційними номерами DSM 12211 і DSM 12175 відповідно, а також їх функціонально еквівалентних мутантів, які мають здатність перетворювати нітрил на амід, екстрактів ферментів із цих мікроорганізмів. 2. Спосіб за п. 1, який відрізняється тим, що як нітрил застосовують необов'язково заміщений аліфатичний нітрил, який містить від 1 до 10 атомів вуглецю. 3. Спосіб за п. 1, який відрізняється тим, що як нітрил застосовують необов'язково заміщений аліфатичний нітрил, який містить від 4 до 10 атомів вуглецю в ароматичній кільцевій системі. 4. Спосіб за п. 3, який відрізняється тим, що ароматичний нітрил вибирають із сполук загальних формул: Даний винахід стосується нових мікроорганізмів родів Actinomadura, Amycolatopsis і Rhodococcus, а також нового способу одержання амідів з використанням цих мікроорганізмів, відповідно з використанням екстракту ферментів цих мікроорганізмів. CN (І) N або R2 (13) 83654 (11) (19) CN де R1 і R2 позначають атом водню, атом галогену або С1-С4алкіл. 5. Спосіб за будь-яким із пп. 1-4, який відрізняється тим, що перетворення здійснюють при температурі від 0 до 50°С і при значенні pH від 4,5 до 10. 6. Штам мікроорганізму Rhodococcus GF270, депонований під реєстраційним номером DSM 12211, його функціонально еквівалентні мутанти, а також екстракт їх ферментів, що мають здатність перетворювати нітрил на амід. 7. Штам мікроорганізму Rhodococcus GF376, депонований під реєстраційним номером DSM 12175, його функціонально еквівалентні мутанти, а також екстракт їх ферментів, що мають здатність перетворювати нітрил на амід. C2 (ІІ), UA R1 3 83654 Для одержання амідів, таких, як, наприклад, амід нікотинової кислоти, який є важливим для тварин і людей вітаміном комплексу вітамінів В, уже відомі численні біотехнологічні способи. Широко відомо, що мікроорганізми, які містять нітрилгідратазу, перетворюють нітрили на відповідні аміди. Так, в [EP-A 0188316] описано спосіб одержання аміду нікотинової кислоти з 3ціанпіридину з використанням мікроорганізмів родів Rhodococcus, Arthrobacter або мікобактерій. Вадою цього способу є те, що дані мікроорганізми мають лише незначну активність щодо перетворення 3-ціанпіридину на аміднікотинову кислоту. B [EP-A 0307926] описано перетворення 3ціанпіридину на амід нікотинову кислоту за допомогою мікроорганізмів виду Rhodococcus rhodochrous J1. Для того щоб ці мікроорганізми каталізували потрібне перетворення, їх слід індукувати. Ще однією вадою цього способу є те, що Rhodococcus rhodochrous J1 має червоне забарвлення і внаслідок цього відбувається фарбування продукту. Крім того, цей мікроорганізм має лише незначну теплостійкість і інгібується, наприклад, субстратом 3-ціанпіримідином. Ще один спосіб одержання аміду нікотинової кислоти з 3-діанпіридину за допомогою мікроорганізмів виду Rhodococcus rhodochrous J1 описано в [EP-A 0362829]. Щоб підвищити питому активність мікроорганізмів, які містять нітрилгідратазу, у середовище для культивування у функції індуктора додають сечовину або похідне сечовини. При використанні цього способу, так само як і способу, описаного вище, відбувається фарбування продукту. Далі в [WO 95/17505] описано спосіб одержання ароматичних амідів з відповідних нітрилів за допомогою мікроорганізмів виду Rhodococcus rhodochrous MЗЗ. Вадою цього способу є червоне забарвлення Rhodococcus rhodochrous MЗЗ, а також високе значення Km для субстрату 3ціанпіридину. Завдання даного винаходу - усун ути згадані вади і розробити такий спосіб одержання амідів, який забезпечував би одержання відповідних амідів з високим виходом і високим ступенем чистоти. Зазначене завдання вирішується за допомогою нових мікроорганізмів за п.п.1 і 3, а також за допомогою способу за п.6. Суть способу за винаходом полягає в тому, що використовуваний як субстрат нітрил перетворюють на відповідний амід за допомогою мікроорганізмів роду Actinomadura, Amycolatopsis або Rhodococcus, за допомогою екстракту ферментів цих мікроорганізмів або за допомогою очищеної нітрилгідратази з мікроорганізмів роду Amycolatopsis або Actinomadura. Застосовувані для біотрансформації нітрили, такі, як, наприклад, 3-ціанпіридин, являють собою сполуки, наявні у продажу. Мікроорганізми за винаходом мають здатність перетворювати використовувані як субстрат нітрили на відповідні аміди. Бажано, щоб ці мікроорганізми мали здатність рости в середовищах, які міс 4 тять нітрили або аміди як єдині джерела вуглецю і/або азоту. Мікроорганізми за винаходом одержують шляхом відповідного відбору, наприклад, із зразків ґрунту, м улу або стічних вод за допомогою звичайних мікробіологічних методів. Доцільно здійснювати відбір мікроорганізмів шляхом вирощування в середовищі, яке в бажаному варіанті містить нітрили або аміди як єдині джерела вуглецю й азоту, в присутності іонів кобальту. Придатні для здійснення відбору нітрили й аміди являють собою насамперед нітрили, які також застосовують як субстрат для наступної біотрансформації, і відповідні одержувані з них аміди. Придатні для росту середовища також відомі спеціалістові в даній галузі; наприклад, може використовуватися середовище, подане в таблиці 1. Як правило, мікроорганізми до здійснення власне біотрансформації культивують (вирощують) у ти х самих умовах, застосовуючи при цьому вищезазначені середовища. Як відомо спеціалістам, нітрилгідратаза утвориться тільки тоді, коли середовище для росту містить іони кобальту як кофактор. Придатними "кобальтовими сполуками, що утворюють іони кобальту", є солі, які містять Co2+ або Co3+. Прикладами солей, які містять Co2+ або Co3+, є хлорид кобальту, сульфат кобальту й ацетат кобальту. У функції кобальтової сполуки доцільно застосовува ти сіль, яка містить Co2+, таку, як, наприклад, CoCl2. Вирощування можна також здійснювати в присутності вітаміну В12 разом із металевим кобальтом або іншими кобальтовими сполуками, які in situ дають іони кобальту. Доцільно застосовувати кобальтову сполуку в кількості від 1 до 10мг/л, бажано від 1 до 3мг/л. Як правило, вирощування здійснюють при температурі від 20 до 50°C і при значенні рН у діапазоні від 5 до 8, бажано при температурі від 30 до 45°C і значенні рН у діапазоні від 5,5 до 7,5. Власне біотрансформацію можна здійснювати за допомогою мікроорганізмів родів Actinomadura, Amycolatopsis, з використанням екстракту ферментів цих мікроорганізмів або з використанням очищеної нітрилгідратази з цих мікроорганізмів. Доцільно здійснювати біотрансформацію з використанням мікроорганізмів виду Actinomadura spadix, наприклад, ізолятів Actinomadura spadix Е3733, Actinomadura spadix E3736, Actinomadura spadix 45A32, Actinomadura spadix 4501 або Actinomadura spadix C15. Бажано біотрансформацію здійснювати з використанням мікроорганізмів, які належать до видів Amycolatopsis NE 31 і Amycolatopsis NA40, або їх функціонально еквівалентних варіантів і мутантів. Особливо бажано застосовувати мікроорганізми, які належать до виду Amycolatopsis NA40. Мікроорганізми зазначених видів, згідно з Будапештським договором, було депоновано 03.06.1997р. у Німецькій колекції мікроорганізмів і клітинних культур (Deutsche Sammlung von Mikroorganismen und Zeilkulturen Gmb, Mascheroderweg Ib, D-38124, Брауншвейг, Німеччина) під назвами Amycolatopsis NE 31 і Amycolatopsis NA40, вони дістали реєстраційні номери DSMZ 11616 і відповідно DSMZ 11617. 5 83654 Обидва ці мікроорганізми було точніше ідентифіковано і зараховано до ще не описаних в літературі видів роду Amycolatopsis. Таким чином, винахід також стосується мікроорганізмів роду Amycolatopsis або Actinomadura, які мають здатність перетворювати амід на нітрил, насамперед мікроорганізмів, які мають назву Amycolatopsis NA40 (DSMZ 11617) і Amycolatopsis NE31 (DSMZ 11616). При створенні винаходу далі було встановлено, що деякі мікроорганізми роду Rhodococcus мають кращі характеристики щодо перетворення нітрилів на аміди в порівнянні з Rhodococcus rhodochrous Л, описаним в [EP-A 0362829]. Цими мікроорганізмами є Rhodococcus GF674, Rhodococcus GF578, Rhodococcus GF473, Rhodococcus GF270 (DSMZ 12211) і Rhodococcus GF376 (DSMZ 12175) або їх функціонально еквівалентні варіанти і мутанти. Згідно з Будапештським договором, в Німецьку колекцію мікроорганізмів і клітинних культур 15.05.1998 р. було поміщено мікроорганізм, який має реєстраційний номер DSMZ 12175, а 08.06.1998р. було поміщено мікроорганізм, який має реєстраційний номер DSMZ 12211. Штами Rhodococcus GF270, GF376, GF473, GF578 і GF674 після ідентифікації зараховано до ще не описаних в науковій літературі видів роду Rhodococcus. Таким чином, винахід також стосується мікроорганізмів Rhodococcus GF270, Rhodococcus GF376, Rhodococcus GF473, Rhodococcus GF578 і Rhodococcus GF674. На відміну від мікроорганізмів роду Actinomadura, відповідно Amycolatopsis мікроорганізми роду Rhodococcus доцільно індукувати перед їхнім використанням для власне біосинтезу. Як індуктори придатні описані в [EP-A 0307926] індуктори, такі, як, наприклад, ацетамід, амід масляної кислоти, метакриламід, амід пропіонової кислоти, кротонамід і амід валеріанової кислоти. Під "функціонально еквівалентними варіантами і мутантами" розуміють мікроорганізми, які походять із вищевказаних організмів-попередників і володіють в основному такими ж властивостями і функціями, що й останні. Такі варіанти і мутанти можуть виникати випадково, наприклад, у результаті опромінення ультрафіолетовим світлом, або під дією хімічних речовин, які викликають мутації. Ідентифікація Amvcolatopsis NA40 Колір повітряного міцелію білий Колір субстратного міцелію жовтогарячий Колір пігменту, який дифундував Спектр цукрів АРА + ГАЛ + МАД КСИ ГЛЮ сліди РИБ + Тип А 6 ДАП Менахінон (у %) 8/4 9/0 9/2 9/4 9/6 9/8 Гомологія 16S-pflHK Фосфоліпіди, такі як ФЕ, ОН-ФЕ, лізо-ФЕ, мет-ФЕ, ФХ, ФГА, ФИ, ФИМ, ФГ, ДФГ, ГЛ Жирні кислоти ізо-16 ізо-15 ізо-17 антеізо-15 антеізо-17 10-Ме-16 10-Ме-17 2-ОН-15 2-ОН-16 Тип MК DL (+) + +++ 96,9% не досліджували +++ + (+) (+) (+) + + + 3f Ідентифікація Amvcolatopsis NE31 Колір повітряного міцелію білий Колір субстратного міцелію жовтогарячий Колір пігменту, який дифундував Спектр цукрів АРА + ГАЛ + МАД КСИ ГЛЮ сліди РИБ + Тип А ДАП DL Менахінон (у %) 8/4 9/0 9/2 + 9/4 +++ 9/6 9/8 Гомологія 169-рДНК 96,1% Фосфоліпіди, такі, як ФЕ, ОН-ФЕ, лізо-ФЕ, мет-ФЕ, ФХ, ФГА, ФИ, не досліджуФИМ, ФГ, ДФГ, ГЛ вали Жирні кислоти ізо-16 +++ ізо-15 + ізо-17 (+) антеізо-15 (+) антеізо-17 (+) 10-Ме-16 10-Ме-17 + 2-ОН-15 + 2-ОН-16 + Тип 3f MК 7 83654 Скорочення і пояснення, які використовувалися при ідентифікації (+) 1-5% + 5-15% ++ 15-30% +++ >30% ДАП діамінопімелінова кислота АРА арабіноза ГАЛ галактоза МАД мадуроза КСИ ксилоза ГЛЮ глюкоза РИБ рибоза Типи цукрів дані згідно з Lechevalier й ін., 1971 Типи жирних кислот дані згідно з Kroppenstedt, 1985 і 1992 9/4 МК-9(Н4) 9/6 МК-9 (H6) 9/8 МК-9 (H8) MK міколові кислоти ФЕ фосфа тидилетаноламін ОН-ФЕ гідрокси-ФЕ мет-ФЕ фосфа тидилметилетаноламін ФХ фосфа тидилхолін ФГА фосфа тидилглюкозамін ФІ фосфа тидилінозитол ФІМ фосфа тидилінозитолманозид ФГ фосфа тидилгліцерин ДФГ дифосфатидилгліцерин ГЛ гліколіпід Жирні кислоти ізо-16 ізогексадеканові кислоти або 14-метилпентадеканові кислоти 10-Ме-18 туберкулостеаринова кислота 2-ОН-16 2-гідроксипальмітинова кислота Ідентифікація штамів GF270. GF376. GF473. GF578 і GF674 Ідентифікацію цих штамів проводили на основі 5 незалежних один від одного характеристик 1. Морфологія і колір колоній: Короткі розгалужені гіфи, що розпадаються на елементи, які нагадують палички і спори. Колонії штамів GF270 і GF376 мають рожево-червоний колір (RAL 3022), а колонії штамів GF578 і GF674 мають яскравочервоний колір (RAL 3012). 2. Діамінокислоти пептидогліканів: Мезодіамінопімелінова кислота. 3. Міколові кислоти: міколові кислоти Rhodococcus: Визначення міколової кислоти з довгим ланцюгом здійснювали за допомогою високотемпературної газової хроматографії. Профілі елюювання міколових кислот штамів GF270 і GF376, а також штамів GF473, GF578 і GF674 були ідентичними. Ланцюги міколових кислот штамів GF270 і GF376 містили 38-46 атомів вуглецю, а ланцюги міколових кислот штамів GF473, GF578 і GF674 містили 40-48 атомів вуглецю. Характеристики міколових кислот порівнювали із характеристиками міколових кислот штамів Rhodococcus. Штам GF270 було ідентифіковано з дуже низьким 8 коефіцієнтом кореляції (0,086) як належний до виду Rhodococcus rhodochrous; GF376 не можна було ідентифікува ти цим методом. Інші три ізоляти GF473, GF578 і GF674 було ідентифіковано з дуже низьким коефіцієнтом кореляції як належні до виду Rhodococcus ruber. 4. Спектр жирних кислот: Нерозгалужені насичені і ненасичені жирні кислоти, включаючи туберкулостеаринову кислоту. Спектр жирних кислот є діагностичною ознакою для представників усіх родів Rhodococcus і споріднених родів Micobacterium, Nocardia, Dietzia, Tsukamurella і деяких видів коринебактерій. Ідентифікацію на видовому рівні здійснювали на основі кількісних і якісних розходжень характеристик жирних кислот штамів GF270, GF376, GF473, GF578 і GF674 і жирних кислот видів Rhodococcus. 5. Часткові послідовності 168-рДНК штамів GF270 і GF376 були ідентичними (100%), хоча порівняння їх з послідовностями штамів Rhodococcus виявило подібність тільки на 99,1% із найбільш спорідненим видом Rhodococcus rhodochrous. Штами GF473 і GF578 мали ідентичні послідовності 168-рДНК (100%). Штам GF674 мав відмінність від штаму GF578 тільки в одній парі основ із 500 (99,8%). Усі три ізоляти мали лише віддалену родинну подібність із Rhodococcus coprophilus (98,4%). На основі хемотаксичних і молекулярнобіологічних даних можна зробити висновок про те, що GF270 і GF376, з одного боку, і GF473, GF578 і GF674, з іншого боку, являють собою штами двох нових видів Rhodococcus. За своїми послідовностями 168-рДНК штами GF270 і GF376 є спорідненими з Rhodococcus rhodochrous (99,1%), а штами GF473, GF578 і GF674 мають лише віддалену родинну подібність із Rhodococcus coprophilus (98,4%). Екстракт ферментів можна отримати шляхом добре відомого фахівцям руйнування мікроорганізмів, наприклад, за допомогою ультразвуку, за допомогою преса типу Френч або з використанням лізозиму. Очевидно, що для здійснення способу цей екстракт ферментів, так само як і цілі клітини мікроорганізмів, можна імобілізувати на придатному носії, який являє собою полімер, або абсорбувати на придатному носії. Ферменти за винаходом, які мають нітрилгідратазну активність, можна отримати із мікроорганізмів роду Amycolatopsis, насамперед із штаму Amycolatopsis NA40 (DSMZ 11617), і вони мають здатність перетворювати нітрил в амід. Основними властивостями цих ферментів є такі: а) рН-оптимум становить 6,5±1,0; б) температурний оптимум при рН7,0 має межі 35-40°C; в) значення Km для субстрату 3-ціанпіридину становить 41,7±7,7м (20°C, 45мМ фосфа тний буфер, рН7,0), насамперед ферменти мають г) молекулярну масу 105кДа, що можна визначити, наприклад, за допомогою електрофорезу в ДСН-ПААГ. 9 83654 Як субстрат для біотрансформації можуть застосовуватися в принципі будь-які нітрили. Доцільно застосовувати або аліфатичні нітрили, які містять від 1 до 10 атомів вуглецю, у разі потреби заміщені, наприклад, гідроксигрупою, аміногрупою, галогеном або карбоксигрупою, або заміщені чи незаміщені ароматичні нітрили, які містять від 4 до 10 атомів вуглецю в ароматичній кільцевій системі. Як аліфатичні нітрили, які містять від 1 до 10 атомів вуглецю, можуть застосовуватися динітрили, гідроксинітрили, амінонітрили, такі, як, наприклад, н-октаннітрил, ціаноцтова кислота, ізокапронітрил, н-валеронітрил, адипонітрил, глутаронітрил, сукцинонітрил, себаконітрил, пропіонітрил, кротонітрил, акрилнітрил, метакрилнітрил, нітрил нмасляної кислоти або азеланітрил. Як ароматичні нітрили, які містять від 4 до 10 атомів вуглецю, можуть застосовуватися нітрили загальних формул де R1 і R2 позначають атом водню, атом галогену або С1-С4алкіл. Атом галогену може являти собою F, Cl, Br або J. С1-С4алкіл може являти собою метил, етил, пропіл, ізопропіл, трет-пропіл, бутил, ізобутил або трет-бутил. Придатними представниками ароматичних нітрилів загальної формули І або II є 2-, 3або 4-ціанпіридин, бензонітрил, фтор-, хлор-, бромбензонітрил, наприклад, орто-, мета-, парахлорбензонітрил або 2-хлор-3-ціанпіридин. Бажано як ароматичний нітрил, який містить від 4 до 10 атомів вуглецю, застосовувати 3-ціанпіридин. Біотрансформацію із застосуванням одноразового або безперервного завантаження субстрату доцільно проводити таким чином, щоб концентрація субстрату не перевищувала 40мас.%, бажано 30мас.%. Спосіб доцільно здійснювати з використанням клітин-споживачів ( які не ростуть). Як середовища для біотрансформації придатні звичайні в даній галузі техніки середовища, такі, як, наприклад, низькомолярний фосфатний буфер, буфер HEPES (N-2-гідроксіетилпіперазин-N'-2етансульфонова кислота), цитратний буфер, боратний буфер, середовища, склад яких поданий у таблицях 1-3, або їхні модифіковані форми, такі як, наприклад, середовище, описане в прикладі 8(1), або буфер трис-НСІ. Біотрансформацію доцільно проводити при температурі від 0 до 50°C і при значенні рН у діапазоні від 4,5 до 10, бажано при температурі від 20 до 40°C і при значенні рН у діапазоні від 4,5 до 10,0. В оптимальному варіанті здійснення біотрансформацію можна проводити в присутності С 1С4спиртів. Як С 1-С4спирти можуть застосовуватися метанол, етанол, пропанол або бутанол. Бажано застосовувати метанол. На закінчення перетворення відповідні аміди можна виділити за допомогою звичайних методів 10 перероблення, наприклад, за допомогоюкристалізації. Приклади Приклад 1 Культивування мікроорганізмів родів Actinomadura і Amvcolatopsis а) У різні зразки ґрунту, поміщені в збагачувальне середовище, склад якого наведено у таблиці 1, вносили різноманітні нітрили або аміди як джерела вуглецю й азоту й інкубували протягом 7-10 днів при 37°C або 45°C. Після цього культури пересівали в таке ж середовище і ще раз культивували протягом 7-10 днів при 37°C. Весь процес повторювали тричі. Після цього культури розріджували і висівали на планшети для одержання окремих колоній. Планшети інкубували протягом 5 днів при 37°C. Після цього різноманітні колонії піддавали тестуванню на необхідну активність. Таким шляхом виділяли штами Amycolatopsis NA40 (DSMZ 11617) і Amycolatopsis NE31 (DSMZ 11616) і потім вирощували їх в оптимізованому середовищі (таблиця 3) при струшуванні протягом 90-100год. при 37°C. Для Amycolatopsis NE31 (DSMZ 11616), Actinomadura spadix E3733 і Actinomadura spadix E3736 як джерело вуглецю й азоту використовували адипонітрил, для Amycolatopsis NA40 (DSMZ 11617) і Actinomadura spadix 45A32 як джерело вуглецю й азоту використовували азеланітрил, для Actinomadura spadix 4501 як джерело вуглецю й азоту використовували н-октанітрил, а для Actinomadura spadix C15 як джерело вуглецю й азоту використовували ціаноцтову кислоту. б) Штам Amycolatopsis NA40 культивували в середовищі, склад якого подано в таблиці 3. Культивування здійснювали в субкультура х (у пробірках об'ємом 4мл) і в "основній культурі" (у колбах об'ємом 500мл) в аеробних умовах при температурі 37°C протягом 2, відповідно 3-4 днів. Ріст клітин вимірювали турбідиметричним методом при довжині хвилі 610нм і суху масу клітин обраховували в такий спосіб: маса сухи х клітин (у мг/мл) = ОГ 610нм ´0,277. Таблиця 1 Збагачувальне середовище нітрил KH2PO4 MgSO4×7H2 O суміш вітамінів СоСl2×6Н2О FeSO4×7H2O додати воду до 1л (рН6,7-7,3) 2,0г 7,0г 0,1г 1,0мл 2,0мг 2,0мг Таблиця 2 Основне середовище мальтоза NaNO3 K2HPO4 MgSO4×7H2 O додати воду до 100мл (рН7,0) 2,0г 1,0г 0,1г 0,05г 11 83654 Таблиця 3 Оптимізоване середовище D-глюкоза м'ясний екстракт K2HPO4 MgSO4×7H2 O СоСl2×6Н2О додати воду до 100мл (pH7,0) 4,5г 0,5г 0,1г 0,05г 1,0мг Приклад 2 Біотрансформація з використанням мікроорганізмів родів Actinomadura і Amvcolatopsis (1) Для визначення нітрилгідратазної активності реакційну суміш (2мл), яка містить 3ціанпіридин (1,0М, 1,0мл), калій-фосфатний буфер (рН7,0, 0,1М, 0,5мл) і 0,5мл суспензії клітин, інкубували при перемішуванні при 20°C протягом 30 хв. Реакцію припиняли шляхом додавання 0,2мл 3н. HCl. Після короткочасного центрифугування визначали вміст утвореного нікотинаміду за допомогою ЖХВР (система типу Shimadzu SPD 6А з С18-колонкою (Develosil ODS-HG-5, 4,6´250см); розчинник: 10мМ KH2PO4/H 3PO4 (рН2,8)/ацетонітрил (в об'ємному співвідношенні 9:1); швидкість потоку: 1мл/хв; абсорбцію вимірю 12 вали при 230нм). Питому активність виражали у вигляді кількості (у мкмолях) утвореного нікотинаміду/МЛ/хв/ОГ 610нм . Швидкості перетворення аліфатичних нітрилів у збагачувальному середовищі (таблиця 1) з використанням виділених бактерій подано в таблиці 5, вплив індукторів і кофакторів, внесених в основне середовище (таблиця 2), подано в таблиці 4, а порівняння активності Amycolatopsis і Rhodococcus в основному середовищі (таблиця 2) подано в таблиці 6. Дані з таблиці 4 свідчать про те, що нітрилгідратаза з Amycolatopsis NA40 експресується конститутивним чином, проте для виявлення активності у функції кофактора потрібен кобальт. (2) Вплив температури на ріст штаму N A40 Субкультури (2мл) інкубували в середовищі, поданому в таблиці 3, протягом 2 днів при 37°C, потім їх пересівали в 20мл середовища, поданого в таблиці 3, яке міститься в струшувальних колбах. Культивування проводили при 37, 40, 45, 50 і 55°C протягом 3-4 днів при струшуванні. Вимірювали ріст клітин і оцінювали нітрилгідратазну активність при 20°C. У таблиці 7 подано дані про вплив температури на нітрилгідратазну активність і ріст клітин. Таблиця 4 Вплив індукторів і кофакторів на питому активність в основному середовищі Індуктор e-капролактам кротонамід метакриламід бутирамід пропіонамід сечовина Ріст(ОГ 610нм ) 1,26 0,66 3,41 3,33 2,19 1,91 1,72 Кофактор FeSO4×7H2O СоСl2×6Н2О Ріст (ОГ 610нм ) 7,97 8,32 8,41 Загальна активність, (мкмолі/мл/хв.) 20,9 9,52 22,9 2,46 0,19 0,92 2,97 Загальна активність (мкмолі/мл/хв.) 0,10 3,36 47,8 Питома активність (мкмолі/мл/хв./ОГ) 16,6 14,5 6,72 0,74 0,88 0,48 1,73 Питома активність (мкмолі/мл/хв./ОГ) 0,01 0,40 5,68 Таблиця 5 Швидкості перетворення аліфатичних нітрилів при використанні виділених бактерій Ріст (OГ 610нм ) Загальна активність Питома активність (мкмолі/мл/хв.) (мкмолі/мл/хв./ОГ) Amycolatopsis NE31 (DSMZ 11616) адипонітрил 2,68 0,377 0,141 Actinomadura spadix E3733 адипонітрил 1,62 0,347 0,214 Actinomadura spadix E3736 адипонітрил 1,36 3,00 2,21 Actinomadura spadix 45A32 азеланітрил 5,81 18,8 3,23 Actinomadura spadix 4501 н-октаннітрил 7,24 32,2 4,45 ціаноцтова Actinomadura spadix C 15 2,04 7,01 3,43 кислота Amycolatopsis NA40 (DSMZ 11617) азеланітрил 5,92 33,0 5,57 Штам Субстрат 13 83654 14 Таблиця 6 Порівняння активностей Amycolatopsis і Rhodococcus rhodochrous J1 Активність щодо 3-ціанпіри-дину Активність щодо 3-ціанпіри-дину Мікроорганізм Amycolatopsis NA40 (DSMZ 11617) (мкмолі/мл/хв) 303 Очищений фермент із штаму NA40 (мкмолі/хв/мг протешу) 1110 (3) Для визначення активності штаму NA40 щодо інших субстратів клітини із сухою масою 0,0388 мг інкубували в описаному вище буфері. Реакцію починали шляхом додавання відповідного субстрату і суміш інкубували при струшуванні протягом 10хв. при 20°C. Реакцію припиняли, додаючи 0,2мл 2н. HCl, і реакційну суміш центрифугували протягом короткого проміжку Мікроорганізм Rhodococcus rhodochrous J1 314 Очищений фермент із штаму J1 (мкмолі/хв/мг протешу) 371 часу. Надосадову рідину аналізували за допомогою ЖХВР або газової хроматографії. У таблиці 8 наведено умови дослідів із визначення специфічності щодо субстрату, а в таблиці 9 подано дані щодо специфічності спочиваючих клітин штаму NA40 стосовно різних субстратів. Відповідні умови дослідів узагальнено в таблиці 8, а результати - у таблиці 9. Таблиця 7 Вплив температури вирощування на нітрилгідратазну активність і на ріст клітин Температура Ріст (мг/мл) 37°С 40°C 45°С 50°C 6,16 5,79 6,56 5,96 Загальна активність (мкмолі/мл/хв.) 4,69 9,89 4,83 1,16 Питома активність (мкмолі/мл/хв./мг) 0,761 1,71 0,736 0,195 Відносна активність (%) 100 225 97 26 Таблиця 8 Умови дослідів для визначення специфічності щодо субстрату Субстрат 3-ціанпіридин 2-ціанпіридин 4-ціанпіридин кротонітрил бензонітрил акрилнітрил орто-хлорбензонітрил мета-хлорбензонітрил пара-хлорбензонітрил 2-хлор-3-ціанпіридин Субстрат ацетонітрил пропіонітрил метакрилнітрил н-бутиронітрил Субстрат (мМ) 1,0 0,25 0,25 0,4 0,03 0,4 0,15 0,15 0,15 0,15 Субстрат (м) 0,4 0,4 0,4 0,4 Метод аналізу ЖХВР ЖХВР ЖХВР ЖХВР ЖХВР ЖХВР ЖХВР ЖХВР ЖХВР ЖХВР Метод аналізу ГХ ГХ ГХ ГХ Утворений амід нікотинамід 2-піколінамід піридин-4-карбоксамід кротонамід бензамід акриламід орто-хлорбензамід мета-хлорбензамід пара-хлорбензамід 2-хлорнікотинамід Утворений амід ацетамід пропіонамід метакриламід н-бутирамід Примітка: орто-, мета-, пара-хлорбензонітрил і 2-хлор-3-ціанпіридин додали в реакційну суміш у вигляді розчину в метанолі. 15 83654 16 Таблиця 9 Специфічність нітрилгідратази штаму NA40 щодо субстрату Субстрат 3-ціанпіридин 4-ціанпіридин 2-ціанпіридин бензонітрил кротонітрил акрилнітрил орто-хлорбензонітрил Відносна активність (%) 100 168 128 51 52 115 96 (4) Температурний оптимум клітин у спокої та їхня теплостійкість Реакцію проводили протягом 10хв. у стандартній реакційній суміші. Температурний оптимум був у діапазоні від 35 до 40° С (мал.5). Після цього клітини інкубували протягом 30хв. при різноманітних температурах і оцінювали активність у стандартних реакційних умовах. Як видно з мал.4, теплостійкість зберігалася приблизно до 40°C. (5) рН-оптимум і рН-стабільність клітин у спокої 19 Для визначення цих характеристик проводили реакцію протягом 10хв. у стандартній реакційній суміші, в якій калій-фосфатний буфер заміняли різноманітними 0,1M буферами. Як видно з мал.6, оптимальне значення рН має діапазон від 4,5 до 10. Після інкубації клітинної суспензії протягом 30хв. при 20°C при різноманітних значеннях рН клітини центрифугували. Потім клітини промивали і ресуспендували в 0,1M калійфосфа тному буфері з рН7,0. Реакцію проводили протягом 10хв. у стандартних умовах, додаючи 3ціанпіридину. Фермент залишався стабільним при значеннях рН у діапазоні від 4,5 до 10,0 (мал.7). (6) Накопичення нікотинаміду, одержуваного з 3-ціанпіридину з використанням штаму NA40 Реакцію проводили в реакційній суміші (30мл), яка містить 500мМ 3-ціанпіридин, 40м калій-фосфатний буфер (рН7,0) і клітини у спокої (суха маса 2,3мг). У ході реакції 7 раз додали 3ціанпіридин (500м) відповідно до витрати попередньої порції. Таким чином, протягом 15год. було внесено 4,0 молі 3-ціанпіридину, у результаті утворилося 3,89 молів (475г/л) нікотинаміду, який відповідає виходові 97,3%. Нікотинова кислота не утворювалася. Приклад 3 Ідентифікація мікроорганізмів роду Amycolatopsis Ідентифікація грунтувалася на використанні таких 5 хемотаксономічних маркерів: 1. Діагностична амінокислота пептидоглікану: мезо-діамінопімелінова кислота. 2. Діагностичні цукри: арабіноза і галактоза. 3. Міколові кислоти: міколових кислот немає. 4. Менахінон: МK-9 (H4). 5. Спектр жирних кислот: ізо/антеізорозгалужені і 2-гідроксижирні кислоти, крім того, Субстрат мета-хлорбензонітрил пара-хлорбензонітрил 2-хлор-3-ціанпіридин ацетонітрил пропіонітрил метакрилнітрил н-бутиронітрил Відносна активність (%) 75 16 126 105 130 194 виявлено незначні кількості 10метилрозгалужених жирних кислот. Такий спектр жирних кислот виявлено у всіх представників роду Amycolatopsis (спектр жирних кислот 3f). Комбінація цих хімічних ознак достатня для виявлення всіх видів роду Amycolatopsis. Характеристики жирних кислот обох культур порівнювали з інформацією, наявною в банку даних жирних кислот, з використанням аналізу основних компонентів. За допомогою цього методу виявилося можливим зарахувати як штам NE31, так і штам NA40 до роду Amycolatopsis, проте здійснити видову ідентифікацію виявилося неможливим, тому що коефіцієнт кореляції був надто низьким. Проте на основі порівняння спектра жирних кислот обох штамів було встановлено, що вони являють собою два штами, які належать до різноманітних видів. Цей факт було підтверджено результатами аналізу послідовності 168-рДНК. У цьому випадку також було встановлено належність до роду Amycolatopsis, однак належність до жодного з описаних видів роду Amycolatopsis не було встановлено. За допомогою цього методу шляхом прямого секвенування було визначено послідовність 168-рДНК, отримана в результаті ампліфікації з використанням ГЩР гена 168-рДНК. Діагностичну частину послідовності 168-рДНК порівнювали з послідовностями типових представників видів роду Amycolatopsis і родинних таксонів. Результати показали, що штам належить до роду Amycolatopsis. Було виявлено найбільшу подібність з Amycolatopsis methanolica, що становить для штаму N A40 96,9% і для штаму NE31 96,1%. Подібність послідовностей обох штамів між собою становила 99,0%. Дослідження заявників, проведені на представниках роду Amycolatopsis, свідчать про те, що для надійної ідентифікації видів коефіцієнт кореляції повинен бути вищим ніж 99,5%. Оскільки розмір 96,9% істотно менший ніж 99,5%, то можна припустити, що обидва ізоляти не належать до представників відомих видів Amycolatopsis. На основі поданих результатів ізоляти не можна зарахувати до будь-якого з відомих видів Amycolatopsis. Заявники виходили з того, що NA40 і NE31 являють собою штами двох нових, дотепер не описаних видів роду Amycolatopsis. 17 83654 ДФГ ГЛ Тип Жирні кислоти ІЗО-16 ізо-15 ізо-17 антеізо-15 антеізо-17 10-Me-16 10-Ме-17 2-ОН-15 2-ОН-16 Тип MK Ідентифікаційні характеристики мікроорганізмів роду Amvcolatoosis Колір повітряного міцелію Колір субстратного міцелію Колір пігменту, який дифундував Спектр цукрів АРА ГАЛ МАД КСИ ГЛЮ РИБ Тип ДАП Менахінон (у %) 8/4 9/0 9/2 9/4 9/6 9/8 Гомологія 168-рДНК Фосфоліпіди ФЕ ОН-ФЕ лізо-ФЕ мет-ФЕ ФХ ФГА ФІ ФІМ ФГ 18 + + v + А DL + П+ОН-ФЕ +++ + (+) + (+) (+) + + + 3f Приклад 4 Очищення нітрилгідратази з мікроорганізму штаму N A40 Штам культивували при 37°C протягом 3 днів у середовищі, склад якого наведено у таблиці 3. Клітини 2-літрової культури збирали центрифугуванням і потім ресуспендували в 0,85%-ому розчині NaCl. Після цього клітини переносили в 0,1M калій-фосфатний буфер (рН7,0), який містить 44мМ н-масляну кислоту, і обробляли ультразвуком. Екстракт клітин центрифугували і відокремлювали клітинний дебрис. Цей екстракт застосовували для очищення ферменту. Протягом усього очищення застосовували калій-фосфатний буфер (рН7,0), який містить 44мМ н-масляну кислоту. Як видно з таблиці 10, фермент після трьох стадій очищення досягав гомогенного стану. (+) + +++ >99,5% + + + v + Таблиця 10 Очищення нітрилгідратази зі штаму N A40 екстракт без клітин ДЕАЕ-Sephacel феніл-TOYOPEARL Загальна активність (одиниці) 73300 68000 64800 Загальний протеїн (мг) 1020 ПО 61,4 Питома активність (од./мг) 71,9 620 1105 Збагачення 1 8,62 15,4 Примітка: 1 одиниця відповідає кількості ферменту, що каталізує утворення нікотинаміду зі швидкістю 1мкмоль/хв. при 20°C. Приклад 5 Вивчення властивостей нітрилгідратази (1) Визначення молекулярної маси, структури субодиниць і вмісту іонів кобальту За допомогою хроматографії на колонках типу G3000 SW (0,75´60см) із TSK-гелем з використанням 0,1М калій-фосфатного буфера (рН7,0) із додаванням 0,2М KCl і 44мМ н-масляної кислоти було встановлено, що молекулярна маса дорівнює 106кДа. Було виявлено, що фермент складається з 2 різних субодиниць а і P, молекулярні маси яких відповідно дорівнюють 30000 і 26000Да. На мал.1 показано діаграму визначення молекулярної маси за допомогою хроматографії на колонці G3000 SW із TSK-гелем. На мал.2 показано діаграму визначення молекулярної маси за допомогою електрофорезу в ДСН-ПААГ. На мал.3 показано спектр поглинання очищеного ферменту. Було виявлено широку смугу поглинання при 300-400нм. (2) Специфічність очищеного ферменту щодо субстрату Визначення специфічності щодо субстрату проводили аналогічно до прикладу 2(1). Результати подано в таблиці 11. 19 83654 20 Таблиця 11 Специфічність очищеної нітрилгідратази щодо субстрату Субстрат (M) 3-ціанпіридин 2-ціанпіридин 4-ціанпіридин кротонітрил бензонітрил акрилнітрил орто-хлорбензонітрил мета-хлорбензонітрил пара-хлорбензонітрил 2-хлор-3-ціанпіридин ацетонітрил пропіонітрил метакрилнітрил н-бутиронітрил 1,0 0,25 0,25 0,4 0,03 0,4 0,15 0,15 0,15 0,15 0,4 0,4 0,4 0,4 Відносна активність (%) Загальна активність ферментативна реа- реакція з використанням (мкмолі/мл/хв.) кція клітин у спокої 17,7 100 100 39,1 221 128 31,6 179 168 11,9 67 52 11,3 64 51 16,6 94 115 22,4 127 96 15,9 90 75 2,30 13 16 16,0 90 126 39,3 222 105 22,1 125 130 17,9 101 194 У реакційну суміш (2,0мл) додали 1,7 одиниці ферменту. Реакційна суміш містила відповідний субстрат в 45мМ фосфатному буфері (рН7,0). (3) Визначення значення KM Значення KM, яке визначали на основі діаграми Lineweaver-Burk, для 3-ціанпіридину становить 41,7мМ, а для акрилнітрилу 3,7мМ. Порівняння зі штамом Rhodococcus rhodochrous J1, в якого значення Км для 3-ціанпіридину становить 200мМ, показує, що даний параметр у штаму NA40 має істотно меншу величину. Це одна з основних переваг штаму NA40. (4) Теплостійкість і температурний оптимум Очищений фермент інкубували при різних температурах протягом 30хв. при рН7,0 і потім протягом 1хв. при 20°C оцінювали перетворення 3-ціанпіридину на амід нікотинової кислоти. При температурі вище ніж 40°C фермент втрачав активність. Теплостійкість, як і у випадку клітин у спокої, зберігалася приблизно до 40°C, температурний оптимум був у діапазоні від 35 до 40°С (мал.5). (5) рН-оптимум і рН-стабільність Для визначення цих характеристик проводили реакцію перетворення 3-ціанпіридину на амід нікотинову кислоту при 20°C в реакційній суміші (2,0мл), яка містить різні буфери (42,5мМ), 1,71 одиниці очищеного ферменту і 500мМ 3ціанпіридин. рН-Оптимум становив приблизно 6,5±1,0 (мал.8). Щоб оцінити рН-стабільність, інкубували 4,2 одиниці очищеного ферменту протягом 1год. при 20°C в різних буферах (45мМ). Частина інкубованого розчину (1,71 одиниці) додали в стандартну реакційну суміш (порівн. приклад 2(1)). Оцінювали збережену активність. Фермент зберігав стабільність при значеннях рН у діапазоні від 5 до 9. Результати подано на мал.9. (6) Інгібітори Оцінювали вплив різноманітних інгібіторів. Результати узагальнено в таблиці 12. Таблиця 12 Вплив різноманітних інгібіторів на активність очищеного ферменту Інгібітор N-етилмалеїнімід йодоцтова кислота 4-хлорртугьбензойна кислота азид натрію гідроксиламін фенілгідразин семікарбазин тирон (двонатрієва сіль 4,5-дигідрокси-1,3-бензолдисульфонової кислоти) орто-фенантролін мМ 1 1 од 1 1 1 1 Відносна активність (%) 100 97 39 69 59 37 8 82 1 110 1 89 21 83654 22 Продовження таблиці 12 Інгібітор α-, α'-дипіридил 8 -гідроксихінолін ЕДТК (етилендіамінтетраоцтова кислота) діетилдитіокарбамат мМ 1 1 1 1 Приклад 6 Вплив метанолу на клітини у спокої штаму NA40 Реакцію проводили протягом 10хв. при різноманітних концентраціях(0-20об.%) метанолу в Відносна активність (%) 100 110 115 89 реакційних сумішах, склад яких наведено в таблиці 13. Як видно з таблиці 14, активність підвищується при додаванні 5-15% метанолу. Таблиця 13 Реакція з використанням клітин у спокої 1,OM 3-ціанпіридин 0,1M КФБ*(рН7,0) метанол суспензія клітин (0,388мг/мл) Загальний об'єм 1 1,0мл 0,9мл 0,1мл 2,0мл 2 1,0мл 0,8мл 0,1мл 0,1мл 2,0мл Методи 3 1,0мл 0,7мл 0,2мл 0,1мл 2,0мл 4 1,0мл 0,6мл 0,3мл 0,1мл 2,0мл 5 1,0мл 0,5мл 0,4мл 0,1мл 2,0мл Примітка: * КФБ позначає калій-фосфатний буфер. Таблиця 14 Вплив метанолу на активність штаму Amycolatopsis NA40 Методи Метанол [об. %] Відносна активність [%] 1 0 100 2 5 123 3 10 128 4 15 130 5 20 105 cus Приклад 7 Накопичення мікроорганізмів роду Rhodococ Різні зразки ґрунту вносили в збагачувальне середовище, склад якого наведено в таблиці 1 і яке містило як джерело вуглецю й азоту ціаноцтову кислоту, і згідно з методом, описаним в прикладі 1, виділяли мікроорганізми Rhodococcus GF270, GF578, GF473 і GF376. Приклад 8 Біотрансформація з використанням мікроорганізмів роду Rhodococcus (1) Теплостійкість мікроорганізмів Rhodococcus GF674. Rhodococcus GF578. Rhodococcus GF270 і Rhodococcus GF376 порівняно з Rhodococcus rhodochrous J1. Для визначення теплостійкості, перераховані вище мікроорганізми культивували в нижчеописаних середовищах. Штам Rhodococcus rhodochrous J1 культивували протягом 72год. у середовищі, описаному в [EP-A 0307926]. Мікроорганізми Rhodococcus GF674, GF578, GF270 і GF376 культивували протягом проміжку часу до 96год. при рН7,0 у таких середовищах. Штам Rhodococcus GF674 культивували в середовищі, що містить 1,0г/л екстракту дріжджів, 5,0г/л фр уктози, 10,0г/л солодового екстракту, 5,0г/л ацетаміду, 2,0г/л KH2PO 4, 0,5г/л MgSO4×7H2 O і 10,0мг СоСl2×6Н2О. Штам Rhodococcus GF578 культивували в середовищі, що містить 1,0г/л екстракту дріжджів, 15,0г/л фруктози, 10,0г/л солодового екстракту, 25,0г/л ацетаміду, 2,0г/л KH2PO4 , 0,5г/л MgSO 4×7H2O і 5,0 мг СоСl2×6Н2О. Штам Rhodococcus GF270 культивували в середовищі, що містить 12,5г/л екстракту дріжджів, 5,0г/л цитрату натрію, 7,5г/л метакриламіду, 2,0г/л KH2PO4,0,5г/л MgSO4×7H2O і 30,0 мг СоСl2×6Н2О. Штам Rhodococcus GF376 культивували в середовищі, що містить 1,0г/л екстракту дріжджів, 10,0г/л цитрату натрію, 15,0г/л солодового екстракту, 7,5г/л бутираміду, 2,0г/л KН2РО4 , 0,5г/л MgSO4×7H2O і 15,0 мг СоСІ2×6Н2О. Потім клітини у спокої інкубували протягом 15хв. при різноманітних температурах, після чого визначали збережену активність у стандартних реакційних умовах згідно з прикладом 2(1). При цьому було встановлено, що штам Rhodococcus GF674 при температурі 50°C має відносну активність, близьку до 100%, а при 60°C ще зберігає приблизно 10% активності. Штам Rhodococcus GF578 при температурі 50°C також має відносну активність, що становить 100%, і має відносну активність, що становить 20% при 60°C. Штам Rhodococcus GF376 має 100%-у відносну активність при температурі до 50°C, 70%-у 23 83654 активність при 60°C і при 70°C зберігає ще приблизно 5%-у відносну активність. Rhodococcus GF270 має майже 100%-у відносну активність при температурі до 60°C і також ще зберігає при 70°C 5%-у відносну активність. Порівняно з цим штам Rhodococcus rhodochrous J1 зберігає до 50°C 100%-у відносну активність, при 60°C має 80%-у активність і при 70°C повністю втрачає активність. Таким чином, можна стверджувати, що штами Rhodococcus GF270 і GF376 мають кращу теплостійкість порівняно зі штамом J1, при цьому штам GF270 має найвищу теплостійкість. (2) Оптимальне значення рН для штамів Rhodococcus Вплив значення рН на нітрилгідратазну активність штамів Rhodococcus GF674, GF578, GF270 і GF376 визначали аналогічно до прикладу 2(5). Оптимальне значення рН для штаму Rhodococcus GF674 становить 7,5-9,5, для GF578 становить 8-8,5, для GF270 становить 6-7,0 і для GF376 становить 6-8. (3) Специфічність штамів Rhodococcus щодо субстрату Дані про специфічність щодо субстрату у вигляді значень відносної активності узагальнено в таблиці 15. (4) Накопичення нікотинаміду штамами Rhodococcus Штами Rhodococcus GF674, GF578, GF270 і GF376 культивували аналогічно до прикладу 2(6) з використанням як субстрат 3-ціанпіридину (приблизно 500м). При цьому штам Rhodococcus GF674 продукував протягом 25год. 6М нікотина 24 міду, штам GF578 продукував протягом 10год. 5,5М нікотинаміду, штам GF270 продукував протягом 20год. приблизно 8,5М нікотинаміду і штам GF376 продукував протягом 20год. 7,5М нікотинаміду. (5) Толерантність активності штамів Rhodococcus щодо 3-ціанпіридину Для вивчення толерантності щодо 3ціанпіридину клітини у спокої інкубували протягом 15хв. при 20°C при концентраціях 3-ціанпіридину в діапазоні від 1 до 10% (мас/об.), після чого клітини центрифугували. Після промивання клітин 0,85%-им NaCI вимірювали збережену активність. Толерантність щодо 3-ціанпіридину як субстрат вивчали при різноманітних концентраціях субстрату. Було встановлено, що при концентрації субстрату 2% (мас/об.) нітрилгідратазна активність штаму Rhodococcus rhodochrous J1 знижується в 1,4 раза, нітрилгідратазна активність штаму Rhodococcus GF674 знижується в 1,4 раза при концентрації субстрату 4% (мас/об.), нітрилгідратазна активність штаму Rhodococcus GF578 залишається практично сталою аж до концентрації субстрату 8%, нітрилгідратазна активність штаму Rhodococcus GF270 знижується в 1,7 раза при концентрації субстрату 4% (мас/об.) і нітрилгідратазна активність штаму Rhodococcus GF376 знижується в 1,25 раза при концентрації субстрату 10% (мас/об.). Штами Rhodococcus rhodochrous J1 мають найгіршу толерантність щодо 3-ціанпіридину порівняно з іншими штамами Rhodococcus. Таблиця 15 3-ціанпіридин 2-ціанпіридин 4-ціанпіридин бензонітрил 2-хлорбензонітрил 3-хлорбензонітрил 4-хлорбензонітрил ацетонітрил пропіонітрил н-бутиронітрил акрилнітрил кротонітрил метакрилнітрил Rhodococcus rhodochrous J1 100 (%) 45 70 27 2,8 43 13 608 434 352 478 78,2 86,9 Rhodococcus GF674 100 (%) 308 231 138 64,8 27,8 0 1,49 274 491 147 98,0 176 Rhodococcus GF578 100 (%) 200 167 85,1 49,0 28,9 0 347 132 368 101 124 122 Rhodococcus GF270 100 (%) 15,7 55,6 13,4 0 8,41 0 659 37,3 181 192 37,1 * 0 Rhodococcus GF376 100 (%) 54,3 79,8 57,2 0 8,63 0 806 245 195 257 110 0 25 83654 26 27 83654 28 29 Комп’ютерна в ерстка Т. Чепелев а 83654 Підписне 30 Тираж 28 прим. Міністерство осв іт и і науки України Держав ний департамент інтелектуальної в ласності, вул. Урицького, 45, м. Київ , МСП, 03680, Україна ДП “Український інститут промислов ої в ласності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for preparation of amides using microorganisms of the rhodococcus species
Автори англійськоюRobbins Karen Trasy, Nagasava Toru
Назва патенту російськоюСпособ получения амидов с использованием микроорганизмов видов rhodococcus
Автори російськоюРобинз Карэн Трэйси, Нагасава Тору
МПК / Мітки
МПК: C12P 13/02, C12R 1/01, C12N 9/78, C12N 1/20
Мітки: мікроорганізмів, rhodococcus, використанням, амідів, одержання, видів, спосіб
Код посилання
<a href="https://ua.patents.su/15-83654-sposib-oderzhannya-amidiv-z-vikoristannyam-mikroorganizmiv-vidiv-rhodococcus.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання амідів з використанням мікроорганізмів видів rhodococcus</a>
Попередній патент: Спосіб керування потужністю передачі висхідної лінії зв’язку
Наступний патент: Спосіб буріння і закінчування свердловин
Випадковий патент: Спосіб одержання багатої на тромбоцити плазми крові