Мікроорганізм, який являє собою штам rhodococcus sp. fz4, здатний перетворювати ацетонітрил в амід, нітрилгідратаза, спосіб одержання амідів та застосування мікроорганізму для знищення або утилізації відходів ацетонітрилу
Формула / Реферат
1. Мікроорганізм, який являє собою штам Rhodococcus sp. FZ4, депонований під реєстраційним номером DSM 13597, і його функціонально еквівалентні варіанти і мутанти, які здатні перетворювати ацетонітрил в амід, причому нітрилгідратазна активність у відношенні до ацетонітрилу складає Km = 2,84±1,00 мМ, а у відношенні до 3-ціанпіридину, відповідно, Km = 80,5±15,0 мМ, при оптимальному значенні pН, яке становить 6,5±1,0.
2. Нітрилгідратаза, яка одержана з мікроорганізму за пунктом 1 і яка характеризується тим, що
а) її Km-значення для ацетонітрилу, який служить субстратом, становить 2,84±1,00 мМ, а для 3-ціанпіридину, який служить субстратом, становить 80,5±15,0 мМ;
б) оптимальне для неї значення pН становить 6,5±1,0.
3. Ферментативний екстракт, який містить нітрилгідратазу за пунктом 2.
4. Спосіб одержання амідів загальної формули
R1-CONH2 III,
у якій R1 означає C1-6алкільний залишок, C2-6алкенільну групу або групу загальної формули
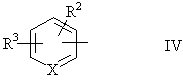 ,
,
у якій X означає атом азоту або групу CH=, а R2 і R3 незалежно один від одного означають атом водню, атом галогену, C1-6алкільну групу або C2-6алкенільну групу, який відрізняється тим, що нітрил загальної формули
R1-CN II,
у якій R1 має вказані вище значення, піддають перетворенню за допомогою мікроорганізму за пунктом 1, ферментативного екстракту за п. 3 або ферменту за пунктом 2.
5. Спосіб за п. 4, який відрізняється тим, що як нітрил використовують 3-ціанпіридин або ацетонітрил.
6. Спосіб за п. 4 або 5, який відрізняється тим, що перетворення проводять при температурі від 5 до 50 °C і значенні pН від 5 до 10.
7. Застосування мікроорганізму за пунктом 1 для знищення або утилізації відходів ацетонітрилу.
Текст
1. Мікроорганізм, який являє собою штам Rhodococcus sp. FZ4, депонований під реєстраційним номером DSM 13597, і його функціонально еквівалентні варіанти і мутанти, які здатні перетворювати ацетонітрил в амід, причому нітрилгідратазна активність у відношенні до ацетонітрилу складає Km = 2,84±1,00мМ, а у відношенні до 3ціанпіридину, відповідно, Km = 80,5±15,0мМ, при оптимальному значенні pН, яке становить 6,5±1,0. 2. Нітрилгідратаза, яка одержана з мікроорганізму за пунктом 1 і яка характеризується тим, що а) її K m-значення для ацетонітрилу, який служить субстратом, становить 2,84±1,00мМ, а для 3ціанпіридину, який служить субстратом, становить 80,5±15,0мМ; б) оптимальне для неї значення pН становить 6,5±1,0. 3. Ферментативний екстракт, який містить нітрилгідратазу за пунктом 2. 4. Спосіб одержання амідів загальної формули R1-CONH2, III у якій R1 означає C1-6алкільний залишок, C2-6алкенільну груп у або гр упу загальної формули UA (21) 2003077000 (22) 08.01.2002 (86) PCT/EP02/00103, 08.01.2002 (31) 01100493.4 (32) 09.01.2001 (33) EP (31) 60/342,373 (32) 27.12.2001 (33) US (46) 10.06.2008, Бюл.№ 11, 2008 р. (72) РОБІНС КАРЕН ТРЕЙСІ, AU/CN, НАГАСАВА ТОРУ (73) ЛОНЗА АГ (56) EP A 0307926, 22.03.1989. DE C 4313649, 26.01.1995. LANGDAHL BJARNE R ET AL: "Nitrile hydrolysis of Rhodococcus erythropolis BL1, an acetonitriletolerant strain isolated from a marine sediment" MICROBIOLOGY (READIN G), vol. 142, no. 1, 1996, pages 145-154, XP001037265, ISSN: 1350-0872. TORU NAGASAWA ET AL : "NITRILE HYDRATASECATAL YZED PRODUCTION OF NICOTINAMIDE FROM 3-C YANOPYRIDINE IN RHODOCOCCUS THODOCHROUS J1" APPLIED AND ENVIRON MENTAL MICROBIOLOGY, WASHINGTON, DC, US, vol. 54, no. 7, 1 July 1988 (1988-07-01), pages 1766-1769, XP000106560, ISSN: 0099-2240. WATANABE I ET AL: "SCREENING ISOL ATION AND TAXONOMIC AL PROPERTIES OF MICROORGANISMS HAVING ACRYLONITRILEHYDRATING ACTIVITY" AGRICULTURAL AND BIOLOGIC AL CHEMISTRY, vol. 51, no. 12, 1987, pages 3193-3200, XP001062886, ISSN: 0002-1369. ASANO Y ET AL: "ALIPH ATIC NITRILE HYDRATASE FROM ARTHROBACTER SP. J-1 PURIFICATION AND CHAR ACTERIZATION" AGRICULTURAL AND BIOLOGIC AL CHEMYSTR Y, JAPAN SOC. FOR BIOSCIENCE, BIOTECHNOLOGY AND AGROCHEM. TOKYO, JP, vol. 5, no. 46, May 1982 (1982-05), pages 1165-1174, XP001068503, ISSN: 0002-1369. 2 (19) 1 3 82982 4 6. Спосіб за п. 4 або 5, який відрізняється тим, 7. Застосування мікроорганізму за пунктом 1 для що перетворення проводять при температурі від 5 знищення або утилізації відходів ацетонітрилу. до 50 °C і значенні pН від 5 до 10. Даний винахід стосується мікроорганізмів, які здатні залишатися толерантними до ацетонітрилу при його присутності принаймні в 3-молярних концентраціях, ферменту з нітрилгідратазною активністю, способу одержання амідів із застосуванням таких мікроорганізмів, відповідно ферменту, а також застосування цих мікроорганізмів для знищення (утилізації) відходів ацетонітрилу. В даний час відомо вже досить багато біотехнологічних методів одержання амідів, таких, наприклад, як амід нікотинової кислоти, який являє собою незамінний для тварин і людини вітамін із сімейства вітамінів В. Так, наприклад, у [ЕР-А 0307926] описаний спосіб перетворення 3-ціанпіридину в амід нікотинової кислоти за допомогою мікроорганізмів Rhodococcus rhodochorous J1. Недолік цього способу полягає в тому, що мікроорганізми Rhodococcus rhodochrous J1 мають червоний колір, і тому кінцевий продукт також набуває відповідного забарвлення. Крім цього такий мікроорганізм характеризується високим Кm-значенням (константа Мі хаеліса) для 3-ціанпіридину, який використовується як субстрат, а також має низьку толерантність до температури і низьку толерантність до 3ціанпіридину. Крім цього в заявці [WO 99/05306] описаний спосіб одержання аміду нікотинової кислоти виходячи з відповідного нітрилу за допомогою мікроорганізмів родів Rhodococcus, Amycolatopsis і Actinomadura. Недолік цього відомого способу полягає в тому, що мікроорганізми роду Amycolatopsis, які використовуються при його здійсненні, інактивуються при підвищених температурах. Ці мікроорганізми мають, крім того, низьку толерантність до 3-ціанпіридину й аміду нікотинової кислоти. Мікроорганізми роду Rhodococcus характеризуються високим Кm-значенням для 3ціанпіридину і малою теплостійкістю. Тому реалізація описаного у вказаній заявці способу в промисловому масштабі є економічно недоцільною. В основу даного винаходу була поставлена задача запропонувати мікроорганізми, які були б більш стійкими, характеризувалися б більш низьким Кm-значенням для такого субстрату, як, наприклад, 3-ціанпіридин, і відповідно до цього забезпечували б рентабельне одержання амідів способом, при здійсненні якого відповідний амід можна було б виділяти з винятково високим виходом і з високим ступенем чистоти. Вказана задача вирішується за допомогою мікроорганізмів згідно із п.1 формули винаходу, за допомогою ферменту згідно із п.5 або 7 і за допомогою способу згідно із п.8. Запропоновані у винаході мікроорганізми одержують шляхом відповідного відбору, наприклад, із зразків ґрунту, з мулу (шламу) або стічних вод за допомогою традиційних мікробіологічних методів. Подібний відбір мікроорганізмів доцільно проводи ти шля хом їх вирощування або культивування в присутності піридинальдоксиму загальної формули або нітрилів як джерела вуглецю й у присутності іонів кобальту і, наприклад, дріжджового екстракту і/або амонієвих солей. Потім з отриманих культур відбирають ті мікроорганізми, які здатні залишатися толерантними до ацетонітрилу при його присутності принаймні в 3-молярній концентрації і які здатні перетворювати нітрили, такі, наприклад, як 3-ціанпіридин і ацетонітрил, у відповідний амід. Як піридинальдоксими можна використовувати піридин-2-, піридин-3- або піридин-4-альдоксим. Для відбору відповідних мікроорганізмів можуть використовуватися також насамперед ті нітрили, які при наступній біотрансформації повинні використовува тися як субстрат, наприклад ацетонітрил (нітрил оцтової кислоти), пропіонітрил, бутиронітрил, нітрил кротонової кислоти, нітрил адипінової кислоти і нітрил малонової кислоти. Як джерело іонів кобальту переважно використовувати так звані "кобальтові сполуки, які генерують іони кобальту", наприклад Со 2+- або Со3+солі, такі як хлориди кобальту, сульфати кобальту й ацетати кобальту. Переважно як кобальтову сполуку використовувати Со 2+-сіль, таку, наприклад, як СоСI2. Разом з тим мікроорганізми можна культивува ти і разом з металевим кобальтом або іншими його сполуками. Звичайно кобальт або його сполуки додають у середовище для вирощування в кількості від 1 до 30мг/л, переважно від 1 до 20мг/л. Як амонієві солі можна використовувати, наприклад, фосфати амонію, такі як (МН4)2НРО4 або (NН4)Н2РО4. Мікроорганізми перед використанням їх власне в процесі біотрансформації культивують у відповідних середовищах. Склади придатних для цієї мети культуральних середовищ наведені, наприклад, нижче в даному описі в таблиці 3 або 5. Звичайно мікроорганізми вирощують при температурі від 20 до 40°С і при значенні рН від 5 до 8, переважно при температурі від 25 до 35°С і значенні рН від 6 до 7,5. У процесі вирощування мікроорганізмів доцільно індукувати активні ферменти, тобто нітрилгідратази, додаванням відповідного індуктора ферментів. Як такі індуктори ферментів можуть використовуватися насичені або ненасичені аліфатичні нітрили або відповідні аміди. Як аліфатичні нітрили можна застосовувати всі С 2-7алканнітрили, такі, наприклад, як бутиронітрил, ізобутиронітрил, ніт 5 82982 6 рил валеріанової кислоти або нітрил ізовалеріаномів, яку слід зазначити особливо, є їх здатність вої кислоти, або С3-7алкеннітрили, такі, наприклад, акумулювати ацетамід у більш високій концентраяк метакрилнітрил або нітрил кротонової кислоти. ції в порівнянні з концентрацією, що відповідає Як аліфатичні аміди можна застосовувати всі С 2насиченому при 30°С розчину ацетаміду (приблизно 220-230г ацетаміду в 100мл води). 7алканаміди, такі, наприклад, як бутирамід, ізобутирамід, амід валеріанової кислоти або амід проПереважні мікроорганізми належать до роду піонової кислоти, або С3-7алкенаміди, такі, наприRhodococcus. До найбільш переважних мікрооргаклад, як метакриламід або амід кротонової нізмів належать штами Rhodococcus sp. FZ4 і їх кислоти. Переважними індукторами ферментів є функціонально еквівалентні варіанти і мутанти. Під метакриламід, бутирамід, ізобутирамід, амід валефункціонально еквівалентними варіантами і мутаріанової кислоти, метакрилнітрил, амід кротонової нтами при цьому маються на увазі такі, які заликислоти, бутиронітрил і ізобутиронітрил. Найбільш шаються толерантними до ацетонітрилу при його переважно використовувати як індуктор ферментів присутності принаймні в 3-молярних концентраціметакрилнітрил. ях. Особливо переважні "непігментовані" штами Як уже вказувалося вище, запропоновані у виRhodococcus, тобто штами, які не мають червононаході мікроорганізми залишаються толерантними го забарвлення, яке може привести до відповідної до ацетонітрилу при його присутності принаймні в зміни кольору цільового продукту. При необхіднос3-молярній концентрації. Подібна здатність зберіті подібні штами можна досить легко одержати з гати толерантність до ацетонітрилу виявляється в пігментоутворюючих мікроорганізмів у результаті тому, що ферментативна активність залишається мутагенезу, який індукується впливом УФстабільною після 1-годинної інкубації з 3-молярним випромінювання або хімічних мута генів. ацетонітрилом у 0,1-молярному калійфосфатному Відповідно до Будапештського договору штам буфері при рН, що дорівнює 7,0, і температурі Rhodococcus sp. FZ4 був депонований 11 липня 20°С, тобто знижується максимум на 10%. Пере2000р. у Німецькій колекції мікроорганізмів і кліважні мікроорганізми протягом 1год залишаються тинних культур (Deutsche Sammlung von в описаних вище умовах толерантними до ацетоMikroorganismen und Zellkulturen GmbH (DSMZ)), нітрилу при його присутності принаймні в 6Mascheroder Weg 1b, D-38124 Braunschweig, під молярній концентрації при зменшенні ферментареєстраційним номером DSM 13597. Цей мікроортивної активності максимум на 50%. Найбільш ганізм на основі його ідентифікаційних даних не переважні мікроорганізми протягом 1год залишавдалося віднести ні до одного відомого дотепер ються в описаних ви ще умовах толерантними до виду Rhodococcus, і тому він був виділений у ноацетонітрилу при його присутності принаймні в 9вий вид. молярній концентрації при зменшенні ферментаФункціонально еквівалентні варіанти і мутанти тивної активності максимум на 70%. штаму Rhodococcus sp. FZ4 можуть виникати в В особливо переважних мікроорганізмів їх ферезультаті спонтанного мутагенезу або їх можна рментативна активність залишається стабільною створювати штучно впливом УФ-випромінювання навіть після інкубації протягом декількох хвилин з або хімічних мутагенів. Переважні варіанти і мута15- і 19-молярним ацетонітрилом (відповідно з нти штаму Rhodococcus sp. FZ4 є "непігментовачистим ацетонітрилом). Так, зокрема, зниження ними", тобто не мають власного червоного забарферментативної активності при інкубації з 15влення, яке може привести до відповідної зміни молярним ацетонітрилом становить після закінкольору цільового продукту. чення 10хв менше 10%. Ферментативний екстракт можна одержувати, Запропоновані у винаході мікроорганізми манаприклад, шляхом лізису мікроорганізмів, зокреють високу термостабільность, тобто підвищену ма за допомогою ультразвуку, пристрою типу стабільність при високих температурах у порів"френч-прес" або методу, заснованого на викориснянні з відомими дотепер мікроорганізмами. Знитанні лізоциму. ження ферментативної активності запропонованих Запропоновані у винаході ферменти з нітрилу винаході мікроорганізмів після 1-годинної інкубагідратазною активністю одержують з описаних ції в 0,1-молярному калійфосфатному буфері з рН вище мікроорганізмів. Переважно при цьому оде7,0 при 60°С переважно становить максимум 10%, ржувати їх з мікроорганізмів роду Rhodococcus, а зниження ферментативної активності після 2насамперед з мікроорганізмів Rhodococcus sp. FZ4 годинної інкубації у вказаних вище умовах стано(DSM 13597). вить максимум 40%. Такі ферменти мають, зокрема, такі властивоПід ферментативною активністю в контексті сті: даного винаходу мається на увазі нітрилгідратазна а) їх Кm-значення для ацетонітрилу, який є активність, насамперед нітрилгідратазна активсубстратом, становить 2,84±1,00мМ, а для 3ність у відношенні 3-ціанпіридину, який служить ціанпіридину, який є субстратом, - 80,5±15,0мМ, у субстратом. кожному випадку в 0,05-молярному калійфосфатДо переліку інших позитивних властивостей ному буфері з pH 7,0 при 20°С; запропонованих у винаході мікроорганізмів налеб) оптимальне для них значення pH становить жать висока толерантність до 3-ціанпіридину, який 6,5±1,0 при 20°С у 0,05-молярному калійфосфатє переважним для застосування субстратом, і до ному буфері. продукту, який утворюється з нього, яким є амід Такі ферменти насамперед мають нікотинової кислоти, а також низьке Кm-значення в) природну молекулярну масу, яка становить для 3-ціанпіридину. Ще однією позитивною власза даними РХВР-аналізу 465±50кДа. тивістю запропонованих у винаході мікроорганіз 7 82982 8 Власне процес біотрансформації можна пропереробкою за звичайними методами, такими, водити з використанням описаних вище мікроорнаприклад, як кристалізація або розпилювальне ганізмів, отриманого з цих мікроорганізмів фермесушіння. нтативного екстракту або виділеного ферменту. Ще одним об'єктом даного винаходу є застоПереважно проводити біотрансформацію з викосування вищеописаних мікроорганізмів, насамперистанням мікроорганізмів Rhodococcus sp. FZ4. ред роду Rhodococcus, для знищення відпрацьоЯк субстрати для біотрансформації можуть ваного ацетонітрилу. використовува тися нітрили загальної формули Ацетонітрил являє собою розчинник, яки знаR1-CN II ходить застосування, наприклад, у рідинній хромаУ цій загальній формулі II замісник R 1 являє тографії високого розділення (РХВР), і тому після собою С 1-6алкільну груп у, С2-6алкенільну груп у або його використання і спрямовування у відхід підлягруп у загальної формули IV гає утилізації. Максимальна концентрація ацетонітрилу, який після його використання в тих чи інших цілях і спрямування у відхід підлягає утилізації з застосуванням запропонованих у винаході мікроорганізмів, може досягати 19М, що відповідає чистому ацетонітрилу. Переважно, однак, використоУ такій загальній формулі IV X означає атом вувати розчин, відповідно суспензію ацетонітрилу 2 3 азоту або групу -СН=, а замісники R і R незалеж0,25-15,0-молярної, більш переважно 1-10но один від одного означають атом водню, атом молярної, концентрації. галогену, С1-6алкільну груп у або С 2-6алкенільну Процес утилізації відпрацьованого ацетонітгруп у. рилу із застосуванням запропонованих у винаході Як С 1-6алкільна група може використовуватися мікроорганізмів переважно проводити при темпеметил, етил, пропіл, ізопропіл, бутил, трет-бутил, ратурі від 5 до 50°С, більш переважно при темпеізобутил, пентил і його ізомери, а також гексил і ратурі від 20 до 40°С. У ході цього процесу знайого ізомери. Як С2-6алкенільна група може викочення pH переважно повинно становити від 5 до ристовуватися, наприклад, вініл, аліл, 1-пропен-110, більш переважно від 6 до 8. іл або 1-пропен-2-іл. Тривалість переробки відпрацьованого ацетоЯк атом галогену може використовуватися нітрилу, у ході якої ацетонітрил перетворюється в атом А, СІ, Вr або І. ацетамід, залежить від концентрації утилізованого Переважними представниками нітрилів загаацетонітрилу. Так, наприклад, при одержанні розльної формули II є ацетонітрил, бутиронітрил, акчину або суспензії ацетаміду 9,5-молярної конценрилонітрил, пропіонітрил, нітрил кротонової кислотрації це перетворення триває приблизно 2год при ти, 2-ціанпіридин, 3-ціанпіридин, 4-ціанпіридин, значенні pH, що дорівнює 7,0, і температурі близьбензонітрил, фторбензонітрил, хлорбензонітрил і ко 20°С. бромбензонітрил. Переважними в більшості випаІдентифікація штаму FZ4 (DSM 13597) дків субстратами є ацетонітрил і 3-ціанпіридин. А) Хемотаксономічні ознаки ("маркери"): Процес біотрансформації переважно проводи1. Діагностична амінокислота пептидоглікану: ти при однократному або безперервному додамезо-діамінопімелінова кислота. ванні субстрату. Концентрація використовуваного 2. Міколові кислоти: присутні міколові кислоти субстрату залежить від його розчинності, що добз ланцюгом довжиною від С 40 до С 48. ре відомо фахівцям у даній галузі техніки. 3. Набір жирних кислот: присутні лінійні, насиПроцес біотрансформації переважно далі прочені і ненасичені жирні кислоти, а також характерводити з використанням спочиваючих (які не росний високий вміст туберкулостеаринової кислоти. туть) клітин. На основі набору жирних кислот штам FZ4 був Як середовища в процесі біотрансформації ідентифікований як такий, що належить до роду можуть використовуватися середовища, які звиRhodococcus. чайно застосовуються в цих цілях, наприклад ниБ) Звичайні ознаки ("маркери"): зькомолярний фосфатний буфер, НЕРЕS-буфер Клітини штаму FZ4 за їх макроскопічним зов(НЕРЕS=N-2-гідроксіетилпіперазин-N'-2нішнім виглядом і морфології були подібні до етансульфонова кислота), цитратний буфер і боRhodococcus rhodochrous. Колонії штаму FZ4 маратний буфер. Під низькомолярним фосфатним ють світло-рожеве забарвлення (RAL 3022), а в буфером мається на увазі переважно 0,01-0,5молодих культурах розвивалися гіфи, що галумолярний фосфатний буфер, найбільш переважно зяться, які розвивалися в палички і коки. 0,05-0,25-молярний фосфатний буфер. Штам FZ4 на основі хемотаксономічних і звиПроцес біотрансформації переважно проводичайних ознак був ідентифікований як такий, що ти при температурі від 5 до 50°С, найбільш переналежить до виду Rhodococcus rhodochrous, хоча і важно при температурі від 20 до 40°С. Переважне з малим коефіцієнтом кореляції. значення рН становить від 5 до 10, найбільш пеВ) Аналіз перших 500 основ 16S рДНК реважно від 6 до 7,5. Подібність послідовності перших 500 основ Після завершення процесу перетворення ніт16S рДНК з аналогічною послідовністю штаму рилу загальної формули II відповідні аміди загальRhodococcus rhodochrous DSM 43241, що є типоної формули, які утворилися з нього вим представником виду Rhodococcus 1 R -СCONH2 III, rhodochrous, становить лише 97,7%, а подібність з 1 у якій R має вказані вище значення, можна аналогічною послідовністю іншого еталонного виділяти, при необхідності після відділення клітин, штаму Rhodococcus rhodochrous становить 99,1%. 9 82982 10 Оскільки подібність між послідовностями перших на Фіг.14 - графік, який відображає залежність 500 основ 16S рДНК штаму FZ4 і штаму активності очищеної нітрилгідратази із штаму Rhodococcus rhodochrous DSM 43241 становила Rhodococcus sp. FZ4 від концентрації ацетонітрименше 99,5%, штам FZ4 не вдалося ідентифікувалу, ти як такий, який належить до виду Rhodococcus на Фіг.15 - графік, який відображає термостаrhodochrous. Тому штам FZ4 був виділений у нобільність очищеної нітрилгідратази із штаму вий вид у роді Rhodococcus. Rhodococcus sp. FZ4, Креслення на Фіг.16 - діаграма, на якій представлене опНа доданих до опису кресленнях показано: тимальне значення pH для очищеної нітрилгідрана Фіг.1 - діаграма, яка ілюструє процес біотази із штаму Rhodococcus sp. FZ4, і трансформації ацетонітрилу в ацетамід спочиваюна Фіг.17 - діаграма, на якій представлена pHчими клітинами штаму Rhodococcus sp. FZ4, стабільність очищеної нітрилгідратази із штаму на Фіг.2 - діаграма, яка відображає вплив темRhodococcus sp. FZ4. ператури на нітрилгідратазну активність штаму Приклад 1 Rhodococcus sp. FZ4 у спочиваючих клітинах і яка Визначення нітрилгідратазної активності дозволяє визначити оптимальне значення темпеДля визначення нітрилгідратазної активності ратури, реакційну суміш, яка містить 3-ціанпіридин (1,0М; на Фіг.3 - діаграма, яка відображає термоста1,0мл), калійфосфатний буфер (0,1М, pH 7,0; більність нітрилгідратазної активності штаму 0,5мл) і суспензію клітин (0,5мл ), інкубували при Rhodococcus sp. FZ4 у спочиваючи х клітинах, перемішуванні і при 20°С протягом 5хв. Реакцію на Фіг.4 - діаграма, яка відображає вплив веприпиняли додаванням HCl (5M; 0,1мл ). Після личини pH на нітрилгідратазну активність штаму фільтрації реакційної суміші (через фільтр із розRhodococcus sp. FZ4 у спочиваючих клітинах і яка міром пор 0,2мкм) кількість утвореного аміду нікодозволяє визначити оптимальне значення pH, тинової кислоти визначали за допомогою РХВР на Фіг.5 - діаграма, яка відображає pH(колонка Waters Spherisorb 5 μ ODS2 (4,6´150мм); стабільність нітрилгідратазної активності штаму KH2PO4/H3PO4 (10мм; pH 2,8)/ацетонітрил у співRhodococcus sp. FZ4 у спочиваючи х клітинах, відношенні 9:1 (об./об.); 1мл/хв; 230нм). Загальну на Фіг.6 - діаграма, яка відображає толерантактивність виражали як кількість утвореного аміду ність нітрилгідратазної активності штаму нікотинової кислоти у мкмолях/(хв´мл), а питому Rhodococcus sp. FZ4 у спочиваючих клітинах до 3активність виражали як кількість утвореного аміду ціанпіридину, нікотинової кислоти у мкмолях/(хв´мл´ОГ 610нм). на Фіг.7 - діаграма, яка відображає толерантПриклад 2 ність нітрилгідратазної активності штаму Виділення штаму Rhodococcns sp. FZ4 (DSM Rhodococcus sp. FZ4 у спочиваючи х клітинах до 13597) аміду нікотинової кислоти, Як описано в [Arch. Microbiol. 170 (1998), на Фіг.8 - діаграма, яка відображає вплив констор.85-90], штам Rhodococcus sp. YH3-3 (TPU центрації ацетонітрилу на нітрилгідратазну актив3453) метаболізує 3-піридинульдоксим через 3ність штаму Rhodococcus sp. FZ4 у спочиваючих ціанпіридин і амід нікотинової кислоти до нікотиноклітинах у процесі біотрансформації ацетонітрилу вої кислоти. У цьому випадку альдоксимдегідратав ацетамід, зну активність, а також нітрилгідратазну й амідазну на Фіг.9 - діаграма, яка відображає вплив конактивність штаму Rhodococcus sp. YH3-3 (TPU центрації ацетонітрилу на нітрилгідратазну актив3453) індукували різними альдоксимами і нітриланість штаму Rhodococcus sp. FZ4 у спочиваючих ми. клітинах, Різні зразки ґрунту вносили в збагачувальне на Фіг.10 - діаграма, яка відображає залежсередовище, склад якого вказаний нижче в таблиність нітрилгідратазної активності штаму ці 1, і інкубували протягом 7-10 днів при 37°С. Rhodococcus sp. FZ4 у спочиваючих клітинах від Отримані таким шляхом культури пересівали в концентрації 3-ціанпіридину, середовище того ж складу і інкубували ще протяна Фіг.11 - діаграма, яка відображає взаємогом 7-10 днів при 37°С. Цю процедуру повторювазв'язок між відкладеними на логарифмічній шкалі ли тричі. Потім культури розбавляли і висівали на молекулярними масами нітрилгідратази й еталончашки. Після 5-денної інкубації вмісту чашок при них білків і відповідним часом утримання при 37°С одержували окремі колонії. Ці окремі колонії РХВР, досліджували відповідно до прикладу 1 на наявна Фіг.12 - діаграма, яка відображає взаємоність нітрилгідратазної активності. Таким шляхом зв'язок між відкладеними на логарифмічній шкалі виділили штам Rhodococcus sp. FZ4 (DSM 13597). молекулярними масами субодиниць нітрилгідратаЗамість 3-піридинальдоксиму як джерело вуглецю зи й еталонних білків і відповідним Rf-значенням можна також використовувати такі нітрили, як ацепри електрофорезі в ПААГ-ДСН, тонітрил, пропіонітрил, бутиронітрил, нітрил крона Фіг.13 - графік, який відображає залежність тонової кислоти, нітрил адипінової кислоти і нітрил активності очищеної нітрилгідратази із штаму малонової кислоти. Rhodococcus sp. FZ4 від концентрації 3ціанпіридину, 11 82982 12 Таблиця 1 Склад збагачувального середовища Компоненти 3-піридинальдоксим (NН4)2НРО4 КН2РО4 NaСІ МgSО4 ´7Н2О СоСI2´6Н2О дріжджовий екстракт Концентрація [г/л] 3,0 або 1,0 2,0 2,0 1,0 0,2 0,01 0,2 Об'єм середовища додаванням води доводять до 1л (pH 7,0). Приклад 3 Вплив кофакторів на нітрилгідратазну активність штаму Rhodococcus sp. FZ4 у процесі вирощування Штам Rhodococcus sp. FZ4 (DSM 13597) вносили в середовище для вирощування попередніх культур, склад якого вказаний у таблиці 2, і при струшуванні інкубували протягом 1-2 днів при 28°С. Отриману попередню культуру пересівали в базальне середовище, склад якого вказаний у таблиці 3 і яке містило або СоСI2, або FeSO4, і при струшуванні інкубували протягом 2-3 днів при 28°С. Нітрилгідратазну активність визначали відповідно до прикладу 1. Отримані результати наведені в таблиці 4. Нітрилгідратазна активність виявлялася тільки при культивуванні штаму Rhodococcus sp. FZ4 у присутності кобальту. Таблиця 2 Склад середовища для виношування попередніх культур Компоненти пептон м'ясний екстракт NaCI дріжджовий екстракт Концентрація [г/л] 5,0 5,0 2,0 0,5 Об'єм середовища додаванням води доводять до 1л (рН 7,0). Таблиця 3 Склад базального середовища Компоненти дріжджовий екстракт пептон L-глутамат, натрієва сіль МgSО4 ´7Н2О СоСI2´6Н2О (або FеSО4 ´7Н2О) амід кротонової кислоти Концентрація [г/л] 2,0 0,2 15,0 0,5 0,004 5,0 Об'єм середовища додаванням води доводять до 1л (рН 6,8). Таблиця 4 Вплив кофакторів на нітрилгідратазну активність штаму в процесі вирощування Загальна Питома активність Ріст активність Кофактор [ОГ 610нм ] [мкмоль/(хв [мкмоль/(хв´мл´ ОГ 610нм )] ´мл) FеSО4 2,86 0,989 0,346 СоСI2 2,79 38,1 13,1 Приклад 4 Вплив індукторів на нітрилгідратазну активність штаму Rhodococcus sp. FZ4 у процесі вирощування Штам Rhodococcus sp. FZ4 (DSM 13597) вносили в середовище для вирощування попередніх культур, склад якого вказаний у таблиці 2, і при струшуванні інкубували протягом 1-2 днів при 28°С. Отриману попередню культуру пересівали в культуральне середовище, склад якого вказаний у таблиці 5 і яке містило різні індуктори, і при струшуванні інкубували протягом 3 днів при 28°С. Нітрилгідратазну активність визначали відповідно до прикладу 1. Отримані результати наведені в таблиці 5. Експресія нітрилгідратази штаму Rhodococcus sp. FZ4 відбувалася в процесі вирощування тільки в присутності одного індуктора. Таблиця 5 Склад культурального середовища Компоненти дріжджовий екстракт цитрат натрію солодовий екстракт індуктор КН2РО4 МgSО4 ´7Н2О СоСI2´6Н2О Концентрація [г/л] 1,0 10,0 15,0 0,2% (мас/об.) 2,0 0,5 0,015 Об'єм середовища додаванням води доводять до 1л (рН 7,0). Таблиця 6 Вплив індукторів на нітрилгідратазну активність Загальна Питома акактивтивність Ріст Індуктор ність [ОГ 610нм ] [мкмоль/(хв´ [мкмоль/( мл´ОГ 610нм )] хв´мл) 1 2 3 4 метакриламід 4,55 569 125 ізобутирамід 3,55 387 109 бутирамід 4,7 344 73,2 метакрилнітрил 4,61 330 71,5 13 82982 Продовження таблиці 6 1 амід кротонової кислоти бутиронітрил амід валеріанової кислоти ізобутиронітрил нітрил кротонової кислоти амід пропіонової кислоти валеронітрил нітрил ізокапронової кислоти ізовалеронітрил нітрил капронової кислоти пропіонітрил акрилоамід 3-пентеннітрил e-капролактам бензонітрил амід піколінової кислоти ціанацетамід ацетамід ацетонітрил 3-ціанпіридин амід ізоникотинової кислоти бензамід акрилонітрил амід нікотинової кислоти сечовина 2 3 4 9,32 558 59,9 5,26 307 322 57,5 5,24 273 52,1 8,24 407 49,4 5,17 149 Дані про субстратну специфічність нітрилгідратазної активності штаму Rhodococcus sp. FZ4 у порівнянні із субстратною специфічністю нітрилгідратазної активності штаму Rhodococcus rhodochrous J1 наведені в таблиці 7. 58,4 5,61 14 28,7 3,70 120 32,4 4,72 134 28,5 3,22 74,7 104 95,8 60,5 62 40,3 40,3 20,3 11,7 13,4 9,08 7,17 3,80 26,1 6,87 4,2 4,75 4,37 4,46 5,54 27,7 30,9 21,6 18,4 12,3 6,59 6,50 4,98 4,13 2,21 5,03 10,9 2,17 3,88 3,27 8,24 5,91 2,12 1,81 3,55 4,94 1,39 6,16 5,66 0,918 Субстрат 23,0 4,72 5,17 4,62 4,44 5,62 Порівняння субстратної специфічності нітрилгідратазної активності штаму Rhodococcus sp. FZ4 і штаму Rhodococcus rhodochrous J1 23,2 4,54 Таблиця 7 Приклад 5 Вирощування штаму Rhodococcus sp. FZ4 Штам Rhodococcus sp. FZ4 вносили в середовище для вирощування попередніх культур, склад якого вказаний у таблиці 2, і при струшуванні інкубували протягом 1-2 днів при 28°С. Отриману попередню культур у пересівали в культуральне середовище, склад якого вказаний у таблиці 5 і яке містило як індуктор метакриламід у концентрації 6г/л, і при стр ушуванні інкубували протягом 3 днів при 28°С. Через 48год додатково додавали метакриламід (0,2% (об./об.)). В описаних нижче прикладах 6-13 використовували спочиваючі клітини штаму Rhodococcus sp. FZ4. Приклад 6 Субстратна специфічність нітрилгідратазної активності штаму Rhodococcus sp. FZ4 Нітрилгідратазну активність штаму Rhodococcus sp. FZ4 при використанні різних субстратів визначали відповідно до прикладу 1, застосовуючи замість 3-ціанпіридину відповідний субстрат і відповідно змінюючи умови проведення РХВР залежно від використовуваного субстрату. ацетонітрил акрилонітрил бутиронітрил пропіонітрил 3-ціанпіридин 4-ціанпіридин нітрил кротонової кислоти бензонітрил 2-ціанпіридин мхлорбензонітрил nхлорбензонітрил метакрилнітрил охлорбензонітрил Відносна активність [%] Rhodococcus штаму Rhodococsp. FZ4 cus rhodochrous J1 0 (нітрилгідратаза А) 646 115 (нітрилгідратаза В) 498 478 466 26 412 435 100 100 98,4 70 92,1 78 41,7 39,3 27 45 39,3 43 8,25 13 3,64 87 0 2,8 Приклад 7 Оптимальна температура для нітрилгідратазної активності штаму Rhodococcus sp. FZ4 і її термостабільність Нітрилгідратазну активність визначали відповідно до прикладу 1 при різних температурах в інтервалі від 20 до 70°С. Оптимальне значення температури для нітрилгідратазної активності припадало на 60°С (Фіг.2). Для визначення термостабільності нітрилгідратазної активності суспензію клітин інкубували протягом 15хв при різних температурах в інтервалі від 40 до 70°С. Після цього нітрилгідратазну активність визначали відповідно до прикладу 1 при 20°С. Після 15-хвилинної інкубації при температурах в інтервалі від 40 до 60°С нітрилгідратазна активність відповідала вихідному рівню (Фіг.3). Приклад 8 Оптимальне значення pH для нітрилгідратазної активності штаму Rhodococcus sp. FZ4 і її pHстабільність Нітрилгідратазну активність визначали відповідно до прикладу 1 при різних значеннях pH в інтервалі від 3 до 12 з використанням різних буферів (0,1-молярних). Оптимальні значення pH для нітрилгідратазної активності припадали на інтервал значень від 6 до 7 (Фіг.4). 15 82982 16 Для визначення pH-стабільності нітрилгідрата30°С. Загальний об'єм реакційної суміші становив зної активності суспензію 20 клітин інкубували при залежно від концентрації 3-ціанпіридину від 2,0 до 20°С протягом 24год при різних значеннях pH в 2,2мл. Реакцію припиняли додаванням HCl (2M; інтервалі від 4 до 10. Після цього суспензію клітин 0,1мл). Після центрифугування реакційної суміші центрифугували. Відділені клітини промивали і (при 12000об/хв протягом 5хв) кількість утвореного ресуспендували в калійфосфатному буфері (0,1М, аміду нікотинової кислоти визначали за допомогою pH 7,0). Нітрилгідратазну активність визначали РХВР відповідно до прикладу 1. Визначене таким відповідно до прикладу 1. Після 24-годинної інкушляхом Кm-значення становило 160мМ (Фіг.10). бації при різних значеннях pH в інтервалі від 5 до Приклад 12 10 нітрилгідратазна активність приблизно відповіПорівняння рівнів нітрилгідратазної активності дала вихідному рівню (Фіг.5). штаму Rhododoccus sp. FZ4 з рівнями нітрилгідраПриклад 9 тазної активності відомих мікроорганізмів Вплив концентрації 3-ціанпіридину на нітрилгіAmvcolatopsis sp. NA40, Rhodococcus sp. GF270 і дратазну активність штаму Rhodococcus sp. FZ4 Rhodococcus rhodochrous J1 Суспензію клітин інкубували протягом 60хв Кm-значення для 3-ціанпіридину, який служить при 20°С у присутності різних концентрацій 3субстратом, в нітрилгідратазній активності штамів ціанпіридину в інтервалі від 0 до 10% (мас/об.). Rhododococcus sp. FZ4, Rhodococcus sp. GF270 Потім клітини відокремлювали, промивали і ресус(DSM 12211, [WO 99/05306]), Amycolatopsis sp. пендували в калійфосфатному буфері (0,1М, pH NA40 (DSM 11617, [WO 99/05306]) і Rhodococcus 7,0). Нітрилгідратазну активність визначали відпоrhodochrous J1 визначали відповідно до прикладу відно до прикладу 1. Після 60-хвилинної інкубації в 11 з використанням відповідного мікроорганізму. присутності різних концентрацій 3-ціанпіридину в Кm -значення, отримані для штамів інтервалі від 0 до 20% (мас/об.) нітрилгідратазна Amycolatopsis sp. NA40 і Rhodococcus sp. FZ4, меактивність приблизно відповідала вихідному рівню нше значень, отриманих для інших мікроорганізмів (Фіг.6). (таблиця 8). Приклад 10 Вплив концентрації аміду нікотинової кислоти Таблиця 8 на нітрилгідратазну активність штаму Rhodococcus sp. FZ4 Порівняння Кm-значень Суспензію клітин інкубували протягом 24год для 3-ціанпіридину, який служить субстратом при 20°С у присутності різних концентрацій аміду нікотинової кислоти в інтервалі від 0 до 20% Кm [м М] (мас/об.). Потім клітини відокремлювали, промиRhododococ- Rhodococ Amycolatopsi Rhodococcus вали і ресуспендували в 0,1-молярному калійфоcus sp. FZ4 cus sp. s sp. NA40 rhodochrous сфатному буфері (0,1М, pH 7,0). Нітрилгідратазну GF270 J1 активність визначали відповідно до прикладу 1. 160 >200 41,7 200 Після 24-годинної інкубації в присутності різних концентрацій аміду нікотинової кислоти в інтервалі Термостабільність нітрилгідратазної активносвід 0 до 20% (мас/об.) нітрилгідратазна активність ті штамів Rhododococcus sp. FZ4, Rhodococcus sp. приблизно відповідала вихідному рівню (Фіг.7). GF270, Amycolatopsis sp. NA40 і Rhodococcus Приклад 11 rhodochrous J1 визначали відповідно до прикладу Визначення Km-значення для 3-ціанпіридину в 7 з використанням відповідного мікроорганізму і нітрилгідратази штаму Rhodococcus sp. FZ4 вказаних у таблиці 9 умов інкубації. НітрилгідратаРеакційну суміш, яка містить 3-ціанпіридин зна активність штаму Rhodococcus sp. FZ4 вияв(0,1-1,0М; 1,0-1,8мл), водний розчин NaCl (0,85%ляла найвищу термостабільність у порівнянні з ний (мас/об.); 0,7-0,1мл), калійфосфатний буфер нітрилгідратазною активністю інших мікроорганіз(0,1М, рН 7,0; 0,3мл) і суспензію клітин (0,01мл), мів. при струшуванні інкубували протягом 10хв при 17 82982 18 Таблиця 9 Порівняння термостабільності нітрилгідратазної активності Умови інкубації Відносна активність [%] Rhodococcus sp. Amycolatopsis sp. GF270 NA40 Rhododococcus sp. FZ4 15хв при 50°С 60°С 70°С 60хв при 20°С 30°С 40°С 50°С 60°С 70°С 60°С протягом 0хв 30хв 60хв 120хв Rhodococcus rhodochrous J1 100 93 2 100 95 5 н.в.а н.в.а н.в.а 100 80 0 100 100 100 100 100 6 100 100 100 100 89 0 100 95 80 32 0 0 н.в.а н.в.а н.в.а н.в.а н.в.а н.в.а 100 100 92-100 72-87 100 67-80 52-68 29-47 н.в.а н.в.а н.в.а н.в.а н.в.а н.в.а н.в.а н.в.а Примітка: ане визначали. Вплив концентрації 3-ціанпіридину на нітрилгідратазну активність штамів Rhododococcus sp. FZ4, Rhodococcus sp. GF270, Amycolatopsis sp. NA40 і Rhodococcus rhodochrous J1 визначали відповідно до прикладу 9 з використанням відпові дного мікроорганізму і вказаних у таблиці 10 концентрацій 3-ціанпіридину. Нітрилгідратазна активність штамів Rhodococcus sp. FZ4 і Rhodococcus sp. GF270 виявляла найвищу толерантність до 3ціанпіридину. Таблиця 10 Порівняння впливу різних концентрацій 3-ціанпіридину на нітрилгідратазну активність 3-ціанпіридин [% (мас/об.)] 0 2,5 5,0 7,5 10,0 Rhododococcus sp. FZ4 100а 100а 100а 100а 100а Відносна активність [%] Rhodococcus sp. Amycolatopsis sp. GF270 NA40 100а 100б а 100 74° 100а 56° 100а 47& а 100 16б Rhodococcus rhodochrous J1 100б н.в.в 86б н.в.в 63б Примітки: аінкубація протягом 60хв, б інкубація протягом 15хв, в не визначали. Вплив концентрації аміду нікотинової кислоти на нітрилгідратазну активність штамів Rhododococcus sp. FZ4, Rhodococcus sp. GF270, Amycolatopsis sp. NA40 і Rhodococcus rhodochrous J1 визначали відповідно до прикладу 9 з використанням відповідного мікроорганізму і вказаних у таб лиці 11 концентрацій аміду нікотинової кислоти. Нітрилгідратазна активність штамів Rhodococcus sp. FZ4 і Rhodococcus sp. GF270 виявляла найвищу толерантність до аміду нікотинової кислоти (таблиця 11). 19 82982 20 Таблиця 11 Порівняння впливу різних концентрацій аміду нікотинової кислоти на нітрилгідратазну активність Амід нікотинової кислоти [% (мас/об.)] 0 10 20 30 Відносна активність [%] Rhododococcus sp. Rhodococcus sp. Amycolatopsis sp. FZ4 GF270 NA40 100 100 100 100 100 55 100 100 0 100 100 0 Rhodococcus rhodochrous J1 н.в.а н.в.а н.в.а н.в.а Примітка: ане визначали. Приклад 13 Біотрансформація 3-ціанпіридину в амід нікотинової кислоти штамом Rhododococcus sp. FZ4 Розчин 3-ціанпіридину додавали 42 порціями (42´0,52г = 21,8г; 0,21моля) до попередньо приготовленої суміші, яка містить суспензію клітин (13,7мг у перерахунку на суху масу клітин, 4мл) і калійфосфатний буфер (0,1М, рН 6,0; 16мл). Кожну наступну порцію 3-ціанпіридину додавали до реакційної суміші після кількісного перетворення в ній 3-ціанпіридину в амід нікотинової кислоти. Реакційна суміш залишалася в ході реакції густою, відповідно щільною. Загальна кількість утвореного аміду нікотинової кислоти становила 25,7г (кількісний вихід). Приклад 14 Біотрансформація ацетонітрилу в ацетамід штамом Rhodococcus sp. FZ4 До реакційної суміші, яка містить калійфосфатний буфер (0,1М, pH 7,0; 4,5мл) і суспензію клітин (4,88мг у перерахунку на суху масу клітин; 0,5мл), протягом 80хв при 20°С по краплях додавали ацетонітрил (5мл; 95ммолів). Наступна реакція відбувалася при 20°С і при струшуванні. Утворення ацетаміду в ході реакції відслідковували за допомогою РХВР (колонка Waters Spherisorp 5 m ODS2 (4,6´150мм); KH2PO4 (10мМ; pH 2,5)/ацетонітрил у співвідношенні 99/1(об./об.); 1,0мл/хв; 210нм). Протягом 120хв утворювалося 6,14г (кількісний вихід) ацетаміду, який накопичувався в реакційному середовищі (Фіг.1). Приклад 15 Вплив концентрації ацетонітрилу на нітрилгідратазну активність штаму Rhodococcus sp. FZ4 у процесі біотрансформації ацетонітрилу в ацетамід Реакційну суміш, яка містить ацетонітрил (0,219,0М; 1,0-1,6мл), водний 20 розчин NaCl (0,85%ний (мас/об.); 0,6-0,0мл), калійфосфатний буфер (0,1М, pH 7,0; 0,3мл) і суспензію клітин (0,1мл), при струшуванні інкубували протягом 10хв при 20°С. Загальний об'єм реакційної суміші становив 2,0мл. Реакцію припиняли додаванням МеОН. Потім реакційну суміш центрифугували (при 12000об/хв протягом 5хв) і за допомогою РХВР відповідно до прикладу 14 визначали кількість утвореного ацетаміду. При концентрації ацетонітрилу в інтервалі від 0,1 до 15М нітрилгідратазна активність залишалася практично постійною (Фіг.8). Приклад 16 Вплив концентрації ацетонітрилу на нітрилгідратазну активність штаму Rhodococcus sp. FZ4 Клітини протягом 1год інкубували в присутності ацетонітрилу (0,0-15,0М) у калійфосфатному буфері (0,1М, рН 7,0) при 20°С. Потім суспензію клітин центрифугували (при 12000об/хв протягом 5хв) і клітини ресуспендували у водному розчині NaCl (0,85%-ному (мас/об.)). Далі реакційну суміш, яка містить цю суспензію клітин (0,1мл), 3ціанпіридин (0,5М; 1,0мл), водний розчин NaCl (0,85%-ний (мас/об.); 0,6мл) і калійфосфатний буфер (0,1М, pH 7,0; 0,3мл), при струшуванні інкубували протягом 5хв при 30°С. Реакцію припиняли додаванням МеОН. Реакційну суміш центрифугували (при 12000об/хв протягом 5хв) і за допомогою РХВР відповідно до прикладу 14 визначали кількість утвореного ацетаміду. Після 1-годинної інкубації в присутності ацетонітрилу в інтервалі концентрацій від 0 до 3М нітрилгідратазна активність залишалася практично незмінною. Після 1-годинної інкубації в присутності 6молярного ацетонітрилу нітрилгідратазна активність усе ще становила 60% від вихідного рівня. Після 1-годинної інкубації в присутності 9молярного ацетонітрилу нітрилгідратазна активність усе ще становила порядку 35% від вихідного рівня (Фіг.9). Приклад 17 Створення непігментованих мутантів штаму Rhodococcus sp. FZ4 Штам Rhodococcus sp. FZ4 вносили в середовище типу "живильного бульйону" (50мл) і інкубували при струшуванні і при 28°С до досягнення оптичної густини ОГ 610нм , що дорівнює 6,29. Потім цю попередню культур у (10мл) пересівали на середовище типу "живильного бульйону" (25мл) і при струшуванні інкубували при 28°С до досягнення оптичної густини ОГ 610нм що дорівнює 1,90. Отриману таким шляхом культур у (10мл) центрифугували (при 8000об/хв протягом 5хв). Надосадову рідину відкидали, а осад, який містить клітини, суспендували в забуференому фосфатом розчині кухонної солі. Отриману суспензію клітин центрифугували (при 8000об/хв протягом 5хв). Надосадову рідину відкидали, а осад, який містить клітини, суспендували в забуференому фосфатом розчині кухонної солі (5мл). Цю суспензію клітин переносили в скляну чашку Петрі (діаметром 90мм). Далі клітини протягом 17хв опромінювали УФ-лампою (15Вт, 254нм) з відстані 25см. Після цього клітини при струшуванні інкубували протя 21 82982 22 гом 4 днів при 28°С у середовищі типу "живильноШтам Rhodococcus sp. FZ4 вирощували відпого бульйону" подвійної концентрації. Отриману відно до прикладу 3 у 2-літровому ферментері. таким шляхом культуру розбавляли в 100 разів і Отриману культуру центрифугували й осад, який 100-мікролітрові аліквоти такої розведеної культумістить клітини, ресуспендували у водному розчині ри висівали на агар для чашкового підрахунку і NaCl (0,85%-ному (мас/об.)). Далі суспензію клітин інкубували при 28°С. У кожній чашці виростало переносили в калійфосфатний буфер (0,1М, рН майже по 150 окремих колоній. Чашки поміщали в 7,0), який містить масляну кислоту (44мМ), і обродоступне для денного світла місце з метою індукубляли ультразвуком. Залишки клітин, які утворивати утворення червоних пігментів. Колонії непіглися в результаті їх р уйнування, видаляли ментованих мутантів можна було легко відрізнити центрифугуванням. Надосадову рідину використовід колоній забарвлених мутантів і колоній мікровували для очищення нітрилгідратази відповідно організмів дикого типу, які мають червоне забарвдо наведених в таблиці 12 умов. Нітрилгідратазну лення. активність визначали відповідно до прикладу 1, Приклад 18 однак замість суспензії клітин використовували Очищення нітрилгідратази з Rhodococcus sp. відповідні екстракти. FZ4 Таблиця 12 Очищення нітрилгідратази з Rhodococcus sp. FZ4 Стадія очищення безклітинний екстракт осадження (NН4)2SO4 ДЕАЕ-се фацел бутил-То уореаrl феніл-сефароза Вміст білка [мг] 335 198 73,0 66,2 26,2 Приклад 19 Визначення молекулярної маси очищеної нітрилгідратази Молекулярну масу визначали за допомогою РХВР (колонка TSK gel G 300 SW (0,75´60см); калійфосфатний буфер (0,1М, pH 7,5) і хлорид калію (0,2М); 0,7мл/хв; 280нм). Молекулярна маса нітрилгідратази становила 465кДа (Фіг.11). Нітрилгідратаза складається з a-субодиниці з молекулярною масою 27,7 кДа і b-субодиниці з молекулярною масою 31,2кДа (Фіг.12). Приклад 20 Термостабільність очищеної нітрилгідратази Розчин, який містить розчин нітрилгідратази (0,697мкмоля/хв; 0,025мл) і калійфосфатний буфер (0,1М, pH 7,0; 0,475мл), інкубували протягом 60хв при різних температурах в інтервалі від 20 до 70°С. Після цього розчин охолоджували за допомогою льодяної бані до 20°С і додавали 3ціанпіридин (0,5М; 0,500мл). Потім реакційну суміш інкубували протягом 10хв при 20°С. Реакцію припиняли додаванням МеОН. Кількість утвореного аміду нікотинової кислоти визначали за допомогою РХВР відповідно до прикладу 1. Після 60хвилинної інкубації при температурах ви ще 40°С нітрилгідратазна активність значно знижувалася, при цьому після 60-хвилинної інкубації при 50°С нітрилгідратазна активність становила лише близько 25% від вихідного рівня (Фіг.15). Приклад 21 Оптимальне значення pH для очищеної нітрилгідратази Реакційну суміш, яка містить 3-ціанпіридин (0,5М; 0,500мл), розчин нітрилгідратази (0,697мкмоля/хв; 0,025мл) і різні буфери з pH в інтервалі від 4 до 11 (0,1М; 0,0475мл), інкубували Загальна активність [мкмоль/хв] 5881 6087 3553 2035 890 Питома активність [мкмоль/(хв´мг)] 17,6 28,4 48,7 30,7 34,0 протягом 10хв при 20°С. Реакцію припиняли додаванням МеОН. Кількість утвореного аміду нікотинової кислоти визначали за допомогою РХВР відповідно до прикладу 1. Оптимальне значення pH для нітрилгідратази припадало на інтервал від 6,0 до 6,5 (Фіг.16). Приклад 22 pH-стабільність очищеної нітрилгідратази Розчин, який містить розчин нітрилгідратази (8,36мкмоля/хв; 0,47мл), різні буфери з pH в інтервалі від 4,0 до 11,0 (0,3М; 0,10мл) і дистильовану воду (0,03мл), інкубували протягом 30хв при 20°С. Потім реакційну суміш, яка містить аліквотну кількість інкубованого на попередній стадії розчину нітрилгідратази (0,05мл), 3-ціанпіридин (0,5М; 0,5мл) і відповідний буфер (0,1М; 0,45мл), інкубували протягом 10хв при 20°С. Реакцію припиняли додаванням МеОН. Кількість утвореного аміду нікотинової кислоти визначали за допомогою РХВР відповідно до прикладу 1. Після 60хвилинної інкубації при значенні pH в інтервалі від 6 до 8 нітрилгідратазна активність приблизно відповідала вихідному рівню (Фіг.17). Приклад 23 Субстратна специфічність очищеної нітрилгідратази Реакційну суміш, яка містить розчин нітрилгідратази (0,695мкмоля/хв; 0,025мл), різні субстрати (0,500мл) і калійфосфатний буфер (0,1 М, pH 7,0; 0,475мл), інкубували протягом 5-10хв при 20°С. Субстрати використовували в концентраціях від 0,015 до 0,250М. Реакцію припиняли додаванням МеОН. Кількість утвореного аміду кислоти визначали за допомогою РХВР. Отримані 20 результати наведені в таблиці 13. Серед усіх протестованих 23 субстратів найвищу активність нітрилгідратаза 82982 24 виявляє у відношенні ацетонітрилу. Таблиця 13 Субстратна специфічність очищеної нітрилгідратази Субстрат ацетонітрил акрилонітрил пропіонітрил бутиронітрил нітрил кротонової кислоти 3-ціанпіридин 4-ціанпіридин бензонітрил м-хлорбензонітрил 2-ціанпіридин n-хлорбензонітрил метакриламід о-хлорбензонітрил Концентрація [М] 0,2 0,2 0,2 0,2 0,2 0,25 0,125 0,015 0,015 0,125 0,015 0,2 0,015 Відносна активність [%] 1008 774 693 578 114 100а 92,8 75,6 66,5 36,7 8,31 1,39 0 Примітка: а загальна активність: 4164мкмоля/(хвх´л). Приклад 24 Вплив потенційних інгібіторів на очищену нітрилгідратазу Розчин, який містить розчин нітрилгідратази (0,695мкмоля/хв; 0,025мл), калійфосфатний буфер (0,1М, рН7,0; 0,475мл), дистильовану воду (0,150мл) і різні потенційні інгібітори (0,100мл), інкубували протягом 5хв при 20°С. Після цього додавали 3-ціанпіридин (1,0М; 0,250мл). Концентрація інгібіторів у реакційній суміші становила 1,0мМ. Реакційну суміш інкубували протягом 10хв при 20°С. Реакцію припиняли додаванням МеОН. Кількість утвореного аміду нікотинової кислоти визначали за допомогою РХВР відповідно до прикладу 1. Отримані результати представлені в таблиці 14. Серед усіх протестованих потенційних інгібіторів найбільшу інгібуючу дію виявляють гідроксиламін і ціанід калію. Таблиця 14 Вплив потенційних інгібіторів на очищену нітрилгідратазу Потенційний інгібітор n-хлормеркурбензойна кислотаа тирон фенілметансульфоніл фторид 1,10-фенантролін сечовина дитіотреїтол Відносна активність [%] 187 114 110 106 106 103 ЕДТКб 100 100в цистеамін 99,1 8-гідроксихінолін 97,8 2,2'-біпіридил 97,8 йодацетат 96,7 N-етилмалеїнімід 95,3 азид натрію 93,5 5,5'-дитіобіс(2-нітробензойна ки93,4 слота)а діетилдитіокарбамат 93,3 D-циклосерин 86,3 фенілгідразин 84,6 2-меркаптоетанол 76,3 гідроксиламін 1,34 ціанід калію 0 Примітки: а 0,1мМ, б етилендіамінтетраоцтова кислота, в загальна активність: 3776мкмолів/(хв´мл). Приклад 25 Вплив іонів металів на активність очищеної нітрилгідратази Вплив іонів металів на активність очищеної нітрилгідратази визначали відповідно до прикладу 24, але з використанням іонів металів замість потенційних інгібіторів. Концентрація іонів металів у реакційній суміші становила 1,0мМ. Отримані результати представлені в таблиці 15. Серед усіх протестованих іонів металів інгібуючу дію виявляють лише катіони срібла і двозарядні катіони ртуті. 25 82982 Таблиця 15 Вплив іонів металів на активність очищеної нітрилгідратази Іони металів Відносна активність [%] СuSО4 177 МnСl2 123 NiСl2 123 ZnSО4 121 FеSО4 113 СаСl2 113 СоСl2 ПО FеСl3 105 100а AgNO3 0 НgСl2б 0 Примітки: а загальна активність: 3375мкмолів/(хв´мл), б 0,1мМ. Приклад 26 Визначення Кm-значення для 3-ціанпіридину в очищеної нітрилгідратази 26 До розчину, який містить розчин нітрилгідратази (0,0697мкмоля/хв; 0,025мл) і калійфосфатний буфер (0,1М, рН 7,0; 0,475мл), додавали 3ціанпіридин у різних концентраціях (3,1-800мМ; 0,500мл). Реакційну суміш інкубували протягом 10хв при 20°С. Реакцію припиняли додаванням метанолу і кількість утвореного аміду нікотинової кислоти визначали за допомогою РХВР відповідно до прикладу 1. Кm-значення для 3-ціанпіридину становило 80,5мМ (Фіг.13). Приклад 27 Визначення Кm-значення для ацетонітрилу в очищеної нітрилгідратази До розчину, який містить розчин нітрилгідратази (0,0697мкмоля/хв; 0,025мл) і калійфосфатний буфер (0,1М, рН 7,0; 0,475мл), додавали ацетонітрил у різних концентраціях (2,5-80мМ; 0,500мл). Реакційну суміш інкубували протягом 10хв при 20°С. Реакцію припиняли додаванням метанолу і кількість утвореного ацетаміду визначали за допомогою РХВР відповідно до прикладу 14. Кmзначення для ацетонітрилу становило 2,84мМ (Фіг.14). 27 82982 28 29 Комп’ютерна в ерстка Л.Литв иненко 82982 Підписне 30 Тираж 26 прим. Міністерство осв іт и і науки України Держав ний департамент інтелектуальної в ласності, вул. Урицького, 45, м. Київ , МСП, 03680, Україна ДП “Український інститут промислов ої в ласності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюMicroorganism, representing the strain of rhodococcus sp. fz4, enabled to convert acetonitrile in amide, nitrile-hydrase, the process for preparation of amides and the use of the microorganism for the removal or the utilization of the waste substances of acetonitrile
Автори англійськоюRobins Karen Treisy, Nagasava Toru
Назва патенту російськоюМироорганизм, который представляет собой штамм rhodococcus sp. fz4, способный превращать ацетонитрил в амид, нитрилгидратаза, способ получения амидов и применение микроорганизма для уничтожения или утилизации отходов ацетонитрила
Автори російськоюРобинс Карен Трейси, Нагасава Тору
МПК / Мітки
МПК: C12N 1/20, C12N 9/78, C12P 13/02
Мітки: ацетонітрилу, амід, спосіб, штам, rhodococcus, амідів, відходів, ацетонітрил, здатний, являє, застосування, мікроорганізм, собою, мікроорганізму, нітрилгідратаза, знищення, утилізації, перетворювати, одержання
Код посилання
<a href="https://ua.patents.su/15-82982-mikroorganizm-yakijj-yavlyaeh-soboyu-shtam-rhodococcus-sp-fz4-zdatnijj-peretvoryuvati-acetonitril-v-amid-nitrilgidrataza-sposib-oderzhannya-amidiv-ta-zastosuvannya-mikroorganizmu-d.html" target="_blank" rel="follow" title="База патентів України">Мікроорганізм, який являє собою штам rhodococcus sp. fz4, здатний перетворювати ацетонітрил в амід, нітрилгідратаза, спосіб одержання амідів та застосування мікроорганізму для знищення або утилізації відходів ацетонітрилу</a>
Попередній патент: Харчова композиція, придатна для поверхневого обсмажування, яка містить соняшниковий лецитин
Наступний патент: Полімерні кон’югати найбластину та способи їх використання
Випадковий патент: Хвилезахисна споруда












