Інтегрований вуглецевий електродний чип для електричного збудження хелатів лантанідів
Номер патенту: 93083
Опубліковано: 25.09.2014
Автори: Суомі Йоханна, Корпєла Тімо Калєві, Кулмала Сакарі, Лааксонен Теппо Тапані, Ескола Яркко Уолеві, Хааконссон Маркус
Формула / Реферат
1. Пристрій для електричного збудження хелатів лантанідів у розчинах електролітів, виконаний у вигляді електрохімічної комірки, яка містить чип з двома електродами з функцією катода і анода, який відрізняється тим, що як хелати лантанідів вибрані хелати тербію Тb(ІІІ), а електроди виконані на резистивному або ізолюючому матеріалі з можливістю збудження хелатів тербію Тb(ІІІ) імпульсами напруги різної полярності.
2. Пристрій за п. 1, який відрізняється тим, що електроди виконані з вуглецевої пасти з питомим опором, переважно, нижче 50 Ом/см2 за технологіями друкування, розпилення або нанесення малюнка.
3. Пристрій за п. 1 або 2, який відрізняється тим, що електроди з вуглецевої пасти виконані на поверхні другого провідника, в тому числі, на поверхні металевої плівки, провідних фарб або провідного полімеру.
4. Пристрій за п. 1, який відрізняється тим, що електроди виконані на резистивному або ізолюючому матеріалі за технологіям друкування, розпилення або нанесення малюнка сріблястою фарбою, з подальшим висушуванням та покриттям вуглецевою пастою та одночасним формуванням катода і анода як верхнього шару вуглецевої пасти з питомим опором, переважно, менше 1000 Ом/см2.
5. Пристрій за п. 1, який відрізняється тим, що електроди виконані у вигляді двох елементів з металу або фольги, що розділені тонким шаром резистивного або ізолюючого матеріалу товщиною 0,01-5 мм, елементи з металу мають покриття з вуглецевої пасти з питомим опором, переважно, менше 1000 Ом/см2, що одночасно формує катод і частину анода та виконане за технологіями друкування, розпилення або нанесення малюнка.
6. Пристрій за п. 1, який відрізняється тим, що поверхня електродів оброблена хімічними речовинами, які містять, переважно, гідрооксиди лужних металів і гідрооксиди лужних рідкоземельних металів.
7. Пристрій за п. 1, який відрізняється тим, що поверхня електродів оброблена кислотою з групи, що включає сірчисту кислоту, хлористоводневу кислоту, фосфорну і оцтову кислоти.
Текст
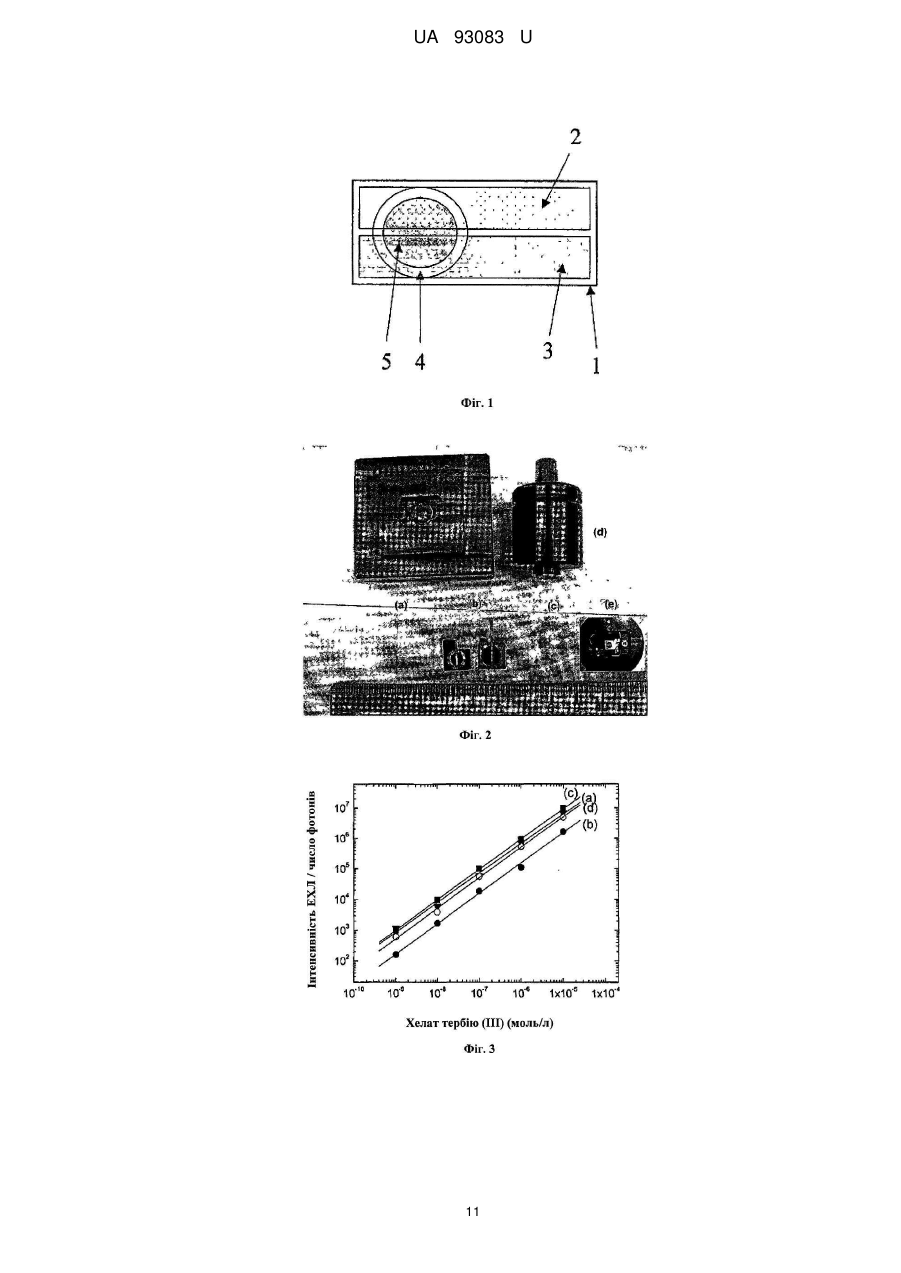
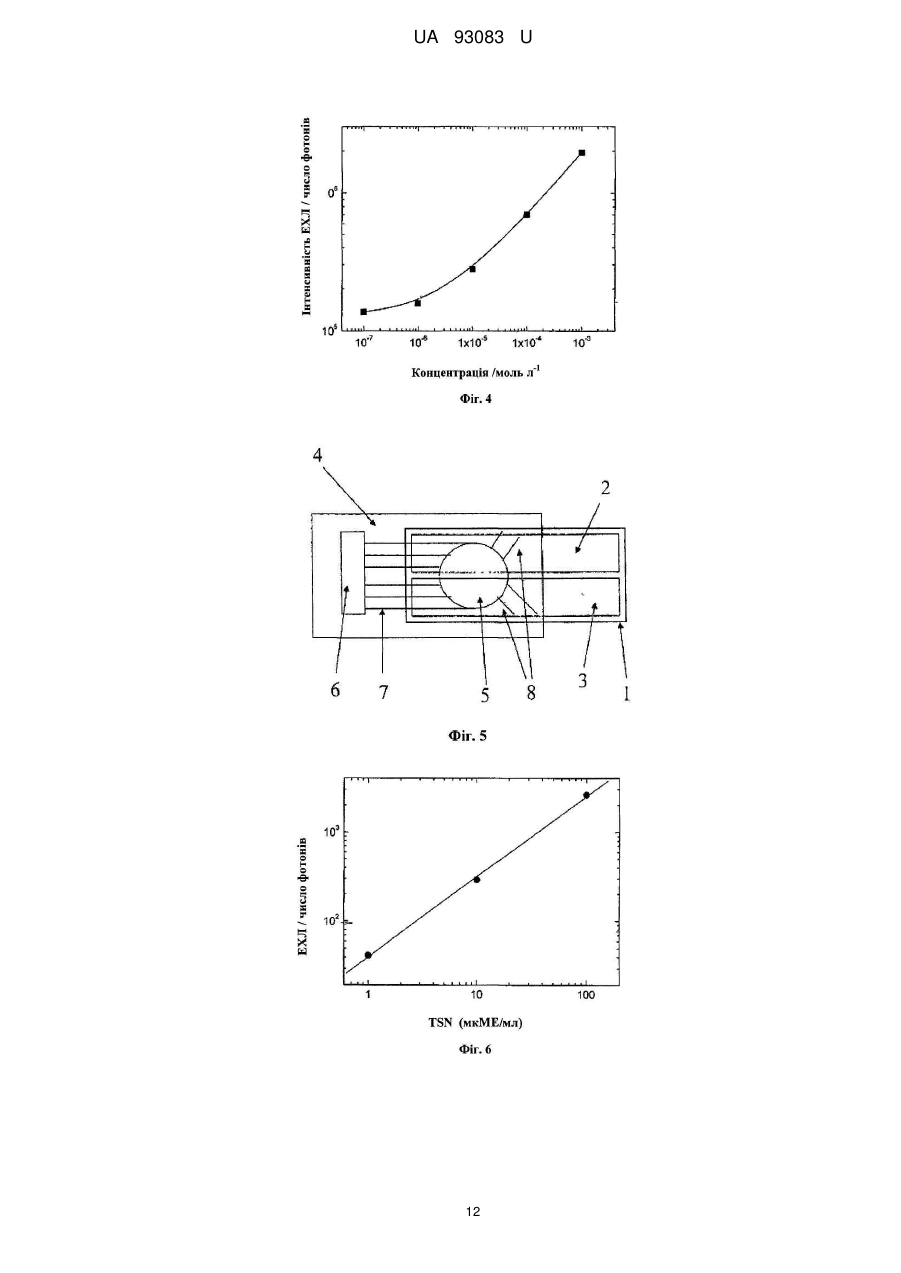
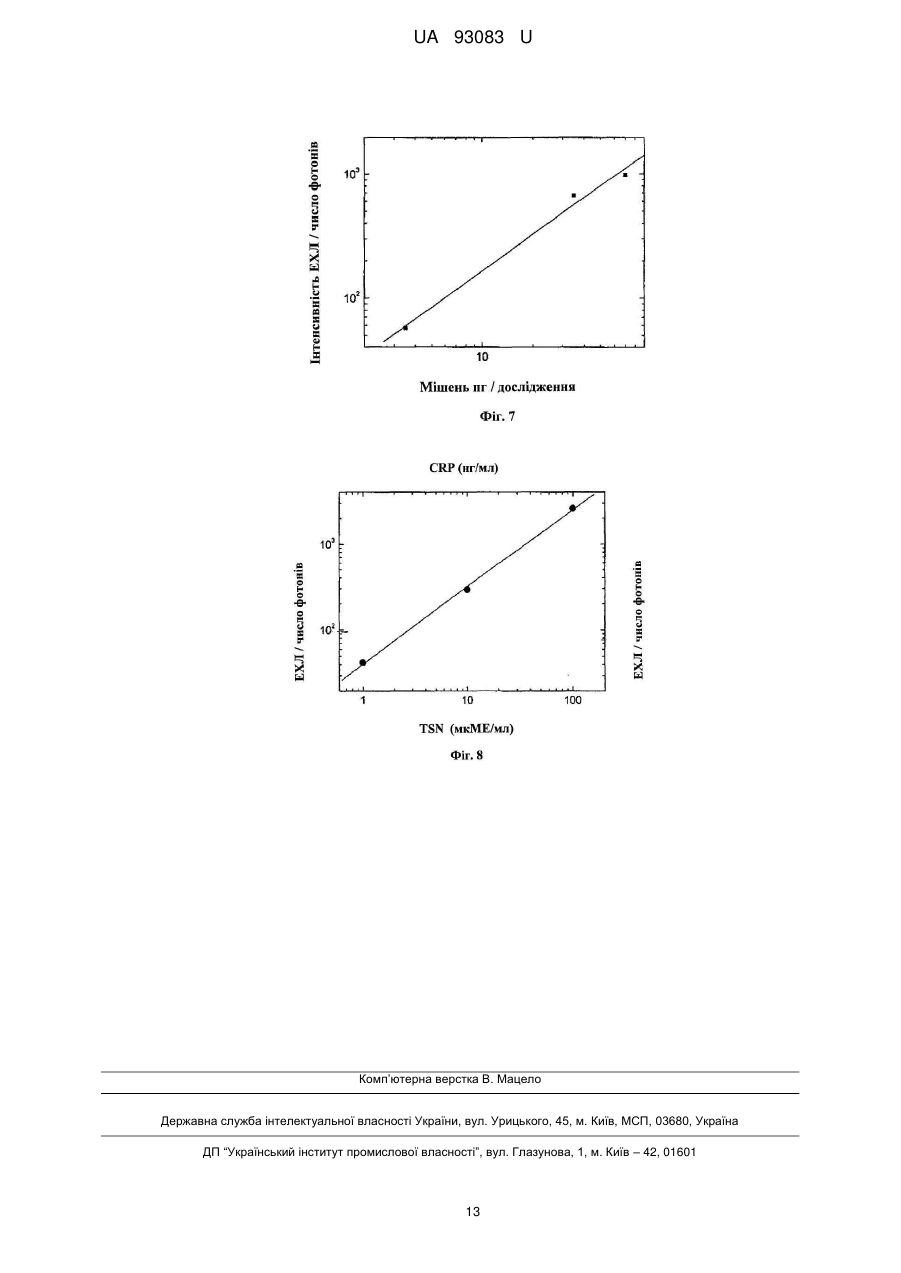
Реферат: Пристрій для електричного збудження хелатів лантанідів у розчинах електролітів, виконаний у вигляді електрохімічної комірки, яка містить чип з двома електродами з функцією катода і анода. Як хелати лантанідів вибрані хелати тербію Тb(ІІІ), а електроди виконані на резистивному або ізолюючому матеріалі з можливістю збудження хелатів тербію Тb(ІІІ) імпульсами напруги різної полярності. UA 93083 U (12) UA 93083 U UA 93083 U 5 10 15 20 25 30 35 40 45 50 55 ГАЛУЗЬ КОРИСНОЇ МОДЕЛІ Корисна модель відноситься до пристроїв, придатних для детектування електрохемілюмінесценції. Корисна модель застосовна, особливо, для швидкої кількісної діагностики при децентралізованому аналізі, особливо коли необхідні дешеві матеріали для електродів, комірки, одноразові діагностичні чіпи і касети. ПЕРЕДУМОВИ КОРИСНОЇ МОДЕЛІ У теперішній час існує настійна необхідність у швидких, чутливих і кількісних технологіях діагностики. Такі технології застосовні у досить великому сегменті ринку, включаючи здоров'я суспільства, дослідження, сільське господарство, охорону навколишнього середовища, ветеринарну медицину й окремі галузі промислового виробництва. Підвищення чутливості, висока продуктивність, простота використання, надійність чи зниження вартості випробування є чинниками, які, у разі реалізації їх в діагностичних технологіях, можуть знайти застосування у нових областях. Дуже висока чутливість може бути отримана при використанні ряду діагностичних приладів, але при високих витратах. Інші засоби можуть бути більш конкурентоздатними, проте вони не можуть бути достатньо широко застосовні у різних областях ринку. Технологія, що поєднує вимогу високої чутливості з комерційною здійсненністю та широким застосуванням, в майбутньому матиме важливе місце і великі можливості на ринку діагностики. Сучасні діагностичні дослідження використовують декілька різних аналітичних методів, наприклад, радіоактивні мітки, ферментне пов'язане імунне обстеження, колориметричний аналіз, і дослідження, що засновані на флуоресценції та хемілюмінесценції, включаючи як анодну, так і електрохемілюмінесценцію (ЕХЛ), що викликається гарячими електронами. Індукована гарячими електронами електрохемілюмінесценція (КЕХЛ) детально описана у патенті US 6251690 [Kulmala S., та ін.]. Кожен з цих методів має характерну сукупність рівня чутливості, легкості використання, надійності, швидкості і вартості обслуговування, які визначають положення на ринку. Відмінності в таких властивостях визначаються фізичними обмеженнями методів. Наприклад, недоліком багатьох застосувань радіоактивного маркування є ослаблення мітки з часом в результаті радіоактивного розпаду, а також виключно висока вартість радіоактивних відходів як з погляду безпеки, так і з погляду навколишнього середовища. Застосування багатьох чутливих методик у децентралізованих обстеженнях обмежується крайньою складністю випробувань та обладнання, тому вимірювання можуть проводити тільки фахівці. Складність вимірювань зазвичай прямо пов'язана з вартістю устаткування і (або) випробування. Як приклад, можна згадати, серед іншого, анодну електрохемілюмінесценцію (EXЛ), яка стала комерційно популярним методом дослідження. Прилади, засновані на застосуванні анодної EXЛ, являють собою лабораторні роботи зі складними особливостями використання, для яких потрібні спеціальні знання; крім того, процес вимірювання включає неодноразові складні етапи промивання та підготовки. Всі згадані вище обставини є чинниками, що збільшують вартість вимірювань, збільшують кількість відходів і роблять неможливим застосувати метод дослідження до практичних потреб децентралізованого аналізу. Комерційно важливі методики вимірювань засновані на ідентифікації та вимірюванні аналітів у сумішах з використанням так званих маркувальних сполук. У вимірюваннях, заснованих на властивостях біологічних молекул, таких як імунологічні обстеження, вимірюваний аналіт (X) в суміші різних молекул може бути селективне приєднаний до антитіла у твердій фазі, а приєднані молекули можуть бути виміряні за допомогою іншого, також такого, що з'єднується з (X), специфічного антитіла, забезпеченого маркером, тобто поміченого відповідною маркуючою сполукою. Прикладами сполук-маркерів є, але не обмежуються ними, радіоактивні ізотопи, ферменти, молекули, які поглинають світло, флуоресціюють або фосфоресціюють, хелати деяких металів та ін. Маркери приєднуються до антитіла за допомогою хімічного зв'язку. Очищену сполуку (X) також можна маркувати й використовувати для визначення немаркованого (X) в невідомому зразку шляхом реакції порівняння. Методи вимірювання ДНК і PHK також засновані на селективності біологічних властивостей та їх також можна вимірювати аналогічним чином. Ряд інших хімічних і біохімічних аналізів, можна виконати таким самим чином. У теперішній час все більш бажано вимірювати одночасно декілька параметрів зразка, щоб знизити витрати і (або) збільшити точність вимірювань. Одній з можливостей здійснити одночасне вимірювання є використання люмінесцентних маркерів (флуоресцентних чи фосфоресцентних) на різних довжинах хвиль або таких, що мають різний час висвічування. Різні методи і стратегії вимірювань, які можуть бути використані в імунодіагностиці, описані в книзі "Керівництво з імунного аналізу" [The Immunoassay Handbook. Edited by David Wild, 1 UA 93083 U 5 10 15 20 25 30 35 40 45 50 55 60 Stockton Press Ltd., New York, 1994, p. 1-618]. Природно, можливо виміряти марковані сполуки у розчинах як такі, тобто аналізуючи тільки сполуки, якщо вони не використані як маркери. Раніше було відомо, що органічні сполуки і хелати металів, які придатні для використання в дослідженнях у якості сполук-маркерів, можуть збуджуватися під дією світла або електрохімічне, так що це призводить до певної люмінесценції. Методи, засновані на фотолюмінесценції або електрохемілюмінесценції, звичайно дуже чутливі та придатні для збудження сполук-маркерів. Проте, оскільки вимірювані концентрації дуже малі, виникають специфічні труднощі. Використання флуоресценції може бути ускладнене, окрім іншого, тиндалевським, релеєвським та раманівським розсіянням. При вимірюванні біологічних зразків після імпульсу збудження з'являється, майже без послаблення, сильна, але короткоживуча вторинна флуоресценція. У рідкій фазі фосфоресценція в основному використовують тільки, коли іони лантанідів використовують з спеціально синтезованою органічною молекулою хелатів. Проблемою таких методик, що засновані на довгоживучій фотолюмінесценції сполук-маркерів, є складність та вартість устаткування. Взагалі, особливими перевагами EXЛ є низька вартість електричного збудження і простіша структура (порівняно з фотолюмінесценцією), яка не потребує складної оптики збудження. Крім того, можна уникнути багатьох проблем фотолюмінесценції, що описані вище. Звичайна, так звана анодна електохемілюмінесценція, в якій використовуються електроди з інертних металів, може бути отримана на маркерах з органічних люмінофорів у неводних розчинах з використанням відносно простого устаткування. Проте, дослідження біологічних властивостей, які представляють основний комерційний інтерес, в більшості випадків поводяться тільки у водних розчинах. Зразки для досліджень біологічних властивостей майже завжди являють собою водні розчини, отже, вимірювальні прилади для маркерів повинні працювати у воді або, щонайменше, у міцелярному водному розчині. Крім того, хелати лише деяких перехідних металів можуть служити ЕХЛ-маркерами у анодній EXЛ у водних або міцелярних водних розчинах. Таким чином найбільш важливим з комерційної точки зору застосуванням анодної EXЛ в 2+ аналітичній хімії є методика, що використовує у якості маркерів похідні хелатів Ru(bpy)3 та визначає маркери у міцелярному водному розчині. Міцелярні розчини завжди чутливі до різних дратівливих чинників через неконтрольовану складність міцелярної рівноваги. Проте індукована гарячими електронами EXЛ, яка не залежить від міцел, має окремі значні переваги порівняно з анодною EXЛ. Тому приклади для даної корисної моделі в основному ілюструють катодну EXЛ. Анодний метод також використовується як в імунних дослідженнях, так і в дослідженнях ДНК-гибридизації [Blackburn, G., та ін., 1991, Clin. Chem. 37: 1534-1539; Kenten, J., та ін. CHn. Chem. 33: 837-879]. Цей метод комерційно використовується фірмою Roche Diagnostics. Лабораторний робот приводить в рух магнітні частинки, за допомогою яких маркер для кількісних вимірювань аналіту переноситься на позолочений робочий електрод, що постійно використовується для проведення імунологічних досліджень і застосувань ДНК- і РНКзондів [Massey; Richard J., та ін. US 5746974; Leland; Jonathan K., та ін. US 5705402]. Повторна обробка магнітолатексних частинок у багатьох випадках утруднена, тому даний спосіб використовують лише для дорогих лабораторних роботів (тобто Elecsys 1010 та 2010), зі складним і точним приладом рідинної обробки. Крім того, постійно працюючий масивний золотий електрод потребує тривалого очищення та попередньої обробки між послідовними аналізами [Elecsys Service Manual (Керівництво з обслуговування Elecsys), с. 70]. Використання мікрочасток в електролюмінесценції є не обов'язково оптимальним, оскільки як показане в патенті US 5705402, збудження речовини-маркера відбувається на поверхні мікрочастинки, яка контактує із золотим електродом. Хоча мікрочастинки малі (діаметр близько 2800 нм), тільки дуже мала частина поверхні сферичної частинки може мати контакт з електродом. Отже, тільки мала частина маркуючої речовини, що переноситься мікрочастинкою, доступна для збудження. Робоча ефективність далі зменшується через погану оптичну прозорість магнітного матеріалу, що містить частинки латексу, тому тільки частина фотонів може бути детектована у напрямі, протилежному (оптично непрозорому) робочому електроду. У цьому напрямі зазвичай розміщують детектор у традиційних дослідженнях. Звичайна анодна EXЛ на основі традиційної електрохімії вимагає використання інертних металів (наприклад платини або золота) або вуглецю у якості робочих електродів. Використання цих матеріалів для електродів обмежене, проте, вузьким потенціальним вікном як результат розпаду води (на аноді утворюється кисень, на катоді - водень). Тому люмінофори, придатні до використання як ЕХЛ-маркери, не можуть електричне збуджуватися звичайним способом на цих традиційних інертних електродах, оскільки через обмежене потенціальне вікно не можна досягти достатніх потенціалів аноду і катоду, необхідних для реакцій збудження. 2 UA 93083 U 5 10 15 20 25 30 35 40 45 50 55 60 Також анодна EXЛ не може забезпечити одночасного збудження і (або) виявлення з розділенням у часі декількох різних маркерів, що необхідне для мультипараметричного аналізу. Анодна EXЛ підходить тільки для потреб дуже великих централізованих лабораторій. Як результат крайньої складності та високої вартості вимірювального приладу анодний пристрій і метод не підходять в їх відомій формі для використання у сфері ринку децентралізованих аналізів, наприклад за призначенням лікарів, в малих медичних клініках, або вдома у пацієнта. На додаток до проблем, що обговорювалися вище, окремим недоліком і для анодної EXЛ та KEXЛ при дослідженнях біологічних властивостей є тривалий час інкубації, необхідний для досягнення молекулами кінетичної рівноваги в реакції, що необхідна для оптимальної точності аналізу. Ця проблема може бути розв'язана цілком задовільно за допомогою пристроїв з пористим диском [US 2009178924 (Al), Ala-Kleme, T. та ін.] та провідником у якості анода. Проблема таких пристроїв така, що до теперішнього часу вони містили тільки робочий електрод і протилежний електрод був у середині постійно використовуваній комірці електрохемілюміномеру. Ретельне промивання комірки обов'язкове і іноді дуже утруднене та особливо видалення анодних плівок на протилежному електроді та забирає багато часу. Як альтернатива, протилежний електрод має бути поміщений у вимірювальну касету біля робочого електроду, але так, щоб це не перешкоджало світлу досягати електрод. Електрохімія гарячих електронів була використана на плоских поверхнях покритого ізолюючим матеріалом кремнієвого електроду або покритого ізолюючим матеріалом алюмінієвого електроду у якості робочого електроду [FI 20100246, Kulmala, S. та ін.] з провідником у якості аноду. Проблема електрохімії гарячих електронів полягає в тому, що невідомий тип електроду, за допомогою якого можна отримати інтегровану на плоскій поверхні систему анод/катод з одним і тим же матеріалом електродів і досягти хороших результатів як з оксидованим силіконом або катодами з алюмінію. Проблема силікону та алюмінію полягає в тому, що чіпи з інтегрованими на плоскій поверхні катода/анода, які виконані з цих матеріалів, не можуть працювати, оскільки маркери можуть збуджуватися лише малою кількістю перших імпульсів збудження. Після цього оксидний шар на аноді, що дуже швидко формується, незабаром повністю перекриє проходження струму через комірку, а також під час формування шару оксиду виникає твердотіла електролюмінесценція високої інтенсивності (відома під назвою гальванолюмінесценція). Гальванолюмінесценція, на жаль, також містить довгоживучі складові люмінесценції, тому вимірювання електрохемілюмінесценції з розділенням у часі не можуть бути використані з хелатами лантанідів у якості маркерів. Проблему можна зменшити шляхом захисту поверхні катод/анодного чіпу з алюмінію або силікону, але виявляється неможливим знайти такий матеріал для електроду, який би забезпечив успішне використання площинних катод/анодних чіпів зі збудженням сполук-маркерів у дослідженнях біологічних властивостей. В ході створення катод/анодного чіпу, в якому анодну частину чіпу на скляній основі з електродом з алюмінію збиралися покрити вуглецевою пастою для запобігання анодному окисленню, нажаль, обидві і анодна і катодна частини були покриті вуглецевою масою. Коли чіпи були виготовлені, їх випробували у вимірюваннях, і на здивування, хелати Tb(III) дали світло з великою амплітудою електричних імпульсів. Вважаємо, що це було обумовлене електрохімією гарячих електронів, навіть при неможливості тунельної емісії в електродах з вуглецю та інших провідників. Для порівняння ми спробували збуджувати також органічні флуорофори (8-гидрокси хінолон та 7-аміно-4-метил кумарін), але жодна з речовин не дала вимірювану EXЛ з електродами з вуглецю. Таким чином, можливо, ми виявили невідоме раніше явище, пов'язане з електродами з вуглецю, яке підходить для електричного збудження хелатів тербію парою вуглецевих електродів. Фулерени, вуглецеві нанотрубки та подібні утворення в сучасних нових технологіях вуглецю були виявлені тільки недавно, і хімія вуглецю, можливо, таїть множину ще невідомих і невивчених областей. Описане вище збудження може якось бути обумовлене поверхнею електроду, що знаходиться в прямому контакті з іонами тербію, замість збудження через ліганд. Можна також припустити, що гази, які утворюються на поверхні електродів (водень і кисень, особливо в їх атомних формах), грають помітну роль в механізмах реакції. У будь-якому випадку, електрохемілюмінесценція, представлена в даному винаході, може бути ефективно використана в дослідженнях біологічних властивостей, навіть якщо механізми реакції поки що не ясні. Відповідно до корисної моделі, можна виготовляти чіпи з двома електродами (ЕЕ-чіпи) для заміни катод/анодних чіпів. У ЕЕ-чіпах не має значення, який з двох електродів на чіпі використовують як катод, а який як анод. Виготовлення електродів з вуглецевої пасти методами друкування, ймовірно, є найдешевшим з можливих технологій виробництва електродів, через що дана інновація є проривною з погляду одноразових основаних на електрохемілюмінесценції 3 UA 93083 U 5 10 15 20 25 30 35 40 45 50 55 60 діагностичних чіпів та касет. Таким чином, високо конкурентна методика електрохемілюмінесценції (порівняно з методикою, основаною на KEXЛ), може бути здійснена з використанням описаних у винаході ЕЕ-чіпів, які значно дешевше, ніж чіпи, що використовуються у KEXЛ. Пристрої, які роблять це можливим, визначені пунктами 1-7 патентної формули. Слід також відмітити, що така пара вуглецевих електродів, що описана в даній корисній моделі, може бути виготовлена безпосередньо на одній половині полімерної касети, після чого згадана половина сама по собі стає більше, ніж звичайний ЕЕ-чіп. На верхній частині цієї половини можуть відбуватися явища пневмоніки, дії з видалення, додавання і фільтрації зразків, а також додавання реагентів. Не вимагається оптичної прозорості цієї половини. А половина без вуглецевого електроду є переважно повністю оптично прозорою, але вона також може містити тільки оптично прозору частину вікна. Це вікно може також, у разі необхідності, функціонувати як оптичний фільтр при відповідному виборі матеріалу. КОРОТКИЙ ОПИС КРЕСЛЕНЬ Фіг. 1. Простий ЕЕ-чіп. Основа - скло розміром 19 мм 19 мм або пластиковий чіп (1), до верхньої частини якого приєднані електроди (2) і (3) за допомогою двосторонньої стрічки, намальованою кистю або надрукованою. Поверх висушених електродів наклеєне кільце (4), виконане з листів адгезивного пластику шляхом перфорації; кільце наклеєне на чіп за допомогою його власного адгезивного матеріалу, таким чином, утворено область комірки (5) з внутрішнім діаметром 7 мм. У комірку можна піпетувати (ввести піпеткою) 80-150 мкл зразка чи іншого розчину. Фіг. 2. Основи пластикового чіпу (а); ЕЕ-чіп, в якому вуглецеві електроди виконані на верхній частині шару з алюмінієвої чи сріблястої фарби, так, що поверхні електричних контактів електродів вільні від вуглецевої пасти (b); Стрічка із захисною плівкою знизу від перфоратору (с); Устаткування для перфорації квадратів зі стрічки та міток, що самі клеються (d); ЕЕ-чіп у вимірювальній комірці перед введенням зразка (e). Фіг. 3. Калібрувальні криві хелату Tb(III) для електродів з вуглецевої пасти, що виготовлені різним чином, (а) Електроди за Прикладом 2. (b) Електроди за Прикладом 3. (с) Електроди за Прикладом 4. (d) Електроди за Прикладом 5. Фіг. 4. Вплив персульфату на інтенсивність електрохемілюмінесценції. Фіг. 5. ПДМС-чіп, з'єднаний з ЕЕ-чіпом. (1) Основа, зазвичай виконана з полімеру, паперу, картону чи скла або будь-якої їх комбінації; (2) та (3) ідентичні вуглецеві електроди, які можуть бути різним чином покриті (по вибору); (4) ПДМС-чіп з камерою витримки та вимірювальною камерою (5) на нижній поверхні і відкрита камера через чіп для введення зразка і додавання реагенту (6), мікроканали (7), що ведуть в області інкубації, та канали відведення повітря (8). ПДМС-чіп і ЕЕ-чіп притиснуті один до одного маленькими затисками. Касети могли б також бути добре склеєні разом, але для запобігання можливому блокуванню мікроканалів використане з'єднання затисками. Замість затисків можна було б також використовувати пластикову рамку для щільного утримання всіх чіпів. Фіг. 6. Імунні дослідження на касеті, що утворена з ЕЕ-ПДМС-чіпу. Фіг.7. Дослідження гибрідізації на ЕЕ-чіпі. Фіг.8. Два одночасних імунних дослідження на ЕЕ-чіпі. ДОКЛАДНИЙ ОПИС ВИНАХОДУ Дана корисна модель показує, як просте та дешеве устаткування може бути використане для різних аналізів настільки ж ефективно, як і описані вище складні засоби, де імунні дослідження або ДНК-гибридизація виконуються на одноразовому ЕЕ-чіпі або з використанням також пористого шару поверх ЕЕ-чіпу. Завдяки цим засобам і вимірювальний прилад, і вимірювальна комірка досить дешеві для потреб децентрализованного аналізу. Дана корисна модель описує різні шляхи одержання ЕЕ-комірок поверх різних дешевих матеріалів. Ці матеріали включають, серед інших, різні види пластику, полімери, папір, папір з різними типами покриттів і картон. Матеріали, подібні цим, легко з'єднати з системами мікроаналізу або касетами, які виконують всі інші необхідні функції, потрібні для аналізу. У масовому виробництві, коли докладають зусиль для виробництва високоякісних товарів за низькими цінами, спосіб друку є дуже хорошим вибором способу виробництва. Електроди, що описані в даній корисній моделі, виключно добре підходять для виготовлення за технологією друкування, що має значні переваги в змаганні на ринку. Раніше стало відомо, що вуглецеві електроди можна використовувати як одноразові аноди в аспекті електрохемілюмінесценції рутенію [FI 981568 (А), Kulmala, S., та ін.], але одиничні вуглецеві аноди не можуть бути використані для збудження хелатів тербію. Фахівець в даній галузі не міг уявити, що шляхом заміни електроду з платини в парі електродів з вуглецю і 4 UA 93083 U 5 10 15 20 25 30 35 40 45 50 55 60 платини на електрод з вуглецю можна отримати особливу електродну систему з особливою поведінкою, принаймні, коли електроди розташовані на одному рівні і близько один від одного (поки у нас немає досвіду з іншою геометрією). Поки у нас немає повної визначеності у розумінні того, чи виникає світло, коли електроди функціонують як катоди чи аноди, або реакція є результатом комбінованого ефекту проміжних ланок при різних полярностях. З експериментальних результатів виявляється, що основна частина світу, щонайменше, утворюється у катода. Дана корисна модель є значним внеском щодо засобів, значущих для ринку децентралізованих аналізів, та робить можливим дешеве, кількісне та швидке тестування. Це досягається шляхом використання ЕЕ-комірок або в їх простій формі, з гідрофобним кільцем, що оточує область комірки, або як елемент, інтегрований в складну касету для аналізу. Предметом корисної моделі є пристрій для збудження маркерів в дослідженнях біологічних властивостей або прямо на поверхні ЕЕ-чіпів, або за допомогою пористих шарів (пористих мембран) в пристрої з ЕЕ-чіпом. Пристрій може бути використаний в експресних імунохімічних дослідженнях та ДНК-дослідженнях. Можливе також, що з часом якісь інші маркери, окрім хелатів тербію, можна буде збуджувати ЕЕ-чіпами і засобами, що описані в даній корисній моделі. Корисна модель включає пристрій, основною частиною якого є ЕЕ-чіп. Поверхня електродів в ЕЕ-чіпі відомим чином може бути покрита антитілами або ДНК і приєднані до покриття молекули-маркери можуть збуджуватися електричними імпульсами. Відповідно до корисної моделі частина електроду (або поверхня додаткового пористого шару), що контактує з частиною електроду, може бути покрита плівками Ленгмюра-Блоджетта або іншими плівками, що легко виготовляються і утворюють особливі переваги. Іноді помітних переваг можна досягти при використанні в дослідженнях біологічних властивостей пористих мембран. За допомогою пористого шару зразок однаково розподіляється в комплексі з електроду з покриттям антитілом. Пористий шар також функціонує як однорідний компенсатор потоку рідині та запобігає утворенню бульбашок в системах мікропневмоніки, температурну дифузію та поверхневі сили, а також виключає проблеми, що обумовлені такими чинниками, в комірках з мікропневмонікою мікропотоків або в комірках з мікрошарами. Плівки (пористі шари, пористі мембрани), які іноді використані у корисній моделі на поверхнях електродів, характеризуються мікропористістю й товщиною менше 100 мкм. Ці види матеріалів доступні з багатьох комерційних джерел, таких як Millipore, MSI, Sartorius, Pall, Sigma та DuPont. Мембрани можуть бути як ізотропними, так і анізотропними. Технологія виготовлення плівок може різнитися і може містити пресування або розтягування, пори можуть бути сформовані або хімічно, або фізично, в анізотропних плівках, шляхом фазового переходу. Відповідні матеріали включають ПТФЕ, полівіниліден флюорід, полікарбонат, полісульфон, нейлон та ефіри целюлози. Вони доступні з комерційних джерел, з різними розмірами пор і товщини, та різними фізико-хімічними властивостями. Волокнисті матеріали, які можуть бути використані, включають волокнисті фільтри, фільтрувальний папір, що фільтрує тканину, та ін. З виробничих причин ЕЕ-чіпи краще за все тримати сухими. Потім пристрої готують до роботи шляхом додавання рідкого зразка або буферного розчину на ЕЕ-чіпи або на пористий шар в чіпах. Так досягаються умови, що підходять для реакцій дослідження біологічних властивостей або прямо на електродах, або між мембраною та електродом. Існує велика кількість альтернативних опцій для ЕЕ-чіпів, що описує дана корисна модель. Основний вибір полягає в прямому використанні достатньо провідної вуглецевої пасти для виготовлення електродів на чіпі, який зазвичай є або пластиковим, паперовим чи скляним чіпом або смужкою, а найбільш типовим є виготовлення методами друкування. Якщо провідність вуглецевої пасти недостатня, можна виконати високо провідний шар під вуглецевою пастою з так званої сріблястої фарби або тонкий металевий шар, який потім покрити вуглецевою пастою. Таким чином, для отримання EXЛ достатньо відносно малих напруг, якщо усередині плівки провідної вуглецевої пасти, на великій відстані, не відбувається падіння потенціалу. ЕЕ-чіпи включають як складові до касет для діагностики за різними способами та з використанням найкращих властивостей різних матеріалів. Метою є підготовка зазвичай виготовлених з полімерів частин касети, наприклад, каналів і комірок, таким чином, щоб після додавання реагентів в сухому вигляді, вони б мали усі необхідні функції для діагностичних вимірювань, зазвичай одноразові касети ніколи не відкривають під час використання або після нього. Далі корисну модель ілюструють приклади та пов'язані з ними креслення і діаграми. 5 UA 93083 U 5 10 15 20 25 30 35 40 45 50 55 60 ПРИКЛАД 1. Виготовлення електродів ЕЕ-чіпу таким чином, що матеріал електроду в області комірки складається тільки з вуглецевої пасти. Пара електродів, що показана на Фіг. 1, була нанесена вуглецевою пастою (Creative Materials 110-04 Carbon Ink, Tyngsboro, MA, USA) поверх пластикового чіпу розміром 10 мм 19 мм з використанням шаблону. У середині чіпу при його виготовленні шляхом фрезерування залишили фланець висотою 0,2 мм та шириною 0,5 мм, який був використаний як резистор між електродами (Фіг. 2 (b)). Після висушування вуглецевої пасти нанесли зовнішній шар сріблястою фарбою (Bison electro G-22, Bison Inc, Netherlands), і цей сріблястий шар майже досяг області комірки (Фіг. 2). Область комірки формували, як показано на Фіг. 1, у лівого кінця електроду шляхом приєднання перфорованого шматка тефлонової стрічки (IrpolaOy, Turku, Finland) або шматка звичайної перфорованої стрічки (квадратної форми, на відміну від шматка круглої форми, що показаний на Фіг. 1, з отвором в середині шматка, який має внутрішній діаметр 7 мм або 8 мм). У цій комірці можна було збудити та виміряти з розділенням у часі обидва халати Tb(III), Тb-2,6-біс[N, N-біс(карбоксиметил)амінометил-4-бензоілфенол і Tb(III)-N1 2 3 3 4-ізотіоцианатобензил)діетилентріамін-N ,N, N, N тетраацетат. Проте значно вищу інтенсивність можна досягти з ЕЕ-чіпами за Прикладом 2, з якими відповідні хелати інших іонів лантанідів дають значно нижчі інтенсивності, ніж тербій. ПРИКЛАД 2. Виготовлення ЕЕ-чіпа зі сріблястої фарби, покритої вуглецевою пастою. Пара електродів, що показана на Фіг. 1, була нанесена сріблястою фарбою (Bison electro G22, Bison Inc, Netherlands) поверх пластикового чіпу розміром 10 мм 19 мм з використанням шаблону. В середині чіпу при його виготовленні шляхом фрезерування залишили фланець висотою 0,2 мм та шириною 0,5 мм, який був використаний у якості резистору між електродами. Після висихання сріблястої фарби протягом 5 годин поверх неї нанесли покриваючий шар вуглецевої пасти (Creative Materials 110-04 Carbon Ink, Tyngsboro, MA, USA) та залишили для висушування протягом ночі при кімнатній температурі. Область комірки сформували шляхом приєднання до лівого кінця електроду перфорованого шматка тефлонової стрічки (Irpola Oy, Turku, Finland) або шматка звичайної перфорованої стрічки, як показано на Фіг. 1. Калібрувальна крива хелату Tb (III) представлена на Фіг. 3 (а), незаштриховані кружки. Вимірювальний інструмент складався з лічильника фотонів Stanford Research SR400, кулоностатичного імпульсного генератора та електродної камери з чорного пластика з приєднаним трубчастим модулем канального фотопомножувача Perkin Elmer (напруга в імпульсі 67 В, заряд імпульсу 30мкК/імп, частота імпульсів 20 Гц). Інтенсивність EXЛ зінтегрована по 1000 імпульсів збудження, час затримки 0,05 мс, вікно вимірювання 6,0 мс). Використаний буфер 0,05 M тетраборат натрію, рН 9,2. ПРИКЛАД 3. Виготовлення ЕЕ-чіпу на папері з вуглецевої пасти. Спочатку папір для випічки (що не пропускає жиру) покрили сріблястою фарбою (Bison electro G-22, Bison Inc, Netherlands), потім поверх срібла нанесли шар вуглецевої пасти (Creative Materials 110-04 Carbon Ink, Tyngsboro, MA, USA). Для імітації шовкотрафаретного друкування при покритті використовували шаблон. Після висихання вуглецевої пасти протягом 2 годин при кімнатній температурі з паперу нарізали смужки, що підходили для використання на основах (Фіг. 2). Щоб срібло не мало прямого контакту з розчинами електролітів, край паперу у фланця на основі покривали вуглецевою пастою. Остаточно папір двосторонньою стрічкою (3M) прикріпили до пластикової основи, паперові кільця, що утворювали область комірки, прикріпили до чіпу. Калібрувальна крива хелату Tb(III) представлена на Фіг. 3 (b), заштриховані кружки. Параметри вимірювань ті ж, що в Прикладі 2. ПРИКЛАД 4. Виготовлення ЕЕ-чіпу з покритих вуглецевою пастою смужок металевої фольги. Спочатку виготовили пару електродів шляхом приклеювання смужок алюмінієвої фольги поверх пластикового чіпу розміром 10 мм 19 мм. У середині чіпу при його виготовленні шляхом фрезерування залишили фланець висотою 0,2 мм (або 0,3 мм, або 0,4 мм) та шириною 0,5 мм, який був використаний як резистор між електродами (Фіг. 1). Смужки алюмінієвої фольги покрили вуглецевою пастою (Creative Materials 110-04 Carbon Ink, Tyngsboro, MA, USA), так що з правого краю контактні області підпружинених штифтів (які під'єднують чіп до імпульсного генератора пристрою) залишалися непокритими. Область комірки формували у лівого кінця електроду приєднанням або перфорованого шматка тефлонової стрічки (Irpola Oy, Turku, Finland) або шматка звичайної перфорованої стрічки як показано на Фіг. 1. Калібрувальна крива хелату Tb(III) представлена на Фіг. 3 с), заштриховані квадрати. Подібні електроди можуть бути виготовлені також з використанням на першому етапі алюмінієвих пластин, одержаних шляхом осадження пари, як в прикладі 8. Параметри вимірювань ті ж самі, що у Прикладі 2. 6 UA 93083 U 5 10 15 20 25 30 35 ПРИКЛАД 5. Виготовлення ЕЕ-чіпу з комерційно доступних металевих наклейок (стікерів), покритих вуглецевою пастою. Спочатку виготовили пару електродів шляхом приклеювання стікерів з мідної фольги (Screen House, Turku, Finland) їх власним адгезивним шаром поверх пластикового чіпу розміром 10 мм 19 мм. У середині чіпу при його виготовленні шляхом фрезерування залишили фланець висотою 0,3 мм та шириною 0,5 мм, який у подальшому був використаний як резистор між електродами (Фіг. 1). Смужки мідної фольги покрили вуглецевою пастою (Creative Materials 11004 Carbon Ink, Tyngsboro, MA, USA), так що контактні області підпружинених штифтів до імпульсного генератора у правого краю смужки залишилися непокритими. Область комірки формували у лівого кінця електроду приєднанням або перфорованого шматка тефлонової стрічки (Irpola Oy, Turku, Finland) або шматка звичайної перфорованої стрічки як показано на Фіг. 1. Калібрувальна крива хелату Tb(III) представлена на Фіг. 3 (d), незаштриховані кружки. Подібні електроди можуть бути виготовлені також з використанням на першому етапі алюмінієвих пластин, одержаних шляхом осадження пари, як в Прикладі 8. Параметри вимірювань ті ж самі, що у Прикладі 2. ПРИКЛАД 6. Вплив персульфату на інтенсивність ЕХЛ. Спочатку виготовили достатню кількість ЕЕ-чіпів за методикою Прикладу 2. При вивченні впливу різних домішок на електрохемілюмінесценцію відмічено, що додавання персульфату збільшує електрохемілюмінесценцію. Це означає, з великою вірогідністю, що персульфат в ході реакції розпадався з утворенням радикалу сірчаної кислоти. Відомо, що радикали сірчаної кислоти приводять до хемілюмінесценції іонів і хелатів Tb(III) у водному розчині [Kulmala S. та ін., Anal. Chim. Acta 294 (1994) 13-25]. При подальшому вивченні впливу концентрації персульфату калію на інтенсивність сигналу відмічено, що збільшення концентрації персульфату призводило до помітного посилення -6 інтенсивності EXЛ хелату Tb(III) (1 10 M Tb-2,6-біс[N,N-біс(карбоксиметил)амінометил-4бензоілфенол) у межах всього дослідженого діапазону концентрацій (Фіг. 4). Можливо, що збільшення інтенсивності має місце аж до найбільших кількостей розчиненого персульфату калію (близько 50 мМ), а з персульфатом натрію можна досягти навіть вищих концентрацій. Параметри вимірювань ті ж самі, що в Прикладі 2. ПРИКЛАД 7. Вплив кислотної та базової обробок. При вивченні стабільності електродів в умовах дії кислот та в базових умовах виявлено, що робота електродів під час повторного використання поліпшувалася. Внаслідок цього провели порівняння, в якому ЕЕ-чіпи, виготовлені за методикою, що описана у Прикладі 2, витримували протягом 15 хвилин в одномолярному розчині їдкого натру (1M NaOH), одномолярному розчині сірчаної кислоти (1M H2SO4) або одномолярному розчині соляної кислоти (1M HCl). Після витримки електроди промили дистильованою водою та провели вимірювання з використанням 1 мкМ хелату Тb-2,6-біс[N,N-біс(карбоксиметил) амінометил-4-бензоілфенол. Параметри вимірювань такі самі, що в Прикладі 2. Результати наведені нижче в таблиці, і кислотна обробка, і базова обробка помітно збільшили ефективність електродів. 40 Таблиця 1 мкМ хелату Tb(III) Вимірювання Повторне вимірювання 45 50 Без обробки 337532 317307 Інтенсивність EXЛ/фотони Обробка 1 M Обробка 1 M NaOH H2SO4 956184 697300 921739 615300 Обробка 1 M HCl 538215 481643 ПРИКЛАД 8. Виготовлення ЕЕ-ПДМС-чіпу для іммунноферментних досліджень. ПДМС-чіп виготовлений відливанням з силіконового еластомеру Sylgard 184 (основа та отверждаючий агент змішані в співвідношенні 10 : 1) у формі для відливання в чашці Петрі. Вологий ПДМС дегазували у вакуумі та витримували протягом 2 годин при температурі 50C. Стверджений ПДМС видалили з форми, розрізали на окремі чіпи. ПДМС-чіпи мали камеру для зразка і подачі реагентів у лівого краю (частина 6 на Фіг. 5), в якій реагенти, що необхідні для аналізу біологічних властивостей, висушували перед аналізом. Камеру введення зразка за допомогою мікроканалів (частина 7 на Фіг. 5) приєднали до об'єднаної камери інкубації та вимірювання (частина 5 на Фіг. 5). Завдяки капілярним силам і гідростатичному тиску рідина переміщалася в камеру інкубації/вимірювання, тоді як повітря виходило з камери через мікроканали (частина 8 на Фіг. 5). Камера інкубації/вимірювання мала 7 UA 93083 U 5 10 15 20 25 30 35 40 45 50 55 мініатюрні опори для підтримки камери ПДМС-чіпу в постійному розмірі та запобігання її стискуванню. Висота камери інкубації/вимірювання складала 0,35 мм, об'єм близько 15 мкл, а загальна товщина ПДМС-чіпа складала 5 мм. Спочатку верхню поверхню скляних чіпів (19,0 мм 10,0 мм) піддали короткій плазмовій обробці. Потім на скляні чіпи у вакуумі через маску напилили шар алюмінію товщиною близько 0,3 мм; сформували обидва електроди чіпу (2 та 3 на Фіг. 1). Після цього алюмінієві електроди додатково покрили вуглецевою пастою (Creative Materials 110-04 Carbon Ink, Tyngsboro, MA, USA) таким чином, що контактні області підпружинених штифтів (до імпульсного генератора) у правого краю смужки залишилися непокритими. У якості модельної аналізованої речовини (аналіту) використовували тіреотропний гормон людини (TSH); як первинне (що захоплює) антитіло використовували -субблок, який приєднує анти-TSH (MOAB, лот: М-21310, номер за каталогом МІТ0406, концентрація 6,87 мг/мл, Medix Inc, USA); як вторинне (що маркує) антитіло був використовували -субблок специфічного антиTSH (клон 5404, лот SPC099, концентрація 5,5 мг/мл, Medix Biochemica Oy Ab, Finland). Калібрувальні стандарти для hTSH отримані шляхом розведення з концентрованого маткового розчину Уоллака (DELFIA hTSH kit, 324 мМЕ/мл TSH). Марковане вторинне антитіло (анти-hTSH, клон 5404, 5,5 мг/мл, Medix Biochemica Oy Ab) отримали шляхом реакції похідних ізотіоцианату хелату Tb (Tb-2,6-біс[N,Nбіс(карбоксиметил)амінометил-4-бензоілфенол з 80-кратним молярним надлишком халату і антитіла. Реакція йшла протягом ночі при рН 9,5. Марковане антитіло відокремили в колонці діаметром 1 см, заповненою 5,5 см Сефадекса G-50 поверх 52 см Сефарози 6В. Після висихання вуглецевої пасти електроди покрили антитілом лунці, що була утворена стрічкою в області вимірювальної комірки на ЕЕ-чіпі таким чином: 150 мкл розчину, що містив 30 мкг/мл захоплюючого антитіла (0,1 M MES, 0,2 M борату, 0,025 % бичачого гама-глобуліну рН 6,5), додали в камеру інкубації та витримали протягом 3 годин в закритих пластикових ємностях з водою, що містив азид, в нижній частині під підставками. Після покриття область комірки промили промивальним розчином (0,05 M TpicH2SO4 буфер, рН 7,75, 0,1 % бичачого Альбуміну, 0,1 % Tween 20, 0,1 % NaN3). Далі ПДМС-чіп (25 мм 14 мм, 5 мм товщиною, частина 4 на Фіг. 5) був приєднаний до ЕЕчіпу із затисками так, що чіпи притиснуті щільно один до одного. Після цього до вхідної камери зразка (частина 6, Фіг. 5) розташованій на лівому краю ПДМС-ЕЕ-касети додали 20 мл розчину 100 нг маркованого вторинного антитіла у 0,05 M Tpic-H2SO4 буфері (рН 7,75, 0,1 % бичачого альбуміну, 0,1 % Tween 20 та 0,1 % NaN3). 0,2 M буферу тетраборату натрію (рН доведений до 7,8 за допомогою H 2SO4, 0,5 % бичачого альбуміну, 0,05 % бичачого гама-глобуліну, 0,01 % Tween 20 і 0,1 % NaN3) використано як буфер для імунних досліджень і вимірювань. Спочатку 25 мкл до hTSH стандарту додали в 175 мкл імунного/вимірювального буферу. Суміш піпетували у вхідну камеру зразка (частина 6, Фіг. 5), в якій вже знаходився маркер у сухому вигляді. Зразок розчинив маркер і суміш під дією капілярних сил та гідростатичного тиску перейшла в камеру інкубування/вимірювання (частина 5, Фіг. 5) по мікроканалах (частина 7, Фіг. 5), тоді як повітря вийшло з комірки через інші мікроканали (частина 8, Фіг. 5). Через 15 хвилин витримки виміряли інтенсивність EXЛ від кожної ПДМС-ЕЕ-касети з використанням вимірювальної апаратури у складі лабораторного кулоностатичного імпульсного генератора, лічильника фотонів Stanford Research Instruments SR 400, багатоканальної схеми Nulleus MCS-II та закритого об'єму для вимірювання комірки, виконаного з чорного пластику з трубчастим модулем канального фотопомножувача Perkin Elmer (амплітуда імпульсу 45 В, заряд імпульсу 15 мкК/імп, частота імпульсів 20 Гц; інтенсивність EXЛ зінтегрована по 200 імпульсам збудження з часом затримки 0,05 мс та вікном вимірювання 6,0 мс.) Результати вимірювання показані на Фіг. 6. ПРИКЛАД 9. Дослідження гібридизації на ЕЕ-чіпах. ЕЕ-чіпи виготовили з осадженого алюмінію і вуглецевої пасти так само, як у Прикладі 6. Область комірки чіпів була утворена стрічкою таким же чином, як у Прикладі 1. Визначувана послідовність складалася з 120 фрагментів нуклеотидів, що характерно для ентеро- і риновірусів людини. Зонд 1 (TTA-GCC-GCA-TTC-AGG-GGG-CGa-AAA-AA-C6-NH2, MedProbe AB, Sweden), комплементарний до 5' кінця визначуваної послідовності, був нанесений на електроди з вуглецевої пасти. В процесі силанізації з (3-амінопропил) триетоксісиланом на електроди, покриті шаром оксиду, додали аміногрупи (APTES). До 3' кінця проби 1 додали поліаденильний хвіст, 6-вуглецевий аліфатичний вуглецевий ланцюжок і замикаючу аміногрупу. Завершальний 8 UA 93083 U 5 10 15 20 25 30 35 40 45 50 55 ковалентний зв'язок утворили за допомогою подвійного реагенту DSS (дисукцинімиділ суберат), відповідно до інструкцій виробника. Другий зонд "Зонд 2" ((NH2)4-GA-AAC-ACG-GAC-ACC-CAA-AGT-A) був маркований похідною Tb (III) (Тb-2,6-бис[N, N-бис(карбоксиметил) аминометил1]-4-бензоілфенол) шляхом витримки зонду з 80-кратним надлишком хелату в 0,5 M буфері карбонату натрію (рН 9,5) протягом ночі. Після витримки маркований зонд були очищені на колонці Сефадекса G50 (NAP-5, колонка GE Healthcare). Гібридизація була виконана наступним чином. Зразок ДНК, мультиплікований у полімеразній ланцюговій реакції RT-PCR, (20 мкл, розведення 1:50, 1:100 та 1:1000) денатурували додаванням 180 мкл NaOH (50 ммоль/л) та інкубували протягом 5 хвилин при 37 °C. Потім зразки нейтралізували додаванням 200 мкл нейтралізуючого буфера (6 SSC, 0,3 % Tween 20, 20 мМ/л лимонної кислоти). 10 мкл нейтралізованого зразка і маркованої проби 2 (0,6 нг/мкл, 50ммоль/л Тріс-HCL буферу рН7,8, 600 мМ/л NaCl, 1 % Triton 100 і 1 % блокуючого реагенту (Roche)) перенесли в нову трубку для аналізу. Після змішування 3,5 мкг суміші піпетували на мембранну частину випробовуваної смужки. Після гібридизації (протягом 5 хвилин) мембрану видалили з силіконового електроду, ЕЕ-чіп тричі промили та виміряли EXЛ. Діаграма розведень зразка показана на Фіг. 7. Параметри вимірювань такі ж як у Прикладі 8. ПРИКЛАД 10. Одночасне визначення двох імунних аналітів на одному EE-чіпі. С-реактивний білок (CRP) та тіреотропний гормон (TSH) визначали одночасно, таким чином, що один з електродів покривали антитілом, захоплюючим CRP, а другий - антитілом, захоплюючим TSH. Електроди ЕЕ-чіпу покрили захоплюючим антитілом в лунках прямокутної форми, які були виконані зі стрічки. Прямокутні отвори виконували в стрічці скальпелем з використанням шаблону. Кожна з лунок покривала більш велику область відповідного електроду, чим кругла область комірки, яка після закінчення попередньої підготовки була виконана додаванням другої стрічки з круглим отвором, як на Фіг. 1. Обидва антитіла одночасно нанесли на електрод, кожен у свою власну лунку в стрічці. АнтіTSH (анти-hTSH, МІТ0406, Medix Biotech Inc., USA) нанесли на електрод інкубацією антитіла (25 мкг/мл, 150 мкл) і витримали протягом 2 годин при кімнатній температурі у розчині, що містив 0,1 M MES, 0,03 M H3BO3,0,5 мМ цитрату калію, 0,025 % глутаральдегіду, та 0,05 % бичачого гама-глобуліну. Після витримки лунку в стрічці тричі промили промивальним розчином (50 мМ Тріс-HCL буфер рН 7,8 з 0,9 % NaCl, 0,09 % NaN3 та 0,05 % Tween 20). Після промивання покритий електрод насищали шляхом витримки насичуючого розчину (50 мМ Тріс-HCL рН 7,8 з 0,9 % NaCl, 0,05 % NaN3 та 0,1 % BSA та 6 % D-сорбітола) у лунці в стрічці протягом 30 хв. Після насичення лунку в стрічці видалили з області електроду (одночасно з одним з покриттів з анти-CRP) і сушили ЕЕ-чіп протягом 2,5 годин при 30C. Так само, анти-CRP був нанесений шляхом витримки (у лунку в стрічці на іншому електроді) антитіла (20 мкг/мл, 150 мкл) протягом 2 годин при кімнатній температурі з 50 мМ Tpic-HCL буферу (рН 7,8 з 0,05 % NaN3 та 0,9 % NaCl). Після витримки поглиблення у стрічці тричі промили промивальним розчином (50 мМ Tpic-HCL буфер рН7,8 з 0,9 % NaCl, 0,09 % NaN3 та 0,05 % Tween 20). Після промивання покритий електрод насищали шляхом витримки насичуючого розчину (50 мМ Tpic-HCL рН 7,8 з 0,05 % NaN3, 0,9 % NaCl, 0,1 % BSA та 6 % Dсорбітол і 1 мМ CaCl2) у лунці в стрічці протягом 30 хв. Після насичення лунку в стрічці видалили (одночасно з одним з етапів покриття анти-TSH) з області електроду і ЕЕ-чіп сушили протягом 2,5 годин при 30C. Марковані антитіла сушили на мембрані таким чином. Антитіло анти-hCRP (74 мкг/мл, Medix Biochemica Oy Ab анти-hCRP клон 6404), марковане хелатом Tb(III) (Тb-2,6-біс[N,Nбіс(карбоксиметил)амінометил-4-бензоілфенол), та антитіло анти-hTSH (80 мкг/мл, клон 5404, Medix Biochemica Oy Ab), марковане тим самим хелатом Tb(III), розчинили у 50 мМ Tpic-HCL буферу (рН 7,7, 0,05 % NaN3, 0,9 % NaCl, 0,5 % BSA, 0,05 % бичачого гама-глобуліну, 0,01 % Tween 20, 1 мМ CaCl2 * H2O). 0,5 мкл розчину антитіло-буфер піпетували у середину мембрани (10 мм 10 мм, Nuclepore Membrane 112110, Whatman) та сушили протягом ночі при кімнатній температурі у кімнатній атмосфері. Стандартні зразки hCRP, що необхідні в імунному дослідженні (зміст CRP 1, 10 та 100 нг/мл) були приготовані в тестових трубках шляхом розбавлення стандартного розчину CRP (Scripps, кат. № C0124) 50 мМ Tpic-HCL буфером (рН 7,7, 0,05 % NaN3, 0,9 % NaCl, 0,5 % BSA, 1 мМ CaCl2 * H2O). Аналогічним чином стандартні зразки TSH (1, 10 та 100 мМЕ/мл) були приготовані розбавленням стандарту TSH (324 мМЕ/мл, Wallac, DELFIA hTSH kit) буфером 50 мМ Tpic-HCL (рН 7,7, 0,05 % NaN3, 0,9 % NaCl). 9 UA 93083 U 5 10 15 Імунний аналіз виконували так, що спочатку і ЕЕ-чіп, і пориста мембрана були сухими. Мембрану приклали точно на верхню частину області комірки EE-чіпу, утворену лункою у стрічці, та закріпили на місці стрічкою з іншого кінця. Почали імунний аналіз з додавання 3,5 мкл обох стандартів аналітів у середину пористої мембрани (CRP 0 нг/мл та TSH 0 мМЕ/мл; CRP 1 нг/мл та TSH 1 мМЕ/мл; CRP 10 нг/мл та TSH 10 мМЕ/мл; CRP 100 нг/мл та TSH 100 мМЕ/мл). Після витримки протягом 10 хвилин при кімнатній температурі мембрану видалили, область комірки ЕЕ-чіпу промили промивальним буфером та додали 80 мкл вимірювального буферу -4 (0,05 M Na2B4O7 та 2 10 M K2S2O9). Обидва аналіта були виміряні таким чином, що перші 10 циклів збудження були виміряні, коли анти-TSH електрод працював як катод, потім змінювали полярність на інших 10 циклів, коли анти-CRP електрод працював як катод. Вимірювання повторили 5 разів і підсумували сигнали від обох електродів. По результатах було встановлено, що світло первинно виникає на катоді, оскільки відгук TSH був отриманий від лівого електроду, і таке подвійне дослідження працюватиме, хоча не завжди має сенс вимірювати в одному зразку ці особливі склади, TSH і CRP. Результати вимірювання представлені на Фіг. 8, параметри ті самі, що у Прикладі 8. ФОРМУЛА КОРИСНОЇ МОДЕЛІ 20 25 30 35 40 1. Пристрій для електричного збудження хелатів лантанідів у розчинах електролітів, виконаний у вигляді електрохімічної комірки, яка містить чип з двома електродами з функцією катода і анода, який відрізняється тим, що як хелати лантанідів вибрані хелати тербію Тb(ІІІ), а електроди виконані на резистивному або ізолюючому матеріалі з можливістю збудження хелатів тербію Тb(ІІІ) імпульсами напруги різної полярності. 2. Пристрій за п. 1, який відрізняється тим, що електроди виконані з вуглецевої пасти з 2 питомим опором, переважно, нижче 50 Ом/см за технологіями друкування, розпилення або нанесення малюнка. 3. Пристрій за п. 1 або 2, який відрізняється тим, що електроди з вуглецевої пасти виконані на поверхні другого провідника, в тому числі, на поверхні металевої плівки, провідних фарб або провідного полімеру. 4. Пристрій за п. 1, який відрізняється тим, що електроди виконані на резистивному або ізолюючому матеріалі за технологіями друкування, розпилення або нанесення малюнка сріблястою фарбою, з подальшим висушуванням та покриттям вуглецевою пастою та одночасним формуванням катода і анода як верхнього шару вуглецевої пасти з питомим 2 опором, переважно, менше 1000 Ом/см . 5. Пристрій за п. 1, який відрізняється тим, що електроди виконані у вигляді двох елементів з металу або фольги, що розділені тонким шаром резистивного або ізолюючого матеріалу товщиною 0,01-5 мм, елементи з металу мають покриття з вуглецевої пасти з питомим опором, 2 переважно, менше 1000 Ом/см , що одночасно формує катод і частину анода та виконане за технологіями друкування, розпилення або нанесення малюнка. 6. Пристрій за п. 1, який відрізняється тим, що поверхня електродів оброблена хімічними речовинами, які містять, переважно, гідрооксиди лужних металів і гідрооксиди лужних рідкоземельних металів. 7. Пристрій за п. 1, який відрізняється тим, що поверхня електродів оброблена кислотою з групи, що включає сірчисту кислоту, хлористоводневу кислоту, фосфорну і оцтову кислоти. 10 UA 93083 U 11 UA 93083 U 12 UA 93083 U Комп’ютерна верстка В. Мацело Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 13
ДивитисяДодаткова інформація
Автори англійськоюKulmala, Sakari, Laaksonen, Teppo, Tapani, Korpela, Timo, Kalevi, Eskola, Jarkko, Uolevi, Suomi, Johanna, Haakonsson, Markus
Автори російськоюКулмала Сакари, Лааксонен Теппо Тапани, Корпела Тимо Калеви, Эскола Яркко Уолеви, Суоми Йохання, Хааконссон Маркус
МПК / Мітки
МПК: G01N 21/66, C01F 17/00, C09K 11/06, G01N 21/76
Мітки: електричного, електродний, вуглецевий, чіп, інтегрований, збудження, хелатів, лантанідів
Код посилання
<a href="https://ua.patents.su/15-93083-integrovanijj-vuglecevijj-elektrodnijj-chip-dlya-elektrichnogo-zbudzhennya-khelativ-lantanidiv.html" target="_blank" rel="follow" title="База патентів України">Інтегрований вуглецевий електродний чип для електричного збудження хелатів лантанідів</a>
Попередній патент: Точний та малобюджетний інтегрований електродний чип для цільового аналізу
Наступний патент: Малобюджетний електродний чип
Випадковий патент: Вітроустановка