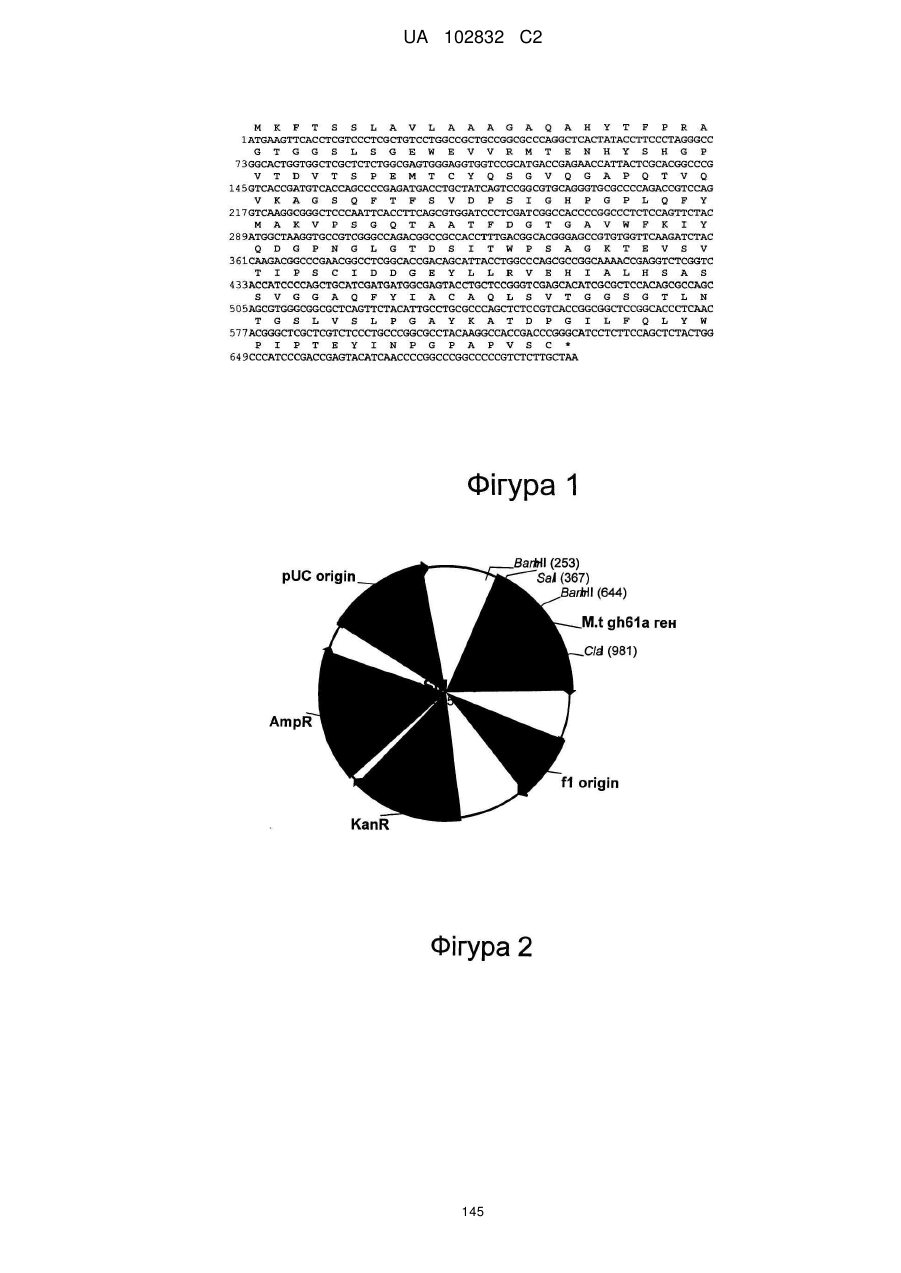
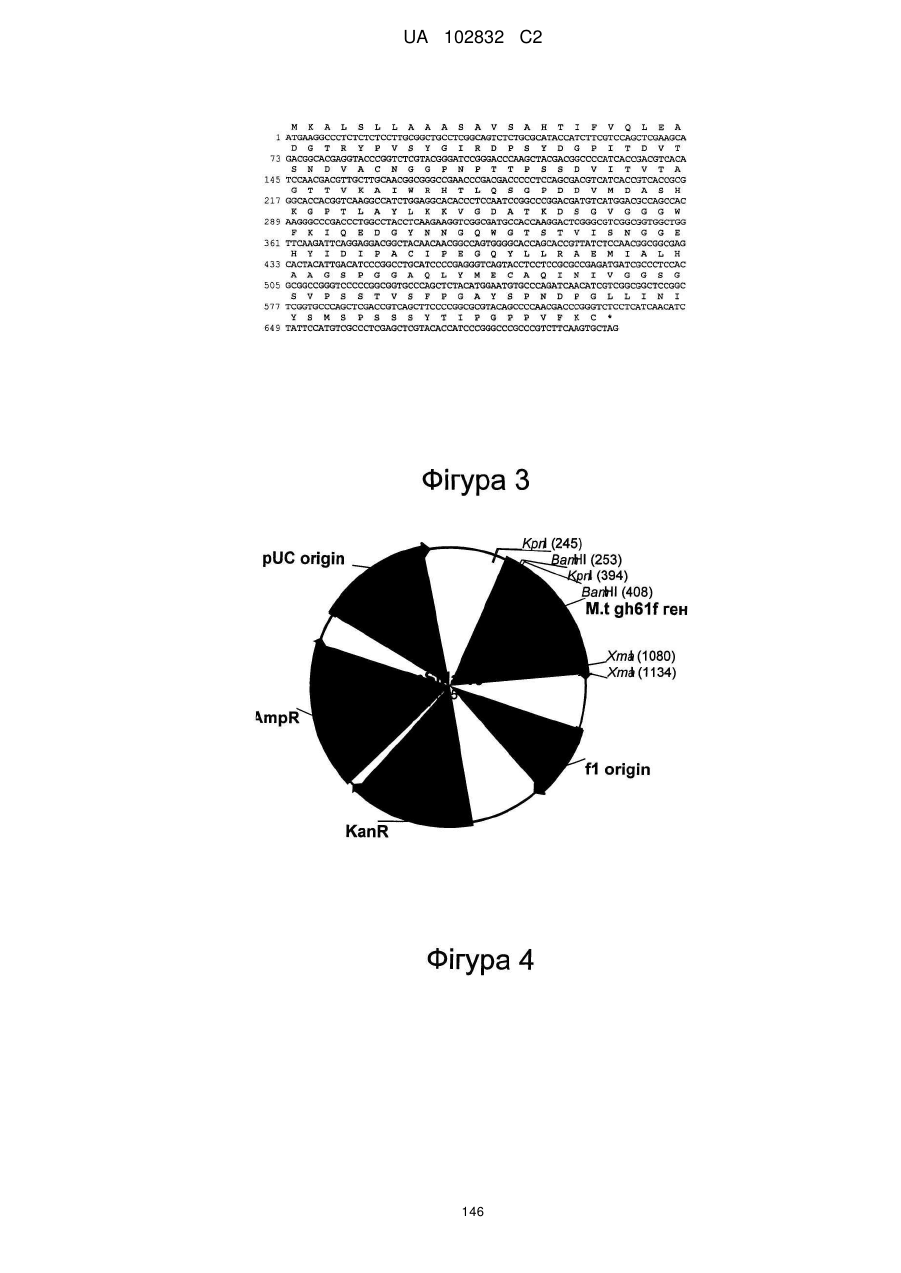
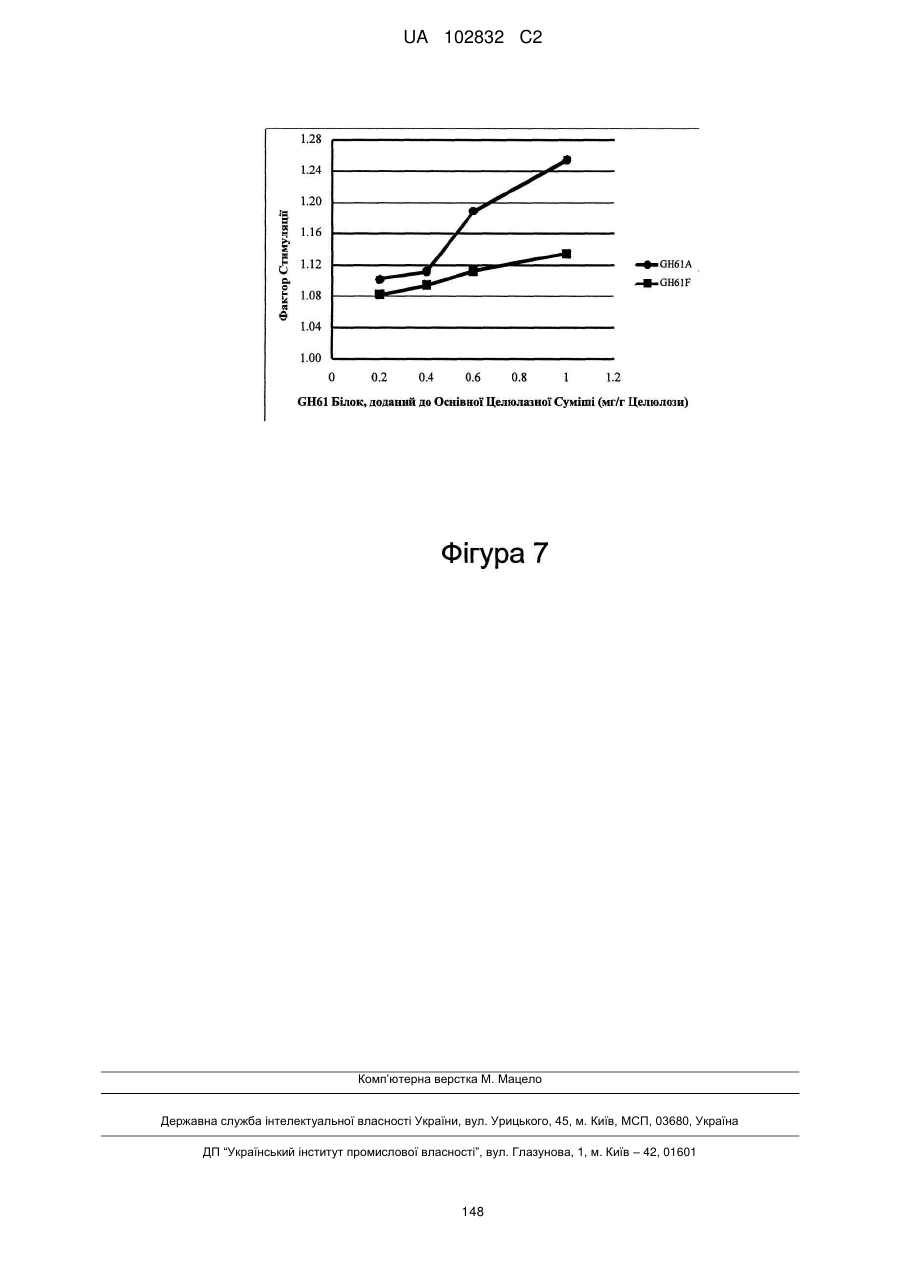
Поліпептид з целюлолітичною підсилюючою активністю та полінуклеотид, що його кодує
Формула / Реферат
1. Ізольований поліпептид з целюлолітичною підсилюючою активністю, вибраний з групи, що включає:
(a) поліпептид, що містить зрілий поліпептид SEQ ID NO: 2 або зрілий поліпептид SEQ ID NO: 4;
(b) поліпептид, кодований полінуклеотидом, що містить зрілий поліпептид, SEQ ID NO: 1.
2. Поліпептид по п. 1, що містить або включає амінокислотну послідовність SEQ ID NO:2 або SEQ ID NO: 4, або її фрагмент з целюлолітичною підсилюючою активністю.
3. Ізольований полінуклеотид, що містить нуклеотидну послідовність, яка кодує поліпептид по будь-якому з пп. 1-2.
4. Нуклеїновокислотний конструкт, що містить полінуклеотид по п. 3, функціонально зв'язаний з однією або більше контрольними послідовностями, які направляють продукування поліпептиду в клітині-хазяїні, де відбувається експресія.
5. Рекомбінантна клітина-хазяїн, що містить нуклеїновокислотний конструкт по п. 4.
6. Спосіб продукування поліпептиду по будь-якому з пп. 1-2, при якому: (а) культивують клітину, яка в своїй формі дикого типу продукує поліпептид, при умовах, сприятливих для продукування поліпептиду; і (b) відновлюють поліпептид,
7. Спосіб продукування поліпептиду по будь-якому з пп. 1-2, при якому: (а) культивують клітину-хазяїн, яка містить нуклеїновокислотний конструкт, що включає нуклеотидну послідовність, яка кодує поліпептид, при умовах, сприятливих для продукування поліпептиду; і (b) відновлюють поліпептид.
8. Спосіб продукування мутанта батьківської клітини, при якому руйнують або видаляють нуклеотидну послідовність, що кодує поліпептид по будь-якому з пп. 1-2, що приводить до мутантного продукування меншої кількості поліпептиду, ніж в батьківській клітині.
9. Спосіб продукування поліпептиду по будь-якому з пп. 1-2, при якому: (а) культивують трансгенну рослину аборослинну клітину, що містить полінуклеотид, що кодує поліпептид, при умовах, сприятливих для продукування поліпептиду; і (b) відновлюють поліпептид.
10. Трансгенна рослина, частина рослини або рослинна клітина, перетворенa з полінуклеотидом, що кодує поліпептид по будь-якому з пп. 1-2.
11. Молекула дволанцюгової інгібіторної РНК, що містить підпослідовність полінуклеотиду по п. 3, де факультативно дволанцюгова інгібіторна РНК являє собою молекулу невеликої інтерферуючої РНК або мікро-РНК.
12. Спосіб інгібування експресії поліпептиду з целюлолітичною підсилюючою активністю в клітині, при якому вводять в клітину або експресують в клітині молекулу дволанцюгової РНК, де дволанцюгова інгібіторна РНК містить підпослідовність полінуклеотиду по п. 3.
13. Спосіб розкладання або перетворення целюлозного матеріалу, при якому: обробляють целюлозний матеріал целюлолітичною ферментною композицією в присутності поліпептиду з целюлолітичною підсилюючою активністю по будь-якому з пп. 1-2, де присутність поліпептиду з целюлолітичною підсилюючою активністю підсилює розкладання целюлозного матеріалу в порівнянні з відсутністю поліпептиду з целюлолітичною підсилюючою активністю.
14. Спосіб пo п. 13, при якому додатково відновлюють розкладений целюлозний матеріал.
15. Спосіб продукування продукту ферментації, при якому:
a) перетворюють на цукор целюлозний матеріал з целюлолітичною ферментною композицією в присутності поліпептиду з целюлолітичною підсилюючою активністю по будь-якому з пп. 1-2, де присутність поліпептиду з целюлолітичною підсилюючою активністю підсилює розкладання целюлозного матеріалу в порівнянні з відсутністю поліпептиду з целюлолітичною підсилюючою активністю;
b) ферментують перетворений на цукор целюлозний матеріал етапу (а) з одним або більше мікроорганізмами, що ферментують, для продукування продукту ферментації; і
c) відновлюють продукт ферментації після проведення ферментації.
16. Спосіб ферментування целюлозного матеріалу, при якому: ферментують целюлозний матеріал з одним або більше мікроорганізмами, що ферментують, де целюлозний матеріал гідролізується з целюлолітичною ферментною композицією в присутності поліпептиду з целюлолітичною підсилюючою активністю по будь-якому з пп. 1-2, і присутність поліпептиду з целюлолітичною підсилюючою активністю підвищує гідроліз целюлозного матеріалу в порівнянні з відсутністю поліпептиду з целюлолітичною підсилюючою активністю.
Текст
Реферат: Винахід належить до ізольованих поліпептидів з целюлолітичною підсилюючою активністю та ізольованих полінуклеотидів, що кодують ці поліпептиди, а також до нуклеїновокислотних конструктів, векторів і клітини-хазяїна, що містять полінуклеотиди, та до способів продукування цих поліпептидів. UA 102832 C2 5 10 15 20 25 30 35 40 45 50 55 60 Посилання на перелік послідовностей Дана заявка містить перелік послідовностей в формі, що читається на комп'ютері. Форма, що читається на комп'ютері, включена в даний документ шляхом посилання. Посилання на сховище біологічного матеріалу Дана заявка включає посилання на сховище біологічного матеріалу, яке включено в даний документ посиланням. Передумови винаходу Область винаходу Даний винахід відноситься до ізольованих поліпептидів з целюлолітичною підсилюючою активністю і ізольованих полінуклеотидів, що кодують поліпептиди. Даний винахід також відноситься до нуклеїновокислотних конструктів, векторів і хазяйських клітин, що містять полінуклеотиди, а також способів продукування та застосування поліпептидів. Опис відомого рівня техніки Целюлоза являє собою полімер простого цукру, де глюкоза зв'язана бета-1,4-зв'язками. Багато мікроорганізмів продукують ферменти, які гідролізують бета-зв'язані глюкани. Ці ферменти включають ендоглюканази, целобіогідролази і бета-глюкозидази. Ендоглюканази розщеплюють целюлозний полімер у випадкових положеннях, відкриваючи його для руйнування целобіогідролазами. Целобіогідролази послідовно звільняють молекули целобіози від кінців целюлозного полімеру. Целобіоза являє собою водорозчинний бета-1,4-зв'язаний димер глюкози. Бета-глюкозидази гідролізують целобіозу до глюкози. Перетворення лігноцелюлозних вихідних матеріалів на етанол має переваги легкої доступності великих кількостей вихідного матеріалу, бажаності уникання горіння або звалищ матеріалів, та чистоти паливного етанолу. Деревина, сільськогосподарські залишки, трав'яні культури і муніципальні тверді відходи розглядаються як вихідні матеріали для виготовлення етанолу. Ці матеріали містять головним чином целюлозу, геміцелюлозу і лігнін. Як тільки целюлоза перетворюється на глюкозу, глюкоза легко ферментується дріжджами на етанол. В даній галузі буде переважним поліпшення здатності перетворення целюлозних вихідних матеріалів. WO 2005/074647 розкриває ізольовані поліпептиди з целюлолітичною підсилюючою активністю і їх полінуклеотиди від Thielavia terrestris. WO 2005/074656 розкриває ізольований поліпептид з целюлолітичною підсилюючою активністю і його полінуклеотид від Thermoascus aurantiacus. WO 2007/089290 розкриває ізольований поліпептид з целюлолітичною підсилюючою активністю і його полінуклеотид від Trichoderma reesei. Даний винахід відноситься до поліпептидів з целюлолітичною підсилюючою активністю і полінуклеотидів, що кодують поліпептиди. Короткий опис даного винаходу Даний винахід відноситься до ізольованих поліпептидів з целюлолітичною підсилюючою активністю, вибраних з групи, що включає: (a) поліпептид, що містить амінокислотну послідовність зі, щонайменше, 60 % ідентичністю до зрілого поліпептиду SEQ ID NO: 2 або SEQ ID NO: 4; (b) поліпептид, кодований полінуклеотидом, що гібридизується при умовах, щонайменше, середньої жорсткості з (i) послідовністю, що кодує зрілий поліпептид, SEQ ID NO: 1 або SEQ ID NO: 3, (ii) кДНК послідовністю, що міститься в послідовності, що кодує зрілий поліпептид, SEQ ID NO: 1 або SEQ ID NO: 3, або (iii) повної довжини комплементарною ниткою (i) або (ii); (c) поліпептид, кодований полінуклеотидом, що містить нуклеотидну послідовність з, щонайменше, 60 % ідентичністю до послідовності, що кодує зрілий поліпептид, SEQ ID NO: 1 або SEQ ID NO: 3; і (d) варіант, що містить заміну, делецію і/або вставку однієї або більше (декількох) амінокислот зрілого поліпептиду SEQ ID NO: 2 або SEQ ID NO: 4. Даний винахід також відноситься до ізольованих полінуклеотидів, що кодують поліпептиди з целюлолітичною підсилюючою активністю, вибраних з групи, що включає: (a) полінуклеотид, що кодує поліпептид, який містить амінокислотну послідовність зі, щонайменше, 60 % ідентичністю до зрілого поліпептиду SEQ ID NO: 2 або SEQ ID NO: 4; (b) полінуклеотид, що гібридизується при умовах, щонайменше, середньої жорсткості з (i) послідовністю, що кодує зрілий поліпептид, SEQ ID NO: 1 або SEQ ID NO: 3, (ii) кДНК послідовністю, що міститься в послідовності, що кодує зрілий поліпептид, SEQ ID NO: 1 або SEQ ID NO: 3, або (iii) повної довжини комплементарною ниткою (i) або (ii); (c) полінуклеотид, що містить нуклеотидну послідовність зі, щонайменше, 60 % ідентичністю до послідовності, що кодує зрілий поліпептид, SEQ ID NO: 1 або SEQ ID NO: 3; і 1 UA 102832 C2 5 10 15 20 25 30 35 40 45 50 55 60 (d) полінуклеотид, що кодує варіант, що містить заміну, делецію і/або вставку однієї або більше (декількох) амінокислот зрілого поліпептиду SEQ ID NO: 2 або SEQ ID NO: 4. Даний винахід також відноситься до нуклеїновокислотних конструктів, рекомбінантних векторів експресії, рекомбінантних хазяйських клітин, що містять полінуклеотиди, і способів продукування поліпептиду з целюлолітичною підсилюючою активністю. Даний винахід також відноситься до способів інгібування експресії поліпептиду з целюлолітичною підсилюючою активністю в клітині, при яких вводять в клітину або експресують в клітині молекулу дволанцюгової РНК (длРНК), де длРНК містить підпослідовність полінуклеотиду даного винаходу. Даний винахід також відноситься до такої молекули дволанцюгової інгібіторної РНК (длРНК), де факультативно длРНК являє собою молекулу ніРНК або міРНК. Даний винахід також відноситься до способів розкладання або перетворення целюлозного матеріалу, при яких: обробляють целюлозний матеріал целюлолітичною ферментною композицією в присутності такого поліпептиду з целюлолітичною підсилюючою активністю, де присутність поліпептиду з целюлолітичною підсилюючою активністю посилює руйнування целюлозного матеріалу в порівнянні з відсутністю поліпептиду з целюлолітичною підсилюючою активністю. Даний винахід також відноситься до способів продукування продукту ферментації, при яких: (a) перетворюють на цукор целюлозний матеріал з целюлолітичною ферментною композицією в присутності поліпептиду з целюлолітичною підсилюючою активністю, де присутність поліпептиду з целюлолітичною підсилюючою активністю підвищує розкладання целюлозного матеріалу в порівнянні з відсутністю поліпептиду з целюлолітичною підсилюючою активністю; (b) ферментують перетворений на цукор целюлозний матеріал етапу (a) з одним або більше мікроорганізмами, що ферментують, для продукування продукту ферментації; і (c) відновлюють продукт ферментації з ферментації. Даний винахід також відноситься до способів ферментування целюлозного матеріалу, при яких: ферментують целюлозний матеріал з одним або більше мікроорганізмами, що ферментують, де целюлозний матеріал гідролізують з целюлолітичною ферментною композицією в присутності поліпептиду з целюлолітичною підсилюючою активністю даного винаходу, і присутність поліпептиду з целюлолітичною підсилюючою активністю підвищує гідроліз целюлозного матеріалу в порівнянні з відсутністю поліпептиду з целюлолітичною підсилюючою активністю. Даний винахід також відноситься до рослин, що містять ізольований полінуклеотид, що кодує поліпептид з целюлолітичною підсилюючою активністю. Даний винахід також відноситься до способів продукування поліпептиду з целюлолітичною підсилюючою активністю, при яких: (a) культивують трансгенну рослину або рослинну клітину, що містить полінуклеотид, що кодує поліпептид з целюлолітичною підсилюючою активністю, при умовах, сприятливих для продукування поліпептиду; і (b) відновлюють поліпептид. Даний винахід додатково відноситься до нуклеїновокислотних конструктів, що містять ген, що кодує білок, де ген є функціонально зв'язаним з нуклеотидною послідовністю, що кодує сигнальний пептид, що містить або включає амінокислоти 1-17 SEQ ID NO: 2 або амінокислоти 1-15 SEQ ID NO: 4, де ген є чужорідним до нуклеотидної послідовності. Короткий опис графічних матеріалів Фігура 1 показує геномну ДНК послідовність і виведену амінокислотну послідовність Myceliophthora thermophila CBS 202.75 GH61 поліпептиду з целюлолітичною підсилюючою активністю (SEQ ID NOs: 1 і 2, відповідно). Фігура 2 показує рестриктазну карту pSMai190. Фігура 3 показує геномну ДНК послідовність і виведену амінокислотну послідовність Myceliophthora thermophila CBS 202.75 GH61F поліпептиду з целюлолітичною підсилюючою активністю (SEQ ID NOs: 3 і 4, відповідно). Фігура 4 показує рестриктазну карту pSMai192. Фігура 5 показує рестриктазну карту pSMai185. Фігура 6 показує рестриктазну карту pSMai198. Фігура 7 показує дію Myceliophthora thermophila GH61A і GH61F поліпептидів з целюлолітичною підсилюючою активністю на ферментний гідроліз попередньо обробленої кукурудзяної соломи. Визначення Целюлолітична підсилююча активність: Вираз "целюлолітична підсилююча активність" визначається в даному документі як біологічна активність, що підсилює гідроліз целюлозного матеріалу білками з целюлолітичною активністю. Для цілей даного винаходу целюлолітичну 2 UA 102832 C2 5 10 15 20 25 30 35 40 45 50 55 60 підсилюючу активність визначають вимірюванням підвищення у відновлених цукрах або в підвищенні загальної кількості целобіози та глюкози з гідролізу целюлозного матеріалу целюлазним білком при наступних умовах: 1-50 мг загального білка/г целюлози в PCS, де загальний білок містить 80-99,5 % вага/вага целюлазного білка/г целюлози в PCS і 0,5-20 % вага/вага білка целюлолітичної підсилюючої активності протягом 1-7 днів при 50 °C в порівнянні з контрольним гідролізом з рівним завантаженням загального білка без целюлолітичної підсилюючої активності (1-50 мг целюлолітичного білка/г целюлози в PCS). В переважному аспекті суміш CELLUCLAST 1,5 л (Novozymes A/S, Bagsvaerd, Данія) в присутності 3 % від загальної ваги білка Aspergillus oryzae бета-глюкозидази (рекомбінантно продукованої в Aspergillus oryzae відповідно до WO 02/095014) або 3 % від загальної ваги білка Aspergillus fumigatus бета-глюкозидази (рекомбінантно продукованої в Aspergillus oryzae відповідно до Прикладу 22 WO 02/095014) завантаження целюлазного білка використовують в якості джерела целюлолітичної активності. Поліпептиди з целюлолітичною підсилюючою активністю мають, щонайменше, 20 %, переважно, щонайменше, 40 %, більш переважно, щонайменше, 50 %, більш переважно, щонайменше, 60 %, більш переважно, щонайменше, 70 %, більш переважно, щонайменше, 80 %, ще більш переважно, щонайменше, 90 %, найбільш переважно, щонайменше, 95 %, і навіть найбільш переважно, щонайменше, 100 % целюлолітичної підсилюючої активності зрілого поліпептиду SEQ ID NO: 2 або SEQ ID NO: 4. Поліпептиді з целюлолітичною підсилюючою активністю підсилюють гідроліз целюлозного матеріалу, каталізованого білками з целюлолітичною активністю, за допомогою зниження кількості целюлолітичного ферменту, необхідного для досягнення такого ж ступеню гідролізу, переважно, щонайменше, 0,1-кратно, більш, щонайменше, 0,2-кратно, більш переважно, щонайменше, 0,3-кратно, більш переважно, щонайменше, 0,4-кратно, більш переважно, щонайменше, 0,5-кратно, більш переважно, щонайменше, 1-кратно, більш переважно, щонайменше, 3-кратно, більш переважно, щонайменше, 4-кратно, більш переважно, щонайменше, 5-кратно, більш переважно, щонайменше, 10-кратно, більш переважно, щонайменше, 20-кратно, навіть більш переважно, щонайменше, 30-кратно, найбільш переважно, щонайменше, 50-кратно, і навіть найбільш переважно, щонайменше, 100-кратно. Целюлолітична активність: Вираз "целюлолітична активність" визначається в даному документі як біологічна активність, яка гідролізує целюлозний матеріал. Целюлолітичний білок може гідролізувати або гідролізує карбоксиметилцелюлозу (CMC), тим самим знижуючи в'язкість суміші інкубації. Результуюче зниження у в'язкості можна визначити вібраційним віскозиметром (наприклад, MIVI 3000 від Sofraser, Франція). Визначення целюлазної активності, виміряне в обчисленні Одиниці Целюлазної В'язкості (CEVU), визначає кількість каталітичної активності, присутньої в зразку, за допомогою вимірювання здатності зразка знижувати в'язкість розчину карбоксиметилцелюлози (CMC). Випробування здійснюють при температурі і pH, придатних для целюлолітичного білка і субстрату. Для CELLUCLAST (Novozymes A/S, Bagsvaerd, Данія) випробування проводять при 40 °C в 0,1 M фосфатному буфері pH 9,0 протягом 30 хвилин з CMC в якості субстрату (33,3 г/л карбоксиметилцелюлози Hercules 7 LFD) і концентрації ферменту приблизно 3,3-4,2 CEVU/мл. CEVU активність обчислюють по відношенню до визнаного ферментного стандарту, такого як CELLUZYME™ Стандарт 17-1194 (отриманий від Novozymes A/S, Bagsvaerd, Данія). Для цілей даного винаходу целюлолітичну активність визначають вимірюванням підвищення в гідролізі целюлозного матеріалу за допомогою целюлолітичної суміші при наступних умовах: 1-10 мг целюлолітичного білка/г целюлози в PCS протягом 5-7 днів при 50ºC в порівнянні з контрольним гідролізом без додавання целюлолітичного білка. Ендоглюканаза: Вираз "ендоглюканаза" визначається в даному документі як ендо-1,4(1,3;1,4)-бета-D-глюкан 4-глюканoгідролаза (E.C. № 3.2.1.4), яка каталізує ендогідроліз 1,4-бетаD-глікозидних зв'язків в целюлозі, целюлозних похідних (таких як карбоксиметилцелюлоза і гидроксіетилцелюлоза), ліхеніні, бета-1,4 зв'язки в змішаних бета-1,3 глюканах, таких як зернові бета-D-глюкани або ксилоглюкани, та іншому рослинному матеріалі, що містить целюлозні компоненти. Для цілей даного винаходу ендоглюканазну активність визначають з використанням карбоксиметилцелюлозного (CMC) гідролізу відповідно до методики Ghose, 1987, Pure і Appl. Chem. 59: 257-268. Целобіогідролаза: Вираз "целобіогідролаза" визначається в даному документі як 1,4-бета-Dглюкан целобіогідролаза (E.C. 3.2.1.91), яка каталізує гідроліз 1,4-бета-D-глюкозидних зв'язків в целюлозі, целоолігосахаридах або в будь-якій бета-1,4-зв'язаній глюкозі, що містить полімер, який вивільняє целобіозу від відновлюючих або невідновлюючих кінців ланцюга. Для цілей даного винаходу целобіогідролазну активність визначають відповідно до методик, описаних 3 UA 102832 C2 5 10 15 20 25 30 35 40 45 50 55 60 Lever та ін., 1972, Anal. Biochem. 47: 273-279 та van Tilbeurgh та ін., 1982, FEBS Letters 149: 152156; van Tilbeurgh і Claeyssens, 1985, FEBS Letters 187: 283-288. В даному винаході застосували спосіб Lever та ін., щоб оцінити гідроліз целюлози в кукурудзяній соломі, в той час як спосіб van Tilbeurgh та ін. використали, щоб визначити целобіогідролазну активність на флуоресцентних дисахаридних похідних. Бета-глюкозидаза: Вираз "бета-глюкозидаза" визначається в даному документі як бета-Dглюкозидна глюкогідролаза (E.C. 3.2.1.21), яка каталізує гідроліз термінальних невідновлюючих бета-D-глюкозних залишків зі вивільненням бета-D-глюкози. Для цілей даного винаходу бетаглюкозидазну активність визначають відповідно до основних методик, описаних Venturi та ін., 2002, J. Basic Microbiol. 42: 55-66, окрім того, що застосували інші умови, як описано в даному документі. Одну одиницю бета-глюкозидазної активності визначають як 1,0 мкмоль pнітрофенолу, що продукується за хвилину при 50 °C, pH 5 з 4 мМ p-нітрофеніл-бета-Dглікопіранозиду в якості субстрату в 100 мМ цитраті натрію, 0,01 % TWEEN® 20. Глікозидгідролаза сімейства 61: Вираз "глікозидгідролаза сімейства 61" або "сімейство GH61" визначається в даному документі як поліпептид, що відноситься до глікозидгідролазного сімейства 61 відповідно до Henrissat B., 1991, A classification of glycosyl hydrolases based on amino-acid sequence similarities, Biochem. J. 280: 309-316, і Henrissat B., і Bairoch A., 1996. Updating the sequence-based classification of glycosyl hydrolases, Biochem. J. 316: 695-696. На даний час Henrissat відмічає сімейство GH61 як некласифіковане, показуючи, що властивості, такі як механізм, каталітичний нуклеофіл/основа, каталітичні донори протонів та 3-D структури, невідомі для поліпептидів, які належать до цього сімейства. Целюлозний матеріал: Целюлозний матеріал може являти собою будь-який матеріал, що містить целюлозу. Переважний полісахарид в первинній оболонці клітини біомаси являє собою целюлозу, другий, найбільш розповсюджений, являє собою геміцелюлозу, а третій являє собою пектин. Вторинна оболонка клітини, що продукується після того, як клітина припиняє рости, також містить полісахариди і зміцнена полімерним лігніном, ковалентно зшитим з геміцелюлозою. Целюлоза являє собою гомополімер ангідроцелобіози та, таким чином, лінійний бета-(1-4)-D-глюкан, в той час, як геміцелюлози включають різноманітність сполук, таких як ксилани, ксилоглюкани, арабіноксилани і манани, в комплексних розгалужених структурах зі спектром замісників. Хоча, звичайно поліморфна целюлоза виявляється в рослинній тканині, головним чином як нерозчинна кристалічна матриця паралельних глюканових ланцюгів. Геміцелюлози звичайно мають водневий зв'язок з целюлозою, а також з іншими геміцелюлозами, які допомагають стабілізувати матрицю оболонки клітини. Целюлоза звичайно знаходиться, наприклад, в стеблинах, листах, шкірках, лушпинні і початках рослин або листах, гілках і деревині дерев. Целюлозний матеріал може являти собою, але не обмежується, трав'янистий матеріал, сільськогосподарський залишок, залишок лісового господарства, муніципальний твердий відхід, макулатуру і м'якоть, і залишок паперової фабрики. Целюлозний матеріал може бути будь-яким типом біомаси включаючи, але не обмежуючись, деревині ресурси, муніципальний твердий відхід, паперовий відхід, зернові і зернові залишки зернові (дивись, наприклад, Wiselogel et al., 1995, у Handbook on Bioethanol (Charles E. Wyman, editor), pp.105-118, Taylor & Francis, Washington D.C.; Wyman, 1994, Bioresource Technology 50: 3-16; Lynd, 1990, Applied Biochemistry and Biotechnology 24/25: 695719; Mosier et al., 1999, Recent Progress in Bioconversion of Lignocellulosics, in Advances in Biochemical Engineering/Biotechnology, T. Scheper, managing editor, Volume 65, pp.23-40, Springer-Verlag, New York). З цього зрозуміло, що целюлоза може бути в формі лігноцелюлози, матеріалу рослинної клітинної оболонки, що містить лігнін, целюлозу і геміцелюлозу в змішаній матриці. В переважному аспекті целюлозний матеріал являє собою лігноцелюлозу. В одному аспекті целюлозний матеріал являє собою трав'янистий матеріал. В іншому аспекті целюлозний матеріал являє собою сільськогосподарський залишок. В іншому аспекті целюлозний матеріал являє собою залишок лісового господарства. В іншому аспекті целюлозний матеріал являє собою муніципальний твердий відхід. В іншому аспекті целюлозний матеріал являє собою макулатуру. В іншому аспекті целюлозний матеріал являє собою м'якоть і залишок паперової фабрики. В іншому аспекті целюлозний матеріал являє собою кукурудзяну солому. В іншому переважному аспекті целюлозний матеріал являє собою волокно кукурудзи. В іншому аспекті целюлозний матеріал являє собою качан кукурудзи. В іншому аспекті целюлозний матеріал являє собою апельсинову цедру. В іншому аспекті целюлозний матеріал являє собою рисову солому. В іншому аспекті целюлозний матеріал являє собою пшеничну солому. В іншому аспекті целюлозний матеріал являє собою просо лозиноподібне. В іншому аспекті целюлозний матеріал являє собою китайський очерет. В іншому аспекті целюлозний матеріал являє собою 4 UA 102832 C2 5 10 15 20 25 30 35 40 45 50 55 60 жом. В іншому аспекті целюлозний матеріал являє собою мікрокристалічну целюлозу. В іншому аспекті целюлозний матеріал являє собою бактеріальну целюлозу. Целюлозний матеріал може бути використаний як підданий або може бути підданим попередній обробці із застосуванням традиційних способів, відомих в даній галузі, як описано в даному документі. В переважному аспекті целюлозний матеріал попередньо обробляють. Попередньо оброблена кукурудзяна солома: Вираз "PCS" або "попередньо оброблена кукурудзяна солома" визначається в даному документі як целюлозний матеріал, що отримують з кукурудзяної соломи за допомогою обробки теплом і розведеною кислотою. Ізольований поліпептид: Вираз "ізольований поліпептид", як використовується в даному документі, посилається на поліпептид, який ізольований з, джерела. В переважному аспекті поліпептид є, щонайменше, 1 % чистим, переважно, щонайменше, 5 % чистим, більш переважно, щонайменше, 10 % чистим, більш переважно, щонайменше, 20 % чистим, більш переважно, щонайменше, 40 % чистим, більш переважно, щонайменше, 60 % чистим, навіть більш переважно, щонайменше, 80 % чистим, і найбільш переважно, щонайменше, 90 % чистим, як визначено SDS-PAGE (електрофорез в поліакриламідному гелі в присутності додецилсульфату натрію). Значно чистий поліпептид: Вираз "значно чистий поліпептид" означає в даному документі препарат поліпептиду, який містить щонайбільше 10 %, переважно щонайбільше 8 %, більш переважно щонайбільше 6 %, більш переважно щонайбільше 5 %, більш переважно щонайбільше 4 %, більш переважно щонайбільше 3 %, навіть більш переважно щонайбільше 2 %, найбільш переважно щонайбільше 1 %, і навіть найбільш переважно щонайбільше 0,5 % по вазі другого поліпептидного матеріалу, з яким він природньо або рекомбінантно асоційований. Отже переважно, що значно чистий поліпептид являється, щонайменше, 92 % чистим, переважно, щонайменше, 94 % чистим, більш переважно, щонайменше, 95 % чистим, більш переважно, щонайменше, 96 % чистим, більш переважно, щонайменше, 97 % чистим, більш переважно, щонайменше, 98 % чистим, навіть більш переважно, щонайменше, 99 % чистим, найбільш переважно, щонайменше, 99,5 % чистим, і навіть найбільш переважно 100 % чистим по вазі загального поліпептидного матеріалу, присутнього в препараті. Поліпептиди даного винаходу переважно знаходяться в значно чистій формі, тобто, препарат поліпептиду є в основному вільним від іншого поліпептидного матеріалу, з яким він природно або рекомбінантно асоційований. Це можна здійснити, наприклад, приготуванням поліпептиду добре відомими рекомбінантними способами або класичними способами очистки. Зрілий поліпептид: Вираз "зрілий поліпептид" визначається в даному документі як поліпептид в його кінцевій формі після трансляції і будь-яких після-трансляційних модифікацій, таких як N-кінцевий процесінг, C-кінцеве усікання, глікозиляція, фосфорилювання і т. д. В переважному аспекті зрілий поліпептид являє собою амінокислоти 18-232 SEQ ID NO: 2 на основі програми SignalP (Nielsen et al., 1997, Protein Engineering 10: 1-6), яка прогнозує, що амінокислоти 1-17 SEQ ID NO: 2 являють собою сигнальний пептид. В іншому переважному аспекті зрілий поліпептид являє собою амінокислоти 16-235 SEQ ID NO: 4 на основі програми SignalP, яка прогнозує, що амінокислоти 1-15 SEQ ID NO: 4 являють собою сигнальний пептид. Послідовність, що кодує зрілий поліпептид: Вираз "послідовність, що кодує зрілий поліпептид" визначається в даному документі як нуклеотидна послідовність, що кодує зрілий поліпептид з целюлолітичною підсилюючою активністю. В переважному аспекті послідовність, що кодує зрілий поліпептид, являє собою нуклеотиди 52-921 SEQ ID NO: 1 на основі програми SignalP, яка прогнозує, що нуклеотиди 1-51 SEQ ID NO: 1 кодують сигнальний пептид. В іншому переважному аспекті послідовність, що кодує зрілий поліпептид, являє собою нуклеотиди 46851 SEQ ID NO: 3 на основі програми SignalP, яка прогнозує, що нуклеотиди 1-45 SEQ ID NO: 3 кодує сигнальний пептид. Ідентичність: Спорідненість між двома амінокислотними послідовностями або між двома нуклеотидними послідовностями описують параметром "ідентичність". Для цілей даного винаходу ступінь ідентичності між двома амінокислотними послідовностями визначають за допомогою алгоритму Needleman-Wunsch (Needleman and Wunsch, 1970, J. Mol. Biol. 48: 443-453), як реалізовано в програмі Needle пакету програм EMBOSS (EMBOSS: The European Molecular Biology Open Software Suite, Rice et al., 2000, Trends in Genetics 16: 276-277), переважно версія 3.0.0 або більш пізня. Використаними факультативними параметрами є штраф за відкриття гепу 10, штраф за продовження гепу 0,5 і матриця заміни EBLOSUM62 (EMBOSS версія BLOSUM62). Результат Needle, позначений "найдовша ідентичність" (отриманий за допомогою опції –nobrief), використовується як відсоткова ідентичність і розраховується наступним чином: 5 UA 102832 C2 5 10 15 20 25 30 35 40 45 50 55 60 (ідентичні залишки x 100)/(довжина вирівнювання – загальне число гепів у вирівнюванні). Для цілей даного винаходу ступінь ідентичності між двома дезоксирибонуклеотидними послідовностями визначають за допомогою алгоритму Needleman-Wunsch (Needleman and Wunsch, 1970, supra), як реалізується в програмі Needle пакету програм EMBOSS (EMBOSS: The European Molecular Biology Open Software Suite, Rice et al., 2000, supra), переважно версія 3.0.0 або більш пізня. Використаними факультативними параметрами є штраф за відкриття гепу 10, штраф за продовження гепу 0,5 і матриця заміни EDNAFULL (EMBOSS версія NCBI NUC4.4). Результат Needle, позначений "найдовша ідентичність" (отриманий за допомогою опції –nobrief), використовується як відсоткова ідентичність і розраховується наступним чином: (ідентичні дезоксирибонуклеотиди x 100)/(довжина вирівнювання – загальне число гепів у вирівнюванні). Гомологічна послідовність: Вираз "гомологічна послідовність" визначається в даному документі як прогнозований білок, що має E значення (або показник очікування), менш ніж 0,001 в пошуку tfasty (Pearson, W.R., 1999, в Bioinformatics Methods and Protocols, S. Misener and S. A. Krawetz, ed., pp. 185-219) з Myceliophthora thermophila поліпептидом з целюлолітичною підсилюючою активністю SEQ ID NO: 2 або SEQ ID NO: 4, або його зрілим поліпептидом. Поліпептидний фрагмент: Вираз "поліпептидний фрагмент" визначають в даному документі як поліпептид, що має одну або більше (декілька) амінокислот, видалених з аміно і/або карбоксильного кінця зрілого поліпептиду SEQ ID NO: 2 або SEQ ID NO: 4; або його гомологічної послідовності; де фрагмент має целюлолітичну підсилюючу активність. В переважному аспекті фрагмент містить, щонайменше, 185 амінокислотних залишків, більш переважно, щонайменше, 195 амінокислотних залишків і найбільш переважно, щонайменше, 205 амінокислотних залишків зрілого поліпептиду SEQ ID NO: 2 або його гомологічну послідовність. В іншому переважному аспекті фрагмент містить, щонайменше, 190 амінокислотних залишків, більш переважно, щонайменше, 200 амінокислотних залишків і найбільш переважно, щонайменше, 210 амінокислотних залишків зрілого поліпептиду SEQ ID NO: 4 або його гомологічну послідовність. Підпослідовність: Вираз "підпослідовність" визначається в даному документі як нуклеотидна послідовність, що має один або більше (декілька) нуклеотидів, видалених з 5' і/або 3' кінця послідовності, що кодує зрілий поліпептид, SEQ ID NO: 1 або SEQ ID NO: 3; або його гомологічної послідовності; де підпослідовність кодує поліпептидний фрагмент з целюлолітичною підсилюючою активністю. В переважному аспекті підпослідовність містить, щонайменше, 555 нуклеотидів, більш переважно, щонайменше, 585 нуклеотидів і найбільш переважно, щонайменше, 615 нуклеотидів послідовності, що кодує зрілий поліпептид, SEQ ID NO: 1 або його гомологічну послідовність. В іншому переважному аспекті підпослідовність містить, щонайменше, 570 нуклеотидів, більш переважно, щонайменше, 600 нуклеотидів і найбільш переважно, щонайменше, 630 нуклеотидів послідовності, що кодує зрілий поліпептид, SEQ ID NO: 3 або його гомологічну послідовність. Алельний варіант: Вираз "алельний варіант" означає в даному документі будь-яку з двох або більше альтернативних форм гена, що займає той самий хромосомний локус. Алельна варіація виникає природно через мутацію і може приводити до поліморфізму в популяціях. Генні мутації можуть мовчати (без змін в кодованому поліпептиді) або можуть кодувати поліпептиди, що мають змінені амінокислотні послідовності. Алельний варіант поліпептиду являє собою поліпептид, кодований алельним варіантом гена. Ізольований полінуклеотид: Вираз "ізольований полінуклеотид", як застосовується в даному документі, посилається на полінуклеотид, що ізольований з джерела. В переважному аспекті полінуклеотид є, щонайменше, 1 % чистим, переважно, щонайменше, 5 % чистим, більш переважно, щонайменше, 10 % чистим, більш переважно, щонайменше, 20 % чистим, більш переважно, щонайменше, 40 % чистим, більш переважно, щонайменше, 60 % чистим, навіть більш переважно, щонайменше, 80 % чистим і найбільш переважно, щонайменше, 90 % чистим, як визначені агарозним електрофорезом. Значно чистий полінуклеотид: Вираз "значно чистий полінуклеотид", як застосовується в даному документі, посилається на препарат полінуклеотиду, вільний від інших сторонніх або небажаних нуклеотидів, у формі, придатній для використання в системах продукування генетично сконструйованого білка. Таким чином, значно чистий полінуклеотид містить, щонайбільше, 10 %, переважно, щонайбільше, 8 %, більш переважно, щонайбільше, 6 %, більш переважно, щонайбільше, 5 %, більш переважно, щонайбільше, 4 %, більш переважно, щонайбільше, 3 %, навіть більш переважно, щонайбільше, 2 %, найбільш переважно, щонайбільше, 1 % і навіть найбільш переважно, щонайбільше, 0,5 % по вазі іншого полінуклеотидного матеріалу, з яким він природно або рекомбінантно асоційований. Значно чистий полінуклеотид може, однак, включати 5" і 3" нетрансльовані ділянки, що зустрічаються в 6 UA 102832 C2 5 10 15 20 25 30 35 40 45 50 55 60 природі, такі як промотори і термінатори. Переважно, щоб значно чистий полінуклеотид є, щонайменше, 90 % чистим, переважно, щонайменше, 92 % чистим, більш переважно, щонайменше, 94 % чистим, більш переважно, щонайменше, 95 % чистим, більш переважно, щонайменше, 96 % чистим, більш переважно, щонайменше, 97 % чистим, навіть більш переважно, щонайменше, 98 % чистим, найбільш переважно, щонайменше, 99 % чистим і навіть найбільш переважно, щонайменше, 99,5 % чистим по вазі. Полінуклеотиди даного винаходу є переважно в значно чистій формі, тобто, препарат полінуклеотиду є в основному вільним від іншого полінуклеотидного матеріалу, з яким він природно або рекомбінантно асоційований. Полінуклеотиди можуть бути геномні, кДНК, РНК, напівсинтетичного, синтетичного походження або будь-які їх комбінації. Послідовність, що кодує: При використанні в даному документі вираз "послідовність, що кодує" означає нуклеотидну послідовність, яка безпосередньо задає амінокислотну послідовність її білкового продукту. Межі послідовності, що кодує, звичайно визначають відкритою рамкою зчитування, яка зазвичай починається з ATG ініціюючого кодону або з альтернативних ініціюючих кодонів, таких як GTG і TTG, і закінчується термінуючим кодоном, таким як TAA, TAG і TGA. Послідовність, що кодує, може бути ДНК, кДНК, синтетичною або рекомбінантною нуклеотидною послідовністю. КДНК: Вираз "кДНК" визначається в даному документі як ДНК молекула, що може бути приготовлена зворотною транскрипцією зі зрілої, сплетеної, мРНК молекули, отриманої з еукаріотичної клітини. КДНК іспитує нестачу інтронних послідовностей, які можуть бути присутніми у відповідній геномній ДНК. Вихідний, первинний РНК транскрипт являє собою попередник до мРНК, що піддається обробці через ряди етапів перед появою в якості зрілої сплетеної мРНК. Ці етапи включають видалення інтронних послідовностей способом, що називають сплайсингом. Отже, кДНК, що походить від мРНК, іспитує нестачу будь-яких інтронних послідовностей. Нуклеїновокислотний конструкт: Вираз "нуклеїновокислотний конструкт", як застосовується в даному документі, посилається на нуклеїновокислотну молекулу, або одно- або дволанцюгову, яка ізольована від гену, що зустрічається в природі, або яка модифікована для включення сегментів нуклеїнових кислот таким шляхом, щоб інша не існувала в природі, або яка синтезована. Вираз нуклеїновокислотний конструкт є синонімом виразу "касета експресії", коли нуклеїновокислотний конструкт містить контрольні послідовності, необхідні для експресії послідовності, що кодує, даного винаходу. Контрольні послідовності: Вираз "контрольні послідовності", як визначається в даному документі, включає всі компоненти, необхідні для експресії полінуклеотиду, що кодує поліпептид даного винаходу. Кожна контрольна послідовність може бути природною або чужорідною до нуклеотидної послідовності, що кодує поліпептид, або природною або чужорідною одна до одної. Такі контрольні послідовності включають, але не обмежуються, лідерну послідовність, послідовність поліаденилювання, пропептидну послідовність, промотор, послідовність сигнального пептиду і термінатор транскрипції. Як мінімум, контрольні послідовності включають промотор та транскрипційні і трансляційні стоп-сигнали. Контрольні послідовності можуть бути забезпечені з лінкерами з метою введення специфічних сайтів рестрикції, що полегшують лігування контрольних послідовностей з кодуючою ділянкою нуклеотидної послідовності, що кодує поліпептид. Функціонально зв'язаний: Вираз "функціонально зв'язаний" означає в даному документі конфігурацію, в якій контрольна послідовність розташована в придатному положенні по відношенню до кодуючої послідовності полінуклеотидної послідовності, так що контрольна послідовність направляє експресію кодуючої послідовності поліпептиду. Експресія: Вираз "експресія" включає будь-який етап, включений в продукування поліпептиду, включаючи, але без обмеження, транскрипцію, пост-транскрипційну модифікацію, трансляцію, пост-трансляційну модифікацію і секрецію. Вектор експресії: Вираз "вектор експресії" визначається в даному документі як лінійна або кільцева ДНК молекула, що включає полінуклеотид, якийо кодує поліпептид даного винаходу, і є функціонально зв'язаним з додатковими нуклеотидами, що передбачають його експресію. Хазяйська клітина: Вираз "хазяйська клітина", як застосовується в даному документі, включає будь-який тип клітини, що є сприйнятливим до перетворення, трансфекції, трансдукції і подібного з нуклеїновокислотним конструктом або вектором експресії, що містить полінуклеотид даного винаходу. Модифікація: Вираз "модифікація" означає в даному документі будь-яку хімічну модифікацію поліпептиду, що складається зі зрілого поліпептиду SEQ ID NO: 2 або SEQ ID NO: 4; або його гомологічної послідовності; а також генетичну маніпуляцію ДНК, що кодує такий поліпептид. 7 UA 102832 C2 5 10 15 20 25 30 35 40 45 50 55 60 Модифікація може являти собою заміну, делецію і/або вставку однієї або більше (декількох) амінокислот, а також заміщеня однієї або більше (декількох) амінокислотних бічних ланцюгів. Штучний варіант: При використанні в даному документі вираз "штучний варіант" означає поліпептид з целюлолітичною підсилюючою активністю, що продукується організмом, який експресує модифіковану полінуклеотидну послідовність послідовності, що кодує зрілий поліпептид, SEQ ID NO: 1 або SEQ ID NO: 3; або її гомологічну послідовність. Модифіковану нуклеотидну послідовність отримують через втручання людини за допомогою модифікації полінуклеотидної послідовності, розкритій в SEQ ID NO: 1 або SEQ ID NO: 3; або її гомологічної послідовності. Детальний опис винаходу Поліпептиди з целюлолітичною підсилюючою активністю В першому аспекті даний винахід відноситься до ізольованих поліпептидів, що містять амінокислотні послідовності, що мають ступінь ідентичності до зрілого поліпептиду SEQ ID NO: 2 або SEQ ID NO: 4 переважно, щонайменше, 60 %, більш переважно, щонайменше, 65 %, більш переважно, щонайменше, 70 %, більш переважно, щонайменше, 75 %, більш переважно, щонайменше, 80 %, більш переважно, щонайменше, 85 %, навіть більш переважно, щонайменше, 90 %, найбільш переважно, щонайменше, 95 % і навіть найбільш переважно, щонайменше, 96 %, щонайменше, 97 %, щонайменше, 98 % або, щонайменше, 99 %, які мають целюлолітичну підсилюючу активність (в подальшому "гомологічні поліпептиди"). В переважному аспекті гомологічні поліпептиди мають амінокислотну послідовність, що відрізняється десятьма амінокислотами, переважно п'ятьма амінокислотами, більш переважно чотирма амінокислотами, навіть більш переважно трьома амінокислотами, найбільш переважно двома амінокислотами і навіть найбільш переважно однією амінокислотою від зрілого поліпептиду SEQ ID NO: 2 або SEQ ID NO: 4. Поліпептид даного винаходу переважно містить амінокислотну послідовність SEQ ID NO: 2 або її алельний варіант; або її фрагмент з целюлолітичною підсилюючою активністю. В переважному аспекті поліпептид містить амінокислотну послідовність SEQ ID NO: 2. В іншому переважному аспекті поліпептид містить зрілий поліпептид SEQ ID NO: 2. В іншому переважному аспекті поліпептид містить амінокислоти 18-232 SEQ ID NO: 2, або їх алельний варіант; або їх фрагмент з целюлолітичною підсилюючою активністю. В іншому переважному аспекті поліпептид містить амінокислоти 18 - 232 SEQ ID NO: 2. В іншому переважному аспекті поліпептид містить амінокислотні послідовності SEQ ID NO: 2 або їх алельний варіант; або їх фрагмент з целюлолітичною підсилюючою активністю. В іншому переважному аспекті поліпептид містить амінокислотну послідовність SEQ ID NO: 2. В іншому переважному аспекті поліпептид містить зрілий поліпептид SEQ ID NO: 2. В іншому переважному аспекті поліпептид містить амінокислоти 18-232 SEQ ID NO: 2 або їх алельний варіант; або їх фрагмент з целюлолітичною підсилюючою активністю. В іншому переважному аспекті поліпептид містить амінокислоти 18-232 SEQ ID NO: 2. Поліпептид даного винаходу переважно містить амінокислотну послідовність SEQ ID NO: 4 або її алельний варіант; або її фрагмент з целюлолітичною підсилюючою активністю. В переважному аспекті поліпептид містить амінокислотну послідовність SEQ ID NO: 4. В іншому переважному аспекті поліпептид містить зрілий поліпептид SEQ ID NO: 4. В іншому переважному аспекті поліпептид містить амінокислоти 16-235 SEQ ID NO: 4, або їх алельний варіант; або їх фрагмент з целюлолітичною підсилюючою активністю. В іншому переважному аспекті поліпептид містить амінокислоти 16 - 235 SEQ ID NO: 4. В іншому переважному аспекті поліпептид містить амінокислотну послідовність SEQ ID NO: 4 або її алельний варіант; або її фрагмент з целюлолітичною підсилюючою активністю. В іншому переважному аспекті поліпептид містить амінокислотну послідовність SEQ ID NO: 4. В іншому переважному аспекті поліпептид складається зі зрілого поліпептиду SEQ ID NO: 4. В іншому переважному аспекті поліпептид містить амінокислоти 16-235 SEQ ID NO: 4 або їх алельний варіант; або їх фрагмент з целюлолітичною підсилюючою активністю. В іншому переважному аспекті поліпептид містить амінокислоти 16-235 SEQ ID NO: 4. В другому аспекті даний винахід відноситься до ізольованих поліпептидів з целюлолітичною підсилюючою активністю, що кодовані полінуклеотидами, які гібридизуються переважно при умовах дуже слабкої жорсткості, більш переважно при умовах слабкої жорсткості, більш переважно при умовах середньої жорсткості, більш переважно при умовах середньо-високої жорсткості, ще більш переважно при умовах високої жорсткості, і найбільш переважно при умовах дуже високої жорсткості з (i) послідовністю, що кодує зрілий поліпептид, SEQ ID NO: 1 або SEQ ID NO: 3, (ii) кДНК послідовністю, що міститься в послідовності, що кодує зрілий поліпептид, SEQ ID NO: 1 або SEQ ID NO: 3, (iii) підпослідовністю (i) або (ii), або (iv) повної 8 UA 102832 C2 5 10 15 20 25 30 35 40 45 50 55 60 довжини комплементарною ниткою (i), (ii) або (iii) (J. Sambrook, E.F. Fritsch, і T. Maniatis, 1989, Molecular Cloning, A Laboratory Manual, 2d edition, Cold Spring Harbor, New York). Підпослідовність послідовності, що кодує зрілий поліпептид, SEQ ID NO: 1 або SEQ ID NO: 3 містить, щонайменше, 100 сусідніх нуклеотидів або переважно, щонайменше, 200 сусідніх нуклеотидів. Більш того, підпослідовність може кодувати поліпептидний фрагмент з целюлолітичною підсилюючою активністю. В переважному аспекті комплементарна нитка являє собою повної довжини комплементарну нитку послідовності, що кодує зрілий поліпептид, SEQ ID NO: 1 або SEQ ID NO: 3. Нуклеотидна послідовність SEQ ID NO: 1 або SEQ ID NO: 3; або підпослідовність з цього; а також амінокислотна послідовність SEQ ID NO: 2 або SEQ ID NO: 4; або їх фрагмент; можна використовувати, щоб конструювати нуклеїновокислотні зонди для ідентифікації і клонування ДНК, що кодує поліпептиди з целюлолітичною підсилюючою активністю, зі штамів різних родів або видів за способами, добре відомими в даній галузі. Зокрема, такі зонди можна використовувати для гібридизація з геномною або кДНК родів або видів, що представляють інтерес, після стандартних блоттинг методів за Саузерном, для того, щоб ідентифікувати і ізолювати відповідний йому ген. Такі зонди можуть бути значно коротшими, ніж повна послідовність, але мають бути, щонайменше, 14, переважно, щонайменше, 25, більш переважно, щонайменше, 35 і найбільш переважно, щонайменше, 70 нуклеотидів в довжину. Однак, переважно, що нуклеїновокислотний зонд являє собою, щонайменше, 100 нуклеотидів в довжину. Наприклад, нуклеїновокислотний зонд може являти собою, щонайменше, 200 нуклеотидів, переважно, щонайменше, 300 нуклеотидів, більш переважно, щонайменше, 400 нуклеотидів або найбільш переважно, щонайменше, 500 нуклеотидів в довжину. Можна використовувати навіть більш довші зонди, наприклад, нуклеїновокислотні зонди, що переважно являють собою, щонайменше, 600 нуклеотидів, більш переважно, щонайменше, 700 нуклеотидів або найбільш переважно, щонайменше, 800 нуклеотидів в довжину. Можна використовувати і ДНК, і РНК зонди. Зонди типово помічені для детектування відповідного гену 32 3 35 (наприклад, з P, H, S, біотином або авідином). Такі зонди охоплені даним винаходом. Геномну ДНК або кДНК бібліотеку, підготовлені з інших штамів можна, таким чином, піддати скринінгу на ДНК, що гібридизується із зондами, описаними вище, і кодує поліпептид з целюлолітичною підсилюючою активністю. Геномну або іншу ДНК з таких інших штамів можна розділити електрофорезом в агарозному або поліакриламідному гелі, або іншими методами розділення. ДНК з бібліотек або розділені ДНК можуть бути перенесеними до і іммобілізованими на нітроцелюлозі або іншому придатному матеріалі-носії. Для того, щоб ідентифікувати клон або ДНК, що є гомологічною з SEQ ID NO: 1 або SEQ ID NO: 3; або її підпослідовністю; в блоттингу за Саузерном переважно використовують матеріал-носій. Для цілей даного винаходу гібридизація показує, що нуклеотидна послідовність гібридизується з міченим нуклеїновокислотним зондом, що відповідає послідовності, що кодує зрілий поліпептид, SEQ ID NO: 1 або SEQ ID NO: 3; кДНК послідовності, що міститься в послідовності, що кодує зрілий поліпептид, SEQ ID NO: 1 або SEQ ID NO: 3; її повної довжини комплементарної нитки; або підпослідовності з цього; при умовах від дуже низької до дуже високої жорсткості. Молекули, з якими нуклеїновокислотний зонд гібридизується при цих умовах, можна виявити з використанням, наприклад, плівки для рентгенографії. В переважному аспекті нуклеїновокислотний зонд являє собою послідовність, що кодує зрілий поліпептид, SEQ ID NO: 1. В іншому переважному аспекті нуклеїновокислотний зонд являє собою нуклеотиди 52 - 921 SEQ ID NO: 1. В іншому переважному аспекті нуклеїновокислотний зонд являє собою полінуклеотидну послідовність, що кодує поліпептид SEQ ID NO: 2, або підпослідовність з цього. В іншому переважному аспекті нуклеїновокислотний зонд являє собою SEQ ID NO: 1. В іншому переважному аспекті нуклеїновокислотний зонд являє собою полінуклеотидну послідовність, яка знаходиться в плазміді pSMai190, що міститься в E. coli NRRL B-50084, де її полінуклеотидна послідовність кодує поліпептид з целюлолітичною підсилюючою активністю. В іншому переважному аспекті нуклеїновокислотний зонд являє собою ділянку, що кодує зрілий поліпептид, яка знаходиться в плазміді pSMai190, яка міститься в E. coli NRRL B-50084. В іншому переважному аспекті нуклеїновокислотний зонд являє собою послідовність, що кодує зрілий поліпептид, SEQ ID NO: 3. В іншому переважному аспекті нуклеїновокислотний зонд являє собою нуклеотиди 46 - 851 SEQ ID NO: 3. В іншому переважному аспекті нуклеїновокислотний зонд являє собою полінуклеотидну послідовність, що кодує поліпептид SEQ ID NO: 4, або підпослідовність з цього. В іншому переважному аспекті нуклеїновокислотний зонд являє собою SEQ ID NO: 3. В іншому переважному аспекті нуклеїновокислотний зонд являє собою полінуклеотидну послідовність, яка знаходиться в плазміді pSMai192, яка 9 UA 102832 C2 5 10 15 20 25 30 35 40 45 50 55 60 міститься в E. coli NRRL B-50086, де полінуклеотидна послідовність з цього кодує поліпептид з целюлолітичною підсилюючою активністю. В іншому переважному аспекті нуклеїновокислотний зонд являє собою ділянку, що кодує зрілий поліпептид, яка знаходиться в плазміді pSMai192, яка міститься в E. coli NRRL B-50086. Для довгих зондів зі, щонайменше, 100 нуклеотидів в довжину, умови від дуже низької до дуже високої жорсткості визначаються як прегібридизація і гібридизація при 42 °C в 5X SSPE, 0,3 % SDS, 200 мкг/мл посіченої та денатурованої ДНК з молочка лососевих, і або 25 % формаміді для дуже низької і низької жорсткостях, 35 % формаміді для середньої і середньовисокої жорсткостях, або 50 % формаміді для високої і дуже високої жорсткостях, після стандартних методів блоттингу за Саузерном оптимально протягом 12-24 годин. Для довгих зондів зі, щонайменше, 100 нуклеотидів в довжину, матеріал-носій остаточно промивають три рази кожний протягом 15 хвилин з використанням 2X SSC, 0,2 % SDS переважно при 45 °C (дуже низька жорсткість), більш переважно при 50 °C (низька жорсткість), більш переважно при 55 °C (середня жорсткість), більш переважно при 60 °C (середньо-висока жорсткість), ще більш переважно при 65 °C (висока жорсткість) і найбільш переважно при 70 °C (дуже висока жорсткість). Для коротких зондів від приблизно 15 нуклеотидів до приблизно 70 нуклеотидів в довжину умови жорсткості визначають як прeгібридизацію, гібридизацію і промивну пост-гібридизацію при від приблизно 5 °C до приблизно 10 °C нижче обчисленої Tm з використанням обчислення за Bolton і McCarthy (1962, Proceedings of the National Academy of Sciences USA 48:1390) в 0,9 M NaCl, 0,09 M Tris-HCl pH 7,6, 6 мM ЕДТА (етилендіамінтетраацетат), 0,5 % NP-40, 1X розчину Денхардта, 1 мМ пірoфосфату натрію, 1 мМ одноосновного фосфат натрію, 0,1 мМ ATP і 0,2 мг РНК дріжджів на мл, після стандартних блоттинг методів за Саузерном оптимально протягом 12-24 годин. Для коротких зондів від приблизно 15 нуклеотидів до приблизно 70 нуклеотидів в довжину матеріал-носій промивають один раз в 6X SCC з 0,1 % SDS протягом 15 хвилин і два рази кожен протягом 15 хвилин з використанням 6X SSC при 5 °C-10 °C нижче обчисленої Tm. В третьому аспекті даний винахід відноситься до ізольованих поліпептидів з целюлолітичною підсилюючою активністю, кодованих полінуклеотидами, що містять або включають нуклеотидні послідовності, що мають ступінь ідентичності до послідовності, що кодує зрілий поліпептид, SEQ ID NO: 1 або SEQ ID NO: 3 переважно, щонайменше, 60 %, більш переважно, щонайменше, 65 %, більш переважно, щонайменше, 70 %, більш переважно, щонайменше, 75 %, більш переважно, щонайменше, 80 %, більш переважно, щонайменше, 85 %, навіть більш переважно, щонайменше, 90 %, найбільш переважно, щонайменше, 95 % і навіть найбільш переважно, щонайменше, 96 %, щонайменше, 97 %, щонайменше, 98 % або, щонайменше, 99 %, які кодують поліпептид з целюлолітичною підсилюючою активністю. Дивись розділ полінуклеотиди в даному документі. В четвертому аспекті даний винахід стосується штучних варіантів, що містять заміну, делецію і/або вставку однієї або більше (або декількох) амінокислот зрілого поліпептиду SEQ ID NO: 2 або SEQ ID NO: 4; або гомологічну послідовність з цього. Переважно, амінокислотні зміни належать до другорядної природи, що являє собою консервативні амінокислотні заміни або вставки, які істотно не впливають на згортання і/або активність білка; невеликі делеції, типово від однієї до приблизно 30 амінокислот; невеликі аміно- або карбоксилтермінальні продовження, такі як аміно-термінальний метіоніновий залишок; невеликий лінкерний пептид до приблизно 20-25 залишків; або невелике продовження, яке сприяє очистці за допомогою зміни сумарного заряду або іншої функції, такої як полі-гістидиновий тракт, антигенна детермінанта або домен зв'язування. Приклади консервативних замін належать до групи основних амінокислот (аргінін, лізин і гістидин), дикарбонових амінокислот (глутамінова кислота і аспарагінова кислота), полярних амінокислот (глутамін і аспарагін), гідрофобних амінокислот (лейцин, ізолейцин і валін), ароматичних амінокислот (фенілаланін, триптофан і тирозин) і невеликих амінокислот (гліцин, аланін, серин, треонін і метіонін). Амінокислотні заміни, які звичайно не змінюють специфічну активність, відомі в даній галузі і описані, наприклад, H. Neurath і R.L. Hill, 1979, In, The Proteins, Academic Press, New York. Обміни, які найбільш часто зустрічаються, являють собою Ala/Ser, Val/Ile, Asp/Glu, Thr/Ser, Ala/Gly, Ala/Thr, Ser/Asn, Ala/Val, Ser/Gly, Tyr/Phe, Ala/Pro, Lys/Arg, Asp/Asn, Leu/Ile, Leu/Val, Ala/Glu і Asp/Gly. На додаток до 20 стандартних амінокислот нестандартні амінокислоти (такі як 4гідроксипролін, 6-N-метиллізин, 2-аміноізомасляна кислота, ізовалін і альфа-метил серин) можуть бути замінені на амінокислотні залишки поліпептиду дикого типу. Невеликі кількості неконсервативних амінокислот, амінокислот, які не кодовані генетичним кодом, і неприродних 10 UA 102832 C2 5 10 15 20 25 30 35 40 45 50 55 60 амінокислот можуть бути замінені амінокислотними залишками. "Неприродні амінокислоти" модифіковані після синтезу білка і/або мають хімічну структуру в їх бічному ланцюзі(ланцюгах), що відрізняється від хімічної структури стандартних амінокислот. Неприродні амінокислоти можуть бути хімічно синтезованими, і, переважно, комерційно доступними, і включають піпеколінову кислоту, тіазолідинкарбонову кислоту, дегідропролін, 3- і 4-метилпролін і 3,3диметилпролін. Альтернативно, амінокислотні зміни мають таку природу, що змінюються фізико-хімічні властивості поліпептидів. Наприклад, амінокислотні зміни можуть покращити термічну стабільність поліпептиду, змінювати специфічність субстрату, змінювати pH оптимум і подібне. Незамінні амінокислоти в батьківському поліпептиді можна визначити відповідно до методів, відомих в даній галузі, таких як сайт-спрямований мутагенез або аланін-скануючий мутагенез (Cunningham and Wells, 1989, Science 244: 1081-1085). В останньому методі одиночні аланінові мутації вводять в кожний залишок в молекулі, і результуючі мутанті молекули досліджуються на біологічну активність (тобто, целюлолітичну підсилюючу активність), щоб ідентифікувати амінокислотні залишки, що є вирішальними для активності молекули. Дивись також, Hilton et al., 1996, J. Biol. Chem. 271: 4699-4708. Активний сайт ферменту або іншу біологічну взаємодію можна також визначити фізичним аналізом структури, як визначають такими методами, як ядерний магнітний резонанс, кристалографія, дифракція електронів або фотоафінне мічення, в поєднанні з мутацією амінокислот з передбачуваним сайтом контакту. Дивись, наприклад, de Vos et al., 1992, Science 255: 306-312; Smith et al., 1992, J. Mol. Biol. 224: 899-904; Wlodaver et al., 1992, FEBS Lett. 309: 59-64. Ідентичності незамінних амінокислот можна також прогнозувати з аналізу ідентичностей з поліпептидами, що відносяться до поліпептиду за даним винаходом. Одиночні або множинні амінокислотні заміни, делеції і/або вставки можна зробити і дослідити з використанням відомих способів мутагенезу, рекомбінації і/або тасування з наступними придатними процедурами скринінгу, такими як ті, що розкриті Reidhaar-Olson і Sauer, 1988, Science 241: 53-57; Bowie і Sauer, 1989, Proc. Natl. Acad. Sci. USA 86: 2152-2156; WO 95/17413 або WO 95/22625. Інші способи, які можуть бути використаними, включають схильний до помилок ПЛР (полімеразна ланцюгова реакція), фаговий дисплей (наприклад, Lowman et al., 1991, Biochem. 30: 10832-10837; патент США № 5223409; WO 92/06204), і спрямований на ділянку мутагенез (Derbyshire et al., 1986, ген 46: 145; Ner et al., 1988, DNA 7: 127). Способи мутагенезу/тасування можна об'єднати з високою пропускною здатністю автоматизованими способами скринінгу, щоб визначати активність клонованих, мутованих поліпептидів, експресованих хазяйськими клітинами (Ness et al., 1999, Nature Biotechnology 17: 893-896). Молекулі мутованої ДНК, які кодують активні поліпептиді, можна відновити з хазяйських клітин і швидко секвенувати з використанням стандартних способів даного рівня техніки. Ці способи допускають швидке визначення важливості індивідуальних амінокислотних залишків в поліпептиді, що представляє інтерес, і можуть бути застосованими до поліпептидів невідомої структури. Загальне число амінокислотних замін, делецій і/або вставок зрілого поліпептиду SEQ ID NO: 2 або SEQ ID NO: 4, складає 10, переважно 9, більш переважно 8, більш переважно 7, більш переважно, щонайбільше, 6, більш переважно 5, більш переважно 4, ще більш переважно 3, найбільш переважно 2 і навіть найбільш переважно 1. Джерела поліпептидів з целюлолітичною підсилюючою активністю Поліпептид даного винаходу може бути отриманим з мікроорганізмів будь-якого роду. Для цілей даного винаходу вираз "отриманий з", як застосовано в даному документі, у зв'язку з даним джерелом означає, що поліпептид, кодований нуклеотидною послідовністю, продукується джерелом або штамом, в який нуклеотидна послідовність з джерела була вставлена. В переважному аспекті поліпептид, отриманий з даного джерела, виділяють позаклітинно. Поліпептид з целюлолітичною підсилюючою активністю даного винаходу може являти собою бактеріальний поліпептид. Наприклад, поліпептид може бути поліпептидом з целюлолітичною підсилюючою активністю грампозитивних бактерій, таких як Bacillus, Streptococcus, Streptomyces, Staphylococcus, Enterococcus, Lactobacillus, Lactococcus, Clostridium, Geobacillus або Oceanobacillus, або поліпептидом з целюлолітичною підсилюючою активністю грамнегативних бактерій, таких як E. coli, Pseudomonas, Salmonella, Campylobacter, Helicobacter, Flavobacterium, Fusobacterium, Ilyobacter, Neisseria або Ureaplasma. В переважному аспекті поліпептид являє собою поліпептидом з целюлолітичною підсилюючою активністю Bacillus alkalophilus, Bacillus amyloliquefaciens, Bacillus brevis, Bacillus circulans, Bacillus clausii, Bacillus coagulans, Bacillus firmus, Bacillus lautus, Bacillus lentus, Bacillus 11 UA 102832 C2 5 10 15 20 25 30 35 40 45 50 55 60 licheniformis, Bacillus megaterium, Bacillus pumilus, Bacillus stearothermophilus, Bacillus subtilis або Bacillus. В іншому переважному аспекті поліпептид являє собою поліпептид з целюлолітичною підсилюючою активністю Streptococcus equisimilis, Streptococcus pyogenes, Streptococcus uberis або Streptococcus equi підвид Zooepidemicus. В іншому переважному аспекті поліпептид являє собою поліпептид з целюлолітичною підсилюючою активністю Streptomyces achromogenes, Streptomyces avermitilis, Streptomyces coelicolor, Streptomyces griseus або Streptomyces lividans. Поліпептид з целюлолітичною підсилюючою активністю даного винаходу може також являти собою грибний поліпептид, і більш переважно поліпептид з целюлолітичною підсилюючою активністю дріжджів, таких як Candida, Kluyveromyces, Pichia, Saccharomyces, Schizosaccharomyces або Yarrowia; або більш переважно поліпептидом з целюлолітичною підсилюючою активністю нитковидних грибів, таких як Acremonium, Agaricus, Alternaria, Aspergillus, Aureobasidium, Botryospaeria, Ceriporiopsis, Chaetomidium, Chrysosporium, Claviceps, Cochliobolus, Coprinopsis, Coptotermes, Corynascus, Cryphonectria, Cryptococcus, Diplodia, Exidia, Filibasidium, Fusarium, Gibberella, Holomastigotoides, Humicola, Irpex, Lentinula, Leptospaeria, Magnaporthe, Melanocarpus, Meripilus, Mucor, Myceliophthora, Neocallimastix, Neurospora, Paecilomyces, Penicillium, Phanerochaete, Piromyces, Poitrasia, Pseudoplectania, Pseudotrichonympha, Rhizomucor, Schizophyllum, Scytalidium, Talaromyces, Thermoascus, Thielavia, Tolypocladium, Trichoderma, Trichophaea, Verticillium, Volvariella або Xylaria. В переважному аспекті поліпептид являє собою поліпептид з целюлолітичною підсилюючою активністю Saccharomyces carlsbergensis, Saccharomyces cerevisiae, Saccharomyces diastaticus, Saccharomyces douglasii, Saccharomyces kluyveri, Saccharomyces norbensis або Saccharomyces oviformis. В іншому переважному аспекті поліпептид являє собою поліпептид з целюлолітичною підсилюючою активністю Acremonium cellulolyticus, Aspergillus aculeatus, Aspergillus awamori, Aspergillus fumigatus, Aspergillus foetidus, Aspergillus japonicus, Aspergillus nidulans, Aspergillus niger, Aspergillus oryzae, Chrysosporium keratinophilum, Chrysosporium lucknowense, Chrysosporium tropicum, Chrysosporium merdarium, Chrysosporium inops, Chrysosporium pannicola, Chrysosporium queenslandicum, Chrysosporium zonatum, Fusarium bactridioides, Fusarium cerealis, Fusarium crookwellense, Fusarium culmorum, Fusarium graminearum, Fusarium graminum, Fusarium heterosporum, Fusarium negundi, Fusarium oxysporum, Fusarium reticulatum, Fusarium roseum, Fusarium sambucinum, Fusarium sarcochroum, Fusarium sporotrichioides, Fusarium sulphureum, Fusarium torulosum, Fusarium trichothecioides, Fusarium venenatum, Humicola grisea, Humicola insolens, Humicola lanuginosa, Irpex lacteus, Mucor miehei, Neurospora crassa, Penicillium funiculosum, Penicillium purpurogenum, Phanerochaete chrysosporium, Thielavia achromatica, Thielavia albomyces, Thielavia albopilosa, Thielavia australeinsis, Thielavia fimeti, Thielavia microspora, Thielavia ovispora, Thielavia peruviana, Thielavia spededonium, Thielavia setosa, Thielavia subthermophila, Thielavia terrestris, Trichoderma harzianum, Trichoderma koningii, Trichoderma longibrachiatum, Trichoderma reesei або Trichoderma viride. В іншому переважному аспекті поліпептид являє собою поліпептид з целюлолітичною підсилюючою активністю Myceliophthora hinnulea, Myceliophthora lutea, Myceliophthora thermophila або Myceliophthora vellerea. В більш переважному аспекті поліпептид являє собою поліпептид з целюлолітичною підсилюючою активністю Myceliophthora thermophila. В найбільш переважному аспекті поліпептид являє собою поліпептид з целюлолітичною підсилюючою активністю Myceliophthora thermophila CBS 202.75, наприклад, поліпептид, що містить зрілий поліпептид SEQ ID NO: 2 або SEQ ID NO: 4. Зрозуміло, що для вищезгаданих видів даний винахід охоплює як викінчені, так і невикінчені стадії, і інші таксономічні еквіваленти, наприклад, анаморфи, незалежно від назви видів, за якими вони відомі. Фахівець в даній галузі легко розпізнає ідентичність придатних еквівалентів. Штами цих видів легкодоступні громадськості в ряді колекцій культур, таких як American Type Culture Collection (ATCC), Deutsche Sammlung von Mikroorganismen und Zellkulturen GmbH (DSM), Centraalbureau Voor Schimmelcultures (CBS) і Agricultural Research Service Patent Culture Collection, Northern Regional Research Center (NRRL). Крім того, такі поліпептиди можна ідентифікувати і отримати з інших джерел, що включають мікроорганізми, ізольовані з природи (наприклад, ґрунт, компости, вода і т. д.) з використанням вищезгаданих зондів. Методи ізоляції мікроорганізмів з природних середовищ добре відомі в даній галузі. Полінуклеотид потім можна отримати подібним скринінгом геномної або кДНК бібліотеки такого мікроорганізму. Як тільки полінуклеотидна послідовність, що кодує поліпептид, 12 UA 102832 C2 5 10 15 20 25 30 35 40 45 50 55 60 визначена із зондом(зондами), полінуклеотид можна ізолювати або клонувати, використовуючи методи, що добре відомі фахівцю в даній галузі (дивись, наприклад, Sambrook et al., 1989, supra). Поліпептиди даного винаходу також включають злиті поліпептиди або поліпептиди злиття, що розщеплюються, в яких інший поліпептид є злитим на N-кінці або C-кінці поліпептиду або його фрагменту. Злитий поліпептид продукується злиттям нуклеотидної послідовності (або її частини), що кодує інший поліпептид до нуклеотидної послідовності (або її частини) даного винаходу. Методи для продукування поліпептидів злиття відомі в даній галузі, і включають лігування кодуючих послідовностей, що кодують поліпептиди, так, що вони знаходяться в рамці, і що експресія злитого поліпептиду контролюється тим самим промотором(промоторами) і термінатором. Поліпептид злиття може додатково містити сайт розщеплення. При секреції білка злиття, сайт розщеплюють, вивільняючи поліпептид з целюлолітичною підсилюючою активністю з білка злиття. Приклади сайтів розщеплення включають, але не обмежуються, Kex2 сайт, що кодує дипептид Lys-Arg (Martin et al., 2003, J. Ind. Microbiol. Biotechnol. 3: 568-76; Svetina et al., 2000, J. Biotechnol. 76: 245-251; Rasmussen-Wilson et al., 1997, Appl. Environ. Microbiol. 63: 3488-3493; Ward et al., 1995, Biotechnology 13: 498-503; і Contreras et al., 1991, Biotechnology 9: 378-381), lle(Glu або Asp)-Gly-Arg сайт, який розщеплюють фактор Xa протеазою після аргінінового залишку (Eaton et al., 1986, Biochem. 25: 505-512); Asp-Asp-Asp-Asp-Lys сайт, який розщеплюють ентерокіназою після лізину (Collins-Racie et al., 1995, Biotechnology 13: 982-987); His-Tyr-Glu сайт або His-Tyr-Asp сайт, який розщеплюють Genenase I (Carter et al., 1989, Proteins: Structure, Function, and Genetics 6: 240-248); Leu-Val-Pro-Arg-Gly-Ser сайт, який розщеплюють тромбіном після Arg (Stevens, 2003, Drug Discovery World 4: 35-48); Glu-Asn-Leu-Tyr-Phe-Gln-Gly сайт, який розщеплюють TEV протеазою після Gln (Stevens, 2003, supra); і Leu-Glu-Val-Leu-Phe-Gln-Gly-Pro сайт, який розщеплюють генетично сконструйованою формою риновірус 3C протеазою людини після Gln (Stevens, 2003, supra). Полінуклеотиди Даний винахід також відноситься до ізольованих полінуклеотидів, що містять або включають нуклеотидні послідовності, що кодують поліпептиди з целюлолітичною підсилюючою активністю даного винаходу. В переважному аспекті нуклеотидна послідовність містить або включає SEQ ID NO: 1. В іншому більш переважному аспекті нуклеотидна послідовність містить або включає послідовність, яка знаходиться в плазміді pSMai190, яка міститься в E. coli NRRL B-50084. В іншому переважному аспекті нуклеотидна послідовність містить або включає послідовність, що кодує зрілий поліпептид, SEQ ID NO: 1. В іншому переважному аспекті нуклеотидна послідовність містить або включає нуклеотиди 52-921 SEQ ID NO: 1. В іншому більш переважному аспекті нуклеотидна послідовність містить або включає послідовність, що кодує зрілий поліпептид, яка знаходиться в плазміді pSMai190, яка міститься в E. coli NRRL B-50084. В переважному аспекті нуклеотидна послідовність містить або включає SEQ ID NO: 3. В іншому більш переважному аспекті нуклеотидна послідовність містить або включає послідовність, яка знаходиться в плазміді pSMai192, яка міститьсяв E. coli NRRL B-50086. В іншому переважному аспекті нуклеотидна послідовність містить або включає послідовність, що кодує зрілий поліпептид, SEQ ID NO: 3. В іншому переважному аспекті нуклеотидна послідовність містить або включає нуклеотиди 46-851 SEQ ID NO: 3. В іншому більш переважному аспекті нуклеотидна послідовність містить або включає послідовність, що кодує зрілий поліпептид, яка знаходиться в плазміді pSMai192, яка міститься в E. coli NRRL B-50086. Даний винахід також охоплює нуклеотидні послідовності, що кодують поліпептиди, що містять або включають амінокислотні послідовності SEQ ID NO: 2 або SEQ ID NO: 4, або зрілий поліпептид з цього, який відрізняється від SEQ ID NO: 1 або SEQ ID NO: 3, або послідовність, що кодує зрілий поліпептид з цього, відповідно, через виродження генетичного коду. Даний винахід також відноситься до підпослідовностей SEQ ID NO: 1 або SEQ ID NO: 3, що кодують фрагменти SEQ ID NO: 2 або SEQ ID NO: 4, що мають целюлолітичну підсилюючу активність, відповідно. Даний винахід також відноситься до мутантних полінуклеотидів, що містять або включають, щонайменше, одну мутацію в послідовності, що кодує зрілий поліпептид, SEQ ID NO: 1 або SEQ ID NO: 3, в якій мутантна нуклеотидна послідовність кодує зрілий поліпептид SEQ ID NO: 2 або SEQ ID NO: 4, відповідно. Методи, що використані для ізоляції або клонування полінуклеотиду, що кодує поліпептид, відомі в даній галузі і включають ізоляцію з геномної ДНК, препарату з кДНК або їх комбінації. Клонування полінуклеотидів даного винаходу з такої геномної ДНК можна провести, наприклад, 13 UA 102832 C2 5 10 15 20 25 30 35 40 45 50 55 60 з використанням добре відомої полімеразної ланцюгової реакції (ПЛР) або антитільного скринінгу бібліотек експресії, щоб виявити фрагменти клонованої ДНК зі спільними структурними властивостями. Дивись, наприклад, Innis et al., 1990, PCR: A Guide to Methods and Application, Academic Press, Нью-Йорк. Можна використовувати інші методики нуклеїновокислотної ампліфікації, такі як лігазна ланцюгова реакція (ЛЛР), лігована активована транскрипція (LAT) і ампліфікація, основана на нуклеотидній послідовності (NASBA). Полінуклеотиди можуть бути клоновані зі штаму Myceliophthora, або іншого, або спорідненого організму і, таким чином, наприклад, можуть являти собою алельний або видовий варіант ділянки, що кодує поліпептид, нуклеотидної послідовності. Даний винахід також відноситься до ізольованих полінуклеотидів, що містять або включають нуклеотидні послідовності, що мають ступінь ідентичності до послідовності, що кодує зрілий поліпептид, SEQ ID NO: 1 або SEQ ID NO: 3 переважно, щонайменше, 60 %, більш переважно, щонайменше, 65 %, більш переважно, щонайменше, 70 %, більш переважно, щонайменше, 75 %, більш переважно, щонайменше, 80 %, більш переважно, щонайменше, 85 %, навіть більш переважно, щонайменше, 90 %, найбільш переважно, щонайменше, 95 % і навіть найбільш переважно, щонайменше, 96 %, щонайменше, 97 %, щонайменше, 98 % або, щонайменше, 99 % ідентичності, яка кодує поліпептид з целюлолітичною підсилюючою активністю. Модифікація нуклеотидної послідовності, що кодує поліпептид даного винаходу, може бути необхідною для синтезу поліпептидів значно подібних до поліпептиду. Вираз "значно подібний" до поліпептиду посилається на поліпептидні форми неприродного походження. Ці поліпептиди, отримані за деяким сконструйованим шляхом, можуть відрізнятися від поліпептиду, ізольованого з його природного джерела, наприклад, штучні варіанти, що відрізняються за специфічною активністю, термостабільністю, pH оптимумом або подібним. Варіантна послідовність може бути сконструйована на основі нуклеотидної послідовності представленої як послідовність, що кодує зрілий поліпептид, SEQ ID NO: 1 або SEQ ID NO: 3, наприклад, підпослідовність з цього, і/або за допомогою введення нуклеотидних замін, що не призводять до іншої амінокислотної послідовності поліпептиду, кодованого нуклеотидною послідовністю, але які відповідають використанню кодону хазяйського організму, призначеного для продукування ферменту, або за допомогою введення нуклеотидних замін, що можуть призводити до іншої амінокислотної послідовності. Для загального опису нуклеотидної заміни дивись, наприклад, Ford et al., 1991, Protein Expression and Purification 2: 95-107. Фахівцю в даній галузі буде очевидно, що такі заміни можна здійснити за межами ділянок, критичних до функції молекули, і все одно отримати активний поліпептид. Амінокислотні залишки, суттєві для активності поліпептиду, кодованого ізольованим полінуклеотидом даного винаходу, і отже переважно не підлягаючому заміні, можна ідентифікувати відповідно до методик, відомих в даній галузі, таких як сайт-спрямований мутагенез або аланін-скануючий мутагенез (дивись, наприклад, Cunningham and Wells, 1989, supra). В останньому методі мутації введені в кожний позитивно заряджений залишок в молекулі, і результуючі мутантні молекули досліджуються на целюлолітичну підсилюючу активність, щоб ідентифікувати амінокислотні залишки, що є критичними для активності молекули. Сайти субстрат-ферментної взаємодії також можна визначити за допомогою аналізу тривимірної структури, оскільки визначені такими методами, як аналіз методом ядерного магнітного резонансу, кристалографія або фотоафінне мічення (дивись, наприклад, de Vos et al., 1992, supra; Smith et al., 1992, supra; Wlodaver et al., 1992, supra). Даний винахід також відноситься до ізольованих полінуклеотидів, що кодують поліпептиди даного винаходу, які гібридизуються при умовах дуже низької жорсткості, переважно умовах низької жорсткості, більш переважно умовах середньої жорсткості, більш переважно умовах середньо-високої жорсткості, ще більш переважно умовах високої жорсткості і найбільш переважно умовах дуже високої жорсткості з (i) послідовністю, що кодує зрілий поліпептид, SEQ ID NO: 1 або SEQ ID NO: 3, (ii) кДНК послідовністю, що міститься в послідовності, що кодує зрілий поліпептид, SEQ ID NO: 1 або SEQ ID NO: 3, або (iii) повної довжини комплементарною ниткою (i) або (ii); або алельними варіантами і підпослідовностями з цього (Sambrook et al., 1989, supra), як визначено в даному документі. В переважному аспекті комплементарна нитка представляє собою повної довжини комплементарну нитку послідовності, що кодує зрілий поліпептид, SEQ ID NO: 1 або SEQ ID NO: 3. Даний винахід також відноситься до ізольованих полінуклеотидів, отриманих (a) гібридизуванням популяції ДНК при умовах дуже низької, низької, середньої, середньо-високої, високої або дуже високої жорсткості з (i) послідовністю, що кодує зрілий поліпептид, SEQ ID NO: 1 або SEQ ID NO: 3, (ii) кДНК послідовністю, що міститься в послідовності, що кодує зрілий поліпептид, SEQ ID NO: 1 або SEQ ID NO: 3, або (iii) повної довжини комплементарною 14 UA 102832 C2 5 10 15 20 25 30 35 40 45 50 55 60 ниткою (i) або (ii); і (b) ізолюванням гібридизуючого полінуклеотиду, який кодує поліпептид з целюлолітичною підсилюючою активністю. В переважному аспекті комплементарна нитка являє собою повної довжини комплементарну нитку послідовності, що кодує зрілий поліпептид, SEQ ID NO: 1 або SEQ ID NO: 3. Нуклеїновокислотні конструкти Даний винахід також відноситься до нуклеїновокислотних конструктів, що містять ізольований полінуклеотид даного винаходу, функціонально зв'язаний з одним або більше (декількома) контрольними послідовностями, що направляють експресію послідовності, що кодує, в придатну хазяйську клітину при умовах, відповідних контрольним послідовностям. Ізольованим полінуклеотидом, що кодує поліпептид даного винаходу, можна маніпулювати різними шляхами, щоб забезпечити експресію поліпептиду. Маніпуляція полінуклеотидної послідовності до її вставки у вектор може бути бажаною або необхідним в залежності від вектору експресії. Методи модифікації полінуклеотидних послідовностей, що використовують способи рекомбінантної ДНК, добре відомі в даній галузі. Контрольна послідовність може являти собою придатну промоторну послідовність, нуклеотидну послідовність, що розпізнається хазяйською клітиною для експресії полінуклеотиду, що кодує поліпептид даного винаходу. Промоторна послідовність містить транскрипційні контрольні послідовності, що опосередкують експресію поліпептиду. Промотор може являти собою будь-яку нуклеотидну послідовність, що показує транскрипційну активність в хазяйській клітині вибору, включаючи мутант, усічені і гібридні промотори, і може бути отриманим з генів, що кодують позаклітинні або внутрішньоклітинні поліпептиди, або гомологічні, або гетерологічні до хазяйської клітини. Прикладами придатних промоторів для направлення транскрипції нуклеїновокислотних конструктів даного винаходу, особливо в бактеріальній хазяйській клітині, є промотори отримані з E. coli lac оперону, Streptomyces coelicolor агарази гену (dagA), Bacillus subtilis леванцукрази гену (sacB), Bacillus licheniformis альфа-амілази гену (amyL), Bacillus stearothermophilus мальтогенної амілази гену (amyM), Bacillus amyloliquefaciens альфа-амілази гену (amyQ), Bacillus licheniformis пеніцилінази гену (penP), Bacillus subtilis xylA і xylB генів і прокаріотичної бета-лактамази гену (Villa-Kamaroff et al., 1978, Proceedings of the National Academy of Sciences USA 75: 3727-3731), а також tac промотор (DeBoer et al., 1983, Proceedings of the National Academy of Sciences USA 80: 21-25). Додаткові промотори описані в "Useful proteins from recombinant bacteria" в Scientific American, 1980, 242: 74-94; і в Sambrook et al., 1989, supra. Прикладами придатних промоторів для направлення транскрипції нуклеїновокислотних конструктів даного винаходу в хазяйську клітину нитковидних грибів є промотори, отримані з генів для Aspergillus oryzae TAKA амілази, Rhizomucor miehei аспаргінової протеїнази, Aspergillus niger нейтральної альфа-амілази, Aspergillus niger кислотостабільної альфа-амілази, Aspergillus niger або Aspergillus awamori глюкоамілази (glaA), Rhizomucor miehei ліпази, Aspergillus oryzae лужної протеази, Aspergillus oryzae тріозофосфатізомерази, Aspergillus nidulans ацетамідази, Fusarium venenatum амілоглюкозидази (WO 00/56900), Fusarium venenatum Daria (WO 00/56900), Fusarium venenatum Quinn (WO 00/56900), Fusarium oxysporum трипсин-подібної протеази (WO 96/00787), Trichoderma reesei бета-глюкозидази, Trichoderma reesei целобіогідролази I, Trichoderma reesei целобіогідролази II, Trichoderma reesei ендоглюканази I, Trichoderma reesei ендоглюканази II, Trichoderma reesei ендоглюканази III, Trichoderma reesei ендоглюканази IV, Trichoderma reesei ендоглюканази V, Trichoderma reesei ксиланaзи I, Trichoderma reesei ксиланaзи II, Trichoderma reesei бета-ксилозидази, а також NA2tpi промотор (гібрид промоторів з генів для Aspergillus niger нейтральної альфа-амілази і Aspergillus oryzae тріозофосфатізомерази); і мутантні, усічені і гібридні промотори з цього. В дріжджовому хазяїні застосовні промотори отримують з генів для Saccharomyces cerevisiae енолази (ENO-1), Saccharomyces cerevisiae галактокінази (GAL1), Saccharomyces cerevisiae алкогольдегідрогенази/гліцеральдегід-3-фосфатдегидрогенази (ADH1, ADH2/GAP), Saccharomyces cerevisiae тріозофосфатізомерази (TPI), Saccharomyces cerevisiae металотіонеїну (CUP1) і Saccharomyces cerevisiae 3-фосфогліцераткінази. Інші застосовні промотори для дріжджових хазяйських клітин описані Romanos et al., 1992, Yeast 8: 423-488. Контрольна послідовність може також являти собою придатну послідовність термінатора транскрипції, послідовність, що розпізнається хазяйською клітиною, щоб обірвати транскрипцію. Послідовність термінатора є функціонально зв'язаною 3" кінцем нуклеотидної послідовності, що кодує поліпептид. В даному винаході можна використати будь-який термінатор, що є функціональним в хазяйській клітині вибору. Переважні термінатори для хазяйських клітин нитковидних грибів є отриманими з генів для Aspergillus oryzae TAKA амілази, Aspergillus niger глюкоамілази, Aspergillus nidulans 15 UA 102832 C2 5 10 15 20 25 30 35 40 45 50 55 антранілатсинтази, Aspergillus niger альфа-глюкозидази і Fusarium oxysporum трипсин-подібної протеази. Переважні термінатори для дріжджових хазяйських клітин є отриманими з генів для Saccharomyces cerevisiae енолази, Saccharomyces cerevisiae цитохрому C (CYC1) і Saccharomyces cerevisiae гліцеральдегід-3-фосфат дегідрогенази. Інші застосовні термінатори для дріжджових хазяйських клітин описані Romanos et al., 1992, supra. Контрольна послідовність може також являти собою придатну лідерну послідовність, нетрансльовану ділянку мРНК, яка важлива для трансляції хазяйської клітини. Лідерна послідовність є функціонально зв'язаною з 5" кінцем нуклеотидної послідовності, що кодує поліпептид. В даному винаході можна використати будь-яку лідерну послідовність, що є функціональною в хазяйській клітині вибору. Переважні лідерні послідовності для хазяйських клітин нитковидних грибів отримані з генів для Aspergillus oryzae TAKA амілази і Aspergillus nidulans тріозофосфат ізомерази. Придатні лідерні послідовності для дріжджових хазяйських клітин отримані з генів для Saccharomyces cerevisiae енолази (ENO-1), Saccharomyces cerevisiae 3-фосфогліцерат кінази, Saccharomyces cerevisiae альфа-фактору і Saccharomyces cerevisiae алкогольдегідрогенази/гліцеральдегід-3-фосфатдегідрогенази (ADH2/GAP). Контрольна послідовність може також являти собою послідовність поліаденилювання, послідовність, функціонально зв'язану з 3" кінцем нуклеотидної послідовності, і, коли транскрибована, розпізнається хазяйською клітиною як сигнал для додавання поліаденозинових залишків до транскрибованої мРНК. В даному винаході можна використовувати будь-яку послідовність поліаденилювання, що є функціональною в хазяйській клітині вибору. Переважні послідовності поліаденилювання для хазяйських клітин нитковидних грибів отримані з генів для Aspergillus oryzae TAKA амілази, Aspergillus niger глюкoамілази, Aspergillus nidulans антранілатсинтази, Fusarium oxysporum трипсин-подібної протеази і Aspergillus niger альфа-глюкозидази. Придатні послідовності поліаденилювання для дріжджових хазяйських клітин описані Guo and Sherman, 1995, Molecular Cellular Biology 15: 5983-5990. Контрольна послідовність також може бути послідовністю, що кодує сигнальний пептид, яка кодує для амінокислотної послідовності, зв'язаної з аміно кінцем поліпептиду і направляє кодований поліпептид в секреторний шлях клітини. 5" Кінець послідовності, що кодує, нуклеотидної послідовності може спадково містити послідовність, що кодує сигнальний пептид, природно зв'язану в рамці зчитування трансляції з сегментом послідовності, що кодує, яка кодує секретований поліпептид. Альтернативно, 5" кінець послідовності, що кодує, може містити послідовність, що кодує сигнальний пептид, яка є чужорідною до послідовності, що кодує. Чужорідна послідовність, що кодує сигнальний пептид, може бути необхідною, коли послідовність, що кодує, природно не містить послідовність, що кодує сигнальний пептид. Альтернативно, чужорідна послідовність, що кодує сигнальний пептид, може легко замістити природну послідовність, що кодує сигнальний пептид, для того, щоб підсилити секрецію поліпептиду. Однак, будь-яку послідовність, що кодує сигнальний пептид, яка направляє експресований поліпептид в секреторний шлях хазяйської клітини вибору, тобто, секретований в середовище культивування, можна використовувати в даному винаході. Ефективні послідовності, що кодують сигнальний пептид, для бактеріальних хазяйських клітин являють собою послідовності, що кодують сигнальний пептид, отримані з генів для Bacillus NCIB 11837 мальтогенної амілази, Bacillus stearothermophilus альфа-амілази, Bacillus licheniformis субтілизину, Bacillus licheniformis бета-лактамази, Bacillus stearothermophilus нейтральних протеаз (nprT, nprS, nprM) і Bacillus subtilis prsA. Додаткові сигнальні пептиди описані Simonen і Palva, 1993, Microbiological Reviews 57: 109-137. Ефективні послідовності, що кодують сигнальний пептид, для хазяйських клітин нитковидних грибів являють собою послідовності, що кодують сигнальний пептид, отримані з генів для Aspergillus oryzae TAKA амілази, Aspergillus niger нейтральної амілази, Aspergillus niger глюкoамілази, Rhizomucor miehei аспарагінової протеази, Humicola insolens целюлази, Humicola insolens ендоглюканази V і Humicola lanuginosa ліпази. Придатні сигнальні пептиди для дріжджових хазяйських клітин отримані з генів для Saccharomyces cerevisiae альфа-фактору і Saccharomyces cerevisiae інвертази. Інші застосовні послідовності, що кодують сигнальний пептид, описані Romanos et al., 1992, supra. В переважному аспекті сигнальний пептид містить або включає амінокислоти 1-17 SEQ ID NO: 2. В іншому переважному аспекті послідовність, що кодує сигнальний пептид, містить або включає нуклеотиди 1-51 SEQ ID NO: 1. 16 UA 102832 C2 5 10 15 20 25 30 35 40 45 50 55 60 В іншому переважному аспекті сигнальний пептид містить або включає амінокислоти 1-15 SEQ ID NO: 4. В іншому переважному аспекті послідовність, що кодує сигнальний пептид, містить або включає нуклеотиди 1-45 SEQ ID NO: 3. Контрольна послідовність може також являти собою послідовність, що кодує пропептид, яка кодує для амінокислотної послідовності, розташованої на аміно кінці поліпептиду. Результуючий поліпептид, відомий як прoфермент або прoполіпептид (або зимоген в деяких випадках). Прoпептид звичайно неактивний і може бути перетвореним на зрілий активний поліпептид каталітичним або автокаталітичним розщепленням прoпептиду з прoполіпептиду. Послідовність, що кодує прoпептид, можна отримати з генів для Bacillus subtilis лужної протеази (aprE), Bacillus subtilis нейтральної протеази (nprT), Saccharomyces cerevisiae альфа-фактору, Rhizomucor miehei аспарагінової протеази, і Myceliophthora thermophila лаккази (WO 95/33836). Оскільки і сигнальний пептид, і прoпептидні послідовності присутні на аміно кінці поліпептиду, прoпептидна послідовність розташована поруч з аміно кінцем поліпептиду, та сигнальна пептидна послідовність розташована поруч з аміно кінцем прoпептидної послідовності. Також може бути бажаним додавання регуляторних послідовностей, що дозволяють регуляцію експресії поліпептиду по відношенню до росту хазяйської клітини. Прикладами регуляторних систем є ті, що сприяють вмиканню або вимиканню експресії гену у відповідь на хімічний або фізичний подразник, включаючи присутність регуляторної сполуки. Регуляторні системи в прокаріотичних системах включають lac, tac і trp операторні системи. В дріжджах можна використовувати ADH2 систему або GAL1 систему. В нитковидних грибах TAKA альфаамілазний промотор, Aspergillus niger глюкoамілазний промотор і Aspergillus oryzae глюкoамілазний промотор можна використовувати в якості регуляторних послідовностей. Інші приклади регуляторних послідовностей є такими, що передбачають ампліфікацію гену. В еукаріотичних системах ці регуляторні послідовності включають дигідрофолат редуктазний ген, що ампліфікується в присутності метотрексату, і металотионеїнові гені, що ампліфікується з важкими металами. В цих випадках нуклеотидна послідовність, що кодує поліпептид, буде функціонально зв'язаною з регуляторною послідовністю. Вектори експресії Даний винахід також відноситься до рекомбінантних векторів експресії, що містять полінуклеотид даного винаходу, промотор, транскрипційні і трансляційні стоп-сигнали. Різні нуклеїнові кислоти і контрольні послідовності, описані в даному документі, можна поєднати разом, щоб продукувати рекомбінантний вектор експресії, що може включати один або більше (декілька) зручних сайтів рестрикції, щоб дозволяти вставку або заміну нуклеотидної послідовності, що кодує поліпептид, в таких сайтах. Альтернативно, полінуклеотидну послідовність даного винаходу можна єкспресувати вставленням нуклеотидної послідовності або нуклеїновокислотного конструкта, що містить послідовність. в придатному векторі для експресії. При створенні вектору експресії послідовність, що кодує, локалізована у векторі так, що послідовність, що кодує, функціонально зв'язана з придатними контрольними послідовностями для експресії. Рекомбінантний вектор експресії може являти собою будь-який вектор (наприклад, плазмідний або вірусний), який можна зручно піддавати методикам рекомбінантної ДНК і який може приводити до експресії нуклеотидної послідовності. Вибір вектору буде типово залежати від сумісності вектору з хазяйською клітиною, в яку вектор повинен бути введений. Вектори можуть являти собою лінійні або закриті кільцеві плазміди. Вектор може являти собою вектор, що автономно реплікується, тобто, вектор, що існує як екстрахромосомна одиниця, реплікація якої незалежна від хромосомної реплікації, наприклад, плазміда, екстрахромосомний елемент, мініхромосома або штучна хромосома. Вектор може містити будь-які засоби для забезпечення само-реплікації. Альтернативно, вектор може бути таким, що, коли вводиться в хазяйську клітину, інтегрується в геном і реплікується разом із хромосомою(хромосомами), в яку він був інтегрований. Крім того, одиночний вектор або плазміда, або два або більше векторів або плазмід, що разом містять загальну ДНК для введення в геном хазяйської клітини, або транспозон, можуть бути використаними. Вектори даного винаходу переважно містять один або більше (декілька) селектуємих маркерів, що дозволяють легку селекцію трансформованих, трансфектованих, перетворених або подібних клітин. Селектуємий маркер являє собою ген, продукт якого забезпечує біоцидну або вірусну резистентність, резистенсність до важких металів, прототрофію до ауксотрофів, і подібне. Прикладами бактеріальних селектуємих маркерів є dal гени з Bacillus subtilis або Bacillus licheniformis, або маркери, що придають антибіотичну резистентність, таку як ампіцилінову, 17 UA 102832 C2 5 10 15 20 25 30 35 40 45 50 55 канаміцинову, хлорамфеніколову або тетрациклінову резистенсність. Придатні маркери для дріжджових хазяйських клітин являють собою ADE2, HIS3, LEU2, LYS2, MET3, TRP1 і URA3. Селектуємі маркери для використання в хазяйській клітині нитковидних грибів включають, але не обмежуються, amdS (ацетамідаза), argB (орнітин карбомоїлтрансфераза), bar (фосфінoтріцин ацетилтрансфераза), hph (гігроміцин фосфотрансфераза), niaD (нітрат редуктаза), pyrG (оротідин-5’-фосфат декарбоксилаза), sC (сульфат аденілтрансфераза) і trpC (антранілат синтаза), а також їх еквіваленти. Переважними для використання в клітині Aspergillus є amdS і pyrG гени Aspergillus nidulans або Aspergillus oryzae і bar ген Streptomyces hygroscopicus. Вектори даного винаходу переважно містять елемент(елементи), що допускає інтеграцію вектору в геном хазяйської клітини або автономну реплікацію вектору в клітині, незалежної від геному. Для інтеграції в геном хазяйської клітини вектор може залежати від полінуклеотидної послідовності, що кодує поліпептид, або будь-який інший елемент вектору для інтеграції в геном гомологічною або негомологічний рекомбінацію. Альтернативно, вектор може містити додаткові нуклеотидні послідовності для направлення інтеграції гомологічною рекомбінацією в геном хазяйської клітини в точному положенні(положеннях) в хромосомі(хромосомах). Щоб підвищити імовірність інтеграції в точному положенні, інтеграційні елементи повинні переважно містити достатню кількість нуклеїнових кислот, таку як 100-10000 пар основ, переважно 400-10000 пар основ, і найбільш переважно 800-10000 пар основ, які мають високий ступінь ідентичності до відповідної цільової послідовності, щоб підсилити імовірність гомологічної рекомбінації. Інтеграційний елементи можуть бути будь-якою послідовністю, яка гомологічна з цільовою послідовністю в геномі хазяйської клітини. Крім того, інтеграційні елементи можуть являти собою нуклеотині послідовності, що не кодують або кодують. З іншого боку, вектор можна інтегрувати в геном хазяйської клітини не-гомологічною рекомбінацією. Для автономної реплікації вектор може додатково включати початок реплікації, що сприяє, щоб вектор автономно реплікувався в хазяйській клітині, що розглядається. Початок реплікації може являти собою будь-який плазмідний реплікатор, що опосередкує автономну реплікацію, яка функціонує в клітині. Вираз "початок реплікації" або "реплікатор плазміди", визначений в даному документі як нуклеотидна послідовність, що дозволяє плазміді або вектору реплікуватися in vivo. Прикладами бактеріальних початків реплікацій є початки реплікації плазмід pBR322, pUC19, pACYC177 і pACYC184, що допускають реплікацію в E. coli, і pUB110, pE194, pTA1060 і pAMß1, що допускають реплікацію в Bacillus. Прикладами початків реплікації для використання в дріжджовій хазяйській клітині є 2 мікронний початок реплікації, ARS1, ARS4, комбінація ARS1 і CEN3, і комбінація ARS4, і CEN6. Прикладами початків реплікації, застосовних в клітині нитковидних грибів, є AMA1 і ANS1 (Gems et al., 1991, Gene 98: 61-67; Cullen et al., 1987, Nucleic Acids Research 15: 9163-9175; WO 00/24883). Ізоляцію AMA1 гену і конструкції плазмід або векторів, що містить ген, можна здійснити відповідно до способів, розкритих в WO 00/24883. Більш ніж одну копію полінуклеотиду даного винаходу можна вставити в хазяйську клітину, щоб посилити продукування генного продукту. Збільшення числа копій полінуклеотиду можна отримати інтегруванням, щонайменше, однієї додаткової копії послідовності в геном хазяйської клітини або включенням селектуємого маркерного гену, що ампліфікується, з полінуклеотидом, де клітини, що містять ампліфіковані копії селектуємого маркерного гену, і таким чином додаткові копії полінуклеотиду, можна вибрати шляхом культивування клітин в присутності придатного агента для селекції. Методики, використані для лігування елементів, описані вище, щоб сконструювати рекомбінантні вектори експресії даного винаходу, добре відомі фахівцю в даній галузі (дивись, наприклад, Sambrook et al., 1989, supra). Хазяйські клітини Даний винахід також відноситься до рекомбінантних хазяйських клітин, що містять ізольований полінуклеотид даного винаходу, які переважно використовують в рекомбінантному продукуванні поліпептидів. Вектор, що містить полінуклеотид даного винаходу, вводять в хазяйську клітину так, що вектор зберігається як хромосомний інтегрант або як екстрахромосомний вектор, що самореплікується, як описано вище. Вираз "хазяйська клітина" охоплює будь-яке потомство батьківської клітини, що не є ідентичним до батьківської клітини через мутації, що трапляються підчас реплікації. Вибір хазяйської клітини буде в значній мірі залежати від гену, що кодує поліпептид, і його джерела. 18 UA 102832 C2 5 10 15 20 25 30 35 40 45 50 55 60 Хазяйська клітина може бути будь-якою клітиною, застосованою в рекомбінантному продукуванні поліпептиду даного винаходу, наприклад, прокаріотичною або еукаріотичною. Прокаріотична хазяйська клітина може являти собою будь-яку грампозитивну бактерію або грамнегативну бактерію. Грампозитивна бактерія включає, але не обмежується, Bacillus, Streptococcus, Streptomyces, Staphylococcus, Enterococcus, Lactobacillus, Lactococcus, Clostridium, Geobacillus і Oceanobacillus. Грамнегативна бактерія включає, але не обмежується, E. coli, Pseudomonas, Salmonella, Campylobacter, Helicobacter, Flavobacterium, Fusobacterium, Ilyobacter, Neisseria і Ureaplasma. Бактеріальна хазяйська клітина може являти собою будь-яку клітину Bacillus. Клітини Bacillus, застосовні в здійсненні даного винаходу, включають, але не обмежуються, клітини Bacillus alkalophilus, Bacillus amyloliquefaciens, Bacillus brevis, Bacillus circulans, Bacillus clausii, Bacillus coagulans, Bacillus firmus, Bacillus lautus, Bacillus lentus, Bacillus licheniformis, Bacillus megaterium, Bacillus pumilus, Bacillus stearothermophilus, Bacillus subtilis і Bacillus thuringiensis. В переважному аспекті бактеріальна хазяйська клітина являє собою клітину Bacillus amyloliquefaciens, Bacillus lentus, Bacillus licheniformis, Bacillus stearothermophilus або Bacillus subtilis. В більш переважному аспекті бактеріальна хазяйська клітина являє собою клітину Bacillus amyloliquefaciens. В іншому більш переважному аспекті бактеріальна хазяйська клітина являє собою клітину Bacillus clausii. В іншому більш переважному аспекті бактеріальна хазяйська клітина являє собою клітину Bacillus licheniformis. В іншому більш переважному аспекті бактеріальна хазяйська клітина являє собою клітину Bacillus subtilis. Бактеріальна хазяйська клітина може також являє собою будь-яку клітину Streptococcus. Клітини Streptococcus, застосовні в практиці даного винаходу включають, але не обмежуються, клітини Streptococcus equisimilis, Streptococcus pyogenes, Streptococcus uberis, і Streptococcus equi підвид Zooepidemicus. В переважному аспекті бактеріальна хазяйська клітина являє собою клітину Streptococcus equisimilis. В іншому переважному аспекті бактеріальна хазяйська клітина являє собою клітину Streptococcus pyogenes. В іншому переважному аспекті бактеріальна хазяйська клітина являє собою клітину Streptococcus uberis. В іншому переважному аспекті бактеріальний хазяйська клітина являє собою клітину Streptococcus equi підвид Zooepidemicus. Бактеріальна хазяйська клітина може також являти собою будь-яку клітину Streptomyces. Клітини Streptomyces, застосовні в практиці даного винаходу включають, але не обмежуються, клітини Streptomyces achromogenes, Streptomyces avermitilis, Streptomyces coelicolor, Streptomyces griseus і Streptomyces lividans. В переважному аспекті бактеріальна хазяйська клітина являє собою клітину Streptomyces achromogenes. В іншому переважному аспекті бактеріальна хазяйська клітина являє собою клітину Streptomyces avermitilis. В іншому переважному аспекті бактеріальна хазяйська клітина являє собою клітину Streptomyces coelicolor. В іншому переважному аспекті бактеріальна хазяйська клітина являє собою клітину Streptomyces griseus. В іншому переважному аспекті бактеріальна хазяйська клітина являє собою клітину Streptomyces lividans. Введення ДНК в клітину Bacillus можна, наприклад, здійснити за допомогою протопластового перетворення (дивись, наприклад, Chang і Cohen, 1979, Molecular General Genetics 168: 111-115), за допомогою компетентних клітин (дивись, наприклад, Young і Spizizen, 1961, Journal of Bacteriology 81: 823-829, або Dubnau і Davidoff-Abelson, 1971, Journal of Molecular Biology 56: 209-221), за допомогою електропорації (дивись, наприклад, Shigekawa і Dower, 1988, Biotechniques 6: 742-751) або за допомогою кон'югації (дивись, наприклад, Koehler і Thorne, 1987, Journal of Bacteriology 169: 5271-5278). Введення ДНК в клітину E coli можна, наприклад, здійснити за допомогою протопластового перетворення (дивись, наприклад, Hanahan, 1983, J. Mol. Biol. 166: 557-580) або за допомогою електропорації (дивись, наприклад, Dower et al., 1988, Nucleic Acids Res. 16: 6127-6145). Введення ДНК в клітину Streptomyces можна, наприклад, здійснити за допомогою протопластового перетворення і електропорації (дивись, наприклад, Gong et al., 2004, Folia Microbiol. (Praha) 49: 399-405), за допомогою кон'югації (дивись, наприклад, Mazodier et al., 1989, J. Bacteriol. 171: 3583-3585) або за допомогою трансдукції (дивись, наприклад, Burke et al., 2001, Proc. Natl. Acad. Sci. USA 98: 6289-6294). Введення ДНК в клітину Pseudomonas можна, наприклад, здійснити за допомогою електропорації (дивись, наприклад, Choi et al., 2006, J. Microbiol. Methods 64: 391-397) або за допомогою кон'югації (дивись, наприклад, Pinedo і Smets, 2005, Appl. Environ. Microbiol. 71: 5157). Введення ДНК в клітину Streptococcus можна, наприклад, здійснити за допомогою натуральної компетентності (дивись, наприклад, Perry і Kuramitsu, 1981, Infect. Immun. 32: 12951297), за допомогою протопластового перетворення (дивись, наприклад, Catt і Jollick, 1991, Microbios. 68: 189-2070, за допомогою електропорації (дивись, наприклад, Buckley et al., 1999, 19 UA 102832 C2 5 10 15 20 25 30 35 40 45 50 55 60 Appl. Environ. Microbiol. 65: 3800-3804) або за допомогою кон'югації (дивись, наприклад, Clewell, 1981, Microbiol. Rev. 45: 409-436). Однак, можна використати будь-який спосіб, відомий в даній галузі, для введення ДНК в хазяйську клітину. Хазяйська клітина може також являти собою еукаріот, такий як клітина ссавця, комахи, рослини або гриба. В переважному аспекті хазяйська клітина являє собою грибну клітину. "Гриби", як використовується в даному документі, включають відділ Ascomycota, Basidiomycota, Chytridiomycota і Zygomycota (як визначено Hawksworth et al., In, Ainsworth і Bisby's Dictionary of The Fungi, 8th edition, 1995, CAB International, University Press, Cambridge, UK), а також Oomycota (як приводиться в Hawksworth et al., 1995, supra, page 171) і всі мітоспорові гриби (Hawksworth et al., 1995, supra). В більш переважному аспекті грибна хазяйська клітина являє собою дріжджову клітину. "Дріжджі", як використовується в даному документі, включають дріжджі ascosporogenous (Endomycetales), дріжджі basidiosporogenous і дріжджі, що належать до Fungi Imperfecti (Blastomycetes). Оскільки класифікація дріжджів може змінитися в майбутньому, для цілей цього винаходу, дріжджі повинні бути визначені, як описано в Biology and Activities of Yeast (Skinner, F.A., Passmore, S.M., і Davenport, R.R., eds, Soc. App. Bacteriol. Symposium Series No. 9, 1980). У ще більш переважному аспекті хазяйська клітини дріжджів являє собою клітину Candida, Hansenula, Kluyveromyces, Pichia, Saccharomyces, Schizosaccharomyces або Yarrowia. В найбільш переважному аспекті хазяйська клітини дріжджів являє собою клітину Saccharomyces carlsbergensis, Saccharomyces cerevisiae, Saccharomyces diastaticus, Saccharomyces douglasii, Saccharomyces kluyveri, Saccharomyces norbensis або Saccharomyces oviformis. В іншому найбільш переважному аспекті хазяйська клітина дріжджів являє собою клітину Kluyveromyces lactis. В іншому найбільш переважному аспекті хазяйська клітина дріжджів являє собою клітину Yarrowia lipolytica. В іншому більш переважному аспекті грибна хазяйська клітина являє собою клітину нитковидного гриба. "Нитковидні гриби" включають всі нитковидні форми підрозділу Eumycota і Oomycota (як визначено Hawksworth et al., 1995, supra). Нитковидні гриби звичайно відрізняються міцеліальною оболонкою, що містить хітин, целюлозу, глюкан, хітозан, манан і інші комплексні полісахариди. Вегетативний ріст здійснюється гіфальною елонгацією, і вуглецевий катаболізм є облігатно аеробним. На відміну від цього, вегетативний ріст дріжджів, таких як Saccharomyces cerevisiae, здійснюється брунькуванням одноклітинного талому, і вуглецевий катаболізм може бути ферментативним. В навіть більш переважному аспекті хазяйська клітина нитковидних грибів являє собою клітину Acremonium, Aspergillus, Aureobasidium, Bjerkandera, Ceriporiopsis, Chrysosporium, Coprinus, Coriolus, Cryptococcus, Filibasidium, Fusarium, Humicola, Magnaporthe, Mucor, Myceliophthora, Neocallimastix, Neurospora, Paecilomyces, Penicillium, Phanerochaete, Phlebia, Piromyces, Pleurotus, Schizophyllum, Talaromyces, Thermoascus, Thielavia, Tolypocladium, Trametes або Trichoderma. В найбільш переважному аспекті хазяйська клітина нитковидних грибів являє собою клітину Aspergillus awamori, Aspergillus fumigatus, Aspergillus foetidus, Aspergillus japonicus, Aspergillus nidulans, Aspergillus niger або Aspergillus oryzae. В іншому найбільш переважному аспекті хазяйська клітина нитковидних грибів являє собою клітину Fusarium bactridioides, Fusarium cerealis, Fusarium crookwellense, Fusarium culmorum, Fusarium graminearum, Fusarium graminum, Fusarium heterosporum, Fusarium negundi, Fusarium oxysporum, Fusarium reticulatum, Fusarium roseum, Fusarium sambucinum, Fusarium sarcochroum, Fusarium sporotrichioides, Fusarium sulphureum, Fusarium torulosum, Fusarium trichothecioides або Fusarium venenatum. В іншому найбільш переважному аспекті хазяйська клітина нитковидних грибів являє собою клітину Bjerkandera adusta, Ceriporiopsis aneirina, Ceriporiopsis aneirina, Ceriporiopsis caregiea, Ceriporiopsis gilvescens, Ceriporiopsis pannocinta, Ceriporiopsis rivulosa, Ceriporiopsis subrufa, Ceriporiopsis subvermispora, Chrysosporium keratinophilum, Chrysosporium lucknowense, Chrysosporium tropicum, Chrysosporium merdarium, Chrysosporium inops, Chrysosporium pannicola, Chrysosporium queenslandicum, Chrysosporium zonatum, Coprinus cinereus, Coriolus hirsutus, Humicola insolens, Humicola lanuginosa, Mucor miehei, Myceliophthora thermophila, Neurospora crassa, Penicillium purpurogenum, Phanerochaete chrysosporium, Phlebia radiata, Pleurotus eryngii, Thielavia terrestris, Trametes villosa, Trametes versicolor, Trichoderma harzianum, Trichoderma koningii, Trichoderma longibrachiatum, Trichoderma reesei або Trichoderma viride. Грибні клітини можна перетворити способом, що включає утворення протопласту, перетворення протопластів і регенерацію оболонки клітини способом, відомим per se. Придатні методики для перетворення хазяйських клітин Aspergillus і Trichoderma описані в європейському 20 UA 102832 C2 5 10 15 20 25 30 35 40 45 50 55 60 патенті EP 238023 і Yelton et al., 1984, Proceedings of the National Academy of Sciences USA 81: 1470-1474. Придатні способи для перетворення видів Fusarium описані Malardier et al., 1989, Gene 78: 147-156, і WO 96/00787. Дріжджі можна перетворити з використанням методик, описаних Becker і Guarente, In Abelson, J.N. і Simon, M.I., editors Guide to Yeast Genetics and Molecular Biology, Methods in Enzymology, Volume 194, pp 182-187, Academic Press, Inc., New York; Ito et al., 1983, Journal of Bacteriology 153: 163; і Hinnen et al., 1978, Proceedings of the National Academy of Sciences USA 75: 1920. Способи продукування Даний винахід також відноситься до способів продукування поліпептиду даного винаходу, при яких: (a) культивують клітину, яка в її формі дикого типу продукує поліпептид, при умовах, сприятливих для продукування поліпептиду; і (b) відновлюють поліпептид. В переважному аспекті клітина належить роду Myceliophthora. В більш переважному аспекті клітина являє собою Myceliophthora thermophila. В найбільш переважному аспекті клітина являє собою Myceliophthora thermophila CBS 202.75. В іншому найбільш переважному аспекті клітина являє собою Myceliophthora thermophila CBS 117.65. Даний винахід також відноситься до способів продукування поліпептиду даного винаходу, при яких: (a) культивують рекомбінантну хазяйську клітину, як описано в даному документі, при умовах, сприятливих для продукування поліпептиду; і (b) відновлюють поліпептид. Даний винахід також відноситься до способів продукування поліпептиду даного винаходу, при яких: (a) культивують рекомбінантну хазяйську клітину при умовах, сприятливих для продукування поліпептиду, де хазяйська клітина включає мутантну нуклеотидну послідовність, що має, щонайменше, одну мутацію в послідовності, що кодує зрілий поліпептид, SEQ ID NO: 1 або SEQ ID NO: 3, де мутантна нуклеотидна послідовність кодує поліпептид, що містить або включає зрілий поліпептид SEQ ID NO: 2 або SEQ ID NO: 4; і (b) відновлюють поліпептид. В способах продукування даного винаходу клітини культивують в живильному середовищі, придатному для продукування поліпептиду з використанням способів, добре відомих в даній галузі. Наприклад, клітину можна культивувати за допомогою культивації в колбі, що струшується, і ферментацією невеликого масштабу або великого масштабу (включаючи безперервні, періодичні, з підживленням або твердофазні ферментації) в лабораторних або промислових ферментерах, що здійснюють в придатному середовищі і при умовах, що дозволяють поліпептиду бути експресованим і/або ізольованим. Культивація відбувається в придатному живильному середовищі, що містить вуглецеві і азотні джерела та неорганічні солі, з використанням методик, відомих в даній галузі. Придатні середовища доступні від комерційних постачальників або можуть бути приготовленими за відомими композиціями (наприклад, в каталогах American Type Culture Collection). Якщо поліпептид секретується в живильне середовище, поліпептид можна зібрати безпосередньо з середовища. Якщо поліпептид не секретується в середовище, його можна зібрати з клітинних лізатів. Поліпептиди можна виявляти з використанням способів, відомих в даній галузі, специфічних для поліпептидів. Ці способи виявлення можуть включати використання специфічних антитіл, утворення ферментного продукту або зникнення ферментного субстрату. Наприклад, ферментний аналіз можна використовувати, щоб визначити активність поліпептиду, як описано в даному документі. Результуючий поліпептид можна зібрати, використовуючи способи, відомі в даній галузі. Наприклад, поліпептид можна зібрати з живильного середовища традиційними методиками, включаючи, але не обмежуючись, центрифугування, фільтрацію, екстракцію, сушку розпиленням, випаровування або осадження. Поліпептиди даного винаходу можна очистити різноманітними методиками, відомими в даній галузі, включаючи, але не обмежуючись, хроматографію (наприклад, іон-обмінну, афінну, гідрофобну, хроматофокусування і ексклюзійну), електрофоретичні методики (наприклад, препаративне ізоелектричне фокусування), диференціальну розчинність (наприклад, фракціонування сульфатом амонію), SDS-PAGE або екстракцію (дивись, наприклад, Protein Purification, J.-C. Janson і Lars Ryden, editors, VCH Publishers, Нью Йорк, 1989), щоб отримати значно чисті поліпептиди. Рослини Даний винахід також відноситься до рослин, наприклад, трансгенної рослини, рослинної частини або рослинної клітини, що містять ізольований полінуклеотид, що кодує поліпептид з целюлолітичною підсилюючою активністю даного винаходу так, щоб експресувати і продукувати поліпептид у відновлювальних кількостях. Поліпептид можна відновити з рослини або рослинної частини. Альтернативно, рослину або рослинну частину, що містить рекомбінантний поліпептид, можна використовувати, як таку, для покращення якості їжі або корму, наприклад, 21 UA 102832 C2 5 10 15 20 25 30 35 40 45 50 55 покращення живильної цінності, смакової привабливості і реологічних властивостей або для руйнування анти-живильного фактору. Трансгенна рослина може бути дводольною (дводольна рослина) або однодольною (однодольна рослина). Прикладами однодольних рослин є трави, такі як мятлик луговий (blue grass, Poa), кормова трава, така як Festuca, Lolium, трава помірної кліматичної зони, така як Agrostis, і зернові, наприклад, пшениця, овес, жито посівне, ячмінь, рис, сорго і кукурудза (зерно). Прикладами дводольних рослин є тютюн, бобові, такі як люпіни, картопля, цукровий буряк, горох, біб і соя, і хрестоцвітні рослини (родина Brassicaceae), такі як цвітна капуста, рапсове насіння і близько родинний модельний організм Arabidopsis thaliana. Прикладами рослинних частин є стеблина, калюс, листя, корінь, плоди, насіння і бульби, а також окремі тканини, що містять ці частини, наприклад, епідерміс, мезофіл, паренхіма, провідні тканини, меристеми. Специфічні компартменти рослинної клітини, такі як хлоропласти, апопласти, мітохондрія, вакуоль, пероксисома і цитоплазма, також вважаються рослинною частиною. Крім того, будь-яка рослинна клітина, будь-якого походження тканини, вважається рослинною частиною. Подібно, рослинні частини, такі як специфічні тканини і клітини, ізольовані, щоб сприяти використанню даного винаходу, також вважаються рослинними частинами, наприклад, зародки, ендосперми, алейрон і оболонки насіння. Також включеними в об'єм даного винаходу є потомство таких рослин, рослинних частин і рослинних клітин. Трансгенну рослину або рослинну клітину, що експресує поліпептид даного винаходу, можна сконструювати відповідно до способів, відомих в даній галузі. В коротшій формі, рослину або рослинну клітину конструюють включенням одного або більше (декількох) конструктів експресії, що кодують поліпептид даного винаходу в рослинний хазяйський геном або хлоропластовий геном і розмноженням результуючої модифікованої рослини або рослинної клітини в трансгенну рослину або рослинну клітину. Конструкт експресії являє собою традиційно нуклеїновокислотний конструкт, що містить полінуклеотид, що кодує поліпептид даного винаходу, функціонально зв'язаний з придатними регуляторними послідовностями, необхідними для експресії нуклеотидної послідовності в рослині або рослинній частині вибору. Крім того, конструкт експресії може включати маркер, що селектується, застосовний для ідентифікації хазяйських клітин, в яких конструкт експресії був інтегрований, і ДНК послідовностей, необхідних для введення конструкту в рослину, що розглядається (останній залежить від способу введення ДНК, що буде використовуватися). Вибір регуляторних послідовностей, таких як промоторні і термінаторні послідовності і факультативно сигнальні або транзитні послідовності, здійснюють, наприклад, в залежності від того, коли, де і як поліпептид бажають, щоб був експресований. Наприклад, експресія гену, що кодує поліпептид даного винаходу, може бути конститутивною або індукованою, або може бути такою, що залежить від розвитку, етап- або тканиноспецифічною, і продукт гену може бути націленим на специфічну тканину або рослинну частину, таку як насіння або листя. Регуляторні послідовності, наприклад, описані Tague et al., 1988, Plant Physiology 86: 506. Для конститутивної експресії 35S-CaMV кукурудзяний убиквітин 1 і рисовий актин 1 промотор можна використовувати (Franck et al., 1980, Cell 21: 285-294, Christensen et al., 1992, Plant Mol. Biol. 18: 675-689; Zhang et al., 1991, Plant Cell 3: 1155-1165). Орган-специфічні промотори можуть являти собою, наприклад, промотор з тканин, що запасають, таких як насіння, бульби картоплі і плоди (Edwards і Coruzzi, 1990, Ann. Rev. Genet. 24: 275-303), або з метаболічних тканин, таких як меристеми (Ito et al., 1994, Plant Mol. Biol. 24: 863-878), насіння специфічний промотор, такий як глютеліновий, проламіновий, глобуліновий або альбуміновий промотор з рису (Wu et al., 1998, Plant and Cell Physiology 39: 885-889), промотор Vicia faba з легуміну B4 і невідомий ген білка насіння з Vicia faba (Conrad et al., 1998, Journal of Plant Physiology 152: 708-711), промотор з білка маси рослинної олії (Chen et al., 1998, Plant and Cell Physiology 39: 935-941), промотор запасного білка napA з Brassica napus, або будь-яке інше насіння-специфічний промотор, відомий в даній галузі, наприклад, як описано в WO 91/14772. Крім того, промотор може являти собою лист-специфічний промотор, такий як промотор rbcs з рису або томату (Kyozuka et al., 1993, Plant Physiology 102: 991-1000, промотор гену аденінметилтрансферази хлорела вірусу (Mitra and Higgins, 1994, Plant Molecular Biology 26: 8593) або промотор гену aldP з рису (Kagaya et al., 1995, Molecular and General Genetics 248: 668674), або індукований раною промотор, такий як картопляний промотор pin2 (Xu et al., 1993, Plant Molecular Biology 22: 573-588). Подібно, промотор може бути індукованим за допомогою абіотичних обробок, таких як температура, посухи або зміни в солоності, або індукованим 22 UA 102832 C2 5 10 15 20 25 30 35 40 45 50 55 екзогенно застосовуваними речовинами, що активують промотор, наприклад, етанол, естроген, рослинні гормони, такі як етилен, абсцизова кислота і гіббереллова кислота, і важкі метали. Енхансерний елемент промотору можна також використовувати, щоб отримати вищу експресію поліпептиду даного винаходу в рослині. Наприклад, енхансерний елемент промотору може являти собою інтрон, що розташований між промотором і нуклеотидною послідовністю, що кодує поліпептид даного винаходу. Наприклад, Xu et al., 1993, supra, розкриває використання першого інтрону рисового актину 1 гену, щоб підсилити експресію. Селектуємий маркерний ген і будь-які інші частини конструкту експресії можна вибрати з тих, що доступні в даній області. Нуклеїновокислотний конструкт вводять в рослинний геном відповідно до традиційних методів, відомих в даній галузі, включаючи Agrobacterium- опосередковане перетворення, вірусопосередковане перетворення, мікроін'єкції, бомбардування частками, біолістичне перетворення і електропорацію (Gasser et al., 1990, Science 244: 1293; Potrykus, 1990, Bio/Technology 8: 535; Shimamoto et al., 1989, Nature 338: 274). Зараз, Agrobacterium tumefaciens-опосередкована передача гену являє собою переважний спосіб для генерування трансгенних дводольних рослин (для огляду, див. Hooykas and Schilperoort, 1992, Plant Molecular Biology 19: 15-38), і може бути також використана для перетворення однодольних рослин, хоча інші способи перетворення часто використовують для цих рослин. Зараз, переважним способом для генерування трансгенних однодольних рослин є бомбардування частками (мікроскопічні золоті або вольфрамові частки, покриті перетворюючою ДНК) зародкові калі або зародки, що розвиваються (Christou, 1992, Plant Journal 2: 275-281; Shimamoto, 1994, Current Opinion Biotechnology 5: 158-162; Vasil et al., 1992, Bio/Technology 10: 667-674). Альтернативний спосіб перетворення однодольних рослин оснований на протопластному перетворенні, як описано Omirulleh et al., 1993, Plant Molecular Biology 21: 415428. Наступне перетворення, трансформанти, що мають введений конструкт експресії, селектуються і генеруються в цілі рослини відповідно до способів, добре відомих в даній галузі. Часто методика перетворення призначена для селективної елімінації генів селекції або під час регенерації, або в наступних генераціях шляхом використання, наприклад, cумісного перетворення з двома розділеними T-ДНК конструктами або сайт специфічної ексцизії гену селекції специфічною рекомбіназою. Даний винахід також відноситься до способів продукування поліпептиду даного винаходу, при яких: (a) культивують трансгенну рослину або рослинну клітину, що містить полінуклеотид, що кодує поліпептид з целюлолітичною підсилюючою активністю даного винаходу при умовах, сприятливих для продукування поліпептиду; і (b) відновлюють поліпептид. Усунення або зменшення целюлолітичної підсилюючої активності Даний винахід також відноситься до способів продукування мутанту батьківської клітини, який включає руйнування або видалення полінуклеотидної послідовності або її ділянки, що кодує поліпептид даного винаходу, що приводить до того, що мутантна клітина продукує менше поліпептиду, ніж батьківська клітина, коли культивується при тих же умовах. Мутантну клітину можна сконструювати зниженням або усуненням експресії нуклеотидної послідовності, що кодує поліпептид даного винаходу, використовуючи способи, добре відомі в даній галузі, наприклад, вставки, розриви, заміщення або делеції. В переважному аспекті нуклеотидну послідовність інактивують. Нуклеотидна послідовність, щоб бути модифікованою або інактивованою, може являти собою, наприклад, ділянку, що кодує або частину з цього, суттєву для активності, або регуляторний елемент, необхідний для експресії кодуючої ділянки. Прикладом такої регуляторної або контрольної послідовності може бути промоторна послідовність або функціональна частина з цього, тобто, частина, що є достатньою для впливової експресії нуклеотидної послідовності. Інші контрольні послідовності для можливої модифікації включають, але не обмежуються, лідерну, послідовність поліаденилювання, прoпептидну послідовність, сигнальну пептидну послідовність, термінатор транскрипції і транскрипційний активатор. Модифікацію або інактивацію нуклеотидної послідовності можна здійснити піддаванням батьківської клітини мутагенезу і вибору мутантних клітин, в яких експресія нуклеотидної послідовності була знижена або усунена. Мутагенез, який може бути специфічним або неспецифічним, можна здійснити, наприклад, шляхом використання придатного фізичного або хімічного мутагенезуючого агенту, шляхом використання придатного олігонуклеотида, або піддаванням ДНК послідовності ПЛР генерованому мутагенезу. Крім того, мутагенез можна здійснити шляхом використання будь-якої комбінації цих мутагенезуючих агентів. 23 UA 102832 C2 5 10 15 20 25 30 35 40 45 50 55 60 Приклади фізичного або хімічного мутагенезуючого агенту, придатного для даної мети включають ультрафіолетове (УФ) випромінювання, гідроксиламін, N-метил-N'-нітро-Nнітрозогуанідин (MNNG), O-метил гідроксиламін, азотисту кислоту, етилметансульфонат (EMS), бісульфіт натрію, мурашину кислоту і нуклеотидні аналоги. При використанні таких агентів, мутагенез типово здійснюють за допомогою інкубування батьківської клітини для мутагенезації в присутності переважного мутагенезуючого агенту при придатних умовах, і скринінгу і/або вибору для мутантних клітин, що проявляють знижену або не проявляють експресію гену. Модифікацію або інактивацію нуклеотидної послідовності можна виконати за допомогою введення, заміни, або відщеплення одного або більше (декількох) нуклеотидів в ген або регуляторний елемент, необхідний для його транскрипції або трансляції. Наприклад, нуклеотиди можна внести або усунути з тим, щоб привести до введення термінуючого кодону, відщеплення ініціюючого кодону, або заряду у відкритій рамці зчитування. Таку модифікацію або інактивацію можна здійснити сайт-направленним мутагенезом або ПЛР генерованим мутагенезом відповідно до способів, відомих в даній галузі. Хоча, в принципі, модифікацію можна здійснити in vivo, тобто, безпосередньо на клітині, що експресує нуклеотидну послідовність, яку модифікують, переважно, щоб модифікація була здійснена in vitro як ілюструється нижче. Приклад традиційного шляху для усунення або зниження експресії нуклеотидної послідовності клітиною ґрунтується на методах заміщення гену, делеції гену або розриву гену. Наприклад, в способі розриву гену, нуклеїновокислотну послідовність, відповідну до ендогенної нуклеотидної послідовності, мутагенезують in vitro для продукування порушеної нуклеїновокислотної послідовності, яку потім трансформують в батьківську клітину для продукування порушеного гену. Гомологічною рекомбінацією порушена нуклеїновокислотна послідовність заміщає ендогенну нуклеотидну послідовність. Може бути бажаним, що порушена нуклеотидна послідовність також кодує маркер, який можна використати для селекції трансформантів, в яких нуклеотидна послідовність була модифікована або зруйнована. В особливо переважному аспекті нуклеотидну послідовність розривають селектуємим маркером, таким як ті, що описані в даному документі. Альтернативно, модифікацію або інактивацію нуклеотидної послідовності можна здійснити загально визнаними антисмислової або РНКі методами, використовуючи послідовність, комплементарну нуклеотидній послідовності. Більш специфічно експресію нуклеотидної послідовності клітиною можна знизити або видалити введенням послідовності, комплементарної нуклеотидній послідовності гену, що може бути транскрибованою в клітину і здатна гібридизувати до мРНК, продукованої в клітині. При умовах, що дозволяють комплементарній антисмисловій нуклеотидній послідовності гібридизуватися до мРНК, кількість трансльованого білка, таким чином, знижується або усувається. Даний винахід додатково відноситься до мутантної клітини батьківської клітини, що включає розрив або делецію нуклеотидної послідовності, що кодує поліпептид або його контрольну послідовність, що приводить до того, що мутантна клітина продукує менше поліпептиду або не продукує поліпептиду в порівнянні з батьківською клітиною. Поліпептид-дефіцитні мутантні клітини, створені таким чином, зокрема придатні як хазяйські клітини для експресії природних і/або гетерологічних поліпептидів. Отже, даний винахід додатково відноситься до способів продукування природного або гетерологічного поліпептиду, при яких: (a) культивують мутантну клітину при умовах, сприятливих для продукування поліпептиду; і (b) відновлюють поліпептид. Вираз "гетерологічні поліпептиди" визначають в даному документі як поліпептиди, що не є природними до хазяйської клітини, природного білку, в якому модифікації були зроблені, щоб змінити природну послідовність, або природного білку, чия експресія кількісно змінена як результат впливу хазяйської клітини за допомогою рекомбінантної ДНК методів. В додатковому аспекті даний винахід відноситься до способу продукування білкового продукту, в основному вільного від целюлолітичної підсилюючої активності, за допомогою ферментації клітини, що продукує і поліпептид даного винаходу, і білковий продукт інтересу за допомогою додавання ефективної кількості агенту, що допускає інгібування целюлолітичної підсилюючої активності, до бульйону ферментації попередньо, під час або після закінчення ферментації, відновлення продукту інтересу з бульйону ферментації, і факультативно піддавання продукту, що витягається, додатковій очистці. В додатковому аспекті даний винахід відноситься до способу продукування білкового продукту, в основному вільного від целюлолітичної підсилюючої активності, за допомогою культивування клітини при умовах, що допускають експресію продукту, що піддає отриману 24 UA 102832 C2 5 10 15 20 25 30 35 40 45 50 55 60 культуральну рідину комбінованій pH і температурній обробці з тим, щоб знизити целюлолітичну підсилюючу активність значно, і відновлення продукту з культуральної рідини. Альтернативно, комбіновану pH і температурну обробку можна здійснити при готуванні ферменту, що витягається з культуральної рідини. Комбіновану pH і температурну обробку можна факультативно використати в комбінації з обробкою з целюлолітичним підсилюючим інгібітором. Відповідно до цього аспекту даного винаходу можливо видалити, щонайменше, 60 %, переважно, щонайменше, 75 %, більш переважно, щонайменше, 85 %, ще більш переважно, щонайменше, 95 %, і найбільш переважно, щонайменше, 99 % целюлолітичної підсилюючої активності. Повне усунення целюлолітичної підсилюючої активності можна отримати, використовуючи цей спосіб. Комбіновану pH і температурну обробку переважно проводять при pH в діапазоні 2-4 або 911 і температурі в діапазоні, щонайменше, 60-70 °C протягом достатнього періоду часу, щоб досягти бажаний ефект, де типово, достатньо 30 - 60 хвилин. Способи, що використовуються для культивації і очистки продукту інтересу можна здійснити за допомогою способів, відомих в даній галузі. Способи даного винаходу для продукування продукту, в основному вільного від целюлолітичний підсилення, представляють особливий інтерес в продукуванні еукаріотичних поліпептидів, зокрема грибних білків, таких як ферменти. Фермент можна вибрати з, наприклад, амілолітичного ферменту, ліполітичного ферменту, протеолітичного ферменту, целюлолітичного ферменту, оксиредуктази або ферменту деградування рослинної клітинної оболонки. Приклади таких ферментів включають амінопептидазу, амілазу, амілоглюкозидазу, карбогідразу, карбоксипептидазу, каталазу, целобіогідролазу, целюлазу, хітиназу, кутиназу, циклодекстрин глікозилтрансферазу, дезоксирибонуклеазу, ендоглюканазу, естеразу, галактозидазу, бета-галактозидазу, глюкoамілазу, глюкозооксидазу, глюкозидазу, галопероксидазу, гемiцелюлазу, інвертазу, ізомеразу, лакказу, лігазу, ліпазу, ліазу, манозидазу, оксидазу, пектинoлітичний фермент, пероксидазу, фітазу, фенолоксидазу, поліфенолоксидазу, протеолітичний фермент, рибонуклеазу, трансферазу, трансглютаміназу або ксиланазу. Целюлолітичні підсилюючо-дефіцитні клітини можна також використовувати, щоб виражати гетерологічні білки, що представляють фармацевтичний інтерес, такі як гормони, фактори росту, рецептори і подібне. Зрозуміло, що вираз "еукаріотичні поліпептиди" включає не тільки природні поліпептиди, але і ті поліпептиди, наприклад, ферменти, які були модифіковані за допомогою амінокислотних замін, делецій або додавань, або інших таких модифікацій, щоб підсилити активність, термостабільність, pH стійкість і подібне. В додатковому аспекті даний винахід відноситься до білкового продукту, в основному вільного від целюлолітичної підсилюючої активності, який продукують за допомогою способу даного винаходу. Способи інгібування експресії поліпептиду з целюлолітичною підсилюючою активністю Даний винахід також відноситься до способів інгібування експресії поліпептиду з целюлолітичною підсилюючою активністю в клітині, що містять введення в клітину або вираження в клітині дволанцюгової РНК (длРНК) молекули, де длРНК включає підпослідовність полінуклеотиду даного винаходу. В переважному аспекті длРНК являє собою приблизно 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25 або більше спарених нуклеотидів в довжину. длРНК являє собою переважно невелику інтерферуючу РНК (ніРНК) або мікро РНК (міРНК). В переважному аспекті длРНК являє собою невелику інтерферуючу РНК (ніРНК) для інгібування транскрипції. В іншому переважному аспекті длРНК являє собою мікро РНК (міРНК) для інгібування трансляції. Даний винахід також відноситься до таких дволанцюгових РНК (длРНК) молекул, що містять ділянку послідовності, що кодує зрілий поліпептид, SEQ ID NO: 1 або SEQ ID NO: 3 для інгібування експресії поліпептиду в клітині. В той час, як даний винахід не обмежується будьяким визначеним механізмом дії, длРНК може вводити клітину і викликати руйнування одноланцюгової РНК (олРНК) подібних або ідентичних послідовностей, включаючи ендогенні мРНК. Коли клітина піддається длРНК, мРНК з гомологічного гену селективно деградується процесом, що називають РНК інтерференцією (РНКi). длРНК даного винаходу можна використовувати в сайлесінг-геновій терапевтиці. В одному аспекті даний винахід забезпечує способи селективного деградування РНК, використовуючи длРНКi даного винаходу. Спосіб можна здійснити in vitro, ex vivo або in vivo. В одному аспекті длРНК молекули можна використовувати, щоб породжувати мутацію зі втратою функції в клітині, органі або тварині. Способи для створення і використання длРНК молекул для 25 UA 102832 C2 5 10 15 20 25 30 35 40 45 50 55 60 селективного деградування РНК, добре відомі в даній галузі, дивись, наприклад, патент США № 6506559; патент США № 6511824; патент США № 6515109; і патент США № 6489127. Композиції Даний винахід також відноситься до композицій, що містять поліпептид даного винаходу. Переважно, композиції збагачені таким поліпептидом. Вираз "збагачений" показує, що целюлолітична підсилююча активність композиції була підвищена, наприклад, з коефіцієнтом збагачення, щонайменше, 1.1. Композиція може містити поліпептид даного винаходу як основний ферментний компонент, наприклад, моно-компонентна композиція. Альтернативно, композиція може містити складні ферментні сполуки, що мають активність, такі як амінопептидаза, амілаза, карбогідраза, карбоксипептидаза, каталаза, целюлаза, хітиназа, кутиназа, циклодекстрин глікозилтрансфераза, дезоксирибонуклеаза, естераза, альфа-галактозидаза, бетагалактозидаза, глюкoамілаза, альфа-глюкозидаза, бета-глюкозидаза, галопероксидаза, інвертаза, лакказа, ліпаза, манозидаза, оксидаза, пектинoлітичний фермент, пептідоглютаміназа, пероксидаза, фітаза, поліфенолоксидаза, протеолітичний фермент, рибонуклеаза, трансглютаміназа або ксиланаза. Додатковий фермент(ферменти) можна продукувати, наприклад, за допомогою мікроорганізму, що належить до роду Aspergillus, переважно Aspergillus aculeatus, Aspergillus awamori, Aspergillus fumigatus, Aspergillus foetidus, Aspergillus japonicus, Aspergillus nidulans, Aspergillus niger, або Aspergillus oryzae; Fusarium, переважно Fusarium bactridioides, Fusarium cerealis, Fusarium crookwellense, Fusarium culmorum, Fusarium graminearum, Fusarium graminum, Fusarium heterosporum, Fusarium negundi, Fusarium oxysporum, Fusarium reticulatum, Fusarium roseum, Fusarium sambucinum, Fusarium sarcochroum, Fusarium sulphureum, Fusarium toruloseum, Fusarium trichothecioides, або Fusarium venenatum; Humicola, переважно Humicola insolens або Humicola lanuginosa; або Trichoderma, переважно Trichoderma harzianum, Trichoderma koningii, Trichoderma longibrachiatum, Trichoderma reesei, або Trichoderma viride. Поліпептидні композиції можна приготувати відповідно до способів, відомих в даній галузі, і можуть бути в формі рідини або сухої композиції. Наприклад, поліпептидна композиція може бути в формі гранулята або мікрогранулята. Поліпептид, який включають в композицію, можна стабілізувати відповідно до способів, відомих в даній галузі. Приклади переважного використання поліпептидних композицій даного винаходу наведені нижче. Дозування поліпептидної композиції даного винаходу та інші умови, при яких композицію використовують, можна визначити на основі способів, відомих в даній галузі. Обробка целюлозного матеріалу Даний винахід також відноситься до способів для розкладання або перетворення целюлозного матеріалу, що містять: обробку целюлозного матеріалу целюлолітичною ферментною композицією в присутності поліпептиду з целюлолітичною підсилюючою активністю даного винаходу. В переважному аспекті спосіб додатково включає відновлення розкладеного або перетвореного целюлозного матеріалу. Даний винахід також відноситься до способів продукування продукту ферментації, при яких: (a) перетворюють в цукор целюлозний матеріал з целюлолітичною ферментною композицією в присутності поліпептиду з целюлолітичною підсилюючою активністю даного винаходу; (b) ферментують перетворений в цукор целюлозний матеріал етапу (a) з одним або більше мікроорганізмами, що ферментують, щоб продукувати продукт ферментації; і (c) відновлюють продукт ферментації з ферментації. Даний винахід також відноситься до способів ферментування целюлозного матеріалу, при яких: ферментують целюлозний матеріал з одним або більше мікроорганізмами, що ферментують, де целюлозний матеріал гідролізован з целюлолітичною ферментною композицією в присутності поліпептиду з целюлолітичною підсилюючою активністю даного винаходу, і присутність поліпептиду з целюлолітичною підсилюючою активністю підвищує гідроліз целюлозного матеріалу в порівнянні з відсутністю поліпептиду з целюлолітичною підсилюючою активністю. В переважному аспекті ферментування целюлозного матеріалу продукує продукт ферментації. В іншому переважному аспекті спосіб додатково включає відновлення продукту ферментації з ферментації. Композиція, що містить поліпептид з целюлолітичною підсилюючою активністю може бути в формі необробленого ферментаційного бульйону з або без клітин, видалених або у формі полуочищеного або очищеного ферментного препарату, або композиція може містити хазяйську клітину даного винаходу як джерело поліпептиду з целюлолітичною підсилюючою активністю в способі ферментації з біомасою. Способи даного винаходу можна використовувати, щоб оцукрювати целюлозний матеріал 26 UA 102832 C2 5 10 15 20 25 30 35 40 45 50 55 до цукрів, здатних до бродіння, і перетворювати цукри, здатні до бродіння, до багатьох придатних речовин, наприклад, хімікатів і палив. Продукування бажаного продукту ферментації з целюлозного матеріалу типово включає в себе попередню обробку, ферментний гідроліз (оцукрювання) і ферментацію. Обробку целюлозного матеріалу відповідно до даного винаходу можна виконати, використовуючи способи, загальновизнані в даній області. Більш того, способи даного винаходу можна реалізувати, використовуючи будь-який загальновизнаний апарат, що оброблює біомасу, сконфігурований, щоб оперувати відповідно до даного винаходу. Гідроліз (оцукрювання) і ферментація, роздільні або одночасні, включають, але не обмежуються, роздільні гідроліз і ферментацію (SHF); одночасні оцукрювання і ферментацію (SSF); одночасні оцукрювання і cумісну ферментацію (SSCF); гібридний гідроліз і ферментацію (HHF); SHCF (роздільний гідроліз і сумісну ферментацію), HHCF (гібридний гідроліз і ферментацію), і пряме мікробне перетворення (DMC). SHF використовує роздільні технологічні операції, щоб спочатку ферментно гідролізувати лігноцелюлозу дo цукрів, здатних до бродіння, наприклад, цукрів глюкози, целобіози, целотріози і пентози, і потім ферментувати цукри, що здатні до бродіння, до етанолу. В SSF ферментний гідроліз лігноцелюлози і ферментація цукрів дo етанолу комбінують на одному етапі (Philippidis, G. P., 1996, Cellulose bioconversion technology, in Handbook on Bioethanol: Production and Utilization, Wyman, C. E., ed., Taylor & Francis, Washington, DC, 179-212). SSCF включає в себе сумісну ферментацію складних цукрів (Sheehan, J., and Himmel, M., 1999, Enzymes, energy and the environment: A strategic perspective on the U.S. Department of Energy's research and development activities for bioethanol, Biotechnol. Prog. 15: 817-827). HHF включає в себе роздільний етап роздільного гідролізу, і на додаток етап одночасного оцукрювання і гідролізу, які можна здійснити в тому ж реакторі. Етапи в HHF процесі можна здійснити при різних температурах, тобто, високотемпературне ферментне оцукрювання, за яким слідкує SSF при нижчій температурі, що штам ферментації може витримати. DMC об'єднує всі три процеси (ферментне продукування, гідроліз лігноцелюлози і ферментацію) на одному або більше етапах, де ті самі організми використовують, щоб продукувати ферменти для перетворення лігноцелюлози до цукрів, здатних до бродіння, і щоб перетворити цукри, здатні до бродіння, в кінцевий продукт (Lynd, L. R., Weimer, P. J., van Zyl, W. H., and Pretorius, I. S., 2002, Microbial cellulose utilization: Fundamentals and biotechnology, Microbiol. Mol. Biol. Reviews 66: 506-577). В даному документі зрозуміло, що будь-який спосіб, відомий в даній галузі, що містить попередню обробку, ферментний гідроліз (оцукрювання), ферментацію або комбінацію з цього можна використовувати в практикуючих способах даного винаходу. Традиційний апарат може включати періодично підживлюючий хімічний реактор з мішалкою, періодичний хімічний реактор з мішалкою, беззупинно поточний хімічний реактор з мішалкою з ультрафільтрацією, і/або безперервний колонковий реактор ідеального витиснення (Fernanda de Castilhos Corazza, Flávio Faria de Moraes, Gisella Maria Zanin and Ivo Neitzel, 2003, Optimal control in fed-batch reactor for the cellobiose hydrolysis, Acta Scientiarum. Technology 25: 33-38; Gusakov, A. V., and Sinitsyn, A. P., 1985, Kinetics of the enzymatic hydrolysis of cellulose: 1. A mathematical model for a batch reactor process, Enz. Microb. Technol. 7: 346-352), реактор здрібнювання (Ryu, S. K., and Lee, J. M., 1983, Bioconversion of waste cellulose by using an attrition bioreactor, Biotechnol. Bioeng. 25: 53-65), або реактор з інтенсивним перемішуванням, індукованим електромагнітним полем (Gusakov, A. V., Sinitsyn, A. P., Davydkin, I. Y., Davydkin, V. Y., Protas, O. V., 1996, Enhancement of enzymatic cellulose hydrolysis using a novel type of bioreactor with intensive stirring induced by electromagnetic field, Appl. Biochem. Biotechnol. 56: 141153). Додаткові типи реактору включають: киплячий шар, бланкет з висхідним потоком, іммобілізований і реактори типу екструдер для гідролізу і/або ферментації. Попередня обробка. В здійсненні способів даного винаходу, будь-який процес попередньої обробки, відомий в даній галузі, можна використати, щоб зруйнувати компоненти стінки рослинної клітини. Целюлозний матеріал можна також піддати попередньому вимочуванню, зволоженню або створенню необхідних умов до попередньої обробки, використовуючи способи, відомі в даній галузі. Традиційні попередні обробки включають, але не обмежуються, попередньою обробкою парою (з або без вибуху), попередню обробку розведеною кислотою, попередню обробку гарячою водою, попередню обробку вапном, мокре окислення, мокрий вибух, аміачний вибух волокна, попередню обробку органічним розчинником і біологічну попередню обробку. Додаткові попередні обробки включають попередні обробки ультразвуком, електропорацію, мікроволни, обробки надкритичним CO2, надкритичним H2O і аміачну перколяцію. 27 UA 102832 C2 5 10 15 20 25 30 35 40 45 50 55 60 Целюлозний матеріал можна попередньо обробити перед гідролізом і/або ферментацією. Попередню обробку переважно здійснюють перед гідролізом. Альтернативно попередню обробку можна провести одночасно з гідролізом, як одночасно з обробкою целюлозного матеріалу з одним або більше целюлолітичними ферментами, або іншими сполуками з ферментною активністю, щоб звільнити цукри, що здатні до бродіння, такі як глюкоза і/або мальтоза. У більшості випадків етап попередньої обробки сам приводить до деякого перетворення біомаси до цукрів, здатних до бродіння (навіть у відсутності ферментів). Попередня обробка парою. В попередній обробці парою целюлозний матеріал нагрівають, щоб зруйнувати компоненти стінки рослинної клітини, включаючи лігнін, геміцелюлозу і целюлозу, щоб зробити целюлозні і інші фракції, наприклад, гемiцелюлазу, доступними для ферментів. Лігноцелюлозний матеріал пропускають до або через реакційний резервуар, де пару накачують, щоб підвищити температуру до необхідної температури і тиску, і утримують там протягом бажаного реакційного часу. Попередня обробка парою переважно здійснюється при 140-230 °C, більш переважно 160-200 °C, і найбільш переважно 170-190 °C, де оптимальний температурний діапазон залежить від будь-якого додавання хімічного каталізатору. Час перебування для попередньої обробки парою складає переважно 1-15 хвилин, більш переважно 3-12 хвилини, і найбільш переважно 4-10 хвилин, де оптимальний час перебування залежить від температурного діапазону і будь-якого додавання хімічного каталізатору. Попередня обробка парою передбачає завантаження з відносно високим вмістом твердої фази, так що целюлозний матеріал є звичайно сирий під час попередньої обробки. Попередню обробку парою часто комбінують з вибуховим розвантаженням матеріалу після попередньої обробки, яке відоме як паровий вибух, а саме, швидке скипання до атмосферного тиску і турбулентної течії матеріалу, щоб підвищити доступну площу поверхні за допомогою фрагментaції (Duff and Murray, 1996, Bioresource Technology 855: 1-33; Galbe and Zacchi, 2002, Appl. Microbiol. Biotechnol. 59: 618-628; номер заявки патенту США 20020164730). Під час попередньої обробки парою, геміцелюлознї ацетильнї групи розщеплюються, і отримана кислота автокаталізує частковий гідроліз геміцелюлози до моносахаридів і олігосахаридів. Лігнін видаляють тільки до обмеженої міри. Каталізатор, такий як H2SO4 або SO2 (типово 0,3-3 % вага/вага) часто додають до попередньої обробки парою, що знижує час і температуру, підвищує відновлення і покращує ферментний гідроліз (Ballesteros et al., 2006, Appl. Biochem. Biotechnol. 129-132: 496-508; Varga et al., 2004, Appl. Biochem. Biotechnol. 113-116: 509-523; Sassner et al., 2006, Enzyme Microb. Technol. 39: 756-762). Хімічна попередня обробка: Вираз "хімічна обробка" стосується будь-якої хімічної попередньої обробки, що стимулює відділення і/або звільнення целюлози, геміцелюлози і/або лігніну. Приклади придатних способів хімічної попередньої обробки включають, наприклад, попередню обробку розведеною кислотою, попередню обробку вапном, мокре окислення, аміачний вибух волокна/заморозку (AFEX), аміачна перколяція (APR) і попередні обробки органічним розчинником. В попередній обробці розведеною кислотою целюлозний матеріал змішують з розведеною кислотою, типово H2SO4, і водою, щоб утворилась завись, підігріта парою до бажаної температури, і після часу перебування скипіла до атмосферного тиску. Попередню обробку розведеною кислотою можна здійснити певною кількістю конструкцій реакторів, наприклад, реактори ідеального витиснення, реактори з протитоком або безперервні реактори ідеального витиснення з підкладкою стягування (Duff and Murray, 1996, supra; Schell et al., 2004, Bioresource Technol. 91: 179-188; Lee et al., 1999, Adv. Biochem. Eng. Biotechnol. 65: 93-115). Декілька способів попередньої обробки в лужних середовищах можна також використовувати. Ці лужні попередні обробки включають, але не обмежуються, попередню обробку вапном, мокре окислення, аміачну перколяцію (APR) і аміачний вибух волокна/заморозку (AFEX). Попередню обробку вапном здійснюють з карбонатом кальцію, гідроксидом натрію або аміаком при низьких температурах 85-150ºC і часах перебування від 1 години до декількох днів (Wyman et al., 2005, Bioresource Technol. 96: 1959-1966; Mosier et al., 2005, Bioresource Technol. 96: 673-686). WO 2006/110891, WO 2006/11899, WO 2006/11900 і WO 2006/110901 розкривають способи попередньої обробки з використанням аміаку. Мокре окислення являє собою термальну попередню обробку, яку здійснюють типово при 180-200ºC протягом 5-15 хвилин з додаванням окислювального агенту, такого як пероксид водню або при підвищеному тиску водню (Schmidt and Thomsen, 1998, Bioresource Technol. 64: 139-151; Palonen et al., 2004, Appl. Biochem. Biotechnol. 117: 1-17; Varga et al., 2004, Biotechnol. Bioeng. 88: 567-574; Martin et al., 2006, J. Chem. Technol. Biotechnol. 81: 1669-1677). Попередню 28
ДивитисяДодаткова інформація
Назва патенту англійськоюPolypeptide with cellulose-decomposing enhanced capacity and polynucleotide coding it
Автори англійськоюHarris, Paul, Maiyuran, Suchindra, Brown, Kimberly
Назва патенту російськоюПолипептид с целлюлозолитической усиливающей активностью полинуклеотид кодирующий его
Автори російськоюХаррис Пол, Маиюран Сучиндра, Браун Кимберли
МПК / Мітки
МПК: C12N 1/15, C12N 1/21, C12N 5/10, C12N 9/24, C12N 15/56, C12P 19/14
Мітки: кодує, активністю, полінуклеотид, поліпептид, підсилюючою, целюлолітичною
Код посилання
<a href="https://ua.patents.su/150-102832-polipeptid-z-celyulolitichnoyu-pidsilyuyuchoyu-aktivnistyu-ta-polinukleotid-shho-jjogo-kodueh.html" target="_blank" rel="follow" title="База патентів України">Поліпептид з целюлолітичною підсилюючою активністю та полінуклеотид, що його кодує</a>
Попередній патент: Присадка для гідравлічного в’яжучого
Наступний патент: Фільтр-прес
Випадковий патент: Вузол подачі тіста формувальної машини