Спосіб одержання c2f5-заміщених піразолів
Формула / Реферат
1. Спосіб одержання С2F5-заміщених піразолів загальної формули (І):
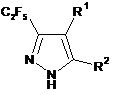 , (І)
, (І)
в якій R1 являє собою Н, С1-С6алкіл, С1-С6галоалкіл, COOR3, COR3, СОС1-С6галоалкіл, Si(C1-C6алкіл)3;
R2 являє собою С1-С6алкіл, С1-С6галоалкіл, COOR3, COR3, CONHR3, P(O)R32, Si(С1-С6алкіл)3, С2-С9гетероарил;
де R3 являє собою незалежно С1-С6алкіл, С3-С10циклоалкіл, С6-С10арил або С2-С9гетероарил, кожен з яких необов'язково заміщений одним або більшою кількість замісників, незалежно вибраних з С1-С6алкілу, С2-С6алкенілу, С2-С6алкінілу, С1-С6алкокси, С3-С10циклоалкілу, С6-С10арилу, С2-С9гетероарилу, галогену, ОН, SH, галоген, -CN, NO2, -NHC1-C6алкілу, -N(C1-C6алкіл)2, -CONHС1-С6алкілу, -СОС1-С6алкілу, -СООС1-С6алкілу, -SС1-С6алкілу, -SOС1-С6алкілу або -SO2С1-С6алкілу;
в якому алкіни загальної формули (II):
![]() , (II)
, (II)
в якій R1 та R2 є такими як визначено вище;
вводять в реакцію з C2F5CHN2, що одержують in situ реакцією C2F5CH2NH2 з NaNO2,
з одержанням C2F5-заміщених піразолів загальної формули (І).
2. Спосіб за п. 1, який відрізняється тим, що C2F5CH2NH2 використовують у формі гідрохлориду і реакцію одержання C2F5CHN2 проводять у суміші метиленхлориду та води.
Текст
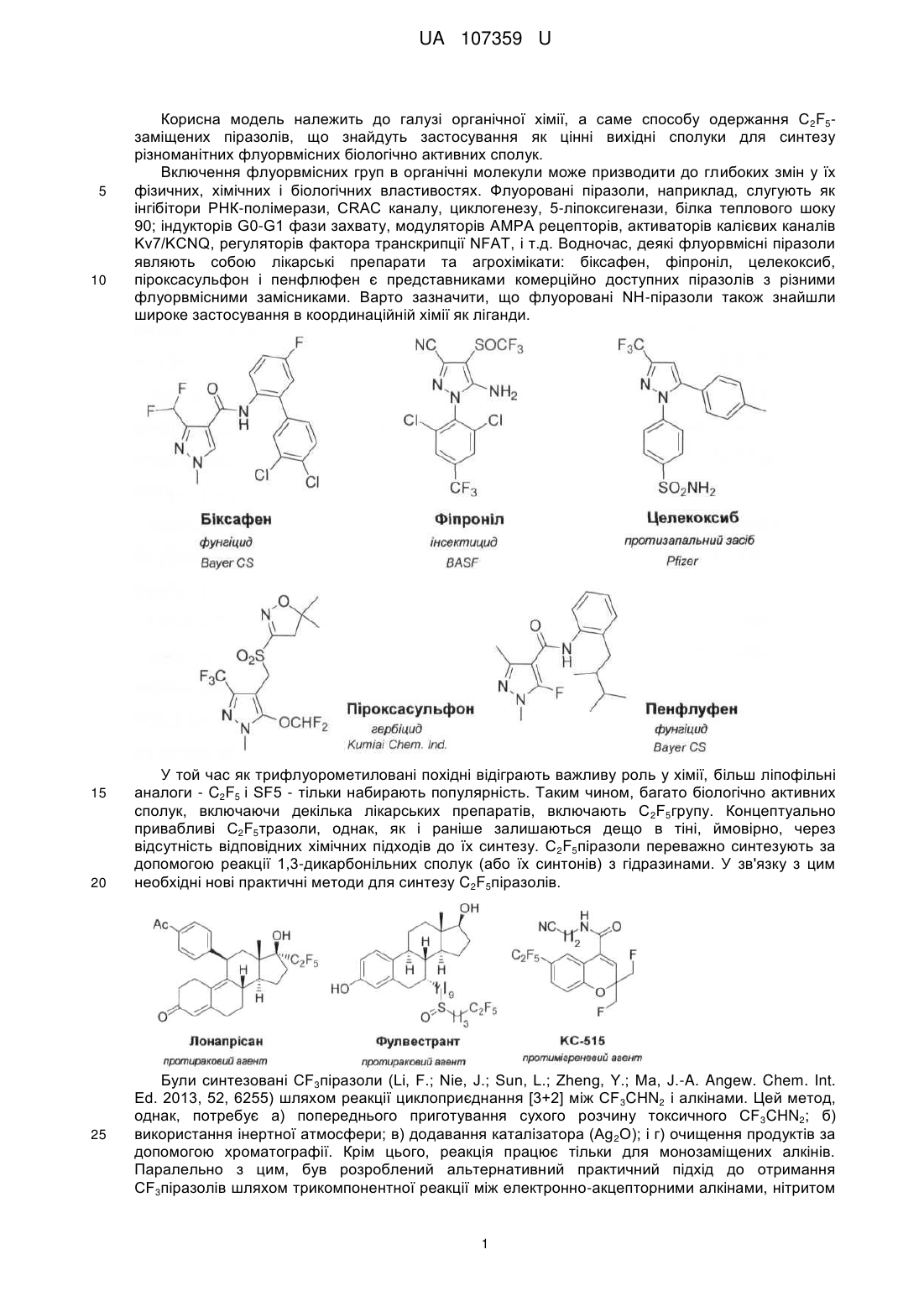
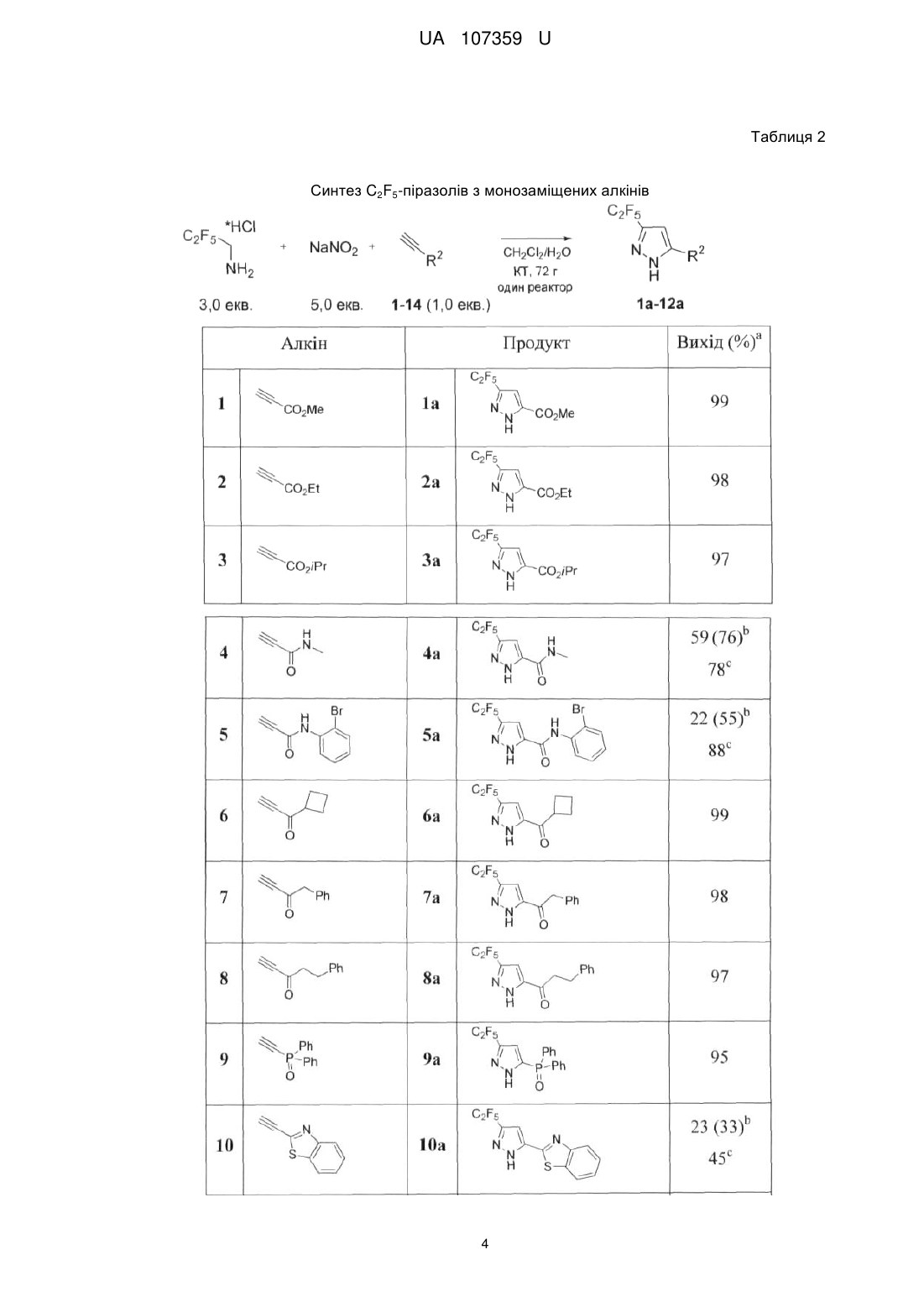
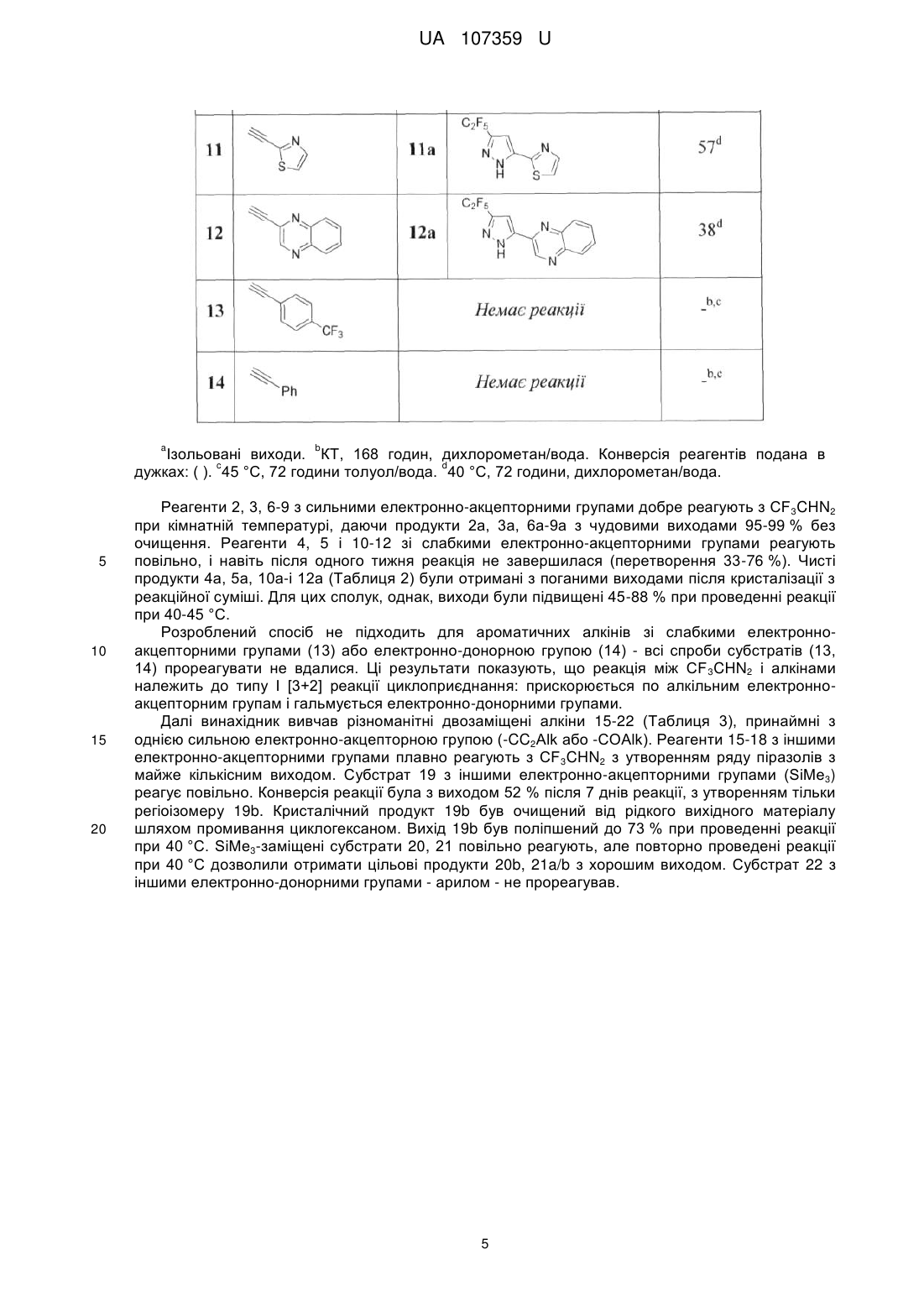
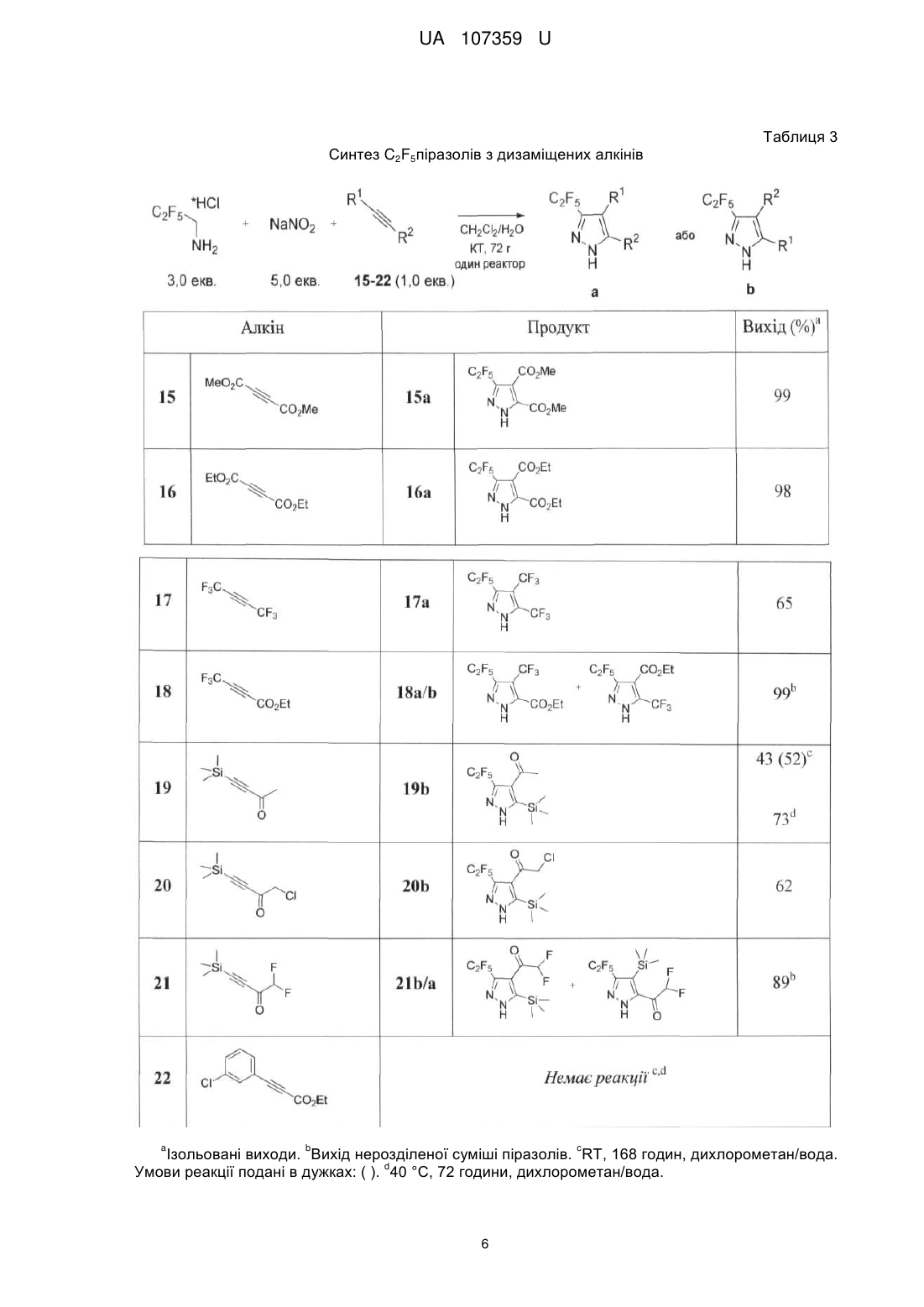
Реферат: Спосіб одержання С2F5-заміщених піразолів, що знайдуть застосування як цінні вихідні сполуки для синтезу різноманітних флуорвмісних біологічно активних сполук, в якому як реагент використовується C2F5CHN2. UA 107359 U (54) СПОСІБ ОДЕРЖАННЯ C2F5-ЗАМІЩЕНИХ ПІРАЗОЛІВ UA 107359 U UA 107359 U 5 10 15 20 25 Корисна модель належить до галузі органічної хімії, а саме способу одержання C2F5заміщених піразолів, що знайдуть застосування як цінні вихідні сполуки для синтезу різноманітних флуорвмісних біологічно активних сполук. Включення флуорвмісних груп в органічні молекули може призводити до глибоких змін у їх фізичних, хімічних і біологічних властивостях. Флуоровані піразоли, наприклад, слугують як інгібітори РНК-полімерази, CRAC каналу, циклогенезу, 5-ліпоксигенази, білка теплового шоку 90; індукторів G0-G1 фази захвату, модуляторів АМРА рецепторів, активаторів калієвих каналів Kv7/KCNQ, регуляторів фактора транскрипції NFAT, і т.д. Водночас, деякі флуорвмісні піразоли являють собою лікарські препарати та агрохімікати: біксафен, фіпроніл, целекоксиб, піроксасульфон і пенфлюфен є представниками комерційно доступних піразолів з різними флуорвмісними замісниками. Варто зазначити, що флуоровані NH-піразоли також знайшли широке застосування в координаційній хімії як ліганди. У той час як трифлуорометиловані похідні відіграють важливу роль у хімії, більш ліпофільні аналоги - C2F5 і SF5 - тільки набирають популярність. Таким чином, багато біологічно активних сполук, включаючи декілька лікарських препаратів, включають C 2F5групу. Концептуально привабливі C2F5тразоли, однак, як і раніше залишаються дещо в тіні, ймовірно, через відсутність відповідних хімічних підходів до їх синтезу. C 2F5піразоли переважно синтезують за допомогою реакції 1,3-дикарбонільних сполук (або їх синтонів) з гідразинами. У зв'язку з цим необхідні нові практичні методи для синтезу C2F5піразолів. Були синтезовані СF3піразоли (Li, F.; Nie, J.; Sun, L.; Zheng, Y.; Ma, J.-A. Angew. Chem. Int. Ed. 2013, 52, 6255) шляхом реакції циклоприєднання [3+2] між CF 3CHN2 і алкінами. Цей метод, однак, потребує а) попереднього приготування сухого розчину токсичного CF3CHN2; б) використання інертної атмосфери; в) додавання каталізатора (Ag 2O); і г) очищення продуктів за допомогою хроматографії. Крім цього, реакція працює тільки для монозаміщених алкінів. Паралельно з цим, був розроблений альтернативний практичний підхід до отримання СF3піразолів шляхом трикомпонентної реакції між електронно-акцепторними алкінами, нітритом 1 UA 107359 U 5 10 натрію і гідрохлоридом трифлуоретиламіну. Цей метод підходить як для моно-, так і для дизаміщених алкінів. Через подібність електронних властивостей CF3- та C2F5груп, було припущено, що реакція між C2F5CHN2 та електронно-акцепторними алкінами може привести до утворення Отже, існує потреба в нових реагентах і реакції синтезу C 2F5-заміщених піразолів. Існуюча потреба вирішується за допомогою розробки способу одержання C2F5-заміщених піразолів, в якому на відміну від відомого CF 3CHN2 як флуорвмісний реагент використовується C2F5CHN2. Піразоловий мотив відіграє важливу роль у матеріалознавстві, органічному синтезі та медичних дослідженнях. У цьому контексті, винахідником було синтезовано новий хімічний реагент C2F5CHN2 з C2F5CHNH2*HCl і нітриту натрію, та розроблено спосіб синтезу C 2F5заміщених піразолів. Отже об'єктом корисної моделі є спосіб одержання C 2F5-заміщених піразолів загальної формули (І): R C2 F5 1 N R N H 15 20 25 , (І) 1 3 3 в якій R являє собою Н, С1-С6алкіл, С1-С6галоалкіл, COOR , COR , СОС1-С6галоалкіл, Si(С1С6алкіл)3; 2 3 3 3 3 R являє собою С1-С6алкіл, С1-С6галоалкіл, COOR , COR , CONHR , P(O)R 2, Si(С1-С6 алкіл)3, С2-С9гетероарил; 3 де R являє собою незалежно С1-С6алкіл, С3-С10циклоалкіл, С6-С10арил або С2С9гетероарил, кожен з яких необов'язково заміщений одним або більшою кількість замісників незалежно вибраних з С1-С6алкілу, С2-С6алкенілу, С2-С6алкінілу, С1-С6алкокси, С3С10циклоалкілу, С6-С10арилу, С2-С9гетероарилу, галогену, ОН, SH, галоген, -CN, NO2, -NHС1С6алкілу, -N(С1-С6алкіл)2, -CONHС1-С6алкілу, -СОС1-С6алкілу, -СООС1-С6алкілу, -SС1-С6алкілу, SO С1-С6алкілу або -SO2С1-С6алкілу; в якому алкіни загальної формули (II): R1 30 35 40 45 50 2 C C R2 , (II) 1 2 в якій R та R є такими як визначено вище; вводять в реакцію з C2F5CHN2, що одержують in situ реакцією C2F5CH2NH2 з NaNO2, з одержанням C2F5-заміщених піразолів загальної формули (І). В запропонованому способі C2F5CH2NH2 використовують у формі гідрохлориду і реакцію одержання C2F5CHN2 проводять у суміші метиленхлориду та води. Термін "С1-С6алкіл" стосується алкільного радикалу, що має від одного до шести атомів вуглецю, і має нерозгалужену або розгалужену будову. Прикладами алкільних груп є, але не обмежується, метил, етил, пропіл, ізопропіл, бутил, ізобутил, втор-бутил, трет-бутил, пентил, 2пентил, 3-пентил, ізопентил, неопентил, (R)-2-метилбутил, (с)-2-метилбутил, 3-метилбутил, 2,3диметилпропіл, 2,3-диметилбутил, гексил і т.і. Термін "С1-С6алкокси", стосується алкокси радикалу, що має від одного до шести атомів вуглецю, що мають нерозгалужену або розгалужену будову. Алкоксигрупами є, але не обмежується, метокси, етокси, пропокси, ізопропокси, бутокси, гексилокси і т.і. Термін "С3-С10циклоалкіл", як тут використовується, стосується моно, конденсованих або місткованих біциклічних або трициклічних карбоциклічних кілець, що містять, в деяких втіленнях, від трьох до десяти атомів вуглецю. Як тут використовується, циклоалкільні кільця можуть необов'язково містити один або два подвійні зв'язки. Термін "циклоалкіл" також включає спіроциклоалкільні групи, включаючи поліциклічні системи, зв'язані через один атом. Циклоалкільними групами є, але не обмежується, циклопропіл, циклобутил, циклопентил, циклогексил, циклогептил, циклопентеніл, циклогексеніл, біцикло[2.2.1]гептаніл, біцикло[3.2.1]октаніл, біцикло[5.2.0]нонаніл, адамантил і т.і. Термін "С6-С10арил", як тут використовується, стосується групи, що походить від ароматичного вуглеводню, що містить шести до десяти атомів вуглецю. Прикладами таких груп є, але не обмежується, феніл і нафтил. Термін "арил" також включає конденсовані поліциклічні ароматичні системи, в яких ароматичне кільце є конденсованим з одним або більше кілець. Прикладами є, але не обмежується, 1-нафтил, 2-нафтил, 1-антрацил і 2-антрацил. Також включеними в межі рамок терміну "арил", як тут використовується, є група, в якій ароматичне кільце є конденсованим з одним або більше неароматичних кілець, таким як інданіл, 2 UA 107359 U 5 10 15 20 фенантридиніл або тетрагідронафтил, де радикал або точка приєднання знаходиться на ароматичному кільці. Термін "С2-С9гетероарил, як тут використовується, стосується ароматичної моноциклічної або біциклічної гетероциклічної групи, що має загалом від 5 до 9 атомів в кільці, і що містить від 2 до 9 атомів вуглецю і від одного до чотирьох гетероатомів, що незалежно вибирають з азоту, кисню і сірки, за умови, що кільце згаданої групи не містить два сусідні атоми кисню або два сусідні атоми сірки. Гетероарильні групи є бензо-конденсованими циклічними системами. Прикладами гетероарильних груп є, але не обмежується, піроліл, фурил, тієніл, імідазоліл, піразоліл, оксазоліл, ізоксазоліл, ізотіазоліл, триазоліл, оксадіазоліл, фуразаніл, тіадіазоліл, тіазоліл, тетразоліл, піридиніл, піразиніл, піримідил, піридазиніл, триазиніл, індоліл, ізоіндоліл, індолізиніл, бензофураніл, бензотіофеніл, індазоліл, бензімідазоліл, бензоксазоліл, фуро[3,2-b] піридиніл, бензотіазоліл, бензофуразаніл, пуриніл, хінолініл, ізохінолініл, хіназолініл, хіноксалініл, нафтиридиніл, цинолініл, фталазиніл, піридо[3,4-сі]піримідил, птеридиніл і т.і. Щоб ретельно дослідити запропоновану реакцію, було вибрано простий монозаміщений алкін 1 з однією електронно-акцепторною СO2Мегрупою. Суміш алкіну 1 C2F5CH2NH2*HCl (1,0 екв.) та NaNO2 (2,0 екв.) у воді/дихлорметані перемішували при кімнатній температурі. Через 10 хвилин органічний шар ставав жовтим, що вказує на утворення C 2F5CHN2. Через 24 години реакційна конверсія складала 55 %, не спостерігалося жодних побічних продуктів. Оптимізація умов реакції - C2F5CH2NH2*НСl (3,0 екв.), NaNO2 (5,0 екв.), 72 години - дозволила досягти повної конверсії реагентів (Таблиця 1, експеримент 6). Дана стандартна процедура дозволила отримати піразол 1а у вигляді білої кристалічної речовини з 99 %-им виходом без очищення (ні кристалізації, ні хроматографії). Реакція не вимагає інертної атмосфери і була проведена на повітрі. Таблиця 1. Оптимізація умов реакції. Таблиця 1 Оптимізація умов реакції 25 Маючи ці обнадійливі результати з піразолом 1а, було вирішено вивчити сферу застосування реакції. По-перше, винахідник перевірив різні монозаміщені алкіни 2-14 при уже оптимізованих умовах реакції (Таблиця 2). 3 UA 107359 U Таблиця 2 Синтез C2F5-піразолів з монозаміщених алкінів 4 UA 107359 U a b Ізольовані виходи. КТ, 168 годин, дихлорометан/вода. Конверсія реагентів подана в c d дужках: ( ). 45 °C, 72 години толуол/вода. 40 °C, 72 години, дихлорометан/вода. 5 10 15 20 Реагенти 2, 3, 6-9 з сильними електронно-акцепторними групами добре реагують з CF 3CHN2 при кімнатній температурі, даючи продукти 2а, 3а, 6а-9а з чудовими виходами 95-99 % без очищення. Реагенти 4, 5 і 10-12 зі слабкими електронно-акцепторними групами реагують повільно, і навіть після одного тижня реакція не завершилася (перетворення 33-76 %). Чисті продукти 4а, 5а, 10а-і 12а (Таблиця 2) були отримані з поганими виходами після кристалізації з реакційної суміші. Для цих сполук, однак, виходи були підвищені 45-88 % при проведенні реакції при 40-45 °C. Розроблений спосіб не підходить для ароматичних алкінів зі слабкими електронноакцепторними групами (13) або електронно-донорною групою (14) - всі спроби субстратів (13, 14) прореагувати не вдалися. Ці результати показують, що реакція між CF 3CHN2 і алкінами належить до типу І [3+2] реакції циклоприєднання: прискорюється по алкільним електронноакцепторним групам і гальмується електронно-донорними групами. Далі винахідник вивчав різноманітні двозаміщені алкіни 15-22 (Таблиця 3), принаймні з однією сильною електронно-акцепторною групою (-CC2Alk або -COAlk). Реагенти 15-18 з іншими електронно-акцепторними групами плавно реагують з CF 3CHN2 з утворенням ряду піразолів з майже кількісним виходом. Субстрат 19 з іншими електронно-акцепторними групами (SіМе3) реагує повільно. Конверсія реакції була з виходом 52 % після 7 днів реакції, з утворенням тільки регіоізомеру 19b. Кристалічний продукт 19b був очищений від рідкого вихідного матеріалу шляхом промивання циклогексаном. Вихід 19b був поліпшений до 73 % при проведенні реакції при 40 °C. SіМе3-заміщені субстрати 20, 21 повільно реагують, але повторно проведені реакції при 40 °C дозволили отримати цільові продукти 20b, 21a/b з хорошим виходом. Субстрат 22 з іншими електронно-донорними групами - арилом - не прореагував. 5 UA 107359 U Таблиця 3 Синтез C2F5піразолів з дизаміщених алкінів a b c Ізольовані виходи. Вихід нерозділеної суміші піразолів. RT, 168 годин, дихлорометан/вода. d Умови реакції подані в дужках: ( ). 40 °C, 72 години, дихлорометан/вода. 6 UA 107359 U 5 10 15 20 25 30 Монозаміщені алкіни 1-12 регіоселективно взаємодіяли з C2F5CHN2 з утворенням тільки 3,5дизаміщених піразолів. Спостерігалося формування 3,4-дизаміщених ізомерів. Дизаміщені алкіни вели себе інакше через електронні і стеричні ефекти. Відповідно до правил орбітальної симетрії - реакція циклоприєднання [3+2] повинна вести до утворення піразолів з групою C2F5 і електронно-акцепторними групами на 3,5-позиції. Продукт 18 отримують у вигляді суміші ізомерів, оскільки C2F5 і CO2Et мають подібну електронноакцепторну природу. Навпаки, реакція алкінів 19, що має електронно-акцепторні (-СОМе) і електронно-донорні (-SіМе3) замісники веде до утворення ізомеру 19b з -SіМе3 у 4-му положенні, з порушенням правил орбітальної симетрії. Імовірно, стеричні утруднення між об'ємними C 2F5- і SіМе3-групами змушують реакцію йти у реверсній регіоселективності - стеричний ефект є більш виразним, ніж електронний ефект. Заміщення одного атому водню в алкіні 19 до більш громіздкого атому хлору - алкін 20 призвело до отримання суміші продуктів 20b/а = 4,0/1,0 (чистий продукт 20b отримували кристалізацією). Заміна двох атомів водню в 20 на громіздкі атоми флуору - алкін 21 - привела до утворення суміші 21b/а = 2,6/1,0. У сполуках 13-15 стеричний ефект компенсував електронний, але вплив стеричного ефекту зменшується зі збільшенням розміру замісника, СН3СО: (19), СІСН2СО (20), F2CHCO (21), збільшуючи відсоток вмісту ізомерів (0 % 19b, 20 % 20b, 28 % 21b). Розробивши надійний практичний спосіб для отримання C 2F5піразолів, винахідник також наводить практичний потенціал одержаних сполук. По-перше, стандартне розщеплення TMSгрупи в 19b призвело до отримання кетону 23. Ця стратегія дає можливість отримання 3,4дизаміщених піразолів з TMS-похідних, в той час як пряма реакція монозаміщених алкінів 1-12 з C2F5CHN2 дає 3,5-дизаміщені піразоли. Крім цього, лужний гідроліз естерної групи в 1а дає кислоту 25 - новий цінний будівельний блок для медичної хімії: багато біологічно активних сполук, в тому числі інсектицидний агент DP-23, містять залишки СF3-аналога 25. Нарешті, алкілування піразолу 1a Mel дає продукт 26 з виходом 69 % після колонкової хроматографії. Основний гідроліз естерної групи в 26 дає кислоту 27 з істинним практичним потенціалом для фармацевтичного застосування: відповідні СF 3-кислоти утворюють відомий противірусний агент AS-136A. 7 UA 107359 U 5 10 15 20 25 30 35 Новий підхід до C2F5-заміщених піразолів був розроблений на основі трикомпонентної реакції між C2F5CH2NH2*HCl, NaNO2 та електронно-акцепторними алкінами. Цей спосіб дуже практичний: він не вимагає а) попередньої ізоляції токсичних проміжних діазосполук; б) інертної атмосфери (реакцію проводять на повітрі); в) будь-яких каталізаторів; г) хроматографічної очистки продуктів. Крім цього, реакція підходить як для моно-, так і для дизаміщених алкінів і дозволяє отримання 3,5 і 3,4-дизаміщених піразолів (через SіМе3-алкіни). Тому, враховуючи важливість флуорованих піразолів, можна припустити, що вчені скоро будуть використовувати цю надзвичайно корисну практичну реакцію в розробці ліків та в агрохімії (де є потреба в надійних простих реакціях). Експериментальна частина. Дихлометан очищали дистиляцією. Всі реагенти були отримані з Enamine Ltd. Температури 1 19 13 плавлення не коригували. Н-, F-, С-ЯМР-спектри знімали при 499,9 МГц, 470,3 МГц та 124,9 1 13 МГц. Хімічні зсуви наведені в мільйонних долях щодо тетраметилсилану Me 4Si ( Н, С) або 19 CFCl3 ( F) використовуючи дейтерій в якості внутрішніх стандартів. МС-аналіз проводили на приладі РХМС з хімічною іонізацією. Загальна методика: До перемішуваної суспензії C2F5CH2NH2*НСl (90 мг, 0,48 ммоль, 3,0 екв.) в СН2Сl2 (4,0 мл)/вода (0,2 мл) додавали нітрит натрію (54 мг, 0,78 ммоль, 5,0 екв.) та алкін (0,16 ммоль, 1,0 екв.). Реакційну суміш енергійно перемішували 72 години при кімнатній температурі. Додавали воду (1,0 мл) і СН2Сl2 (3 мл). Органічний шар відокремлювали. Водний шар промивали СН2Сl2 (2 × 3 мл). Об'єднані органічні шари сушили над Na2SO4 і випаровували у вакуумі з отриманням чистого продукту. Метил 3-(пентафлуоретил)-1H-піразол-5-карбоксилат (1а) Сполуку 1а отримували у формі білої твердої речовини (39 мг, 99 %), слідуючи загальній методиці. Тпл. = 79-80 °C. 1 Н ЯМР (500 МГц; CDCl3; Me4Si), : 11,81 (ш с, 1H, NH), 7,11 (с, 1H, CH), 3,96 (c, 3H, CH3). 13 1 C ЯМР (125 МГц; CDCl3; Me4Si), : 159,0 (c, CO), 142,8 (ш c, С), 135,5 (ш с, С, 118,6 (kт, JC2 1 2 F=285,0 Гц, JC-F=36,3 Гц, CF2CF3), 110,2 (та, JC-F =250,0 Гц, JC-F=38,9 Гц, CF 2CF3), 108,6 (c, CH), 52,7 (c, CH3). 19 F ЯМР (375 МГц; CDCl3; CFCl3), : -85,1 (c, 3F, CF2CF3), -113,8 (c, 2F, CF2CF3). + MC (XI): m/z (%) = 245 [M+1] . Аналітичні розрахунки для C7H5F5N2O2 С, 34,44; H, 2,06; N, 11,48. Знайдено: С, 34,14; Н, 2,34; N, 11,68. Етил 3-(пентафлуоретил)-1H-піразол-5-карбоксилат (2а) Сполуку 2а отримували у формі білої твердої речовини (41 мг, 98 %), слідуючи загальній методиці. Тпл. = 90 °C. 8 UA 107359 U Н ЯМР (500 МГц; CDCI3; Me4Si), : 11,89 (ш с, 1H, NН), 7,13 (с, 1H, CH), 4,45 (к, J=7,0 Гц, 2H, СН2СН3), 1,42 (т, J=7,0 Гц, 3Н, СН2СН3). 13 1 С ЯМР (125 МГц; CDCI3; Me4Si), : 158,3 (с, СО), 142,2 (ш с, С), 135,4 (ш с, С), 118,3 (кт, JC2 1 2 F=285,3 Гц, JC-F=36,3 Гц, CF2CF3), 109,8 (тк, JC-F=250,0 Гц, JC-F=38,0 Гц, CF2CF3), 108,2 (с, СН), 61,8 (s. OCH2), 13,7 (с, СН3). 19 3 3 F ЯМР (375 МГц; CDCI3; CFCl3), : -85,1 (т, J(F,F) = 3,8 Гц, 3F, CF2CF3), -113,8 (к, J(F, F) 3,8 Гц, 2F, CF2CF3). + MC (XI): m/z (%) = 259 [M+1] . Аналітичні розрахунки для C8H7F5N2O2: С, 37,22; Н, 2,73; N, 10,85. Знайдено: С, 37,51; Н, 3,02; N, 10,74. Ізопропіл 3-(пентафлуоретил)-1Н-піразол-5-карбоксилат (3а) Сполуку 3а отримували у формі білої твердої речовини (42 мг, 97 %), слідуючи загальній методиці. Тпл. = 85-86 °C. 1 Н ЯМР (500 МГц; CDCI3; Me4Si), : 7,12 (с, 1H, CH), 5,31 (м, J=6,5 Гц, 1Н, СНСН3), 1,38 (6, J=6,5 Гц, 6Н, СНСН3). 13 2 С ЯМР (125 МГц; CDCI3; Me4Si), : 158,0 (с, CO), 141,8 (т, JC-F =30,0 Гц, CCF2), 135,7 (ш с, 1 2 1 2 С), 118,2 (кт, JC-F =285,3 Гц, JC-F=36,3 Гц, CF2CF3), 109,9 (тк, JC-F=250,0 Гц, JC-F=38,0 Гц, CF2CF3), 108,1 (с, СН), 70,1 (с, ОСH), 21,3 (с, СН3). 19 F ЯМР (375 МГц; CDCI3; CFCl3), : -85,1 (с, 3F, CF2CF3), -113,8 (с, 2F, CF2CF3). + МС (XI): m/z (%) = 273 [M+1] . Аналітичні розрахунки для C9H9F5N2O2: С, 39,72; Н, 3,33; N, 10,29. Знайдено: С, 39,59; Н, 3,61; N, 10,14. N-Метил-3-(пентафлуоретил)-1Н-піразол-5-карбоксамід (4а) Реакцію проводили в толуені/воді при 45 °C, слідуючи загальній методиці. Неочищений продукт промивали циклогексаном (0,3 мл), отримуючи чисту сполуку 4а у формі білої твердої речовини (30 мг, 78 %). Тпл. = 172-173 °C. 1 Н ЯМР (500 МГц; CD3OD; Me4Si), : 7,09 (с, 1Н, СН), 2,90 (с, 3Н, СН3). 13 С ЯМР (125 МГц; CD3OD; Me4Si), : 158,9 (с, СО), 144,3 (с, С), 140,8 (ш с, С), сигнали для CF2CF3 не отримані, 103,4 (с, СН), 24,5 (с, СН3). 19 F ЯМР (375 МГц; CD3OD; CFCI3), : -85,4 (ш с, 3F, CF2CF3), -113,3 (ш с, 2F, CF2CF3). + МС (XI): m/z (%) = 244 [М+1] . Аналітичні розрахунки для C7H6F5N3O: С, 34,58; Н, 2,49; N, 17,28. Знайдено: С, 34,25; Н, 2,77; N, 17,51. N-(2-бромофеніл)-3-(пентафлуоретил)-1H-піразол-5-карбоксамід (5а) Реакцію проводили в толуені/воді при 45 °C, слідуючи загальній методиці. Неочищений продукт промивали хлороформом (0,3 мл), отримуючи чисту сполуку 5а у формі білої твердої речовини (54 мг, 78 %). Тпл. = 152-153 °C. 1 3 Н ЯМР (500 МГц; ДМСО-d6; Me4Si), : 14,81 (с, 1H, NН), 10,37 (с, 1H, NН), 7,74 (д, J(H, H) = 3 3 10,5 Гц, 1Н, Ph), 7,57 (с, 1Н, CH), 7,52 (ш с, 1Н, Ph), 7,46 (т, JH-h=9,0 Гц, 1Н, Ph), 7,27 (t, J(H, H) = 9,0 Гц, 1Н, Ph). 13 2 C ЯМР (125 МГц; ДМСО-d6; Me4Si), : 156,7 (с, СО), 139,9 (т, JC-F=31,1 Гц, CCF2), 138,7 (с), сигнали для CF2CF3 не отримані, 135,2 (с), 133,0 (с), 129,4 (с), 128,8 (с), 128,4 (с), 120,9 (с), 105,5 (с, СН). 19 F ЯМР (375 МГц; ДМСО-d66; CFCl3), : -83,2 (ш с, 3F, CF2CF3), -110,6 (ш с, 2F, CF2CF3). + МС (XI): m/z (%) = 383, 385 [М+1] . Аналітичні розрахунки для C12H7BrF5N3O: С, 37,52; Н, 1,84; N, 10,94. Знайдено: С, 37,73; Н, 2,07; N, 10,58. Циклобутил [3-(пентафлуоретил)-1Н-піразол-5-іл]метанон (6а) Сполуку ба отримували у формі жовтої твердої речовини (43 мг, 99 %), слідуючи загальній методиці. Тпл. = 67-68 °C. 1 Н ЯМР (500 МГц; CDCI3; Me4Si), : 11,78 (ш с, 1Н, NН), 6,56 (с, 1H, СН), 3,82 (кв, J=7,0 Гц, 1H, СН), 2,46 (м, 2Н), 2,33 (м, 2Н), 2,14 (м, 1Н), 1,98 (м, 1Н). 13 2 С ЯМР (125 МГц; CDCI3; Me4Si), : 191,5 (с, СО), 142,2 ( JC-F=31,3 Гц, CCF2), 1 2 1 2 140.4 (ш с, С), 118,3 (кт, JC-F=285,3 Гц, JC-F=36,3 Гц, CF2CF3), 109,8 (тк, JC-F=250,0 Гц, JCF=38,0 Гц, CF2CF3), 107,2 (с, СН), 42,5 (s. СН), 24,3 (с, СН2), 17,8 (с, СН2). 19 F ЯМР (375 МГц; CDCI3; CFCl3), : -85,0 (ш с, 3F, CF2CF3), -113,5 (ш с, 2F, CF2CF3). + МС (XI): m/z (%) = 269 [М+1] . Аналітичні розрахунки для C10H9F5N2O: С, 44,79; Н, 3,38; N, 10,45. Знайдено: С, 45,02; Н, 3,61; N, 10,16. 1 5 10 15 20 25 30 35 40 45 50 55 9 UA 107359 U 5 10 15 20 25 30 35 40 45 50 55 1-[3-(Пентафлуоретил)-1H-піразол-5-іл]-2-фенілетанон (7а) Сполуку 7а отримували у формі білої твердої речовини (49 мг, 98 %), слідуючи загальній методиці. Тпл. = 75-76 °C. 1 Н ЯМР (500 МГц; CDCI3; Me4Si), : 11,67 (ш с, 1H, NН), 7,36-7,26 (м, 5Н, Ph), 7,04 (с, 1Н, СН),4,16(с, 2Н, CH2). 13 C ЯМР (125 МГц; CDCI3; Me4Si), : 187,8 (c, CO), 142,0 (т, J=28,7 Гц, CCF 2), 141,3 (c, С), 1 2 132,0 (c, Ph), 129,1 (c, Ph), 128,6 (c, Ph), 127,3 (c, Ph), 118,3 (кт, JC-F=285,0 Гц, JC-F=36,3 Гц, 1 2 CF2CF3), 109,7 (тк, JC-F=250,0 Гц, JC-F=38,9 Гц, CF2CF3), 108,9 (с, CH), 46,1 (c, CH2). 19 3 3 F ЯМР (375 МГц; CDCI3; CFCІ3), : -85,0 (т, J(F, F) = 3,8 Гц, 3F, CF2CF3), -113,5 (к, J(F, F) = 3,8 Гц, 2F, CF2CF3). + MC (XI): m/z (%) = 305 [M+1] . Аналітичні розрахунки для C13H9F5N2O: С, 51,33; H, 2,98; N, 9,21. Знайдено: С, 51,61; Н, 3,32; N, 9,07. 1-[3-(Пентафлуоретил)-1Н-піразол-5-іл]-3-феніл-1-пропанон (8а) Сполуку 8а отримували у формі білої твердої речовини (49 мг, 97 %), слідуючи загальній методиці. Тпл. = 57-58 °C. 1 Н ЯМР (500 МГц; CDCI3; Me4Si), : 7,33-7,21 (м, 5Н, Ph), 7,04 (с, 1H, СН), 4,16 (с, 2Н, CH 2), 3,25 (т, J=7,5 Гц, 2Н, СН2), 3,09 (т, J=7,5 Гц, 2Н, СН2). 13 С ЯМР (125 МГц; CDCI3; Me4Si), : 189,7 (с, СО), 142,1 (т, J=28,5 Гц, CCF2), 141,5 (с, С), 1 2 139,6 (с, Ph), 128,3 (с, Ph), 128,0 (с, Ph), 126,2 (с, Ph), 118,2 (кт, JC-F=281,0 Гц, JC-F=36,3 Гц, 1 2 CF2CF3), 109,5 (тк, JC-F=250,0 Гц, JC-F=38,9 Гц, CF2CF3), 107,4 (с, СН), 41,0(с, СН2),29,1(с, СН2). 19 F ЯМР (375 МГц; CDCI3; CFCІ3), : -85,1 (с, 3F, CF2CF3), -113,6 (с, CF2CF3). + МС (XI): т/г (%) = 319 [М+1] . Аналітичні розрахунки для C13H9F5N2O: С, 52,84; Н, 3,48; N, 8,80. Знайдено: С, 52,51; Н, 3,12; N, 8,92. 5-(Дифенілфосфорил)-3-(пентафлуоретил)-1Н-піразол (9а) Синтез був проведений, слідуючи загальній методиці. Протягом реакції продукт частково осаджували з реакційної суміші. Після трьох днів додавали воду (1,0 мл) та СН 2Сl2 (10 мл). Водну фазу відокремлювали та відокремлену органічну суспензію випарювали під тиском, отримуючи чистий продукт 9а у формі білої твердої речовини (59 мг, 95 %). Тпл. > 200 °C. 1 Н ЯМР (500 МГц; ДМСО-d6; Me4Si), : 14,81 (ш с, NH), 7,67 (ш с, 6Н, Ph+Ph), 7,59 (ш с, 4Н, Ph+Ph), 6,82 (с, 1Н, СН). 13 С ЯМР (125 МГц; ДМСО-d6; Me4Si), : 140,0 (ш с, С), сигнали NCP не показані, 132,7 (д, 4 1 3 J(C, P) = 2,5 Гц, СН, Ph), 131,4 (д, J(C, P) = 97,5 Гц, С, Ph), 131,2 (д, J(C, P) = 11,3 Гц, СН, Ph), 2 1 2 128,9 (д, J(C, P) = 12,5 Гц, СН, Ph), 118,5 (кт, JC-F=285,0 Гц, JC-F=36,3 Гц, CF2CF3), 112,0 (д, 2 1 2 J(C, P) = 16,3 Гц, СН), 110,6 (тк, JC-F=250,0 Гц, JC-F=38,9 Гц, CF2CF3). 19 F ЯМР (375 МГц ДМСО-d6; CFC13), : -83,7 (ш с, 3F, CF2CF3), -110,6 (ш с, 2F, CF2CF3). 31 Р ЯМР (202 МГц ДМСО-d6; Н3РО4), : 8,8 (ш с, Р). + МС (XI): m/z (%) = 387 [М+1] . Аналітичні розрахунки для C17H12F5N2OP: С, 52,86; Н, 3,13; N, 7,25. Знайдено: С, 53,02; Н, 3,41; N, 7,02. 2-[3-(Пентафлуоретил)-1H-піразол-5-іл-1,3-бензотіазол (10а) Реакцію проводили в толуені/воді при 45 °C, слідуючи загальній методиці. Неочищений продукт кристалізували з гексану (0,5 мл), отримуючи чисту сполуку 10а у формі сірої твердої речовини (24 мг, 45 %). Тпл. = 142-143 °C. 1 Н ЯМР (500 МГц; CDCI3; Me4Si), : 12,07 (ш с, 1H, NH), 8,11 (д, J=8,0 Гц, 1Н, СН), 7,96 (д, J=8,0 Гц, 1H, СН), 7,56 (т, J=8,0 Гц, 1H, СН), 7,48 (т, J=8,0 Гц, 1Н, СН), 7,13 (с, 1Н, СН). 13 C ЯМР (125 МГц; CDCI3; Me4Si), : 152,7 (с, NCS), 139,0 (ш с, С), 134,2 (с, СН), 126,6 (с, СН), 125,8 (с, СН), 123,1 (с, СН), 121,5 (с, СН), C2F5 не показано, 105,4 (с, СН). 19 F ЯМР (375 МГц; CDCI3; CFCl3), : -84,6 (с, 3F, CF2CF3), -113,4 (с, 2F, CF2CF3). + МС (XI): m/z (%) = 320 [M+1] . Аналітичні розрахунки для C12H6F5N3S: С, 45,15; Н, 1,89; N, 13,16; S, 10,04. Знайдено: С, 45,47; Н, 2,01; N, 12,88; S, 9,77. 2-[3-(Пентафлуоретил)-1H-піразол-5-іл]тіазол (11а) Реакцію проводили в дихлорометані/воді при 40 °C протягом 72 годин, слідуючи загальній методиці. Неочищений продукт промивали циклогексаном (0,2 мл), отримуючи чисту сполуку 11а у формі сірої твердої речовини (24 мг, 57 %). Тпл. = 127-128 °C. 1 Н ЯМР (500 МГц; ДМСО-d6; Me4Si), : 14,77 (ш с, 1H, NH), 8,01 (с, 1Н, СН), 7,92 (с, 1Н, СН), 7,34 (с, 1Н, СН). 10 UA 107359 U С ЯМР (125 МГц; ДМСО-d6; Me4Si), : 155,2 (ш с, NCS), 143,7 (с, СН), 140,5 (ш с, С), 138,4 (ш с, С), 121,9 (с, СН), 104,4 (с, СН), C2F5 не показано. 19 F ЯМР (375 МГц; ДМСО-d6; CFCl3), : -83,2 (с, 3F, CF2CF3), -110,6 (с, 2F, CF2CF3). + МС (XI): m/z (%) = 270 [M+1] . Аналітичні розрахунки для C8H4F5N3S: С, 35,69; Н, 1,50; N, 15,61; S, 11,91. Знайдено: С, 35,21; Н, 1,38; N, 15,29; S, 12,08. 2-[3-((Пентафлуоретил)-1H-піразол-5-іл]хіноксалін(12а) Реакцію проводили в дихлорометані/воді при 40 °C протягом 72 годин, слідуючи загальній методиці. Утворювався білий осад, який відфільтровували, висушували на повітрі, отримуючи чистий продукт 12а у формі білої твердої речовини (18 мг, 38 %). Тпл. > 200 °C. 1 Н ЯМР (500 МГц; ДМСО-d6; Me4Si), : 15,10-14,65 (ш с, 1Н, NH), 9,56 (с, 1H, СН), 8,14 (д, J=8,0 Гц, 2Н, СН), 7,91 (м, 2Н, СН), 7,99 (с, 1Н, СН). 13 С ЯМР (125 МГц; ДМСО-d6; Me4Si), : 143,7 (с), 142,5 (с), 141,5 (с), 141,1 (с), 131,2 (с), 130,6 (с), 129,2 (с), 128,9 (с), 105,6 (с), два mреm-С атоми та C2F5 не показані. 19 F ЯМР (375 МГц; ДМСО-d6; CFCl3), : -83,1 (с, 3F, CF2CF3), -110,5 (с, 2F, CF2CF3). + МС (XI): m/z (%) = 315 [М+1] . Аналітичні розрахунки для C13H7F5N4: С, 49,69; Н, 2,25; N, 17,83. Знайдено: С, 49,33; Н, 2,53; N, 17,99. Диметил 3-(пентафлуоретил)-1H-піразол-4,5-дикарбоксилат (15а) Сполуку 15а отримували у формі білої твердої речовини (48 мг, 99 %), слідуючи загальній методиці. Тпл. = 59-60 °C. 1 Н ЯМР (500 МГц; CDCI3; Me4Si), : 3,97 (с, 3Н, СН3), 3,95 (с, 3Н, СН3). 13 С ЯМР (125 МГц; CDCI3; Me4Si), : 162,0 (с, СО), 158,0 (с, СО), 139,9 (т, J=28,7 Гц, CCF2), 1 2 1 134,1 (с, C), 118,4 (кт, JC-F = 285,0 Гц, JC-F =36,3 Гц, CF2CF3), 117,1 (с, C), 110,1 (тк, JC-F=250,0 2 Гц, JC-F=38,9 Гц, CF2CF3), 53,3 (с, СН3), 53,2 (с, СН3). 19 3 3 F ЯМР (375 МГц; CDCI3; CFCI3), : -84,3 (т, J(F, F) = 3,8 Гц, 3F, CF2CF3), -112,3 (к, J(F, F) = 3,8 Гц, 2F, CF2CF3). + МС (XI): m/z (%) = 303 [M+1] . Аналітичні розрахунки для C9H7F5N2O4: С, 35,78; Н, 2,34; N, 9,27. Знайдено: С, 35,49; Н, 2,57; N, 9,10. Діетил 3-(пентафлуоретил)-1Н-піразол-4,5-дикарбоксилат (16а) Сполуку 16а отримували у формі безбарвної олії (52 мг, 98 %), слідуючи загальній методиці. 1 Н ЯМР (500 МГц; CDCI3; Me4Si), : 12,05 (ш с, 1H, NH), 4,41 (м, 4Н, СН2+СН2), 1,37 (м, 6Н, СН3+СН3). 13 С ЯМР (125 МГц; CDCI3; Me4Si), : 161,2 (с, СО), 157,2 (с, СО), 139,4 (т, J=28,7 Гц, CCF2), 1 2 1 133,7 (с, С), 117,9 (кт, JC-F=285,0 Гц, JC-F=36,3 Гц, CF2CF3), 117,1 (с, C), 109,9 (тк, JC-F=250,0 Гц, 2 JC-F=38,9 Гц, CF2CF3), 62,3 (с, ОСН2), 62,0 (с, ОСН2), 13,5 (с, СН3), 13,4 (с, СН3). 19 F ЯМР (375 МГц; CDCI3; CFC13), : -84,3 (с, 3F, CF2CF3), -112,2 (с, 2F, CF2CF3). + МС (XI): m/z (%) = 331 [М+1] . Аналітичні розрахунки для C11H11F5N2O4: С, 40,01; Н, 3,26; N, 8,48. Знайдено: С, 39,88; Н, 3,59; N, 8,35. 3-(Пентафлуоретил)-4,5-біс(трифлуорометил)-1H-піразол (17а) Одержували розчин бic-трифлуорометилацетилену (17) в сухому СН2Сl2 при -30 °C (колба 1). Додавали аліквоту розчину 17 (100 мг, 0,62 ммоль) в сухому СН 2Сl2 (приб. 5 мл) до попередньо отриманого розчину (колба 2) C2F5CHN2 (отриманий з C2F5CH2NH2*HCl (115 мг, 0,62 ммоль, 1,0 екв.)) в дихлорометані при -10 °C. Реакційну суміш додавали до розчину кімнатної температури та залишали на 12 години. Органічний шар відокремлювали, висушували над сульфатом натрію та концентрували під вакуумом, отримуючи піразол 17а (129 мг, 0,40 ммоль, 65 % вихід) у формі жовтуватої сполуки. Продукт є летким! 13 1 С ЯМР (125 МГц; ДМСО-d6; Me4Si), : 137,8-136,0 (ш с, CF3-C=N+C2F5-C=N), 119,4 (к, JC2 1 2 F=267,5 Гц, CF 3), 118,2 (к, JC-F=268,8 Гц, CF3), 117,7 (кт, JC-F=285,0 Гц, JC-F=36,3 Гц, CF2CF3), 2 1 2 112,3 (к, JC-f=41,3 Гц, CCF3), 109,0 (тк, JC-F=250,0 Гц, JC-F=38,9 Гц, CF2CF3). 19 F ЯМР (375 МГц; ДМСО-d6; CFCl3), 8: -55,7 (с, 3F, CF3), -61,4 (с, 3F, CF3), -84,2 (с, 3F, CF2CF3), -111,7 (с, 2F, CF2CF3). + МС (XI): m/z (%) = 321 [M-1] . Аналітичні розрахунки для C7HF11N2: С, 26,10; Н, 0,31; N, 8,70. Знайдено: С, 26,47; Н, 0,65; N, 9,03. Етил 3-(пентафлуоретил)-4-(трифлуорометил)-1Н-піразол-5-карбоксилат (18а), Етил 3-(пентафлуоретил)-5-(трифлуорометил)-1Н-піразол-4-карбоксилат(18b) 13 5 10 15 20 25 30 35 40 45 50 55 11 UA 107359 U 5 10 15 20 25 30 35 40 45 50 55 60 Сполуку 18 отримували як два нероздільні регіоізомери (2,6/1) у формі безбарвних олій (51 мг, 99 %), слідуючи загальній методиці. 1 Н ЯМР (500 МГц; CDCI3; Me4Si), : 4,49, 4,39 (2 к, J=7,0 Гц, OCH2), 1,43, 1,37 (2т, /=7,0Гц, СH3). 13 С ЯМР (125 МГц; CDCI3; Me4Si сигнали основного ізомеру 18а), : 156,7 (с, СО) 139,8 (т, 1 J=31,5 Гц, CCF2), 134,8 (с, С), 120,0 (к, JC-F=267,5 Гц, CF3), CF2CF3 та CCF3 не показано, 109,9 1 2 (тк, JC-F=250,0 Гц, JC-F=38,9 Гц, CF2CF3), 62,9 (с, ОСН2), 13,4 (с, СН3). 19 F ЯМР (375 МГц; CDCI3; CFCl3), : -55,1, -61,6 (2 с, 3F, CF3), -83,1, -83,6 (2 с, 3F, CF2CF3), 109,5, -111,0 (2 с, 2F, CF2CF3). + МС (XI): m/z (%) = 327 [М+1] . Аналітичні розрахунки для C9H6F8N2O2: С, 33,14; Н, 1,85; N, 8,59. Знайдено: С, 33,45; Н, 1,98; N, 8,31. 1-[3-(Пентафлуоретил)-5-(триметилсиліл)-1H-піразол-4-іл]етанон(19b) Реакцію проводили при 40 °C, слідуючи загальній методиці. Неочищений продукт промивали холодним циклогексаном (0,1 мл), отримуючи чисту сполуку 19b у формі білої твердої речовини (35 мг, 73 %). Тпл. = 102-103 °C. 1 Н ЯМР (500 МГц; CDCI3; Me4Si), : 10,51 (ш с, 1Н, N//), 2,56 (с, 3Н, СН 3), 0,38 (с, 9H, Si(CH3)3). 13 С ЯМР (125 МГц; CDCI3; Me4Si), : 193,4 (с, СО), 150,4 (с, С), 139,5 (т, J=28,7 Гц, CCF2), 1 2 1 2 128,8 (с, С), 118,2 (кт, JC-F=285,0 Гц, JC-F=36,3 Гц, CF2CF3), 111,1 (тк, JC-F=250,0 Гц, JC-F=38,9 5 Гц, CF2CF3), 29,9 (т, JCF=7,5 Гц, СН3), -2,3 (с, Si(CH3)3). 19 F ЯМР (375 МГц; CDCI3; CFCl3), : -82,4 (с, 3F, CF2CF3), -104,9 (с, 2F, CF2CF3). МС (XI): m/z (%) = 301 [M+1]. Аналітичні розрахунки для C10H13F5N2OSi: С, 40,00; Н, 4,36; N, 9,33. Знайдено: С, 39,76; Н, 4,45; N, 9,61. 2-Хлор-1-[3-(пентафлуоретил)-5-(триметилсиліл)-1H-піразол-4-іл]етанон (20b) Реакцію проводили при 40 °C, слідуючи загальній методиці. Неочищений продукт (4/1 суміш діастереомерів) промивали холодним гексаном (0,2 мл), отримуючи чисту сполуку 20b у формі білої твердої речовини (29 мг, 55 %). Тпл. = 107-108 °C. 1 Н ЯМР (500 МГц; CDCI3; Me4Si), : 10,60 (ш с, 1H, N//), 4,68 (с, 2H, CH 2), 0,40 (с, 9H, Si(CH3)3). 13 С ЯМР (125 МГц; CDCI3; Me4Si), : 187,1 (с, СО), 151,7 (с, С), 139,2 (т, J=31,5 Гц, CCF2), 5 125,6 (с, С), C2F5 не показано, 48,3 (т, JCF=7,5 Гц, СН2), -2,5 (с, Si(CH3)3). 19 F ЯМР (375 МГц; CDCI3; CFCl3), : -82,4 (с, 3F, CF2CF3), -105,2 (с, 2F, CF2CF3). + МС (XI): m/z (%) = 336 [M+1] . Аналітичні розрахунки для C10H12F5N2OSi: С, 35,88; Н, 3,61; N, 8,37. Знайдено: С, 36,16; Н, 3,33; N, 8,05. 2,2-Дифлуор-1-[3-(пентафлуоретил)-4-(триметилсиліл)-1H-піразол-5-іл]етанон (21а), 2,2-Дифлуор-1-[3-(пентафлуоретил)-5-(триметилсиліл)-1H-піразол-4-іл]етанон (21b) Сполуку 21b/а отримували як два нероздільні регіоізомери (2,6/1) у формі безбарвних олій (48 мг, 89 %), слідуючи загальній методиці. 1 2 Н ЯМР (500 МГц; CDCI3; Me4Si), : 10,79 (ш с, 1Н, N/7), 6,56, 6,32 (2 т, JC-F=53,6 Гц, 1H, CHF2), 0,38, 0,30 (2 с, 9Н, Si(CH3)3). 13 2 C ЯМР (125 МГц; CDCI3; Me4Si; основний ізомер 21b), : 185,3 (т, JC-F=26,3 Гц, COCHF2), 2 1 2 151,8 (с, С), 139,9 (т, JC-F=31,3 Гц, CCF2), 123,2 (с, С), 118,4 (кт, JC-F=285,0 Гц, JC-F=36,3 Гц, 1 2 1 2 CF2CF3), 110,4 (тк, JC-F=250,0 Гц, JC-F=38,9 Гц, CF2CF3), 107.t (tt, JC-F=247,5 Гц, JC-F=7,5 Гц, CHF2), -2,6 (с, Si(CH3)3). 19 F ЯМР (375 МГц; CDCI3; CFCl3), : -83,1, -83,8 (с + ш с, 3F, CF2CF3), -107,2, -108,4 (c + ш c, 2 6 2F, CF2CF3), -127,3, 127,0 (ш с + дт, JFH=52,6 Гц, JFF=7,5 Гц, 2F, CHF2), + МС (XI): m/z (%) = 337 [M+1] . Аналітичні розрахунки для C10H11F7N2OSi: С, 35,72; Н, 3,30; N, 8,33. Знайдено: С, 35,45; Н, 3,13; N, 8,54. 1-[3-(Пентафлуоретил)-1H-піразол-4-іл] етанон (23) Сполуку 19b (50 мг, 0,17 ммоль) розчиняли в метанолі (3 мл). Додавали воду (0,5 мл) та KHF2 (5 мг), як зазначено. Реакційну суміш нагрівали зі зворотним холодильником протягом 10 годин. Після охолодження до кімнатної температури, метанол випарювали у вакуумі. Додавали воду (1 мл) та суміш екстрагували дихлорметаном (3 × 2 мл). Органічну фракцію об'єднували, висушували над Na2SO4 та випарювали під вакуумом, отримуючи піразол 23 (17 мг, 0,08 ммоль, 46 % вихід) у формі білої твердої речовини. Тпл. = 152-153 °C. 1 Н ЯМР (500 МГц; ДМСО-d6; Me4Si), : 8,75 (с, 1H, СН), 2,44 (с, 3Н, СH3). 12 UA 107359 U С ЯМР (125 МГц ДМСО-d6; Me4Si), : 190,2 (с, СО), 137,9 (т, J=28,7 Гц, CCF2), 136,7 (с), 1 2 1 2 121,5 (с), 119,1 (кт, JC-F=285,0 Гц, JC-F=36,3 Гц, CF2CF3), 110,9 (тк, JC-F=250,0 Гц, JC-F=38,9 Гц, CF2CF3), 29,0 (с, СН3). 19 F ЯМР (375 МГц; ДМСО-d6; CFCl3), : -80,9 (с, 3F, CF2CF3), -107,4 (с, 2F, CF2CF3). + МС (XI): m/z (%) = 229 [М+1] . Аналітичні розрахунки для C7H5F5N2O: С, 36,86; Н, 2,21; N, 12,38. Знайдено: С, 36,51; Н, 2,44; N, 12,17. 1-[3-(Трифлуорметил)-5-(триметилсиліл)-1H-піразол-4-іл] етанон (24) До перемішуваної суспензії додавали CF3CH2NH2*HCl (65 мг, 0,48 ммоль, 3,0 екв.) в СН2Сl2 (4,0 мл)/вода (0,2 мл), нітрит натрію (54 мг, 0,78 ммоль, 5,0 екв.) та алкін 19 (22 мг, 0,16 ммоль, 1,0 екв.). Реакційну суміш енергійно перемішували 168 годин при кімнатній температурі. Додавали воду (1,0 мл) та СН2Сl2 (3 мл) по інструкції. Органічний шар відокремили. Водний шар промивали СН2Сl2 (2 × 3 мл). Об'єднані органічні шари сушили над Na 2SO4 і випарювали у вакуумі з отриманням неочищеного продукту. Залишається тверда речовина, яку промивали холодним циклогексаном (0,1 мл), отримуючи чистий продукт 24 (30 мг, 0,12 ммоль, 75 % вихід) у формі білої твердої речовини. Тпл.= 120-122 °C. 1 Н ЯМР (500 MHz; CDCI3; Me4Si), : 11,16 (ш с, 1H, NH), 2,57 (с, 3Н, СН3), 0,39 (с, 9H, Si(CH3)3). 13 2 С ЯМР (125 МГц; CDCI3; Me4Si), : 192,6 (с, СО), 151,3 (с, С), 141,0 (к, J(C, F) = 36,1 Гц, 1 CCF3), 127,1 (с), 120,8 (к, JC-F = 270,0 Гц, CF3), 29,2 (с, СН3), 2,6 (с, Si(CH3)3). 19 F ЯМР (375 МГц; CDCI3; CFCl3), : -58,1 (с, CF3). Аналітичні розрахунки для C9H13F3N2OSi: С, 43,19; Н, 5,24; N, 11,19. Знайдено: С, 43,42; Н, 5,53; N, 10,94. + МС (XI): m/z (%) = 251 [M+1] . 3-(Пентафлуоретил)-1H-піразол-5-карбонова кислота (25) До розчину піразолу 1а (93 мг, 0,38 ммоль) в МеОН (0,5 мл) додавали 1N NaOH (1,6 мл, 1,60 ммоль). Реакційну суміш енергійно перемішували при кімнатній температурі протягом 20 год. Розчинник випарювали під вакуумом, додавали воду (5 мл). Водну фазу промивали СН 2Сl2 (2*1 мл). Органічний шар відкидали. У водну фазу для підкислення додавали конц. НСl до рН = 1. Утворювався білий осад. Суспензію екстрагували ЕtOАс (3*5мл). Об'єднаний органічний шар сушили над сульфатом натрію і випарювали у вакуумі з отриманням чистої кислоти 25 (71 мг, 0,31 ммоль, вихід 81 %) у формі білої твердої речовини. Тпл.= 134-135 °C. 1 Н ЯМР (500 МГц; ДМСО-d6; Me4Si), : 14,78 (с, 1H, N#), 7,20 (с, 1H, СН). 13 C ЯМР (125 МГц; ДМСО-d6; Me4Si), : 159,6 (с, СО2Н), 140,2 (т, V(C, F) = 28,8 Гц, CCF2), 1 2 1 2 136,8 (с, С), 118,3 (кт, JC-F=285,0 Гц, JC-F=36,3 Гц, CF2CF3), 112,4 (тк, JC-F=250,0 Гц, JC-F=38,9 Гц, CF2CF3), 108,1 (с, СН). 19 F ЯМР (375 МГц; ДМСО-d6; CFCl3), : -85,2 (с, 3F, CF2CF3), -113,8 (с, 2F, CF2CF3). + МС (XI): m/z (%) = 231 [М+1] . Аналітичні розрахунки для C6H3F5N2O2: С, 31,32; Н, 1,31; N, 12,17. Знайдено: С, 31,63; Н, 1,02; N, 12,48. 1-Метил-3-(пентафлуоретил)-1H-піразол-5-карбонової кислоти метиловий естер (26) Піразол 1a (450 мг, 1,8 ммоль) розчиняли в сухому DMF (5 мл). Додавали сухий К 2СО3 (472 мг, 3,6 ммоль) та МеІ (523 мг, 3,6 ммоль). Реакційну суміш енергійно перемішували при кімнатній температурі протягом 20 год. Реакційну суміш піддавали колонковій хроматографії на силікагелі з використанням гексану/ЕtOАс = 4/1 у формі розчинника. R f= 0,6. Безбарвна рідина 26 (328 мг, 1,2 ммоль, 69 % вихід). 1 Н ЯМР (500 МГц; CDCI3; Me4Si), : 7,10 (с, 1H, СН), 4,25 (с, 3Н, СH3), 3,92 (с, 3Н, СН3). 13 2 С ЯМР (125 МГц; CDCI3; Me4Si), : 158,9 (с, СО), 139,0 (т, J(C, F) = 28,8 Гц, CCF2), 133,5 (с, 1 2 1 2 С), 118,3 (кт, JC-F=285,0 Гц, JC-F=36,3 Гц, CF2CF3), 108,6 (с, СН), 110,4 (тк, JC-F=250,0 Гц, JCF=38,9 Гц, CF2CF3), 52,0 (с, СН3), 40,0 (с, СН3). 19 F ЯМР (375 МГц; CDCI3; CFCl3), : -85,2 (с, 3F, CF2CF3), -113,8 (с, 2F, CF2CF3). + МС (XI): m/z (%) = 259 [M+1] . Аналітичні розрахунки для C8H7F5N2O2: С, 37,22; Н, 2,73; N, 10,85. Знайдено: С, 37,48; Н, 2,91; N, 10,56. 1-Метил-3-(пентафлуоретил)-1H-піразол-5-карбонова кислота (27) До розчину піразолу 26 (100 мг, 0,38 ммоль) в МеОН (0,5 мл) додавали IN NaOH (0,8 мл, 0,80 ммоль). Реакційну суміш енергійно перемішували при кімнатній температурі протягом 20 год. Розчинник випарювали під вакуумом і додавали воду (5 мл). Водну фазу промивали СН 2Сl2 (2*1мл). Органічний шар відкидали. Водну фазу підкислювали конц. НСl до рН = 1. Отримували білий осад. Суспензію екстрагували СН2СІ2 (3*5 мл). Об'єднаний органічний шар сушили над 13 5 10 15 20 25 30 35 40 45 50 55 60 13 UA 107359 U 5 10 сульфатом натрію і випарювали у вакуумі з отриманням чистої кислоти 27 (92 мг, 0,37 ммоль, 97 % вихід) у формі білої твердої речовини. Тпл.= 125-126 °C. 1 Н ЯМР (500 МГц; CDCI3; Me4Si), : 7,25 (с, 1Н, СН), 4,28 (с, 3Н, СН3). 13 2 С ЯМР (125 МГц; CDCI3; Me4Si), : 162,4 (с, СО), 139,4 (т, J(C, F) = 28,5 Гц, CCF2), 132,8 (с, 1 2 1 2 С), 118,2 (кт, JC-F=285,0 Гц, JC-F=36,5 Гц, CF2CF3), 109,8 (тк, JC-F=250,0 Гц, JC-F=38,9 Гц, CF2CF3), 112,0 (с, СН), 40,0 (с, СН3). 19 F ЯМР (375 МГц; CDCI3; CFCl3), : -85,1 (с, 3F, CF2CF3), -113,8 (с, 2F, CF2CF3). + МС (XI): m/z (%) = 243 [М-1] . Аналітичні розрахунки для C7H5F5N2O2: С, 34,44; Н, 2,06; N, 11,48. Знайдено: С, 34,17; Н, 1,91: N, 11,37. ФОРМУЛА КОРИСНОЇ МОДЕЛІ 1. Спосіб одержання С2F5-заміщених піразолів загальної формули (І): R C2 F5 1 N 15 20 25 R N H , (І) 1 3 3 в якій R являє собою Н, С1-С6алкіл, С1-С6галоалкіл, COOR , COR , СОС1-С6галоалкіл, Si(C1C6алкіл)3; 2 3 3 3 3 R являє собою С1-С6алкіл, С1-С6галоалкіл, COOR , COR , CONHR , P(O)R 2, Si(С1-С6алкіл)3, С2С9гетероарил; 3 де R являє собою незалежно С1-С6алкіл, С3-С10циклоалкіл, С6-С10арил або С2-С9гетероарил, кожен з яких необов'язково заміщений одним або більшою кількість замісників, незалежно вибраних з С1-С6алкілу, С2-С6алкенілу, С2-С6алкінілу, С1-С6алкокси, С3-С10циклоалкілу, С6С10арилу, С2-С9гетероарилу, галогену, ОН, SH, галоген, -CN, NO2, -NHC1-C6алкілу, -N(C1C6алкіл)2, -CONHС1-С6алкілу, -СОС1-С6алкілу, -СООС1-С6алкілу, -SС1-С6алкілу, -SOС1-С6алкілу або -SO2С1-С6алкілу; в якому алкіни загальної формули (II): R1 C C 1 30 2 2 R2 , (II) в якій R та R є такими як визначено вище; вводять в реакцію з C2F5CHN2, що одержують in situ реакцією C2F5CH2NH2 з NaNO2, з одержанням C2F5-заміщених піразолів загальної формули (І). 2. Спосіб за п. 1, який відрізняється тим, що C2F5CH2NH2 використовують у формі гідрохлориду і реакцію одержання C2F5CHN2 проводять у суміші метиленхлориду та води. Комп’ютерна верстка А. Крулевський Державна служба інтелектуальної власності України, вул. Василя Липківського, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 14
ДивитисяДодаткова інформація
МПК / Мітки
МПК: C07D 231/00
Мітки: c2f5-заміщених, піразолів, спосіб, одержання
Код посилання
<a href="https://ua.patents.su/16-107359-sposib-oderzhannya-c2f5-zamishhenikh-pirazoliv.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання c2f5-заміщених піразолів</a>
Попередній патент: Спосіб одержання c2f5-заміщених піразолінів
Наступний патент: Пристрій для визначення сили притискання пружної клеми рейкового скріплення до рейки
Випадковий патент: Спосіб лікування післяопераційної лімфореї, як ускладнення оперативних втручань на шиї