Спосіб одержання c2f5-заміщених піразолінів
Формула / Реферат
1. Спосіб одержання С2F5-заміщених піразолінів загальної формули (І):
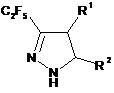 , (I)
, (I)
в якій R1, R2 та R3 являють собою незалежно один від одного Н, F, CN, С1-С6-алкіл, COOR4, COOR4, SO2F, SO2R4, -(С1-С6-алкіл)-СОOR4, -(С1-С6-алкіл)-COR4, С6-С10-арил або С2-С9-гетероарил, кожен С6-С10-арил або С2-С9-гетероарил необов'язково заміщений одним або більшою кількість замісників, незалежно вибраних з С1-С6-алкілу, С2-С6-алкенілу, С2-С6-алкінілу, С1-С6-алкокси, С3-С10-циклоалкілу, С6-С10-арилу, С2-С9-гетероарилу, ОН, SH, Hal, -CN, NO2, -NHС1-С6-алкілу, -N(С1-С6-алкіл)2, -CONHС1-С6-алкілу, -СОС1-С6 алкілу, -СООС1-С6-алкілу, -SС1-С6-алкілу, -SOС1-С6-алкілу або -SO2С1-С6-алкілу;
де R4 являє собою незалежно С1-С6-алкіл, С3-С10-циклоалкіл, С6-С10-арил або С2-С9-гетероарил, кожен з яких необов'язково заміщений одним або більшою кількість замісників, незалежно вибраних з С1-С6 алкілу, С2-С6-алкенілу, С2-С6-алкінілу, С1-С6-алкокси, С3-С10-циклоалкілу, С6-С10-арилу, С2-С9-гетероарилу, галогену, ОН, SH, -CN, NO2, -NHС1-С6-алкілу, -N(С1-С6 алкіл)2, -CONHС1-С6-алкілу, -СОС1-С6-алкілу, -СООС1-С6-алкілу, -SС1-С6-алкілу, -SOС1-С6-алкілу або -SO2С1-С6-алкілу;
або R1 та R2 можуть бути об'єднані разом, утворюючи 5-членну циклічну систему, що містить N як елемент кільця, і де кільце, яке необов'язково заміщене одним або більшою кількість замісників, незалежно вибраних з =O, С1-С6-алкілу, С6-С10-арилу, де С1-С6-алкільний та С6-С10-арильний фрагменти необов'язково заміщені одним або більшою кількість замісників, незалежно вибраних з галогену, С1-С6-алкілу, С1-С6-алкокси, С3-С10-циклоалкілу, С6-С10-арилу, -СООС1-С6-алкілу;
в якому алкени загальної формули (II):
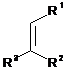 , (II)
, (II)
в якій R1, R2 та R3 є такими, як визначено вище;
вводять в реакцію з C2F5CHN2, що одержують in situ реакцією C2F5CH2NH2 з NaNO2,
з одержанням С2F5-заміщених піразолінів загальної формули (І).
2. Спосіб за п. 1, який відрізняється тим, що C2F5CH2NH2 використовують у формі гідрохлориду і реакцію одержання C2F5CHN2 проводять у суміші метиленхлориду та води.
Текст
Реферат: Спосіб одержання С2F5-заміщених піразолінів загальної формули (І): C2 F5 R N R N H 1 1 2 , (I) 2 3 4 в якій R , R та R являють собою незалежно один від одного Н, F, CN, С1-С6-алкіл, COOR , 4 4 4 4 COOR , SO2F, SO2R , -(С1-С6-алкіл)-СОOR , -(С1-С6-алкіл)-COR , С6-С10-арил або С2-С9гетероарил, кожен С6-С10-арил або С2-С9-гетероарил необов'язково заміщений одним або більшою кількістю замісників, незалежно вибраних з С1-С6-алкілу, С2-С6-алкенілу, С2-С6алкінілу, С1-С6-алкокси, С3-С10-циклоалкілу, С6-С10-арилу, С2-С9-гетероарилу, ОН, SH, Hal, -CN, NO2, -NHС1-С6-алкілу, -N(С1-С6-алкіл)2, -CONHС1-С6-алкілу, -СОС1-С6-алкілу, -СООС1-С6-алкілу, -SС1-С6-алкілу, -SOС1-С6-алкілу або -SO2С1-С6-алкілу. UA 107358 U UA 107358 U 5 10 15 20 Корисна модель стосується галузі органічної хімії, а саме способу одержання C2F5заміщених піразолінів, що знайдуть застосування як цінні вихідні сполуки для синтезу різноманітних флуорвмісних біологічно активних сполук. Включення флуормісних груп в органічні молекули впливає на їх фізико-хімічні та біологічні властивості. Близько 20 % всіх лікарських препаратів та агрохімікатів містять щонайменше один атом флуору: трифлуорметильна група представлена особливо часто. В останні роки, все 5 6 більше ліпофільних аналогів трифлуорметилу - C2F5 і SF5 - привертали значну увагу винахідників. У пентафлуоретильних похідних часто підтверджуються кращі біологічні властивості, на відміну від трифлуорметильних аналогів. Тому використовують багато C2F5вмісних біологічно активних сполук, у тому числі декілька лікарських препаратів. Але способи, якими вводять фрагмент C2F5 в органічні молекули, не повністю досліджені в порівнянні з трифлуорметильними аналогами: хіміки в основному використовують пряме пентафлуорування, і недооцінюють C2F5-bmicthi будівельні блоки. Отже, існує потреба в нових реагентах і реакції синтезу C2F5-замнцених сполук. Існуюча потреба вирішується за допомогою розробки способу одержання C2F5-заміщених піразолінів, в якому на відміну від відомого CF3CHN2 як флуорвмісний реагент використовується C2F5CHN2. Піразоліновий мотив відіграє важливу роль у матеріалознавстві, органічному синтезу та медичних дослідженнях: , 25 а, отже, C2F5-піразолін є привабливим об'єктом. У цьому контексті, винахідником було синтезовано новий хімічний реагент C2F5CHN2 з C2F5CH2NH2*HCl і нітриту натрію, та розроблено спосіб синтезу C2F5-заміщених піразолінів. Отже об'єктом корисної моделі є спосіб одержання C2F5-заміщених піразолінів загальної формули (І): 30 1 UA 107358 U , (І) 1 5 10 15 20 2 3 4 в якій R , R та R являють собою незалежно один від одного Н, F, CN, С1-С6-алкіл, COOR , 4 4 4 4 COOR , SO2F, SO2R , -(С1-С6-aлкiл)-COOR , -(С1-С6-алкіл)-COR , С6-С10-арил або С2-С9гетероарил, кожен С6-С10-арил або С2-С9-гетероарил необов'язково заміщений одним або більшою кількість замісників, незалежно вибраних з С1-С6-алкілу, С2-С6-алкенілу, С2-С6-алкінілу, С1-С6-алкокси, С3-С10-циклоалкілу, С6-С10-арилу, С2-С9-гетероарилу, ОН, SH, Hal, -CN, NO2, NHС1-С6-алкілу, -N(С1-С6-алкіл)2, -CONHС1-С6-алкілу, -СОС1-С6-алкілу, -СООС1-С6-алкілу, -SС1С6-алкілу, -SOС1-С6-алкілу або -SO2С1-С6-алкілу; 4 де R являє собою незалежно С1-С6-алкіл, С3-С10-циклоалкіл, С6-С10-арил або С2-С9гетероарил, кожен з яких необов'язково заміщений одним або більшою кількість замісників, незалежно вибраних з С1-С6-алкілу, С2-С6-алкенілу, С2-С6-алкінілу, С1-С6-алкокси, С3-С10циклоалкілу, С6-С10-арилу, С2-С9-гетероарилу, галогену, ОН, SH, -CN, NO2, -NHС1-С6-алкілу, N(С1-С6-алкіл)2, -CONHС1-С6-алкілу, -СОС1-С6-алкілу, -СООС1-С6-алкілу, -SС1-С6-алкілу, -SOС1С6-алкілу або -SO2С1-С6-алкілу; 1 2 або R та R можуть бути об'єднані разом, утворюючи 5-членну циклічну систему, що містить N як елемент кільця, і де кільце, яке необов'язково заміщене одним або більшою кількість замісників, незалежно вибраних з =O, С1-С6-алкілу, С6-С10-арилу, де С1-С6-алкільний та С6-С10арильний фрагменти, необов'язково заміщені одним або більшою кількість замісників, незалежно вибраних з галогену, С 1-С6-алкілу, С1-С6-алкокси, С3-С10-циклоалкілу, С6-С10-арилу, СООС1-С6-алкілу; в якому алкени загальної формули (II): , (II) 25 30 35 40 45 1 2 3 в якій R , R та R є такими, як визначено вище; вводять в реакцію з C2F5CHN2, що одержують in situ реакцією C2F5CH2NH2 з NaNO2, з одержанням C2F5-заміщених піразолінів загальної формули (І). В запропонованому способі C2F5CH2NH2 використовують у формі гідрохлориду і реакцію одержання C2F5CHN2 проводять у суміші метиленхлориду та води. Як зазначається вище, термін "галоген" означає хлор, бром, йод та флуор. Термін "С1-С6-алкіл" стосується алкільного радикалу, що має від одного до шести атомів вуглецю і має нерозгалужену або розгалужену будову. Прикладами алкільних груп є, але не обмежується, метил, етил, пропіл, ізопропіл, бутил, ізобутил, втор-бутил, трет-бутил, пентил, 2пентил,3-пентил, ізопентил, неопентил, (R)-2-метилбутил, (с)-2-метилбутил, 3-метилбутил, 2,3диметилпропіл, 2,3-диметилбутил, гексил і т. і. Термін "С1-С6-алкокси", стосується алкокси радикалу, що має від одного до шести атомів вуглецю, що мають нерозгалужену або розгалужену будову. Алкокси групами є, але не обмежується, метокси, етокси, пропокси, ізопропокси, бутокси, гексилокси і т.і… Термін "С3-С10-циклоалкіл", як тут використовується, стосується моно, конденсованих або місткованих біциклічних або трициклічних карбоциклічних кілець, що містять, в деяких втіленнях, від трьох до десяти атомів вуглецю. Як тут використовується, циклоалкільні кільця можуть необов'язково містити один або два подвійні зв'язки. Термін "циклоалкіл" також включає спіроциклоалкільні групи, включаючи поліциклічні системи, зв'язані через один атом. Циклоалкільними групами є, але не обмежується, циклопропіл, циклобутил, циклопентил, 2 UA 107358 U 5 10 15 20 25 30 циклогексил, циклогептил, циклопентеніл, циклогексеніл, біцикло[2.2.1]гептаніл, біцикло[3.2.1]октаніл, біцикло[5.2.0]нонаніл, адамантил і т. і. Термін "С6-С10-арил", як тут використовується, стосується групи, що походить від ароматичного вуглеводню, що містить від шести до десяти атомів вуглецю. Прикладами таких груп є, але не обмежується, феніл і нафтил. Термін "арил" також включає конденсовані поліциклічні ароматичні системи, в яких ароматичне кільце є конденсованим з одним або більше кілець. Прикладами є, але не обмежується, 1-нафтил, 2-нафтил, 1-антрацил і 2антрацил. Також включеними в межі рамок терміну "арил", як тут використовується, є група, в якій ароматичне кільце є конденсованим з одним або більше неароматичних кілець, таким як інданіл, фенантридиніл або тетрагідронафтил, де радикал або точка приєднання знаходиться на ароматичному кільці. Термін "С2-С9-гетероарил, як тут використовується, стосується ароматичної моноциклічної або біциклічної гетероциклічної групи, що має загалом від 5 до 9 атомів в кільці і що містить від 2 до 9 атомів вуглецю і від одного до чотирьох гетероатомів, що незалежно вибирають з азоту, кисню і сірки, за умови, що кільце згаданої групи не містить два сусідні атоми кисню або два сусідні атоми сірки. Гетероарильні групи є бензо-конденсованими циклічними системами. Прикладами гетероарильних груп є, але не обмежується, піроліл, фурил, тієніл, імідазоліл, піразоліл, оксазоліл, ізоксазоліл, ізотіазоліл, триазоліл, оксадіазоліл, фуразаніл, тіадіазоліл, тіазоліл, тетразоліл, піридиніл, піразиніл, піримідил, піридазиніл, триазиніл, індоліл, ізоіндоліл, індолізиніл, бензофураніл, бензотіофеніл, індазоліл, бензімідазоліл, бензоксазоліл, фуро[3,2-b] піридиніл, бензотіазоліл, бензофуразаніл, пуриніл, хінолініл, ізохінолініл, хіназолініл, хіноксалініл, нафтиридиніл, цинолініл, фталазиніл, піридо[3,4-d]піримідил, птеридиніл і т. і. Отримуваний in situ діазоалкан C2F5CHN2 швидко реагує з алкенами формули (II), що містять електронно-акцепторні групи. Таким чином, щоб вловити C2F5CHN2, спочатку був вибраний активний алкен 1 з двома електронно-акцепторними групами. Винахідник проводив експеримент наступним чином: NaNO2 (4,0 екв.) додавали до суспензії C2F5CH2NH2*НСl (3,0 екв.) в суміші дихлорметан/вода при 0 °C на повітрі. Реакційну суміш перемішували протягом 10 хвилин, поки органічний шар не ставав жовтим, далі додавали малеімід 1 (1,0 екв.). Через 72 1 2 години при кімнатній температурі отримували суміш Δ-/ Δ-піразолінів 1а/1b з кількісним виходом. Згодом було оптимізовано експериментальні умови, щоб зменшити кількість C2F5CH2NH2*НСl до 1,5 екв., не впливаючи на конверсію реакції (Таблиця 1). Таблиця 1 Експеримент 1 2 3 4 C2F5CH2NH2HCl (екв.) 3,0 2,0 1,5 1,3 NaNO2 (екв.) 4,0 3,0 3,0 3,0 Перетворення (%) 100 100 100 95 Таблиця 2 3 UA 107358 U Таблиця 2 Алкен Продукт Співвідношення Вихід (%) а b 1 1а/1b 1:0,14 99 2 2а/2b 1:5,6 98 3 3а/3b 1:3,7 99 4 4а/4b 1:0,9 97 5 5а/5b 1:1,5 99 6 6b 99 7 b b b b Немає реакції [а] Ізольований вихід. [b] Вихід суміші ізомерів а/b 5 10 15 Малеіміди 2-6 також вводили в реакцію з C2F5CHN2 (Таблиця 2). У кожному експерименті 1 2 1 2 отримували суміш Δ-(а) та Δ-(b) піразолінів з 97-99 %-им виходом. Співвідношення Δ-/ Δізомерів добре корелює з електронними властивостями малеімідного N-замісника. Чим більше 2 електроноакцепторний замісник, тим активніше це веде до більш високого вмісту Δ-ізомеру: 1 2 (12 %) → 4 (47 %) 2 (85 %) 6 (100 %). Δ-піразолін (с), тим не менше, не утворився: передбачені біциклічні алкени можуть бути надто напружені відповідно до правила Бредта. Тризаміщений алкен 7 не реагує через стеричні ускладнення. Щоб всебічно вивчити реакційні властивості C2F5CHN2, винахідник також протестував монозаміщені алкени 8-17 (Таблиця 3). Вихідні сполуки 8-14 з сильними електронноакцепторними групами повністю прореагували з C2F5CHN2; однак алкени з більш слабкими електронно-акцепторними групами (15) або електронно-донорними групами (16, 17) не реагували. Ці результати показують, що реакція між C2F5CHN2 і алкенами належить до типу І [3+2] циклоприєднання: вона прискорюється завдяки електронно-акцепторним групам та сповільнюється завдяки електронно-донорним групам на алкені. 4 UA 107358 U Таблиця 3 Алкен Продукт Вихід (%) 8 8с 97 9 9с b 98 10 10с 99 11 11с 97 12c 95 13 13c 95 14 14c 98 12 15 Немає реакції 16 Немає реакції 17 Немає реакції [а] Ізольовані виходи. [b] містить 12 % ізомеру 9а 5 а UA 107358 U 5 10 Реакція є регіоселективною і призводить до утворення одного регіоізомеру з замісниками на 2 позиціях 3 і 5 піразольного ядра. Крім того, більш термодинамічно стабільні Δ-піразоліни (с) з кон'югованими N=С та подвійними/потрійними зв'язками електронно-акцепторними групами були переважно отримані. Алкен 9 дає продукт 9с з незначним утворенням ізомеру 9а (12 %). Далі були вивчені вимоги до стеричних реакцій. Винахідник вибрав різноманітні ди- і тризаміщені алкени (19-28) з щонайменше однією сильною електронно-акцепторною групою (1 CO2Alk або -СОМе) (Таблиця 4). 1,1-дизаміщені субстрати плавно дали відповідний Δ-піразолін (а) незалежно від другого замісника: електронно-акцепторної групи (19, 20) або електроннодонорної групи (21, 22). 1,2-дизаміщені субстрати, однак, були менш активні: алкени з електронно-акцепторними групами (23, 24), як другого замісника, повністю вступають в реакцію 2 з C2F5CHN2 (з отриманням Δ-піразолінів (с)), а ті, які мають електронно-донорні групи (25-26) як другий замісник, не вступають у реакцію. Навіть після 7 днів реакція пройшла лише на 16 % для 25, і 26 % для 26. Тризаміщені алкени 27 та 28, з трьома електронно-акцепторними групами не реагують. Ці дані показують, що C2F5CHN2 реагує лише з моно- та дизаміщеними алкенами. 15 Таблиця 4 Алкен Продукт Вихід (%) 19 19а 99 20 20а 95 21 21а 96 22 22а 97 23 23с 98 24 24с 98 25 25с 16 26 26с 26 b c d d 6 а UA 107358 U Таблиця 4 27 Немає реакції 28 Немає реакції [а] Ізольовані виходи. [b] Суміш піразолінів 20а і піразолу 29 (2/1) отримували (Supporting information), [с] Реакційний час: 7 днів. Са. 7 % цис-ізомеру. [d] Реакційний час: 7 днів. 1 Розрахунковий вихід за H ЯМР 1 5 2 Вищеописана реакція утворює пентафлуоретилзаміщені Δ- та Δ-піразолінові будівельні блоки, що є доступними для синтезу, і це дає можливість їх освоєння як біологічно активних 1 сполук в порівнянні з їх нефлуорваними аналогами. Δ-піразоліни, в свою чергу, проходять 2 1 ізомеризацію до Δ-ізомерів в кислих умовах. В цьому контексті, застосовучи довільний Δпіразолін з таблиці 1 (суміш 1а/1b) з каталітичною кількістю трифлуорцтової кислоти в 2 дихлорметані, кількісно отримували чистий Δ-ізомер 1b (Схема 2). Схема 2 1 2 Кислотна ізомеризація Δ-піразоліну 1а в Δ-ізомер 1b 10 15 20 25 30 35 40 Таким чином, новий хімічний реагент C2F5CHN2 був отриманий при реакції C2F5CH2NH2*HCl з NaNO2 в суміші вода/дихлорметан, при 0 °C. Було одержано ряд C2F5-заміщених піразолінів. Синтез сполук є практичним: реакція проходить на повітрі при кімнатній температурі, без будьяких каталізаторів, і в звичайних розчинниках - Н2О/СН2Сl2. Більш того, продукти виділяється з чудовим виходом без подальшого очищення. Враховуючи важливість як C2F5, так і фрагментів піразолу в хімії, можна сказати, що синтезовані сполуки є перспективними молекуламимішенями. Експериментальна частина Дихлометан очищали дистиляцією. Всі реагенти отримували від Enamine Ltd. Температури 1 19 13 плавлення не коригували. Н-, F-, С-ЯМР-спектри знімали при 499,9 МГц, 470,3 МГц та 124,9 1 13 МГц. Хімічні зсуви наведені в мільйонних частках щодо тетраметилсилану Me4Si ( H, С) або 19 CFCl3 ( F), використовуючи дейтерій як внутрішні стандарти. МС-аналіз проводили на приладі РХМС з хімічною іонізацією. Загальна методика Перемішану суспензію C2F5CH2NH2*HCl (45 мг, 0,24 ммоль, 1,5 екв.) в СН2Сl2 (2,0 мл)/вода (0,1 мл) охолоджували до 0 °C, додавали нітриту натрію (33 мг, 0,48 ммоль, 3,0 екв.). Реакційну суміш енергійно перемішували протягом 10 хвилин, з подальшим додаванням алкену (0,16 ммоль, 1,0 екв.). Через 1 годину охолоджування на бані, реакційну суміш додатково перемішували протягом 72 годин при кімнатній температурі. Додавали воду (1,0 мл) і СН 2Сl2 (3 мл). Органічний шар відокремлювали. Водний шар промивали СН 2Сl2 (2×3 мл). Об'єднані органічні шари сушили над Na2SO4 і упарювали у вакуумі з отриманням чистого продукту. (3RS, 3RS, 6RS)-5-Бензил-3-(пентафлуоретил)-3а, 6а-дигідропіроло[3,4-с]піразол-4,6(3H, 5H)-діон (1а), (3RS, 6RS)-5-Бетил-3-(пентафлуоретил)-3а, 6а-дигідропіроло[3,4-с]піразол-4,6(1H, 5H)-діон (1b). Суміш 1a/1b (1/0,14) отримували як білу тверду речовину (55 мг, 99 %), слідуючи загальній методиці. Тпл.=94-95 °C. 1 H ЯМР (500 МГц; CDCl3; Me4Si; основний ізомер 1a), δ: 7,32 (с, 5Н, Ph), 5,91 (дд, J=7,5, 1,0 Гц, 1Н), 5,65 (м, 1H), 3,45 (дд, J=7,5, 1,0 Гц, 1Н), 4,62 (с, 2Н, CH2Ph). 7 UA 107358 U С ЯМР (125 МГц; CDCl3; Me4Si; основний ізомер 1а), : 172,4 (с, NCO), 167,2 (с, NCO), 1 134,3 (с, С, Ph), 128,9 (с, СH, Ph), 128,8 (с, СH, Ph), 128,6 (с, СH, Ph), 118,4 (кт, JC-F=285,0 Гц, 2 1 2 JC-F=35,0 Гц, CF2CF3), 111,8 (тк, JC-F=257,8 Гц, JC-F=40,0 Гц, CF2CF3), 95,0 (с, NCHCO), 91,1 (τ, 2 JC-F=35,0 Гц, CHCF2CF3), 43,3 (с, CH2Ph), 38,1 (с, CHCHCO). 19 F ЯМР (375 МГц; CDCl3; CFCl3; основний ізомер 1a), : -83,51 (с, 3F, CF2CF3), -118,10 (дд, 2 3 2 3 JC-F=273,8 Гц, JC-F=7,5 Гц, 1F, CFFCF3), -118,11 (дд, JC-F=273,8 Гц, JC-F=18,8 Гц, 1F, CFFCF3). + MC (XI): m/z (%) = 320 [M+1-N2] . (3RS, 6RS)-5-Бензил-3-(пентафлуоретил)-3а, 6а-дигідропіроло[3,4-с]піразол-4,6(1H, 5H)-діон (1b). Суміш 1a/1b (20 мг) розчиняли в СН2Сl2 (1 мл) та додавали CF3CO2H (5 мкл). Після 3 годин при кімнатній температурі, СН2Сl2 (5 мл) додавали реакційну суміш. Органічну фазу промивали 2 N вод. K2СО3 (2*1 мл), водою (1 мл) і висушували над сульфатом натрію. Випарювання розчинника проводили у вакуумі із отриманням чистого ізомеру 1b (19 мг, 95 % вихід). Олія. 1 3 H ЯМР (500 МГц; CDCl3+CF3CO2D; Me4Si), δ: 7,34 (с, 5Н, Ph), 5,04 (1Н, д, JH-H=10,5 Гц, 2 2 3 СОСH), 4,76 (1Н, д, JH-H=14,5 Гц, NCHHPh), 4,73 (1Н, д, JH-H=14,5 Гц, NCHHPh), 4,60 (1H, д, JHH=10,5 Гц, СОСH). 13 2 С ЯМР (125 МГц; CDCl3+CF3CO2D; Me4Si), δ: 175,7 (с, NCO), 171,6 (с, NCO), 134,1 (дд, JCF=32,5, 28,8 Гц, CCF2), 133,8 (с, С, Ph), 129,0 (с, СH, Ph), 128,7 (с, СH, Ph), 128,6 (с, СH, Ph), 1 2 1 2 118,2 (кт, JC-F=285,0 Гц, JC-F=36,3 Гц, CF2CF3), 109,8 (тк, JC-F=248,8 Гц, JC-F=38,1 Гц, CF2CF3), 63,0 (с, СНСО), 51,8 (с, СНСО), 43,7 (с, CH2Ph). 19 3 2 F ЯМР (375 МГц; CDCl3; CFCl3), δ: -83,15 (τ, JF-F=3,8 Гц, 3F, CF2CF3), -111,39 (д, JF-F=294,0 2 Гц, 1F, CFFCF3), -112,91 (д, JF-F=294,0 Гц, 1F, CFFCF3). + MC (XI): m/z (%) = 348 [M+1] . Аналітичний підрахунок для C14H10F5N3O2: С, 48,43; Η, 2,90; Ν, 12,10. Знайдено: С, 48,12; Η, 2,62; Ν, 11,95. (3RS, 3RS, 6RS)-5-Феніл-3-(пентафлуоретил)-3а, 6а-дигідропіроло[3,4-с]піразол-4,6(3H, 5H)діон (2а), (3RS, 6RS)-5-Феніл-3-(пентафлуоретил)-3а, 6а-дигідропіроло[3,4-с]піразол-4,6(1H, 5H)-діон (2b). Суміш 2а/2b (1/5,6) отримували як білу тверду речовину (52 мг, 98 %), слідуючи загальній методиці. Тпл. = 124-125 °C. 1 H ЯМР (500 МГц; CDCl3; Me4Si), δ: 7,51 (τ, J=7,5 Гц, 3Η, Ph, 2b), 7,45 (τ, J=7,5 Гц, 3Η, Ph, 2a), 7,27 (д, J=7,5 Гц, 2H, Ph, 2b), 7,22 (д, J=7,5 Гц, 2Η, Ph, 2a), 7,06 (ш с, NH, 1H, 2b), 6,04 (дд, J=7,5, 3 3 1,0 Гц, 1H, 2a), 5,81 (м, 1H, 2a), 5,04 (1H, д, JH-H=10,5 Гц, СОСH, 2b), 4,60 (1H, д, JH-H=10,5 Гц, СОСH, 2b), 3,65 (дд, J=7,5, 1,0 Гц, 1H, 2а). 13 C ЯМР (125 МГц; CDCl3; Me4Si, основний ізомер 2b), δ: 173,3 (с, NCO), 169,9 (с, NCO), 2 134,7 (дд, JC-F=33,8, 30,0 Гц, CCF2), 130,9 (с, С, Ph), 129,4 (с, СН, Ph), 129,3 (с, СН, Ph), 126,1 (с, 1 2 1 2 СН, Ph), 118,4 (кт, JC-F=285,0 Гц, JC-F=36,3 Гц, CF2CF3), 111,3 (тк, JC-F=255,1 Гц, JC-F=38,9 Гц, CF2CF3), 63,1 (с, СНСО), 51,2 (с, СНСО). 19 2 F ЯМР (375 МГц; CDCl3; CFCl3), : -82,41 (с, 3F, CF2CF3, 2a), -83,07 (τ, JF-F=3,8 Гц, 3F, 2 2 CF2CF3, 2b), -111,40 (д, JF-F=293,3 Гц, 1F, CFFCF3, 2b), -112,81 (д, JF-F=293,3 Гц, 1F, CFFCF3, 2 3 2 3 2b), -117,60 (дд, JF-F=278,2 Гц, JF-H=7,5 Гц, 1F, CFFCF3, 2a), -125,11 (дд, JF-F=278,2 Гц, JFH=18,8 Гц, 1F, CFFCF3, 2a). + MC (XI): m/z (%)=334 [M+1] . (3RS, 3RS, 6RS)-5-(2-бромофеніл)-3-(пентафлуоретил)-3а, 6а-дигідропіроло[3,4-с]піразол4,6(3H, 5H)-діон (3а), (3RS, 6RS)-5-(2-бромофеніл)-3-(пентафлуоретил)-3а, 6а-дигідропіроло[3,4-с)піразол-4,6(1H, 5H)-діон (3b). Суміш 3a/3b (1/3,7) отримували як білу тверду речовину (65 мг, 99 %), слідуючи загальній методиці. Тпл.=62-63 °C. 1 H ЯМР (500 МГц; CDCl3; Me4Si), : 7,50 (τ, J=7,5 Гц, 2Η, С6H4, 3b), 7,46 (м, 2Н, С6H4, 3а), 7,25 (д, J=7,5 Гц, 2Н, С6H4, 3b), 7,20 (д, J=7,5 Гц, 2Н, С6H4, 3а), 7,06 (ш с, NH, 1Н, 3b), 6,01 (дд, J=7,5, 3 3 2,0 Гц, 1H, 3а), 5,80 (м, 1H, 3а), 5,01 (1H, д, JH-H=10,5 Гц, СОСH, 3b), 4,57 (1H, д, JH-H=10,5 Гц, СОСH, 3b), 3,61 (дд, J=7,5, 3,0 Гц, 1H, 3а). 13 С ЯМР (125 МГц; CDCl3; Me4Si основний ізомер 3b), : 173,4 (с, NCO), 169,8 (с, NCO), 134,5 2 (дд, JC-F=33,8, 31,3 Гц, CCF2), 130,9 (с, С, Ph), 129,4 (с, СН+СН, Ph), 129,3 (с, СН+СН, Ph), 126,1 1 2 1 2 (с, СН, Ph), 118,4 (кт, JC-F=284,0 Гц, JC-F=35,0 Гц, CF2CF3), 110,2 (тк, JC-F=250,0 Гц, JC-F=40,0 Гц, CF2CF3), 63,1 (с, СНСО), 51,8 (с, СНСО). 19 3 F ЯМР (375 МГц; CDCl3; CFCl3), : -82,45 (с, 3F, CF2CF3, 3а), -83,07 (τ, JF-F=3,8 Гц, 3F, 2 2 CF2CF3, 3b), -111,41 (д, JF-F=293,3 Гц, 1F, CFFCF3, 3b), -112,83 (д, JF-F=293,3 Гц, 1F, CFFCF3, 13 5 10 15 20 25 30 35 40 45 50 55 60 8 UA 107358 U 2 5 10 15 20 25 30 35 40 45 50 55 60 3 2 3 3b), -117,56 (дд, JF-F=274,5 Гц, JF-h=7,5 Гц, 1F, CFFCF3, 3a), -125,10 (дд, JF-F=274,5 Гц, JFH=18,8 Гц, 1F, CFFCF3, 3a). + MC (XI): m/z (%) = 412, 414 [M+1] . (3RS, 3RS, 6RS)-5-(4-Метоксифеніл)-3-(пентафлуоретил)-3а, 6а-дигідропіроло[3,4-с]піразол4,6(3H, 5H)-діон (4а), (3RS, 6RS)-5-(4-Метоксифеніл)-3-(пентафлуоретил)-3а, 6а-дигідропіроло[3,4-с]піразол4,6(1H, 5H)-діон (4b). Суміш 4a/4b (1/0,9) отримували як білу тверду речовину (56 мг, 97 %), слідуючи загальній методиці. Тпл.=125-126 °C. 1 H ЯМР (500 МГц; CDCl3; Me4Si), : 7,17 (д, J=8,5 Гц, 2H, С6H4, 4b), 7,12 (д, J=8,5 Гц, 2Н, С6H4, 4а), 7,05 (ш с, NH, 1H, 4b), 7,00 (д, J=8,5 Гц, 2Н, С6H4, 4а), 6,97 (ш с, NH, 1H, 4b), 6,01 (д, 3 3 J=7,5 Гц, 1H, 4а), 5,80 (м, 1Н, 4а), 5,03 (1Н, д, JH-H=10,5 Гц, СОСH, 4b), 4,58 (Ш, д, JH-H=10,5 Гц, СОСH, 4b), 3,84 (с, 3Н, ОСH3, 4а), 3,83 (с, 3Н, ОСH3, 4b), 3,60 (дд, J=7,5, 2,5 Гц, 1H, 4а). 13 С ЯМР (125 МГц; CDCl3; Me4Si), : 173,5, 172,0 (2с, NCO, 4a+4b), 169,9, 166,0 (2c, NCO, 2 4a+4b), 160,1, 160,0 (c, COMe, Ph, 4a+4b), 134,7 (дд, JC-F=33,8, 30,0 Гц, CCF2,4b), 127,4 (c, CH, 1 2 Ph, 4a+4b), 123,4, 122,8 (2 c, CH, Ph, 4a+4b), 118,4 (кт, JC-F=283,4 Гц, JC-F=35,0 Гц, CF2CF3, 1 2 4a+4b), 114,7 (2 c, CH, Ph, 4a+4b), 111,1 (тк, JC-F=263,8 Гц, JC-F=40,0 Гц, CF2CF3, 4a+4b), 94,8 (c, 2 NCHCO, 4a), 91,6 (τ, JC-F=35,0 Гц, CHCF2CF3, 4a), 63,0 (c, CHCO, 4b), 55,5 (с, ОСН3, 4a+4b), 51,7 (c, CHCO, 4b), 38,1 (c, CHCHCO, 4a). 19 3 F ЯМР (375 МГц; CDCl3; CFCl3), : -82,44 (с, 3F, CF2CF3, 4a), -83,08 (τ, JF-F=3,8 Гц, 3F, 2 2 CF2CF3, 4b), -111,38 (д, JF-F=293,3 Гц, 1F, CFFCF3, 4b), -112,82 (д, JF-F=293,3 Гц, 1F, CFFCF3, 2 3 2 3 4b), -117,55 (дд, JF-F=274,5 Гц, JF-H=7,5 Гц, 1F, CFFCF3, 4a), -125,31 (дд, JF-F=274,5 Гц, JFH=18,8 Гц, 1F, CFFCF3, 4a). + MC (XI): m/z (%)=364 [M+1] . (3RS, 3RS, 6RS)-5-(1-Нафтил)-3-(пентафлуоретил)-3а, 6а-дигідропіроло[3,4-с]піразол4,6(3H, 5H)-діон (5а), (3RS, 6RS)-5-(1-Нафтил)-3-(пентафлуоретил)-3а, 6а-дигідропіроло[3,4-с]піразол-4,6(1H, 5H)діон (5b). Суміш 5a/5b (1/1,5) отримували як білу тверду речовину (61 мг, 99 %), слідуючи загальній методиці. Тпл.=85-86 °C. ЯМР спектри складні, тому що кожен ізомер представлений двома атропоізомерами відповідно до ускладненого повороту навколо N-нафтильного зв'язку. 1 H ЯМР (500 МГц; CDCl3; Me4Si), : 8,01-6,92 (м, Нафтил 5а+5b та NH 5b), 6,17, 6,07 (2 д, 3 J=7,5 Гц, 1H, 5a), 5,94 (м, 1H, 5a), 5,16, 5,09 (1H, д, JH-H=10,5 Гц, СОСH, 5b), 4,71, 4,64 (1H, д, 3 JH-H=10,5 Гц, СОСH, 5b), 3,83, 3,74 (2 д, J=7,5, 1H, 5a). 13 C ЯМР (125 МГц; CDCl3; Me4Si, основний ізомер 5b), : 173,3, 173,2 (2 с, NCO), 169,5 (с, 2 NCO), 133,7 (дд, JC-F=32,5, 30,0 Гц, CCF2), 134,3 (с), 130,3 (с), 128,6 (с), 128,4 (с), 127.4 (с), 127,0 1 (с), 126,9 (с), 126,6 (с), 126,5 (с), 125,8 (с), 121,1 (с), 124,9 (с), 121,0 (с), 120.5 (с), 118,0 (кт, JC2 1 2 F=285,0 Гц, JC-F=35,0 Гц, CF2CF3), 109,8 (тк, JC-F=266,3 Гц, JC-F=38,9 Гц, CF2CF3), 63,2, 62,9 (2 с, СНСО), 51,7 (2 с, СНСО). 19 F ЯМР (375 МГц; CDCl3; CFCl3), : -82,37, -82,39 (2 с, 3F, CF2CF3, 5a), -82,93, -83.02 (2 с, 3F, 2 2 CF2CF3, 5b), -110,70, -111,30 (2 д, JF-F=297,0 Гц, 1F, CFFCF3, 5b), -112,41, -112,62 (2 д, JF2 3 F=297,0 Гц, 1F, CFFCF3, 5b), -117,62, -117,65 (2 дд, JF-F=275,0 Гц, JF-H=7,5 Гц, 1F, CFFCF3, 5a), 2 3 125,28, -125,38 (2 дд, JF-F=275,0 Гц, JF-H=18,8 Гц, 1F, CFFCF3, 5a). + MC (XI): m/z (%)=384 [M+1] . Етил 4-[(3RS, 6RS)-4,6-діоксо-3-(пентафлуоретил)-3а, 4,6,6а-тетрагідропіроло[3,4-с]піразол5(1H)-ил]бензоат (6b) Сполуку 6b отримували як білу тверду речовину (64 мг, 99 %), слідуючи загальній методиці. Тпл.=149 °C. 1 H ЯМР (500 МГц; CDCl3; Me4Si), : 8,17 (д, J=8,5 Гц, 2H, С6H4), 7,40 (д, J=8,5 Гц, 2Н, С6H4), 7,07 (ш с, 1H, NH), 5,09 (д, J=10,5 Гц, 1H, СОСH), 4,63 (д, J=10,5 Гц, 1Н, СОСH), 4,42 (к, J=7,5 Гц, 2Н, ОСH2СН3), 1,42 (т, J=7,5 Гц, 3Н, ОСН2СH3). 13 С ЯМР (125 МГц; CDCl3; Me4Si), : 172,8 (с, NCO), 169,2 (с, NCO), 165,5 (с, COO), 134.6 (с, 2 С, С6Н4), 134,1 (дд, JC-F=32,5, 30,0 Гц, CCF2), 131,1 (с, С, С6H4), 130,6 (с, СН, С6Н4), 125,9 (с, СН, 1 2 1 2 С6Н4), 118,4 (кт, JC-F=285,0 Гц, JC-F=36,3 Гц, CF2CF3), 109,7 (тк, JC-F=250,0 Гц, JC-F=36,3 Гц, CF2CF3), 63,1 (с, СНСО), 61,4 (с, СН3СН2О), 51,8 (с, СНСО), 14,3 (с, СН3СН2О). 19 2 F ЯМР (375 МГц; CDCl3; Me4Si), : -83,07 (с, 3F, CF2CF3), -111,38 (д, JF-F=293,3 Гц, 1F, 2 CFFCF3), -112,91 (д, JF-F=293,3 Гц, 1F, CFFCF3). + MC (XI): m/z (%)=406 [M+1] . Аналітичний підрахунок для C16H12F5N3O4: С, 47,42; Н, 2,98; N, 10,37. Знайдено: С, 47,15; Н, 2,71; N, 10,14. 9 UA 107358 U 5 10 15 20 25 30 35 40 45 50 55 3-(Пентафлуоретил)-4,5-дигідро-1H-піразол-5-карбонітрил (8с) Сполуку 8с отримували як білу тверду речовину (33 мг, 97 %), слідуючи загальній методиці. Тпл.=34-35 °C. 1 H ЯМР (500 МГц; CDCl3; Me4Si), : 6,67 (ш с, 1Н, NH), 4,55 (м, 1H, СH), 3,20 (м, 2Н, СН2). 13 1 2 С ЯМР (125 МГц; CDCl3; Me4Si), : 123,3 (с, CN), 118,2 (кт, JC-F=283,8 Гц, JC-F=35,0 Гц, 1 2 2 CF2CF3), 112,6 (с, С), 111,9 (тк, JC-F=256,3 Гц, JC-F=36,3 Гц, CF2CF3), 59,4 (τ, JC-F=22,5 Гц, CCF2), 33,5 (с, СН2). 19 2 3 F ЯМР (375 МГц; CDCl3; CFCl3), : -83,31 (с, 3F, CF2CF3), -125,81 (дд, JF-F=270,7 Гц, JF2 3 H=11,3 Гц, 1F, CFFCF3), -126,92 (дд, JF-F=270,7 Гц, JF-H=15,0 Гц, 1F, CFFCF3). + MC (XI): m/z (%)=214 [M+1] . Аналітичний підрахунок для C6H4F5N3: С, 33,82; Η, 1,89; Ν, 19,72. Знайдено: С, 33,62; Η, 1,98; Ν, 19,45. Метил 3-(пентафлуоретил)-4,5-дигідро-1H-піразол-5-карбоксилат (9с) Метил (3RS, 5RS)-5-(пентафлуоретил)-4,5-дигідро-3H-піразол-3-карбоксилат (9а) Суміш 9с/9а (1/0,12) отримували як білу тверду речовину (39 мг, 98 %), слідуючи загальній методиці. Аналітично чистий зразок 9с отримували кристалізацією з циклогексану. Тпл.=9192 °C. 1 H ЯМР (500 МГц; CDCl3; Me4Si), : 6,50 (ш с, 1H, NH), 4,51 (м, 1H, СH), 3,86 (с, 3Н, СH3), 3,23 (м, 2Н, СH2). 13 1 2 С ЯМР (125 МГц; CDCl3; Me4Si), : 161,9 (с, СО), 142,2 (с, C), 118,7 (кт, JC-F=285,0 Гц, JC2 2 F=35,0 Гц, CF2CF3), 112,7 (тк, 'jc.F=256,3 Гц, JC-f=37,5 Гц, CF2CF3), 60,2 (дд, JC-f=23,8, 21,3 Гц, CCF2), 52,4 (с, ОСН3), 32,0 (с, СН2). 19 2 3 F ЯМР (375 МГц; CDCl3; CFCl3), : -83,33 (с, 3F, CF2CF3), -125,91 (дд, JF-F=270,7 Гц, JF2 3 H=11,3 Гц, 1F, CFFCF3), -127,10 (дд, JF-F=270,7 Гц, JF-H=15,0 Гц, 1F, CFFCF3). + MC (XI): m/z (%)=257 [M+1] . Аналітичний підрахунок для C7H7F5N2O2: С, 34,16; Η, 2,87; Ν, 11,38. Знайдено: С, 33,95; Η, 2,51; Ν, 11,55. трет-Бутил 5-(пентафлуоретил)-4,5-дигідро-1H-піразол-3-карбоксилат (10с) Сполуку 10с отримували як білу тверду речовину (46 мг, 99 %), слідуючи загальній методиці. Тпл.=116-117 °C. 1 H ЯМР (500 МГц; CDCl3; Me4Si), : 6,29 (ш с, 1H, NH), 4,45 (м, 1H, СH), 3,17 (м, 2Н, СH2), l, 55(c, 9H, tBu). 13 1 2 С ЯМР (125 МГц; CDCl3; Me4Si), : 160,3 (с, СО), 144,0 (с, С), 118,4 (кт, JC-F=285,0 Гц, JC1 2 2 F=36,3 Гц, CF2CF3), 112,4 (тк, JC-F=255,0 Гц, JC-F=37,5 Гц, CF2CF3), 82,3 (с, °C(СН3)3), 59,7 (т, JCF=23,8 Гц, CCF2), 31,8 (с, СН2) 27,7 (с, °C(СН3)3). 19 2 3 F ЯМР (375 МГц; CDCl3; CFCl3), : -83,33 (с, 3F, CF2CF3), -125,74 (дд, JF-F=270,7 Гц, JF2 3 H=11.3 Гц, 1F, CFFCF3), -126,91 (дд, JF-F=270,7 Гц, JF-H=15,0 Гц, 1F, CFFCF3). + MC (XI): m/z (%)=289 [M+1] . Аналітичний підрахунок для C10H13F5N2O2: С, 41,67; Η, 4,55; Ν, 9,72. Знайдено: С, 41,33; Η, 4,29; Ν, 9,45. 1-[5-(Пентафлуоретил)-4,5-дигідро-1H-піразол-3-ил/етанон (11c) Сполуку 11с отримували як білу тверду речовину (39 мг, 97 %), слідуючи загальній методиці. Тпл.=61-62 °C. 1 H ЯМР (500 МГц; CDCl3; Me4Si), : 6,50 (ш с, 1H, NH), 4,48 (м, 1H, СH), 3,16 (м, 2Н, СH2), 1,55 (с, 3Н, СH3). 13 1 2 С ЯМР (125 МГц; CDCl3; Me4Si), : 193,7 (с, СО), 150,3 (с, С), 118,8 (кт, JC-F=283,8 Гц, JC1 2 2 F=36,3 Гц, CF2CF3), 112,8 (тк, JC-F=255,0 Гц, JC-F=35,0 Гц, CF2CF3), 60,3 (дд, JC-F=25,0, 21,3 Гц, CCF2), 30,4 (с, СН2) 25,5 (с, СН3). 19 2 3 F ЯМР (375 МГц; CDCl3; CFCl3), : -83,27 (с, 3F, CF2CF3), -125,74 (дд, JF-F=270,7 Гц, JF2 3 H=11,3 Гц, 1F, CFFCF3), -126,85 (дд, JF-F=270,7 Гц, JF-H=11,3 Гц, 1F, CFFCF3). + MC (XI): m/z (%) = 251 [M+1] . Аналітичний підрахунок для C7H7F5N2O: С, 36,53; Η, 3,07; Ν, 12,17. Знайдено: 36,12; Η, 2,78; Ν, 11,95. 5-(пентафлуоретил)-4,5-дигідро-1H-піразол-3-сульфонілфлуорид (12с) Сполуку 12с отримували як білу тверду речовину (41 мг, 95 %), слідуючи загальній методиці. Жовтувата олія. 1 H ЯМР(500 МГц; CDCl3; Me4Si), : 6,92 (ш с, 1Н, NH), 4,77 (м, 1H, СH), 3,44 (м, 2Н, СH2). 10 UA 107358 U С ЯМР (125 МГц; CDCl3; Me4Si), : 140,7 (д, JC-F=38,8 Гц, CSO2F), 118,0 (кт, JC-F=285,0 Гц, 1 2 2 JC-F=35,0 Гц, CF2CF3), 111,6 (тк, JC-F=256,3 Гц, JC-F=36,3 Гц, CF2CF3), 61,3 (д, JC-F=23,8 Гц, CCF2), 31,3 (с, СН2). 19 2 3 F ЯМР (375 МГц; CDCl3; CFCl3), : -83,14 (с, 3F, CF2CF3), -126,01 (дд, JF-F=274,5 Гц, JF2 3 H=11,3 Гц, 1F, CFFCF3), -126,92 (дд, JF-F=274,5 Гц, JF-H=11,3 Гц, 1F, CFFCF3), -191.00 (c, 1F, SO2F). + MC (XI): m/z (%)=271 [M+1] . Аналітичний підрахунок для C5H4F6N2O2S: С, 22,23; Η, 1,49; Ν, 10,37; S, 11,87. Знайдено: С, 22,01; Η, 1,35; Ν, 10,22; S, 12,03. 3-(метилсульфоніл)-5-(пентафлуоретил)-4,5-дигідро-1H-піразол (13с) Сполуку 13с отримували як білу тверду речовину (40 мг, 95 %), слідуючи загальній методиці. Тпл.=74-75 °C. 1 H ЯМР (500 МГц; CDCl3; Me4Si), : 6,50 (ш с, 1H, NH), 4,59 (м, 1H, СH), 3,37 (м, 2Н, СH2),3,18 (с, 3Н, СH3). 13 1 2 С ЯМР (125 МГц; CDCl3; Me4Si), : 150,7 (с, C), 118,3 (кт, JC-F=285,0 Гц, JC-F=35,0 Гц, 1 2 2 CF2CF3), 112,1 (тк, JC-F=255,0 Гц, JC-F=36,3 Гц, CF2CF3), 60,4 (τ, JC-F=23,8 Гц, CCF2), 40,7 (с, ОСН3), 30,4 (с, СН2). 19 F ЯМР (375 МГц; CDCl3; CFCl3), : -83,28 (ш с, 3F, CF2CF3), -125,20-126,80 (м, 2F, CF2CF3). + MC (XI): m/z (%) - 267 [M+1] . Аналітичний підрахунок для C6H7F7N2O2S: С, 27,07; Η, 2,65; Ν, 10,52; S, 12,05. Знайдено: С, 27,41; Η, 2,33; Ν, 10,21; S, 12,32. 5-(пентафлуоретил)-3-(фенілсульфоніл)-4,5-дигідро-1H-піразол (14с) Сполуку 14с отримували як білу тверду речовину (51 мг, 98 %), слідуючи загальній методиці. Жовтувата олія. 1 3 3 H ЯМР (500 МГц; CDCl3; Me4Si), : 7,95 (д, JH-H=7,0 Гц, 2Н, Ph), 7,69 (τ, JH-H=7,0 Гц, 1H, Ph), 3 7,60 (τ, JH-H=7,0 Гц, 2H, Ph), 4,56 (псевдо кв, J=11,5 Гц, 1H, СH), 3,36 (дд, J=17,0, 11,5 Гц, СHН), 3,19 (дд, J=17,0, 11,5 Гц, СHН). 13 С ЯМР (125 МГц; CDCl3; Me4Si), : 150,6 (с, C=N), 137,5 (с, Ph), 134,1 (с, Ph), 1 2 1 129.1 (с, Ph), 128,0 (с, Ph), 118,5 (кт, JC-F=286,0 Гц, JC-F=36,5 Гц, CF2CF3), 111,9 (тк, JC2 2 F=256,0 Гц, JC-F=36,5 Гц, CF2CF3), 60,7 (τ, JC-F=23,8 Гц, CCF2), 31,1 (с, СН2). 19 2 3 F ЯМР (375 МГц; CDCl3; CFCl3), : -83,29 (ш с, 3F, CF2CF3), -125,78 (дд, JF-F=274,5 Гц, JF2 3 H=11,3 Гц, 1F, CFFCF3), -126,59 (дд, JF-F=274,5 Гц, JF-H=11,3 Гц, 1F, CFFCF3). + MC (XI): m/z (%)=329 [M+1] . Аналітичний підрахунок для C11H9F5N2O2S: С, 40,25; Η, 2,76; Ν, 8,53; S, 9,77. Знайдено: С, 40,43; Η, 2,99; Ν, 8,21; S, 9,52. Етил 3-(3-нітропіридин-2-ил)-5-(пентафлуоретил)-4,5-дигідро-3H-піразол-3-карбоксилат (19а) Сполуку 19а отримували як суміш ізомерів у вигляді жовтої рідини (61 мг, 99 %), слідуючи загальній методиці. Основний ізомер (37 мг) отримували випаровуванням з розбавленого розчину 19а в ізопропанолі. Біла тверда речовина. Тпл.=97-98 °C. 1 H ЯМР (500 МГц; CDCl3; Me4Si), : 8,73 (ш с, 1H, Ру), 8,45 (д, J=8,5 Гц, 1Н, Ру), 7,58 (м, 1H, Ру), 5,08 (м, 1H, CHCF2), 4,03 (ш м, 2Н, СH2СН3), 2,80 (м, 1H, СHН), 2,71 (м, 1Н, СНH), 1,27 (т, J=7,0 Гц, 3Н, СН2СH3). 13 С ЯМР (125 МГц; CDCl3; Me4Si), : 165,6 (с, СО), 152,1 (с, Ру), 148,7 (с, Ру), 144,0 (с, Ру), 1 2 133,4 (с, Ру), 124,2 (с, Ру), 118,7 (кт, JC-F=284,0 Гц, JC-F=35,0 Гц, CF2CF3), CF2 не видно, 102,8 (с, 2 NCCO), 88,2 (т, JC-F=21,3 Гц, CCF2), 62,9 (с, ОСН2), 27,6 (с, СН2), 13,4 (с, СН3). 19 2 3 F ЯМР (375 МГц; CDCl3; CFCl3), : -83,35 (с, 3F, CF2CF3), -120,91 (дд, JF-F=274,5 Гц, JF2 3 H=11,3 Гц, 1F, CFFCF3), -122,54 (дд, JF-F=274,5 Гц, JF-H=15,0 Гц, 1F, CFFCF3). + MC (XI): m/z (%) = 355 [M+1-N2] . Метил 3-флуор-5-(пентафлуоретил)-4,5-дигідро-3#-піразол-3-карбоксилат (20a), Метил 3-(пентафлуоретил)-1H-піразол-5-карбоксилат (29) Загальна методика призводить до утворення суміші 20а (цис + транс)/29 (2/1) у вигляді жовтуватої олії (39 мг, 95 % вихід). Жовтувата олія. 1 H ЯМР (500 МГц; CDCl3; Me4Si, тільки основний 20а), : 5,32, 5,17 (2 м, 1Н, СHСF2), 3,97, 3,96 (2 с, 3Н, ОСH3), 2,69, 2,34 (2 м, 1Н, СHН), 1,95(м, 1Н, СНH). Основний піразол 29 отримували з суміші 20а/29 таким чином: до розчину 20а/29 (39 мг, 0,15 ммоль) в дихлорометані (1 мл) додавали NEt3 (45 мг, 0,15 ммоль). Реакційну суміш перемішували при кімнатній температурі протягом 3 годин. Додавали дихлорметан (2 мл). Реакційну суміш промивали водою (1 мл), 1н. НСl (1 мл) та знову водою (1 мл). Органічну фазу сушили над Na2SO4 та випарювали у вакуумі з отриманням чистого піразолу 29 (15 мг, 0,14 ммоль) у вигляді білої твердої речовини. Тпл. = 80 °C 13 2 2 5 10 15 20 25 30 35 40 45 50 55 60 11 1 UA 107358 U H ЯМР (500 МГц; CDCl3; Me4Si), : 11,8 (ш с, 1H, ΝΗ), 7,11 (с, 1H, СН), 3,96 (с, 3Н, СH3). 1 С ЯМР (125 МГц; CDCl3; Me4Si), : 159,0 (с, СО), 142,8 (ш с, C), 135,5 (ш с, С), 118,6 (кт, JC2 1 2 F=285,0 Гц, JC-F=36,3 Гц, CF2CF3), 110,2 (тк, JC-F=250,0 Гц, JC-F=38,9 Гц, CF2CF3), 108,6 (с, СН), 52,7 (с, СН3). 19 F ЯМР (375 МГц; CDCl3; CFCl3), : -85,14 (с, 3F, CF2CF3), -113,82 (с, CF2CF3). + МС (XI): m/z (%) - 245 [M+1] . Аналітичний підрахунок для C7H5F5N2O2: С, 34,44; Η, 2,06; Ν, 11,48. Знайдено: С, 34,14; Η, 2,34; Ν, 11,68. Метил 3-метил-5-(пентафлуоретил)-4,5-дигщро-3H-піразол-3-карбоксилат (21а) Сполуку 21а отримували як суміш цис-/транс-ізомерів (2/1) у вигляді жовтуватої олії (40 мг, 96 %), слідуючи загальній методиці. Безбарвна олія. 1 H ЯМР (500 МГц; CDCl3; Me4Si), : 5,16, 5,05 (2 м, 1H, СHСF2), 3,86, 3,77 (2 с, 3Н, ОСH3), 2,48, 2,23 (2 дд, J=13,5, 9,0 Гц, СHН, 1Н), 1,92, 1,52 (2 м, СНH, 1H), 1,82, 1,53 (2 с, 3Н, СH3). 13 1 2 С ЯМР (125 МГц; CDCl3; Me4Si), : 169,8, 168,9 (2 с, СО), 118,4 (кт, JC-F=280,0 Гц, JC-F=36,3 1 2 Гц, CF2CF3), 112,3 (тк, JC-F=255,0 Гц, JC-F=36,3 Гц, CF2CF3), 97,1, 96,0 (2 с, NCCO), 88,4, 86,2 (2 2 т, JC-F=23,0 Гц, CCF2), 52,8 (с, ОСН3), 28,5, 27,3 (2 с, СН2), 21,9, 20,8 (2 с, СН3). 19 2 F ЯМР (375 МГц; CDCl3; CFCl3), : -83,24, -83,29 (2 с, 3F, CF2CF3), -121,34, -121,36 (2 дд, JF3 2 3 F=274,5 Гц, JF-H=15,0 Гц, 1F, CFFCF3), -123,27, -123,53 (2 дд, JF-F=274,5 Гц, JF-H=18,9 Гц, 1F, CFFCF3). + MC (XI): m/z (%)=233 [M+1-N2] . Метил 3-(2-метокси-2-оксоетил)-5-(пентафлуоретил)-4,5-дигідро-3H-піразол-3-карбоксилат (22а) Сполуку 22а отримували як суміші цис-/транс-ізомерів (1/1) у вигляді жовтуватої олії (49 мг, 97 %), слідуючи загальній методиці. Безбарвна олія. 1 H ЯМР (500 МГц; CDCl3; Me4Si), : 5,35, 5,25 (2 м, 1H, СHСF2), 3,84, 3,77, 3,74, 3,68 (4c, 6H, 2 2 ОСH3+ОСH3), 3,89, 3,32 (2 д, JH-H=17,5 Гц, СHНСО), 2,95, 2,74 (2 д, JH-H=17,5 Гц, 1H, СНHСО), 2 2 2,77, 2,36 (2 дд, JH-H=13,5, 8,0 Гц, СHН), 2,16, 1,68 (2 дд, JH-H=13,5, 8,0 Гц, СHН). 13 С ЯМР (125 МГц; CDCl3; Me4Si), : 169,4, 169,1, 168,0, 166,9 (4 s, CO+CO), С2F5 не видно, 2 98,5, 97,7 (2 с, NCCO), 88,9, 88,8 (2 τ, JC-F=22,5 Гц, CCF2), 53,2 (с, ОСН3), 53,2, 51,9, 51,8 (3 с, ОСН3+ОСН3), 39,3, 37,3 (2 с, СН2), 28,5, 27,3 (2 с, СН2). 19 2 F ЯМР (375 МГц; CDCl3; CFCl3), : -83,29, -83,31 (2 с, 3F, CF2CF3), -120,64, -121,60 (2 дд, JF3 2 3 F=285,8 Гц, JF-H=15,0 Гц, 1F, CFFCF3), -123,27, -123,53 (2 дд, JF-F=285,8 Гц, JF-H=18,9 Гц, 1F, CFFCF3). + МС (XI): m/z (%)=291 [M+1-N2] . Діетил (4RS, 5RS)-5-(пентафлуоретил)-4,5-дигідро-1H-піразол-3,4-дикарбоксилат (23с) Сполуку 23с отримували як білу тверду речовину (52 мг, 98 %), слідуючи загальній методиці. Вміст приб. 7 % цис-ізомеру. Аналітично чистий зразок отримували шляхом кристалізації з циклогексану. Тпл.=51-52 °C. 1 H ЯМР (500 МГц; CDCl3; Me4Si), : 6,53 (ш с, 1Н, NH), 4,78 (псевдо к, J=8,5 Гц, 1H, СHСF2), 4,30 (м, 5Н, СH+СH2+СH2), 1,35 (т, J=7,0 Гц, 3Н, СH3), 1,31 (т, J=7,0 Гц, 3Н, СH3). 13 С ЯМР (125 МГц; CDCl3; Me4Si), : 168,4 (с, СО), 160,3 (с, СО), C2F5 нe видно, 139,6 (с, 2 NCCO), 64,5 (дд, JC-F=25,0, 22,3 Гц, CCF2), 62,2 (с, ОСН2), 61,5 (с, ОСН2), 50,3 (с, СНСО), 13,7 (с, СН3), 13,5 (с, СН3). 19 2 3 F ЯМР (375 МГц; CDCl3; CFCl3), : -83,30 (с, 3F, CF2CF3), -124,91 (дд, JF-F=274,5 Гц, JF2 3 H=11,3 Гц, 1F, CFFCF3), -126,32 (дд, JF-F=274,5 Гц, JF-H=11,3 Гц, 1F, CFFCF3). + МС (XI): m/z (%)=333 [M+1] . Аналітичний підрахунок для C11H13F5N2O4: С, 39,77; Η, 3,94; Ν, 8,43. Знайдено: С, 39,41; Η, 3,62; Ν, 8,63. Диметил (4RS, 5RS)-5-(пентафлуоретил)-4,5-дигідро-1H-піразол-3,4-дикарбоксилат (24с) Сполуку 24с отримували як безбарвну олію (48 мг, 98 %), слідуючи загальній методиці. Безбарвна олія. 1 H ЯМР (500 МГц; CDCl3; Me4Si), : 6,82 (ш с, 1H, NH), 4,80 (псевдо к, J=12,0 Гц, 1Н, СHСF2), 4,33 (д, J=9,0 Гц, 1Н, СHСО), 3,85 (с, 3Н, СH3), 3,82 (с, 3Н, СH3). 13 С ЯМР (125 МГц; CDCl3; Me4Si), : 169,3 (с, СО), 161,2 (с, СО), 139,1 (с, NCCO), 118,6 (кг, 1 2 1 2 JC-F=285,0 Гц, JC-F=35,0 Гц, CF2CF3), 112,2 (тк, JC-F=255,0 Гц, JC-F=37,5 Гц, CF2CF3), 64,8 (дд, 2 JC-F=26,3, 22,5 Гц, CCF2), 53,4 (с, ОСН3), 52,6 (с, ОСН3), 50,3 (с, СНСО). 19 2 3 F ЯМР (375 МГц; CDCl3; CFCl3), : -83,11 (с, 3F, CF2CF3), -124,85 (дд, JF-F=274,5 Гц, JF2 3 H=11,3 Гц, 1F, CFFCF3), -126,18 (дд, JF-F=274,5 Гц, JF-H=15,0 Гц, 1F, CFFCF3). + MC (XI): m/z (%)=305 [M+1] . 1 13 5 10 15 20 25 30 35 40 45 50 55 12 UA 107358 U Аналітичний підрахунок для C9H9F5N2O4: С, 35,54; Η, 2,98; Ν, 9,21. Знайдено: С, 35,21; Η, 2,62; Ν, 9,45. ФОРМУЛА КОРИСНОЇ МОДЕЛІ 5 1. Спосіб одержання С2F5-заміщених піразолінів загальної формули (І): C2 F5 R 1 N R N H 10 15 20 25 2 , (I) 1 2 3 4 в якій R , R та R являють собою незалежно один від одного Н, F, CN, С1-С6-алкіл, COOR , 4 4 4 4 COOR , SO2F, SO2R , -(С1-С6-алкіл)-СОOR , -(С1-С6-алкіл)-COR , С6-С10-арил або С2-С9гетероарил, кожен С6-С10-арил або С2-С9-гетероарил необов'язково заміщений одним або більшою кількістю замісників, незалежно вибраних з С 1-С6-алкілу, С2-С6-алкенілу, С2-С6-алкінілу, С1-С6-алкокси, С3-С10-циклоалкілу, С6-С10-арилу, С2-С9-гетероарилу, ОН, SH, Hal, -CN, NO2, NHС1-С6-алкілу, -N(С1-С6-алкіл)2, -CONHС1-С6-алкілу, -СОС1-С6-алкілу, -СООС1-С6-алкілу, -SС1С6-алкілу, -SOС1-С6-алкілу або -SO2С1-С6-алкілу; 4 де R являє собою незалежно С1-С6-алкіл, С3-С10-циклоалкіл, С6-С10-арил або С2-С9-гетероарил, кожен з яких необов'язково заміщений одним або більшою кількістю замісників, незалежно вибраних з С1-С6-алкілу, С2-С6-алкенілу, С2-С6-алкінілу, С1-С6-алкокси, С3-С10-циклоалкілу, С6С10-арилу, С2-С9-гетероарилу, галогену, ОН, SH, -CN, NO2, -NHС1-С6-алкілу, -N(С1-С6-алкіл)2, CONHС1-С6-алкілу, -СОС1-С6-алкілу, -СООС1-С6-алкілу, -SС1-С6-алкілу, -SOС1-С6-алкілу або SO2С1-С6-алкілу; 1 2 або R та R можуть бути об'єднані разом, утворюючи 5-членну циклічну систему, що містить N як елемент кільця, і де кільце, яке необов'язково заміщене одним або більшою кількістю замісників, незалежно вибраних з =O, С1-С6-алкілу, С6-С10-арилу, де С1-С6-алкільний та С6-С10арильний фрагменти необов'язково заміщені одним або більшою кількістю замісників, незалежно вибраних з галогену, С 1-С6-алкілу, С1-С6-алкокси, С3-С10-циклоалкілу, С6-С10-арилу, СООС1-С6-алкілу; в якому алкени загальної формули (II): 30 R R 3 2 R , (II) 1 35 1 2 3 в якій R , R та R є такими, як визначено вище; вводять в реакцію з C2F5CHN2, що одержують in situ реакцією C2F5CH2NH2 з NaNO2, з одержанням С2F5-заміщених піразолінів загальної формули (І). 2. Спосіб за п. 1, який відрізняється тим, що C2F5CH2NH2 використовують у формі гідрохлориду і реакцію одержання C2F5CHN2 проводять у суміші метиленхлориду та води. Комп’ютерна верстка О. Рябко Державна служба інтелектуальної власності України, вул. Василя Липківського, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 13
ДивитисяДодаткова інформація
МПК / Мітки
МПК: C07D 231/28, C07D 231/54, C07D 231/06
Мітки: одержання, c2f5-заміщених, спосіб, піразолінів
Код посилання
<a href="https://ua.patents.su/15-107358-sposib-oderzhannya-c2f5-zamishhenikh-pirazoliniv.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання c2f5-заміщених піразолінів</a>
Попередній патент: Спосіб одержання 2,2-дифлуордіазоетану
Наступний патент: Спосіб одержання c2f5-заміщених піразолів
Випадковий патент: Фармацевтична композиція, що містить аспірин та бісопролол












