Спосіб одержання заміщених 5-аміно-3-арил-1н-піразолів
Номер патенту: 78461
Опубліковано: 15.03.2007
Автори: Черненко Віталій Миколайович, Афанасіаді Людмила Михайлівна, Десенко Сергій Михайлович
Формула / Реферат
Спосіб одержання заміщених 5-аміно-3-арил-1Н-піразолів загальної формули І
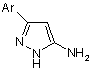 , І
, І
 ;
;  ;
;  ;
;
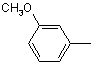 ;
; 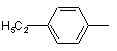 ;
; 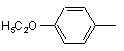 ;
;
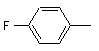 ;
; 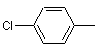 ;
; 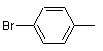 ;
;
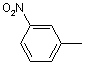 ;
; 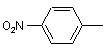 ;
;
при якому проводять синтез заміщених β-хлорцинамонітрилів і їх взаємодію з гідразингідратом у спиртовому середовищі до утворення основних продуктів, який відрізняється тим, що синтез заміщених β-хлорцинамонітрилів здійснюють обробкою заміщених арилметилкетонів формілуючою сумішшю хлороксиду фосфору в диметилформаміді у співвідношенні 1:2 при температурі реакції 35-45°С, утворений напівпродукт конденсують з гідрохлоридом гідроксиламіну, і синтез проводять впродовж часу, необхідного для повного завершення реакції.
Текст
Спосіб одержання заміщених 5-аміно-3-арил1Н-піразолів загальної формули І Ar H 5C 2 ; ; H 5C 2O ; F Cl ; ; Br ; O2N ,І H 3C Ar ; ; CH 3O (19) UA ; ; ; при якому проводять синтез заміщених βхлорцинамонітрилів і їх взаємодію з гідразингідратом у спиртовому середовищі до утворення основних продуктів, який відрізняє ться тим, що синтез заміщених β-хлорцинамонітрилів здійснюють обробкою заміщених арилметилкетонів формілуючою сумішшю хлороксиду фосфору в диметилформаміді у співвідношенні 1:2 при температурі реакції 35-45°С, утворений напівпродукт конденсують з гідрохлоридом гідроксиламіну, і синтез проводять впродовж часу, необхідного для повного завершення реакції. (13) NH 2 78461 N H C2 O2N (11) N CH 3O Винахід відноситься до області органічної хімії, саме, до способу одержання заміщених 5аміно-3-арил-1Н-піразолов загальної формули І Ar N N H NH 2 ,І 3 78461 H 3C Ar ; ; CH 3O ; CH 3O 4 Спосіб не знайшов практичного використання. Відомий спосіб одержання 5-аміно-3-метил-1феніл-1Н-піразолу [Десенко С.М., Орлов В.Д., Азагетероциклы на основе ароматических непредельных кетонов, Фолио, Харьков, 1998, с. 118-119], що складається із двох стадій. Спосіб реалізується за наступною схемою: 2 CH3CN H 5C 2 ; ; ; Cl ; C6H5NH NH2 CN H3C H2 N N N C6H5 H 5C 2O F CH3 NH Na ; Br 4 O2N O2N ; . Завдяки наявності аміногрупи ці сполуки необхідні при вирішенні низки практичних задач у препаративному органічному синтезі, наприклад, при одержанні азобарвників, азометинів, анілідів, як інтермедіати синтезу різних складних гетероциклічних сполук, а також передбачається їх використання як фізіологічно активних речовин, що мають важливе значення у життєдіяльності людського організму. Однак внаслідок складності технології одержання сполуки формули І обмежено використовуються в органічному синтезі лише як реактиви у невеликих кількостях у лабораторних синтезах та дослідженнях. Відомий спосіб одержання 5-аміно-3-арил-1Нпіразолів [Грандберг Й., Дин Вэй-пы, Кост А., Ж. общей химии, 31, 2311, (1961)]. У даному способі автори описують тільки останню стадію одержання 5-аміно-3-арил-1Н-піразолів. Ця стадія складається із взаємодії ароїлацетонітрилу з гідразингідратом. Для одержання продуктів реакції, що використовуються на останній стадії, необхідно синтезувати ще три проміжних продукти, що для спеціаліста у даній області є очевидним. Авторами цієї роботи одержано всього лише два продукти - 5-аміно-3-феніл- і 5-аміно-3-(4амінофеніл)-1Н-піразоли. Виходи кінцевих продуктів вказані лише на останній стадії без урахування виходів проміжних продуктів на попередніх стадіях (виходи дво х описаних у джерелі продуктів на останній стадії складають 55 % і 85 %, відповідно). Недоліком відомого способу вже на останній стадії є відгін розчинника у вакуумі і перекристалізації з легкозаймистих, токсичних розчинників (петролейний ефір, бензол). На першій стадії одержують діацетонітрил дією металічного натрію на ацетонітрил. Для переводу металічного натрію у диспергований стан використовують толуол та велику кількість сухого ефіру. Реакція взаємодії ацетонітрилу з натрієм сильно екзотермічна та проходить з виділенням величезної кількості тепла. Потребується ефективний тепловідвід, інакше може бути викид реакційної маси і займання легкозаймистого ефіру при контакті з нагрівальними приладами. Діацетонітрил, що утворився, екстрагують ефіром, що потребує подальшого його відгону після висушування розчину сульфатом магнію. Проміжний діацетонітрил перекристалізовують із бензолу, легкозаймистого розчинника. Час реакції приблизно 28-30 годин. На другій стадії одержаний діацетонітрил вводять у реакцію з феніл-гідразином у водному середовищі у присутності великої кількості соляної кислоти до утворення 5-аміно-3-метил-1фенілпіразолу. Час реакції приблизно 3-4 години. Загальний час синтезу 5-аміно-3-метил-1фенілпіразолу становить приблизно 30-35 годин. Недоліком відомого способу є використання великої кількості легкозаймистих вогненебезпечних розчинників (ефір, бензол). Використання токсичної, кров'яної отрути і канцерогенної речовини фенілгідразину також обмежує використання даної методики за відомим способом. Вказані недоліки не дають можливості використання цього способу у широких масштабах як у лабораторних дослідженнях, так і на виробництві хімічних речовин. Відомий спосіб одержання 5-аміно-З-арил-ІНпіразолів, що складається із чотирьох стадій [Десенко С.М., Орлов В.Д., Азагетероциклы на основе ароматических непредельных кетонов. Фолио, Харьков, 1998, с. 118-119]. Спосіб здійснюється за схемою: O Ar O O SOCl 2 NCCH2COOEt Ar OH Cl Ar OEt O CN NaOH (aq.) Ar O N2H4 *H2O N N H NH2 Ar CN На першій стадії одержують заміщені бензоїлхлориди дією тіоніл-хлоридом на заміщені ароматичні кислоти, очищення яких у деяких випадках вимагає вакуумної перегонки або перекристаліза 5 78461 6 ції із органічних розчинників. Бензоїлхлориди, що щених арилметилкетонів формілюючою сумішшю утворюються на першій стадії, є лакриматорами, хлороксиду фосфору у диметилформаміді у співщо подразнюють шкіру на руках і слизову оболонвідношенні 1:2 і при температурі реакційної маси ку очей та рота. Крім того, вони легко гідролізу35-45°С. Суміш витримують в цих умовах до одеються, що вимагає проведення реакції в умовах ржання продукту формілювання і конденсують з повного зневоднювання. Час реакції приблизно 8 гідрохлоридом гідроксиламіну. годин. Для введення формільної групи в органічні Друга стадія синтезу полягає у взаємодії ароїсполуки використовується формілюючий склад, лхлоридів з етиловим ефіром ціаноцтової кислоти що складається із суміші хлороксиду фосфору і в ацетоні. Присутність легкозаймистого й токсичдиметилформаміду. Для даного класу сполук фоного розчинника робить цю стадію реакції вогнермілюючої суміші (хлороксид фосфонебезпечною. Час реакції приблизно 6-8 годин. ру:диметилформамід - 1:2) раніш не використовуЕтиловий ефір β-ароїлціаноцтової кислоти, що вався. Його використання не є очевидним, утворився на другій стадії реакції, перетворюють в оскільки інші формілюючі склади для даної реакції ароїлацетонітрил обробкою 10%-ним розчином виявилися не придатними (наприклад, викорисїдкого натру. Виділяють продукт реакції насичентання тіонілхлориду, ди фосфорилхлориду). ням вуглекислим газом. Час проведення реакції У реакції одержання заявляємих сполук склад приблизно 30 годин. формілюючої суміші було підібрано таким чином На останній стадії одержують основний про(співвідношення хлороксиду фосфор у до диметидукт взаємодією ароїл-ацетонітрилу з гідразингідлформаміду - 1:2), щоб реакція пройшла з максиратом при нагріванні на киплячій водяній бані у мальним виходом без додаткових затрат вихідних середовищі етилового спирту. Розчинник і надлиреагентів. І цей склад виявився оптимальним. Опшковий гідразингідрат відгоняють у вакуумі. Залитимальним виявився і температурний режим форшок перекристалізовують із етилацетату. Час реамілювання, підібраний нами, а саме 35-45°С. кції приблизно 10 годин. При проведенні процесу формілювання при Недоліком цього відомого способу є те, що це температурі нижче, ніж 25°С із реакційної маси багатостадійний спосіб, тривалий за часом (з уравиділяють вихідний ацетофенон, що не прореагухуванням перекристалізацій кожного проміжного вав. Це свідчить про те, що реакція формілювання продукту на всіх те хнологічних стадіях цей процес ацетофенону при температурі нижчій, ніж заявлязаймає приблизно 50-56 годин), трудомісткий проється, не проходить. Аналіз масла з використанцес, пов'язаний з виділенням і очищенням проміжням тонкошарової хроматографії (ТШХ) у гептані них продуктів та вакуумної перегонки (кожна техпоказав відсутність продукту формілювання і нанологічна стадія потребує вакуумної перегонки). явність виключно вихідного ацетофенону. Вихід кінцевого продукту за відомою методиЯкщо перша стадія синтезу здійснюється при кою у перерахуванні на вихідні ароїлхлориди заграничній температурі, а саме 50°С, масло, що складає приблизно 25-40% в залежності від замісвиділяється із реакційної суміші, глибоко забарвника в арильному фрагменті. Технологічні стоки лене внаслідок утворення великої кількості смолизабруднені соляною кислотою і розчинами їдкого стих продуктів. При цій температурі відбувається натру. частковий розклад формілюючої суміші. Ви хід Використання зрідженого газу (вуглекислота) продукту формілювання незначний, складає притакож ускладнює проведення реакції, вимагає підблизно 20%. вищеної уваги при роботі із зрідженим газом. При зміні співвідношення реагентів - хлорокЗа відомою методикою не можна одержати сид фосфор у (1 частина) - диметилформамід (1 деякі заміщені аміно-піразоли, наприклад, що місчастина) [у заявляємому способі 1:2] реакція фортять нітрогрупу, гетероциклічні залишки - фуріл, мілювання проходить не повністю, утворюються тіофен та ін. смолисті напівпродукти, що важко ідентифікуютьНайбільш близьким за технічною суттю до ся, та дають слабке забарвлення продукту форміспособу, що заявляється, є останній, який і прийнлівання. Із реакційної маси частково виділено ацеято нами за прототип. тофенон, що не прореагував. Задача даного винаходу полягає у розробці Диметилформамід використовується у даній нового, простого і доступного методу одержання реакції формілювання не тільки як формілюючий заміщених 5-аміно-3-арил-1Н-піразолів, в якому за агент, але й як розчинник, середовище, в якому рахунок зміни умов проведення синтезу на стадії протікає реакція, благоприємно діє на хід процесу утворення заміщених β-хлорциннамонітрилів і виформілювання у необхідному напрямку. користання вогнебезпечних і нетоксичних реагенОбробка арилметилкетонів вказаним складом тів можна було б спростити процес, скоротити кіформілюючої суміші в оптимальному температурлькість технологічних стадій, підвищити вихід і ному режимі дозволяє прискорити реакцію утвоякість кінцевих продуктів зменшити кількість шкідрення β-хлорциннамонітрилів шляхом конденсації ливих технологічних стоків. формільного похідного з гідрохлоридом гідроксиПоставлена в основу цього винаходу задача ламіну. Це дає можливість відмовитися від одервирішується тим, що у способі одержання 5-аміножання проміжних продуктів (як за способом3-арил-1Н-піразолів, що включає синтез заміщепрототипом) і замінити перші 2 стадії реакції у проних β-хлорциннамонітрилів і їх конденсацію з гідтотипі однією стадією формілювання. Це привело разингідратом у спиртовому середовищі, відповіддо значного скорочення тривалості технологічного но винаходу, синтез заміщених βпроцесу і одержанню кінцевих продуктів - заміщехлорциннамонітрилів здійснюють обробкою замі 7 78461 8 них 5-аміно-3-арил-1Н-піразолів у дві реакційні Нижче наведено приклади конкретного викостадії. нання одержання заміщених 5-аміно-3-арил-1НЗбільшення виходу кінцевих продуктів і їх піразолів. якість відбулося за рахунок зменшення технологіПриклад 1. Одержання 5-аміно-3-феніл-1Нчних стадій і підбору оптимального температурнопіразолу. го режиму і концентраційного співвідношення реаУ тригорлій колбі, що обладнана зворотним гентів на стадії формілювання, що запобігає холодильником і розмішувачем, містять 200мл (2,1 утворенню смолистих продуктів. М) хлороксиду фосфору, при перемішуванні крапЗа заявляємим способом відпала необхідність лями додають 320мл диметилформаміду при темв одержанні і очищенні проміжних продуктів (як за пературі 20-25°С. Суміш витримують 30 хвилин, прототипом), що дозволило відмовитися від застододають порціями при інтенсивному перемішувансування вогненебезпечних і токсичних речовин та ні (у чотири прийоми) 120мл (120г, 1 моль) ацетозрідженого газу. фенону при температурі 35-45°С і залишають на 3 Основні продукти - заміщені 5-аміно-3-арилгодини до утворення напівпродукту. До реакційної 1Н-піразоли вже у результаті синтезу одержують маси додають 156г (2 моля) порціями по 1-2г суходостатньо чистими і потребують перекристалізації го гідро-хлориду гідроксиламіну (на киплячій водятільки із води (у відомому способі використовують ній бані). Після закінчення додавання суміш вилидля очистки етилацетат або суміш петролейного вають при перемішуванні у 2,5л холодної води. ефіру з бензолом). Таким чином, виключаються Утворений продукт - β-хлорциннамонітрил у видодаткові витрати органічних розчинників для очигляді масла відділяють. стки основного продукту, зменшуючи їх вартість. У круглодонну колбу із зворотним холодильниХлористий водень, що виділяється на першій ком, поміщають 124г (0,76 моля) βстадії, утилізується пропусканням у розчин гідрохлорциннамонітрилу і 76мл (1,52 моля) гідразингіксиду натрію і розбавляються водою. У відомому драту в 1л е тилового спирту. Суміш кип'ятять на способі утворюється велика кількість хлористововодяній бані протягом 6 годин. Спирт і гідразингіддневих відходів, що забруднюють промислові сторат, що не прореагував, відганяють на роторному ки. випарнику. Залишок розбавляють 1л води при Таким чином, заявляємий спосіб одержання перемішуванні. Осад, що випав, відфільтровують і заміщених 5-аміно-З-арил-ІН-піразолів дозволяє перекристалізовують із води. виключити використання легкозаймистих розчинЗовнішній вигляд - білі кристали. ників і мінімізувати шкідливі стоки виробництва. Вихідні дані: вихід 101г (60 %), Т. пл. 125Указані удосконалення позитивно відбивають127°С. ся і на синтезі другої стадії взаємодії рЕлементний аналіз - знайдено %: N 26.40, хлорциннамонітрилів з гідразингідратом. Синтез С9Н9N3. кінцевих продуктів проходить скоріше, і за 6 годин Обчислено %: 26.42. реакція протікає повністю (у прототипі - 8 годин). Структура 5-аміно-3-феніл-1Н-піразолу підСпосіб, що пропонується, складається із 2-х тверджена також спектральними даними. стадій і реалізується за схемою: Спектри ядерного магнітного резонансу (ЯМР Ar Н1) виміряно на спектрометрі VARIAN Mercury VXO 1) POCl3/ДМФА Cl N2H4*H2O 2) NH2OH*HCl 200 (200МГц) у розчинах дейтероCN N Ar CH3 Ar NH2 диметилсульфоксиду (ДМСО-d6), вн утрішній станN H дарт - тетраметилсилан; δ (м.ч.): 5.75 (1Н, с, СН піразол), 4.76 (2Н, у.с., NH2), 11.73 (1Н, у.с, NH), I 7.0-7.8 (5Н, м, Аr). На першій стадії одержують βПриклад 2. Одержання 5-аміно-3-(4хлорциннамонітрили. Для цього відповідні арилхлорфеніл)-1Н-піразолу (див. таблицю 2, поз. 2). метилкетони формілюють сумішшю хлороксиду Синтез проводять аналогічно прикладу 1, з тіфосфор у у диметилформаміді з наступною конєю лише різницею, що замість незаміщеного ацеденсацією з гідрохлоридом гідроксиламіну. тофенону використовують 4'-хлорацетофенон у На другій стадії β-хлорциннамонітрили конкількості 129мл (154г, 1 моль). Зовнішній вигляд денсують з гідразингідратом у спиртовому середобілі кристали. вищі, процес проводять вподовж 6 годин до повноВихідні дані: 158г (80%), Т. пл. 173-175°С. го завершення реакції і утворення кінцевих Елементний аналіз - знайдено %: N 21.70, продуктів. С9Н8Сl3. Загальна тривалість технологічного процесу Обчислено %: 21.69. за способом, що заявляється, складає 20-22 годиСпектр ЯМР Н1, δ (м.ч.): 5.74 (1Н, с, СН пірани. Вихід кінцевих продуктів за способом , що зазол), 4.89 (2Н, у.с., NH2), 11.78 (1Н, у.с., NH), 7.20являється, становить 50-80%. 7.85 (4Н, м. Аr). У таблиці 1 дано порівняльні характеристики Приклад 3. Одержання 5-аміно-3-(4способу, що заявляється, і прототипу. бромфеніл)-1Н-піразолу (див. таблицю 2, поз. 3). У таблиці 2 наведено температури плавлення, Синтез проводять аналогічно прикладу 1. Для виходи основних продуктів реакції одержання 51 реакції беруть 199 г (1 моль) 4'-бромацетофенону. аміно-3-арил-1Н-піразолів та спектри ЯМР Н заЗовнішній вигляд - білі кристали. міщених піразолів, що одержані за заявляємим Вихідні дані: 162г (67%), Т. пл. 173-175°С. способом, і для порівняння аналогічні характерисЕлементний аналіз - знайдено %: N 17.65, тики сполук, отриманих за способом-прототипом. C9H8Br3. 9 78461 10 Обчислено %: 17.63. Спектр ЯМР Н1, δ (м.ч.): 5.66 (1Н, с, СН піраСпектр ЯМР Н1, δ (м.ч.): 5.70 (1Н, с, СН піразол), 4.75 (2Н, y.c., NH 2), 11.50 (1Н, y.c., NH), 6.70зол), 4.63 (2Н, у.с., NH2), 11.55 (1Н, у.с., NH), 7.307.70 (4Н, м. Аr), 3.74 (3Н, с, ОСН3). 7.70 (4Н, м, Аr). Приклад 9. Одержання 5-аміно-3-(3Приклад 4. Одержання 5-аміно-3-(4метоксифеніл)-1Н-піразолу (див. таблицю 2, поз. фтор феніл)-1Н-піразолу (див. таблицю 2, поз. 4). 9). Синтез проводять аналогічно прикладу 1. Для Синтез проводять аналогічно прикладу 1. Для реакції беруть 122мл (138г, 1 моль) 4'реакції беруть 136мл (150г, 1 моль) 3'фторацетофенону. Зовнішній вигляд - білі кристаметоксиацетофенону. Зовнішній вигляд - білі крисли. тали. Вихідні дані: 130г (72%), Т. пл. 130-131°С. Вихідні дані: 95г (50%), Т. пл. 88-89°С. Елементний аналіз - знайдено %: N 23.72, Елементний аналіз - знайдено %: N 22.21, C9H8FN3. C10H11N3 O. Обчислено %: 23.75. Обчислено %: 22.20. Спектр ЯМР Н1, δ (м.ч.): 5.71 (1Н, с, СН піраСпектр ЯМР Н1, δ (м.ч.): 5.75 (1Н, с, СН піразол), 4.82 (2Н, у.с., NH2), 11.74 (1Н, у.с., NH), 7.10зол), 4.73 (2Н, у.с., NH2), 11.88 (1Н, у.с., NH), 6.607.80 (4Н, м, Аr). 7.40 (4Н, м, Аr), 3.76 (3Н, с, ОСН3). Приклад 5. Одержання 5-аміно-3-(4Приклад 10. Одержання 5-аміно-3-(4нітрофеніл)-1Н-піразолу (див. таблицю 2, поз. 5). зтилфеніл)-1Н-піразолу (див. таблицю 2, поз. 10). Синтез проводять аналогічно прикладу 1. Для Синтез проводять аналогічно прикладу 1. Для реакції беруть 165г (1 моль) 4'-нітроацетофенону. реакції беруть 145мл (148г, 1 моль) 4'Зовнішній вигляд - оранжевий дрібнокристалічний етилацетофенону. Зовнішній вигляд - білі кристапорошок. ли. Вихідні дані: 162г (78 %), Т. пл. 251-253°С. Вихідні дані: 114г (60%), Т. пл. 110-11°С. Елементний аналіз - знайдено %: N 15.67, Елементний аналіз - знайдено %: N 22.44, C9H8N4O2. С11Н13N3 . Обчислено %: 15.69. Обчислено %: 22.47. Спектр ЯМР Н1, δ (м.ч.): 5.88 (1Н, с, СН піраСпектр ЯМР Н1, δ (м.ч.): 5.70 (1Н, с, СН піразол), 5.10 (2Н, у.с., NH2), 12.00 (1Н, у.с., NH), 7.70зол), 4.92 (2Н, у.с., NH2), 11.12 (1Н, у.с., NH), 7.058.30 (4Н, м. Аr). 7.60 (4Н, м. Аr), 1.16 (3Н, т, СН3), 2.57 (2Н, кв, Приклад 6. Одержання 5-аміно-3-(3СН2). нітрофеніл)-1Н-піразолу (див. таблицю 2, поз. 6). Приклад 11. Одержання 5-аміно-3-(4Синтез проводять аналогічно прикладу 1. Для етоксифеніл)-1Н-піразолу (див. таблицю 2, поз. реакції беруть 165 г (1 моль) 3'-нітроацетофенону. 11). Зовнішній вигляд - жовті кристали. Синтез проводять аналогічно прикладу 1. Для Вихідні дані: 154 г (74 %), Т. пл. 134-136°С. реакції беруть 164г (1 моль) 4'Елементний аналіз - знайдено %: N 15.67, етоксиацетофенону. Зовнішній вигляд - білі крисC9H8N4O2. тали. Обчислено %: 15.65. Вихідні дані: 138г (67%), Т. пл. 155-157°С. Спектр ЯМР Н1, δ (м.ч.): 5.84 (1Н, с, СН піраЕлементний аналіз - знайдено %: N 20.67, зол), 5.05 (2Н, у.с., NH2), 11.79 (1Н, y.c., NH), 7.50С10Н13N3 О. 8.50 (4Н, м. Аr). Обчислено %: 20.65. Приклад 7. Одержання 5-аміно-3-(4Спектр ЯМР Н1, δ (м.ч.): 5.65 (1Н, с, СН піраметилфеніл)-1Н-піразолу (див. таблицю 2, поз. 7). зол), 4.75 (2Н, у.с., NH2), 11.43 (1Н, у.с., NH), 6.60Синтез проводять аналогічно прикладу 1. Для 7.90 (4Н, м. Аr), 1.29 (3Н, т, СН3), 3.99 (2Н, кв, реакції беруть 134мл (134г, 1 моль) 4'СН2). метилацетофенону. Зовнішній вигляд - білі крисДані таблиць 1 й 2 показують, що спосіб, що тали. заявляється, має низку суттєви х переваг у порівВихідні дані: 99г (56%), Т. пл. 143-145°С. нянні з прототипом і дозволяє: Елементний аналіз - знайдено %: N 24.26, - підвищити ви хід кінцевих продуктів (до 50C10H11N3 . 80%) у порівнянні із прототипом (25-40 %), а також Обчислено %: 24.25. їх якість за рахунок відсутності смолистих напівСпектр ЯМР Н1, δ (м.ч.): 5.70 (1Н, с, СН пірапродуктів; зол), 4.70 (2Н, y.c., NH 2), 11.61 (1Н, y.c., NH), 7.00- зменшити кількість технологічних стадій син7.60 (4Н, м. Аr), 2.28 (3Н, с, СН3). тезу до дво х (у прототипі - чотири), див. табл. 1; Приклад 8. Одержання 5-аміно-3-(4скоротити тривалість процесу до 20-22 годин (у метоксифеніл)-1Н-піразолу (див. таблицю 2, поз. прототипі - 50-56 годин); спосіб одержання сполук, 8). що заявляється, простий у технологічному викоСинтез проводять аналогічно прикладу 1. Для нанні, здійснюється у дві те хнологічні стадії з виреакції беруть 150г (1 моль) 4'користанням доступної сировини та може легко метоксиацетофенону. Зовнішній вигляд - білі крисвідтворюватися у виробничих умовах; тали. - використати у синтезі доступні реагенти, що Вихідні дані: 119г (62 %), Т. пл. 141-143°С. випускаються вітчизняною промисловістю; Елементний аналіз - знайдено %: N 22.21, - забезпечити відсутність токсичних, легкозайС10Н11N3 О. мистих і вогненебезпечних речовин. Це робить Обчислено %: 22.19. спосіб, що заявляється, не тільки технологічним, 11 78461 12 але й доступним для застосування у лабораторних арильних або гетарильних замісників різної електі промислових умовах; ронної природи; - значно зменшити шкідливі стоки за рахунок - проводити синтез без застосування зріджеутилізації хлористоводневих розчинів; ного газу; - розширити технологічні можливості прове- уде шевити вартість кінцевих продуктів шлядення реакції одержання заміщених 5-аміно-3хом використання для очищення дешевих розчинарил-1Н-піразолів; широко варіювання у молекулі ників (вода); - виключити очищення проміжних продуктів. Таблиця 1. Порівняльні характеристики способу одержання заміщених З-арил-5-аміно-ІН-піразолів і прототипу Застосування легкоТривалість Очищення Вихід основнозаймистих, вогненебеКількість стадій реакції процесу, годипроміжних прого продукту, %* зпечних, вибухови х на дуктів речовин, лакриматорів 2 1. Синтез заміщених β-хлорциннамоСпосіб, що нітрилів 20-22 50-80 Не потрібно Не застосовується заявляється 2. Синтез заміщених 3-арил-5-аміно-1Нпіразолів 4 1. Синтез заміщених бензоїлхлоридів. 2. Синтез етилових Потрібні перекриста лізація, Ацетон, зріджений Прототип ефірів β-ароїлцианоц25-40 (переравакуумтової кислоти. 50-56 газ, заміщені бензоїлховано нами) перегонки, пе- хлориди-лакриматори 3. Синтез β-ароїлреосадження ацетонітрилів 4. Синтез 3-арил-5аміно-1Н-піразолів * з урахуванням виходів продуктів на кожній проміжній стадії 13 78461 14 Таблиця 2. Характеристики сполук, одержаних за способом, що заявляється, і за способом-прототипом NN Сполуки I Т. пл, °С Вихід, % 1 С6Н5 125-127 60 2 4-Сl-С6Н4 173-175 80 3 4-Вr-С6Н4 173-175 67 4 4-F-С6Н4 130-131 72 5 4-NO2-C6H4 251-253 78 6 3-NО2-С6Н4 134-136 74 7 4-СН3-С6Н4 143-145 56 8 4-СН3О-С6Н4 141-143 62 9 3-СН3О-С6Н4 88-89 50 10 4-С3Н5-С6Н4 110-113 60 11 4-С2Н5O-С6Н4 155-157 67 121-123* 121-126** 55*** ЯМРН1, δ (м.ч.) 5.75 (1H, с, СН піразол), 4.76 (2H, y.c., NH 2), 11.73 (1H, y.c., NH), 7.0-7.8 (5Н, м. Аr) 5.74 (1H, с, СН піразол), 4.89 (2H, y.c., NH 2), 11.78 (1H, y.c., NH), 7.20-7.85 (4Н, м. Аr) 5.70 (1H, с, СН піразол), 4.63 (2H, y.c., NH 2), 11.55 (1H, y.c., NH), 7.30-7.70 (4Н, м. Аr) 5.71 (1H, с, СН піразол), 4.82 (2H, y.c., NH 2), 11.74 (1H, y.c., NH), 7.10-7.80 (4Н,м, Аr) 5.88 (1H, с, СН піразол), 5.10 (2H, y.c., NH 2), 12.00 (1Н, у.с., NH), 7.70-8.30 (4Н, м. Аr) 5.84 (1H, с, СН піразол), 5.05 (2H, y.c., NH 2), 11.79 (1Н, у.с., NH), 7.50-8.50 (4Н, м. Аr) 5.70 (1H, с, СН піразол), 4.70 (2H, y.c., NH 2), 11.61 (1H, y.c., NH), 7.00-7.60 (4Н, м. Аr), 2.28 (3Н, с, СН3) 5.66 (1H, с, СН піразол), 4.75 (2H, y.c., NH 2), 11.50 (1H, y.c., NH), 6.70-7.70 (4Н, м. Аr), 3.74 (3Н, с, ОСН3) 5.75 (1H, с, СН піразол), 4.73 (2H, y.c., NH 2), 11.88 (1H, y.c., NH), 6.60-7.40 (4Н, м, Аr), 3.76 (3Н, с, ОСН3) 5.70 (1H, с, СН піразол), 4.92 (2H, y.c., NH 2), 11.12 (1H, y.c., NH), 7.05-7.60 (4Н, м. Аr), 1.16 (3Н, т, СН3), 2.57 (2Н, кв, CH2) 5.65 (1H, с, СН піразол), 4.75 (2H, y.c., NH 2), 11.43 (1H, y.c., NH), 6.60-7.90 (4Н, м. Аr), 1.29 (3Н, т, СН3), 3.99 (2Н, кв, СН3) Прототип 1 С6Н3 Виміряно нами 5.75 (1H, с, СН піразол), 4.76 (2H, y.c., NH 2), 11.73 (1H, y.c., NH), 7.0-7.8 (5Н, м. Аr) * Десенко С.М., Орлов В.Д., Азагетероциклы на основе ароматических непредельных кетонов, Фолио, Харьков, 1998, с. 118-119. ** Трандберг И. И., Дин Вэй-пы, Кост А. В., Ж. общей химии, 31, 2311 (1961). *** Вихід на кінцевій стадії, зазначений у відомому джерелі-прототипі. Комп’ютерна в ерстка М. Мацело Підписне Тираж 26 прим. Міністерство осв іт и і науки України Держав ний департамент інтелектуальної в ласності, вул. Урицького, 45, м. Київ , МСП, 03680, Україна ДП “Український інститут промислов ої в ласності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for the preparation of substituted 5-amino-3-aryl-1h-pyrazoles
Автори англійськоюChernenko Vitalii Mykolaiovych, Desenko Serhii Mykhailovych, Afanasiadi Liudmyla Mykhailivna
Назва патенту російськоюСпособ получения замещенных 5-амино-3-арил-1н-пиразолов
Автори російськоюЧерненко Виталий Николаевич, Десенко Сергей Михайлович, Дэсэнко Сергей Михайлович, Афанасиади Людмила Михайловна
МПК / Мітки
МПК: C07D 231/10, C07D 231/02
Мітки: спосіб, заміщених, одержання, 5-аміно-3-арил-1н-піразолів
Код посилання
<a href="https://ua.patents.su/7-78461-sposib-oderzhannya-zamishhenikh-5-amino-3-aril-1n-pirazoliv.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання заміщених 5-аміно-3-арил-1н-піразолів</a>
Попередній патент: Система постачання електричної енергії
Наступний патент: Спосіб одержання сировини з глинозему для вирощування монокристалів лейкосапфіру
Випадковий патент: N'-[(1н-імідазол-5-іл)метилен]ізонікотиногідразиди, які виявляють протитуберкульозну активність











