Спосіб лікування людини, що страждає від вірусної інфекції, фармацевтична композиція, комбінація речовин для отримання ліків та фармацевтична комбінація
Номер патенту: 40589
Опубліковано: 15.08.2001
Автори: Сторер Річард, МАТТН Ян Мартін, ПЕНН Чарльз Річард, УІЛЬЯМСОН Крістофер, КОУТС Джонатан Алан Віктор
Формула / Реферат
1. Способ лечения человека, страдающего вирусной инфекцией, включающий прием человеком фармацевтической композиции, содержащей агент, обладающий противовирусной активностью, отличающийся тем, что используют композицию, содержащую соединение, которым является (-)-цис-4-амино-1-(2-гидроксиметил-1,3-оксатиолан-5-ил)-(1Н)-пиримидин-2-он, его фармацевтически приемлемая соль или фармацевтически приемлемый эфир, и другой агент, обладающий противовирусной активностью, причем количество (+)-энантиомера соединения, его фармацевтически приемлемой соли или его фармацевтически приемлемого эфира составляет не более 5 вес.% от общего веса их (-) и (+) энантиомеров.
2. Способ по п. 1, отличающийся тем, что вирусной инфекцией является ВИЧ-инфекция.
3. Способ по п. 2, отличающийся тем, что композиция содержит фармацевтически приемлемый носитель.
4. Способ по п. 2, отличающийся тем, что в качестве другого агента используют ациклический нуклеозид, интерферон, ингибитор почечной экскреции, ингибитор транспорта нуклеозида, 2',3'-дидеоксинуклеозид, иммуномодулятор, эритропоэтин, амплиген, тиомодулин, тимопентин, фоскарнет, рибавирин или ингибитор связи ВИЧ с CD4.
5. Способ по п. 3, отличающийся тем, что в качестве соединения используют (-)-цис-4-амино-1 -(2-гидроксиметил-1,3 -оксатиолан-5-ил)-( 1 Н)-пиримидин-2-он.
6. Способ по п. 4, отличающийся тем, что в качестве соединения используют (-)-цис-4-амино-1-(2-гидроксиметил-1,3-оксатиолан-5-ил)-(1Н)-пиримидин-2-он.
7. Способ по одному из пп. 1-6, отличающийся тем, что соединение, фармацевтически приемлемую соль или фармацевтически приемлемый эфир используют в количестве 10-1500 мг на единицу лекарственной формы.
8. Способ по п. 7, отличающийся тем, что соединение, фармацевтически приемлемую соль или фармацевтически приемлемый эфир используют в количестве 20-1000 мг на единицу лекарственной формы.
9. Способ по п. 8, отличающийся тем, что соединение, фармацевтически приемлемую соль или фармацевтически приемлемый эфир используют в количестве 50-700 мг на единицу лекарственной формы.
10. Способ по одному из пп. 1-6, отличающийся тем, что композиция содержит (+)-энантиомера не более 2 вес.% от общего веса (-) и (+) энантиомеров .
11. Способ по п. 10, отличающийся тем, что композиция содержит (+)-энантиомера не более 1 вес.% от общего веса (-) и (+) энантиомеров %.
12. Способ по одному из пп. 1-6, отличающийся тем, что соединение, фармацевтически приемлемую соль или фармацевтически приемлемый эфир и указанный агент вводят последовательно.
13. Способ по одному из пп. 1-6, отличающийся тем, что соединение, фармацевтически приемлемую соль или фармацевтически приемлемый эфир и указанный агент вводят одновременно.
14. Способ по одному из пп. 1-6, отличающийся тем, что соединение, фармацевтически приемлемую соль или фармацевтически приемлемый эфир вводят в дозах 0,1 - 750 мг/кг веса тела в день.
15. Способ по п. 14, отличающийся тем, что соединение, фармацевтически приемлемую соль или фармацевтически приемлемый эфир вводят в дозах 0,5 - 60 мг/кг веса тела в день.
16. Способ по п. 15, отличающийся тем, что соединение, фармацевтически приемлемую соль или фармацевтически приемлемый эфир вводят в дозе 1-20 мг/кг веса тела в день.
17. Фармацевтическая композиция для лечения вирусной инфекции, отличающаяся тем, что она содержит соединение, которым является (-)-цис-4-амино-1 -(2-гидроксиметил-1,3-оксатиолан-5-ил)-(1Н)-пиримидин-2-он, его фармацевтически приемлемая соль или фармацевтически приемлемый эфир, и другой агент, обладающий противовирусной активностью, причем количество (+)-энантиомера соединения, его фармацевтически приемлемой соли или его фармацевтически приемлемого эфира составляет не более 5 вес. % от общего веса их (-) и (+) энантиомеров.
18. Фармацевтическая композиция по п. 17, отличающаяся тем, что она содержит фармацевтически приемлемый носитель.
19. Фармацевтическая композиция по п. 18, отличающаяся тем, что в качестве другого агента она содержит ациклический нуклеозид, интерферон, ингибитор почечных выделений, ингибитор переноса нуклеозида, 2',3'-дидеоксинуклеозид, иммуномодулятор, эритропоэтин, амплиген, тиомодулин, тимопентин, фоскарнет, рибавирин или ингибитор связи ВИЧ с CD4.
20. Фармацевтическая композиция по п. 18, отличающаяся тем, что в качестве соединения она содержит (-)-цис-4-амино-1-(2-гидроксиметил-1,3-оксатиолан-5-ил)-(1Н)-пиримидин-2-он.
21. Фармацевтическая композиция по п. 19, отличающаяся тем, что в качестве соединения она содержит (-)-цис-4-амино-1 -(2-гидроксиметил-1,3-оксатиолан-5-ил)-( 1Н)-пиримидин-2-он.
22. Фармацевтическая композиция по одному из пп. 17 - 21, отличающаяся тем, что она содержит соединение, фармацевтически приемлемую соль или фармацевтически приемлемый эфир в количестве 10-1500 мг на единицу лекарственной формы.
23. Фармацевтическая композиция по п. 22, отличающаяся тем, что она содержит соединение, фармацевтически приемлемую соль или фармацевтически приемлемый эфир в количестве 20-1000 мг на единицу лекарственной формы.
24. Фармацевтическая композиция по п. 23, отличающаяся тем, что она содержит соединение, фармацевтически приемлемую соль или фармацевтически приемлемый эфир в количестве 50-700 мг на единицу лекарственной формы.
25. Фармацевтическая композиция по п. 24, отличающаяся тем, что она содержит (+)-энантиомера не более 2 вес %. от общего веса (-) и (+) энантиомеров.
26. Фармацевтическая композиция по п. 25, отличающаяся тем, что композиция содержит (+)-энантиомера не более 1 вес. % от общего веса (-) и (+) энантиомеров.
27. Комбинация веществ для изготовления лекарств, предназначенных для лечения ВИЧ-инфекции, отличающаяся тем, что она включает (-)-(2R, цис)-4-амино-1-(2-гидроксиметил-1,3-оксатиолан-5-ил)-(1Н)-пиримидин-2-он или его фармацевтически приемлемую соль и другой терапевтический агент.
28. Комбинация по п. 27, отличающаяся тем, что лекарства предназначены для лечения ВИЧ-инфекции указанными (-)-энантиомером и другим терапевтическим агентом введением их последовательно.
29. Комбинация по п. 27, отличающаяся тем, что лекарства предназначены для лечения ВИЧ-инфекции указанными (-)-энантиомером и другим терапевтическим агентом введением их одновременно.
30. Фармацевтическая комбинация для лечения вирусной инфекции, отличающаяся тем, что она содержит (-)-(2R,цис)-1-амино-1-(2-гидроксиметил-1,3-оксатиолан-5-ил)-(1Н)-пиримидин-2-он или его фармацевтически приемлемую соль, вводимые последовательно в отдельных фармацевтических составах или одновременно в отдельных или в комбинированных фармацевтических составах с другим терапевтическим агентом, выбранным из группы, состоящей из ациклических нуклеозидов, интерферонов, ингибиторов почечных выделений, ингибиторов переноса нуклеозида, 2',3'-дидеоксинуклеозидов, иммуномодуляторов, эритропоэтина, амплигена, тиомодулина, тимопентина, фоскарнета, рибавирина или ингибитора связи ВИЧ с CD4.
Текст
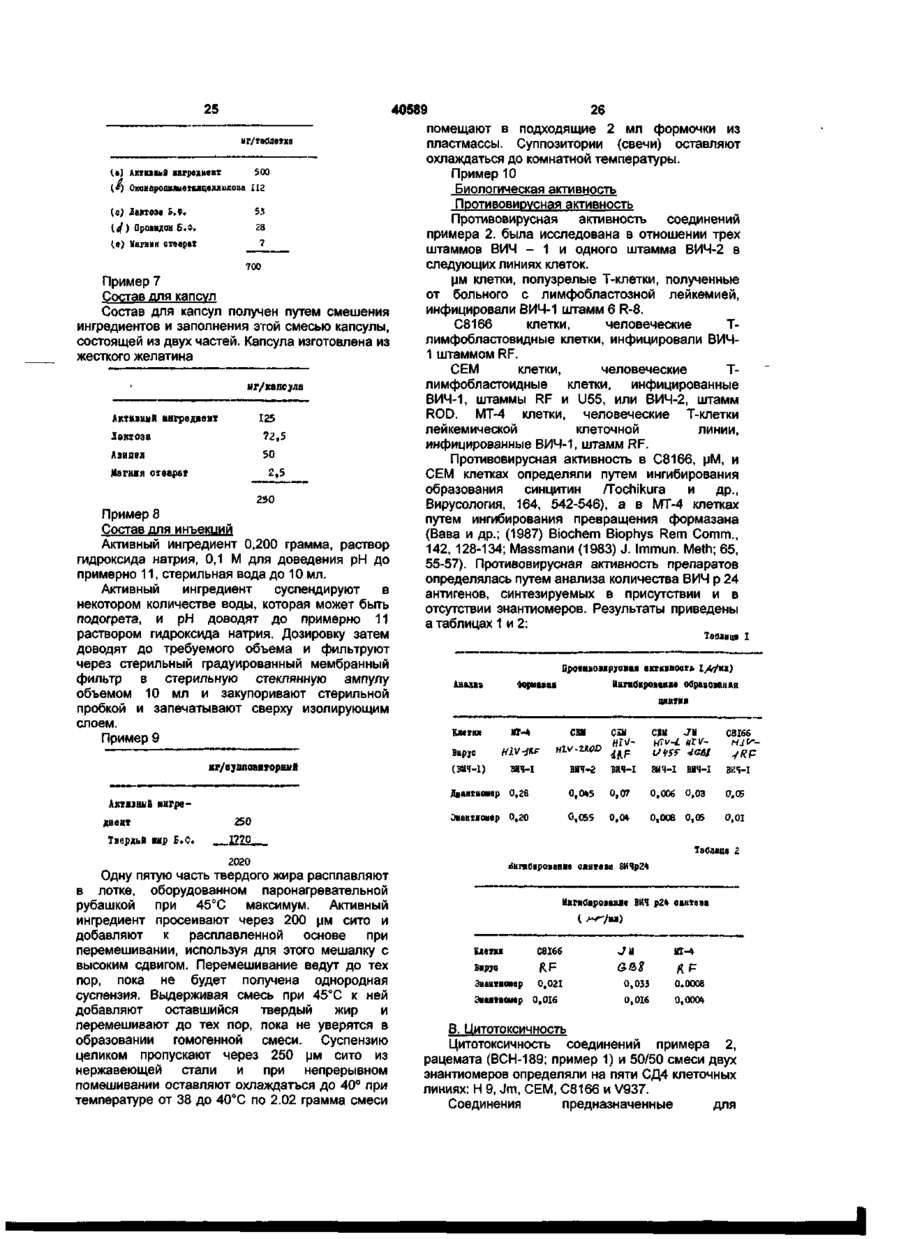
1. Способ лечения человека, страдающего вирусной инфекцией, включающий прием человеком фармацевтической композиции, содержащей агент, обладающий противовирусной активностью, отличающийся тем, что используют композицию, содержащую соединение, которым является (-)-цис-4-амино-1(2-гидроксиметил-1,3-оксатиолан-5-ил)-(1 Н)пиримидин-2-он, его фармацевтически приемлемая соль или фармацевтически приемлемый эфир, и другой агент, обладающий противовирусной активностью, причем количество (+)-энантиомера соединения, его фармацевтически приемлемой соли или его фармацевтически приемлемого эфира составляет не более 5 вес.% от общего веса их (-) и (+) энантиомеров. 2. Способ по п. 1, отличающийся тем, что вирусной инфекцией является ВИЧ-инфекция. 3. Способ по п. 2, отличающийся тем, что композиция содержит фармацевтически приемлемый носитель. 4. Способ по п. 2, отличающийся тем, что в качестве другого агента используют ациклический нуклеозид, интерферон, ингибитор почечной экскреции, ингибитор транспорта нуклеозида, 2',3'дидеоксинуклеозид, иммуномодулятор, эритропоэтин, амплиген, тиомодулин, тимопентин, фоскарнет, рибавирин или ингибитор связи ВИЧ с CD4. 5. Способ по п. 3, отличающийся тем, что в качестве соединения используют (-)-цис-4-амино-1 -(2-гидроксиметил-1,3 -оксатиолан-5-ил)-( 1 Н)пиримидин-2-он. 6. Способ по п. 4, отличающийся тем, что в качестве соединения используют (-)-цис-4-амино1-(2-гидроксиметил-1,3-оксатиолан-5-ил)-(1 Н)пиримидин-2-он. 7. Способ по одному из пп. 1-6, отличающийся тем, что соединение, фармацевтически приемлемую соль или фармацевтически приемлемый эфир используют в количестве 10-1500 мг на единицу лекарственной формы. 8. Способ по п. 7, отличающийся тем, что соединение, фармацевтически приемлемую соль или фармацевтически приемлемый эфир используют в количестве 20-1000 мг на единицу лекарственной формы. 9. Способ по п. 8, отличающийся тем, что соединение, фармацевтически приемлемую соль или фармацевтически приемлемый эфир используют в количестве 50-700 мг на единицу лекарственной формы. 10. Способ по одному из пп. 1-6, отличающийся тем, что композиция содержит (+)-энантиомера не более 2 вес.% от общего веса (-) и (+) энантиомеров . 11. Способ по п. 10, отличающийся тем, что композиция содержит (+)-энантиомера не более 1 вес.% от общего веса (-) и (+) энантиомеров %. 12. Способ по одному из пп. 1-6, отличающийся тем, что соединение, фармацевтически приемлемую соль или фармацевтически приемлемый эфир и указанный агент вводят последовательно. 13. Способ по одному из пп. 1-6, отличающийся тем, что соединение, фармацевтически приемлемую соль или фармацевтически приемлемый эфир и указанный агент вводят одновременно. 14. Способ по одному из пп. 1-6, отличающийся тем, что соединение, фармацевтически приемлемую соль или фармацевтически приемлемый эфир вводят в дозах 0,1 - 750 мг/кг веса тела в день. 15. Способ по п. 14, отличающийся тем, что СМ О о 00 ю о» соединение, фармацевтически приемлемую соль или фармацевтически приемлемый эфир вводят в дозах 0,5 - 60 мг/кг веса тела в день. 16. Способ по п. 15, отличающийся тем, что соединение, фармацевтически приемлемую соль или фармацевтически приемлемый эфир вводят в дозе 1-20 мг/кг веса тела в день. 17. Фармацевтическая композиция для лечения вирусной инфекции, отличающаяся тем, что она содержит соединение, которым является (-)-цис-4-амино-1 -(2-гидроксиметил-1,3оксатиолан-5-ил)-(1 Н)-пиримидин-2-он, его фармацевтически приемлемая соль или фармацевтически приемлемый эфир, и другой агент, обладающий противовирусной активностью, причем количество (+)-энантиомера соединения, его фармацевтически приемлемой соли или его фармацевтически приемлемого эфира составляет не более 5 вес. % от общего веса их (-) и (+) энантиомеров. 18. Фармацевтическая композиция по п. 17, отличающаяся тем, что она содержит фармацевтически приемлемый носитель. 19. Фармацевтическая композиция по п. 18, отличающаяся тем, что в качестве другого агента она содержит ациклический нуклеозид, интерферон, ингибитор почечных выделений, ингибитор переноса нуклеозида, 2',3'дидеоксинуклеозид, иммуномодулятор, эритропоэтин, амплиген, тиомодулин, тимопентин, фоскарнет, рибавирин или ингибитор связи ВИЧ с CD4. 20. Фармацевтическая композиция по п. 18, отличающаяся тем, что в качестве соединения она содержит (-)-цис-4-амино-1-(2-гидроксиметил1,3-оксатиолан-5-ил)-(1 Н)-пиримидин-2-он. 21. Фармацевтическая композиция по п. 19, отличающаяся тем, что в качестве соединения она содержит (-)-цис-4-амино-1 -(2-гидроксиметил1,3-оксатиолан-5-ил)-( 1 Н)-пиримидин-2-он. 22. Фармацевтическая композиция по одному из пп. 17 - 21, отличающаяся тем, что она содержит соединение, фармацевтически приемлемую соль или фармацевтически приемлемый эфир в количестве 10-1500 мг на единицу лекарственной формы. 23. Фармацевтическая композиция по п. 22, отличающаяся тем, что она содержит соединение, фармацевтически приемлемую соль или фармацевтически приемлемый эфир в Изобретение относится к нуклеозидным аналогам и их использованию в медицине. Более конкретно, изобретение относится к нуклеозидным аналогам 1,3-оксатиолана, фармацевтическим композициям на их основе и их использованию при лечении вирусных инфекций. Соединение формулы (I) 40589 количестве 20-1000 мг на единицу лекарственной формы. 24. Фармацевтическая композиция по п. 23, отличающаяся тем, что она содержит соединение, фармацевтически приемлемую соль или фармацевтически приемлемый эфир в количестве 50-700 мг на единицу лекарственной формы. 25. Фармацевтическая композиция по п. 24, отличающаяся тем, что она содержит (+)энантиомера не более 2 вес %. от общего веса () и (+) энантиомеров. 26. Фармацевтическая композиция по п. 25, отличающаяся тем, что композиция содержит (+)энантиомера не более 1 вес. % от общего веса () и (+) энантиомеров. 27. Комбинация веществ для изготовления лекарств, предназначенных для лечения ВИЧинфекции, отличающаяся тем, что она включает (-)-(2R, цис)-4-амино-1-(2-гидроксиметил-1,3оксатиолан-5-ил)-(1 Н)-пиримидин-2-он или его фармацевтически приемлемую соль и другой терапевтический агент. 28. Комбинация по п. 27, отличающаяся тем, что лекарства предназначены для лечения ВИЧинфекции указанными (-)-энантиомером и другим терапевтическим агентом введением их последовательно. 29. Комбинация по п. 27, отличающаяся тем, что лекарства предназначены для лечения ВИЧинфекции указанными (-)-энантиомером и другим терапевтическим агентом введением их одновременно. 30. Фармацевтическая комбинация для лечения вирусной инфекции, отличающаяся тем, что она содержит (-)-(2Р,цис)-1-амино-1-(2гидроксиметил-1,3-оксатиолан-5-ил)-(1 Н)пиримидин-2-он или его фармацевтически приемлемую соль, вводимые последовательно в отдельных фармацевтических составах или одновременно в отдельных или в комбинированных фармацевтических составах с другим терапевтическим агентом, выбранным из группы, состоящей из ациклических нуклеозидов, интерферонов, ингибиторов почечных выделений, ингибиторов переноса нуклеозида, 2',3'-дидеоксинуклеозидов, иммуномодуляторов, эритропоэтина, амплигена, тиомодулина, тимопентина, фоскарнета, рибавирина или ингибитора связи ВИЧ с CD4. 40589 агент, обладающий противовирусной активностью, причем количество (+)-энантиомера соединения, его фармацевтически приемлемой соли или его фармацевтически приемлемого эфира составляет не более 5 вес/вес. % общего веса их (-) и (+) энантиомеров. Было обнаружено, что оба энантиомера соединения формулы (I) обладают равным действием против ВИЧ, но один из энантиомеров, HOCH: а именно (-)-энантиомер, обладает существенно более низкой цитотоксичностью, чем другой энантиомер. Поэтому предпочтительно, чтобы (I) количество (+)- энантиомера не превышало 2 известное также как ВСН-189 или NGPB-21, вес/вес. %, а в оптимальном варианте его было описано как соединение, обладающее содержание должно быть менее 1%. противовирусной активностью, в частности, как Химическая формула (-) энантомера средство против вируса иммунодефицита представлена следующим образом: (-)-цис-4человека (ВИЧ), являющегося причиной СПИД амино-1 -(2-гидроксиметил-1,3-оксатиолан-5-ил)(5thAnty-Aids Conference, Montreal, Canada 5 th - 9 t h (1Н)-пиримидин-2-он (далее - соединение А). Он June 1989: абсолютно стереохимичен с соединением Abstracts T.C.O.1 и M.C.P. 63; заявка ЕПВ формулы (1-1), формула которого (2R, цис)-40382562). амино-1 -(2-гидроксиметил-1,3-оксатиолан-5-ил )Соединение формулы (1) представляет собой (1 Н)-пиримидин-2-он. рацемическую смесь двух энантиомеров, формулы (1-1) и (I-2): Предпочтительные эфиры соединения (А) включают соединения, в которых атом водорода 2-оксиметильной группы замещены ацильной 0 R c функциональной группой ' " , в которой (1-2) некарбонильная группировка R эфира выбрана из группы: водород, линейный или разветвленный алкил (например, метил, этил, н-пропил, третбутил, н-бутил), алкоксиалкил (например, метоксиметил), аралкил (например, бензил), арилоксиалкил (например, феноксиметил), арил (например, фенил, возможно замещенный галогеном, Сі-4 алкилом или С і ^ алкосилом), сульфоновые эфиры (например, алкил- или аралкилсульфонил, например, метасульфонил); эфиры аминокислот (например, L-валил или Lи было описано и исследовано в форме изолейцил), а также мониды или трифосфаты. рацемата. В настоящее время только соединение Что касается вышеописанных эфиров, если не З'-азидо-З'-дезокситимидин (AZT, зидовудин, BW указано иное, любая представленная алкильная 509U) апробировано в качестве препарата для группировка содержит преимущественно 1-16 лечения заболеваний, спровоцированных ВИЧ. атомов углерода, в частности 1-4 атома углерода. Способ лечения человека, включающий прием Любая арильная группировка, представленная в композиции, содержащей это соединение таких эфирах, преимущественно включает обладает тем недостатком, что соединение дает фенильную группу. значительный побочный эффект и поэтому не В частности, эфирами могут быть Сі-іб может быть использовано, или, будучи алкиловые эфиры, незамещенный бензиловый использованным, может привести к выводу из эфир или бензиловый эфир, замещенный по строя значительного числа больных. крайней мере одним атомом галогена (бромом, В основу изобретения поставлена задача хлором, фтором или иодом), алкилом С-мб, С-мв разработать способ лечения человека, алкокси, нитро или трифторметильной группой. страдающего вирусной инфекцией, с Фармацевтически приемлемые соли использованием соединения, которое не давало соединения (А) включают те, которые получены из бы побочных эффектов. фармацевтически приемлемых неорганических и В способе лечения человека, страдающего органических кислот и оснований. К подходящим вирусной инфекцией, включающем прием кислотам относятся, например, человеком фармацевтической композиции, хлористоводородная, бромистоводородная, содержащей агент, обладающий противовирусной серная, азотная, перхлорная, фумаровая, активностью, эта цель достигается тем, что малеиновая, фосфорная, гликолевая, молчная, композиция содержит соединение, которым салициловая, янтарная, параявляется (-)-цис-4-амино-1-(2-гидроксиметил-1,3тол уол сул ьфови иная, уксусная, лимонная, оксатиолан-5-ил)-(1 Н)-пиримидин-2-он, его метаносульфо-, муравьиновая, бензойная, фармацевтически приемлемая соль или малоновая, нафталин-2-сульфо-, и бензосульфофармацевтически приемлемый эфир, и другой кислоты. Другие кислоты, такие как щавелевая, NH2 40589 хотя сами по себе фармацевтически не приемлемы, могут быть использованы как посредники при получении соединений, используемых в способе, и их фармацевтически приемлемых кислых солей присоединения. Соли, полученные из соответствующих оснований, включают щелочные металлы (например, натрий), щелочноземельные металлы (например, магний), аммоний и NR4 + (где R это С-1-16 алкил). В дальнейшем под соединениями следует понимать как соединение (А), так и его фармацевтические приемлемые соли и эфиры. Указанные соединения либо сами по себе обладают противовирусной активностью, либо переходят в таковые в процессе метаболизма. В частности, эти соединения эффективны при ингибировании репликации ретровирусов, включая ретровирусы человека, такие как вирус иммунодефицита человека (ВИЧ), являющийся причиной СПИДа. Поэтому в композиции, применяемой в способе лечения, эти соединения используются в качестве активного терапевтического средства, в частности, в качестве противовирусного средства, например, при лечении ретровирусных инфекционных заболеваний. Соединения также используются в композициях, применяемых в способах лечения осложнений, вызванных СПИДом, таких как СПИДассоциированный комплекс (ARC), прогрессирующая генерализованная лимфоденопатия (PGL), СПИД-ассоциированные осложнения нервной системы (такие как тропический парапарез или слабоумие (деменация), анти-ВИЧ серопозитивные и ВИЧположительные осложнения, саркома Капоши, тромбоцитопеническая пурпура и ассоциированные инфекционные заболевания, например, пневмоцистоз Pneumocistosis carinii. Соединение (А) или его фармацевтически приемлемые производные также полезны в в предотвращении прогрессии клинических заболеваний индивидуумов, анти-ВИЧсероположительных или ВИЧ-антиген положительных, а также в профилактике последующей устойчивости к ВИЧ. Соединение (А) или его фармацевтически приемлемые производные могут быть также использованы для предотвращения загрязнения вирусом жидкостей, таких как кровь или семенная жидкость in vitro. Специалистам, работающий в данной области понятно, что термин лечить"здесь распространяется и на профилактику, а также на лечение установившихся инфекционных заболеваний или симптомов. Кроме того понятно, что количество соединения (А) данного изобретения, которое необходимо для лечения может варьироваться не только в зависимости от соединения, выбранного для лечения, но также от способа его введения, природы заболевания, которое необходимо лечить, возраста и состояния больного, и может быть в конце концов предоставлено на усмотрение врача или ветеринара. Однако, как 8 правило, подходящая доза может находиться в интервале от примерно 0,1 до примерно 750 мг/кг массы тела в сумки, предпочтительно - в интервале от примерно 0,5 до 60 мг/кг/сутки, наиболее предпочтительно, от 1 до 20 мг/кг/ сутки. Необходимая доза может обычно вводиться за один раз или же быть может осуществлено дробное введение через соответствующие интервалы, например, необходимое количество вводимого препарата может быть разбито на две, три, четыре или более суб-доз в сутки. Соединение удобно вводить в единицах лекарственной формы, содержащей например, от 10 до 1500 мг, обычно от 20 до 1000 мг, и более удобно, когда содержится от 50 до 700 мг активного ингредиента на единицу лекарственной формы. В идеальном варианте активный ингредиент следует вводить в таком количестве, чтобы пик концентраций активного ингредиента в плазме составлял примерно от 1 до 75 рМ, предпочтительно от примерно 2 до 50 рМ, а наиболее предпочтительно от примерно 3 до примерно 30 мМ. Такое состояние может быть достигнуто, например, при внутривенных инъекциях 0,1-5% раствора активного ингредиента, возможно в физиологическом растворе, или при оральном приеме в виде шариков, содержащих примерно от 1 до примерно 100 мг активного ингредиента. Желательный уровень в крови может поддерживаться при непрерывной инфузии, обеспечивающей примерно от 0,01 до примерно 5,0 мг/кг/час или при периодической внутривенном вливании, содержащем примерно от 0,4 до примерно 5,0 мг/кг активного ингредиента. Хотя можно вводить соединение данного изобретения и само по себе, однако предпочтительно, когда оно вводится в виде активного ингредиента фармацевтического препарата. Таким образом данное изобретение обеспечивает еще и фармацевтическую композицию, содержащую соединение (А) или фармацевтически приемлемое производное данного соединения вместе с одним или более фариацевтически приемлемыми носителями и, возможно, другими терапевтическими и/или профилактическими ингредиентами. Носитель(и) должен быть "приемлем" в смысле совместимости с другими ингредиентами состава препарата и не отравлять реципиента, который принимает этот препарат. Фармацевтические композиции (препараты) могут находиться в лекарственных формах, подходящих для перорального, ректального, назального, локального (включая трансбуккальный и подъязычный), влагалищного или парентерального (включая внутримышечный, подкожный и внутривенный) способов введения или в форме, подходящей для ингаляции или вдувания. Препараты могут, когда это бывает удобным, представлены в виде дискретных единиц лекарственных форм и могут быть получены любым из методов, хорошо известных специалистам в области фармации. Все 40589 10 средств, загустителей или красящих добавок. вышеперечисленные методы включают стадию Составы, пригодные для локального введения смешения активного соединения с жидкими носив полость рта, включают лепешки, содержащие телями или тонко измельченными твердыми активный ингредиент в ароматизированной носителями или с теми и другими, если в этом основе, обычно это бывает сахароза и гумиарабик возникает необходимость, введение продукта в или трагакант; пастилки, содержащие активный желаемый состав. ингредиент в инертной основе, такой как желатин Фармацевтические композиции (препараты) и глицерин или сахароза и гуммиарабик; воду для подходящие для перорального введения могут полоскания рта, содержащую активный обычно выпускаться в виде капсул, крахмальных ингредиент в подходящем жидком носителе. облаток или таблеток, каждая из которых Фармацевтические препараты, пригодные для содержит предварительно рассчитанное ректального введения, в которых носительколичество активного ингредиента; в виде твердое вещество, наиболее предпочтительно порошков или гранул; в виде раствора, суспензии готовить в виде суппозиториев. Подходящими или эмульсии. Активный ингредиент может быть носителями будут масло какао и другие также выпущен в виде шариков, паст или материалы, обычно используемые для этих целей лекарственной кашки. Таблетки и капсулы для специалистами, а суппозитории обычно можно перорального введения могут содержать формировать путем смешения активного традиционные добавки, такие как связующие соединения с размягченным или расслабленным средства, лабриканты, дезинтеграторы или носителем, после чего полученную смесь смачивающие средства. Таблетки могут иметь охлаждают и формуют из нее суппозитории. покрытие, наносимое хорошо известными специалистам методами. Жидкие пероральные Препараты, подходящие для введения во препараты могут быть, например, в форме водных влагалище могут быть приготовлены в виде или масляных суспензий, растворов, эмульсий, пессариев, тампонов, кремов, гелей, паст, пен или сиропов, эликсиров, или могут выпускаться в виде спреев, содержащих в дополнение к активному сухого продукта, который может быть разбавлен ингредиенту подходящие носители, которые водой или другим подходящим разбавителем хорошо известны специалистам. перед употреблением. Такие жидкие препараты Для введения внутриназально соединения для перорального введения могут содержать настоящего изобретения могут выпускаться в традиционные добавки типа суспендирующих форме спреев, диспергируемых порошков или в средств, эмульгаторов, не водных разбавителей форме капель. (которые могут включать съедобные масла) или Капли могут быть приготовлены на водной или консерванты. неводной основе, также содержащей один или Соединения, соответствующие настоящему более диспергирующих средств, изобретению, могут также использоваться в солюбилизирующих средств или суспендирующих форме для парентерального введения (инъекций, средств. Жидкие спреи обычно поставляют в например, болюзные инъекции или непрерывные баллончиках, находящихся под давлением. инфузии) и могут быть выпущены в виде ампул, Для проведения ингаляций соединения, предварительно заполненных шприцев, соответствующие настоящему изобретению, небольших инфузионных объемов или во обычно доставляют из инсуфлятора флаконах, содержащих многократные дозы с (порошковдувателя), аэрозольного ингалятора добавленными туда консервантами. Композиции или упаковки, находящейся под давлением или могут быть в таких формах, как суспензии, любыми другими традиционными средствами растворы или эмульсии в масляных или водных доставки аэрозольных спреев. Упаковки, разбавителях, и могут содержать дополнительные находящиеся под давлением могут содержать компоненты, такие как суспендирующие, подходящий распылитель, такой, как стабилизирующие и/или диспергирующие дихлордифторметан, диоксид углерода, средства. В альтернативном варианте препарат трихлортрифторметан, дихлортетрафторэтан и для инъекций или инфузии может быть выпущен в другие подходящие газы. В случае сжатого вида порошка, который получают в асептических аэрозоля дозировка может осуществляться за условиях из стерильного твердого продукта или счет клапана, подающего отмеренное количество. путем лиофилизации из раствора, этот порошок В альтернативном варианте, для введения затем перед употреблением разбавляют препарата путем ингаляции или инсуфляции, подходящим разбавителем, например, соединения, соответствующие настоящему изобретению, могут быть предоставлены а виде стерильной, апирогенной водой. сухих порошковых композиций, например, Для локального нанесения на кожу порошковой смеси соединения и подходящего соединения, соответствующие настоящему основания типа лактозы или крахмала. изобретению, могут быть приготовлены в виде Порошковая композиция может быть выпущена, мазей, кремов иди лосьонов, или в виде например, в виде капсул или патронов или, трансдермальной облатки (пластыря). Мази и например, в виде желатиновых или блистерных кремы могут быть, например, созданы на водной упаковок из которых порошок может быть введен с или масляной основе с добавлением подходящих помощью ингалятора или кнсуфлятора. загустителей и/или желирующих средств. Лосьоны могут быть созданы на водной или масляной В случае необходимости вышеописанные основе, и могут также содержать один или более препараты адаптируют таким образом, чтобы эмульгирующих средств, суспендирующих обеспечить постепенное освобождение активного 11 40589 12 ингредиента и постоянную его доставку в структуры, например, как описано в европейской организм. патентной заявке № 0382562. Специалистам в данной области должно быть Фармацевтические препараты, понятно, что для некоторых методов, описанных соответствующие данному изобретению, могут здесь ниже, требуемая стереохимическая также содержать другие активные ингредиенты, структура соединения (А) может быть получена такие КАК противомикробные средства или либо, если в качестве исходного материала консерванты. берется оптически исходной материал или путем Соединения данного изобретения могут быть растворения рацемической смеси на любой также использованы в сочетании с другими подходящей стадии синтеза. В случае всех лекарственными средствами, например, с другими процессов оптически чистый требуемый продукт противоинфекционными средствами. В частности, может быть получен путем растворения конечного соединения данного изобретения могут быть продукта каждой реакции. использованы вместе с известными противовирусными средствами. В одном из таких процессов (А) 1,3-оксатиолан формулы (VIII) Таким образом настоящее изобретение обеспечивает комбинацию содержащую R l 0 О соединение (А) или физиологически приемлемое производное этого соединения, а также терапевтически активное средство, а частности, противовирусное средство. в которой аномерная группа L является Комбинации, о которых шла речь выше, можно замещаемой группой, подвергается представить в форме фармацевтического взаимодействию с соответствующим основанием. препарата для использованная и такие Подходящие группы L включат -OR где R фармацевтические препараты, содержащие алкильная группа, например, Сі _ в алкильная комбинацию, определенную выше, вместе с группа такая, как метильная группа или R фармацевтически приемлемым носителем представляет ацильную группа, например Сі _ є составляют еще один аспект настоящего ацильная группа, такая, как ацетил иди галоген, изобретения. например, иод, бром или хлор. Подходящие терапевтические средства для Соединение формулы VIII преимущественно использования в таких комбинациях включают взаимодействует с предшественником ациклические нуклеозиды, такие как ацикловир пиримидинового основания (предварительное или ганцикловир, интерфероны, такие, как а, (3 или силилированное основание таким силилирующим а - интерферон, ингибиторы почечной экскреции средством, как гекоаметилдисилазан/или такие, как пробенецид, ингибиторы транспорта цитозином в подходящем растворителе, таком как нуклеозидов такие, как дипиридамол, 2,3метиленхлорид, с использованием кислоты дидеоксинуклеозиды, такие как A Z Т, 2,3Льюиса, такой как тетрахдорид титана, олова IV, дидеоксицитидин, 2,3-дидеоксиаденозин, 2,3соединения, например SnCU или дидеоксинозин, 2,3-дидеокситимедин, 2,3триметилсилилтрифлат. дидеокси-2,3-дидегидротимидин и 2,3-дидеокси1,3-оксатиолан формулы (VIII) может быть 2,3-дидегидроцитидин, иммуномодуляторы такие, получен, например при взаимодействии как интерлейкин-2(1 L 2) и колониестимулирующий альдегида формулы (Vn) с меркаптоацеталем фактор гранулоцитного макрофага (КСФМГ), формулы (VI) в подходящем органическом эритропоэтин, амплиген, тимодулин, тимопентин, растворителе, таком как толуол в присутствии фоскарнет, рибавирин и ингибиторы ВИЧкислотного катализатора, например, КИСЛОТЫ связывания с СД-4 рецепторами, например, Льюиса, такой как хлорид цинка. растворимыми СД-4, фрагментами СД-4, СД-4 (HSCH2CH(OC2H5)2) формула (VI) и гибридными молекулами (СД-4-антигенный СбН5СО2СН2СНО формулы (VII). маркер хелперных Т-лимфоцитов), ингибиторы Меркаптоацетали формулы (VI) могут быть гликозилирования, такие как 2-деокси-О- глюкоза, получены способами, которые известны настаноспермин и 1-деоксинодмиримицин. специалистам в данной области, например, Индивидуальные компоненты таких G.Hesse и I. Jorder, Chember 85, 924 - 932(1952). комбинаций можно вводить либо Альдегиды формулы (VII) могут быть последовательно, либо одновременно, в получены согласно известным методам, раздельном или вместе в объединенном например, Е. G. Halloquist и Н. Hibber Can. 4. фармацевтическом препарате. Research, 8, 129-136 (1933). Преимущественно В тех случаях, когда соединение (А) или неочищенный альдегид (VII) может быть фармацевтически приемлемое производное этого очищен путем превращения в кристаллический соединения используется в комбинации со вторым бисульфитный аддукт присоединения с терапевтическим средством, активным в последующим восстановлением этого аддукта в отношении того же вируса, доза каждого свободный альдегид. соединения может быть либо талой же, как в тех Во втором процессе (В) соединение (А) случаях, когда соединение используется одно. получают путем интерконверсии соединения Соединение (А) и его фармацевтически формулы (IX) приемлемые соединения могут быть получены способами, известными специалистам в данной области, для получения соединений аналогичной 40589 14 группы могут быть удалены традиционными носи* в способами. Так, например, алкил, силил, ацил и гетероциклические защитные группы можно удалить путем сольволиза, например, при гидролизе в присутствии кислоты или основания. в которой Н-представляет основание, Аралкильные защитные группы могут быть превращаемое в цитозин. Такая интерконверсия удалены, например, такие как трифенилметил, может осуществлена либо путем простой аналогично путем сольволиза, например, путем химической трансформации (например, конверсии гидролиза в кислой среде. Такие аралкильные урацила в цитозин), или путем ферментативного группы, как бензил, можно отщепить, например, превращения с использованием путем обработки в F3 эфиратом и уксусным деоксирисовилтрансферезы. Такие способы и ангидридом с последующим удалением условия для интерконверсии основания хорошо образующихся при этой ацетатных групп на известны специалистам в области химии соответствующей стадии синтеза. Силильные нуклеозидов. группы можно удалить, использовав для этих В третьем процессе (С) соединение формулы целей источник фторидионов, такой как тетра-н(XI) бутиламмоний фторид. В предыдущих процессах соединение (А), как правило, получают в виде смеси цис- и трамсизомеров, из которых цис-изомер представляет может быть превращено в соединение (А) интерес. путем конверсии аномерной ЫНг группы в Эти изомеры могут быть разделаны цитозиновое основание способами, хорошо физическими методами, например путем известными специалистами в химии нуклеозидов. хроматографирования на силикагело, или путем В большинстве реакций, описанных здесь фракционной кристаллизации, с использованием выше, сообщалось в контексте нуклесаидного либо непосредственно самого соединения или синтеза, например, в книге Аналоги нуклеозидовподходящего производного этого соединения, Химия, Биология и применение в медицине, например, ацетатов (полученных, например, при R Т. Walker и др., eds, Plenum Press, New York взаимодействии с уксусным ангидридом), которые (1979), стр. 165-192; Т. Ueda в работе "Химия затем возвращают после разделения в исходный нуклеозидов и нуклеотидов", т.І, L. В. Townsend продукт ( например, путем деацетилирования в ed., Plenum Press New York (1988) стр. 165-192. метанольном растворе аммиака). Следует понять, что вышеприведенные Фармацевтически приемлемые соли реакции для своего осуществления могут настоящего изобретения могут быть получены в нуждаться в использовании исходных материалов, соответствии с описанием, приведенным в имеющих защищенные функциональные группы, и патенте США № 4,383 114, раскрытие которого вследствие этого может понадобиться либо на дается здесь как ссылка. Так, например, когда промежуточной, либо на конечной стадии снятие хотят получить кислую соль присоединения защитной группы для получения необходимого соединения (А), продукт из любого вышеприведенсоединения. Защита и снятие защиты ного способа может быть превращен в соль путем функциональных групп может осуществляться с обработки полученного свободного основания использованием традиционных методов. Так, подходящей кислотой с использованием например, аминогруппы могут быть защищены традиционных методов. Фармацевтически группой, вьбранной из следующей группы: приемлемые кислые соли присоединения могут аралкил/ например, бензил/, а ацил, арил быть получены при взаимодействии свободного (например, 2,4 динитрофенил) или силил; основания с соответствующей кислотой возможно последующее удаление защитной группы в присутствии подходящего растворителя, такого осуществляется, если это необходимо, путем как эфир (например, этилацетата) или спирта) гидролиза или гидрогенолиза в подходящих например, этанола, метанола или изопропанола). стандартных условиях. Гидроксильная группа Неорганические основные соли могут быть может быть защищена с использованием любых получены при взаимодействии исходного традиционных гидроксилзащитных групп, соединения с подходящим основанием, таким как например, описанных в книге "Защитные группы в алкоксид, (например, метоксид натрия) возможно органической химии", Ed. Y.F.W.Mcomie Plenum в присутствии растворителя, такого как спирт) Press, 1973) или "Защитные группы в например, метанол). Фармацевтически органическом синтезе" 'Theodora W. Breene (John приемлемые соли могут быть также получены из Willy and Sons 1981). К подходящим других солей, включая фармацевтически гидроксилзащитным группам относятся, например, приемлемые соли, соединения (А) с алкил) например, метил, трет.бутил, или использованием стандартных методов. метоксиметил), аралкил/например, бензил, Соединение (А) может быть превращено в дифенилметил, или трифенилметил), фармацевтически приемлемый фосфат или гетероциклические группы, такие как другую соль (эфир ) при взаимодействии с тетрагидропиранил, ацил /например, ацетил, или фосфорилирующми соединением, таким как РОС бензоил) и силильные группы, такие как Із или подходящим этерифицирующим агентом, триалкилсилил, например треттаким как галоидангидрид или ангидрид. Эфир бутилдиметилсилил. Гидроксилзащищающие или соль соединения (А) могут быть превращены 13 15 40589 16 холодильником в токе азота, нагревали до тех пор в исходное соединения (А) путем гидролиза. пока раствор не стал прозрачным. Этот раствор Разделение конечного продукта или охладили и затем упарили до образования промежуточного продукта или исходного бесцветного масла, которое затем растворили в материала может быть осуществлено известными атмосфере азота в ацетонитриле (50 мл). Раствор способами, описанными, например, "Стереохимия добавили к перемешиваемому охлажденному соединений углерода" Е. L. Elier /McGraw Hill, льдом раствору 5-метокси-1,3-оксатиолан-21962/ и "Таблицы растворителей" S. Н. Willen. метанолабензоата /промежуточное соединение 1) Так, например, соединение (А) может быть (19,43 грамма) в ацетонитриле (600 мл) и получено методом хиральной ВЭЖХ с добавили триметилсилилтрифторметансульфонат использованием подходящей стационарной фазы, (14,7 мл). Удалили ледяную баню и раствор например, ацетилированного (3 -циклодекстрина нагревали в течение 45 минут в токе азота. После или триацетата целлюлозы и подходящего охлаждения и упаривания, остаток очистили растворителя, например, спирта, такого как методом колоночной хроматографии пропустив этанол, или водного раствора, например, над 1 кг силикагеля. Me r ск 9385 / и, триэтиламонийацетата. В альтернативном проэлюирован смесью хлороформ/ метанол = 9:1. варианте соединения могут быть разделены Нужные фракции охладили и упарили, получив в методом селективного анантио катаболизма, результате сырой остаток. Этот остаток подвергли катализируемого ферментом, таким как цитидинфракционной кристаллизации из минимального деаминаза, или путем селективной количества горячего метанола (1200 мл), в ферментативной деградации подходящего результате получили озаглавленное соединение производного в присутствии 5'-нуклвотидазы. При (6,32 грамма) а виде белых кристаллов. разделении с использованием ферментативных Параметры ЯМР спектра: методов, можно использовать раствор фермента или, более удобно, иммобилизованный фермент. (ДМСО-сІб) 11.36 (1Н, ); Иммобилизация ферментов может быть 7,50-8,00 (6Н, м); 6,20 (1Н, ); 5,46 (2Н, осуществлена способами, хорошо известными 4,62 (2Н, м), 3,48 (1Н, м), 3,25 (1Н, м). специалистам в данной области, например, путем Промежуточное соединение 3 адсорбции на смоле, такой как Eupergit С. /±/-цис-4-амино-1 -/2-бензоилоксиметил-1,3Далее приводится описание данного оксатиолан-3-ил/изобретения, иллюстрируемое следующими 1 Н-пиримидин-2-он примерами, которые ни коим образом не ограничивают рамки данного изобретения. Метод (а) Промежуточный ПРОДУКТ 1 Суспензию цитозина (20,75 грамм) и сульфата 5-метокси-1,3-оксатиолан-2-метанол-бензоат аммония несколько мл) в гексаметилдисилазане Раствор хлорида цинка (1,6 грамма) в горячем (110 мл) перемешивали и нагревали с обратным метаноле (15 мл) добавили при перемешивании к холодильников в течение двух с половиной часов перемешиваемому раствору в токе азота. Растворитель удалили упариванием, меркаптоацетальдегида, диметилацеталя (34,2 а твердый остаток растворили в сухом грамма) и бензоилоксиацетальдегида (48,3 ацатонитриле (350 мл). Этот раствор перенесли, грамма) в толуоле (1300 мл), затем полученный используя гибкую иглу, в перемешиваемый, раствор нагревали с обратным холодильников в охлажденный льдом раствор 5-метокси-1,3токе азота в течение 50 минут. Охлажденную оксатиолан-2-метанол бензоата (промежуточное смесь сконцентрировали, разбавили некоторым соединение 1) (43,57 грамм) в ацетонитриле (650 количеством толуола, затем отфильтровали через мл) в токе азота. Добавили кизельгур. Соединенные фильтраты и толуол триметилсилилтрифторметансульфонат (33 мл), промыли насыщенным раствором водного раствору позволили нагреться до комнатной бикарбоната натрия дважды и рассолом, температуры (1,5 часа), затем в течение ночи высушили (MgSCM) затем упарили до масла, нагревали с обратным холодильником. которое пропустили через хроматографическую Оставшуюся смесь сконцентрировали, разбавили колонку, заполненную диоксидом кремния (2 кг, насыщенным водным раствором бикарбоната Me гск 9385), проэлюировали хлороформом и натрия (500 мл), затем проэкстрагировали получили озаглавленный продукт в виде масла этил ацетатом (Зх 500 мл). Объединенные (45,1 грамма), представляющего смесь аномеров экстракты промыли водой (2x250 мл) и рассолом (1:1); параметры ЯМР спектра (ДМСО- d6) 6(3,1(250 мл), высушили над (MgSO/j), затем упарили 3,3 (4Н), 3,42 (6Н), 4,4-4,6 (4Н), до получения пены, которую пропустили через 5,41 (1Н), 5,46 (1Н), 5,54 (1Н), 5,63(1 Н) хроматографическую колонку, заполненную 7,46 (4Н), 7,58 (2Н), 8,07 (4Н); макс диоксидом кремния (600 грамм, Me r ск 7734), (СНВ 1717 см"1 проэлюировали смесью этилацетата и метанола Промежуточный продукт (в результате получили смесь аномеров) 1:1) /±/-цис-1-/2-бензоилоксиметил-1,3-оксатиолан31.59 грамма. Смесь перекристаллизовали из 5-ИЛ/-/1Н/воды 45 мл) и этанола (9,0 мл), в результате ПИРИМИДИН-2-4-ДИОН получили твердый остаток 10,23 грамма, который перекристаллизовали из этанола (120 мл) и воды) 30 мл), в результате получили озаглавленньй Смесь тщательно измельченного урацила продукт в виде твердого вещества белого цвета (9,62 грамма), гексаметилсилазана (50 мл) и сульфата аммония (30 мг) нагрели с обратным 17 40589 18 (±)-цис-4-амино-1 -(2-гидроксиметил-1,3(9,26 грамм); макс (МеОН) 229,4 мм ( Чем 610); оксатиолан-5-ил)-(1 Н)пидимидин-2-она 14О 272,4 мм ( 1ел* 293); параметры ЯМР спектра 1Н ЯМР (ДМСО de) б (А) 25 мг рацемического продукта примера (1) подвергали препаративной ВЭЖХ в следующих 3,14 (1Н), 3,50 (1Н), 4,07 (2Н), 5,52 (1Н), условиях; 5,66 (1Н), 6,28 (1Н); 7,22 (2Н), 7,56 (2Н), Колонка: Мерк Н і ваг триацетат целлюлозы, 7,72 (2Н), 8,10 (2Н). 250 х 10 мм, Юр Метод (в) Элюент: этанол Оксихлорид фосфора (7,0 мл) по каплям Скорость потока: 3 мл/мин добавили к перемешиваемому, охлаждаемой Детектор: УФ, 270 нм льдом суспензии 1,2,4-триазола (11,65 грамм) в ацетонитриле (120 мл), затем, сохраняя Температура: комнатная. температуру внутри реакционного сосуда ниже Выпаривание соответствующих собранных 15°С, по каплям добавили триэтиламин (22,7 мл). фракций, давало (-M2R, цис)-4-амино-1-(2Через 10 минут медленно добавили раствор (±)гидрокси метил-1,3-оксатиолан-5-ил)-(1 Н)цис-1-(2-бензоилоксиметил-1,3-оксатиолан-3-ил)(1 Н)-пиримидин-2,4-диона (6,27 грамм) в пиримидин-2-она (6,8 мг примерно 100%) L a д> ацетонитриле (330 мл). Затем перемешивание 137° (с. 1.01 МеОН) и (+)(2S, цис)-4-амино-1-(2гидроксиметил-1,3-оксатиолан-5-ил)-(1 Н)продолжали при комнатной температуре в г pi течение ночи. Затем смесь охладили на ледяной бане и медленно добавили триэтиламин (30 мл) пиримидин-2-она 3.6 мг/примерно 90% L a lD вслед затем - воду (21 мл). Полученный раствор +127°(с.1,01 МеОН). упарили и, остаток разделили между насыщенным В) 26 мг рацемического продукта примера 1 раствором бикарбоната натрия (400 мл) и подвергали препаративной ВЭЖХ в следующих хлороформом (3 х 200 мл). Объединенные условиях: хлороформные экстракты сушили над сульфатом Колонка: ASTEC циклобонд 1 ацетил, 250x4.6 магния, фильтровали и упаривали, получая сырой мм; остаток (9,7 грамма). Остаток растворяли в 1,4Элюент: 0,2% ацетат триэтиламмония диоксане (240 мл) и добавляли (получен добавлением ледяной уксусной кислоты концентрированный раствор водного аммиака к 0,2.% раствору триэтиламина в воде до (0,880 грамм, 550 мл). Через 1,5 часа раствор конечной величины рН 7,2); упаривали, и остаток растворяли в метаноле. Эта Скорость потока; 2 мл/мин; процедура вызывала осаждение твердого осадка, Детектор: УФ,300 нм; который отфильтровывали. Маточный раствор Температура: комнатная. пропускали через хроматографическую колонку, Выпаривание соответствующих фракций заполненную силикагелем (600 грамм, Мерк 9385). давало неочищенный (-) (2R, цис) -4-амино-1-( 2Нужные фракции собирали и упаривали, получая гидроксиметил-1,3-оксатиолан-5-ил) -(1Н)указанное в заголовке соединение в виде пиримидин-2-он (25 мг) и неочищенный (+) (2S, твердого вещества желтовато-коричневого цвета цис)-4-амино-(2-гидроксиметил-1,3-оксатиолан-5(2,81 грамма), идентичного соединению, ил)-(1Н)-пиримидин-2-он (17 мг). Эти фракции полученному по методу (А). раздельно подвергали дальнейшей Пример I препаративной ВЭЖХ в следующих условиях: (±)-(2R,S цис-4-амино-1-(2-гидроксиметил-1,3Колонка: ASTEC циклобонд 1 ацетил, 250x4.6 оксатиолан-5-ил)мм (1 Н)-пиримидин-2-он Элюент: 15 мМ ацетат аммония, рН 6.8; Скорость потока: 0,5 мл/мин. Детектор: УФ, 300 нм, Суспензию (цис)-4-амино-1-(2Температдра: 5°С. бензоилоксиметил-1,3-оксатиолан-5-ил)-(1 Н)Упаривание соответствующих собранных пиримидин-2-она (промежуточное соединение 3) фракций давало 5,0 мг /около 91%/ (-)(2R, цис)-4(8.19 грамма) и Амберлитовой смолы IRA-400 амино-1-/2-гидроксиметил-1,3-оксатиолан-5-ил/(ОН) (8.24 грамма) в метаноле (250 мл) (1Н)-пиримидин-2-она и 7,6 мг (около 96%) (+) (2S, перемешивали и нагревали с обратным цис)-4-амино-1- (2-гидроксиметил-1,3-оксатиоланхолодильником в течение 1 часа 15 минут. 5-ил)-(1 Н)-пиримидин-2-она. Твердые вещества отфильтровывали, затем Пример 3 промывали метанолом. (-)-(2R, цис)-4-амино-1-(2-гидроксиметил-1,3Объединенные фильтраты упаривали. оксатиолан-5-ил) Остаток растирали с эти л ацетатом /80 мл/. -(1 Н)-пиримидин-2-он Полученный белый остаток отфильтровывали, получая указанный в заголовке продукт (5,09 грамма), параметры ЯМР спектра 1Н ЯМР (ДМСО (i) (±)-(2R , 9 цис)-4-амино-1-(2-гидроксиметилde) 5 3.04 (1Н), 3,40 (1Н), 3,73(2Н), 1,3оксатиолан-5-ил)-(1Н)-пиримидинон, 5.18 (1Н), 5,29(1Н), 5,73 (1Н), 6,21 (1Н-), 7,19 первичный кислый Фосфат, аммониевая соль (2Н), 7.81 (1Н). Пример 2 Холодную (0°% перемешиваемую суспензию Хиральное ВЭЖХ разделение энантиомеров ;140 7 20 19 40589 (±)-(2R,S цис)-4-амино-1 -(2-гидроксиметил-1,31Н ЯМР (ДМСО) 5 3.04 (1Н); 3.40 (1Н), 3,73 оксатиолан-5-ил)-(1 Н)-пиримидин-2-она (1,0 (2Н); 5,18(1 Н); грамм) из примера 1 в сухом триэтилфосфате (20 5.29 (1Н); 5,73 (1Н); 6,21 (1Н); 7,19 (2Н); 7,61 мл) обрабатывали оксихлоридом фосфора (2,44 (1Н). мл) и, смесь перемешивали при 0°С в течение 35 Соответствующие фракции, полученные на минут, затем гасили в ледяной воде (60 грамм). колонке из Сефадекса, содержание второй Добавлением 1Н норм, водного раствора элюируемый компонент, объединяли и упаривали. гидроксида натрия доводили рН холодной смеси Остаток растворяли в воде (30 мл), обрабатывали до значения 2,5, затем смесь пропускали через щелочной фосфагазой, выделенной из Escherichia колонку, заполненную активированным углем (10 coli (EC 3.1.3.1) (1.5 мл с 416 ед./мл), затем грамм, DARCO), которую элюировали сначала инкубировали при 37°С в течение часа. водой, потом смесью водный раствор аммиакаРастворитель удаляли упариванием, и остаток этанол, Фракции, содержащие сырой пропускали через хроматографическую колонку, монофосфат, объединяли и концентрировали. заполненную диоксид кремния 60 грамм, Мерк Полученный раствор пропускали через колонку, 7734), элюировали хлороформ-метанольными заполненную ДЕАЕ Сефадексом А - 25 (НСОз смесями. Упаривание соответствующих фракций форма). Элюирование осуществляли в градиенте из смеси метанол-этилацетат давало (-)-(цис)-4концентраций: вода (120 мл) до О.1М раствора амино-1 -/2-гидроксиметил-1,3-оксатиолан-5-ил)NH4HCO (240 мл) затем 0.2, 0.3 и 0.4М NH4HCO3 (1Н)-пиримидин-2-он в виде твердого вещества (120, 240 и 400мл соответственно). \а21 Соответствующие фракции объединяли и белого цвета (0.52 грамма); г*о ]J -132° ( 1.08 концентрировали. Полученный раствор МеОН); 1Н ЯМР (ДМСО) б 3.04 (1Н); 3,40 (1Н); 3,75 (2Н); 5.18 (1Н); разбавляли водой (40 мл) и сушили лиофильной 5,29 (1Н); 5.73 (1Н); 6.1 (1Н); 7.19(2Н); сушкой, в результате получали указанный в 7,81 (1Н). заголовке продукт в виде твердого вещества Пример 4 белого цвета. (1.37 грамм); Лмакс. (рН 6, буфер) (-)- (2R. цис)-4-амино-1-(2-гидроксиметил-1.3i% оксатиолан-52 7 1 н м ( п і ^ = 190); ил)-(1 Н)-пиримидин-2-он 1Н ЯМР (Д20) б 3.23 (1Н), 3,55 (1Н); 4,04.2(2Н), 5,43 (1Н); 6,07 (1Н), 6,33 (1Н); 8.08 (1Н). ( і ) Три колбы объемом по 50 мл с ( ii ) (-)-(2R, цио)-4-амино-1-/2-гидроксиметилпитательным бульоном (Oxcid 2td) 1,3-оксатиолан иннокулировали каждую с помощью петли, -5-ИЛ/-/1 Н/-пиримидин-2-он и (+)-(2S, цис) -4заполненной бактериями Escherichia coli (ATCC 23 амино 848), снятыми с чашек с питательным агаром. -1 -/2-гидроксиметил-1,3-оксатиолан-5-ил/Колбы инкубировали в течение ночи при 37°С при /1Н/встряхивании с 250 оо/мин, а затем содержимое пиримидин-2-он каждой колбы использовали для иннокуляции 41 СДД среды (глутаминовая кислота 3 г/л, MgSO4 5-нуклеотидазу (из crotalus atrox venom (EC 0.2 г/л; H2SO4, 2.5 г/л; NaCI 2.3 г/л; Na2HPO4-2H2O 3.1.3.5/ /60 мг с содержанием 17 единиц/мг/ 1.1 г/л; NaH2HPO4-2H2O 0.6 г/л; цитидин 1.2 г/л) в добавляли к раствору аммониевой соли б' ферментере объемом семь литров. Ферментация первичного кислого фосфата (±)-(2R,S цис)-4культур проводилась при встряхивании 750 амино-(2-гидроксиметил-1,3-оксатиолан-3-ил)об/мин, 37°С о аэрацией 4 м/мин. После 24 (1 Н)-пиримидин-2-она, (1,35 грамма) в буфере (30 часового выращивания клетки собирали путем мл), полученном из глицина (526 мг) и хлорида центрифугирования /5000 грамм, 30 минут/выход магния (190 мг) и воды (100 мл), и смесь составил 72 грамма влажной массы. Клеточные выдерживали при 37°С в течение 2.5 часов. Затем гранулы повторно суспендировали в 300 мл 20мМ добавляли еще 20 мг фермента и инкубацию трис HCI буфера рН 7.5/ и разрушали продолжали еще в течение 3,5 часов. Эту смесь ультразвуком (4 х 45 секунд). Клеточный дебрис пропускали через колонку, заполненную ДЕАЕ удаляли центрифугированием (30.000 г, 30 минут), Сефадексом А-25 (НСОз - форма). Элюирование а белок (протеин) супернатанта осаждали проводили водой (160 мл), затем 0.1, 0.2, 0,3 и 0,4 добавлением до сульфата аммония до 75% М NH4HCO3 (по 200 мл каждого раствора). насыщения. Осадок собрали путем Соответствующие фракции, содержащие первый центрифугирования (30,000 г, 30 минут) и гранулы элюируемый компонент объединяли и упаривали, ресуспендировали в 25 мл HEPES буфере /100 остаток подвергали хроматографированию на мМ, рН 7,0), содержащем сульфат аммония (75% колонке, заполненной силикагелем /60 грамм насыщение). Раствор фермента получили путем Merck 7734), которою затем элюировали центрифугирования (12,000 об/мин, 30 минут). хлороформ-метанольными смесями. Упаривание Слой супернатантный слили, а гранулы соответствующих фракций из смеси метанолрастворили в трис -НС буфере (100 мМ, рН 7,0), этилацетат давало: 0,30 грамм (+)-( цис)-4доведя объем до первоначального. амино-1-(2-гидроксиметил-1,3 оксатиолан-5-ил)(1 Н)-пиримидин-2-она в виде твердого веществе (ii) Продукт примера 1 (115 мг) был растворен в воде (ICO мл) и перемешан. К нему добавила раствор фермента (0,3 мл) и смесь выдерживали белого цвета +137° (с І.04МеОН); F 22 21 40589 Колонка: капилярньй патрон, Сферисоро ODSпри постоянной рН за счет непрерывного 13мм добавления HCI (25 мл). Превращение Элюент дигидрофосфат аммония (50 мл) + 5% контролировалось методом хиральной ВЭЖХ, МеС. которая показала, что происходило предпочтительное дезаминирование (+) Скорость потоки: 1,5 мл/мин энантиомера субстрата. Через 22 часа (+) Детектор: Уф, 270 нм энантиомер субстрата (RT 12,5 мин) был Времена удерживания: СН-180-5 мин, полностью выделен, и рН раствора довели до дезаминированный СН-189 8. 1 мин. 10,5, добавляя концентрированный раствор 2. Аналитическая хиральная ВЭЖХ гидроксида натрия. Колонка Циклобонд 1 ацетил, 250x4, 6 мм Олюент: 0,2% раствор триэтиламмоний Раствор, полученный выше, проэлюировали ацетата (рН 7,2) через колонку, заполненную ОАЕ Сефадексом (А Скорость потока 1,0 мл/мин 25; Pharmacia; 30x1,6см), уравновешенную Детектор: Уф, 270 нм предварительно до рН 11. Колонку промыли водой Времена удерживания: СН-189, 12,0 мин и 12,3 (200 мл), и затем 0,1 HCI. Были отобраны фракции мин, дезаминированный ВСН-189 8,5 мин и 10, 2 по 40 мл и проанализированы методом ВЭЖХ с мин. обратимойт фазой. Фракции 3-13, содержащие (Ниопровращение отслеживалось путем непрореагировавший (-) энантиомер субстрата наблюдения за снижением пика в момент 12,3 объединили и довели их рН до 7,5 добавлением минут и накоплением продукта в момент 10,2 HCI. мин.). Фракция 47, содержащая дезаминированный Пример 5 продукт, была доведена до рН 7,5 добавлением (-)-цис-4-8-амино-1 -/2-гидроксиметил-1.3разбавленного NaOH. Анализ, проведенньй оксатиолан-5-ил методом хиральной ВЭЖХ, показал, что этот (1 Н)-пиримидин-2-он материал это - смесь, состоящая в основном из одного энантиомера /RT 10/2 мин/ и другого Бактериальные петли: клеток d.coli (ATCC энантиомера ( RT 8,5 мин) - побочный продукт. 32848), снятые с хорошо проросших чашек с (iii) Стадия ( ii ) была повторена в более питательным агаром, были использованы для широком масштабе. Соединение примера Т (363 ИНОКУЛЯЦИИ двух колб Frarence каждая из мг) в 250 мл воды инкубировали с раствором которых содержала 250 мл питательного бульона. фермента (0,5 мл), полученного в стадии (і). Через Культуру инкубировали при 37°С при 18 и соответственно 48 часов добавили еще встряхивании (250 об/мин, 5 см) в течение 18 порции по 0,3 мл раствора фермента. часов. Затем содержимое этих колб было Реакционную смесь перемешивали в течение 70 использовано для инокуляции 40 литров СДД часов, затем оставили стоять еще на 64 часа. среды с цитидином в 70-литровом ферментере. Анализ проведенный методом хиральной ВЭЖХ, Условия ферментации были следующие: показал, что (+) энантиомер субстрата полностью аэрация 40 л/мин, скорость перемешивания 750 дозаминирован, и полученный раствор довели, об/мин при температуре 37°С. Три импеллера добавляя NaOH, до рН 10.5. Rushton были вставлены в ферментер. Раствор, полученный выше, пропустили через Ферментационный процесс длился 18 часов, ту же CAB колонку и проэлюировали так же, как в затем выращенный урожай собрали, использовав стадии (і). Фракции 2-6, содержащие смесь центрифугу Sharpies для непрерывного остатков субстрата и дозаминированного центрифугирования. Клеточную пасту (вес продукта, были собраны. Фракции 7-13, влажный 150 грамм) заморозили при -20°С прежде содержащие остатки субстрата //-/энантиомер/ чем провести разрушение клеток. были собраны и рН было доведено до 7,5. СДД среда Фракции 25-26, содержащие дозаминированный грамм/литр продукт бьли собраны и нейтрализованы. L -глутаминовая Фракции 2-6 были вновь пропущены через ту кислота 3 же ОАЕ колонку, фракции 3-11 из этой второй колонки содержали нейрореагировавший субстрат с MgSO4 0,2 ((-)энантиомер). Фракция 70 содержала K2SO4 2,5 дезаминированный продукт. NaCI 2,3 ( iv) Фракции растворенного субстрата из NaH2BO4 0,6 стадий (ii) и (iii) были объединены и их рН Na2HPO4 1,1 доведено до 7,5. Раствор проэлюирован через Была приготовлена эта среда на колонку ХАР-16/40x2,4 см), упакованную в воде. дистиллированной воде. Простерилизована при Колонка была промыта водой, и затем 121 °С в течение 30 минут. Цитидин (1,6, проэлюирована смесью ацетон: вода = 1:4 об/об. грамм/литр) был простерилизован и добавлен Фракции, содержащие (-) энантиомер ВСН 189, перед иннокуляцией. были собраны и после сушки вымораживанием Замороженная клеточная паста (150 (лиофильной) был получен порошок белого цвета грамм/была оттаяна и суспендирована в 750 мл (190 мг). 100 мМ НЕРЕ S/N [2-гидроксиэтил] пиперизин - N 1 2-этансульфокислота /буфере /рН 7,5), Методы ВОЖХ, использованные выше, содержащем 1 мМ этилендиаминтетрауксусной соответствуют следующим параметрам: кислоты (натриевая соль) и 1 мМ дитиотрейтола) Аналитическая ЗЖХ с обратимой фазой: 24 23 40589 разрушающий буферный раствор). Клетки были объема слоя в час). Уридиновьй аналог разрушены в результате пропускания суспензии адсорбировали на полимере/смоле/, и (-)через Manton - Baclin гомогенизатор под энантиомер пропустили через эту смолу. Весь (2 2 давлением 7500 фунт/дюйм (42,10 кПа). Такая )энантиомер, оставшийся на смоле (удалили процедура была повторена трижды с охлаждепромыванием 0,04% раствора аммиака (2 объема нием суспензии примерно до 5°С после каждого слоя), скорость потока 0,8 объемов слоя/час). прохождения через гомогенизатор. Гомогенизат рН прошедших растворов и промывных вод осветлили путем центрифугирования (1400 г. 60 (600 мл) довели до рН 7,0, добавляя мин). Цитидин дезаминазную активность концентрированную серную кислоту, и раствор адсорбировали на Q-сефарозной колонке (490 мг пропустили через ХАД16 смолу (50 мл, скорость объем слоя), уравновешенной 50 мМ Трис потока 1,4 объема слоя/час/. Колонку промыли (гидроксиметил) метиламином (рН 7,5), дистиллированной водой (2,6 объема слоя, содержащем 1 мМ хлорида натрия. Собранные скорость потока 2 объема слоя в час), и (-)активные фракции (210 мл) пропустили через энантиомер проэлюировали смесью ацетон : вода, фенил-Сефарозную -колонку (490 мл объема взятой в соотношении 1:3) скорость потока 1,5 слоя) предварительно уравновешенную объема слоя в час). буферным раствором, содержащим 3,2 М Масса, содержащая фракцию (-) энантиомера сульфата аммония. Связанный фермент (4 объема слоя) была сконцентрирована на проэлюировали раствором сульфата аммония в испарителе Buchi до небольшого объема, после градиенте уменьшающихся концентраций. этого была профильтрована через стеклянный Фракции, содержащие цитидин дезаминазную фильтр № 3. Фильтрат высушили, использовав активность были собраны (695 мл), частично лиофильную сушку, в результате получили 1,4 очищенный фермент был затем осажден 80% грамма продукта, название которого дано в сульфатом аммония. После центрифугирования заголовке, идентичного продукту, полученному в (1400 г, 60 мин) гранулы ресуспендировали в 54 примере 4. мл супернатантного слоя из выше приведенной Пример 6 стадии и хранили и при 4°С. Составы для таблеток 6.2 мл этого раствора центрифугировали А. Следующий состав получен путем влажной (18000 г, 80 минут) и гранулы растворили в 24 мл грануляции ингредиентов с раствором провидона 0,5 М Калий фосфатном буфере (рН 7,5). В в воде, высушивания и проверки, вслед за которой течение ночи систему подвергли деализу в 1М идет добавление стеарата магния и прессование. фосфатном буфере, рН 7,5. Удержанный объем иг/івблвтна был затем проэлюирован равным объемом дистиллированной воды (20 мл). К 35 мл этого (а)Активный ингредиент 250 раствора добавили 1 грамм сухих шариков Euper210 (е) Лактоза &
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod for treating a human suffering from viral infection, pharmaceutical composition, combination of compounds for the preparation of medications and pharmaceutical combination
Автори англійськоюCoates Jonathan Alan Victor, Mutton Ian Martin, Penn Charlz Richard, Storer Richard, Uilyamson Kristofer
Назва патенту російськоюСпособ лечения человека, страдающего от вирусной инфекции, фармацевтическая композиция, комбинация веществ для получения лекарств и фармацевтическая комбинация
Автори російськоюКоутс Джонатан Алан Виктор, Маттн Ян Мартин, Пенн Чарльз Ричард, Сторер Ричард, Уильямсон Кристофер
МПК / Мітки
МПК: A61K 31/506, A61K 31/513, A61K 31/39
Мітки: інфекції, страждає, отримання, ліків, вірусної, речовин, спосіб, комбінація, фармацевтична, композиція, людини, лікування
Код посилання
<a href="https://ua.patents.su/16-40589-sposib-likuvannya-lyudini-shho-strazhdaeh-vid-virusno-infekci-farmacevtichna-kompoziciya-kombinaciya-rechovin-dlya-otrimannya-likiv-ta-farmacevtichna-kombinaciya.html" target="_blank" rel="follow" title="База патентів України">Спосіб лікування людини, що страждає від вірусної інфекції, фармацевтична композиція, комбінація речовин для отримання ліків та фармацевтична комбінація</a>
Попередній патент: Мітчик з внутрішнім підводом мастильно-охолоджувальної рідини
Наступний патент: Інструмент для натягування дроту
Випадковий патент: Біологічно активна домішка