Гуманізоване моноклональне антитіло, що зв’язується з steap-1, та його застосування
Номер патенту: 94628
Опубліковано: 25.05.2011
Автори: Рубінфелд Бонні, Денніс Майкл С., Полакіс Пол, Якобовіц Айя
Формула / Реферат
1. Гуманізоване моноклональне антитіло, що зв'язується з STEAP-1, що містить важкий ланцюг (НС), який містить
(1) HVR-H1, що містить амінокислотну послідовність SEQ ID NO:14;
(2) HVR-H2, що містить амінокислотну послідовність SEQ ID NO:15;
(3) HVR-H3, що містить амінокислотну послідовність SEQ ID NO:16; і
(4) HC-FR1, що містить амінокислотну послідовність SEQ ID NO:25.
2. Антитіло за п. 1, що додатково містить щонайменше один, два або три каркасних райони (FR), вибрані з
(1) HC-FR2, що містить амінокислотну послідовність SEQ ID NO:22, 75 або 76;
(2) HC-FR3, що містить амінокислотну послідовність SEQ ID NO:23, 78 або 79; і
(3) HC-FR4, що містить амінокислотну послідовність SEQ ID NO:24.
3. Антитіло за п. 1, що додатково містить легкий ланцюг (LC), який містить
(1) HVR-L1, що містить амінокислотну послідовність SEQ ID NO:11;
(2) HVR-L2, що містить амінокислотну послідовність SEQ ID NO:12; і
(3) HVR-L3, що містить амінокислотну послідовність SEQ ID NO:13.
4. Антитіло за п. 3, що містить легкий ланцюг (LC) SEQ ID NO:6.
5. Антитіло за п. 1, де вказаний НС містить SEQ ID NO:10.
6. Антитіло за п. 4, де вказаний НС містить SEQ ID NO:10.
7. Антитіло за п. 1, де вказане антитіло є фрагментом антитіла, вибраним із фрагментів Fab, Fab'-SH, Fv, scFv або (Fab')2.
8. Спосіб детектування присутності STEAP-1 у біологічній пробі, що передбачає приведення біологічної проби в контакт з антитілом за п. 1 в умовах, пермісивних для зв'язування вказаного антитіла з STEAP-1, і детектування того, чи утвориться комплекс між антитілом і STEAP-1.
9. Спосіб за п. 8, де біологічна проба одержана з організму пацієнта, що припустимо має клітинно-проліферативне порушення клітин передміхурової залози, легені, ободової кишки, сечового міхура, яєчника або саркоми Юїнга.
10. Імунокон'югат, що містить антитіло за п. 1, ковалентно зв'язане з цитотоксичним агентом.
11. Імунокон'югат за п. 10, де цитотоксичний агент вибраний з токсину, хіміотерапевтичного агента, лікарського засобу, антибіотика, радіоактивного ізотопу і нуклеолітичного ферменту.
12. Імунокон'югат за п. 11, де імунокон'югат має формулу Ab-(L-D)p, і де:
(a) Аb означає антитіло за п. 1 або п. 3;
(b) L означає лінкер;
(c) D означає лікарський засіб, і
(d) р змінюється в інтервалі приблизно від 1 до 20.
13. Імунокон'югат за п. 12, де L вибраний з 6-малеїмідокапроїлу (МС), малеїмідопропаноїлу (МР), валін-цитруліну (val-cit), аланін-фенілаланіну (ala-phe), п-амінобензилоксикарбонілу (РАВ), N-сукцинімідил-4-(2-піридилтіо)пентаноату (SPP), N-сукцинімідил-4-(N-малеїмідометил)циклогексан-1-карбоксилату (SMCC), N-сукцинімідил-(4-иодацетил)амінобензоату (SIAB) і 6-малеїмідокапроїл-валін-цитрулін-п-амінобензилоксикарбонілу (MC-vc-PAB).
14. Імунокон'югат за п. 13, де D вибраний з ауристатину і долостатину.
15. Імунокон'югат за п. 14, де D означає групу лікарського засобу формули DE або DF
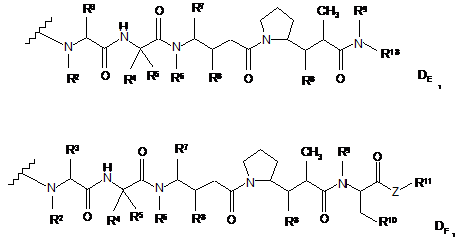
і де кожний з R2 і R6 означає метил, кожний з R3 і R4 означає ізопропіл, R5 означає Н, R7 означає втор-бутил, кожен R8 незалежно вибраний з СН3, О-СН3, ОН і Н; R9 означає Н; R10 означає арил; Z означає -О- або -NH-; R11 означає Н, С1-С8-алкіл або -(СН2)2-О-(СН2)2-О-(СН2)2-О-СН3; і R18 означає -C(R8)2-C(R8)2-apил; і
р змінюється в інтервалі приблизно від 1 до 8.
16. Імунокон'югат за п. 12, що має активність, пов'язану зі знищенням клітин in vitro або in vivo.
17. Імунокон'югат за п. 12, що має формулу Ab-(L-MMAE)p, де L означає лінкер, а р змінюється в інтервалі від 2 до 5.
18. Імунокон'югат за п. 17, де L містить val-cit.
19. Імунокон'югат за п. 17, де L містить МС.
20. Імунокон'югат за п. 17, де L містить РАВ.
21. Імунокон'югат за п. 17, де L містить MC-vc-PAB.
22. Імунокон'югат за п. 12, де D означає майтансиноїд.
23. Імунокон'югат за п. 22, де D вибраний з DM1, DM3 і DM4.
24. Імунокон'югат за п. 22, де вказаний лінкер приєднаний до антитіла через тіолову групу на антитілі.
25. Імунокон'югат за п. 22, де вказаний лінкер, L, вибраний з N-сукцинімідил-4-(2-піридилтіо)пентаноату (SPP), N-сукцинімідил-4-(N-малеїмідометил)циклогексан-1-карбоксилату (SMCC) і N-сукцинімідил-(4-йодацетил)амінобензоату (SIAB).
26. Імунокон'югат за п. 25, де D є DM4.
27. Імунокон'югат за п. 26, де L містить SPP.
28. Імунокон'югат за п. 26, де L містить SMCC.
29. Імунокон'югат за п. 26, де р складає від 2 до 6.
30. Фармацевтична композиція, що містить імунокон'югат за п. 12 і фармацевтично прийнятний носій.
31. Спосіб лікування клітинно-проліферативного порушення, що передбачає введення індивідууму ефективної кількості фармацевтичної композиції за п. 30.
32. Спосіб за п. 31, де клітинно-проліферативне порушення вибране з клітинно-проліферативного порушення передміхурової залози, легені, ободової кишки, сечового міхура, яєчника і саркоми Юїнга.
33. Цистеїн-вбудоване антитіло, що містить антитіло за п. 1 або п. 3, де один або більше амінокислотних залишків замінені одним або більше амінокислотними залишками вільного цистеїну, що мають величину реакційної здатності тіолів в інтервалі від 0,6 до 1,0.
34. Цистеїн-вбудоване антитіло за п. 33, де один або більше амінокислотних залишків вільного цистеїну розташовані в легкому ланцюзі.
35. Цистеїн-вбудоване антитіло за п. 33, де один або більше амінокислотних залишків вільного цистеїну розташовані у важкому ланцюзі.
36. Імунокон'югат, що містить цистеїн-вбудоване антитіло за п. 33, ковалентно зв'язане з цитотоксичним агентом.
37. Імунокон'югат за п. 36, де цитотоксичний агент вибраний з токсину, хіміотерапевтичного агента, лікарського засобу, антибіотика, радіоактивного ізотопу і нуклеолітичного ферменту.
38. Цистеїн-вбудоване антитіло за п. 33, ковалентно приєднане до захоплюючої мітки, детектованої мітки або твердого носія.
39. Кон'югат антитіло-лікарський засіб, що містить цистеїн-вбудоване антитіло за п. 33, де вказане антитіло ковалентно приєднане до лікарського засобу ауристатину або майтансиноїду.
40. Кон'югат антитіло-лікарський засіб, що містить цистеїн-вбудоване антитіло за п. 33 (Аb) і лікарський засіб ауристатин або майтансиноїд (D), причому цистеїн-вбудоване антитіло приєднане через один або більше амінокислотних залишків вільного цистеїну лінкерною частиною (L) до D; при цьому сполука має формулу І:
Ab-(L-D)p, I
де р дорівнює 1, 2, 3 або 4.
41. Кон'югатна сполука антитіло-лікарський засіб за п. 40, де р дорівнює 2.
42. Кон'югатна сполука антитіло-лікарський засіб за п. 40, де L має формулу
-Аа- Ww - Yу-,
в якій
-А- означає подовжуючу ланку, ковалентно зв'язану з цистеїновим тіолом цистеїн-вбудованого антитіла (Аb); а дорівнює 0 або 1;
кожний -W- незалежно означає амінокислотну ланку; w означає ціле число від 0 до 12;
-Y- означає спейсерну ланку, ковалентно приєднану до лікарської частини; і у дорівнює 0, 1 або 2.
43. Кон'югатна сполука антитіло-лікарський засіб за п. 42, що має формулу:
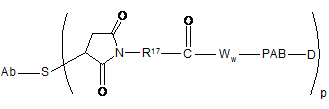 ,
,
де РАВ означає пара-амінобензилкарбамоїл, і R17 означає двовалентний радикал, вибраний з (СН2)r, С3-С8карбоциклілу, О-(СН2)r, арилену, (СН2)r-арилену, -арилен-(СН2)r, (СН2)r-(С3-С8карбоциклілу), (C3-C8карбоцикліл)-(СН2)r, С3-С8гетероциклілу, (СН2)r-(С3-С8гетероциклілу), -(С3-С8гетероцикліл)-(СН2)r, -(CH2)rC(O)NRb(CH2)r-, -(CH2CH2O)r-, -(СН2СН2О)r-СН2-, (CH2)rC(O)NRb(CH2CH2O)r, -(CH2)rC(O)NRb(CH2CH2O)rCH2-, -(CH2CH2O)rC(O)NRb(CH2CH2O)r-, -(CH2CH2O)rC(O)NRb(CH2CH2O)r-CH2 і -(CH2CH2O)rC(O)NRb(CH2)r-; де Rb означає Н, С1-С6 алкіл, феніл або бензил; і r незалежно означає ціле число від 1 до 10.
44. Кон'югатна сполука антитіло-лікарський засіб за п. 42, де Ww є валін-цитруліном.
45. Кон'югатна сполука антитіло-лікарський засіб за п. 43, де R17 є (СН2)5 або (СН2)2.
46. Кон'югатна сполука антитіло-лікарський засіб за п. 42, що має формулу:
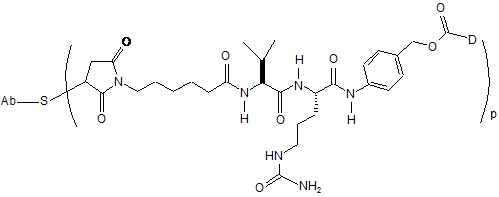 .
.
47. Кон'югатна сполука антитіло-лікарський засіб за п. 40, де D є ММАЕ, що має структуру:
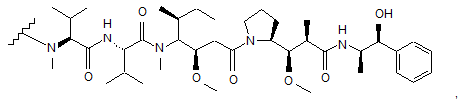
де хвилястою лінією показаний сайт приєднання до лінкера L.
48. Фармацевтична композиція, що містить кон'югат антитіло-лікарський засіб за п. 39 і фармацевтично прийнятний розріджувач, носій або ексципієнт.
49. Спосіб лікування раку, що передбачає введення пацієнту фармацевтичної композиції за п. 48.
50. Спосіб за п. 49, де рак вибраний із групи, що складається з раку передміхурової залози, раку легені, раку ободової кишки, раку сечового міхура, раку яєчника і саркоми Юїнга.
51. Спосіб за п. 49, де пацієнту вводять хіміотерапевтичний агент у комбінації з кон'югатною сполукою антитіло-лікарський засіб, де хіміотерапевтичний агент вибраний з летрозолу, цисплатину, карбоплатину, таксолу, паклітакселу, оксаліплатину, доксетакселу, 5-ФУ, лейковорину, лапатинібу і гемцитабіну.
52. Цистеїн-вбудоване антитіло за п. 33, що містить цистеїн в одному або більше положеннях, вибраних з 15, 43, 110, 144, 168 і 205 легкого ланцюга, відповідно до нумерації Кабата, і 41, 88, 115, 118, 120, 171, 172, 282, 375 і 400 важкого ланцюга, відповідно до нумерації EU.
53. Антитіло за п. 52, де цистеїн знаходиться в положенні 205 легкого ланцюга.
54. Антитіло за п. 52, де цистеїн знаходиться в положенні 118 важкого ланцюга.
55. Кон'югатна сполука антитіло-лікарський засіб за п. 40, де D є DM4, що має структуру:
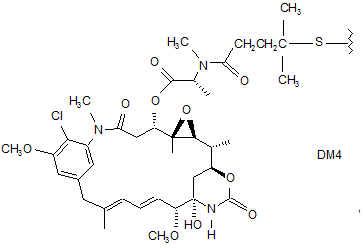
де хвилястою лінією показаний сайт приєднання до лінкера L.
56. Кон'югатна сполука антитіло-лікарський засіб, вибрана із структур:
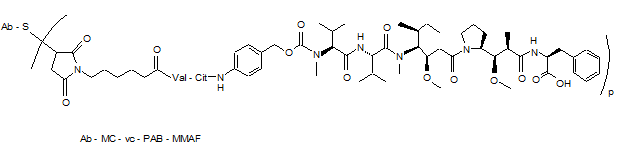 ,
,
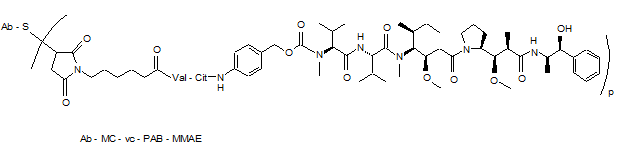 ,
,
 ,
,
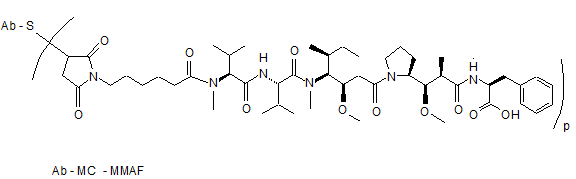 ,
,
 ,
,
де Val означає валін; Cit означає цитрулін; р дорівнює 1, 2, 3 або 4; і Аb означає анти-STEAP-1-антитіло за п. 33.
57. Антитіло за п. 3, де LC містить
(1) ділянку легкого ланцюга, що містить амінокислотну послідовність SEQ ID NO:90;
(2) ділянку легкого ланцюга, що містить амінокислотну послідовність SEQ ID NO:92;
(3) ділянку легкого ланцюга, що містить амінокислотну послідовність SEQ ID NO:93;
(4) ділянку легкого ланцюга, що містить амінокислотну послідовність SEQ ID NO:94;
(5) ділянку легкого ланцюга, що містить амінокислотну послідовність SEQ ID NO:95;
(6) ділянку легкого ланцюга, що містить амінокислотну послідовність SEQ ID NO:96;
(7) ділянку легкого ланцюга, що містить амінокислотну послідовність SEQ ID NO:97;
(8) ділянку легкого ланцюга, що містить амінокислотну послідовність SEQ ID NO:98;
(9) ділянку легкого ланцюга, що містить амінокислотну послідовність SEQ ID NO:99;
(10) ділянку легкого ланцюга, що містить амінокислотну послідовність SEQ ID NO:100; і
(11) ділянку легкого ланцюга, що містить амінокислотну послідовність SEQ ID NO:101.
Текст
1. Гуманізоване моноклональне антитіло, що зв'язується з STEAP-1, що містить важкий ланцюг (НС), який містить (1) HVR-H1, що містить амінокислотну послідовність SEQ ID NO:14; (2) HVR-H2, що містить амінокислотну послідовність SEQ ID NO:15; (3) HVR-H3, що містить амінокислотну послідовність SEQ ID NO:16; і (4) HC-FR1, що містить амінокислотну послідовність SEQ ID NO:25. 2. Антитіло за п. 1, що додатково містить щонайменше один, два або три каркасних райони (FR), вибрані з (1) HC-FR2, що містить амінокислотну послідовність SEQ ID NO:22, 75 або 76; (2) HC-FR3, що містить амінокислотну послідовність SEQ ID NO:23, 78 або 79; і (3) HC-FR4, що містить амінокислотну послідовність SEQ ID NO:24. 2 (19) 1 3 94628 (ala-phe), п-амінобензилоксикарбонілу (РАВ), Nсукцинімідил-4-(2-піридилтіо)пентаноату (SPP), Nсукцинімідил-4-(N-малеїмідометил)циклогексан-1карбоксилату (SMCC), N-сукцинімідил-(4иодацетил)амінобензоату (SIAB) і 6 R3 N O R2 R3 N R2 2 6 O CH3 N N 5 R4 R R6 R8 R8 5 R4 R R6 R9 N R8 3 і де кожний з R і R означає метил, кожний з R і 4 5 7 R означає ізопропіл, R означає Н, R означає 8 втор-бутил, кожен R незалежно вибраний з СН3, 9 10 О-СН3, ОН і Н; R означає Н; R означає арил; Z 11 означає -О- або -NH-; R означає Н, С1-С8-алкіл 18 або -(СН2)2-О-(СН2)2-О-(СН2)2-О-СН3; і R означає 8 8 -C(R )2-C(R )2-apил; і р змінюється в інтервалі приблизно від 1 до 8. 16. Імунокон'югат за п. 12, що має активність, пов'язану зі знищенням клітин in vitro або in vivo. 17. Імунокон'югат за п. 12, що має формулу Ab-(LMMAE)p, де L означає лінкер, а р змінюється в інтервалі від 2 до 5. 18. Імунокон'югат за п. 17, де L містить val-cit. 19. Імунокон'югат за п. 17, де L містить МС. 20. Імунокон'югат за п. 17, де L містить РАВ. 21. Імунокон'югат за п. 17, де L містить MC-vc-PAB. 22. Імунокон'югат за п. 12, де D означає майтансиноїд. 23. Імунокон'югат за п. 22, де D вибраний з DM1, DM3 і DM4. 24. Імунокон'югат за п. 22, де вказаний лінкер приєднаний до антитіла через тіолову групу на антитілі. 25. Імунокон'югат за п. 22, де вказаний лінкер, L, вибраний з N-сукцинімідил-4-(2піридилтіо)пентаноату (SPP), N-сукцинімідил-4-(Nмалеїмідометил)циклогексан-1-карбоксилату (SMCC) і N-сукцинімідил-(4йодацетил)амінобензоату (SIAB). 26. Імунокон'югат за п. 25, де D є DM4. 27. Імунокон'югат за п. 26, де L містить SPP. 28. Імунокон'югат за п. 26, де L містить SMCC. 29. Імунокон'югат за п. 26, де р складає від 2 до 6. 30. Фармацевтична композиція, що містить імунокон'югат за п. 12 і фармацевтично прийнятний носій. 31. Спосіб лікування клітинно-проліферативного порушення, що передбачає введення індивідууму ефективної кількості фармацевтичної композиції за п. 30. O N R8 R18 DE O CH3 O N R9 N R7 O H N малеїмідокапроїл-валін-цитрулін-памінобензилоксикарбонілу (MC-vc-PAB). 14. Імунокон'югат за п. 13, де D вибраний з ауристатину і долостатину. 15. Імунокон'югат за п. 14, де D означає групу лікарського засобу формули DE або DF R7 O H N 4 O , O Z R10 R11 DF , 32. Спосіб за п. 31, де клітинно-проліферативне порушення вибране з клітинно-проліферативного порушення передміхурової залози, легені, ободової кишки, сечового міхура, яєчника і саркоми Юїнга. 33. Цистеїн-вбудоване антитіло, що містить антитіло за п. 1 або п. 3, де один або більше амінокислотних залишків замінені одним або більше амінокислотними залишками вільного цистеїну, що мають величину реакційної здатності тіолів в інтервалі від 0,6 до 1,0. 34. Цистеїн-вбудоване антитіло за п. 33, де один або більше амінокислотних залишків вільного цистеїну розташовані в легкому ланцюзі. 35. Цистеїн-вбудоване антитіло за п. 33, де один або більше амінокислотних залишків вільного цистеїну розташовані у важкому ланцюзі. 36. Імунокон'югат, що містить цистеїн-вбудоване антитіло за п. 33, ковалентно зв'язане з цитотоксичним агентом. 37. Імунокон'югат за п. 36, де цитотоксичний агент вибраний з токсину, хіміотерапевтичного агента, лікарського засобу, антибіотика, радіоактивного ізотопу і нуклеолітичного ферменту. 38. Цистеїн-вбудоване антитіло за п. 33, ковалентно приєднане до захоплюючої мітки, детектованої мітки або твердого носія. 39. Кон'югат антитіло-лікарський засіб, що містить цистеїн-вбудоване антитіло за п. 33, де вказане антитіло ковалентно приєднане до лікарського засобу ауристатину або майтансиноїду. 40. Кон'югат антитіло-лікарський засіб, що містить цистеїн-вбудоване антитіло за п. 33 (Аb) і лікарський засіб ауристатин або майтансиноїд (D), причому цистеїн-вбудоване антитіло приєднане через один або більше амінокислотних залишків вільного цистеїну лінкерною частиною (L) до D; при цьому сполука має формулу І: Ab-(L-D)p, I де р дорівнює 1, 2, 3 або 4. 41. Кон'югатна сполука антитіло-лікарський засіб за п. 40, де р дорівнює 2. 5 94628 17 42. Кон'югатна сполука антитіло-лікарський засіб за п. 40, де L має формулу -Аа- W w - Yу-, в якій -А- означає подовжуючу ланку, ковалентно зв'язану з цистеїновим тіолом цистеїн-вбудованого антитіла (Аb); а дорівнює 0 або 1; кожний -W- незалежно означає амінокислотну ланку; w означає ціле число від 0 до 12; -Y- означає спейсерну ланку, ковалентно приєднану до лікарської частини; і у дорівнює 0, 1 або 2. 43. Кон'югатна сполука антитіло-лікарський засіб за п. 42, що має формулу: O де РАВ означає пара-амінобензилкарбамоїл, і R означає двовалентний радикал, вибраний з (СН2)r, С3-С8карбоциклілу, О-(СН2)r, арилену, (СН2)rарилену, -арилен-(СН2)r, (СН2)r-(С3С8карбоциклілу), (C3-C8карбоцикліл)-(СН2)r, С3С8гетероциклілу, (СН2)r-(С3-С8гетероциклілу), -(С3b С8гетероцикліл)-(СН2)r, -(CH2)rC(O)NR (CH2)r-, (CH2CH2O)r-, -(СН2СН2О)r-СН2-, b (CH2)rC(O)NR (CH2CH2O)r, b (CH2)rC(O)NR (CH2CH2O)rCH2-, b (CH2CH2O)rC(O)NR (CH2CH2O)r-, b (CH2CH2O)rC(O)NR (CH2CH2O)r-CH2 і b b (CH2CH2O)rC(O)NR (CH2)r-; де R означає Н, С1-С6 алкіл, феніл або бензил; і r незалежно означає ціле число від 1 до 10. 44. Кон'югатна сполука антитіло-лікарський засіб за п. 42, де W w є валін-цитруліном. 45. Кон'югатна сполука антитіло-лікарський засіб 17 за п. 43, де R є (СН2)5 або (СН2)2. 46. Кон'югатна сполука антитіло-лікарський засіб за п. 42, що має формулу: O R17 N Ab C Ww PAB D S O p 6 , O O O O N Ab N N S H O D O H N O p H HN NH2 O . 47. Кон'югатна сполука антитіло-лікарський засіб за п. 40, де D є ММАЕ, що має структуру: O H N N O OH H N N N O O O O , де хвилястою лінією показаний сайт приєднання до лінкера L. 48. Фармацевтична композиція, що містить кон'югат антитіло-лікарський засіб за п. 39 і фармацевтично прийнятний розріджувач, носій або ексципієнт. 49. Спосіб лікування раку, що передбачає введення пацієнту фармацевтичної композиції за п. 48. 50. Спосіб за п. 49, де рак вибраний із групи, що складається з раку передміхурової залози, раку легені, раку ободової кишки, раку сечового міхура, раку яєчника і саркоми Юїнга. 51. Спосіб за п. 49, де пацієнту вводять хіміотерапевтичний агент у комбінації з кон'югатною сполукою антитіло-лікарський засіб, де хіміотерапевтичний агент вибраний з летрозолу, цисплатину, карбоплатину, таксолу, паклітакселу, оксаліплатину, доксетакселу, 5-ФУ, лейковорину, лапатинібу і гемцитабіну. 52. Цистеїн-вбудоване антитіло за п. 33, що містить цистеїн в одному або більше положеннях, вибраних з 15, 43, 110, 144, 168 і 205 легкого ланцюга, відповідно до нумерації Кабата, і 41, 88, 115, 118, 120, 171, 172, 282, 375 і 400 важкого ланцюга, відповідно до нумерації EU. 53. Антитіло за п. 52, де цистеїн знаходиться в положенні 205 легкого ланцюга. 54. Антитіло за п. 52, де цистеїн знаходиться в положенні 118 важкого ланцюга. 55. Кон'югатна сполука антитіло-лікарський засіб за п. 40, де D є DM4, що має структуру: 7 94628 8 CH3 H3C O N CH3 O H3 C O O S CH2CH2C O Cl N CH3O DM4 O N CH3O HO де хвилястою лінією показаний сайт приєднання до лінкера L. H 56. Кон'югатна сполука антитіло-лікарський засіб, вибрана із структур: O Ab - S H N O O N , O O N O O Val - Cit N H H N N N O O O O O OH p O Ab - MC - vc - PAB - MMAF , O Ab - S H N O O N O N O OH N N O Val - Cit N H H N O O O O p O Ab - MC - vc - PAB - MMAE , Ab - S O O N O Ab - MC - MMAE H N N O OH N N O H N O O O O p , 9 94628 10 Ab - S O O N H N N O O O H N N N O O O O O OH p Ab - MC - MMAF , O O O N O O H3 C O CH2CH2S Ab S N n p O N O H3 C O O Cl O N CH3O O N CH3O HO O H Ab - BMPEO - DM1 , де Val означає валін; Cit означає цитрулін; р дорівнює 1, 2, 3 або 4; і Аb означає анти-STEAP-1антитіло за п. 33. 57. Антитіло за п. 3, де LC містить (1) ділянку легкого ланцюга, що містить амінокислотну послідовність SEQ ID NO:90; (2) ділянку легкого ланцюга, що містить амінокислотну послідовність SEQ ID NO:92; (3) ділянку легкого ланцюга, що містить амінокислотну послідовність SEQ ID NO:93; (4) ділянку легкого ланцюга, що містить амінокислотну послідовність SEQ ID NO:94; (5) ділянку легкого ланцюга, що містить амінокислотну послідовність SEQ ID NO:95; (6) ділянку легкого ланцюга, що містить амінокислотну послідовність SEQ ID NO:96; (7) ділянку легкого ланцюга, що містить амінокислотну послідовність SEQ ID NO:97; (8) ділянку легкого ланцюга, що містить амінокислотну послідовність SEQ ID NO:98; (9) ділянку легкого ланцюга, що містить амінокислотну послідовність SEQ ID NO:99; (10) ділянку легкого ланцюга, що містить амінокислотну послідовність SEQ ID NO:100; і (11) ділянку легкого ланцюга, що містить амінокислотну послідовність SEQ ID NO:101. Даний винахід стосується анти-STEAP-1антитіл і їх кон„югатів. Крім того, винахід стосується способів застосування анти-STEAP-1-антитіл і їх кон„югатів. У людини рак передміхурової залози є однієї з найбільш часто діагностованих злоякісних пухлин у чоловіків і є другою основною причиною раку, що викликає смерть у чоловіків. Американська асоціація раку оцінила, що протягом 2000 року буде діагностовано 180400 нових випадків раку передміхурової залози, з 31900 смертними наслідками від цього захворювання. На пізніх стадіях, рак передміхурової залози метастазує у кісту. Незважаючи на досягнуті успіхи в ранній діагностиці і лікуванні локально обмежених пухлин, рак передміхурової залози після метастазування є невиліковним. У пацієнтів з метастазуючим раком передміхурової залози при гормональній терапії буде в кінцевому рахунку розвиватися стан, який не піддається лікуванню андрогеном (андрогенє-незалежний), що буду приводити до прогресування і смерті. В даний час простатичний антиген (антиген передміху 11 рової залози) (PSA) є найбільше широко використовуваним пухлинним маркером для скринінга, діагностики і моніторингу рака передміхурової залози. Однак широко розповсюджене застосування PSA як інструменту для скринінга є дискусійним, тому що PSA не дає можливості точно відрізнити доброякісне захворювання передміхурової залози від злоякісного. У залежності від стадії, лікування раку передміхурової залози і сечового міхура містить у собі один з наступних терапевтичних впливів або їх комбінацію: хірургії для видалення ракової тканини, променевої терапії, хіміотерапії, депривації андрогену (наприклад, гормональної терапії) у випадку раку передміхурової залози. Хоча хірургія або променева терапія істотно поліпшують виживаність пацієнтів з ранніми стадіями цього захворювання, терапевтичні можливості обмежені для запущених випадків, зокрема, для рецидивів пухлин після гормонального видалення. У більшості пацієнтів, що піддаються гормональній терапії, прогресує розвиток андроген-незалежного захворювання. В даний час немає ефективного лікування для 20-40% пацієнтів з раком передміхурової залози, у яких розвивається рецидивуюче захворювання після хірургії або променевої терапії, або для пацієнтів, у яких виявлені метастази в момент установлення діагнозу. Хіміотерапія має токсичні побічні дії, особливо в літніх пацієнтів. Розвиток нових форм терапії, особливо для захворювання, що не піддається лікуванню депривацією андрогену, украй необхідно для лікування раку передміхурової залози. Був ідентифікований новий антиген клітинної поверхні, STEAP-1 (див. патент США № 6329503). STEAP-1 є членом сімейства поверхневих серпентиноподібних трансмембранних антигенів. Він експресується переважно при раку передміхурової залози, і, отже, члени цього сімейства були названі “STEAP-1” (Шестидоменні Трансмембранні Епітеліальні Антигени Простати). Білки STEAP людини виявляють високу міру структурної консервативності в цьому сімействі, але не виявляють істотної структурної гомології з жодним з відомих білків людини. Очевидно, STEAP-1 є мембранним білком типу IIIa, що експресується переважно в клітинах передміхурової залози в тканинах здорової людини. Структурно STEAP-1 є білком, що складається з 339 амінокислот, характеризується молекулярною топологією із шести трансмембранних доменів і внутрішньоклітинних N- і С-кінців, що дозволяє припустити, що він укладений «серпентиноподібним» чином у три позаклітинні і дві внутрішньоклітинні петлі. Експресія білка STEAP-1 підтримується на високому рівні при різних станах раку передміхурової залози. STEAP1 надекспресується у високій мірі і при інших типах раку в людини, таких як рак легені й ободової кишки. Були індуковані мишачі антитіла до фрагментів STEAP-1 людини, і було показано, що ці антитіла зв'язують STEAP-1 на клітинній поверхні (див. патент США № 20040253232А1). Терапія на основі антитіл виявилася дуже ефективною в лікуванні різних типів раку. Наприклад, HERCEPTIN® і RITUXAN® (обидва з 94628 12 Genentech, S. San Francisco) успішно використовувалися для лікування раку молочної залози і неходжкінської лімфоми, відповідно. HERCEPTIN® є гуманізованим моноклональним антитілом, одержаним з рекомбінантної ДНК, і це антитіло селективно зв'язується з позаклітинним доменом протоонкогену рецептора 2 епідермального фактора росту (HER2) людини. Надекспресія HER2 спостерігається в 25-30% первинних ракових пухлин молочної залози. RITUXAN® є генетично сконструйованим моноклональним химерним миша/людина антитілом, спрямованим проти антигену CD20, що виявляється на поверхні нормальних і злоякісних В-лімфоцитів. Обилва ці антитіла продукуються в клітинах СНО. Застосування кон„югатів антитіло-лікарський засіб для локальної доставки цитотоксичних і цитостатичних агентів, тобто лікарських засобів для знищення або інгібування пухлинних клітин, у лікуванні раку (Syrigos and Epenetos (1999) Anticancer Research 19:605-614; Niculescu-Duvaz and Springer (1997) Adv. Drg Del. Rev. 26:151-172; Патент США 4975278) дає можливість націленої доставки лікарської частини молекули в пухлину і внутрішньоклітинне нагромадження в ній, коли системне введення цих некон„югованих лікарських агентів може приводити до неприйнятних рівнів токсичності у відношенні нормальних клітин, а також клітин пухлини, що повинні бути еліміновані (Baldwin et al., (1986) Lancet pp. (Mar. 15, 1986):603-05; Thrope, (1985) “Antinody Carriers Of Cytotoxic Agents In Cancer Therapy: A Rewiew,” in Monoclonal Antibodies ‟84: Biological And Clinical Applications, A. Pinchera et al., (eds), pp. 475-506). За допомогою цього домагаються максимальної ефективності з мінімальною токсичністю. Повідомлялося, що як поліклональні, так і моноклональні антитіла застосовні в цих стратегіях (Rowland et al., (1986) Cancer Immunol. Immunother., 21:183-87). Лікарські засоби, використовувані в цих способах, містять у собі даунорубіцин, доксорубіцин, метотрексат і віндесин (Rowland et al., Cancer Immunol. Immunother., 21:183-87 (1986)). Токсини, використовувані в кон„югатах антитіло-токсин, містять у собі бактеріальні токсини, такі як дифтерійний токсин, токсини рослин, такі як рицин, токсини з малими молекулами, такі як гелданаміцин (Kerr et al. (1997) Bioconjugate Chem. 8(6):781-784; Mandler et al. (2000) Journal of the Nat. Cancer Inst. 92(19): 1573-1581; Mandler et al. (2000) Bioorganic & Med. Chem. Letters 10:1025-1028; Mandler et al. (2000) Bioconjugate Chem. 13:786-791), майтансиноїди (ЕР 1391213; Liu et al., (1996) Proc. Natl. Acad. Sci. USA 93:8618-8623) і каліхеаміцин (Lode et al. (1998) Cancer Res. 58:2928; Hinman et al. (19933) Cancer Res. 53:3336-3342). Ці токсини можуть виконувати їхній цитотоксичну і цитостатичну дії з використанням механізмів, що включають у себе зв'язування тубуліну, зв'язування ДНК або інгібування топоізомерази (Meyer, D.L. and Senter, P.D. “Recent Advances in Antibody Drug Conjugates for Cancer Therapy” in Annual Reports in Medicnal Chemistry, Vol 38 (2003) Chapter 23, 229-237). Деякі терапевтичні лікарські засоби мають тенденцію бути неактивними або менш активними при кон'ю 13 гації з великими антитілами або лігандами рецепторів білків. ZEVALIN® (ібритумомаб тіуксетан, Biogen/Idec) є кон„югатом антитіло-радіоізотоп, що складається з мишачого Ig1 каппа моноклонального антитіла, спрямованого проти антигену CD20, що виявляється на поверхні нормальних і злоякіс111 90 них В-лімфоцитів, і радіоізотопу In або Y, зв'язаного лінкером-хелатором тіосечовиною (Wiseman et al (2000) Eur. Jour. Nucl. Med. 27(7):766-77; Wiseman et al (2002) Blood 99(12):4336-42; Witzig et al (2002) J. Clin. Oncol. 20(10):2453-63; Witzig et al (2002) J. Clin. Oncol. 20(15):3262-69). Хоча ZEVALIN має активність проти В-клітинної не-ходжкінської лімфоми (NHL), введення приводить до важких і пролонгованих цитопеній у більшості пацієнтів. MYLOTARG™ (гемтуцумаб озогаміцин, Wyeth Pharmaceuticals), кон„югат антитіло-лікарський засіб, що складається з huCD33-антитіла, зв'язаного з каліхеаміцином, був схвалений у 2000 році для лікування гострого мієлоїдного лейкозу за допомогою ін'єкції (Drugs of the Future (2000) 25(7):686; Патенти США з номерами 4970198; 5079233; 5585089; 5606040; 5693762; 5739116; 5767285; 5773001). Кантуцумаб мертансин (Immunogen, Inc.), кон„югат антитілолікарський засіб, що складається з антитіла hu242, зв'язаного через дисульфідний лінкер SPP з частиною майтансиноїдного лікарського засобу, DM1, розробляється для лікування типів раку, що експресують антиген CanAg, таких як рак ободової кишки, рак підшлункової залози, рак шлунка й інші. MLN-2704 (Millennium Pharm., BZL Biologies, Immunogen Inc.), кон„югат антитіло-лікарський засіб, що складається з моноклонального антитіла проти специфічного мембранного антигену (PSMA), зв'язаного з частиною майтансиноїдного лікарського засобу, DM1, розробляється для потенційного лікування пухлин передміхурової залози. Ту ж саму частину майтансиноїдного лікарського засобу, DM1, зв'язували через не-дисульфідний лінкер, SMCC, з мишачим моноклональним антитілом, TA.1 (Chari et al. (1992) Cancer Research 52: 127-131). Повідомлялося, що цей кон„югат був у 200 разів більш сильним, ніж відповідний кон„югат з дисульфідним лінкером. Автори цього посилання вважали, що лінкер SMCC є “нерозщеплюваним”. Декілька коротких пептидних сполук були виділені з морського молюска, Dolabella auricularia, і було виявлено, що вони мають біологічну активність (Pettit et al (1993) Tetrahedron 49:9151; Nakamura et al (1995) Tetrahedron Letters 36:50595062; Sone et al (1995) Journal Org Chem. 60:4474). Були також одержані аналоги цих сполук, і було виявлено, що деякі з них мають біологічну активність (див. огляд Pettit et al (1998) Anti-Cancer Drug Design 13:243-277). Наприклад, ауристатин E (US 5635483) є синтетичним аналогом морського природного продукту Доластатину 10, агента, що інгібує полімеризацію тубуліну зв'язуванням з тим же сайтом на тубуліні, що і протираковий лікарський засіб вінкристин (G. R. Pettit, (1997) Prog. Chem. Org. Nat. Prod. 70: 1-79). Доластатин 10, ауристатин PE і ауристатин E є лінійними пептидами, що 94628 14 мають 4 амінокислоти, три з яких є унікальними для класу сполук доластатину, і С-кінцевий амід. Ці ауристатинові пептиди, ауристатин E (AE) і монометилауристатин (MMAE), синтетичні аналоги доластатину, кон„югували: (і) з химерними моноклональними антитілами cBR96 (специфічними у відношенні Lewis Y на карциномах); (ii) з cAC10, що специфічні у відношенні CD30 при гематологічних злоякісних захворюваннях (Klussman, et al (2004), Bioconjugate Chemistry 15(4):765-773; Doronina et al (2003) Nature Biotechnology 21 (7):778-784; "Monomethylvaline Compounds Capable of Conjugation to Ligands"; Francisco et al (2003) Blood 102(4):1458- 1465; US 2004/0018194; (iii) анти-CD20-антитілами, такими як RITUXAN® (ритуксимаб) (WO 04/032828), для лікування CD20експресуючих ракових захворювань і імунних порушень; (iv) анти-Eph2-антитілами 2H9 і анти-іL-8антитілами для лікування колоректального раку (Mao, et al (2004) Cancer Research 64(3):781-788); (v) E-селектин-антитілом (Bhaskar et al (2003) Cancer Res. 63:6387-6394); і (vi) іншими антиCD30-антитілами (WO 03/043583). Монометилауристатин (MMAE) був також кон'югований з 2H9, антитілом проти Eph2R, що є рецептором тирозинкінази типу 1 TM із близькою гомологією між мишею і людиною і надекспресується в клітинах колоректального раку (Mao et al (2004) Cancer Res. 64:781-788). Повідомлялося, що монометилауристатин MMAF, варіант ауристатину E (MMAE) з фенілаланіном на С-кінці (US 5767237; US 6124431), є менш ефективним, чим MMAE, але більш ефективним при кон'югації з моноклональними антитілами (Senter et al, Proceedings of the American Association for Cancer Research, Volume 45, Abstract Number 623, presented March 28, 2004). Ауристатин F фенілендіамін (AFP); варіант із фенілаланіном MMAE зв'язували з анти-CD70-mAb, 1F6, через С-кінець за допомогою фенілендіамінового спейсера (Law et al, Proceedings of the American Association for Cancer Research, Volume 45, Abstract Number 625, presented March 28, 2004). У даній галузі існує потреба в додаткових лікарських засобах для лікування різних типів раку, таких як ракові пухлини і метастази ракових пухлин у передміхуровій залозі, легені й ободовій кишці. Особливо корисні лікарські засоби для цієї мети містять у собі націлені на клітини передміхурової залози, легені або ободової кишки кон„югати анти-STЕАР-1-антитіло-лікарський засіб, що мають більш низьку токсичність, але усе ще корисну терапевтичну ефективність. Даний винахід націлений на ці й інші обмеження і проблеми, що маються в минулому. Цитування будь-якого посилання в цій заявці не є визнанням того, що це посилання є прототипом цієї заявки. Усі цитовані тут посилання, у тому числі патенти, заявки на патенти і публікації включені як посилання в їх повному виді. Цей винахід забезпечує анти-STЕАР-1антитіла і способи їх застосування. В одному аспекті, забезпечене антитіло, що зв'язується з STEAP-1, причому це антитіло міс 15 тить варіабельний домен легкого ланцюга, що містить амінокислотну послідовність, показану на фігурі 2А (SEQ ID NO:6), або варіабельний домен важкого ланцюга, що містить амінокислотну послідовність, показану на фігурі 2В (SEQ ID NO:9). В одному аспекті, забезпечене антитіло, що зв'язується з STEAP-1, причому це антитіло містить варіабельний домен легкого ланцюга, що містить амінокислотну послідовність, показану на фігурі 2А (SEQ ID NO:6), і варіабельний домен важкого ланцюга, що містить амінокислотну послідовність, показану на фігурі 2В (SEQ ID NO:9). В одному аспекті, забезпечене антитіло, що зв'язується з STEAP-1, причому це антитіло містить варіабельний домен важкого ланцюга, що має щонайменше 90%, щонайменше 91%, щонайменше 92%, щонайменше 93%, щонайменше 94%, щонайменше 95%, щонайменше 96%, щонайменше 97%, щонайменше 98% або щонайменше 99% ідентичність послідовності з амінокислотною послідовністю SEQ ID NO:9 або 10. В одному варіанті здійснення, це антитіло містить каркасну область 1 варіабельного домену важкого ланцюга SEQ ID NO:9 або 10. В одному варіанті здійснення, це антитіло містить каркасну область 1 варіабельного району важкого ланцюга SEQ ID NO:25 або каркасну область 2 варіабельного району важкого ланцюга SEQ ID NO:75 або 76 або 77 або каркасну область 3 варіабельного району важкого ланцюга SEQ ID NO:78 або 79. В одному аспекті, це антитіло містить варіабельний домен легкого ланцюга, що має щонайменше 90%, щонайменше 91%, щонайменше 92%, щонайменше 93%, щонайменше 94%, щонайменше 95%, щонайменше 96%, щонайменше 97%, щонайменше 98% або щонайменше 99% ідентичність послідовності з амінокислотною послідовністю SEQ ID NO:6. В одному варіанті здійснення, це антитіло містить варіабельний домен легкого ланцюга SEQ ID NO:6. В одному аспекті, забезпечене антитіло, що зв'язується з STEAP-1, причому це антитіло містить варіабельний домен важкого ланцюга, що має щонайменше 90%, щонайменше 91%, щонайменше 92%, щонайменше 93%, щонайменше 94%, щонайменше 95%, щонайменше 96%, щонайменше 97%, щонайменше 98% або щонайменше 99% ідентичність послідовності з амінокислотною послідовністю SEQ ID NO:9 або 10. В одному варіанті здійснення, це антитіло містить каркасну область 1 варіабельного домену важкого ланцюга SEQ ID NO:9 або 10. В одному варіанті здійснення, це антитіло містить каркасну область 1 варіабельного району важкого ланцюга SEQ ID NO:25 або каркасну область 2 варіабельного району важкого ланцюга SEQ ID NO:75 або 76 або 77 або каркасну область 3 варіабельного району важкого ланцюга SEQ ID NO:78 або 79. В одному варіанті здійснення, це антитіло додатково містить варіабельний домен легкого ланцюга, що має щонайменше 90%, щонайменше 91%, щонайменше 92%, щонайменше 93%, щонайменше 94%, щонайменше 95%, щонайменше 96%, щонайменше 97%, щонайменше 98% або щонайменше 99% ідентичність послідовності з амінокислотною послідовністю SEQ ID 94628 16 NO:6. В одному варіанті здійснення, це антитіло містить варіабельний домен легкого ланцюга SEQ ID NO:6. У деяких варіантах здійснення, забезпечений полінуклеотид, що кодує кожне з вищевказаних антитіл. В одному варіанті здійснення, забезпечений вектор, що містить цей полінуклеотид. В одному варіанті здійснення, забезпечена клітинахазяїн, що містить цей вектор. В одному варіанті здійснення, ця клітина-хазяїн є еукаріотичною. В одному варіанті здійснення, цією клітиноюхазяїном є клітина яєчника китайського хом'ячка (СНО). В одному варіанті здійснення, забезпечений спосіб одержання анти-STЕАР-1-антитіла, причому цей спосіб передбачає культивування клітини-хазяїна при умовах, що підходять для експресії полінуклеотиду, що кодує це антитіло, і виділення цього антитіла. В одному аспекті, забезпечене антитіло, що зв'язується з STEAP-1, що експресується на поверхні клітини. В одному варіанті здійснення, це антитіло зв'язується з епітопом у районі STEAP-1 людини або миші. В одному варіанті здійснення, ця клітина є клітиною ссавця. В одному варіанті здійснення, ця клітина є клітиною людини. В одному варіанті здійснення, ця клітина є раковою клітиною. В одному варіанті здійснення, ця клітина є клітиною передміхурової залози, легені або ободової кишки. В одному варіанті здійснення, ця ракова клітина є клітиною раку передміхурової залози. В іншому варіанті здійснення, ця клітина є клітиною з метастазу первинного раку передміхурової залози, легені або ободової кишки. У деяких варіантах здійснення, кожне з вищевказаних антитіл є моноклональним антитілом. В одному варіанті здійснення, це антитіло є фрагментом антитіла, вибраним із фрагментів Fab, Fаb'SH, Fv, scFv або (Fab‟)2. В одному варіанті здійснення, це антитіло є гуманізованим. В одному варіанті здійснення, це антитіло є антитілом людини. В одному аспекті, забезпечений спосіб детектування присутності STEAP-1 у біологічній пробі, причому цей спосіб передбачає контактування біологічної проби з кожним з вищевказаних антитіл при умовах, пермісивних для зв'язування цього антитіла з STEAP-1, і детектування, або утворюється комплекс між цим антитілом і STEAP-1. В одному варіанті здійснення, ця біологічна проба є пробою зі ссавця, що має або приблизно має порушення клітин передміхурової залози і/або клітинно-проліферативне порушення клітин або тканин, що включає в себе рак передміхурової залози, легені, ободової кишки, сечового міхура і яєчника і саркому Юїнга, а також метастази первинного раку передміхурової залози, легені, ободової кишки, сечового міхура і яєчника і саркоми Юїнга. Див., наприклад, патент США No. 6329503; і Rodeberg, D.A. et al., Clin. Cancer Res. 11(12):45454552 (2005)). В одному аспекті, забезпечений спосіб діагностики клітинно-проліферативного порушення, асоційованого зі збільшеною експресією STEAP-1, що передбачає контактування тест-клітини з кожним з вищевказаних антитіл; визначення рівня експресії STEAP-1 детектуванням зв'язування цього антиті 17 ла з STEAP-1 і порівняння рівня експресії STEAP-1 цією тест-клітиною з рівнем експресії STEAP-1 контрольною клітиною, причому більш високий рівень експресії STEAP-1 тест-клітиною в порівнянні з контрольною клітиною вказує на присутність клітинно-проліферативного порушення, асоційованого зі збільшеною експресією STEAP-1. В одному варіанті здійснення, цією тест-клітиною є клітина з пацієнта, що приблизно має клітиннопроліферативне порушення, таке як проліферативне порушення передміхурової залози. В одному варіанті здійснення, цей спосіб передбачає визначення рівня експресії STEAP-1 на поверхні тестклітини (такої як, наприклад, ракова клітина передміхурової залози) і порівняння рівня експресії STEAP-1 на поверхні тест-клітини з рівнем експресії STEAP-1 на поверхні контрольної клітини (такої як, наприклад, нормальна клітина передміхурової залози, інша, ніж ненормально проліферуюча клітина передміхурової залози). В одному аспекті, забезпечений спосіб діагностики клітинно-проліферативного порушення, асоційованого зі збільшенням клітин, таких як клітини передміхурової залози, що експресують STEAP-1, що передбачає контактування тест-клітин у біологічній пробі з кожним з вищевказаних антитіл; визначення рівня антитіла, зв'язаного в тестклітинами в пробі, детектуванням зв'язування цього антитіла з STEAP-1 і порівняння цього рівня антитіла, зв'язаного з клітинами в контрольній пробі, причому цей рівень зв'язаного антитіла нормалізують щодо кількості STEAP-1-експресуючих клітин у тест-пробі і контрольній пробі, причому більш високий рівень зв'язаного антитіла в тестпробі в порівнянні з контрольною пробою указує на присутність клітинно-проліферативного порушення, асоційованого з клітинами, що експресують STEAP-1. В одному аспекті, забезпечений спосіб детектування розчинного STEAP-1 у крові або сироватці, що передбачає контактування тест-проби крові або сироватки зі ссавця, що приблизно має клітинно-проліферативне порушення передміхурової залози, з анти-STЕАР-1-антитілом відповідно до винаходу і детектування збільшення розчинного STEAP-1 у тест-пробі щодо контрольної проби крові або сироватки зі здорового ссавця. В одному варіанті здійснення, цей спосіб детектування застосовний як спосіб діагностики клітиннопроліферативного порушення передміхурової залози, асоційованого зі збільшенням розчинного STEAP-1 у крові або сироватці ссавця. В одному аспекті, антитіла відповідно до винаходу містять у собі цистеин-вбудовані антитіла, де одна або кілька амінокислот вихідного антитіла замінені вільною амінокислотою цистеїном, як описано в WO2006/034488 (включеному тут як посилання в повному виді). Цистеїн-вбудоване антитіло містить одну або кілька амінокислот у вигляді вільного цистеїну, що має величину реакційної здатності (реактивності) тіолу в діапазоні 0,6-1,0. Амінокислота вільний цистеїн є залишком цистеїну, що був вбудований у вихідне антитіло і не є частиною дисульфідного містка. Цистеїнвбудовані антитіла застосовні для приєднання 94628 18 цитотоксичних і/або візуалізуючих сполук у сайті вбудованого цистеїну, наприклад, через малеїмід або галогенацетил. Нуклеофільна реакційна здатність (реактивність) тіолової групи залишку цистеїну з малеїмідною групою є приблизно в 1000 разів більш високою в порівнянні з групою будь-якої іншої амінокислоти в білку, такою як аміногрупа залишків лізину або N-кінцева аміногрупа. Тіолспецифічна функціональна група в йодацетильних реагентах і малеїмідних реагентах може взаємодіяти з амінними групами, але вимагаються більш високий рН (>9,0) і більш тривалі періоди часу реакції (Garman, 1997, Non-Radioactive Labelling: A Practical Approach, Academic Press, London). Цистеїн-вбудовані антитіла можуть бути застосовні в лікуванні раку і містять у собі антитіла, специфічні у відношенні поверхневих і трансмембранних рецепторів і пухлина-асоційованих антигенів (ТАА). Такі антитіла можуть бути використані у вигляді «голих» антитіл (не кон„югованих з лікарським засобом або міткою) або у вигляді кон„югатів антитіло-лікарський засіб (ADC). Цистеїнвбудовані антитіла відповідно до винаходу можуть бути сайт-специфічними й ефективно зв'язаними з тіол-реактивним реагентом. Цим тіол-реактивним реагентом може бути мультифункціональний лінкерний реагент, що захоплює мічений реагент, що містить флуорофор або реагент проміжний продукт лікарський засіб-лінкер. Це цистеїн-вбудоване антитіло може бути позначено детектованою міткою, іммобілізовано на твердофазному носії і/або кон„юговане з лікарським засобом. Реакційна здатність тіолу може бути додана будь-якому антитілу, де заміна амінокислот реакційноспроможними амінокислотами (цистеїнами) може бути одержана в діапазонах у легкому ланцюзі, вибраних з діапазонів амінокислот: L-10-L-20; L-38-L-48; L-105-L115; L-139-L-149; L-163-L-173; і в діапазонах у важкому ланцюзі, вибраних з діапазонів амінокислот: H-35-H-45; H-83-H-93; H-114-H-127 і H-170-H-184, і в Fc-районі в діапазонах, вибраних з H-268-H-291; H-319-H-344; H-370-H-380 і H-395-H-405, де нумерація положень амінокислот починається від положення 1 системи нумерації Кабата (Kabat et al. (1991) Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD) і продовжується послідовно після цього, як описано в WO 2006/034488. Реакційна здатність тіолу може бути також додана визначеним доменам антитіла, таким як константний домен легкого ланцюга (CL) і константні домени важкого ланцюга, CH1, CH2 і CH3. Цистеїновие заміни, що приводять до величин реакційної здатності тіола 0,6 і більш, можуть бути одержані в константних доменах важкого ланцюга α, δ, ε, γ і μ інтактних антитіл: IgA, IgD, IgE, IgG и IgM, відповідно, у тому числі в підкласах IgG: IgG1, IgG2, IgG3, IgG4, IgA и IgA2. Такі антитіла і їхні застосування описані в WO 2006/034488. Цистеїн-вбудовані антитіла відповідно до винаходу переважно зберігають антигензв„язувальну здатність їхніх копій дикого типу, вихідних антитіл. Таким чином, цистеїн-вбудовані антитіла здатні зв'язуватися, переважно специфічно, з антигенами. Такі антигени містять у собі, наприклад, пухли 19 на-асоційовані антигени (ТАА), поверхневі рецепторні білки й інші поверхневі молекули клітин, трансмембранні білки, білки передачі сигналів, регуляторні фактори виживання клітин, регуляторні фактори проліферації клітин, молекули, асоційовані з розвитком або диференціюванням тканини (наприклад, молекули, про які відомо або передбачається, що вони сприяють функціонально розвитку або диференціюванню тканини), лімфокіни, цитокіни, молекули, що беруть участь у регуляції клітинного циклу, молекули, що беруть участь в утворенні і розвитку судин, і молекули, асоційовані з ангіогенезом (наприклад, молекули, про які відомо або передбачається, що вони сприяють функціонально ангіогенезу). Антитіло відповідно до винаходу може бути кон„юговане з іншими тіол-реактивними агентами, у яких реактивною групою є, наприклад, малеїмід, йодацетамид, піридилдисульфід або інший тіолреактивний партнер кон'югації (Haugland, 2003, Molecular Probes Handbook of Fluorescent Probes and Research Chemicals, Molecular Probes, Inc.; Brinkley, 1992, Bioconjugate Chem. 3:2; Garman, 1997, Non-Radioactive Labelling: A Practical Approach, Academic Press, London; Means (1990) Bioconjugate Chem. 1:2; Hermanson, G. in Bioconjugate Techniques (1996) Academic Press, San Diego, pp. 40-55, 643-671). Цим партнером може бути цитотоксичний агент (наприклад, токсин, такий як доксорубіцин або коклюшний токсин), флуорофор, такий як флуоресцентний барвник, такий як флуоресцеїн або родамін, хелатинуючий агент для візуалізації або радіотерапевтичного металу, пептидильна або непептидильна мітка або мітка детектування або кліренс агент, що модифікує, такий як різні ізомери поліетиленгліколю, пептид, що зв'язується з третім компонентом, або інший вуглеводний або ліпофільний агент. В одному аспекті, антитіла відповідно до винаходу можуть бути кон„юговані з будь-яким фрагментом, що може бути ковалентно приєднаний до антитіла через реактивний фрагмент, активований фрагмент або реакційноспроможну тіолову групу цистеїну. (Singh et al (2002) Anal. Biochem. 304: 147-15; Harlow E. and Lane, D. (1999) Using Antibodies: A Laboratory Manual, Cold Springs Harbor Laboratory Press, Cold Spring Harbor, NY; Lundblad R.L. (1991) Chemical Reagents for Protein Modification, 2nd ed. CRC Press, Boca Raton, FL). Ця приєднана мітка може функціонувати для: (і) забезпечення детектованого сигналу; (ii) взаємодії з другою міткою для модифікації детектованого сигналу, забезпечуваного першою або другою міткою, наприклад, для утворення FRET (передачі енергії резонансу флуоресценції); (iii) стабілізації або взаємодій збільшення афінності зв'язування, з антигеном або лігандом; (iv) впливу на рухливість, наприклад, електрофоретичну рухливість або проникність у клітину, за допомогою заряду, гідрофобності, або форми інших фізичних параметрів, або (v) забезпечення частини, що захоплює, для модуляції афінності лігандів, зв'язування антитіло/антиген, або комплексоутворення іонів. Мічені цистеїн-вбудовані антитіла можуть бути застосовні в діагностичних аналізах, наприклад, 94628 20 для детектування експресії антигену, що представляє інтерес, у конкретних клітинах, тканинах або сироватці. Для діагностичних застосувань, це антитіло звичайне мітять детектованою частиною молекули. Доступні численні мітки, що можуть бути звичайно згруповані в наступні категорії. 3 11 14 Радіоізотопи (радіонукліди), такі як H, C, C, 18 32 35 64 68 86 99 111 123 124 125 F, P, S, Cu, Ga, Y, Tc, In, I, I, I, 131 133 177 211 213 I, Xe, Lu, At або Bi. Мічені радіоізотопом антитіла застосовні в експериментах візуалізації з націлюванням з використанням рецептора. Це антитіло може бути позначене реагентамилігандами, що зв'язують, хелатують або іншим способом утворюють комплекс із радіоізотопним металом, де цей реагент є реактивним з тіолом вбудованого цистеїну, з використанням способів, описаних у Current Protocols in Immunology, Volumes 1 and 2, Coligen et al, Ed. WileyInterscience, New York, NY, Pubs. (1991). Хелатутворюючі ліганди, що можуть утворювати комплекс з іоном металу, містять у собі DOTA, DOTP, DOTMA, DTPA і TETA (Macrocyclics, Dallas, TX). Радіонукліди можуть бути націлені за допомогою комплексоутворення з кон„югатами антитілолікарський засіб відповідно до винаходу (Wu et al (2005) Nature Biotechnology 23(9): 1 137-1 146). Лінкерні реагенти, такі як DOTA-малеїмід (4малеїмідобутирамідобензил-DOTA), можуть бути одержані реакцією амінобензил-DOTA з 4малеїмідомасляною кислотою (Fluka), активованою ізопропілхлорформіатом (Aldrich), відповідно до процедури Axworthy et al (2000) Proc. Natl. Acad. Sci. USA 97(4): 1802-1807). Реагенти DOTAмалеїмід взаємодіють з амінокислотними залишками вільного цистеїну цистеїн-вбудованих антитіл і забезпечують комплексоутворюючй метал ліганд на цьому антитілі (Lewis et al (1998) Bioconj. Chem. 9:72-86). Хелатоутворюючі лінкерні реагенти, що мітять, такі як DOTA-NHS (моно-(Nгідроксисукцинімідний ефір 1,4,7,10тетраазациклододекан-1,4,7,10-тетраоцтової кислоти) комерційно доступні (Macrocyclics, Dallas, TX). Візуалізація з використанням рецепторамішені з міченими радіонуклідом антитілами може забезпечувати маркер активації шляху за допомогою детектування і кількісного визначення прогресивного нагромадження антитіл у тканині пухлини (Albert et al (1998) Bioorg. Med. Chem. Lett. 8: 12071210). Ці кон„юговані радіоізотопи-метали можуть залишатися внутрішньоклітинними після деградації лізосомами. Комплекси хелатів металів, що підходять як мітки антитіл для експериментів візуалізації описані в: US 5,342,606; US 5,428,155; US 5,316,757; US 5,480,990; US 5,462,725; US 5,428,139; US 5,385,893; US 5,739,294; US 5,750,660; US 5,834,456; Hnatowich et al (1983) J. Immunol. Methods 65: 147-157; Meares et al (1984) Anal. Biochem. 142:68-78; Mirzadeh et al (1990) Bioconjugate Chem. 1:59-65; Meares et al (1990) J. Cancer l990, Suppl. 10:21-26; Izard et al (1992) Bioconjugate Chem. 3:346-350; Nikula et al (1995) Nucl. Med. Biol. 22:387-90; Camera et al (1993) Nucl. Med. Biol. 20:955-62; Kukis et al (1998) J. Nucl. Med. 39:2105-2110; Verel et al (2003) J. Nucl. Med. 44: 21 1663- 1670; Camera et al (1994) J. Nucl. Med. 21 :640-646; Ruegg et al (1990) Cancer Res. 50:42214226; Verel et al (2003) J. Nucl. Med. 44: 1663-1670; Lee et al (2001) Cancer Res. 61 :4474-4482; Mitchell, et al (2003) J. Nucl. Med. 44: 1 105-11 12; Kobayashi et al (1999) Bioconjugate Chem. 10: 103-1 11; Miederer et al (2004) J. Nucl. Med. 45: 129-137; DeNardo et al (1998) Clinical Cancer Research 4:2483-90; Blend et al (2003) Cancer Biotherapy & Radiopharmaceuticals 18:355-363; Nikula et al (1999) J. Nucl. Med. 40:166-76; Kobayashi et al (1998) J. Nucl. Med. 39:829-36; Mardirossian et al (1993) Nucl. Med. Biol. 20:65-74; Roselli et al (1999) Cancer Biotherapy & Radiopharmaceuticals, 14:209-20. (b) Флуоресцентні мітки, такі як хелати рідкісноземельних металів (хелати європію), типи флуоресцеїну, у тому числі FITC, 5карбоксифлуоресцеїн, 6-карбоксифлуоресцеїн; типи родаміну, у тому числі TAMRA; дансил; Лісамін; ціаніни; фікоеритрини; Техаський червоний; і їхні аналоги. Ці флуоресцентні мітки можуть бути кон„юговані з антитілами з використанням способів, описаних, наприклад, у Current Protocols in Immunology, supra. Флуоресцентні барвники і флуоресцентні реагенти-мітки містять у собі барвники і мітки, комерційно доступні з Invitrogen/Molecular Probes (Eugene, OR) і Pierce Biotechnology, Inc. (Rockford, IL). (c) Різні фермент-субстратні мітки є доступними або описаними (US 4275149). Фермент звичайно каталізує зміну фарбування в субстраті, що може бути виміряне спектрофотометрично. Альтернативно, цей фермент може змінювати флуоресценцію або хемілюмінесценцію субстрату. Способи кількісного визначення зміни флуоресценції описані вище. Хемілюмінесцентний субстрат стає електронно-збудженим хімічною реакцією і може потім випускати світло, що може бути виміряне (наприклад, з використанням хемілюмінометра), або віддає енергію флуоресцентному акцептору. Приклади ферментних міток містять у собі люциферази (наприклад, люциферазу світляків і бактеріальну люциферазу; US 4,737,456), люциферин, 2,3-дигідрофталазиндіони, малатдегідрогеназу, уреазу, пероксидазу, таку як пероксидаза хрону (HRP), лужну фосфатазу (AP), β-галактозидазу, глюкоамілазу, лізозим, сахаридоксидази (наприклад, глюкозооксидазу, галактозооксидазу і глюкозо-6-фосфатдегідрогеназу), гетероциклічні оксидази (такі як уриказа і ксантиноксидаза), лактопероксидазу, мікоперокисдазу, і т.п.Способи кон'югації ферментів з антитілами описані в О'Sullіvаn et al (1981) "Methods for the Preparation of Enzyme-Antibody Conjugates for use in Enzyme Immunoassay", in Methods in Enzym. (ed J. Langone & H. Van Vunakis), Academic Press, New York, 73: 147-166. Приклади фермент-субстратних комбінацій містять у собі, наприклад: (і) пероксидазу хрону (HRP) з пероксидазою водню як субстратом, причому ця пероксидаза водню окисляє попередник барвника (наприклад, ортофенілендіамін (OPD) або гідрохлорид 3,3',5,5'тетраметилбензидину (TMB)); 94628 22 (ii) лужну фосфатазу (AP) з паранітрофенілфосфатом як хромогенний субстрат і (iii) β-D-галактозидазу (β-D-Gal) із хромогенним субстратом (наприклад, p-нітрофеніл-β-Dгалактозидазою) або флуорогенним субстратом 4метилумбеліферил-β-D-галактозидазою. Численні інші фермент-субстратні комбінації доступні кваліфікованим в даній галузі фахівцям. У відношенні загального огляду див. US 4275149 і US 4318980. Мітка може бути опосередковано кон„югована з бічним ланцюгом амінокислоти, бічним ланцюгом активованої амінокислоти, цистеїн-вбудованим антитілом і т.п. Наприклад, це антитіло може бути кон„юговане з біотином, і кожна з цих трьох широких категорій міток, зазначених вище, може бути кон„югована з авідином або стрептавідином, або навпаки. Біотин зв'язується селективно зі стрептавідином і, отже, ця мітка може бути кон„югована з антитілом цим непрямим способом. Альтернативно, для досягнення непрямої кон'югації цієї мітки з поліпептидним варіантом, цей поліпептидний варіант кон„югують з малим гаптеном (наприклад, дигоксином), і один з різних вищевказаних типів міток кон„югують з антитілом проти кон„югата гаптенполіпептидний варіант (наприклад, анти-дигоксинантитілом). Таким чином, може бути досягнута непряма кон'югація мітки з цим поліпептидним варіантом (Hermanson, G. (1996) in Bioconjugate Techniques Academic Press, San Diego). Антитіло даного винаходу може бути використане в будь-якому способі аналізу, такому як ELISA, аналізи конкурентного зв'язування, прямі і непрямі сендвіч-аналізи й аналізи імунопреципітації (Zola, (1987) Monoclonal Antibodies: A Manual of Techniques, pp.147-158, CRC Press, Inc.). Мітка детектування може бути використана для локалізації, візуалізації і кількісного визначення події зв'язування або впізнавання. Мічені антитіла відповідно до винаходу можуть детектувати рецептори клітинної поверхні. Іншим застосуванням для детектовано мічених антитіл є спосіб імунозахоплення на основі гранул, що передбачає кон'югацію гранули з флуоресцентно міченим антитілом і детектування сигналу флуоресценції після зв'язування ліганду. Подібні методології детектування зв'язування використовують дії резонансу поверхневих плазмонів (SPR) для вимірювання і детектування взаємодій антитіло-антиген. Мітки детектування, такі як флуоресцентні барвники і хемілюмінесцентні барвники (Briggs et al (1997) "Synthesis of Functionalised Fluorescent Dyes and Their Coupling to Amines and Amino Acids," J. Chem. Soc, Perkin-Trans. 1:1051-1058), забезпечують детектований сигнал і звичайно застосовні для мічення антитіл, що переважно має наступні властивості: (і) це мічене антитіло повинне виробляти дуже високий сигнал з низьким тлом, так що малі кількості антитіл можуть бути точно детектовані як у безклітинних аналізах, так і в аналізах на основі клітин; і (ii) це мічене антитіло повинное бути фотохімічно стійким, так що цей флуоресцентний сигнал може бути підданий спостереженню, моніторингу і реєстрації без значимого фотознебарвлення. Для застосувань із залученням повер 23 хневого зв'язування міченого антитіла з мембранами або поверхнями клітин, зокрема, живих клітин, ці мітки переважно (iii) мають гарну водорозчинність для одержання ефективної концентрації кон„югата і чутливості детектування і (iv) є нетоксичними для живих клітин, так щоб не зруйнувати нормальні метаболічні процеси цих клітин або не викликати передчасної смерті клітин. Пряме кількісне визначення інтенсивності клітинної флуоресценції і підрахунок флуоресцентно мічених подій, наприклад, зв'язування клітинною поверхнею кон„югатів пептид-барвник, може проводитися на системі (FMAT® 8100 HTS System, Applied Biosystems, Foster City, Calif.), що автоматизує змішування і зчитування, у нерадіоактивних аналізах з живими клітинами або гранулами (Miraglia, "Homogeneous cell- and bead-based assays for high throughput screening using fluorometric microvolume assay technology", (1999) J. of Biomolecular Screening 4: 193-204). Застосування мічених антитіл також містять у собі аналізи зв'язування рецептора клітинної поверхні, імунозахоплюючі аналізи, імунофлуоресцентні твердофазні аналізи (FLISA), розщеплення каспазою (Zheng, "Caspase-3 controls both cytoplasmic and nuclear events associated with Fas-mediated apoptosis in vivo", (1998) Proc. Natl. Acad. Sci. USA 95:618-23; US 6,372,907), аналізи апоптоза (Vermes, "A novel assay for apoptosis. Flow cytometric detection of phosphatidylserine expression on early apoptotic cells using fluorescein labelled Annexin V" (1995) J. Immunol. Methods 184:39-51) і цитотоксичності. Технологія флуорометричного аналізу мікрообсягу може бути також використана для ідентифікації підвищувальної або понижуючої регуляції молекулою, що націлена на клітинну поверхню (Swartzman, "A homogeneous and multiplexed immunoassay for high-throughput screening using fluorometric microvolume assay technology", (1999) Anal. Biochem. 271: 143-51). Мічені антитіла відповідно до винаходу застосовні як візуалізуючі біомаркери і зонди різними методами і способами медико-біологічної і молекулярної візуалізації, такими як: (і) MRI (МРТ) (магнітно-резонансна томографія); (ii) MicroCT (мікроКт) (комп'ютерна томографія); (iii) SPECT (однофотонна емісійна комп'ютерна томографія); (iv) PET (позитронна емісійна томографія) Chen et al (2004) Bioconjugate Chem. 15:41-49; (v) біолюмінесценція; (vi) флуоресценція і (vii) ультразвукове дослідження. Імуносцинтиграфія є процедурою візуалізації, в якій антитіла, мічені радіоактивними речовинами, вводять тварині або пацієнту-людині й одержують картину ділянок у тілі, в яких локалізується це антитіло (US 6528624). Біомаркери візуалізації можуть бути об'єктивно обмірювані й оцінені як індикатор нормальних біологічних процесів, патогенних процесів або фармакологічних відповідних реакцій на терапевтичне втручання. Біомаркери можуть бути біомаркерами декількох типів: маркери Типу 0 є природними анамнестичними маркерами захворювання і корелюють тривало з відомими клінічними показниками, наприклад, MRI-оцінкою синовіального запалення в ревматоїдному артриті; маркери Типу I уловлюють 94628 24 дію втручання відповідно до механізму дії, навіть хоча цей механізм не асоційований із клінічним результатом; маркери Типу II діють як сурогатні кінцеві результати, де зміна в цьому біомаркері або сигнал з цього біомаркера пророкує клінічну користь для «валідизації» націленої реакції, наприклад, обмірюваної за допомогою СТ (КТ) ерозії кісти в ревматоїдному артриті. Таким чином, біомаркери візуалізації можуть забезпечувати фармакодинамічну (PD) терапевтичну інформацію відносно: (і) експресії білка-мішені, (ii) зв'язування терапевтичного засобу з цим білком-мішенню, тобто селективності, і (iii) фармакокінетичних даних кліренсу і періоду напіввиведення. Переваги біомарекрів візуалізації in vivo відносно біомаркерів на основі лабораторних аналізів містять у собі: неінвазивну обробку, кількісну оцінку всього тіла, повторювані введення доз і оцінку, тобто множинні часові точки, і потенційно стерпні ефекти від преклінічних (малі тварини) до клінічного (людина) результатів. Для деяких застосувань, біовізуалізація витісняє або мінімізує кількість експериментів на тваринах у преклінічних дослідженнях. Способи мічення пептидів добре відомі. Див. Haugland, 2003, Molecular Probes Handbook of Fluorescent Probes and Research Chemicals, Molecular Probes, Inc.; Brinkley, 1992, Bioconjugate Chem. 3:2; Garman, (1997) Non-Radioactive Labelling: A Practical Approach, Academic Press, London; Means (1990) Bioconjugate Chem. 1:2; Glazer et al (1975) Chemical Modification of Proteins. Laboratory Techniques in Biochemistry and Molecular Biology (T. S. Work and E. Work, Eds.) American Elsevier Publishing Co., New York; Lundblad, R. L. and Noyes, C. M. (1984) Chemical Reagents for Protein Modification, VoIs. I and II, CRC Press, New York; Pfleiderer, G. (1985) "Chemical Modification of Proteins", Modern Methods in Protein Chemistry, H. Tschesche, Ed., Walter DeGryter, Berlin and New York; and Wong (1991) Chemistry of Protein Conjugation and Cross-linking, CRC Press, Boca Raton, FIa.); De Leon-Rodriguez et al (2004) Chem.Eur. J. 10: 1149-1155; Lewis et al (2001) Bioconjugate Chem. 12:320-324; Li et al (2002) Bioconjugate Chem. 13:110-115; Mier et al (2005) Bioconjugate Chem. 16:240-237. Пептиди і білки, мічені двома частинами молекули, флуоресцентним репортером і гасником у достатній близькості, піддають переносу енергії резонансу флуоресценції (FRET). Репортерні групи звичайно є флуоресцентними барвниками, що збуджуються світлом при визначеній довжині хвилі і переносять енергію до акцепторної групи, або гасниек, із придатним зрушенням Стокса для емісії при максимальній яскравості. Флуоресцентні барвники містять у собі молекули з підвищеної ароматичністю, такі як флуоресцеїн і родамін, і їх похідні. Флуоресцентний репортер може бути частково або власне кажучи погашений частиною, що гасить, у інтактному пептиді. Після розщеплення цього пептиду пептидазою або протеазою, може бути обмірюване детектоване збільшення флуоресценції (Knight, C. (1995) "Fluorimetric Assays of Proteolytic Enzymes", Methods in Enzymology, Academic Press, 248: 18-34). 25 Мічені антитіла відповідно до винаходу можуть бути також використані як агенти афінного очищення. У цьому процесі, мічене антитіло іммобілізують на твердій фазі, такий як смола Сефадекс або фільтрувальний папір, з використанням способів, добре відомих у даній галузі. Це іммобілізоване антитіло контактує з пробою, що містить підлягаючий очищенню антиген, і після цей носій промивають придатним розчинником, що буде видаляти власне кажучи весь матеріал у цій пробі, за винятком підлягаючого очищенню антигену, що зв'язаний з іммобілізованим поліпептидним варіантом. Нарешті, цей носій промивають іншим придатним розчинником, таким як гліциновий буфер, рН 5,0, що буде вивільняти цей антиген з поліпептидного варіанта. Реагенти, що мітять, звичайно несуть реакційноспроможну функціональну групу, що може реагувати (і) безпосередньо з тіолом цистеїну цистеїнвбудованого антитіла з утворенням міченого антитіла, (ii) з лінкерним реагентом з утворенням проміжного продукту лінкер-мітка, або (iii) з лінкерним антитілом з утворенням міченого антитіла. Реакциійноспроможні функціональні групи реагентів, що мітять, містять у собі: малеїмід, галогенацетил, сукцинімідиловий ефір йодацетаміду (наприклад, NHS, N-гідроксисукцинімід), ізотіоціанат, сульфонілхлорид, 2,6-дихлортриазиніл, пентафторфеніловий ефір і фосфорамідит, хоча можуть бути також використані інші функціональні групи. Прикладом реакційноспроможної функціональної групи є N-гідроксисукцинімідиловий ефір (NHS) замісника карбоксильної групи детектованої мітки, наприклад, біотину або флуоресцентного барвника. NHS-ефір цієї мітки може бути попередньо утворений, виділений, очищений і/або охарактеризований, або він може бути утворений in situ і може реагувати з нуклеофільною групою антитіла. Звичайно карбоксильна форма цієї мітки активується реакцією з деякою комбінацією карбодіімідного реагенту, наприклад, дициклогексилкарбодііміду, діізопропілкарбодііміду, або уронієвого реагенту, наприклад, TSTU (тетрафторборату O(N-сукцинімідил)-N,N,N‟,N‟-тетраметилуронію, HBTU (гексафторфосфату O-бензотриазол-1-іл)N,N,N‟,N‟-тетраметилуронію) або HATU (гексафторфосфатом O-(7-азабензотриазол-1-іл)-N,N,N‟,N‟тетраметилуронію), активатора, такого як 1гідроксибензотриазол (HOBt) і Nгідроксисукцинімід, з одержанням NHS-ефіру цієї мітки. У деяких випадках, ця мітка й антитіло можуть бути зв'язані активацією in situ цієї мітки і реакцією з антитілом з утворенням кон„югата міткаантитіло в одній стадії. Інші реагенти, що активують і зв'язують, містять у собі TBTU (гексафторфосфат 2-(1H-бензотриазо-1-іл)-1-1,3,3тетраметилуронію), TFFH (2фторгексафторфосфат N,N‟,N",N‟"тетраметилуронію), PyBOP (гексафторфосфат бензотриазол-1-іл-окси-трис-піролідинофосфонію, EEDQ (2-етокси-1-етоксикарбоніл-1,2дигідрохінолін), DCC (дициклогексилкарбодіімід); DIPCDI (діізопропілкарбодіімід), MSNT (1(мезитилен-2-сульфоніл)-3-нітро-1H-1,2,4-триазол 94628 26 і арилсульфонілгалогеніди, наприклад, триізопропілбензолсульфонілхлорид. Альбумінзв„язувальні пептид-Fab-сполуки відповідно до винаходу: В одному аспекті, антитіло відповідно до винаходу зливають з альбумінзв„язувальним білком. Зв'язування з білком плазми може бути ефективним засобом поліпшення фармакокінетичних властивостей короткоживучих молекул. Альбумін є найбільш багатим білком у плазмі. Зв„язуючі сироватковий альбумін пептиди (ABP) можуть змінювати фармакодинаміку злитих білків з активними доменами, у тому числі змінювати поглинання тканиною, проникнення в тканину і дифузію в тканині. Ці фармакодинамічні параметри можуть модулюватися специфічним вибором придатної послідовності зв„язуючого сироватковий альбумін пептиду (US 20040001827). Ряд альбумінзв„язувальних білків був ідентифікований скринінгом з використанням фагового дисплея (Dennis et al. (2002) "Albumin Binding As A General Strategy For Improving The Pharmacokinetics Of Proteins" J Biol Chem. 277:35035-35043; WO 01/45746). Сполуки відповідно до винаходу містять у собі послідовності ABP, описані: (і) Dennis et al (2002) J Biol Chem. 277:35035-35043 у таблицях III і IV, стор. 35038; (ii) US 20040001827 у [0076] SEQ ID NO: 9-22; і (iii) WO 01/45746 на сторінках 12-13, усі з яких включені тут як посилання. Альбумінзв„язувальні (ABP)Fab конструювали злиттям альбумінзв„язувального пептиду, наприклад, з C-кінцем важкого ланцюга Fab у стехіометричному співвідношенні 1:1 (1 ABP/1 Fab). Було показано, що асоціація цих ABP-Fab з альбуміном збільшувала період напіввиведення антитіла більш ніж у 25 разів у кроликах і мишах. Таким чином, вищеописані реакційноспроможні залишки Cys можуть вводитися в ці ABP-Fab і використовуватися для сайтспецифічної кон'югації з цитотоксичними лікарськими засобами з наступними дослідженнями на тварин in vivo. Зразкові послідовності альбумінзв„язувальних білків містять у собі, але не обмежуються ними, амінокислотні послідовності, приведені в SEQ ID NO:80-84. CDKTHTGGGSQRLMEDICLPRWG CLWEDDF SEQ ID NO:80 QRLMEDICLPRWGCLWEDDF SEQ ID NO:81 QRLIEDICLPRWGCLWEDDF SEQ ID NO:82 RLIEDICLPRWGCLWEDD SEQ ID NO:83 DICLPRWGCLW SEQ ID NO:84 Кон„югати антитіло-лікарський засіб В іншому аспекті, цей винахід забезпечує імунокон„югати, або кон„югати антитіло-лікарський засіб (ADC), що містять антитіло, кон„юговане з цитотоксичним агентом, таким як хіміотерапевтичний агент, лікарський засіб, агент, що інгібує ріст, токсин (наприклад, ферментативно активний токсин бактеріального, грибкового, рослинного або тваринного походження, або їхні фрагменти), або радіоактивний ізотоп (тобто радіокон„югат). В іншому аспекті, цей винахід забезпечує способи застосування цих імунокон„югатів. В одному аспекті, цей імунокон„югат містить кожне з вищевказаних анти-STЕАР-1-антитіл, ковалентно приєднане 27 до цитотоксичного агента або детектованого агента. Застосування кон„югатів антитіло-лікарський засіб для локальної доставки цитотоксичних або цитостатичних агентів, тобто лікарських засобів для знищення або інгібування пухлинних клітин при лікуванні раку (Syrigos and Epenetos (1999) Anticancer Research 19:605-614; Niculescu-Duvaz and Springer (1997) Adv. Drg Del. Rev. 26: 151-172; Патент США 4,975,278), дає можливість націленої доставки лікарської частини молекули в пухлину і внутрішньоклітинне її нагромадження, у той час як системне введення цих некон„югованих лікарських агентів може приводити до неприйнятних рівнів токсичності для нормальних клітин, а також пухлинних клітин, що повинні бути еліміновані (Baldwin et al., (1986) Lancet pp. (Mar. 15, 1986):603-05; Thorpe, (1985) "Antibody Carriers Of Cytotoxic Agents In Cancer Therapy: A Review," in Monoclonal Antibodies '84: Biological And Clinical Applications, A. Pinchera et al. (eds), pp. 475-506). За допомогою цього домагаються максимальної ефективності з мінімальною токсичністю. Повідомлялося, що як поліклональні, так і моноклональні антитіла застосовні в цих стратегіях (Rowland et al., (1986) Cancer Immunol. Immunother., 21:18387). Лікарські засоби, використовувані в цих способах, містять у собі даунорубіцин, доксорубіцин, метотрексат і віндесин (Rowland et al., Cancer Immunol. Immunother., 21:183-87 (1986)). Токсини, використовувані в кон„югатах антитіло-токсин, містять у собі бактеріальні токсини, такі як дифтерійний токсин, токсини рослин, такі як рицин, токсини з малими молекулами, такі як гелданаміцин (Mandler et al. (2000) Journal of the Nat. Cancer Inst. 92(19): 1573-1581; Mandler et al. (2000) Bioorganic & Med. Chem. Letters 10:1025-1028; Mandler et al. (2000) Bioconjugate Chem. 13:786-791), майтансиноїди (ЕР 1391213; Liu et al., (1996) Proc. Natl. Acad. Sci. USA 93:8618-8623) і каліхеаміцин (Lode et al. (1998) Cancer Res. 58:2928; Hinman et al. (19933) Cancer Res. 53:3336-3342). Ці токсини можуть виконувати їх цитотоксичні і цитостатичні дії з використанням механізмів, що включають у себе зв'язування тубуліну, зв'язування ДНК або інгібування топоізомерази. Деякі терапевтичні лікарські засоби мають тенденцію бути неактивними або менш активними при кон'югації з великими антитілами або лігандами рецепторів білків. ZEVALIN® (ібритумомаб тіуксетан, Biogen/Idec) є кон„югатом антитіло-радіоізотоп, що складається з мишачого IgG1 каппа моноклонального антитіла, спрямованого проти антигену CD20, що виявляється на поверхні нормальних і злоякіс111 90 них В-лімфоцитів, і радіоізотопу In або Y, зв'язаного лінкером-хелатором тіосечовиною (Wiseman et al (2000) Eur. Jour. Nucl. Med. 27(7):766-77; Wiseman et al (2002) Blood 99(12):4336-42; Witzig et al (2002) J. Clin. Oncol. 20(10):2453-63; Witzig et al (2002) J. Clin. Oncol. 20(15):3262-69). Хоча ZEVALIN має активність проти В-клітинної не-ходжкінської лімфоми (NHL), введення приводить до важких і пролонгованих цитопеній у більшості пацієнтів. MYLOTARG™ (гемтуцумаб озогаміцин, Wyeth Pharmaceuticals), 94628 28 кон„югат антитіло-лікарський засіб, що складається з huCD33-антитіла, зв'язаного з каліхеаміцином, був схвалений у 2000 році для лікування гострого мієлоїдного лейкозу за допомогою ін'єкції (Drugs of the Future (2000) 25(7):686; Патенти США з номерами 4,970,198; 5,079,233; 5,585,089; 5,606,040; 5,693,762; 5,739,116; 5,767,285; 5,773,001). Кантуцумаб мертанзин (Immunogen, Inc.), кон„югат антитіло-лікарський засіб, що складається з антитіла huС2042, зв'язаного через дисульфідний лінкер SPP з частиною майтансиноїдного лікарського засобу, DM1, розвивається для лікування типів раку, що експресують антиген CanAg, таких як рак ободової кишки, рак підшлункової залози, рак шлунка й інші. MLN-2704 (Millennium Pharm., BZL Biologies, Immunogen Inc.), кон„югат антитілолікарський засіб, що складається з антитіла проти специфічного мембранного моноклонального антигену передміхурової залози (PSMA), зв'язаного з частиною майтансиноїдного лікарського засобу, DM1, розвивається для потенційного лікування пухлин передміхурової залози. Ауристатинові пептиди, ауристатин E (AE) і монометилауристатин (MMAE), синтетичні аналоги доластатину, кон„югували з химерними моноклональними антитілами cBR96 (специфічними у відношенні Lewis Y на карциномах) і cAC10 (специфічними у відношенні CD30 на гематологічних злоякісних пухлинах (Doronina et al (2003) Nature Biotechnology 21 (7):778-784) і знаходяться в розвитку у відношенні терапевтичного застосування. Тут описані хіміотерапевтичні агенти, застосовні в генеруванні імунокон„югатів. Ферментативно активні токсини і їхні фрагменти, що можуть бути використані, містять у собі ланцюг А дифтерійного токсину, незв'язуючі активні фрагменти дифтерійного токсину, ланцюг А екзотоксину (з Pseudomonas aeruginosa), ланцюг А рицину, ланцюг А абрину, ланцюг А модекіну, альфа-сарцин, білки Aleurites fordii, білки діантину, білки Phytolaca americana (PAPI, PAPII і PAP-S), інгібітор Мomordica charantia, курцин, кротин, інгібітор Saponaria officinalis, гелонін, мітогелін, рестриктоцин, феноміцин, еноміцин і трикотецени. Див., наприклад, WO 93/21232, опублікований 28 жовтня, 1993. Різні радіонукліди доступні для одержання радіокон„югованих антитіл. Приклади містять у 212 131 131 90 186 собі Bi, I, In, Y і Re. Кон„югати цього антитіла і цитотоксичного агента одержують з використанням різних біфункціональних білокзв„язувальних агентів, таких як N-сукцинімідил-3(2-піридилдитіол)пропіонат (SPDP), імінотіолан (IT), біфункціональні похідні імідоефірів (такі як диметиладипімідат-HCl), активні ефіри (такі як дисукцинімідилсуберат), альдегіди (такі як глутаровий альдегід), біс-азидо-сполуки (такі як біс-(пазидобензоїл)гександіамін), похідні біс-діазонію (такі як біс-(п-діазонійбензоїл)етилендіамін), діізоціанати (такі як толуол-2,6-діізоціанат) і біс-активні сполуки фтору (такі як 1,5-дифтор-2,4динітробензол). Наприклад, імунотоксин рицин може бути одержаний, як описано в Vitetta et al (1987) Science, 238: 1098. Мічена вуглецем-14 1ізотіоціанатобензил-3метилдіетилентриамінпентаоцтова кислота (MX 29 DTPA) є зразковим хелатоутворюючим агентом для кон'югації радіонукліда з антитілом (WO94/11026). Кон„югати антитіла й одного або декількох токсинів з малою молекулою, таких як каліхеаміцин, майтансиноїди, доластатини, ауристатини, трихотецен і CC1065, і похідних цих токсинів, що мають активність токсинів, також обговорюються тут. Майтансин і майтансиноїди У деяких варіантах здійснення, імунокон„югат містить антитіло (повної довжини або фрагменти) відповідно до винаходу, кон„юговане з однією або декількома молекулами майтансиноїдів. Майтансиноїди є мітотичними інгібіторами, що діють інгібуванням полімеризації тубуліну. Майтансин був уперше виділений з Африканського чагарнику Maytenus serrata (Патент США № 3896111). Потім було виявлено, що деякі мікроби також продукують майтансиноїди, такі як майтансинол і С-3ефіри майтансинолу (патент США № 4151042). Описано синтетичний майтансинол і його похідні й аналоги, наприклад, у патентах США з номерами 4137230; 4248870; 4256746; 4260608; 4265814; 4294757; 4307016; 4308268; 4308269; 4309428; 4313946; 4315929; 4317821; 4322348; 4331598; 4361650; 4364866; 4424219; 4450254; 4362663 і 4371533. Групи майтансиноїдних лікарських засобів є привабливими групами лікарських засобів у кон„югатах антитіло-лікарський засіб, тому що вони є: (і) відносно доступними для одержання ферментацією або хімічною модифікацією, дериватизацією продуктів ферментації, (ii) придатними для дериватизації функціональними групами, що підходять для кон'югації через недисульфідні лінкери з антитілами, (iii) стабільними в плазмі і (iv) ефективними проти різних ліній пухлинних клітин. Похідні майтансину, що підходять для застосування як групи майтансиноїдних лікарських засобів, добре відомі в даній галузі і можуть бути виділені з природних джерел відповідно до відомих способів, одержані способами генної інженерії (див. Yu et al (2002) PNAS 99:7968-7973), або майтансинол і аналоги майтансинолу одержують синтетично відповідно до відомих способів. Зразкові групи майтансиноїдних лікарських засобів містять у собі групи, що мають модифіковане ароматичне кільце, таке як: C-19-дехлор (US 4256746) (одержане відновленням гідридом літіюалюмінію ансамітоцину P2); C-20-гідрокси (або C20-деметил) +/-C-19-дехлор (патенти США з номерами 4361650 і 4307016) (одержані деметилуванням з використанням Streptomyces або Actinomyces або дехлоруванням з використанням LAH) і C-20-деметокси, C-20-ацилокси (-OCOR), +/дехлор (патент США № 4294757) (одержані ацилуванням з використанням ацилхлоридів), і що мають модифікації в інших положеннях. Зразкові групи майтансиноїдних лікарських засобів містять у собі також такі групи майтансиноїдних лікарських засобів кон„югату, як: C-9-SH (US 4424219) (одержані реакцією майтансинолу з H2S або P2S5); C-14-алкоксиметил(деметокси/CH2OR) (US 4331598); C-14-гідроксиметил або ацилоксиметил (CH2OH або CH2OAc) (US 4450254) (одер 94628 30 жані з Nocardia); C-15-гідрокси/ацилокси (US 4,364,866) (одержані перетворенням майтансинолу з використанням Streptomyces); C-15-метокси (патенти США з номерами 4313946 і 4315929) (виділені з Trewia nudlflora); C-18-N-деметил (патенти США з номерами 4362663 і 4322348) (одержані деметилуванням майтансинолу з використанням Streptomyces) і 4,5-дезокси (патент США 4371533) (одержані відновленням майтансинолу сумішшю трихлорид титану/LAH). Зразкові варіанти груп майтансиноїдних лікарських засобів кон„югатів містять у собі: DM1; DM3 і DM4, що мають структури: у яких хвиляста лінія вказує на ковалентне приєднання атома сірки цього лікарського засобу до лінкеру (L) кон„югата антитіло-лікарський засіб. Був повідомлений HERCEPTIN® (трастуцумаб), зв'язаний за допомогою SMCC з DM1 (WO 2005/037992, що спеціально включений тут як посилання в повному вигляді). Кон„югат антитілолікарський засіб даного винаходу може бути одержаний відповідно до описаних в цьому посиланні процедур. 31 94628 32 Інші зразкові майтансиноїдні кон„югати антитіло-лікарський засіб мають наступні структури й абревіатури (де Ab означає антитіло і р дорівнює 1-~8): Зразкові кон„югати антитіло-лікарський засіб, у яких DM1 зв'язаний через лінкер BMPEO з тіоло вою групою цього антитіла, мають структуру й абревіатуру: де Ab означає антитіло; n дорівнює 0, 1 або 2 і р дорівнює 1, 2, 3 або 4. Імунокон„югати, що містять майтансиноїди, способи їх одержання і їхнє терапевтичне застосування описані, наприклад, у патентах США з номерами 5208020; 5416064; 6441163 і Європейському патенті EP 0425235 B1, описи яких спеціально включені тут як посилання. Liu et al., Proc. Natl. Acad. Sci. USA 93:8618-8623 (1996) описували імунокон„югати, що містять майтансиноїд, названий DM1, зв'язаний з моноклональним антитілом C242, спрямованим проти колоректального раку людини. Було виявлено, що цей кон„югат був високотоксичним у відношенні культивованих клітин раку ободової кишки і виявляв протипухлинну активність в аналізі росту пухлини in vivo. Chari et 33 al., Cancer Research 52:127-131 (1992) описують імунокон„югати, у яких майтансиноїд був кон„югований через дисульфідний лінкер з мишачим антитілом A7, що зв'язується з антигеном на лініях клітин раку ободової кишки, або з іншим мишачим моноклональним антитілом TA.1, що зв'язує онкоген HER-2/neu. Цитотоксичність цього кон„югата TA.1-майтансиноїд випробували in vitro на лінії клітин раку молочної залози SK-BR-3, що 5 експресує 3 × 10 поверхневих антигенів HER-2 на клітину. Цей кон„югат з лікарським засобом досягав міри цитотоксичності, подібної до міри цитотоксичності вільного майтансиноїдного лікарського засобу, що могла бути збільшена збільшенням кількості молекул майтансиноїду на молекулу антитіла. Кон„югат A7-майтансиноїд виявляв низьку системну цитотоксичність у мишах. Кон„югати анти-STЕАР-1-антитіломайтансиноїд одержують шляхом хімічного зв'язування антитіла з молекулою майтансиноїду без значимого зменшення біологічної активності цього антитіла або молекули майтансиноїду. Див., наприклад, патент США 5208020 (опис якого спеціально включено тут як посилання). У середньому 34 молекули майтансиноїду на молекулу антитіла виявляли ефективність у посиленні цитотоксичності у відношенні клітин-мішеней і не робили негативного впливу на функцію або розчинність цього антитіла, хоча очікувалося, що навіть одна молекула токсину на антитіло буде підсилювати цитотоксичність у порівнянні з застосуванням «голого» антитіла. Майтансиноїди добре відомі в даній галузі і можуть бути синтезовані відомими способами або виділені з природних джерел. Придатні майтансиноїди описані, наприклад, у патенті США № 5208020 і в інших патентах і непатентних публікаціях, на які приводяться посилання вище. Переважними майтансиноїдами є майтансинол і аналоги майтансинолу, модифіковані в ароматичному кільці або в інших положеннях молекули майтансинолу, наприклад, різні складні ефіри майтансинолу. У даній галузі відомі багато зв„язуючі (лінкерні) групи для одержання кон„югатів антитіломайтансиноїд, у тому числі, наприклад, зв'язуючі групи, описані в патентах США з номерами 5208020, 6441163 або Європейському патенті 0425235 B1, Chari et al., Cancer Research 52: 127131 (1992) і US 2005/0169933 A1, описи яких спеціально включені тут як посилання. Кон„югати антитіло-майтансиноїд, що містять лінкерний компонент SMCC, можуть бути одержані, як описано в Заявці на патент США № 11/141344, поданої 31 травня 2005 року, "Antibody Drug Conjugates and Methods". Ці зв„язувальні групи містять у собі дисульфідні групи, прості тіоефірні групи, кислотолабільні групи, фотолабільні групи, пептидазалабільні групи або естераза-лабільні групи, описані в приведених вище патентах. Додаткові зв„язувальні групи описані і приведені як приклади тут. Кон„югати антитіла і майтансиноїду можуть бути одержані з використанням різних біфункціональних агентів зв'язування білків, таких як Nсукцинімідил-3-(2-піридилдитіо)пропіонат (SPDP), 94628 34 сукцинімідил-4-(N-малеїмідометил)циклогексан-1карбоксилат (SMCC), імінотіолан (IT), біфункціональні похідні імідоефірів (такі як диметиладипімідатHCl), активні ефіри (такі як дисукцинімідилсуберат), альдегіди (такі як глутаровий альдегід), бісазидо-сполуки (такі як біс-(пазидобензоїл)гександіамін), похідні біс-діазонію (такі як біс-(п-діазонійбензоїл)етилендіамін), діізоціанати (такі як толуол-2,6-діізоціанат) і біс-активні сполуки фтору (такі як 1,5-дифтор-2,4динітробензол). Особливо переважні зв„язуючі агенти містять у собі N-сукцинімідил-3-(2піридилдитіо)пропіонат (SPDP) (Carlsson et al, Biochem. J. 173:723-737 (1978)) і N-сукцинімідил-4(2-піридилтіо)пентаноат (SPP), для забезпечення дисульфідного зв'язку. Цей лінкер може бути приєднаний до молекули майтансиноїду в різних положеннях у залежності від типу цього зв'язку. Наприклад, ефірний зв'язок може бути утворений реакцією з гідроксильною групою з використанням загальноприйнятих способів зв'язування. Ця реакція може відбуватися в положенні С-3, що має гідроксильну групу, у положенні С-14, модифікованому гідроксиметилом, у положенні С-15, модифікованому гідроксильною групою й у положенні С-20, що має гідроксильну групу. У переважному варіанті здійснення, цей зв'язок утворений у положенні С-3 майтансинолу або аналогу майтансинолу. В одному варіанті здійснення, кожне з антитіл відповідно до винаходу (повної довжини або фрагмент) кон„югують з однією або декількома молекулами майтансиноїду. В одному варіанті цього імунокон„югата, цитотоксичним агентом D є майтансиноїд DM1. В одному варіанті цього імунокон„югата, цей лінкер вибраний із групи, що складається з SPDP, SMCC, IT, SPDP і SPP. Ауристатини і доластатини У деяких варіантах здійснення цей імунокон„югат містить антитіло відповідно до винаходу, кон„юговане з доластатинами або пептидними аналогами і похідними доластатинів, ауристатинами (Патенти США № 5,635,483; 5,780,588). Було показано, що доластатини й ауристатини перешкоджають динаміці мікротрубочок, гідролізу GTP і розподілу ядер і клітин (Woyke et al (2001) Antimicrob. Agents and Chemother. 45(12):35803584) і мають протиракову і протигрибкову активність (Pettit et al (1998) Antimicrob. Agents Chemother. 42:2961-2965). Доластатинова або ауристатинова лікарська частина може бути приєднана до антитіла через N (аміно)- кінець або С (карбоксил)-кінець частини пептидного лікарського засобу (WO 02/088172). Зразкові варіанти ауристатина містять у собі зв'язані з N-кінцем частини лікарського засобу монометилауристатина DE і DF, описані в статті "Senter et al, Proceedings of the American Association for Cancer Research, Volume 45, Abstract Number 623, presented March 28, 2004, опис якої спеціально включено як посилання в повному вигляді. Одним зразковим варіантом ауристатина є ММАЕ в якому хвиляста лінія вказує на ковалент 35 94628 36 не приєднання до лінкеру (L) кон„югата антитіло лікарський засіб). Іншим зразковим варіантом ауристатина є ММА, у якому хвиляста лінія вказує на ковалентне приєднання до лінкеру (L) кон„югата антитілолікарський засіб) (US 2005/0238649): Додаткові зразкові варіанти, що містять MMAE або MMAF і різні лінкерні компоненти (описані до датково тут), мають наступні структури й абревіатури (де Ab означає антитіло і р дорівнює 1-~8): Звичайно частини лікарського засобу на основі пептидів можуть бути одержані шляхом утворення пептидного зв'язку між двома або більше амінокислотами і/або пептидними фрагментами. Такі пептидні зв'язки можуть бути одержані, наприклад, відповідно до способу рідкофазного синтезу (див. E. Schroder and K. Lϋbke, "The Peptides", volume 1, pp 76-136, 1965, Academic Press), що добре відомий в галузі хімії пептидів. Частини лікарського засобу ауристатина/доластатина можуть бути одержані відповідно до способів: Патентів США 5,635,483; 5,780,588; Pettit et al (1989) J. Am. Chem. Soc. 111:5463-5465; Pettit et al (1998) AntiCancer Drug Design 13:243-277; Pettit, G.R., et al. Synthesis, 1996, 719-725; Pettit et al (1996) J. Chem. Soc. Perkin Trans. 15:859-863 і Doronina (2003) Nat Biotechnol 21(7):778-784. 37 Каліхеаміцин В інших варіантах здійснення, цей імунокон„югат містить антитіло відповідно до винаходу, кон„юговане з однією або декількома молекулами каліхеаміцину. Сімейство каліхеаміцинових антибіотиків здатно продукувати розриви в двохоанцюжковій ДНК при субпікомолярних концентраціях. У відношенні одержання кон„югатів сімейства каліхеаміцину див. патенти США з номерами 5712374, 5714586, 5739116, 5767285, 5770701, 5770710, 5773001, 5877296 (усі належать American Cyanamid Company). Структурні аналоги каліхеаміцину, що можуть бути використані, містять у со1 1 1 бі, але не обмежуються ними, 1 , 2 , 3 , N1 ацетил-1 , PSAG і θ11) (Hinman et al., Cancer Research 53:3336-3342 (1993), Lode et al., Cancer Research 58:2925-2928 (1998) вищевказані патенти США, видані American Cyanamid). Іншим протипухлинним лікарським засобом, з яким може бути кон„юговане це антитіло, є QFA, що являє собою антифолат. Як каліхеаміцин, так і QFA мають внутрішньоклітинні сайти дії і не перетинають легко плазматичну мембрану. Таким чином, клітинне поглинання цих агентів через опосередковану антитілом інтерналізацію в сильній мірі підсилює їх цитотоксичні ефекти. Інші цитотоксичні агенти Інші протипухлинні агенти, що можуть бути кон„юговані з антитілами відповідно до винаходу, містять у собі BCNU, стрептозоїцин, вінкристин і 5фторурацил, сімейство агентів, відоме під загальною назвою LL-E33288-комплекс, описане в патентах США 5053394, 5770710, а також еспераміцини (патент США 5877296). Ферментативно активні токсини і їхні фрагменти, що можуть бути використані, містять у собі ланцюг А дифтерійного токсину, незв'язуючі активні фрагменти дифтерійного токсину, ланцюг А екзотоксину (з Pseudomonas aeruginosa), ланцюг А рицину, ланцюг А абрину, ланцюг А модекіну, альфа-сарцин, білки Aleurites fordii, білки діантину, білки Phytolaca americana (PAPI, PAPII і PAP-S), інгібітор Момоrdіса charantia, курцин, кротин, інгібітор Saponaria officinalis, гелонін, мітогелін, рестриктоцин, феноміцин, еноміцин і трикотецени. Див., наприклад, WO 93/21232, опублікований 28 жовтня, 1993. Даний винахід розглядає додатково імунокон„югат, утворений між антитілом і сполукою з нуклеолитичною активністю (наприклад, рибонуклеазною або ДНК-ендонуклеазною, наприклад, дезоксинуклеазною, ДНК-азною активністю). Для селективної деструкції пухлини, це антитіло може містити високо радіоактивний атом. Різні радіоактивні ізотопи є доступними для одержання радіокон„югованих антитіл. Приклади містять у 211 131 125 90 186 188 153 212 32 собі At , I , I , Y , Re , Re , Sm , Bi , P , 212 Pb і радіоактивні ізотопи Lu. При використанні цього кон„югата для детектування, він може містити радіоактивний атом для сцинтиграфічних дос99m 123 ліджень, наприклад, Тc або I , або спінову мітку для магнітної ядерно-резонансної (ЯМР) томографії (також відомої як магнітна резонансна томографія, MRI), таку як йод-123, йод-131, індій 94628 38 111, фтор-19, вуглець-13, азот-15, кисень-17, гадоліній, марганець або залізо. Радіоактивні або інші мітки можуть бути включені в кон„югат відомими способами. Наприклад, пептид може бути синтезований хімічним синтезом амінокислот з використанням придатних попередників амінокислот, що включають у себе, напри99m клад, фтор-19 замість водню. Такі мітки, як Тc 123 186 188 111 або I , Re , Re і In можуть бути приєднані через залишок цистеїну в цьому пептиді. Ітрій-90 може бути приєднаний через залишок лізину. Спосіб IODOGEN (Fraker et al (1978) Biochem. Biophys. Res. Commun. 80: 49-57) може бути використаний для включення йоду-123. "Monoclonal Antibodies in Immunoscintigraphy" (Chatal, CRC Press 1989) докладно описує інші способи. Кон„югати антитіла і цитотоксичного агента можуть бути одержані з використанням різних біфункціональних агентів зв'язування білків, таких як N-сукцинімідил-3-(2-піридилдитіо)пропіонат (SPDP), сукцинімідил-4-(Nмалеїмідометил)циклогексан-1-карбоксилат (SMCC), імінотіолан (IT), біфункціональні похідні імідоефірів (такі як диметиладипімідат-HCl), активні ефіри (такі як дисукцинімідилсуберат), альдегіди (такі як глутаровий альдегід), біс-азидо-сполуки (такі як біс-(п-азидобензоїл)гександіамін), похідні біс-діазонію (такі як біс-(пдіазонійбензоїл)етилендіамін), діізоціанати (такі як толуол-2,6-діізоціанат) і біс-активні сполуки фтору (такі як 1,5-дифтор-2,4-динітробензол). Наприклад, рициновий імунотоксин може бути одержаний, як описано в Vitetta et al., Science 238: 1098 (1987). Мічена вуглецем-14 1-ізотіоціанатобензил-3метилдіетилентриамінпентаоцтова кислота (MXDTPA) є зразковим хелатоутворюючим агентом для кон'югації радіонукліда з антитілом. Див. WO94/11026. Цей лінкер може бути «розщеплюваним лінкером», що полегшує вивільнення цитотоксичного лікарського засобу в клітині. Наприклад, може бути використаний кислотолабільний лінкер, пептидаза-чутливий лінкер, фотолабільний лінкер, диметильний лінкер або дисульфідовмісний лінкер (Chari et al., Cancer Research 52: 127-131 (1992); Патент США № 5,208,020). Як сполуки відповідно до винаходу особливо обговорюються, але не обмежуються ними, ADC, одержаний з реагентами, що зшивають: BMPS, EMCS, GMBS, HBVS, LC-SMCC, MBS, MPBH, SBAP, SIA, SIAB, SMCC, SMPB, SMPH, сульфоEMCS, сульфо-GMBS, сульфо-KMUS, сульфоMBS, сульфо-SIAB, сульфо-SMCC і сульфо-SMPB і SVSB (сукцинімідил-(4-вінілсульфон)бензоат), що є комерційно доступними (наприклад, з Pierce Biotechnology, Inc., Rockford, IL., U.S.A). Див. сторінки 467-498, 2003-2004 Applications Handbook and Catalog. Одержання кон„югатів антитіло-лікарський засіб: У кон„югатах антитіло-лікарський засіб (ADC) відповідно до винаходу, антитіло (Ab) кон„юговане з однією або декількома частинами (складовими молекули) лікарського засобу (D), наприклад, приблизно 1 – приблизно 20 частинами лікарського засобу на антитіло, через лінкер (L). В одному ва 39 ріанті здійснення, кількість частин лікарського засобу (D) на антитіло дорівнює від приблизно 1 до приблизно 5, альтернативно, від приблизно 2 до приблизно 6, альтернативно, від приблизно 2 до приблизно 5, альтернативно, від приблизно 3 до приблизно 4 частин лікарського засобу на антитіло. Оскільки кількість частин лікарського засобу на антитіло є середньою кількістю у всіх кон„югатах у популяції кон„югата антитіло-лікарський засіб, кількість частин лікарського засобу на антитіло може не бути цілим числом. ADC формули I може бути одержаний декількома способами з використанням реакцій органічної хімії, умов і реагентів, відомих кваліфікованим в даній галузі фахівцям, що включають у себе: (1) реакцію нуклеофільної групи антитіла з бівалентним лінкерним реагентом, з утворенням Ab-L, через ковалентний зв'язок, з наступною реакцією з частиною лікарського засобу D; і (2) реакцію нуклеофільной групи частини лікарського засобу з бивалентним лінкерним реагентом, з утворенням D-L, через ковалентний зв'язок, з наступною реакцією з нуклеофільною групою антитіла. Додаткові способи одержання ADC описані тут. Ab-(L-D)p Формула I Цей лінкер може бути складений з одного або декількох лінкерних компонентів. Зразкові лінкерні компоненти містять у собі 6-малеїмідокапроїл ("MC"), малеїмідопропаноїл ("MP"), валін-цитрулін ("val-cit"), аланін-фенілаланін ("ala-phe"), памінобензилоксикарбоніл ("PAB"), N-сукцинімідил4-(2-піридилтіо)пентаноат ("SPP"), N-сукцинімідил4-(N-малеїмідометил)циклогексан-1-карбоксилат ("SMCC) і N-сукцинімідил-(4йодацетил)амінобензоат ("SIAB"). В одному варіанті здійснення цим лінкером є валін-цитрулін-памінобензилоксикарбоніл ("vc-PAB"). Додаткові лінкерні компоненти відомі в даній галузі і деякі описані тут. У деяких варіантах здійснення, цей лінкер може містити амінокислотні залишки. Зразкові амінокислотні лінкерні компоненти містять у собі дипеп 94628 40 тид, трипептид, тетрапептид або пентапептид. Зразкові дипептиди містять у собі: валін-цитрулін (vc або val-cit), аланін-фенілаланін (af або ala-phe). Зразкові трипептиди містять у собі: гліцин-валінцитрулін (gly-val-cit) і гліцин-гліцин-гліцин (gly-glygly). Амінокислотні залишки, що складають амінокислотний лінкерний компонент, містять у собі амінокислотні залишки, що зустрічаються в природі, і амінокислотні аналоги, що не зустрічаються в природі, такі як цитрулін. Амінокислотні лінкерні компоненти можуть бути сконструйовані й оптимізовані в їхній селективності у відношенні ферментативного розщеплення конкретними ферментами, наприклад, пухлиноасоційованою протеазою, катепсином В, С і D, протеазою або плазміном. Зразкові структури лінкерних компонентів показани нижче (де хвиляста лінія вказує на сайти ковалентного приєднання до інших компонентів ADC): Додаткові зразкові лінкерні компоненти й абревіатури містять у собі (де Ab означає антитіло і р дорівнює 1-~8): 41 Нуклеофільні групи на антитілах містять у собі, але не обмежуються ними: (і) N-кінцеві аміногрупи, (ii) аміногрупи бічних ланцюгів, наприклад, лізина, (iii) тіолові групи бічних ланцюгів, наприклад, цистеїну, і (iv) гідроксил цукри або аміногрупи, якщо це антитіло є глікозилованим. Аміногрупи, тіолові і гідроксильні групи є нуклеофільними і здатні реагувати з утворенням ковалентних зв'язків з електрофільними групами на лінкерних частинах молекули і лінкерних реагентах, що включають у себе:: (і) активні ефіри, такі як NHS-ефіри, HOBt-ефіри, галогенформіати і галогенангідриди кислот; (ii) алкіл- і бензилгалогеніди, такі як галогенацетаміди; (iii) альдегідні, кетонові, карбоксильні і малеїмідні групи. Деякі антитіла мають відновлюючі міжланцюжкові дисульфіди, тобто цистеїнові містки. Антитіла можуть бути зроблені реакційноспроможними для кон'югації з лінкерними реагентами обробкою агентом, що відновлює, таким як ДТТ (дитіотреїтол). Таким чином, кожен цистеїновий місток буде утворювати, теоретично, два реакційноспроможних тіолових нуклеофіла. Додаткові нуклеофільні групи можуть бути введені в антитіла за допомогою реакції лізинів з 2-імінотіоланом (реагентом Траута), що приводить до перетворення аміну в тіол. Реакційноспроможні тіолові групи можуть бути введені в антитіло (або його фрагмент) введенням одного, двох, трьох, чотирьох або більше залишків цистеїну (наприклад, одержанням мутантних антитіл, що містять один або декілька неприродних цистеїнових амінокислотних залишків). Кон„югати антитіло-лікарський засіб відповідно до винаходу можуть бути також одержані шляхом модифікації антитіла для введення електрофільних частин молекул, що можуть взаємодіяти з нуклеофільними замісниками на лінкерному реагенті або лікарському засобі. Цукри глікозилованих антитіл можуть бути окислені, наприклад, періодатними реагентами, що окисляють, з утворенням альдегідних або кетонових груп, що можуть взаємодіяти з аміногрупою лінкерних реагентів або 94628 42 лікарських частин. Іміногрупи основ Шифа можуть утворювати стабільний зв'язок або можуть бути відновлені, наприклад, боргідридними реагентами з утворенням стабільних амінних зв'язків. В одному варіанті здійснення, реакція вуглеводної частини глікозилованого антитіла з галактозооксидазою або метаперіодатом натрію може давати карбонільні (альдегідні або кетонові) групи в білку, що можуть взаємодіяти з придатними групами на лікарському засобі (Hermanson, Bioconjugate Techniques). В іншому варіанті здійснення, білки, що містять N-кінцеві залишки серину або треоніну, можуть взаємодіяти з метаперіодатом натрію, приводячи до утворення альдегіду замість першої амінокислоти (Geoghegan & Stroh, (1992) Bioconjugate Chem. 3: 138-146; US 5362852). Такий альдегід може реагувати з лікарською частиною або нуклеофілом лінкера. Подібним чином, нуклеофільні групи на частині лікарського засобу містять у собі, але не обмежуються ними: аміногрупу, тіолову, гідроксильну, гідразидну, оксимну, гідразинову, тіосемікарбазонову, гідразинову, карбоксилатну й арилгідразидну групи, здатні реагувати з утворенням ковалентних зв'язків з електрофільними групами на лінкерних частинах і лінкерних реагентах, що включають у себе: (і) активні ефіри, такі як NHS-ефіри, HOBtефіри, галогенформіати і галогенангідриди кислот; (ii) алкіл- і бензилгалогеніди, такі як галогенацетаміди; (iii) альдегіди, кетони, карбоксильні і малеїмідні групи. Способи кон'югації частин лінкер-лікарський засіб з націленими на клітини білками, такими як антитіла, імуноглобуліни або їхні фрагменти, можуть бути знайдені, наприклад, у US 5,208,020; US 6,441,163; WO2005037992; WO2005081711 і WO2006/034488, усі з яких включені тут як посилання в їхньому повному вигляді. Альтернативно, злитий білок, що містить антитіло і цитотоксичний агент, може бути одержаний, наприклад, рекомбінантними способами або пептидним синтезом. Довжина ДНК може містити від 43 94628 повідні райони, що кодують ці дві частини кон„югата, розташовані або поруч один з одним, або розділені районом, що кодує лінкерний пептид, що не руйнує бажані властивості цього кон„югата. Ще в одному варіанті здійснення, це антитіло може бути кон„юговане з «рецептором» (таким як стрептавідин) для використання в попередньому націлюванні на пухлину, в якому цей кон„югат ан 2 6 44 титіло-рецептор вводять пацієнту, з наступним видаленням не зв'язаного кон„югата з кровотоку з використанням агента кліренсу, і потім введенням «ліганда» (наприклад, авідину), що кон„югований з цитотоксичним агентом (наприклад, радіонуклідом). В одному варіанті такого імунокон„югата цитотоксичний агент, D, є ауристатином формули DE або DF в якій кожний з R і R означають метил, кож3 4 7 ний з R і R означають ізопропіл, R означає втор8 бутил, кожен R незалежно вибраний з CH3, О9 10 CH3, OH і H; R означає H; R означає арил; Z 11 означає -O- або -NH-; R означає H, C1-C8 або 18 алкіл -(CH2)2-O-(CH2)2-O-(CH2)2-O-CH3 і R означає 8 8 -C(R )2-C(R )2-арил; і (d) p знаходиться в інтервалі від приблизно 1 до 8. Наступні варіанти здійснення забезпечені додатково для кожного з вищеописаних кон„югатів. В одному варіанті здійснення, імунокон„югат має вбиваючу клітини in vitro або in vivo активність. В одному варіанті здійснення, лінкер приєднують до антитіла через тіолову групу на антитілі. В одному варіанті здійснення, цей лінкер може бути відщиплений протеазою. В одному варіанті, лінкер міс тить дипептид val-cit. В одному варіанті, лінкер містить п-амінобензильну ланку. В одному варіанті, це п-амінобензильна ланка розташована між лікарським засобом і сайтом розщеплення протеазою у цьому лінкері. В одному варіанті, цією памінобензильною ланкою є памінобензилоксикарбоніл (PAB). В одному варіанті, лінкер містить 6-малеїмідокапроїл. В одному варіанті, 6-малеїмідокапроїл розташований між антитілом і сайтом розщеплення протеазою у цьому лінкері. Вищеописані варіанти можуть зустрічатися окремо або в будь-якій комбінації один з одним. В одному варіанті, лікарський засіб вибраний з MMAE і MMAF. В одному варіанті, імунокон„югат має формулу в якій Ab означає кожне з вищевказаних антиSTЕАР-1-антитіл, S означає атом сірки і p знахо диться в інтервалі від приблизно 2 до приблизно 5. В одному варіанті, імунокон„югат має формулу в якій Ab означає кожне з вищевказаних антиSTEAP-1-антитіл, S означає атом сірки і p знаходиться в інтервалі від приблизно 1 до приблизно 6, від приблизно 2 до приблизно 5, від приблизно 2 до приблизно 6, від приблизно 2 до приблизно 4, від приблизно 2 до приблизно 3, від приблизно 3 до приблизно 4, від приблизно 3 до приблизно 5, від приблизно 3 до приблизно 6 або від приблизно 4 до приблизно 6. Способи візуалізації міченого антитіла: В іншому варіанті здійснення відповідно до винаходу, цистеїн-вбудовані антитіла можуть бути позначені через тіол цистеїну радіонуклідами, флуоресцентними барвниками, субстратними частинами, що запускають біолюмінесценцію, суб 45 стратними частинами, що запускають хемілюмінесценцію, ферментами й іншими детектуючими мітками для експериментів візуалізації з діагностичними, фармакодинамічними і терапевтичними застосуваннями. Звичайно, мічене цистеїнвбудоване антитіло, тобто «біомаркер» або «зонд», вводять ін'єкцією, або перфузією пероральним введенням усередину живому організму, наприклад, людині, гризуну або іншій малій тварині, у перфузований орган або у пробу тканини. Розподіл цього зонда детектується протягом деякого періоду часу і представляється у вигляді зображення. Вироби: В іншому варіанті здійснення відповідно до винаходу, забезпечений виріб, або «набір», що містить матеріали, застосовні для лікування вищеописаних порушень. Цей виріб містить у собі контейнер і інструкцію або вкладиш упаковки на цьому контейнері або прикладений до цього контейнера. Придатні контейнери містять у собі, наприклад, склянки, флакони, шприци, блістерну упаковку і т.д. Ці контейнери можуть бути виконані з різних матеріалів, таких як скло або пластик. Контейнер містить композицію кон„югата антитілолікарський засіб (ADC), що є ефективною для лікування цього стану, і може мати стерильний отвір доступу (наприклад, цей контейнер може бути пакетом для внутрішньовенного розчину або флаконом із кришкою, що проколюється голкою для підшкірних ін'єкцій). Щонайменше одним активним агентом у цій композиції є ADC. Інструкція або вкладиш упаковки вказує, що ця композиція використовується для лікування вибраного стану, такого як рак. Альтернативно або додатково, цей виріб може, крім того, містити другий (або третій) контейнер, що містить фармацевтично прийнятний буфер, такий як бактеріостатична вода для ін'єкції (BWFI), забуферений фосфатом сольовий розчин, розчин Рінгера і розчин декстрози. Крім того, він може містити в собі інші матеріали, бажані з комерційної точки зору і з погляду користувача, у тому числі інші буфери, розріджувачі, фільтри, голки і шприци. Фармацевтичні композиції: В одному аспекті, забезпечена фармацевтична композиція, що містить будь-який з вищеописаних імунокон„югатів і фармацевтично прийнятний носій. В одному аспекті, забезпечений спосіб лікування клітинно-проліферативного порушення передміхурової залози, легені, ободової кишки, сечового міхура або яєчника або саркоми Юінга, причому цей спосіб передбачає введення індивідууму цієї фармацевтичний композиції. В одному варіанті здійснення, раком передміхурової залози, легені, ободової кишки, сечового міхура або яєчника або клітинно-проліферативним порушенням саркоми Юїнга є метастазування первинного раку передміхурової залози, легені, ободової кишки, сечового міхура або яєчника або саркоми Юїнга. В одному варіанті здійснення, це клітиннопроліферативне порушення асоційоване зі збільшеною експресією STEAP-1 на поверхні клітини. В одному аспекті, забезпечений спосіб інгібування проліферації клітин, причому цей спосіб 94628 46 передбачає піддавання клітини дії кожного з вищеописаних імунокон„югатів при умовах, пермісивних для зв'язування цього імунокон„югата в STEAP-1. В одному варіанті здійснення, пухлинною клітиною є пухлинна клітина передміхурової залози, легені, ободової кишки, сечового міхура або яєчника або клітина саркоми Юїнга ссавця, що має або приблизно має проліферативне порушення клітин передміхурової залози, легені, ободової кишки, сечового міхура або яєчника або саркоми Юїнга, у тому числі, але не тільки, метастазування первинної ракової пухлини передміхурової залози, легені, ободової кишки, сечового міхура або яєчника або пухлини саркоми Юїнга. В одному варіанті здійснення, клітиною раку передміхурової залози, легені, ободової кишки, сечового міхура або яєчника або саркоми Юїнга є ксенотрансплантат. В одному варіанті здійснення, цей вплив відбувається in vitro. В одному варіанті, цей вплив відбувається in vivo. В одному аспекті, забезпечений спосіб застосування анти-STEAP-1-антитіла відповідно до винаходу для аналізу розчинного STEAP-1 у сироватці ссавця, що має клітинно-проліферативне порушення передміхурової залози, легені або ободової кишки (або метастазування первинного випадку такого порушення), що вимірює клінічну прогресію або регресію цих захворювань, або встановлення обтяженості пухлиною або рецидиву. Файл цього патенту або заявки містить щонайменше один малюнок, виконаний у кольорі. Копії цього патенту або публікації заявки на патент із кольоровим малюнком (малюнками) будуть забезпечені патентним відомством після запиту і сплати необхідних зборів. Фігура 1 зображує амінокислотну послідовність STEAP-1 людини (SEQ ID NO:1), зіставлену з STEAP-1 з миші і собакоподібної мавпи (cyno) (SEQ ID NO:2 і 3, відповідно). Позаклітинні домени 1, 2 і 3 позначені і маркіровані затіненими боксами. Фігури 2А-2В: Фігура 2А зображує амінокислотну послідовність варіабельного району легкого ланцюга мишачого анти-STЕАР-1-антитіла 120.545, зіставлену з химерним антитілом (120 химера) і гуманізованим антитілом (120 трансплантат) і зіставлену з послідовністю підгрупи III людини. CDR укладені в бокси (CDR-L1, CDR-L2 і CDR-L3). Послідовності, що оточують ці CDR, є каркасними послідовностями (FR-L1-FR-L4). Ці послідовності пронумеровані відповідно до нумерації Кабата. Кабат, Хотіа і контактні CDR зазначені біля вміщених у бокси CDR. Фігура 2B зображує амінокислотну послідовність варіабельного району важкого ланцюга мишачого анти-STЕАР-1антитіла (120.545), зіставлену з химерним антитілом (120 химера) і гуманізованим антитілом (120 трансплантат) і зіставлену з послідовністю каппа I людини. Гуманізовані варіанти 24, 37, 48, 67 і 37/48, 67, 71 і 78 одержували виконанням наступних амінокислотних змін: A24V, V37I, V48M, F67I і L78F у важкому ланцюзі антитіла 120 трансплантат. CDR укладені в бокси. Послідовності FR-H1, FR-H2, FR-H3 і FR-H4 оточують ці CDR (CDR-H1, CDR-H2 і CDR-H3). Ці послідовності пронумерова 47 ні відповідно до нумерації Кабата. Кабат, Хотіа і контактні CDR зазначені біля вміщених у бокси CDR. Фігури 3А і 3В показують зразкові акцепторні послідовності консенсусних каркасів варіабельної області важкого ланцюга (VH) людини для застосування на практиці даного винаходу з наступними ідентифікаторами послідовностей, де SEQ ID NO FR перераховані в послідовності FR-H1, FR-H2, FR-H3, FR-H4: - консенсусний каркас “A” підгрупи I VH людини мінус CDR по Кабату (SEQ ID NO:26, 27, 28, 29). - консенсусні каркаси “В”, “C” і “D” підгрупи I VH людини мінус подовжені гіперваріабельні райони (SEQ ID NO:30, 31, 28, 29; SEQ ID NO:30, 31, 32, 29 і SEQ ID NO:30, 31, 33, 29). - консенсусний каркас “A” підгрупи II VH людини мінус CDR по Кабату (SEQ ID NO:34, 35, 36, 29). - консенсусні каркаси “В”, “C” і “D” підгрупи II VH людини мінус подовжені гіперваріабельні райони (SEQ ID NO:37, 38, 36, 29; SEQ ID NO:37, 38, 39, 29 і SEQ ID NO:37, 38, 40, 29). - консенсусний каркас “A” підгрупи III VH людини мінус CDR по Кабату (SEQ ID NO:41, 42, 43, 29). - консенсусні каркаси “У”, “C” і “D” підгрупи III VH людини мінус подовжені гіперваріабельні райони (SEQ ID NO:44, 45, 43, 29; SEQ ID NO:44, 45, 46, 29 і SEQ ID NOs:44, 45, 46, 29). - каркас “A" акцептора 1 VH людини мінус CDR по Кабату (SEQ ID NO:48, 42, 49, 29). - каркаси “B” і “C” акцептора 1 VH людини мінус подовжені гіперваріабельні райони (SEQ ID NO:44, 45, 49, 29 і SEQ ID NO:44, 45, 50, 29). - каркас “A" акцептора 2 VH людини мінус CDR по Кабату (SEQ ID NO:48, 42, 51, 29). - каркаси “B”, “C” і “D” акцептора 2 VH людини мінус подовжені гіперваріабельні райони (SEQ ID NO:44, 45, 51, 29; SEQ ID NO:44, 45, 52, 29 і SEQ ID NO:44, 45, 53, 29). Фігури 4А і 4В показують зразкові акцепторні послідовності консенсусних каркасів варіабельної області легкого ланцюга (VL) людини для застосування на практиці даного винаходу з наступними ідентифікаторами послідовностей: - консенсусний каркас (kv1-1) підгрупи I-1 каппа VL людини: SEQ ID NO:54, 55, 56, 57 - консенсусний каркас (kv1) підгрупи I каппа VL людини: SEQ ID NO:54, 58, 56, 57 - консенсусний каркас (kv2) підгрупи II каппа VL людини: SEQ ID NO: 58, 59, 60, 57 - консенсусний каркас (kv3) підгрупи III каппа VL людини: SEQ ID NO:61, 62, 63, 57 - консенсусний каркас (kv4) підгрупи IV каппа VL людини: SEQ ID NO:64, 65, 66, 57. Фігура 5 зображує зіставлення послідовностей Fc-районів IgG людини, humIgG1 (не-A-алотипу, SEQ ID NO:85; і А-алотипу, де амінокислотна послідовність SREEM у SEQ ID NO:85 змінена на SRDEL), humIgG2 (SEQ ID NO:86), humIgG3 (SEQ ID NO:87) і humIgG4 (SEQ ID NO:88) з розходженнями між цими послідовностями, відзначеними зірочками. Цифри над цими послідовностями 94628 48 представляють систему нумерації EU. Показана також константна область каппа. Фігури 6А-6D зображують FACS-аналіз, нормалізований щодо рівня дисплея кожного антитіла або варіанта на фагу. Фігура 6А показує зсуви FACS на STEAP-1-експресуючих клітинах (LB50) для чотирьох прикладів антитіл. Фігура 6В показує зсуви FACS на не експресуючих STEAP-1 клітинах (S408) для декількох антитіл, як показано на цій фігурі й у прикладі 1. Фігури 6С і 6D є зіставленнями зсувів FACS після нормалізації щодо рівнів фагового дисплея. Фігури 7А-7F графічно зображують FACSаналізи, що показують зв'язування анти-STEAP-1мишиної, химерної і гуманізованої версії 24 антитіл з STEAP-1 людини, експресованим на клітинній поверхні. Фігури 7А-7С показують, що мишаче анти-STЕАР-1-антитіло 120, химерне антитіло 120 і гуманізоване антитіло 120v.24 зв'язують STEAP-1 людини і собакоподібноі мавпи, але не мишачий STEAP-1. Фігури 7D-7F є графіками FACS, що показують зв'язування мишачого антитіла 120, химерного антитіла 120 і гуманізованого антитіла 120v.24 (клону 67) з STEAP-1 людини, що експресується на клітинній поверхні. Екзогенний STEAP-1 стабільно експресувався в клітинах 293 (названих клітинами LB50) і клітинах PC3 названих клітинами PS5.4) (фігури 7D і 7E) і ендогенно експресувався в клітинах LNCaР BR (фігура 7F). Фігури 8А і 8В. Фігура 8А є графіком, що показує, що введення мишачого анти-STЕАР-1антитіла 120-Мс-vc-PAB-MMAE при 3 мг/кг було ефективним у моделі ксенотрансплантату пухлини передміхурової залози (клітинах LNCaP-Ner). Див. приклад 4. Фігура 8В є графіком, що показує, що єдине введення дози гуманізованого анти-STЕАР1-антитіла 120v.24-MC-vc-PAB-MMAE (3 мг/кг), 120v.24-MC-MMAF (6 мг/кг), 120v.24-MC-MMAF (12 мг/кг) і химерного анти-STЕАР-1-антитіла 120 chimera-MC-vc-PAB-MMAE (3 мг/кг) є ефективним у моделі ксенотрансплантату клітин LNCaР передміхурової залози. Див. приклад 4. Фігура 9 є графіком, що показує, що введення анти-STEAP-1-антитіла 120 chimera-MC-vc-PABMMAE (що скорочується як анти-STEAP-vcMMAE) при 3 мг/кг або анти-STEAP-1-антитіла 120 chimera-MC-MMAF (що скорочується як антиSTEAP-mcMMAF) при 6 мг/кг, є ефективним у моделі ксенотрансплантату раку передміхурової залози кастрованих SCID-бежевих мишей (з уродженою відсутністю природних клітин-кілерів), трансплантованих клітинами LNCaP. Див. приклад 4. Фігура 10 є графіком, що показує, що введення анти-STEAP-1-антитіла 120 chimera-MC-vc-PABMMAE (що скорочується як анти-STEAP-vcMMAE (при 3 мг/кг) є ефективним у моделі ксенотрансплантату раку передміхурової залози самців SCIDбежевих мишей (з уродженою відсутністю природних клітин-кілерів) (андроген-залежних), трансплантованих клітинами LuCap 77. Див. приклад 4. Фігура 11 є графіком, що показує, що введення гуманізованого анти-STEAP-1-антитіла 120v.24MC-vc-PAB-MMAE при 3 мг/кг, гуманізованого анти-STEAP-1-антитіла 120v.24-MC-MMAF при 6 49 мг/кг і 12 мг/кг кастрованим SCID-бежевим мишам (з уродженою відсутністю природних клітинкілерів) (андроген-залежним), трансплантованим пухлиною передміхурової залози LuCap35V, є ефективним щодо контролів. Див. приклад 4. Фігура 12 є діаграмою, що зображує STEAP-1, що міститься у клітинній мембрані. Зв'язування анти-STEAP-1-антитіла 120 залежить від конформації і не впізнає лінійний епітоп STEAP-1 (пептид, описаний как SEQ ID NO:102). Фігури 13A-13D показують STEAP-1, що експресується на поверхні клітин, детектований імуногістохімією. Фігура 13А показує імуногістохімічне фарбування клітин 293, експресуючих екзогенний STEAP-1 на клітинній поверхні. Фігура 13В показує імунохімічне фарбування клітин РС3, експресуючих екзогенний STEAP-1 на клітинній поверхні. Фігура 13С показує імуногістохімічне фарбування клітин LNCa, експресуючих ендогенний STEAP-1 на клітинній поверхні. Фігура 13D показує імуногістохімічне фарбування клітин LuCAP 77, експресуючих ендогенний STEAP-1 на клітинній поверхні. Фігури 14А-14Е є графіками, що показують відносну ефективність анти-STEAP-1-антитіла 120v.24-MCMMAF і анти-STEAP-1антитіла 120v.24MC-vc-РАВ-ММАЕ для знищення STEAP-1експресуючих клітин in vitro. Клітини PS5.4 (фігура 14А) є клітинами РС3, трансформованими вектором, що кодує STEAP-1, так що STEAP-1 експресується на клітинній поверхні. Клітини LB50 (фігура 14В) є клітинами 293, трансформованими вектором, що кодує STEAP-1, так що STEAP-1 експресується на клітинній поверхні. Клітини LNCaP (фігура 14С) експресують STEAP-1 ендогенно. "РС3 vec" (фігура 14D) і "293 vec" (фігура 14Е) належать до клітин 293 і клітин РС3, відповідно, трансформованим контрольним вектором. Фігура 15 показує зображення цистеїнових сконструйованих кон'югатів анти-STEAP-1антитіло-лікарський засіб (ADC), у яких частина, що є лікарським засобом, приєднана до групи цистеїну, що знаходиться в: легкому ланцюзі (LCADC); важкому ланцюзі (НС-ADC) і Fc-районі (FcADC). Фігура 16 показує стадії: (і) відновлення аддуктів дисульфідів цистеїну і міжланцюжкових і внутрішньоланцюжкових дисульфідів у цистеїновому сконструйованому анти-STEAP-1-антитілі (ThioMab) агентом, що відновлює, ТСЕР (гідрохлоридом трис-(2-карбоксіетил)фосфіну); (іі) часткового окислювання, тобто повторного окислювання для повторного утворення міжланцюжкових і внутрішньоланцюжкових дисульфідів, за допомогою dhAA (дегідроаскорбінової кислоти) і (ііі) кон'югації повторно окисленого антитіла з проміжним продуктом лікарський засіб-лінкер з утворенням кон'югата цистеїн-вбудоване анти-STEAP-1-антитілолікарський засіб (ADC). Фігури 17А-С показують сайти амінокислотних замін, виконані для генерування цистеїнвбудованих анти-STEAP-1-антитіл (thio-mAb). Фігура 17А показує тіо-Lc-варіант V205C з відповідною послідовною нумерацією і стандартизованою нумерацією відповідно до системи Кабата (SEQ ID NO:103-113, відповідно, в порядку виникнення). 94628 50 Фігура 17В показує тіо-НС-варіант A118 з відповідною послідовною нумерацією і стандартизованою нумерацією відповідно до системи EU (SEQ ID NO:114-124, відповідно, в порядку виникнення). Фігура 17С показує Tio-Fc-варіант S400C з відповідною послідовною нумерацією і стандартизованою нумерацією відповідно до системи EU (SEQ ID NO:125-135, відповідно, в порядку виникнення). Фігури 18A-F зображують FACS-аналізи, що показують, що кон'югати анти-STEAP-1тіоантитіло-лікарський засіб (TDC) зберігають здатність зв'язування з STEAP-1, що експресується на клітинній поверхні. Фігури 18А-18С є FACSграфіками, що показують зв'язування FACS антиSTEAP-1-TDC thio-human120-vc-PAB-MMAE (LCV205C) (що скорочується як huSteap1 TDC (L205C) vc і thio-human120-vc-PAB-MMAE (HCA118C) (що скорочується як huSteap1 TDC (HCA118C) vc) з STEAP-1 людини, що експресується на клітинній поверхні. Екзогенний STEAP-1 стабільно експресувався в клітинах 293 (які називаються клітинами LB50) і клітинах PC3 (які називаються клітинами PS5.4) (Фігури 18А і 18В), і ендогенно експресувався в клітинах LNCaР BR (Фігура 18С). Фігури 18D, 18E і 18F є зіставленнями FACS-зсувів, показаних на фігурах 7А, 7В и 7С, відповідно. Фігури 19A-C показують відносну ефективність кон„югатів анти-STЕАР-1-тіоантитіло-лікарський засіб (TDC) thio-humanl20-vc-P AB-MMAE (LCV205C) (що скорочується як huSteap1 TDC (L205C) vc) і thio-humanl20-vc-PAB-MMAE (HCA118C) (що скорочується як huSteap1 TDC (HCA118C) vc) для знищення STEAP-1експресуючих клітин in vitro. Клітини LB50 (фігура 19А) є клітинами 293, трансформованими вектором, що кодує STEAP-1, так що STEAP-1 експресується на клітинній поверхні. Клітини PS5.4 (фігура 19В) є клітинами PC3, трансформованими вектором, що кодує STEAP-1, так що STEAP-1 експресується на клітинній поверхні. Клітини LNCaР (фігура 19С) експресують STEAP-1 ендогенно. Фігура 20 є графіком, що показує, що введення анти-STEAP-1-TDC thio-humanl20-vc-PAB-MMAE (HCA118C) (що скорочується як hu Steap1 HC TDC vc) при 3 мг/кг є ефективним щодо контролів у моделі ксенотрансплантату раку передміхурової залози самців SCID-бежевих мишей (з уродженою відсутністю природних клітин-кілерів) (андрогензалежних), трансплантованих клітинами LNCaР. Див. приклад 8. Фігура 21 є графіком, що показує, що введення анти-STEAP-1-TDC thio-human120-vc-PAB-MMAE (HCA118C) (що скорочується як hu Steap1 HC TDC vc) при 3 мг/кг або thio-human120-MC-MMAF (HCA118C) (що скорочується як hu Steap1 HC TDC mc) при 1, 3 або 6 мг/кг, є ефективним щодо контролів у моделі ксенотрансплантату раку передміхурової залози самців SCID-бежевих мишей (з уродженою відсутністю природних клітин-кілерів) (андроген-залежних), трансплантованих клітинами LNCaР. Див. приклад 8. Фігура 22 є графіком, що показує, що введення анти-STEAP-1-TDC thio-human120-vc-PAB-MMAE 51 (HCA118C) (що скорочується як hu Steapl НС TDC vc) при 3 мг/кг або thio-human120-MC-MMAF (HCA125C) (що скорочується як hu Steapl НС TDC me) при 3 або 6 мг/кг, є ефективним щодо контролів у моделі ксенотрансплантату раку передміхурової залози кастрованих SCID-бежевих мишей (з уродженою відсутністю природних клітин-кілерів), трансплантованих пухлиною LuCaP 35V передміхурової залози. Див. приклад 8. Фігура 23 показує сайти амінокислотних замін, виконаних для генерування цистеїн-вбудованого анти-STEAP-1-антитіла (thio-mAb), названого "Simmons IV" або просто "SGIV". Амінокислотна послідовність легкого ланцюга SGIV (SEQ ID NO:90) показана в зіставленні з легким ланцюгом антитіла ти 120 (SEQ ID NO:5) і антитіла 120.v24 antibody (SEQ ID NO:91). Цей тіо-Lc-варіант SGIV з відповідною послідовною нумерацією і стандартизованою нумерацією відповідно до системи Кабата показаний у зіставленні з вихідним антитілом ти 120, а також тіо-Lc-варіантом 12O.v24 з відповідною послідовною нумерацією і стандартизованою нумерацією відповідно до системи. CDR укладені в бокси (CDR-L1, CDR-L2 і CDR-L3). Послідовності, що оточують ці CDR, є каркасними послідовностями (FR-L1-FR-L4). Ці послідовності пронумеровані відповідно до нумерації Кабата. Кабат, Хотіа і контактні CDR зазначені біля укладених у бокси CDR. Див. приклад 9. Фігура 24 показує сайти каркасних амінокислотних замін, виконаних для генерування різних варіантів цистеїн-вбудованих анти-STEAP-1 антитіл (thio-mAb), антитіл SGIV і 120v.24. Амінокислотна послідовність легкого ланцюга SGIV (SEQ ID NO:136) зі стандартизованою нумерацією відповідно до нумерації Кабата показана в зіставленні з варіантами LS.VLVH1 (SEQ ID NO:92); LS.VLVH2 (SEQ ID NO:93); LS.Q (SEQ ID NO:94) і LS.CH1 (SEQ ID NO:95). Амінокислотна послідовність легкого ланцюга 12O.v24 (SEQ ID NO:137) зі стандартизованою нумерацією відповідно до нумерації Кабата показана в зіставленні з варіантами ED.FW1 (SEQ ID NO:96); ED.FW2 (SEQ ID NO:97); ED.FW3 (SEQ ID NO:98); ED.all (SEQ ID NO:99); ED.Pro (SEQ ID NO:100) і ED.pl (SEQ ID NO:101). CDR укладені в бокси. Послідовності пронумеровані відповідно до нумерації Кабата. Див. приклад 9. Фігура 25 показує графіки Скетчарда зв'язування антитіл з STEAP-1, що експресується на поверхні клітин LNCaP.BR. Проби в двох повторностях вимірювали з використанням антитіла 120.v24 (фігури 25(A)-(D)) і SGIV-варіанта (фігури 25(E)-(H)). Див. приклад 9. Фігура 26 показує графіки Скетчарда зв'язування антитіл з STEAP-1, що експресується на поверхні клітин 293.LB50. Проби в двох повторностях вимірювали з використанням антитіла 120.v24 (фігури 25(A)-(D)) і SGIV-варіанта (фігури 26(E)(H)). Див. приклад 9. Фігура 27 є таблицею, що порівнює середні афінності зв'язування, обмірювані аналізом Скетчарда, для антитіл mu 1789, mu 120, Fc-химерного антитіла, гуманізованого антитіла 120.v24, thio120.v24 і thio-SGIV у клітинах PC-3-PS5.4, 293 94628 52 LB50 і LNCaP-BR, а також у клітинах 293, транзиторно експресуючих STEAP-1. Див. приклад 9. Фігура 28 зображує FACS-аналіз, що показує FACS-зсуви на клітинах, стабільно трансфікованих STEAP-1 (293 STEAP-1 LB48, 293 STEAP-1 LB50 і 293 STEAP-1 LB53), із пробами антитіл SGIV і 120.v24. Див. приклад 9. Фігура 29 показує титр антитіл, що спостерігається в різних зборах із клітин, що продукують антитіло SGIV або 120.v24. Забезпечено виділені антитіла, що зв'язуються з STEAP-1. Крім того, забезпечені імунокон„югати, що містять анти-STЕАР-1-антитіла. Антитіла і імунокон„югати відповідно до винаходу застосовні, наприклад, для діагностики або лікування порушень, асоційованих зі зміненою експресією, наприклад, збільшеною експресією, STEAP-1. У деяких варіантах здійснення, антитіла і імунокон„югати відповідно до винаходу застосовні для діагностики або лікування клітиннопроліферативного порушення, такого як пухлина або рак. У деяких варіантах здійснення, STEAP-1 експресується в пухлині або раковій пухлині тканини передміхурової залози, легені або ободової кишки. У деяких варіантах здійснення, антитіла або імунокон„югати відповідно до винаходу застосовні для детектування експресії STEAP-1 на поверхні нормальних і/або пухлинних або ракових клітин тканин передміхурової залози, легені або ободової кишки. Забезпечені полінуклеотиди, що кодують антиSTЕАР-1-антитіла. Забезпечено вектори, що містять полінуклеотиди, що кодують анти-STЕАР-1антитіла, і забезпечені клітини-хазяї, що містять такі вектори. Забезпечені також композиції, у тому числі фармацевтичні композиції, що містять будьякі один або декілька з цих полінуклеотидів, антиSTЕАР-1-антитіл або імунокон„югатів відповідно до винаходу. Забезпечено способи лікування клітиннопроліферативного порушення, що включає в себе, але не обмежуваного ними, пухлину або рак, антиSTEAP-антитілом, кон„югатом антитіло-лікарський засіб або імунокон„югатом. Такі способи містять у собі, але не обмежуються ними, лікування пухлини або раку передміхурової залози, легені або ободової кишки ссавця. Забезпечено способи детектування експресії STEAP-1 у клітині тканини з використанням анти-STEAP-1-антитіла, кон„югата антитіло-лікарський засіб або імунокон„югата. Такі способи містять у собі, але не обмежуються ними, детектування експресії STEAP-1, як не обмежуючий приклад, на нормальній клітині, пухлинній клітині або раковій клітині передміхурової залози, легені або ободової кишки. Загальні способи Способи і процедури, описані або цитовані тут, звичайно цілком зрозумілі і звичайно застосовуються з використанням загальноприйнятої методології кваліфікованими в даній галузі фахівцями, такі як, наприклад, широко використовувані методології, описані в Sambrook et al., Molecular Cloning: A Laboratory Manual 3rd, edition (2001) Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N. Y.; Current Protocols in Molecular Biology 53 (F. M. Ausubel, et al. eds., (2003)); the series Methods in Enzymology (Academic Press, Inc.): Рсr 2: A Practical Approach (M. J. MacPherson, B. D. Hames and G. R. Taylor eds. (1995)), Harlow and Lane, eds. (1988) Antibodies, A Laboratory Manual, and Animal Cell Culture (R. I. Freshney, ed. (1987)); Oligonucleotide Synthesis (M. J. Gait, ed., 1984); Methods in Molecular Biology, Humana Press; Cell Biology: A Laboratory Notebook (J. E. Cellis, ed., 1998) Academic Press; Animal Cell Culture (R. I. Freshney), ed., 1987); Introduction to Cell and Tissue Culture (J. P. Mather and P. E. Roberts, 1998) Plenum Press; Cell and Tissue Culture: Laboratory Procedures (A. Doyle, J. B. Griffiths, and D. G. Newell, eds., 1993-8) J. Wiley and Sons; Handbook of Experimental Immunology (D. M. Weir and C. C. Blackwell, eds.); Gene Transfer Vectors for Mammalian Cells (J. M. Miller and M. P. Calos, eds., 1987); PCR: The Polymerase Chain Reaction, (Mullis et al., eds., 1994); Current Protocols in Immunology (J. E. Coligan et al., eds., 1991); Short Protocols in Molecular Biology (Wiley and Sons, 1999); Immunobiology (C. A. Janeway and P. Travers, 1997); Antibodies (P. Finch, 1997); Antibodies: A Practical Approach (D. Catty., ed., IRL Press, 19881989); Monoclonal Antibodies: A Practical Approach (P. Shepherd and C. Dean, eds., Oxford University Press, 2000); Using Antibodies: A Laboratory Manual (E. Harlow and D. Lane (Cold Spring Harbor Laboratory Press, 1999); The Antibodies (M. Zanetti and J. D. Capra, eds., Harwood Academic Publishers, 1995); and Cancer: Principles and Practice of Oncology (V. T. De Vita et al., eds., J. B. Lippincott Company, 1993). Визначення й абревіатури Визначення “Виділеним" антитілом є антитіло, що було ідентифіковано і відділене або витягнуте з компонента його природного оточення. Забруднюючі компоненти його природного оточення є речовинами, що можуть перешкоджати дослідженню, діагностичним або терапевтичним застосуванням цього антитіла і можуть містити в собі ферменти, гормони й інші білкові або небілкові розчинені речовини. У деяких варіантах здійснення, антитіло очищають (1) до більш ніж 95 мас. % антитіла, як визначено, наприклад, за допомогою методу Лоурі, і, у деяких варіантах здійснення, до більш ніж 99 мас. %; (2) до міри, достатньої для одержання щонайменше 15 залишків або N-кінця внутрішньої амінокислотної послідовності, з використанням наприклад, секвенатора з обертовою чашею, або (3) до гомогенності за допомогою електрофорезу в ДСН-ПААГ при відновлювальних або невідновлювальних умовах з використанням, наприклад, барвника Кумасі або барвника, що містить срібло. Виділене антитіло містить у собі антитіло in situ у рекомбінантних клітинах, тому що щонайменше один з компонентів природного оточення антитіла не буде присутній. Однак, звичайно виділене антитіло одержують з використанням щонайменше однієї стадії очищення. “Виділеною молекулою нуклеїнової кислоти” є молекула нуклеїнової кислоти, що відділена щонайменше від однієї іншої молекули нуклеїнової 94628 54 кислоти, з якою вона звичайно асоційована, наприклад, у її природному оточенні. Крім того, виділена молекула нуклеїнової кислоти містить у собі молекулу нуклеїнової кислоти, що міститься в клітинах, що звичайно експресують цю молекулу нуклеїнової кислоти, але ця молекула нуклеїнової кислоти присутня позахромосомно або в хромосомному місці розташування, що відрізняється від її природного хромосомного місця розташування. “Очищена” означає, що молекула присутня в пробі в концентрації щонайменше 95 мас. % або щонайменше 98 мас. % у розрахунку на пробу, у якій вона міститься. Термін “власне кажучи однакова” або “власне кажучи така ж” означає в даному контексті досить високу міру подібності між двома чисельними величинами (наприклад, однієї, асоційованої з антитілом відповідно до винаходу, і іншої, асоційованої з посилальним/порівняльним антитілом), так що кваліфікований у даній галузі фахівець може вважати, що розходження між цими двома величинами є малим або не має біологічної і/або статистичної значимості, у контексті біологічної властивості, вимірюваної зазначеними величинами (наприклад, величинами KD). Це розходження між зазначеними двома величинами дорівнює, наприклад, менш приблизно 50%, менш приблизно 40%, менш приблизно 30%, менш приблизно 20% і/або менш приблизно 10% як функція посилальної/порівняльної величини. Фраза “істотно зменшена” або “істотно відрізняється” означає в даному контексті досить високу міру розходження між двома чисельними величинами (звичайно однієї, асоційованої з деякою молекулою, і іншої, асоційованої з посилальною/порівняльною молекулою), так що кваліфікований у даній галузі фахівець може вважати, що розходження між цими двома величинами є статистично значимим розходженням у контексті біологічної властивості, вимірюваної зазначеними величинами (наприклад, величинами KD). Це розходження між зазначеними двома величинами складає, наприклад, приблизно більш 10%, приблизно більш 20%, приблизно більш 30%, приблизно більш 40% і/або приблизно більш 50% як функції посилальної/порівняльної величини. Термін “вектор” стосується в даному контексті молекули нуклеїнової кислоти, здатної транспортувати іншу нуклеїнову кислоту, з якою він був зв'язаний. Одним типом вектора є “плазміда”, що є кільцевою двохланцюжковою ДНК, у яку можуть бути ліговані додаткові ДНК-сегменти. Іншим типом вектора є фаговий вектор. Іншим типом вектора є вірусний вектор, у якому додаткові ДНКсегменти можуть бути ліговані у вірусний геном. Деякі вектори здатні до реплікації в клітині-хазяїні, у яку вони введені (наприклад, бактеріальні вектори, що мають бактеріальний сайт ініціації реплікації, і епісомні вектори ссавців). Інші вектори (наприклад, неепісомні вектори ссавців) можуть бути інтегровані в геном клітини-хазяїна після введення в клітину-хазяїна і за допомогою цього реплікуватися разом з геномом хазяїна. Крім того, деякі вектори здатні керувати експресією генів, з якими вони функціонально зв'язані. Такі вектори назива 55 ють тут «рекомбінантними експресуючими векторами» або просто «експресуючими векторами». Звичайно, експресуючі вектори, використовувані в способах рекомбінантних ДНК, знаходяться часто у формі плазмід. У даному описі, «плазміда» або «вектор» можуть використовуватися взаємозамінно, тому що плазміда є найбільш часто використовуваною формою вектора. “Полінуклеотид” або “нуклеїнова кислота”, використовувані взаємозамінно тут, означає полімери нуклеотидів будь-якої довжини, і містять у собі ДНК і РНК. Ці нуклеотиди можуть бути дезоксирибонуклеотидами, рибонуклеотидами, модифікованими нуклеотидами або основами і/або їх аналогами або будь-яким субстратом, що може бути включений у полімер ДНК- або РНК-полімеразою або синтетичною реакцією. Полінуклеотид може містити модифіковані нуклеотиди, такі як метиовані нуклеотиди і їхні аналоги. Якщо є присутньою модифікація у відношенні нуклеотидної структури, вона може вироблятися до або після зборки цього полімеру. Послідовність нуклеотидів може перериватися ненуклеотидними компонентами. Полінуклеотид може містити модифікацію (модифікації), зроблені після синтезу, наприклад, кон'югацію з міткою. Інші типи модифікацій містять у собі, наприклад, «кепи», заміну одного або декількох що природних нуклеотидів аналогом, міжнуклеотидні модифікації, такі як модифікації з незарядженими зв'язками (наприклад, метилфосфонати, фосфоефіри, фосфоамідати, карбамати і т.д.) і з зарядженими зв'язками (наприклад, фосфоротіоати, фосфородитіоати і т.д.), модифікації, що містять бічні ланцюги, такі як, наприклад, білки (наприклад, нуклеази, токсини, антитіла, сигнальні пептиди, поло-L-лізин і т.д.), модифікації з інтеркаляторами (наприклад, акридином, псораленом і т.д.), модифікації, що містять хелатори (наприклад, метали, радіоактивні метали, бор, окисні метали і т.д.), модифікації, що містять алкілуючі агенти, модифікації з модифікованими зв'язками (наприклад, альфа-аномерні нуклеїнові кислоти і т.д.), а також немодифіковані форми полінуклеотиду (полінуклеотидів). Крім того, кожна з гідроксильних груп, що звичайно є присутньою у цукрах, може бути замінена, наприклад, фосфонатними групами, фосфатними групами, захищена стандартними захисними групами або активована для одержання додаткових зв'язків з додатковими нуклеотидами або може бути кон„югована з твердими або напівтвердими носіями. 5‟- і 3‟-кінцеві ОН можуть бути фосфориловані або замінені аміногрупами або органічними кепуючими групами з 1-20 атомів вуглецю. Інші гідроксили можуть бути також дериватізовані стандартними захисними групами. Полінуклеотиди можуть також містити аналогові форми цукрів рибози або дезоксирибози, що звичайно відомі в даній галузі, у тому числі, наприклад, 2‟-Ометил-, 2‟-О-аліл-, 2‟-фтор- або 2‟-азидорибозу, карбоциклічні аналоги цукрів, -аномерні цукри, епімерні цукри, такі як арабіноза, ксилози або ліксози, піранозні цукри, фуранозні цукри, седогептулози, ациклічні аналоги й основні нуклеозидні аналоги, такі як метилрибоза. Один або декілька фосфодіефірних зв'язків можуть бути замінені 94628 56 альтернативними зв„язувальними групами. Ці альтернативні зв„язувальні групи містять у собі, але не обмежуються ними, варіанти, у яких фосфат замінений P(O)S (“тіоатом”), P(S)S (“дитіоатом”), (O)NR2 (“амідатом”), P(O)R, P(O)OR', CO або CH2 (“формацеталем”), у яких кожен R або R' означає незалежно H або заміщений або незаміщений алкіл (1-20 C), необов'язково містить простий ефірний зв'язок (-O-), арил, алкеніл, циклоалкил, циклоалкеніл або аралкил. Не всі зв'язки в полінуклеотиді повинні бути ідентичними. Попередній опис застосовний до всіх згадуваних тут полінуклеотидів, що включає в себе РНК і ДНК. “Олігонуклеотид” означає звичайно в даному контексті короткі, звичайно одноланцюжкові, звичайно синтетичні полінуклеотиди, що звичайно, але не обов'язково, мають довжину приблизно 200 нуклеотидів. Терміни “олігонуклеотид” і “полінуклеотид” не є взаємовиключними. Попередній опис для полінуклеотидів так само і цілком застосовний до олігонуклеотидів. “Процентна (%) ідентичність амінокислотної послідовності” у відношенні посилальної поліпептидної послідовності визначається як відсоток амінокислотних залишків у кандидатній послідовності, що ідентичні з амінокислотними залишками в посилальній поліпептидній послідовності, після зіставлення цих послідовностей і введення «гепів», якщо необхідно, для досягнення максимальної процентної ідентичності послідовності, без обліку консервативних замін як частини ідентичності цієї послідовності. Зіставлення для цілей визначення процентної ідентичності амінокислотної послідовності може досягатися різними способами, що знаходяться в рамках кваліфікації в даній галузі, наприклад, з використанням загально доступного комп'ютерного програмного забезпечення, такого як програми BLAST, BLAST-2, ALIGN або Megalign (DNASTAR). Кваліфіковані в даній галузі фахівці можуть визначити придатні параметри для зіставлення послідовностей, у тому числі будь-які алгоритми, необхідні для одержання максимального зіставлення протягом повної довжини порівнюваних послідовностей. Однак, для цих цілей величини % ідентичності амінокислотної послідовності генерують з використанням комп'ютерної програми для порівняння послідовностей ALIGN-2. Автором комп'ютерної програми для порівняння послідовностей є Genentech, Inc., і вихідний код програми був введений з документацією користувача в U.S. Copyright Office, Washington D. C, 20559, де він був зареєстрований під U.S. Copyright Registration No. TXU510087. Ця програма ALIGN-2 загально доступна з Genentech, Inc., South San Francisco, California, або може бути компілована з вихідного коду. Програма ALIGN-2 повинна компілюватися для застосування на операційній системі UNIX, переважно цифровій UNIX V4.0D. Усі параметри порівняння встановлюються програмою ALIGN-2 і не варіюються. У ситуаціях, коли ALIGN-2 використовується для порівняння амінокислотних послідовностей, цю %-у ідентичність конкретної амінокислотної послідовності А щодо конкретної амінокислотної послідовності В, з конкретною амінокислотною 57 послідовністю В або проти конкретної амінокислотної послідовності В (що може бути альтернативно перефразоване як конкретна амінокислотна послідовність А, що має або містить деяку % ідентичність амінокислотної послідовності щодо конкретної амінокислотної послідовності В, з конкретною амінокислотною послідовністю В або проти конкретної амінокислотної послідовністі В) розраховують у такий спосіб: 100 × X/Y, де Х означає кількість амінокислотних залишків, оцінених як ідентичні збіги програмою зіставлення послідовностей ALIGN-2 у зіставленні цією програмою А і В, і де Y означає загальну кількість амінокислотних залишків у В. Повинно бути зрозуміло, що, коли довжина амінокислотної послідовності А не дорівнює довжині амінокислотної послідовності В, %-а ідентичність амінокислотної послідовності А відносно В не буде дорівнює %-ій ідентичності амінокислотної послідовності В відносно А. Якщо немає інших вказівок, усі величини %ої ідентичності амінокислотних послідовностей, використовувані тут, одержані, як описано в безпосередньо попередньому абзаці, з використанням комп'ютерної програми ALIGN-2. Термін “STEAP-1” стосується в даному контексті будь-якого нативного STEAP-1 з будь-якої хребетної тварини, що включає в себе ссавців, таких як примати (наприклад, люди, собакоподібна мавпа (cyno)) і гризуни (наприклад, миші і щури), якщо немає іншої вказівки. Цей термін містить у собі «повнорозмірний» непроцесований STEAP-1, а також будь-яку форму STEAP-1, що виникає з процесинга в клітині. Цей термін містить у собі також природні варіанти STEAP-1, наприклад, сплайсингові варіанти, алельні варіанти і ізоформи. Амінокислотна послідовність STEAP-1 людини зображена на фігурі 1 (SEQ ID NO:1). В одному варіанті здійснення, STEAP-1 експресується на клітинній поверхні, наприклад, на поверхні нормальних клітин передміхурової залози, легені або ободової кишки і має збільшену експресію в ракових клітинах передміхурової залози, легені або ободової кишки або метастазах таких ракових клітин. Фігура 1 зображує також амінокислотну послідовність STEAP-1 з миші і собакоподібної мавпи (SEQ ID NO:2 і 3, відповідно). “Антитіла” (Ab) і “імуноглобуліни” (Ig) є глікопротеїнами, що мають подібні структурні характеристики. У той час як антитіла виявляють специфічність зв'язування у відношенні конкретного антигену, імуноглобуліни містять у собі як антитіла, так і інші антитіло-подібні молекули, що звичайно позбавлені антигенної специфічності. Поліпептиди останнього типу продукуються, наприклад, при низьких рівнях лімфатичною системою і при збільшених рівнях мієломами. Терміни “антитіло” і “імуноглобулін” використовуються взаємозамінно в самому широкому змісті і містять у собі моноклональні антитіла (наприклад, повнорозмірні або інтактні моноклональні антитіла), поліклональні антитіла, моновалентні антитіла, мультиспецифічні антитіла (наприклад, біспецифічні антитіла, поки вони виявляють бажану біологічну активність) і можуть також містити в 94628 58 собі деякі фрагменти антитіл (як описано більш докладно тут). Антитіло може бути химерним антитілом, антитілом людини, гуманізованим антитілом і/або афінно зрілим антитілом. Термін “анти-STЕАР-1-антитіло” або “антитіло, що зв'язується з STEAP-1”, стосується антитіла, що здатно зв'язувати STEAP-1 з достатньою афінністю, так що це антитіло застосовне як діагностичний і/або терапевтичний агент в націлюванні на STEAP-1. Переважно, міра зв'язування антиSTЕАР-1-антитіла з неспорідненим білком, що не є білком STEAP-1, складає приблизно менше 10% зв'язування цього антитіла з STEAP-1, як обмірювано, наприклад, радіоімуноаналізом (RIA). У деяких варіантах здійснення, антитіло, що зв'язується з STEAP-1, має константу дисоціації (Kd) (1 мкМ, 100 нМ, 10 нМ, 1 нМ або 0,1 нМ. У деяких варіантах здійснення, анти-STЕАР-1-антитіло зв'язується з епітопом STEAP-1, що є консервативним серед STEAP-1 з різних видів. Термін “варіабельна область” або “варіабельний домен” антитіла стосується аміно-кінцевих доменів важкого або легкого ланцюга цього антитіла. Варіабельний домен важкого ланцюга може називатися “VH”. Варіабельний домен легкого ланцюга може називатися “VL”. Ці домени є звичайно найбільш варіабельними частинами антитіла і містять антигензв„язувальні сайти. Термін «варіабельні» стосується того факту, що визначені частини варіабельних доменів сильно відрізняються по послідовності серед антитіл і використовуються в зв'язуванні і специфічності кожного конкретного антитіла у відношенні його конкретного антигену. Однак, ця варіабельність розподілена нерівномірно протягом варіабельних доменів антитіл. Вона сконцентрована в трьох сегментах, які називаються визначальними комплементарність районами (CDR) або гіперваріабельними районами (HVR), у варіабельних доменах як легкого ланцюга, так і важкого ланцюга. Більш високо консервативні частини варіабельних доменів називають каркасними районами (областями) (FR). Варіабельні домени нативних важкого і легкого ланцюгів, кожний, містять чотири FR-області, у значній мірі приймаючі конфігурацію бета-шару, з'єднані трьома CDR, що утворюють петлі, які з'єднують цю структуру бета-складчастого бішару або, у деяких випадках утворюючі частину цієї структури бета-складчастого бішіру. CDR у кожному ланцюзі утримуються разом у тісній близькості цими FR-областями, причому CDR з іншого ланцюга сприяє утворенню антигензв„язувального сайта антитіл (див. Kabat et al., Sequences of Proteins of Immunological Interest, Fifth Edition, National Institute of Health, Bethesda, MD (1991)). Константні домени не беруть участь безпосередньо в зв'язуванні антитіла з антигеном, але виявляють різні ефекторні функції, такі як участь антитіла в антитілозалежній клітинній токсичності. “Легкі ланцюги” антитіл (імуноглобулінів) з будь-якого виду хребетних можуть бути віднесені в одному з двох ясно різних типів, що називаються каппа () і лямбда (), на основі амінокислотних послідовностей їхній константних доменів. 59 У залежності від амінокислотних послідовностей константних доменів їхніх важких ланцюгів, антитіла (імуноглобуліни) можуть бути віднесені до різних класів. Маються п'ять основних класів імуноглобулінів: IgA, IgD, IgE, IgG і IgM, і деякі з них можуть бути додатково підрозділені на підкласи (ізотипи), наприклад, IgG1, IgG2, IgG3, IgG4, IgA1 і IgA2. Константні домени важких ланцюгів, що відповідають цим різним класам імуноглобулінів, названі α, δ, ε, і μ, відповідно. Структури субодиниць і тривимірні кофігурації різних класів імуноглобулінів добре відомі й описані в загальному вигляді, наприклад, у Abbas et al. Cellular and Mol. Immunology, 4th ed. (2000). Антитіло може бути частиною більшої злитої молекули, утвореною ковалентною або нековалентною асоціацією цього антитіла з одним або декількома іншими білками або пептидами. Терміни “повнорозмірне антитіло”, “інтактне антитіло” і “повне антитіло” використовуються тут взаємозамінно у відношенні антитіла в його власне кажучи інтактній формі, не у вигляді фрагментів антитіл, визначених нижче. Ці терміни стосуються, зокрема, антитіла з важкими ланцюгами, що містять Fc-район. “Фрагменти антитіл” містять тільки частину інтактного антитіла, причому ця частина зберігає щонайменше одну функцію або більшість функцій або усі функції інтактного антитіла і, отже, зберігає здатність зв'язування антигену. В іншому варіанті здійснення, фрагмент антитіла, наприклад, фрагмент, що містить Fc-район, зберігає щонайменше одну з біологічних функцій, звичайно асоційованих з Fc-районом, коли він присутній в інтактному антитілі, таких як FcRn-зв'язування, модуляція часу напівжиття антитіла (in vivo), ADCC-функція і зв'язування комплементу. В одному варіанті здійснення, фрагментом антитіла є моновалентне антитіло, що має час напівжиття in vivo, власне кажучи таке ж, що і час напівжиття інтактного антитіла. Наприклад, такий фрагмент антитіла може містити антигенів„язувальне плече, зв'язане з Fcпослідовністю, здатне додавати цьому фрагменту стабільність in vivo. Розщеплення антитіл папаїном робить два ідентичних антигензв„язувальних фрагменти, які називаються фрагментами “Fab", кожний з який має єдиний антигензв„язувальний сайт, і залишковий фрагмент “Fc”, назва якого відбиває його здатність легко кристалізуватися. Обробка пепсином робить фрагмент F(ab‟)2, що має два антигензв„язувальних сайта й усе ще здатний зшивати антиген. “Fv” є мінімальним фрагментом антитіла, що містить повний антигензв„язувальний сайт. В одному варіанті здійснення, двохланцюжковий різновид Fv складається з димера одного варіабельного домену важкого ланцюга й одного варіабельного домену легкого ланцюга в тісній, нековалентній асоціації. В одноланцюжкового різновиду Fv (scFv), один варіабельний домен важкого ланцюга й один варіабельний домен легкого ланцюга можуть бути ковалентно зв'язані гнучким пептидним лінкером, так що легкий і важкий ланцюги можуть асоціюватися в «димерній» структурі, 94628 60 аналогічній структурі в двохланцюжковому різновиді Fv. Саме в цій конфігурації три CDR кожного варіабельного домену взаємодіють, визначаючи антигензв„язувальний сайт на поверхні цього димера VH-VL. Разом, ці шість CDR додають антигензв„язувальну специфічність цьому антитілу. Однак, навіть єдиний варіабельний домен (або половина Fv, що містить тільки три CDR, специфічних у відношенні антигену) має здатність впізнавати і зв'язувати антиген, хоча і з більш низькою афінністю, ніж повний сайт зв'язування. Фрагмент Fab містить варіабельні домени важкого і легкого ланцюга і також містить константний домен легкого ланцюга і перший константний домен (СН1) важкого ланцюга. Фрагменти Fab‟ відрізняються від фрагментів Fab додаванням декількох залишків на карбокси-кінці СН1-домену важкого ланцюга, у тому числі одного або декількох цистеїнів із шарнірної області антитіла. Fаb'SH означає тут Fab‟, у якому залишок (залишки) цистеїну константних доменів несуть вільну тіолову групу. Фрагменти F(ab‟)2 антитіла спочатку продукуються у вигляді пар фрагментів Fab‟, що мають цистеїни шарнірної області між ними. Відомі також інші хімічні зчеплення фрагментів антитіл. “Одноланцюжкові Fv” або фрагменти “scFv” антитіла містять домени VH і VL антитіла, причому ці домени присутні в одноланцюжковому поліпептидному ланцюзі. Звичайно, цей поліпептид scFv додатково містить поліпептидний лінкер між доменами VH і VL, що дозволяє scFv утворювати бажану структуру для зв'язування антигену. У відношенні огляду scFv див. Pluckthun, in The Pharmacology of Monoclonal Antibodies, vol. 113, Rosenburg and Moore eds., Springer-Verlag, New York, pp. 269-315 (1994). Термін “діатіла" стосується малих фрагментів антитіл із двома антигензв„язувальними сайтами, причому ці фрагменти містять варіабельний домен важкого ланцюга (VH), з'єднаний з варіабельним доменом легкого ланцюга (VL) в одному і тому ж поліпептидному ланцюзі (VH-VL). З використанням лінкера, що є занадто коротким для дозволу спарювання між цими двома доменами на одному і тому ж ланцюзі, ці домени спонукються до спарювання з комплементарними доменами іншого ланцюга і створюють два антигензв„язувальних сайта. Діатіла можуть бути бівалентними або біспецифічними. Діатіла описані більш повно, наприклад, у EP 404,097; WO93/1161; Hudson et al. (2003) Nat. Med. 9: 129-134; and Hollinger et al., Proc. Natl. Acad. Sci. USA 90: 6444-6448 (1993). Триатіла і тетратіла описані також у Hudson et al. (2003) Nat. Med. 9: 129-134. Термін “моноклональне антитіло” стосується в даному контексті антитіла, одержаного з популяції власно кажучи гомогенних антитіл, тобто індивідуальні антитіла, що складають цю популяцію, є ідентичними, за винятком можливих мутацій, наприклад, природних мутацій, що можуть бути присутніми у мінорних кількостях. Таким чином, визначення «моноклональні» указує природу цього антитіла як такого, що не є сумішшю різних антитіл. У деяких варіантах здійснення, таке моноклональне антитіло звичайно містить у собі антитіло,
ДивитисяДодаткова інформація
Назва патенту англійськоюHumanized monoclonal antibody that binds to steap-1 and use thereof
Автори англійськоюDennis, Mark, S., Rubinfeld, Bonnee, Polakis, Paul, Jakobovits, Aya
Назва патенту російськоюГуманизированное моноклональное антитело, которое связывается с steap-1, и его применение
Автори російськоюДеннис Майкл С., Рубинфелд Бонни, Полакис Пол, Якобовиц Айя
МПК / Мітки
МПК: C12N 15/13, C07K 16/30, A61K 39/395, A61P 35/00
Мітки: зв'язується, гуманізоване, steap-1, застосування, антитіло, моноклональне
Код посилання
<a href="https://ua.patents.su/160-94628-gumanizovane-monoklonalne-antitilo-shho-zvyazuehtsya-z-steap-1-ta-jjogo-zastosuvannya.html" target="_blank" rel="follow" title="База патентів України">Гуманізоване моноклональне антитіло, що зв’язується з steap-1, та його застосування</a>
Попередній патент: Візок залізничного вагона з адаптером підшипника
Наступний патент: Спосіб електролітичного очищення стічних вод від органічних речовин
Випадковий патент: Спосіб виготовлення циліндричного зубчатого колеса