Профілактика або терапевтичне лікування інфекції, викликаної вірусом імунодефіциту людини
Номер патенту: 103880
Опубліковано: 10.12.2013
Автори: Раманатан Шрінівасан, Матіас Аніта А., Карні Брайан П.
Формула / Реферат
1. Застосування сполуки 6-(3-хлор-2-фторбензил)-1-[(2S)-1-гідрокси-3-метилбут-2-ил]-7-метоксі-4-оксо-1,4-дигідрохінолін-3-карбонової кислоти у кількості від 75 мг до 95 мг, від 125 мг до 175 мг, від 150 мг до 200 мг або від 250 мг до 350 мг або її фармацевтично прийнятної солі в одній дозованій формі та атазанавіру у кількості від 150 мг до 550 мг або його фармацевтично прийнятної солі в іншій дозованій формі для профілактики або терапевтичного лікування вірусу імунодефіциту людини (ВІЛ).
2. Застосування за п. 1, яке відрізняється тим, що людині вводять від 75 мг до 95 мг 6-(3-хлор-2-фторбензил)-1-[(2S)-1-гідрокси-3-метилбут-2-ил]-7-метоксі-4-оксо-1,4-дигідрохінолін-3-карбонової або її фармацевтично прийнятної солі.
3. Застосування за п. 1, яке відрізняється тим, що людині вводять від 125 мг до 175 мг 6-(3-хлор-2-фторбензил)-1-[(2S)-1-гідрокси-3-метилбут-2-ил]-7-метоксі-4-оксо-1,4-дигідрохінолін-3-карбонової кислоти або її фармацевтично прийнятної солі.
4. Застосування за п. 1, яке відрізняється тим, що людині вводять від 150 мг до 200 мг 6-(3-хлор-2-фторбензил)-1-[(2S)-1-гідрокси-3-метилбут-2-ил]-7-метоксі-4-оксо-1,4-дигідрохінолін-3-карбонової кислоти або її фармацевтично прийнятної солі.
5. Застосування за п. 1, яке відрізняється тим, що людині вводять від 250 мг до 350 мг 6-(3-хлор-2-фторбензил)-1-[(2S)-1-гідрокси-3-метилбут-2-ил]-7-метоксі-4-оксо-1,4-дигідрохінолін-3-карбонової кислоти або її фармацевтично прийнятної солі.
6. Застосування за будь-яким з пп. 1-5, яке відрізняється тим, що передбачає спільне введення 6-(3-хлор-2-фторбензил)-1-[(2S)-1-гідрокси-3-метилбут-2-ил]-7-метоксі-4-оксо-1,4-дигідрохінолін-3-карбонової кислоти або її фармацевтично прийнятної солі та атазанавіру або його фармацевтично прийнятної солі.
7. Застосування за будь-яким з пп. 1-5, яке відрізняється тим, що передбачає введення єдиної дозованої форми, що містить 6-(3-хлор-2-фторбензил)-1-[(2S)-1-гідрокси-3-метилбут-2-ил]-7-метоксі-4-оксо-1,4-дигідрохінолін-3-карбонову кислоту або її фармацевтично прийнятну сіль та атазанавір або його фармацевтично прийнятну сіль.
8. Застосування за будь-яким з пп. 1-7, яке додатково передбачає введення дозованої форми ритонавіру або його фармацевтично прийнятної солі.
9. Застосування за п. 8, яке відрізняється тим, що передбачає спільне введення 6-(3-хлор-2-фторбензил)-1-[(2S)-1-гідрокси-3-метилбут-2-ил]-7-метоксі-4-оксо-1,4-дигідрохінолін-3-карбонової кислоти або її фармацевтично прийнятної солі та ритонавіру або його фармацевтично прийнятної солі.
10. Застосування за п. 8, яке відрізняється тим, що передбачає введення єдиної дозованої форми, що містить 6-(3-хлор-2-фторбензил)-1-[(2S)-1-гідрокси-3-метилбут-2-ил]-7-метоксі-4-оксо-1,4-дигідрохінолін-3-карбонову кислоту або її фармацевтично прийнятну сіль та ритонавір або його фармацевтично прийнятну сіль.
11. Застосування за п. 8, яке відрізняється тим, що передбачає спільне введення атазанавіру або його фармацевтично прийнятної солі та ритонавіру або його фармацевтично прийнятної солі.
12. Застосування за п. 8, яке відрізняється тим, що передбачає введення єдиної дозованої форми, що містить атазанавір або його фармацевтично прийнятну сіль та ритонавір або його фармацевтично прийнятну сіль.
13. Застосування за будь-яким з пп. 1-12, яке відрізняється тим, що вводять від 150 мг до 450 мг атазанавіру або його фармацевтично прийнятної солі.
14. Застосування за будь-яким з пп. 1-12, яке відрізняється тим, що вводять від 250 мг до 550 мг атазанавіру або його фармацевтично прийнятної солі.
15. Застосування за будь-яким з пп. 8-14, яке відрізняється тим, що людині вводять від 50 мг до 150 мг ритонавіру або його фармацевтично прийнятної солі.
16. Застосування сполуки 6-(3-хлор-2-фторбензил)-1-[(2S)-1-гідрокси-3-метилбут-2-ил]-7-метоксі-4-оксо-1,4-дигідрохінолін-3-карбонової кислоти у дозованій формі, яка містить 85 мг цієї сполуки або її фармацевтично прийнятної солі, атазанавіру у дозованій формі, яка містить 300 мг атаназавіру або його фармацевтично прийнятної солі, ритонавіру у дозованій формі, яка містить 100 мг ритонавіру або його фармацевтично прийнятної солі, для профілактики або терапевтичного лікування вірусу імунодефіциту людини (ВІЛ).
17. Застосування за п. 16, яке відрізняється тим, що передбачає спільне введення 6-(3-хлор-2-фторбензил)-1-[(2S)-1-гідрокси-3-метилбут-2-ил]-7-метоксі-4-оксо-1,4-дигідрохінолін-3-карбонової кислоти або її фармацевтично прийнятної солі та атазанавіру або його фармацевтично прийнятної солі, ритонавіру або його фармацевтично прийнятної солі.
18. Композиція для профілактики або терапевтичного лікування вірусу імунодефіциту людини (ВІЛ), що містить 6-(3-хлор-2-фторбензил)-1-[(2S)-1-гідрокси-3-метилбут-2-ил]-7-метоксі-4-оксо-1,4-дигідрохінолін-3-карбонову кислоту у кількості від 75 мг до 95 мг, від 125 мг до 175 мг, від 150 мг до 200 мг або від 250 мг до 350 мг або її фармацевтично прийнятну сіль; атазанавір у кількості від 150 мг до 550 мг або його фармацевтично прийнятну сіль та фармацевтично прийнятний носій або розріджувач.
19. Композиція за п. 18, яка містить від 75 мг до 95 мг 6-(3-хлор-2-фторбензил)-1-[(2S)-1-гідрокси-3-метилбут-2-ил]-7-метоксі-4-оксо-1,4-дигідрохінолін-3-карбонової кислоти або її фармацевтично прийнятної солі.
20. Композиція за п. 18, яка містить від 125 мг до 175 мг 6-(3-хлор-2-фторбензил)-1-[(2S)-1-гідрокси-3-метилбут-2-ил]-7-метоксі-4-оксо-1,4-дигідрохінолін-3-карбонової кислоти або її фармацевтично прийнятної солі.
21. Композиція за п. 18, яка містить від 150 мг до 200 мг 6-(3-хлор-2-фторбензил)-1-[(2S)-1-гідрокси-3-метилбут-2-ил]-7-метоксі-4-оксо-1,4-дигідрохінолін-3-карбонової кислоти або її фармацевтично прийнятної солі.
22. Композиція за п. 18, яка містить від 250 мг до 350 мг 6-(3-хлор-2-фторбензил)-1-[(2S)-1-гідрокси-3-метилбут-2-ил]-7-метоксі-4-оксо-1,4-дигідрохінолін-3-карбонової кислоти або її фармацевтично прийнятної солі.
23. Композиція за п. 18, яка містить від 150 мг до 450 мг атазанавіру або його фармацевтично прийнятної солі.
24. Композиція за п. 18, яка містить від 250 мг до 550 мг атазанавіру або його фармацевтично прийнятної солі.
25. Композиція за будь-яким з пп. 18-24, яка додатково містить ритонавір або його фармацевтично прийнятну сіль.
26. Композиція за п. 25, яка містить від 50 мг до 150 мг ритонавіру або його фармацевтично прийнятної солі.
27. Композиція для профілактики або терапевтичного лікування вірусу імунодефіциту людини (ВІЛ), що містить 6-(3-хлор-2-фторбензил)-1-[(2S)-1-гідрокси-3-метилбут-2-ил]-7-метоксі-4-оксо-1,4-дигідрохінолін-3-карбонову кислоту у кількості 85 мг або її фармацевтично прийнятну сіль; атазанавір у кількості 300 мг або його фармацевтично прийнятну сіль; ритонавір у кількості 100 мг або його фармацевтично прийнятну сіль та фармацевтично прийнятний носій або розріджувач.
28. Набір для профілактики або терапевтичного лікування вірусу імунодефіциту людини (ВІЛ), який включає: (1) 6-(3-хлор-2-фторбензил)-1-[(2S)-1-гідрокси-3-метилбут-2-ил]-7-метоксі-4-оксо-1,4-дигідрохінолін-3-карбонову кислоту у кількості від 75 мг до 95 мг, від 125 мг до 175 мг, від 150 мг до 200 мг або від 250 мг до 350 мг або її фармацевтично прийнятну сіль; (2) атазанавір у кількості від 150 мг до 550 мг або його фармацевтично прийнятну сіль; та (3) один або більше контейнерів.
29. Набір за п. 28, який включає від 75 до 95 мг 6-(3-хлор-2-фторбензил)-1-[(2S)-1-гідрокси-3-метилбут-2-ил]-7-метоксі-4-оксо-1,4-дигідрохінолін-3-карбонової кислоти або її фармацевтично прийнятної солі.
30. Набір за п. 28, який включає від 125 до 175 мг 6-(3-хлор-2-фторбензил)-1-[(2S)-1-гідрокси-3-метилбут-2-ил]-7-метоксі-4-оксо-1,4-дигідрохінолін-3-карбонової кислоти або її фармацевтично прийнятної солі.
31. Набір за п. 28, який включає від 150 мг до 200 мг 6-(3-хлор-2-фторбензил)-1-[(2S)-1-гідрокси-3-метилбут-2-ил]-7-метоксі-4-оксо-1,4-дигідрохінолін-3-карбонової кислоти або її фармацевтично прийнятної солі.
32. Набір за п. 28, який включає від 250 мг до 350 мг 6-(3-хлор-2-фторбензил)-1-[(2S)-1-гідрокси-3-метилбут-2-ил]-7-метоксі-4-оксо-1,4-дигідрохінолін-3-карбонової кислоти або її фармацевтично прийнятної солі.
33. Набір за п. 28, який включає від 150 мг до 450 мг атазанавіру або його фармацевтично прийнятної солі.
34. Набір за п. 28, який включає від 250 мг до 550 мг атазанавіру або його фармацевтично прийнятної солі.
35. Набір за будь-яким з пп. 28-34, який додатково включає ритонавір або його фармацевтично прийнятну сіль.
36. Набір за п. 35, який включає від 50 мг до 150 мг ритонавіру або його фармацевтично прийнятної солі.
37. Набір для профілактики або терапевтичного лікування вірусу імунодефіциту людини (ВІЛ), який включає: (1) 6-(3-хлор-2-фторбензил)-1-[(2S)-1-гідрокси-3-метилбут-2-ил]-7-метоксі-4-оксо-1,4-дигідрохінолін-3-карбонову кислоту у дозованій формі, яка містить 85 мг цієї сполуки, або її фармацевтично прийнятну сіль; (2) атазанавір у дозованій формі, яка містить 300 мг атазанавіру, або його фармацевтично прийнятну сіль; (3) ритонавір у дозованій формі, яка містить 100 мг ритонавіру, або його фармацевтично прийнятну сіль; та (4) один або більше контейнерів.
38. Застосування 6-(3-хлор-2-фторбензил)-1-[(2S)-1-гідрокси-3-метилбут-2-ил]-7-метоксі-4-оксо-1,4-дигідрохінолін-3-карбонової кислоти у кількості від 75 мг до 95 мг, від 125 мг до 175 мг, від 150 мг до 200 мг або від 250 мг до 350 мг або її фармацевтично прийнятної солі разом з атазанавіром у кількості від 150 мг до 550 мг або його фармацевтично прийнятною сіллю у виробництві ліків для профілактики або терапевтичного лікування вірусу імунодефіциту людини (ВІЛ).
39. Застосування 6-(3-хлор-2-фторбензил)-1-[(2S)-1-гідрокси-3-метилбут-2-ил]-7-метоксі-4-оксо-1,4-дигідрохінолін-3-карбонової кислоти у кількості від 75 мг до 95 мг, від 125 мг до 175 мг, від 150 мг до 200 мг або від 250 мг до 350 мг або її фармацевтично прийнятної солі разом з атазанавіром у кількості від 150 мг до 550 мг або його фармацевтично прийнятною сіллю та з ритонавіром або його фармацевтично прийнятною сіллю у виробництві ліків для профілактики або терапевтичного лікування вірусу імунодефіциту людини (ВІЛ).
40. Застосування 6-(3-хлор-2-фторбензил)-1-[(2S)-1-гідрокси-3-метилбут-2-ил]-7-метоксі-4-оксо-1,4-дигідрохінолін-3-карбонової кислоти у кількості 85 мг або її фармацевтично прийнятної солі, атазанавіру у кількості 300 мг або його фармацевтично прийнятної солі та ритонавіру у кількості 100 мг або його фармацевтично прийнятної солі у виробництві ліків для профілактики або терапевтичного лікування вірусу імунодефіциту людини (ВІЛ).
41. Застосування 6-(3-хлор-2-фторбензил)-1-[(2S)-1-гідрокси-3-метилбут-2-ил]-7-метоксі-4-оксо-1,4-дигідрохінолін-3-карбонової кислоти у кількості від 75 мг до 95 мг, від 125 мг до 175 мг, від 150 мг до 200 мг або від 250 мг до 350 мг або її фармацевтично прийнятної солі разом з атазанавіром у кількості від 150 мг до 550 мг або його фармацевтично прийнятною сіллю у виробництві ліків для інгібування активності ретровірусної інтегрази в людини.
42. Застосування 6-(3-хлор-2-фторбензил)-1-[(2S)-1-гідрокси-3-метилбут-2-ил]-7-метоксі-4-оксо-1,4-дигідрохінолін-3-карбонової кислоти у кількості від 75 мг до 95 мг, від 125 мг до 175 мг, від 150 мг до 200 мг або від 250 мг до 350 мг або її фармацевтично прийнятної солі разом з атазанавіром у кількості від 150 мг до 550 мг або його фармацевтично прийнятною сіллю та з ритонавіром або його фармацевтично прийнятною сіллю у виробництві ліків для інгібування активності ретровірусної інтегрази в людини.
43. Застосування 6-(3-хлор-2-фторбензил)-1-[(2S)-1-гідрокси-3-метилбут-2-ил]-7-метоксі-4-оксо-1,4-дигідрохінолін-3-карбонової кислоти у кількості 85 мг або її фармацевтично прийнятної солі, атазанавіру у кількості 300 мг або його фармацевтично прийнятної солі та ритонавіру у кількості 100 мг або його фармацевтично прийнятної солі у виробництві ліків для інгібування активності ретровірусної інтегрази в людини.
44. Композиція для профілактики або терапевтичного лікування вірусу імунодефіциту людини (ВІЛ), що містить 6-(3-хлор-2-фторбензил)-1-[(2S)-1-гідрокси-3-метилбут-2-ил]-7-метоксі-4-оксо-1,4-дигідрохінолін-3-карбонову кислоту у кількості від 75 мг до 95 мг, від 125 мг до 175 мг, від 150 мг до 200 мг або від 250 мг до 350 мг або її фармацевтично прийнятну сіль; атазанавір у кількості від 150 мг до 550 мг або його фармацевтично прийнятну сіль; ритонавір або його фармацевтично прийнятну сіль та фармацевтично прийнятний носій або розріджувач.
45. Набір для профілактики або терапевтичного лікування вірусу імунодефіциту людини (ВІЛ), що містить (1) 6-(3-хлор-2-фторбензил)-1-[(2S)-1-гідрокси-3-метилбут-2-ил]-7-метоксі-4-оксо-1,4-дигідрохінолін-3-карбонову кислоту у кількості від 75 мг до 95 мг, від 125 мг до 175 мг, від 150 мг до 200 мг або від 250 мг до 350 мг або її фармацевтично прийнятну сіль; (2) атазанавір у кількості від 150 мг до 550 мг або його фармацевтично прийнятну сіль; (3) ритонавір або його фармацевтично прийнятну сіль; (4) один або більше контейнерів; та (5) інструкцію із застосування, що передбачає введення 6-(3-хлор-2-фторбензил)-1-[(2S)-1-гідрокси-3-метилбут-2-ил]-7-метоксі-4-оксо-1,4-дигідрохінолін-3-карбонової кислоти або її фармацевтично прийнятної солі разом з ритонавіром або його фармацевтично прийнятною сіллю, причому активні інгредієнти необов’язково знаходяться в одній дозованій формі.
46. Набір для профілактики або терапевтичного лікування вірусу імунодефіциту людини (ВІЛ), що містить (1) 6-(3-хлор-2-фторбензил)-1-[(2S)-1-гідрокси-3-метилбут-2-ил]-7-метоксі-4-оксо-1,4-дигідрохінолін-3-карбонову кислоту у кількості 85 мг або її фармацевтично прийнятну сіль; (2) атазанавір у кількості 300 мг або його фармацевтично прийнятну сіль; (3) ритонавір у кількості 100 мг або його фармацевтично прийнятну сіль; (4) один або більше контейнерів; та (5) інструкцію із застосування, що передбачає введення 6-(3-хлор-2-фторбензил)-1-[(2S)-1-гідрокси-3-метилбут-2-ил]-7-метоксі-4-оксо-1,4-дигідрохінолін-3-карбонової кислоти або її фармацевтично прийнятної солі разом з ритонавіром або його фармацевтично прийнятною сіллю, причому активні інгредієнти необов’язково знаходяться в одній дозованій формі.
Текст
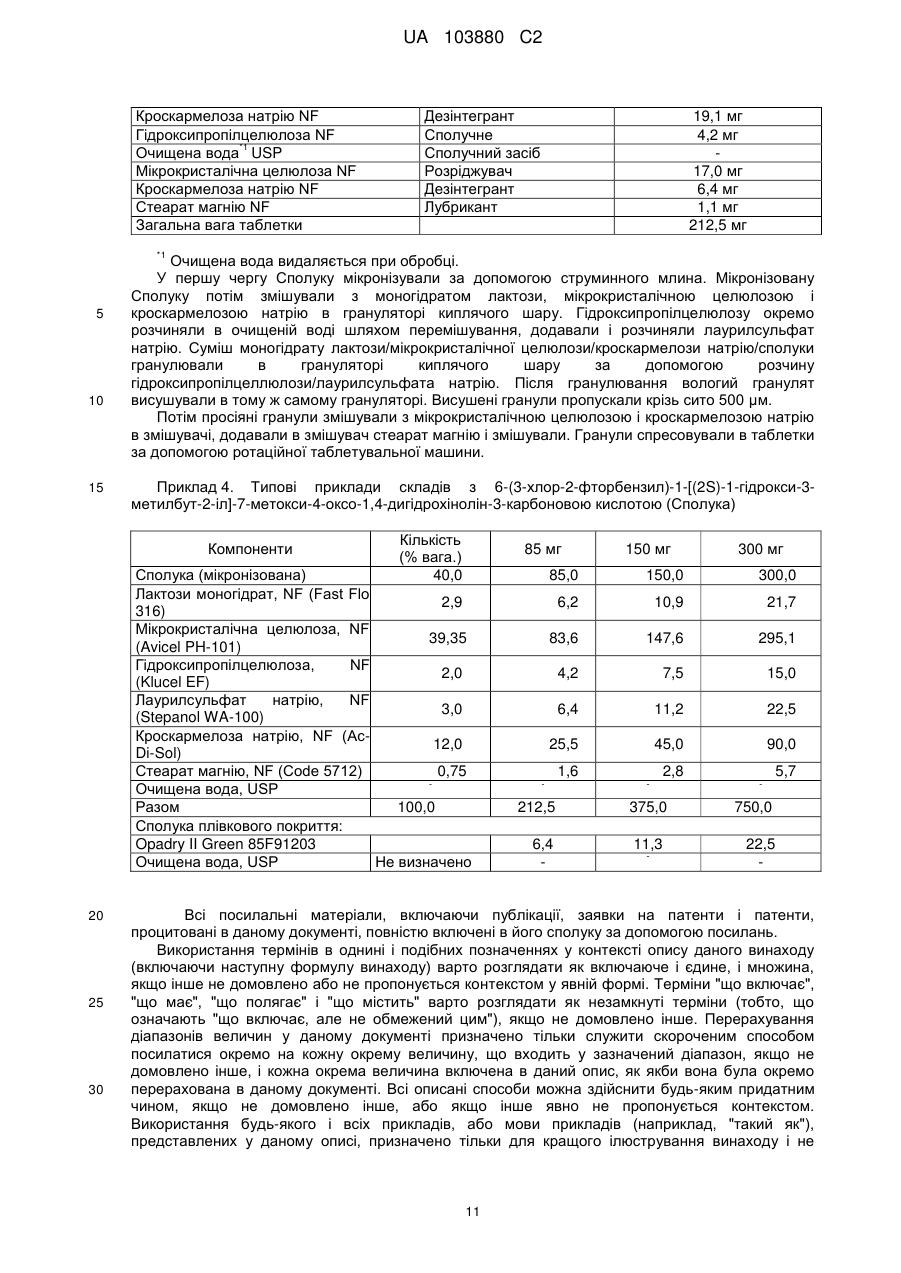
Реферат: Винаходи належать до медицини та фармацевтики і стосуються застосування, композицій та наборів для лікування інфекції, викликаної вірусом імунодефіциту людини (ВІЛ), шляхом введення 6-(3-хлор-2-фторбензил)-1-[(2S)-1-гідрокси-3-метилбут-2-ил]-7-метоксі-4-оксо-1,4дигідрохінолін-3-карбонової кислоти або її фармацевтично прийнятної солі разом з атазанавіром або його фармацевтично прийнятною сіллю і, необов’язково, з ритонавіром або його фармацевтично прийнятною сіллю. UA 103880 C2 (12) UA 103880 C2 UA 103880 C2 5 10 15 20 25 30 35 40 45 50 55 60 Ряд 4-оксихінолінів, включаючи сполуку 6-(3-хлор-2-фторбензил)-1-[(2S)-1-гідрокси-3метилбут-2-іл]-7-метокси-4-оксо-1,4-дигідрохінолін-3-карбонову кислоту (далі, Сполука), ідентифіковані як засоби проти вірусу імунодефіциту людини (ВІЛ). Див. Заявку на патент США серійний номер 10/492,833, подану 20 листопада 2003, що опублікована як Публікація заявки на патент США номер 2005/0239819. Зокрема, Сполуку описано як таку, що має інгібіторну дію відносно білка інтегрази ВІЛ. Скорочення ВІЛ позначає вірус, що належить до сімейства ретровірусів і є збудником захворювання синдрому набутого імунодефіциту (СНІД). Відповідно, фармацевтичний засіб, що зменшує вірусне навантаження, вірусний геном або реплікацію ВІЛ в організмі, може бути ефективним для лікування або профілактики СНІД. Як вартість лікування, так і можливість небажаних побічних дій можуть збільшуватися при збільшенні необхідної дози ліків. Таким чином, є потреба в способах і композиціях, що застосовуються для одержання прийнятної противірусної дії з використанням зменшеної дози Сполуки. КОРОТКИЙ ОПИС ВИНАХОДУ Дослідження показують, що системний вплив Сполуки у людини поліпшується, якщо Сполуку вводять разом з атазанавіром (ATV), при спільному введенні ритонавіру або без нього. Виявлено, що доза 300 мг Сполуки, введена разом з атазанавіром, має системний вплив, еквівалентний дозі 300 мг Сполуки при введенні разом з ритонавіром. Крім того, виявлено, що доза 85 мг Сполуки при введенні з атазанавіром, посиленим ритонавіром, має системний вплив, еквівалентний дозі 150 мг Сполуки, введеної окремо. Відповідно, згідно з одним із варіантів реалізації даного винаходу, запропоновано спосіб лікування вірусної інфекції у людини, що включає введення людині 1) 6-(3-хлор-2-фторбензил)1-[(2S)-1-гідрокси-3-метилбут-2-іл]-7-метокси-4-оксо-1,4-дигідрохінолін-3-карбонової кислоти або її фармацевтично прийнятної солі; і 2) сполуки, що інгібує шлях УГТ (уридиндифосфатглюкуронозилтрансферази) або метаболізм УГТ, або її фармацевтично прийнятної солі. Відповідно до одного з варіантів реалізації даного винаходу, зазначений спосіб додатково включає введення людині сполуки, що інгібує цитохром P-450, або її фармацевтично прийнятної солі. Згідно із даним винаходом також запропонована фармацевтична композиція, що включає 1) 6-(3-хлор-2-фторбензил)-1-[(2S)-1-гідрокси-3-метилбут-2-іл]-7-метокси-4-оксо-1,4-дигідрохінолін3-карбонову кислоту або її фармацевтично прийнятну сіль; 2) сполуку, що інгібує шлях УГТ або метаболізм УГТ, або її фармацевтично прийнятну сіль; і 3) фармацевтично прийнятний носій або розріджувач. Відповідно до одного з варіантів реалізації даного винаходу, запропоновано застосування сполуки 6-(3-хлор-2-фторбензил)-1-[(2S)-1-гідрокси-3-метилбут-2-іл]-7-метокси-4-оксо-1,4дигідрохінолін-3-карбонової кислоти або її фармацевтично прийнятної солі, для виробництва ліків для лікування вірусної інфекції у людини, що включає введення людині зазначеної сполуки або її фармацевтично прийнятної солі, разом зі сполукою, яка інгібує шлях УГТ або метаболізм УГТ, або її фармацевтично прийнятною сіллю. Відповідно до одного з варіантів реалізації даного винаходу, запропоновано застосування сполуки 6-(3-хлор-2-фторбензил)-1-[(2S)-1-гідрокси-3-метилбут-2-іл]-7-метокси-4-оксо-1,4дигідрохінолін-3-карбонової кислоти або її фармацевтично прийнятної солі, для виробництва ліків для лікування вірусної інфекції у людини, що включає введення людині зазначеної сполуки або її фармацевтично прийнятної солі, разом зі сполукою, яка інгібує шлях УГТ або метаболізм УГТ, або її фармацевтично прийнятною сіллю, і зі сполукою, яка інгібує цитохром P-450, або її фармацевтично прийнятною сіллю. Відповідно до одного з варіантів реалізації даного винаходу, запропоновано застосування сполуки, що інгібує шлях УГТ або метаболізм УГТ, або її фармацевтично прийнятної солі, для виробництва ліків, що застосовується для поліпшення фармакокінетики 6-(3-хлор-2фторбензил)-1-[(2S)-1-гідрокси-3-метилбут-2-іл]-7-метокси-4-оксо-1,4-дигідрохінолін-3карбонової кислоти або її фармацевтично прийнятної солі, після введення людині. Відповідно до одного з варіантів реалізації даного винаходу, запропонований набір, що включає: (1) 6-(3-хлор-2-фторбензил)-1-[(2S)-1-гідрокси-3-метилбут-2-іл]-7-метокси-4-оксо-1,4дигідрохінолін-3-карбонову кислоту або її фармацевтично прийнятну сіль; (2) сполука, що інгібує шлях УГТ або метаболізм УГТ, або її фармацевтично прийнятну сіль; (3) один або більше контейнерів; і (4) інструкцію із застосування, що стосується введення 6-(3-хлор-2-фторбензил)1-[(2S)-1-гідрокси-3-метилбут-2-іл]-7-метокси-4-оксо-1,4-дигідрохінолін-3-карбонової кислоти або її фармацевтично прийнятної солі, разом зі сполукою, яка інгібує шлях УГТ або метаболізм УГТ, або її фармацевтично прийнятною сіллю. 1 UA 103880 C2 5 10 15 20 25 30 35 40 45 50 55 Відповідно до одного з варіантів реалізації даного винаходу, запропонований набір, що включає: (1) одиничну дозовану форму, що містить 6-(3-хлор-2-фторбензил)-1-[(2S)-1-гідрокси3-метилбут-2-іл]-7-метокси-4-оксо-1,4-дигідрохінолін-3-карбонову кислоту або її фармацевтично прийнятну сіль; (2) сполука, що інгібує шлях УГТ або метаболізм УГТ, або її фармацевтично прийнятну сіль; (3) один або більше контейнерів; і (4) інструкцію із застосування, що стосується введення 6-(3-хлор-2-фторбензил)-1-[(2S)-1-гідрокси-3-метилбут-2-іл]-7-метокси-4-оксо-1,4дигідрохінолін-3-карбонової кислоти або її фармацевтично прийнятної солі, разом зі сполукою, яка інгібує шлях УГТ або метаболізм УГТ, або її фармацевтично прийнятною сіллю. Відповідно до одного з варіантів реалізації даного винаходу, запропоновано застосування сполуки 6-(3-хлор-2-фторбензил)-1-[(2S)-1-гідрокси-3-метилбут-2-іл]-7-метокси-4-оксо-1,4дигідрохінолін-3-карбонової кислоти або її фармацевтично прийнятної солі, для виробництва ліків для інгібування активності ретровірусної інтегрази у людини, що включає введення людині зазначеної сполуки або її фармацевтично прийнятної солі, разом зі сполукою, яка інгібує шлях УГТ або метаболізм УГТ, або її фармацевтично прийнятною сіллю. Відповідно до одного з варіантів реалізації даного винаходу, запропоновано застосування сполуки 6-(3-хлор-2-фторбензил)-1-[(2S)-1-гідрокси-3-метилбут-2-іл]-7-метокси-4-оксо-1,4дигідрохінолін-3-карбонової кислоти або її фармацевтично прийнятної солі, для виробництва ліків для інгібування активності ретровірусної інтегрази в людини, що включає введення людині зазначеної сполуки або її фармацевтично прийнятної солі, разом зі сполукою, яка інгібує шлях УГТ або метаболізм УГТ, або її фармацевтично прийнятною сіллю, і зі сполукою, яка інгібує цитохром P-450. Відповідно до одного з варіантів реалізації даного винаходу, запропоновано застосування сполуки, що інгібує шлях УГТ або метаболізм УГТ, або її фармацевтично прийнятної солі, для виробництва ліків, що застосовується у людини для зниження на 40 – 60 % дози 6-(3-хлор-2фторбензил)-1-[(2S)-1-гідрокси-3-метилбут-2-іл]-7-метокси-4-оксо-1,4-дигідрохінолін-3карбонової кислоти або її фармацевтично прийнятної солі, після введення людині. Відповідно до одного з варіантів реалізації даного винаходу, запропоновано застосування сполуки, що інгібує шлях УГТ або метаболізм УГТ, або її фармацевтично прийнятної солі, у сполученні зі сполукою, яка інгібує цитохром P-450, або її фармацевтично прийнятною сіллю, для виробництва ліків, що застосовується у людини для зниження на 40 – 60 % дози 6-(3-хлор2-фторбензил)-1-[(2S)-1-гідрокси-3-метилбут-2-іл]-7-метокси-4-оксо-1,4-дигідрохінолін-3карбонової кислоти або її фармацевтично прийнятної солі, після введення людині. Відповідно до одного з варіантів реалізації даного винаходу, запропоновано застосування 6(3-хлор-2-фторбензил)-1-[(2S)-1-гідрокси-3-метилбут-2-іл]-7-метокси-4-оксо-1,4-дигідрохінолін-3карбонової кислоти або її фармацевтично прийнятної солі, і сполуки, що інгібує шлях УГТ або метаболізм УГТ, або її фармацевтично прийнятної солі, для профілактичного або лікувального впливу на вірусну інфекцію у людини. Відповідно до одного з варіантів реалізації даного винаходу, запропонована сполука 6-(3хлор-2-фторбензил)-1-[(2S)-1-гідрокси-3-метилбут-2-іл]-7-метокси-4-оксо-1,4-дигідрохінолін-3карбонова кислота або її фармацевтично прийнятна сіль, для профілактичного або лікувального впливу на вірусну інфекцію у людини, включаючи введення людині зазначеної сполуки або її фармацевтично прийнятної солі, разом зі сполукою, яка інгібує шлях УГТ або метаболізм УГТ, або її фармацевтично прийнятною сіллю. Відповідно до одного з варіантів реалізації даного винаходу, запропонована сполука 6-(3хлор-2-фторбензил)-1-[(2S)-1-гідрокси-3-метилбут-2-іл]-7-метокси-4-оксо-1,4-дигідрохінолін-3карбонова кислота або її фармацевтично прийнятна сіль, для профілактичного або лікувального впливу на вірусну інфекцію у людини, включаючи введення людині зазначеної сполуки або її фармацевтично прийнятної солі, разом зі сполукою, яка інгібує шлях УГТ або метаболізм УГТ, або її фармацевтично прийнятною сіллю, і зі сполукою, яка інгібує цитохром P-450, або її фармацевтично прийнятною сіллю. Відповідно до одного з варіантів реалізації даного винаходу, запропоновано сполуку, що інгібує шлях УГТ або метаболізм УГТ, або її фармацевтично прийнятна сіль, для поліпшення фармакокінетики 6-(3-хлор-2-фторбензил)-1-[(2S)-1-гідрокси-3-метилбут-2-іл]-7-метокси-4-оксо1,4-дигідрохінолін-3-карбонової кислоти або її фармацевтично прийнятної солі, після введення людині. Відповідно до одного з варіантів реалізації даного винаходу, запропоновано сполуку 6-(3хлор-2-фторбензил)-1-[(2S)-1-гідрокси-3-метилбут-2-іл]-7-метокси-4-оксо-1,4-дигідрохінолін-3карбонова кислота або її фармацевтично прийнятна сіль, для інгібування активності ретровірусної інтегрази у людини, включаючи введення людині зазначеної сполуки або її 2 UA 103880 C2 5 10 15 20 25 30 35 40 45 50 55 60 фармацевтично прийнятної солі, разом зі сполукою, яка інгібує шлях УГТ або метаболізм УГТ, або її фармацевтично прийнятною сіллю. Відповідно до одного з варіантів реалізації даного винаходу, запропоновано сполуку 6-(3хлор-2-фторбензил)-1-[(2S)-1-гідрокси-3-метилбут-2-іл]-7-метокси-4-оксо-1,4-дигідрохінолін-3карбонова кислота або її фармацевтично прийнятна сіль, для інгібування активності ретровірусної інтегрази у людини, включаючи введення людині зазначеної сполуки або її фармацевтично прийнятної солі, разом зі сполукою, яка інгібує шлях УГТ або метаболізм УГТ, або її фармацевтично прийнятною сіллю, і зі сполукою, яка інгібує цитохром P-450, або її фармацевтично прийнятною сіллю. Відповідно до одного з варіантів реалізації даного винаходу, запропоновано сполуку, що інгібує шлях УГТ або метаболізм УГТ, або її фармацевтично прийнятна сіль, для зменшення на 40 – 60 % дози 6-(3-хлор-2-фторбензил)-1-[(2S)-1-гідрокси-3-метилбут-2-іл]-7-метокси-4-оксо1,4-дигідрохінолін-3-карбонової кислоти або її фармацевтично прийнятної солі, після введення людині. Відповідно до одного з варіантів реалізації даного винаходу, запропоновано сполуку, що інгібує шлях УГТ або метаболізм УГТ, або її фармацевтично прийнятну сіль, у сполученні зі сполукою, яка інгібує цитохром P-450, або її фармацевтично прийнятною сіллю, для зменшення на 40 – 60 % дози 6-(3-хлор-2-фторбензил)-1-[(2S)-1-гідрокси-3-метилбут-2-іл]-7-метокси-4-оксо1,4-дигідрохінолін-3-карбонової кислоти або її фармацевтично прийнятної солі, після введення людині. Відповідно до одного з варіантів реалізації даного винаходу, запропонована 6-(3-хлор-2фторбензил)-1-[(2S)-1-гідрокси-3-метилбут-2-іл]-7-метокси-4-оксо-1,4-дигідрохінолін-3карбонова кислота або її фармацевтично прийнятна сіль, і сполука, що інгібує шлях УГТ або метаболізм УГТ, або її фармацевтично прийнятна сіль, для профілактичного або лікувального впливу на ретровірусну інфекцію у людини. Відповідно до одного з варіантів реалізації даного винаходу, запропонований противірусний засіб(и), що включає (а) сполуку 6-(3-хлор-2-фторбензил)-1-[(2S)-1-гідрокси-3-метилбут-2-іл]-7метокси-4-оксо-1,4-дигідрохінолін-3-карбонову кислоту або її фармацевтично прийнятну сіль, і (б) сполуку, що інгібує шлях УГТ або метаболізм УГТ, або її фармацевтично прийнятну сіль, у сполученні. Відповідно до одного з варіантів реалізації даного винаходу, запропонований противірусний засіб(и), що включає (а) сполуку 6-(3-хлор-2-фторбензил)-1-[(2S)-1-гідрокси-3-метилбут-2-іл]-7метокси-4-оксо-1,4-дигідрохінолін-3-карбонову кислоту або її фармацевтично прийнятну сіль, що застосовується у сполученні з (б) сполукою, яка інгібує шлях УГТ або метаболізм УГТ, або її фармацевтично прийнятною сіллю. Відповідно до одного з варіантів реалізації даного винаходу, запропоновано сполуку 6-(3хлор-2-фторбензил)-1-[(2S)-1-гідрокси-3-метилбут-2-іл]-7-метокси-4-оксо-1,4-дигідрохінолін-3карбонова кислота або її фармацевтично прийнятна сіль, що застосовується у сполученні зі сполукою, яка інгібує шлях УГТ або метаболізм УГТ, або її фармацевтично прийнятною сіллю. Відповідно до одного з варіантів реалізації даного винаходу, запропонований противірусний засіб(и), що включає (a) сполуку 6-(3-хлор-2-фторбензил)-1-[(2S)-1-гідрокси-3-метилбут-2-іл]-7метокси-4-оксо-1,4-дигідрохінолін-3-карбонову кислоту або її фармацевтично прийнятну сіль; (б) сполуку, що інгібує шлях УГТ або метаболізм УГТ, або її фармацевтично прийнятну сіль; і (в) сполуку, що інгібує цитохром P-450, або її фармацевтично прийнятну сіль, у сполученні. Відповідно до одного з варіантів реалізації даного винаходу, запропонований противірусний засіб(и), що включає сполуку 6-(3-хлор-2-фторбензил)-1-[(2S)-1-гідрокси-3-метилбут-2-іл]-7метокси-4-оксо-1,4-дигідрохінолін-3-карбонову кислоту або її фармацевтично прийнятну сіль, що застосовується у сполученні зі сполукою, яка інгібує шлях УГТ або метаболізм УГТ, або її фармацевтично прийнятною сіллю, і сполукою, яка інгібує цитохром P-450, або її фармацевтично прийнятною сіллю. Відповідно до одного з варіантів реалізації даного винаходу, запропоновано сполуку 6-(3хлор-2-фторбензил)-1-[(2S)-1-гідрокси-3-метилбут-2-іл]-7-метокси-4-оксо-1,4-дигідрохінолін-3карбонова кислота або її фармацевтично прийнятна сіль, що застосовується у сполученні зі сполукою, яка інгібує шлях УГТ або метаболізм УГТ, або її фармацевтично прийнятною сіллю, і сполукою, яка інгібує цитохром P-450, або її фармацевтично прийнятною сіллю. Відповідно до одного з варіантів реалізації даного винаходу, запропоновано застосування атазанавіру або його фармацевтично прийнятної солі, у сполученні з ритонавіром, або його фармацевтично прийнятною сіллю, для виробництва ліків для поліпшення фармакокінетики 6(3-хлор-2-фторбензил)-1-[(2S)-1-гідрокси-3-метилбут-2-іл]-7-метокси-4-оксо-1,4-дигідрохінолін-3карбонової кислоти або її фармацевтично прийнятної солі, після введення людині. 3 UA 103880 C2 5 10 15 20 25 30 35 40 45 50 55 60 ДОКЛАДНИЙ ОПИС ВИНАХОДУ У даному описі термін "спільне введення" відноситься до введення двох або більше засобів протягом періоду до 24 годин один після іншого, наприклад, як частина клінічної схеми лікування. Відповідно до інших варіантів реалізації, "спільне введення" відноситься до введення протягом 2 годин один після іншого. Відповідно до інших варіантів реалізації, "спільне введення" відноситься до введення протягом 30 хвилин один після іншого. Відповідно до інших варіантів реалізації, "спільне введення" відноситься до введення протягом 15 хвилин один після іншого. Відповідно до інших варіантів реалізації, "спільне введення" відноситься до введення в той самий час, або як частина однієї сполуки, або як численні сполуки, які вводять тим самим або різними шляхами. Термін "одинична дозована форма" відноситься до фізично окремої одиниці, такої як капсула, таблетка або розчин, що підходить як однократне дозування для пацієнта-людини, причому кожна одиниця містить заздалегідь задану кількість одного або більше активних компонентів, розраховану для одержання терапевтичного ефекту, разом з, щонайменше, одним фармацевтично прийнятним розріджувачем або носієм, або їх сполученням. При бажанні, ефективну добову дозу Сполуки можна вводити у вигляді двох, трьох, чотирьох, п'яти, шести або більше субдоз, що вводяться окремо через відповідні інтервали протягом доби, можливо, у вигляді одиничних дозованих форм. Концентрацію Сполуки в кровотоці можна виміряти як концентрацію в плазмі (наприклад, нг/мл). Фармакокінетичні параметри для визначення концентрації в плазмі включають, але не обмежені цим, максимальну спостережувану концентрацію в плазмі (Cmax), спостережувану концентрацію в плазмі наприкінці інтервалу дозування або "мінімальну" концентрацію (C tau або Cmin), площу під кривою концентрації від часу (ППК) від початку відліку до останнього моменту часу, що піддається кількісному визначенню (ППК0-last), ППК від початку відліку до нескінченності (ППК0-inf), ППК інтервалу дозування (ППКtau), час максимальної спостережуваної після введення концентрації (tmax), і період напіввиведення Сполуки із плазми (t1/2). Введення Сполуки з їжею у відповідності зі способами згідно із даним винаходом, також може збільшити абсорбцію Сполуки. Абсорбцію Сполуки можна виміряти за допомогою концентрації, що досягається в кровотоці через якийсь час після введення Сполуки. Збільшення абсорбції при введенні Сполуки з їжею можна також виявити по збільшенню C max і/або ППК Сполуки у порівнянні із зазначеними величинами при введенні Сполуки без їжі. Зазвичай інгібітори протеази вводять із їжею. Згідно із даним винаходом також запропонований спосіб лікування або профілактики захворювань, порушень і станів. Приклад захворювання, порушення або стану включає, але не обмежений цим, ретровірусну інфекцію, або захворювання, порушення або стан, пов'язане з ретровірусною інфекцією. Ретровіруси являють собою РНК-віруси, і в цілому розділяються на сімейства альфа-ретровірусів, бета-ретровірусів, дельта-ретровірусів, епсилон-ретровірусів, гамма-ретровірусів, лентивірусів і спумавірусів. Приклади ретровірусів включають, але не обмежені цим, вірус імунодефіциту людини (ВІЛ), Т-лімфотропний вірус людини (HTLV), вірус саркоми Рауса (ВСР) і вірус лейкозу птахів. У цілому, для білків зрілого вірусу в коді генома ретровірусу є три гени: ген gag (групоспецифічний антиген), що кодує центральний компонент і структурні білки вірусу; ген pol (полімераза), що кодує ферменти вірусу, включаючи зворотну транскриптазу, протеазу та інтегразу; і ген env (оболонка), що кодує білки поверхні ретровірусу. Ретровірус приєднується до клітини-хазяїна і впроваджується в неї шляхом виділення в клітину-хазяїна, серед іншого, комплексу РНК і продуктів pol. Потім зворотна транскриптаза робить дволанцюгову ДНК із вірусної РНК. Дволанцюгова ДНК проникає в ядро клітини хазяїна та інтегрується в геном клітини за допомогою вірусної інтегрази. Вірус, що зароджується з інтегрованої ДНК, утворюється, коли під дією клітинної полімерази вірусна ДНК перетворюється в мРНК, і під дією вірусної протеази виробляються необхідні для утворення вірусу білки. Частинки вірусу піддаються активній реплікації і вивільняються із клітини-хазяїна, утворюючи зрілий вірус. Активні агенти можна вводити людині будь-яким загальновживаним чином. Хоча активні агенти можливо вводити у вигляді вихідних сполук, краще вводити їх у вигляді фармацевтичної композиції. Термін "фармацевтична композиція, що містить Сполуку" відноситься до фармацевтичної композиції, що містить Сполуку або її фармацевтично прийнятну сіль, разом з одним або більше фармацевтично прийнятним носієм або розріджувачем, і, можливо, з іншими лікарськими агентами і/або компонентами. Сіль, носій або розріджувач повинні бути прийнятними з погляду сумісності з іншими компонентами і відсутності шкідливого впливу на реципієнта. Приклади носіїв або розріджувачів для перорального введення включають кукурудзяний крохмаль, лактозу, стеарат магнію, тальк, мікрокристалічну целюлозу, стеаринову 4 UA 103880 C2 5 10 15 20 25 30 35 40 45 50 55 60 кислоту, повідон, кросповідон, двоосновний фосфат кальцію, натрій крохмаль гліколат, гідроксипропілцелюлозу (наприклад, гідроксипропілцелюлозу з низьким ступенем заміщення), гідроксипропілметилцелюлозу (наприклад, гідроксипропілметилцелюлозу 2910), і лаурилсульфат натрію. Фармацевтичні композиції можна приготувати будь-яким придатним способом, таким як способи, добре відомі в області фармацевтики, наприклад, такі як способи, описані в Gennaro et al., Remington's Pharmaceutical Sciences (18th ed., Mack Publishing Co., 1990), особливо в Part 8: Pharmaceutical Preparations and their Manufacture. Зазначені способи включають стадію об'єднання Сполуки з носієм або розріджувачем і, можливо, з одним або більше допоміжними інгредієнтами. Зазначені допоміжні інгредієнти включають загальновживані в даній області інгредієнти, такі як наповнювачі, сполучні, формотворні, лубриканти, барвники, ароматизатори, підсолоджувачі, консерванти (наприклад, протимікробні консерванти), суспендуючі агенти, загущувачі, емульгатори і/або змочувальні агенти. Фармацевтичні композиції можуть забезпечувати контрольоване, повільне вивільнення або вповільнене вивільнення агента (наприклад, Сполуки) протягом деякого інтервалу часу. Контрольоване, повільне вивільнення, або вповільнене вивільнення агента (наприклад, Сполуки) може забезпечувати наявність агента в кровотоці людини протягом ще тривалішого періоду часу, ніж звичайні сполуки. Фармацевтичні композиції включають, але не обмежені цим, таблетки з покриттям, пеллети, розчини, порошки, капсули, і дисперсії Сполуки в середовищі, нерозчинному у фізіологічних рідинах або композиції, у яких вивільнення лікувальної сполуки відбувається за розпадом фармацевтичної композиції через механічну, хімічну або ферментативну дію. Фармацевтична композиція згідно із даним винаходом може бути, наприклад, у формі пігулки, капсули, розчину, порошку або таблетки, що містять заздалегідь задану кількість Сполуки. Відповідно до одного з варіантів реалізації даного винаходу, фармацевтична композиція перебуває у формі таблетки, що містить Сполуку і компоненти таблетки, використані і описані в Прикладах згідно із даним описом. Для перорального введення дрібнодисперсні порошки або гранули можуть містити розбавляючі, диспергуючі або поверхнево-активні засоби, і можуть бути представлені, наприклад, у воді або в сиропі, в капсулах або в саше в сухому стані, або в неводному розчині або суспензії, до складу яких можуть входити суспендуючі засоби, або в таблетках, до складу яких можуть входити сполучні або лубриканти. При введенні у формі рідкого розчину або суспензії, сполука може містити Сполуку та очищену воду. Можливі компоненти рідкого розчину або суспензії включають придатні підсолоджувачі, ароматизатори, консерванти (наприклад, протимікробні консерванти), буферні засоби, розчинники, і їх суміші. Компонент сполуки може виконувати більш ніж одну функцію. Наприклад, придатний буферний засіб може також діяти як ароматизатор, а також підсолоджувач. Придатні підсолоджувачі включають, наприклад, сахарин натрій, сахарозу і маніт. Можна застосовувати суміш двох або більше підсолоджувачів. Підсолоджувачі або їх суміші зазвичай присутні в кількості приблизно від 0,001 % до 70 % від загальної ваги композиції. Придатні ароматизатори можуть бути присутні у фармацевтичній композиції для одержання аромату вишні, аромату цукрової вати, або іншого придатного аромату, щоб зробити фармацевтичну композицію ще придатнішою для прийому всередину людиною. Ароматизатор або їх суміш зазвичай присутня в кількості приблизно від 0,0001 % до 5 % від загальної ваги композиції. Придатні консерванти включають, наприклад, метилпарабен, пропілпарабен, бензоат натрію і хлорид бензалконію. Можна застосовувати суміш двох або більше консервантів. Консервант або їх суміш зазвичай присутня в кількості приблизно від 0,0001 % до 2 % від загальної ваги композиції. Придатні буферні засоби включають, наприклад, лимонну кислоту, цитрат натрію, фосфорну кислоту, фосфат калію, і різні інші кислоти і солі. Можна застосовувати суміш двох або більше буферних засобів. Буферні засоби або їх суміші зазвичай присутні в кількості приблизно від 0,001 % до 4 % від загальної ваги композиції. Придатні розчинники для рідкого розчину або суспензії включають, наприклад, сорбіт, гліцерин, пропіленгліколь і воду. Можна застосовувати суміш двох або більше розчинників. Розчинник або система розчинників зазвичай присутній у кількості приблизно від 1 % до 90 % від загальної ваги композиції. Фармацевтичну композицію можна вводити спільно з допоміжними засобами. Наприклад, неіоногенні ПАВ, такі як поліоксиетиленолеїловий простий ефір і поліоксиетилен-нгексадециловий простий ефір, можна вводити спільно або включати до складу фармацевтичної 5 UA 103880 C2 5 10 15 20 25 30 35 40 45 50 55 60 композиції, щоб штучно збільшити проникність стінок кишечника. Ферментні інгібітори також можна вводити спільно або включати до складу фармацевтичної композиції. Сполука Відповідно до одного з варіантів реалізації даного винаходу, вводять дозу 85±10 мг 6-(3хлор-2-фторбензил)-1-[(2S)-1-гідрокси-3-метилбут-2-іл]-7-метокси-4-оксо-1,4-дигідрохінолін-3карбонової кислоти або її фармацевтично прийнятної солі. Відповідно до одного з варіантів реалізації даного винаходу, вводять дозу 85±5 мг 6-(3-хлор2-фторбензил)-1-[(2S)-1-гідрокси-3-метилбут-2-іл]-7-метокси-4-оксо-1,4-дигідрохінолін-3карбонової кислоти або її фармацевтично прийнятної солі. Відповідно до одного з варіантів реалізації даного винаходу, вводять дозу 85±2 мг 6-(3-хлор2-фторбензил)-1-[(2S)-1-гідрокси-3-метилбут-2-іл]-7-метокси-4-оксо-1,4-дигідрохінолін-3карбонової кислоти або її фармацевтично прийнятної солі. Відповідно до одного з варіантів реалізації даного винаходу, вводять дозу 150±25 мг 6-(3хлор-2-фторбензил)-1-[(2S)-1-гідрокси-3-метилбут-2-іл]-7-метокси-4-оксо-1,4-дигідрохінолін-3карбонової кислоти або її фармацевтично прийнятної солі. Відповідно до одного з варіантів реалізації даного винаходу, вводять дозу 150±10 мг 6-(3хлор-2-фторбензил)-1-[(2S)-1-гідрокси-3-метилбут-2-іл]-7-метокси-4-оксо-1,4-дигідрохінолін-3карбонової кислоти або її фармацевтично прийнятної солі. Відповідно до одного з варіантів реалізації даного винаходу, вводять дозу 175±25 мг 6-(3хлор-2-фторбензил)-1-[(2S)-1-гідрокси-3-метилбут-2-іл]-7-метокси-4-оксо-1,4-дигідрохінолін-3карбонової кислоти або її фармацевтично прийнятної солі. Відповідно до одного з варіантів реалізації даного винаходу, вводять дозу 175±10 мг 6-(3хлор-2-фторбензил)-1-[(2S)-1-гідрокси-3-метилбут-2-іл]-7-метокси-4-оксо-1,4-дигідрохінолін-3карбонової кислоти або її фармацевтично прийнятної солі. Відповідно до одного з варіантів реалізації даного винаходу, вводять дозу 170±25 мг 6-(3хлор-2-фторбензил)-1-[(2S)-1-гідрокси-3-метилбут-2-іл]-7-метокси-4-оксо-1,4-дигідрохінолін-3карбонової кислоти або її фармацевтично прийнятної солі. Відповідно до одного з варіантів реалізації даного винаходу, вводять дозу 170±10 мг 6-(3хлор-2-фторбензил)-1-[(2S)-1-гідрокси-3-метилбут-2-іл]-7-метокси-4-оксо-1,4-дигідрохінолін-3карбонової кислоти або її фармацевтично прийнятної солі. Відповідно до одного з варіантів реалізації даного винаходу, вводять дозу 300±50 мг6-(3хлор-2-фторбензил)-1-[(2S)-1-гідрокси-3-метилбут-2-іл]-7-метокси-4-оксо-1,4-дигідрохінолін-3карбонової кислоти або її фармацевтично прийнятної солі. Відповідно до одного з варіантів реалізації даного винаходу, вводять дозу 300±20 мг 6-(3хлор-2-фторбензил)-1-[(2S)-1-гідрокси-3-метилбут-2-іл]-7-метокси-4-оксо-1,4-дигідрохінолін-3карбонової кислоти або її фармацевтично прийнятної солі. Відповідно до одного з варіантів реалізації даного винаходу, вводять дозу 300±10 мг 6-(3хлор-2-фторбензил)-1-[(2S)-1-гідрокси-3-метилбут-2-іл]-7-метокси-4-оксо-1,4-дигідрохінолін-3карбонової кислоти або її фармацевтично прийнятної солі. Сполуки, що інгібують шлях УГТ або метаболізм УГТ. Заснований на уридин-5'-дифосфоглюкуронозилтрансферазі (УДФглюкуронозилтрансфераза, УГТ), метаболізм Фази 2 через реакцію кон'югації (глюкуронування), являє собою один з ряду важливих первинних або вторинних метаболічних шляхів для ендогенних і екзогенно введених молекул, включаючи багато ліків. Реакції глюкуронування приводять до збільшеної розчинності у воді ліків, які пройшли метаболізм, що сприяє їх видаленню з організму. Хоча взаємодії між ліками через шлях УГТ менш поширені і зазвичай менш значні, ніж взаємодії, засновані на цитохромі P450, інгібування зазначеного шляху може привести до клінічно значимих змін у фармакокінетиці молекул, що піддаються зазначеному шляху метаболізму. Інгібування зазначеного шляху може привести до посиленого системного впливу ліків, що може збільшити потужність і/або побічні дії. Індукція зазначеного шляху може привести до ще нижчих впливів, які можуть поставити під загрозу ефективність ліків, що цікавлять. Показано, що ряд сполук інгібує активність УГТ у людини. Зазначені сполуки включають природні продукти (флавоноїди), жирні кислоти, стероїди, бензодиазепіни і нестероїдні протизапальні ліки. Див, наприклад, Grancharov, K. et al., Pharmacology and Therapeutics, 2001, 89, 171-186; Kiang, T.K.L. et al., Pharmacology and Therapeutics, 2005, 106, 97-132; Williams, J.A. et al., Drug Metabolism and Disposition, 2004, 32, 1201-1208; і Опубліковану міжнародну заявку на патент № WO/2003/055494. Одним з конкретних засобів, що блокують активність УГТ і що застосовуються у способах згідно із даним винаходом, є атазанавір (1-[4-(піридин-2-іл)-феніл]-4(S)-2,5-бі-[N-(N 6 UA 103880 C2 5 10 15 20 25 30 35 40 45 метоксикарбоніл-(L)-трет-лейцил)аміно]-6-феніл-2-азагексан або її фармацевтично прийнятна сіль), описаний у Патентах США 5,849,911 і 6,087,783. У Прикладах, наведених нижче, застосовували комерційно доступний Реатаз (сульфат атазанавіру) ((3-12-біс(1,1-диметилетил)8-гідрокси-4,11-диоксо-9-(фенілметил)-6-((-4-(2-піридиніл)феніл)метил)-2,5,6,10,13пентаазатетрадекандиової кислоти диметиловий ефір (3S, 8S, 9S, 12S), сульфат (1:1) (сіль)). Конкретна доза атазанавіру, яку можна використовувати згідно із даним винаходом, становить 400±150 мг атазанавіру або його фармацевтично прийнятної солі. Конкретна доза атазанавіру, яку можна використовувати згідно із даним винаходом, становить 400±100 мг атазанавіру або його фармацевтично прийнятної солі. Конкретна доза атазанавіру, яку можна використовувати згідно із даним винаходом, становить 300±100 мг атазанавіру або його фармацевтично прийнятної солі. Конкретна доза атазанавіру, яку можна використовувати згідно із даним винаходом, становить 300±10 мг атазанавіру або його фармацевтично прийнятної солі. Деякі сполуки, що інгібують шлях УГТ або метаболізм УГТ, можуть також інгібувати цитохром P-450. Відповідно, термін "сполуки, що інгібують шлях УГТ або метаболізм УГТ" включає такі сполуки. Сполуки, що інгібують цитохром P-450 Використовуваний у даному описі термін "Сполуки, що інгібують цитохром P-450" включає сполуки, що зменшують метаболізм Сполуки 1 за участю цитохрома P450, зокрема, метаболізм Сполуки 1 за участю цитохрома P450 3A. Відповідно, зазначений термін включає інгібітори цитохрома P450, а також субстрати цитохрома P450 та інші сполуки, що зменшують метаболізм Сполуки 1 за участю цитохрома P450. Відомий ряд таких сполук: див. наприклад http://medicine.iupui.edu/flockhart/table.htm; і публікацію міжнародної заявки WO 2008/010921. Типові сполуки включають циметидин, фторхінолони, флувоксамін, тиклопідин, тіотепа, тиклопідин, гемфіброзил, монтелукаст, флуоксетин, флувоксамін, кетоконазол, лансопразол, омепразол, тиклопідин, аміодарон, флуконазол, ізоніазид, аміодарон, бупропіон, хлорфенирамін, циметидин, кломіпрамін, дулоксетин, флуоксетин, галоперідол, метадон, мібефрадил, пароксетин, хінідин, ритонавір, дисульфірам, індинавір, нелфінавір, аміодарон, циметидин, кларитроміцин, дилтіазем, еритроміцин, флувоксамін, ітраконазол, кетоконазол, мібефрадил, нефазодон, тролеандоміцин і верапаміл. Конкретна підгрупа інгібіторів цитохрома P-450, що застосовуються у способах згідно із даним винаходом, включає кетоконазол, ітраконазол, кларитроміцин, телітроміцин, індинавір, нелфінавір, саквінавір, нефазодон, еритроміцин і ритонавір, і їх фармацевтично прийнятні солі. Інша конкретна підгрупа інгібіторів цитохрома P-450, що застосовуються у способах згідно із даним винаходом, включає інгібітори протеази ВІЛ індинавір, нелфінавір, саквінавір і ритонавір. Одним з конкретних засобів, що блокують активність цитохрома P-450 і що застосовуються у способах згідно із даним винаходом, є ритонавір, або його фармацевтично прийнятна сіль. Конкретна доза ритонавіру, яку можна застосовувати згідно із даним винаходом, становить 100±50 мг ритонавіру або його фармацевтично прийнятної солі. Конкретна доза ритонавіру, яку можна застосовувати згідно із даним винаходом, становить 100±25 мг ритонавіру або його фармацевтично прийнятної солі. Конкретна доза ритонавіру, яку можна застосовувати згідно із даним винаходом, становить 100±10 мг ритонавіру або його фармацевтично прийнятної солі. Про інші конкретні засоби, що блокують активність цитохрома P-450 і що застосовуються у способах згідно із даним винаходом, відомо з публікації міжнародної заявки WO 2008/010921. Відповідно до одного з конкретних варіантів реалізації даного винаходу, сполука, що інгібує цитохром P-450, являє собою сполуку наступної формули: O N Ph O S N N O N H H N O N H O S N Ph 50 або її фармацевтично прийнятну сіль. Конкретні варіанти реалізації даного винаходу. Відповідно до одного з варіантів реалізації, даний винахід включає введення приблизно 85 мг (наприклад, ± 10 мг, 5 мг або 2 мг) Сполуки з атазанавіром і ритонавіром, для одержання системного впливу, еквівалентного дозі 150 мг Сполуки, що вводиться з ритонавіром. 7 UA 103880 C2 5 10 15 20 25 30 35 40 45 50 55 Відповідно до одного з варіантів реалізації, даний винахід включає введення приблизно 175 мг (наприклад, ± 25 мг або 10 мг) Сполуки з атазанавіром або його фармацевтично прийнятною сіллю, і, можливо, з ритонавіром або його фармацевтично прийнятною сіллю. Відповідно до одного з варіантів реалізації, даний винахід включає введення приблизно 170 мг (наприклад, ± 25 мг або 10 мг) Сполуки з атазанавіром або його фармацевтично прийнятною сіллю, і, можливо, з ритонавіром або його фармацевтично прийнятною сіллю. Відповідно до одного з варіантів реалізації, даний винахід включає введення приблизно 300 мг (наприклад, ± 150 мг, 100 мг, 50 мг або 10 мг) атазанавіру або його фармацевтично прийнятної солі, і, можливо, ритонавіру або його фармацевтично прийнятної солі. Відповідно до одного з варіантів реалізації даного винаходу запропонований набір, що включає: (1) одиничну дозовану форму, що містить 85 мг ± 10 мг 6-(3-хлор-2-фторбензил)-1[(2S)-1-гідрокси-3-метилбут-2-іл]-7-метокси-4-оксо-1,4-дигідрохінолін-3-карбонової кислоти або її фармацевтично прийнятної солі; (2) сполука, що інгібує шлях УГТ або метаболізм УГТ (наприклад, атазанавір) або її фармацевтично прийнятну сіль; (3) один або більше контейнерів; і (4) інструкцію із застосування, що стосується введення 6-(3-хлор-2-фторбензил)-1-[(2S)-1гідрокси-3-метилбут-2-іл]-7-метокси-4-оксо-1,4-дигідрохінолін-3-карбонової кислоти або її фармацевтично прийнятної солі разом зі сполукою, яка інгібує шлях УГТ або метаболізм УГТ, або її фармацевтично прийнятною сіллю. Відповідно до одного з варіантів реалізації даного винаходу запропонований набір, що включає: (1) одиничну дозовану форму, що містить 170 мг ± 25 мг 6-(3-хлор-2-фторбензил)-1[(2S)-1-гідрокси-3-метилбут-2-іл]-7-метокси-4-оксо-1,4-дигідрохінолін-3-карбонової кислоти або її фармацевтично прийнятної солі; (2) сполука, що інгібує шлях УГТ або метаболізм УГТ (наприклад, атазанавір) або її фармацевтично прийнятну сіль; (3) один або більше контейнерів; і (4) інструкцію із застосування, що стосується введення 6-(3-хлор-2-фторбензил)-1-[(2S)-1гідрокси-3-метилбут-2-іл]-7-метокси-4-оксо-1,4-дигідрохінолін-3-карбонової кислоти або її фармацевтично прийнятної солі разом зі сполукою, яка інгібує шлях УГТ або метаболізм УГТ, або її фармацевтично прийнятною сіллю. Відповідно до одного з варіантів реалізації даного винаходу запропонований набір, що включає: (1) одиничну дозовану форму, що містить 175 мг ± 25 мг 6-(3-хлор-2-фторбензил)-1[(2S)-1-гідрокси-3-метилбут-2-іл]-7-метокси-4-оксо-1,4-дигідрохінолін-3-карбонової кислоти або її фармацевтично прийнятної солі; (2) сполука, що інгібує шлях УГТ або метаболізм УГТ (наприклад, атазанавір) або її фармацевтично прийнятну сіль; (3) один або більше контейнерів; і (4) інструкцію із застосування, що стосується введення 6-(3-хлор-2-фторбензил)-1-[(2S)-1гідрокси-3-метилбут-2-іл]-7-метокси-4-оксо-1,4-дигідрохінолін-3-карбонової кислоти або її фармацевтично прийнятної солі разом зі сполукою, яка інгібує шлях УГТ або метаболізм УГТ, або її фармацевтично прийнятною сіллю. Далі даний винахід буде проілюстровано наступними необмежувальними прикладами. ПРИКЛАДИ Приклад 1. Фармакокінетична взаємодія між атазанавіром/р і Сполукою Визначали ефекти спільного введення атазанавіру/р (ATV/r) зі Сполукою. У даному дослідженні оцінювали безпеку і фармакокінетику стаціонарного стану для Сполуки і ATV/r, що вводяться спільно. Способи Здорових суб'єктів випадковим чином розподіляли на групи для проведення досліджень відповідно до наступних шести послідовностей, для одержання тільки Сполуки QD (щодня), тільки ATV/r (300/100 мг QD) і Сполуки + ATV/r QD, причому кожне дослідження проводили протягом чотирнадцяти днів. Дози Сполуки становили 200 мг у дослідженні 1 і 150 мг (еталон) і 85 мг у дослідженні 2. Границі відсутності змін ФК при 90 % довірчих інтервалах (ДІ) навколо середнього геометричного відношення (СГВ) (спільне введення: окремо) становили 70 – 143 % для Сполуки і 70 – 125 % для ATV, при тому що не було рекомендовано регулювання дози при на 30 % меншому впливі інших ліків. Результати У дослідженні 1, 33/61 і в дослідженні 2, 19/30 суб'єктів завершили кожне дослідження; скасування були в основному через відомі побічні дії ATV. Фармакокінетичні результати представлені нижче: Дослідження 1 ППКtau Cmax % СГВ (90 % ДИ) a Сполука (n=33) 200 (185, 216) 185 (169, 203) 8 ATV (n=33) 79,2 (73,6, 85,3) 84,3 (78,2, 90,9) UA 103880 C2 Ctau Дослідження 2 ППКtau Cmax Ctau 288 (253, 327) b Сполука (n=20) 107 (95,1, 121) 90,9 (81,4, 102) 138 (118, 161) 65,5 (59,1, 72,6) ATV (n=20) 88,6 (79,6, 98,7) 96,0 (86,1, 107) 82,6 (71,9, 94,9) a дослідження і еталон 200 мг дослідження 85 мг, еталон 150 мг b 5 10 15 20 25 30 35 40 45 50 55 Ефективність впливу Сполуки підвищувалася при спільному введенні з ATV/r, імовірно завдяки інгібуванню метаболізму UGT1A1/3 на додаток до інгібування CYP3A. Знижену дозу Сполуки вибирали шляхом моделювання різних доз із використанням компартментної моделі на WinNonlin (Pharsight Corporation, Mountain View, CA, USA), що включає спостережувані дані по взаємодії між ліками з атазанавіром з дослідження 1. Були зроблені розрахунки для одержання еквівалентних впливів Сполуки на пацієнтів, що одержували і не одержували атазанавір, за допомогою порівнянь фармакокінетичної (біо)еквівалентності (Pharsight Corporation, Mountain View, CA, USA). Також була приділена увага мінімізації числа індивідуумів із значеннями впливів, що украй різко відхиляються (високими або низькими). Зазначене моделювання було згодом підтверджене клінічними дослідженнями, які встановили, що зазначене зменшення дози приведе до еквівалентних Cmax і ППК для Сполуки, якщо зазначену зменшену дозу вводять разом з атазанавіром/р. Через той факт, що ця взаємодія проявляється як більш ясний ефект при мінімальних (Ctau) концентраціях, зазначена більш низька доза продовжує забезпечувати високі мінімальні концентрації, при цьому обмежуючи непотрібні високі системні впливи Сполуки. Так, дози 85 мг і 150 мг Сполуки з атазанавіром/р як думають, забезпечують такі ж системні впливи (ППК), що і дози 150 мг і 300 мг, посилені ритонавіром, без атазанавіру. Впливи ATV були помірковано нижче при 200 мг Сполуки і не чинили впливу на зменшену дозу 85 мг. Відповідно, зменшені на 20 – 40 % дози Сполуки можна вводити з атазанавіром, забезпечуючи еквівалентний вплив. Висновок Таким чином, відповідно до проведених досліджень, можна вводити зменшену дозу Сполуки (наприклад, 85±10 мг) з атазанавіром і ритонавіром для одержання системного впливу, порівнянного із впливом ще вищої дози Сполуки, що вводиться тільки з ритонавіром. Думають, що атазанавір підсилює фармакокінетичний вплив Сполуки шляхом блокування метаболічного шляху UGT1A1/3 Сполуки. Подібні дослідження проводили для визначення ефекту п'яти різних інгібіторів протеази на фармакокінетику Сполуки. У зазначених дослідженнях застосовували різні дози ритонавіру (100 мг QD або 200 мг BID (двічі в добу)). Виявлено, що три з п'яти досліджених інгібіторів протеази не чинили впливу на фармакокінетику Сполуки. Тільки два (включаючи атазанавір) з п'яти, як виявлено, мали посилюючу дію на фармакокінетику Сполуки. Приклад 2. Фармакокінетична взаємодія між атазанавіром і Сполукою Визначали ефекти спільного введення атазанавіру (ATV) і Сполуки. У зазначеному дослідженні оцінювали безпеку і фармакокінетику в стані рівноваги при спільному введенні Сполуки та ATV. Передумови Елвітегравір (EVG), інгібітор інтегрази ВІЛ, що метаболізується в першу чергу шляхом CYP3A і глюкуронування, показує значно більш високі системні рівні (посилення) при спільному введенні з низькими дозами потужного інгібітору, заснованого на механізмі CYP3A, ритонавіру (EVG/r). У зазначеному дослідженні вивчали здатність атазанавіру (ATV), іншого сильного, але менш потужного інгібітору CYP3A, що також інгібує опосередковуваний УГТ метаболізм, підсилювати вплив EVG у плазмі. Способи Здорові суб'єкти одержували EVG/r 300/100 мг або EVG/ATV 300/400 мг рандомізованим, перехресним чином протягом 10 днів кожний, причому останню дозу вводили разом з маркерним субстратом CYP3A мідазоламом (сироп для прийому всередину; 5 мг) і проводили відбір зразків на фармакокінетику (ФК). Впливи елвітегравіру (введеного з ATV у порівнянні з RTV) оцінювали з довірчим інтервалом (ДІ) 90 % у наступних границях 1) від 80 до 125 % для встановлення еквівалентного посилення або 2) 60 – 167 % для встановлення не погіршених впливів EVG у порівнянні з тими, що спостерігалися, у Фазі 2 і в планованій Фазі 3 досліджень за ФК параметрами ППКtau, Cmax, і Ctau. Фармакокінетику ATV, мідазоламу та ритонавіру також визначали для описової статистики. 9 UA 103880 C2 5 10 15 Результати П'ятнадцять із 18 включених суб'єктів завершили дослідження; 2 суб'єктів зняли через побічні дії (ПД), в одного з них була висипка (одержував EVG/ATV) а в іншого підвищена креатинінфосфокіназа (одержував EVG/r). Не спостерігалося ПД категорії 4 або серйозних ПД. Для набору ФК аналізу (n=14 через один викид) середнє геометричне відношення (90 % ДІ) (EVG/ATV у порівнянні з EVG/r) для EVG Cmax, ППКtau, Ctau становило 108 (99, 119), 107 (95,6, 119), 89,9 (71,4, 113) і середнє T 1/2 EVG становило 5,2 у порівнянні з 6,3 ч. Відповідні величини для мідазоламу становили Cmax, ППК0-last, і ППКinf 98,8 (89,6, 109), 91,8, (83,3, 101), і 89,5 (80,7, 99,3), дозволяючи припустити подібну дію на CYP3A доз ATV 400 і RTV 100 мг при спільному введенні з EVG. Відповідно до інгібування UGT1A1 під дією ATV, середня ППКtau GS-9200, опосередковуваного UGT1A1/3 глюкуронідного метаболіту EVG, була на 37 % нижче при введенні EVG/ATV у порівнянні з EVG/r. Для атазанавіру середні (%КВ) ППК tau і Ctau становили 16300 (29,5 %) нг∙ч/мл і 74,5 (45,7 %) нг/мл, відповідно, і були нижче, ніж раніше отримані дані. Висновки Атаназавір, що вводиться один раз на добу, має здатність до посилення дії EVG шляхом інгібування опосередковуваного CYP3A метаболізму, так само як під дією ритонавіру. Приклад 3. Типовий приклад складів з 6-(3-хлор-2-фторбензил)-1-[(2S)-1-гідрокси-3метилбут-2-іл]-7-метокси-4-оксо-1,4-дигідрохінолін-3-карбоновою кислотою 20 Таблиця 1 Таблетки 200 мг Компонент Сполука Маніт USP Колоїдний діоксид кремнію NF Лаурилсульфат натрію NF Кросповідон NF Гіпромелоза 2910 USP *1 Очищена вода USP Кроскармеліоза натрію NF Стеарат магнію NF Загальна вага таблетки *1 25 30 35 Дія Лікарська речовина Розріджувач Глідант ПАВ Дезінтегрант Сполучне Сполучний засіб Дезінтегрант Лубрикант Кількість на таблетку 200,0 мг 107,6 мг 25,0 мг 10,0 мг 25,0 мг 20,0 мг 100,0 мг 2,4 мг 490,0 мг Очищена вода віддаляється при обробці. У першу чергу Сполуку мікронізували за допомогою струминного млина. Мікронізовану Сполуку потім змішували з манітом, кросповідоном і колоїдним діоксидом кремнію в поліетиленовому (ПЕ) мішку, а потім тричі пропускали крізь сито 500 μм. Гіпромелозу 2910 окремо розчиняли в очищеній воді шляхом перемішування, додавали і розчиняли лаурилсульфат натрію. Суміш маніт/кросповідон/колоїдний діоксид кремнію/Сполука поміщали в гранулятор киплячого шару і гранулювали за допомогою розчину гіпромелози/лаурилсульфата натрію. Після гранулювання вологий гранулят висушували в тому ж самому грануляторі. Висушений гранулят пропускали крізь сито 500 μм. Потім просіяні гранули змішували із кроскармелозою натрію в змішувачі, додавали в змішувач стеарат магнію і змішували. Гранули спресовували в таблетки за допомогою ротаційної таблетувальної машини. Таблиця 2 Таблетки 85 мг Компонент Сполука Лактози моногідрат NF Мікрокристалічна целюлоза NF Лаурилсульфат натрію NF Дія Лікарська речовина Розріджувач Розріджувач ПАВ 10 Кількість на таблетку 85,0 мг 6,2 мг 67,1 мг 6,4 мг UA 103880 C2 Кроскармелоза натрію NF Гідроксипропілцелюлоза NF *1 Очищена вода USP Мікрокристалічна целюлоза NF Кроскармелоза натрію NF Стеарат магнію NF Загальна вага таблетки Дезінтегрант Сполучне Сполучний засіб Розріджувач Дезінтегрант Лубрикант 19,1 мг 4,2 мг 17,0 мг 6,4 мг 1,1 мг 212,5 мг *1 5 10 15 Очищена вода видаляється при обробці. У першу чергу Сполуку мікронізували за допомогою струминного млина. Мікронізовану Сполуку потім змішували з моногідратом лактози, мікрокристалічною целюлозою і кроскармелозою натрію в грануляторі киплячого шару. Гідроксипропілцелюлозу окремо розчиняли в очищеній воді шляхом перемішування, додавали і розчиняли лаурилсульфат натрію. Суміш моногідрату лактози/мікрокристалічної целюлози/кроскармелози натрію/сполуки гранулювали в грануляторі киплячого шару за допомогою розчину гідроксипропілцеллюлози/лаурилсульфата натрію. Після гранулювання вологий гранулят висушували в тому ж самому грануляторі. Висушені гранули пропускали крізь сито 500 μм. Потім просіяні гранули змішували з мікрокристалічною целюлозою і кроскармелозою натрію в змішувачі, додавали в змішувач стеарат магнію і змішували. Гранули спресовували в таблетки за допомогою ротаційної таблетувальної машини. Приклад 4. Типові приклади складів з 6-(3-хлор-2-фторбензил)-1-[(2S)-1-гідрокси-3метилбут-2-іл]-7-метокси-4-оксо-1,4-дигідрохінолін-3-карбоновою кислотою (Сполука) Компоненти Кількість (% вага.) 40,0 85 мг Сполука (мікронізована) Лактози моногідрат, NF (Fast Flo 2,9 316) Мікрокристалічна целюлоза, NF 39,35 (Avicel PH-101) Гідроксипропілцелюлоза, NF 2,0 (Klucel EF) Лаурилсульфат натрію, NF 3,0 (Stepanol WA-100) Кроскармелоза натрію, NF (Ac12,0 Di-Sol) Стеарат магнію, NF (Code 5712) 0,75 Очищена вода, USP Разом 100,0 Сполука плівкового покриття: Opadry II Green 85F91203 Очищена вода, USP Не визначено 20 25 30 150 мг 300 мг 85,0 150,0 300,0 6,2 10,9 21,7 83,6 147,6 295,1 4,2 7,5 15,0 6,4 11,2 22,5 25,5 45,0 90,0 1,6 212,5 6,4 2,8 375,0 11,3 5,7 750,0 22,5 Всі посилальні матеріали, включаючи публікації, заявки на патенти і патенти, процитовані в даному документі, повністю включені в його сполуку за допомогою посилань. Використання термінів в однині і подібних позначеннях у контексті опису даного винаходу (включаючи наступну формулу винаходу) варто розглядати як включаюче і єдине, і множина, якщо інше не домовлено або не пропонується контекстом у явній формі. Терміни "що включає", "що має", "що полягає" і "що містить" варто розглядати як незамкнуті терміни (тобто, що означають "що включає, але не обмежений цим"), якщо не домовлено інше. Перерахування діапазонів величин у даному документі призначено тільки служити скороченим способом посилатися окремо на кожну окрему величину, що входить у зазначений діапазон, якщо не домовлено інше, і кожна окрема величина включена в даний опис, як якби вона була окремо перерахована в даному документі. Всі описані способи можна здійснити будь-яким придатним чином, якщо не домовлено інше, або якщо інше явно не пропонується контекстом. Використання будь-якого і всіх прикладів, або мови прикладів (наприклад, "такий як"), представлених у даному описі, призначено тільки для кращого ілюстрування винаходу і не 11 UA 103880 C2 5 10 15 20 25 30 35 40 45 50 55 накладає обмежень на об'єм винаходу, якщо у формулі винаходу не зазначено інше. Мову опису не слід розглядати як вказівку на будь-який елемент, що не входить у формулу винаходу, як на істотну частину реалізації винаходу. Варіанти реалізації в даному описі забезпечують ілюстрацію варіантів реалізації даного винаходу і не повинні розглядатися як такі, що обмежують об'єм винаходу. Кваліфікованому фахівцеві зрозуміло, що в заявлений винахід входить безліч інших варіантів реалізації, і що передбачається, що опис і приклади розглядають тільки як приклад, тоді як істинний об'єм і сутність винаходу показані в наступній формулі винаходу. ФОРМУЛА ВИНАХОДУ 1. Застосування сполуки 6-(3-хлор-2-фторбензил)-1-[(2S)-1-гідрокси-3-метилбут-2-ил]-7-метоксі4-оксо-1,4-дигідрохінолін-3-карбонової кислоти у кількості від 75 мг до 95 мг, від 125 мг до 175 мг, від 150 мг до 200 мг або від 250 мг до 350 мг або її фармацевтично прийнятної солі в одній дозованій формі та атазанавіру у кількості від 150 мг до 550 мг або його фармацевтично прийнятної солі в іншій дозованій формі для профілактики або терапевтичного лікування вірусу імунодефіциту людини (ВІЛ). 2. Застосування за п. 1, яке відрізняється тим, що людині вводять від 75 мг до 95 мг 6-(3-хлор2-фторбензил)-1-[(2S)-1-гідрокси-3-метилбут-2-ил]-7-метоксі-4-оксо-1,4-дигідрохінолін-3карбонової або її фармацевтично прийнятної солі. 3. Застосування за п. 1, яке відрізняється тим, що людині вводять від 125 мг до 175 мг 6-(3хлор-2-фторбензил)-1-[(2S)-1-гідрокси-3-метилбут-2-ил]-7-метоксі-4-оксо-1,4-дигідрохінолін-3карбонової кислоти або її фармацевтично прийнятної солі. 4. Застосування за п. 1, яке відрізняється тим, що людині вводять від 150 мг до 200 мг 6-(3хлор-2-фторбензил)-1-[(2S)-1-гідрокси-3-метилбут-2-ил]-7-метоксі-4-оксо-1,4-дигідрохінолін-3карбонової кислоти або її фармацевтично прийнятної солі. 5. Застосування за п. 1, яке відрізняється тим, що людині вводять від 250 мг до 350 мг 6-(3хлор-2-фторбензил)-1-[(2S)-1-гідрокси-3-метилбут-2-ил]-7-метоксі-4-оксо-1,4-дигідрохінолін-3карбонової кислоти або її фармацевтично прийнятної солі. 6. Застосування за будь-яким з пп. 1-5, яке відрізняється тим, що передбачає спільне введення6-(3-хлор-2-фторбензил)-1-[(2S)-1-гідрокси-3-метилбут-2-ил]-7-метоксі-4-оксо-1,4дигідрохінолін-3-карбонової кислоти або її фармацевтично прийнятної солі та атазанавіру або його фармацевтично прийнятної солі. 7. Застосування за будь-яким з пп. 1-5, яке відрізняється тим, що передбачає введення єдиної дозованої форми, що містить 6-(3-хлор-2-фторбензил)-1-[(2S)-1-гідрокси-3-метилбут-2-ил]-7метоксі-4-оксо-1,4-дигідрохінолін-3-карбонову кислоту або її фармацевтично прийнятну сіль та атазанавір або його фармацевтично прийнятну сіль. 8. Застосування за будь-яким з пп. 1-7, яке додатково передбачає введення дозованої форми ритонавіру або його фармацевтично прийнятної солі. 9. Застосування за п. 8, яке відрізняється тим, що передбачає спільне введення 6-(3-хлор-2фторбензил)-1-[(2S)-1-гідрокси-3-метилбут-2-ил]-7-метоксі-4-оксо-1,4-дигідрохінолін-3карбонової кислоти або її фармацевтично прийнятної солі та ритонавіру або його фармацевтично прийнятної солі. 10. Застосування за п. 8, яке відрізняється тим, що передбачає введення єдиної дозованої форми, що містить 6-(3-хлор-2-фторбензил)-1-[(2S)-1-гідрокси-3-метилбут-2-ил]-7-метоксі-4оксо-1,4-дигідрохінолін-3-карбонову кислоту або її фармацевтично прийнятну сіль та ритонавір або його фармацевтично прийнятну сіль. 11. Застосування за п. 8, яке відрізняється тим, що передбачає спільне введення атазанавіру або його фармацевтично прийнятної солі та ритонавіру або його фармацевтично прийнятної солі. 12. Застосування за п. 8, яке відрізняється тим, що передбачає введення єдиної дозованої форми, що містить атазанавір або його фармацевтично прийнятну сіль та ритонавір або його фармацевтично прийнятну сіль. 13. Застосування за будь-яким з пп. 1-12, яке відрізняється тим, що вводять від 150 мг до 450 мг атазанавіру або його фармацевтично прийнятної солі. 14. Застосування за будь-яким з пп. 1-12, яке відрізняється тим, що вводять від 250 мг до 550 мг атазанавіру або його фармацевтично прийнятної солі. 15. Застосування за будь-яким з пп. 8-14, яке відрізняється тим, що людині вводять від 50 мг до 150 мг ритонавіру або його фармацевтично прийнятної солі. 12 UA 103880 C2 5 10 15 20 25 30 35 40 45 50 55 60 16. Застосування сполуки 6-(3-хлор-2-фторбензил)-1-[(2S)-1-гідрокси-3-метилбут-2-ил]-7метоксі-4-оксо-1,4-дигідрохінолін-3-карбонової кислоти у дозованій формі, яка містить 85 мг цієї сполуки або її фармацевтично прийнятної солі, атазанавіру у дозованій формі, яка містить 300 мг атаназавіру або його фармацевтично прийнятної солі, ритонавіру у дозованій формі, яка містить 100 мг ритонавіру або його фармацевтично прийнятної солі, для профілактики або терапевтичного лікування вірусу імунодефіциту людини (ВІЛ). 17. Застосування за п. 16, яке відрізняється тим, що передбачає спільне введення 6-(3-хлор-2фторбензил)-1-[(2S)-1-гідрокси-3-метилбут-2-ил]-7-метоксі-4-оксо-1,4-дигідрохінолін-3карбонової кислоти або її фармацевтично прийнятної солі та атазанавіру або його фармацевтично прийнятної солі, ритонавіру або його фармацевтично прийнятної солі. 18. Композиція для профілактики або терапевтичного лікування вірусу імунодефіциту людини (ВІЛ), що містить 6-(3-хлор-2-фторбензил)-1-[(2S)-1-гідрокси-3-метилбут-2-ил]-7-метоксі-4-оксо1,4-дигідрохінолін-3-карбонову кислоту у кількості від 75 мг до 95 мг, від 125 мг до 175 мг, від 150 мг до 200 мг або від 250 мг до 350 мг або її фармацевтично прийнятну сіль; атазанавір у кількості від 150 мг до 550 мг або його фармацевтично прийнятну сіль та фармацевтично прийнятний носій або розріджувач. 19. Композиція за п. 18, яка містить від 75 мг до 95 мг 6-(3-хлор-2-фторбензил)-1-[(2S)-1гідрокси-3-метилбут-2-ил]-7-метоксі-4-оксо-1,4-дигідрохінолін-3-карбонової кислоти або її фармацевтично прийнятної солі. 20. Композиція за п. 18, яка містить від 125 мг до 175 мг 6-(3-хлор-2-фторбензил)-1-[(2S)-1гідрокси-3-метилбут-2-ил]-7-метоксі-4-оксо-1,4-дигідрохінолін-3-карбонової кислоти або її фармацевтично прийнятної солі. 21. Композиція за п. 18, яка містить від 150 мг до 200 мг 6-(3-хлор-2-фторбензил)-1-[(2S)-1гідрокси-3-метилбут-2-ил]-7-метоксі-4-оксо-1,4-дигідрохінолін-3-карбонової кислоти або її фармацевтично прийнятної солі. 22. Композиція за п. 18, яка містить від 250 мг до 350 мг 6-(3-хлор-2-фторбензил)-1-[(2S)-1гідрокси-3-метилбут-2-ил]-7-метоксі-4-оксо-1,4-дигідрохінолін-3-карбонової кислоти або її фармацевтично прийнятної солі. 23. Композиція за п. 18, яка містить від 150 мг до 450 мг атазанавіру або його фармацевтично прийнятної солі. 24. Композиція за п. 18, яка містить від 250 мг до 550 мг атазанавіру або його фармацевтично прийнятної солі. 25. Композиція за будь-яким з пп. 18-24, яка додатково містить ритонавір або його фармацевтично прийнятну сіль. 26. Композиція за п. 25, яка містить від 50 мг до 150 мг ритонавіру або його фармацевтично прийнятної солі. 27. Композиція для профілактики або терапевтичного лікування вірусу імунодефіциту людини (ВІЛ), що містить 6-(3-хлор-2-фторбензил)-1-[(2S)-1-гідрокси-3-метилбут-2-ил]-7-метоксі-4-оксо1,4-дигідрохінолін-3-карбонову кислоту у кількості 85 мг або її фармацевтично прийнятну сіль; атазанавір у кількості 300 мг або його фармацевтично прийнятну сіль; ритонавір у кількості 100 мг або його фармацевтично прийнятну сіль та фармацевтично прийнятний носій або розріджувач. 28. Набір для профілактики або терапевтичного лікування вірусу імунодефіциту людини (ВІЛ), який включає: (1) 6-(3-хлор-2-фторбензил)-1-[(2S)-1-гідрокси-3-метилбут-2-ил]-7-метоксі-4-оксо1,4-дигідрохінолін-3-карбонову кислоту у кількості від 75 мг до 95 мг, від 125 мг до 175 мг, від 150 мг до 200 мг або від 250 мг до 350 мг або її фармацевтично прийнятну сіль; (2) атазанавір у кількості від 150 мг до 550 мг або його фармацевтично прийнятну сіль; та (3) один або більше контейнерів. 29. Набір за п. 28, який включає від 75 до 95 мг 6-(3-хлор-2-фторбензил)-1-[(2S)-1-гідрокси-3метилбут-2-ил]-7-метоксі-4-оксо-1,4-дигідрохінолін-3-карбонової кислоти або її фармацевтично прийнятної солі. 30. Набір за п. 28, який включає від 125 до 175 мг 6-(3-хлор-2-фторбензил)-1-[(2S)-1-гідрокси-3метилбут-2-ил]-7-метоксі-4-оксо-1,4-дигідрохінолін-3-карбонової кислоти або її фармацевтично прийнятної солі. 31. Набір за п. 28, який включає від 150 мг до 200 мг 6-(3-хлор-2-фторбензил)-1-[(2S)-1-гідрокси3-метилбут-2-ил]-7-метоксі-4-оксо-1,4-дигідрохінолін-3-карбонової кислоти або її фармацевтично прийнятної солі. 32. Набір за п. 28, який включає від 250 мг до 350 мг 6-(3-хлор-2-фторбензил)-1-[(2S)-1-гідрокси3-метилбут-2-ил]-7-метоксі-4-оксо-1,4-дигідрохінолін-3-карбонової кислоти або її фармацевтично прийнятної солі. 13 UA 103880 C2 5 10 15 20 25 30 35 40 45 50 55 60 33. Набір за п. 28, який включає від 150 мг до 450 мг атазанавіру або його фармацевтично прийнятної солі. 34. Набір за п. 28, який включає від 250 мг до 550 мг атазанавіру або його фармацевтично прийнятної солі. 35. Набір за будь-яким з пп. 28-34, який додатково включає ритонавір або його фармацевтично прийнятну сіль. 36. Набір за п. 35, який включає від 50 мг до 150 мг ритонавіру або його фармацевтично прийнятної солі. 37. Набір для профілактики або терапевтичного лікування вірусу імунодефіциту людини (ВІЛ), який включає: (1) 6-(3-хлор-2-фторбензил)-1-[(2S)-1-гідрокси-3-метилбут-2-ил]-7-метоксі-4-оксо1,4-дигідрохінолін-3-карбонову кислоту у дозованій формі, яка містить 85 мг цієї сполуки, або її фармацевтично прийнятну сіль; (2) атазанавір у дозованій формі, яка містить 300 мг атазанавіру, або його фармацевтично прийнятну сіль; (3) ритонавір у дозованій формі, яка містить 100 мг ритонавіру, або його фармацевтично прийнятну сіль; та (4) один або більше контейнерів. 38. Застосування 6-(3-хлор-2-фторбензил)-1-[(2S)-1-гідрокси-3-метилбут-2-ил]-7-метоксі-4-оксо1,4-дигідрохінолін-3-карбонової кислоти у кількості від 75 мг до 95 мг, від 125 мг до 175 мг, від 150 мг до 200 мг або від 250 мг до 350 мг або її фармацевтично прийнятної солі разом з атазанавіром у кількості від 150 мг до 550 мг або його фармацевтично прийнятною сіллю у виробництві ліків для профілактики або терапевтичного лікування вірусу імунодефіциту людини (ВІЛ). 39. Застосування 6-(3-хлор-2-фторбензил)-1-[(2S)-1-гідрокси-3-метилбут-2-ил]-7-метоксі-4-оксо1,4-дигідрохінолін-3-карбонової кислоти у кількості від 75 мг до 95 мг, від 125 мг до 175 мг, від 150 мг до 200 мг або від 250 мг до 350 мг або її фармацевтично прийнятної солі разом з атазанавіром у кількості від 150 мг до 550 мг або його фармацевтично прийнятною сіллю та з ритонавіром або його фармацевтично прийнятною сіллю у виробництві ліків для профілактики або терапевтичного лікування вірусу імунодефіциту людини (ВІЛ). 40. Застосування 6-(3-хлор-2-фторбензил)-1-[(2S)-1-гідрокси-3-метилбут-2-ил]-7-метоксі-4-оксо1,4-дигідрохінолін-3-карбонової кислоти у кількості 85 мг або її фармацевтично прийнятної солі, атазанавіру у кількості 300 мг або його фармацевтично прийнятної солі та ритонавіру у кількості 100 мг або його фармацевтично прийнятної солі у виробництві ліків для профілактики або терапевтичного лікування вірусу імунодефіциту людини (ВІЛ). 41. Застосування 6-(3-хлор-2-фторбензил)-1-[(2S)-1-гідрокси-3-метилбут-2-ил]-7-метоксі-4-оксо1,4-дигідрохінолін-3-карбонової кислоти у кількості від 75 мг до 95 мг, від 125 мг до 175 мг, від 150 мг до 200 мг або від 250 мг до 350 мг або її фармацевтично прийнятної солі разом з атазанавіром у кількості від 150 мг до 550 мг або його фармацевтично прийнятною сіллю у виробництві ліків для інгібування активності ретровірусної інтегрази в людини. 42. Застосування 6-(3-хлор-2-фторбензил)-1-[(2S)-1-гідрокси-3-метилбут-2-ил]-7-метоксі-4-оксо1,4-дигідрохінолін-3-карбонової кислоти у кількості від 75 мг до 95 мг, від 125 мг до 175 мг, від 150 мг до 200 мг або від 250 мг до 350 мг або її фармацевтично прийнятної солі разом з атазанавіром у кількості від 150 мг до 550 мг або його фармацевтично прийнятною сіллю та з ритонавіром або його фармацевтично прийнятною сіллю у виробництві ліків для інгібування активності ретровірусної інтегрази в людини. 43. Застосування 6-(3-хлор-2-фторбензил)-1-[(2S)-1-гідрокси-3-метилбут-2-ил]-7-метоксі-4-оксо1,4-дигідрохінолін-3-карбонової кислоти у кількості 85 мг або її фармацевтично прийнятної солі, атазанавіру у кількості 300 мг або його фармацевтично прийнятної солі та ритонавіру у кількості 100 мг або його фармацевтично прийнятної солі у виробництві ліків для інгібування активності ретровірусної інтегрази в людини. 44. Композиція для профілактики або терапевтичного лікування вірусу імунодефіциту людини (ВІЛ), що містить 6-(3-хлор-2-фторбензил)-1-[(2S)-1-гідрокси-3-метилбут-2-ил]-7-метоксі-4-оксо1,4-дигідрохінолін-3-карбонову кислоту у кількості від 75 мг до 95 мг, від 125 мг до 175 мг, від 150 мг до 200 мг або від 250 мг до 350 мг або її фармацевтично прийнятну сіль; атазанавір у кількості від 150 мг до 550 мг або його фармацевтично прийнятну сіль; ритонавір або його фармацевтично прийнятну сіль та фармацевтично прийнятний носій або розріджувач. 45. Набір для профілактики або терапевтичного лікування вірусу імунодефіциту людини (ВІЛ), що містить (1) 6-(3-хлор-2-фторбензил)-1-[(2S)-1-гідрокси-3-метилбут-2-ил]-7-метоксі-4-оксо-1,4дигідрохінолін-3-карбонову кислоту у кількості від 75 мг до 95 мг, від 125 мг до 175 мг, від 150 мг до 200 мг або від 250 мг до 350 мг або її фармацевтично прийнятну сіль; (2) атазанавір у кількості від 150 мг до 550 мг або його фармацевтично прийнятну сіль; (3) ритонавір або його фармацевтично прийнятну сіль; (4) один або більше контейнерів; та (5) інструкцію із 14 UA 103880 C2 5 10 застосування, що передбачає введення 6-(3-хлор-2-фторбензил)-1-[(2S)-1-гідрокси-3-метилбут2-ил]-7-метоксі-4-оксо-1,4-дигідрохінолін-3-карбонової кислоти або її фармацевтично прийнятної солі разом з ритонавіром або його фармацевтично прийнятною сіллю, причому активні інгредієнти необов’язково знаходяться в одній дозованій формі. 46. Набір для профілактики або терапевтичного лікування вірусу імунодефіциту людини (ВІЛ), що містить (1) 6-(3-хлор-2-фторбензил)-1-[(2S)-1-гідрокси-3-метилбут-2-ил]-7-метоксі-4-оксо-1,4дигідрохінолін-3-карбонову кислоту у кількості 85 мг або її фармацевтично прийнятну сіль; (2) атазанавір у кількості 300 мг або його фармацевтично прийнятну сіль; (3) ритонавір у кількості 100 мг або його фармацевтично прийнятну сіль; (4) один або більше контейнерів; та (5) інструкцію із застосування, що передбачає введення 6-(3-хлор-2-фторбензил)-1-[(2S)-1-гідрокси3-метилбут-2-ил]-7-метоксі-4-оксо-1,4-дигідрохінолін-3-карбонової кислоти або її фармацевтично прийнятної солі разом з ритонавіром або його фармацевтично прийнятною сіллю, причому активні інгредієнти необов’язково знаходяться в одній дозованій формі. Комп’ютерна верстка І. Скворцова Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 15
ДивитисяДодаткова інформація
Назва патенту англійськоюTherapeutic compositions and the use thereof
Автори російськоюKearney, Brian, P., Mathias, Anita A., Ramanathan, Srinivasan
МПК / Мітки
МПК: A61K 31/426, A61P 31/18, A61K 31/4402, A61K 31/47
Мітки: людини, вірусом, лікування, імунодефіциту, профілактика, викликаної, інфекції, терапевтичне
Код посилання
<a href="https://ua.patents.su/17-103880-profilaktika-abo-terapevtichne-likuvannya-infekci-viklikano-virusom-imunodeficitu-lyudini.html" target="_blank" rel="follow" title="База патентів України">Профілактика або терапевтичне лікування інфекції, викликаної вірусом імунодефіциту людини</a>
Попередній патент: Композиція холодоагенту
Наступний патент: Профілактика або терапевтичне лікування інфекції, викликаної вірусом імунодефіциту людини
Випадковий патент: Запобіжний роз'єм