Спосіб інгібування ретровірусної інфекції, яка викликана вірусом імунодефіциту людини (віл), спосіб інгібування вірусу імунодефіциту людини (віл)
Формула / Реферат
1. Способ ингибирования ретровирусной инфекции, вызванной вирусом иммунодефицита человека (ВИЧ), заключающийся во введении пациенту, нуждающемуся в лечении, серинового ингибитора протеазы лейкоцитов (СЛПИ) в количестве, достаточном для блокирования ретровирусной инфекции.
2. Способ ингибирования вируса иммунодефицита человека (ВИЧ), заключающийся во введении пациенту, нуждающемуся в лечении, аналога серинового ингибитора протеазы лейкоцитов (СЛПИ), выбранного из группы, состоящей из СЛПИ Phe 72 мутеина, СЛПИ Gly 20 мутеина, СЛПИ Gly 72 мутеина, СЛПИ Val 72 мутеина, СЛПИ Phe 25 мутеин, СЛПИ Gly 25 мутеин и СЛПИ Val 25 мутен.
Текст
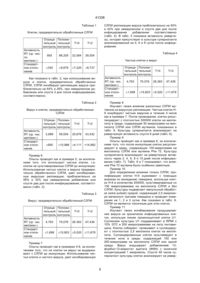
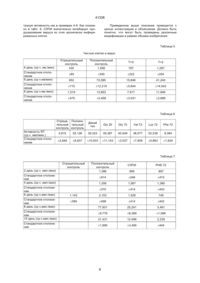
1. Способ ингибирования ретровирусной инфекции, вызванной вирусом иммунодефицита человека (ВИЧ), заключающийся во введении пациенту, нуждающемуся в лечении, серинового ингибитора протеазы лейкоцитов (СЛПИ) в количестве, достаточном для блокирования ретровирусной инфекции. 2. Способ ингибирования вируса иммунодефицита человека (ВИЧ), заключающийся во введении пациенту, нуждающемуся в лечении, аналога серинового ингибитора протеазы лейкоцитов (СЛПИ), выбранного из группы, состоящей из СЛПИ Phe 72 мутеина, СЛПИ Gly 20 мутеина, СЛПИ Gly 72 мутеина, СЛПИ Val 72 мутеина, СЛПИ Phe 25 мутеин, СЛПИ Gly 25 мутеин и СЛПИ Val 25 мутеин. (19) (21) 95048317 (22) 09.09.1993 (24) 17.09.2001 (31) 07/943369 (32) 09.09.1992 (33) US (86) PCT/US93/08486, 09.09.1993 (46) 17.09.2001, Бюл. № 8, 2001 р. (72) Ейзенберг Стівен, US, Вохл Шарон, US, Томпсон Роберт, US (73) АМГЕН ІНК, US (56) 1. US 4760130 A, 1988. 2. WO 86/03519 A, 1986. 3. EP 0252057 A, 1988. 4. EP 0384559 A, 1990. 5. WO 91/08769 A, 1991. 6. EP 0346500 A1, 1989. 41338 но их возникающая за счет вируса дисфункция может вносить вклад в повышенную воспримчивость к условно-патогенным инфекциям, которые являются признаком СПИД. Так как моноцит-макрофаги служат в качестве резервуаров для ВИЧ-1, введение селективной метки в эту популяцию, дополнительно к Т-лимфоцитам, заслуживает дальнейшего рассмотрения (Finberg, R.W., et. al., Science 252: 1703-05, 1991. Ранние сообщения группы Fox (JADA 118:709-711, 1989) указывают, что компонент слюны человека блокирует репликацию ВИЧ. Недавно, Hatttori (FEBS Lett. 248:48-52, 1989) показал,что ингибитор триптазы (трипсин-подобного фермента) может ингибировать образование синцитий Т-клеток индуцируемое ВИЧ. При исследовании различных потенциальных модуляторов инфекции ВИЧ-1, недавно авторы идентифицировали эндогенный источник ингибирующей активности, который замедляет инфицирование и/или репликацию ВИЧ-1. Фактором ответственным за противовирусную активность является сериновый ингибитор протеазы лейкоцитов (СЛПИ). СЛПИ является сильнодействующим ингибитором эластазы лейкоцита человека и катепсина G и трипсина человека и был выделен из паротидных секреций (Thompson, R.C., and K.Ohlsson, (1986) Proc. Natl. Acad. Sci. USA, 83:6692-96; и US патент № 4760130). СЛПИ является теперь доступным за счет получения с помощью рекомбинантной ДНК; US патентная заявка № 07/712354, поданная 7 июня 1991 и заявка РСТ публикация № WO 86/03519, поданная 4 декабря 1985). Способность СЛПИ и/или его производных и аналогов блокировать инфицирование и/или репликацию ВИЧ-1 может быть основанием для терапевтического воздействия на инфекцию ВИЧ-1. Настоящее изобретение обеспечивает новые способы для профилактики или лечения ретровирусных инфекций клеток млекопитающих, в частности, профилактику инфекции клеток человека зараженного вирусом иммунодифицита человека (ВИЧ) и сопутствующих заболеваний, включая синдром приобретенного иммунодифицита человека (СПИД). В объем этого изобретения включены фармацевтические композиции для лечения ретровирусных инфекций, в частности инфекции ВИЧ у человека, включающие сериновый ингибитор протеазы лейкоцитов (СЛПИ), или его аналог или его производное, и фармацевтически приемлемый носитель. Изобретение также включает способ лечения инфекций ВИЧ в клетках человека, включающий введение ему эффективного количества СЛПИ или его аналога или его производного. На фиг. 1 изображено как СЛПИ блокирует репликацию ВИЧ в моноцитах в зависимости от дозы. Выделенные моноциты человека высевают на чашки и выдерживают с ВИЧ-СЛПИ в течение 1 часа при 37°С, промывают и инкубируют при 37°С, удаляя надосадочные жидкости и добавляя свежую среду каждые четыре дня. ЕС50 для этих экспериментов была менее 0,1 мг/мл (8,5 наномоль) с полным ингибированием при 10 мг/мл (850 Нмоль). Как показано на фиг. 2, ингибирующий эффект СЛПИ является длительным. На 18 сутки ВИЧ еще ингибирован на 90%. Настоящее изобретение обеспечивает способы профилактики ретровирусов, в частности, инфекции ВИЧ клеток млекопитающего, в частности, клеток человека и сопутствющих заболеваний, включая синдром приобретенного иммунодифицита человека (СПИД). Термин "фармацевтически приемлемый носитель" как он использован здесь обозначает нетоксичный, обычно инертный носитель для активного ингредиента, который не оказывает вредного влияния на ингредиент или на пациента которому вводят композицию. Термин "эффективное количество", как он использован здесь, обозначает предварительно определенное количество СЛПИ, или его аналога или его производного, достаточное для того чтобы быть эффективным против ВИЧ in vivo. Согласно настоящему изобретению ретровирусные инфекции лечат введением противовирусных агентов в дозах достаточных для снижения влияния таких инфекций. Ретровирусные инфекции причастны к ряду заболеваний, включая (но не ограничиваясь ими) рак, аутоиммунные заболевания и синдром приобретенного иммунодефицита. Инфекция вируса иммунодефицита человека представляет особый интерес согласно настоящему изобретению. Различные противовирусные агенты известны в области, занимающейся этими проблемами. Большинство из них ингибирует активность ретровирусной ревертазы и включает зидовудин (АЗТ) аналог тимидина, дидэзоксиинозин (ддИ), и дидэзоксицитозин (ддЦ). Зидовудин является основным противовирусным лекарством используемым при лечении инфекции ВИЧ. Противовирусные агенты являются обычно эффективными в дозах в области от около 50 мг/день до около 1000 мг/день, более предпочтительно, от около 100 мг/день до около 500 мг/день, и в случае зидовудина, особенно около 300 мг/день до 500 мг/день. Эти агенты обычно вводят в форме оральных композиций. Ингибиторы протеазы, использованные в этом изобретении. могут быть получены с помощью хорошо известных в этой области способов (см. патент США 4760130, Европейскую патентную заявку 85905 953.7, заявку РСТ WO 86/03519 и патентную заявку США 07/712,354). Настоящее изобретение относится к ингибиторам протеазы, которые выделены в чистой форме. Предпочтительно, сериновые ингибиторы протеазы по настоящему изобретению являются протеинами с однопептидной цепью, которые являются, по существу, гомологами, и более предпочтительно, биологически эквивалентными нативному сериновому ингибитору протеазы, выделенному из паротидных секреций человека. Нативный сериновый ингибитор относится также к нативному паротидному ингибитору. Термином "биологически эквивалентный", как он использован повсюду в описании и в формуле изобретения, обозначают, что композиции способны ингибировать полученную из моноцита протеазу, которая ингибируется СЛПИ, но необязательно в той же самой степени. Термином "производные", как 2 41338 используют повсюду в последующем описании и в формуле изобретения, обозначают степень гомологичности аминокислоты с нативным паротидным ингибитором, предпочтительно превышающую 40%, более предпочтительно 50%, с преимущественно предпочтительными группами протеинов, являющимися более чем на 60% гомологичными с нативным паротидным ингибитором. Процент гомологичности, как описано выше, расчитывают как процент компонентов, найденных в меньшей из двух последовательностей, которые могут быть найдены в большей из двух последовательностей, причем под компонентом понимают последовательность четырех соседних аминокислот. Одно из полезных СЛПИ производных представляет СЛПИ, усеченную молекулу СЛПИ, содержащую только последние 60 аминокислот нативного паротидного ингибитора. Эти 60 аминокислот являются: татка под номерами Gly 20, Gly 75, Val 72, b Phe 72. СЛПИ мутеины также включаются в объем изобретения. СЛПИ мутеины, которые соответствуют СЛПИ мутеинам Gly 72, Val 25 и Phe 72, здесь называются как Gly 25, Val 25 и Phe 25. Некоторые рассматриваемые СЛПИ мутеины имеют следующую аминокислотную последовательность: где R7 представляет собой аланин и R3, R4, R5, R6, R8 и R9 являются одинаковыми или различными аминокислотами и один или более из R4, R3, R5, R6, R8 и R9 могут быть метионином, валином, аланином, фенилаланином, тирозином, триптофаном, лизином, глицином, или аргинином. Аналоги также включают, например, PEG-илированные формы СЛПИ или СЛПИ, который может иметь улучшенные терапевтические характеристики по сравнению с нативным протеином. Мутеины, которые могут быть пригодны для PEG-илирования включают мутеины, которые содержат цистеиновый остаток в положениях 13, 23, 52, 58, 68 и/или 75 СЛПИ и при соответствующих сайтах 5, 11, 21 и 28 в СЛПИ. Получение цистеиновых мутеинов для PEG-илирования раскрыто в заявке РСТ WO 92/16221, поданной 13 марта, 1992, которая вводится здесь ссылкой. Полезная стадия при получении мутеина может включать стадию рефолдинга (refolding), в которой цистеин добавляют к раствору, содержащему протеин. Цистеин может добавляться в стадию разворачивания и может связываться с замещенным свободным цистеином в мутеине. Можно также выделить из моноцитов СЛПИ ингибируемый протеин (СИП) из моноцитных клеток человека, используя стандартные биохимические процедуры, хорошо известные для специалистов в этой области, и выделять протеины с протеолитической активностью, которые ингибируются СЛПИ. После выделения протеина (и, при необходимости, его секвенирования, клонирования его гена и экспрессирования его в клетки хозяина, т.е. рекомбинантного получения СИП) можно скринировать егопо способности ингибировать СИП с помощью приемов, хорошо известных в этой области. Или же можно определять их структуру и конструировать из них ингибиторы, также с помощью приемов, хорошо известных специалистам в этой области. Если СЛПИ или его аналог или производное используют для борьбы с инфекциями ВИЧ у человека, соединение может быть введено орально или парентерально, в носителе, включающем один или более из фармацевтически приемлемых носителей, количество которого определяют растворимостью и химической природой соединения, выбранного пути введения и стандартной биологической практикой. Для орального введения СЛПИ, или его аналог, или его производное, могут быть приготовлены в стандартных дозированных формах таких как капсулы или таблетки, каждая из которых содержит определенное количество активного ингредиента, и от около 10 до 1000 мг, более предпочтительно, 10-200 мг в день для паци Следующую нуклеотидную последовательность используют для кодирования приведенных выше молекул из 60 аминокислот: СЛПИ был построен за счет делении из сигнальной последовательности СЛПИ гена и нуклеотидов, соответствующих первым 47 аминокислотам зрелого СЛПИ протеина, как описано в патентной заявке США 07/712354. СЛПИ может быть также получен по способу примера 8, описанному в заявке РСТ WO 86/03519 и Европейской патентной заявке 85905953.7. Хотя пример 8 в этих двух заявках раскрывает способы получения СЛПИ, этот способ можеет быть также использован для того, чтобы получить СЛПИ. СЛПИ может быть использован для выработки антител, пригодных для очистки СЛПИ. Антитела могут быть получены, например, способами, описанными в Е. Наrlow and D. Lane, Antibodies: A Laboratory Manual, p. 92-114 (Cold Springs Harbor Laboratory, 1988). Термином "аналоги", как он использован здесь, обозначают любое соединение, включающее, например, небольшие органические соединения, которые функционально биологически эквиваленты СЛПИ в ингибировании инфекции ВИЧ. Такие производные и аналоги могут быть выделены способами, хорошо известными специалистам в этой области, включающими использование клеток моноцитов для скринирования соединений, которые предотвращают связывание СЛПИ с ними. Аналоги могут также включать специфические СЛПИ мутеины, которые имееют, по крайней мере, эквивалентную, а в некоторых случаях более высокую активность, чем нативный протеин. Особенно полезные СЛПИ мутеины включают замещение следующих аминокислот в положениях ос 3 41338 ента, даже более предпочтительно, 20-200 мг в день для пациента, в фармацевтически приемлемом носителе. Для парентерального введения СЛПИ, его аналог или его производное, вводят либо с помощью внутривенной, либо подкожной или внутримышечной инъекции, в композиции с фармацевтически приемлемыми связующими или носителями. Для введения путем инъекции, предпочтительно, используют соединение в растворе в стерильном водном носителе, которое может также содержать другие сорастворители, такие как буферы, или консерванты, а также достаточные количества фармацевтически приемлемых солей или глюкозы для того чтобы сделать раствор изотоническим. Подкожные инъекции являются предпочтительным путем введения. Дозы в основном являются такими же, как те, которые определены выше для орального введения. Подходящие связующие или носители для отмеченных выше композиций могут быть найдены в стандартных фармацевтических руководствах, например, в "Remington's Pharmaceutical Sciences", 16th ed., Mack Publishing Company, Easton, PA, 1980. Дозы соединения будут меняться в зависимости от формы введения и свойства выбранного активного агента. Более того, они будут изменяться в зависимости от особенностей пациента или хозяина (включающего млекопитающих, включающих людей), которые подвергаются лечению. Обычно, лечение начинают малыми дозами, существенно меньшими, чем оптимальная доза соединения. После этого увеличивают понемногу до оптимального эффекта, который достигают при данных обстоятельствах. Вообще, наиболее желательно соединение вводить в концентрации, которая будет обычно приводить к эффективным противовирусным результатам без того чтобы вызывать какие-либо нежелательные или разрушительные побочные эффекты. Желательно поддерживать уровень соединения в крови на уровне, достаточном для ингибирования ретровирусной инфекции клеток хозяина. Это может быть установлено опытным определением количества соединения, которое является эффективным для предотвращения ретровирусной инфекции клеток хозяина, например, ВИЧ в моноцитах, in vitro, и затем используя стандартную фармакокинетическую методику,определяют количество соединения, необходимое для сохранения уровня в плазме при одном и том же уровне ингибирования, или вплоть до более чем в 10-100 раз. Хотя композиции, раскрытые здесь, являются эффективными и относительно безопасными для лечения инфекций ВИЧ, не исключают возможность сопутствующего введения этих композиций с другими противовирусными лекарствами или агентами для получения положительных результатов. Такие другие противовирусные лекарства или агенты включают растворимые СД4, зидовудин, дидэзоксицитидин, фосфонформат рибаварин, противовирусные интерфероны (например, альфа-интерферон или интерлейкин-2) или аэрозоль пентамидина. Изобретение иллюстрируется следующими примерами. Пример 1 Моноциты периферической крови (МПК) выделяют от здорового донора, высевают на чашки с культурой и инкубируют в течение нескольких дней. СЛПИ смешивают с ВИЧ (ВаІ) и применяют к МПК в течение 1 часа при 37°С. Клетки промывают и инкубируют в течение дополнительного времени, с изменением среды и определением ревертазы в супернатантах каждые три дня. Находят, что СЛПИ эффективно блокирует репликацию ВИЧ при концентрации 1 мкг/мл (фиг. 1). При концентрациях менее или равных 20 мкг/мл ингибирование СЛПИ уменьшается. Эффект ингибирования является продолжительным, с значительным ингибированием, наблюдаемым на 18 день (фиг. 2). Пример 2 МПК высевают на чашки и инкубируют как в примере 1. СЛПИ выдерживают с клетками в течение около 1 часа, затем клетки промывают и обрабатывают ВИЧ. Меняют среду и анализ проводят как в примере 1. Находят, что СЛПИ более эффективен при блокировании ВИЧ, если клетки предварительно обрабатывают СЛПИ, чем если клетки обрабатывают смесью СЛПИ и ВИЧ. Пример 3 Демонстрируют также в основном те же подходы, как в примере 1, но заменяя моноциты на Тклетки, так как СЛПИ является эффективным в ингибировании репликации ВИЧ в Т-клетках. Пример 4 Линию клеток Т-лимфоцитов человека (Н-9) выдерживают в суспензии культуры RPVI 1640 с 10% эмбриональной телячьей сыворотки (ЭТС) и 200 микрограммами на литр гентамицина. СЛПИ добавляют в среду культуры с конечной концентрацией 100 микрограмм на миллилитр. Спустя 24 часа клетки промывают, инокулируют в течение 4 часов ВИЧ штамом 111 В, вновь промывают и ресуспендируют с плотностью 500000 клеток на миллилитр. Добавляют среду и выдерживают с СЛПИ с конечной концентрацией 100 микрограмм на миллилитр тотчас после ресуспендирования (Т=0) или два дня спустя после ресуспендирования (Т=2). Культуру супернатанта собирают и культуры питают каждые два дня. Супернатант собирают 8 дней спустя после инфицирования и анализируют на ревертазную активность измерением поглощения меченного тритием тимидина в поли(rА)-олиго(dТ) матрицу. Как показано в табл. 1, в клетках, предварительно обработанных СЛПИ, ингибированная СЛПИ вирусная репликация составляет приблизительно 62% и 54%, при незамедлительном добавлении или спустя два дня после инфицирования, соответственно. Пример 5 Опыты проводят как описано в примере 4, за исключением того, что 1000-кратно концентрированный штамм ВИЧ 111 В инкубируют 100 микрограммами СЛПИ в течение 6 часов на льду до инокуляции. Эту смесь ВИЧ/СЛПИ 1000-кратно разбавляют до инокуляции в течение 4 часов. 4 41338 Таблица 1 СЛПИ репликацию вируса приблизительно на 50% и 42% при немедленном и спустя два дня после инфицирования добавлении соответственно (табл. 4). В табл. 5 показана активность ревертазы, которая присутствует в культуре супернатанта анализированной на 4, 6 и 8 сутки после инфицирования. Клетки, предварительно обработанные СЛПИ Отрица- Положительный тельный контроль контроль Активность RT (ср. число имп/мин.) Стандартное отклонение 955 86,205 Т=0 Т=2 32,594 39,554 Таблица 4 Чистые клетки и вирус ±330 ±9,676 ±7,220 Отрица- Положительный тельный контроль контроль ±8,737 Активность RT (ср. чис. имп/мин.) Стандартное отклонение Как показано в табл. 2, при использовании вируса и клеток, предварительно обработанных СЛПИ, СЛПИ ингибирует репликацию вируса приблизительно на 64% и 26%, при немедленном добавлении или спустя 2 дня после инфицирования, соответственно. Вирус и клетки, предварительно обработанные СЛПИ Активность RT (ср. чис. имп/мин.) Стандартное отклонение Т=0 Т=2 20,676 43,432 2,889 59,004 ±565 ±10,988 ±4,111 +14,982 Пример 6 Опыты проводят как в примере 5, за исключением того, что используют чистые клетки, т.е. клетки не культивированные СЛПИ до инокуляции. Использование чистых клеток и вируса предварительно обработанного СЛПИ, дает ингибированную вирусную репликацию, приблизительно на 59% и 32% при немедленном добавлении или спустя два дня после инифицирования, соответственно (табл. 3). Таблица 3 Вирус, предварительно обработанный СЛПИ Отрица- Положительный тельный контроль контроль Активность RT (ср. чис. имп/мин.) Стандартное отклонение Т=0 Т=2 28.383 47,436 4,763 70,076 ±1,698 Т=2 28,383 47,436 4,763 70,076 ±1,698 ±15,803 ±5,520 ±11,679 Пример 8 Изучают также влияние различных СЛПИ мутеинов на вирусную репликацию. Чистые клетки Н9 инкубируют чистым вирусом в течение 4 часов как в примере 7. После промывания, клетки ресуспендируют с плотностью 500000 клеток на миллилитр в среде, содержащей 30 микрограмм на миллилитр СЛПИ или СЛПИ мутеинов, показанных в табл. 6. Культуру супернатанта анализируют на ревертазную активность спустя 8 дней (табл. 6). Пример 9 Опыты проводят как в примере 8, за исключением того, что после инокуляции клетки ресуспендируют в среду, содержащую 100 микрограмм на миллилитр СЛПИ или мутеина Phe 72. Культуру супернатанта анализируют на ревертазную активность через 2, 4, 6, 8 и 10 дней после инфицирования (табл. 7). Табл. 6 и 7 показывают, что влияние Phe 72 мутеина было особенно заметным. Пример 10 Для определения влияния только СЛПИ, пролифирацию клетки Н-9 оценивают с помощью анализа по вхождению тимидина, используя клетки Н-9 в количестве 200000, культивированные со 100 микрограммами на миллилитр СЛПИ и без СЛПИ. Культуры подвергают импульсной обработке (were pulsed) средой, содержащей 2,5 микрокюри меченного тритием тимидина и проводят измерения на 1, 2 и 3 сутки. Как показано в табл. 8, СЛПИ не является токсичным для этих клеток. Пример 11 Изучают также ингибирование продуцирования вируса из хронически инфицированных клеток, используя линию промоноцитной клетки U1. Суспензию культуры U1 поддерживают в RPMI с 10% ЭТС и 200 микрограммами на литр гентамицина. Клетки собирают, промывают и суспендируют с плотностью 2,5 миллиона клеток на миллилитр. Суспендированные клетки культивируют в течение ночи в среде, содержащей 100 или 200 микрограмм на миллилитр СЛПИ или одной среды. Вирус индуцируют добавлением 13форбол-12-миристат ацетата (ФМА) с конечной концентрацией 1 микромоль. Спустя 48 часов супернатант культуры клетки анализируют на ревер Таблица 2 Отрица- Положительный тельный контроль контроль Т=0 ±15,803 ±5,520 ±11,679 Пример 7 Опыты проводят как в примерах 4-6, за исключением того, что ни клетки ни вирус не выдерживают с СЛПИ до инокуляции. Использование чистых клеток и чистого вируса, дает ингибированную 5 41338 тазную активность как в примерах 4-9. Как показано в табл. 9, СЛПИ значительно ингибирует продуцирование вируса из этих хронически инфицированных клеток. Приведенное выше описание приводится с целью иллюстрации и объяснения. Должно быть понятно, что могут быть проведены различные модификации в рамках объема изобретения. Таблица 5 Чистые клетки и вирус Отрицательный контроль 435 Положительный контроль 1,556 ±85 ±300 ±222 ±204 72,085 15,846 41,240 ±12,219 ±5,644 ±14,542 13,853 7,617 11,946 ±475 Стандартное отклонение 1,287 1,519 Стандартное отклонение 8 день (ср.ч.им./мин) 797 ±715 Стандартное отклонение 6 день (ср.ч.им/мин) Т=2 952 4 день (ср.ч. им./мин) Т=0 ±3,458 ±3,031 ±2,889 Таблица 6 Отрица- Положительный тельный контроль контроль Активность RT (ср.ч. имп/мин.) Стандартное отклонение Дикий тип Gly 20 Gly 72 Val 72 Lys 72 Phe 72 4,815 55.126 39,323 39,387 40,549 36,077 52,239 8,384 ±2,849 ±6,637 ±10,933 ±11,143 ±3,537 ±7,859 ±5,863 ±1,924 Таблица 7 Отрицательный контроль СЛПИ РНЕ-72 995 897 ±914 ±246 ±472 1,356 1,087 1,380 ±370 ±414 ±442 1,142 2,103 1,526 748 ±389 ±498 ±414 ±442 77,931 25,241 3,491 ±9,779 ±8,399 ±1,086 21,431 12,499 2,239 ±1,890 ±3,495 ±444 2 день (ср.ч. имп./мин) Стандартное отклонение 4 день (ср.ч. имп./мин) Стандартное отклонение 6 день (ср.ч.имп./мин) Стандартное отклонение 8 день (ср.ч.имп./мин) Стандартное отклонение 10 день (ср.ч.имп./мин) Стандартное отклонение Положительный контроль 1,386 6 41338 Таблица 8 Активность RT (ср. число импульсов в минуту) Пролиферация Н-9 1 день 53,326 ±2,529 ±3,783 20,437 61,892 54,592 ±1,503 Стандартное отклонение 67,401 ±581 Стандартное отклонение + СЛПИ 100 мкг/мл З день 20,860 Контроль (-СЛПИ) 2 день ±216 ±2,781 Таблица 9 -ФМА -СЛПИ Активность RT (ср.ч./имп.мин.) Стандартное отклонение -ФМА +СЛПИ (200 мкг/мл) +ФМА -СЛПИ +ФМА +СЛПИ (200 мкг/мл) +ФМА +СЛПИ (100 мкг/мл) 1,052 994 5,052 2,864 2,648 ±352 ±447 ±2,053 ±403 ±374 Фиг. 1 7 41338 Фиг. 2 __________________________________________________________ ДП "Український інститут промислової власності" (Укрпатент) Україна, 01133, Київ-133, бульв. Лесі Українки, 26 (044) 295-81-42, 295-61-97 __________________________________________________________ Підписано до друку ________ 2002 р. Формат 60х84 1/8. Обсяг ______ обл.-вид. арк. Тираж 50 прим. Зам._______ ____________________________________________________________ УкрІНТЕІ, 03680, Київ-39 МСП, вул. Горького, 180. (044) 268-25-22 ___________________________________________________________ 8
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod for inhibiting retroviral infection caused by human immunodeficiency virus (hiv), method for inhibiting human immunodeficiency virus (hiv)
Автори англійськоюEisenberg Stephen, Vohl Sharon, Thompson Robert
Назва патенту російськоюСпособ ингибирования ретровирусной инфекции, вызванной вирусом иммунодефицита человека (вич), способ ингибирования вируса иммунодефицита человека (вич)
Автори російськоюЭйзенберг Стивен, Вохл Шарон, Томпсон Роберт
МПК / Мітки
МПК: A61P 43/00, A61K 38/55, C07K 14/47, C07K 14/81, C12N 9/99, A61P 31/12, A61P 37/04, A61P 31/14, C12N 15/09, A61P 31/18
Мітки: людини, інфекції, викликана, спосіб, ретровірусної, імунодефіциту, вірусом, віл, вірусу, інгібування, яка
Код посилання
<a href="https://ua.patents.su/8-41338-sposib-ingibuvannya-retrovirusno-infekci-yaka-viklikana-virusom-imunodeficitu-lyudini-vil-sposib-ingibuvannya-virusu-imunodeficitu-lyudini-vil.html" target="_blank" rel="follow" title="База патентів України">Спосіб інгібування ретровірусної інфекції, яка викликана вірусом імунодефіциту людини (віл), спосіб інгібування вірусу імунодефіциту людини (віл)</a>
Попередній патент: Маленький контейнер
Наступний патент: Спосіб управління розливанням металу на багатострумковій машині безперервного лиття заготовок
Випадковий патент: Спосіб отримання паливних гранул