Інтравагінальне кільце, що містить анастрозол і левоноргестрел, для лікування ендометріозу
Номер патенту: 109655
Опубліковано: 25.09.2015
Автори: Таллінг Крістіне, Паккалін Арто, Шміц Хайнц, Кнауте Рудольф, Королайнен Хенрійкка, Юкарайнен Харрі
Формула / Реферат
1. Інтравагінальне кільце (ІВК), що містить анастрозол і левоноргестрел, для особливого застосування для лікування ендометріозу, де системний вплив анастрозолу, якого досягають після вивільнення з ІВК, відповідає впливу анастрозолу після перорального введення в дозуванні менше 1 мг, або від 0,1 мг до 0,9 мг, анастрозолу на день, і системний вплив левоноргестрелу, якого досягають після вивільнення з ІВК, відповідає впливу левоноргестрелу після пероральною введення в дозуванні більше 10 мкг, але менше ніж 50 мкг, на день, причому інтравагінальне кільце не містить естрогену.
2. Інтравагінальне кільце для особливого застосування для лікування ендометріозу за п. 1, де заявлених цільових швидкостей вивільнення досягають тільки через один, два або три дні після початку лікування унаслідок сплеск-ефекту.
3. Інтравагінальне кільце для особливого застосування для лікування ендометріозу за п. 1 або 2, де період лікування триває від 1 тижня до 3 місяців.
4. Інтравагінальне кільце для особливого застосування для лікування ендометріозу за п. 3, де період довготривалого вивільнення триває від 4 до 6 тижнів.
Текст
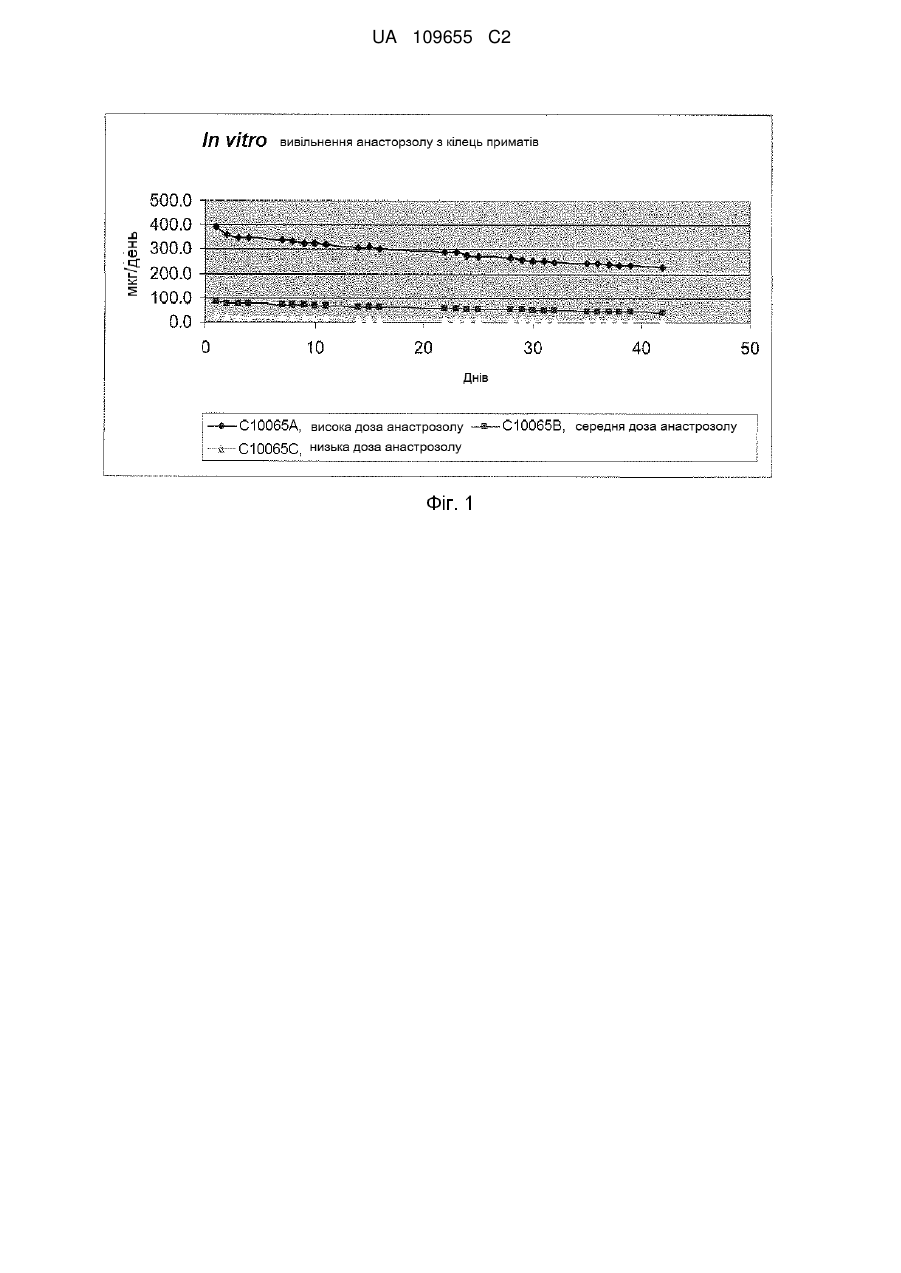
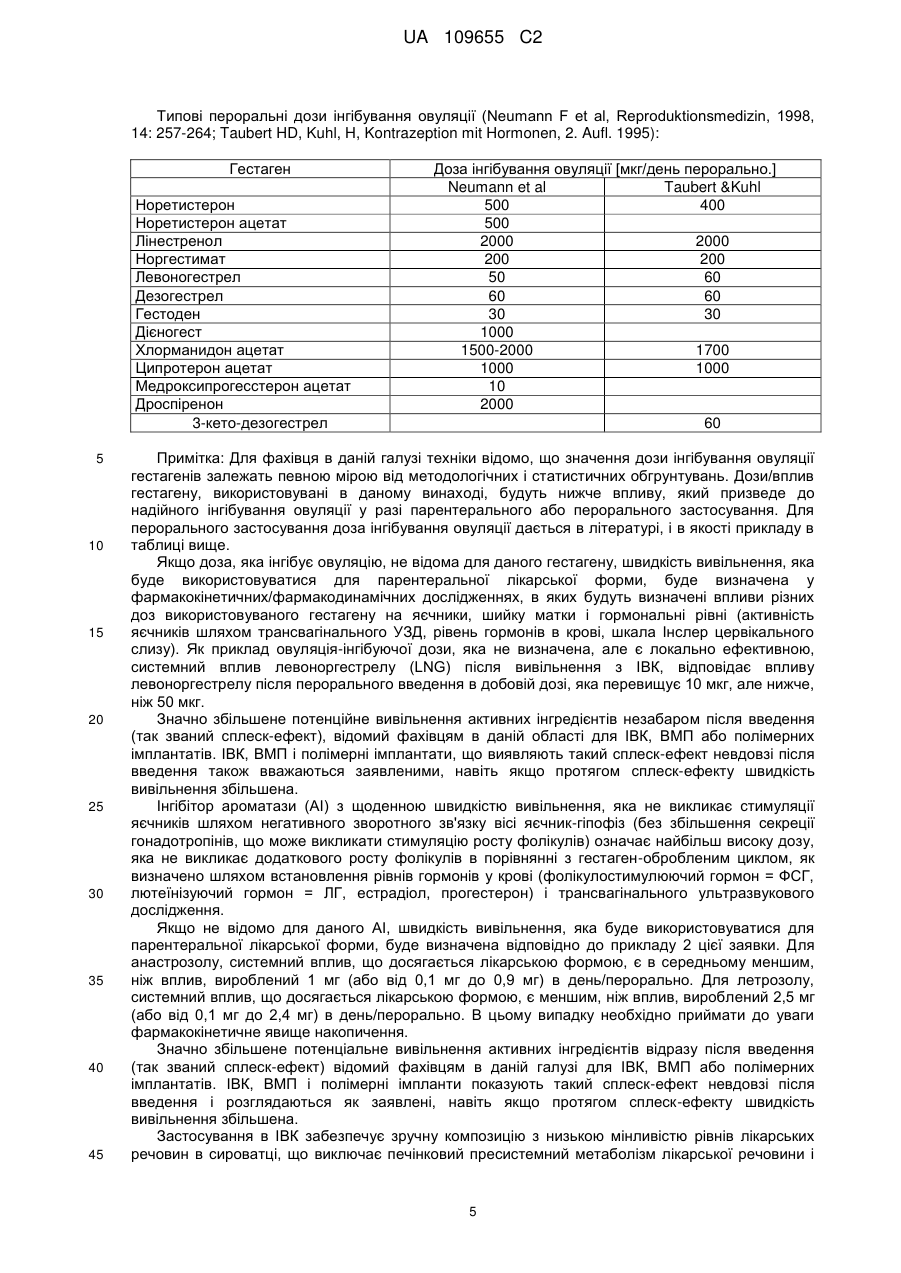
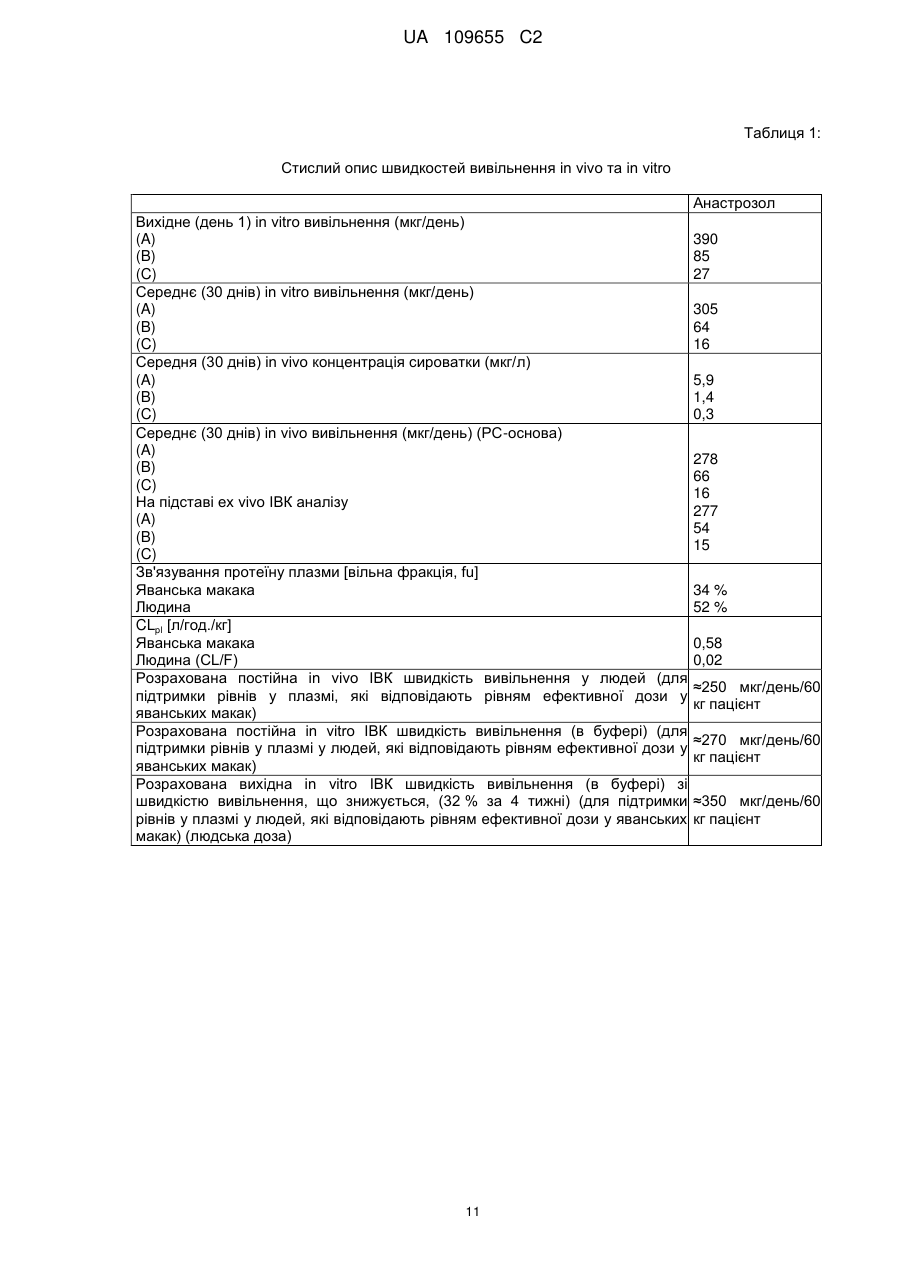
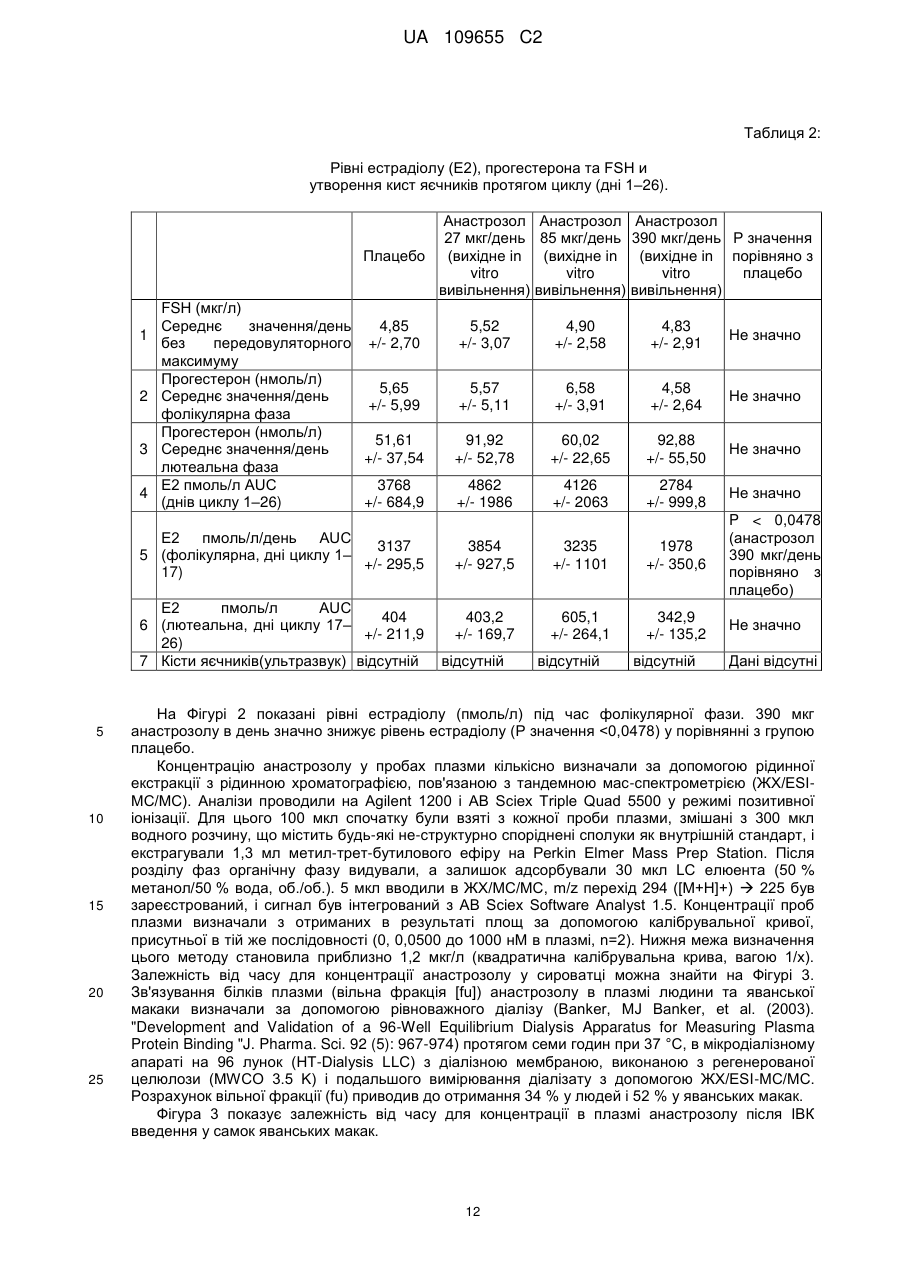
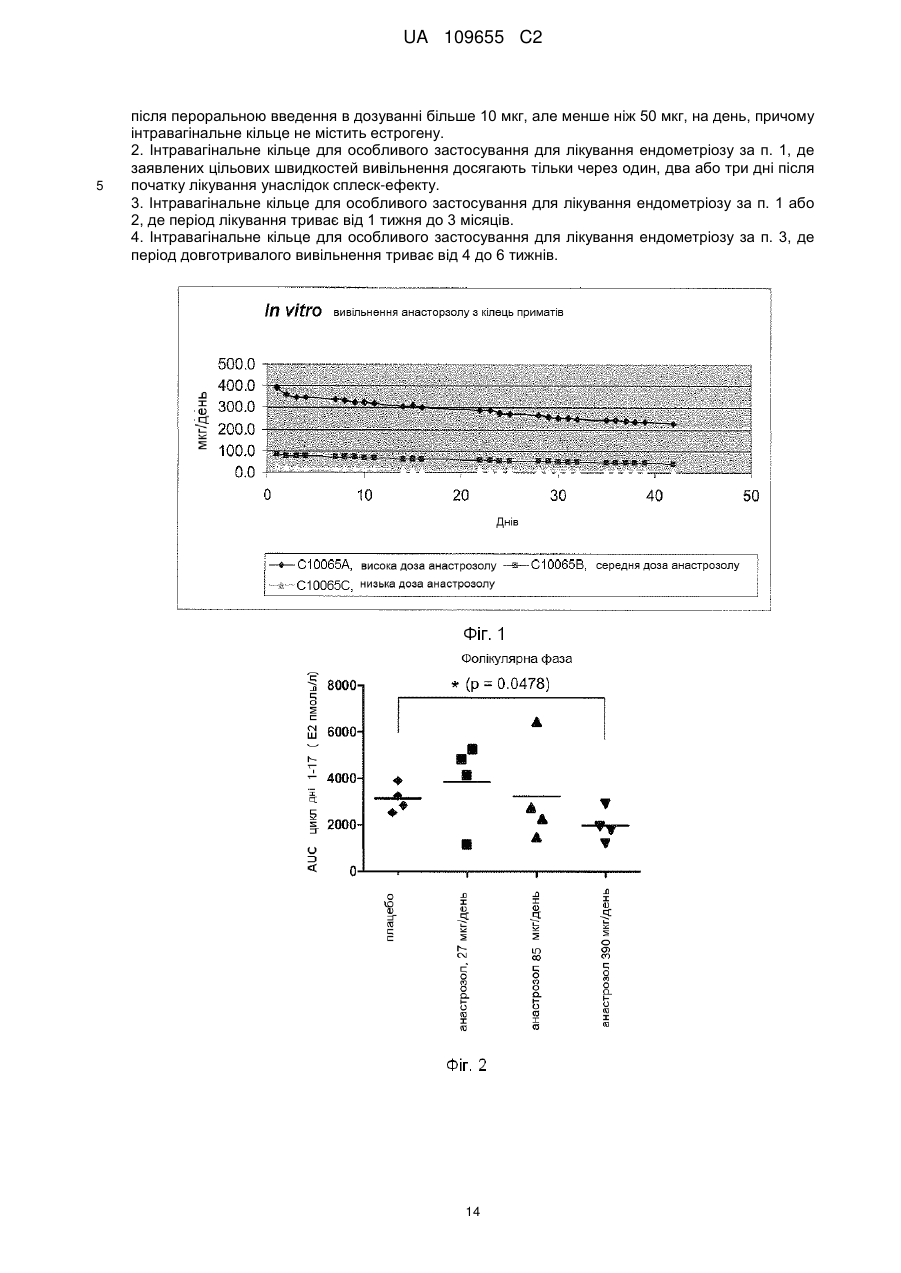
Реферат: Винахід стосується інтравагінального кільця, (ІВК), що містить анастрозол і левоноргестрел, для особливого застосування для лікування ендометріозу, де системний вплив анастрозолу, якого досягають після вивільнення з ІВК, відповідає впливу анастрозолу після перорального введення в дозуванні менше 1 мг, або від 0,1 мг до 0,9 мг, анастрозолу на день, і системний вплив левоноргестрелу, якого досягають після вивільнення з ІВК, відповідає впливу левоноргестрелу після пероральною введення в дозуванні більше 10 мкг, але менше ніж 50 мкг, на день, причому інтравагінальне кільце не містить естрогену. UA 109655 C2 (12) UA 109655 C2 UA 109655 C2 5 10 15 20 25 30 35 40 45 50 55 60 Даний винахід для лікування ендометріозу відноситься до забезпечення парентеральної лікарської форми (система доставки) для контрольованого вивільнення інгібітору ароматази (AI) зі швидкістю, яка не викликає стимуляції яєчників негативним зворотним зв'язком вісі яєчникгіпофіз (без збільшення секреції гонадотропінів, які викликають стимуляцію росту фолікулів) і гестагену (прогестин/прогестоген) зі швидкістю, яка забезпечує ефективність контрацепції виходячи з відомих місцевих ефектів (таких, як, наприклад, зменшення кількості та загущення цервікального слизу послаблюючого просування сперми, вплив на ендометрій і на трубну рухливість, послаблюючий імплантацію і перенесення яйцеклітин). Комбінація AI і гестагенів в дозуваннях, що інгібують овуляцію може призвести до симптомів естрогенового дефіциту через сильне інгібування ендогенного синтезу естрогену (наприклад, припливи, зниження щільності кісткової тканини). Завдяки низьким дозуванням, які використовують в даному винаході (AI без контррегуляції і гестагени без надійного інгібування овуляції), ризик розвитку симптомів естрогенного дефіциту ефективно зводять до мінімуму за рахунок комбінації. Краща лікарська форма, описана в даній заявці, являє собою лікарську форму на основі полімеру, яка містить щонайменше одне відділення, де зазначене одне або кожне відділення містять ядро або ядро, включене в мембрану, де ядро і мембрана по суті складаються з однакових або різних полімерних композицій, де щонайменше одне відділення містить AI і щонайменше одне відділення, яке може бути таким же або відрізнятися від такого, що містить AI, містить гестаген. Парентеральна лікарська форма може бути будь лікарською формою, придатною для доставки терапевтично активних агентів з контрольованою швидкістю вивільнення протягом тривалого періоду часу (наприклад, для інтравагінального кільця [ІВК; терміни інтравагінальне кільце і вагінальне кільце використовують як синоніми]) від 1 тижня до 3 місяців, переважно від 4 до 6 тижнів, внутрішньоматкового пристрою (ВМП, терміни внутрішньоматковий пристрій і внутрішньоматкова система використовують як синоніми), з часом його застосування, який може становити від 3 місяців до 1 року і більше. Краща лікарська форма, як сказано, являє собою або ІВК, або ВМП, що пропонує додаткові переваги для досягнення додаткових місцевих ефектів в осередках ураження ендомертіозом в безпосередній близькості від місця застосування. Ендометріоз являє собою хронічне захворювання, що уражає приблизно 10 % жінок репродуктивного віку. Захворювання характеризується наявністю ендометрій-подібної тканини за межами порожнини матки. Існують різні теорії про патогенез ендометріозу. Ймовірно, у більшості випадків він ініціюється ретроградною менструацією, за якої тканини ендометрію проходять через фаллопієві труби в черевну порожнину, у якій клітини ендометрію прилипають до поверхні черевних тканин і органів з утворенням ектопічних ендометріальних імплантів, тобто осередків ураження ендомертіозом. Ця ендометрій-подібна тканина може реагувати таким самим чином, як нормальний ендометрій, на зміни гормонального середовища під час менструального циклу, так що, при зміні концентрацій естрогену і прогестерону, тканина реагує таким самим чином, як сам ендометрій. Однак, під час хвороби, ці осередки ураження ендомертіозом можуть відділятися упродовж нормального менструального циклу. Наявність ендометріальних імплантів на черевних поверхнях (ендометріальні вузлики) може викликати запальну реакцію, яка разом з ростом нервових волокон може представляти патофізіологічні/анатомічні відповідні реакції, викликаючи симптоми, які зазвичай пов'язані з ендометріозом, такі як тазові болі, дисменорея і діаспареунія. Сучасні методи лікування ендометріозу засновані на пригніченні вироблення яєчниками естрогену за допомогою центрального інгібування вісі яєчник-гіпофіз (наприклад, гонадотропінвивільнюючі аналоги гормонів (GnRH-аналоги), даназол, медроксипрогестерон ацетат, дієногест, комбіновані пероральні контрацептиви (КПК)). Однак, інгібування вироблення яєчниками естрогену під час лікування аналогами GnRH призводить до побічних ефектів, пов'язаних з дефіцитом естрогенів, таких, як припливи і втрата кісткової маси, як найбільш важливі з них, якщо естроген не додають під час лікування. Інші побічні ефекти можуть включати: перехідні вагінальні кровотечі, сухість піхви, зниження лібідо, болючість молочних залоз, безсоння, депресію, дратівливість, втому, головний біль, зниження еластичності шкіри. Тому, щоб зменшити ці побічні ефекти під час терапії GnRH-аналогами, були створені так звані схеми терапії прикриття, в яких (кон'юговані) естрогени або норетистерон ацетат (NETA, який метаболізується частково в естрадіол) додавали під час терапії з GnRH-аналогами. Обидві терапії (GnRH-аналоги + естроген або GnRH-аналоги + NETA) застосовують при їх повній ефективній дозі, що також передбачає, що може мати місце весь спектр очікуваних побічних ефектів цих препаратів. КПК, які застосовують самі по собі, також ефективні в лікуванні ендометріозу і не вимагають жодних терапій прикриття. 1 UA 109655 C2 5 10 15 20 25 30 35 40 45 50 55 60 Однак, як і у випадку з режимами терапії прикриття, екзогенний естроген застосовують до пацієнта шляхом лікування з КПК, в цьому випадку сильний естроген етинілестрадіол. У цьому випадку, застосування екзогенного естрогену може теоретично погіршити ефективність гестагенів або GnRH-аналогів у відношенні естроген-залежних захворювань ендометріозу. З іншого боку інгібування вісі яєчник-гіпофіз не має жодного впливу на сайти вироблення естрогену за межами яєчників, що може мати вирішальне значення для нових методів лікування ендометріозу. Попередні дослідження показали, що фермент аромат аза, який каталізує перетворення тестостерону та інших андрогенних прекурсорів в естрогени, експресується в осередках ураження ендометріозом (Urabe M et al, Acta Endocrinol (Copenh). 1989, 121 (2):25964, Noble LS et al, J Clin Endocrinol Metab. 1996, 81 (1):174-9). Отже, і це може пояснити невдачі в лікуванні вищезазначеними методами лікування, які лише інгібують вироблення яєчниками естрогену, осередки ураження ендомертіозом можуть локально виробляти значну кількість естрадіолу. Крім того, було показано, що запальний медіатор простагландін E2 діє як потужний стимулятор експресії ароматази, додатково підсилюючи місцеве вироблення естрогену в запальному середовищі осередків ураження ендомертіозом (Noble LS et al, J Clin Endocrinol Metab. 1997, 82 (2):600-6). AI за типових дозувань (наприклад, анастрозол 1 мг/день) знижує системні рівні естрогенів у постменопаузних жінок більше ніж на 85 % (Geisler J et al, J Clin Oncol 2002, 20 (3): 751-757). У пре-менопаузних жінок цей ефект знижується шляхом контррегуляції через вісь яєчник-гіпофіз (тобто визначення гіпофізом зниженого системного рівня естрогену призводить до послідовної секреції гонадотропінів, що стимулюють синтез естрогенів в яєчниках і частково блокують ефект AI), що призводить до стимуляції росту фолікулів яєчників (насправді, цей ефект корисний для пацієнтів, які страждають від безпліддя яєчників, щоб стимулювати зростання фолікулів). З цієї причини, AI, в лікуванні пацієнтів з ендометріозом, використовували в дозах, які зазвичай використовують у жінок в постменопаузі для лікування раку молочної залози у комбінації з препаратами інгібування контррегуляції в різних клінічних дослідженнях, наприклад, з NETA (Ailawadi RK et al, Fertility & Sterility 2004, 81 (2): 290-296), або КПК (Amsterdam LL et al 2005, Fertility & Sterility 2005, 84 (2): 300-304). Додатково до інгібування контррегуляції, зниження побічних ефектів, пов'язаних з дефіцитом естрогенів розглядається як перевага цих комбінацій. Однак, введення екзогенного естрогену або NETA в ці комбінації може знизити ефективність (див. вище) AI у відношенні лікування симптомів ендометріозу. WO 03/15872 описує спосіб лікування або профілактики міоми матки або ендометріозу шляхом введення AI пацієнтові інтравагінально. Винахід розкриває переваги локальних ефектів монотерапії за допомогою AI, заявляючи зниження системних побічних ефектів за рахунок місцевого введення. Заявка не розкриває комбінацію AI з гестагеном у вигляді парентеральної лікарської форми і, зокрема, не розкриває комбінацію AI з гестагеном в ІВК або ВМП. На відміну від даного винаходу, WO 03/15872 не розкриває жодних засобів для досягнення ефективної контрацепції, яка необхідна в даному винаході, так як вона має вирішальне значення для повноцінної інформації про значущий профіль продукту, щоб запобігти вагітності, якщо жінка дітородного віку проходить лікування з використанням AI. Технічний результат, як описано в даному винаході, полягає в комбінації як AI, так і контрацептивної активності гестагену в одній лікарській парентеральній формі, для виключення їх фізичного розділення і тим самим виключення можливість того, щоб AI використовувались для лікування ендометріозу без контрацептивного захисту. Така можливість не виключена, коли використовують дві фізично відокремлювані лікарські форми. Також була запропонована комбінація AI з гестагеном (AI+NETA, Ailawadi RK et al 2004) або КПК (Amsterdam LL et al 2005; WO 04/69260) для перорального застосування. Обидві комбінації спрямовані на запобігання симптомів дефіциту естрогенів шляхом екзогенного введення естрогенної активності (естрогеновий метаболізм NETA; етинілестрадіолу в КПК). Недоліком цих методів лікування, та їх відмінність від винаходу, описаного в даній заявці, полягає в тому, що в обох випадках необхідне введення екзогенної активності естрогену (NETA частково перетворюється на естрогени, КПК, що містять сильний естроген етинілестрадіол) для того, щоб уникнути побічних ефектів. Однак, це послаблює фармакодинамічний вплив AI на ендометріоїдні тканини. Крім того, вказані джерела не описують переваги місцевого застосування AI для інгібування ароматази, що локально експресується в осередках ураження ендомертіозом в безпосередній близькості від лікарської форми і, тим самим зменшення дози, необхідної для досягнення бажаного повного фармакологічного ефекту. Найбільш близькою до винаходу, описаного в даній заявці, може бути заявка на патент WO 03/17973, яка розкриває застосування AI шляхом вагінального введення, окремо або в комбінації з іншими сполуками, що впливають на метаболізм естрогенів, наприклад, інгібіторами 2 UA 109655 C2 5 10 15 20 25 30 35 40 45 50 55 60 циклооксигенази-2 (інгібітори ЦОГ-2), інгібіторами 17-бета-окси-стероїд-дегідрогенази-1 (інгібітори 17ßHSD-1). Крім того, в винаході заявлений спосіб, який не інгібує синтез естрогенів яєчниками. Винахід розкриває переваги комбінації AI з іншими лікарськими речовинами, що впливають на метаболізм естрогенів, за допомогою місцевого застосування. Дана заявка не розкриває комбінацію AI з гестагеном у вигляді парентеральної лікарської форми і, зокрема, не розкриває комбінацію AI з гестагеном, в описаному дозуванні в ІВК. На відміну від даного винаходу WO 03/17973 не розкриває будь-які засоби для досягнення ефективності контрацепції. Знову ж таки, важливо визнати, що тільки фізично не роздільна комбінація активності AI і контрацептивного ефекту призводить до значущих продуктів. US 2011/0033519 A1 (дата публікації: 10 лютого 2011 р.) описує лікарські форми, які доставляють інгібітори ароматази, необов'язково в комбінації з протизаплідними речовинами, місцево в тканини матки. Таким чином, такі захворювання, як міома, аденоміоз та ендометріоз, мають бути вилікувані або попереджені. Так як гестагени можуть стимулювати ріст міоми, їх використання не рекомендуовано і, замість цього, мідь та інші благородні метали є кращими в якості основи контрацепції. Відповідні дози інгібітора ароматази ВМП - наприклад, для анастрозола - як повідомлялося, становлять від 1 мкг до 10 мг на день. Однак патент пропонує термін використання 5-10 років, що, як вважають, навряд чи може бути реалізовано з технічної точки зору. Один з аспектів винаходу, описаного в даній заявці при використанні ІВК/ВМП заснований на концепції застосування дози AI місцево, що не викликає контррегулюючих наслідків вісі яєчник-гіпофіз, але проявляє ароматазо-інгібуючу дію в осередках ураження ендомертіозом. Без проти регулюючих ефектів, як наслідок введення AI, відсутня необхідність застосування гестагенів або КПК для інгібування вісі яєчник-гіпофіз, що дозволяє знизити дозу гестагенів до доз, необхідних для досягнення контрацептивної ефективності за рахунок місцевих механізмів. Таким чином, можна буде уникнути симптомів дефіциту естрогенів і відпаде необхідність у введенні екзогенних естрогенів. Крім того, оскільки ендометріоз є естроген-залежним захворюванням, відсутність введення екзогенних естрогенів не погіршує терапевтичну ефективність AI. Так як гестагени також мають інгібуючу дію на експресію ароматази, то гестагени в даному винаході можна додавати до дії AI. Щоб уникнути притирегулюючих наслідків вісі яєчник-гіпофіз з максимальною дозою AI, з одного боку, і для досягнення кращої протизаплідної ефективності контрацепції тільки на основі гестагенів, з максимально можливою дозою гестагенів нижче дози інгібування овуляції, з іншого боку, необхідно застосовувати активні інгредієнти в композиції з контрольованим вивільненням, уникаючи великих коливань рівнів сироватки, які можуть викликати контррегуляцію за віссю яєчник-гіпофіз. Це буде досягнуто за рахунок парентеральних лікарських форм, переважно ІВК або ВМП. Таким чином, винахід, описаний в даній заявці, поєднує в собі ефективне лікування ендометріозу з надійним методом контрацепції в режимі застосування, який забезпечує ретельне дотримання режиму терапії за допомогою парентеральної лікарської форми (з відсутністю поглинання AI без контрацептивного захисту, відповідно без небажаних впливів AI на ембріон). На відміну від способів, описаних в рівні техніки, комбінація даного винаходу дозволить знизити вплив як AI, так і гестагену до обсягу, необхідного для досягнення ефективності, що також зведе до мінімуму ризик несприятливих побічних ефектів, пов'язаних зі зменшенням рівня естрогену, як, наприклад, приливи і втрата кісткової маси і т.д. Для того щоб звести до мінімуму ризик пов'язаних з дефіцитом естрогенів побічних ефектів, вплив гестагену, розглянутий в даному винаході, буде нижче впливу, який досягається шляхом введення зазначеного гестагенц в дозі інгібування овуляції (незалежно від шляху введення), але достатньо високий, щоб забезпечити контрацептивну ефективність за рахунок місцевих ефектів, як, наприклад, вимірюють за шкалою Інслер (Insler V et al, Int J Gynecol Obstet 1972, 10: 223-228). Пероральні дози інгібування овуляції різних гестагенів - які, після перорального прийому, призводить до конкретних гестаген-специфічних концентрацій у плазмі або сироватці описані в літературі, як, наприклад, в Neumann F et al, Reproduktionsmedizin 1998, 14: 257-264 або Taubert HD, Kuhl, H, Kontrazeption mit Hormonen, 2. Aufl. 1995. Більш конкретно: доза AI в комбінації не буде істотно стимулювати активність яєчників за рамками типових лише гестагенових ефектів, як очікується для даного винаходу в дозі гестагену для введення. Експериментальна модель для визначення дози гестагену і AI описана в експериментальній частині. Лікарська форма згідно даного винаходу, що містить комбінацію AI і гестагена, особливо придатна для лікування ендометріозу із забезпеченням ефективності у відношенні симптомів, пов'язаних з ендометріозом, зводячи до мінімуму ризик побічних ефектів, пов'язаних з 3 UA 109655 C2 5 10 15 20 25 30 35 40 45 50 55 дефіцитом естрогенів (наприклад, втрата кісткової маси, приливи). У той же час винахід забезпечить фізично не роздільний щоденний вплив гестагену для гарантування надійної контрацептивної ефективності і таким чином уникнення ризику вагітності з подальшим небажаним впливом AI на ембріон. Це являє собою головний аспект винаходу, оскільки значно підвищує безпечність цільового продукту (див. для порівняння WO 03/15872 і WO 03/17973). Крім того, на відміну від перорального застосування, парентеральне/місцеве застосування в лікарській формі з контрольованою швидкістю вивільнення, наприклад, реалізоване в кращому рішенні (ІВК/ВМП), що забезпечує відповідне дозування для досягнення бажаного медичного результату з найкращим можливим зменшенням серйозних побічних ефектів, пов'язаних з коливальними впливами активних інгредієнтів (наприклад, амплітуда між максимальними рівнями сироватки, після прийому пероральних композицій і мінімальними рівнями сироватки перед наступним прийомом). Крім того, місцеве застосування може бути особливо корисно для лікування осередків ураження ендомертіозом в безпосередній близькості від парентеральної лікарської форми (наприклад, у випадку вагінального ендометріозу, глибокого інфільтрованого ендометріозу, аденоміозу або ендометріозу дугласового простору). Інгібітори ароматази являють собою сполуки, які інгібують дію ферменту ароматази, що перетворює андрогени в естрогени в процесі, який називають ароматизацією. Своєю дією AI зменшують або блокують синтез естрогенів. Селективними AI наприклад, є анастрозол (Arimidex®), екземестан (Aromasin®), фадрозол (Afema®), форместан (Lentaron®), летрозол (Femara®), пентрозол, ворозол (Rivizor®) або AI BGS649 від Novartis, які, на сьогоднішній день, можуть бути знайдені в клінічній розробці (clinicaltrials.gov-Identifier: NCT01116440; NCT01190475) та їх фармацевтично прийнятні солі. Парентеральна лікарська форма являє собою лікарську форму для введення лікарських препаратів, в якій поглинання лікарських препаратів здійснюється в обхід шлунково-кишкового тракту. Вона може бути будь-якою лікарською формою, придатною для доставки терапевтично активних агентів з контрольованою швидкістю вивільнення протягом тривалого періоду часу. Таким чином, лікарська форма може бути представлена в найрізноманітніших втіленнях, включаючи, наприклад, трансдермальні пластирі, імпланти, ін'єкції депо (у тому числі мікрочастинок, лікарських форм формуючих депо in situ і т.д.), інтравагінальні, інтрацервікальні та внутрішньоутробні лікарські форми. Відповідно до кращого варіанту втілення, лікарська форма являє собою ІВК або ВМП. ІВК являє собою по суті кільцеву полімерну лікарську форму, яка забезпечує контрольоване вивільнення активного інгредієнта(ів) в піхву протягом тривалого періоду часу. ВМП являє собою будь-яку полімерну лікарську форму, яка забезпечує контрольоване вивільнення активного інгредієнта(ів) внутрішньоутробно в матку протягом тривалих періодів часу. Підшкірним імплантатом є, по суті, полімерна лікарська форма у формі стрижня, що містить один або кілька стрижнів, яка забезпечує контрольоване системне вивільнення активного інгредієнта(ів) в тіло протягом тривалого періоду часу. Швидкість вивільнення представляє середню вивільнену кількість активної лікарської речовини впродовж 24 годин з лікарської форми, яка доступна для поглинання навколишніми тканинами. Фахівець у цій галузі знатиме, що середня швидкість вивільнення з парентеральної лікарської форми може знизитися протягом періоду застосування. Лікарська форма з контрольованим довгостроковим вивільненням означає будь-яку лікарську форму, придатну для введення лікарських препаратів протягом тривалого періоду часу, яка запобігає коливанням рівнів препарату, що зазвичай викликаються композиціями негайного вивільнення (наприклад, таблетками, ін'єкціями і т.д.). Гестаген являє собою синтетичний прогестерон, який має прогестогенні ефекти, подібні прогестерону. Гестагени, крім прогестерону, наприклад, являють собою алілестренол, хлормадинону ацетат, ципротерону ацетат, дезогестрел, дієногест, дроспіренон, дидрогестерон, етоногестрел, етинодіол, гестоден, левоноргестрел, лінестренол, медрогестон, медроксипрогестерон, мегестрол, номогестрол, норетиндрон, норетистерон, норетінодрел, норгестімат, норгестрел, квінгестрон або трімегестон та інші затверджені або комерційно доступні гестагени, і їх фармацевтичні прийнятні солі. Ці гестагени також можуть бути надані у вигляді складних ефірів або будь-яких інших відповідних хімічних модифікацій. Гестаген в щоденній швидкості вивільнення нижче дози інгібування овуляції, але достатньо високій, щоб забезпечити надійний контрацептивний захист означає, що відомі ефекти, як, наприклад, зменшення кількості та загущення цервікального слизу послаблюючого просування сперми, вплив на ендометрій і трубну рухливість, послаблюючу імплантацію і перенесення яйцеклітин, запобігання запліднення яйцеклітини. Дозування гестагену, яке є типовим для цього ефекту, може бути знайдено в препараті Microlut® з дозою таблетки 30 мкг левоноргестролу. 4 UA 109655 C2 Типові пероральні дози інгібування овуляції (Neumann F et al, Reproduktionsmedizin, 1998, 14: 257-264; Taubert HD, Kuhl, H, Kontrazeption mit Hormonen, 2. Aufl. 1995): Гестаген Норетистерон Норетистерон ацетат Лінестренол Норгестимат Левоногестрел Дезогестрел Гестоден Дієногест Хлорманидон ацетат Ципротерон ацетат Медроксипрогесстерон ацетат Дроспіренон 3-кето-дезогестрел 5 10 15 20 25 30 35 40 45 Доза інгібування овуляції [мкг/день перорально.] Neumann et al Taubert &Kuhl 500 400 500 2000 2000 200 200 50 60 60 60 30 30 1000 1500-2000 1700 1000 1000 10 2000 60 Примітка: Для фахівця в даній галузі техніки відомо, що значення дози інгібування овуляції гестагенів залежать певною мірою від методологічних і статистичних обгрунтувань. Дози/вплив гестагену, використовувані в даному винаході, будуть нижче впливу, який призведе до надійного інгібування овуляції у разі парентерального або перорального застосування. Для перорального застосування доза інгібування овуляції дається в літературі, і в якості прикладу в таблиці вище. Якщо доза, яка інгібує овуляцію, не відома для даного гестагену, швидкість вивільнення, яка буде використовуватися для парентеральної лікарської форми, буде визначена у фармакокінетичних/фармакодинамічних дослідженнях, в яких будуть визначені впливи різних доз використовуваного гестагену на яєчники, шийку матки і гормональні рівні (активність яєчників шляхом трансвагінального УЗД, рівень гормонів в крові, шкала Інслер цервікального слизу). Як приклад овуляція-інгібуючої дози, яка не визначена, але є локально ефективною, системний вплив левоноргестрелу (LNG) після вивільнення з ІВК, відповідає впливу левоноргестрелу після перорального введення в добовій дозі, яка перевищує 10 мкг, але нижче, ніж 50 мкг. Значно збільшене потенційне вивільнення активних інгредієнтів незабаром після введення (так званий сплеск-ефект), відомий фахівцям в даній області для ІВК, ВМП або полімерних імплантатів. ІВК, ВМП і полімерні імплантати, що виявляють такий сплеск-ефект невдовзі після введення також вважаються заявленими, навіть якщо протягом сплеск-ефекту швидкість вивільнення збільшена. Інгібітор ароматази (AI) з щоденною швидкістю вивільнення, яка не викликає стимуляції яєчників шляхом негативного зворотного зв'язку вісі яєчник-гіпофіз (без збільшення секреції гонадотропінів, що може викликати стимуляцію росту фолікулів) означає найбільш високу дозу, яка не викликає додаткового росту фолікулів в порівнянні з гестаген-обробленим циклом, як визначено шляхом встановлення рівнів гормонів у крові (фолікулостимулюючий гормон = ФСГ, лютеїнізуючий гормон = ЛГ, естрадіол, прогестерон) і трансвагінального ультразвукового дослідження. Якщо не відомо для даного AI, швидкість вивільнення, яка буде використовуватися для парентеральної лікарської форми, буде визначена відповідно до прикладу 2 цієї заявки. Для анастрозолу, системний вплив, що досягається лікарською формою, є в середньому меншим, ніж вплив, вироблений 1 мг (або від 0,1 мг до 0,9 мг) в день/перорально. Для летрозолу, системний вплив, що досягається лікарською формою, є меншим, ніж вплив, вироблений 2,5 мг (або від 0,1 мг до 2,4 мг) в день/перорально. В цьому випадку необхідно приймати до уваги фармакокінетичне явище накопичення. Значно збільшене потенціальне вивільнення активних інгредієнтів відразу після введення (так званий сплеск-ефект) відомий фахівцям в даній галузі для ІВК, ВМП або полімерних імплантатів. ІВК, ВМП і полімерні імпланти показують такий сплеск-ефект невдовзі після введення і розглядаються як заявлені, навіть якщо протягом сплеск-ефекту швидкість вивільнення збільшена. Застосування в ІВК забезпечує зручну композицію з низькою мінливістю рівнів лікарських речовин в сироватці, що виключає печінковий пресистемний метаболізм лікарської речовини і 5 UA 109655 C2 5 10 15 20 25 30 35 40 45 50 55 підвищує дотримання режиму лікуванню, оскільки відпадає потреба в щоденному нагадуванні про прийом препарату. Зокрема, протизаплідний принцип таблетки гестагену (ТТП, "таблетка тільки прогестину") в дозі нижчій дози інгібування овуляції потребує точного режиму дозування для забезпечення надійного протизаплідного ефекту. У цьому аспекті безперервне введення з ІВК має велику перевагу. Місцеве застосування забезпечує можливість прийнятного дозування для досягнення бажаного медичного результату зі зниженням серйозних побічних ефектів, пов'язаних з системним впливом активних інгредієнтів. Для фахівця в даній галузі, відомо, що застосування ІВК (або альтернативних композицій депо, також особливо у випадку полімерних лікарських форм) може привести до зміни (зменшення) швидкості щоденного вивільнення протягом періоду застосування. Лікарські форми, які проявляють такі зміни, вважаються заявленими. Переважні лікарські форми являють собою лікарські форми для місцевого застосування, зокрема ІВК і ВМП. ІВК є особливо кращим. Переважні ІВК і ВМП містять анастрозол як інгібітор ароматази. Особлива перевага надається анастрозол-вмісним ІВК. Особливу перевагу також надають анастрозол-вмісним ІВК, у якого системний вплив анастрозолу досягається шляхом вивільнення з ІВК, що відповідає впливу анастрозолу після перорального прийому в дозі меншій 1 мг (або від 0,1 мг до 0,9 мг) анастрозолу в день. Аналогічно, особливо краще для даного ІВК, містити левоноргестрел як гестаген. Переважні ІВК і ВМП містять левоноргестрел, дієногест чи гестоден як гестаген. Особлива перевага надається ІВК, що містять левоноргестрел як гестаген. Особливу перевагу також надають ІВК, у якого системний вплив левоноргестрелу досягається після вивільнення з ІВК, що відповідає впливу левоноргестрелу після перорального прийому в дозі більшій 10 мкг, але меншій 50 мкг на день. Аналогічно, особливо бажано для цього ІВК, містити анастрозол як інгібітор ароматази. Особлива перевага надається ІВК, що містить анастрозол як інгібітор ароматази і левоноргестрел як гестаген. Особливу перевагу також надають ІВК, який містять анастрозол як інгібітор ароматази і левоноргестрел як гестаген, в якому системний вплив анастрозолу досягається шляхом вивільнення з ІВК, що відповідає впливу анастрозолу після перорального прийому в дозі меншій ніж 1 мг (або від 0, 1 мг до 0,9 мг) анастрозолу в день, і в якому системний вплив левоноргестрелу досягається після вивільнення з ІВК, що відповідає впливу левоноргестрелу після перорального прийому в дозі більшій ніж 10 мкг, але меншій ніж 50 мкг на день. В особливо кращих ІВК, тривалість довгострокового вивільнення становить від одного тижня до трьох місяців, особливо переважно від 4 до 6 тижнів. Також для кращих ВМП, довгострокове вивільнення становить не менше 3 місяців, переважно один рік або більше. Внаслідок сплеск-ефекту, лікарські форми згідно з даним винаходом можуть досягти бажаних швидкостей вивільнення у відповідності з винаходом тільки через один, два або три дні після початку лікування, у виняткових випадках лише через тиждень. Початок лікування в даному випадку означає час, в який лікарська форма була введена. Всі бажані варіанти виконання, згадані в даній заявці, можуть бути використані для лікування ендометріозу. Особлива перевага надається лікуванню ендометріозу з одночасною контрацепцією. Особливу перевагу також надають способу одночасного лікування ендометріозу та контрацепції з використанням, залежно від обставин, однієї з вищевказаних кращих лікарських форм. ДЕТАЛЬНИЙ ОПИС ПАРЕНТЕРАЛЬНОЇ ЛІКАРСЬКОЇ ФОРМИ Парентеральні лікарські форми, включаючи, наприклад, імплантати, внутрішньоматкові пристрої і інтравагінальні кільця, здатні забезпечити контрольоване вивільнення активного інгредієнта(ів) протягом тривалого періоду часу, як правило, формуються з біосумісних полімерів і містять лікарську речовину або лікарські речовини, що вивільняються шляхом дифузії через полімерну матрицю. Ряд різних конструкцій лікарських форм відомий з літератури. Деякі лікарські форми можуть містити полімерну матрицю, але без мембрани або стінки, що охоплює зазначені матриці (монолітна лікарська форма), тоді як деякі інші лікарські форми містять полімерну матрицю, ядро, охоплене в мембрану. Широке використання було досягнуто шляхом одночасного введення двох або більше терапевтично активних речовин, з літератури відомий ряд різних конструкцій лікарських форм. Згідно варіанту виконання даного винаходу, лікарська форма містить щонайменше одне відділення, що містить ядро, або ядро, вставлене в мембрану, де вказані ядро і мембрана містять однакові або різні полімерні композиції, в яких щонайменше одне з відділень містить AI 6 UA 109655 C2 5 10 15 20 25 30 35 40 45 50 55 і, необов'язково, щонайменше, одне відділення, яке може бути таким же або відмінним того, що містить AI, може містити гестаген або сполуку, що має прогестогенну активність. Таким чином, відділення містить по суті, полімерну композицію, де полімерна композиція ядра, мембрана або обидва з них можуть містити терапевтично активну речовину або речовини. Полімерна композиція може бути відповідним чином обрана таким чином, щоб вивільнення терапевтично активного агента регулювалося ядром, мембраною або обома. У відповідності з варіантом виконання, в якому лікарська форма включає два або кілька відділень, ці відділення можуть бути розташовані поруч один з одним, пліч-о-пліч, одне на іншому або, щонайменше, частково один в одному, і можуть додатково бути відокремлені один від одного шляхом відокремлення мембран або відділення з інертним плацебо. Відділення можуть бути суцільними або порожнистими. Мембрана, якщо така є, може охоплювати всю лікарську форму або покривати тільки частину лікарської форми, причому ступінь покриття може змінюватися в залежності від ряду факторів, наприклад, таких, як вибір матеріалів та вибір активних речовин. Мембрана може складатися більш ніж з одного шару. Товщина мембрани залежить від матеріалів і активних речовин, що використовуються в ній, а також бажаних профілів вивільнення, але в цілому товщина менше, ніж товщина ядра мембрани. Полімерні композиції ядра, мембрани і можливої розділової мембрани або відділення з інертним плацебо, можуть бути однаковими або різними і можуть бути засновані на одному полімері або суміші полімерів або можуть бути виконані з полімерів, які змішуються один з одним. В принципі будь-який полімер, який або біологічно розпадається, або біологічно не розпадається, може бути використаний до тих пір, поки він біосумісний. Приклади найбільш часто використовуваних полімерних матеріалів включають, але не обмежуються наведеним, полісілоксани, поліуретани, термопластичні поліуретани, етилен/вінілацетатні кополімери (EVA), й кополімери діметілсілоксанів і метілвінілсілоксанов, біорозкладані полімери, наприклад полі(гідроксіалканові кислоти), полі(молочну кислоту), полі(гліколеву кислоту), полі(гліколіди), полі(L-лактид), полі(лактид-гліколіди), і суміш щонайменше двох із них. Структурна цілісність матеріалу може бути підвищена за рахунок додавання частинок матеріалу, такого, як діоксид кремнію або кізельгур. Полімерна композиція може також містити додаткові матеріали, наприклад, для регулювання гідрофільних чи гідрофобних властивостей для того, щоб досягти бажаної швидкості вивільнення одного або декількох терапевтичних речовин, враховуючи, що всі добавки повинні бути біосумісними і нешкідливими для пацієнта. Ядро або мембрана можуть також містити, наприклад, комплекс формуючих агентів, таких як похідні циклодекстрина, для регулювання початкового викиду речовини, до прийнятого або бажаного рівня. Допоміжні речовини, наприклад, такі як поверхнево-активні речовини, піногасники, стабілізатори, солюбілізатори або сповільнювачі поглинання, або суміш будь-яких двох або більше таких речовин, також можуть бути додані для того, щоб забезпечити бажані фізичні властивості корпусу лікарської форми. Крім того, добавки, такі як пігменти, агенти додання глянцю, матуючі речовини, барвники, слюда або рівні їм, можуть бути додані до корпусу лікарської форми або мембрани або обом для того, щоб забезпечити лікарську форму з бажаним зовнішнім виглядом. ВИГОТОВЛЕННЯ ПАРЕНТЕРАЛЬНОЇ ЛІКАРСЬКОЇ ФОРМИ Парентеральна лікарська форма у відповідності з цим винаходом може бути виготовлена у відповідності зі стандартними методами, відомими в даній галузі, і форма і розмір лікарської форми можуть бути вільно обрані фахівцем в даній галузі. Достатня кількість принаймні одного терапевтично активного агента може бути включена в полімерну композицію ядра або мембрани за допомогою різних методів, зазначений метод залежить від стабільності речовини. Наприклад, речовина може бути однорідно змішана з полімерною матрицею, або полімерний матеріал і вказану речовину можна розчинити у відповідному розчиннику або суміші розчинників (дихлорметан, тетрагідрофуран та ін…), видаленням великої частини розчинника при зниженому тиску, дозволяючи в'язкому розчину кристалізуватися шляхом подальшої сушки і гранулювання композиції, що містить лікарські речовини та полімери. Терапевтично активна речовина також може бути змішана в розплавленому полімері, особливо коли термопластичні еластомери використовуються з наступним охолодженням суміші. Потім композиції, яка містить лікарські речовини і є полімерною, надають потрібну форму за допомогою відомих методів, наприклад, таких як лиття, лиття під тиском, відцентрове формування/лиття під тиском, лиття, екструзія, така як спільна екструзія, екструзія покриття та/або суміш екструзії і інші відповідні методи. 7 UA 109655 C2 5 10 15 20 25 30 35 40 45 50 55 60 Матеріал для мембран, з або без терапевтично активними речовинами, може бути виготовлений у відповідності з методами, описаними вище. Мембрана може бути нанесена на ядра, наприклад, шляхом лиття, розпилення або занурення, або за допомогою екструзійного покриття або методів спільної екструзії, або механічного розтягу або формування роздувом стандартних, сформованих з трубок мембран газом під тиском, наприклад, повітрям, або шляхом набухання в відповідному розчиннику, наприклад, такому як пропанол, ізопропанол, циклогексан, диглім або подібних. Полімерний стрижень, отриманий таким чином, можна розрізати на шматки необхідної довжини, щоб сформувати відділення, що містить ядро, або ядро, вставлене в мембрану. Відділення, або два чи більше відділень, з'єднаних разом, можуть бути використані як підшкірний імплантат, або прикріплені до корпусу внутрішньоматкової спіралі або прикріплені до, наприклад, по суті кільцевої лікарської форми будь-яким способом, придатним для цього. Термін "по суті кільцева" слід розуміти як такий, що охоплює додатково до кільцевої лікарської формі будь-яку іншу по суті кільцеву структуру, яка є придатною для внутрішньоутробного або вагінального введення, таку як, наприклад, спірально згорнуті спіралі, і кільцеві системи, що мають скручені поверхні. Внутрішньоматкові засоби можуть, додатково до по суті кільцевої форми, мати різні форми та можуть бути, наприклад, T-, S-, 7 - або омега-подібної форми. Відділення для приєднання до внутрішньоматкового пристрою може бути порожнім, так що воно може бути легко розташоване на корпусі. Альтернативно, ядро може бути спочатку нанесено на корпус і на наступній стадії бути охоплене в мембрану. Імплантати мають зазвичай стрижневі форми. Кінці відділень або комбінацію відділень можна з'єднати за допомогою сполучного засобу, яким можуть бути будь метод, механізм, пристрій або матеріал, відомий в даній галузі для зв'язування або з'єднання матеріалів або конструкцій разом. З'єднання може включати, наприклад, з'єднання розчинником, з'єднання клеєм, з'єднання теплом, теплове злиття, тиск тощо. Трубчасті з'єднання можна з'єднувати за допомогою пробки або стопора з будь-якого інертного, біологічно сумісного матеріалу, наприклад інертного матеріалу, який не допускає транспортування активного матеріалу. Крім того, по суті кільцеві лікарські форми також можуть бути одержані шляхом розміщення відділення або комбінації відділень в прес-форму при підвищеній температурі і ін'єкції розплавленого поліетилену високої щільності між кінцями, після чого підготовлені кільця охолоджують, або шляхом з'єднання кінців разом за допомогою паяння. Приклад 1: Визначення дози гестагену відповідно до даного винаходу за допомогою дослідження інгібування овуляції У дослідженні інгібування овуляції передбачений гестаген буде протестований в різних дозуваннях, щоб визначити вплив гестагену на дозрівання фолікул яєчників і овуляцію засобами трансвагінального ультразвукового дослідження та вимірювання рівнів гормонів в крові (естрадіолу, прогестерону). Додатково, цервікальний слиз буде досліджений відповідно до шкали Інслер з урахуванням планованих змін характеристик слизу, типових для тільки гестагенових методів контрацепції (Insler V et al, Int J Gynecol Obstet 1972, 10 (6): 223-228). Доза, яка інгібує овуляцію нижче 95 %, і переважно в діапазоні приблизно 40-80 % і дає оцінку Інслер цервікального слизу
ДивитисяДодаткова інформація
Назва патенту англійськоюParenteral pharmaceutical form which releases aromatse inhibitor and gestagens, for the treatment of endomeriosis
Автори англійськоюPakkalin, Arto, Knauthe, Rudolf, Schmitz, Heinz, Talling, Christine, Jukarainen, Harri, Korolainen, Henrikka
Автори російськоюПаккалин Арто, Кнауте Рудольф, Шмиц Хайнц, Таллинг Кристине, Юкарайнен Харри, Королайнен Хенрийкка
МПК / Мітки
МПК: A61P 15/18, A61K 31/567, A61P 15/00, A61K 31/4196, A61K 9/00, A61K 31/569, A61K 45/06
Мітки: містить, інтравагінальне, анастрозол, ендометріозу, кільце, лікування, левоноргестрел
Код посилання
<a href="https://ua.patents.su/17-109655-intravaginalne-kilce-shho-mistit-anastrozol-i-levonorgestrel-dlya-likuvannya-endometriozu.html" target="_blank" rel="follow" title="База патентів України">Інтравагінальне кільце, що містить анастрозол і левоноргестрел, для лікування ендометріозу</a>
Попередній патент: Спосіб очищення стічних вод та пристрій для його здійснення в послідовно-циклічних реакторах
Наступний патент: Катодний вуглецевий блок для одержання алюмінію в електролізері і спосіб його виготовлення
Випадковий патент: Спосіб реконструкції м'якого піднебіння та язичка