Процес виробництва вакцин
Формула / Реферат
1. Спосіб одержання імуногенної композиції, що включає кон'югацію сахариду до білка-носія з використанням карбодіімідної конденсації, в якому сахарид містить (зокрема, як частину своєї повторюваної одиниці), або був дериватизований для введення, аміно- та/або карбоксильні групи, і в якому білок-носій містить, або був дериватизований для введення, аміно- та/або карбоксильні групи, що включає наступні етапи:
i - якщо білок-носій містить як аміно-, так і карбоксильні групи, то сахарид містить або аміно-, або карбоксильні групи:
(a) змішування сахариду та аліквоти карбодііміду, необхідної для проведення кон'югації, та
(b) додавання необхідної аліквоти білка-носія проводять протягом періоду часу від 1 хвилини до 6 годин, де принаймні чверть аліквоти додають протягом першої половини періоду та принаймні чверть аліквоти додають протягом другої половини періоду;
ii - якщо сахарид містить як аміно-, так і карбоксильні групи, то білок-носій містить або аміно-, або карбоксильні групи:
(a) змішування білка-носія та аліквоти карбодііміду, необхідної для проведення кон'югації, та
(b) додавання необхідної аліквоти сахариду проводять протягом періоду часу від 1 хвилини до 6 годин, де принаймні чверть аліквоти додають протягом першої половини періоду та принаймні чверть аліквоти додають протягом другої половини періоду;
iii - якщо білок-носій містить як аміно-, так і карбоксильні групи, то сахарид містить як аміно, так і карбоксильні групи:
(a) змішування білка-носія і сахариду, та
(b) додавання аліквоти карбодііміду, необхідної для проведення кон'югації, проводять протягом періоду часу від 1 хвилини до 6 годин, де принаймні чверть аліквоти додають протягом першої половини періоду та принаймні чверть аліквоти додають протягом другої половини періоду;
та де аліквота карбодііміду складає від 0,01 до 3 мг карбодііміду/мг сахариду; сахарид є присутнім при заключній концентрації 0,5-50 мг/мл на етапі b); білок-носій є присутнім при заключній концентрації 1-50 мг/мл на етапі b); вихідне співвідношення білка-носія та сахариду складає від 5:1 до 1:5 (ваг.:ваг.); концентрація солі, присутньої на етапі b), складає 0-2 М; рН реакції на етапі b) складає рН 4,5-6,5 або рН 4,5-7,5, якщо на етапі b) є присутньою сполука, яка підтримує стабільною проміжну сполуку; та температура реакції на етапі b) складає від 4 до 37 °С.
2. Спосіб за п. 1, в якому на етапі b) період часу складає від 1 хвилини до 4 годин, від 2 хвилин до З годин, від З хвилин до 2 годин, від 4 до 60 хвилин, від 5 до 50 хвилин, від 6 до 40 хвилин, від 7 до 30 хвилин або від 8 до 20 хвилин.
3. Спосіб за п. 1, в якому на етапі b) період часу складає від 1 хвилини до 5 годин, від 10 хвилин до 4 годин, від 20 хвилин до 3 годин, від 30 хвилин до 2 годин, від 40 до 90 хвилин або від 50 до 70 хвилин.
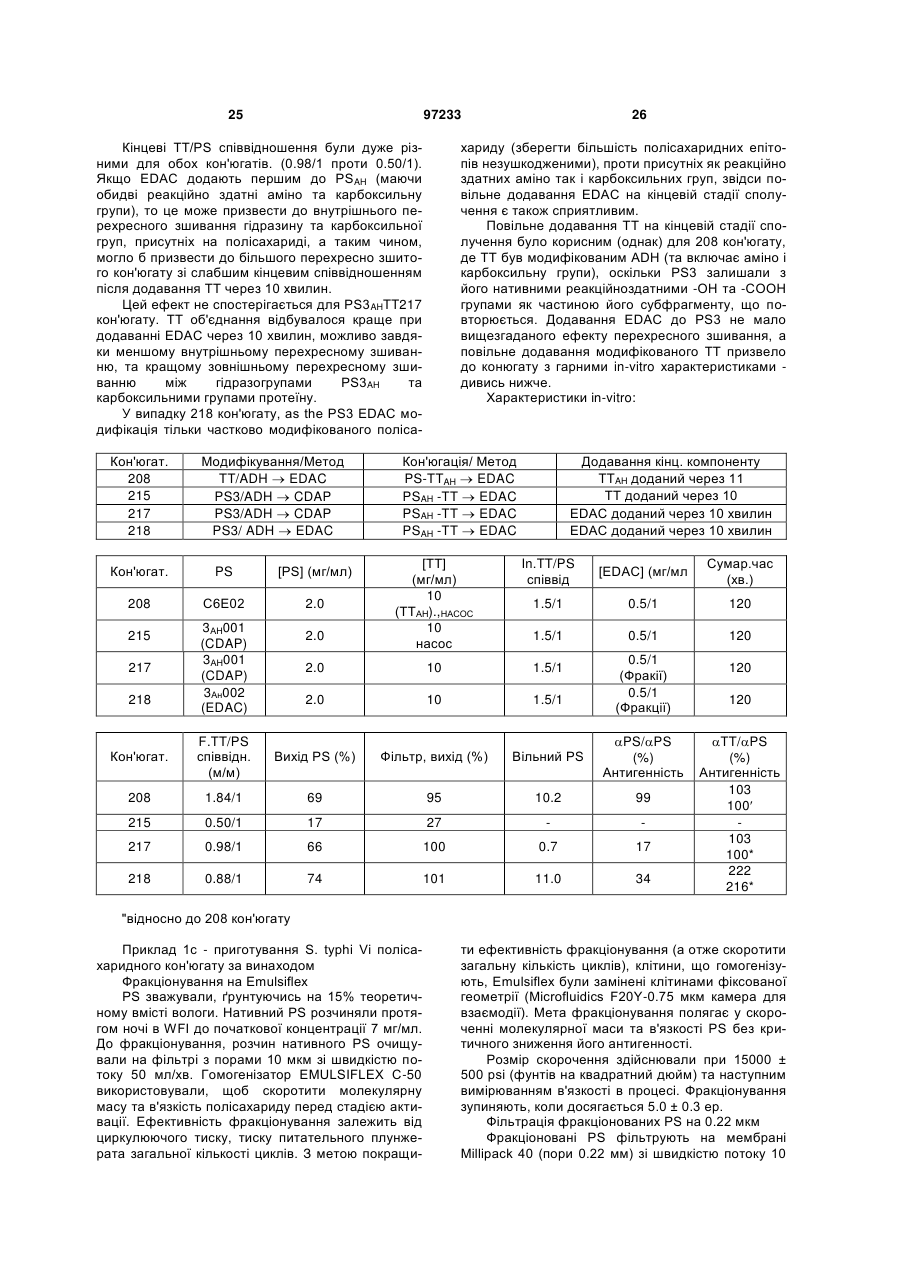
4. Спосіб за пп. 1-3, в якому карбодіімід являє собою EDAC (1-етил-3-{3-диметиламінопропіл)карбодіімід) або карбодіімід, відмінний від EDAC.
5. Спосіб за пп. 1-4, в якому аліквота карбодііміду, необхідна для проведення кон'югації, складає від 0,05 до 2 або від 0,09 до 1 мг/мг сахариду.
6. Спосіб за пп. 1-5, в якому сахарид та/або білок-носій був дериватизований для включення аміногруп або карбоксильних груп.
7. Спосіб за п. 6, в якому дериватизацію здійснюють шляхом приєднання гетеро- або гомо-біфункціонального лінкера.
8. Спосіб за п. 7, в якому лінкер містить від 4 до 12 атомів вуглецю.
9. Спосіб за п. 7 або 8, в якому лінкер містить дві реакційноздатні аміногрупи.
10. Імуногенна композиція за пп. 7-9, в якій лінкер являє собою ADH.
11. Спосіб за п. 7 або 8, в якому лінкер містить дві реакційноздатні групи карбонової кислоти.
12. Спосіб за п. 7 або 8, в якому лінкер містить реакційноздатну аміногрупу на одному кінці та реакційноздатну групу карбонової кислоти на іншому кінці.
13. Спосіб за пп. 7-12, в якому дериватизацію здійснюють шляхом проведення реакції великого надлишку лінкера з сахаридом та/або білком-носієм, що піддають дериватизації.
14. Спосіб за пп. 7-13, в якому сахарид містить реакційноздатну гідроксильну групу як частину своєї повторюваної одиниці, яка є частково дериватизованою за допомогою аміногрупи лінкера.
15. Спосіб за п. 14, в якому сахарид є частково дериватизованим методом CDAP.
16. Спосіб за пп. 7-13, в якому сахарид містить реакційноздатну аміногрупу як частину своєї повторюваної одиниці, яка є частково дериватизованою за допомогою карбоксильної групи лінкера.
17. Спосіб за п. 16, в якому сахарид є частково дериватизованим за допомогою карбодіімідної конденсації.
18. Спосіб за пп. 7-13, в якому сахарид містить реакційноздатну гідроксильну групу як частину своєї повторюваної одиниці, яка є частково дериватизованою за допомогою аміногрупи лінкера.
19. Спосіб за п. 18, в якому сахарид є частково дериватизованим за допомогою карбодіімідного способу.
20. Спосіб за пп. 1-19, в якому на етапі b) аліквоту карбодііміду, сахариду або білка-носія додають з постійною швидкістю з використанням насоса.
21. Спосіб за пп. 1-19, в якому на етапі b) аліквоту карбодііміду, сахариду або білка-носія додають у декілька прийомів протягом періоду часу.
22. Спосіб за п. 21, в якому принаймні чверть аліквоти додають протягом першої половини періоду та принаймні чверть аліквоти додають протягом другої половини періоду.
23. Спосіб за п. 21 або 22, в якому аліквоту "а" додають в 4-100 стадій "s".
24. Спосіб за п. 23, в якому a/s аліквоти додають на кожній стадії.
25. Спосіб за п. 23 або 24, в якому, якщо одна стадія відбувається в момент часу "нуль" періоду "р", то кожна наступна стадія відбувається в момент часу, який дорівнює p/(s-1).
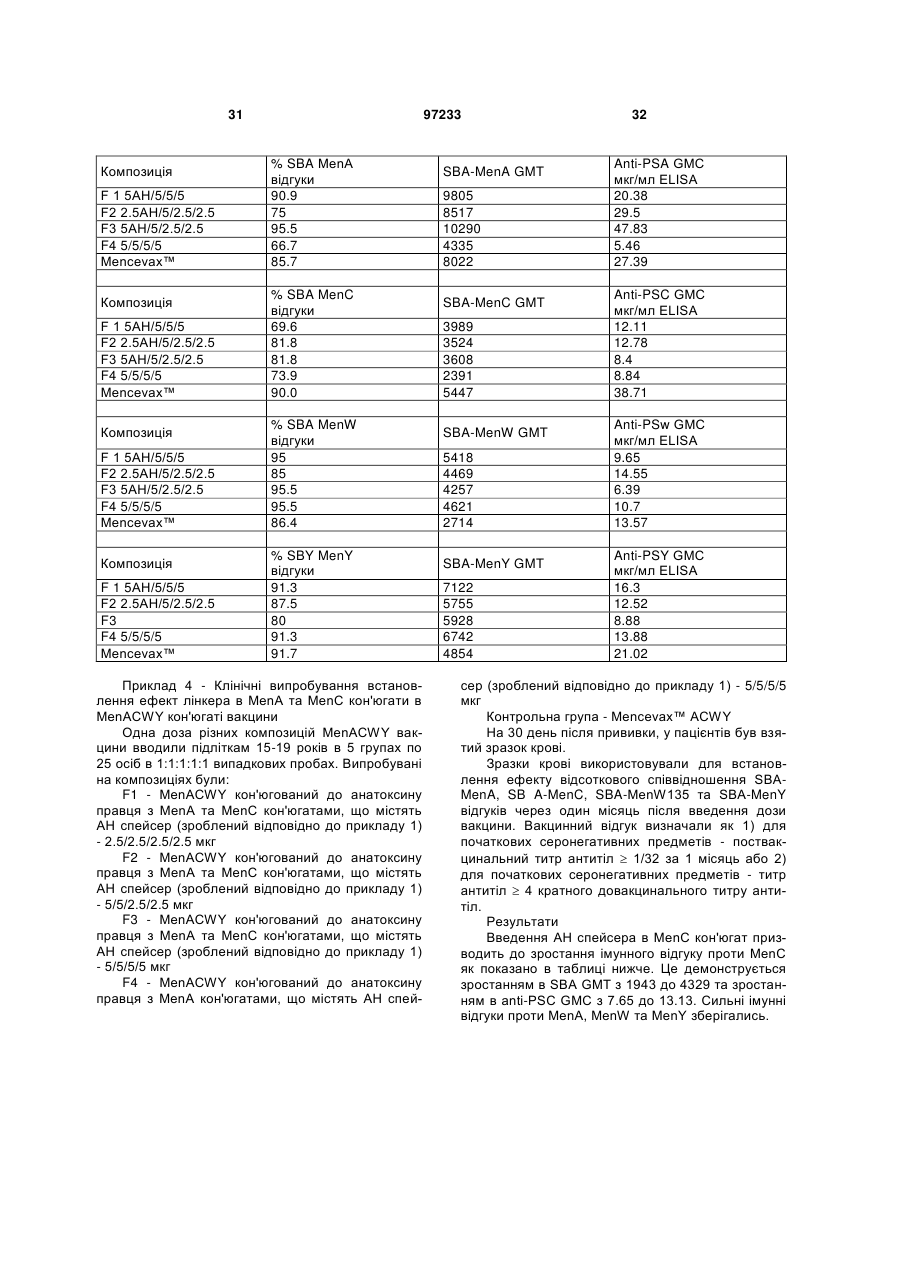
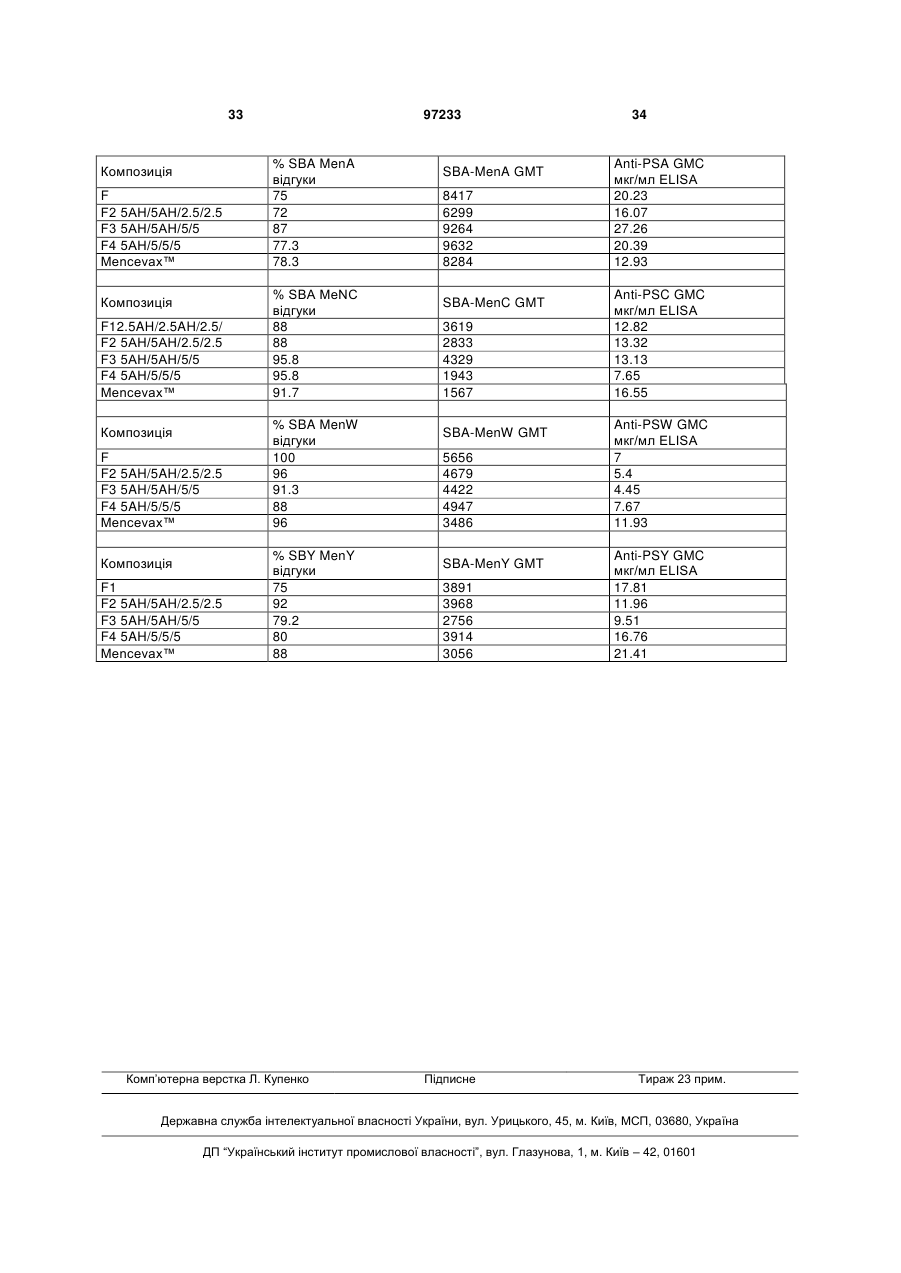
26. Спосіб за пп. 1-25, в якому початкове співвідношення білка-носія та сахариду складає від4:1 до 1:1 або від 3:1 до 2:1 (ваг./ваг.).
27. Спосіб за пп. 1-26, в якому концентрація солі, наприклад NaCI, що є присутньою на етапі b), становить 0,1-1 або 0,2-0,5 М.
28. Спосіб за пп. 1-27, в якому рН реакційної суміші на етапі b) підтримують на рівні рН 4,7-6,0 або 5-5,5.
29. Спосіб за пп. 1-27, в якому N-гідроксисукцинімід є також присутнім в реакційній суміші на етапі b), а рН реакційної суміші на етапі b) підтримують в межах рН 4,5-7,5.
30. Спосіб за пп. 1-29, в якому температуру реакції на етапі b) підтримують на рівні 10-32, 17-30 або 22-27 °С.
31. Спосіб за пп. 1-30, в якому після додавання аліквот на етапі b) підтримують реакцію протягом додаткових від 10 хвилин до 72 годин, від 20 хвилин до 48 годин, від 30 хвилин до 24 годин, від 40 хвилин до 12 годин, від 50 хвилин до 6 годин або 1-3 години.
32. Спосіб за пп. 1-31, в якому відразу після закінченні реакції рН доводять до значення 7,5-9.
33. Спосіб за пп. 1-32, який включає наступний етап с), на якому сахарид-білковий кон'югат очищають на ексклюзивній хроматографічній колонці.
34. Спосіб за пп. 1-33, який включає наступний етап d), на якому сахарид-білковий кон'югат стерильно фільтрують.
35. Спосіб за пп. 1-34, який включає наступний етап е), на якому ефективну дозу сахарид-білкового кон'югату рецептують з фармацевтично прийнятним наповнювачем для виготовлення імуногенної композиції або вакцини.
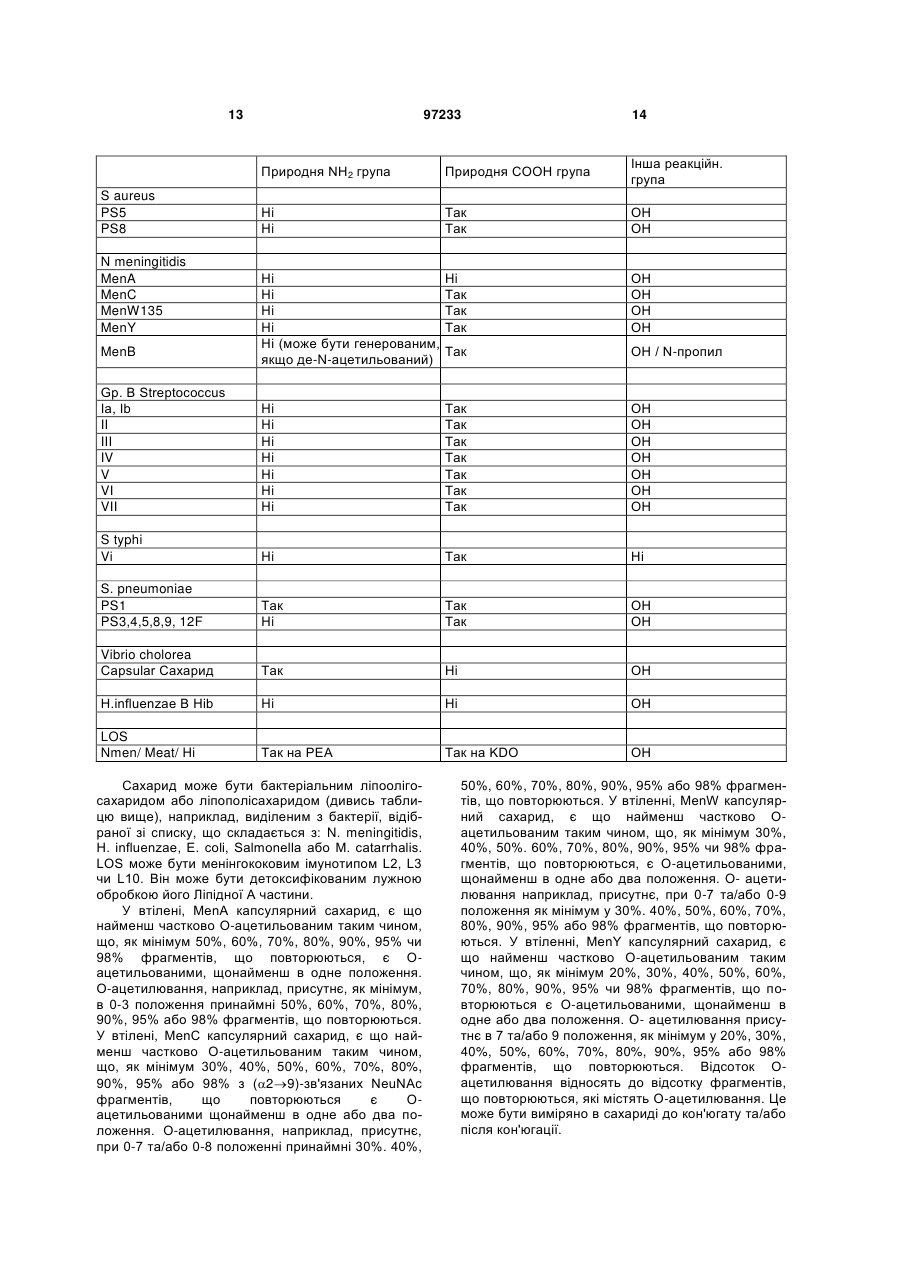
36. Спосіб за пп. 1-35, в якому сахарид є бактеріальним капсулярним сахаридом, зокрема, виділеним з бактерій, вибраних зі списку, що складається з: N. Meningitidis серогрупи А, В, С, W135 або Y, Streptococcus pneumoniae серотипів 1, 2, 3, 4, 5, 6А, 6В, 7F, 8, 9N, 9V, 10А, 11А, 12F, 14, 15В, 17F, 18С, 19А, 19F, 20, 22F, 23F або 33F, групи В Streptococcus групи Іа, lb, II, III, IV, V, VI або VII, Staphylococcus aureus типу 5, Staphylococcus aureus типу 8, Salmonella typhi (Vi сахарид), Vibrio cholerae або H. influenzae типу b.
37. Спосіб за пп. 1-36, в якому усереднена молекулярна вага сахариду складає 1000-2000000, 5000-1000000, 10000-500000, 50000-400000, 75000-300000 або 100000-200000.
38. Спосіб за пп. 1-37, в якому сахарид є або нативним полісахаридом, або фракціонованим з коефіцієнтом не більш ніж х10 (зокрема, шляхом мікрофлюїдизації).
39. Спосіб за пп. 1-35, в якому сахарид є бактеріальним ліпоолігосахаридом або ліпополісахаридом, наприклад, виділеним з бактерій, що вибрані з групи, що складається з: N. meningitidis, Н. influenzae, Е. соlі, Salmonella або М. catarrhalis.
40. Спосіб за пп. 1-39, в якому білок-носій містить один або більше Т-хелперних епітопів.
41. Спосіб за пп. 1-40, в якому білок-носій є вибраним з групи, що складається з: ТТ, DT, CRM197, фрагмента С ТТ, білка D Н. influenzae, пневмококового PhtD та пневмококового пневмолізину.
42. Імуногенна композиція або вакцина, що отримана за допомогою способу за пп. 1-41.
43. Застосування імуногенної композиції або вакцини за п. 42 у виробництві лікарського засобу для попередження або лікування захворювання.
44. Спосіб попередження або лікування захворювання, що містить стадію введення ефективної дози імуногенної композиції або вакцини за п. 42 пацієнту, що потребує цього.
45. Застосування чи спосіб за п. 43 або п. 44, де захворювання є таким, що викликається бактеріями, вибраними з групи, що складається з: N. meningitidis, Streptococcus pneumoniae, М. catarrhalis, групи В Streptococcus, Staphylococcus aureus, Salmonella typhi, Vibrio cholerae, E. coli та H. influenzae.
Текст
1. Спосіб одержання імуногенної композиції, що включає кон'югацію сахариду до білка-носія з використанням карбодіімідної конденсації, в якому сахарид містить (зокрема, як частину своєї повторюваної одиниці), або був дериватизований для введення, аміно- та/або карбоксильні групи, і в якому білок-носій містить, або був дериватизова 2 (19) 1 3 сполуку; та температура реакції на етапі b) складає від 4 до 37 °С. 2. Спосіб за п. 1, в якому на етапі b) період часу складає від 1 хвилини до 4 годин, від 2 хвилин до З годин, від З хвилин до 2 годин, від 4 до 60 хвилин, від 5 до 50 хвилин, від 6 до 40 хвилин, від 7 до 30 хвилин або від 8 до 20 хвилин. 3. Спосіб за п. 1, в якому на етапі b) період часу складає від 1 хвилини до 5 годин, від 10 хвилин до 4 годин, від 20 хвилин до 3 годин, від 30 хвилин до 2 годин, від 40 до 90 хвилин або від 50 до 70 хвилин. 4. Спосіб за пп. 1-3, в якому карбодіімід являє собою EDAC (1-етил-3-{3диметиламінопропіл)карбодіімід) або карбодіімід, відмінний від EDAC. 5. Спосіб за пп. 1-4, в якому аліквота карбодііміду, необхідна для проведення кон'югації, складає від 0,05 до 2 або від 0,09 до 1 мг/мг сахариду. 6. Спосіб за пп. 1-5, в якому сахарид та/або білокносій був дериватизований для включення аміногруп або карбоксильних груп. 7. Спосіб за п. 6, в якому дериватизацію здійснюють шляхом приєднання гетеро- або гомобіфункціонального лінкера. 8. Спосіб за п. 7, в якому лінкер містить від 4 до 12 атомів вуглецю. 9. Спосіб за п. 7 або 8, в якому лінкер містить дві реакційноздатні аміногрупи. 10. Імуногенна композиція за пп. 7-9, в якій лінкер являє собою ADH. 11. Спосіб за п. 7 або 8, в якому лінкер містить дві реакційноздатні групи карбонової кислоти. 12. Спосіб за п. 7 або 8, в якому лінкер містить реакційноздатну аміногрупу на одному кінці та реакційноздатну групу карбонової кислоти на іншому кінці. 13. Спосіб за пп. 7-12, в якому дериватизацію здійснюють шляхом проведення реакції великого надлишку лінкера з сахаридом та/або білком-носієм, що піддають дериватизації. 14. Спосіб за пп. 7-13, в якому сахарид містить реакційноздатну гідроксильну групу як частину своєї повторюваної одиниці, яка є частково дериватизованою за допомогою аміногрупи лінкера. 15. Спосіб за п. 14, в якому сахарид є частково дериватизованим методом CDAP. 16. Спосіб за пп. 7-13, в якому сахарид містить реакційноздатну аміногрупу як частину своєї повторюваної одиниці, яка є частково дериватизованою за допомогою карбоксильної групи лінкера. 17. Спосіб за п. 16, в якому сахарид є частково дериватизованим за допомогою карбодіімідної конденсації. 18. Спосіб за пп. 7-13, в якому сахарид містить реакційноздатну гідроксильну групу як частину своєї повторюваної одиниці, яка є частково дериватизованою за допомогою аміногрупи лінкера. 19. Спосіб за п. 18, в якому сахарид є частково дериватизованим за допомогою карбодіімідного способу. 20. Спосіб за пп. 1-19, в якому на етапі b) аліквоту карбодііміду, сахариду або білка-носія додають з постійною швидкістю з використанням насоса. 97233 4 21. Спосіб за пп. 1-19, в якому на етапі b) аліквоту карбодііміду, сахариду або білка-носія додають у декілька прийомів протягом періоду часу. 22. Спосіб за п. 21, в якому принаймні чверть аліквоти додають протягом першої половини періоду та принаймні чверть аліквоти додають протягом другої половини періоду. 23. Спосіб за п. 21 або 22, в якому аліквоту "а" додають в 4-100 стадій "s". 24. Спосіб за п. 23, в якому a/s аліквоти додають на кожній стадії. 25. Спосіб за п. 23 або 24, в якому, якщо одна стадія відбувається в момент часу "нуль" періоду "р", то кожна наступна стадія відбувається в момент часу, який дорівнює p/(s-1). 26. Спосіб за пп. 1-25, в якому початкове співвідношення білка-носія та сахариду складає від4:1 до 1:1 або від 3:1 до 2:1 (ваг./ваг.). 27. Спосіб за пп. 1-26, в якому концентрація солі, наприклад NaCI, що є присутньою на етапі b), становить 0,1-1 або 0,2-0,5 М. 28. Спосіб за пп. 1-27, в якому рН реакційної суміші на етапі b) підтримують на рівні рН 4,7-6,0 або 5-5,5. 29. Спосіб за пп. 1-27, в якому Nгідроксисукцинімід є також присутнім в реакційній суміші на етапі b), а рН реакційної суміші на етапі b) підтримують в межах рН 4,5-7,5. 30. Спосіб за пп. 1-29, в якому температуру реакції на етапі b) підтримують на рівні 10-32, 17-30 або 22-27 °С. 31. Спосіб за пп. 1-30, в якому після додавання аліквот на етапі b) підтримують реакцію протягом додаткових від 10 хвилин до 72 годин, від 20 хвилин до 48 годин, від 30 хвилин до 24 годин, від 40 хвилин до 12 годин, від 50 хвилин до 6 годин або 1-3 години. 32. Спосіб за пп. 1-31, в якому відразу після закінчення реакції рН доводять до значення 7,5-9. 33. Спосіб за пп. 1-32, який включає наступний етап с), на якому сахарид-білковий кон'югат очищають на ексклюзивній хроматографічній колонці. 34. Спосіб за пп. 1-33, який включає наступний етап d), на якому сахарид-білковий кон'югат стерильно фільтрують. 35. Спосіб за пп. 1-34, який включає наступний етап е), на якому ефективну дозу сахаридбілкового кон'югату рецептують з фармацевтично прийнятним наповнювачем для виготовлення імуногенної композиції або вакцини. 36. Спосіб за пп. 1-35, в якому сахарид є бактеріальним капсулярним сахаридом, зокрема, виділеним з бактерій, вибраних зі списку, що складається з: N. Meningitidis серогрупи А, В, С, W135 або Y, Streptococcus pneumoniae серотипів 1, 2, 3, 4, 5, 6А, 6В, 7F, 8, 9N, 9V, 10А, 11А, 12F, 14, 15В, 17F, 18С, 19А, 19F, 20, 22F, 23F або 33F, групи В Streptococcus групи Іа, lb, II, III, IV, V, VI або VII, Staphylococcus aureus типу 5, Staphylococcus aureus типу 8, Salmonella typhi (Vi сахарид), Vibrio cholerae або H. influenzae типу b. 37. Спосіб за пп. 1-36, в якому усереднена молекулярна вага сахариду складає 1000-2000000, 5000-1000000, 10000-500000, 50000-400000, 75000-300000 або 100000-200000. 5 97233 6 38. Спосіб за пп. 1-37, в якому сахарид є або нативним полісахаридом, або фракціонованим з коефіцієнтом не більш ніж х10 (зокрема, шляхом мікрофлюїдизації). 39. Спосіб за пп. 1-35, в якому сахарид є бактеріальним ліпоолігосахаридом або ліпополісахаридом, наприклад, виділеним з бактерій, що вибрані з групи, що складається з: N. meningitidis, Н. influenzae, Е. соlі, Salmonella або М. catarrhalis. 40. Спосіб за пп. 1-39, в якому білок-носій містить один або більше Т-хелперних епітопів. 41. Спосіб за пп. 1-40, в якому білок-носій є вибраним з групи, що складається з: ТТ, DT, CRM197, фрагмента С ТТ, білка D Н. influenzae, пневмококового PhtD та пневмококового пневмолізину. 42. Імуногенна композиція або вакцина, що отримана за допомогою способу за пп. 1-41. 43. Застосування імуногенної композиції або вакцини за п. 42 у виробництві лікарського засобу для попередження або лікування захворювання. 44. Спосіб попередження або лікування захворювання, що містить стадію введення ефективної дози імуногенної композиції або вакцини за п. 42 пацієнту, що потребує цього. 45. Застосування чи спосіб за п. 43 або п. 44, де захворювання є таким, що викликається бактеріями, вибраними з групи, що складається з: N. meningitidis, Streptococcus pneumoniae, М. catarrhalis, групи В Streptococcus, Staphylococcus aureus, Salmonella typhi, Vibrio cholerae, E. coli та H. influenzae. Даний винахід стосується вдосконалених методів проведення реакцій карбодіімідної конденсації. Зокрема, він стосується з'єднання сахаридів та протеїнів з використанням карбодіімідної конденсації. Він також стосується імуногенних композицій, які можуть містити сахарид-протеїнові кон'югати за даним винаходом. Бактеріальні капсулярні полісахариди широко використовувались протягом багатьох років для попередження бактеріальних захворювань. Однак, проблемою такого використання є Т-незалежна природа імунного відгуку. Ці антигени є слабкоімуногенними у немовлят. Ця проблема може бути вирішена шляхом кон'югації плісахаридних антигенів до протеїну-носія (джерело Т-хелперних епітопів) який потім може бути використаний для виклику Т-залежного імунного відгуку навіть на першому році життя. Різноманітні методи кон'югації відомі з рівня техніки. Кон'югати можуть бути отримані прямим відновлюючим амінуванням, як описано в US 4365170 (Jennings) та US 4673574 (Anderson). Інші методи описані в ЕР-0-161-188, ЕР-208375 та ЕР0-477508. Метод кон'югації може альтернативно грунтуватися на активації гідроксильних груп сахариду 1-ціано-4-диметиламінопіридиній тетрафтороборатом (CDAP) з утворенням ціанатного ефіру. Активований сахарид може бути приєднаний безпосередньо, або через спейсерну (лінкерну) групу, до аміногрупи протеїну-носія. Наприклад, ціанатний ефір може бути з'єднаний з гександиаміном або дигідразидом адипінової кислоти (АН або ADH) та амінопохідне сахариду приєднано до протеїну-носія, за допомогою конденсації з використанням карбодііміду (наприклад, EDAC або EDC), через карбоксильну групу протеїну-носія. Такі кон'югати описані в опублікованій РСТ заявці WO 93/15760 Uniformed Services University, а також WO 95/08348 та WO 96/29094. Також це видно в публікації Сhu С. et al Infect. Immunity, 1983 245 256. Взагалі, наступні типи хімічних груп протеїнуносія можуть бути використані для конденсації/кон'югації: A) Карбоксил (наприклад, аспарагінової та глютамінової кислот), який може бути кон'югований до натуральних або модифікованих аміногруп сахаридних фрагментів з використанням карбодіімідних методів; B) Аміногрупа (наприклад, лізину), яка може бути кон'югована до натуральних або модифікованих карбоксильних груп сахаридних фрагментів з використанням карбодіімідних методів; C) Сульфогідрил (наприклад, цистеїну); D) Гідроксильна група (наприклад, тірозину); Е) Імідазолільна група (наприклад, гістидину); F) Гуанідильна група (наприклад, аргініну); та О) Індолильна група (наприклад, триптофану). Взагалі, в сахариді наступні групи можуть бути використані для конденсації: ОН, СООН or NH2. Альдегідні групи можуть бути генеровані різними видами обробок, відомих з рівня техніки, таких, як: перйодат, кислотний гідроліз, перекис водню тощо. Методи прямої конденсації: Сахарид-ОН + CNBr або CDAP ціанатний ефір + NH2-NH2 кон'югат Сахарид-Альдегід + ΝΗ2-Прот Основа Шифа + NaCNBH3 кон'югат Сахарид-СООН + ΝΗ2-Прот + EDAC кон'югат Сахарид-NН2 + СООН-Прот + EDAC кон'югат Методи прямої непрямої конденсації через спейсер (лінкер) Сахарид-ОН + CNBr або CDAP ціанатний ефір + NH2—NH2 сахарид— NH2 + СООН-Прот + EDAC кон'югат Сахарид-ОН + CNBr або CDAP ціанатний ефір + NH2—SH сахарид—SH + SH-Прот (нативний Протеїн з незахищеним цистеїном або отриманий після модифікації аміногруп протеїну, наприклад, SPDP) сахарид-S-S-Прот Сахарид-ОН + CNBr або CDAP ціанатний ефір + NH2—SH сахарид—SH + малеімід-Прот (модифікація аміногруп) кон'югат Сахарид-СООН + EDAC + NH2—NH2 сахарид------NH2 + EDAC + СООН-Прот кон'югат 7 Сахарид-СООН + EDAC+ NH2—SH сахарид—SH + SH-Πрот (нативний Протеїн з незахищеним цистеїном або отриманий після модифікації аміногруп протеїну, наприклад, SPDP) сахаридS-S-Прот Сахарид-СООН + EDAC+ NH2—SH сахарид—SH + малеімід-Πрот (модифікація аміногруп) кон'югат Сахарид-Альдегід + NH2—NH2 сахарид-NН2 + EDAC + СООН-Прот кон'югат Як може бути видно, карбодіімідні методи (наприклад, використання EDAC) є дуже зручні для реакцій кон'югації, оскільки вони використовують групи сахариду та або протеїну, які можуть бути натурально присутніми або легко вводитися модифікацією. Також зручно зв'язувати компоненти через пептидний зв'язок. Карбодііміди (RN=C=NR') є ненасиченими сполуками з аленовою структурою (Nakajima and Ikada 1995 Bioconjugate Chem. 6 :123-130; Hoare and Koshland 1967 JBC 242:2447-2453). Цей реагент відносно нестабільний при власному реакційному рН (4.5-6.5), однак, в даній галузі існує тенденція додавати разом всі компоненти реакції сахарид/протеїн/карбодіімідної кон'югації. Авторами винаходу було знайдено, що в залежності від природи сахариду та протеїну, що вводяться в кон'югацію, кращі властивості кінцевого кон'югату для застосування вакцини можуть бути досягнуті шляхом повільного додавання певної компоненти реакції до суміші. В цих діях одне або більше переваг/вдосконалень може бути реалізоване так, як: переробка сахариду в кон'югат, здатність кон'югату до стерильного фільтрування, кращий контроль кон'югації, більш легка відтворюваність та/або попередження внутрішнього перехресного зв'язування. Відповідно, в одному з втілень що стосується методу кон'югації сахариду з протеїном-носієм з використанням методу карбодіімідної конденсації, в якому сахарид містить (наприклад, як частина фрагменту, що повторюється), або містить в результаті модифікації, аміно та/або карбоксильні групи, і в якому протеїн-носій містить, або містить в результаті модифікації, аміно та/або карбоксильні групи, що включає наступні варіанти: І) - якщо протеїн-носій містить як аміно, так і карбоксильні групи і сахарид містить або аміно або карбоксильні групи: a) змішування сахариду та аліквоти карбодііміду, необхідної для проведення кон'югації, та b) додавання аліквоти протеїну-носія проводять протягом періоду від 35 секунд до 6 годин; 11) - якщо сахарид містить як аміно, так і карбоксильні групи і протеїн-носій містить або аміно або карбоксильні групи: a) змішування протеїну-носія та аліквоти карбодііміду, необхідної для проведення кон'югації, та b) додавання аліквоти сахариду проводять протягом періоду від 35 секунд до 6 годин; III) - якщо протеїн-носій містить як аміно, так і карбоксильні групи і сахарид містить як аміно, так і карбоксильні групи: a) змішування протеїну-носія і сахариду, та 97233 8 b) додавання аліквоти карбодііміду, необхідного для проведення кон'югації проводять протягом періоду від 35 секунд до 6 годин. Будь-який підходящий карбодіімід може бути використаний за умови, що він здатний конденсувати сахариди та протеїни у водному середовищі. В одному з втілень даного винаходу в якості карбодііміду може виступати EDAC (1-етил-3-(3диметил-амінопропил)карбодіімід) [також відомий як EDC] або це може бути інший карбодіімід, ніж EDAC. Термін "сахарид" по всьому тексту опису може означати полісахарид або олігосахарид та включає обидва значення. Він може також означати ліпополісахарид (LPS) або ліпоолігосахарид (LOS). До того, як використати полісахариди (такі як бактеріальні полісахариди) можуть бути виділені з вихідного штаму (наприклад, бактерії) чи виділені з вихідного штаму та фракціоновані до певного ступеню відомими методами (дивися, наприклад, ЕР497524 та ЕР497525; Shousun Chen Szu et at. Carbohydrate Research Vol 152 p7-20 (1986)) наприклад, мікрофлюїдизацією. Полісахариди можуть бути фракціоновані для того, щоб понизити в'язкість в полісахаридних зразках та/або покращити здатність до фільтрування кон'югованих продуктів. Олігосахариди мають низьке число фрагментів, що повторюються (зазвичай 5-30 фрагментів, що повторюються) та є типовими гідролізованими полісахаридами. Значення терміну "протеїн-носій" охоплює як малі, так і великі поліпептиди (>10 kDa). Очевидно, що більш ймовірним для великих поліпептидів є те, що вони міститять реакційно здатні як аміно, так і карбоксильні групи без будь-якої модифікації. Згідно з суттю винаходу, термін "нативний полісахарид" відносситься до сахариду, що не був підданий процесам, метою яких є зменшення розміру сахариду. Полісахарид може стати злегка меншим в розмірі під час нормальних процедур очистки. Такий сахарид залишається нативним. Тільки, якщо полісахарид був підданий процесам фракціонування, то такий полісахарид не буде розглядатися як нативний. Згідно з суттю винаходу, вираз "фракціонування з коефіцієнтом до х 2" означає, що сахарид піддають прогнозованому процесу скорочення розміру сахариду але підтримують розмір більше ніж половину розміру нативного полісахариду. х3, х4 і т.д. інтерпретують таким же чином, тобто сахарид піддають прогнозованому процесу скорочення розміру сахариду але підтримують розмір більше ніж третина, чверть і т.д. розміру нативного полісахариду. Період часу від 35 секунд до 6 годин в стадії b) методу для додавання повної аліквоти кінцевої компоненти може становити від 50 секунд до 5 годин, від 1 хвилини до 4 годин, від 2 хвилин до 3 годин, від 3 хвилин до 2 годин, від 4 до 60 хвилин, від 5 до 50 хвилин, від 6 до 40 хвилин, від 7 до 30 хвилин або від 8 до 20 хвилин. Він також може бути від 1 хвилини до 5 годин, від 10 хвилин до 4 годин, від 20 хвилин до 3 годин, від 30 хвилин до 2 годин, від 40 до 90 хвилин, або від 50 до 70 хвилин. Цей час можна регулювати відповідно до кон 9 кретних сахариду та протеїну, що вводяться в конденсацію. В одному з втілень аліквоту кінцевої компоненти (наприклад, карбодіімід, сахарид чи протеїн) додають до реакційної суміші при постійній швидкості протягом певного періоду часу (це легко досягається, з використанням насосу, що працює при постійній швидкості). Альтернативно вона може бути додана декількома порціями протягом певного періоду часу. Хоча це може бути зроблено багатьма шляхами, в основних частинах аліквоту слід добавляти протягом всього періоду. Наприклад, принаймі одна чверть аліквоти може додаватись протягом першої половини періоду, та що найменш одна чверть аліквоти протягом другої половини періоду. Загальна кількість відміряної аліквоти 'а', наприклад, в мл чи мг може додаватись в 4100 етапів ('s') через період, в одному з втілень стадії систематизують так що рівні кількості (a/s) вводять на всіх стадіях. В одному з втілень стадії рівномірно розташовують з проміжками через період 'р' (в секундах). Таким чином, якщо одна стадія відбувається а час ноль з періодом 'р', тоді кожна наступна стадія могла б відбуватися в час, який дорівнює p/(s-1). Об'єм аліквоти кінцевої компоненти доданої на стадії b) може регулюватись зручністю додавання аліквоти до реакції з бажаним періодом часу. Карбодіімід може додаватись як водний розчин (зазвичай буферизований при рН 7.5 перед додаванням до реакції) або як твердий порошок (EDAC, наприклад, є високорозчинним у водному середовищі). Звичайно, якщо карбодіімід - це остання компонента, що додається до реакції (варіант III стадія b)), повільне розчинення карбодііміду може бути використане, так що повна аліквота порошку додається до реакції всіх одночасно, але він розчиняється зі швидкістю, що узгоджується з бажаним періодом, понад який аліквота стає доступною до реакції. Якщо протеїн та/чи сахарид не містить аміно або карбоксильну групи (чи тільки одну з них), він може бути модифікований, щоб ввести її в нього (чи ввести іншу, якщо він не містив її). Наприклад, тільки для сахариду, що містить реакційно здатні гідроксильні групи (наприклад, менінгококова серогрупа А капсулярного сахариду), така група була б використана для модифікації на аміно чи карбоксильній групах, настільки, що може відбутися EDAC конденсація. Це може відбуватися в субодиницях, що повторюються, або може бути групою присутньою тільки на кінці молекули сахариду. Як було б зазначено, що де відбувається модифікація, там може бути корисним тільки частково модифіковани половина. Для сахаридів з субодиницями, що повторюються, епітоп мішені може бути присутнім в кожному повторенні. Тому, якщо відбувається часткова модифікація (для цього мається на увазі 0.5-20, 1-15, 3-12, чи 5-10% реакційноздатної групи мішнні є фактично модифікованою), то це може мати перевагу в зберіганні більшості епітопів та значному запобіганні перехресного зшивання. Якщо сахарид чи протеїн вже мають тільки аміно чи карбоксильну (наприклад, Vi сахарид з 97233 10 Salmonella typhi який природньо містить карбоксильну, але не аміно групи), модифікування може відбуватися, щоб надати їй інший тип групи (тобто аміно групи для Vi). Зазначалося, однак, що як модифікування може бути частковим цієї дії може змінити переважаючу реакцію винаходу з типу І на тип llІ. Наприклад, якщо Vi сахарид є кон'югованим до протеїну-носію, який включає як аміно так і карбоксильну групи, варіант І додає повільно аліквоту протеїну в стадії b). Якщо карбоксильна група Vi сахариду частково модифікована аміно групами, то він буде містити як карбоксильну так і аміно групи, таким чином, варіант III, повільне додавання аліквоти карбодііміду в стадії b), стає найбільш важливим. Модифікація може відбуватися через додавання гетеро- чи гомо-біфункціонального лінкеру. Це може проходити за подібними хімічними процесами, як описано вище для стадії конюгації сахарид-протеїн (наприклад, карбодіімідним або CDAP методом). Лінкер може містити від 4 до 20, 4 до 12, чи 5 до 10 атомів вуглецю, він може містити дві реакційноздатні аміно групи, дві реакційноздатні карбоксильні групи, чи одна з кожної (наприклад, гександиамін, 6-амінокапронова кислота, або гідразид адипінової кислоти). Як правило, модифікація відбувається через реагування великого надлишку лінкеру з сахаридом та/або протеїномносієм, щоб бути модифікованим. Це дозволяє модифікації протікати з мінімальним внутрішнім перехресним зшиванням (що може бути можливим, якщо, наприклад, карбоксильна група на сахариді модифікується аміно групами, використовуючи карбодіімідну конденсацію). Надлишковий лінкер легко видаляється з використанням методики такої, як діафільтрація. В одному з втілень сахарид включає реакційноздатну гідроксильну групу як частину його фрагменту, що повторюється, яка є частково модифікованою через аміно групу на лінкері (наприклад, методом CDAP). В іншому втіленні сахарид включає реакційноздатну аміно групу як частину його фрагменту, що повторюється, яка є частково модифікованою через карбоксильну групу на лінкері (наприклад, карбодіімідним методом). В подальших втіленнях сахарид включає реакційноздатну карбоксильну групу як частину його фрагменту, що повторюється, яка є частково модифікованою через аміно групу на лінкері (наприклад, карбодіімідним методом). Аліквота карбодііміду, щоб виконати кон'югацію (присутню в стадії або а) або b) реакції винаходу) складала від 0.01 до 3,4).05 до 2, чи 0.09 до 1 мг карбодііміду/мг сахариду. Хоча ці кількості розраховували по відношенню до EDAC будучи карбодіімідом, ці кількості можуть регулюватись, якщо будь-який інший карбодіімід використовується множенням кількості в ряду: (молекулярна маса іншого карбодііміду)/( молекулярна маса EDAC). Взагалі, сахарид може бути присутнім в методах винаходу з кінцевою концентрацією 0.5-50 мг/мл в стадії b). Це буде залежати від розміру та природи сахариду, та степеню будь-якої модифікації. Наприклад, для олігосахаридів буде необ 11 хідною велика концентрація, але для великих полісахаридів буде більш прийнятною набагато менша концентрація. Якщо він має великий кінець частково модифікований аміно чи карбоксильними групами, то менша концентрація може бути прийнятною, щоб зменшити можливість будь-якого перехресного зшивання. Протеїн-носій може бути присутній з кінцевою концентрацією 1-50 мг/мл в стадії b). Початкове співвідношення протеїну-носія до сахариду в способах за винаходом може складати 5:1 до 1:5, 4:1 до 1:1, чи 3:1 до 2:1 (м/м). Крім того, це буде залежити від розміру та природи сахариду та степеню будь-якої модифікації. Сольові умови (наприклад, NaCI) також можуть змінюватись в залежності від природи сахариду/протеїну. Зазвичай близько 0.2М NaCI може знаходитись в стадії b) способів за винаходом, але може складати 0-2, 0.1-1 чи 0.2-0.5 М. В межах рН в стадії b) способів за винаходом, рН реакції може складати будь-який рН, де карбодіімід є активованим - наприклад, рН 4.5-6.5, 4.76.0, чи 5-5.5. Цей рН, зазвичай, утримується протягом реакції додаванням кислоти/основи за потребою. EDAC, як правило, є стабільним при рН 7.5, хоча, якщо кон'югація вимагає проведення при вищих рН, то, як відомо, існують сполуки, що зберігають реакційне середовище стабільним (такі як N-гідроксисукцинімід), які також можуть бути присутніми в стадії b), в цих випадках рН реакції в стадії b) може утримуватись при рН 4.5-7.5. Температура реакції протягом стадії b) способів за винаходом може складати 4-37,10-32,17-30, чи 22-27°С, та як правило, утримується протягом реакції. В способах за винаходом, повна аліквота додається одноразово в стадії b) реакція, як правило підтримується протягом подальших від 10 хвилин до 72 годин, 20 хвилин до 48 годин, 30 хвилин до 24 годин, 40 хвилин до 12 годин, 50 хвилин до 6 годин, або 1-3 години. Іноді реакція завершується, рН регулюється до 7.5-9 (якщо присутній Nгідроксисукцинімід, то до вищого його кінця), щоб вернутися до діапазону рН, в якому карбодіімід стабільний. Іноді кон'югований, сахарид-протеїн кон'югат може бути очищений від: непрореагувавших компонентів, вільного сахариду, і т.д. вприскуванням його в a size exclusion chromatographycolumn (наприклад, Сефакрил S400HR, Pharmacia). Як правило, це виконується при 2-8 °С. Кон'югат стерильно фільтрувати, потім зберігають. Наприкінці, ефективна доза (наприклад, 1-20, 2-15, чи 3-10 мкг сахарид /доза) кон'югату сахарид-проїн може розроблюватись з фармацевтично прийнятним наповнювачем (наприклад, сіллю або допоміжною речовиною) для виготовлення імуногенної композиції або вакцини. В термінах сахариди даного винаходу, будьякий сахарид вірусного, трубкового, бактеріально 97233 12 го чи еукаріотного походження може бути кон'югований, використовуючи способи винаходу. Це може бути Vi сахарид з Salmonella typhi, чи інший сахарид ніж Vi. Це може бути капсулярний сахарид Hib з Н. influenzae тип b, або може бути сахарид інший ніж Hib. В одному з втілень сахарид є бактеріальним капсулярним сахаридом, наприклад, виділений з бактерії, відібраної зі списку, що складається з: N. meningitidis serogroup А (МеnА), В (МеnВ), С (MenC), W135 (MenW) або Υ (MenY), Streptococcus рпеитопіае серотипи 1, 2, 3, 4, 5, 6А, 6В, 7F, 8, 9N, 9V, 10А, 11 A, 12F, 14, 15В, 17F, 18С, 19А, 19F, 20, 22F, 23F чи 33F, Група В Стрептококова група la, Ib, II, III, IV, V, VI, або VII, Staphylococcus aureus тип 5, Staphylococcus aureus тип 8, Salmonella typhi (Vi сахарид), Vibrio cholerae, або Η. influenzae тип b. Середньозважена молекулярна маса сахариду може складати 1000-2000000, 5000-1000000, 10000-500000, 50000-400000, 75000-300000, або 100000-200000. Молекулярна маса або середня молекулярна маса сахариду тут приписується до середньозваженої молекулярної маси (Mw) сахариду, виміряної перед кон'югацією і, яка вимірюється методом MALLS. Методика MALLS добре відома фахівцям та, як правило, виконується як описано в прикладі 2. Для MALLS аналізу сахаридів, можуть використовувати в комбінації дві колонки (TSKG6000 та 5000PWxl) та елюють сахариди водою. Сахариди детектують, використовуючи детектор розсію чого світла (наприклад, Wyatt Dawn DSP устаткований 10мВт аргоновим лазером з довжиною хвилі 488нм) та inferometric рефрактометр (наприклад, Wyatt Otilab DSP устаткований Р100 коміркою та червоним фільтром з довжиною хвилі 498нм). У втіленні, полідисперсність сахариду складає 1-1.5, 1-1.3, 1-1.2, 1-1.1 або 1-1.05 та після кон'югації до носію протеїну, полідисперсність кон'югату складає 1.0-2.5, 1.0-2.0. 1.0-1.5, 1.0-1.2, 1.5-2.5, 1.7-2.2 або 1.5-2.0. Всі вимірювання полідисперсністі зроблені методом MALLS. Сахарид може бути або нативним полісахаридом або може бути фракціонованим з фактором не більше ніж 2, 4, 6, 8, 10 чи 20 кратно (наприклад, мікрофлюїдизацією [наприклад, на приборі Emulsiflex C-50] чи за іншою відомою методикою [наприклад, методами нагрівання, хімічними, окиснюючими, обробки ультразвуком]). Олігосахариди, в значній мірі, можуть бути фракціоновані долі [наприклад, відомими методами нагрівання, хімічними або окиснюючими]. Структури більшості з цих сахаридів є відомими (та тому або вони природньо містять будь-яку аміно чи карбоксильну групи для карбодіімідної методики, або будь-яку іншу реакційноздатну групу, яку можна модифікувати аміно чи карбоксильними групами (дивись таблицю нижче). 13 97233 14 Природня NH2 група Природня СООН група Інша реакційн. група Hi Hi Так Так ОН ОН Hi Hi Hi Hi Hi (може бути генерованим, якщо де-N-ацетильований) Hi Так Так Так ОН ОН ОН ОН Так ОН / N-пропил Gp. В Streptococcus Іa, Ib II III IV V VI VII Hi Hi Hi Hi Hi Hi Hi Так Так Так Так Так Так Так ОН ОН ОН ОН ОН ОН ОН S typhi Vi Hi Так Ні S. pneumoniae PS1 PS3,4,5,8,9, 12F Так Hi Так Так ОН ОН Vibrio cholorea Capsular Сахарид Так Hi ОН H.influenzae В Hib Hi Hi ОН LOS Nmen/ Meat/ Hi Так на PEA Так на KDO ОН S aureus PS5 PS8 N meningitidis MenA MenC MenW135 MenY MenB Сахарид може бути бактеріальним ліпоолігосахаридом або ліпополісахаридом (дивись таблицю вище), наприклад, виділеним з бактерії, відібраної зі списку, що складається з: N. meningitidis, Η. influenzae, E. coli, Salmonella або М. catarrhalis. LOS може бути менінгококовим імунотипом L2, L3 чи L10. Він може бути детоксифікованим лужною обробкою його Ліпідної А частини. У втілені, МеnА капсулярний сахарид, є що найменш частково О-ацетильованим таким чином, що, як мінімум 50%, 60%, 70%, 80%, 90%, 95% чи 98% фрагментів, що повторюються, є Оацетильованими, щонайменш в одне положення. О-ацетилювання, наприклад, присутнє, як мінімум, в 0-3 положення принаймні 50%, 60%, 70%, 80%, 90%, 95% або 98% фрагментів, що повторюються. У втілені, МеnС капсулярний сахарид, є що найменш частково О-ацетильованим таким чином, що, як мінімум 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95% або 98% з (29)-зв'язаних NeuNAc фрагментів, що повторюються є Оацетильованими щонайменш в одне або два положення. О-ацетилювання, наприклад, присутнє, при 0-7 та/або 0-8 положенні принаймні 30%. 40%, 50%, 60%, 70%, 80%, 90%, 95% або 98% фрагментів, що повторюються. У втіленні, MenW капсулярний сахарид, є що найменш частково Оацетильованим таким чином, що, як мінімум 30%, 40%, 50%. 60%, 70%, 80%, 90%, 95% чи 98% фрагментів, що повторюються, є О-ацетильованими, щонайменш в одне або два положення. О- ацетилювання наприклад, присутнє, при 0-7 та/або 0-9 положення як мінімум у 30%. 40%, 50%, 60%, 70%, 80%, 90%, 95% або 98% фрагментів, що повторюються. У втіленні, MenY капсулярний сахарид, є що найменш частково О-ацетильованим таким чином, що, як мінімум 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95% чи 98% фрагментів, що повторюються є О-ацетильованими, щонайменш в одне або два положення. О- ацетилювання присутнє в 7 та/або 9 положення, як мінімум у 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95% або 98% фрагментів, що повторюються. Відсоток Oацетилювання відносять до відсотку фрагментів, що повторюються, які містять О-ацетилювання. Це може бути виміряно в сахариді до кон'югату та/або після кон'югації. 15 Протеїн-носій може бути будь-яким пептидом або протеїном. Він може містити один або більше Т-допоміжних епітопи. В одному з втілень винаходу протеїн-носій відбирають з групи, яка складається з: ТТ, DT, CRM197, фрагменту С з ТТ, протеїну D з Н. influenzae, пневмококового PhtD, та пневмококового Pneumolysis. Носій протеїну може бути провцевим анатоксином (ТТ), фрагментом С правцевого анатоксину, нетоксичними мутантами правцевого анатоксину [як вважається, всі такі варіанти ΤΤ є одинаковим типом носію протеїну за суттю цього винаходу], дифтерійний анатоксин (DT), CRM197, інші нетоксичні мутанти дифтерійного анатоксину [такі як CRM176, CRM 197, CRM228, CRM 45 (Uchida et al J. Biol. Chem. 218; 3838-3844. 1973); CRM 9, CRM 45, CRM102, CRM 103 та CRM107 та інші мутанти, описані Nicholls та Youle в Genetically Engineered Toxins, Ed: Frankel, Maecel Dekker Inc. 1992; делеція чи мутація Glu148 до Asp, Gin до Ser та/або Ala 158 до Gly та інші мутації розкриті в US 4709017 або US 4950740; мутації, як мінімум, одного чи більше залишків Lys 516, Lys 526, Phe 530 та/або Lys 534 та інші мутації розкриті в US 5917017 чи US 6455673; або фрагмент розкритий в US 5843711] (як вважається, всі такі варіанти DT є однаковим типом джерела протеїну за суттю цього винаходу), пневмококовий пневмолізин (Kuo et al (1995) Infect Immun 63; 2706-13), ОМРС (менінгококовий поверхнево мембраний протеїн - зазвичай виділений з N. meningitidis serogroup В - ЕР0372501), синтетичні пептиди (ЕР0378881, ЕР0427347), протеїни теплового удару (WO 93/17712, WO 94/03208), коклюшеві протеїни (WO 98/58668, EP0471177), цитокіни, лімфокіни, фактори ростучи гормони (WO 91/01146), неприродні протеїни, що включають багатократні CD4+ Τ клітинні епітопи людини з різних патогенних похідних антигенів (Falugi et al (2001) Eur J Immunol 31; 3816-3824) таких як N19 протеїн (Baraldoi et al (2004) Infect Immun 72; 48847) пневмококовий поверхневий протеїн PspA (WO 02/091998), протеїни, що вводять залізо (WO 01/72337), токсини А або В з С difficile (WO 00/61761), Η. influenzae Протеїн D (EP594610 та WO 00/56360), пневмококовий PhtA (WO 98/18930, також переданий на розгляд до Sp36),пневмококовий PhtD (розкритий в WO 00/37105, та також переданий на розгляд до Sp036D), пневмококовий PhtB (розкритий в WO 00/37105, та також переданий на розгляд до SpO36B), або PhtE (розкритий в WO00/30299 та переданий на розгляд до як BVH-3). В подальших підходах винаходу обумовлюється кон'югат сахарид-протеїн носій (або імуногенна композиція чи вакцина), що може бути отримана, або отримана за способами винаходу. Використання імуногенної композиції чи вакцини винаходу у виробництві медикаменту для попередження чи лікування хвороби, та методу запобігання чи лікування хвороби, включаючий стадії регулювання ефективної дози імуногенної композиції чи вакцини винаходу на пацієнта, в необхідності цього далі передбачається. Використання чи метод може бути таким, що захворювання є випадком відібраної бактерії зі списку, що 97233 16 складається з: N. meningitidis, Streptococcus pneumoniae, M. catarrhalis. Група В Streptococcus, Staphylococcus aureus. Salmonella typhi, Vibrio cholerae, E. coli, та Н. influenzae. Імуногенні композиції винаходу можуть також містити DTPa або DTPw вакцину (наприклад, одну включаючи DT, ТТ, та або вакцина цілих клітин коклюшу (Pw) vaccine або вакцина без клітинного коклюшу (Ра) (включаючи, наприклад, анатоксин коклюшу, FHA, пертактин, та, по вибору агглютиногени 2 та 3). Такі комбінації можуть також включати вакцини проти гепатиту В (наприклад, вони можуть містити поверхневий антиген гепатиту В) [НерВ], необов'язково сорбований на фосфаті алюмінію). В одному з втілень імуногенна композиція винаходу включає Hib, МеnА та МеnС кон'югати сахариду, чи Hib та МеnС кон'югати сахариду, чи Hib, МеnС та MenY кон'югати сахариду, чи МеnА, МеnС, MenW та MenY кон'югати сахариду, в яких, щонайменш один, два або всі кон'югати сахариду, отримані відповідно до способу за винаходом. Імуногенні композиції винаходу необов'язково включають додаткові вірусні антигени, що надають захист від або проти хвороби, спричиненої кором та/або свинкою та/або краснухою та/або вітряною оспою. Наприклад, імуногенна композиція винаходу містить антигени кору, свинки та краснухи (MMR) або кору, свинки, краснухи та вітряної оспи (MMRV). У втіленні, ці вірусні антигени необов'язково присутні в такомуж вмісті, як присутні в композиції менінгококовий та/або Hib кон'югат(и) сахариду. В одному з втілень ці вірусні антигени є ліофілізованими. В одному з втілень імуногенна композиція винаходу подальше включає антиген з N. meningitidis серогрупи В. Антиген є необов'язково з зовнішньої мембрани везикули приготовлений з N. meningitidis серогрупи В, як описано в ЕР301992, WO 01/09350, WO 04/14417, WO 04/14418 та WO 04/14419.в основному, імуногенна композиція винаходу може включати дозу кожного кон'югату сахариду між 0.1 та 20 мкг, 2 та 10 мкг, 2 та 6 мкг або 4 та 7 мкг сахариду. "Біля" або " близько" визначається з 10% більше а бо менше даної фігури за метою винаходу. В одному з втілень, імуногенна композиція винаходу підтримується або буфером при, або підтримується в межах рН 7.0 та 8.0, рН 7.2 та 7.6 або близько або точно рН 7.4. Імуногенна композиція або вакцини винаходу є необов'язково ліофілфзованою в присутності стабілізуючого агенту, наприклад, поліолу такого як сахароза або трегалоза. Необов'язково, імуногенна композиція або вакцина за винаходом містить кількість ад'юванту достатню, щоб посилити імунний відгук на імуноген. Підходящий ад'ювант включає, але не обмежений, солі алюмінію (алюміній фосфат або алюміній гідроксид), скваленова суміш (SAF-1), мурамипептид, похідні сапоніну, препарати клітинних стінок мікобактерій, монофосфоліпід А, похідні міколової кислоти, неіоногенні блок-сополімерні поверхнево-активні речовини (ПАР), Quil А, В субодиниця токсину холери, поліфосфазен та його 17 похідні, та імуностимулюючи комплекси (ISCOMs), такі як ті, що описані Takahashi et al. (1990) Nature 344:873-875. Для N. meningitidis або HibMen комбінацій, може бути прийнятним не використовувати ніякої солі алюмінію як ад'юванту або жодного ад'юванту. Як зі всіма імуногенними композиціями чи вакцинами, імунологічно ефективні кількості імуногенів повинні визначатися емпірично. Фактори, як зазначалося, включають імуногенність, необов'язково імуноген буде скомплексованим з чи ковалентно прикріпленим до ад'юванту або до протеїнуносія, або до іншого носія, спосіб введення та число імунізуючих доз, що вводяться. Активний агент може бути присутнім в різних концентраціях в фармацевтичній композиції чи вакцині винаходу. Як правило, мінімальна концентрація речовини є необхідною кількістю, щоб досягти його призначеного використання, в той час як, максимальна концентрація - це максимальна кількість, що буде залишатися в розчині або гомогенно суспендуватися з початковою сумішшю. Наприклад, мінімальна кількість фармацевтичного агенту є необов'язково однією, яка забезпечить єдину терапевтично ефективну дозу. Для біоактивних речовин мінімальна концентрація - це необхідна кількість для виявлення біоактивності, а максимальна концентрація є в точці, в якій суспензія не бути втримана гомогенною. У випадку однодозованих одиниць, кількість є такою ж, як для одноразового терапевтичного примінення. Взагалі, очікується, що кожна доза включатиме 1-100мкг протеїнового антигену, необов'язково 5-50мкг або 5-25мкг. Наприклад, дози бактеріальних сахаридів становлять 10-20 мкг, 5-10 мкг, 2.5-5 мкг чи 1-2.5 мкг сахариду в кон'югаті. Вакцинні препарати за даним винаходом можуть бути використані для захисту та лікування ссавців (наприклад, людей) чутливих до інфекцій, методом введення згаданої вакцини системно або через слизову оболонку. Пацієнти- люди- необов'язково немовлята (до 12 місяців), діти, що починають ходити (12-24, 12-16 чи 12-14 місяців), діти (2-10, 3-8 чи 3-5 років) юнаки (12-21, 14-20 чи 1519 років) чи дорослі. Ці введення можуть включати введення внутрішньом'язово, інтраперитонеально, інтрадермально або підшкірно; або шляхом введення через слизову оболонку - оральний/аліментарний, респіраторний, сечостатевий тракти. Інтраназальному введенню вакцини для лікування пневмонії чи отиту надається перевага (як назофаренгальний носій пневмококів може бути більш ефективно попереджена, відповідно ослаблена інфекція на самій ранній стадії). Хоча вакцина за винаходом може вводитись як одноразова доза, компоненти з цього можуть також вводитись разом в один і той же час або в різні часи (наприклад, якщо сахариди присутні в вакцині, вони можуть вводитись окремо в один і той же час або 1-2 тижні після введення вакцини бактеріального протеїну для оптимальної координації імуного відгуку з відповідністю один до одного). На додаток до одноразового шляху введення, можуть бути використані 2 різні шляхи введення. Наприклад, 97233 18 вірусні антигени можуть вводитись ID (інтрадермально), доки бактеріальні протеїни можуть вводитись lМ (внутрішньом'язово) чи IN (інтраназально). Якщо сахариди присутні, вони можуть вводитись lМ (або ID) та бактеріальні протеїни можуть вводитись IN (або ID). На додаток, вакцини за винаходом можуть вводитись lМ для примуючих доз та IN для ревакцинуючих доз. Приготування вакцини, в основному, описано в Vaccine Design ("The sub-unit and adjuvant approach" (eds Powell M.F. & Newman M.J.) (1995) Plenum Press New York). Інкапсуляціяз ліпосомами описана Fullerton, US Patent 4,235,877. Подальший аспект винаходу - це процес виготовлення імуногенної композиції чи вакцини за винаходом, що включає стадію змішування МеnА та МеnС сахаридів за винаходом, виготовлених способом за винаходом, з МеnW та MenY, що не вироблялись відповідно до винаходу, та з фармацевтично прийнятним ексципіентом. Під термінами "що містить", "містити" та "містить" заявник має на увазі необов'язкове заміщення на терміни "що складається з", "складатися з" та "складається з", відповідно, в кожному прикладі. Всі ссилки або патентні заявки, цитовані в цьому описі винаходу об'єднані ссилкою тут. Винахід ілюструється прикладами, що додаються. Приклади, наведені нижче, виконували, використовуючи стандартні методики, які добре відомі та знайомі фахівцям, виключення описані в деталях. Приклади ілюструють але не обмежують винахід. Приклади Приклад 1 - приготування полісахаридних кон'югатів Приклад 1а - приготування менінгококового МеnА та МеnС капсулярного полісахаридного кон'югату відповідно до винаходу МеnС -ТТ кон'югати були вироблені, використовуючи нативні полісахариди (понад 150kDa як виміряно за MALLS) або злегка мікрофлюїдизовані. МеnА-ТТ кон'югати були вироблені, використовуючи або нативний полісахарид або злегка мікрофлюїдизований полісахарид понад 60kDa як виміряно за методом MALLS прикладу 2. Фракціонування було здійснене мікрофлюїдизацією, з використанням гомогенізатору Emulsiflex C-50. Потім полісахариди фільтрували через фільтр 0.2мкм. Для того, щоб кон'югувати МеnА капсулярного полісахариду до правцевого анатоксину через спайсер, використовували наступний метод. Ковалентне зв'язування полісахариду та спайсера (ADH) виконували хімічним сполученням, за яким полісахариди активують при контрольованих умовах циануюючим агентом, 1-циано-4диметиламіно-піридину тетрафтороборатом (CDAP). Спайсер реагує з цианованим PS через його гідразогрупи, утворюючи стабільний ізосечовинний зв'язок між спайсером та полісахаридом. 10мг/мл розчин МеnА (рН 6.0) [3.5 г] був оброблений свіжо приготовленим 100мг/мл розчином CDAP в суміші ацетонітрил/вода (50/50 (о/о)) для отримання співвідношення CDAP/MenA 0.75 (м/м). Після 1.5 хвилин, рН підняли до 10.0. Три хвилини потому, додали ADH, щоб отримати співвідношен 19 ня ADH/MenA 8.9. рН розчину понизили до 8.75 та реакція продовжувалась 2 години підтримуючи цей рН (з утриманням температури 25 °С). PSAAH розчин концентрували до чверті початкового об'єму та потім діафільтрували з 30 об'ємами 0.2М розчину NaCI, використовуючи мембрану Filtron Omega з порами 10kDa, та фільтрували ретентат. Перед реакцією кон'югації (карбоімідна конденсація), очищений ТТ розчин та PSAAH розчин розвели до досягнення концентрації 10 мг/мл для PSAAH тa 10 мг/мл для ТТ. EDAC (і-етил-3-(3диметил-амінопропил)карбодіімід) додали до розчину PSAH (2г сахариду) з метою досягти кінцевого співвідношення 0.9 мг EDAC/мг PSAAH. рН довели до 5.0. Очищений правцевий анатоксин додали за допомогою перистатичного насосу (через 60 хвилин) для досягнення 2 мг TT/mg PSAAH. Розчин, що одержали в результаті, залишили на 60 хв при +25°С зі струшуванням, щоб кінцевий сумарний час склав 120 хв. Розчин нейтралізували додаванням 1М розчину Tris-Hcl рН 7.5 (1/10 кінцевого об'єму) та залишили на 30 хвилин при +25°С, а потім на ніч при температурі від +2°С до +8°С. Кон'югат робили прозорим, використовуючи фільтр з порами 10мкм, та очищували на колонці Сефакрил S400HR (Pharmacia, Sweden). Колонку збалансували в 10 мМ Tris-HCI (рН 7.0), 0.075 Μ NaCI розчинах та кон'югат (близько 660мл) загрузили в колонку (+2°С до +8°С). Пулелюювання вибирали за значенням оптичної густини при 280 нм. Збирання почали, коли поглинання зросло до 0.05. Збір продовжували до досягнення Kd 0.30. Кон'югат фільтрували стерилізованим при +20°С, потім зберігали від +2°С до +8°С. Кон'югат, що отримали в результаті, мав співвідношення полісахарид:протеїн 1:2-1:4 (м/м). Для того, щоб кон'югувати МеnС капсулярного полісахариду до правцевого анатоксину через спайсер, використали наступний метод. Ковалентне зв'язування полісахариду та спайсера (ADH) виконують хімічним сполученням, за яким полісахарид активують при контрольованих умовах цианулюючим агентом, 1-циано-4-диметиламінопіридину тетрафтороборатом (CDAP). Спайсер реагує з цианованим PS через його гідразогрупи, утворюючи стабільний ізосечовинний зв'язок між спайсером та полісахаридом. 20мг/мл розчин МеnС (рН6.0) (3.5 г) обробили свіжо приготовленим 100мг/мл розчином CDAP в суміші ацетонітрил/вода (50/50 (о/о)) для отримання співвідношення CDAP/MenC 1.5 (м/м). Після 1.5 хвилин, рН підвищили до 10.0. При активації рН додали 5М розчин NaCI, щоб досягти кінцеву концентрацію розчину NaCI 2M. Три хвилини потому, додали ADH для отримання співвідношення ADH/MenC 8.9. рН розчину понизили до 8.75 та реакція продовжувалась ще 2 години (утримана при 25 °С). Розчин PSCAH був концентрований щонайменше до 150 мл, а потім діалізований з 30 об'ємами 0.2М розчину NaCI, використовуючи мембрану Filtron Omega з порами 10kDa, ретентат фільтрували. 97233 20 Перед реакцією сполучення, очищений розчин ТТ та PSCAH розчин (2г шкала) розводили в 0.2М розчині NaCI до досягнення концентрації 15 мг/мл для PSCAH та 20 мг/мл для ТТ. Очищений правцевий анатоксин додали до розчину PSCAH з метою досягти 2 мг ТТ/мг PSCAH. рН доводять до 5.0. EDAC (16.7 мг/мл в Tris 0.1 Μ pΗ 7.5) додали за допомогою перистальтичного насосу (через 10 хвилин), щоб досягти кінцеве співвідношення 0.5 мг EDAC/мг PSCAH. Розчин, що отримали в результаті, залишали на 110 хв при +25°С зі струшуванням та рН регулюванням для одержання кінцевого сумарного часу 120 хв. Потім розчин нейтралізували, додаючи 1М розчин TrisHcl рН 9.0 (1/10 кінцевого об'єму) та залишили на 30 хвилин при +25°С, а потім на всю ніч від +2°С до +8°С. Кон'югат робили прозорим, використовуючи фільтр з порами 10мкм, та очищували на колонці Сефакрил S400HR (Pharmacia, Sweden). Колонку збалансували в 10 мМ розчині Tris-HCI (рН 7.0), 0.075 Μ NaCI та кон'югат (близько 460мл) загрузили в колонку (від +2°С до +8°С). Пул елюювання вибирали за значенням оптичної густини при 280 нм. Збирання почали, коли поглинання зросло до 0.05. Збір продовжували до досягнення Kd 0.20. Кон'югат фільтрували стерилізованим при +20°С, потім зберігали від +2°С до +8°С. Кон'югат, що отримали в результаті мав співвідношення полісахарид:протеїн 1 :2-1:4 (м/м). Виконані різноманітні експерименти додавання EDAC понад 10-45 хвилин - в кожному випадку була отримана гарна якість МеnС кон'югатів. Якщо, однак ТТ носій повільно додавали останнім до суміші МеnС-ADH + EDAC, це призводило до гель - кон'югату, що не могло бути очищеним. Експерименти також виконували, додаючи EDAC всі одразу в реакцію але кінцеве співвідношення TT/PS (2.7/1) (м/м) кон'югату було нижче ніж для кон'югату, отриманому через реакцію де EDAC додавали понад 10 хвилин (3.3/1); до того ж обидві TT та PS були нижче ніж, ті що виміряні відносно кон'югату отриманого реакцією де EDAC додавали понад 10 хвилин. Зазначте приблизну % Модифікації полісахаридів МеnСАН: після CDAP обробки з ADH близько 3.47% гідроксильних груп були модифікованими з ADH (з розрахунку дві доступні гідроксильні групи на субодиницю, що повторюється). Для МеnА: близько 11.5% гідроксильних груп модифікованих з ADH (приймаючи до уваги наявність тільки однієї доступної гідроксильної групи на одиницю, що повторюється). Приклад 1b - приготування пневмококового капсулярного PS 3 полісахаридного кон'югату 1) PS03-TTAH процес : PS03-TTAH208 Фракціонування на Emulsiflex PS зважували, ґрунтуючись на 10% теоретичному вмісті вологи. Нативний PS розчиняли протягом ночі в 2М розчині NaCI до початкової концентрації 3 мг/мл. Перед фракціонуванням розчин нативного PS очищували на фільтрі з порами 5 мкм. Гомогенізатор EMULSIFLEX C-50 використовували для зменшення молекулярної маси та в'яз 21 кості полісахариду перед стадією активації. Ефективність фракціонування залежить від циркулюючого тиску, тиску питательного плунжера та загальної кількості циклів. З метою покращити ефективність фракціонування (а отже скоротити загальну кількість циклів), клітини, що гомогенізують, Emulsiflex були замінені клітинами фіксованої геометрії (Microfluidics F20Y-0.75 мкм камера для взаємодії). Мета фракціонування полягає у скороченні молекулярної маси та в'язкості PS без критичного зниження його антигенності. Розмір скорочення робили при 6000 ± 500 psi (фунтів на квадратний дюйм) та наступним вимірюванням в'язкості в процесі. Фракціонування зупиняли, коли досягалась 2.0 ± 0.2 ер. Фільтрація фракціонованих PS на 0.22 мкм Фракціоновані PS фільтрували на мембрані Millipack 40 (пора 0.22 мм) зі швидкістю потоку 10 мл/хв. ТТ модифікування Стадію модифікування проводили при 25°С з постійним струшуванням у водяній бані з контролем Т° температури. ТТ розводили в 0.2М розчині NaCI, щоб отримати кінцеву концентрацію ТТ 25 мг/мл. ADH додавали в твердій формі до розчину ТТ, щоб досягти кінцевої концентрації 0.2М. Після повного розчинення ADH, рН розчину встановлювали на 6.2+/- 0.1, використовуючи розчин НСІ. Потім EDAC додали до розчину TT/ADH, щоб досягти кінцеву концентрацію 0.02М. рН встановлювали на 6.2+/-0.1 використовуючи розчин НСІ та утримували регулюючи рН протягом 1 години. Після стадії модифікування, рН підвищили до рН9.5 використовуючи розчин NaOH для зупинення реакції. Розчин залишали на 2 години при регулюванні рН перед стадією діафільтрації. Діафільтрація ТТAH похідну діафільтрували з метою видалення непрореагувавших ADH та EDAC сопродуктів. Діафільтрацію виконували на мембрані 2 CENTRAMATE (0.09 м , з порами 10 kDa). Розчин діалізували на фоні 20 об'ємів 0.2М розчину NаСІ. Наступну за стадією діафільтрації виконували кількісним аналізом ADH (TNBS аналіз) в проникненні після 5,10,15 та 20 об'ємів діафільтрації. Фільтрація на 0.22 мкм В заключення ТТАН фільтрували на мембрані (Millipack 40) з порами 0.22 зі швидкістю потоку 10 мл/хв. Потім фільтрований ТТАН зберігали при 70°С. PS3-TTAH кон'югат Умови процесу були наступними: Початкова концентрація PS3 2 мг/мл в 2 Μ розчині NaCI, початкове TTAH/PS3 співвідношення 1.5/1 (м/м), EDAC концентрація 0.5 мг/мг PS, та ТТ концентрація 10 мг/мл в 0.15М розчині NaCI. 50мг PS3 розводили в 2М розчині NaCI, щоб отримати кінцеву концентрацію PS 2мг/мл. Очищений TTAH розчин розбавили в 0.2М розчині NaCI, щоб досягти концентрацію 10 мг/мл. рН розчину PS3 доводили до 5, використовуючи розчин НСІ. EDAC додали в твердому стані до розчину PS3 з метою досягти кінцеву концентрацію 0.5 мг EDAC/ мг PS. рН довели до 5.0 ± 0,05 за допомо 97233 22 гою розчину НСІ та ТТАН додали вручну через 11 хвилин (аліквота/хв). Розчин, що отримали в результаті, інкубували 109 хв при + 25°С зі струшуванням та регулюванням рН, щоб отримати кінцевий сумарний час 120 хв. Потім розчин нейтралізували додаванням 1М розчину Tris-HCI рН 7.5 та залишили на 30 хв при +25°С. Кон'югат заключно очищували (робили прозорим) на мембрані з порами 5мкм та вприскували в колонку Сефакрил S400HR. 2) PS03-TTah процес : PS03AH-TT215 Фракціонування на Emulsiflex Як зазначено вище. Фільтрація фракціонованих PS на 0.22 мкм Як зазначено вище. PS3 модифікування Стадію модифікування проводили при 25°С з постійним струшуванням у водяній бані з контролем Т° температури. PS3 розводили в NaCI розчині 2М щоб отримати кінцеву концентрацію PS 3 мг/мл. рН розчину PS встановлювали на 6.0 перед додаванням CDAP (0.25 мг/мг PS, розчинення до 100 мг/мл в суміші ацетонітрил/WFI). рН підвищили до 9.5, використовуючи NaOH перед додаванням ADH (8.9 мг ADH/мг PS, розчинення до 100 мг/мл в 0.2М розчині NaCI). рН утримували на 9.5 та регулювали протягом 60 хвилин. Відсоток модифікування відповідав 2.4% (2.4 мг ADH/100 мг PS). Це може бути виміряно по відомій методиці: TNBS для оцінки ADH; та DMAB чи резорцин (Monsigny et al (1988) Anal. Biochem. 175, 525-530) для кількісного аналізу PS. У цьому випадку, TNBS дозування було 228 мкг/мл та PS дозування: 5250 мкг/мл. Поданий Mw ADH становить 174.2, та Mw фрагменту, що повторюється, PS3 становить 338.27 (маючи 1 СООН та 4 ОН групи), це становить 1.3 мкмоль ADH /15.52 мкмоль фрагменту, що повторюється, або 1,3 мкмоль ADH / 62.08 мкмоль реакційно здатної гідроксильної групи. 2.09% PS3 гідроксильних груп були ADH модифікованими гідроксильними групами. Діафільтрація PS3AH похідні діафільтрували з метою видалення непрореагувавших ADH та CDAP сопродуктів. Діафільтрацію проводили на мембрані UFP-302 C-H24LA (42 см , з порами 30 kDa). Розчин діалізували на фоні 20 об'ємів 0.2М розчину NaCI. Наступна за стадією діафільтрацією була виконана кількісним аналізом ADH (TNBS аналіз) в проникненні після 5,10,15 та 20 об'ємів діафільтрації. Фільтрація на 0.22 мкм PSAH заключно фільтрували на мембрані (МiІІірасk 40) з порами 0.22 мкм зі швидкістю потоку 10 мл/хв. Потім відфільтрований PS3AH зберігали при 4°С. PS3AH-TT кон'югат Умови процесу були наступними: Початкова концентрація PS3 2 мг/мл в 2 Μ розчині NaCI, початкове TT/PS3AH співвідношення 1.5/1 (м/м), EDAC концентрація 0.5 мг/мг PS, та ТТ концентрація 10 мг/мл в 0.15М розчині NaCI. 50мг of PS3AH розводили в 0.2М розчині NaCI, щоб отримати кінцеву концентрацію PS 2 мг/мл. Очищений ТТ розчин розбавили в 0.2М розчині 23 NaCI, щоб досягти концентрацію 10 мг/мл. PS3AH розчин доводили до рН 5, використовуючи розчин НСІ. EDAC додали і твердому стані до PS3AH розчину з метою досягти кінцеву концентрацію 0.5 мг EDAC/ мг PS. рН довели до 5.0 ± 0.05 за допомогою розчину НСІ та через 10 хвилин додали ТТ, використовуючи перистальтичний насос Розчин, що отримали в результаті, інкубували 110 хв при + 25°С зі струшуванням та регулюванням рН, щоб отримати кінцевий сумарний час 120 хв. Потім розчин нейтралізували додаванням 1М розчину Tris-HCI рН 7.5 та залишили на 30 хв при +25°С. Кон'югат заключно очищували (робили прозорим) на мембрані з порами 5мкм та вприскували в колонку Сефакрил S400HR. 3) PS03AH-TT process : PS3AH-TT217 Фракціонування на Emulsiflex Як зазначено вище. Фільтрація фракціонованих PS на 0.22 мкм Як зазначено вище. PS3 модифікування Як для 215 кон'югату. Діафільтрація Як для 215 кон'югату. Фільтрація на 0.22 мкм Як для 215 кон'югату. PS3AH-TT кон'югат Умови процесу були наступними: Початкова концентрація PS3 2 мг/мл в 2 Μ розчині NaCI, початкове TT/PS3AH співвідношення 1.5/1 (м/м), EDAC концентрація 0.5 мг/мг PS, та ТТ концентрація 10 мг/мл в 0.15М розчині NaCI. 50мг of PS3AH розводили в 0.2М розчині NaCI, щоб отримати кінцеву концентрацію PS 2 мг/мл. Очищений ТТ розчин розбавили в 0.2М розчині NaCI, щоб досягти концентрацію 10 мг/мл. PS3AH та ТТ розчини змішали та довели рН до 5 використовуючи розчин НСІ. EDAC розчинили в Tris 1M буфері рН 7.5. 40мкл EDAC додавали кожної хвилини (10 хвилин, щоб досягти співвідношення EDAC/PS (0.5мг EDAC/мг PS)). Розчин, що отримали в результаті, інкубували 110 хв при + 25°С зі струшуванням та регулюванням рН, щоб отримати кінцевий сумарний час 120 хв. Потім розчин нейтралізували додаванням 1М розчину Tris-HCI рН 7.5 та залишили на 30 хв при +25°С. Кон'югат заключно очищували (робили прозорим) на мембрані з порами 5мкм та вприскували в колонку Сефакрил S400HR. 4) PS03AH-TT процес : PS3AH-TT218 Фракціонування на Emulsiflex Як зазначено вище. Фільтрація фракціонованих PS на 0.22 мкм Як зазначено вище. PS3 модифікування Стадію модифікування проводили при 25°С з постійним струшуванням у водяній бані з контролем температури. PS3 розводили в NaCI розчині 2М щоб отримати кінцеву концентрацію PS 3 мг/мл. EDAC додавали в твердому стані, щоб досягти співвідношення EDAC/ PS 0.1мг/мг PS. Після повного розчинення, рН розчину встановлювали на 5. Потім через 44 хвилини додали ADH (8.9мг ADH/мг PS, розчинення до 100мг/мл в 0.2М розчині NaCI), використовуючи перистальтичний насос (не зважаючи на присутність по суті надмірністі 97233 24 ADH, пряме додавання також було б добрим ОК). рН утримували 5.0+/-0.1 та регулювали протягом 120 хвилин (44' + 76'). Реакцію зупиняли підвищуючи рН до 7.5 використовуючи гідроксид натрію. Відсоток модифікування відповідав 3.7% (мг ADH/ мг PS). TNBS дозування було 220 мкг/мл та PS дозування - 5902 мкг/мл, таким чином 1.26 мкмоля ADH / 17.44 мкмоля фрагменту, що повторюється (=мкмоль реакційноздатної СООН групи). Таким чином, 7.22% PS3 карбоксильних груп були ADH модифікованими СООН групами. Діафільтрація PS3AH похідні діафільтрували з метою видалення непрореагувавших ADH та EDAC сопродуктів. Діафільтрацію проводили на мембрані UFP-302 C-H24LA (42 см , з порами 30 kDa). Розчин діалізували на фоні 23 об'ємів 0.2М розчину NaCI. Наступна за стадією діафільтрацією була виконана кількісним аналізом ADH (TNBS аналіз) в проникненні після 5,10,15 та 20 об'ємів діафільтрації. Фільтрація на 0.22 мкм PSAH заключно фільтрували на мембрані з порами 0.22 мкм (МiІІірасk 40) зі швидкістю потоку 10 мл/хв. Потім відфільтрований PS3AH зберігали при 4°С. PS3AH-TT кон'югат Умови процесу були наступними: Початкова концентрація PS3AH 2 мг/мл в 2 Μ розчині NaCI, початкове TT/PS3AH співвідношення 1.5/1 (м/м), EDAC концентрація 0.5 мг/мг PS, та ТТ концентрація 10 мг/мл в 0.15М розчині NaCI. 50мг PS3AH розбавили 0.2М розчином NaCI, щоб отримати кінцеву концентрацію PS 2 мг/мл. Очищений ТТ розчин розбавили в 0.2М розчині NaCI, щоб досягти концентрацію 10 мг/мл. PS3AH та ТТ розчини змішали разом. рН довели до 5.0 ± 0.05 за допомогою розчину НСІ та EDAC добавили вручну через 10 хвилин (рівні частини-аліквоти додавали кожну хвилину). Розчин, що отримали в результаті, інкубували 110 хв при + 25°С зі струшуванням та регулюванням рН, щоб отримати кінцевий сумарний час 120 хв. Потім розчин нейтралізували додаванням 1М розчину Tris-HCI рН 7.5 та залишили на 30 хв при +25°С. Кон'югат заключно очищували (робили прозорим) на мембрані з порами 5мкм та вприскували в колонку Сефакрил S400HR. Висновки: Різні кон'югати були отримані з використанням карбодіімідних методів на стадії кон'югації. Останній доданий до реакційного розчину компонент може бути або ТТ протеїном або EDAC реагентом. Час додавання може впливати на результуючі кон'югати. PS3AHTT215 & 217 кон'югати: Одинакові компоненти та умови використовували для приготування обох кон'югатів. Спосіб, в якому додавали останній компонент, був інший. PS3AHTT217 кон'югат призвів до продукту, який відповідав критеріям in-vitro. Він був зроблений додаванням EDAC через 10 хвилин. PS3AHTT215 кон'югат, однак, не міг бути відфільтрований на стерильній мембрані. Для нього, останній доданий до реакційного середовища компонент був ТТ (через 10 хвилин). 25 97233 Кінцеві TT/PS співвідношення були дуже різними для обох кон'югатів. (0.98/1 проти 0.50/1). Якщо EDAC додають першим до PSAH (маючи обидві реакційно здатні аміно та карбоксильну групи), то це може призвести до внутрішнього перехресного зшивання гідразину та карбоксильної груп, присутніх на полісахариді, а таким чином, могло б призвести до більшого перехресно зшитого кон'югату зі слабшим кінцевим співвідношенням після додавання ТТ через 10 хвилин. Цей ефект не спостерігається для PS3AHTT217 кон'югату. ТТ об'єднання відбувалося краще при додаванні EDAC через 10 хвилин, можливо завдяки меншому внутрішньому перехресному зшиванню, та кращому зовнішньому перехресному зшиванню між гідразогрупами PS3AH та карбоксильними групами протеїну. У випадку 218 кон'югату, as the PS3 EDAC модифікація тільки частково модифікованого полісаКон'югат. 208 215 217 218 Модифікування/Метод TT/ADH EDAC PS3/ADH CDAP PS3/ADH CDAP PS3/ ADH EDAC Додавання кінц. компоненту TTAH доданий через 11 ТТ доданий через 10 EDAC доданий через 10 хвилин EDAC доданий через 10 хвилин [EDAC] (мг/мл Сумар.час (хв.) 1.5/1 0.5/1 120 1.5/1 0.5/1 120 2.0 10 1.5/1 2.0 10 1.5/1 [PS] (мг/мл) 208 С6Е02 2.0 218 Кон'югація/ Метод PS-TTAH EDAC PSAH -TT EDAC PSAH -TT EDAC PSAH -TT EDAC In.TT/PS співвід PS 217 хариду (зберегти більшість полісахаридних епітопів незушкодженими), проти присутніх як реакційно здатних аміно так і карбоксильних груп, звідси повільне додавання EDAC на кінцевій стадії сполучення є також сприятливим. Повільне додавання ТТ на кінцевій стадії сполучення було корисним (однак) для 208 кон'югату, де ТТ був модифікованим ADH (та включає аміно і карбоксильну групи), оскільки PS3 залишали з його нативними реакційноздатними -ОН та -СООН групами як частиною його субфрагменту, що повторюється. Додавання EDAC до PS3 не мало вищезгаданого ефекту перехресного зшивання, а повільне додавання модифікованого ТТ призвело до конюгату з гарними in-vitro характеристиками дивись нижче. Характеристики in-vitro: [ТТ] (мг/мл) 10 (ТТАН).,НАСОС 10 насос Кон'югат. 215 26 3АН001 (CDAP) 3АН001 (CDAP) 3Ан002 (EDAC) 2.0 0.5/1 (Фракії) 0.5/1 (Фракції) Кон'югат. F.TT/PS співвідн. (м/м) Вихід PS (%) Фільтр, вихід (%) Вільний PS PS/PS (%) Антигенність 208 1.84/1 69 95 10.2 99 215 0.50/1 17 27 217 0.98/1 66 100 0.7 17 218 0.88/1 74 101 11.0 34 120 120 TT/PS (%) Антигенність 103 100 103 100* 222 216* "відносно до 208 кон'югату Приклад 1с - приготування S. typhi Vi полісахаридного кон'югату за винаходом Фракціонування на Emulsiflex PS зважували, ґрунтуючись на 15% теоретичному вмісті вологи. Нативний PS розчиняли протягом ночі в WFI до початкової концентрації 7 мг/мл. До фракціонування, розчин нативного PS очищували на фільтрі з порами 10 мкм зі швидкістю потоку 50 мл/хв. Гомогенізатор EMULSIFLEX C-50 використовували, щоб скоротити молекулярну масу та в'язкість полісахариду перед стадією активації. Ефективність фракціонування залежить від циркулюючого тиску, тиску питательного плунжерата загальної кількості циклів. З метою покращи ти ефективність фракціонування (а отже скоротити загальну кількість циклів), клітини, що гомогенізують, Emulsiflex були замінені клітинами фіксованої геометрії (Microfluidics F20Y-0.75 мкм камера для взаємодії). Мета фракціонування полягає у скороченні молекулярної маси та в'язкості PS без критичного зниження його антигенності. Розмір скорочення здійснювали при 15000 ± 500 psi (фунтів на квадратний дюйм) та наступним вимірюванням в'язкості в процесі. Фракціонування зупиняють, коли досягається 5.0 ± 0.3 ер. Фільтрація фракціонованих PS на 0.22 мкм Фракціоновані PS фільтрують на мембрані Millipack 40 (пори 0.22 мм) зі швидкістю потоку 10 27 мл/хв. Відфільтровані фракціоновані PS зберігають при -20°С. Модифікування полісахариду Vi 1.5 г фракціонованих Vi PS розчинили при 25 C в ЕРІ при взбовтуванні (5 мг/мл). 13.35 г ADH (8.9 мг ADH/мг PS) додають до PS розчину. Після повного розчинення 1N розчином НСІ довели рН до 5.0 ± 0.05. EDAC (0.1 мг/мг PS) додали в твердому стані. Розчин залишили на 60 хвилин при 25°С. Потім розчин нейтралізували, додаючи 1М Tris-HCI рН 7.5, та залишили що найменше на 30 хвилин при 25°С (максимум 2 години). Встановили, що рівень модифікування складає 4.55% використовуючи TNBS дозування (мг ADH/100 мг PS). TNBS дозування було 200 мкг/мл та PS дозування - 4034 мкг/мл; таким чином 0.0697 мкмоль ADH /16.46 мкмоль фрагменту, що повторюється (Mw245). 1.3 мкмоль ADH /16.46 мкмоль реакційноспроможних СООН груп на Vi, таким чином 7% Vi COOH груп були ADH модифікованими СООН групами. Діафільтрація PSViAH похідну діафільтрували з метою видалення непрореагувавших ADH та EDAC сопродуктів. Діафільтрацію проводили на мембрані 2 CENTRAMATE (0.09 м , пора 10 kDa). Розчин діалізували проти 20 об'ємів 0.2М розчину NaCI. Наступною за стадією діафільтрації виконували кількісним аналізом ADH (TNBS проба) в проникненні після 3,5, 10 та 20 об'ємів діафільтрації. Фільтрація на 0.22 мкм PSViAH на кінцевій стадії фільтрували на мембрані з порами 0.22 мкм (Millipack 40) зі швидкістю потоку 10 мл/хв. Відфільтрований PSViAH зберігають при +2/+8°С протягом не більше 4 днів. PSVIAH-TT кон'югати Умови процесу були наступні: Початкова PSViAH концентрація 2 мг/мл в 0.2 Μ розчині NaCI, початкове TT/PSViAH співвідношення - 2.5/1 (м/м), EDAC концентрація 0.25 мг/мл PS та ТТ концентрація 10 мг/мл в 0.2М розчині NaCI. 1г PSVJAH розведений в 0.2М розчині NaCI, щоб отримати кінцеву PS концентрацію 2 мг/мл (дозування уронової кислоти). Очищений ТТ розчин розводили в 0.2М розчині NaCI, щоб досягти концентрацію 10 мг/мл. ТТ додавали до PSVJAH розчину з метою досягти кінцеве співвідношення 2.5 мг ТТ/ мг PS. 1N розчином НСІ рН доводять до 5.0 ± 0.05. Потім EDAC розчин (7.5 мг/мл в 0.1 Μ Tris pH 7.5) додали (через 10 хвилин перестальтичним насосом), для досягнення 0.25 мг EDAC/ мг PSViAH. Розчин, який одержали в результаті, інкубували 50 хв при + 25°С зі струшуванням та рН регуляцією, щоб отримати кінцевий сумарний час 60 хв. Потім розчин нейтралізували додаванням 1М розчину TrisHCI рН 7.5 та залишили на 30 хв при +25°С. Кон'югат перенесли при 4°С та залишають на всю ніч при умові слабкого струшування до стадії хроматографування. Очистка Перед елююванням на Сефакрилі S400HR, кон'югат очищували (робили прозорим) використовуючи 10 мкм фільтр Kleenpak. Швидкість потоку зафіксували на 100 мл/хв. Потім кон'югат вприску 97233 28 вали на Сефакрил S400HR та відбірочний пул оцінювали по Kd величині. Наступний критерій був використаний для відбору пулу: від OD= 0.05 при 280 нм зібраних на старті та фініші, коли Kd= 0.22. Стерилізуюча фільтрація До фільтрації, основну масу перенесли назад до кімнатної температури. Потім кон'югат фільтрували на Opticap 4" стерилізуючій мембрані. Швидкість потоку зафіксували на 30 мл/хв. Аналітичні Результуючий кон'югат мав кінцеве TT/PS співвідношення (м/м) 2.44/1, вміст PS - 3.7% та PSA/PS антигенність - 58%. Приклад 1d - приготування інших полісахаридних кон'югатів Ковалентне зв'язування Haemophilus influen zae (Hib) PRP полісахариду до ΤΤ було проведене хімічною конденсацією розробленою Сhu та іншими (Infection and Immunity 1983, 40 (1); 245-256). Hib PRP полісахарид був активований додаванням CNBr та інкубацією при рН 10.5 протягом 6 хвилин. Потім рН була понижена до рН 8.75 та додали гідразид адипінової кислоти (ADH) й інкубацію продовжували ще протягом 90 хвилин. Активований PRP був приєднаний до очищеного антитоксину правця через карбодіімідну конденсацію використовуючи 1-етил-3-(3-диметиламінопропил)карбодіімід (EDAC). EDAC додавали до активованого PRP, щоб досягти кінцеве співвідношення 0.6 мг EDAC/мг активованого PRP. рН довели до 5.0 та додали очищений антитоксин правця, щоб досягти 2мг ТТ/мг активованого PRP. Результуючий розчин залишили на три дні з м'яким перемішуванням. Після фільтрації через 0.45мкм мембрану, кон'югат очищували на колонці з сефакрилом S500HR (Pharmacia, Sweden) збалансованій в 0.2М NaCI. MenC-TT кон'югати були вироблені, з використанням нативних полісахаридів (більше 150kDa як виміряно MALLS), або незначною мірою мікрофлюїдизовані. МеnА-ТТ кон'югати були вироблені, з використанням або нативних полісахаридів або незначною мірою мікрофлюїдизованих полісахаридів більше 60kDa як виміряно MALLS методом прикладу 2. MenW та MenY-TT кон'югати були вироблені, з використанням фракціонованих полісахаридів близько 100-200kDa як виміряно MALLS (дивись приклад 2). Фракціонування здюйснювалимікрофлюїдизацією з використанням гомогенізатора Emulsiflex С-50. Потім полісахариди фільтрували через 0.2мкм фільтр. Активація та пряме сполучення проводили як описано в WO96/29094 та WO 00/56360. Коротко, полісахарид концентрацією 10-20мг/мл в 2М NaCI рН 5.5-6.0 змішали з CDAP розчином (100мг/мл свіжо виготовлений в ацетонітрилі/WFI, 50/50) до кінцевого CDAP/ полісахарид співвідношенні 0.75/1 чи 1.5/1. Після 1.5 хвилин, рН підвищили розчином гідроксиду натрію до рН10.0. Через три хвилини додали антитоксин правця, щоб досягти співвідношення протеїн/полісахарид 1.5/1 для MenW, 1.2/1 для MenY, 1.5/1 для МеnА або р 1.5/1 для МеnС. Реакція продовжувалась від одного до двох годин. 29 Після стадії сполучення, додали гліцин до кінцевого співвідношення гліцин/PS (м/м) 7.5/1 та рН довели до 9.0. Суміш залишили на 30 хвилин. Кон'югат очищували використовуючи 10 мкм фільтер Kleenpak, а потім загрезили в Сефакрилову колонку S400HR використовуючи для елюювання буфер 150mM NaCI, 10 мМ чи 5мМ Tris pH7.5. Клінічні серії фільтрували на стерилізуючий мембрані Opticap 4. Кон'югати, які отримані в результаті, мали середнє співвідношення полісахарид:протеїн 1:1-1:5 (м/м). Приклад 2 - визначення молекулярної маси використовуючи MALLS Детектори було з'єднано з РХВТ колонкою з виключенням розміру часток, з якої отримували елюат. З одного боку, детектор розсіювання лазерного світла вимірював інтенсивність світла, розсіяного під 16 кутами макромолекулярним розчином, і з іншого боку, інтерференційний рефрактометр, лінійно розміщений, дозволяв визначати кількість вимитого зразка. За цими інтенсивностями можна визначати розмір і форму макромолекул в розчині. Середню молекулярну масу (Mw) визначали як суму мас всіх різновидів, помножену на їх відповідну молекулярну масу і поділену на суму мас всіх різновидів. a) Середньо масова молекулярна маса: -Mw Wi Mi m2 Mw m1 Wi b) Середньо чисельна молекулярна маса: -Мn Ni Mi m1 Mn Ni m0 2 c) Середньоквадратичний радіус: -Rw- та R w це квадрат радіусу визначений за: R2w чи (r 2 )w miri2 m1 (-mi- є маса розсіюючого центру і та -ri- є відстань між розсіюючим центром і та центром тяжіння макромолекули). d) Полідисперсність визначається як співвідношення -Mw / Μn-. Менінгококові полісахариди аналізували методом MALLS, загружаючи в дві РХВТ колонки (TSKG6000 та 5000PWxl), які використовували в комбінації. 25мкл полісахариду загрузили до колонки та елюювали 0.75 мл фільтрованої води. Полісахариди виявляли використовуючи світловий детектор розсіювання (Wyatt Dawn DSP, оснащений 10мВт аргоновим лазером з довжиною хвилі 488нм) та нижньометричний рефрактометр (Wyatt Otilab DSP, оснащений Р100 коміркою і червоним фільтром = 498нм). 97233 30 Молекулярні маси полісахаридів та відновлення всіх зразків розраховували методом Debye використовуючи підбір багаточлена порядку 1 в програмі Astra 4.72. Приклад 3 - Клінічні випробування встановлення ефекту лінкера в МеnА в MenACWY кон'югаті вакцини Одна доза різних композицій MenACWY вакцини вводили підліткам 15-19 років в 5 групах по 25 осіб в 1:1:1:1:1 випадкових пробах. Випробувані на композиціях були: F1 - MenACWY кон'югований до анатоксину правця з МеnА кон'югатом, що містить АН (ADH) спейсер (зроблений відповідно до прикладу 1) 5/5/5/5 мкг F2 - MenACWY кон'югований до анатоксину правця з МеnА кон'югатом, що містить АН спейсер (зроблений відповідно до прикладу 1) 2.5/5/2.5/2.5 мкг F3 - MenACWY кон'югований до анатоксину правця з МеnА кон'югатом, що містить АН спейсер (зроблений відповідно до прикладу 1) - 5/5/2.5/2.5 мкг F4 - MenACWY кон'югований до анатоксину правця з без спейсеру в будь-якому кон'югаті 5/5/5/5 мкг Контрольна група - Mencevax™ ACWY На 30 день після прививки, у пацієнтів був взятий зразок крові. Зразки крові використовували для встановлення ефекту відсоткового співвідношення SBAMenA, SBA-MenC, SBA-MenW135 тa SBA-MenY відгуків через один місяць після введення дози вакцини. Вакцинний відгук визначали як 1) для початкових серонегативних предметів - поствакцинальний титр антитіл 1/32 за 1 місяць або 2) для початкових серонегативних предметів - титр антитіл 4 кратного довакцинального титру антитіл. Результати Як показано в Таблиці нижче, використання спейсеру в MenА кон'югаті призводить до зростання імунного відгуку проти МеnА. Відсоткове співвідношення відгуків підвищується з 66% до 90-95% коли додавали АН спейсер. Це відображалося в зростанні в SBA GMT з 4335 до 10000 та зростанні в GMC з 5 до 20-40. Несподівано, використання АН спейсеру також призводить до зростання імунного відгуку проти МеnС після перевірки зростанням у відсотковому співвідношенні відгуків та зростанням в SBA GMT. Зростання могло б також бути видним в SBA-GMT проти MenY (6742-7122) та проти MenW (4621-5418) коли ввели спейсер. 31 Композиція F 1 5АН/5/5/5 F2 2.5АН/5/2.5/2.5 F3 5АН/5/2.5/2.5 F4 5/5/5/5 Mencevax™ Композиція F 1 5АН/5/5/5 F2 2.5АН/5/2.5/2.5 F3 5АН/5/2.5/2.5 F4 5/5/5/5 Mencevax™ Композиція F 1 5АН/5/5/5 F2 2.5АН/5/2.5/2.5 F3 5АН/5/2.5/2.5 F4 5/5/5/5 Mencevax™ Композиція F 1 5АН/5/5/5 F2 2.5АН/5/2.5/2.5 F3 F4 5/5/5/5 Mencevax™ 97233 % SBA МenА відгуки 90.9 75 95.5 66.7 85.7 % SBA MenC відгуки 69.6 81.8 81.8 73.9 90.0 % SBA MenW відгуки 95 85 95.5 95.5 86.4 % SBY MenY відгуки 91.3 87.5 80 91.3 91.7 Приклад 4 - Клінічні випробування встановлення ефект лінкера в МеnА та МеnС кон'югати в MenACWY кон'югаті вакцини Одна доза різних композицій MenACWY вакцини вводили підліткам 15-19 років в 5 групах по 25 осіб в 1:1:1:1:1 випадкових пробах. Випробувані на композиціях були: F1 - MenACWY кон'югований до анатоксину правця з MenA та МеnС кон'югатами, що містять АН спейсер (зроблений відповідно до прикладу 1) - 2.5/2.5/2.5/2.5 мкг F2 - MenACWY кон'югований до анатоксину правця з МеnА та МеnС кон'югатами, що містять АН спейсер (зроблений відповідно до прикладу 1) - 5/5/2.5/2.5 мкг F3 - MenACWY кон'югований до анатоксину правця з МеnА та МеnС кон'югатами, що містять АН спейсер (зроблений відповідно до прикладу 1) - 5/5/5/5 мкг F4 - MenACWY кон'югований до анатоксину правця з МеnА кон'югатами, що містять АН спей SBA-MenA GMT 9805 8517 10290 4335 8022 SBA-MenC GMT 3989 3524 3608 2391 5447 SBA-MenW GMT 5418 4469 4257 4621 2714 SBA-MenY GMT 7122 5755 5928 6742 4854 32 Anti-PSA GΜC мкг/мл ELISA 20.38 29.5 47.83 5.46 27.39 Anti-PSC GΜC мкг/мл ELISA 12.11 12.78 8.4 8.84 38.71 Anti-PSw GΜC мкг/мл ELISA 9.65 14.55 6.39 10.7 13.57 Anti-PSY GΜC мкг/мл ELISA 16.3 12.52 8.88 13.88 21.02 сер (зроблений відповідно до прикладу 1) - 5/5/5/5 мкг Контрольна група - Mencevax™ ACWY На 30 день після прививки, у пацієнтів був взятий зразок крові. Зразки крові використовували для встановлення ефекту відсоткового співвідношення SBAMenA, SB A-MenC, SBA-MenW135 та SBA-MenY відгуків через один місяць після введення дози вакцини. Вакцинний відгук визначали як 1) для початкових серонегативних предметів - поствакцинальний титр антитіл 1/32 за 1 місяць або 2) для початкових серонегативних предметів - титр антитіл 4 кратного довакцинального титру антитіл. Результати Введення АН спейсера в МеnС кон'югат призводить до зростання імунного відгуку проти МеnС як показано в таблиці нижче. Це демонструється зростанням в SBA GMT з 1943 до 4329 та зростанням в anti-PSC GMC з 7.65 до 13.13. Сильні імунні відгуки проти МеnА, MenW та MenY зберігались. 33 Композиція F F2 5АН/5АН/2.5/2.5 F3 5АН/5АН/5/5 F4 5АН/5/5/5 Mencevax™ Композиція F12.5AH/2.5AH/2.5/ F2 5АН/5АН/2.5/2.5 F3 5АН/5АН/5/5 F4 5АН/5/5/5 Mencevax™ Композиція F F2 5AH/5AH/2.5/2.5 F3 5AH/5AH/5/5 F4 5AH/5/5/5 Mencevax™ Композиція F1 F2 5AH/5AH/2.5/2.5 F3 5AH/5AH/5/5 F4 5AH/5/5/5 Mencevax™ 97233 % SBA MenA відгуки 75 72 87 77.3 78.3 % SBA МеNС відгуки 88 88 95.8 95.8 91.7 % SBA MenW відгуки 100 96 91.3 88 96 % SBY MenY відгуки 75 92 79.2 80 88 Комп’ютерна верстка Л. Купенко SBA-MenA GMT 8417 6299 9264 9632 8284 SBA-MenC GMT 3619 2833 4329 1943 1567 SBA-MenW GMT 5656 4679 4422 4947 3486 SBA-MenY GMT 3891 3968 2756 3914 3056 Підписне 34 Anti-PSA GMC мкг/мл ELISA 20.23 16.07 27.26 20.39 12.93 Anti-PSC GMC мкг/мл ELISA 12.82 13.32 13.13 7.65 16.55 Anti-PSW GMC мкг/мл ELISA 7 5.4 4.45 7.67 11.93 Anti-PSY GMC мкг/мл ELISA 17.81 11.96 9.51 16.76 21.41 Тираж 23 прим. Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП ―Український інститут промислової власності‖, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for manufacturing vaccines
Автори англійськоюBiemans Ralph Leon, Duvivier Pierre
Назва патенту російськоюПроцесс производства вакцин
Автори російськоюБиманс Ральф Леон, Дювивье Пьер
МПК / Мітки
МПК: A61P 31/04, A61K 39/102, A61K 39/095, A61K 39/116
Мітки: процес, виробництва, вакцин
Код посилання
<a href="https://ua.patents.su/17-97233-proces-virobnictva-vakcin.html" target="_blank" rel="follow" title="База патентів України">Процес виробництва вакцин</a>
Попередній патент: Ізольоване антитіло, яке зв’язує моноцитний хемоатрактантний білок 1 (мср-1) людини
Наступний патент: Розчин хлориду натрію для відновлення вологовмісту композиції ліофілізованого фактора ix
Випадковий патент: Лікарський препарат для місцевого застосування у вигляді пластиру, що містить збудник алергічної реакції уповільненого типу, і способи його застосування