Застосування тенектеплази для лікування гострого ішемічного інсульту
Формула / Реферат
1. Спосіб лікування гострого ішемічного інсульту у людини, що включає введення людині тенектеплази в сумарній дозі від приблизно 0,05 до 0,5 мг/кг, що дається у вигляді початкової болюсної дози від приблизно 0,05 до 0,15 мг/кг, з подальшою інфузією кількості, що дорівнює сумарній дозі мінус початкова доза, протягом періоду часу приблизно 50-90 хвилин.
2. Спосіб за п. 1, в якому сумарна доза становить від приблизно 0,2 до 0,3 мг/кг.
3. Спосіб за п. 1 або 2, в якому сумарна доза становить приблизно 0,25 мг/кг.
4. Спосіб за будь-яким з пп. 1-3, в якому початкова доза становить від приблизно 0,08 до 0,12 мг/кг.
5. Спосіб за будь-яким з пп. 1-4, в якому початкова доза становить приблизно 0,1 мг/кг.
6. Спосіб за будь-яким з пп. 1-5, в якому час інфузії становить приблизно 55-70 хвилин.
7. Спосіб за будь-яким з пп. 1-6, в якому час інфузії становить приблизно 60 хвилин.
8. Спосіб за будь-яким з пп. 1-7, в якому сумарна доза становить приблизно 0,25 мг/кг і додається у вигляді початкового болюсу приблизно 0,1 мг/кг, з подальшою інфузією приблизно 0,15 мг/кг протягом приблизно 60 хвилин.
9. Спосіб за будь-яким з пп. 1-8, в якому тенектеплаза вводиться людині в інтервалі часу від приблизно 15 хвилин до 20 годин від початку гострого ішемічного інсульту.
10. Спосіб за будь-яким з пп. 1-9, в якому тенектеплаза вводиться людині в інтервалі часу від приблизно 30 хвилин до 6 годин від початку гострого ішемічного інсульту.
11. Спосіб за будь-яким з пп. 1-10, в якому тенектеплаза вводиться людині в інтервалі часу від приблизно 30 хвилин до 3-х годин від початку гострого ішемічного інсульту.
12. Спосіб за будь-яким з пп. 1-11, в якому болюс є внутрішньовенним.
13. Спосіб за будь-яким з пп. 1-12, що додатково включає введення людині ефективної кількості другого лікарського засобу, в якій перший лікарський засіб являє собою тенектеплазу.
14. Спосіб за п. 13, в якому другий лікарський засіб являє собою нейропротективний засіб, тромболітичний засіб, антагоніст глікопротеїну ІІb/ІІІа або антитіло до CD18.
15. Набір для здійснення способу за п. 1, що містить:
(a) контейнер, який містить тенектеплазу; і
(b) інструкції по застосуванню тенектеплази для лікування гострого ішемічного інсульту у людини за допомогою введення людині тенектеплази в сумарній дозі від приблизно 0,05 до 0,5 мг/кг, що дається у вигляді початкової болюсної дози від приблизно 0,05 до 0,15 мг/кг, з подальшою інфузією кількості, що дорівнює сумарній дозі мінус початкова доза, протягом періоду часу приблизно 50-90 хвилин.
16. Набір за п. 15, в якому сумарна доза становить від приблизно 0,2 до 0,3 мг/кг.
17. Набір за п. 15 або 16, в якому сумарна доза становить приблизно 0,25 мг/кг.
18. Набір за будь-яким з пп. 15-17, в якому початкова болюсна доза становить від приблизно 0,08 до 0,12 мг/кг.
19. Набір за будь-яким з пп. 15-18, в якому сумарна доза становить приблизно 0,25 мг/кг, що дається у вигляді початкового болюсу приблизно 0,1 мг/кг, з подальшою інфузією приблизно 0,15 мг/кг протягом приблизно 60 хвилин.
20. Набір за будь-яким з пп. 15-19, що додатково включає контейнер, який містить другий лікарський засіб, де інструкції включають інструкції по застосуванню другого лікарського засобу в комбінації з тенектеплазою для лікування ішемічного інсульту у людини за допомогою введення людині ефективної кількості другого лікарського засобу.
21. Набір за п. 20, в якому другий лікарський засіб являє собою нейропротективний засіб, тромболітичний засіб, антагоніст глікопротеїну ІІb/ІІІa або антитіло до CD18.
Текст
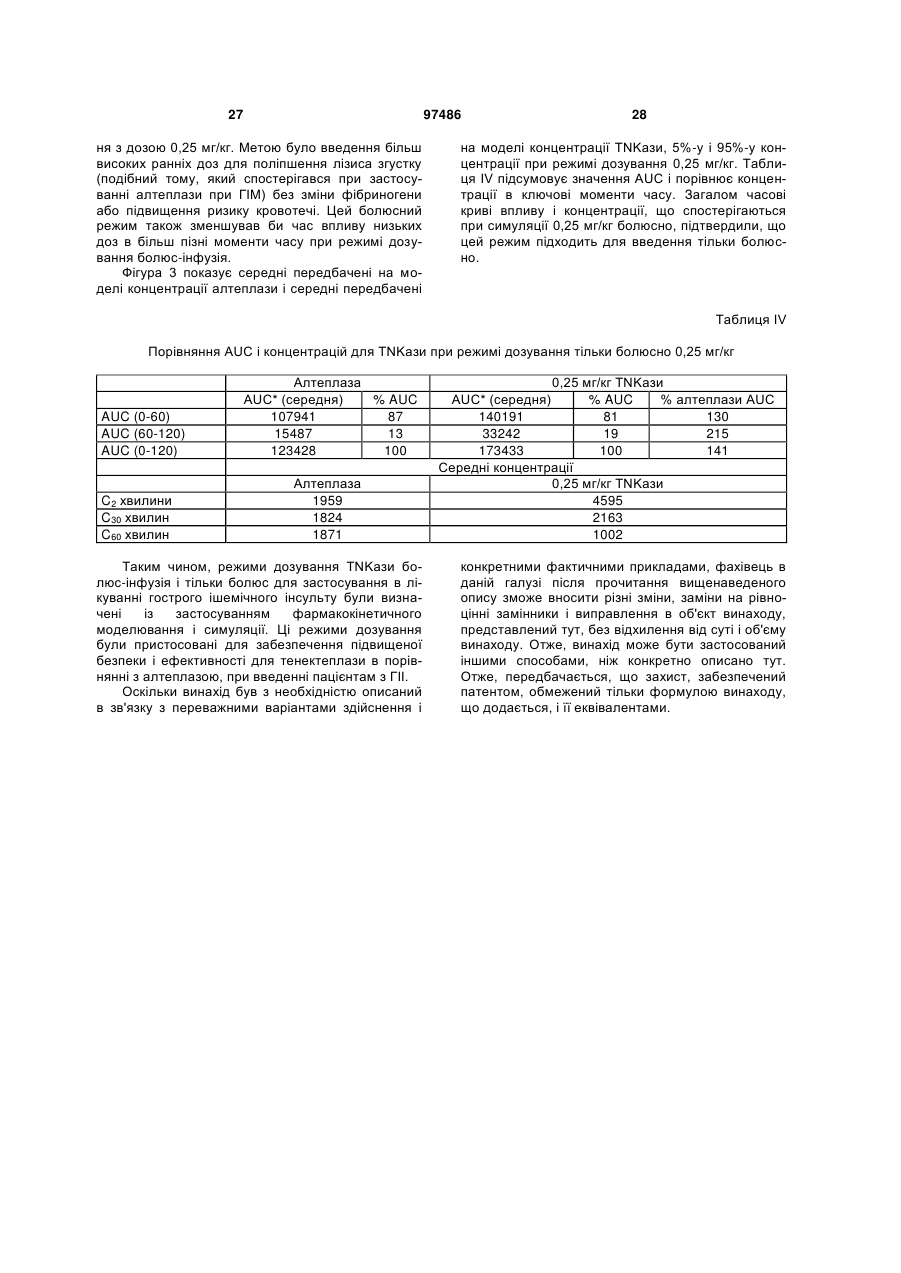
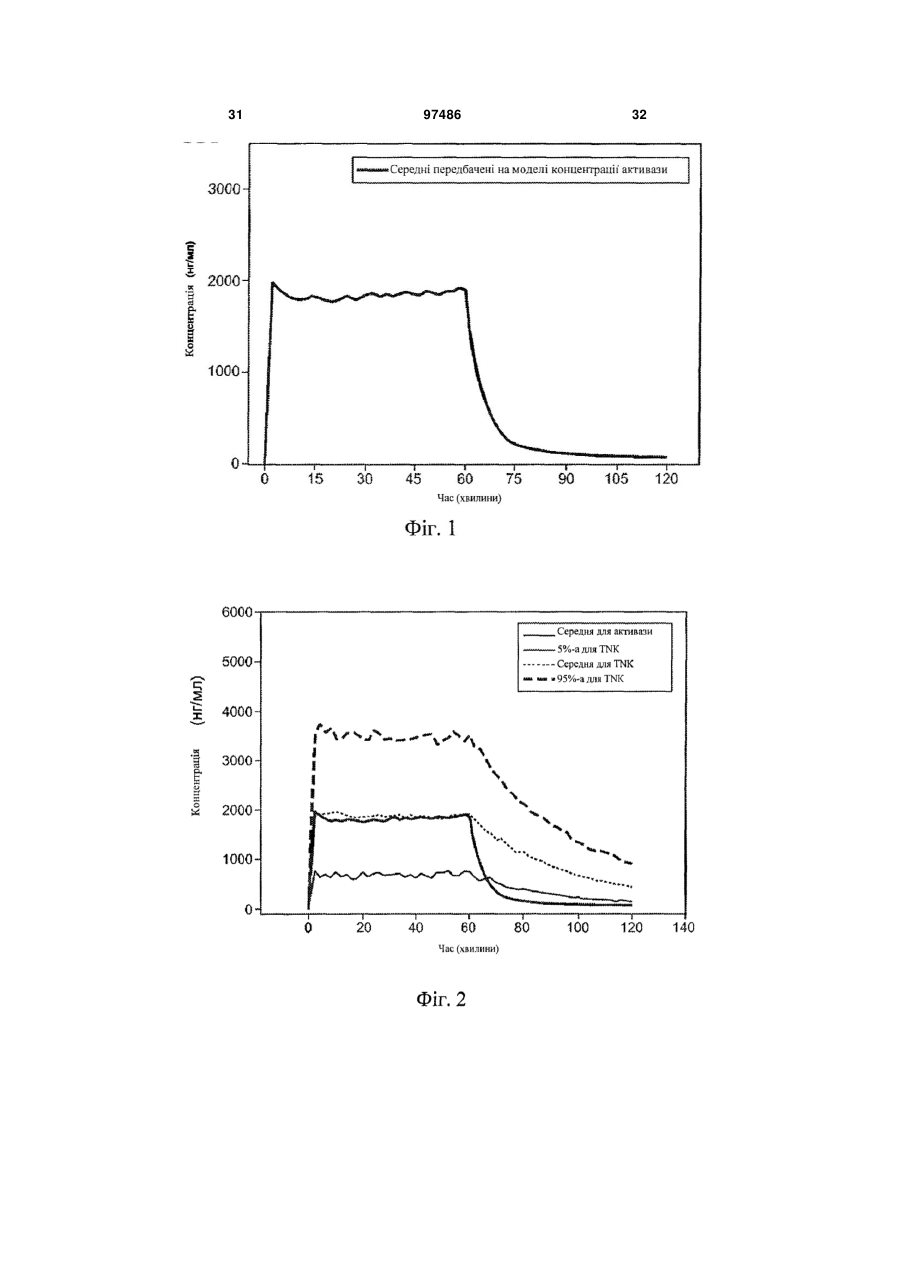
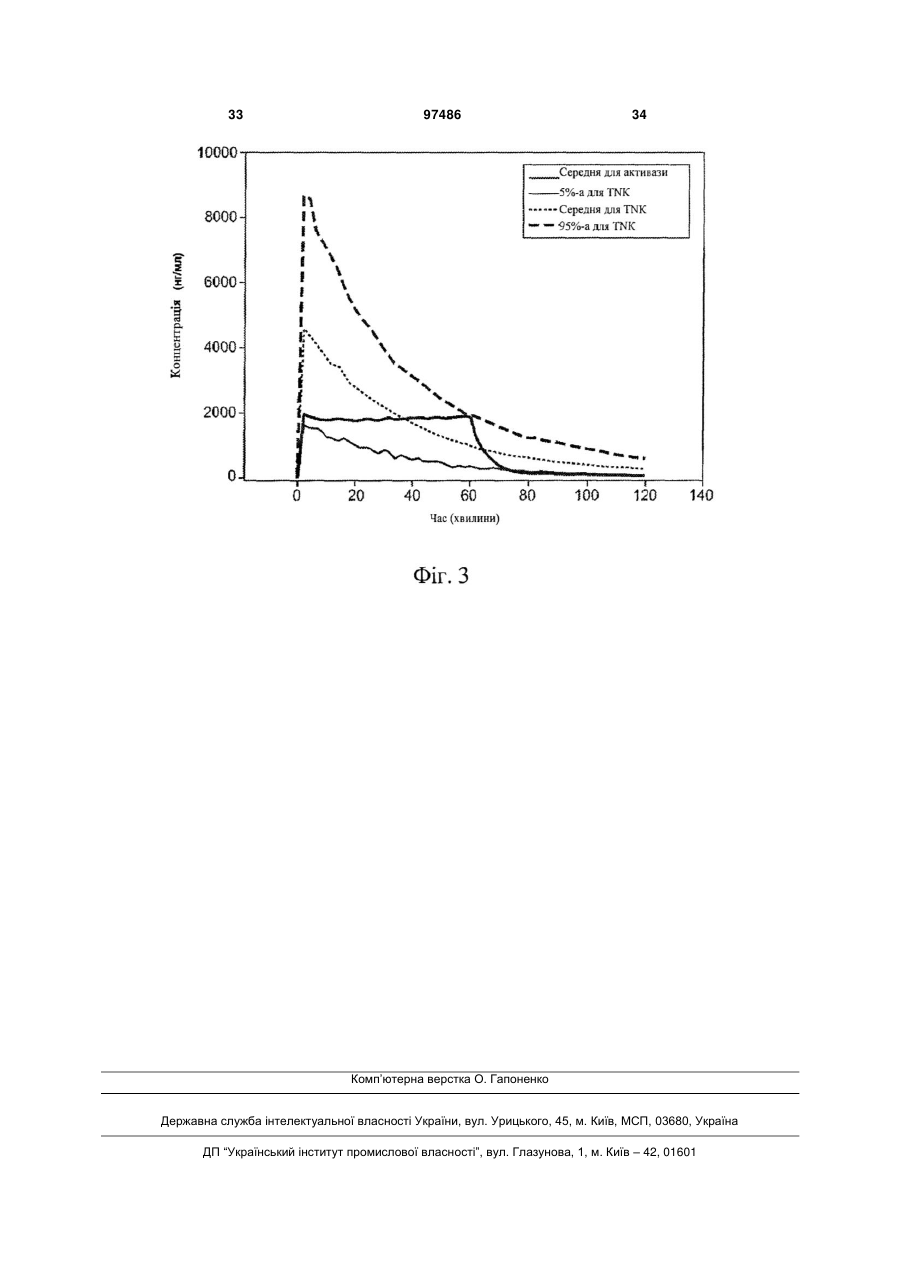
1. Спосіб лікування гострого ішемічного інсульту у людини, що включає введення людині тенектеплази в сумарній дозі від приблизно 0,05 до 0,5 мг/кг, що дається у вигляді початкової болюсної дози від приблизно 0,05 до 0,15 мг/кг, з подальшою інфузією кількості, що дорівнює сумарній дозі мінус початкова доза, протягом періоду часу приблизно 50-90 хвилин. 2. Спосіб за п. 1, в якому сумарна доза становить від приблизно 0,2 до 0,3 мг/кг. 3. Спосіб за п. 1 або 2, в якому сумарна доза становить приблизно 0,25 мг/кг. 4. Спосіб за будь-яким з пп. 1-3, в якому початкова доза становить від приблизно 0,08 до 0,12 мг/кг. 5. Спосіб за будь-яким з пп. 1-4, в якому початкова доза становить приблизно 0,1 мг/кг. 6. Спосіб за будь-яким з пп. 1-5, в якому час інфузії становить приблизно 55-70 хвилин. 7. Спосіб за будь-яким з пп. 1-6, в якому час інфузії становить приблизно 60 хвилин. 8. Спосіб за будь-яким з пп. 1-7, в якому сумарна доза становить приблизно 0,25 мг/кг і додається у вигляді початкового болюсу приблизно 0,1 мг/кг, з подальшою інфузією приблизно 0,15 мг/кг протягом приблизно 60 хвилин. 9. Спосіб за будь-яким з пп. 1-8, в якому тенектеплаза вводиться людині в інтервалі часу від приблизно 15 хвилин до 20 годин від початку гострого ішемічного інсульту. 10. Спосіб за будь-яким з пп. 1-9, в якому тенектеплаза вводиться людині в інтервалі часу від приблизно 30 хвилин до 6 годин від початку гострого ішемічного інсульту. 2 (19) 1 3 97486 4 тичний засіб, антагоніст глікопротеїну ІІb/ІІІa або антитіло до CD18. Попередній рівень техніки «Споріднені» заявки Це непопередня заявка, подана відповідно до умов 37 CFR § 1.53(b), за якою вимагається пріоритет відповідно до 35 U.S.C. § 119(е) за попередньою заявкою США з реєстраційним № 60/823868, поданої 29 серпня 2006 року, повний зміст якої включений в даний документ за допомогою посилання. Галузь техніки, до якої належить винахід: Винахід стосується способу лікування інсульту із застосуванням тромболітичного агента, більш конкретно, способу введення тенектеплази в певному режимі дозування для лікування гострого ішемічного інсульту. Опис споріднених галузей техніки: Інсульт являє собою загальний термін для позначення гострого пошкодження мозку внаслідок хвороби кровоносних судин. Він представляє серйозну проблему для суспільства, оскільки приблизно 500000 осіб в Сполучених Штатах кожний рік вмирають або отримують постійну непрацездатність внаслідок інсульту. Інсульт може бути класифікований на дві основні групи: геморагічний інсульт (внаслідок виливу крові з нормальних кровоносних судин) і ішемічний інсульт (церебральна ішемія внаслідок відсутності кровопостачання); ця заявка пов'язана з останнім. Ішемічний інсульт відповідальний приблизно за одну третю частину від всіх смертей в промислово розвинених країнах і є головною причиною серйозної, тривалої непрацездатності дорослих у віці 45 років. Зрозуміло, що існує необхідність в фармакотерапії для лікування гострого ішемічного інсульту. Значні зсуви були досягнуті в розумінні механізмів інсульту і каскаду процесів, які відбуваються внаслідок інсульту; також стають більш зрозумілими пошкодження нейронів і загибель клітин. Трьома основними механізмами ішемічного інсульту є тромбоз, емболія і системна гіпоперфузія (з виникаючою в результаті ішемією і гіпоксією). При кожному з цих типів інсульту ділянка мозку, яка вмирає внаслідок припинення кровопостачання в ній, називається інфаркт. Обструкція артерії мозку внаслідок тромбозу, який сформувався на стінці артерії мозку, загалом називається «тромбоз судин головного мозку». При емболії судин мозку, оклюзуюча речовина, що блокує артерію мозку, формується дистальніше в системі циркуляції (наприклад, ембол надходить в артерію мозку з серця). Оскільки складно розрізнити, чи викликаний інсульт тромбозом або емболією, термін «тромбоемболія» застосовується для включення обох цих типів інсульту. Системна гіпоперфузія може виникати як наслідок підвищених рівнів лактату в крові, зниженого гематокриту, низького кров'яного тиску або нездатності серця адекватно перекачувати кров. Коли симптоми інсульту спостерігаються менше 24 годин і пацієнт повністю відновлюється, кажуть, що пацієнт має перенесену транзиторну ішемічну атаку (ТІА). Симптомами ТІА є тимчасове порушення мовлення, зору, чутливості або рухів. Оскільки вважається, що ТІА часто є передвісником повномаштабного інсульту, пацієнти, що перенесли ТІА, є кандидатами для профілактичної терапії інсульту із застосуванням антикоагулянтів (наприклад, кумарину і гепарину) або антитромбоцитарних засобів(таких як аспірин або тиклопідин), наприклад. Гострий ішемічний інсульт (ГІІ) є гетерогенним патологічним процесом; прогнозування перебігу, відновлення, непрацездатності або смерті є складним. Звичайно він виникає внаслідок гострого оклюзійногo ураження артерії в результаті тромбоемболії. Локалізація оклюзійного ураження артерії при гострому інсульті є порівняно гетерогенною. Тромболітичні засоби, такі як рекомбінантний активатор тканинного плазміногена (rtPA), застосовувалися в лікуванні інсульту, що відбувся внаслідок тромбоемболії, і діяли за допомогою лізування тромбу, що викликає ішемію. Дійсно, внутрішньовенні rtPA (алтеплаза, ACTIVASE) є єдиними засобами, схваленими для лікування гострого ішемічного інсульту. Внутрішньовенний rtPA (0,9 мг/кг, максимум 90 мг), причому 10% дози дається у вигляді болюсу, з подальшою інфузією, що продовжується 60 хвилин, являє собою лікування, що рекомендується протягом 3 годин від початку ішемічного інсульту. Вважають, що цей засіб є найбільш придатним, коли він вводиться так скоро, наскільки це можливе після початку гострого інсульту (Gross et al., Neurosurgery, 36: 1172-1177 (1995); Ingall et al., Stroke, 35: 2418-2424 (2004); The ATLANTIS, ECASS, and NINDS rt-PA Study Group Investigators, Lancet, 363: 768-774 (2004)), для відновлення, щонайменше, часткового, церебрального кровотоку в ділянці ішемії і для підтримки життєздатності нейронів. Є, однак, додаткове свідчення, що більш пізнє введення є ефективним, за допомогою інших способів, наприклад, із застосуванням методів дифузійно-зваженої і перфузійної МРТ і перфузійної КТ. Tomsick, J. Vase. Interv. Radiol, 15: S67-S76 (2004). Крім того, вплив через катетер внутрішньоартеріальним активатором тканинного плазміногена (tPA) або урокіназою окремо або з допоміжною балонною ангіопластикою/стентуванням було успішно застосовано у тих пацієнтів, яким протипоказане внутрішньовенне лікування гострого ішемічного інсульту. Ramee et al., Stroke, 35: e109-e111 (2004). Також був запропонований комбінований внутрішньовенний і внутрішньоартеріальний підхід до лікування tPA для реканалізації у пацієнтів з ішемічним інсультом. The IMS Study Investigators, Stroke, 35: 904-912 (2004). Тромболізис, лізис згустка в артерії мозку із застосуванням tPA протягом годин від появи симп 5 томів ішемічного інсульту, був схвалений для лікування гострого ішемічного інсульту з 1996 року. Два інших засоби, про-урокіназа (внутрішньоартеріальне введення прямо в М1 або М2 артеріальний тромб) і анкрод для внутрішньовенного застосування, засіб, що знижує рівень фібриногену, отриманий з отрути малайського щитомордника, показали терапевтичну корисність і можуть бути корисні для лікування гострого ішемічного інсульту в майбутньому. Ефект антитіл до ІСАМ-1 у кролика, що є моделлю для емболічного інсульту, з подальшим тромболізисом із застосуванням tPA, був також досліджений (Bowes et al., Exp. Neurol, 119:215-219 (1993)). Хоч tPA (в межах 30 хвилин після початку ішемії) і антитіла до ІСАМ-1 (протягом 5 хвилин після початку ішемії), кожний окремо, поліпшували неврологічні наслідки в порівнянні з контрольними, введення комбінації двох сполук в один і той же час було не більш ефективним, ніж введення кожної сполуки окремо. Коли тромболізис відстрочений на три години після емболії, ні tPA, ні комбінація засобів не зменшують неврологічні порушення. Експерименти на кроликах також показали, що tPA (30 хвилин після початку ішемії) і антитіла до CD18 (5 хвилин після початку ішемії) кожний нарізно поліпшували неврологічні наслідки, хоча введення комбінації двох сполук в один і той же час було не більш ефективним, ніж введення будь-якої сполуки нарізно (Bowes et al., Neurology, 45: 815-819 (1995)). Комбінація антитіл до ІСАМ-1 (15 хвилин після ішемії) і tPA (2 години після ішемії) збільшували тривалість інтервалу часу після ішемії, при якому tPA зберігав свою ефективність. Тобто, комбінація була ефективною в збільшенні терапевтичного вікна для tPA за межі ефективного терапевтичного вікна tPA при введенні кролику тільки tPA. Цей ефект також спостерігався у щурів, яким вводився tPA і інгібітор глікопротеїнового рецептора IIВ/IIІА. Li et al., Circulation, 107: 28372843 (2003). Патентні публікації US 2002/0081294 і US 2004/0057951 розкривають спільне введення тромболітика і антитіл до CD18 для поліпшення кровотоку в інфаркт-пов'язаній артерії у ссавця, такого як людина (наприклад, при гострому інфаркті міокарда (ГІМ) у ссавця з блокованою коронарною артерією або локальним ішемічним інсультом, викликаним обструкцією артерії мозку). Патент США № 6541452 розкриває асоційований з мозком інгібітор tPA і його застосування в лікуванні інсульту. Патентна публікація США 2004/0176347 розкриває фармацевтичну композицію для лікування ішемічних захворювань мозку, що включає в себе агент, поліпшуючий функцію астроцитів, і тромболітик, переважно tPA, як активні інгредієнти. Тенектеплаза (TNK, TNKASE, Genentech, Inc., South San Francisco, CA) являє собою генноінженерний варіант tPA людини, клонований і експресований в клітинах яєчника китайського хом'ячка. Keyt et al., Proc. Natl. Acad. Sci USA, 91: 36703674 (1994). Див. також Verstraete, Am. J. Med., 109: 52-58 (2000), огляд тромболітичних засобів третього покоління загалом. Схвалена в США для однократного болюсного введення пацієнтам з ГІМ, тенектеплаза була створена для отримання 97486 6 підвищеної специфічності до фібрину і підвищеного часу напівжиття в порівнянні з алтеплазою. Тенектеплаза і алтеплаза мали рівні показники 30денної смертності пацієнтів, коли тенектеплаза з однократним болюсним введенням порівнювалася з алтеплазою з фронтальним навантаженням при гострому інфаркті міокарда в подвійному сліпому рандомізованому випробуванні ASSENT-2. Простота введення тенектеплази може сприяти більш швидкому стаціонарному і подальшому лікуванню. Van de Werf et al., Lancet, 354: 716-722 (1999). Результати дослідження ASSENT-2 показали, що загальне число випадків інсульту і 30-денна смертність були нижче у пацієнтів жіночої статі старше 75 років, що отримували лікування тенектеплазою, ніж у таких же пацієнтів, що отримували алтеплазу, хоча відмінність була статистично недостовірною. Автори роблять висновок, що пацієнти жіночої статі і пацієнти віком старше 75 років будуть, ймовірно, отримувати велику користь від тромболітика, який вводиться відповідно до режиму дозування, адаптованого до конкретної маси тіла, наприклад, тенектеплази. Vermeer, Thrombosis Research, 103: Supplement 1, S101-S104 (September 30 2001). Інші тромболітичні засоби, які можуть бути придатні в лікуванні ГІМ, включають стрептокіназу, урокіназу, аністреплазу, алтеплазу, саруплазу, ретеплазу, ланотеплазу, стафілокіназу, фібролазу, проурокіназу і активатор плазміногена летючої миші-вампіра. Iqbal, Clinical and Applied Thrombosis/Hemostasis, 6/1: 1-13 (2000). Подальші дані з тенектеплазою визначають, що вона показує загалом такі ж профілі ефективності і переносимості, як і алтеплаза, з порівнянною смертністю після одного року. Тенектеплаза має явну перевагу над алтеплазою у вигляді зниженої смертності у пацієнтів, одержуючих пізнє лікування, і меншого числа ускладнень у вигляді нецеребральних кровотеч в ASSENT-2. Dunn and Goa, Am J Cardiovasc Drugs 1 (1), 51-66 (2001). Callahan et al., HeartDrag 1/5: 281-290 (2001) являє собою огляд, в якому повідомляється, що і r-РА, і тенектеплаза є ефективними в лікуванні ГІМ, коли вони застосовуються у вигляді болюсної терапії, і ця особливість може сприяти більш ранньому початку лікування, так само, як і більш низькій вартості лікування. У більш пізньому дослідженні було виявлено, що тромболітики (ретеплаза, тенектеплаза, алтеплаза і стрептокіназа), мабуть, мають однакову ефективність в зниженні смертності, і явні переваги «прискореної» алтеплази в GUSTO-I цьому відповідають. Dundar et al., QJM, 96: 103-113 (2003). В випробуванні, яке називається ASSENT-3 PLUS, було виявлено, що тенектеплаза ефективна для лікування ГІМ в поєднанні з низькомолекулярним гепарином еноксапарином (ENOX) або нефракціонованим гепарином на дошпитальному етапі. Комбінація тенектеплази з ENOX знижує ранні ішемічні ускладнення, але знижені дози ENOX повинні бути протестовані для використання у немолодих пацієнтів. Wallentin et al., Circulation, 108: 135-142 (2003); Патент США № 7084118. У лікуванні ішемічного інсульту Jonas et al., Annals of the New York Academy of Sciences, 939: 257-267 (2001), розкривають прогностичну цінність 7 модельних тварин при оцінці недоліків нейропротекторів в порівнянні з перевагами тромболізису. Засоби, заявлені як нейропротективні при інсульті у модельних тварин, всі виявилися невдалими у випробуваннях на людях. Повідомлялося, що тромболізис є сприятливим при інсультах у тварин і людини. У тварин дія нейропротекторів і тромболітиків на обширність інфаркту залежить від часу: при ранньому початку лікування спостерігається найкращий ефект; і перевага поступово - і згодом повністю - пропадає із збільшенням відстрочки часу до першого введення. Дані по тваринах також показують, що загалом сприятливі ефекти нейропротекторів слабіше і швидше повністю пропадають, ніж у тромболітиків. Дані, отримані на людях, показують, що випробування нейропротекторів були невдалими, коли починалися в межах вікна, яке значно перевищувало тривалість вікна для (будь-якого) успіху, що спостерігається в дослідженнях цих засобів на тваринах. Навпаки, дослідження тромболізису у людей однаково обмежували час введення до вікон, в яких ці засоби показали сприятливий ефект на тваринах. У клінічних дослідженнях інсульту нейропротектори не давали переваги, оскільки їх ефекти щонайбільше були дуже слабими, і вони застосовувалися в моменти часу, які, як і очікувалося з досліджень на модельних тваринах, були дуже пізніми. Тромболітична терапія такими засобами, як тенектеплаза і урокіназа, яка має більш сильний ефект, ніж нейропротектори у модельних тварин, застосовувалася в клініці протягом раннього вікна оптимальної ефективності і приводила до сприятливих результатів. Галузь застосування внутрішньовенного і внутрішньоартеріального тромболізису для лікування гострого ішемічного інсульту швидко розширяється. Обмеження для застосування існуючих тромболітиків привели до розвитку нових тромболітичних засобів протягом останнього десятиріччя, які називаються тромболітики третього покоління. Два з декількох тромболітиків третього покоління були досліджені для лікування гострого ішемічного інсульту і включали тенектеплазу і ретеплазу. Завдяки структурним модифікаціям тромболітики третього покоління мають більш довгий період напівжиття і більш хороше проникнення в тромботичні масу. Перше проспективне клінічне дослідження на людях оцінювало безпеку і ефективність ретеплази для внутрішноартеріального введення у 16 пацієнтів з ішемічним інсультом, які були поганими кандидатами для внутрішньовенної терапії алтеплазою. Повна або майже повна реканалізація спостерігалася після лікування у 88% пацієнтів. Очікується, що розробка і застосування тромболітиків третього покоління підвищить швидкість реканалізації і клінічного відновлення у пацієнтів з ішемічним інсультом. Qureshi et al., Current Opinion in Investigational Drugs 3(12): 1729-1732 (2002). Наприклад, монтеплаза, модифікована rtPA, зменшує об'єм інфаркту і геморагічної трансформації в дослідженнях емболічного інсульту на щурах. Muramatsu et al., Neurological Research, 24: 311-316 (2002). Інші такі лікарські засоби включають ланотеплазу, плазмін або розгалужену форму 97486 8 плазміну (мікроплазмін), тромболітик прямої дії з непов'язаною з тромболітичними властивостями нейропротективною терапевтичною активністю, рекомбінантний активатор плазміногена з слинної залози desmodus rotundus (rDSPA) альфа-1 і мутатний активований фібрином плазміноген людини (ВВ 10153; British Biotech Inc.). Огляд цих напрямів відкриття і розвитку лікарських засобів був приведений в Lapchak, Expert Opinion on Investigational Drugs 11: 1623- 1632 (2002). Мультицентрове рандомізоване подвійне сліпе клінічне дослідження з послідовним підвищенням дози, яке називається дослідження інсульту CLEAR, проводиться в цей час для оцінки безпеки ептифібатиду, циклічного гептапептиду для внутрішньовенного введення, який вибірково блокує глікопротеїновий рецептор тромбоцитів IIb/ІIIа, в комбінації з низькими дозами rtPA при гострому ішемічному інсульті протягом трьох годин. Передбачалося, що тенектеплаза може бути нейропротектором після інсульту внаслідок своєї підвищеної в порівнянні з алтеплазою специфічності до фібрину, своєї стійкості до РАІ-І і подовженого періоду біологічного напівжиття (18 в порівнянні з 10 хвилинами для алтеплази), і ці властивості можуть приводити до менших мозкових крововиливів, ніж алтеплаза, у пацієнтів з інсультами. Попереднє дослідження тенектеплази булo виконане на 88 пацієнтах з гострим ішемічним інсультом, включених у випробування з 2000 до 2003 року, із застосуванням чотирьох рівнів доз тенектеплази: 0,1, 0,2, 0,4 і 0,5 мг/кг. У перших трьох рівнях симптоматичних внутрішньочерепних крововиливів (ВЧК) не було. Два з 13 пацієнтів мали симптоматичне ВЧК при використанні дози 0,5 мг/кг, і збільшення числа випадків ВЧК спостерігалося з підвищенням доз (8%-38%), з такими ж результатами, як в групі алтеплази в більш ранньому дослідженні гострого ішемічного інсульту. Тенектеплазу в цей час продовжують досліджувати в рандомізованому клінічному дослідженні контрольованої фази IIb у пацієнтів з гострим ішемічним інсультом із застосуванням 0,1 мг/кг тенектеплази, 0,4 мг/кг тенектеплази і 0,9 мг/кг rtPA. У ранніх дослідженнях на тваринах активність тенектеплази порівнювалася з алтеплазою на кроликах як модель емболічного інсульту і периферійна кровотеча. Інфузія алтеплази або болюсне введення тенектеплази приводило до дозозалежного лізису згустка. Було виявлено, що тенектеплаза є на порядок більш сильною, ніж алтеплаза при розрахунку міліграм на кілограм маси. На відміну від алтеплази, тенектеплаза викликала меншу системну активацію плазміногена і меншу геморагічну трансформацію в цій моделі. Тенектеплаза не подовжувала шаблонний час кровотечі. Автори стверджують, що шляхом поєднання підвищеної специфічності до фібрину із зниженим кліренсом в плазмі можливе отримання тромболітичного засобу (тенектеплази), яке буде більш відповідним і більш сильним, ніж tPA дикого типу. Згідно з думкою авторів, значне зменшення числа геморагічних конверсій може бути властиве 9 консервації системного плазміногена, що спостерігається для цієї молекули. Thomas et al., Stroke, 25: 2072-2078 (1994). В іншому дослідженні на тваринах, тенектеплаза, що застосовується в дозі 0,6 мг/кг або 1,5 мг/кг, порівнювалася з tPA дикого типу у кролика як модель емболічного інсульту. І tPA дикого типу, і тенектеплаза викликали тромболізис у більшості суб'єктів, і не мали відмінностей між собою. Ні тенектеплаза, ні tPA не впливали на розмір геморагій. Тенектеплаза показала порівнянні швидкості реканалізації в порівнянні з tPA дикого типу в моделі емболічного інсульту. Оскільки tPA підвищує швидкість кровотечі, крововилив, асоційований з лікуванням тенектеплазою, статистично не відрізняється від контрольної групи або групи з tPA. Автори передбачили, що тенектеплаза є перспективною як альтернативне тромболітичне лікування при інсульті, але вони не змогли продемонструвати безпеку її застосування в порівнянні з tPA дикого типу. Chapman et al., Stroke, 32: 748-52 (2001). Більш пізні дослідження на людях мали багато паралелей з дослідженнями на тваринах, не тільки в природі порушень, що йдуть за ішемією, але також і в їх залежності від часу. Callaway, Current Neuropharmacology, 2/3: 277-294 (2004). Спільне введення NXY-059 (100 мг/кг) і тенектеплази (0,9 мг/кг) протягом шести годин після емболічного інсульту у кроликів поліпшує клінічні показники. Lapchak et al., Experimental Neurology 188: 279-285 (Aug. 2004); Comment in Exp Neurol., 188: 195-199 (Aug. 2004). Wagner and Jauch Experimental neurology 188 (2): 195-199 (2004); Comment on Exp Neurol. 188 (2) 279-85 (2004) означає вікно для лікування гострого інсульту тромболітиками, такими як тенектеплаза, спільно з засобами, що захищають центральну нервову систему (ЦНС), такими як блокатори вільних радикалів, NXY 059 і оксиди азоту. Lapchak et al., Experimental Neurology, 185: 154-159 (2004) надає порівняння тенектеплази з алтеплазою по клінічних показниках після емболічних інсультів з невеликими згустками у кроликів. Модель емболічного інсульту з невеликим згустком в кролика (RSCEM) застосовувалася для аналізу дозозалежних профілів тенектеплази (0,1 мг/кг 3,3 мг/кг) і алтеплази (0,9 мг/кг 3,3 мг/кг), які вводилися внутрішньовенно протягом 1 години після емболізації. У додаткових дослідженнях, тенектеплаза (0,9 мг/кг) або алтеплаза (3,3 мг/кг) вводилися протягом 3 (або 6) годин після емболізації для визначення терапевтичного вікна для тромболітиків. Для обох досліджень протягом 24 годин після емболізації проводився аналіз поведінки, що дозволяв визначити ефективну дозу для інсульту (Р50) або масу згустка (мг), яка викликає неврологічний дефіцит у 50% кроликів. Дослідження показує, що тенектеплаза має широкий терапевтичний діапазон, терапевтичне вікно щонайменше 3 години і тривалий ефект. Крім того, профіль безпеки тенектеплази не відрізняється від профілю алтеплази. Тенектеплаза не підвищує швидкість внутрішномозкового крововиливу (ВМК) більше швидкості, отриманої для алтеплази. Однак терапевтичний діапазон і вікно для 97486 10 алтеплази більш обмежені, ніж для тенектеплази. Ці доклінічні дослідження дають можливість передбачити, що тенектеплаза має кращий фармакологічний профіль, ніж алтеплаза, і підтримують дослідження тенектеплази в рандомізованих подвійних сліпих клінічних дослідженнях у пацієнтів з інсультами. Див. також Araujo et al., Society for Neuroscience Abstract Viewer and Itinerary Planner, Volume: 2003, Page: Abstract No. 102.2 (2003) Conference: 33rd Annual Meeting of the Society of Neuroscience, New Orleans, LA, USA, November 0812 2003. Існує необхідність в способі поліпшення клінічного виходу при гострому ішемічному інсульті, шляхом, наприклад, підвищення мозкового кровотоку і/або зменшення розміру інфаркту, із застосуванням тенектеплази. Суть винаходу Відповідно, винахід такий, як він описаний в формулі винаходу. В одному аспекті винахід надає спосіб лікування гострого ішемічного інсульту у людини, що включає введення людині тенектеплази в сумарній дозі приблизно від 0,05 до 0,5 мг/кг, що вводиться як (а) початкова болюсна доза від приблизно 0,015 до 0,15 мг/кг, з подальшою інфузією кількості, що дорівнює сумарній дозі мінус початкова доза, протягом періоду часу приблизно 50-90 хвилин, або (b) тільки болюс. Для зручності тенектеплаза вводиться людині в формі фармацевтично прийнятного складу, такого як склади, представлені тут більш детально. Переважно, сумарна доза становить від приблизно 0,2 до 0,3 мг/кг, більш переважно приблизно 0,25 мг/кг. В одному варіанті здійснення цього способу, сумарна доза дається у вигляді початкового болюсу з подальшою інфузією. Переважно, початкова доза становить від приблизно 0,08 до 0,12 мг/кг, більш переважно, приблизно 0,1 мг/кг болюс і/або період інфузії становить приблизно 55-70 хвилин, більш переважно приблизно 60 хвилин. У конкретному переважному варіанті здійснення, загальна доза становить приблизно 0,25 мг/кг, і вводиться у вигляді початкової болюсної дози приблизно 0,1 мг/кг, з подальшою інфузією приблизно 0,15 мг/кг протягом 60 хвилин. В іншому конкретному переважному варіанті здійснення, тенектеплаза вводиться людині в загальній дозі приблизно 0,25 мг/кг протягом приблизно 60 хвилин, у вигляді початкової болюсної дози приблизно 0,1 мг/кг протягом хвилини з подальшої інфузією приблизно 0,25 мг/кг протягом інших приблизно 60 хвилин. В іншому варіанті здійснення цього способу сумарна доза дається тільки у вигляді болюсу. Загальна доза звичайно становить від приблизно 0,05 до приблизно 0,5 мг/кг. У переважному варіанті здійснення, загальна доза становить приблизно 0,25 мг/кг. Переважно в обох способах тенектеплаза вводиться людині за час від приблизно 15 хвилин до приблизно 20 годин від початку гострого ішемічного інсульту, більш переважно від приблизно 45 хвилин до приблизно 6 годин і ще більш переважно не більш, ніж через приблизно 3 години від початку гострого ішемічного інсульту. У переважному 11 варіанті здійснення, болюс є внутрішньовенним і інфузія є тривалою. У переважному варіанті здійснення обох цих способів вони додатково включають введення людині ефективної кількості другого лікарського засобу, причому першим лікарським засобом є тенектеплаза. Другий лікарський засіб переважно являє собою нейропротектор, тромболітик, антагоніст глікопротеїну IIb/ІIIа або антитіла до CD18. Цей другий лікарський засіб може вводитися людині або до, або після, або одночасно з тенектеплазою. Такий другий лікарський засіб, наприклад, може вводитися ссавцеві пізніше, ніж приблизно 3 години після початку ішемічного інсульту (наприклад, щонайменше один раз протягом 3-8 годин і, переважно, протягом 3-6 годин від початку інсульту). В іншому аспекті винахід надає набір, що містить: контейнер, який містить тенектеплазу; і інструкції по застосуванню тенектеплази для лікування гострого ішемічного інсульту у людини за допомогою введення тенектеплази людині в сумарній дозі від приблизно 0,05 до 0,5 мг/кг, що дається у вигляді (а) початкової болюсної дози від приблизно 0,015 до 0,15 мг/кг, з подальшою інфузією кількості, що дорівнює сумарній дозі мінус початкова доза протягом періоду часу приблизно 50-90 хвилин, або (b) у вигляді болюсу. Переважно сумарна доза становить від приблизно 0,2 до 0,3 мг/кг, більш переважно приблизно 0,25 мг/кг і початкова болюсна доза становить від приблизно 0,08 до 0,12 мг/кг. В одному варіанті здійснення набору сумарну дозу дають у вигляді початкової болюсної дози з подальшою інфузією. У переважному варіанті здійснення сумарна доза становить приблизно 0,25 мг/кг, які вводять у вигляді болюсу 0,1 мг/кг з подальшою інфузією приблизно 0,15 мг/кг протягом 60 хвилин. В особливо переважному варіанті здійснення набору, сумарна доза становить приблизно 0,25 мг/кг, яку вводять у вигляді болюсу 0,1 мг/кг з подальшою інфузією приблизно 0,15 мг/кг протягом приблизно 60 хвилин. В іншому особливо переважному варіанті здійснення набору тенектеплазу дають в сумарній дозі приблизно 0,25 мг/кг протягом приблизно 60 хвилин, яку вводять у вигляді початкового болюсу 0,1 мг/кг протягом 1 хвилини з подальшою інфузією приблизно 0,15 мг/кг після перерви тривалістю 60 хвилин. В іншому варіанті здійснення набору сумарна доза вводиться тільки у вигляді болюсу. Набори тут переважно додатково містять контейнер, який містить другий лікарський засіб, причому інструкції включають інструкції із застосування другого лікарського засобу в комбінації з тенектеплазою для лікування ішемічного інсульту у людини за допомогою введення людині ефективної кількості другого лікарського засобу. Переважним другим лікарським засобом є нейропротектор, тромболітик, антагоніст глікопротеїну IIb/ІIIа або антитіла до CD18. Короткий опис креслень Фігура 1 показує середні передбачені на моделях концентрації ACTIVASE (алтеплази) після введення 0,9 мг/кг у вигляді 10%-го болюсу протя 97486 12 гом 1 хвилини і 90% протягом іншої години. Представлені результати моделювання на групі з 1000 суб'єктів. Демографічні дані були основані на характеристиках, що спостерігаються в попередньому дослідженні інсульту AIS. Фігура 2 показує передбачені на моделях фармакокінетичні (ФК) профілі, отримані внаслідок моделювання на 1000 суб'єктів, що порівнюють середні передбачені на моделях концентрації алтеплази (ACTIVASE) і передбачені на моделях середні величини для тенектеплази (TNK), 5% і 95% концентрації від 0,25 мг/кг при режимі болюсінфузія. Моделювання було основане на ТNKазі, що вводиться в дозі 0,25 мг/кг у вигляді болюсу 0,1 мг/кг протягом 1 хвилини, і інфузії 0,15 мг/кг протягом години. 5%-а TNK є найбільш низько розташованою (і суцільною) лінією на графіку, середня для TNK представлена пунктирною лінією, розташованою близько до середньої лінії для Activase (активази), і 95%-а TNK представлена найбільш високо розташованою переривчастою лінією. Середня передбачена на моделі концентрація алтеплази основана на 0,9 мг/кг (максимальне 90 мг/кг) у вигляді 10%-го болюсу і 90% протягом години (середня для Activase представлена суцільною лінією, яка виходить на плато і потім знижується через 60 хвилин). Фігура 3 показує передбачені на моделях ФК профілі, отримані при моделюванні на 1000 суб'єктів, що порівнюють середні передбачені на моделях концентрації алтеплази (ACTIVASE) для режиму болюс-інфузія і передбачені на моделях середні величини для тенектеплази (TNK), 5% і 95% концентрації від 0,25 мг/кг при режимі тільки болюс. 5%-а TNK є більш низько розташованою (і суцільною) лінією на графіку, середня для TNK представлена пунктирною лінією, розташованою вище середній лінії для Activase, і 95%-а TNK представлена найбільш високо розташованою переривчастою лінією. Середня передбачена на моделі концентрація алтеплази основана на 0,9 мг/кг (максимально 90 мг/кг) у вигляді 10%-го болюсу і 90% протягом години (середня для Activase представлена суцільною лінією, яка виходить на плато і потім знижується через 60 хвилин). Докладний опис переважних варіантів здійснення А. Визначення «Інсульт» визначений в даному описі як неврологічний дефіцит, викликаний цереброваскулярною катастрофою (ЦВК), яка порушує кровопостачання мозку протягом щонайменше 24 годин. Інсульт може приймати різні форми, включаючи геморагічний інсульт і ішемічний інсульт, де кожна форма може мати додаткові підрозділи. Таким чином, наприклад, геморагічний інсульт може характеризуватися раптовим розвитком неврологічного дефіциту з ВМК або субарахноїдальним крововиливом (САК), в той час як підтипи ішемічного інсульту включають лакунарний, тромбоемболічний і кардіоемболічний інсульти. Термін «інсульт» застосовується тут в найбільш широкому значенні і включає всі форми інсульту, незалежно від того, перераховані вони тут чи ні. 13 «Транзиторна ішемічна атака» або «ТІА» визначається тут як тимчасове порушення кровопостачання мозку, яке повністю відновлюється через 24 години і звичайно триває хвилини і до години. «Гострий ішемічний інсульт» визначається тут як гострий розвиток місцевого або глобального порушення функції мозку внаслідок тромбоемболії, що триває більш ніж 24 години, або що приводить до смерті. Гострий місцевий ішемічний інсульт являє собою пошкодження мозку, викликане перервою в кровопостачанні в його ділянки. Гострий ішемічний інсульт, що є в даному описі об'єктом інтересу, звичайно викликається обструкцією будь-якої однієї або множини артерій, включаючи головні артерії мозку (наприклад, середню мозкову артерію, передню мозкову артерію, задню мозкову артерію, внутрішню сонну артерію, хребетну артерію або базилярну артерію), і вторинні артерії або артеріоли. «Артеріальна обструкція», як правило, являє собою єдиний ембол або тромб або множину частинок згустка, які закупорюють основні або вторинні артерії або артеріоли. Термін «внутрішношлуночковий крововилив» або «ВШК» застосовується для позначення кровотечі всередині або навколо шлуночків мозку. ВШК часто поділяється на чотири ступеня: ступінь 1: кровотеча відбувається на маленькій площі шлуночків; ступінь 2: кровотеча також відбувається всередині шлуночків; ступінь 3: шлуночки заповнені кров'ю; ступінь 4: кровотеча розповсюджується на речовину мозку навколо шлуночків. «Підвищення мозкового кровотоку або зменшення розміру інфаркту» означає процес поліпшення клінічного виходу за допомогою включення статистично або фізіологічно значущого підвищення мозкового кровотоку і/або статистично або фізіологічно значущого зменшення розміру інфаркту у ссавців, що отримували лікування, в порівнянні з ссавцями, що не отримували лікування, що визначається із застосуванням методів, які добре відомі в даній галузі, таких як візуалізація судин. Переважно мозковий кровоток, як визначається через 2-4 години після введення антагоніста, підвищується, щонайменше, на 30% і переважно, щонайменше, на 50% відносно ссавця, що не отримував лікування. Бажано, щоб розмір інфаркту, що вимірюється через 48 годин після введення антагоніста, меншав на 20% і переважно на 50% в порівнянні з ссавцем, що не отримував лікування. «Інфаркт» являє собою зону некрозу в тканині або органі, наприклад, серці або мозку, яка виникає внаслідок обструкції місцевої циркуляції тромбом або емболом. Розмір інфаркту може бути виміряний із застосуванням відомих способів. «Інфаркт-пов'язана артерія» являє собою артерію, яка, коли вона, щонайменше, частково блокується тромбом або емболом, приводить до утворення інфаркту тканини або органу, наприклад, серця або мозку. «Лікування» стосується і терапевтичного лікування, і профілактичних і превентивних заходів. Потребуючі лікування суб'єкти включають тих, хто вже має порушення, так само, як і тих, кому необхідно запобігти розвитку порушення. Переважним тут є лікування тих індивідуумів, у яких був діагно 97486 14 стований інсульт, зокрема, гострий ішемічний інсульт. Термін «тенектеплаза», що застосовується тут, також відомий під торговою маркою TNK-tPA або TNKASE варіант активатора тканинного плазміногена, стосується варіанту tPA, позначеного як T103N, N117Q, K296А, Н297А, R298A, R299A tPA, доступного в Genentech, Inc. (South San Francisco СА), в якому Thr103 tPA дикого типу замінений на Asn (T103N), Asnl17 tPA дикого типу замінений на Gln (Nl17Q) і Lys-His-Arg-Arg (SEQ ID NO: 1) замінені на Ala-Ala-Ala-Ala (SEQ ID NO: 2) (KHRR296299AAAA). Див. розділ рівень техніки в даному описі і патент США № 5612029. Термін «листівка-вкладиш в упаковці» застосовується відносно інструкцій, що звичайно вкладаються в промислові упаковки терапевтичних продуктів, які містять інформацію про свідчення, застосування, дози, введення, протипоказання, поєднання упакованого продукту з іншими терапевтичними продуктами і/або ускладненнях, що стосуються застосування таких терапевтичних продуктів, і т.д. «Лікарський засіб» являє собою активні ліки для лікування інсульту або його симптомів або побічних ефектів. «Другий лікарський засіб» являє собою засіб, який може бути доданий як допоміжний до першого лікарського засобу, тенектеплази, для лікування інсульту. Приклади такого другого лікарського засобу включають, без обмеження, аспірин, молекулу міжклітинної адгезії (ІСАМ)-І і антагоністи LFA-I, включаючи антитіла, такі як енлімомаб (моноклональне антитіло до ІСАМ-1) і антитіла до CD18 і CD11а, антилейкоцитарні антитіла людини, такі як Hu23F2G, антагоністи глікопротеїну IIb/ІIIа, такі як ептифібатид (INTEGRELIN) (циклічний гептапептид для внутрішньовенного введення, який вибірково блокує глікопротеїновий рецептор тромбоцитів IIb/ІIIа), прямі інгібітори тромбіну, зовнішній або місцевий ультразвук, механічне витягання або розчинення тромбу, фібринолітичні засоби, засоби, що поліпшують загоєння нейрональних пошкоджень, такі як основний фактор росту фібробластів (наприклад, FIBLAST), нейропротективні засоби, такі як цитиколін, магній, налмефен, дизосилпін, німодипін, ламотриджин, сипатриджин, лубелузол, мексилетин, клометіазол, блокатори кальцієвих і натрієвих каналів, антгагоністи бетааміно-3-гідрокси-5-метилізоксазол-4-пропіонової кислоти, агоністи серотоніну, модулятори трансмембранних калієвих каналів, засоби, які інгібують активацію астроцитів (наприклад, ΟΝΟ 2506), антиоксиданти (наприклад, МСІ-186), антиадгезивні моноклональні антитіла і антагоністи і антитіла, що інгібують агрегацію тромбоцитів, такі як аргатробан і абциксимаб (REOPRO), фенітоїн, оксиди азоту, протектори ЦНС, блокатори вільних радикалів, такі як тирилазад, реакційноспроможні метаболіти кисню і антиоксиданти і інші тромболітичні засоби, що не є тенектеплазою, як визначено нижче, такі як, наприклад, ацилований плазміноген-стрептокіназний активаторний комплекс (APSAC), одноланцюжковий урокіназаплазміногенний активатор (scu-PA), подібні до 15 тромбіну ферменти з отрути змій, такі як анкрод (переважно для внутрішньовенного введення, засіб, що знижує рівень фібриногену, отриманий з отрути малайського щитомордника), стрептокіназа (наприклад, SAKSTAR), урокіназа, анистреплаза, алтеплаза, саруплаза, ретеплаза, ланотеплаза (SUN-9216; Genetics Institute Inc.), плазмін, розгалужена форма плазміна (мікроплазмін; ThromboGenics Ltd), тромболітики прямої дії з непов'язаною з тромболітичними властивостями нейропротективною активністю, рекомбінантний активатор плазміногена з слинної залози desmodus rotundus (rDSPA) альфа-1 (Schering/Teijin Pharmaceuticals), мутантний активований фібрином плазміноген людини (ВВ 10153; British Biotech Inc.), стафілокіназа, фібролаза, проурокіназа (для внутрішньоартеріального введення прямо в М1 або М2 артеріальний тромб), монтеплаза (модифікований rtPA), памітеплаза, тизокіназа і активатор плазміногена летючої миші-вампіра, засіб, поліпшуючий функцію астроцитів, такий як засіб, розкритий в US 2004/0176347, засіб на основі спинової пастки, такий як NXY-059 (серовив), клопідогрель, блокатор рецепторів н-метилдекстро-аспарагінової кислоти, протисудомний засіб, інгібітор каспази 3, ((трет-бутиліміно)метил) 1,3 (бензендисульфонат динатрію N-оксид), ебселен, глутатіонпероксидаза, норфеназон, ровелізумаб, тактацистину бета-лактон, цукубаенолід, 4фосфонометилпіпеколінова кислота, еліпродил, антитіла до гангліозиду GM1 і біологічно активні варіанти, солі і похідні будь-якої з вищеперелічених сполук. «Тромболітичний засіб» являє собою молекулу, яка руйнує і/або розчиняє тромб. Зразкові тромболітичні засоби включають стрептокіназу, ацилований плазміноген-стрептокіназний активаторний комплекс (APSAC), урокіназу, одноланцюжковий урокіназа-плазміногенний активатор (scu-PA), подібні до тромбіну ферменти з отрути змій, такі як анкрод (Bell, W. "Defibrinogenating enzymes" In Colman et al., (eds): Hemostasis and Thrombosis Lippincott, Philadelphia (1987) p. 886), tPA і біологічно активні варіанти кожного з описаних вище засобів. Придатні тромболітики, які можуть бути застосовані в цьому винаході, розкриті, наприклад, в патентах США №№ 5770425; 5770426; 5612029; 5520911; 5736134; 5728567; 5714145; 5840564; 5616486; 5411871; 5520913; 5262170; і 5108901. Термін «спільне введення» або «спільне застосування», що застосовується тут, означає введення другого лікарського засобу під час ефективного терапевтичного вікна для тенектеплази, що вводиться окремо. Таким чином, другий лікарський засіб може вводитися до, одночасно або після тенектеплази. В залежності від типу другого лікарського засобу, введення другого лікарського засобу, такого як антитіло до CD18, переважно починають в інтервалі часу від приблизно 1 години до початку введення тенектеплази до безпосередньо перед початком введення (1-15 хвилин), більш переважно, одночасно з початком введення. Спільне введення також включає в себе введення другого лікарського засобу після початку введення 97486 16 тенектеплази, наприклад, від приблизно 15-30 хвилин до приблизно 3 годин після введення тенектеплази. Спільне введення включає введення в формі єдиного складу, в якому два лікарських засоби можуть, але не повинні, бути фізично відділені один від іншого. «Ефективне терапевтичне вікно» для тенектеплази, введеної окремо, означає період часу, наступний після інфаркту, викликаного блокуванням артерії, протягом якого тенектеплаза, коли вона вводиться без інших засобів, ефективна для відновлення кровотоку в артерії, в порівнянні з контрольною групою, не одержуючою тенектеплазу. Ефективне терапевтичне вікно для тенектеплази є видоспецифічним, але може бути з легкістю визначено за допомогою стандартних тестів, що оцінюють ефективність тенектеплази в порівнянні з контролем. Термін «антитіло до CD18», коли він застосовується в даному описі, стосується антитіла, яке зв'язує CD18 (переважно CD18 людини) і інгібує або істотно знижує біологічну активність CD18. У нормі антитіло буде блокувати (частково або повністю) здатність клітини (наприклад, нейтрофіла), експресувати субодиницю CD18 на своїй поверхні для зв'язування з ендотелієм. Приклади антитіл до CD18 включають МНМ23 (Hildreth et al. (1983)); М18/2 (IgG23; Sanches-Madrid et al., Eur. J. Immunol. 13(3):202-208 (1983)); H52 (American Type Culture Collection (ATCC) Deposit HB 10160); Mas 191c і ІОТ18 (Vermot Desroches et al., Scand. J. Immunol. 33(3):277-286 (1991)); і NA-8 (WO 94/12214). Переважне антитіло являє собою антитіло, яке зв'язує епітоп CD18, з яким зв'язується або МНМ23 або Н52. Переважно антитіло має високу афінність до поліпептиду CD18. У переважному варіанті здійснення антитіло має афінність до антигену CD18 приблизно 4 нМ або менше. Переважно, афінність становить приблизно 3 нМ або менш і найбільш переважно приблизно 1 нМ або менше. У деяких варіантах здійснення антитіло може зв'язуватися з ділянкою у позаклітинному домені CD18, який асоційований з CD11b, і антитіло може також дисоціювати на альфа і бета ланцюгу (наприклад, антитіло може викликати дисоціацію комплексу CD11b і CD18, як у випадку антитіла МНМ23). II. Способи здійснення винаходу Крім раннього втручання, результат лікування інсульту із застосуванням тромболітичних агентів, таких як тенектеплаза, і виживаність і відновлення пацієнтів з інсультами після лікування тісно пов'язано з тим, яким чином проводиться тромболітична терапія. Даний винахід надає поліпшений протокол лікування інсульту, зокрема, гострого ішемічного інсульту, із застосуванням тенектеплази. Протоколи лікування і режими дозування згідно з даним винаходом мають результатом такі фармакокінетичні профілі, які забезпечують максимальну ефективність і безпеку, і, отже, представляють значний прогрес в тромболітичній терапії інсульту. В одному аспекті винахід надає спосіб лікування гострого ішемічного інсульту у людини, що включає введення людині тенектеплази в сумарній 17 дозі приблизно від 0,05 до 0,15 мг/кг (переважно від приблизно 0,2 до 0,3 мг/кг, і, більш переважно, приблизно 0,25 мг/кг), яка дається у вигляді початкової дози від приблизно 0,015 до 0,15 мг/кг болюсно (переважно від приблизно 0,08 до 0,12 мг/кг болюсно, більш переважно приблизно 0,1 мг/кг болюсно), з подальшою інфузією кількості сумарної дози, що залишилася від приблизно 0,05 до 0,5 мг/кг (переважно від приблизно 0,2 до 0,3 мг/кг, більш переважно приблизно 0,25 мг/кг) протягом періоду часу приблизно 50-90 хвилин, більш переважно приблизно 55-70 хвилин, і, найбільш переважно, приблизно 60 хвилин. Наприклад, якщо загальна доза становить приблизно 0,25 мг/кг тенектеплази, тоді початкова болюсна доза становить переважно приблизно 0,1 мг/кг, і подальша інфузія проводиться в дозі приблизно 0,15 мг/кг. Виходячи з результатів сучасних експериментів, це найбільш переважний режим, при якому подальша інфузія проводиться протягом приблизно 60 хвилин. Помічено, однак, що найбільш переважний режим дозування може варіювати в межах точно позначеного діапазону доз, в залежності від різних чинників, включаючи конкретний тип і об'єм інсульту, стан пацієнта, час, що пройшов з початку інсульту і тому подібне. Інфузія тенектеплази може йти безпосередньо після завершення введення болюсної дози або може бути відділена від закінчення введення болюсної дози інтервалом часу аж до 30 хвилин, але переважним є початок інфузії відразу після завершення введення болюсної дози. Переважно, болюсна ін'єкція є внутрішньовенною, але вона може вводитися іншим способом, наприклад, внутрішньоартеріально. Переважно, інфузія продовжується внутрішньовенно, внутрішньом'язово, внутрішньоперитонеально, всередину спиномозкового каналу, підшкірно, всередину суглоба, інтрасиновіально або внутрішньотрахеально, але переважним способом інфузії є внутрішньовенне введення. В альтернативному аспекті, гострий ішемічний інсульт у людини лікують за допомогою введення тенектеплази в сумарній дозі від приблизно 0,05 до 0,15 мг/кг, переважно від приблизно 0,2 до 0,3 мг/кг, більш переважно приблизно 0,25 мг/кг, що даються виключно у вигляді болюсу. Переважно, болюс є внутрішньовенним. Інсульт являє собою серйозний стан і третю ведучу причину смерті в Сполучених Штатах. Оскільки смертність і міра відновлення залежать від швидкості діагностики і втручання, в способах даного винаходу розглядається, що тенектеплаза буде вводитися пацієнту так скоро, як це можливо, з моменту, коли був діагностований стан гострого ішемічного інсульту або запідозрений гострий дефіцит при неврологічному обстеженні. Початкові клінічні симптоми гострого ішемічного інсульту звичайно включають один або більше із (1) зміни свідомості, такі як ступор або кома, плутаність свідомості або збудження, втрата пам'яті, епінапад і/або делірий; (2) головний біль, який є інтенсивним або надзвичайно важким, асоційований зі зниженим рівнем свідомості/неврологічним дефіцитом і/або включає в себе незвичайний/важкий біль в шиї або обличчі; (3) 97486 18 афазія (незв'язне мовлення або складність розуміння мови); (4) слабість або асиметрія обличчя; (5) втрата координації, слабість, параліч або втрата чутливості однієї або більше кінцівок; (6) атаксія (порушення стійкості, незручність або трудність ходьби); (7) втрата зору; і (8) інтенсивне запаморочення, двоїння в очах, одностороння втрата чутливості, нудота, блювання і/або світлобоязнь. Наявність одного або більше з цих виявів може бути початковою ознакою гострого ішемічного інсульту, яка може бути верифікована шляхом подальшого диференціально-діагностичного і неврологічного обстеження. Неврологічне обстеження і, додатково, методи нейровізуалізації, такі як комп'ютерна томографія (КТ) (включаючи КТ без контрастного посилення і перфузійну КТ) і магнітно-резонансна томографія (МРТ) (включаючи дифузійно-зважену візуалізацію (ДВВ) і перфузійну візуалізацію (ПВ)); візуалізація судин (наприклад, дуплексне сканування і транскраніальний Доплерівський ультразвук і лазерний Доплер); і ангіографія (наприклад, комп'ютеризована цифрова субтракційна ангіографія (ЦСА) і МР-ангіографія), так само, як і інші інвазивні або неінвазивні методи, доступні для діагностики гострого ішемічного інсульту. Існує декілька шкал, придатних для оцінки міри тяжкості інсульту. Вони включають індекс Бартела (Mahoney and Barthel, Maryland State Medical Journal, 14: 56-61 (1965)), модифіковану шкалу Ранкіна (Rankin, Scot. Med., J. 2: 200-215 (1957); van Swieten et al., Stroke, 19: 604-607 (1988); Duncan et al., Stroke, 31: 1429-1438 (2000)), шкалу Глазго (Jennett and Bond, Lancet, 1(7905): 480-4 (1975); Teasdale, J. Neuro. Neurosurg. Psychiatry, 41: 603-610 (1978); Jennett et al., Lancet, 1: 480-484 (1995)) і шкалу інсульту Національного інституту здоров'я (NIHSS) (Brott et al., Stroke, 20: 864-870 (1989)). Способи даного винаходу придатні для лікування гострого ішемічного інсульту всіх мір тяжкості. Переважно тенектеплаза в даному описі буде вводитися в дозах і режимах дозування щонайменше один раз в будь-який момент протягом 24 годин, наступних відразу після початку інсульту. У деяких варіантах здійснення тенектеплаза спочатку вводиться пацієнту в інтервалі часу від приблизно 15 хвилин (або приблизно 30 або 45 хвилин) до приблизно 20 годин (більш переважно приблизно 10 годин, або приблизно 6 годин, або 3 години, або приблизно 90 хвилин або приблизно 60 хвилин) від початку інсульту. У конкретному варіанті здійснення пацієнт, що поступив протягом 3 годин від появи ознак і симптомів, відповідних гострому ішемічному інсульту, зазнає тромболітичної терапії тенектеплазою відповідно до даного винаходу. У способі в даному описі пацієнту може вводитися разом з тенектеплазою ефективна кількість другого лікарського засобу (де тенектеплаза є першим лікарським засобом). Другий лікарський засіб може являти собою один або більше лікарських засобів і може включати, наприклад, засоби, перераховані вище. Такі переважні лікарські засоби включають нейропротективні засоби, протисудомні засоби, засоби на основі спинової пастки, молеку 19 ли міжклітинної адгезії (ІСАМ)-І і антагоністи LFA-I, такі як антитіла до CD11a і CD18, антагоністи глікопротеїну IIb/ІIIа, засоби, прискорюючі загоєння пошкоджень нейронів, антитіла, інгібуючі агрегацію і адгезію тромбоцитів, і людські антилейкоцитарні антитіла або інші тромболітичні засоби, що не є тенектеплазою. Більш переважними є нейропротективні засоби, інші тромболітичні засоби, антагоністи глікопротеїнів IIb/ІIIа і антитіла до CD18. Ці другі лікарські засоби, як правило, застосовуються в тих же дозах і вводяться такими ж шляхами, як ті, що застосовуються вище в даному описі, або приблизно від 1 до 99% від доз, що застосовувалися до цього часу. Якщо такі другі лікарські засоби взагалі застосовуються, то, переважно, вони застосовуються в більш низьких дозах, ніж якщо тенектеплаза не присутня, особливо дози, наступні за початковою дозою, що вводиться разом з тенектеплазою, з метою усунути або зменшити побічні ефекти, викликані терапією. Якщо другий лікарський засіб вводиться в ефективній кількості з болюсною дозою тенектеплази, він може вводитися з будь-якою такою дозою, наприклад, тільки з однією такою дозою або з більш ніж однією такою дозою. В одному варіанті здійснення другий лікарський засіб вводиться з початковою болюсною дозою. В іншому варіанті здійснення другий лікарський засіб вводиться з першою і другою дозою. У ще одному додатковому варіанті здійснення другий лікарський засіб вводиться з всіма дозами тенектеплази. Поєднане введення включає спільне введення (одночасне введення) із застосуванням окремих складів або єдиного фармацевтичного складу і послідовне введення в будь-якому порядку, при якому переважно існує період часу, коли обидва (або всі) активні засоби одночасно виявляють свою біологічну активність. Переважно, щоб після початкової експозиції кількість такого засобу знижувалася або елімінувалася, таким чином, щоб знизити час дії на суб'єкта засобу з побічними ефектами, такого як преднізон і циклофосфамід. Крім того, пристрій, такий як пристрій INTERCOOL і/або застосування льоду зовні при 33°С або такій же температурі, може бути використано разом з тенектеплазою для лікування інсульту. Терапевтичні склади тенектеплази отримують для зберігання за допомогою змішування тенектеплази, що має необхідну міру чистоти, з додатковими фізіологічно прийнятними носіями, наповнювачами або стабілізаторами (Remington's Pharmaceutical Sciences 16th edition, Osol, A. Ed. (1980)), в формі ліофілізованих складів або водних розчинів. Прийнятні носії, наповнювачі або стабілізатори є нетоксичними для реципієнтів в дозах і концентраціях, що застосовуються, і включають буфери, такі як фосфатний, цитратний і інших органічних кислот; антиоксиданти, включаючи аскорбінову кислоту; низькомолекулярні (менше, ніж приблизно 10 залишків) поліпептиди; білки, такі як сироватковий альбумін, желатин або імуноглобуліни; амінокислоти, такі як гліцин, глутамін, аспарагін, гістидин, аргінін або лізин; моносахариди, дисахариди і інші вуглеводи, включаючи глюкозу, 97486 20 манозу, трегалозу або декстрини; хелатуючі агенти, такі як ЕДТА; спирти з цукру, такі як маніт або сорбіт; солеутворювальні протиіони, такі як натрій; і/або неіоногенні поверхнево-активні речовини, такі як TWEEN, PLURONICS або PEG. Активні інгредієнти можуть також бути включені в мікрокапсули, отримані, наприклад, за допомогою методів коацервації або за допомогою міжфазної полімеризації, наприклад, гідроксиметилцелюлозні або желатинові мікрокапсули і поли-(метилметакрилат)ні мікрокапсули, відповідно, в системи доставки колоїдних лікарських препаратів (наприклад, ліпосоми, альбумінові мікросфери, мікроемульсії, наночастинки і нанокапсули) або в макроемульсії. Такі методи розкриті в Remington's Pharmaceutical Sciences 16th edition, Osol, A. Ed. (1980). Склади, що застосовуються для введення in vivo, повинні бути стерильні. Це з легкістю виконується за допомогою фільтрації через стерильні фільтруючі мембрани, з попередньою або подальшою ліофілізацією і відновленням. Можуть застосовуватися засоби з уповільненим вивільненням. Придатні приклади засобів з уповільненим вивільненням включають напівпроникні матриці з твердих гідрофобних полімерів, що містять тенектеплазу, які мають вигляд профільованих виробів, наприклад, плівок або мікрокапсул. Приклади матриць для уповільненого вивільнення включають поліефіри, гідрогелі (наприклад, полі(2гідроксіетил-метакрилат) або полівініловий спирт, полілактиди (патент США № 3773919). співполімери L-глютамінової кислоти і етил-L-глутамату, недеградований етилен-вінілацетат, деградовані співполімери молочної і гліколевої кислот, такі як LUPRON DEPOT (мікросфери для ін'єкцій, складені із співполімера молочної і гліколевої кислот і леупроліда ацетату) і полі-D-(-)-3-гідроксимасляну кислоту. В той час як полімери, такі як полімер етилен-вінілацетату і молочної і гліколевої кислот, роблять можливим вивільнення молекул протягом 100 днів, деякі гідрогелі вивільняють білки протягом більш короткого періоду часу. Коли інкапсульовані антитіла залишаються в організмі протягом тривалого часу, вони можуть денатурувати або агрегувати внаслідок впливу рідини при 37°С, що приведе до втрати біологічної активності і можливих змін в імуногенності. Раціональні стратегії можуть бути розроблені для стабілізації в залежності від механізму, що використовується. Наприклад, якщо виявлено, що механізмом агрегації є утворення міжмолекулярного S-S зв'язку за допомогою тіо-дисульфідної заміни, стабілізація може бути досягнута шляхом модифікації сульфгідрильних залишків, ліофілізації з кислих розчинів, контролю рівня вологості, застосування відповідних добавок і розробки специфічних полімерних матриксних композицій. Композиції тенектеплази з уповільненим вивільненням також включають тенектеплазу, укладену в ліпосоми. Ліпосоми, що містять тенектеплазу, отримують за допомогою способів, відомих в даній галузі, таких, як описано в Epstein et al., Proc. Natl. Acad. ScL USA, 82: 3688 (1985); Hwang et al., Proc. Natl Acad. ScL USA, 77: 4030 (1980); і Патенти 21 США N№ 4485045 і 4544545. Як правило, ліпосоми маленькі (приблизно 200-800 ангрстрем), одношарового типу, в яких рідкий вміст має більш ніж приблизно 30 молярних % холестерину, причому вибрана пропорція адаптована для оптимальної терапії тенектеплазою. Ліпосоми з підвищеним часом циркуляції розкриті в патенті США № 5013556. Точна сумарна доза тенектеплази, що застосовується і співвідношення доз тенектеплази в болюсі і інфузії, або чи потрібно використати тільки болюсне введення, буде залежати, наприклад, від точної природи інсульту, з приводу якого провестися лікування, тяжкість і течія інсульту, чи вводиться тенектеплаза в профілактичних або терапевтичних цілях, попередній терапії, історії хвороби пацієнта і відповіді на тенектеплазу і рішення лікуючого лікаря. Прогрес при цій терапії легко можна спостерігати із застосуванням загальноприйнятих методів і досліджень, представлених в деталях в даному описі. В іншому варіанті здійснення винаходу, надаються готові вироби і набори, що містять матеріали, придатні для поліпшення клінічних результатів при інсульті. Готовий виріб включає в себе контейнер з етикеткою. Придатні контейнери включають, наприклад, пляшки, флакони і пробірки. Контейнери можуть бути зроблені з різних матеріалів, таких як скло або пластик. Контейнер зберігає композицію, яка ефективна для лікування інсульту, як визначено в даному описі, і може мати стерильний отвір для доступу (наприклад, контейнер може являти собою пакет для внутрішньовенного введення або флакон, що має пробку, яка піддається проколюванню голкою для підшкірних ін'єкцій). Активною речовиною в композиції є тенектеплаза. Етикетка на контейнері показує, що композиція застосовується для лікування інсульту, як описано вище, і може також визначати свідчення для застосування in vivo, таке, як описане вище. Зокрема, в одному варіанті здійснення, набір містить контейнер, що містить тенектеплазу, і інструкції із застосування тенектеплази для лікування гострого ішемічного інсульту у людини за допомогою введення тенектеплази людині в сумарній дозі від приблизно 0,05 до 0,5 мг/кг, що дається як (а) початкова болюсна доза, що становить від приблизно 0,015 до 0,15 мг/кг, з подальшою інфузією кількості, що дорівнює сумарній дозі мінус початкова доза протягом періоду часу приблизно 50-90 хвилин, або (b) болюс. Переважно, сумарна доза становить від приблизно 0,2 до 0,3 мг/кг, більш переважно приблизно 0,25 мг/кг, і початкова доза по варіанту (а), описаному вище, становить від приблизно 0,08 до 0,12 мг/кг, більш переважно приблизно 0,1 мг/кг. В одному варіанті здійснення набору, сумарна доза дається у вигляді початкового болюсу з подальшою інфузією. У переважному варіанті здійснення, сумарна доза становить приблизно 0,25 мг/кг, що дається у вигляді початкової дози приблизно 0,1 мг/кг болюсно, з подальшою інфузією приблизно 0,15 мг/кг протягом 60 хвилин. В іншому варіанті здійснення набору, сумарна доза дається у вигляді болюсу. 97486 22 Ці набори можуть також додатково включати в себе контейнер, що містить другий лікарський засіб, де інструкції включають вказівки по застосуванню другого лікарського засобу в комбінації з тенектеплазою для лікування ішемічного інсульту у людини за допомогою введення людині ефективної кількості другого лікарського засобу. Зразкові другі лікарські засоби і переважні другі лікарські засоби перераховані вище. Набори за даним винаходом можуть також містити інший контейнер, що містить фармацевтично прийнятний буфер, такий як фосфатнобуферний розчин, розчин Рінгера і розчин декстрози. Він може додатково включати інші матеріали, бажанo з точки зору торгівлі і споживача, включаючи інші буфери, розріджувачі, фільтри, голки, шприци і листівки-вкладиші в упаковку з інструкціями із застосування. Наведений нижче приклад пропонується як ілюстрація і не в порядку обмеження. Розкриття всіх цитувань в описі однозначно включені в даному описі як посилання. Приклад Визначення режиму дозування тенектеплази для лікування гострого ішемічного інсульту Стратегія дозування, яка підвищує безпеку і ефективність лікування ГІІ тенектеплазою, була розроблена за допомогою виконання ФК (фармакокінетичного) моделювання. Було встановлено, що результати ефективності тромболітиків пов'язані з дозою і концентрацією і для ACTIVASE (алтеплази) (Gulba et al. J. Am. Coll. Cardiol, 30/7 1611-1617 (1997); Tanswell et al.., J. Am. Coll. Cardiol, 19/5 1071-1075 (1992)), і для ТNKази (тенектеплази) (Wang-Clow et al., Am. Heart J., 141/1 33-40 (2001); Tanswell et al., Clin. Pharmacokinet, 41/15 1229-45 (2002)). Ці спостереження підтверджували, що ФК підхід для вибору доз тромболітиків є доцільним. Більш того аналіз in-vivo дослідження ФК і фармакодинаміки (ФД) із застосуванням ФК на кролику, підтвердили, що алтеплаза і ТNKаза мали приблизно рівну силу, при порівнянні площі під кривою (AUC) і часу 50%го лізису згустку (Thomas et al., Stroke, 25/10 20722078 (1994)). Це було також визначено з клінічного дослідження ТІМІ10В пацієнтів з ГІМ, які зазнавали лікування алтеплазою і ТNKазою, в якому було виявлено, що однаковими є не тільки показники ефективності і безпеки, але також концентрації алтеплази і ТNKази в ключові моменти часу 30 хвилин і 90 хвилин при лікуванні. Ці моменти часу були важливими, оскільки вони відмічали зміни в швидкості інфузії і закінчення інфузії алтеплази, відповідно (Modi et al., J. Clin. Pharm., 40/5: 508515 (2000)). Виходячи з цього був зроблений висновок, що режим дозування ТNKази, який повторює часовий профіль концентрацій, так само, як і вплив алтеплази протягом періоду лікування (0-60 хвилин) буде приводити до однакової ефективності і потенційно підвищеної безпеки при ГІІ, внаслідок відношень між концентрацією ліків і відповіддю і за рахунок однакової ефективності при однакових концентраціях. Відповідно, ФК моделювання здійснювалося із застосуванням архівних ФК даних для алтеплази 23 97486 при гострому інфаркті міокарда (ГІМ), так само, як і даних для ТNKази при ГІМ і інсульті, для надання відповідної дози ТNKази для гострого ішемічного інсульту. На основі ФК моделювання доза 0,25 мг/кг, що дається у вигляді початкового болюсу 0,1 мг/кг, з подальшою інфузією 0,15 мг/кг протягом 60 хвилин, була переважним режимом. Болюс 0,25 мг/кг був другим варіантом дозування ТNKази в стратегії дозування при ГІІ. Режими дозування ТNKази були отримані із застосуванням підходу моделювання і симуляції, призначених для узагальнення часових профілів впливу і концентрації алтеплази під час періоду лікування, асоційованого з USPI-дозою 0,9 мг/кг (10% болюсно протягом 1 хвилини і 90% протягом часу, що залишився до години). Це вимагає побудови структурної моделі і моделей помилок для алтеплази (ФК моделі), основаної на опублікованих параметрах ФК і концентраціях, і створення ФК моделі популяції для ТNKази на основі внутрішніх даних по ГІМ і ГІІ. Всі розрахунки виконувалися із застосуванням програмного пакету для моделювання NONMEM Версії 5 (Beal, Boeckman, and Sheiner NONMEM user's guide, 1988-1992. 1992. San Francisco, CA, University of California at San Francisco). Алтеплаза була описана як наступні двох- і трьохкомпонентні фармакокінетики (Seifried et al., Thrombosis & Haemostasis, 61/3: 497-501 (1989); Tanswell et al., Arzneimittelforschung, 41/12: 1310-19 (1991); Tanswell et al., Clin. Pharmacol. Ther., 46/2: 155-62 (1989); Tanswell et al., J. Amer. College of Cardiology. 19/5: 1071-75 (1992); Tebbe et al., The American Journal of Cardiology, 64/8: 448-53 (1989)). Двохкомпонентна модель була вибрана, оскільки вона була описана в літературі найбільш недавно, і з більш часто застосовуваним режимом дозування з фронтальним навантаженням (Neuhaus et al., J. Am. Coll. Cardiol., 19/5: 885-891 (1992)). Також застосовувалися такі параметри ФК, як середнє і стандартне відхилення концентрацій на 30 і 90 хвилинах (Tanswell et al., J. Am. Coll. Cardiol., 19/5: 1071-75 (1992)). Оскільки модель була основана на ФК, пов'язаній з режимом дозування алтеплази при ГІМ, параметри ФК розглядали як відповідні приблизні значення для застосування як симулюючі концентрації, які були б досягнуті при USPIдозуванні алтеплази при ГІІ (Genentech). Параметри остаточної фармакокінетичної моделі алтеплази, що застосовуються для симуляцій, зведені в таблиці І. Таблиця І ФК параметри для алтеплази Параметр Типовий кліренс Типовий об'єм К12 К21 Оцінка отриманих на моделі параметрів 518 мл/хв. (23%) 3100 мл (20%) -1 0,0271 хв. (0%) -1 0,0113 хв. (0%) Комп'ютерна модель фармакокінетики ТNKази була отримана із застосуванням даних по концен 24 траціях в сироватці в індивідуальних пацієнтів з дослідження ГІМ ТІМІ10В (Modi et al., supra) і попереднього дослідження ГІІ з підвищенням дози. Комбіновані дані були найбільш добре описані із застосуванням двохкомпонентної моделі. Результати остаточної моделі були зведені в таблиці II. Таблиця II Оцінки фінальної моделі ТNKази (тенектеплази) Оцінка отриманих на моделі параметрів FOCE with INTER 830 9778 106 мл/хв. (3%) 0,377 (24%) -0,200 (40%) 4070 мл (4,7%) -1 0,00249 хв. (13%) -1 0,0102 хв. (8,7%) 18,1 нг/мл (4,9%) 14,7% (28%) 15,4% (47%) 33,3% (22%) 31,5% (1,0%) ~0 мг/мл -1 0,02604 день Параметр Спосіб № концентрації Цільова функція Звичайний кліренс Маса на кліренс Вік на кліренс Звичайний Vc К12 К12 Початковий рівень CL Vc початкового рівня власн. доб. К10 Оскільки ФК-аналіз ТNKази не диференціював ендогенний tPA від введеної ТNKази, початковий параметр був включений в модель для визначення рівнів ендогенного tPA. Маса і вік були включені як незалежні змінні на кліренс (CL), відповідно до формули: CL j CLWTj / 818 0,377 AGE j / 58 , 0,200 CL являє собою популяційну оцінку CL, CLj являє собою індивідуальний CL, WTj являє собою індивідуальну масу із середньою масою 81,8 і AGEj являє собою індивідуальний вік із середнім віком 58. Популяційна ФК модель для ТNKази була потім застосована в оцінці режиму дозування і симуляціях відповідних режимів дозування для ГІІ з метою отримання таких же профілів концентрація-час і часу впливу, які були передбачені для алтеплази. Основою для режимів дозування ТNKази був профіль концентрація-час і час впливу режиму дозування USPI для алтеплази протягом часу впливу 60 хвилин (Фігура 1). Стратегія полягала в застосуванні цього режиму дозування як приблизної мети для дозування ТNKази. Фігура 1 дає можливість передбачити, що 10%-й болюс алтеплази приводить до концентрацій засобу, близьким до плато, з подальшою фактично постійною концентрацією алтеплази протягом інших 60 хвилин. Оцінені на моделі середні рівні концентрацій, отримані через двохвилинні інтервали від 2 до 60 хвилин, були потім використані для розрахунку середньої 25 97486 ефективної концентрації (комп'ютерна програма JMP версії 5.1. 2003) (SAS Institute Inc.) і AUC (площі під кривий). На основі профілю час-концентрація, що спостерігається, перший режим дозування ТNKази для лікування інсульту включав в себе болюс з подальшою постійною інфузією. Необхідна болюсна доза для створення середньої ефективної концентрації була отримана на основі наступноїформули: Болюсна доза Vd Сефектив. де: Vd = об'єм розподілу Сефектив. = середня ефективна концентрація алтеплази Середня ефективна концентрація алтеплази і Vd (об'єм розподілу) ТNKази становили ~1800 нг/мл і 4072 мл, відповідно, що вимагає приблизної болюсної дози ТNKази 0,1047 мг/кг. Вплив алтеплази був визначений як AUC від 0 до 60 хвилин. Доза ТNKази, необхідна для отримання такого ж впливу протягом періоду дозування 60 хвилин, була отримана за допомогою наступної формули: Загальна доза TNKаза AUCактиваза ˆ CL TNKаза де: 26 AUCактиваза = AUC алтеплази протягом 0-60 хвилин періоду впливу ˆ CLTNKаза = кліренс об'єму розподілу ТNKази. AUC алтеплази протягом 60-хвилинного режиму дозування була розрахована по наступній формулі: AUC алтеплази=Сефектив.60 хвилин, де: Сефектив. = середня ефективна концентрація алтеплази від 0 до 60 хвилин Середня ефективна концентрація алтеплази становила приблизно 1800 нг/мл, що приводило до AUC 108000 нг*хв./мл. При кліренсі об'єму розподілу ТNKази 105 мл/хв., загальна доза ТNKази, необхідна для підтримки концентрації і часу впливу, відповідними ефективній концентрації, становила 0,16 мг/кг, що вводяться протягом 1 години. У більшій мірі застосовна клінічно доза 0,1 мг/кг болюсно і 0,15 мг/кг у вигляді інфузії протягом 60 хвилин була визначена виходячи з розрахованої болюсної дози 0,1047 мг/кг і дози 60-хвилинної інфузії 0,16 мг/кг і протестована в 1000-суб'ектній симуляції. Фігура 2 показує, як середня 5%-а і 95%-а концентрації для цього режиму порівнювалися з передбаченими на моделі концентраціями алтеплази. AUC для періоду лікування 0-60 хвилин, періодів після лікування 60-120 хвилин і загальна AUC від 0 до 120 хвилин були розраховані із застосуванням комп'ютерної програми WinNonlin версії 3.0 2001 (WinNonlin) і зведені в таблиці III. Таблиця III Порівняння AUC і концентрацій для ТNKази Режим дозування болюс/інбузія 0,25 мг/кг AUC (0-60) AUC (60-120) AUC (0-120) Алтеплаза AUC* (середня) % AUC 107941 87 15487 13 123428 100 C2 хвилини C30 хвилин C60 хвилин Алтеплаза 1959 1824 1871 0,25 мг/кг ТNKази AUC* (середня) % AUC % алтеплази AUC 111102 66 103 57809 34 376 168911 100 137 Cepедні концентрації 0,25 мг/кг ТNKази 1934 1874 1877 *AUC = Площа під кривою На основі цих результатів доза ТNKази 0,25 мг/кг, введена у вигляді 0,1 мг/кг болюсно протягом 1 хвилини і 0,15 мг/кг протягом часу, що залишився до 1 години, була визначена як приблизний режим дозування для ТNKази при ГІІ. Вважалося, що додаткові режими дозування визначалися, якщо результати могли бути поліпшені. У клінічних дослідженнях, що зводяться до випробування алтеплази при інсульті, кровотеча була виявом токсичності засобу, що обмежує дозу. Однак в літературі з ГІМ передбачалося, що більш високі концентрації тромболітиків можуть поліпшувати лізис згустку. Ці відносини між часом впливу і відповіддю спостерігалися, щонайменше, в двох дослідженнях, в яких алтеплаза вводилася в режимі дозування з фронтальним навантаженням, приводячи до поліпшених результатів при ГІМ (Gulba et al., supra; Neuhaus et al., supra). Оскільки специфічність до фібрину ТNKази могла теоретично робити можливою більш високі дози з меншим впливом на фібриноген і подальшим ризиком кровотечі, був розглянутий болюсний режим дозуван 27 97486 ня з дозою 0,25 мг/кг. Метою було введення більш високих ранніх доз для поліпшення лізиса згустку (подібний тому, який спостерігався при застосуванні алтеплази при ГІМ) без зміни фібриногени або підвищення ризику кровотечі. Цей болюсний режим також зменшував би час впливу низьких доз в більш пізні моменти часу при режимі дозування болюс-інфузія. Фігура 3 показує середні передбачені на моделі концентрації алтеплази і середні передбачені 28 на моделі концентрації ТNKази, 5%-у і 95%-у концентрації при режимі дозування 0,25 мг/кг. Таблиця IV підсумовує значення AUC і порівнює концентрації в ключові моменти часу. Загалом часові криві впливу і концентрації, що спостерігаються при симуляції 0,25 мг/кг болюсно, підтвердили, що цей режим підходить для введення тільки болюсно. Таблиця IV Порівняння AUC і концентрацій для ТNKази при режимі дозування тільки болюсно 0,25 мг/кг AUC (0-60) AUC (60-120) AUC (0-120) C2 хвилини C30 хвилин C60 хвилин Алтеплаза AUC* (середня) % AUC 107941 87 15487 13 123428 100 Алтеплаза 1959 1824 1871 Таким чином, режими дозування ТNKази болюс-інфузія і тільки болюс для застосування в лікуванні гострого ішемічного інсульту були визначені із застосуванням фармакокінетичного моделювання і симуляції. Ці режими дозування були пристосовані для забезпечення підвищеної безпеки і ефективності для тенектеплази в порівнянні з алтеплазою, при введенні пацієнтам з ГІІ. Оскільки винахід був з необхідністю описаний в зв'язку з переважними варіантами здійснення і 0,25 мг/кг ТNKази AUC* (середня) % AUC % алтеплази AUC 140191 81 130 33242 19 215 173433 100 141 Середні концентрації 0,25 мг/кг ТNKази 4595 2163 1002 конкретними фактичними прикладами, фахівець в даній галузі після прочитання вищенаведеного опису зможе вносити різні зміни, заміни на рівноцінні замінники і виправлення в об'єкт винаходу, представлений тут, без відхилення від суті і об'єму винаходу. Отже, винахід може бути застосований іншими способами, ніж конкретно описано тут. Отже, передбачається, що захист, забезпечений патентом, обмежений тільки формулою винаходу, що додається, і її еквівалентами. 29 97486 30 31 97486 32 33 97486 34 Комп’ютерна верстка О. Гапоненко Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюUse of tenecteplase for treating acute ischemic stroke
Автори англійськоюKuebler, Peter
Назва патенту російськоюПрименение тенектеплазы для лечения острого ишемического инсульта
Автори російськоюКюблер Питер
МПК / Мітки
МПК: A61K 38/16, A61P 9/10
Мітки: інсульту, лікування, застосування, тенектеплази, гострого, ішемічного
Код посилання
<a href="https://ua.patents.su/17-97486-zastosuvannya-tenekteplazi-dlya-likuvannya-gostrogo-ishemichnogo-insultu.html" target="_blank" rel="follow" title="База патентів України">Застосування тенектеплази для лікування гострого ішемічного інсульту</a>