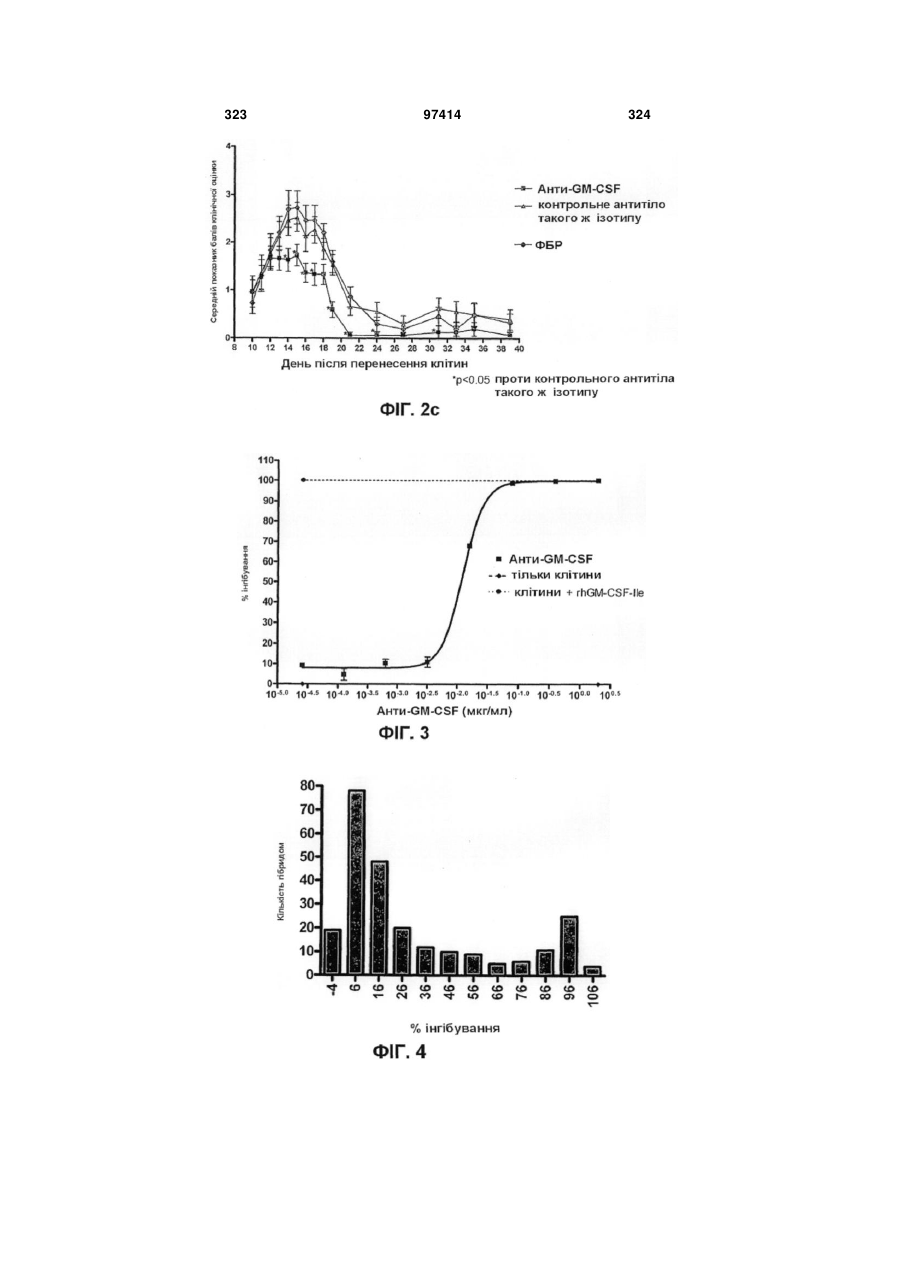
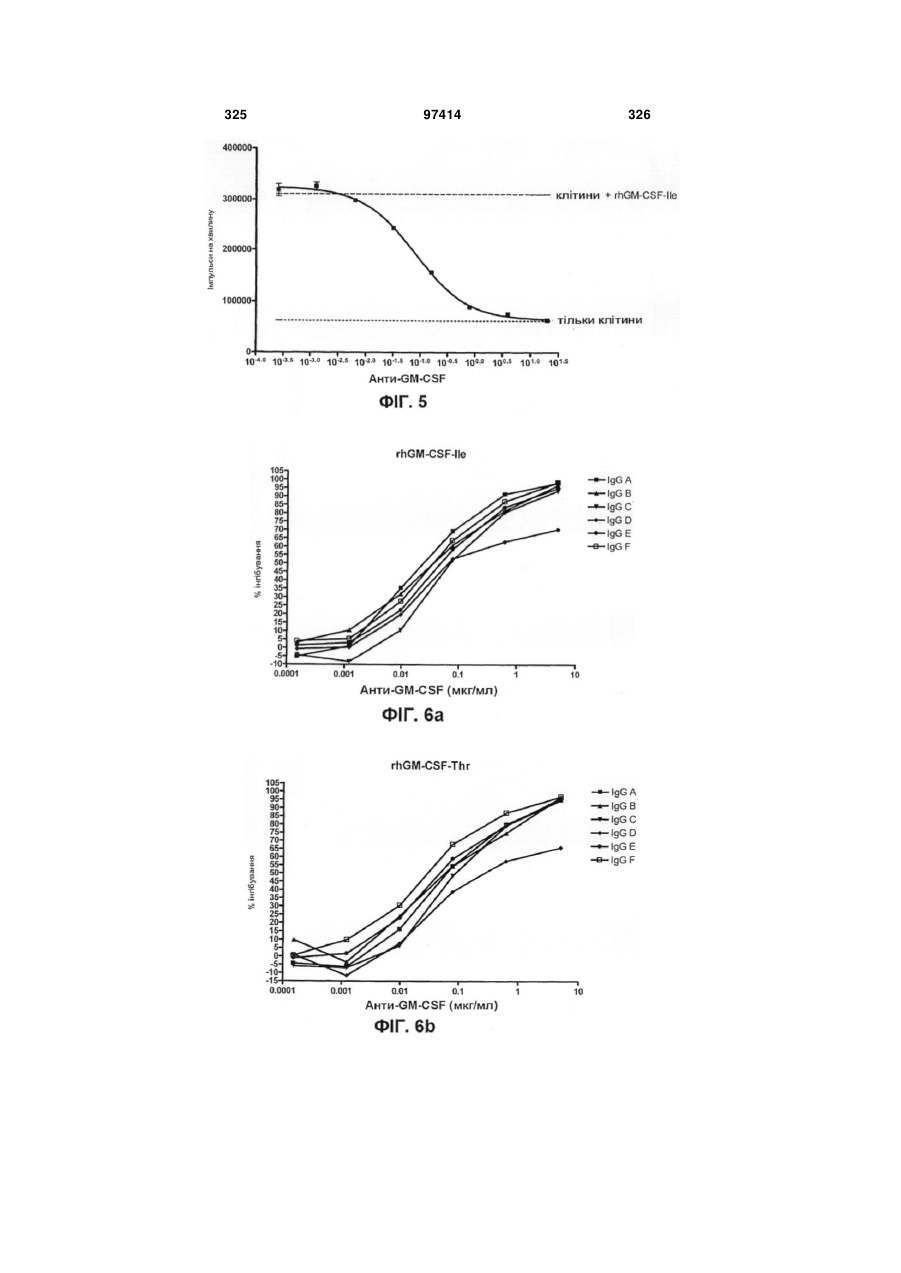
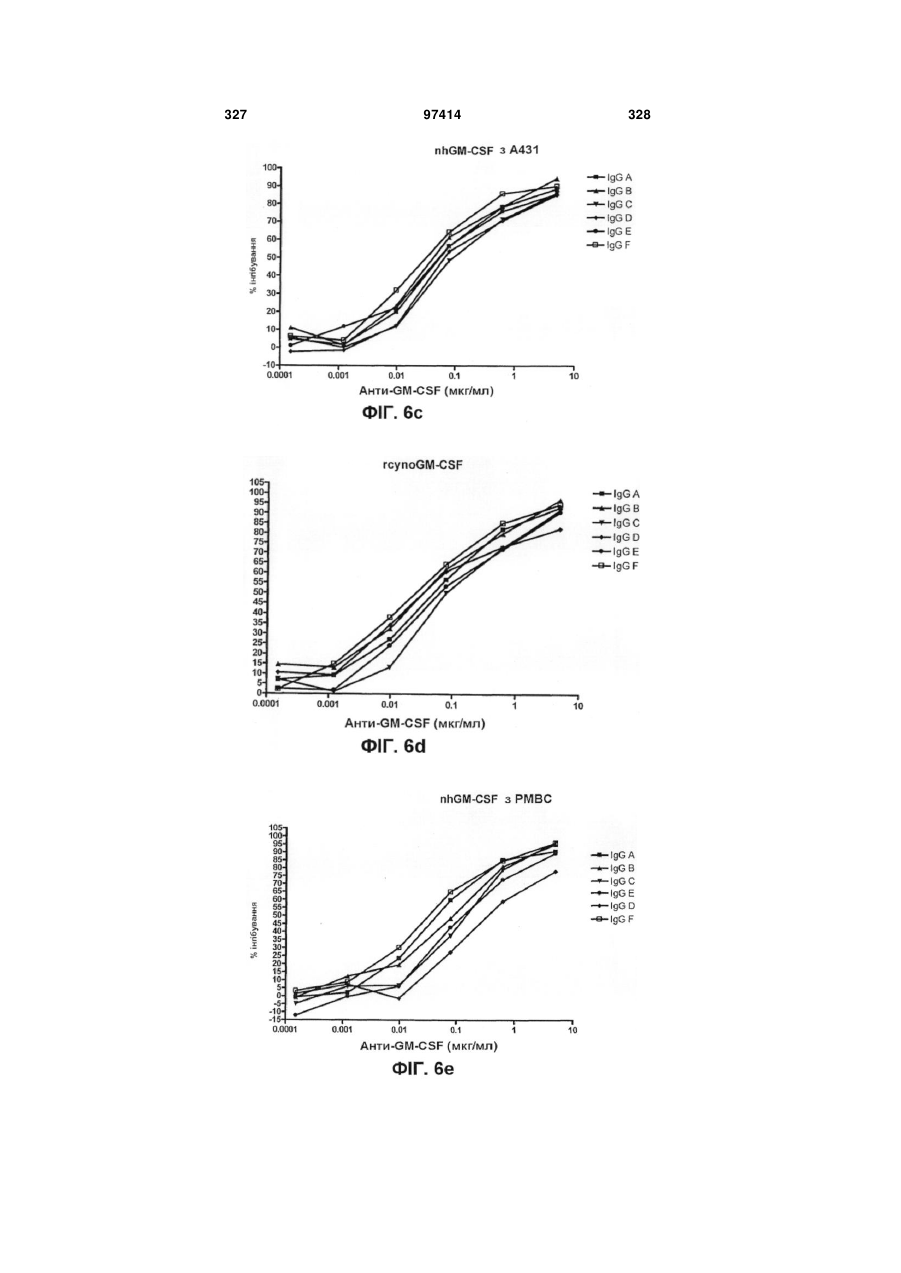
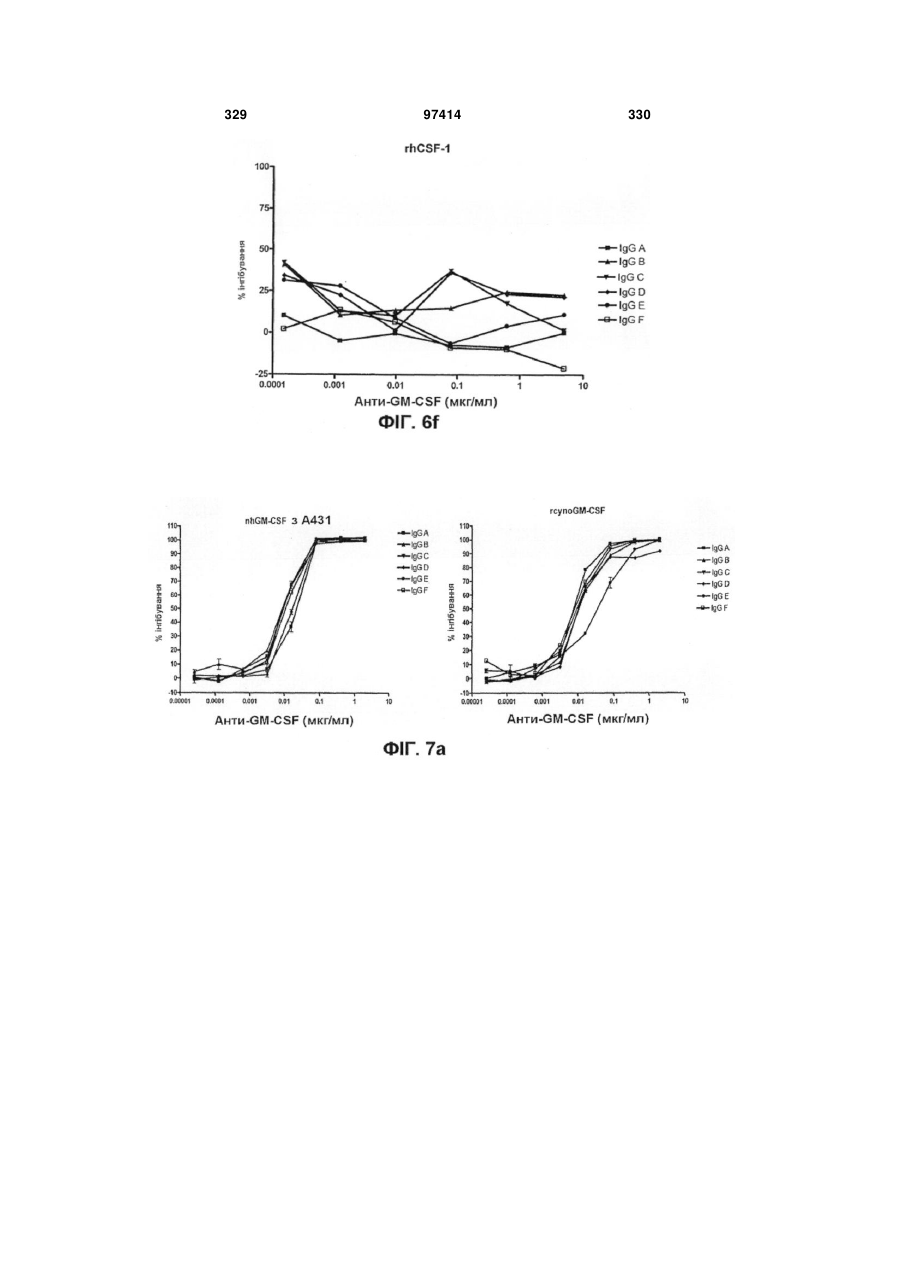
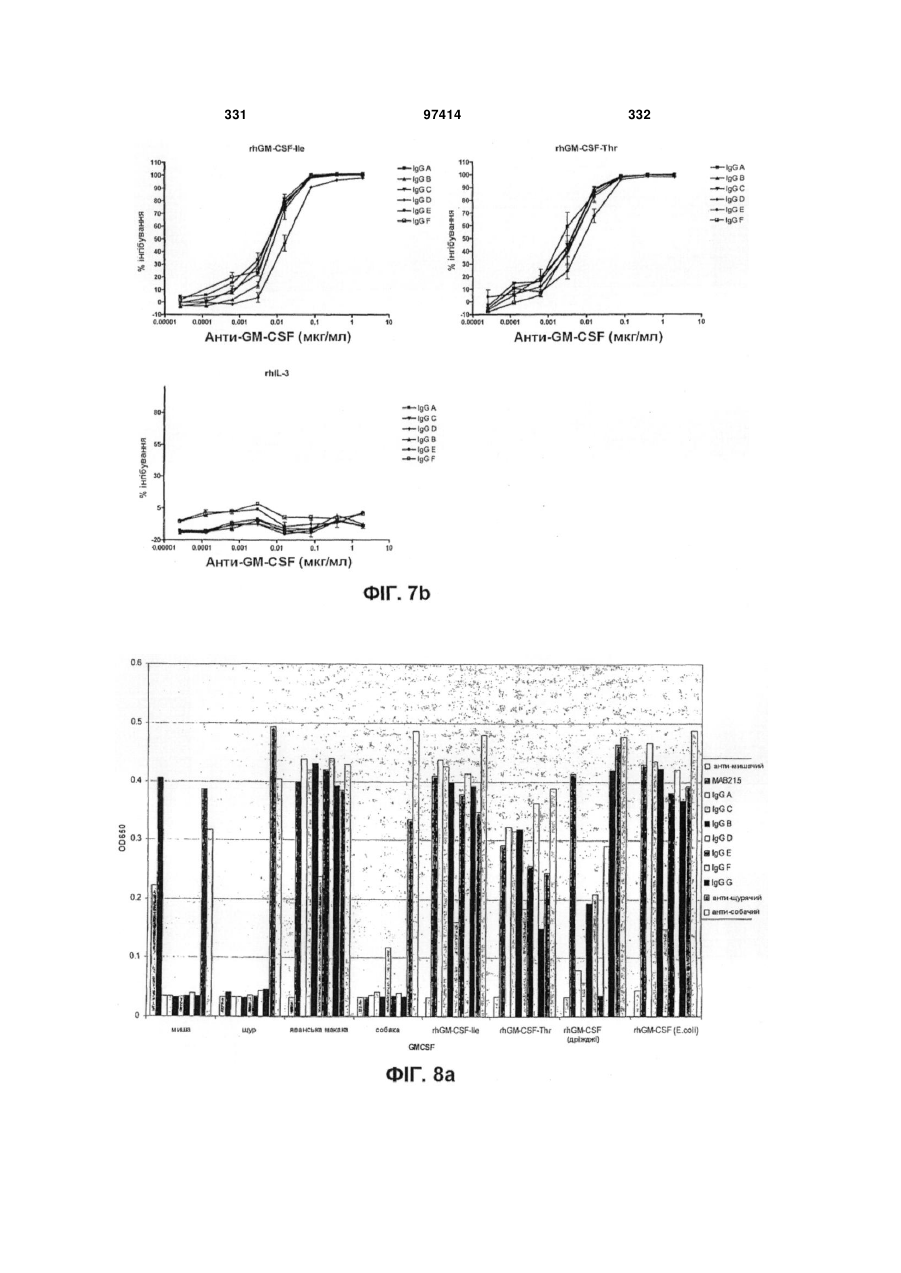
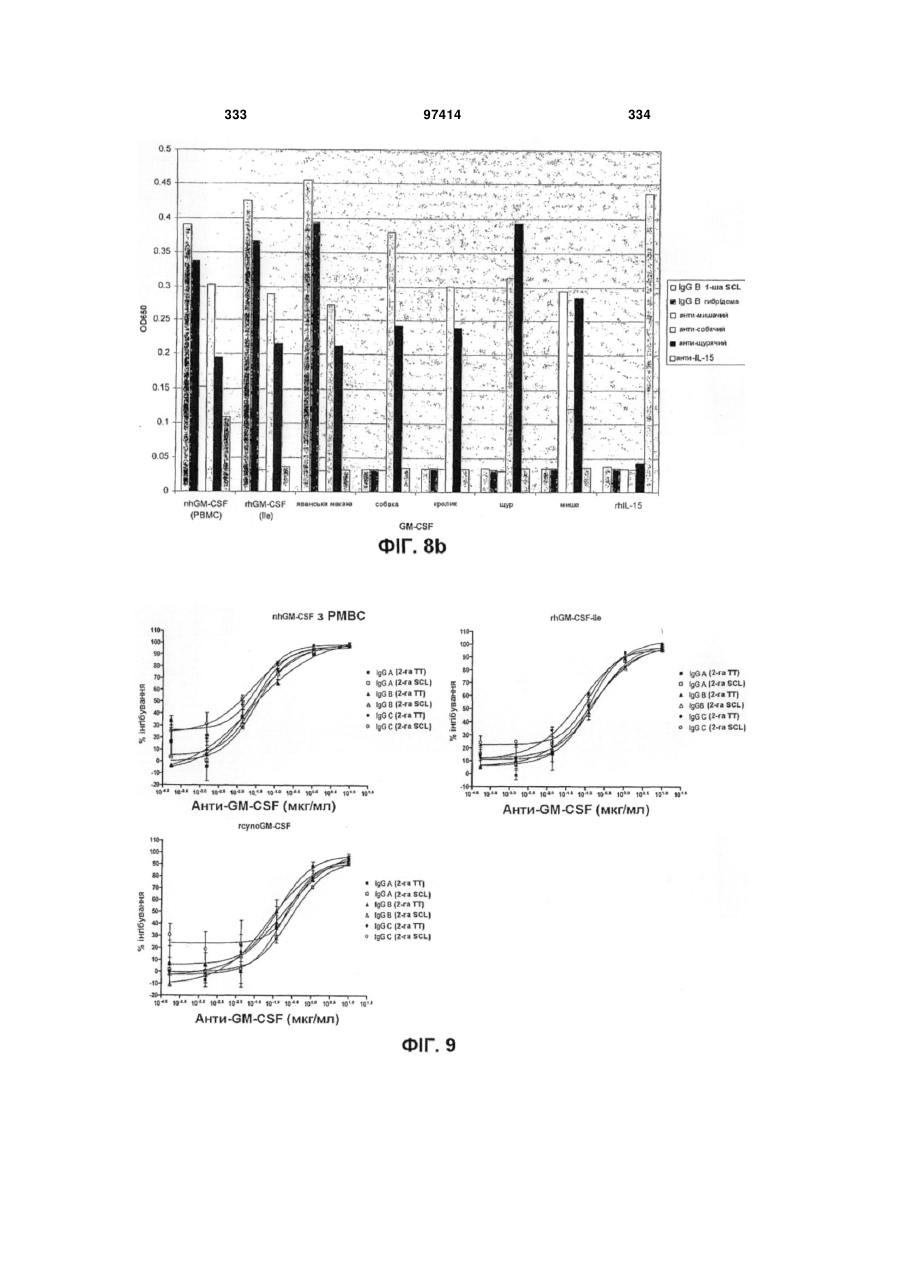
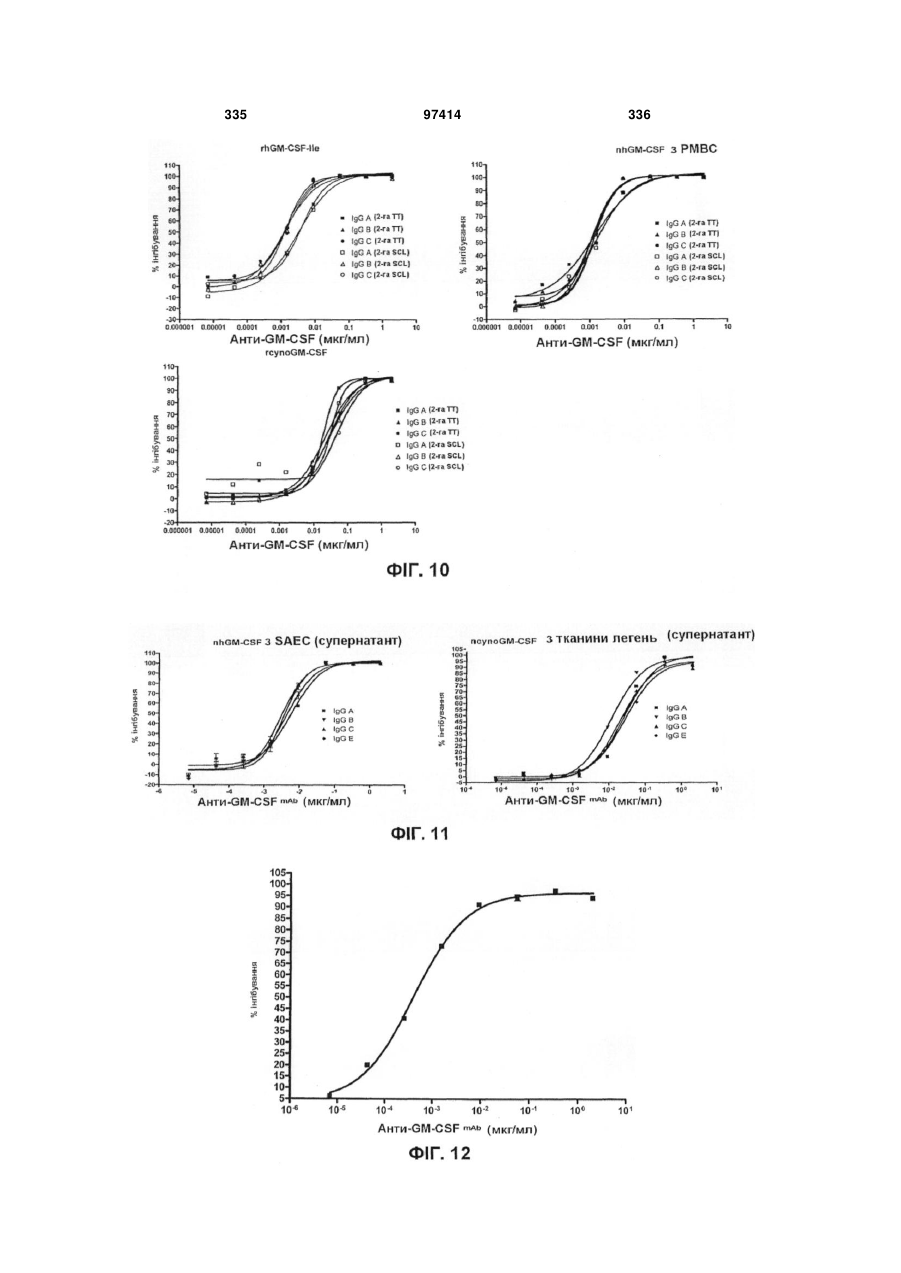
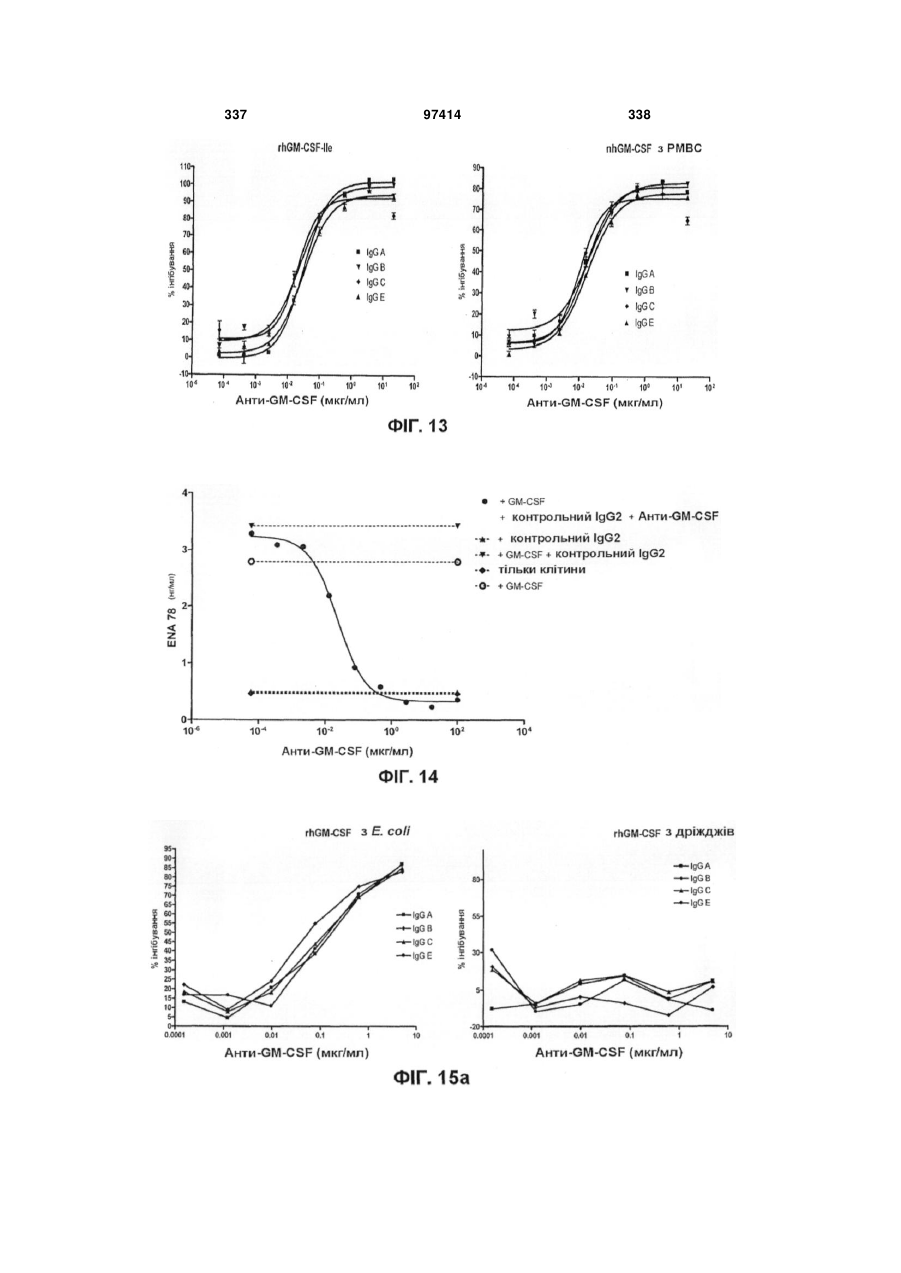
Виділене людське антитіло, яке зв’язується з gm-csf
Номер патенту: 97414
Опубліковано: 10.02.2012
Автори: Кірчнер Жаклін А., Олсон Кара, Брейзел Кеннет А., Бароне Дауфине, Ескобар Хосе Карлос
Формула / Реферат
1.Виділене людське антитіло, яке зв'язується з GM-CSF, що містить:
A) CDRH (гіперваріабельну ділянку важкого ланцюга)1 послідовності SEQ ID NO: 22, CDRH2 послідовності SEQ ID NO: 23 та CDRH3 послідовності SEQ ID NO: 24, і
Б) CDRL (гіперваріабельну ділянку легкого ланцюга)1 послідовності SEQ ID NO: 16, CDRL2 послідовності SEQ ID NO: 17 та CDRL3 послідовності SEQ ID NO: 18.
2. Виділене антитіло за п. 1, яке відрізняється тим, що зазначене антитіло є моноклональним антитілом, поліклональним антитілом, рекомбінантним антитілом, гуманізованим антитілом, химерним антитілом, поліспецифічним антитілом або фрагментом зазначеного антитіла.
3. Виділене антитіло за п. 2, яке відрізняється тим, що фрагментом зазначеного антитіла є фрагмент Fab, фрагмент Fab', фрагмент F(ab')2, фрагмент Fv, діатіло або молекула одноланцюгового антитіла.
4. Виділене антитіло за п. 2, яке відрізняється тим, що зазначене антитіло є моноклональним антитілом.
5. Виділене антитіло за п. 1, яке відрізняється тим, що зазначене антитіло є антитілом типу IgG1-, IgG2-, IgG3- або IgG4-.
6. Виділене антитіло за п. 5, яке відрізняється тим, що зазначене антитіло є антитілом типу IgG1- або IgG2-.
7. Виділене антитіло за п. 1, яке відрізняється тим, що зазначене антитіло є зв'язаним з групою-міткою.
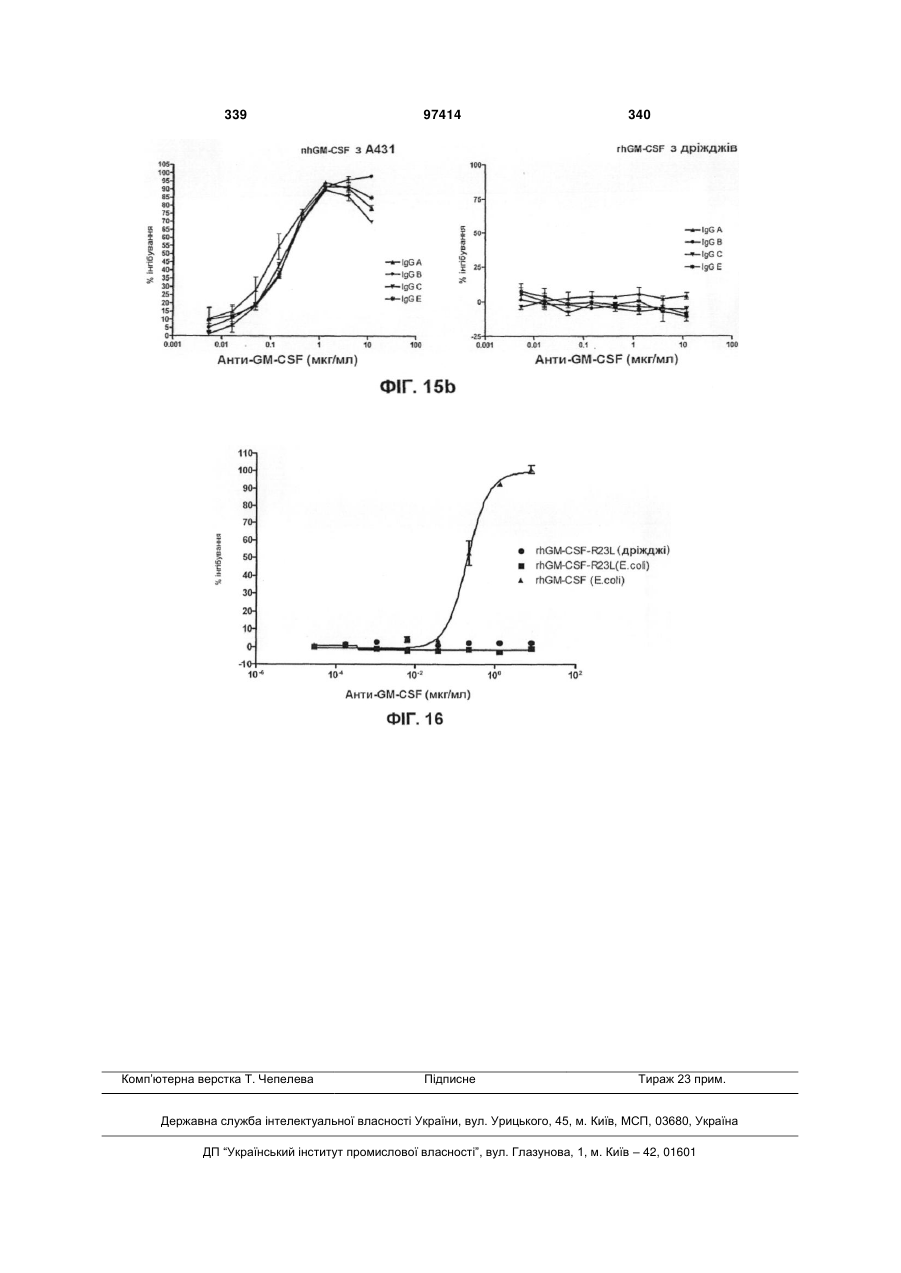
8. Виділене антитіло за п. 1, яке відрізняється тим, що зазначене антитіло пригнічує зв'язування GM-CSF із позаклітинною частиною людського GM-CSF.
9. Виділене антитіло за п. 1 для лікування або попередження стану, асоційованого з GM-CSF у пацієнта.
10. Виділене антитіло за п. 9, яке відрізняється тим, що стан вибраний з групи, що складається з ревматичних розладів, автоімунних розладів, гематологічних розладів, онкологічних розладів, запальних розладів, дегенеративних станів нервової системи, шлунково-кишкових, шлунково-сечових розладів та ендокринних розладів.
11. Виділене антитіло за п. 9, яке відрізняється тим, що стан вибраний з групи, що складається з розсіяного склерозу, ревматоїдного артриту, астми, псоріазу, атопічного дерматиту та саркоїдозу.
12. Виділене антитіло за п. 9, яке відрізняється тим, що виділений антигензв'язуючий білок вводиться самостійно або у складі комбінованої терапії.
13. Виділене антитіло за п. 1, яке відрізняється тим, що зазначене антитіло містить варіабельну ділянку важкого ланцюга (VH), що є принаймні на 90 % ідентичною з амінокислотною послідовністю, вибраною з групи, що складається з послідовності SEQ ID NO: 21, та/або варіабельну ділянку легкого ланцюга (VL), що є принаймні на 90 % ідентичною з амінокислотною послідовністю, вибраною з групи, що складається з послідовності SEQ ID NO: 15.
14. Виділений антигензв'язуючий білок п. 13, який відрізняється тим, що VH складається з послідовності SEQ ID NO: 21, та VL складається з послідовності SEQ ID NO: 15.
15. Молекула нуклеїнової кислоти, яка кодує антитіло за п. 1.
16. Молекула нуклеїнової кислоти за п. 15, яка відрізняється тим, що зазначена молекула нуклеїнової кислоти функціонально з'єднана з контрольною послідовністю.
17. Вектор, який містить молекулу нуклеїнової кислоти за п. 15.
18. Вектор, який містить молекулу нуклеїнової кислоти за п. 16.
19. Клітина-хазяїн, яка містить молекулу нуклеїнової кислоти за п. 16.
20. Клітина-хазяїн, яка містить вектор за п. 18.
21. Спосіб одержання антитіла за п. 1, який включає етап одержання зазначеного антитіла з клітини-хазяїна, яка виділяє зазначене антитіло.
22. Фармацевтична композиція, яка містить антитіло за п. 1 та фармацевтично прийнятний носій.
23. Фармацевтична композиція за п. 22, яка додатково містить додаткову активну речовину.
24. Фармацевтична композиція за п. 23, яка відрізняється тим, що зазначена додаткова активна речовина вибрана з групи, що складається з радіоізотопу, радіонукліду, токсину, або терапевтичної та хіміотерапевтичної груп.
25. Використання виділеного антитіла за п. 1 у виробництві медикаменту для лікування або попередження стану, асоційованого з GM-CSF у пацієнта.
26. Використання за п. 25, яке відрізняється тим, що стан вибраний з групи, що складається з ревматичних розладів, автоімунних розладів, гематологічних розладів, онкологічних розладів, запальних розладів, дегенеративних станів нервової системи, шлунково-кишкових, гастроуринарних розладів та ендокринних розладів.
27. Використання за п. 25, яке відрізняється тим, що стан вибраний з групи, що складається з розсіяного склерозу, ревматоїдного артриту, астми, псоріазу, атопічного дерматиту та саркоїдозу.
28. Використання за п. 25, яке відрізняється тим, що виділений антигензв'язуючий білок вводиться самостійно або у складі комбінованої терапії.
29. Використання принаймні одного антитіла за п. 1 у виробництві медикаменту для пригнічення зв'язування GM-CSF з позаклітинною частиною GM-CSFR у хворого.
Текст
1.Виділене людське антитіло, яке зв'язується з GM-CSF, що містить: A) CDRH (гіперваріабельну ділянку важкого ланцюга)1 послідовності SEQ ID NO: 22, CDRH2 послідовності SEQ ID NO: 23 та CDRH3 послідовності SEQ ID NO: 24, і Б) CDRL (гіперваріабельну ділянку легкого ланцюга)1 послідовності SEQ ID NO: 16, CDRL2 послідовності SEQ ID NO: 17 та CDRL3 послідовності SEQ ID NO: 18. 2. Виділене антитіло за п. 1, яке відрізняється тим, що зазначене антитіло є моноклональним антитілом, поліклональним антитілом, рекомбінантним антитілом, гуманізованим антитілом, химерним антитілом, поліспецифічним антитілом або фрагментом зазначеного антитіла. 3. Виділене антитіло за п. 2, яке відрізняється тим, що фрагментом зазначеного антитіла є фрагмент Fab, фрагмент Fab', фрагмент F(ab')2, фраг 2 (19) 1 3 97414 4 з амінокислотною послідовністю, вибраною з групи, що складається з послідовності SEQ ID NO: 15. 14. Виділений антигензв'язуючий білок п. 13, який відрізняється тим, що VH складається з послідовності SEQ ID NO: 21, та VL складається з послідовності SEQ ID NO: 15. 15. Молекула нуклеїнової кислоти, яка кодує антитіло за п. 1. 16. Молекула нуклеїнової кислоти за п. 15, яка відрізняється тим, що зазначена молекула нуклеїнової кислоти функціонально з'єднана з контрольною послідовністю. 17. Вектор, який містить молекулу нуклеїнової кислоти за п. 15. 18. Вектор, який містить молекулу нуклеїнової кислоти за п. 16. 19. Клітина-хазяїн, яка містить молекулу нуклеїнової кислоти за п. 16. 20. Клітина-хазяїн, яка містить вектор за п. 18. 21. Спосіб одержання антитіла за п. 1, який включає етап одержання зазначеного антитіла з клітини-хазяїна, яка виділяє зазначене антитіло. 22. Фармацевтична композиція, яка містить антитіло за п. 1 та фармацевтично прийнятний носій. 23. Фармацевтична композиція за п. 22, яка додатково містить додаткову активну речовину. 24. Фармацевтична композиція за п. 23, яка відрізняється тим, що зазначена додаткова активна речовина вибрана з групи, що складається з радіоізотопу, радіонукліду, токсину, або терапевтичної та хіміотерапевтичної груп. 25. Використання виділеного антитіла за п. 1 у виробництві медикаменту для лікування або попередження стану, асоційованого з GM-CSF у пацієнта. 26. Використання за п. 25, яке відрізняється тим, що стан вибраний з групи, що складається з ревматичних розладів, автоімунних розладів, гематологічних розладів, онкологічних розладів, запальних розладів, дегенеративних станів нервової системи, шлунково-кишкових, гастроуринарних розладів та ендокринних розладів. 27. Використання за п. 25, яке відрізняється тим, що стан вибраний з групи, що складається з розсіяного склерозу, ревматоїдного артриту, астми, псоріазу, атопічного дерматиту та саркоїдозу. 28. Використання за п. 25, яке відрізняється тим, що виділений антигензв'язуючий білок вводиться самостійно або у складі комбінованої терапії. 29. Використання принаймні одного антитіла за п. 1 у виробництві медикаменту для пригнічення зв'язування GM-CSF з позаклітинною частиною GM-CSFR у хворого. Дана заявка претендує на пріоритет попередньої заявки Сполучених Штатів, серійний номер 61/087,551, яку було подано 8 серпня 2008 р., та попередньої заявки Сполучених Штатів, серійний номер 60/994,343, яку було подано 18 вересня 2007 р., на розкриття яких вона спирається і які включені шляхом посилання. Гранулоцитарно-макрофагальний колонієстимулювальний фактор (GM-CSF; CSF2) являє собою добре вивчений білок, який вже довгий час цінується за свої гемопоетичні властивості (тобто, стимуляція проліферації та диференціації клітинпрекурсорів та проліферації зрілих клітин мієлоїдного походження) (розглянуто у Blood 77: 1131, 1991; Rev Infect Dis 12: 41, 1990; Med. Oncol. 13: 141, 1996). GM-CSF конститутивно продукується епітеліальними клітинами легень та клітинами Панета кишечника (BBRC 312: 897, 2003), але найрізноманітніші клітини експресують GM-CSF при активації з домінуючою експресією з Т-клітин, макрофагів/моноцитів, фібробластів та ендотеліальних клітин (J Infect Dis 172:1573, 1995; J Infect Dis 185: 1490, 2002; J Allergy Clin Immunol 112: 653, 2003). GM-CSF рецептор (GM-CSFR; CSFR2) складається з гетерологічного комплексу двох білків; альфа-поліпептиду з високою спорідненістю, який є специфічним для GM-CSF, та бетаполіпептиду з низькою спорідненістю, що є спільним для GM-CSF, IL-3 та IL-5 (розглянуто у J Allergy Clin Immunol 112: 653, 2003; Cytokine and Growth Factor Reviews 12: 19, 2001). GM-CSFR експресується на всіх клітинах мієлоїдного походження. GM-CSF збільшує активність вродженої імунної системи, опосередковуючи сигнали, які викликають або впливають на диференціацію, виживання, проліферацію та активацію клітин мієлоїдного походження, включаючи макрофаги/моноцити, дендритні клітини (ДК), нейтрофіли та еозинофіли (розглянуто в: J Immun 143: 1198, 1989; Rev Infect Dis 12: 41, 1990; Blood 77: 1131, 1991; Trends in Immun. 23: 403, 2002; Growth Factors 22: 225, 2004). GM-CSF є важливим фактором для генерації in vitro ДК та макрофагів типу 1 моноцитарного походження (PNAS 101: 4560, 2004) і продемонстрував здатність індукувати диференціацію та активацію ДК in vivo (Blood 95: 2337, 2000). Людські макрофаги моноцитарного походження, що генеруються у присутності GM-CSF (макрофаги типу 1), продукують високі рівні прозапальних цитокінів, таких як IL-23, але не IL-12, тоді як макрофаги типу 2, що генеруються у присутності M-CSF (CSF1), продукують протизапальні цитокіни, такі як IL-10, але не IL-23 (PNAS 101: 4560, 2004). Людські моноцити або макрофаги, стимульовані GM-CSF, демонструють підсилену функцію, включаючи цитотоксичність, продукування інших прозапальних цитокінів (IL-1β, TNFα та IL-6) і фагоцитоз. Спираючись на зазначені ефекти, останнім часом багато зусиль 2 було спрямовано на вивчення GM-CSF як потужного ад'юванту для застосування при інфекційних захворюваннях або з введеннями вакцин (розглянуто в Eur J Clin Microbiol Infect Dis. 13: S47, 1994; Curr Opin Hematol. 7: 168, 2000). Дійсно, введення rhGM-CSF в деяких клінічних умовах 5 значно покращує результат та елімінацію грибкової інфекції (Eur J Clin Microbiol Infect Dis 13: S18, 1994; J Med Microbiol 47: 1998). Мікроглія являє собою осідлі макрофаги ЦНС, і дані досліджень in vitro вказують на те, що GMCSF є ключовим цитокіном, що збільшує виживання, активацію, проліферацію і навіть диференціацію як ембріональних, так і зрілих мікрогліальних клітин (Glia 12: 309,1994; J Immunol Methods 300: 32, 2005). Окрім того, існує декілька звітів з досліджень моделі множинного склерозу на мишах, які забезпечують докази критичної ролі презентуючих антиген клітин (АРС, мікроглія або ДК) у періваскулярному просторі ЦНС щодо початку та персистенції захворювання (Nat. Med. 11: 146, 2005; Nat. Med. 11: 328, 2005; Nat. Med. 11: 335, 2005). Стимуляція мікроглії GM-CSF активує МНСІІ та збільшує презентацію антигену. Тільки нещодавно було встановлено роль GMCSF як прозапального цитокіну при захворюванні та несуттєвість його як гемопоетичного фактору росту (розглянуто в Trends in Immun. 23: 403, 2002; Growth Factors 22: 225, 2004), а також його роль у спричиненні та підсиленні запальних/аутоімунних захворювань. Підвищені рівні GM-CSF спостерігались на місцевих ділянках запалення при множинному склерозі (МС), ревматоїдному артриті (РА), астмі, псоріазі, атопічному дерматиті та саркоїдозі. Підвищення рівнів GM-CSF звичайно не спостерігається у сироватці, таким чином визначення зв'язку із захворюванням вимагає аналізу цільових тканин. При МС, було проведено два клінічних дослідження, у яких рівні білка GM-CSF вимірювали методом ELISA (імуноферментного твердофазного аналізу) у спинномозковій рідині (СМР) та сироватці у хворих з ремітивно-рецидивуючою формою (РР), що страждають на активний МС (нові симптоми або погіршення існуючих симптомів протягом 2 тижнів відбору зразків тканини) та у порівнянні з РРМС хворими зі стабільним захворюванням (відсутність епізодів протягом попередніх 6 місяців) або хворими на інше неврологічне захворювання (ІНЗ) у якості контролю (Eur Neurol 33: 152,1993; Immunopharmacol. Immunotoxicol. 20: 373,1998). Важливо, що контрольні групи ІНЗ не включали хворих на хворобу Альцгеймера та хворих, що страждають на судинну деменцію, оскільки значно підвищені рівні GM-CSF були відмічені у звітах для СМР та сироватки таких хворих (Acta Neurol Scand 103: 166, 2001). Рівні GM-CSF знаходились в межах низького діапазону пг, але були значно вище при активному захворюванні РРМС в СМР у порівнянні із СМР при стабільному захворюванні та із СМР при активному захворюванні на МС у порівнянні з СМРІНЗ. Крім того, спостерігались більш високі рівні пухлинного некротичного фактору (ТNF)-альфа в СМР при активному у порівнянні зі стабільним захворюванням, а також більш високі рівні як TGFбета, так і IL-10 в СМР при стабільному у порівнянні з активним захворюванням. Дослідження включали дуже ретельне дотримання критеріїв включення з урахуванням поточного лікування хворих та клінічного визначення активного у порів 97414 6 нянні зі стабільним захворюванням, а також синхронність відбору зразків. Цікаво, що не було відмічено значної різниці у рівнях GM-CSF у сироватці серед будь-яких груп. Крім того, в одному дослідженні спостерігалося селективне імуногістохімічне визначення GM-CSF в астроцитах МС уражень, але не в контрольній білій речовині ЦНС (n = 3, МС донори, Glia 12: 309, 1994). Зрештою, активовані Т-клітини та моноцити/макрофаги спроможні продукувати велику кількість GM-CSF при активації під час запальної відповіді. Це є достатнім доказом присутності як цього типу клітин при МС ураженнях (Ann Neurol. 47: 707, 2000), так і Τ клітин в СМР (розглянуто в Curr. Neurol. Neurosci. Rep. 1: 257, 2001). Окрім зв'язку експресії GM-CSF з МС, існує велика кількість даних щодо зв'язку інших запальних/аутоімунних захворювань і навіть деякі докази щодо загострення захворювання при введенні екзогенного GM-CSF. При РА підвищені рівні GMCSF було виявлено у синовіальній рідині (СР) хворих з РА або псоріатичним артритом (ПсА) у порівнянні з остеоартритом (ОА) (біологічна проба, Clin. Exp. Immunol. 72: 67, 1988) та у порівнянні з контрольними не-РА групами (біологічна проба, Rheumatol Int. 14: 177, 1995). Крім того, існує чітка кореляція між присутністю CD68+ макрофагів у суглобах і тяжкістю захворювання хворих на PA (Ann Rheum Dis 64: 834, 2005). Зрештою, опубліковані звіти про те, що лікування GM-CSF хворих на РА з синдромом Фелті (нейтропенія) може призводити до загострення захворювання (Blood 74: 2769, 1989). За допомогою імуногістохімії було встановлено, що при астмі рівень GM-CSF підвищується у зразках бронхіальної біопсії хворих на астму, а також спостерігалась кореляція між підвищенням рівнів GM-CSF та підвищенням рівня FEV1 після лікування з використанням стероїдів (Chest 105: 687,1994; Am Rev Respir Dis 147: 1557, 1993). Також повідомлялося про підвищення рівня GM-CSF у мокротинні хворих, що страждають на легку переміжну астму (Ann Allergy Asthma Immunol 86: 304, 2001). Дані, що підтверджують антагонізм GM-CSF, включають дослідження, в якому еозинофіл-активуюча діяльність з боку BALF симптоматичних пацієнтів була послаблена анти-GM-CSF mAb (in vitro, Eur. Respir. J. 12: 872, 1998). При псоріазі експресія GM-CSF була виявлена у псоріатичній шкірі, але не в контрольних зразках шкіри (Arch Dermatol Res. 287: 158, 1995; Clin Exp Dermatol. 19: 383, 1994; Dermatologica. 181: 16, 1990). Також існують повідомлення про те, що лікування псоріазу з використанням GM-CSF може призвести до загострення захворювання (Br J Dermatol. 128:468, 1993). При атопічному дерматиті (АД) значно більша кількість експресуючих мРНК GM-CSF клітин була виявлена за допомогою гібридизації in situ в біопсіях уражень при хронічному АД у порівнянні з гострим АД або неураженою шкірою (р< 0.05; J Clin Invest. 95: 211, 1995). В другому дослідженні більш високі рівні GM-CSF було виявлено за допомогою імуногістохімічного дослідження ураженої АД шкіри (як епідермального, так і дермального відсіків), 7 та культури кератиноцитів з неураженої шкіри хворих на АД демонстрували підвищене спонтанне та стимульоване форболу міристат-ацетатом (ФМА) продукування GM-CSF у порівнянні з кератиноцитами неатопічних контрольних зразків (J СІіn Invest 99: 3009, 1997). Миші з дефіцитом GM-CSF (Science 264: 713, 1994; PNAS 91: 5592, 1994) та GM-CSFRc (Immunity 2: 211, 1995; PNAS 92: 9565, 1995) були генеровані множинними групами. У мишей була відсутня явна різниця у рівнях кровотворення в стабільному стані, але вони демонстрували гістологічні докази альвеолярного протеїнозу, були більш вразливими до інфекцій та демонстрували помірну затримку продукування IgG та знижені антиген-специфічні відгуки Τ клітин після імунізації гемоціаніном фісурелли (KLH, PNAS 94:12557, 1997). GM-CSF-/- миші є резистентними до індукованого MOG35-55 ЕАЕ (J Ехр Med.194: 873, 2001), індукованого колагеном (CIA; JI 161: 3639, 1998) та індукованого mBSA/IL-1 артриту (Arthritis Rheum 44: 111, 2001). Навпаки, GM-CSFGM-CSF трансгенні (Тg) миші були генеровані у багатьох лабораторіях та демонструють розвиток запального/аутоімунного захворювання (Cell 51: 675, 1987; JI 166: 2090, 2001; J Clin Invest 97: 1102, 1996; J Allergy Clin Immunol 111: 1076,2003; Lablnvest 77: 615, 1997). Таким чином, в рівні техніки існує необхідність в інгібіторах GM-CSF. Запропоновані білки, що зв'язуються з антигеном, які зв'язуються з GM-CSF, зокрема людським GM-CSF. Білки, що зв'язуються з антигеном, GMCSF людини, можуть інгібувати, впливати або модулювати як мінімум одну з біологічних реакцій, пов'язаних з GM-CSF, і, як такі, придатні для полегшення впливу пов'язаних з GM-CSF захворювань або розладів. Зв'язування деяких білків, що зв'язуються з антигеном, з GM-CSF може, таким чином, інгібувати, впливати або блокувати проведення сигналу GM-CSF, зменшувати міграцію моноцитів в пухлини та зменшувати акумуляцію пов'язаних з пухлиною макрофагів (ППМ). Також запропоновано системи експресії, зокрема клітинні лінії, для продукування білків, що зв'язуються з антигеном GM-CSF, та способи діагностики та лікування захворювань, пов'язаних з GM-CSF людини. Деякі із запропонованих виділених білків, що зв'язуються з антигеном, включають (А) одну або більше ділянку важкого ланцюга, що визначає комплементарність (CDRH), вибрану з групи, яка складається з: (і) CDRH1, яка вибрана з групи, що складається з SEQ ID NO: 10, 22, 70, 94 та 142; (іі) CDRH2, яка вибрана з групи, що складається з SEQ ID NO: 11, 23, 28, 35, 47, 59, 71, 95, 106, 119 та 143; (ііі) CDRH3, яка вибрана з групи, що складається з SEQ ID NO: 12, 24, 36, 48, 60, 72, 83, 96, 108, 120, 132 та 144; і (iv) CDRH (і), (іі) та (ііі), які містять одну або більше замін, делецій або вставок амінокислот довжиною не більше 4 амінокислот; (В) одну або більше ділянку легкого ланцюга, що визначає комплементарність (CDRL), вибрану з групи, яка складається з: (і) CDRL1, яка вибрана з групи, що складається з SEQ ID NO: 4, 16, 30,40, 97414 8 52,64,88, 100, 107, 112, 118, 124, 125 та 136; (іі) CDRL2, яка вибрана з групи, що складається з SEQ ID NO: 5, 17, 29, 34, 41, 65, 77, 101, 113, 130, 131 та 137; (ііі) CDRL3, яка вибрана з групи, що складається з SEQ ID NO: 6, 18, 42, 46, 66, 78, 84, 89, 90, 102, 114, 126 та 138; і (iv) CDRL (і), (іі) та (ііі), які містять одну або більше замін, делецій або вставок амінокислот довжиною не більше 4 амінокислот; або (С) одну або більше CDRH важкого ланцюга у відповідності до А) та одну або більше CDRL легкого ланцюга у відповідності до (В). В одному з варіантів, виділений білок, що зв'язується з антигеном, може включати як мінімум одну або дві CDRH, як наведено вище, у відповідності до (А), і як мінімум одну або дві CDRL, як наведено вище, у відповідності до (В). Ще в одному аспекті виділений білок, що зв'язується з антигеном, включає CDRH1, CDRH2, CDRH3, CDRL1, CDRL2 та CDRL3. Крім того, CDRH, як наведено вище, у відповідності до (А), додатково вибрана з групи, що складається з: (і) CDRH1, яка вибрана з групи, що складається з SEQ ID NO: 10, 22, 70, 94 та 142; (іі) CDRH2, яка вибрана з, що складається з SEQ ID NO: 11, 23, 28, 35, 47, 59, 71, 95, 106, 119 та 143; (ііі) CDRH3, яка вибрана з групи, що складається з SEQ ID NO: 12, 24, 36, 48, 60, 72, 83, 96, 108, 120, 132 та 144; і (iv) CDRH (і), (іі) і (ііі), яка містить одну або більше замін, делецій або вставок амінокислот довжиною не більше двох амінокислот; CDRH у відповідності до вищевказаного (В), вибрана з групи, що складається з: (і) CDRL1, яка вибрана з групи, що складається з SEQ ID NO: 4, 16, 30, 40, 52, 64, 88, 100, 107, 112, 118, 124, 125 та 136; (іі) CDRL2, яка вибрана з групи, що складається з SEQ ID NO: 5, 17, 29, 34, 41, 65, 77, 101, 113, 130, 131 та 137; (ііі) CDRL3, яка вибрана з групи, що складається з SEQ ID NO: 6, 18, 42, 46, 66, 78, 84, 89, 90, 102, 114, 126 та 138; і (iv) CDRL (і), (іі) та (ііі), яка містить одну або більше замін, делецій або вставок амінокислот довжиною не більше 2 амінокислот; або (С) одну або більше CDRH важкого ланцюга у відповідності до (А) та одну або більше CDRL легкого ланцюга у відповідності до (В). В іншому варіанті виділений білок, що зв'язується з антигеном, може включати (А) CDRH, яка вибрана з групи, що складається з (і) CDRH1, яка вибрана з групи, що складається з SEQ ID NO: 10, 22, 70, 94 та 142; (іі) CDRH2, яка вибрана з групи, що складається з SEQ ID NO: 11, 23, 28, 35, 47, 59, 71, 95, 106, 119 та 143; (ііі) CDRH3, яка вибрана з групи, що складається з SEQ ID NO: 12, 24, 36, 48, 60, 72, 83, 96, 108, 120, 132 та 144; (В) CDRL, яка вибрана з групи, що складається з (і) CDRL1, яка вибрана з групи, що складається з SEQ ID NO: 4, 16, 30, 40, 52, 64, 88, 100, 107, 112, 118, 124, 125 та 136; (іі) CDRL2, яка вибрана з групи, що складається з SEQ ID NO: 5, 17, 29, 34, 41, 65, 77, 101, 113, 130, 131 та 137; (ііі) CDRL3, яка вибрана з групи, що складається з SEQ ID NO: 6, 18, 42, 46, 66, 78, 84, 89, 90, 102, 114, 126 та 138; або (С) одну або більше CDRH важкого ланцюга у відповідності до (А) та одну або більше CDRL легкого ланцюга у відповідності до (В). В одному з варіантів 9 виділений білок, що зв'язується з антигеном, може включати (A) CDRH1, яка вибрана з групи, що складається з SEQ ID NO: 10, 22, 70, 94 та 142; CDRH2, яка вибрана з групи, що складається з SEQ ID NO: 11, 23, 28, 35, 47, 59, 71, 95, 106, 119 та 143; CDRH3, яка вибрана з групи, що складається з SEQ ID NO: 12, 24, 36, 48, 60, 72, 83, 96, 108, 120, 132 та 144; і (В) CDRL1, яка вибрана з групи, що складається з SEQ ID NO: 4, 16, 30, 40, 52, 64, 88, 100, 107, 112, 118, 124, 125 та 136; CDRL2, яка вибрана з групи, що складається з SEQ ID NO: 5, 17, 29, 34, 41, 65, 77, 101, 113, 130, 131 та 137; і CDRL3, яка вибрана з групи, що складається з SEQ ID NO: 6, 18, 42, 46, 66, 78, 84, 89, 90, 102, 114, 126 та 138. В іншому варіанті послідовність варіабельного важкого ланцюга (VH), є як мінімум на 90% ідентичною послідовності амінокислот, вибраній з групи, що складається з SEQ ID NO: 9, 21, 33, 45, 57, 69, 81, 93, 105, 117, 129 та 141, та/або послідовність варіабельного легкого ланцюга (VL) є як мінімум на 90% ідентичною послідовності амінокислот, вибраній з групи, що складається з SEQ ID NO: 3, 15, 27, 39, 51, 63, 75, 87, 99, 111, 123 та 135. У подальшому варіанті VH вибрана з групи, що складається з SEQ ID NO: 9, 21, 33, 45, 57, 69, 81, 93, 105, 117, 129 та 141, та/або VL вибрана з групи, що складається з SEQ ID NO: 3, 15, 27, 39, 51, 63, 75, 87, 99, 111, 123 та 135. В іншому аспекті запропоновано виділений білок, що зв'язується з антигеном, який специфічно зв'язується з епітопом, що містить послідовності GM-CSF, де антитіло, що зв'язується з GM-CSF, протидіє активації опосередкованого GM-CSF проведенню сигналу в клітині, що містить GM-CSFR. В іншому аспекті запропоновано виділений білок, що зв'язується з антигеном, який зв'язується з GM-CSF і який включає: (А) одну або більше CDR важкого ланцюга (CDRH), яка вибрана з групи, що складається з (і) CDRH1, послідовність якої є як мінімум на 80% ідентичною послідовності CDRH1, яка вибрана з групи, що складається з SEQ ID NO: 10, 22, 70, 94 та 142; (іі) CDRH2, послідовність якої є як мінімум на 80% ідентичною послідовності CDRH2, яка вибрана з групи, що складається з SEQ ID NO: 11, 23, 28, 35, 47, 59, 71, 95, 106, 119 та 143; (ііі) CDRH3, послідовність якої є як мінімум на 80% ідентичною послідовності CDRH3, яка вибрана з групи, що складається з SEQ ID NO: 12, 24, 36, 48, 60, 72, 83, 96, 108, 120, 132 та 144; (В) одну або більше CDR легкого ланцюга (CDRL), яка вибрана з групи, що складається з: (і) CDRL1, послідовність якої є як мінімум на 80% ідентичною послідовності CDRL1, яка вибрана з групи, що складається з SEQ ID NO: 4, 16, 30, 40, 52, 64, 88, 100, 107, 112, 118, 124, 125 та 136; (іі) CDRL2, послідовність якої є як мінімум на 80% ідентичною послідовності CDRL2, яка вибрана з групи, що складається з SEQ ID NO: 5, 17, 29, 34, 41, 65, 77, 101, 113, 130, 131 та 137; (ііі) CDRL3, послідовність якої є як мінімум на 80% ідентичною послідовності CDRL3, яка вибрана з групи, що складається з SEQ ID NO: 6, 18, 42, 46, 66, 78, 84, 89, 90, 102, 114, 126 та 138; або (С) одну або більше CDRH важкого ланцюга у відповідності до (А) та одну або 97414 10 більше CDRL легкого ланцюга у відповідності до (В). В одному варіанті виділений білок, що зв'язується з антигеном, включає (А) одну або більше CDRH, яка вибрана з групи, що складається з: (і) CDRH1, послідовність якої є як мінімум на 90% ідентичною послідовності CDRH1, яка вибрана з групи, що складається з SEQ ID NO: 10, 22, 70, 94 та 142; (іі) CDRH2, послідовність якої є як мінімум на 90% ідентичною послідовності CDRH2, яка вибрана з групи, що складається з SEQ ID NO: 11, 23, 28, 35, 47, 59, 71, 95, 106, 119 та 143; (ііі) CDRH3, послідовність якої є як мінімум на 90% ідентичною послідовності CDRH3, яка вибрана з групи, що складається з SEQ ID NO: 12, 24, 36, 48, 60, 72, 83, 96, 108, 120, 132 та 144; (В) одну або більше CDRL, яка вибрана з групи, що складається з: (і) CDRL1, послідовність якої є як мінімум на 90% ідентичною послідовності CDRL1, яка вибрана з групи, що складається з SEQ ID NO: 4, 16, 30, 40, 52, 64, 88, 100, 107, 112, 118, 124, 125 та 136; (іі) CDRL2, послідовність якої є як мінімум на 90% ідентичною послідовності CDRL2, яка вибрана з групи, що складається з SEQ ID NO: 5, 17, 29, 34, 41, 65, 77, 101, 113, 130, 131 та 137; (ііі) CDRL3, послідовність якої є як мінімум на 90% ідентичною послідовності CDRL3, яка вибрана з групи, що складається з SEQ ID NO: 6, 18, 42, 46, 66, 78, 84, 89, 90, 102, 114, 126 та 138; або (С) одну або більше CDRH важкого ланцюга у відповідності до (А) та одну або більше CDRL легкого ланцюга у відповідності до (В). В іншому аспекті запропоновано виділений білок, що зв'язується з антигеном, який зв'язується з GM-CSF, де білок, що зв'язується з антигеном, включає А) ділянку важкого ланцюга, що визначає комплементарність (CDRH), яка вибрана з групи, що складається з (і) CDRH3, яка вибрана з групи, що складається з SEQ ID NO: 12, 24, 36, 48, 60, 72, 83, 96, 108, 120, 132 та 144; (іі) CDRH3, послідовності амінокислот якої відрізняється від CDRH3 (і) додаванням, делецією або заміною амінокислот довжиною не більше двох амінокислот; (ііі) послідовності амінокислот CDRH3, яка вибрана з групи, що складається з X1X2X3X4X5X6X7X8FDX9 (SEQ ID NO: 83), де Φ1 вибраний з групи, що складається з Ε без амінокислоти, Х2 вибраний з групи, що складається з G без амінокислоти, Х3 вибраний з групи, що складається з Р, D та G, Х4 вибраний з групи, що складається з Y, W, R та K, Х5 вибраний з групи, що складається з S, W, F та Т, Х6 вибраний з групи, що складається з Υ та L, Х7 вибраний з групи, що складається з D та G, Х8 вибраний з групи, що складається з Υ, без амінокислоти, і Х9 вибраний з групи, що складається з Μ, Τ та V; та/або В) ділянку легкого ланцюга, що визначає комплементарність (CDRL), яка вибрана з групи, що складається з (і) CDRL3, яка вибрана з групи, що складається з SEQ ID NO: 6, 18, 42, 46, 66, 78, 84, 89, 90, 102, 114, 126 та 138 (іі) CDRL3, послідовність амінокислот якої відрізняється від CDRL3 (і) додаванням, делецією або заміною амінокислот довжиною не більше двох амінокислот; і ііі) послідовності амінокислот CDRL3, яка вибрана з групи, що складається з Х1QХ2Х3Х4Х5Х6Х7Т (SEQ ID NO: 84), де Φ1 вибраний з групи, що складається з Q та 11 L, Х2 вибраний з групи, що складається з Υ та S, Х3 вибраний з групи, що складається з D, G та F, Х4 вибраний з групи, що складається з R, Τ та S, Х5 вибраний з групи, що складається з S та V, Х6 вибраний з групи, що складається з F та Р, і Х7 вибраний з групи, що складається з R та W; і X1X2X3X4DSSNX5X6X7 (SEQ ID NO: 89), де Х1 вибраний з групи, що складається з S та А, Х2 вибраний з групи, що складається з S та А, Х3 вибраний з групи, що складається з W та F, Х4 вибраний з групи, що складається з D та Т, Х5 вибраний з групи, що складається з G, W без амінокислоти, Х6 вибраний з групи, що складається з V, L та Р, і Х6 вибраний з групи, що складається з V без амінокислоти. В іншому варіанті білок, що зв'язується з антигеном, додатково включає: A) CDRH, яка вибрана з групи, що складається з: (і) CDRH1, яка вибрана з групи, що складається з SEQ ID NO: 10, 22, 70, 94 та 142; (іі) CDRH1, послідовність амінокислот якої відрізняється від CDRH1 (і) додаванням, делецією або заміною амінокислот довжиною не більше двох амінокислот; (ііі) послідовності амінокислот CDRH1, яка вибрана з групи, що складається з X1X2GX3X4XFX5X6YX7X8X9 (SEQ ID NO: 94), де X1 вибраний з групи, що складається з G без амінокислоти, Х2 вибраний з групи, що складається з G без амінокислоти, Х3 вибраний з групи, що складається з Υ та F, Х4 вибраний з групи, що складається з Τ та S, Х5 вибраний з групи, що складається з Т, S та G, Х6 вибраний з групи, що складається з G та S, Х7 вибраний з групи, що складається з Υ та G, Х8 вибраний з групи, що складається з І та М, та Х9 вибраний з групи, що складається з Η та S, або (iv) CDRH2, яка вибрана з групи, що складається з SEQ ID NO: 5, 17, 29, 34, 41, 65, 77, 101, 113, 130, 131 та 137; (ν) CDRH2, послідовність амінокислот якої відрізняється від CDRH2 (iv) додаванням, делецією або заміною амінокислот довжиною не більше двох амінокислот; або (vi) послідовності амінокислот CDRH2, яка вибрана з групи, що складається з Х1Х2Х3Х4Х5Х6СХ7Х8Х9Х10Х11Х12Х13Х14Х15G (SEQ ID NO: 106), де Х1 вибраний з групи, що складається з W без амінокислоти, Х2 вибраний з групи, що складається з І та Y, Х3 вибраний з групи, що складається з N, S та І, Х4 вибраний з групи, що складається з Р, А та Y, Х5 вибраний з групи, що складається з N та Y, Х6 вибраний з групи, що складається з S та N, Х7 вибраний з групи, що складається з G та N, Х8 вибраний з групи, що складається з Τ та R, Х9 вибраний з групи, що складається з N та D, Х10 вибраний з групи, що складається з Υ та S, Х11 вибраний з групи, що складається з А та Ν, Х12 вибраний з групи, що складається з Q та R, Х13 вибраний з групи, що складається з K та R, Х14 вибраний з групи, що складається з F та L, та Х15 вибраний з групи, що складається з Q, K та R; або В) CDRL, яка вибрана з групи, що складається з: (і) CDRL1, яка вибрана з групи, що складається з SEQ ID NO: 4, 16, 30, 40, 52, 64, 88, 100, 107, 112, 118, 124, 125 та 136; (іі) CDRL1, послідовність амінокислот якої відрізняється від CDRL1 (і) додаванням, делецією або заміною амінокислот довжиною не більше двох 97414 12 амінокислот; (ііі) послідовності амінокислот CDRL1, яка вибрана з групи, що складається з KSSQSX1XLYSSX2NX3NX4LX5 (SEQ ID NO: 107), де Φ1 вибраний з групи, що складається з V та І, Х2 вибраний з групи, що складається з S та Ν, Х3 вибраний з групи, що складається з Ε та K, Х4 вибраний з групи, що складається з Υ та F, та Х5 вибраний з групи, що складається з Τ та А; RASX1X2X3X4X5X6YX7X8 (SEQ ID NO: 118), де X1 вибраний з групи, що складається з Q та Р, Х2 вибраний з групи, що складається з S та Y, Х3 вибраний з групи, що складається з V, L та І, Х4 вибраний з групи, що складається з S та С, Х5 вибраний з групи, що складається з S та N, Х6 вибраний з групи, що складається з S, І, Τ без амінокислоти, Х7 вибраний з групи, що складається з F та L, та Х8 вибраний з групи, що складається з А та Ν; або X1X2X3X4X5X6YX7X8X9X10NX11VX12 (SEQ ID NO: 125), де X1 вибраний з групи, що складається з І, S та Т, Х2 вибраний з групи, що складається з R та G, вибраний з групи, що складається з Τ та S, Х4 вибраний з групи, що складається з R та S, Х5 вибраний з групи, що складається з G та S, Х6 вибраний з групи, що складається з S, Η та D, Х7 вибраний з групи, що складається з І та V, Х8 вибраний з групи, що складається з А та G, Х9 вибраний з групи, що складається з G без амінокислоти, Х10 вибраний з групи, що складається з S та Υ, Х11 вибраний з групи, що складається з Υ та Т, та Х12 вибраний з групи, що складається з Q, N та S; або (iv) CDRL2, яка вибрана з групи, що складається з SEQ ID NO: 5, 17, 29, 34, 41, 65, 77, 101, 113, 130, 131 та 137; (ν) CDRL2, послідовність амінокислот якої відрізняється від CDRL2 (iv) додаванням, делецією або заміною амінокислот довжиною не більше двох амінокислот; або (vi) послідовності амінокислоти CDRL2, яка вибрана з групи, що складається з X1X2X3X4X5X6X7 (SEQ ID NO: 130), де Φ1 вибраний з групи, що складається з G, Τ та W, Х2 вибраний з групи, що складається з Τ та А, Х3 вибраний з групи, що складається з S та А, Х4 вибраний з групи, що складається з S та Т, Х5 вибраний з групи, що складається з R та L, Х6 вибраний з групи, що складається з А, Е та Q, та Х7 вибраний з групи, що складається з Τ та S; або X1X2X3X4RPS (SEQ ID NO: 131), де Φ1 вибраний з групи, що складається з Ε та S, Х2 вибраний з групи, що складається з D, V та Ν, Х3 вибраний з групи, що складається з D, S та Ν, та Х4 вибраний з групи, що складається з Q, G та Н. В одному з аспектів виділені білки, що зв'язуються з антигеном, запропоновані в даному описі, можуть являти собою моноклональне антитіло, поліклональне антитіло, рекомбінантне антитіло, людське антитіло, гуманізоване антитіло, химерне антитіло, поліспецифічне антитіло або фрагмент вказаного антитіла. В іншому варіанті фрагмент антитіла виділених білків, що зв'язуються з антигеном, може бути Fab фрагментом, Fab' фрагментом, F(ab')2 фрагментом, Fv фрагментом, діатілом або молекулою одноланцюгового антитіла. У подальшому варіанті виділений білок, що зв'язується з антигеном, являє собою людське антитіло і може являти собою lgG1, lgG2, lgG3 або lgG4. 13 В іншому аспекті виділений білок, що зв'язується з антигеном, може бути зв'язаним з групоюміткою і може конкурувати за зв'язування з позаклітинною частиною людського GM-CSF з білком, що зв'язується з антигеном та з одним із запропонованих виділених білків, що зв'язуються з антигеном. Ще в одному аспекті запропоновано виділений білок, що зв'язується з антигеном, який конкурує для зв'язування з частиною людського GM-CSF, яка взаємодіє з рецептором, з білком, що зв'язується з антигеном. В одному з варіантів, білок, що зв'язується з антигеном, являє собою моноклональне антитіло, поліклональне антитіло, рекомбінантне антитіло, людське антитіло, гуманізоване антитіло, химерне антитіло, поліспецифічне антитіло або фрагмент вказаного антитіла. У споріднених варіантах запропоновано людські та моноклональні антитіла та фрагменти антигену, в тому числі Fab фрагмент, Fab' фрагмент, F(ab')2 фрагмент, Fv фрагмент, діатіло або молекулу одноланцюгового антитіла. В інших варіантах білок, що зв'язується з антигеном, має тип lgG1-, lgG2- lgG3або lgG4-. Крім того, додатково запропоновано виділений білок, що зв'язується з антигеном, сполучений з групою-міткою. В іншому аспекті винаходу додатково розглядається інгібування активності GM-CSF з метою обмеження сигналів, які спричиняють або впливають на диференціацію, виживання, проліферацію та активацію клітин мієлоїдного походження, включаючи макрофаги/моноцити, дендритні клітини (ДК), нейтрофіли та еозинофіли, та/або диференціацію та/або активацію ДК. Окрім того, у винаході розглядається інгібування активності GM-CSF з метою обмеження продукування високих рівнів прозапальних цитокінів, таких як IL-23, макрофагами моноцитарного походження (макрофаги типу 1). В іншому аспекті запропоновано виділені полінуклеотиди, які кодують білки, що зв'язуються з антигеном, які зв'язуються з GM-CSF, де виділені полінуклеотиди функціонально зв'язані з контрольною послідовністю. В іншому аспекті запропоновано вектори експресії та клітини-хазяї, які перетворені або трансфіковані векторами експресії, що включають вищезазначені виділені полінуклеотиди, які кодують білки, що зв'язуються з антигенами, які можуть зв'язуватись з GM-CSF. В іншому аспекті також запропоновано способи одержання білків, що зв'язуються з антигенами, які включають стадію одержання білка, що зв'язується з антигеном, з клітини-хазяїна, яка виділяє білок, що зв'язується з антигеном. В іншому аспекті запропоновано фармацевтичну композицію, що включає як мінімум один із запропонованих вищезазначених білків, що зв'язуються з антигеном, та фармацевтично прийнятну допоміжну речовину. В одному варіанті фармацевтична композиція може включати додатковий активний агент, вибраний з групи, що складається з радіоізотопу, радіонукліду, токсину або терапевтичної та хіміотерапевтичної групи. 97414 14 В іншому аспекті запропоновано спосіб лікування або профілактики у пацієнта стану, пов'язаного з GM-CSF, де спосіб включає введення пацієнту ефективної кількості як мінімум одного виділеного білка, що зв'язується з антигеном. В одному з варіантів стан вибраний з групи, що складається з ревматичних розладів, аутоімунних розладів, гематологічних розладів, онкологічних розладів, запальних розладів, дегенеративних станів нервової системи, розладів шлунковокишкової системи, гастроуринарних, ендокринних розладів тощо. В одному з варіантів стан являє собою розлад або захворювання, яке вибране з групи, що складається з множинного склерозу (МС), ревматоїдного артриту (РА), астми, псоріазу, атопічного дерматиту та саркоїдозу. Інший варіант включає лікування виділеним білком, що зв'язується з антигеном, окремо або в складі комбінованої терапії. Ще в одному варіанті стан вибраний з раку молочної залози, раку передміхурової залози, раку ободової та прямої кишки, ендометріальної аденокарциноми, лейкемії, лімфоми, меланоми, раку шлунку, астроцитального раку, раку ендометрію, раку шийки матки, раку сечового міхура, раку нирок та раку яєчників. В іншому аспекті винаходу запропоновано спосіб інгібування зв'язування GM-CSF з позаклітинною частиною GM-CSFR у хворого, що включає введення ефективної кількості як мінімум одного білка, що зв'язується з антигеном, запропонованого в даному описі. В іншому аспекті винаходу пропонується спосіб інгібування фосфорилування людського GMCSFR у хворого, що включає введення ефективної кількості як мінімум одного білка, що зв'язується з антигеном, як описано в даному описі. В іншому аспекті виділений білок, що зв'язується з антигеном, зменшує хемотаксис моноцитів при введенні пацієнту. В одному з варіантів білок, що зв'язується з антигеном, інгібує міграцію моноцитів. В іншому варіанті міграція моноцитів в пухлини інгібується, коли виділений білок, що зв'язується з антигеном, вводять пацієнту. Крім того, в іншому аспекті запропоновано спосіб лікування множинного склерозу, який включає введення ізольованого білка, що зв'язується з антигеном, як описано в даному описі. Також розглянуто такі стани, як рецидивноремітивний множинний склероз, прогресуючорецидивний множинний склероз, первиннопрогресуючий множинний склероз або вторинний прогресуючий множинний склероз. В одному з аспектів також запропоновано спосіб лікування ревматоїдного артриту, що включає введення виділеного білка, що зв'язується з антигеном, як описано в даному описі. У додаткових аспектах запропоновано виділені білки, що зв'язуються з антигеном, які є перехресно-реактивними з GM-CSF яванської макаки в межах 1 log людського GM-CSF і які зв'язуються з GM-CSF з ІС50 < 1 нМ, за даними GM-CSFзалежного аналізу. Детальніше наведені та інші аспекти будуть описані в даному описі. Кожний із запропонованих аспектів може включати різноманітні варіанти, за 15 пропоновані в даному описі. Таким чином, передбачається, що кожний з варіантів, що включає один елемент або комбінації елементів, може бути включений до кожного розкритого аспекту. Інші ознаки, об'єкти та переваги розкритого винаходу будуть очевидними з наступного детального опису. ФІГУРИ 1a-d: А) Профілактичне застосування МАb проти мишачого GM-CSF при активному відстроченому нападі ЕАЕ та зменшена зустрічальність захворювання. З метою індукування активного SJL/PLP 139-151 ЕАЕ, 11 мишам вводили 250 мкг PLP 139-151 + CFA підшкірно та оцінювали стан тварин протягом трьох тижнів. 11 мишам на групу вводили 500 мкг mAb проти мишачого GM-CSF, контрольне mAb такого ж ізотипу або фосфатний буферний розчин (ФБР) в день імунізації. Щоденно проводили зважування та оцінку стану в балах. Клінічна оцінка 0: відсутність захворювання; 1: хвіст ненапружений; 2: незначне порушення рефлексу випрямлення або порушення ходи; 3: тяжкий ступінь слабкості задніх кінцівок, частковий параліч задніх кінцівок; 4: повний параліч задніх кінцівок, використання для руху передніх кінцівок. mAb проти GM-CSF демонструє затримку нападів у порівнянні з контрольними тваринами, із зустрічальністю 45% у порівнянні з 91-100% у контрольних групах. В та С) Профілактичне застосування mAb проти GM-CSF запобігало зниженню маси (В) та знижувало середній бал клінічної оцінки (С). D) Результати застосування одноразової дози 500 мкг mAb проти mGM-CSF, контрольного mAb такого ж ізотипу або ФБР у день початку захворювання, η = 14 мишей. Терапевтичне застосування mAb проти GM-CSF при активному ЕАЕ знижувало середній бал клінічної оцінки. Ρ < 0,05 проти контрольного антитіла такого ж ізотопу або ФБР. ФІГУРИ 2а-с: А) Терапевтичне застосування mAb проти mGM-CSF при активному ЕАЕ прискорювало одужання. Одужання = зниження ≥ 1 загального показника ≥ 2d безперервно до показника ≤ 1. В) Терапевтичне введення mAb проти mGMCSF у день початку захворювання (13-й день після імунізації) знижувало рівень запалення ЦНС у порівнянні з мишами, яких лікували із застосуванням mAb проти mGM-CSF, контрольного mAb такого ж ізотипу або контролю ФБР. С та D) Профілактичне або терапевтичне застосування mAb проти mGMCSF при адоптивному переносі полегшеного захворювання ЕАЕ. В моделі адоптивного переносу ЕАЕ, 15 мишам вводили 100 мкг PLP 139-151 + CFA, клітини лімфатичних вузлів витягали на 10-й день після імунізації, стимулювали пептидом PLP протягом 4 дні in vitro та вводили за допомогою ін'єкції мишам-реципієнтам. Стан мишей оцінювали протягом трьох тижнів щодо ваги та клінічних показників. ФІГУРА С демонструє лікування у день переносу клітин, ФІГУРА D демонструє лікування у день початку ЕАЕ. ФІГУРА 3: Репрезентативний аналіз фосфорилування TF-1 Stat5, що демонструє інгібування mAb проти GM-CSF або 0,4 нг/мл rhGM-CSF-lle. ФІГУРА 4: Гістограма, що демонструє розподіл інгібування rhGM-CSF-lle в аналізі фосфорилуван 97414 16 ня TF-1 STAT5 супернатанту гібридоми ту з імунізованих rhGM-CSF з Е. соlі мишей. ФІГУРА 5: Репрезентативний аналіз проліферації AML-5, що демонструє інгібування mАb проти GM-CSF 0,5 нг/мл rhGM-CSF-lle. ФІГУРИ 6а-f: Інгібування GM-CSF та CSF-1 за допомогою mAb,одержаного та очищеного із супернатантів гібридоми в аналізі проліферації AML-5. ФІГУРИ 7а-b: інгібування GM-CSF та IL-3 за допомогою mAb, одержаного та очищеного із супернатантів гібридоми в аналізі фосфорилування TF-1 Stat5. ФІГУРИ 8а-b: Результати вимірювання методом ELISA зв'язування mАb проти GM-CSF із супернатанту гібридоми або рекомбінантих mAb проти GM-CSF різних видів. ФІГУРА 9: Інгібування GM-CSF людини та га яванської макаки рекомбінантним mAb (2 ТТ та ша 2 SCL) в аналізі проліферації AML-5. ФІГУРА 10: Інгібування GM-CSF людини та га яванської макаки рекомбінантним mAb (2 ТТ та га 2 SCL) в аналізі фосфорилування TF-1 Stat5. ФІГУРА 11: Інгібування природного GM-CSF з легень людини та яванської макаки рекомбінантша ним mAb (1 ТТ) в аналізі фосфорилування TF-1 Stat5. ФІГУРА 12: Інгібування природного GM-CSF з га ПМЯЛ яванської макаки рекомбінантним mAb (2 SCL) IgG В в аналізі фосфорилування TF-1 Stat5. ФІГУРА 13: Інгібування GM-CSF людини рекога мбінантним mAb (2 ТТ) в аналізі моноцитів людини. ФІГУРА 14: Інгібування індукованого GM-CSF продукування МІР-1b та ENA78 в суцільній крові га рекомбінантним mAb (2 SCL) IgG В. ФІГУРИ 15a-b: mAb, одержаний та очищений із супернатантів гібридоми не інгібує rhGM-CSF з ® дріжджів (Leukine ) в аналізі проліферації AML-5 (а) або аналізі моноцитів (b). ФІГУРА 16: mAb нейтралізує rhGM-CSF з Е. ® соlі, але не rhGM-CSF дріжджів (Leukine ) або неглікозильований rhGM-CSF-R23L з Е. соlі. Слід розуміти, що даний винахід не обмежується конкретною методологією, протоколами та реактивами, тощо, які описані в даному описі, і як такі можуть змінюватися. Термінологія, яка використовується в даному описі, наведена з метою опису тільки конкретних варіантів і не має на меті обмежувати контекст розкритого в описі винаходу, який визначається виключно формулою винаходу. Способи та методи даної заявки загалом виконуються відповідно до традиційних способів, які є добре відомими в даній області, і як описано в різних загальних та більш специфічних посиланнях, які цитуються та обговорюються в межах даного опису, якщо не вказано інше. Див. Sambrook et al., Molecular Cloning: A Laboratory Manual, 3rd ed, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. (2001), Ausubel et al., Current Protocols in Molecular Biology, Greene Publishing Associates (1992) та Harlow and Lane Antibodies: A Laboratory Manual Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. (1990). Термін "полінуклеотид" включає як одноланцюгові, так і двохланцюгові нуклеїнові кислоти, 17 а також включає геномні ДНК, РНК, мРНК, кДНК, або синтетичного походження або деякі їх комбінації, не пов'язані з послідовностями, які звичайно існують у природі. Виділені полінуклеотиди, що включають вказані послідовності, можуть включати окрім вказаних послідовностей, послідовності, які кодують до десяти або навіть до двадцяти інших білків або їх частин, або можуть включати функціонально зв'язані регуляторні послідовності, які контролюють експресією кодуючої ділянки згаданих послідовностей нуклеїнових кислот, та/або можуть включати послідовності вектора. Нуклеотиди, що включають полінуклеотид, можуть бути рибонуклеотидами або дезоксирибонуклеотидами або модифікованою формою будь-якого типу нуклеотиду. Зазначені модифікації включають модифіковані основи, такі як похідні бромуридину та інозину, модифікації рибози, такі як 2',3'дидезоксирибоза, та модифікації внутрішньонуклеотидного зв'язку, такі як фосфортіолят, фосфордитіолят, фосфорселеноат, фосфордиселеноат, фосфоранілотіолят, фосфораніладат та фосфорамідат. Під терміном "олігонуклеотид" мається на увазі полінуклеотид, що містить 100 або менше нуклеотидів. У деяких варіантах, довжина олігонуклеотидів становить від 10 до 60 основ. В інших варіантах, довжина олігонуклеотидів становить від 12, 13, 14, 15, 16, 17, 18, 19 або 20 до 40 нуклеотидів. Олігонуклеотиди можуть бути одноланцюговими або двохланцюговими, наприклад, для застосування в конструюванні мутантного гена. Олігонуклеотиди можуть бути смисловими або антисмисловими олігонуклеотидами. Олігонуклеотид може включати мітку, що піддається детектуванню, таку як радіомітка, флуоресцентна мітка, гаптен або антигенна мітка, для аналізів з метою виявлення. Олігонуклеотиди можуть використовуватися як праймери ПЛР, праймери клонування або зонди для гібридизації. Термін "контрольна послідовність" відноситься до послідовності полінуклеотиду, яка може впливати на експресію та обробку кодування послідовностей, з якими вона зв'язана. Природа таких контрольних послідовностей може залежати від організму-хазяїна. У конкретних варіантах, контрольні послідовності для прокаріотів можуть включати промотор, сайт зв'язування з рибосомою та послідовність термінації транскрипції. Наприклад, контрольні послідовності для еукаріотів можуть включати промотори, що містять одну або декілька ділянок розпізнавання для факторів транскрипції, послідовності енхансерів транскрипції та послідовність термінації транскрипції. "Контрольні послідовності" можуть включати лідерні послідовності та/або послідовності злиття з партнером. Під терміном "вектор" мається на увазі будьяка молекула або об'єкт (наприклад, нуклеїнова кислота, плазміда, бактеріофаг або вірус), що використовується для перенесення інформації, яка кодує білок, в клітину-хазяїна. Термін "вектор експресії" або "експресійна конструкція" відноситься до вектору, який є придатним для трансформації клітини-хазяїна та містить послідовності нуклеїнових кислот, які спрямовують та/або контролюють 97414 18 (у поєднанні з клітиною-хазяїном) експресію однієї або більше гетерологічних кодуючих ділянок, функціонально пов'язаних з нею. Експресійна конструкція може включати, не обмежуючись ними, послідовності, які впливають або контролюють транскрипцію, трансляцію та, у випадку присутності інтронів, впливають на сплайсинг кодуючої ділянки РНК, функціонально пов'язаної з нею. В даному описі "функціонально зв'язаний" означає, що компоненти, до яких цей термін застосований, знаходяться у взаємовідношенні, яке дозволяє здійснювати властиві їм функції. Наприклад, контрольна послідовність, така як, промотор, у векторі, який "функціонально пов'язаний" з послідовністю, що кодує білок, організовані таким чином, що нормальна активність контрольної послідовності приводить до транскрипції послідовності, яка кодує білок, результатом чого є рекомбінантна експресія кодованого білка. Під терміном "трансфекція" мається на увазі поглинання чужорідної або екзогенної ДНК клітиною, і клітина стає "трансфікованою", коли екзогенна ДНК введена усередину клітинної мембрани. Цілий ряд методів забезпечення трансфекції добре відомий в даній області і розкритий у даному описі. Див., наприклад, Graham et al., 1973, Virology 52: 456; Sambrook et al., 2001, Molecular Cloning: A Laboratory Manual, вище; Davis et al., 1986, Basic Methods in Molecular Biology, Elsevier; Chu et al., 1981, Gene 13: 197. Такі методи можуть застосовуватися для введення одного або більше екзогенних фрагментів ДНК в придатні клітинихазяї. Під терміном "поліпептид" або "білок" мається на увазі макромолекула, що містить послідовність амінокислот природного білка, тобто, білок, продукований клітиною природного походження, тобто не рекомбінантною; або він продукований генетично модифікованою або рекомбінантною клітиною та включає молекули, що містять послідовність амінокислот природного білка, або молекули, що містять делеції, додавання та/або заміни однієї або більше амінокислот в порівнянні з природною послідовністю. Термін також включає амінокислотні полімери, в яких одна або більше амінокислот являють собою хімічні аналоги відповідних амінокислот і полімерів природного походження. Терміни "поліпептид" та "білок" включають білки, що зв'язуються з антигеном GM-CSF, антитіла або послідовності, які містять делеції, додавання та/або заміни однієї або більше амінокислот в порівнянні з білком, що зв'язуються з антигеном. Термін "фрагмент поліпептиду" позначає поліпептид, який містить аміно-кінцеву делецію, карбоксилкінцеву делецію та/або делецію всередині молекули в порівнянні з повнорозмірним природним білком. Такі фрагменти можуть також містити модифіковані амінокислоти у порівнянні з природним білком. У деяких варіантах, довжина фрагментів становить від приблизно 5 до 500 амінокислот. Наприклад, довжина фрагменту може становити як мінімум 5, 6, 8, 10, 14, 20, 50, 70, 100, 110, 150, 200, 250, 300, 350, 400 або 450 амінокислот. Придатні поліпептидні фрагменти включають імунологічно функціональні фрагменти антитіл, зокрема 19 домени зв'язування. У випадку антитіла, з яким зв'язується GM-CSF, придатні фрагменти включають, не обмежуючись ними, ділянку CDR, варіабельний домен важкого або легкого ланцюга, частину ланцюга антитіла або тільки його варіабельну ділянку, в тому числі дві CDR, тощо. Терміном "виділений білок" позначається білок, який є очищеним від білків або поліпептидів або інших забруднюючих речовин, які б перешкоджали його терапевтичному, діагностичному, профілактичному, науковому або іншому застосуванню. "Варіант" поліпептиду (наприклад, білок, що зв'язуються з антигеном, або антитіло) включає послідовність амінокислот, де один або більше залишків амінокислот вставлений, видалений та/або замінений в послідовності амінокислот в порівнянні з іншою послідовністю поліпептиду. Варіанти включають химерні білки. "Похідне" поліпептиду являє собою поліпептид (наприклад, білок, що зв'язується з антигеном, або антитіло), який є хімічно модифікованим деяким чином, що відрізняється від варіантів вставки, делеції або заміни, наприклад, через з'єднання з іншим хімічним компонентом. Термін "природного походження", який застосовується в даному описі до біологічних матеріалів, таких як поліпептиди, нуклеїнові кислоти, клітини-хазяї, тощо, позначає матеріали, які існують в природі. Під "білком, що зв'язуються з антигеном" в даному описі, мається на увазі білок, який специфічно зв'язується зі специфічним цільовим антигеном; причому запропонованим антигеном є GM-CSF або GM-CSF людини. Вважається, що білок, який зв'язуються з антигеном, "специфічно зв'язується з відповідним цільовим антигеном, якщо константа дисоціації (Kd) -8 дорівнює ≤ 10 М. Антитіло специфічно зв'язується з антигеном з "високою спорідненістю", якщо Kd -9 дорівнює ≤ 5 × 10 М, та зв'язується з "дуже висо-10 кою спорідненістю", якщо Kd дорівнює ≤ 5 × 10 Μ. В одному з варіантів, антитіло демонструє Kd ≤ -9 10 Μ та швидкість дисоціації приблизно 1 × 10 4 /сек. В одному з варіантів, швидкість дисоціації -5 дорівнює ≤ 1 × 10 . У інших варіантах, антитіла зв'язуються з GM-CSF або GM-CSF людини з Kd -8 -10 від приблизно 10 Μ до 10 М, і в іншому варіанті -10 вони зв'язуються з Kd ≤ 2 × 10 . Під "ділянкою, що зв'язується з антигеном" мається на увазі білок, або частина білка, яка специфічно зв'язується з вказаним антигеном. Наприклад, та частина білка, що зв'язується з антигеном замістить залишки амінокислот, які взаємодіють з антигеном і надають білку, що зв'язується з антигеном, його специфічність та спорідненість по відношенню до антигену, позначається як "ділянка, що зв'язується з антигеном." Ділянка, що зв'язується з антигеном, звичайно включає одну або більше "ділянок зв'язування, що визначають комплементарність" ("CDR"). Деякі ділянки, що зв'язуються з антигеном, також включають одну або більше "каркасних" ділянок. "CDR" являє собою послідовність амінокислот, яка сприяє специфічності та спорідненості зв'язування з антигеном. 97414 20 "Каркасні" ділянки можуть допомогти в підтримці відповідної конформації CDR для сприяння зв'язування між ділянкою, що зв'язується з антигеном, та антигеном. У деяких аспектах запропоновано рекомбінантні білки, що зв'язуються з антигеном, які зв'язуються з білком GM-CSF або GM-CSF людини. У даному контексті "рекомбінантний білок" являє собою білок, одержаний із застосуванням рекомбінантних методів, тобто, через експресію рекомбінантної нуклеїнової кислоти, як описано в даному описі. Способи та методи продукування рекомбінантних білків добре відомі в даній галузі. Термін "антитіло" позначає інтактний імуноглобулін будь-якого ізотипу, або його фрагмент, який може конкурувати з інтактним антитілом за специфічне зв'язування з цільовим антигеном та включає, наприклад, химерні, гуманізовані, повністю людські антитіла та антитіла з подвійною специфічністю. "Антитіло" як таке являє собою різновид білка, що зв'язується з антигеном. Інтактне антитіло загалом включає як мінімум два повні важкі ланцюги та два повні легкі ланцюги, але в деяких випадках може включати меншу кількість ланцюгів, наприклад, антитіла, що природно зустрічаються у верблюжачих, які можуть включати тільки важкі ланцюги. Антитіла можуть походити виключно з єдиного джерела, або можуть бути "химерними", тобто, різні частини антитіла можуть походити з двох різних антитіл, як описано нижче. Білки, що зв'язуються з антигеном, антитіла, або фрагменти зв'язування можуть бути продуковані в гібридомах, методами рекомбінації ДНК або ферментним або хімічним розщепленням інтактних антитіл. Якщо не вказано інше, термін "антитіло" включає, окрім антитіл, що містять два повні важкі ланцюги та два повні легкі ланцюги, їх похідні, варіанти, фрагменти та мутеїни, приклади яких описані нижче. Термін "легкий ланцюг" включає повнорозмірний легкий ланцюг та його фрагменти, що містять достатню послідовність варіабельних ділянок для забезпечення специфічності зв'язування. У типовому антитілі ссавця присутній повнорозмірний легкий ланцюг, який включає домен варіабельної ділянки, VL, та домен константної ділянки, CL, де домен варіабельної ділянки легкого ланцюга спрямований до аміно-кінця поліпептиду. Типові легкі ланцюги антитіла людини включають ланцюги капа або ланцюги лямбда. Термін "важкий ланцюг" включає повнорозмірний важкий ланцюг та його фрагменти, що містять достатню послідовність варіабельних ділянок для забезпечення специфічності зв'язування. Антитіло ссавця з повнорозмірним важким ланцюгом звичайно включає домен варіабельної ділянки, VH, і три домени константних ділянок, СН1, СН2 та СН3. Домен VH спрямований до аміно-кінця поліпептиду, а домени СH спрямовані до карбоксильного кінця, де СН3 є найближчим до карбоксильного кінця поліпептиду. Важкі ланцюги людини звичайно можуть мати ізотипи, які включають IgG (в тому числі підтипи lgG1, lgG2, lgG3 та lgG4), IgA (в тому числі підтипи ІgА1 та ІgА2), ІgМ та ІgЕ. 21 Термін "функціональний фрагмент" (або просто "фрагмент") ланцюга антитіла або імуноглобуліну (важкого або легкого ланцюга) в даному описі являє собою білок, що зв'язується з антигеном, який включає частину (незважаючи на те, яким чином дана частина одержана або синтезована) антитіла, якій бракує як мінімум деяких амінокислот, що є присутніми в повнорозмірному ланцюгу, але яка здатна специфічно зв'язуватись з антигеном. Такі фрагменти є біологічно активними в тому, що вони специфічно зв'язуються з цільовим антигеном та можуть конкурувати з іншими білками, що зв'язуються з антигеном, зокрема з інтактними антитілами, за специфічне зв'язування з даним епітопом. В одному з аспектів такий фрагмент зберігає як мінімум одну CDR, що є присутньою в повнорозмірнму легкому або важкому ланцюгу, та в деяких варіантах буде включати єдиний важкий ланцюг та/або легкий ланцюг або їх частини. Такі біологічно активні фрагменти можуть бути продуковані методами рекомбінації ДНК, або можуть бути продуковані ферментним або хімічним розщепленням білків, що зв'язуються з антигеном, включаючи інтактні антитіла. Імунологічно функціональні фрагменти імуноглобуліну включають, не обмежуючись ними, Fab, Fab', F(ab')2, Fv, доменні антитіла та одноланцюгові антитіла, та можуть походити з будь-якого ссавцевого джерела, включаючи, але не обмежуючись ними, людину, мишу, щура, верблюда або кролика. Далі обговорюється, що функціональна частина білків, що зв'язується з антигеном, яка розкривається в даному описі, наприклад, одна або більше CDR, може бути ковалентно зв'язаною з іншим білком або з молекулою невеликого розміру для створення терапевтичного агента, спрямованого на конкретну мішень в організмі, що володіє біфункціональними терапевтичними властивостями або демонструє пролонгований період напіввиведення з сироватки. "Фрагмент Fab" складається з одного легкого ланцюга та СН1 і варіабельних ділянок одного важкого ланцюга. Важкий ланцюг Fab молекули не може утворювати дисульфідний зв'язок з іншою молекулою важкого ланцюга. Ділянка "Fc" містить два фрагменти важкого ланцюга, що включають домени антитіла СН1 та СН2. Два фрагменти важкого ланцюга утримуються разом за допомогою двох або більше дисульфідних зв'язків та гідрофобною взаємодією доменів СН3. "Фрагмент Fab'" містить один легкий ланцюг та частину одного важкого ланцюга, який містить домен VH та домен СН1, а також ділянку між доменами СН1 та СН2, таким чином, що зв'язок дисульфіду між ланцюгами може утворюватись між двома важкими ланцюгами двох фрагментів Fab' з утворенням молекули F(ab')2. "Фрагмент F(ab')2" містить два легкі ланцюги і два важкі ланцюги, що містять частину константної ділянки між доменами СН1 та СН2, таким чином, що дисульфідний зв'язок між ланцюгами може утворюватись між двома важкими ланцюгами. Фрагмент F(ab')2, таким чином, складається з двох фрагментів Fab', які утримуються разом за допо 97414 22 могою дисульфідного зв'язку між двома важкими ланцюгами. "Ділянка Fv" включає варіабельні ділянки як важких, так і легких ланцюгів, але не містить константних ділянок. "Одноланцюгові антитіла" являють собою молекули Fv, в яких варіабельні ділянки важких та легких ланцюгів сполучені гнучким лінкером з утворенням єдиного поліпептидного ланцюга, який формує ділянку, що зв'язуються з антигеном. Одноланцюгові антитіла детально обговорюються у публікації РСТ WO 88/01649 та патентах США №№ 4,946,778 та 5,260,203. "Доменне антитіло" являє собою імунологічно функціональний фрагмент імуноглобуліну, що містить тільки варіабельну ділянку важкого ланцюга або варіабельну ділянку легкого ланцюга. У деяких випадках, дві або більше ділянок VH ковалентно зв'язані за допомогою пептидного лінкера для утворення двохвалентного доменного антитіла. Дві ділянки VH двохвалентного доменного антитіла можуть бути спрямовані на один і той же або різні антигени. "Двохвалентний білок, що зв'язується з антигеном" або "двохвалентне антитіло" включає два сайти, що зв'язуються з антигеном. У деяких випадках, два сайти зв'язування володіють однаковою специфічністю по відношенню до антигену. Двохвалентні білки, що зв'язуються з антигеном, та двохвалентні антитіла можуть бути біспецифічними, див. нижче. "Поліспецифічний білок, що зв'язується з антигеном", або "поліспецифічне антитіло" являє собою білок, що спрямований на більш ніж один антиген або епітоп. "Біспецифічний", "з подвійноюспецифічністю" або "біфункціональний" білок, що зв'язуються з антигеном, або антитіло являє собою гібридний білок, що зв'язується з антигеном, або антитіло, відповідно, що містить два різні сайти, що зв'язуються з антигеном. Біфункціональні білки, що зв'язуються з антигеном, та антитіла являють собою різновиди поліспецифічного білка, що зв'язується з антигеном, або антитіла і можуть бути продуковані різноманітними способами, в тому числі, але не обмежуючись ними, злиття гібридом або з'єднання фрагментів Fab'. Див., наприклад, Songsivilai and Lachmann, 1990, Clin. Exp. Immunol. 79: 315-321; Kostelny et al., 1992, J. Immunol. 148: 1547-1553. Два сайти зв'язування біфункціонального білка, що зв'язується з антигеном, або антитіла зв'язуються з двома різними епітопами, які можуть знаходитись на одному або різних білках-мішенях. Термін "нейтралізуючий білок, що зв'язуються з антигеном" або "нейтралізуюче антитіло" позначає білок, що зв'язуються з антигеном, або антитіло, відповідно, яке зв'язується з лігандом, перешкоджає зв'язуванню ліганду з його партнером по зв'язуванню та перериває біологічну реакцію, яка в іншому випадку була б результатом зв'язування ліганду з його партнером по зв'язуванню. При оцінці зв'язування та специфічності білка, що зв'язуються з антигеном, наприклад, антитіла або його імунологічно функціонального фрагмента, антитіло або фрагмент буде істотною мірою інгібувати 23 зв'язування ліганду з його партнером по зв'язуванню, якщо надлишок антитіла зменшує кількість зв'язувань партнера по зв'язуванню з лігандом як мінімум на приблизно 20%, 30%, 40%, 50%, 60%, 70%, 80%, 85%, 90%, 95%, 97%, 99% або більше (за даними аналізу конкурентного зв'язування in vitro). У випадку білків, що зв'язуються з антигеном GM-CSF, така нейтралізуюча молекула буде зменшувати здатність GM-CSF зв'язуватись з GMCSFR. Термін "конкурувати", якщо він застосовується в контексті білків, що зв'язуються з антигеном, (наприклад, нейтралізуючі білки, що зв'язуються з антигеном, або нейтралізуючі антитіла), які конкурують за один епітоп, позначає конкурування між білками, що зв'язуються з антигеном, яка визначається за допомогою аналізу, в якому досліджуваний білок, що зв'язується з антигеном, (наприклад, антитіло або його імунологічно функціональний фрагмент), перешкоджає або інгібує специфічне зв'язування довідкового білка, що зв'язується з антигеном (наприклад, лігандом або довідковим антитілом), із звичайним антигеном (наприклад, GM-CSF або його фрагментом). Численні типи аналізів конкурентного зв'язування можуть застосовуватись, наприклад: прямий або непрямий твердофазний радіоімунологічний аналіз (RIA), прямий або непрямий твердофазний імуноферментний аналіз (ЕІА), "сендвічевий" аналіз конкурування (див., наприклад, Stahli et al., 1983, Methods in Enzymology 9: 242-253); твердофазний прямий аналіз ЕІА із застосуванням біотину-авідину (див., наприклад, Kirkland et al., 1986, J. Immunol. 137: 3614-3619), твердофазний аналіз RIA із застосуванням прямої мітки, прямий мічений багатошаровий аналіз твердої фази (див., наприклад, Harlow and Lane, 1988, Antibodies, A Laboratory Manual, Cold Spring Harbor Press); прямий мічений RIA твердої фази із застосуванням мітки 1-125 (див., наприклад, Morel et al., 1988, Molec. Immunol. 25: 7-15); прямий біотин-авідин ЕІА твердої фази (див., наприклад, Cheung, et al., 1990, Virology 176: 546-552); та прямий мічений RIA (Moldenhauer et al., 1990, Scand. J. Immunol. 32: 77-82). Звичайно, такий аналіз передбачає застосування очищеного антигену, пов'язаного з твердою поверхнею або клітинами, що несуть будь-який з них, немаркованого білка, що зв'язується з антигеном, який випробовується, та міченого референтного білка, що зв'язується з антигеном. Конкурентне інгібування вимірюється за допомогою визначення кількості мічених зв'язків з твердою поверхнею або клітинами у присутності білка, що зв'язується з антигеном, який випробовується. Звичайно білок, що зв'язується з антигеном, який випробовується, присутній в надлишку. Білки, що зв'язуються з антигеном, які ідентифікуються за допомогою конкурентного аналізу (конкуруючі білки, що зв'язуються з антигеном), включають білки, що зв'язуються з антигеном, які зв'язуються з тим самим епітопом, що і референтні білки, що зв'язуються з антигеном, та білки, що зв'язуються з антигеном, які зв'язуються з суміжним епітопом достатньо проксимально до зв'язку 97414 24 епітопу з референтним білком, що зв'язується з антигеном, для утворення стеричної невідповідності. Додаткові деталі щодо способів визначення конкурентного зв'язування запропоновано в прикладах в даному описі. Звичайно, коли конкуруючий білок, що зв'язуються з антигеном, присутній в надлишку, він інгібуватиме специфічне зв'язування референтного білка, що зв'язується з антигеном, до звичайного антигену як мінімум на 40%, 45%, 50%, 55%, 60%, 65%, 70% або 75%. У деякому відношенні, зв'язування інгібується як мінімум на 80%, 85%, 90%, 95% або 97% або більше. Терміном "антиген" позначається молекула або частина молекули, яка є здатною бути зв'язаною селективним агентом зв'язування, таким як білок, що зв'язуються з антигеном, (включаючи, наприклад, антитіло або його імунологічний функціональний фрагмент) та додатково здатний до використовування на тваринах для того, щоб продукувати антитіла, що здатні до зв'язування з даним антигеном. Антиген може мати один або більше епітопи, які здатні до взаємодії з різними білками, що зв'язуються з антигеном, наприклад, антитілами. Термін "епітоп" включає будь-який детермінант, що є здатним до специфічного зв'язування з білком, що зв'язуються з антигеном. Епітоп являє собою ділянку антигену, який зв'язаний білком, що зв'язується з антигеном, який є специфічно націленим на даний антиген, і коли антиген являє собою білок, включає специфічні амінокислоти, які контактують з білком, що зв'язується з антигеном. Частіше всього, епітопи знаходяться на білках, які, як розуміється, включають не пост-трансляційні модифікації амінокислот, але в деяких випадках можуть знаходитися на інших видах молекул, таких як нуклеїнові кислоти. Епітопи можуть включати хімічно активні поверхневі групи молекул, такі як амінокислоти, бокові ланцюги цукрів, фосфорильні або сульфонільні групи, та можуть мати специфічні тривимірні структурні характеристики, та/або специфічні характеристики заряду. Загалом, антитіла, що є специфічними для конкретного цільового антигену, переважно розпізнає епітоп на цільовому антигені в комплексній суміші білків та/або макромолекул. Термін "ідентичність" позначає взаємовідношення між послідовностями двох або більше молекул поліпептиду або двох або більше полінуклеотидів, як визначається вирівнюванням або порівнюванням послідовності. Під "процентною ідентичністю" мається на увазі відсоток ідентичних залишків між амінокислотами або нуклеотидом у молекулах, що порівнюються, та обчислюється, спираючись на розмір найменшої з порівнюваних молекул. Для цих обчислень, гепи у вирівнюваннях (якщо такі є) повинні посилатися на конкретну математичну модель або комп'ютерну програму (тобто, "алгоритм"). Способи, які можуть застосовуватися для обчислення ідентичності вирівняних нуклеїнових кислот або поліпептидів, включають ті, що описані у Computational Molecular Biology, (Lesk, A. M., ed.), 1988, New York: Oxford University Press; Biocomputing Informatics and Genome Projects, (Smith, D. W., ed.), 1993, New York: 25 Academic Press; Computer Analysis of Sequence Data, Part I (Griffin, A. M., and Griffin, H. G., eds.), 1994, New Jersey: Humana Press; von Heinje, G., 1987, Sequence Analysis in Molecular Biology, New York: Academic Press; Sequence Analysis Primer (Gribskov, M. and Devereux, J., eds.), 1991, New York: M. Stockton Press; and Carillo et al., 1988, SI AM J. Applied Math. 48: 1073. У обчисленні процентної ідентичності, порівнювані послідовності є вирівняними у такому відношенні, яке забезпечує найбільшу відповідність між послідовностями. Комп'ютерна програма, що використовується для визначення процентної ідентичності, являє собою пакет програми GCG, який включає GAP (Devereux et al., 1984, Nucl. Acid Res. 12:387; Genetics Computer Group, University of Wisconsin, Madison, Wl). Комп'ютерний алгоритм GAP застосовується для того, щоб вирівняти два поліпептиди або полінуклеотиди, для яких ідентичність процентної послідовності має бути визначена. Послідовності вирівнюються для оптимальної відповідності до їх відповідної амінокислоти або нуклеотиду ("діапазон відповідності", як визначається алгоритмом). Штраф за відкриття гепу (що обчислюється 3 × середню діагональ, де "середня діагональ" являє собою середню величину діагоналі матриці порівняння, що використовувалась; "діагональ" являє собою показник або число, що призначається кожній довершеній відповідності амінокислот конкретною матрицею порівняння) та штраф за подовження гепу (яке звичайно складає 1/10 штрафу за відкриття гепу), також як і матрицю порівняння, як наприклад РАМ 250 або BLOSUM 62, що застосовуються у поєднанні з алгоритмом. У певних варіантах, стандартна матриця порівняння (Див., Dayhoff et al., 1978, Atlas of Protein Sequence and Structure 5: 345-352 for the РАМ 250 comparison matrix; Henikoff et al., 1992, Proc. Natl. Acad. Sci. U.S.A. 89: 10915-10919 for the BLOSUM 62 comparison matrix) також застосовується алгоритмом. Рекомендовані параметри для визначення процентної ідентичності для поліпептидів або послідовностей нуклеотидів, із застосуванням програми GAP, наступні: Алгоритм: Needleman et al., 1970, J. Моl. Biol. 48:443-453; Матриця порівняння: BLOSUM 62 з Henikoff et al., 1992, вище; Штраф за геп: 12 (але без штрафу для кінцевих гепів) Штраф за довжину гепу: 4 Поріг схожості: 0 Певні схеми вирівнювання для вирівнювання двох послідовностей амінокислот можуть приводити до відповідності лише короткої ділянки двох послідовностей, і дана невелика вирівняна ділянка може мати найвищу ідентичність послідовності, навіть якщо не існує ніякого істотного взаємовідношення між двома повними послідовностями. Відповідно, вибраний спосіб вирівнювання (Програма GAP) може бути за бажанням скоректований для того, щоб приводити до вирівнювання, яке охоплює як мінімум 50 суміжних амінокислот цільового поліпептиду. 97414 26 Як застосовується в даному описі, "істотною мірою чистий" означає, що описаний вид молекули являє собою наявний домінуючий вид, тобто, на молярній основі він є більш розповсюдженим, ніж будь-які інші індивідуальні види в такій же суміші. У певних варіантах, істото чиста молекула являє собою композицію, де об'єктний вид включає як мінімум 50% (на молярній основі) всіх видів макромолекул, що є в наявності. У інших варіантах, істотно чиста композиція буде включати як мінімум 80%, 85%, 90%, 95% або 99% всієї всіх видів макромолекул, наявних в композиції. У певних варіантах, надзвичайно гомогенна субстанція була очищена до такого ступеня, що забруднюючі види не можуть бути знайдений в композиції звичними способами виявлення, і тому композиція складається з окремих видів макромолекул, що можна простежити. Термін "терапевтично ефективна кількість" відноситься до кількості GM-CSF білка, що зв'язуються з антигеном, яка є визначеною для продукування будь-якої терапевтичної реакції у ссавця. Такі терапевтично ефективні кількості легко з'ясовуються будь-яким фахівцем у даній галузі. Термін "амінокислота" вживається в його нормальному значенні у даній галузі. Двадцять амінокислот природного походження та їх скорочення використовуються традиційно. Див., Immunology-Α Synthesis, 2nd Edition, (E. S. Golub and D. R. Gren, eds.), Sinauer Associates: Sunderland, Mass. (1991). Стереоізомери (наприклад, D-амінокислоти) двадцяти звичних амінокислот, амінокислоти неприродного походження, такі як [альфа]-, [альфа]дизаміщені амінокислоти, N-алкіл амінокислоти та інші нетрадиційні амінокислоти можуть також бути придатними компонентами для поліпептидів. Приклади нетрадиційних амінокислот включають: 4гідроксипролин, [гамма]-карбоксиглютамат, [іпсилон]-Ν,Ν,Ν-триметиллізин, [іпсилон]-Nацетиллізин, О-фосфосерин, N-ацетилсерин, Nформілметіонін, 3-метилгістидин, 5-гідроксилізин, [сигма]-N-метиларгінін та інші подібні амінокислоти та імінокислоти (наприклад, 4-гідроксипролін). У позначенні поліпептиду, що використовується в даному описі, лівий напрям являє собою амінокінцевий напрям, а правий напрям - карбоксилкінцевий напрям, відповідно до стандартного використання та домовленості. A. Загальний огляд Білки, що зв'язуються з антигеном, які зв'язуються з білком GM-CSF, зокрема людським білком GM-CSF (hGM-CSF), запропоновані в даному описі. Запропоновані білки, що зв'язуються з антигеном, являють собою поліпептиди, в яких одна або більше ділянок, що визначають комплементарність (CDR), як описано в даному описі, вбудовані та/або приєднані. У деяких білках, що зв'язуються з антигеном, CDR вбудовані в "каркасну" ділянку, яка орієнтує CDR таким чином, що забезпечуються відповідні властивості CDR щодо зв'язування з антигеном. Загалом, білки, що зв'язуються з антигеном, які запропоновано, можуть перешкоджати, блокувати, зменшувати або модулювати взаємодію між GM-CSFR та GM-CSF. 27 Деякі білки, що зв'язуються з антигеном, які описані в даному описі, являють собою антитіла або походять від антитіл. У деяких варіантах, поліпептидна структура білків, що зв'язуються з антигеном, базується на антитілах, включаючи, але не обмежуючись ними, моноклональні антитіла, антитіла з подвійною специфічністю, мінітіла, доменні антитіла, синтетичні антитіла (що іноді позначаються в даному описі як "міметичні антитіла"), химерні антитіла, гуманізовані антитіла, антитіла людини, злиті антитіла (що іноді позначаються в даному описі як "кон'югати антитіл") та їх фрагменти, відповідно. Різноманітні структури додатково описуються в даному описі. Білки, що зв'язуються з антигеном, які запропоновано в даному описі, продемонстрували здатність зв'язуватися з певними епітопами GM-CSF, зокрема GM-CSF людини. Як результат, білки, що зв'язуються з антигеном, які запропоновано в даному описі, здатні інгібувати активність GM-CSF. Зокрема, білки, що зв'язуються з антигеном, які зв'язуються з даними епітопами, інгібують, inter alia, індукцію проведення сигналу GM-CSFR, індукований GM-CSF ріст або диференціацію клітин та інші фізіологічні ефекти, які індукуються GM-CSF при зв'язуванні з GM-CSFR. Білки, що зв'язуються з антигеном, які розкриті в даному описі, мають різноманітне застосування. Деякі з білків, що зв'язуються з антигеном, наприклад, є придатними для аналізів специфічного зв'язування, афінного очищення GM-CSF, зокрема hGM-CSF або його лігандів, та для скринінгових аналізів з метою ідентифікації інших антагоністів дії GM-CSF. Деякі з білків, що зв'язуються з антигеном, придатні для інгібування зв'язування GMCSFR з GM-CSF, або для інгібування аутофосфорилування GM-CSF. Білки, що зв'язуються з антигеном, можуть застосовуватися в різноманітних лікувальних цілях, як пояснено в даному описі. Наприклад, деякі GMCSF білки, що зв'язуються з антигеном, придатні для лікування станів, пов'язаних з GM-CSF, наприклад, зменшення хемотаксису моноцитів у пацієнтів, інгібування міграції моноцитів в пухлини або інгібування акумуляції макрофагів, що пов'язані з пухлиною, в пухлині, як додатково описано в даному описі. Інші види застосування білків, що зв'язуються з антигеном, включають, наприклад, діагностику захворювань або станів, які пов'язані з GM-CSF, та скринінгові аналізи для визначення присутності або відсутності GM-CSF. Деякі з білків, що зв'язуються з антигеном, які описані в даному описі, придатні для лікування наслідків, симптомів та/або патологій, які пов'язані з активністю GMCSF. Вони включають, не обмежуючись ними, різні види запальних захворювань. В. Білки, що зв'язуються з антигеном GM-CSF Запропоновані різноманітні агенти, здатні до селективного зв'язування, які є придатними для регулювання активності GM-CSF. Такі агенти включають, наприклад, білки, що зв'язуються з антигеном, які містять домен, що зв'язується з антигеном (наприклад, одноланцюгові антитіла, доменні антитіла, імуноадгезії та поліпептиди з ділянкою, що зв'язується з антигеном) та специфічно 97414 28 зв'язуються з поліпептидом GM-CSF, зокрема GMCSF людини. Деякі з агентів, наприклад, є придатними для інгібування зв'язування GM-CSFR з GMCSF і, таким чином, можуть застосовуватись для інгібування одного або більше видів активності, що пов'язані з проведенням сигналу GM-CSF. В цілому, запропоновані білки, що зв'язуються з антигеном, звичайно включають одну або більше CDR, як описано в даному описі (наприклад, 1, 2, 3, 4, 5 або 6 CDR). У деяких випадках, білок, що зв'язується з антигеном, включає (а) структуру поліпептиду та (b) одну або більше CDR, які вставлені та/або приєднані до структури поліпептиду. Поліпептидна структура може мати багато різних форм. Наприклад, вона може бути або включати, каркас антитіл природного походження, або їх фрагмент або варіант, або може бути повністю синтетичного походження. Приклади різних поліпептидних структур додатково описано нижче. У деяких варіантах, поліпептидна структура білків, що зв'язуються з антигеном, являє собою антитіло або походить від антитіла, в тому числі, не обмежуючись ними, моноклональні антитіла, антитіла з подвійною специфічністю, мінітіла, доменні антитіла, синтетичні антитіла (які іноді позначаються в даному описі як "міметичні антитіла"), химерні антитіла, гуманізовані антитіла, злиті антитіла (які іноді позначаються як "кон'югати антитіл") та частини або фрагменти кожного з них, відповідно. У деяких випадках, білок, що зв'язується з антигеном, являє собою імунологічний фрагмент антитіла (наприклад, Fab, Fab', F(ab')2 або scFv). Різноманітні структури додатково описані та визначені в даному описі. Деякі білки, що зв'язуються з антигеном, як запропоновано в даному описі, специфічно зв'язуються з GM-CSF людини. "Специфічно зв'язується" в даному описі означає, що константа -8 -10 дисоціації рівноваги становить від
ДивитисяДодаткова інформація
Назва патенту англійськоюHuman gm-csf antigen binding proteins
Автори англійськоюKirchner, Jacqueline A., Brasel, Kenneth A., Olson, Kara, Escobar, Jose Carlos, Barone, Dauphine
Назва патенту російськоюВыделенное человеческое антитело, связывающееся с gm-csf
Автори російськоюКирчнер Жаклин А., Брейзел Кеннет А., Олсон Кара, Эскобар Хосе Карлос, Бароне Дауфине
МПК / Мітки
МПК: A61K 39/395, A61P 37/00, C12N 15/63, C12N 15/13, C07K 16/24
Мітки: gm-csf, антитіло, зв'язується, людське, яке, виділене
Код посилання
<a href="https://ua.patents.su/170-97414-vidilene-lyudske-antitilo-yake-zvyazuehtsya-z-gm-csf.html" target="_blank" rel="follow" title="База патентів України">Виділене людське антитіло, яке зв’язується з gm-csf</a>
Попередній патент: Спосіб деформування реологічно складних металів та сплавів
Наступний патент: Лікарський послаблюючий засіб
Випадковий патент: Залежна підвіска колісного транспортного засобу