Тверда фармацевтична композиція
Формула / Реферат
1. Тверда фармацевтична композиція, яка містить (а) цилостазол, (b) попередньо желатинізований крохмаль в кількості від 10 до 90 % по масі, з розрахунку на загальну вагу композиції, (с) один або декілька типів ентеросолюбільних компонентів і (d) органічну кислоту.
2. Тверда фармацевтична композиція за п. 1, де органічна кислота міститься в кількості від 0,5 до 5 % по масі.
3. Тверда фармацевтична композиція за п. 1 або 2, де органічна кислота є лимонною кислотою.
4. Тверда фармацевтична композиція за будь-яким з пп. 1-3, де один або декілька типів ентеросолюбільних компонентів містять ацетат сукцинат гідроксипропілметилцелюлози, фталат гідроксипропілметилцелюлози, карбоксиметилетилцелюлозу, співполімер метакрилової кислоти L і/або співполімер метакрилової кислоти S.
5. Тверда фармацевтична композиція за п. 3, де ентеросолюбільні компоненти містять співполімер метакрилової кислоти S.
6. Тверда фармацевтична композиція за будь-яким з пп. 1-5, де попередньо желатинізований крохмаль є попередньо желатинізованим кукурудзяним крохмалем.
7. Тверда фармацевтична композиція за будь-яким з пп. 1-6, яка отримана за допомогою наступних стадій (i) і (ii):
(i) стадії змішування цилостазолу, крохмалю, одного або декількох типів ентеросолюбільних компонентів і органічної кислоти для отримання вихідної композиції, і
(ii) стадії обробки вихідної композиції для попереднього желатинізування крохмалю.
8. Тверда фармацевтична композиція за п. 7, де крохмаль на стадії (i) є одним крохмалем або сумішшю, що складається з крохмалю, частково попередньо желатинізованого крохмалю і/або попередньо желатинізованого крохмалю, за умови, що крохмаль на стадії (i) не є тільки попередньо желатинізованим крохмалем.
9. Тверда фармацевтична композиція за будь-яким з пп. 1-8, яка представлена в формі частинки.
10. Тверда фармацевтична композиція за будь-яким з пп. 1-8, яка представлена в формі гранули або порошку.
11. Тверда фармацевтична композиція за п. 10, яка отримана за допомогою способу екструзійної грануляції.
12. Капсула, яка містить тверду фармацевтичну композицію за будь-яким з пп. 9, 10 або 11.
13. Таблетка, яка містить тверду фармацевтичну композицію за будь-яким з пп. 9, 10 або 11.
14. Спосіб отримання твердої фармацевтичної композиції за будь-яким з пп. 1-11, де крохмаль попередньо желатинізують шляхом нагрівання в процесі отримання.
15. Спосіб за п. 14, де нагрівання супроводжується зволожуванням.
16. Тверда фармацевтична композиція, яка отримана способом за п. 14 або 15.
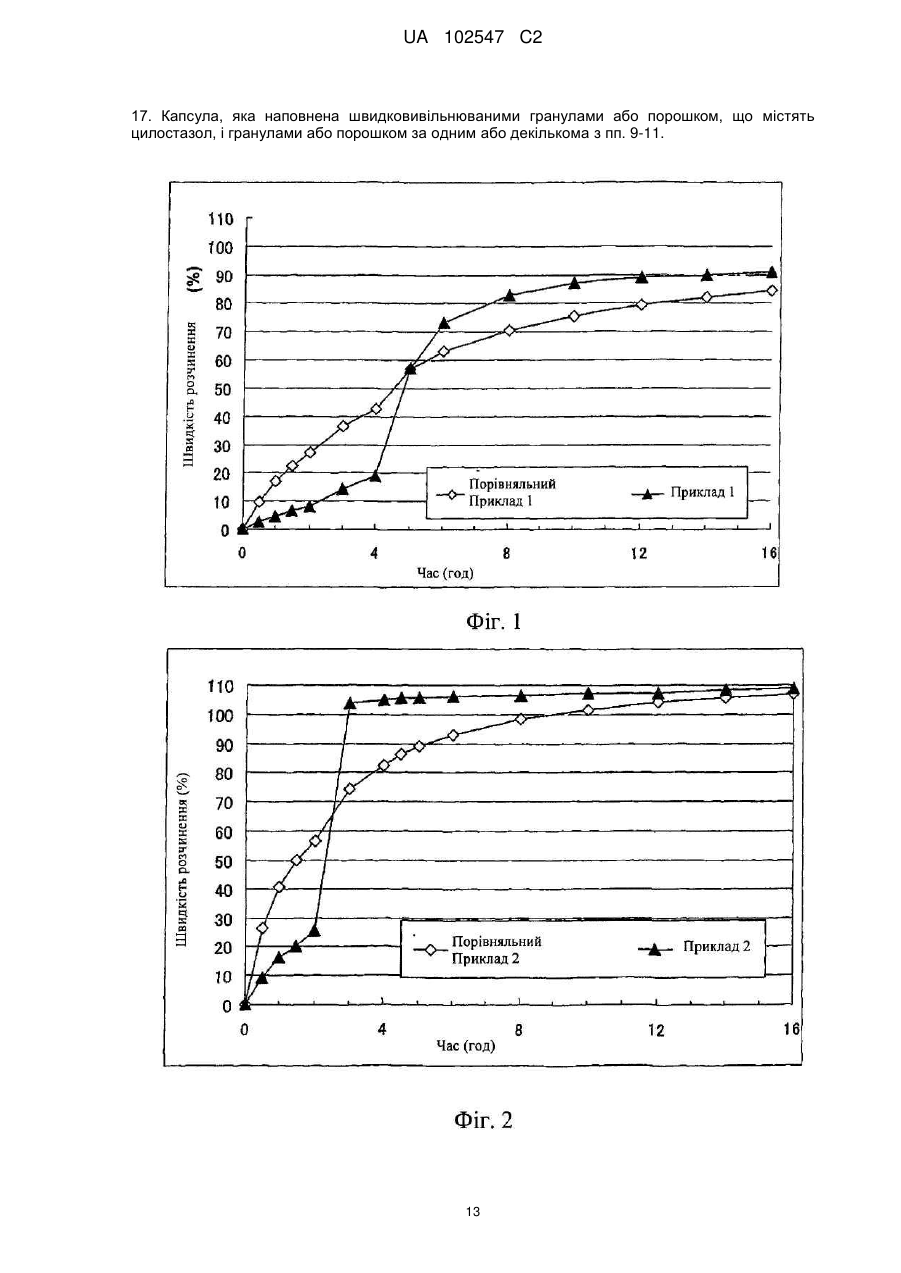
17. Капсула, яка наповнена швидковивільнюваними гранулами або порошком, що містять цилостазол, і гранулами або порошком за одним або декількома з пп. 9-11.
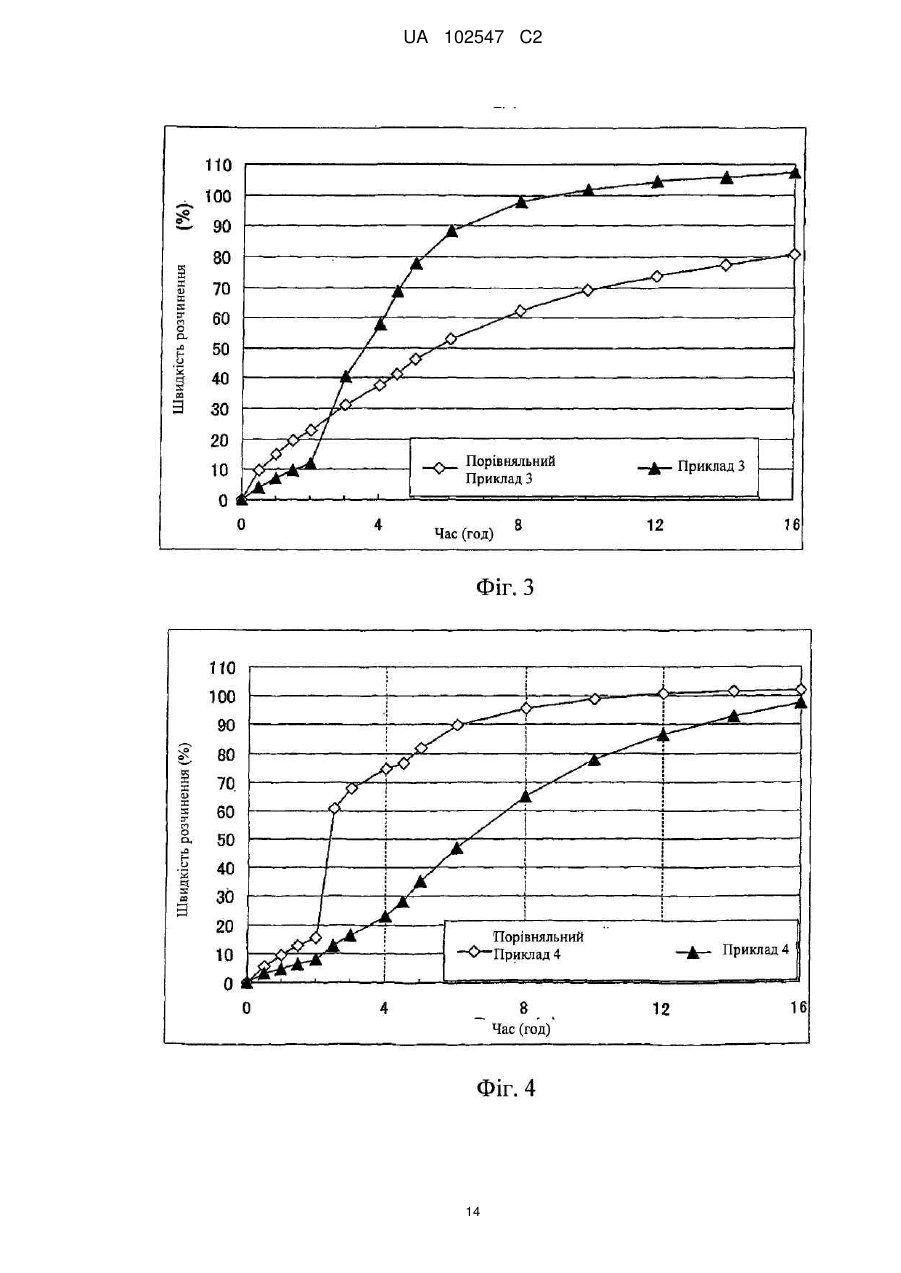
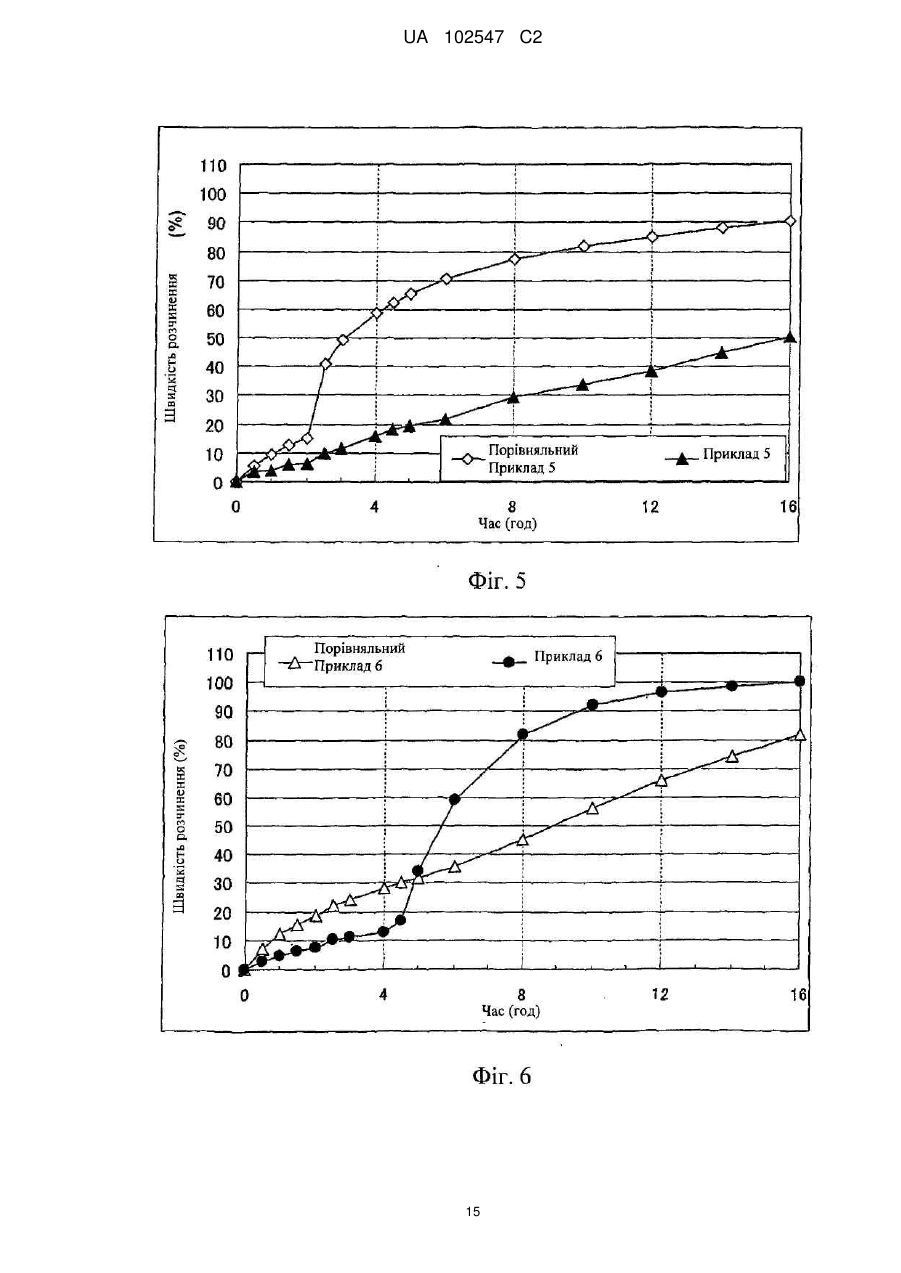
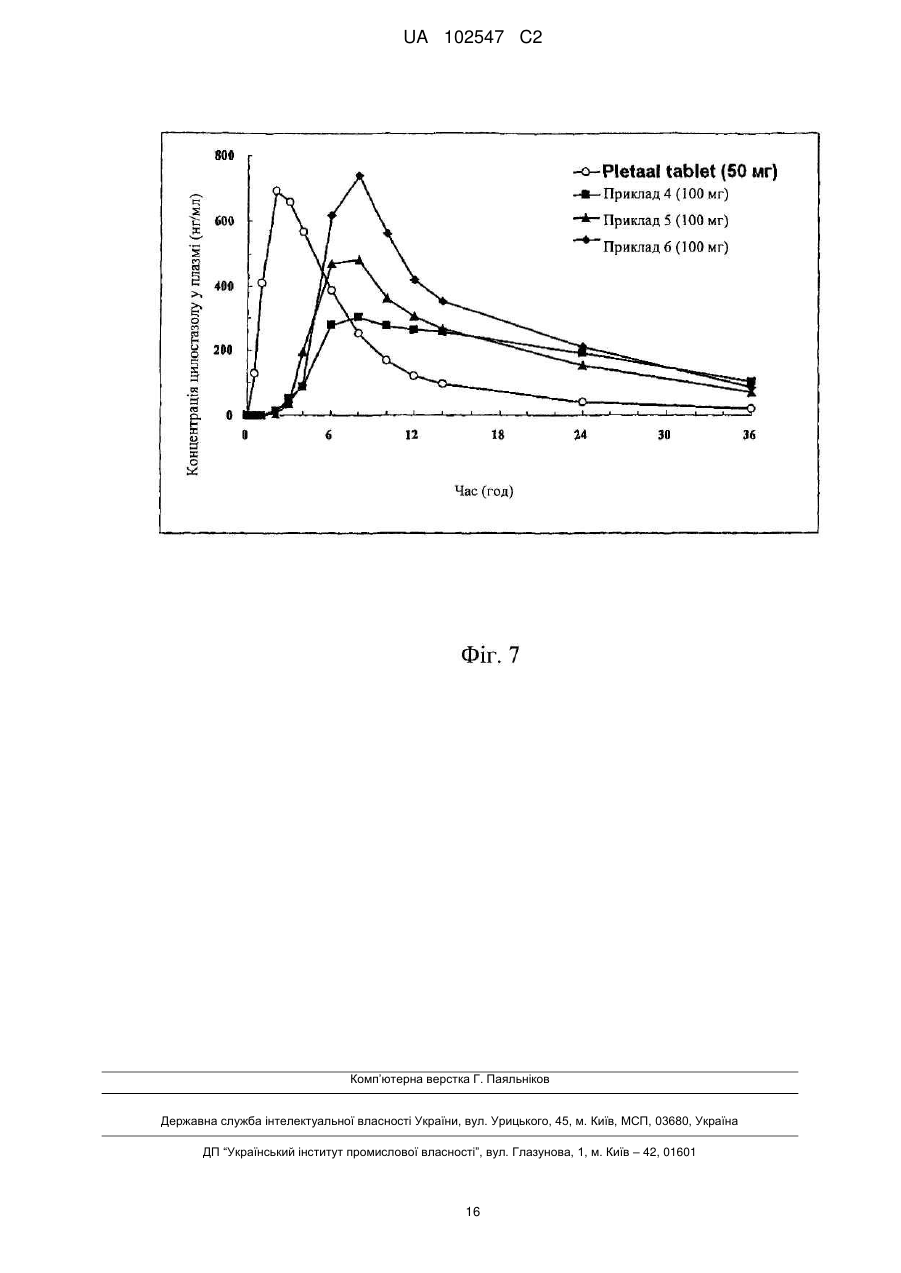
Текст
Реферат: Винахід стосується твердої фармацевтичної композиції з уповільненим вивільненням, що містить (а) цилостазол, (b) попередньо желатинізований крохмаль в кількості від 10 до 90 % по масі, з розрахунку на загальну вагу композиції, і (с) один або декілька типів ентеросолюбільних компонентів і органічну кислоту. UA 102547 C2 (12) UA 102547 C2 UA 102547 C2 5 10 15 20 Галузь техніки Даний винахід належить до твердої фармацевтичної композиції. Більш конкретно, він належить до твердої фармацевтичної композиції з уповільненим вивільненням, що містить (а) активний лікарський компонент, зокрема цилостазол, (b) попередньо желатинізований крохмаль в кількості від 10 до 90 % по масі, з розрахунку на загальну вагу композиції, і (с) один або декілька типів ентеросолюбільних компонентів. Рівень техніки Тверда фармацевтична композиція з уповільненим вивільненням є корисною композицією, оскільки вона здатна контролювати концентрацію активного компонента в крові з метою поліпшення умов прийому (наприклад, зниження частоти прийому), для поліпшення тривалості терміну дії активного компонента, який має короткий період напіввиведення in vivo, для зниження побічного ефекту активного компонента, для якого різниця між мінімальною концентрацією в крові і концентрацією, при якій виявляється побічний ефект, мала і т. д. Цилостазол є 6-[4-(1-циклогексил-1Н-тетразол-5-іл)бутокси]-3,4- дигідрокарбостирилом, відповідно до формули (1), який виявляє сильну інгібуючу дію на агрегацію тромбоцитів, а також інгібуючу дію на фосфодіестеразу, противиразкову активність, гіпотензивну дію, протизапальну дію і т. д., і, отже, широко застосовується як антитромботичний засіб, лікарський засіб для поліпшення церебрального кровообігу, протизапальний засіб, противиразковий лікарський засіб, гіпотензивний лікарський засіб, антиастматичний лікарський засіб, інгібітор фосфодіестерази і т. д. Таблетки цилостазолу, які називаються Pletaal tablet 50® і Pletaal tablet 100® (OTSUKA PHARMACEUTICAL CO., LTD.) вже знаходяться в продажу (JP-63(1988)-20235B). Крім цього, цилостазол також використовується для поліпшення різних ішемічних захворювань, таких як виразка, біль і озноб, які є симптомами хронічної закупорки артерії, оскільки цилостазол також виявляє периферичне розширення судин. 25 30 35 40 45 50 Незважаючи на те, що традиційні таблетки цилостазолу звичайно застосовують для перорального введення двічі на день дорослим, для немолодих пацієнтів, які звичайно страждають на вказані захворювання, було б бажаним поліпшити режим прийому, переважно розробити композицію з його уповільненим вивільненням, яка дозволила б здійснювати прийом перорально один раз на день. Крім того, також було б бажаним розробити композицію з ним, на яку не впливав би режим харчування, оскільки таблетки цилостазолу мають схильність до того, що на них може позначитися режим харчування, а саме при прийомі після їжі С макс підвищується в 2,3 рази і AUC підвищується в 1,4 рази, в порівнянні з прийомом натщесерце. Крім того, ефект цилостазолу на розширення кровоносних судин може призвести до корисного ефекту, такого як збільшення кровообігу, однак, з іншого боку, він може викликати головні болі або пришвидшене серцебиття. Деякі пацієнти, які приймали цилостазол, іноді страждають на головні болі як побічний ефект цилостазолу. З метою зниження приступу головного болю необхідно знизити максимальний рівень цилостазолу в плазмі і, крім того, розробити композицію цилостазолу з уповільненим вивільненням, яка при повторному введенні може підтримувати його достатній ефективний рівень в плазмі. Загалом фармацевтична композиція для перорального застосування проходить через шлунок, який є сильнокислотною ділянкою, і через кишечник, який є ділянкою від нейтральної до основної. Отже, з метою розробки композиції з уповільненим вивільненням фармацевтичного лікарського засобу для перорального застосування необхідно брати до уваги, що лікарський засіб, який розробляється, досягне нижнього відділу шлунково-кишкового тракту (нижнього відділу тонкого кишечнику і товстого кишечнику), проходячи через ділянки з різним рН. Крім того, для забезпечення можливості однократного денного застосування або підтримки ефективного рівня лікарського засобу в плазмі, знижуючи С макс для зменшення побічного ефекту, необхідне достатнє вивільнення лікарського засобу з композиції з уповільненим вивільненням навіть після досягнення композицією нижнього відділу шлунково-кишкового тракту. 1 UA 102547 C2 5 10 15 20 25 30 35 40 45 50 55 60 Розчинна в кишечнику композиція, покрита ентеросолюбільним покриттям, відома як композиція з уповільненим вивільненням, яка має здатність до уповільненого вивільнення в нижньому відділі шлунково-кишкового тракту. Однак, з метою контролювання вивільнення лікарського засобу через покриття, дана здатність вимагає стадії покривання плівкою, таким чином, процес отримання є складним. З іншого боку, також відома матрична композиція, розроблена для уповільненого вивільнення з використанням ентеросолюбільного метакрилового полімеру, яка, як вважається, має можливість контролювати точне вивільнення лікарського засобу за рахунок тонкої рНчутливості ентеросолюбільної полімерної речовини. Як приклад подібної композиції відома матрична композиція, яка отримана шляхом пресування суміші ентеросолюбільної полімерної речовини і лікарського засобу (наприклад, JP-4(1992)-43049-B, JP-6(1994)-199657-A, US 4968508, US-2006/0159753-A). Однак, у разі таких таблетованих композицій, їх площа поверхні мала і їх розчинність низька. Отже, композиція, що містить погано розчинний лікарський засіб, у якого швидкість розчинення запізнюється, може мати деякі важкощі з вивільненням її лікарського засобу. Крім того, JP-6(1994)-24991-A розкриває композицію, яка отримана за рахунок вологого змішування порошкової суміші, що містить співполімер метакрилової кислоти S з етанолом, і подальшого екструзійного гранулювання. Дана композиція являє собою гранули, які придатні для диспергування в шлунково-кишковому тракті, і, отже, в більшій мірі можна зменшити індивідуальну варіативність щодо абсорбції лікарського засобу в порівнянні з таблетованою композицією. Однак, в тому випадку, якщо кількість ентеросолюбільної полімерної речовини в матричній композиції збільшується в необхідній мірі для вивільнення лікарського засобу, то існує трудність при виробництві. Незважаючи на те, що, як було указано вище, були вивчені різні способи контролю вивільнення лікарського засобу, в більшості способів існувала можливість того, що швидкість вивільнення лікарського засобу змінюється в тонкому кишечнику, через явище спалаху або зміни рН. Крохмаль переважно застосовувався як наповнювач для фармацевтичної композиції внаслідок його відмінної стійкості і безпеки, і, крім того, при його застосуванні як носія для гранул, отриманих за допомогою способу екструзійної грануляції, крохмаль забезпечує полегшення процедури стадії грануляції. Однак він має недолік, знижуючи стійкість твердої композиції, і властивості композиції, що вводиться, яка містить крохмаль, щодо вивільнення лікарського засобу, є незадовільними. Для розв'язання вищеназваних проблем автори даного винаходу ретельним чином вивчили різні композиції, що містять як наповнювач крохмаль, і виявили, що тверда фармацевтична композиція, отримана за рахунок попереднього утворення желатинізованого крохмалю після змішування лікарського засобу і крохмалю, або після гранулювання суміші, має високу фізичну стійкість композиції, чудові властивості по вивільненню лікарського засобу композиції, що вводиться, і чудову засвоюваність наповнювача (WO 2005/113009). Однак, відносно деяких лікарських засобів, таких як цилостазол, для підтримки їх абсорбції, залишається необхідність подальшого контролю швидкості вивільнення лікарського засобу між тонким кишечником і товстим кишечником, які є ділянками, розташованими після області впливу амілази. Розкриття винаходу Задачею даного винаходу є розв'язання вищезазначених проблем, які мають місце в твердій фармацевтичній композиції, що містить активний лікарський компонент (зокрема, цилостазол) і попередньо желатинізований крохмаль як наповнювач. Конкретніше, задачею даного винаходу є забезпечення твердої фармацевтичної композиції з уповільненим вивільненням, яка може контролювати властивості вивільнення лікарського засобу в нижньому відділі шлунковокишкового тракту, які були недостатніми, може знизити частоту застосування, може зменшити побічні ефекти за рахунок зниження Смакс і т. д. Автори даного винаходу провели ретельні дослідження для досягнення вищезгаданої задачі і виявили, що вивільнення лікарського засобу після впливу амілази може контролюватися за рахунок способу, в якому ентеросолюбільний компонент додається до композиції із попередньо желатинізованим крохмалем, який є матрицею. І також автори даного винаходу виявили, що рецептура композиції може бути далі поліпшена за рахунок вибору певного типу ентеросолюбільних компонентів, і, крім того, виявили, що додавання до неї кислоти може впливати на фармакокінетику. Даний винахід був виконаний на основі нових відкриттів. Даний винахід належить до наступних винаходів. Даний винахід забезпечує тверду фармацевтичну композицію, що містить (а) активний лікарський компонент, (b) попередньо желатинізований крохмаль (α-крохмаль) в кількості від 10 2 UA 102547 C2 5 10 15 20 25 30 35 40 45 50 55 60 до 90 % по масі, з розрахунку на загальну вагу композиції, і (с) один або декілька типів ентеросолюбільних компонентів. Вказаний в описі активний лікарський компонент головним чином означає важкорозчинний лікарський засіб, такий як цилостазол. Переважна тверда фармацевтична композиція є твердою фармацевтичною композицією з уповільненим вивільненням. Також, даний винахід забезпечує вищезгадану тверду фармацевтичну композицію, за винятком випадків, коли ентеросолюбільний компонент(и) в (с) складається тільки з співполімера метакрилової кислоти LD. Крім того, даний винахід забезпечує вищезгадану тверду фармацевтичну композицію, де один або декілька типів ентеросолюбільних компонентів містять фталат гідроксипропілметилцелюлози, ацетат сукцинат гідроксипропілметилцелюлози, карбоксиметилетилцелюлозу, співполімер метакрилової кислоти L і/або співполімер метакрилової кислоти S. Переважно, один або декілька типів ентеросолюбільних компонентів даного винаходу є ентеросолюбільними компонентами двох або більше типів, які мають різні діапазони рН, при яких кожний ентеросолюбільний компонент може бути розчинений, які можуть бути вибрані з групи, яка складається з ацетату сукцинату гідроксипропілметилцелюлози, фталату гідроксипропілметилцелюлози, карбоксиметилетилцелюлози, співполімера метакрилової кислоти L, співполімера метакрилової кислоти S і співполімера метакрилової кислоти LD. Більш переважно, один або декілька типів ентеросолюбільних компонентів даного винаходу є наступними двома типами ентеросолюбільних компонентів: один може бути розчинений при рН 5 або більше, і інший може бути розчинений при рН 6 або більше; або один може бути розчинений при рН 6 або більше, і інший може бути розчинений при рН 7 або більше. Крім того, вищезгаданий ентеросолюбільний компонент(и) переважно містить співполімер метакрилової кислоти, за винятком випадків, коли ентеросолюбільний компонент(и) складається тільки зі співполімера метакрилової кислоти LD. Переважно, один або декілька типів ентеросолюбільних компонентів містять співполімер метакрилової кислоти L і/або співполімер метакрилової кислоти S, і, більш переважно, співполімер метакрилової кислоти L і співполімер метакрилової кислоти S. Співвідношення співполімера метакрилової кислоти L і співполімера метакрилової кислоти S цим не обмежується, але переважно складає від 30:70 до 70:30, від 40:60 до 60:40 або приблизно 50:50. Крім того, даний винахід забезпечує вищезгадану тверду фармацевтичну композицію, яка також містить органічну кислоту. Органічна кислота міститься в кількості від 0,5 до 5 % по масі, переважно від 1 до 3 % по масі, більш переважно біля 2 % по масі, з розрахунку на загальну вагу композиції. Переважною органічною кислотою, наприклад, є лимонна кислота. Крім того, переважною є комбінація співполімера метакрилової кислоти S як ентеросолюбільного компонента, і лимонної кислоти як органічної кислоти. Даний винахід забезпечує вищезгадану тверду фармацевтичну композицію, де сировиною для попередньо желатинізованого крохмалю є один або декілька крохмалів, вибраних з кукурудзяного крохмалю, пшеничного крохмалю, картопляного крохмалю, рисового крохмалю, маніокового крохмалю і тапіокового крохмалю. Переважною сировиною для попередньо желатинізованого крохмалю є кукурудзяний крохмаль. І, даний винахід забезпечує вищезгадану тверду фармацевтичну композицію, яка представлена у вигляді частинок або у вигляді гранул, або порошку. Гранули або порошок переважно отримують способом екструзійного гранулювання. Крім того, даний винахід забезпечує композицію у вигляді капсул, які містять або тверду фармацевтичну композицію у вигляді частинок, або тверду фармацевтичну композицію у вигляді гранул/порошку; або композицію у вигляді таблеток, які містять або тверду фармацевтичну композицію у вигляді частинок, або тверду фармацевтичну композицію у вигляді гранул/порошку, або обидва її види. Також даний винахід забезпечує спосіб отримання вищезгаданої твердої фармацевтичної композиції, який включає наступні стадії (i) і (ii): (i) змішування активного лікарського компонента, крохмалю і одного або декількох типів ентеросолюбільних компонентів для отримання вихідної композиції, і (ii) обробку вихідної композиції для попереднього желатинізування крохмалю. Крохмаль на стадії (i) включає один крохмаль або суміш, яка складається з крохмалю, частково попередньо желатинізованого крохмалю і/або попередньо желатинізованого крохмалю, за умови, що крохмаль на стадії (i) не є тільки попередньо желатинізованим крохмалем. Даний винахід також забезпечує вищезгаданий спосіб отримання твердої фармацевтичної композиції, де крохмаль попередньо желатинізують шляхом нагрівання в процесі отримання. Крім того, даний винахід забезпечує спосіб отримання вищезгаданої твердої фармацевтичної композиції, де нагрівання супроводжується зволожуванням. Також 3 UA 102547 C2 5 10 15 20 25 30 35 40 45 50 55 60 даний винахід забезпечує тверду фармацевтичну композицію, отриману з використанням вищезгаданого способу. І, даний винахід забезпечує капсули, які наповнені швидковивільними гранулами або порошком, що містить активний лікарський компонент, і вищезгаданими гранулами або порошком з уповільненим вивільненням. Далі детально описана тверда фармацевтична композиція і спосіб її отримання. Тверда фармацевтична композиція Тверда фармацевтична композиція за даним винаходом містить (a) активний лікарський компонент, (b) попередньо желатинізований крохмаль і (с) один або декілька типів ентеросолюбільних компонентів. Тверда фармацевтична композиція за даним винаходом звичайно містить від 10 до 90 % по масі, переважно від 20 до 80 % по масі, більш переважно від 25 до 70 % по масі попередньо желатинізованого крохмалю (α-крохмаль), з розрахунку на загальну вагу композиції. При додаванні в такій кількості попередньо желатинізованого крохмалю тверда фармацевтична композиція за даним винаходом буде мати необхідні характеристики, такі як висока фізична міцність композиції і необхідне ефективне і уповільнене вивільнення активного інгредієнта в травному тракті при застосуванні. Застосовуваний в описі вихідний крохмаль включає будь-який звичайний крохмаль без обмеження, такий як кукурудзяний крохмаль, пшеничний крохмаль, картопляний крохмаль, рисовий крохмаль, маніоковий крохмаль, тапіоковий крохмаль, які можуть застосовуватися у вигляді окремого крохмалю або в комбінації двох або більшого числа крохмалів. Застосовуваний в описі вихідний крохмаль може бути сумішшю з частково попередньо желатинізованим крохмалем і/або попередньо желатинізованим крохмалем вищезгаданого крохмалю. Попереднє желатинізування крохмалю може проводитися в процесі отримання твердої композиції, переважно в формі фармацевтичної композиції, отриманої змішуванням крохмалю з активним компонентом і іншими фармацевтичними носіями. Попереднє желатинізування крохмалю включає часткове попереднє желатинізування крохмалю. До переважних попередньо желатинізованих крохмалів належать попередньо желатинізований кукурудзяний крохмаль, попередньо желатинізований картопляний крохмаль і попередньо желатинізований пшеничний крохмаль. Особливо переважним попередньо желатинізованим крохмалем є попередньо желатинізований кукурудзяний крохмаль, оскільки звичайний кукурудзяний крохмаль має однорідні по розміру частинки від 10 до 30 мкм і легко переробляється в необхідні композиції, і, отже, його попередньо желатинізований продукт легко обробляється, оскільки кукурудзяний крохмаль має більш низькі характеристики поглинання вологи в порівнянні з іншим крохмалем. Застосовуваний в описі "ентеросолюбільний компонент" може бути без обмеження будьяким типом з поширених ентеросолюбільних компонентів, які не розчиняються в шлунку, але розчиняються в кишечнику. Фактично, ентеросолюбільний компонент включає, наприклад, ентеросолюбільні похідні целюлози, такі як ацетат фталат целюлози, ацетат тримелітат целюлози, ацетат сукцинат целюлози, фталат метилцелюлози, ацетат сукцинат гідроксипропілметилцелюлози, фталат гідроксипропілметилцелюлози, фталат гідроксиметилетилцелюлози, ацетат малеат гідроксипропілметилцелюлози, тримелітат гідроксипропілметилцелюлози і карбоксиметилетилцелюлозу; вінільні похідні, такі як фталат полівінілбутилату, ацетат фталат полівінілового спирту, ентеросолюбільні співполімери похідних акрилової кислоти, такі як співполімер метакрилової кислоти і етилакрилату (наприклад, метакрилова кислота - етилакрилат) і співполімер метакрилової кислоти і метилметакрилату (наприклад, співполімер метакрилової кислоти L, співполімер метакрилової кислоти S). Ентеросолюбільний компонент можевикористовуватися окремо або в комбінації з двома або більше типами компонентів. Серед них переважними варіантами є ацетат сукцинат гідроксипропілметилцелюлози, фталат гідроксипропілметилцелюлози, карбоксиметилетилцелюлоза, співполімер метакрилової кислоти L, співполімер метакрилової кислоти S, і більш переважними варіантами є ацетат сукцинат гідроксипропілметилцелюлози, співполімер метакрилової кислоти L і співполімер метакрилової кислоти S. При використанні двох і більше ентеросолюбільних компонентів переважно, щоб діапазон рН для кожного компонента, при якому кожний ентеросолюбільний компонент може розчинятися, відрізнялися один від одного. У такому випадку ентеросолюбільні компоненти включають ацетат сукцинат гідроксипропілметилцелюлози, фталат гідроксипропілметилцелюлози, співполімер метакрилової кислоти L, співполімер метакрилової кислоти S і співполімер метакрилової кислоти LD. Також переважним є комбінування двох типів ентеросолюбільних компонентів, де один може бути розчинений при рН 6 або більше (наприклад, співполімер метакрилової кислоти 4 UA 102547 C2 5 10 15 20 25 30 35 40 45 50 55 60 L), і де інший може бути розчинений при рН 7 або більше (наприклад, співполімер метакрилової кислоти S). Також переважним є комбінування двох типів ентеросолюбільних компонентів, де один може бути розчинений при рН 5 або більше, і де інший може бути розчинений при рН 6 або більше. Більш переважно, коли ентеросолюбільним компонентом є співполімер метакрилової кислоти L і/або співполімер метакрилової кислоти S, і ще більш переважно, співполімер метакрилової кислоти L і співполімер метакрилової кислоти S. Крім того, при використанні одного типу ентеросолюбільного компонента переважно комбінувати органічну кислоту з ентеросолюбільним компонентом. У цьому випадку переважним ентеросолюбільним компонентом є ацетат сукцинат гідроксипропілметилцелюлози, співполімер метакрилової кислоти L або співполімер метакрилової кислоти S, і переважною органічною кислотою є лимонна кислота. Ентеросолюбільний(і) компонент(и) можуть бути включені в кількості від 1 до 30 % по масі, переважно від 5 до 20 % по масі, більш переважно від 5 до 15 % по масі, з розрахунку на загальну вагу композиції. Активний лікарський компонент, що включається до складу твердої фармацевтичної композиції даного винаходу, може бути будь-яким видом лікарських засобів, що має будь-яку фармацевтичну активність, за умови, що даний засіб можна застосовувати перорально. Вони можуть бути водорозчинними лікарськими засобами або важкорозчинними у воді лікарськими засобами. Прикладами лікарських засобів є лікарські засоби, що включаються в різні фармацевтичні препарати, такі як засоби для органів дихання, засоби для органів травлення, серцево-судинні засоби, засоби для центральної нервової системи, засоби для периферичної нервової системи, антибіотики, хіміотерапевтичні засоби, протипухлинні засоби, інгібітори агрегації тромбоцитів, протиалергійні засоби, вітаміни або поживні речовини. Переважними лікарськими засобами є важкорозчинні у воді лікарські засоби. Крім того, переважні лікарські засоби належать до Класу II (висока проникність, низька розчинність) в "Waiver of in Vivo Bioavailability and Bioequivalents Studies for Immediate Release Solids Dosage Forms Containing Certain Active Moieties/Active Ingredients Based on Biopharmaceutics Classification System (FDA Guidance)" (в цьому описі вона може іноді згадуватися як "Система класифікації біофармацевтичних засобів"). При включенні в препарат з уповільненим вивільненням важкорозчинних у воді лікарських засобів він може вивільняти активний засіб в органах травної системи поступово і ефективно і, отже, може виявляти бажану фармацевтичну активність при застосуванні. Активні лікарські компоненти можуть застосовуватися окремо або в комбінації двох або більшого числа видів лікарських засобів. Активні компоненти, що використовуються в твердій фармацевтичній композиції, наприклад, включають теофілін, грепафлоксацин, картеолол, прокатерол, ребаміпід, арипіпразол, цилостазол, Physuline, толваптан, ацетамінофен, ніфедипін, кетопрофен, напроксен, диклофенак, ітраконазол, піроксикам, фенітоїн і верапаміл. Серед них до переважних прикладів належать цилостазол, кетопрофен, напроксен, диклофенак, ітраконазол, піроксикам, фенітоїн і верапаміл, і більш переважним є цилостазол. Ці лікарські засоби особливо корисні, коли вони включені в препарат з уповільненим вивільненням. Активний компонент може бути включений в тверду фармацевтичну композицію у прийнятній кількості, яка може варіюватися в залежності від виду і ефективності активного компонента, статі і віку пацієнтів, лікування яких проводиться, і так далі, але може складати, наприклад, від приблизно 0,01 до 70 % по масі, переважно від 0,1 до 60 % по масі, більш переважно від 1 до 60 % по масі, з розрахунку на загальну вагу (суха вага) композиції. Органічна кислота, що використовується в твердій фармацевтичній композиції даного винаходу, наприклад, включає винну кислоту, яблучну кислоту, янтарну кислоту, лимонну кислоту, малеїнову кислоту, оцтову кислоту, щавлеву кислоту і інш. Органічна кислота може бути використана окремо або в комбінації з двома або більше видами органічних кислот. Серед них переважною є лимонна кислота. Також, тверда фармацевтична композиція може містити прийнятну кількість різних інших допоміжних речовин, таких як наповнювачі, зв'язувальні речовини, регулятори pH, розпушувачі, стимулятори абсорбції, лубриканти, барвники, ароматизатори, віддушки і т. п., якщо вони не надають якої-небудь небажаної дії. До цих допоміжних речовин належать, наприклад, наповнювачі (наприклад, лактоза, білий цукор, маніт, хлорид натрію, глюкоза, карбонат кальцію, каолін, кристалічна целюлоза, силікати); зв'язувальні речовини (наприклад, вода, етанол, простий сироп, водний розчин глюкози, водний розчин крохмалю, водний розчин желатину, карбоксиметилцелюлоза, натрійкарбоксиметилцелюлоза, шелак, метилцелюлоза, гідроксипропілметилцелюлоза, гідроксипропілцелюлоза, полівінілпіролідон, полівініловий спирт, желатин, декстрин, пулулан); 5 UA 102547 C2 5 10 15 20 25 30 35 40 45 50 55 60 регулятори pH (наприклад, лимонна кислота, лимонний ангідрид, цитрат натрію, цитрат натрію дигідрат, безводний гідрофосфат динатрію, безводний дигідрофосфат натрію, натрію гідрофосфат, натрію дигідрофосфат); розпушувачі (наприклад, кальцію кармелоза, низькозаміщена гідроксипропілцелюлоза, кармелоза, натрію кроскармелоза, натрію карбоксиметилкрохмаль, кросповідон); пластифікатори (наприклад, полісорбат 80); стимулятори абсорбції (наприклад, четвертинні амонієві основи, лаурилсульфат натрію); лубриканти (наприклад, очищений тальк, стеарати, поліетиленгліколь, колоїдні силікати, складний ефір сахарози і жирної кислоти); барвники (наприклад, жовтий оксид заліза, жовтий полуторний оксид заліза, полуторний оксид, β-каротин, оксид титану, харчові барвники, такі як харчовий синій № 1, мідний хлорофіл, рибофлавін); ароматизатори (наприклад, аскорбінова кислота, аспартам, солодка гортензія, хлорид натрію, фруктоза, сахарин, цукрова пудра). Тверда фармацевтична композиція даного винаходу може бути представлена будь-яким типом твердих композицій, таким як тонкодисперсні порошки, частинки, порошки, гранули, таблетки або подібне. Крім того, тверда фармацевтична композиція даного винаходу може бути представлена в формі виробів з оболонкою або капсул. Серед цих композицій переважними є гранули або порошки. Для надання форми гранул переважне включення в тверду фармацевтичну композицію кристалічної целюлози. При включенні кристалічної целюлози композиція може легко бути отримана в сферичній формі за допомогою звичайної технології для надання сферичної форми, і, отже, вона легко гранулюється за допомогою способу екструзійної грануляції. Крім того, композиція, отримана в сферичній формі, легко упаковується в капсули. Також вигідною є можливість ефективного нанесення оболонки на сферичну композицію. Кристалічна целюлоза може бути включена в кількості від 2 до 90 % по масі, переважно від 5 до 80 % по масі, більш переважно від 5 до 70 % по масі, з розрахунку на загальну вагу фармацевтичної композиції. Крім того, композиція даного винаходу у вигляді капсул може підтримувати постійну концентрацію активного компонента в крові за рахунок наповнення гранулами або порошком з швидким вивільненням і гранулами або порошком з уповільненим вивільненням, де кожний з них містить активний лікарський компонент. Спосіб отримання Тверда фармацевтична композиція даного винаходу може бути отримана шляхом попереднього желатинізування композиції, що містить активний лікарський компонент, крохмаль і ентеросолюбільний компонент (яка далі називається "вихідною композицією). Більш конкретно, тверда фармацевтична композиція може бути отримана за допомогою наступних стадій (i) і (ii): (i) стадії змішування активного лікарського компонента, крохмалю і ентеросолюбільного компонента для отримання вихідної композиції, і (ii) стадії обробки вихідної композиції для попереднього желатинізування крохмалю. Компоненти вихідної композиції, отриманої на стадії (i), залишаються в колишньому стані в кінцевій твердій фармацевтичній композиції, крім крохмалю, який попередньо желатинізується для перетворення його в α-крохмаль на стадії (ii). Відповідно на стадії (i) активний лікарський компонент, крохмаль, який буде попередньо желатинізований, і інші додаткові компоненти (різні носії) можуть бути включені для отримання вихідної композиції в тих же кількостях, що і в кінцевій твердій фармацевтичній композиції. Вихідна композиція в доповнення до вищезазначених компонентів переважно містить воду. Вміст води в вихідній композиції не обмежений певним діапазоном, але звичайно складає від 30 до 80 % по масі, переважно від 40 до 80 % по масі, більш переважно від 40 до 70 % по масі, з розрахунку на загальну вагу вихідної композиції. При додаванні води в такому діапазоні, як указано вище, вихідній композиції можуть бути легко додані бажані форми, і далі вона може бути ефективно піддана подальшій стадії попереднього желатинізування. Вихідна композиція може бути представлена будь-якими типами твердих композицій, такими як тонкодисперсні порошки, порошки, гранули, таблетки і так далі. Форма вихідної композиції може зберігатися навіть після піддавання її попередньому желатинізуванню на стадії (ii) для утворення бажаної твердої фармацевтичної композиції, що містить попередньо желатинізований крохмаль (α-крохмаль). Відповідно, вихідна композиція переважно сформована в композицію, аналогічну кінцевому продукту, прийнятному для необхідного лікарського засобу. Способи надання вихідній композиції бажаної форми не обмежені, але це може бути здійснене за допомогою звичайного способу. Якщо тверда фармацевтична композиція представлена в формі гранул, переважне включення в вихідну композицію кристалічної целюлози (кількість кристалічної целюлози вказана вище) і гранулювання композиції за допомогою способу екструзійної грануляції на стадії (i). 6 UA 102547 C2 5 10 15 20 25 30 35 40 45 50 55 60 Отриманим таким чином вихідна композиція піддається наступній стадії (ii), на якій звичайний крохмаль попередньо желатинізується для перетворення його в α-крохмаль. Попереднє желатинізування може бути проведене за допомогою звичайного способу для перетворення вихідного крохмалю в α-крохмаль. Наприклад, якщо вихідна композиція містить воду, як вказано вище, вихідна композиція піддається термічній обробки. Термічна обробка може бути проведена з використанням будь-якої звичайної термічної обробки, наприклад, нагрівання парою, нагрівання сухим гарячим повітрям, високочастотного індукційного нагрівання, мікрохвильового нагрівання і т. п. Температура нагрівання може змінюватися в залежності від способу нагрівання, але звичайно знаходиться в діапазоні від 75 до 100ºC, переважно від 80 до 100ºC. У залежності від способу нагрівання час нагрівання може бути відповідним чином визначений фахівцем в даній галузі техніки. Крім того, якщо вихідна композиція не містить воду, то вихідна композиція переважно піддається нагріванню з парою, наприклад, за допомогою розпилювання води на вихідну композицію і потім обробки парою і мікрохвилями, в результаті чого крохмаль перетворюється в α-крохмаль. Умови нагрівання відповідають вказаним вище. Якщо вихідна композиція містить кристалічну целюлозу і представлена в формі гранул, отриманих за допомогою способу екструзійної грануляції, то гранули мають однорідну сферичну форму (високий ступінь сферичної форми) і, отже, належним чином піддаються мікрохвильвому нагріванню. Якщо мікрохвильовому нагріванню піддається вихідна композиція, що має сферичну форму з неплоскою (увігнуто-опуклою) поверхнею, насамперед нагріваються частини, що мають опуклу поверхню, і волога відганяється від поверхні, і, таким чином, попереднє желатинізування здійснюється з меншою ефективністю. З іншого боку, якщо мікрохвильовому нагріванню піддається вихідна композиція, що має високий ступінь сферичної форми, насамперед нагрівається внутрішня частина вихідної композиції, і, отже, поверхня зберігає вологу з меншим випаровуванням під час термічної обробки, і, таким чином, може бути виконане ефективне попереднє желатинізування. Таким чином, вихідна композиція піддається обробці для попереднього желатинізування крохмалю, що міститься в композиції, для отримання бажаної композиції, що містить попередньо желатинізований крохмаль (α-крохмаль). Фармацевтична композиція, отримана після попереднього желатинізування, містить вологу і, отже, переважно піддається сушінню для видалення вологи. Сушінняздійснюється за допомогою звичайного способу, наприклад, витримування в сушильній камері при температурі від 50 до 90ºC, переважно від 60 до 80ºC. Час сушіння може бути при бажанні визначений фахівцем в даній галузі техніки в залежності від форми фармацевтичної композиції і температури сушіння і так далі. Тверда фармацевтична композиція даного винаходу може бути препаратом, отриманим з використанням вищезгаданих стадій (i) і (ii) і, можливо, стадії сушіння (тобто препаратом, отриманим за допомогою попереднього желатинізування), або в альтернативному варіанті вона може бути препаратом, отриманим за допомогою піддавання "твердої композиції, отриманої за допомогою попереднього желатинізування", подальшій стадії обробки будь-якими звичайними способами, які звичайно застосовуються для отримання фармацевтичних композицій. Наприклад, гранули, отримані за допомогою попереднього желатинізування, можуть бути піддані таблетуванню для надання твердій фармацевтичній композиції форми таблеток. Крім того, тверда фармацевтична композиція або продукт подальшої обробки може бути піддані покриванню оболонкою для отримання продукту, покритого оболонкою. Далі, тверда фармацевтична композиція або продукт подальшої обробки може бути упакований в капсули для отримання необхідної твердої фармацевтичної композиції в формі капсул. Тверда фармацевтична композиція даного винаходу може бути легко отримана, оскільки ентеросолюбільний компонент міститься як матриця, а не речовина плівкового покриття. Отже, отримання гранульованої композиції і аналогічної композиції даного винаходу може бути проведене в більш короткий час в порівнянні з отриманням традиційної композиції з плівковим покриттям, і, таким чином, можна знизити вартість виробництва. Крім цього, тверда фармацевтична композиція даного винаходу має високу фізичну міцність композиції, чудові характеристики вивільнення прийнятої композиції, чудову засвоюваність наповнювача, і, особливо, чудові характеристики вивільнення між тонким кишечником і товстим кишечником. І, тверда фармацевтична композиція даного винаходу має властивість контролю швидкості вивільнення за рахунок дії ентеросолюбільних компонентів певного типу і органічної кислоти після того, як композиція переварена і розщеплена амілазами в тонкому кишечнику. Таким чином, це дозволяє використовувати різні властивості уповільненого вивільнення, такі як пероральне застосування один раз на день і зниження побічних ефектів. короткий опис креслень 7 UA 102547 C2 5 10 15 20 25 30 35 40 45 50 55 60 Фіг. 1 є графіком, який показує характеристики розчинення твердих фармацевтичних композицій (Прикладу 1 і Порівняльного Прикладу 1). Фіг. 2 є графіком, який показує характеристики розчинення твердих фармацевтичних композицій (Прикладу 2 і Порівняльного Прикладу 2). Фіг. 3 є графіком, який показує характеристики розчинення твердих фармацевтичних композицій (Прикладу 3 і Порівняльного Прикладу 3). Фіг. 4 є графіком, який показує характеристики розчинення твердих фармацевтичних композицій (Прикладу 4 і Порівняльного Прикладу 4). Фіг. 5 є графіком, який показує характеристики розчинення твердих фармацевтичних композицій (Прикладу 5 і Порівняльного Прикладу 5). Фіг. 6 є графіком, який показує характеристики розчинення твердих фармацевтичних композицій (Прикладу 6 і Порівняльного Прикладу 6). Фіг. 7 є графіком, який показує зміну середньої концентрації в плазмі цилостазолу з часом при застосуванні твердих фармацевтичних композицій (Прикладів 4-6 і Порівняльного Прикладу 7) (n=7, значення ± стандартне відхилення). Переважний спосіб здійснення винаходу Даний винахід більш детально ілюстрований наступними прикладами і експериментами, але вони не повинні розглядатися як обмеження. Приклад 1 Змішують кукурудзяний крохмаль (торгова марка: "Nisshoku Corn Starch", виробництво Nippon Shokuhin Kako K.K.) (90 г), кристалічну целюлозу (торгова марка: "CEOLUS PH301", виробництво Asahi Kasei Corporation) (30 г), ацетат сукцинат гідроксипропілметилцелюлози (торгова марка: "AS-HF", виробництво Shin-Etsu Chemical Co., Ltd) (30 г) і цилостазол (виробництво Otsuka Pharmaceutical Co., Ltd.) (150 г), і суміш вміщують в швидкісну мішалку (номер моделі: NSK-150, виробництво Okada Seiko K.K.), потім туди ж при перемішуванні додають 37,5 мл 4 % водного розчину полісорбату 80 (який містить 1,5 г полісорбату 80) і очищену воду (92,5 г) для отримання вихідної композиції (вихідна композиція Прикладу 1). Вихідну композицію піддають екструзійній грануляції за допомогою екструзійного гранулятора, забезпеченого куполоподібною матрицею (діаметр отвору: 0,6 мм, DomeGran DGL1, виробництво DALTON Co. LTD.), для отримання вологих гранул. Вологі гранули обробляють за допомогою сфероїдизатора (Murmerizer QJ-400, виробництво DALTON Co. LTD.) для регулювання форми і розміру гранул, за допомогою чого була отримана вихідна композиція у вигляді вологих гранул. Вихідну композицію у вигляді вологих гранул нагрівають і зволожують з використанням парової печі (HEALSIO, виробництво SHARP CORPORATION) в "режимі прогрівання" протягом 20 хвилин таким чином, що кукурудзяний крохмаль може бути попередньо желатинізований. Гранули, нагріті/зволожені подібним чином, сушать в повітряно-сушильній шафі при температурі 60ºC протягом 6 годин для отримання твердої фармацевтичної композиції в формі гранул (Приклад 1). Приклад 2 Змішують кукурудзяний крохмаль (торгова марка: "Nisshoku Corn Starch", виробництво Nippon Shokuhin Kako K.K.) (90 г), кристалічну целюлозу (торгова марка: "CEOLUS PH301", виробництво Asahi Kasei Corporation) (30 г), ацетат сукцинат гідроксипропілметилцелюлози (торгова марка: "AS-HF", виробництво Shin-Etsu Chemical Co., Ltd) (30 г) і цилостазол (виробництво Otsuka Pharmaceutical Co., Ltd.) (150 г), і суміш вміщують в швидкісну мішалку (номер моделі: NSK-150, виробництво Okada Seiko K.K.), потім туди ж при перемішуванні додають 37,5 мл 4 % водного розчину полісорбату 80 (який містить 1,5 г полісорбату 80) і очищену воду (67,5 г) для отримання вихідної композиції (вихідна композиція Прикладу 2). Вихідну композицію піддають екструзійній грануляції за допомогою екструзійного гранулятора, забезпеченого куполоподібною матрицею (діаметр отвору: 0,6 мм, DomeGran DGL1, виробництво DALTON Co. LTD.), для отримання вологих гранул. Вологі гранули обробляють за допомогою сфероїдизатора (Murmerizer QJ-400, виробництво DALTON Co. LTD.) для регулювання форми і розміру гранул, за допомогою чого була отримана вихідна композиція у вигляді вологих гранул. Вихідну композицію у вигляді вологих гранул нагрівають і зволожують з використанням парової печі (HEALSIO, виробництво SHARP CORPORATION) в "режимі прогрівання" протягом 20 хвилин таким чином, що кукурудзяний крохмаль може бути попередньо желатинізований. Гранули, нагріті/зволожені подібним чином, сушать в повітряно-сушильній шафі при температурі 60ºC протягом 6 годин для отримання твердої фармацевтичної композиції в формі гранул (Приклад 2). 8 UA 102547 C2 5 10 15 20 25 30 35 40 45 50 55 Приклад 3 Змішують кукурудзяний крохмаль (торгова марка: "Nisshoku Corn Starch", виробництво Nippon Shokuhin Kako K.K.) (69 г), кристалічну целюлозу (торгова марка: "CEOLUS PH301", виробництво Asahi Kasei Corporation) (51 г), співполімер метакрилової кислоти L (торгова марка: "Eudragit Ll00", виробництво EVONIK) (30 г) і цилостазол (виробництво Otsuka Pharmaceutical Co., Ltd.) (150 г), і суміш вміщують в швидкісну мішалку (номер моделі: NSK-150, виробництво Okada Seiko K.K.), потім туди ж при перемішуванні додають очищену воду (130 г) для отримання вихідної композиції (вихідна композиція Прикладу 3). Вихідну композицію піддають екструзійній грануляції за допомогою екструзійного гранулятора, забезпеченого куполоподібною матрицею (діаметр отвору: 0,6 мм, DomeGran DGL1, виробництво DALTON Co. LTD.), для отримання вологих гранул. Вологі гранули обробляють за допомогою сфероїдизатора (Murmerizer QJ-400, виробництво DALTON Co. LTD.) для регулювання форми і розміру гранул, за допомогою чого була отримана вихідна композиція у вигляді вологих гранул. Вихідну композицію у вигляді вологих гранул нагрівають і зволожують з використанням парової печі (HEALSIO, виробництво SHARP CORPORATION) в "режимі прогрівання" протягом 20 хвилин таким чином, що кукурудзяний крохмаль може бути попередньо желатинізований. Гранули, нагріті/зволожені подібним чином, сушать в повітряно-сушильній шафі при температурі 60ºC протягом 6 годин для отримання твердої фармацевтичної композиції в формі гранул (Приклад 3). Приклад 4 Змішують кукурудзяний крохмаль (торгова марка: "Nisshoku Corn Starch", виробництво Nippon Shokuhin Kako K.K.) (69 г), кристалічну целюлозу (торгова марка: "CEOLUS PH301", виробництво Asahi Kasei Corporation) (21 г), співполімер метакрилової кислоти L (торгова марка: "Eudragit Ll00", виробництво EVONIK) (15 г), співполімер метакрилової кислоти S (торгова марка: "Eudragit Sl00", виробництво EVONIK) (15 г), попередньо желатинізований крохмаль (торгова марка: "Amycol З", виробництво NIPPON STARCH CHEMICAL CO., LTD.) (30 г) і цилостазол (виробництво Otsuka Pharmaceutical Co., Ltd.) (150 г), і суміш вміщують в швидкісну мішалку (номер моделі: NSK-150, виробництво Okada Seiko K.K.), потім туди ж при перемішуванні додають 75 мл 4 % водного розчину полісорбату 80 (який містить 3 г полісорбату 80) і очищену воду (20 г) для отримання вихідної композиції (вихідна композиція Прикладу 4). Вихідну композицію піддають екструзійній грануляції за допомогою екструзійного гранулятора, забезпеченого куполоподібною матрицею (діаметр отвору: 0,6 мм, DomeGran DGL1, виробництво DALTON Co. LTD.), для отримання вологих гранул. Вологі гранули обробляють за допомогою сфероїдизатора (Murmerizer QJ-400, виробництво DALTON Co. LTD.) для регулювання форми і розміру гранул, за допомогою чого була отримана вихідна композиція у вигляді вологих гранул. Вихідну композицію у вигляді вологих гранул нагрівають і зволожують з використанням парової печі (HEALSIO, виробництво SHARP CORPORATION) в "режимі прогрівання" протягом 20 хвилин таким чином, що кукурудзяний крохмаль може бути попередньо желатинізований. Гранули, нагріті/зволожені подібним чином, сушать в повітряно-сушильній шафі при температурі 60ºC протягом 6 годин для отримання твердої фармацевтичної композиції в формі гранул (Приклад 4). Приклад 5 Змішують кукурудзяний крохмаль (торгова марка: "Nisshoku Corn Starch", виробництво Nippon Shokuhin Kako K.K.) (69 г), кристалічну целюлозу (торгова марка: "CEOLUS PH301", виробництво Asahi Kasei Corporation) (21 г), співполімер метакрилової кислоти S (торгова марка: "Eudragit Sl00", виробництво EVONIK) (30 г), попередньо желатинізований крохмаль (торгова марка: "LYCATAB PGS", виробництво ROQUETTE) (30 г) і цилостазол (виробництво Otsuka Pharmaceutical Co., Ltd.) (150 г), і суміш вміщують в швидкісну мішалку (номер моделі: NSK-150, виробництво Okada Seiko K.K.), потім туди ж при перемішуванні додають 75 мл 4 % водного розчину полісорбату 80 (який містить 3 г полісорбату 80) і очищену воду (20 г) для отримання вихідної композиції (вихідна композиція Прикладу 5). Вихідну композицію піддають екструзійній грануляції за допомогою екструзійного гранулятора, забезпеченого куполоподібною матрицею (діаметр отвору: 0,6 мм, DomeGran DGL1, виробництво DALTON Co. LTD.), для отримання вологих гранул. Вологі гранули обробляють за допомогою сфероїдизатора (Murmerizer QJ-400, виробництво DALTON Co. LTD.) для регулювання форми і розміру гранул, за допомогою чого була отримана вихідна композиція у вигляді вологих гранул. 9 UA 102547 C2 5 10 15 20 25 30 35 40 45 50 55 Вихідну композицію у вигляді вологих гранул нагрівають і зволожують з використанням парової печі (HEALSIO, виробництво SHARP CORPORATION) в "режимі прогрівання" протягом 20 хвилин таким чином, що кукурудзяний крохмаль може бути попередньо желатинізований. Гранули, нагріті/зволожені подібним чином, сушать в повітряно-сушильній шафі при температурі 60ºC протягом 6 годин для отримання твердої фармацевтичної композиції в формі гранул (Приклад 5). Приклад 6 Змішують кукурудзяний крохмаль (торгова марка: "Nisshoku Corn Starch", виробництво Nippon Shokuhin Kako K.K.) (69 г), кристалічну целюлозу (торгова марка: "CEOLUS PH301", виробництво Asahi Kasei Corporation) (21 г), співполімер метакрилової кислоти S (торгова марка: "Eudragit Sl00", виробництво EVONIK) (30 г), попередньо желатинізований крохмаль (торгова марка: "LYCATAB PGS", виробництво ROQUETTE) (30 г), лимонну кислоту (6 г) і цилостазол (виробництво Otsuka Pharmaceutical Co., Ltd.) (150 г), і суміш вміщують в швидкісну мішалку (номер моделі: NSK-150, виробництво Okada Seiko K.K.), потім туди ж при перемішуванні додають 75 мл 4 % водного розчину полісорбату 80 (який містить 3 г полісорбату 80) і очищену воду (20 г) для отримання вихідної композиції (вихідна композиція Прикладу 6). Вихідну композицію піддають екструзійній грануляції за допомогою екструзійного гранулятора, забезпеченого куполоподібною матрицею (діаметр отвору: 0,5 мм, DomeGran DGL1, виробництво DALTON Co. LTD.), для отримання вологих гранул. Вологі гранули обробляють за допомогою сфероїдизатора (Murmerizer QJ-400, виробництво DALTON Co. LTD.) для регулювання форми і розміру гранул, за допомогою чого була отримана вихідна композиція у вигляді вологих гранул. Вихідну композицію у вигляді вологих гранул нагрівають і зволожують з використанням парової печі (HEALSIO, виробництво SHARP CORPORATION) в "режимі прогрівання" протягом 20 хвилин таким чином, що кукурудзяний крохмаль може бути попередньо желатинізований. Гранули, нагріті/зволожені подібним чином, сушать в повітряно-сушильній шафі при температурі 60ºC протягом 6 годин для отримання твердої фармацевтичної композиції в формі гранул (Приклад 6). Порівняльні Приклади 1-6 Не піддаючи обробці нагріванням/зволоженням, вихідні композиції у вигляді вологих гранул (отримані в ході Прикладів 1-6) безпосередньо сушать в повітряно-сушильній шафі при температурі 60ºC протягом 6 годин для отримання твердої фармацевтичної композиції в формі гранул (Порівняльні Приклади 1-6). Експеримент 1 З використанням фармацевтичних композицій Прикладу 1 і Порівняльного Прикладу 1, які представлені в формі гранул, проводять наступні експерименти. Кожну композицію відважують в кількості, еквівалентній 100 мг цилостазолу, яку піддають аналізу на розчинення відповідно до наступної умови: розчин, що аналізується: 900 мл 4 % водного розчину полісорбату 80; спосіб з використанням лопатевої мішалки (100 обертів за хвилину). Для визначення швидкості розчинення лікарського засобу вимірюють УФ поглинання зразків, зареєстроване в кожний визначений момент часу. Через дві години після початку аналізу в кожний розчин, що аналізується, додають 0,18 г амілази (торгова марка: "a-Amylase", виробництво Wako Pure Chemical Industries, Limited) і через 4 години після початку аналізу туди ж додають буферний розчин для доведення рН кожного розчину, що аналізується, до 7,0. Результати приведені на фіг. 1. Що стосується Порівняльного Прикладу 1, то його розчинення почалося відразу ж після початку аналізу на розчинення, і швидкість вивільнення лікарського засобу сильно залежала від додавання амілази або підвищення рН. Тоді як для Прикладу 1 швидкість вивільнення лікарського засобу різко підвищувалася через 4 години після початку аналізу на розчинення, тобто в той час, коли рН змінювався; і після 6 годин швидкість вивільнення для Прикладу 1 перевищила швидкість для Порівняльного Прикладу 1. Експеримент 2 З використанням фармацевтичних композицій Прикладу 2 і Порівняльного Прикладу 2, які представлені в формі гранул, проводять наступні експерименти. Кожну композицію відважують в кількості, еквівалентній 100 мг цилостазолу, яку піддають аналізу на розчинення відповідно до наступної формули: розчин, що аналізується: 900 мл 0,3 % водного розчину лаурилсульфату натрію; спосіб з використанням лопатевої мішалки (100 обертів за хвилину). Для визначення швидкості розчинення лікарського засобу вимірюють УФ поглинання зразків, зареєстроване в кожний визначений момент часу. Через дві години після початку аналізу в кожний розчин, що аналізується, додають 0,18 г амілази (торгова марка: "a-Amylase", виробництво Wako Pure 10 UA 102547 C2 5 10 15 20 25 30 35 40 45 50 55 Chemical Industries, Limited) і через 4 години після початку аналізу туди ж додають буферний розчин для доведення рН кожного розчину, що аналізується, до 7,1. Результати приведені на фіг. 2. Через 2 години після початку аналізу, за рахунок додавання амілази лікарський засіб Прикладу 2 швидко розчинився, і це підтвердило, що дія попередньо желатинізованого крохмалю зберігалася. Експерименти 3-6 Використовуючи Приклади 3-6 і Порівняльні Приклади 3-6, проводять аналіз аналогічний Експерименту 2 (Експерименти 3-6). Однак, через 4 години для Експериментів 3, 4 і 5 рН доводять до "7,1" і для Експерименту 6 до "7,5". Для всіх випадків, як і внаслідок Експерименту 3, розчинення для Прикладів 3 6 було більш уповільненим, ніж розчинення для Порівняльних Прикладів 3 6 (фіг. 3-6). На закінчення, згідно з результатами Експериментів 1-6, було виявлено, що композиції даного винаходу мають дві властивості, а саме: вивільнення лікарського засобу в кожній композиції, що містить попередньо желатинізований крохмаль за рахунок дії амілази, яка дигерує крохмаль, і, додатково, контролювання вивільнення лікарського засобу в залежності від рН за рахунок дії ентеросолюбільного компонента. Дослідження фармакокінетичних характеристик З використанням гранул, що містять цилостазол, отриманих в Прикладах 4 6, кожну гранулу, що містить 100 мг цилостазолу, після їжі вводять 7 здоровим дорослим чоловікам, і потім з плином часу відбирають кров і вимірюють концентрацію цилостазолу в крові. І, аналогічно, 7 здоровим дорослим чоловікам після їжі вводять комерційно доступний Pletaal tablet® (який містить 50 мг цилостазолу), і потім з плином часу відбирають кров і вимірюють концентрацію цилостазолу в крові. Результати приведені в Таблиці 1 і на фіг. 7. У порівнянні з Порівняльним Прикладом момент часу Смакс у всіх прикладах може відставати. Серед даних результатів результат Прикладу 6, що містить органічну кислоту, показав велику Смакс і AUC в порівнянні з Прикладами 4 і 5. Тоді як композиції Прикладів 4 і 5 (головним чином Прикладу 4) показали знижену Смакс в порівнянні з Порівняльним Прикладом і, крім того, показали фармакокінетичний профіль, який може підтримувати активність лікарського засобу протягом тривалого періоду. Співполімер метакрилової кислоти L є ентеросолюбільним компонентом, який може бути розчинений при рН 6 або вище, і співполімер метакрилової кислоти S є ентеросолюбільним компонентом, який може бути розчинений при рН 7 або вище. Згідно з результатами Експериментів 3-5, в яких відповідно приведені швидкості розчинення Прикладів 3-5, було виявлено, що для сповільнення розчинення, чим вищий діапазон рН, при якому може бути розчинений ентеросолюбільний компонент, що міститься, тим повільніша швидкість розчинення. Однак, як показано на фіг.7, якщо кожна гранула даного винаходу, яка містить цилостазол, фактично вводиться здоровим дорослим людям, то результат не відповідає результату аналізів на розчинність (див. результати Прикладу 4 і Прикладу 5). А саме, гранули, у яких нижчий діапазон рН, при якому ентеросолюбільний компонент може бути розчинений (тобто Приклад 4, для якого нижчий його діапазон рН, ніж для Прикладу 5), мають профіль, який робить розчинення поступовим і забезпечує довготривалу підтримувану ефективність. І, було виявлено, що тверда фармацевтична композиція, яка містить комбінацію двох або більше ентеросолюбільних компонентів, які мають різні діапазони рН для розчинення (як наприклад, Приклад 4), має фармакокінетичний профіль, при якому знижується С макс і підтримується постійний рівень в крові, даючи довготривалу ефективність, що підтримується протягом тривалого періоду після введення, в порівнянні з варіантами, де використовується один тип ентеросолюбільного компонента. З іншого боку, у разі Прикладу 6, де міститься ентеросолюбільний компонент, що має більш високий діапазон рН для розчинення і, крім того, де міститься органічна кислота, вважається, що розчинення все більше і більше сповільнюється, навіть якщо рН біля лікарського засобу підвищується, оскільки органічна кислота сповільнює реальне підвищення рН. Однак, як і для результату аналізу на розчинення в Експерименті 6, так і для описаного тут фармакокінетичного дослідження, лікарський засіб в Прикладі 6 різко розчинявся після підвищення діапазону рН, при якому ентеросолюбільний компонент може бути розчинений, хоч і спостерігалася невелика затримка розчинення. Було виявлено, що тверда фармацевтична композиція, що містить нарівні з ентеросолюбільним компонентом (як в Прикладі 6) також і органічну кислоту (наприклад, лимонну кислоту), має такий фармакокінетичний профіль, при якому відбувається розчинення достатньої кількості лікарського засобу протягом короткого періоду часу після зміни рН, тоді як початкове розчинення знижується. 11 UA 102547 C2 5 Основуючись на отриманих результатах, стало можливим розробити композицію з уповільненим вивільненням, яка відповідає будь-яким цілям, за рахунок підбору прийнятним чином композицій даного винаходу, і, крім того, можливо розробити композицію з уповільненим вивільненням, яка може підтримувати постійний рівень лікарського засобу в крові протягом тривалого періоду за рахунок комбінування даної композиції з уповільненим вивільненням і звичайної композиції без уповільненого вивільнення. Таблиця 1 Композиція Порівняльний Приклад 7 (50 мг) Приклад 4 (100 мг) Приклад 5 (100 мг) Приклад 6 (100 мг) AUCt (нг·год./мл) 5555 Смакс (нг/мл) 715 Тмакс (год.) 2,4 AUC (нг·год./мл) 5973 6679 7282 9810 351 524 747 11,1 7,1 7,4 15114 12029 11305 Примітка) "год.» означає годину(и). AUCt: Площа під кривою залежності між рівнем в плазмі і минулим часом (в правилі трапецій). AUC: Площа під кривою залежності між рівнем в плазмі і минулим часом до нескінченного часу. Смакс: Максимальна концентрація в плазмі. Тмакс: Час, необхідний для досягнення максимальної концентрації в плазмі. 10 15 20 25 30 35 40 45 ФОРМУЛА ВИНАХОДУ 1. Тверда фармацевтична композиція, яка містить (а) цилостазол, (b) попередньо желатинізований крохмаль в кількості від 10 до 90 % по масі, з розрахунку на загальну вагу композиції, (с) один або декілька типів ентеросолюбільних компонентів і (d) органічну кислоту. 2. Тверда фармацевтична композиція за п. 1, де органічна кислота міститься в кількості від 0,5 до 5 % по масі. 3. Тверда фармацевтична композиція за п. 1 або 2, де органічна кислота є лимонною кислотою. 4. Тверда фармацевтична композиція за будь-яким з пп. 1-3, де один або декілька типів ентеросолюбільних компонентів містять ацетат сукцинат гідроксипропілметилцелюлози, фталат гідроксипропілметилцелюлози, карбоксиметилетилцелюлозу, співполімер метакрилової кислоти L і/або співполімер метакрилової кислоти S. 5. Тверда фармацевтична композиція за п. 3, де ентеросолюбільні компоненти містять співполімер метакрилової кислоти S. 6. Тверда фармацевтична композиція за будь-яким з пп. 1-5, де попередньо желатинізований крохмаль є попередньо желатинізованим кукурудзяним крохмалем. 7. Тверда фармацевтична композиція за будь-яким з пп. 1-6, яка отримана за допомогою наступних стадій (i) і (ii): (i) стадії змішування цилостазолу, крохмалю, одного або декількох типів ентеросолюбільних компонентів і органічної кислоти для отримання вихідної композиції, і (ii) стадії обробки вихідної композиції для попереднього желатинізування крохмалю. 8. Тверда фармацевтична композиція за п. 7, де крохмаль на стадії (i) є одним крохмалем або сумішшю, що складається з крохмалю, частково попередньо желатинізованого крохмалю і/або попередньо желатинізованого крохмалю, за умови, що крохмаль на стадії (i) не є тільки попередньо желатинізованим крохмалем. 9. Тверда фармацевтична композиція за будь-яким з пп. 1-8, яка представлена в формі частинки. 10. Тверда фармацевтична композиція за будь-яким з пп. 1-8, яка представлена в формі гранули або порошку. 11. Тверда фармацевтична композиція за п. 10, яка отримана за допомогою способу екструзійної грануляції. 12. Капсула, яка містить тверду фармацевтичну композицію за будь-яким з пп. 9, 10 або 11. 13. Таблетка, яка містить тверду фармацевтичну композицію за будь-яким з пп. 9, 10 або 11. 14. Спосіб отримання твердої фармацевтичної композиції за будь-яким з пп. 1-11, де крохмаль попередньо желатинізують шляхом нагрівання в процесі отримання. 15. Спосіб за п. 14, де нагрівання супроводжується зволожуванням. 16. Тверда фармацевтична композиція, яка отримана способом за п. 14 або 15. 12 UA 102547 C2 17. Капсула, яка наповнена швидковивільнюваними гранулами або порошком, що містять цилостазол, і гранулами або порошком за одним або декількома з пп. 9-11. 13 UA 102547 C2 14 UA 102547 C2 15 UA 102547 C2 Комп’ютерна верстка Г. Паяльніков Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 16
ДивитисяДодаткова інформація
Назва патенту англійськоюSolid pharmaceutical formulation
Автори англійськоюMukai, Tadashi
Назва патенту російськоюТвердая фармацевтическая композиция
Автори російськоюМукаи Тадаси
МПК / Мітки
МПК: A61K 9/16, A61K 31/4709, A61P 7/02
Мітки: композиція, тверда, фармацевтична
Код посилання
<a href="https://ua.patents.su/18-102547-tverda-farmacevtichna-kompoziciya.html" target="_blank" rel="follow" title="База патентів України">Тверда фармацевтична композиція</a>
Попередній патент: Використання захисних несучих для додаткових каналів
Наступний патент: Спосіб комплексного хроматографічного встановлення наявних рослинних жирів в молокопродуктах
Випадковий патент: Спосіб одержання пектину яблучного