Гетероариламіни, фармацевтична композиція, спосіб інгібування холінестерази у ссавців, спосіб покращення пам’яті
Формула / Реферат
Гетероариламины общей формулы (I):
где один из R2, R3 и боковая цепь, содержащая >C=Z, могут быть, необязательно, присоединены, предпочтительно атому углерода, отмеченному звездочкой, в кольце В, чем к атому кольца А,
кольцо А представляет бензо,
R1 представляет фенил, фенил(С1-С6) алкил, циннамил или гетероарилметил, где гетероарильный остаток указанного гетероарилметила выбран из имидазоло, тиазоло, тиено, пиридо и изоксазоло, и где указанный фенил и указанный гетероарильный остаток могут быть, необязательно, замещены одним или двумя заместителями, независимо выбранными из (С1-С6)алкила, (С1-С4)алкокси и галоида, R2 и R3 независимо выбраны из водорода, (С1-С6)алкокси, (С1-С6)алкила, необязательно замещенного от одного до трех атомами фтора, бензилокси, гидрокси, фенилом, бензилом, галоидом, нитро, циано, COOR4, CONHR4, NR4R5, NR4 СOR5, SОрСН2-фенилом, где р равно 0,1 или 2,
или R2 и R3 присоединяются к соседним атомам углерода и образуют вместе с атомами, к которым они присоединяются, пяти- или шестичленное кольцо, где каждый атом кольца представляет углерод, азот или кислород (например метилендиокси, этилендиокси или лактамовое кольцо), R4 и R5 независимо выбраны из водорода и (С1-С6,)алкила, или R4 и R5, если они являются частью указанной группы NR4R5, необязательно образуют вместе с азотом, к которому они присоединяются, кольцо, содержащее от четырех до восьми членов, где один атом кольца представляет азот и другие представляют углерод, кислород или азот, или R4 и R5, если они являются частью указанной группы NR4 COR5, необязательно, образуют вместе с атомом азота и углерода к которым они присоединяются, четырех - восьмичленное лактамовое кольцо,
Х представляет азот или СН,
Y представляет кислород, серу или NR6,
R6 представляет водород, (С1-С6)алкил, СО(С1.С6)алкил или SO2-фенил, где фенильный остаток указанного SO2- фенила может быть, необязательно, замещен одним-пятью заместителями, независимо выбранными из (С1-С4)алкила, n представляет целое число от 1 до 4,
каждый q, независимо, равен 1 или 2, и
Z представляет кислород или серу,
при условии, что любая CHq группа, где q равно 1, должна быть присоединена к одной и только такой другой CHq группе, где q равно 1, или фармацевтически приемлемая соль такого соединения.
2. Соединение по пункту 1, имеющее формулу:
где
Х представляет СН, ССНз или N,
Y представляет NH, NСНз, NСН2СНз, S, О или NSO2C6H5,
R2 и R3 независимо выбраны из группы, состоящей из (С1-С4)алкила, хлора, фтора, метокси, амино, и -NНС(0)СНз,
или R2 и R3 вместе с углеродами к которым они присоединяются, образуют y-
лактамовое кольцо, и
R1 представляет бензил, метоксибензил, фторбензил или группу формулы:
где W представляет водород, (С1-С6)алкил, фенил или бензил.
3. Соединение по пункту 2, отличающееся тем, что Х представляет СН, ССНз или N; Y представляет NH, NСНз, серу или кислород;
R2 и R3 независимо выбраны из группы, состоящей из (С1-C4)алкила, хлора, фтора, метокси, амино и -NНС(O)СНз, и
R, представляет бензил.
4. Соединение по пункту 3, отличающееся тем, что R2 и R3 независимо выбраны из группы, состоящей из (С1-С4)алкила, хлора, амино и -NНС(O)СНз.
5. Соединение по пункту 1, выбранное из группы, состоящей из:
1-(2-метил-1Н-бензимидазол-5-ил)-3-[1-(фенилметил)-4-пиперидинил]-1-пропанон гидрохлорида;
1-(2-фенил-1Н-бензимидазол-5-ил)-3-[1-(фенилметил)-4-пиперидинил]-1-пропанон гидрохлорида;
1-(1-этил-2-метил-1Н-бензимидазол-5-ил)-3-[1-(фенилметил)-4-пиперидинил]-1-пропанон гидрохлорида;
1-(2-метил-6-бензотиазолил)-3-[1-(фенилметил)-4-пиперидинил]-1-пропанон гидрохлорида;
1-(2—метил-6-бензотиазолил)-3-[1-((2-метил-4-тиазолил)метил)-4-пиперидинил]-1-пропанона;
1-(5-метилбензо[Ь]тиен-2-ил)-3-[1-(фенилметил)-4-пиперидинил]-1-пропанона;
1-(6-метилбензо[Ь]тиен2-ил)-3-[1-(фенилметил)-4-пиперидинил]-1-пропанона;
1-(3,5-диметилбензо[Ь]тиен-2-ил)-3-[1-(фенилметил)-4-пиперидинил]-1-пропанона;
1-(бензо[Ь]тиен-2-ил)-3-[1-(фенилметил)-4-пиперидинил]-1-пропанона;
1-(бензофуран-2-ил)-3-[1-(фенилметил)-4-пиперидинил]-1-пропанона;
1-(1-фенилсульфонил-6-метилиндол-2-ил)-3-[1-(фенилметил)-4-пиперидинил]-1-пропанона;
1-(6-метилиндол-2-ил)-3-[1-(фенилметил)-4-пиперидинил]-1-пропанона;
1-(1-фенилсульфонил-5-аминоиндол-2-ил)-3-[1-(фенилметил)-4-пиперидинил]-1-пропанона;
1-(5-аминоиндол-2-ил)-3-[1-(фенилметил)-4-пиперидинил]-1-пропанонаи
1-(5-ацетиламиноиндол-2-ил)-3-[1-(фенилметил)-4-пиперидинил]-1-пропанона.
6. Соединение по пункту 1, выбранное из группы, состоящей из:
1-(2-метил-1Н-бензимидазол-5-ил)-3-[1-(фенилметил)-4-пиперидинил]-1-пропанона;
1-(2-фенил-1Н-бензимидазол-5-ил)-3-[1-(фенилметил)-4-пиперидинил]-1-пропанона;
1-(1-этил-2-метил-1Н-бензимидазол-5-ил)-3-[1-(фенилметил)-4-пиперидинил]-1-пропанона;
1-(2-метил-6-бензотиазолил)-3-[1-(фенилметил)-4-пиперидинил]-1-пропанона.
7. Фармацевтическая композиция ингибирующая ацетилхолинэстеразу, отличающаяся тем, что в качестве активного компонента содержит эффективное количество соединения по п. 1 и фармацевтически приемлемый носитель.
8. Фармацевтическая композиция по п. 7 для усиления памяти или лечения, или предупреждения болезни Альцгеймера.
9. Способ ингибирования холинэстеразы у млекопитающего, отличающийся тем, что вводят млекопитающему ингибирующее холинэстеразу количество соединения по пункту 1.
10. Способ усиления памяти или лечения, или предупреждения болезни Альцгеймера, включающий введение пациенту эффективного для усиления памяти количества соединения по пункту 1.
Текст
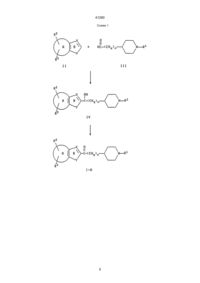
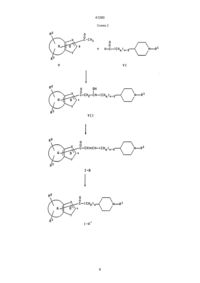
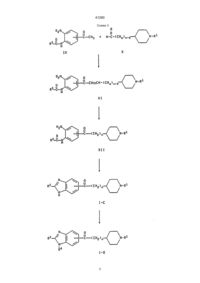
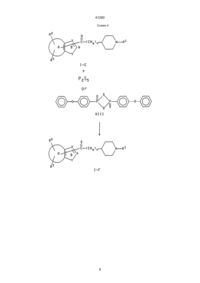
УКРАЇНА UA (19) (11) 41290 (13) C2 (51) 7 C07D211/32, C07D401/06, C07D405/06, C07D407/06, C07D409/06, C07D413/06, C07D417/06, A61K31/445 МІНІСТЕРСТВО ОСВІТИ І НАУКИ УКРАЇНИ ДЕРЖАВНИЙ ДЕПАРТАМЕНТ ІНТЕЛЕКТУАЛЬНОЇ ВЛАСНОСТІ ОПИС ДО ПАТЕНТУ НА ВИНАХІД R3 (CHq)n N R1 , где один из R2, R3 и боковая цепь, содержащая >C=Z, могут быть, необязательно, присоединены, предпочтительно, к атому углерода, отмеченному звездочкой, в кольце В, чем к атому кольца А, кольцо А представляет бензо, R1 представляет фенил, фенил(С1-С6)алкил, циннамил или гетероарилметил, где гетероарильный остаток указанного гетероарилметила выбран из имидазоло, тиазоло, тиено, пиридо и изоксазоло, и где указанный фенил и указанный гетероарильный остаток могут быть, необязательно, замещены одним или двумя заместителями, независимо выбранными из (С1-С6)алкила, (С1-С4)алкокси и галоида, R2 и R3 независимо выбраны из водорода, (С1-С6)алкокси, (С1-С6)алкила, необязательно замещенного от одного до трех атомами фтора, бензилокси, гидрокси, фенилом, бензилом, галоидом, нитро, циано, COOR4, CONHR4, NR4R5, O X C R2 (CH2)2 N R1 Y или R2 X O C R3 Y (CH2)2 N R1 , (13) C 41290 A Z (11) X * B Y UA R2 NR4СOR5, SOрСН2-фенилом, где р равно 0, 1 или 2, или R2 и R3 присоединяются к соседним атомам углерода и образуют вместе с атомами, к которым они присоединяются, пяти- или шестичленное кольцо, где каждый атом кольца представляет углерод, азот или кислород (например метилендиокси, этилендиокси или лактамовое кольцо), R4 и R5 независимо выбраны из водорода и (С1-С6)алкила, или R4 и R5, если они являются частью указанной группы NR4R5, необязательно образуют вместе с азотом, к которому они присоединяются, кольцо, содержащее от четырех до восьми членов, где один атом кольца представляет азот и другие представляют углерод, кислород или азот, или R4 и R5, если они являются частью указанной группы NR4COR5, необязательно, образуют вместе с атомом азота и углерода, к которым они присоединяются, четырех-восьмичленное лактамовое кольцо, Х представляет азот или СН, Y представляет кислород, серу или NR6, R6 представляет водород, (С1-С6)алкил, СО(С1-С6)алкил или SO2-фенил, где фенильный остаток указанного SО2-фенила может быть, необязательно, замещен одним-пятью заместителями, независимо выбранными из (С1-С4)алкила, n представляет целое число от 1 до 4, каждый q, независимо, равен 1 или 2, и Z представляет кислород или серу, при условии, что любая CHq группа, где q равно 1, должна быть присоединена к одной и только такой другой CHq группе, где q равно 1, или фармацевтически приемлемая соль такого соединения. 2. Соединение по пункту 1, имеющее формулу: (19) (21) 94005424 (22) 31.08.1992 (24) 17.09.2001 (31) 771,283 (32) 03.10.1991 (33) US (86) PCT/US92/07230, 31.08.1992 (46) 17.09.2001, Бюл. № 8, 2001 р. (72) Чен Юнінг Л., US, Нейджел Артур А., US (73) ЕЙСАЙ КО., ЛТД., JP (56) ЕР 0487071, С07D401/06, 21.11.1991. EP 0441517, С07D401/06, 29.01.1991. EP 0296560, С07D211/26, 22.06.1988. EP 0449186, С07D211/22, 26.03.1991. EP 0378207, С07D211/32, 11.01.1990. EP 0288563, С07D211/14, 30.09.1986. EP 0351282, С07D401/06, 03.07.1989. EP 0363963, С07D401/06, 12.10.1999. EP 0411631, С07D401/06, 02.08.1990 (57) 1. Гетероариламины общей формулы (I): C2 (54) ГЕТЕРОАРИЛАМІНИ, ФАРМАЦЕВТИЧНА КОМПОЗИЦІЯ, СПОСІБ ІНГІБУВАННЯ ХОЛІНЕСТЕРАЗИ У ССАВЦІВ, СПОСІБ ПОКРАЩЕННЯ ПАМ'ЯТІ 41290 1-(2-метил-6-бензотиазолил)-3-[1-((2-метил-4тиазолил)метил)-4-пиперидинил]-1-пропанона; 1-(5-метилбензо[b]тиен-2-ил)-3-[1-(фенилметил)4-пиперидинил]-1-пропанона; 1-(6-метилбензо[b]тиен-2-ил)-3-[1-(фенилметил)4-пиперидинил]-1-пропанона; 1-(3,5-диметилбензо[b]тиен-2-ил)-3-[1-(фенилметил)-4-пиперидинил]-1-пропанона; 1-(бензо[b]тиен-2-ил)-3-[1-(фенилметил)-4-пиперидинил]-1-пропанона; 1-(бензофуран-2-ил)-3-[1-(фенилметил)-4-пиперидинил]-1-пропанона; 1-(1-фенилсульфонил-6-метилиндол-2-ил)-3-[1(фенилметил)-4-пиперидинил]-1-пропанона; 1-(6-метилиндол-2-ил)-3-[1-(фенилметил)-4-пиперидинил]-1-пропанона; 1-(1-фенилсульфонил-5-аминоиндол-2-ил)-3-[1(фенилметил)-4-пиперидинил]-1-пропанона; 1-(5-аминоиндол-2-ил)-3-[1-(фенилметил)-4-пиперидинил]-1-пропанона и 1-(5-ацетиламиноиндол-2-ил)-3-[1-(фенилметил)4-пиперидинил]-1-пропанона. 6. Соединение по пункту 1, выбранное из группы, состоящей из: 1-(2-метил-1Н-бензимидазол-5-ил)-3-[1-(фенилметил)-4-пиперидинил]-1-пропанона; 1-(2-фенил-1Н-бензимидазол-5-ил)-3-[1-(фенилметил)-4-пиперидинил]-1-пропанона; 1-(1-этил-2-метил-1Н-бензимидазол-5-ил)-3-[1(фенилметил)-4-пиперидинил]-1-пропанона; 1-(2-метил-6-бензотиазолил)-3-[1-(фенилметил)4-пиперидинил]-1-пропанона. 7. Фармацевтическая композиция, ингибирующая ацетилхолинэстеразу, отличающаяся тем, что в качестве активного компонента содержит эффективное количество соединения по п. 1 и фармацевтически приемлемый носитель. 8. Фармацевтическая композиция по п. 7 для усиления памяти или лечения, или предупреждения болезни Альцгеймера. 9. Способ ингибирования холинэстеразы у млекопитающего, отличающийся тем, что вводят млекопитающему ингибирующее холинэстеразу количество соединения по пункту 1. 10. Способ усиления памяти или лечения, или предупреждения болезни Альцгеймера, включающий введение пациенту эффективного для усиления памяти количества соединения по пункту 1. где X представляет СН, ССН3 или N, Y представляет NH, NСН3, NСН2СН3, S, О или NSO2C6H5, R2 и R3 независимо выбраны из группы, состоящей из (С1-С4)алкила, хлора, фтора, метокси, амино, и -NНС(O)СН3, или R2 и R3 вместе с углеродами, к которым они присоединяются, образуют g-лактамовое кольцо, и R1 представляет бензил, метоксибензил, фторбензил или группу формулы: N N , N W W S , O N W или S Cl , где W представляет водород, (С1-С6)алкил, фенил или бензил. 3. Соединение по пункту 2, отличающееся тем, что Х представляет СН, ССН3 или N; Y представляет NH, NСН3, серу или кислород; R2 и R3 независимо выбраны из группы, состоящей из (С1-С4)алкила, хлора, фтора, метокси, амино и -NНС(O)СН3, и R1 представляет бензил. 4. Соединение по пункту 3, отличающееся тем, что R2 и R3 независимо выбраны из группы, состоящей из (С1-С4)алкила, хлора, амино и -NНС(O)СН3. 5. Соединение по пункту 1, выбранное из группы, состоящей из: 1-(2-метил-1Н-бензимидазол-5-ил)-3-[1-(фенилметил)-4-пиперидинил]-1-пропанон гидрохлорида; 1-(2-фенил-1Н-бензимидазол-5-ил)-3-[1-(фенилметил)-4-пиперидинил]-1-пропанон гидрохлорида; 1-(1-этил-2-метил-1Н-бензимидазол-5-ил)-3-[1(фенилметил)-4-пиперидинил]-1-пропанон гидрохлорида; 1-(2-метил-6-бензотиазолил)-3-[1-(фенилметил)4-пиперидинил]-1-пропанон гидрохлорида; Настоящее изобретение относится к гетероариламинам формулы (I), приведенной ниже, и фармацевтически приемлемым солям таких соединений. Соединения формулы (I) представляют ингибиторы ацетилхолинэстеразы и являются полезными для усиления памяти у пациентов, страдающих от слабоумия и болезни Альцгеймера. Болезнь Альцгеймера связана с дегенерацией холинергических нейронов в базальном переднем отделе мозга, которые играют фундаментальную роль в познавательных функциях, включая память (Becker at al., Drug Development Research, 12, 163195 (1988)). В результате такой дегенерации у пациентов, страдающих от этой болезни, наблюдается заметное снижение синтеза ацетилхолина, активности холинацетилтрансэстеразы, активности ацетилхолинэстеразы и усвоении холина. Известно, что ингибиторы ацетилхолинэстеразы являются эффективными в усилении холинергической активности и полезными для улучшения памяти у пациентов с болезнью Альцгеймера. Ингибированием фермента ацетилхолинэстеразы и соединения увеличивают уровень нейропереносимого ацетилхолина в мозгу и, таким образом, усиливают память. 2 41290 R6 представляет водород, (С1-С6)алкил, СО(С1-С6)алкил или SO2-фенил, где фенильный остаток указанного SO2-фенила необязательно может быть замещен одним-пятью заместителями, необязательно выбранными из (С1-С4)алкила; n равно целому от 1 до 4; каждый q представляет, независимо, 1 или 2 и Z представляет кислород или серу при условии, что любая CHq группа, где q равно 1, должна присоединяться к одной и только такой другой группе CHq, у которой q равно 1. Настоящее изобретение также относится к фармацевтически приемлемым аддитивным солям кислоты соединений формулы (I). Примеры таких фармацевтически приемлемых аддитивных солей кислот представляют соли хлористоводородной кислоты, n-толуолсульфоновой кислоты, фумаровой кислоты, малеиновой кислоты, лимонной кислоты, сукциновой кислоты, салициловой кислоты, щавелевой кислоты, бромистоводородной кислоты, фосфорной кислоты, метансульфоновой кислоты, винной кислоты, диn-толуолвинной кислоты и миндальной кислоты. Кроме того, это изобретение относится к фармацевтической композиции для ингибирования ацетилхолинэстеразы, содержащей соединение формулы (I) или его фармацевтически приемлемую соль присоединения кислоты и фармацевтически приемлемый носитель. Изобретение, кроме того, относится к способу ингибирования ацетилхолинэстеразы у млекопитающих, включающему введение млекопитающему соединения формулы (I) или его фармацевтически приемлемой соли присоединения кислоты в количестве, эффективном для ингибирования ацетилхолинэстеразы. Изобретение, кроме того, относится к способу усиления памяти или лечения или предупреждения болезни Альцгеймера у млекопитающих, заключающемуся во введении млекопитающему соединения формулы (I) или его фармацевтически приемлемой соли присоединения кислоты в количестве, эффективном для усиления памяти, или лечения или предупреждения болезни Альцгеймера. Термин "млекопитающий", как он использован здесь, включает людей. Термин "галоид", как он использован здесь, включает хлор, бром или фтор. Предпочтительные соединения этого изобретения являются соединениями формулы Becker at al., supra, сообщает, что соответствующие изменения, следующие за ингибированием холинэстеразы, совпадают предсказанными уровнями пика ацетилхолина в мозгу. Они также обсуждают эффективность трех известных ингибиторов ацетилхолинэстеразы физостигмина, метрифоната и тетрагидроаминоакридина. Патентная заявка США № 07/639614 от 10 января 1991 г. и патентная заявка США № 07/676918 от 28 марта 1991 г., обе, относятся, в общем, к настоящему применению и также относятся к гетероариламиновым ингибиторам ацетилхолинэстеразы. Настоящее изобретение относится к соединениям формулы: R2 X * B Y A Z C R3 (CHq)n N R1 (I) где один из R2, R3 и боковая цепь, содержащая -С=Z, могут быть необязательно присоединены к атому углерода, отмеченному звездочкой в кольце В, скорее чем к атому кольца А; кольцо А представляет бензо, тиено пиридо, пиразино, пиримидо, фурано, селено, пирроло, тиазоло или имидазоло; R1 представляет фенил, фенил-(С1-С6)алкил, циннамил, или гетероарилметил, где гетероарильный остаток указанного гетероарилметила выбран из имидазоло, тиазоло, тиено, пиридо и изоксазоло и где указанный фенильный и указанный гетероарильный остаток могут быть необязательно замещенными одним или двумя заместителями, независимо выбранными из (С1-С6)алкила, (С1-С6)алкокси и галоида; R2 и R3 являются независимо выбранными из водорода, (С1-С6)алкокси, (С1-С6)алкила, необязательно замещенного от одного до трех атомами фтора, бензилокси, гидрокси, фенила, бензила, галоида, нитро, циано, COOR4, CONHR4, NR4R5, NR4COR5 или СОрCH2-фенила, где р равно 0, 1 или 2; или R2 и R3 присоединяются к соседним атомам углерода и образуют, вместе с углеродами, к которым они присоединяются, 5-ти или 6-тичленное кольцо, где каждый атом кольца представляет углерод, азот или кислород (например, метилендиокси, этилендиокси или лактамовое кольцо); R4 и R5 являются независимо выбранными из водорода и (С1-С6)алкила, или R4 и R5, если они являются частью указанного NR4R5, необязательно образуют, вместе с азотом, к которому они присоединяются, кольцо, содержащее от 4 до 8 атомов, в котором один из атомов кольца представляет азот и другие представляют углерод, кислород или азот, или R4 и R5, если они являются частью указанного NR4COR5, необязательно образуют, вместе с атомом азота и углерода, к которым они присоединяются, 4-х-8-мичленное лактамовое кольцо; Х представляет азот или СН; Y представляет кислород, серу или NR6; O X C R2 (CH2) 2 N R1 Y или R2 X O C R3 3 Y (CH2)2 N R1 , 41290 1-(5-бензтиенил)-3-[1-(фенилметил)-4-пиперидинил]-1-пропанон; 1-(6-хиназолил)-3-[1-(фенилметил)-4-пиперидинил]-1-пропанон; 1-(6-бензоксазолил)-3-[1-(фенилметил)-4-пиперидинил]-1-пропанон; 1-(5-бензофуранил)-3-[1-(фенилметил)-4-пиперидинил]-1-пропанон; 1-(5-метил-бензимидазол-2-ил)-3-[1-(фенилметил)-4-пиперидинил]-1-пропанон; 1-(6-метил-бензимидазол-2-ил)-3-[1-(фенилметил)-4-пиперидинил]-1-пропанон; 1-(5-хлор-бензо[b]тиен-2-ил)-3-[1-(фенилметил)4-пиперидинил]-1-пропанон; 1-(5-азаиндол-2-ил)-3-[1-(фенилметил)-4-пиперидинил]-1-пропанон; 1-(6-азабензо[b]тиен-2-ил)-3-[1-(фенилметил)-4пиперидинил]-1-пропанон; 1-(1H-2-oкco-пиppoлo-[2',3',5,6]бeнзo[b]тиeнo-2ил)-3-[1-(фенилметил)-4-пиперидинил]-1-пропанон; 1-(6-метил-бензотиазол-2-ил)-3-[1-(фенилметил)-4-пиперидинил]-1-пропанон; 1-(6-метокси-индол-2-ил)-3-[1-(фенилметил)-4пиперидинил]-1-пропанон; 1-(6-метокси-бензо[b]тиен-2-ил)-3-[1-(фенилметил)-4-пиперидинил]-1-пропанон; 1-(6-ацетиламино-бензо[b]тиен-2-ил)-3-[1-(фенилметил)-4-пиперидинил]-1-пропанон и 1-(5-ацетиламино-бензо[b]тиен-2-ил)-3-[1-(фенилметил)-4-пиперидинил]-1-пропанон. Формула (I), приведенная выше, включает соединения, идентичные тем, которые уже описаны, но фактически, один или более атомов водорода, азота или углерода заменяются их изотопами (например, изотопами тритиа, углерода-14 или азота15). Такие соединения являются полезными для исследований и диагностических целей в фармокинетических исследованиях метаболизма и в опытах по связыванию. Соединения формулы (I) могут иметь оптически-активные центры и поэтому могут существовать в различных изомерных формах. Изобретение включает все изомеры таких соединений, имеющих формулу (I), включая их смеси. Получение соединений, имеющих формулу (I), иллюстрируется следующими реакционными схемами. За исключением случаев, оговоренных особо, в реакционных схемах и последующем обсуждении, R1, R2, R3, R4, R5, R6 n, q, р, X, Y и Z и структурная формула (I) имеют значения, как они определены выше. Символ * (т. е. звездочка), который появляется в нескольких структурах, представленных в реакционных схемах, для каждой структуры, в которой он появляется, обозначает, что боковая цепь, Х представляет СН, ССН3, ССН2СН3 или N; Y представляет NН, NСН3NСН2СН3, S, О или NSО2С6Н5; R2 и R3 представляют заместители, независимо выбранные из групп, состоящих из (С1-С4)алкила, хлора, фтора, метокси, амино и NHC CH3 ; или R2 и R3, вместе с углеродом, к коO торому они присоединяются, образуют g-лактамовое кольцо; и R1 представляет бензил, метоксибензил, фторбензил или группу формулы: CH2 N N W N CH2 , W S , O N CH2 W или S CH 2 Cl , W представляет водород, (С1-С6)алкил, фенил или бензил. Конкретные предпочтительные соединения изобретения представляют: 1-(2-метил-1Н-бензимидазол-5-ил)-3-[1-(фенилметил)-4-пиперидинил]-1-пропанон; 1-(2-фенил-1Н-бензимидазол-5-ил)-3-[1-(фенилметил)-4-пиперидинил]-1-пропанон; 1-(1-этил-2-метил-1Н-бензимидазол-5-ил)-3-[1(фенилметил)-4-пиперидинил]-1-пропанон; 1-(2-метил-6-бензотиазолил)-3-[1-(фенилметил)4-пиперидинил]-1-пропанон; 1-(2-метил-6-бензотиазолил)-3-[1-((2-метил-4-тиазолил)метил)-4-пиперидинил]-1-пропанон; 1-(5-метилбензо[b]тиен-2-ил)-3-[1-(фенилметил)4-пиперидинил]-1-пропанон; 1-(6-метилбензо[b]тиен-2-ил)-3-[1-(фенилметил)4-пиперидинил]-1-пропанон; 1-(3,5-диметил-бензо[b]тиен-2-ил)-3-[1-(фенилметил)-4-пиперидинил)-1-пропанон; 1-(бензо[b]тиен-2-ил)-3-[1-(фенилметил)-4-пиперидинил]-1-пропанон; 1-(бензофуран-2-ил)-3-[1-(фенилметил)-4-пиперидинил]-1-пропанон; 1-(1-фенилсульфонил-6-метил-индол-2-ил)-3-[1(фенилметил)-4-пиперидинил]-1-пропанон; 1-(6-метил-индол-2-ил)-3-[1-(фенилметил)-4-пиперидинил]-1-пропанон; 1-(1-фенилсульфонил-5-амино-индол-2-ил)-3-[1(фенилметил)-4-пиперидинил]-1-пропанон; 1-(5-амино-индол-2-ил)-3-[1-(фенилметил)-4-пиперидинил]-1-пропанон и 1-(5-ацетиламино-индол-2-ил)-3-[1-(фенилметил)-4-пиперидинил]-1-пропанон. Примеры других соединений изобретения представляют: 1-(6-хинолил)-3-[1-(фенилметил)-4-пиперидинил]-1-пропанон; 1-(5-индолил)-3-[1-(фенилметил)-4-пиперидинил]-1-пропанон; C C C содержащая или группу, O , Z S может быть необязательно присоединена к атому углерода, отмеченному звездочкой, скорее, чем к атому кольца А. Все статьи, книги, патенты и патентные заявки, указанные в следующем ниже обсуждении, приводятся здесь в качестве ссылок. 4 41290 Схема 1 5 41290 Схема 2 6 41290 Схема 3 7 41290 Схема 4 8 41290 Схема 5 Схема 1 иллюстрирует способ получения соединений формулы (I), где Z представляет кисло кой в кольце В (далее оно рассматривается как соединение формулы (1-А)). Исходные соединения, имеющие формулы (II) и (III), являются либо коммерчески доступными, либо получаемыми способами, описанными в литературе (См. J. Med. Chem., 33, 2777 (1990); Tetrahedron Letters, 30, 6117, (1989); Eur. J. Med. C Z род и боковая цепь, содержащая , присоединяется к атому углерода, отмеченному звездоч 9 41290 Chem., 25, 191 (1990); Heteracycles, 29, 849 (1989); J. Orq. Chem., 47, 757 (1982); J. Orq. Chem, 54, 4350 (1989); Tetrahedron, 44, 3195 (1988); Zur. J. Med. Chem. Chim. Ther., 21, 233 (1986); Chem. Ber., 88, 34 (1954); Tetrahedron, 28, 2553 (1972); J. Chem. Soc. (С) 1733 (1968); United States Patent 4909694; J. Heterocyclic Chem, 25, 1271 (1988); Bull. Chem. Soc. Jpn, 58, 785 (1986); J. Ind. Chem. Soc, 12, 561 (1975) и Synthetic Communications 14, 947 (1984)). Относительно схемы 1, соединение формулы (II) взаимодействует с соответствующим соединением формулы (III) в присутствии основания, с образованием соответствующего соединения формулы (IV). Эту реакцию обычно проводят в соответствующем инертном растворителе при температуре от около -78°С до около 0°С. Соответствующие растворители включают тетрагидрофуран (ТГФ), простой эфир, толуол, метиленхлорид, бензол и диоксан. Соответствующие основания включают литий(бис)триметилсилил/амид, литийдиизопропиламид, натрийдиизопропиламид, натрийбис(триметилсилил)амид, н-бутиллитий, (н-BuLi), с-бутиллитий (S-BuLi) и т-бутиллитий (т-BuLi). Соединение формулы (IV), полученное в предыдущей стадии, затем превращают в соответствующее соединение формулы (I-А) взаимодействием его с окисляющим агентом. Примеры окисляющих агентов, которые могут быть использованы, включают двуокись марганца, трехокись хрома и двуокись селена. Двуокись марганца является предпочтительной. Обычно окисление проводят в инертном реакционном растворителе при температуре от около комнатной до около 80°С, предпочтительно, от около 50°С до около 80°С. Примеры соответствующих растворителей представляют метиленхлорид, хлороформ, этилацетат, бензол и толуол. Предпочтительным растворителем является метиленхлорид или бензол. Схема 2 иллюстрирует способ получения соединений формулы (I), где Z представляет кислород и n равно 2, 3 или 4 (далее это относится к соединениям формулы (I-А)), и соединений формулы (I), где n равно 2, 3 или 4 и (CHq)n группа содержит, по крайней мере, одну углерод-углеродную двойную связь (далее это относится к соединениям формулы (I-В)). Относительно cхемы 2, исходные соединения, имеющие формулу (V) и (VI), могут быть коммерчески доступными или получены, как описано в литературе (См.: J. Org. Chem., 54, 4350, (1989); Tetrahedron, 44, 3195 (1988); Chem. Pharm. Bull., 39, 181 (1991); Chem. Ber., 119, 2069 (1986) и J. Ind. Chem. Soc., 12, 561 (1975)). Как показано в схеме 2, соединение формулы (V) взаимодействует с альдегидом формулы (VI) в присутствии основания с образованием соответствующего соединения формулы (VII). Соответствующие основания для этой реакции включают гидрид натрия, литий(бис)триметилсилил/амид, пиперидин, пирролидин, литийдиизопропиламид, натрийдиизопропиламид, н-бутиллитий и s-бутиллитий. Реакцию обычно проводят в инертном реакционном растворителе, таком как ТГФ, диметилформамид (ДМФА), диоксан, толуол, метиленхлорид или эфир, с предпочтительными ТГФ, эфиром или толуолом. Температура реакции может быть в области от около -78°С до около 40°С и является предпочтительной от около -78°С до около 0°С. Если реакцию между соединениями формулы (V) и (VI) проводят в присутствии натрий или калий (С1-С5)алкоксида, то, предпочтительно, используют толуол, ДМФА, ТГФ или метиленхлорид в качестве растворителя, с (С1-С4)спиртом или без него, и реакцию проводят при температуре от около -40°С до 80°С, более предпочтительно, от около 0°С до около комнатной температуры. Подвергая соединение формулы (VII), полученные таким образом, реакции элиминирования, получают соответствующее соединение формулы (I-В). Элиминирование обычно проводят взаимодействием соединения формулы (VII), в присутствии основания, с реагентом, способным образовывать удаляемую группу при взаимодействии с гидрокси группой формулы (VII). Соответствующие реагенты включают уксусный ангидрид, R7SO2Cl, R7COCI, R7OCOCI и R7NCO, где R7 выбран из (C1-С4)алкила или фенила, необязательно замещенного (С1-С6)алкилом, (С1-С4)алкокси или нитро. Примеры соответствующих оснований представляют триэтиламин, диизопропилэтиламин, диазобициклоундекан (ДБУ) и диазабициклононан. Растворитель может быть любым инертным реакционным растворителем (например, метиленхлорид, хлороформ, ТГФ или толуол). Температура реакции может быть в области от около 0°С до около 60°С и, предпочтительно, от около 0°С до около комнатной температуры. Кроме того, соединения формулы (I-В) могут быть получены взаимодействием соответствующего соединения формулы (VII) с солью Burgess Inner. Соль Burgess Inner может быть получена из хлорсульфонилизоцианата, метанола и триэтиламина, как описано в J. Amer. Chem. Soc., 90, 4744 (1968). Вообще, эту реакцию проводят в инертном растворителе, таком как ТГФ, эфир бензол, толуол или диоксан, предпочтительно, ТГФ, при температуре от около комнатной до температуры флегмы растворителя, предпочтительно, от около 50°С до около 80°С. Соответствующее соединение формулы (I-A') затем получают гидрированием соединения формулы (I-В), полученного в вышеуказанной стадии. Вообще гидрирование сопровождается использованием двуокиси платины или палладия на угле при давлении от около 0,2 кг/см2 до около 0,35 кг/см2. Соответствующие инертные реакционные растворители включают ТГФ, метанол, этанол, этилацетат и их смеси. Предпочтительно, растворитель представляет смесь этанола и ТГФ или смесь этанола и этилацетата. Температура реакции может быть в области от около 0°С до около 60°С. Предпочтительно, 10 41290 температура представляет комнатную температуру. Получение соединений, имеющих формулы (I-С) и (I-Д) иллюстрируется в cхеме 3. Соединения формулы (I-С) представляют те соединения формулы (I), где А представляет бензо, Y представляет NR6, R6 представляет водород, Х представляет азот, R3 представляет водород и R2 присоединяется к атому углерода, отмеченному звездочкой (*) в кольце В. Соединения формулы (I-Д) представляют те соединения формулы (I), где А представляет бензо, Y представляет NR6, R6 представляет значение другое, чем водород, Х представляет азот, R3 представляет водород и R2 присоединяется к атому углерода, отмеченному звездочкой (*) в кольце В. Относительно схемы 3, реакцию соединения формулы (IX) с альдегидом формулы (Х) с получением соединения формулы (XI) проводят, используя способ, представленный в схеме 2 и описанный выше для реакции стадий V®VII®I-В®I-А'. Полученное соединение формулы (XII) затем подвергают циклизации в присутствии кислоты с получением соответствующего соединения формулы (I-С). Примеры кислоты, которые могут быть использованы, представляют уксусную кислоту, смесь уксусной кислоты и (С1-С4)спирта, хлористоводородную кислоту и эфир, насыщенный хлористым водородом. Эту реакцию обычно проводят при температуре от около комнатной до около 120°С. Температуры от около 60°С до около 90°С являются предпочтительными. Группа R6 может быть присоединена к соединению формулы (I-С) для получения соответствующего соединения, имеющего формулу (I-Д), взаимодействием соединения формулы (I-С) с соединением формулы R6L, где L представляет удаляемую группу. Эту реакцию обычно проводят в инертном растворителе в присутствии основания при температуре от около -78°С до около температуры флегмы растворителя. Соответствующие основания включают гидрид натрия, литийдиизопропиламид, т-бутиллитий, т-бутоксид калия. Соответствующие растворители включают ТГФ метиленхлорид, бензол, эфир, толуол или диоксан. Реакцию, предпочтительно, проводят в ТГФ в присутствии гидрида натрия при температуре от около 0°С до около 30°С. Схема 4 иллюстрирует получение соединений формулы (I), где Z представляет серу (далее это относится к соединениям формулы (I-F)), из соединений формулы (I-Е). Это превращение сопровождается взаимодействием соединения (I-Е) с реагентом Lawesson (2,4-бис(4-метоксифенил)-1,3-дитиа-2,4-дифосфетан-2,4дисульфид) или пентасульфида фосфора (P2S5). Типично, эту реакцию проводят в инертном реакционном растворителе, таком как ТГФ, ацетонитрил, хлороформ или толуол при температурах от около комнатной температуры до около 120°С. Предпочтительно, реакцию проводят в ТГФ или толуоле при температуре от около 60°С до около 80°С. Соединения формулы (I), где R1 представляет заместитель, другой, чем бензил, могут быть получены из соответствующих соединений формулы (I), где R1 представляет бензил (далее это относится к соединениям формулы (I-G)), как описано ниже и иллюстрируется схемой 5. Сначала, соединение формулы (I-G) взаимоClCOR9 , где действует с хлорформатом формулы O R9 представляет –СІСНСН3, –СН2СН3 или – СН2С6Н5. Предпочтительный реагент представляет 1-хлорэтилхлорформат (эфир хлормуравьиной кислоты). Эту реакцию, которая дает соответствующее соединение формулы (XIV), обычно проводят в инертном реакционном растворителе, таком как метиленхлорид, хлороформ, дихлорэтан, ТГФ или толуол, предпочтительно, толуол, при температуре от около 60°С до около 100°С, предпочтительно, от около 80°С до около 85°С. Нагревание соединения формулы (XIV), полученного таким образом, в (С1-С4)спирте, предпочтительно, метаноле или этаноле, дает соответствующее соединение формулы (XV). Температура реакции может быть в области от около 80°С до около температуры флегмы растворителя и, предпочтительно, около температуры флегмы растворителя. Соединение формулы (XV), полученное в вышеуказанной стадии, затем алкилируют и, таким образом, превращают в соответствующее соединение формулы (I) взаимодействием его с соединением формулы R1L, где L представляет удаляемую группу, в присутствии основания. Примеры соответствующих живущих групп представляют хлор, бром, иод, мезилат, тозилат и трифлат (OTf). Соответствующие основания включают пиридин, триэтиламин, диметиламинопиридин и карбонат калия. Триэтиламин является предпочтительным. Обычно алкилирование проводят в инертном реакционном растворителе, таком как метиленхлорид или ДМФА, при температуре от около 0°С до около 100°С, предпочтительно, от около комнатной температуры до около 60°С. В каждой приведенной выше реакции давление не является критическим. Подходящим является давление в области около 0,5 до 3 атм и нормальное давление (обычно около 1 атмосферы) является предпочтительным для удобства. Для этих реакций, где предпочтительные температуры меняются в зависимости от реагирующих соединений, не установлено предпочтительной температуры. Для таких реакций предпочтительные температуры для данных реагентов могут быть определены наблюдением за реакцией с использованием тонкослойной хроматографии. Соединения изобретения могут быть введены пациенту различными способами, например, орально в виде капсул или таблеток, парентерально в виде стерильных растворов или суспензий и, в некоторых случаях, внутривенно в форме раствора. 11 41290 1 H-ЯМР (СDСІ3): d 1,3-2,1 (м, 7Н), 2,3-2,5 (м, 3Н), 2,7-3,0 (м, 2Н), 3,47 (с, 2Н), 5,37 (д, 1H), 5,65,8 (м, 2Н), 7,0-7,7 (м, 9Н), м. д. Соединения, указанные в названиях примеров 2-4, были получены способом, аналогичным тому, который описан в примере 1. Пример 2 1-(2-(6-метилбензотиенил))-3-[1-(фенилметил)-4-пиперидинил]-2-пропен-1-ол 1 H-ЯМР (СDСІ3): d 1,3-2,0 (м, 7Н), 2,4 (с, 3Н), 2,8-2,95 (м, 2Н), 3,45 (с, 2Н), 5,35 (д, 1H), 5,6-5,8 (м, 2Н), 7,0-7,6 (м, 9Н), м. д. Пример 3 1-(2-(2,5-диметил-бензотиенил))-3-[1-(фенилметил)-4-пиперидинил]-2-пропен-1-ол 1 H-ЯМР (СDСІ3): d 1,35-2,0 (м, 7Н), 2,3 (с, 3Н), 2,5 (с, 3Н), 2,8-2,9 (м, 2Н), 3,5 (с, 2Н), 3,7-3,8 (м, 1H), 5,5-5,9 (м, 3Н), 7,0-7,8 (м, 8Н), м. д. Пример 4 1-(2-бензотиенил)-3-[1-(фенилметил)-4-пиперидинил]-2-пропен-1-ол 1 H-ЯМР (CDCl3): d 1,3-2,0 (м, 7Н), 2,7-2,9 (м, 2Н), 3,45 (с, 2Н), 5,4 (д, 1H), 5,6-5,8 (м, 2Н), 7,1 (с, 1H), 7,2-7,3 (м, 7Н), 7,65 (дд,1H), 7,72 (дд, 1H) м. д. Пример 5 5-метил-бензотиен-2-ил-2-[1-(фенилметил)-4пиперидинил]винил кетон Раствор неочищенного 1-(2-(5-метил-бензотиенил))-3-[1-(фенилметил)-4-пиперидинил]-2-пропен-1-ола (750 мг, 2,16 ммоля) из примера 1, в 30 мл бензола обрабатывают двуокисью марганца (1,8 г, 20,7 ммоля), и полученную суспензию нагревают при кипячении с обратным холодильником в течение 2 часов. Смесь охлаждают до комнатной температуры и фильтруют через целит (Celite®). Фильтрат концентрируют досуха, с получением 602 мг неочищенного коричневого полутвердого продукта. 1 H-ЯМР (CDCI3): d 1,4-1,9 (м, 4Н), 2,0 (дт, 2Н), 2,15-2,3 (м, 1H), 2,4 (с, 3Н), 2,8-3,0 (м, 2Н), 3,5 (с, 2Н), 6,8 (с, 0,4Н), 6,85 (с, 0,6Н), 7,0-7,18 (м, 1H), 7,2-7,9 (м, 9Н), м. д. Указанные в названии примеров 6 и 7 соединения были получены способом, аналогичным способу, описанному в примере 5. Пример 6 2,5-диметил-бензотиен-2-ил-2-[1-(фенилметил)-4-пиперидинил]винил кетон 1 H-ЯМР (СDСІ3): d 1,5-2,0 (м, 4Н), 2,1 (дт, 2Н), 2,2-2,4 (м, 1H), 2,56 (с, 3Н), 2,8 (с, 3Н), 2,9-3,05 (м, 2Н), 3,56 (с, 2Н), 6,72 (с, 0,4Н), 6,8 (с, 0,6Н), 7,06 (д, 0,6Н), 7,1 (д, 4Н), 7,3-7,8 (м, 8Н), м. д. Пример 7 Бензотиен-2-ил-2-[1-(фенилметил)-4-пиперидинил]винил кетон 1 H-ЯМР (CDCI3): d 1,4-1,9 (м, 4Н), 1,95-2,1 (дт, 2Н), 2,2-2,35 (м, 1H), 2,8-3,0 (м, 2Н), 3,54 (с, 2Н), 6,86 (с, 0,4Н), 6,9 (с, 0,6Н), 7,1 (д, 0,6Н), 7,15 (д, 0,4Н), 7,2-8,0 (м, 10Н), м. д. Пример 8 1-(5-метил-бензо[b]тиен-2-ил)-3-[1-(фенилметил)-4-пиперидинил]-1-пропанон Раствор неочищенного 5-метил-бензотиен-2ил-2-[1-(фенилметил)-4-пиперидинил]винилкетона из примера 5 (600 мг, 1,6 ммоля) в смеси этанола (20 мл) и этилацетата (40 мл) обрабатывают оки Соединения изобретения в форме свободного основания могут быть включены в композицию и введены в форме их фармацевтически приемлемых солей присоединения кислот. Дневная доза соединений изобретения обычно находится в области от около 1 до 300 мг/день для взрослого человека и может быть введена одной дозой или несколькими дозами. Для парентерального введения, когда соединения изобретения вводят в форме раствора или суспензии, они обычно присутствуют при концентрации, по крайней мере, 1 вес.% и, предпочтительно, между 4-70 вес.% (на полный вес раствора) (of the unit). Парентеральная доза обычно находится между около 5 до 100 мг активного соединения(ий). Соединения настоящего изобретения могут быть введены орально с инертным разбавителем или съедобным носителем, или они могут быть заключены в желатиновые капсулы или сформованы в таблетки. Такие препараты должны содержать, по крайней мере, 0,5% активного соединения(ий), но концентрация может меняться в зависимости от отдельной формы и может быть от 4 до 70 вес.% (на полный вес препарата). Оральная доза, типично, содержит между 1,0 мг и 300 мг активного соединения. Активность соединений настоящего изобретения в качестве ингибиторов ацетилхолинэстеразы может быть определена рядом стандартных биологических или фармакологических тестов. Одна из таких процедур для определения ингибирования холинэстеразы описана Ellmanet alb "A New and Rapid Colorimetric Determination of Acetylcholinesterase Activity", Biochem. Pharm, 1,88 (1961). Настоящее изобретение иллюстрируется следующими примерами. Понятно, однако, что изобретение не ограничивается конкретными деталями этих примеров. Температуры плавления не поправлены. Спектры протонного магнитного резонанса (1Н-ЯМР) и С13 ядерного магнитного резонанса (С13ЯМР) были измерены для растворов в дейтерохлороформе (CDCI3) и положение пиков выражается в частях на миллион (ppm) с использованием в качестве стандарта тетраметилсилана (TMS). Формы пиков определяются следующим образом: с - синглет; d - дублет; m - триплет; кв. - квартет; м - мультиплет; ш - широкий. Пример 1 1-(2-(5-метил-бензотиенил))-3-[1-(фенилметил)-4-пиперидинил]-2-пропен-1-ол Раствор 5-метил-бензотиофена (356 мг, 2,4 ммоля) в 10 мл сухого тетрагидрофурана (ТГФ) обрабатывают н-бутиллитием (н-BuLi) при -10°С? и смесь перемешивают при комнатной температуре в течение 30 минут. К реакционной смеси добавляют раствор 3-/4/N-бензилпиперидинил/пропеналя (550 мг, 2,4 ммоля) в 5 мл сухого ТГФ при комнатной температуре. После перемешивания в течение 30 минут смесь гасят водой и экстрагируют хлороформом. Органический слой сушат и концентрируют с получением 750 мг (90%) желаемого продукта. 12 41290 Раствор бензофуран-2-ил 2-[1-(фенилметил)4-пиперидинил]винилкетона (410 мг) в смеси этанола (70 мл) и этилацетата (40 мл) обрабатывают оксидом платины (80 мг) и гидрируют при 3,1 кг/см2 в течение 1 часа. Смесь фильтруют через Celite®, и фильтрат концентрируют досуха, получая не белое твердое вещество, которое перекристаллизовывают из этилацетата, получая 162 мг белых кристаллов. Т. пл. 199-200°С 1 Н-ЯМР (СDСІ3): d 1,4-2,2 (м, 7Н), 2,4-2,6 (м, 2Н), 2,97 (т, 2Н), 3,3-3,5 (м, 2Н), 4,01 (ABq, 2H), 7,17,7 (м, 10Н) м. д. Пример 14 1-(2-(N-фенилсульфонил-6-метил-индолил))-3[1-(фенилметил)-4-пиперидинил]-2-пропен-1-ол Раствор N-фенилсульфонил-6-метилиндола (1,18 г, 4,34 ммоля) в 30 мл сухого ТГФ охлаждают до -78°С и обрабатывают 3,5 мл (5,2 ммоля) 1,5 М литийдиизопропиламида в циклогексане при -78°С. После перемешивания при -78°С в течение 1 часа раствор 3-[1-(фенилметил)-4-пиперидинил]-2пропеналя (1,0 г, 4,36 ммоля) в 5 мл сухого ТГФ добавляют при -78°С и перемешивают при этой температуре в течение 40 минут. Смесь гасят водой и экстрагируют хлороформом. Органический слой сушат и концентрируют, получая 2,23 г оранжевого масла. Масло очищают хроматографией на силикагеле, используя в качестве элюента 2% метанола в хлороформе, и получают 1,0 г указанного в названии соединения в виде желтого масла. 1 H-ЯМР (СDСІ3): d 1,4-1,8 (м, 4Н), 1,9-2,1 (м, 3Н), 2,45 (с, 3Н), 2,85-2,95 (м, 2Н) 3,3 (шир. с, 1H), 3,5 (с, 2Н), 5,6-5,9 (м, 3Н), 6,55 (с, 1H), 7,02 (дд, 1H), 7,2-7,9 (м, 12Н) м. д. Пример 15 N-фенилсульфонил-6-метил-индол-2-ил-2-[1(фенилметил)-4-пиперидинил]винилкетон Раствор 1-(2-(N-фенилсульфонил-6-метил-индолил))-3-[1-(фенилметил)-4-пиперидинил]-2-пропен-1-ола (1,2 г, 2,4 ммоля) в 30 мл сухого метиленхлорида обрабатывают двуокисью марганца (MnO2) (1,0 г, 11,5 ммолей). Смесь перемешивают в течение 4 часов при кипячении с обратным холодильником, охлаждают до комнатной температуры и фильтруют через Celite®. Фильтрат концентрируют, получая желтое масло, которое очищают хроматографией на колонке с силикагелем, используя в качестве элюента хлороформ с 2,5% метанола в хлороформе, получая 740 мг (выход 62%) указанного в названии соединения в виде желтого масла. 1 H-ЯМР (CDCl3): d 1,4-1,8 (м, 4Н), 1,9-2,1 (м, 2Н), 2,15-2,3 (м, 1H), 2,5 (с, 3Н), 2,85-3,0 (м, 2Н), 3,5 (с, 2Н), 6,55 (с, 0,45Н), 6,55 (с, 0,55Н), 6,9 (д, 0,55Н), 6,98 (д, 0,45Н), 7,0 (с, 1H), 7,1 (д, 1H), 7,257,55 (м, 9Н), 7,9-8,1 (м, 3Н) м. д. Пример 16 1-(1-фенилсульфонил-6-метил-индол-2-ил)-3[1-(фенилметил)-4-пиперидинил]-1-пропанон Раствор N-фенилсульфонил-6-метил-индол-2ил-2-[1-(фенилметил)-4-пиперидинил]винилкетона (360 мг, 7,2 ммоля) в смеси ТГФ/этанол (25 мл/25 мл) обрабатывают пятиокиcью платины сью платины (PtO2) (60 мг) и гидрируют при давлении 3,5 кг/см2 в течение 2 часов. (Тонкослойная хроматография указывает на то, что реакция не окончена). Добавляют дополнительно 45 мг PtO2, и смесь гидрируют дополнительно 1 час. Смесь фильтруют через Celite®, и фильтрат концентрируют досуха и очищают хроматографией, используя хлороформ с 2% метанола в хлороформе в качестве элюента с получением 232 мг указанного в названии соединения. 1 H-ЯМР (CDCl3): d 1,2-2,1 (м, 9Н), 2,52 (с, 3Н), 2,9-3,0 (м, 2Н), 3,05 (т, 2Н), 3,52 (с, 2Н), 7,2-7,4 (м, 6Н), 7,7 (с, 1H), 7,75 (д, 1H), 7,9 (с, 1Н) м. д. Указанные в названии примеров 9-11 соединения были получены способом, аналогичным тому, который был описан в примере 8. Пример 9 1-(5-метил-бензо[b]тиен-2-ил)-3-[1-(фенилметил)-4-пиперидинил]-1-пропанон 1 H-ЯМР (CDCl3): d 1,2-2,05 (м, 9Н), 2,5 (с, 3Н), 2,7-2,8 (м, 2Н), 3,0 (т, 2Н), 3,5 (с, 2Н), 7,2-7,4 (м, 6Н), 7,65 (с, 1H), 7,8 (д, 1H), 7,9 (с, 1Н) м. д. Пример 10 1-(3,5-диэтил-бензо[b]тиен-2-ил)-3-[1-(фенилметил)-4-пиперидинил]-1-пропанон 1 H-ЯМР (CDCl3): d 1,2-2,0 (м, 9Н), 2,5 (с, 3Н), 2,75 (с, 3Н), 2,8-3,0 (м, 4Н), 3,5 (с, 2Н), 7,2-7,8 (м, 8Н) м. д. Пример 11 1-(бензотиен-2-ил)-3-[1-(фенилметил)-4-пиперидинил]-1-пропанон 1 H-ЯМР (CDCl3): d 1,1-2,0 (м, 9Н), 2,8-2,95 (м, 2Н), 3,05 (т, 2Н), 3,5 (с, 2Н), 7,2-7,5 (7Н), 7,8-7,9 (м, 2Н), 7,95 (с, 1Н) м. д. Пример 12 Бензофуран-2-ил-2-[1-(фенилметил)-4-пиперидинил]винил кетон К раствору диизопропиламина (0,5 мл, 3,6 ммоля) в 15 мл сухого ТГФ добавляют 2,5 М н-бутиллития (1,3 мл, 3,3 ммоля) при -78°С. После перемешивания при -78°С в течение 20 минут добавляют раствор бензофуран-2-ил метилкетона (0,48 г, 3 ммоля) в 3 мл сухого ТГФ при -78°С и перемешивают при этой температуре в течение 1,5 часов. Смесь гасят водой и рассолом и экстрагируют этилацетатом. Органический слой сушат и концентрируют, получая 1,117 г продукта в виде масла. Масло растворяют в 15 мл метиленхлорида и обрабатывают мезилхлоридом (0,24 мл, 3 ммоля) и триэтиламином (0,42 мл, 3 ммоля) при комнатной температуре. Смесь перемешивают при комнатной температуре в течение ночи, затем гасят водой и экстрагируют метиленхлоридом. Органический слой сушат и концентрируют, получая 0,827 г неочищенного продукта, который очищают хроматографией на силикагеле, используя в качестве элюента хлороформ с 5% метанола в хлороформе, получая 430 мг не белых кристаллов. Т. пл. 186-188°С. 1 H-ЯМР (CDCI3): d 1,8-3,0 (м, 7Н), 3,1-3,4 (м, 2Н), 4,0 (шр. с, 2Н), 6,9 (с, 0,4Н), 6,96 (с, 0,6Н), 7,1 (д, 0,6Н), 7,15 (д, 0,4Н), 7,2-7,7 (м, 10Н) м. д. Пример 13 Бензофуран-2-ил-3-[1-(фенилметил)-4-пиперидинил]-1-пропанон 13 41290 (PtO2) (40 мг) и гидрируют при 3,1 кг/см2 в течение 75 минут. Смесь фильтруют через целит (Celite®). Фильтрат концентрируют досуха, получая темное масло, которое очищают хроматографией на силикагеле, используя хлороформ в качестве элюента и получая 200 мг указанного в названии соединения в виде желтого масла. 1 H-ЯМР (CDCI3): d 1,2-1,75 (м, 7Н), 1,8-2,0 (м, 2Н), 2,5 (с, 3Н), 2,8-3,0 (м, 4Н), 3,5 (с, 2Н), 7,0 (с, 1H), 7,1 (д, 1H), 7,2-8,0 (м, 12Н) м. д. Пример 17 1-(6-метил-индол-2-ил)-3-[1-(фенилметил)-4пиперидинил]-1-пропанон Суспензию N-фенилсульфонил-6-метил-индол-2-ил-2-[1-(фенилметил)-4-пиперидинил]этилкетона (150 мг) в 20 мл метанола обрабатывают 1,5 мл раствора 2N гидроокиси натрия (NaOH), нагревают при кипячении с обратным холодильником и перемешивают при этой температуре в течение 70 минут. Смесь гасят водой и экстрагируют хлороформом. Органический слой сушат и концентрируют, получая 100 мг указанного в названии соединения в виде коричневого твердого вещества. 1 H-ЯМР (CDCI3): d 1,2-1,8 (м, 7Н), 1,8-2,0 (м, 2Н), 2,42 (с, 3Н), 2,8-3,0 (м, 4Н), 3,5 (с, 2Н), 6,95 (д, 1H), 7,1 (с, 1H), 7,2-7,35 (м, 6Н), 7,55 (д, 1H) м. д. Пример 18 1-(2-бензотиазолил)-3-[1-(фенилметил)-4-пиперидинил]-2-пропен-1-ол Раствор бензотиазола (0,243 г, 1,8 ммоля) в 5 мл сухого ТГФ обрабатывают 1,5 М литийдиизопропиламида в циклогексане (1,45 мл) при -78°С и перемешивают при этой температуре в течение 15 минут. Раствор 3-[1-(фенилметил)-4-пиперидинил]пропеналя (452 мг, 1,97 ммоля) в 3 мл сухого ТГФ добавляют при -78°С и перемешивают при этой температуре в течение 30 минут. Смесь гасят водой и экстрагируют хлороформом. Органический слой сушат и концентрируют, получая желтое вязкое масло с количественным выходом. 1 H-ЯМР (CDCI3): d 1,6-2,15 (м, 7Н), 2,85-3,0 (м, 2Н), 3,5 (с, 2Н), 5,5 (д, 1H), 5,7-6,1 (м, 2Н), 7,2-7,6 (м, 7Н), 7,9 (д, 1H), 8,0 (д, 1H) м. д. Пример 19 2-бензотиазолил-2-[1-(фенилметил)-4-пиперидинил]-винилкетон Раствор 1-(2-бензотиазолил)-3-[1-(фенилметил)-4-пиперидинил]-2-пропен-1-ола (654 мг, 1,8 ммоля) в 25 мл метиленхлорида обрабатывают MnO2 (0,782 г, 9 ммолей) и нагревают при кипячении с обратным холодильником. Через 3 часа смесь фильтруют через Celite®, и фильтрат концентрируют, получая 0,655 мг темного масла. Масло очищают хроматографически на силикагеле, используя в качестве элюента 2% метанола в хлороформе, получая 0,487 г янтарного масла, которое становится твердым при стоянии в течение ночи. 1 H-ЯМР (CDCI3): d 1,5-1,9 (м, 4Н), 2,0-2,15 (м, 2Н), 2,3-2,5 (м, 1H), 3,5 (с, 2Н), 7,2-7,6 (м, 9Н), 8,0 (дд, 1Н), 8,2 (дд, 1Н) м. д. Пример 20 1-(бензотиазол-2-ил)-3-[1-(фенилметил)-4-пиперидинил]-1-пропанон Раствор 2-бензотиазолил-2-[1-(фенилметил)4-пиперидинил]виниликетона (146 мг, 0,4 ммоля) в смеси этилацетат/этанол (10 мл/10 мл) обрабатывают PtO2 (20 мг), и гидрируют при 3,5 кг/см2 в течение 3 часов. Смесь фильтруют через Celite®, и фильтрат концентрируют досуха, получая 0,154 г темного масла. Масло очищают хроматографией на колонке с силикагелем, используя в качестве элюeнта хлороформ и получают 37 мг указанного в названии соединения в виде коричневого масла. 1 H-ЯМР (CDCI3): d 1,2-1,4 (м, 3Н), 1,7-1,85 (м, 4Н), 1,85-2,1 (м, 2Н), 2,8-3,0 (м, 2Н), 3,3 (дд, 2Н), 3,5 (с, 2Н), 7,2-7,4 (м, 5Н), 7,45-7,65 (м, 2Н), 7,95 (дд, 1H), 8,2 (д, 1H) м. д. Пример 21 N-фенилсульфонил-5-нитроиндол Раствор 5-нитроиндола (1,62 г, 10 ммолей) в 30 мл диметилформамида (ДМФА) обрабатывают 60% гидридом натрия (0,44 г, 11 ммолей) при комнатной температуре. Через 3 минуты добавляют бензолсульфонилхлорид (1,766 г, 10 ммолей). Смесь перемешивают при комнатной температуре в течение ночи и обрабатывают 250 мл воды. Полученный осадок фильтруют, получая желтое твердое вещество, которое откачивают в вакууме, получая 2,7 г (89%) указанного в названии соединения. 1 H-ЯМР (CDCI3): d 6,82 (д, 1H), 7,45-7,55 (м, 2Н), 7,6 (д, 1H), 7,72 (д, 1H), 7,9 (м, 2Н), 8,1 (д, 1H), 8,2 (дд, 1H), 8,5 (д, 1H) м. д. Пример 22 N-фенилсульфонил-5-нитроиндол-2-ил-2-[1(фенилметил)-4-пиперидинил]винилкетон Раствор N-фенилсульфонил-5-нитроиндола (646 мг, 2,14 ммоля) в 10 мл сухого ТГФ обрабатывают литийдиизопропиламидом 1,5 М в циклогексане (1,7 мл, 2,6 ммоля) при -78°. Через 1 час добавляют раствор 3-(4-(Nфенилметилпиперидинил))пропеналя (490 мг, 2,14 ммоля) в 2 мл сухого ТГФ при -78°С. Через 40 минут реакции при -78°С смесь гасят водой и экстрагируют метиленхлоридом. Органический слой сушат и концентрируют, получая 1,149 г желтого масла. Масло растворяют в 30 мл бензола, обрабатывают МnO2 (1,86 г, 21,4 ммоля) и нагревают при кипячении с обратным холодильником в течение 4 часов. Добавляют дополнительно 900 мг МnO2, и смесь нагревают при кипячении с обратным холодильником в течение ночи. Смесь фильтруют через Celite®, и фильтрат концентрируют, получая коричневое масло, которое очищают хроматографией на колонке с силикагелем, используя в качестве элюeнта хлороформ, получая указанное в названии соединение в виде коричневого масла. 1 H-ЯМР (CDCI3): d 1,45-1,95 (м, 4Н), 1,95-2,1 (м, 2Н), 2,15-2,4 (м, 1H), 2,9-3,05 (м, 2Н), 3,55 (с, 2Н), 6,55 (с, 0,5Н), 6,62 (с, 0,5Н), 6,98 (д, 0,5Н), 7,05 (д, 1H), 7,1 (с, 1H), 7,2-7,4 (м, 4Н), 7,5-7,7 (м, 4Н), 8,05-8,15 (м, 2Н), 8,2-8,4 (м, 2Н), 8,5 (д, 1H) м. д. Пример 23 N-фенилсульфонил-5-нитроиндол-2-ил-2-[1(фенилметил)-4-пиперидинил]этилкетон 14 41290 Остаток суспендируют в 50 мл 1:1 смеси этилацетат:вода и доводят рН до 8,5 раствором 1N гидроокиси натрия (NaOH). Слой этилацетатный сушат (Na2SO4) и выпаривают, получая 0,1 г (72%) свободного основания указанного в названии соединения в виде масла. TLC (10:1 СНСl3:СН3ОН), Rf=0,64. 1 H-ЯМР (CDCl3): d 8,26 (с, 1), 7,92 (д, 1H), 7,28 (м, 6Н), 4,18 (кв, 2Н), 3,48 (с, 2Н), 3,05 (м, 2Н), 2,85 (м, 2Н), 2,54 (с, 3Н), 1,4-2,0 (м, 9Н), 1,30 (т, 3Н). Масло растворяют в этилацетате, и к этому раствору по каплям добавляют раствор НСl, растворенный в эфире. Полученный осадок фильтруют и растирают с гексаном, получая 0,105 г указанного в названии соединения в виде гигроскопичного белого твердого вещества. Т. пл. 165-167°С. Масс спектр: 389,2 (р), 298,0 (р-91), 172,0 (р217), 90,9 (р-298, основной пик). Пример 27 1-(2-метил-6-бензотиазолил)-3-[1-(фенилметил)-4-пиперидинил]-2-пропен-1-он Смесь 0,191 г (0,001 М) 2-метил-6-бензотиазолил метилкетона. (полученного как описано S.S. Sawhney, J. Singh and Bansal, J. Jnd. Chem. Soc. 12, 561 (1975)) и 0,203 г (0,001 М) 4-фopмилN-бeнзилпипepидинa в 5 мл ТГФ охлаждают до -78°С в атмосфере азота. К этому раствору по каплям добавляют 0,73 мл (0,001 М) литийдиизопропиламида (1,5 М раствор в ТГФ). Реакционную смесь перемешивают при -78°С в течение 1 часа и затем нагревают до 0°С. Реакционную смесь гасят 5 мл воды и экстрагируют этилацетатом. Экстракты этилацетата сушат (Na2SO4) и выпаривают, получая 0,4 г коричневой смолы. Этот остаток хроматографируют на 30 г силикагеля, используя 98:2 смесь СН2СІ2:СН3ОН в качестве элюeнта. Соответствующие фракции объединяют, получая 0,122 г (32%) указанного в названии соединения в виде аморфного твердого вещества. TLC (10:1 СН2СІ2:СН3ОН), Rf=0,63. 1 H-ЯМР (CDCI3): d 8,42 (с, 1H), 7,9 (м, 2Н), 7,35-7,5 (м, 5Н), 6,8-7,1 (м, 2Н), 3,52 (с, 2Н), 2,95 (м, 2Н), 2,8 (с, 3Н), 1,4-2,5 (м, 7Н). Масс спектр: 376.1600. Вычислено для С23Н24N2OS: ±2,6 м. д. Пример 28 1-(2-метил-6-бензотиазолил)-3-[1-(фенилметил)-4-пиперидинил]-1-пропанон гидрохлорид Раствор 0,120 г (0,319 мМ) свободного основания, указанного в названии соединения из примера 27, растворяют в 50 мл этанола. К этому раствору добавляют 50 мг PtO2, и смесь гидрируют при 3,5 кг/см2 в течение 1 часа. Реакционную смесь фильтруют, и этанол выпаривают, получая 0,112 г (100%) указанного в названии соединения (свободное основание) в виде аморфного твердого вещества. TLC (10:1 СН2СІ2:СН3ОН), Rf=0,5. 1 H-ЯМР (CDCI3): d 8,45 (с, 1H), 8,02 (дд, 2Н), 7,25 (м, 5Н), 3,5 (с, 2Н), 3,02 (м, 2Н), 2,85 (м, 2Н), 2,83 (с, 3Н), 1,4-2,0 (м, 9Н). Масс спектр: 378 (р), 287 (р-91), 172 (р-206), 91 (р-287, основной пик). Раствор N-фенилсульфонил-5-нитроиндол-2ил-2[1-(фенилметил)-4-пиперидинил]винилкетон (187 мг, 0,35 ммоля) в смеси этилацетат/этанол (20 мл/8 мл) обрабатывают PtO2 (50 мг) и гидрируют при 2,8 кг/см2 в течение 1,5 часов. Смесь фильтруют через Celite®, и фильтрат концентрируют, получая 177 мг (100%) коричневого масла. 1 H-ЯМР (CDCI3): 1,1-2,0 (м, 9Н), 2,75-2,9 (м, 2Н), 2,92 (т, 2Н), 3,42 (с, 2Н), 6,68 (д, 1H), 6,72 (дд, 1H), 6,8 (с, 1H), 7,1-7,5 (м, 8Н), 7,7-7,9 (м, 3Н) м. д. Пример 24 5-нитроиндол-2-ил 2-[1-(фенилметил)-4-пиперидинил]этилкетон Раствор N-фенилсульфонил-5-нитроиндол-2ил-2-[1-(фенилметил)-4-пиперидинил]этилкетона (160 мг, 0,32 ммоля) в 3 мл метанола и 2 мл 2N NaOH нагревают при кипячении с обратным холодильником в течение 2 часов. Смесь концентрируют досуха, и остаток разбавляют рассолом и экстрагируют хлороформом. Органический слой сушат и концентрируют досуха, получая 144 мг коричневого твердого вещества, которое очищают хроматографически на колонке с силикагелем, получая 31 мг указанного в названии соединения в виде твердого коричневого продукта. 1 H-ЯМР (CDCl3): d 1,1-2,0 (м, 9Н), 2,8-3,0 (м, 4Н), 3,5 (с, 2Н), 6,76 (дд, 1H), 6,9 (с, 1H), 6,96 (с, 1H), 7,1-7,3 (м, 6Н) м. д. Пример 25 1-/1-этил-2-метил-1Н-бензимидазол/-5-ил/-3//1-(фенилметил)-4-пиперидинил/-2-пропен-1-он Смесь 0,1 г (0,5 мМ) 1-этил-2-метилбензимидазол-5-ил метилкетона и 0,1 г (0,5 мМ) 4-формилN-бензилпиперидина в 10 мл тетрагидрофурана (ТГФ) охлаждают до -78°С в атмосфере азота. К этой смеси по каплям добавляют 0,5 мл (0,5 мМ) 1M раствора литий бис/триметилсилил//амида в ТГФ. Реакционную смесь перемешивают при -78°С в течение 1 часа, затем нагревают до комнатной температуры. К реакционной смеси добавляют 10 мл воды и доводят рН до 2,0 1N соляной кислоты (НСl). Смесь экстрагируют 15 мл этилацетата. Затем рН водного слоя последовательно доводят до 3,0, 4,0, 5,0, 6,5 1N раствором NaOH, каждый раз экстрагируя 10 мл этилацетата. Этилацетатные экстракты при рН=5,0 и 6,5 объединяют, сушат над сульфатом натрия (Na2SO4) и выпаривают, получая 50 мг (26%) указанного в названии соединения в виде масла. Проводят тонкослойную хроматографию продукта (10:1 СНСl3:СН3ОН), Rf=0,58. 1 H-ЯМР (СDСl3): d 8,22 (с, 1Н), 7,88 (д, 1H), 7,30 (м, 5Н), 6,90 (м, 3Н), 4,14 (кв, 2Н), 3,50 (с, 2Н), 3,05 (м, 2Н), 2,85 (м, 2Н), 2,61 (с, 3Н), 1,4-2,1 (м, 5Н), 1,40 (т, 3Н) м. д. Пример 26 1-(1-этил-2-метил-1Н-бензимидазол-5-ил)-3-[1(фенилметил)-4-пиперидинил]-1-пропанон гидрохлорид К раствору указанного в названии соединения из примера 25 0,14 г (0,36 мМ) в 20 мл этанола добавляют 10 мг PtO2, и смесь гидрируют при 3,5 кг/см2 в течение 1 часа. Реакционную смесь фильтруют, и этанол выпаривают. 15 41290 1 H-ЯМР (СDСІ3): d 9,12 (д, 1H), 8,84 (с, 1Н), 8,25 (д, 1Н), 7,96 (д, 2Н), 7,6 (м, 3Н), 2,66 (с, 3Н). Пример 33 3-[1-(1-фенилметил)-4-пиперидинил]-1-(3-нитро-4-ацетамидофенил)2-пропен-1-он Раствор 2,6 г (11,7 мМ) N-ацетил-3-нитро-4аминоацетофенона в 25 мл ТГФ охлаждают до -60°С в атмосфере азота. К раствору добавляют 4,7 мл (11,7 мМ) N-бутиллития (2,5 М в гексане), поддерживая температуру ниже -60°С. Реакционную смесь перемешивают в течение 15 минут. Добавляют по каплям раствор 4-формил-N-бензилпиперидина, в 5 мл ТГФ, поддерживая температуру реакции ниже -55°С. Реакционную смесь перемешивают в течение 1 часа и затем нагревают до комнатной температуры. При комнатной температуре реакционную смесь гасят 10 мл воды и экстрагируют этилацетатом. Этилацетатные экстракты объединяют, сушат над (Na2SO4) и выпаривают, получая темное масло. Это масло хроматографируют на силикагеле, используя 5:1 СНСl3:ЕtOАс в качестве элюента. Соответствующие фракции объединяют, получая 1,2 г (25%) указанного в названии соединения в виде масла, которое медленно кристаллизуется. TLC (10:1 СНСl3:СН3ОН), Rf=0,45. 1 H-ЯМР (CDCI3): d 8,90 (д, 1H), 8,76 (с, 1H), 8,14 (д, 1H), 8,30 (м, 5Н), 3,53 (с, 2Н), 2,94 (м, 2Н), 2,32 (с, 3Н), 1,5-2,15 (м, 5Н). Пример 34 3-[1-(-фенилметил)-4-пиперидинил]-1-(3-нитро-4-бензоил-амидофенил)-2-пропен-1-он Раствор 0,80 г (2,90 мМ) указанного в названии соединения примера 32 в 30 мл безводного ТГФ охлаждают до -70°С в атмосфере азота. К раствору по каплям добавляют 1,2 мл (2,9 мМ) N-бутиллития (2,5 М раствор в гексане), получая темный раствор. Раствор перемешивают при -70°С в течение 10 минут. К этой смеси по каплям добавляют раствор 0,6 г (2,9 мМ) 4-формил-N-бензилпиперидина в 10 мл ТГФ. Реакционной смеси позволяют медленно нагреться до комнатной температуры и перемешивают в течение 18 часов. Реакционную смесь гасят 25 мл воды и экстрагируют этилацетатом. Этилацетатные экстракты сушат над (Na2SO4) и выпаривают. Остаток хроматографируют на силикагеле, используя 1:1 СНСl3:ЕtOАс в качестве элюeнта. Соответствующие фракции объединяют, получая 0,45 г (34%) указанного в названии соединения в виде аморфного твердого вещества. TLC (10:1 СНСl3:СН3ОН), Rf=0,67. 1 H-ЯМР (CDCI3): d 9,14 (д, 1H), 8,82 (c, 1H), 8,22 (д, 1H), 7,98 (д, 2Н), 7,55 (м, 3Н), 7,32 (м, 5Н), 7,10 (м, 1H), 6,85 (м, 1Н), 3,54 (с, 1H), 2,95 (м, 2Н), 1,4-2,3 (м, 7Н). Пример 35 1-(3-амино-4-ацетамидофенил)-3-[1-(фенилметил)-4-пиперидинил]-1-пропанон К раствору 0,9 г (2,2 мМ) указанного в названии соединения из примера 33 в 50 мл этанола добавляют 20 мг PtO2, смесь гидрируют при 3,5 кг/см2 в течение 1 часа. Смесь фильтруют, и этанол выпаривают, получая 0,9 г (100%) указанного в названии соединения в виде масла. Этот остаток растворяют в этилацетате, к которому добавляют НСl, растворенную в этилацетате (EtOAc). Полученный осадок фильтруют и сушат в вакууме с выходом 92 (70%) мг указанного в названии соединения. Т. пл.=110-112°С. Пример 29 N-ацетил-4-аминоацетофенон Смесь 5 г (0,37 М) 4-аминоацетофенона, 3,8 мл (0,04 М) уксусного ангидрида и 5,5 (0,04 М) триэтиламина растворяют в 50 мл метиленхлорида (CH2Cl2) и перемешивают при комнатной температуре в течение 18 часов. Белый твердый осадок из раствора собирают фильтрованием. Твердое вещество промывают водой и сушат на воздухе с выходом 3,32 г (49%) N-ацетил-4-аминоацетофенона. TLC (1:1 СН2Сl3:ЕtOАс), Rf=0,61. 1 Н-ЯМР (СDСl3): d 8,58 (шир. с, 1H), 7,90 (д, 2Н), 7,64 (д, 2Н), 2,56 (с, 3Н), 2,19 (с, 3Н). Пример 30 N-бензоил-4-аминоацетофенон Смесь 5,0 г (0,37 М) 4-аминоацетофенона, 4,7 мл (0,04 М) бензоилхлорида и 5,5 мл (0,04 М) триэтиламина растворяют в 50 мл метиленхлорида (CH2Cl2) и перемешивают при комнатной температуре в течение 18 часов. Полученный осадок фильтруют и промывают водой. Остаток растворяют в хлороформе (СНСІ3) и сушат над Na2SO4. Выпаривают СНСІ3, получая 4,2 г (47%) N-бензоил-4-аминоацетофенона. Т. пл.=206-208°С. 1 H-ЯМР (СDСl3+ДМСО): d 9,58 (шир. с, 1H), 7,80 (м, 6Н), 7,34 (м, 3Н), 2,44 (с, 3Н). Пример 31 N-ацетил-2-нитро-4-аминоацетофенон К 10 мл дымящей азотной кислоты, охлажденной до 0°С добавляют порциями 1,0 г (5,6 мМ) Nацетил-4-аминоацетофенона. Температуру поддерживают ниже 5°С для предотвращения избытка нитрования бензольного кольца. Раствор перемешивают в течение 15 минут при 0°С и затем осторожно выливают в лед. Осаждается желтое твердое вещество, и его собирают фильтрованием, получая 0,42 г (34%) указанного в названии соединения. TLC (2:1 СНСl3:ЕtOАс), Rf=0,78. 1 H-ЯМР (CDCI3): d 8,9 (д, 1H), 8,77 (с, 1H), 8,16 (с, 1H), 2,64 (с, 3Н), 2,34 (с, 3Н). Пример 32 N-бензоил-3-нитро-4-аминоацетофенон К 10 мл дымящей азотной кислоты, охлажденной до -5°С добавляют порциями 2,5 г (0,01 М) Nбензоил-4-аминоацетофенона. Температуру поддерживают ниже 0°С. Реакционную смесь перемешивают в течение 10 минут и полученный раствор выливают в лед. Получают осадок желтого твердого вещества, который собирают фильтрованием. Твердое вещество растворяют в СНСІ3 и хроматографируют на силикагеле, используя СНСІ3 в качестве элюента. Соответствующие фракции объединяют и выпаривают, получая 1,0 г (35%) указанного в названии соединения в виде желтого твердого вещества. 16 41290 1 H-ЯМР (CDCl3): d 7,6 (с, 1H), 7,2-7,5 (м, 7Н), 3,5 (с, 2Н), 2,85 (м, 4Н), 2,21 (с, 3Н), 1,2-2,0 (м, 9Н). Массспектр: 379,2 (р), 202,3 (р-176,9), 172,3 (р-206,9), 91,0 (-288,3, основной пик). Пример 36 1-(2-метил-1Н-бензимидазол-5-ил)-3-[1-(фенилметил)-4-пиперлидинил]-1-пропанол гидрохлорид Раствор 0,6 г (1,6 мМ) свободного основания указанного в названии соединения примера 35 в 10 мл уксусной кислоты нагревают на паровой бане (80-90°С) в течение 1 часа. Уксусную кислоту выпаривают, и остаток растворяют в 25 мл этилацетата. К этому раствору добавляют 25 мл воды и доводят рН до 3,0. Отделяют слой этилацетата от водного слоя, и затем водный слой последовательно доводят до рН=5,0, 6,0 и 9,0, каждый раз экстрагируя этилацетатом. Этилацетатный экстракт с рН=9,0 сушат над (Na2SO4) и выпаривают, получая 0,4 г (69%) свободного основания указанного в названии соединения (свободное основание). 1 H-ЯМР (CDCI3): d 8,08 (с, 1H), 7,80 (с, 1H), 7,47 (м, 1H), 7,25 (м, 6Н), 3,47 (с, 2Н), 2,8-3,0 (м, 4Н), 2,59 (с, 3Н), 1,90 (м, 2Н), 1,64 (м, 4Н), 1,25 (м, 3Н). TLC (10:1:0,1 СНСl3:СН3ОН:NН4OН), Rf (свободное основание)=0,50. Твердое аморфное вещество растворяют в этилацетате и к нему добавляют раствор хлористого водорода в эфире (НСl). Полученный осадок фильтруют и сушат, получая 0,26 г (62%) указанного в названии соединения в виде твердого рыжевато-коричневого продукта. Масс спектр: 361,3 (р), 270,2 (р-91,1), 172,3 (р-189), 91,1 (0-270,2, основной пик). Пример 37 1-(3-амино-4-бензоиламидофенил)-3-[1-(фенилметил)-4-пиперидинил]-1-пропанон К раствору 0,45 г (1,0 мМ) соединения указанного в названии примера 34 в 50 мл этанола добавляют 25 мг РtO2 и смесь гидрируют при 3,5 кг/см2 в течение 1 часа. После фильтрования для удаления катализатора выпаривают этанол, получая указанное в названии соединение в виде аморфного твердого вещества. 1 H-ЯМР (CDCI3): d 8,15 (с, 1H), 7,90 (д, 2Н), 7,2-7,7 (м, 10Н), 3,88 (шир. с, 2Н), 3,50 (с, 2Н), 2,90 (м, 4Н), 1,2-2,0 (м, 9Н). Это вещество используют для получения соединения примера 38 без дальнейшей очистки. Пример 38 1-(2-фенил-1H-бензимидазол-5-ил)-3-[/1-(фенилметил)-4-пиперидинил]-1-пропанон гидрохлорид Соединение, указанное в названии, примера 37, растворяют в 50:50 смеси этанола и уксусной кислоты и нагревают при 75°С в течение 3 часов. Реакционную смесь охлаждают до комнатной температуры и разбавляют водой. рН смеси доводят до 9,5, и смесь экстрагируют этилацетатом. Этилацетатные экстракты сушат над (Na2SO4) и выпаривают, получая 0,19 г (45%) свободного основания указанного в названии соединения. TLC (10:1:0,1 CHCl3:CH3OH:NH4OH), Rf=0,40. H-ЯМР (CDCI3): d 8,14 (д, 2Н), 7,86 (д, 1H), 7,2-7,6 (м, 11Н), 3,58 (с, 2Н), 2,92 (м, 4Н), 1,2-2,1 (м, 9Н). Остаток растворяют в этилацетате и к этому раствору по каплям добавляют эфирный раствор НСl. Полученный осадок собирают фильтрованием и сушат, получая указанное в названии соединение в виде рыжевато-коричневого твердого продукта. Т. пл. >300°С. Масс спектр: 424,2 (р+1). Пример 39 1-(2-метил-6-бензтиазолил)-3-(4-пиперидинил)-1-пропанон Смесь 0,90 г (2,38 мМ) 1-(2-метил-6-бензтиазолил)-3-(1-(фенилметил)-1-пропанона (пример 27) и 0,33 мл (3,1 мМ) 1-хлорэтилхлорформата в 10 мл 1,2-дихлорэтана кипятят с обратным холодильником в течение 2 часов. Полученный коричневый раствор охлаждают до комнатной температуры и разбавляют 15 мл воды. Эту смесь экстрагируют дважды 20 мл этилацетата. Этилацетатные экстракты объединяют, сушат над (Na2SO4) и выпаривают, получая 1,0 г (100%) 1-(2-метил-6-бензотиазолил)-3-[(1-хлорэтилформил)-4-пиперидинил]-1-пропанона в виде масла. TLC (10:1 СН2СІ2:СН3ОН), Rf=0,86. 1 H-ЯМР (CDCI3): d 8,4 (с, 1H), 7,9 (м, 2Н), 6,55 (кв, 1H), 2,65-3,2 (м, 4Н), 2,77 (с, 3Н), 1,83 (д, 3Н), 1,4-1,95 (м, 9Н). 13 С-ЯМР (CDCI3, м. д.) 198,1, 171,3, 155,8, 137,4, 135,8, 133,4, 125,9, 122,1, 83,3, 44,2, (2), 35,7, 35,3, 32,0, 30,4, (2), 25,4, 20,3. Метанольный раствор (5 мл) 0,9 г (2,28 мМ) вышеуказанного масла кипятят с обратным холодильником в течение 1 часа. При охлаждении образуется желтый осадок. Этот осадок растворяют в 4 N НСl и раствор экстрагируют эфиром. Раствор НСl доводят до рН 9 карбонатом натрия (Nа2СО3) и экстрагируют этилацетатом. Этилацетатные экстракты сушат над (Na2SO4) и выпаривают, получая 0,250 г (38%) указанного в названии соединения в виде аморфного твердого желтого вещества. TLC (10:1 СН2СІ2:СН3ОН), Rf=0,01. 1 H-ЯМР (CDCl3): d 8,5 (с, 1H), 7,95 (м, 2Н), 3,2 (м, 2Н), 2,85 (с, 1H), 2,6 (м, 2Н), 1,1-1,8 (м, 9Н). 13 С-ЯМР (CDCI3, м. д.) 198,1, 156,3, 136,0, (2), 132,0, 125,9, 122,3, 122,1, 46,4, (2), 35,8, 35,7, 33,0, 31,4, (2), 20,5. Пример 40 1-(2-метил-6-бензиазолил)-3-[1-(2-метил-4-тиазолил)метил)-4-пиперидинил]-1-пропанон гидрохлорид Смесь 250 мг (0,87 мМ) соединения указанного в названии примера 39, 0,160 мг (0,87 мМ) 2метил-4-хлорметилтиазола и 0,36 мл (2,60 мМ) триэтиламина кипятят с обратным холодильником в 5 мл метиленхлорида в течение 12 часов. Реакционную смесь охлаждают до комнатной температуры и разбавляют 10 мл воды. Смесь экстрагируют этилацетатом, и этилацетатные экстракты объединяют и сушат (Na2SO4), и выпаривают, получая 0,27 г желтого смолообразного продукта. 1 17 41290 Это вещество хроматографируют на 10 силикагеля, используя 98:2 СНСІ3:СН3ОН в качестве элюeнта. Соответствующие фракции объединяют и выпаривают, получая 100 мг (29%) указанного в названии соединения в виде желтого аморфного вещества. TLC (10:1 СН2СІ2:СН3ОН), Rf=0,21. 1 H-ЯМР (СDСІ3): d 8,50 (с, 1Н), 7,9 (м, 2Н), 6,87 (с, 1Н), 3,62 (с, 2Н), 3,0 (м, 4Н), 2,87 (с, 3Н), 2,69 (с, 3Н), 2,0 (т, 2Н), 1,7 (м, 4Н), 1,35 (м, 3Н). Масс спектр: 399,2 (р), 287,2 (р-112, основной пик), 223,1 (р-176,1), 193,1 (р-206,1), 176,0 (р-223), 112,0 (р-287), 71,0 (р-328). Это вещество растворяют в этилацетате и к нему добавляют эфирный раствор газообразного НСl. Полученный осадок фильтруют и перекристаллизовывают из СН2СІ2/эфир, получая 92 мг указанного в названии соединения. Т. пл.=184-186°С. Пример 41 1-(5-амино-индол-2-ил)-3-[1-(фенилметил)-4пиперидинил]-1-пропанон Раствор 1-(1-фенилсульфонил-5-амино-индол-2-ил)-3-(N-фенилметилпиперидин-4-ил)-1-пропанона (160 мг, 0,32 ммоля) в 3 мл метанола и 2 мл 2N раствора NaOH нагревают при кипячении с обратным холодильником в течение 2 часов. Смесь концентрируют досуха, и остаток разбавляют рассолом и экстрагируют хлороформом. Органический слой сушат и концентрируют досуха, получая 144 мг коричневого твердого продукта, который очищают хроматографией на колонке с силикагелем, получая 31 мг указанного в названии соединения в виде коричневого твердого продукта. 1 H-ЯМР (СDСІ3): d 1,1-2,0 (м, 9Н), 2,8-3,0 (м, 4Н), 3,5 (с, 2Н), 6,76 (дд, 1H), 6,9 (с, 1H), 6,96 (с, 1H), 7,1-7,3 (м, 6Н) м. д. Пример 42 1-(5-N-ацетиламино-индол-2-ил)-3-(фенилметил)-4-пиперидинил/-1-пропанон Раствор 1-(5-амино-индол-2-ил)-3-[1-(фенилметил)-4-пиперидинил]-1-пропанона (18 мг, 0,05 ммоля) в 0,5 мл метиленхлорида обрабатывают раствором триэтиламина (6 мг, 0,06 ммоля) в 0,5 мл метиленхлорида и раствором ацетилхлорида (4,7 мг, 0,06 ммоля) в 0,5 мл метиленхлорида при комнатной температуре, и смесь перемешивают при комнатной температуре в течение 4 часов. Смесь гасят водой и экстрагируют метиленхлоридом. Органический слой сушат и концентрируют получая 11 мг указанного в названии соединения. 1 H-ЯМР (CDCI3): d 1,2-2,1 (м, 9Н), 2,2 (с, 3Н), 2,8-3,0 (м, 4Н), 3,5 (с, 2Н), 7,07-7,65 (м, 9Н), 8,0 (с, 1H), 9,35 (с, 1H) м. д. __________________________________________________________ ДП "Український інститут промислової власності" (Укрпатент) Україна, 01133, Київ-133, бульв. Лесі Українки, 26 (044) 295-81-42, 295-61-97 __________________________________________________________ Підписано до друку ________ 2002 р. Формат 60х84 1/8. Обсяг ______ обл.-вид. арк. Тираж 50 прим. Зам._______ ____________________________________________________________ УкрІНТЕІ, 03680, Київ-39 МСП, вул. Горького, 180. (044) 268-25-22 ___________________________________________________________ 18
ДивитисяДодаткова інформація
Назва патенту англійськоюHeteroarylamines, a pharmaceutical composition, a method for inhibition of choline esterase by mammals, a method for the improvement of memory
Автори англійськоюCHEN YUHPYNG L, MAGEL ARTHUR A
Назва патенту російськоюГетероариламины, фармацевтическая композиция, способ ингибирования холинэстеразы у млекопитающих, способ улучшения памяти
Автори російськоюЧЕН Юпинг Л., НЕЙДЖЕЛ Артур А.
МПК / Мітки
МПК: A61P 25/02, A61P 21/00, C07D 417/06, C07D 405/06, C07D 235/08, A61K 31/415, A61K 31/443, C07D 417/14, C07D 401/06, C07D 409/06, A61K 31/4433, A61K 31/4184, A61K 31/454, A61K 31/445, A61K 31/4427
Мітки: гетероариламіни, спосіб, покращення, інгібування, ссавців, композиція, фармацевтична, пам'яті, холінестерази
Код посилання
<a href="https://ua.patents.su/18-41290-geteroarilamini-farmacevtichna-kompoziciya-sposib-ingibuvannya-kholinesterazi-u-ssavciv-sposib-pokrashhennya-pamyati.html" target="_blank" rel="follow" title="База патентів України">Гетероариламіни, фармацевтична композиція, спосіб інгібування холінестерази у ссавців, спосіб покращення пам’яті</a>
Попередній патент: Гетероарилпохідні (варіанти) та фармацевтична композиція на їх основі
Наступний патент: Фторовані похідні 17b-заміщеного-4-aзa-5a-андростан-3-ону і фармацевтична композиція на їх основі
Випадковий патент: Спосіб одержання метилтіометиларенів