Арипіпразолу геміфумарат і спосіб його одержання
Номер патенту: 94624
Опубліковано: 25.05.2011
Автори: Бомбек Сергея, Кросель Весна, Гойяк Урска, Смрколь Матей, Стефанік Марко, Мерславік Маріо, Вайс Анамарія
Формула / Реферат
1. Арипіпразолу геміфумарат, який відрізняється тим, що співвідношення між арипіпразолом і фумаратом складає 2:1.
2. Арипіпразолу геміфумарат за п. 1, який відрізняється тим, що він є кристалічним.
3. Арипіпразолу геміфумарат за п. 2, який відрізняється тим, що характеризується порошковою рентгенограмою, що має піки приблизно при 12,1, 15,8, 17,9, 19,7, 21,8±0,2° кута 2θ.
4. Арипіпразолу геміфумарат за п. 3, який відрізняється тим, що має піки при приблизно 6,7, 8,9, 11,1, 12,1, 15,8, 17,9, 19,7, 21,8, 24,6±0,2° кута 2θ.
5. Арипіпразолу геміфумарат за п. 2, який відрізняється тим, що він має ендометричний пік на термограмі, одержаний методом диференціальної скануючої колориметрії (DSC), приблизно при 187-192°С.
6. Арипіпразолу геміфумарат за п. 1, який відрізняється порошковою рентгенограмою, представленою на Фіг. 1.
7. Арипіпразолу геміфумарат за п. 1, який відрізняється термограмою, одержаною методом DSC, представленою на Фіг. 2.
8. Аморфний арипіпразолу геміфумарат.
9. Аморфний арипіпразолу геміфумарат, який відрізняється порошковою рентгенограмою, представленою на Фіг. 6.
10. Спосіб одержання арипіпразолу геміфумарату, при якому:
А) арипіпразол розчиняють в розчиннику при температурі від 15 °С до температури дефлегмації використаного розчинника;
Б) фумарову кислоту додають в молярному співвідношенні 0,5-0,7 по відношенню до арипіпразолу і суміші нагрівають до температури, що складає від 15°С до температури дефлегмації використаного розчинника;
В) одержаний розчин, необов'язково, охолоджують і
Г) осад, що випав, необов'язково, фільтрують.
11. Спосіб за п. 10, який відрізняється тим, що арипіпразол і фумарову кислоту додають в зворотному порядку, а саме арипіпразол додають до фумарової кислоти.
12. Спосіб за п. 10 або 11, де органічний розчинник вибирають з вуглеводнів, галогенованих вуглеводнів, простих ефірів, складних ефірів, кетонів і спиртів або комбінації вказаних розчинників.
13. Спосіб за п. 12, який відрізняється тим, що органічним розчинником є етанол, тетрагідрофуран, ацетонітрил і/або метиленхлорид.
14. Арипіпразолу геміфумарат за п. 1, який відрізняється тим, що має середній розмір частинок менше 70 мкм.
15. Арипіпразолу геміфумарат за п. 14, який відрізняється тим, що має середній розмір частинок менше 50 мкм.
16. Арипіпразолу геміфумарат за п. 15, який відрізняється тим, що має середній розмір частинок менше 30 мкм.
17. Арипіпразолу геміфумарат за п. 16, який відрізняється тим, що має середній розмір частинок менше 20 мкм.
18. Фармацевтична композиція, яка відрізняється тим, що містить арипіпразолу геміфумарат за будь-яким з пп. 1-9 або 14-17 і фармацевтично прийнятні ексципієнти.
19. Фармацевтична композиція за п. 18, яка відрізняється тим, що агломерати арипіпразолу геміфумарату зруйновані.
20. Фармацевтична композиція за п. 18, яка відрізняється тим, що агломерати арипіпразолу геміфумарату були просіяні.
21. Фармацевтична композиція за п. 18, яка відрізняється тим, що має такий профіль розчинення, що щонайменше 80 % арипіпразолу розчиняється в 0,1 М НСl протягом 30 хв.
22. Фармацевтична композиція за п. 18, яка відрізняється тим, що має такий профіль розчинення, що щонайменше 80 % арипіпразолу розчиняється в ацетатному буфері з рН 4,5 протягом 30 хв.
23. Застосування арипіпразолу геміфумарату для одержання фармацевтичної лікарської форми.
24. Застосування за п. 23, яке відрізняється тим, що арипіпразолу геміфумарат є арипіпразолу геміфумарат за будь-яким з пп. 1-9 або 14-17.
Текст
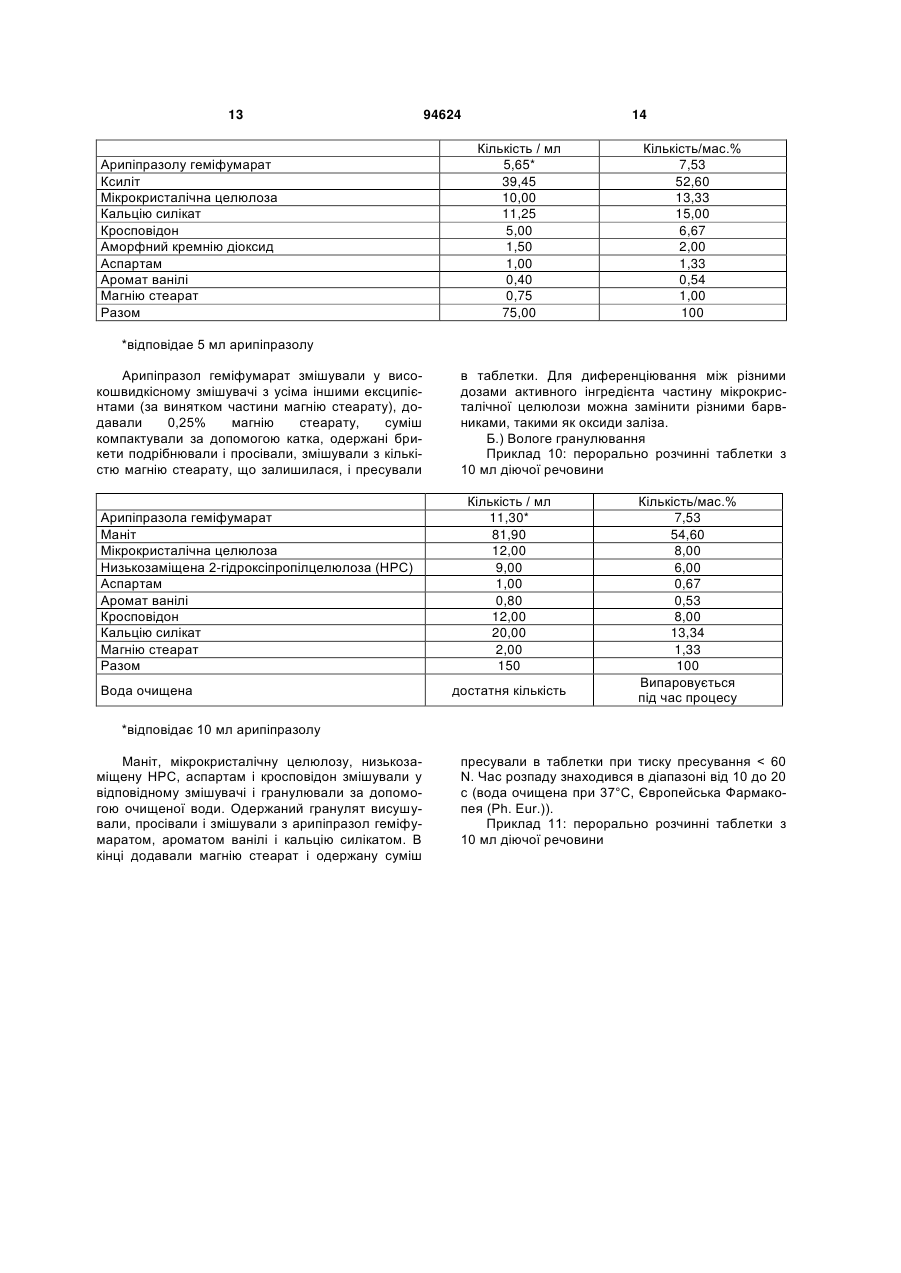
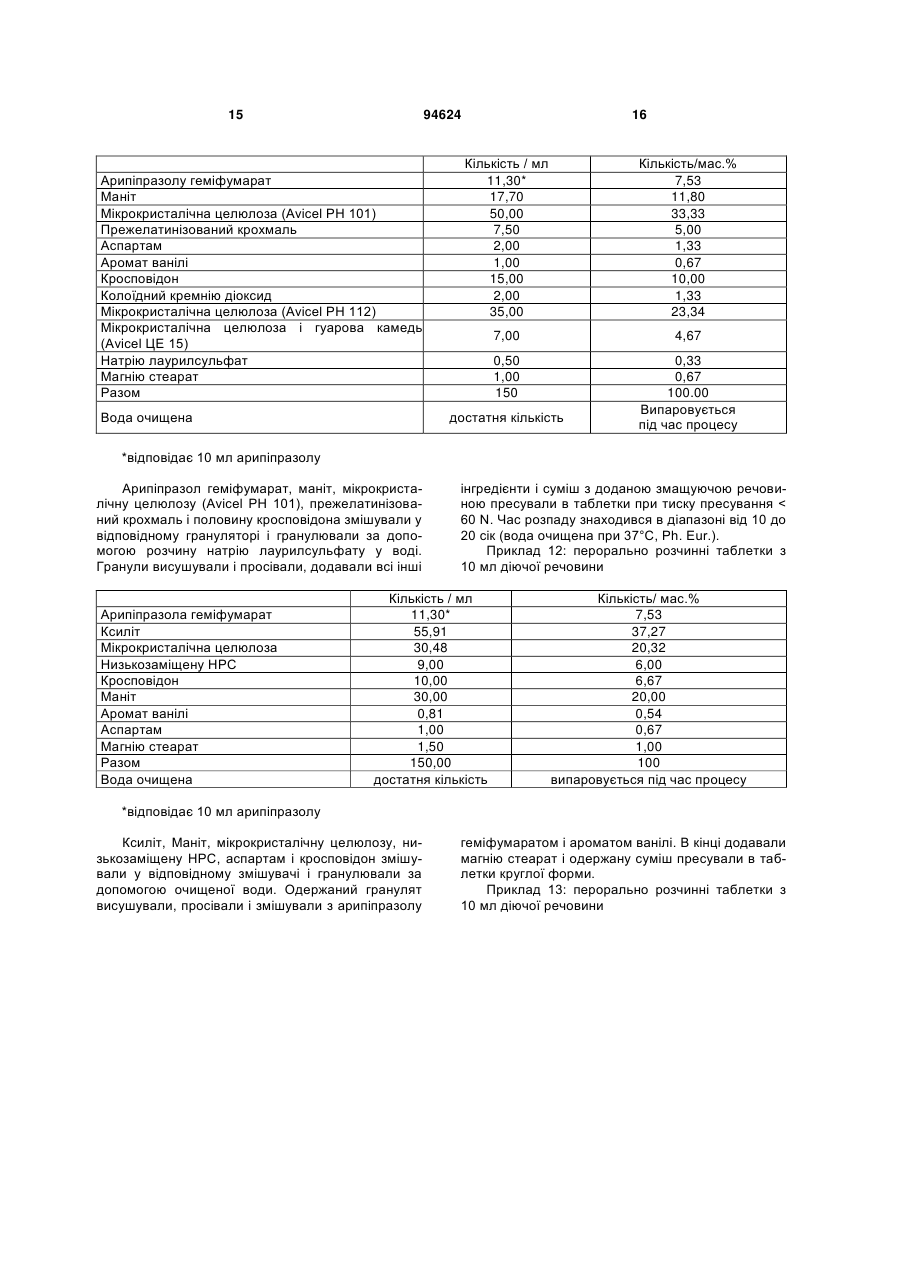
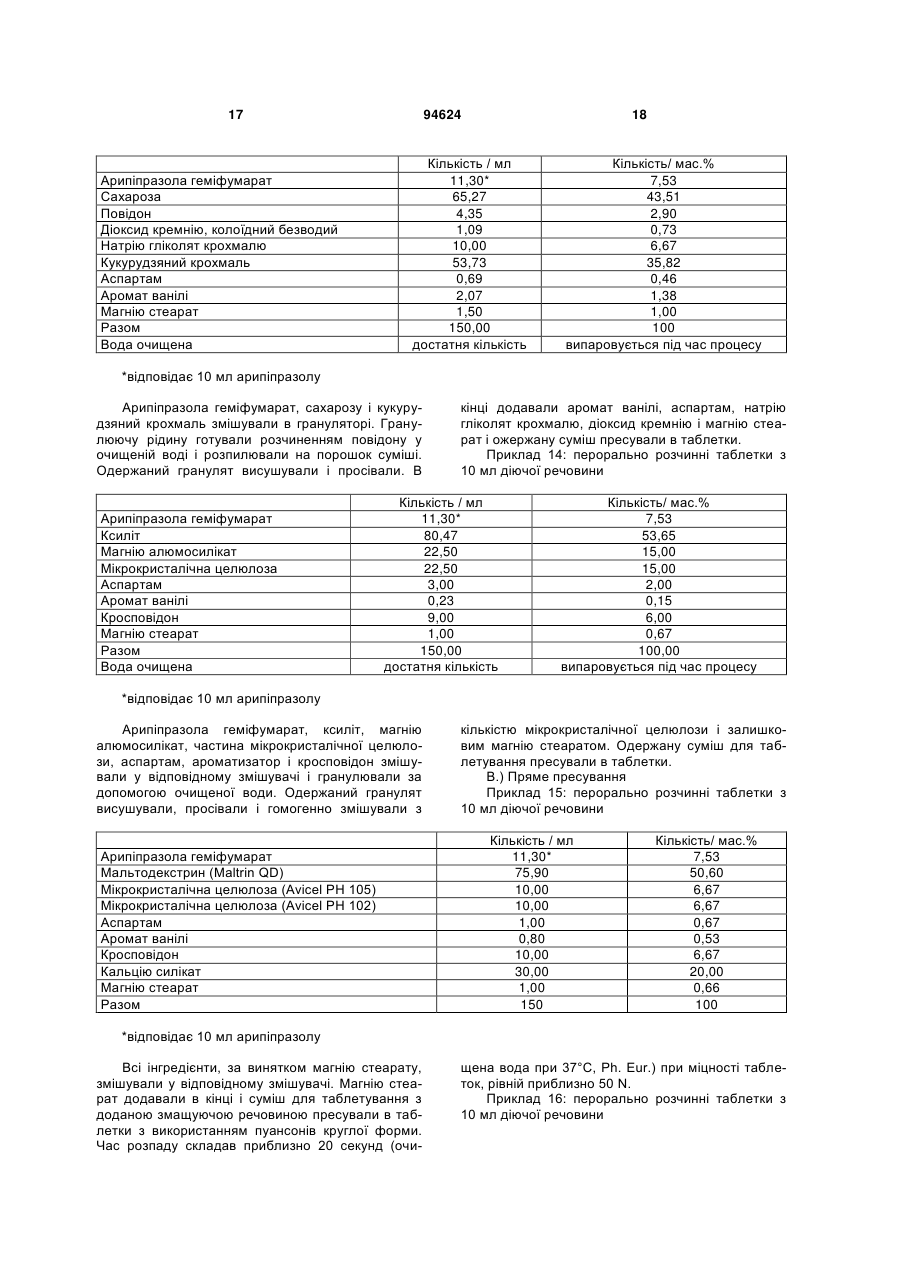
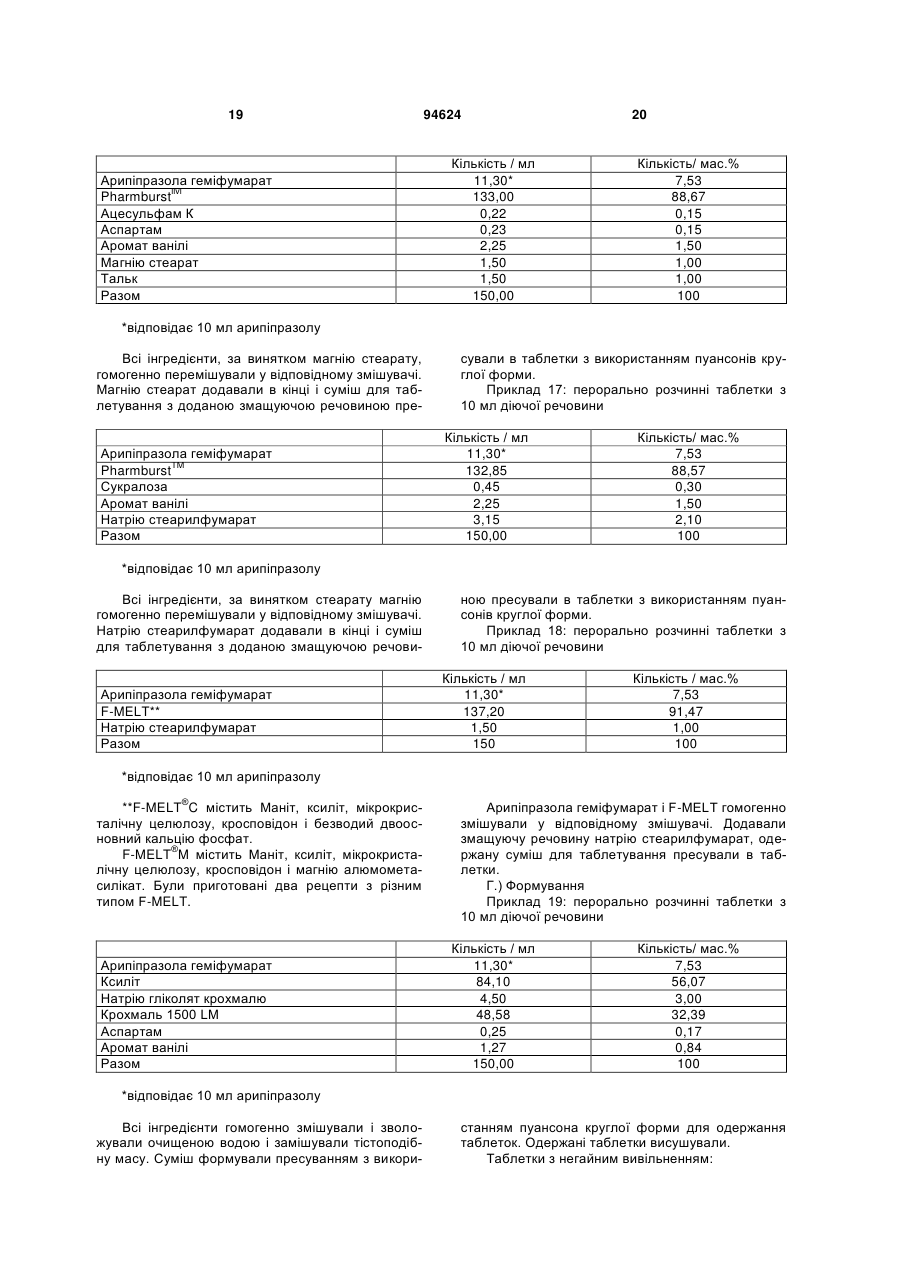
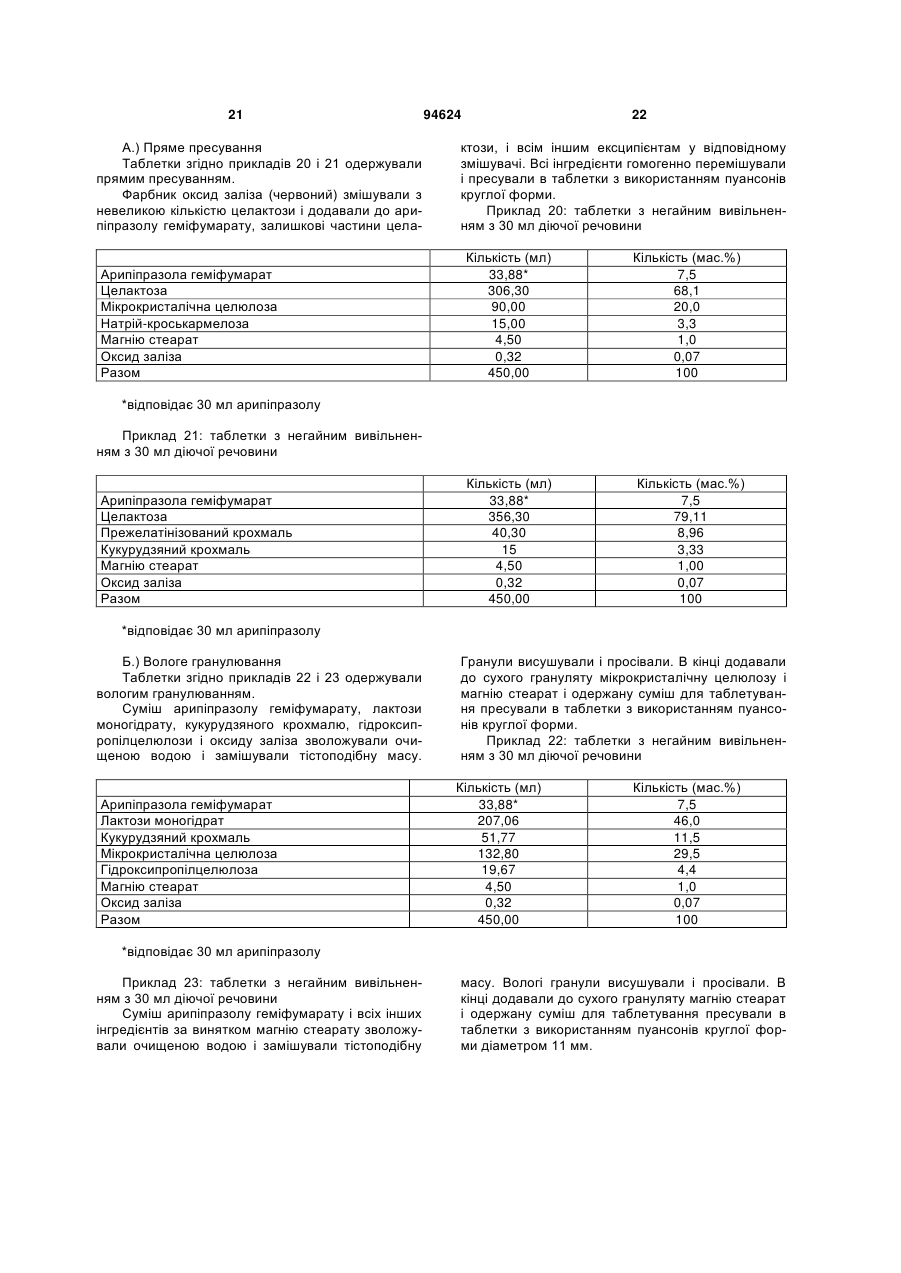
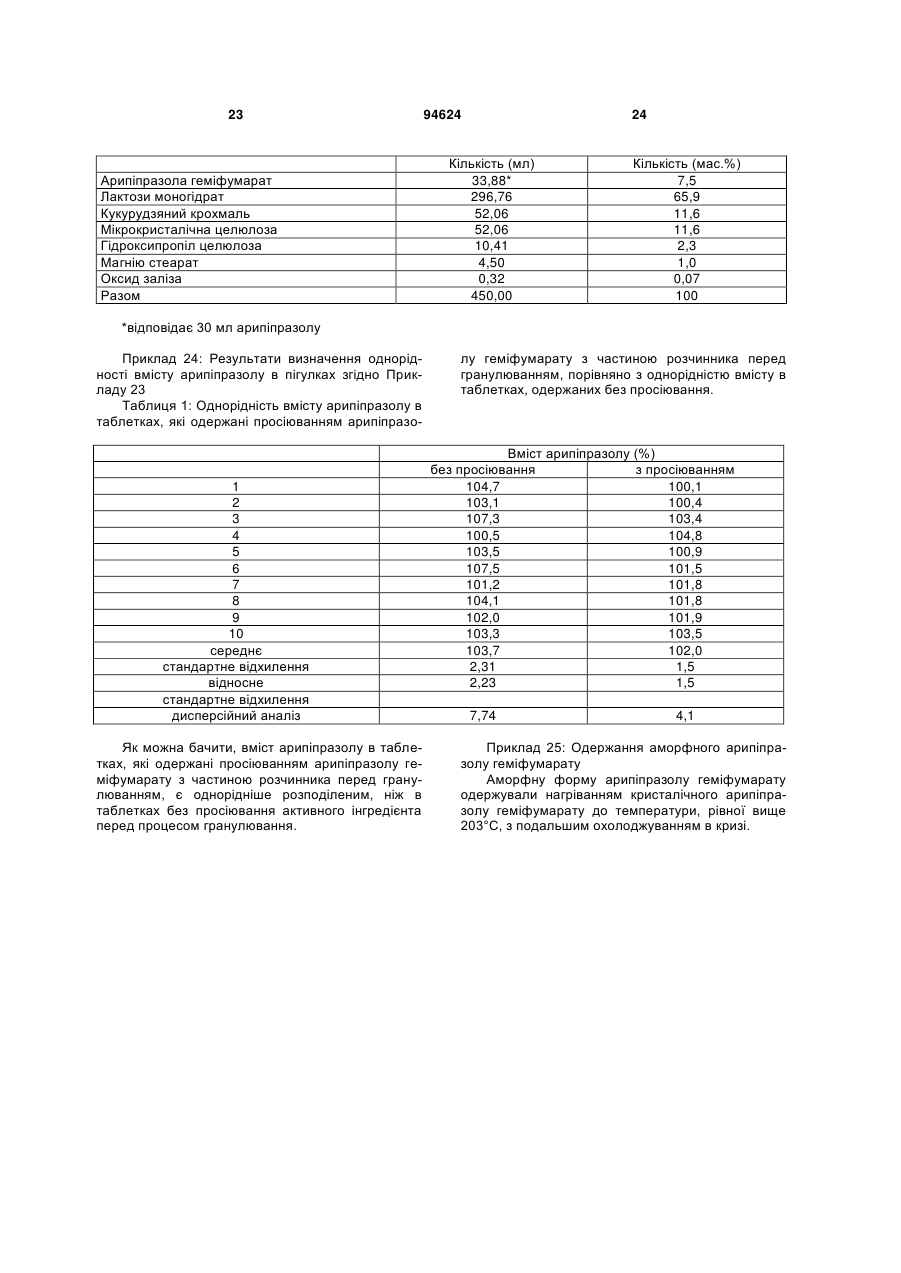
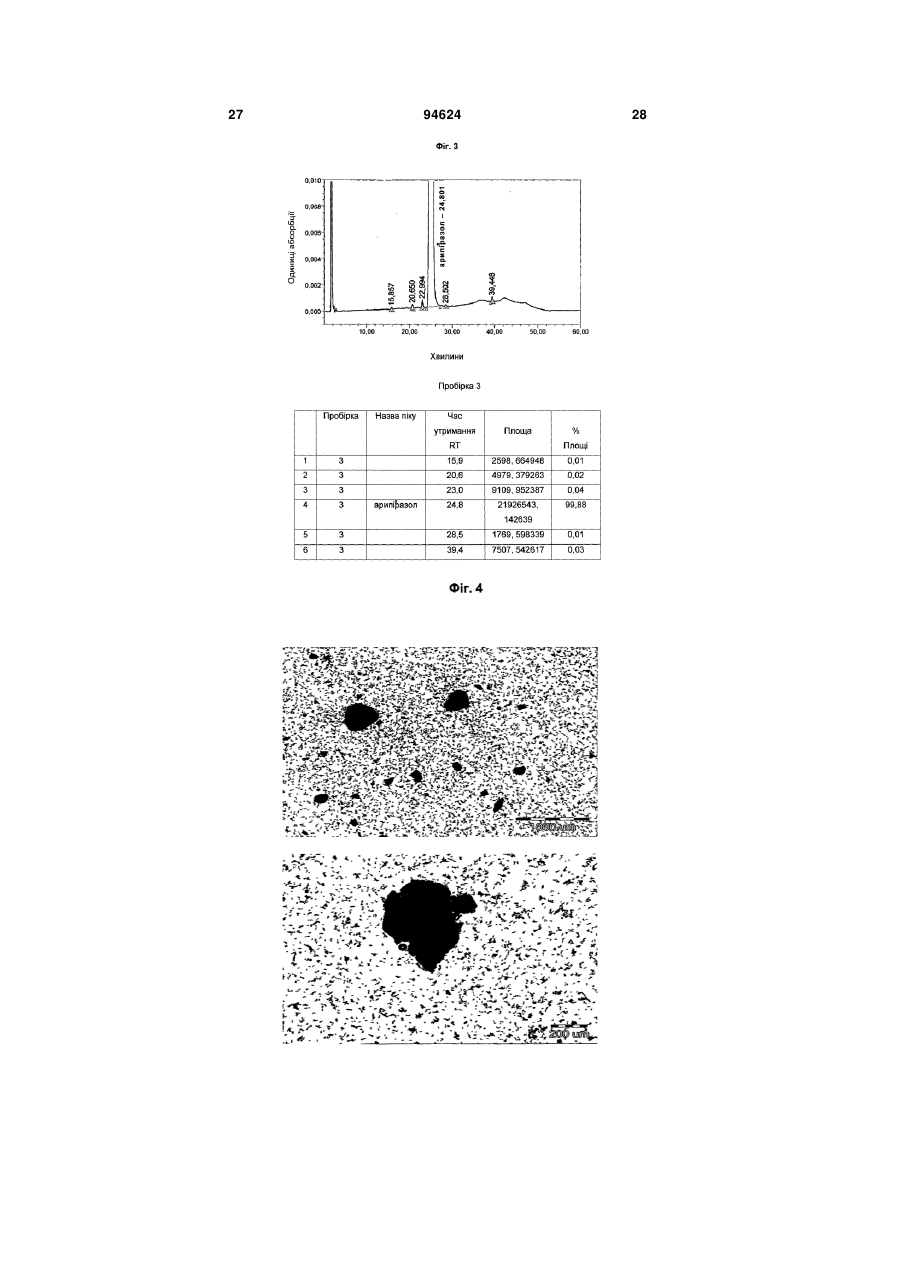
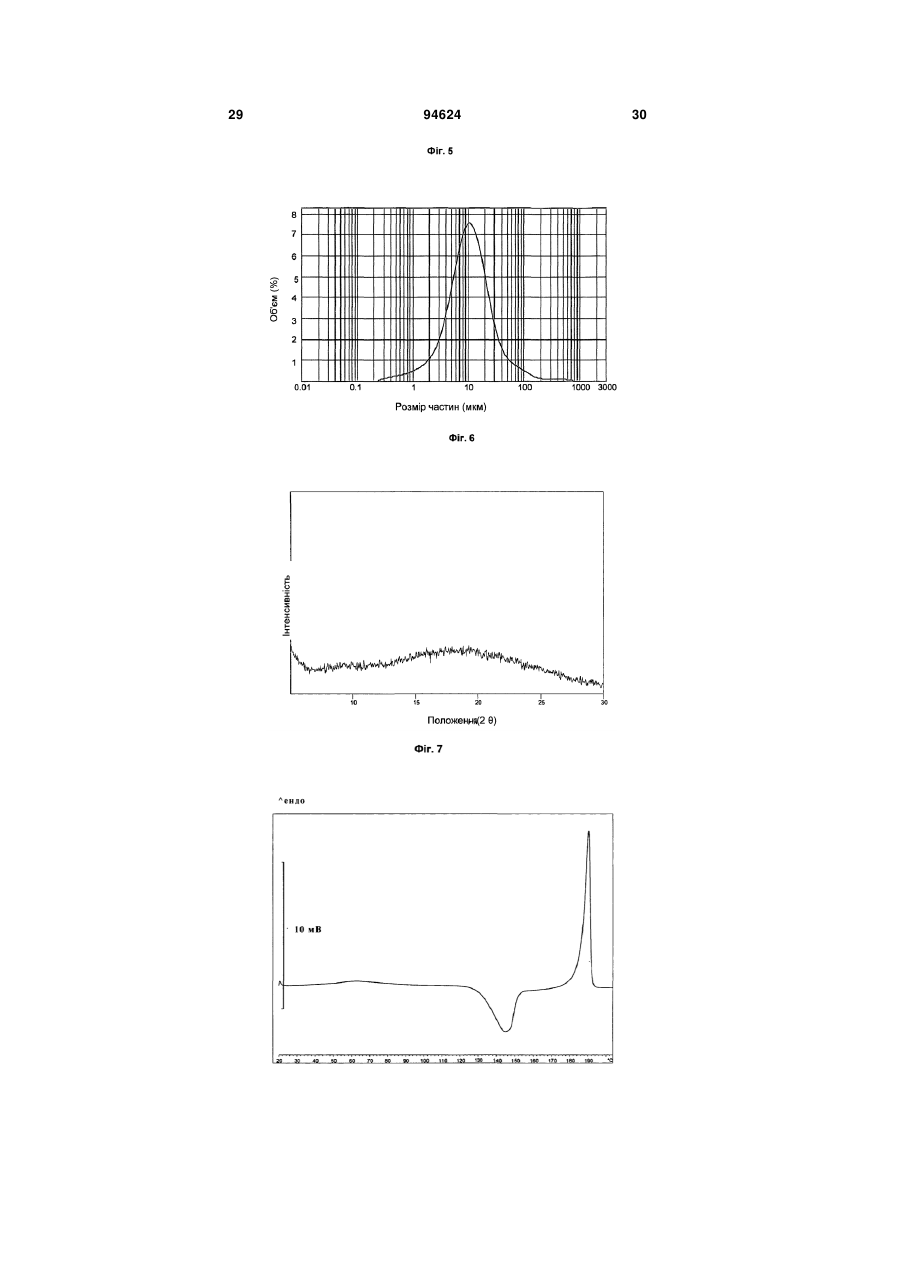
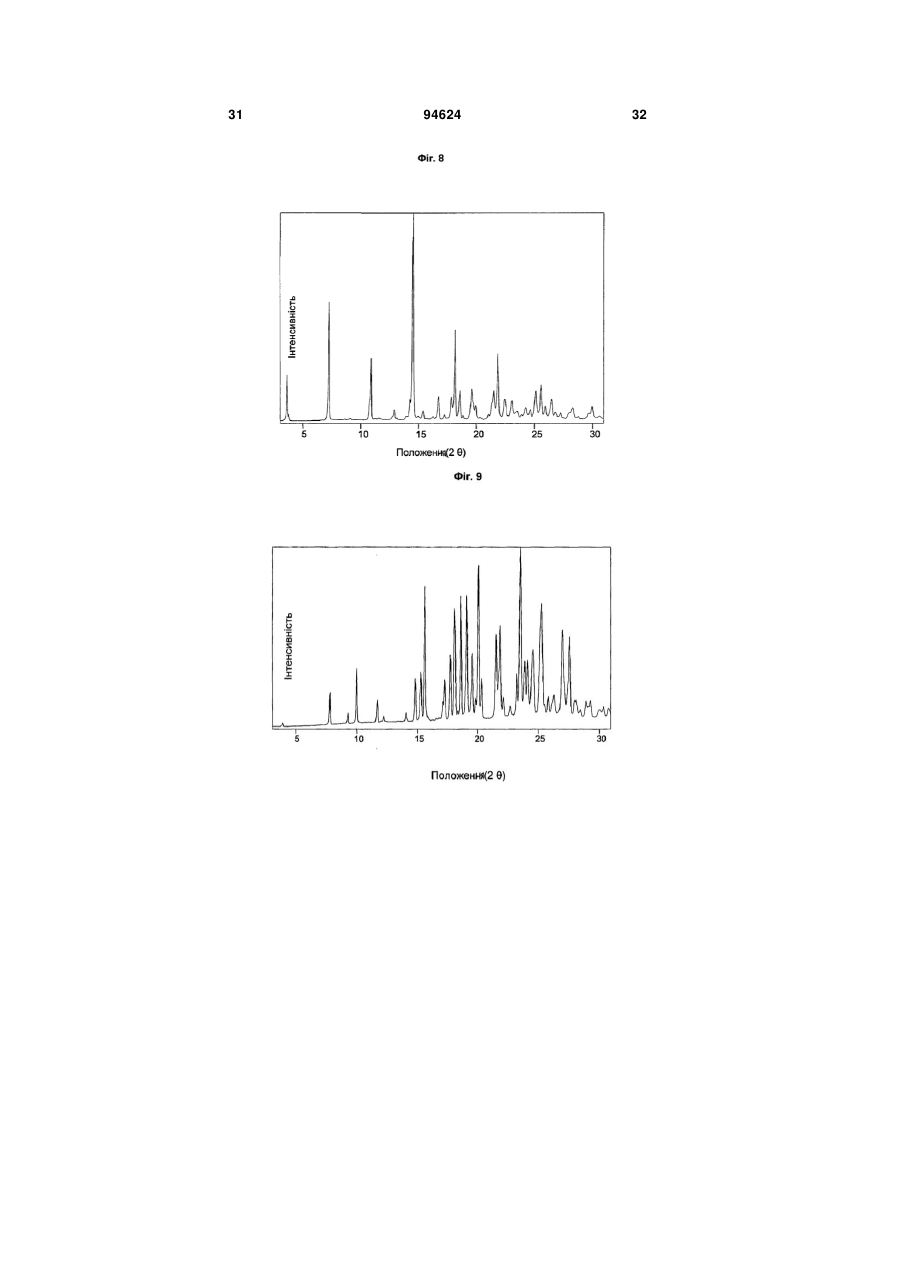
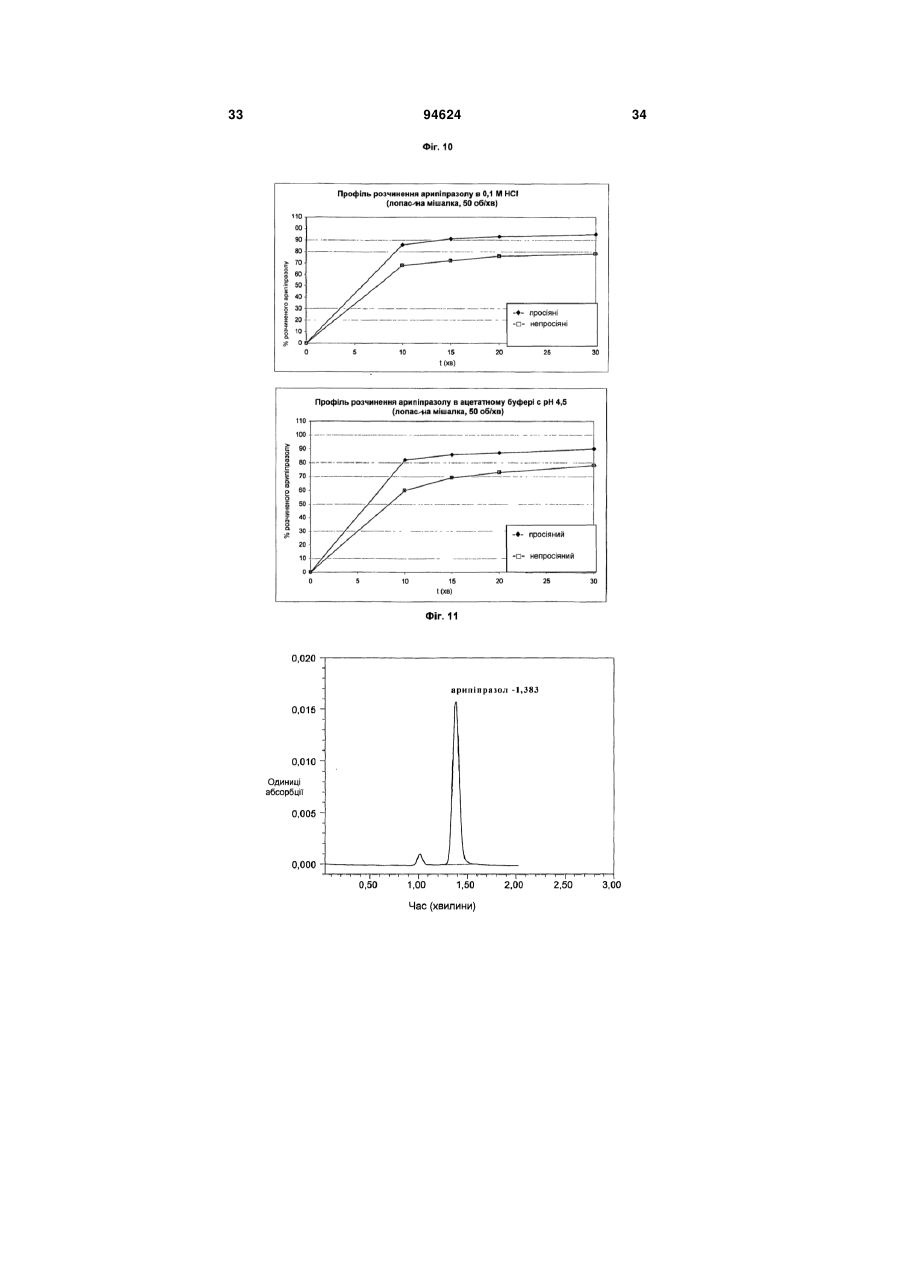
1. Арипіпразолу геміфумарат, який відрізняється тим, що співвідношення між арипіпразолом і фумаратом складає 2:1. 2. Арипіпразолу геміфумарат за п. 1, який відрізняється тим, що він є кристалічним. 3. Арипіпразолу геміфумарат за п. 2, який відрізняється тим, що характеризується порошковою рентгенограмою, що має піки приблизно при 12,1, 15,8, 17,9, 19,7, 21,8±0,2° кута 2θ. 4. Арипіпразолу геміфумарат за п. 3, який відрізняється тим, що має піки при приблизно 6,7, 8,9, 11,1, 12,1, 15,8, 17,9, 19,7, 21,8, 24,6±0,2° кута 2θ. 5. Арипіпразолу геміфумарат за п. 2, який відрізняється тим, що він має ендометричний пік на термограмі, одержаний методом диференціальної скануючої колориметрії (DSC), приблизно при 187192°С. 6. Арипіпразолу геміфумарат за п. 1, який відрізняється порошковою рентгенограмою, представленою на Фіг. 1. 7. Арипіпразолу геміфумарат за п. 1, який відрізняється термограмою, одержаною методом DSC, представленою на Фіг. 2. 8. Аморфний арипіпразолу геміфумарат. 9. Аморфний арипіпразолу геміфумарат, який відрізняється порошковою рентгенограмою, представленою на Фіг. 6. 2 (19) 1 3 94624 4 21. Фармацевтична композиція за п. 18, яка відрізняється тим, що має такий профіль розчинення, що щонайменше 80 % арипіпразолу розчиняється в 0,1 М НСl протягом 30 хв. 22. Фармацевтична композиція за п. 18, яка відрізняється тим, що має такий профіль розчинення, що щонайменше 80 % арипіпразолу розчиняється в ацетатному буфері з рН 4,5 протягом 30 хв. 23. Застосування арипіпразолу геміфумарату для одержання фармацевтичної лікарської форми. 24. Застосування за п. 23, яке відрізняється тим, що арипіпразолу геміфумарат є арипіпразолу геміфумарат за будь-яким з пп. 1-9 або 14-17. Даний винахід відноситься до арипіпразолу геміфумарату, його кристалічній і аморфній формі, способу його одержання, фармацевтичної композиції, що його містить, а також його застосування для одержання фармацевтичної лікарської форми. Арипіпразол, що має хімічну назву 7-[4-[4-(2,3дихлорфеніл)-1-піперазініл]бутоксі]-3,4-дигідро2(1Н)-хінолінон, і його солі придатні для лікування шизофренії. Терапевтичне застосування відоме, наприклад, з ЕР-А-0 367 141. У ЕР-А-0 367 141 також описані способи одержання арипіпразолу і його солей, таких як сіль гідрохлориду, сульфату, фумарату і малеату. Різні кристалічні форми арипіпразолу і його гідратів розкриті в WO-A-03/026659, заявці на патент Японії №. 191256/1990, що не проходила експертизу, і четвертому Японсько-корейському Симпозіумі за Технологією Розділення (Жовтень 6-8, 1996). Нові поліморфні форми і солі також описані в WO-A2004/083183, WO-A-2004/106322, WO-A2005/009990, WO-A-2005/016261, WO-A2005/058835, WO-A-2006/012237 і WO-A2006/30446. Додатково, в ЕР-А-1 145 711, ЕР-А-1 566 174 і WO-A-03/030868 розкриті готові лікарські форми, що швидко диспергують у воді, містять медикамент, високоефективний розпушувач і диспергуючий агент, де СаSіО3 є переважним диспергуючим агентом. Однак досі є потреба у формі арипіпразолу, яка є стабільною, відтворною і знаходиться у відповідній формі для подальшої переробки у фармацевтичні композиції, що проявляють високу однорідність вмісту і покращуване вивільнення лікарського засобу арипіпразолу. Дані цілі досягаються за допомогою арипіпразолу геміфумарату за п.п. 1-9 і 14 - 16 формул винаходу. Окрім цього об'єктами винаходу є спосіб одержання арипіпразолу геміфумарату за п.п. 10 13 і фармацевтична композиція, що містить арипіпразолу геміфумарат, за п.п. 18 - 22, а також застосування арипіпразолу геміфумарату за п.п. 23 24. На Фіг. 1 представлена порошкова рентгенограма арипіпразолу геміфумарату. На Фіг. 2 представлена термограма арипіпразолу геміфумарату, одержана методом DSC (диференціальна скануюча калориметрія). На Фіг. 3 представлена хроматограма арипіпразолу геміфумарату, одержана методом ВЕРХ (високоефективна рідинна хроматографія). На Фіг. 4 представлено зображення частинок арипіпразолу геміфумарату. На Фіг. 5 представлена діаграма розподілу за розміром частинок арипіпразолу геміфумарату. На Фіг. 6 представлена порошкова рентгенограма аморфного арипіпразолу геміфумарату. На Фіг. 7 представлена термограма аморфного арипіпразолу геміфумарату, одержана методом DSC. На Фіг. 8 представлена порошкова рентгенограма арипіпразолу фумарату (1:1) типу І, одержаного згідно ЕР-А- 0 367 141. На Фіг. 9 представлена порошкова рентгенограма арипіпразолу фумарату (1:1) типу II. На Фіг. 10 представлений профіль розчинення арипіпразолу з пігулок згідно прикладу 23 в 900 мл 0,1 Μ НСІ і в 900 мл ацетатного буфера з рН 4,5. На Фіг. 11 представлена ВЕРХ хроматограма арипіпразолу в розчині для визначення профілю розчинення з пігулок згідно прикладу 23. На Фіг. 12 представлена фотографія частинок арипіпразолу типу III згідно Aoki (Study on Crystal th Transformation of Aripiprazole, 4 Japan-Korea Symposium on Separation Technology, p. 937 (1996)). Порошкові рентгенограми були одержані на Phillips PW3040/60 X' Pert PRO порошковому дифрактометрі з CuK випромінюванням з довжиною хвилі 1,541874А. DSC скани були записані на скануючому калориметрі DSC 822e Mettler Toledo. Зразки масою приблизно 3 мл. сканували при швидкості нагрівання 10°С/хв, в атмосфері азоту. ВЕРХ хроматограму солі арипіпразолу геміфумарату одержували на хроматографі Waters Alliance 2690 з детектором PDA 996. Хроматографічне розділення проводили з використанням аналітичної колонки Inertsil ODS-3, 250x4,6 мм, 5 мкм. Застосовували наступні умови хроматографії: концентрація зразка 1 мг/мл, визначення при 250 нм, витрата потоку 1,5 мл/хв, об'єм зразка 20 мкл, що вводиться. Застосовували градієнтне елюювання з використанням мобільної фази А (0,1 Μ КН2РО4 : CH3CN = 81:19 (об/об)) і мобільної фази В (0,1 Μ ΚΗ2ΡΟ4 : CH3CN = 50:50 (об/об)) при режимі (0 хв 10%В, 40 хв 90%В, 45 хв 90%В). Дослідження зразків розчинення за допомогою ВЕРХ здійснювали з використанням аналітичної колонки Gemini С18 110Е, 100 4,6 мм внутрішній діаметр, 5 мкм. Застосовували наступні умови хроматографії: визначення при 250 нм, мобільна фаза 0,005 Μ КН2РО4 : CH3CN = 40:60 (об/об), витрата потоку 1,0 мл/хв, об'єм зразка, що вводиться 5 мкл і температура колонки 30°С. 5 Розподіл частинок арипіпразолу геміфумарату за розміром визначали способом лазерної дифракції з використанням приладу лазерної дифракції Malvern Mastersizer 2000. Зразки для аналізу готували шляхом диспергування зваженої кількості частинок арипіпразолу геміфумарату у високочистому ізопарафіні-розчиннику. Термін «середній розмір частинки» означає узагальнений діаметр частинки. Виявлена нова сіль арипіпразолу, а саме арипіпразолу геміфумарат, яка відрізняється від арипіпразолу фумарату, розкритого в ЕР-А-0 367 141, тим, що співвідношення між арипіпразолом і фумаратом складає 2:1. Таким чином, даний винахід відноситься до арипіпразолу геміфумарату, який відрізняється тим, що молярне співвідношення між арипіпразолом і фумаратом складає 2:1. Нова сіль є стабільною, відтворною і придатною для одержання фармацевтичних препаратів. У переважному варіанті втілення даного винаходу арипіпразолу геміфумарат є кристалічним і може бути охарактеризований за допомогою порошкової рентгенограми, з піками при приблизно 12,1, 15,8, 17,9, 19,7, 21,8 ± 0,2° кута 2 . Арипіпразола геміфумарат можна додатково охарактеризувати за допомогою піків порошкової рентгенограми при приблизно 6,7, 8,9, 11,1, 12,1, 15,8, 17,9, 19,7, 21,8, 24,6 ± 0,2° кута 2. Він може бути або мати поліморфну чистоту 100%, або включати іншу поліморфну або аморфну форму. Порошкова рентгенограма кристалічного арипіпразолу геміфумарату згідно винаходу показана на Фіг. 1. Арипіпразола геміфумарат згідно даного винаходу можна також охарактеризувати за ендотермічним піком DSC приблизно при 187-192°С. Приклад DSC термограми арипіпразолу геміфумарату згідно винаходу показаний на Фіг. 2. Згідно іншого варіанту втілення даного винаходу арипіпразолу геміфумарат є аморфним. Переважно аморфний арипіпразолу геміфумарат характеризується порошковою рентгенограмою, як показано на Фіг. 6. Даний винахід також направлений на спосіб одержання арипіпразолу геміфумарату. Спосіб одержання арипіпразолу геміфумарату відрізняється тим, що він включає: A) розчинення арипіпразолу в розчиннику при температурі від 15°С до температури флегми використаного розчинника Б) додавання фумарової кислоти в молярному співвідношенні 0,5 - 0,7 по відношенню до арипіпразолу і нагрівання суміші до температури, складовій від 15°С до температури флегми використаного розчинника B) необов'язково, охолоджування одержаного розчину і Г) необов'язково, фільтрування випавшого осаду Переважно, даний спосіб приводить до одержання кристалічного арипіпразолу геміфумарату. Одержаний кристалічний продукт можна перетворити на аморфний арипіпразол за допомогою методик, відомих в даній області, таких як нагрівання 94624 6 кристалічного арипіпразолу вище за його температуру плавлення і швидке охолоджування. Фумарова кислота, додана на стадії Б), може знаходитися у формі розчину або в твердій формі. У іншому аспекті даного способу одержання арипіпразолу геміфумарату порядок додавання арипіпразолу і фумарової кислоти може також бути зворотним, і арипіпразол додають до розчину фумарової кислоти. Арипіпразол можна додавати у формі розчину або в твердій формі Згідно переважному варіанту втілення способу за винаходом після стадії Б), тобто після додавання фумарової кислоти до розчину арипіпразолу або після додавання арипіпразолу до розчину фумарової кислоти не додають додатковий розчинник і, зокрема, органічний розчинник, такий як антирозчинник. Основу арипіпразолу можуть одержувати згідно способу, розкритому у ЕР-А-0 367 141, і також можуть додатково перекристалізувати і/або очищати до рівня, рівного 99,9%. Арипіпразол, використаний при одержанні геміфумаратної солі, може бути або чистим, або неочищеним. Якщо арипіпразол геміфумарат, одержаний згідно даного винаходу, не є задовільно чистим, його можуть перекристалізувати до рівня чистоти, що становить 99,9%. Відповідні розчинники для кристалізації арипіпразолу геміфумарату і, зокрема, відповідні розчинники, які можуть використовувати на стадії А) і/або Б) способу згідно винаходу для одержання арипіпразолу геміфумарату, включають органічні розчинники, такі як вуглеводні (наприклад, пентан, гексан, гептан), галогеновані вуглеводні (наприклад, метиленхлорид), нітрил (наприклад, ацетонітрил), кетон, прості ефіри (наприклад, тетрагідрофуран), складні ефіри і спирти (наприклад, метанол, етанол, ізопропанол, пропанол, бутанол). Згідно одного варіанту втілення способу за винаходу, геміфумаратну сіль можуть виділяти в сольватованій формі. Потім розчинник можуть видаляти висушуванням. Використання в даному описі, терміну «висушування», як правило, означає видалення розчинника до досягнення вмісту залишкових розчинників в арипіпразолі геміфумараті, що становить менш приблизно 6000 м.д. Висушування можуть здійснювати, наприклад, із застосуванням тепла, переважно, при нормальному або зниженому тиску, або шляхом приведення арипіпразолу геміфумарату в контакт з вологим або сухим повітрям в сушарці з псевдозрідженим шаром, де атмосфера в сушарці псевдозрідженого шару має, щонайменше, 15% вологість. Термін «знижений тиск» означає тиск нижче однієї атмосфери, переважніше, нижче приблизно 10 мм рт.ст. Розмір частинок арипіпразолу геміфумарату, одержаного згідно даного винаходу, може знаходитися в діапазоні рівному 0,1 - 250 мкм. Наприклад, розмір одержаних частинок арипіпразолу геміфумарату залежить від швидкості охолоджування розчину. Згідно одного з варіантів втілення способу даного винаходу і, зокрема, якщо потрібні частинки 7 меншого розміру, одержаний арипіпразолу геміфумарат можуть просівати, подрібнювати або мікронізувати, можливо, разом з іншими ексципієнтами. При даному процесі прикладене механічне зусилля до поверхні частинок, приводить до зменшення розміру частинок, однак, це може також спровокувати структурні зміни в матеріалі. Наприклад, як подріблювальне обладнання зазвичай використовують повітряноструйний млин, кульовий млин або молотковий млин. Основним принципом обробки у повітряноструйному млині є зіткнення і стирання між частинками, суспендованими у високошвидкісному потоці повітря, яке вносить енергію до камери млина. У кульовому млині частинки розламуються за допомогою удару подрібнюючого середовища (кульки, кубики, циліндри і так далі), яке може займати до половини об'єму камери млина. Завдяки обертанню камери, подрібнююче середовище падає з підведеного положення. Між всіма елементами також відбувається тертя, що вносить значний внесок до стирання і, таким чином, в аморфну природу подрібнюваного матеріалу. Одному з найширше використовуваних млинів у фармацевтичній промисловості є молотковий млин. У такому обладнані частинки піддаються дії молотків, що швидко обертаються. Під час подрібнення матеріал додатково ударяється об перфорований захисний екран, який розміщений над вихідним штуцером камери. Дуже тонкоподрібнені частинки активного інгредієнта можуть спонтанно агломерувати завдяки Ван-дер-ваальсовим і електростатичним силам. На Фіг. 4 показані малі частинки арипіпразолу геміфумарату нерегулярної форми і сплавлені в агломерати. Згідно способу за даним винаходом частинки активного інгредієнту одержують без агломератів, що виключно придатні для виготовлення препарату. Приклад розподілу за розміром частинок арипіпразолу геміфумарату згідно винаходу показаний на Фіг. 5. Агломерати активного інгредієнта роблять величезний вплив на фізико-хімічні властивості пігулок. Унаслідок агломерації вміст активного інгредієнта може бути нерівномірно розподілений, і вивільнення лікарського засобу з пігулок може бути сповільнене. Таким чином, бажано запобігати агломерації або руйнувати агломерати на частинки малого розміру з використанням відповідних методик. Згідно одного варіанту втілення способу даного винаходу це досягається шляхом просіювання одержаного арипіпразолу геміфумарату. Зокрема, активний інгредієнт арипіпразолу геміфумарат просівають разом з частиною розчинника, такого як маїсовий крохмаль або лактозу, через сито, що має номінальний розмір отворів, рівний від приблизно 0,2 до приблизно 1,0 мм, переважно, 0,4 - 0,8 мм і найбільш переважні приблизно 0,6 мм, перед процесом гранулювання. Крім того, агломерати арипіпразолу геміфумарату можна також руйнувати за допомогою будь-яких інших способів, таких як ультразвук або подрібнення. У переважному варіанті втілення, арипіпразолу геміфумарат згідно даного винаходу по суті не містить агломератів. Зокрема, середній розмір частинок арипіпразолу геміфумарату згідно даного 94624 8 винаходу складає менше 70 мкм, переважно, менше 50 мкм, найпереважніше, менше 30 мкм. Найбільш переважний середній розмір частинок арипіпразолу геміфумарату складає менше 20 мкм. Даний винахід також відноситься до фармацевтичних композицій, що містять арипіпразолу геміфумарат згідно винаходу як активний інгредієнт в суміші з одним або більш носіями або допоміжною речовиною (речовинами), зазвичай вживаними у фармацевтичній промисловості. Фармацевтичні композиції згідно винаходу зазвичай містять 1-90 мас.%, переважно, 2-50 мас.%, найпереважніше, 3-30 мас.%, активного інгредієнта. Додатково, фармацевтичні композиції можуть відрізнятися тим, що вони містять кількість арипіпразолу геміфумарату, що відповідає 1 - 50 мл арипіпразолу на лікарську форму. Найпереважніше, фармацевтичні композиції згідно даного винаходу містять кількість арипіпразолу геміфумарату, що відповідає 2 мл, 5 мл, 10 мл, 15 мл, 20 мл або 30 мл арипіпразолу на лікарську форму. Фармацевтичні композиції за даним винаходом можуть бути придатними для перорального (наприклад, порошки, таблетки, таблетки, покриті оболонкою, капсули, таблетки, що руйнуються перорально, жувальні таблетки, розчини, суспензії або емульсії), парентерального (наприклад, ін'єкційні розчини для внутрішньовенного, внутрішньом'язового, підшкірного або внутрішньочеревинного застосування), ректального (супозиторії), трансдермального (пластирі) або місцевого (мазі або пластирі) введення або для застосування у формі імплантів. Тверді, м'які або рідкі фармацевтичні композиції згідно винаходу можна одержувати способами, зазвичай вживаними у фармацевтичній промисловості. Тверда фармацевтична композиція додатково містить, щонайменше, одну допоміжну речовину, вибрану з групи наповнювачів або носіїв, зв'язуючих речовин, розчинників, розпушувачів, змащуючих речовин, ковзаючих речовин, поверхневоактивних речовин, підсолоджувачів, ароматизаторів, стабілізаторів і так далі. Розчинники можна вибрати (не обмежуючись вказаним) з групи лактози в різних формах (безводна, моногідрат, лактоза, висушена рзпилювальним методом і так далі), мікрокристалічної целюлози (такі як комерційно доступні Avicel PH 101, Avicel PH 102 або Avicel PH 112), порошкоподібної целюлози, силіцифікованої мікрокристалічної целюлози, кальцію фосфату, кальцію гідрофосфату, кальцію карбонату, сахарози, глюкози, фруктози, декстратів, мальтодекстринів, інших сахаридів, таких як маніт, лактит, ксиліт, сорбіт, кальцію лактат, або комбінованих розчинників (наприклад, FMELT). Крохмалі, такі як прежелатинізований крохмаль, також можна використовувати як розчинник. Композиція згідно винаходу може також містити зв'язуючі речовини, такі як повідон, мікрокристалічну целюлозу, гідроксиетилцелюлозу, гідроксипропілцелюлозу, низькозаміщена гідроксипропілцелюлоза (що містить 5 - 16 мас.% гідроксіпропільних груп), гідроксіпропілметилцелюлозу або інші ефіри целюлози, крохмаль, пре 9 желатинізований крохмаль, желатин, поліметакрилат або суміш зв'язуючих речовин. Крім того, можуть бути також присутніми розпушувачі і/або високоефективні розпушувачі, такі як крохмалі (наприклад, маїсовий крохмаль, картопляний крохмаль), модифіковані крохмалі (натрію гликолят крохмалю), модифікована целюлоза (кроскармелоза, тобто поперечно-зшита натрій карбоксиметилцелюлоза), поперечно-зшитий полівінілпіролідон (кросповидон), мікрокристалічна целюлоза, натрій карбоксиметилцелюлоза, Amberlite®, альгінова кислота, натрію альгінат, гуаровая камедь, геллановая камедь, Xanthan SM®, кальцію силікат, магнію силікат, магнію трисиликат, магнію алюмометасиликат (Neusilin®) і інші солі магнію. Переважно, щоб ексципієнти включали, щонайменше, один розпушувач або високоефективний розпушувач, вибраний з кроскармелози, кросповидона і мікрокристалічної целюлози. Додатково, як ексципієнти можуть бути також присутніми змащуючі речовини, такі як стеаринова кислота, магнію стеарат, кальцію стеарат, натрію лаурилсульфат, гідрогенізоване рослинне масло, гідрогенізована касторова олія, натрію стеарилфумарат, тальк, макроголи. Переважно, щоб ексципієнти включали, щонайменше, одну змащуючу речовину, вибрану з магнію стеарату, натрію стеарилфумарату або гідрогенізованого рослинного масла. До композиції згідно винаходу також можна додавати ковзаючі речовини. їх можна вибрати з групи, що складається з тальку, кремнію діоксиду різних сортів (таких як колоїдний або осаджений кремнію діоксид) і так далі. Ексципієнти можуть мати численні функції, тобто один ексципієнт може бути розчинником і додатково зв'язуючою речовиною, зв'язуючою речовиною і розпушувачем і так далі. Як варіант, в твердий фармацевтичний препарат можуть включати сурфактанти. Сурфактанти можуть вибирати з групи неіоногенних або іонних сурфактантів або їх сумішей. Відповідні неіоногенні сурфактанти вибрані з групи алкілглюкозидів, алкілмальтозидів, алкілтіоглюкозидів, лаурилмакроголгліцеридів, поліоксиетилен алкілфенолів, поліоксіетиленалкілових простих ефірів, складних ефірів поліетиленгліколю і жирних кислот, складних ефірів поліетиленгліколь-гліцерину і жирних кислот, складних ефірів поліоксіетилен-сорбітану і жирних кислот, поліоксіетилен-поліоксіпропілен блокових сополімерів, складних ефірів полігліцерину і жирних кислот, поліоксіетиленгліцеридів, поліоксиетиленових рослинних масел, поліоксиетиленових гідрогенізованих рослинних масел, стеролів і їх сумішей. Переважними неіоногенними сурфактантами є складні ефіри поліоксіетиленсорбітану і жирних кислот, які продають під торговими назвами Polysorbate або Tween. Відповідні іонні сурфактанти вибрані з групи солей жирних кислот, солей жовчі, фосфоліпідів, складних ефірів фосфорної кислоти, карбоксилатів, сульфатів, сульфонатів і їх сумішей. Переважним іонним сурфактантом є натрію лаурилсульфат. 94624 10 Додатково, композиція може містити підсолоджувачі. Прикладами підсолоджувачів є аспартам, ацесульфам, натрію сахарин, дикалію гліцирризінат, посконник кропиволистний і тауматин. У фармацевтичній композиції згідно винаходу також можуть міститися ароматизатори, такі як природні або синтетичні матеріали, наприклад, ванільний ароматизатор. Як правило, для одержання фармацевтичної композиції згідно винаходу можна застосовувати будь-який спосіб виготовлення фармацевтичних композицій, наприклад, пряме пресування, вологу (за допомогою води або спирту) або суху грануляцію і так далі. Переважний спосіб одержання фармацевтичних композицій, що містять арипіпразолу геміфумарат як активний інгредієнт, включає змішування вказаного активного інгредієнта з щонайменше одним носієм(ями) або допоміжною речовиною(ами), зазвичай вживаними у фармацевтичній промисловості, і перетворення суміші на готову лікарську форму. Фармацевтичну композицію арипіпразолу геміфумарату можна піддавати технологічній обробці і упаковувати при модифікованій атмосфері. Атмосферу, що має модифікований вміст кисню або зменшений парціальний тиск кисню, можна одержати застосуванням зниженого атмосферного тиску, наприклад, шляхом створення часткового вакууму за допомогою відповідного насоса або шляхом часткового заморожування або зріджування атмосфери, або шляхом застосування інертного газу, такого як азот або аргон, або шляхом застосування абсорбентів кисню, хоча висока ефективність таких абсорбентів, що призводить до дуже сильного зниження рівня кисню, зазвичай не є необхідною. Фармацевтичну композицію згідно винаходу можна зберігати в упаковці, при цьому переважній є блистерна упаковка або флакон. У такому разі формують упаковану композицію. Упаковка може бути надана за допомогою уловлювання і видалення вільного кисню. Композицію можна укласти в матеріал, істотним чином непроникний для газообміну, у вигляді упаковки, яка має атмосферу, що має необхідний понижений вміст кисню. Упаковка, істотним чином непроникна для газообміну, переважно, вибрана з групи, що складається з блистерної упаковки на основі двошарової алюмінієвої фольги, блістера, що складається з алюмінійполіхлор-3-фторетиленового гомополімера і полівінілхлоридного ламіната, або флакона. Фармацевтична композиція згідно винаходу має такий профіль розчинення, що щонайменше 80% арипіпразолу геміфумарату розчиняється в 0,1 Μ НСІ протягом 30 хвилин або щонайменше 80% арипіпразолу геміфумарату розчиняється в ацетатному буфері з рН 4,5 протягом 30 хвилин. Дослідження однорідності вмісту і розчиненню арипіпразолу з пігулок згідно Прикладу 23 показані нижче. На Фіг. 10 показані профілі розчинення арипіпразолу в 900 мл 0,1 Μ НСІ і в 900 мл ацетатного буфера, рН 4,5, що має, відповідно. Обидва профілі показують, що просіювання позитивно 11 впливає на розчинення, оскільки розчинення просіяного арипіпразолу геміфумарату відбувається на 17-19% швидше в 0,1 Μ НСІ і на 12-22% в ацетатному буфері. Надалі винахід пояснюється детальніше з посиланням на приклади і фігури. Приклади І. Синтез Приклад 1: Одержання арипіпразолу геміфумарату 4,8 г 7-(4-(4-(2,3-дихлорфеніл)-1-піперазініл)3,4-дигідро карбостирилу, одержаного, як описано в ЕР-В-0 367 141, приклад 1, розчиняли в 72 мл етанолу. До цього розчину додавали 0,6 г фумарової кислоти. Суспензію витримували при нагріванні із зворотним холодильником протягом 15 хвилин і потім охолоджували протягом 3 годин до кімнатної температури. Осад виділяли фільтруванням і висушували при 50°С при 40 мм. рт.ст. з одержанням арипіпразолу геміфумарату з виходом 94,8%. Діапазон плавлення: 187 - 192°С. 1Н ЯМР (ДМСО, діметилсульфоксид): δ 1,60 1,72 (4Н, m), 2,38 - 2,47 (4Н, m), 2,59 (4Н, bm), 2,99 (4Н, bm), 3,92 (2Н, t), 6,43 - 6,44 (1Н, d), 6,45 - 6,50 (1Н, dd), 6.60 (1Н, s), 7,02 - 7,05 (1Н, d), 7,12 - 7,15 (1Н, m), 7,29 - 7,31 (2Н, m) i 9,98 (1Н, s). Приклад 2: Одержання арипіпразолу геміфумарату з тетрагідрофурану 1,2 г 7-(4-(4-(2,3-дихлорфеніл)-1-піперазініл)3,4-дигідро карбостірилу розчиняли в 25 мл тетрагідрофурану. До цього розчину додавали 0,127 г фумарової кислоти. Суспензію витримували при 20 - 25°С протягом 12 годин. Осад виділяли фільтруванням і висушували при 50°С при 40 мм. рт.ст. з одержанням арипіпразолу геміфумарату з виходом 62,7%. Приклад 3: Одержання арипіпразолу геміфумарату з ацетонітрилу 1,2 г 7-(4-(4-(2,3-дихлорфеніл)-1-піперазініл)3,4-дигідро карбостірилу суспендували в 25 мл ацетонітрилу. До цієї суспензії додавали 0,127 г фумарової кислоти. Суспензію витримували при 20 - 25°С протягом 12 годин. Осад виділяли фільтруванням і висушували при 50°С при 40 мм. рт.ст. з одержанням арипіпразолу геміфумарату з виходом 89%. Приклад 4: Одержання арипіпразолу геміфумарату з метиленхлориду 1,2 г 7-(4-(4-(2,3-дихлорфеніл)-1-піперазініл)3,4-дигідро карбостірилу розчиняли в 25 мл метиленхлориду. До цього розчину додавали 0,127 г фумарової кислоти. Суспензію витримували при 20 - 25°С протягом 12 годин. Осад виділяли фільтруванням і висушували при 50°С при 40 мм. рт.ст. з одержанням арипіпразолу геміфумарату з виходом 76,8%. Приклад 5: Синтез неочищеного арипіпразолу Суспензію дихлорметану (50 мл) і 1-(2,3дихлорфеніл) піперазину гідрохлориду (4,65 г) перемішували протягом 10 хвилин, потім додавали розчин NAOH (0,71 г в 20 мл води; рН 7 - 8). Після перемішування протягом 30 хвилин шари 94624 12 розділяли і екстрагували водний шар одноразово за допомогою 10 мл дихлорметану. Органічні шари випаровували у вакуумі з одержанням 4 г 1(2,3-дихлорфеніл) піперазину у вигляді масла. До розчину 1-(2,3-дихлорфеніл) піперазину (4 г) в ацетонітрилі (20 мл) і воді (30 мл) додавали 4,8 г 7-(4-(4-(2,3-дихлорфеніл)-1-піперазініл)-3,4дигідрокарбостірилу, 0,2 г натрію іодіду і 2,6 мл триетиламіну при інтенсивному перемішуванні. Всю суміш далі нагрівали із зворотним холодильником протягом 3 годин і суспендували протягом 1 години при кімнатній температурі. Продукт фільтрували і промивали водою (10 мл). Одержаний неочищений арипіпразол був типом III згідно Aoki (Study on Crystal Transformation of Aripiprazole, The Fourth Japan-Korea Symposium on Separation Technology, p.937 (1996)). Фотографії частинок арипіпразолу типу III показані на Фіг. 12. Приклад 6: Одержання арипіпразолу геміфумарату з етанолу Неочищений арипіпрозол (2 г) розчиняли в етанолі (20 мл) при нагріванні із зворотним холодильником. До цього розчину додавали розчин фумарової кислоти (0,26 г, 50°С) в етанолі (5 мл). Суспензію витримували при нагріванні із зворотним холодильником протягом 15 хвилин, охолоджували до кімнатної температури і перемішували при кімнатній температурі протягом 2-3 годин. Кристали, що випали в осад, виділяли фільтруванням, промивали етанолом (2 мл) і висушували при 60°С. Вихід: 2,15 г (95%), середній розмір час2 тинок: 29 мкм, питома поверхня: 2,4 м /г. Приклад 7: Одержання арипіпразолу геміфумарату з суміші етанол-вода Неочищений арипіпрозол (1 г) суспендували в етанолі (10 мл) і воді (30 мл). Суспензію нагрівали до дистиляції для утворення розчину і додавали фумарову кислоту (0,15 г). Суспензію витримували при нагріванні із зворотним холодильником протягом 10 хвилин, охолоджували до кімнатної температури і перемішували при кімнатній температурі протягом 2-3 годин. Кристали, що випали в осад, виділяли фільтруванням, промивали сумішшю вода/етанол (5 мл) і висушували при кімнатнійтемпературі. Вихід: 1,08 г (96%). Приклад 8: Одержання арипіпразолу фумарату (1:1) типу II Неочищений арипіпрозол (2 г) суспендували в ацетонітрилі (30 мл) і воді (0,4 мл). Суспензію нагрівали до дефлегмації з утворенням розчину і додавали фумарову кислоту (0,58 г). Суспензію витримували при нагріванні із зворотним холодильником протягом 10 хвилин, охолоджували до кімнатної температури і перемішували при кімнатній температурі протягом 12 годин. Кристали, що випали в осад, виділяли фільтруванням, промивали ацетонітрилом (5 мл) і висушували при кімнатній температурі. Вихід: 2,47 г (98%). II. Фармацевтичні препарат Перорально розчинні таблетки А.) Сухе гранулювання Приклад 9: перорально розчинні таблетки з 5 мл діючої речовини 13 Арипіпразолу геміфумарат Ксиліт Мікрокристалічна целюлоза Кальцію силікат Кросповідон Аморфний кремнію діоксид Аспартам Аромат ванілі Магнію стеарат Разом 94624 14 Кількість / мл 5,65* 39,45 10,00 11,25 5,00 1,50 1,00 0,40 0,75 75,00 Кількість/мас.% 7,53 52,60 13,33 15,00 6,67 2,00 1,33 0,54 1,00 100 *відповідае 5 мл арипіпразолу Арипіпразол геміфумарат змішували у високошвидкісному змішувачі з усіма іншими ексципієнтами (за винятком частини магнію стеарату), додавали 0,25% магнію стеарату, суміш компактували за допомогою катка, одержані брикети подрібнювали і просівали, змішували з кількістю магнію стеарату, що залишилася, і пресували Арипіпразола геміфумарат Маніт Мікрокристалічна целюлоза Низькозаміщена 2-гідроксіпропілцелюлоза (НРС) Аспартам Аромат ванілі Кросповідон Кальцію силікат Магнію стеарат Разом Вода очищена в таблетки. Для диференціювання між різними дозами активного інгредієнта частину мікрокристалічної целюлози можна замінити різними барвниками, такими як оксиди заліза. Б.) Вологе гранулювання Приклад 10: перорально розчинні таблетки з 10 мл діючої речовини Кількість / мл 11,30* 81,90 12,00 9,00 1,00 0,80 12,00 20,00 2,00 150 достатня кількість Кількість/мас.% 7,53 54,60 8,00 6,00 0,67 0,53 8,00 13,34 1,33 100 Випаровується під час процесу *відповідає 10 мл арипіпразолу Маніт, мікрокристалічну целюлозу, низькозаміщену НРС, аспартам і кросповідон змішували у відповідному змішувачі і гранулювали за допомогою очищеної води. Одержаний гранулят висушували, просівали і змішували з арипіпразол геміфумаратом, ароматом ванілі і кальцію силікатом. В кінці додавали магнію стеарат і одержану суміш пресували в таблетки при тиску пресування < 60 N. Час розпаду знаходився в діапазоні від 10 до 20 с (вода очищена при 37°С, Європейська Фармакопея (Ph. Eur.)). Приклад 11: перорально розчинні таблетки з 10 мл діючої речовини 15 94624 Арипіпразолу геміфумарат Маніт Мікрокристалічна целюлоза (Avicel PH 101) Прежелатинізований крохмаль Аспартам Аромат ванілі Кросповідон Колоїдний кремнію діоксид Мікрокристалічна целюлоза (Avicel PH 112) Мікрокристалічна целюлоза і гуарова камедь (Avicel ЦЕ 15) Натрію лаурилсульфат Магнію стеарат Разом Вода очищена 16 Кількість / мл 11,30* 17,70 50,00 7,50 2,00 1,00 15,00 2,00 35,00 Кількість/мас.% 7,53 11,80 33,33 5,00 1,33 0,67 10,00 1,33 23,34 7,00 4,67 0,50 1,00 150 0,33 0,67 100.00 Випаровується під час процесу достатня кількість *відповідає 10 мл арипіпразолу Арипіпразол геміфумарат, маніт, мікрокристалічну целюлозу (Avicel PH 101), прежелатинізований крохмаль і половину кросповідона змішували у відповідному грануляторі і гранулювали за допомогою розчину натрію лаурилсульфату у воді. Гранули висушували і просівали, додавали всі інші Арипіпразола геміфумарат Ксиліт Мікрокристалічна целюлоза Низькозаміщену НРС Кросповідон Маніт Аромат ванілі Аспартам Магнію стеарат Разом Вода очищена інгредієнти і суміш з доданою змащуючою речовиною пресували в таблетки при тиску пресування < 60 N. Час розпаду знаходився в діапазоні від 10 до 20 сік (вода очищена при 37°С, Ph. Eur.). Приклад 12: перорально розчинні таблетки з 10 мл діючої речовини Кількість / мл 11,30* 55,91 30,48 9,00 10,00 30,00 0,81 1,00 1,50 150,00 достатня кількість Кількість/ мас.% 7,53 37,27 20,32 6,00 6,67 20,00 0,54 0,67 1,00 100 випаровується під час процесу *відповідає 10 мл арипіпразолу Ксиліт, Маніт, мікрокристалічну целюлозу, низькозаміщену НРС, аспартам і кросповідон змішували у відповідному змішувачі і гранулювали за допомогою очищеної води. Одержаний гранулят висушували, просівали і змішували з арипіпразолу геміфумаратом і ароматом ванілі. В кінці додавали магнію стеарат і одержану суміш пресували в таблетки круглої форми. Приклад 13: перорально розчинні таблетки з 10 мл діючої речовини 17 Арипіпразола геміфумарат Сахароза Повідон Діоксид кремнію, колоїдний безводий Натрію гліколят крохмалю Кукурудзяний крохмаль Аспартам Аромат ванілі Магнію стеарат Разом Вода очищена 94624 18 Кількість / мл 11,30* 65,27 4,35 1,09 10,00 53,73 0,69 2,07 1,50 150,00 достатня кількість Кількість/ мас.% 7,53 43,51 2,90 0,73 6,67 35,82 0,46 1,38 1,00 100 випаровується під час процесу *відповідає 10 мл арипіпразолу Арипіпразола геміфумарат, сахарозу і кукурудзяний крохмаль змішували в грануляторі. Гранулюючу рідину готували розчиненням повідону у очищеній воді і розпилювали на порошок суміші. Одержаний гранулят висушували і просівали. В Арипіпразола геміфумарат Ксиліт Магнію алюмосилікат Мікрокристалічна целюлоза Аспартам Аромат ванілі Кросповідон Магнію стеарат Разом Вода очищена кінці додавали аромат ванілі, аспартам, натрію гліколят крохмалю, діоксид кремнію і магнію стеарат і ожержану суміш пресували в таблетки. Приклад 14: перорально розчинні таблетки з 10 мл діючої речовини Кількість / мл 11,30* 80,47 22,50 22,50 3,00 0,23 9,00 1,00 150,00 достатня кількість Кількість/ мас.% 7,53 53,65 15,00 15,00 2,00 0,15 6,00 0,67 100,00 випаровується під час процесу *відповідає 10 мл арипіпразолу Арипіпразола геміфумарат, ксиліт, магнію алюмосилікат, частина мікрокристалічної целюлози, аспартам, ароматизатор і кросповідон змішували у відповідному змішувачі і гранулювали за допомогою очищеної води. Одержаний гранулят висушували, просівали і гомогенно змішували з Арипіпразола геміфумарат Мальтодекстрин (Maltrin QD) Мікрокристалічна целюлоза (Avicel PH 105) Мікрокристалічна целюлоза (Avicel PH 102) Аспартам Аромат ванілі Кросповідон Кальцію силікат Магнію стеарат Разом кількістю мікрокристалічної целюлози і залишковим магнію стеаратом. Одержану суміш для таблетування пресували в таблетки. В.) Пряме пресування Приклад 15: перорально розчинні таблетки з 10 мл діючої речовини Кількість / мл 11,30* 75,90 10,00 10,00 1,00 0,80 10,00 30,00 1,00 150 Кількість/ мас.% 7,53 50,60 6,67 6,67 0,67 0,53 6,67 20,00 0,66 100 *відповідає 10 мл арипіпразолу Всі інгредієнти, за винятком магнію стеарату, змішували у відповідному змішувачі. Магнію стеарат додавали в кінці і суміш для таблетування з доданою змащуючою речовиною пресували в таблетки з використанням пуансонів круглої форми. Час розпаду складав приблизно 20 секунд (очи щена вода при 37°С, Ph. Eur.) при міцності таблеток, рівній приблизно 50 N. Приклад 16: перорально розчинні таблетки з 10 мл діючої речовини 19 Арипіпразола геміфумарат llvl Pharmburst Ацесульфам К Аспартам Аромат ванілі Магнію стеарат Тальк Разом 94624 Кількість / мл 11,30* 133,00 0,22 0,23 2,25 1,50 1,50 150,00 20 Кількість/ мас.% 7,53 88,67 0,15 0,15 1,50 1,00 1,00 100 *відповідає 10 мл арипіпразолу Всі інгредієнти, за винятком магнію стеарату, гомогенно перемішували у відповідному змішувачі. Магнію стеарат додавали в кінці і суміш для таблетування з доданою змащуючою речовиною преАрипіпразола геміфумарат TM Pharmburst Сукралоза Аромат ванілі Натрію стеарилфумарат Разом сували в таблетки з використанням пуансонів круглої форми. Приклад 17: перорально розчинні таблетки з 10 мл діючої речовини Кількість / мл 11,30* 132,85 0,45 2,25 3,15 150,00 Кількість/ мас.% 7,53 88,57 0,30 1,50 2,10 100 *відповідає 10 мл арипіпразолу Всі інгредієнти, за винятком стеарату магнію гомогенно перемішували у відповідному змішувачі. Натрію стеарилфумарат додавали в кінці і суміш для таблетування з доданою змащуючою речовиАрипіпразола геміфумарат F-MELT** Натрію стеарилфумарат Разом ною пресували в таблетки з використанням пуансонів круглої форми. Приклад 18: перорально розчинні таблетки з 10 мл діючої речовини Кількість / мл 11,30* 137,20 1,50 150 Кількість / мас.% 7,53 91,47 1,00 100 *відповідає 10 мл арипіпразолу ® **F-MELT C містить Маніт, ксиліт, мікрокристалічну целюлозу, кросповідон і безводий двоосновний кальцію фосфат. ® F-MELT M містить Маніт, ксиліт, мікрокристалічну целюлозу, кросповідон і магнію алюмометасилікат. Були приготовані два рецепти з різним типом F-MELT. Арипіпразола геміфумарат Ксиліт Натрію гліколят крохмалю Крохмаль 1500 LM Аспартам Аромат ванілі Разом Арипіпразола геміфумарат і F-MELT гомогенно змішували у відповідному змішувачі. Додавали змащуючу речовину натрію стеарилфумарат, одержану суміш для таблетування пресували в таблетки. Г.) Формування Приклад 19: перорально розчинні таблетки з 10 мл діючої речовини Кількість / мл 11,30* 84,10 4,50 48,58 0,25 1,27 150,00 Кількість/ мас.% 7,53 56,07 3,00 32,39 0,17 0,84 100 *відповідає 10 мл арипіпразолу Всі інгредієнти гомогенно змішували і зволожували очищеною водою і замішували тістоподібну масу. Суміш формували пресуванням з викори станням пуансона круглої форми для одержання таблеток. Одержані таблетки висушували. Таблетки з негайним вивільненням: 21 А.) Пряме пресування Таблетки згідно прикладів 20 і 21 одержували прямим пресуванням. Фарбник оксид заліза (червоний) змішували з невеликою кількістю целактози і додавали до арипіпразолу геміфумарату, залишкові частини целаАрипіпразола геміфумарат Целактоза Мікрокристалічна целюлоза Натрій-кроськармелоза Магнію стеарат Оксид заліза Разом 94624 22 ктози, і всім іншим ексципієнтам у відповідному змішувачі. Всі інгредієнти гомогенно перемішували і пресували в таблетки з використанням пуансонів круглої форми. Приклад 20: таблетки з негайним вивільненням з 30 мл діючої речовини Кількість (мл) 33,88* 306,30 90,00 15,00 4,50 0,32 450,00 Кількість (мас.%) 7,5 68,1 20,0 3,3 1,0 0,07 100 Кількість (мл) 33,88* 356,30 40,30 15 4,50 0,32 450,00 Кількість (мас.%) 7,5 79,11 8,96 3,33 1,00 0,07 100 *відповідає 30 мл арипіпразолу Приклад 21: таблетки з негайним вивільненням з 30 мл діючої речовини Арипіпразола геміфумарат Целактоза Прежелатінізований крохмаль Кукурудзяний крохмаль Магнію стеарат Оксид заліза Разом *відповідає 30 мл арипіпразолу Б.) Вологе гранулювання Таблетки згідно прикладів 22 і 23 одержували вологим гранулюванням. Суміш арипіпразолу геміфумарату, лактози моногідрату, кукурудзяного крохмалю, гідроксипропілцелюлози і оксиду заліза зволожували очищеною водою і замішували тістоподібну масу. Арипіпразола геміфумарат Лактози моногідрат Кукурудзяний крохмаль Мікрокристалічна целюлоза Гідроксипропілцелюлоза Магнію стеарат Оксид заліза Разом Гранули висушували і просівали. В кінці додавали до сухого грануляту мікрокристалічну целюлозу і магнію стеарат і одержану суміш для таблетування пресували в таблетки з використанням пуансонів круглої форми. Приклад 22: таблетки з негайним вивільненням з 30 мл діючої речовини Кількість (мл) 33,88* 207,06 51,77 132,80 19,67 4,50 0,32 450,00 Кількість (мас.%) 7,5 46,0 11,5 29,5 4,4 1,0 0,07 100 *відповідає 30 мл арипіпразолу Приклад 23: таблетки з негайним вивільненням з 30 мл діючої речовини Суміш арипіпразолу геміфумарату і всіх інших інгредієнтів за винятком магнію стеарату зволожували очищеною водою і замішували тістоподібну масу. Вологі гранули висушували і просівали. В кінці додавали до сухого грануляту магнію стеарат і одержану суміш для таблетування пресували в таблетки з використанням пуансонів круглої форми діаметром 11 мм. 23 Арипіпразола геміфумарат Лактози моногідрат Кукурудзяний крохмаль Мікрокристалічна целюлоза Гідроксипропіл целюлоза Магнію стеарат Оксид заліза Разом 94624 24 Кількість (мл) 33,88* 296,76 52,06 52,06 10,41 4,50 0,32 450,00 Кількість (мас.%) 7,5 65,9 11,6 11,6 2,3 1,0 0,07 100 *відповідає 30 мл арипіпразолу Приклад 24: Результати визначення однорідності вмісту арипіпразолу в пігулках згідно Прикладу 23 Таблиця 1: Однорідність вмісту арипіпразолу в таблетках, які одержані просіюванням арипіпразо 1 2 3 4 5 6 7 8 9 10 середнє стандартне відхилення відносне стандартне відхилення дисперсійний аналіз Як можна бачити, вміст арипіпразолу в таблетках, які одержані просіюванням арипіпразолу геміфумарату з частиною розчинника перед гранулюванням, є однорідніше розподіленим, ніж в таблетках без просіювання активного інгредієнта перед процесом гранулювання. лу геміфумарату з частиною розчинника перед гранулюванням, порівняно з однорідністю вмісту в таблетках, одержаних без просіювання. Вміст арипіпразолу (%) без просіювання з просіюванням 104,7 100,1 103,1 100,4 107,3 103,4 100,5 104,8 103,5 100,9 107,5 101,5 101,2 101,8 104,1 101,8 102,0 101,9 103,3 103,5 103,7 102,0 2,31 1,5 2,23 1,5 7,74 4,1 Приклад 25: Одержання аморфного арипіпразолу геміфумарату Аморфну форму арипіпразолу геміфумарату одержували нагріванням кристалічного арипіпразолу геміфумарату до температури, рівної вище 203°С, з подальшим охолоджуванням в кризі. 25 94624 26 27 94624 28 29 94624 30 31 94624 32 33 94624 34 35 Комп’ютерна верстка Л. Купенко 94624 Підписне 36 Тираж 24 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюAripiprazole hemifumarate and process for its preparation
Автори англійськоюMerslavic, Marjo, Gojak, Urska, Smrkolj, Matej, Bombek, Sergeja, Stefanic, Marko, Vajs Anamarija, Kroselj, Vesna
Назва патенту російськоюАрипипразола гемифумарат и способ его получения
Автори російськоюМерславик Марио, Гойяк Урска, Смрколь Матей, Бомбек Сергея, Стефаник Марко, Вайс Анамария, Кросель Весна
МПК / Мітки
МПК: A61P 25/18, C07D 215/22, A61K 31/496
Мітки: спосіб, геміфумарат, одержання, аріпіпразолу
Код посилання
<a href="https://ua.patents.su/18-94624-aripiprazolu-gemifumarat-i-sposib-jjogo-oderzhannya.html" target="_blank" rel="follow" title="База патентів України">Арипіпразолу геміфумарат і спосіб його одержання</a>
Попередній патент: Спосіб і пристрій для виготовлення розплавленого чавуну
Наступний патент: Клапан регулювання витрати
Випадковий патент: Спосіб зміни кліматичних умов на планетах що мають атмосферу