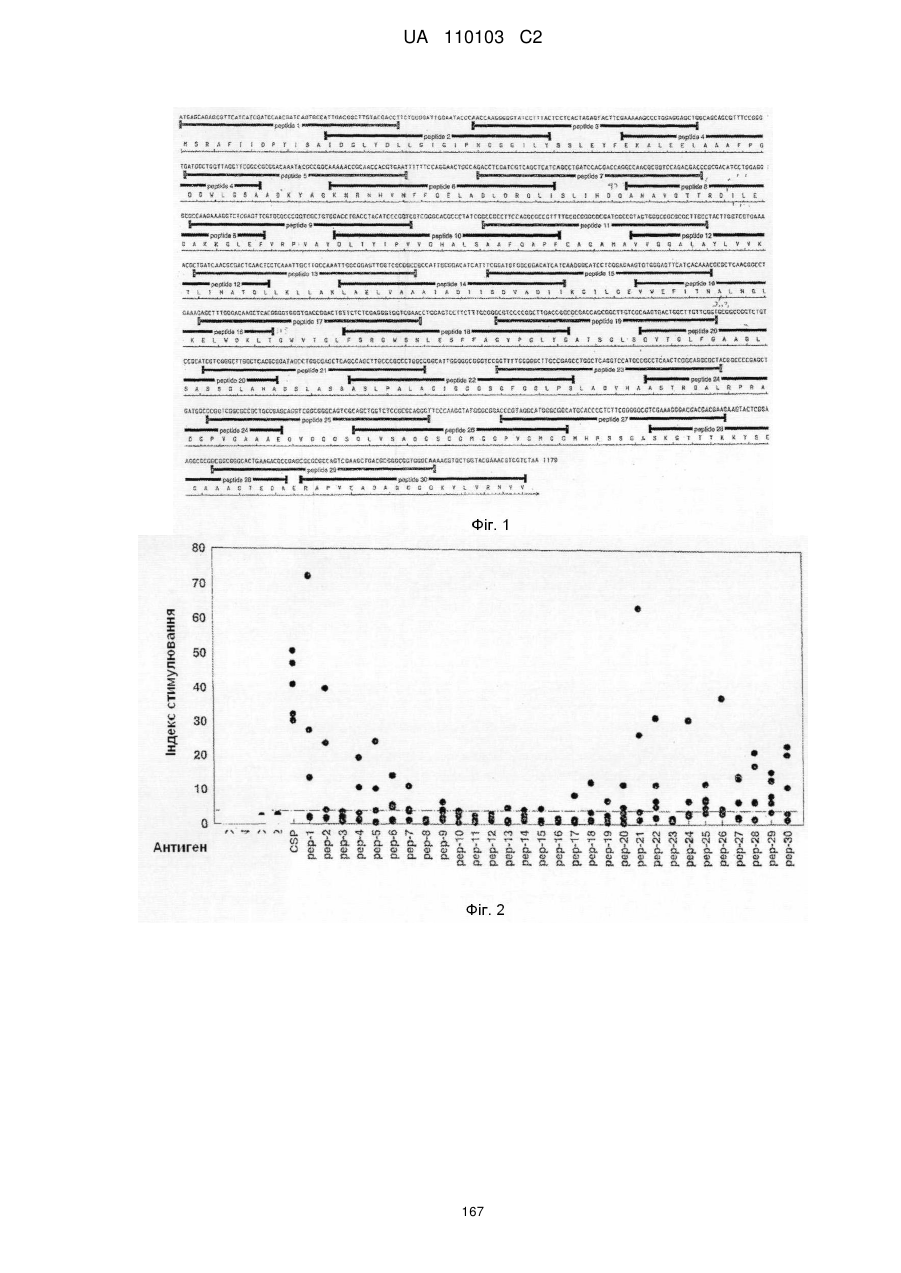
Модифікований туберкульозний антиген
Номер патенту: 110103
Опубліковано: 25.11.2015
Автори: елінас Анн-Марі, Браун Джеймс, Мюрфі Денніс, Меттенс Паскаль, Блейс Норманд
Формула / Реферат
1. Модифікований білок Rv3616c, що включає амінокислотну послідовність SEQ ID No: 163.
2. Модифікований білок Rv3616c згідно з пунктом 1, що складається з амінокислотної послідовності SEQ ID No: 163.
3. Модифікований білок Rv3616c, що включає амінокислотну послідовність SEQ ID No: 164.
4. Модифікований білок Rv3616c згідно з пунктом 3, що складається з амінокислотної послідовності SEQ ID No: 164.
5. Модифікований білок Rv3616c, що включає амінокислотну послідовність SEQ ID No: 165.
6. Модифікований білок Rv3616c згідно з пунктом 5, що складається з амінокислотної послідовності SEQ ID No: 165.
7. Модифікований білок Rv3616c, що включає амінокислотну послідовність SEQ ID No: 166.
8. Модифікований білок Rv3616c згідно з пунктом 7, що складається з амінокислотної послідовності SEQ ID No: 166.
9. Модифікований білок Rv3616c, що включає амінокислотну послідовність SEQ ID No: 167.
10. Модифікований білок Rv3616c згідно з пунктом 9, що складається з амінокислотної послідовності SEQ ID No: 167.
11. Модифікований білок Rv3616c, що включає амінокислотну послідовність SEQ ID No: 168.
12. Модифікований білок Rv3616c згідно з пунктом 11, що складається з амінокислотної послідовності SEQ ID No: 168.
13. Модифікований білок Rv3616c, що включає амінокислотну послідовність SEQ ID No: 169.
14. Модифікований білок Rv3616с згідно з пунктом 13, що складається з амінокислотної послідовності SEQ ID No: 169.
15. Модифікований білок Rv3616c згідно з будь-яким з пунктів 1-14, де вказаний білок має менше, ніж 500 амінокислотних залишків у довжину.
16. Модифікований білок Rv3616c згідно з пунктом 15, де вказаний білок має менше, ніж 400 амінокислотних залишків у довжину.
17. Модифікований білок Rv3616c за будь-яким з пп. 1-16, який є представленим у вигляді фармацевтичної композиції, що додатково включає фармацевтично прийнятний носій або наповнювач.
18. Модифікований білок Rv3616c за будь-яким з пп. 1-16, який є представленим у вигляді фармацевтичної композиції, що додатково включає енхансер неспецифічної імунної відповіді.
19. Модифікований білок Rv3616c за будь-яким з пп. 1-16, який є представленим у вигляді гібридного білка, що додатково включає додатковий гетерологічний поліпептид.
20. Спосіб лікування, поліпшення стану або запобігання туберкульозу, що полягає у введенні ефективної кількості модифікованого білка Rv3616c згідно з будь-яким з пп. 1-16 суб'єкту, який цього потребує, де вказаний поліпептид викликає імунну відповідь.
21. Спосіб за п. 20 для запобігання реактивації туберкульозу.
22. Спосіб за п. 20 для затримування реактивації туберкульозу.
23. Спосіб за п. 20 для лікування латентного туберкульозу.
24. Спосіб за п. 20 для запобігання латентному туберкульозу.
25. Спосіб за п. 20 для лікування туберкульозу.
26. Спосіб за п. 20 для запобігання туберкульозу.
27. Полінуклеотид, що включає послідовність, яка кодує модифікований білок Rv3616c за будь-яким з пп. 1-16.
28. Полінуклеотид за п. 27, що включає послідовність, яка кодує поліпептид, який включає амінокислотну послідовність SEQ ID No: 163.
29. Полінуклеотид за п. 27, що включає послідовність, що кодує поліпептид, який включає амінокислотну послідовність SEQ ID No: 164.
30. Полінуклеотид за п. 27, що включає послідовність, що кодує поліпептид, який включає амінокислотну послідовність SEQ ID No: 165.
31. Полінуклеотид за п. 27, що включає послідовність, що кодує поліпептид, який включає амінокислотну послідовність SEQ ID No: 166.
32. Полінуклеотид за п. 27, що включає послідовність, що кодує поліпептид, який включає амінокислотну послідовність SEQ ID No: 167.
33. Полінуклеотид за п. 27, що включає послідовність, що кодує поліпептид, який включає амінокислотну послідовність SEQ ID No: 168.
34. Полінуклеотид за п. 27, що включає послідовність, що кодує поліпептид, який включає амінокислотну послідовність SEQ ID No: 169.
35. Полінуклеотид за будь-яким з пп. 27-34, який є представленим у формі фармацевтичної композиції, що додатково включає фармацевтично прийнятний носій або наповнювач.
36. Полінуклеотид за будь-яким з пп. 27-34, який включає послідовність, що кодує гібридний білок відповідно за п. 19.
37. Спосіб лікування, поліпшення стану або запобігання туберкульозу, що полягає у введенні ефективної кількості полінуклеотиду за будь-яким з пп. 27-34 суб'єкту, який цього потребує, де вказаний поліпептид індукує імунну відповідь.
38. Спосіб за п. 37 для запобігання або реактивації туберкульозу.
39. Спосіб за п. 37 для затримування реактивації туберкульозу.
40. Спосіб за п. 37 для лікування латентного туберкульозу.
41. Спосіб за п. 37 для запобігання латентного туберкульозу.
42. Спосіб за п. 37 для лікування туберкульозу.
43. Спосіб за п. 37 для запобігання туберкульозу.
Текст
Реферат: Винахід стосується модифікованих білків Rv3616c та їх застосування як лікарських засобів, особливо для запобігання та лікування туберкульозу. UA 110103 C2 (12) UA 110103 C2 UA 110103 C2 5 10 15 20 25 30 35 40 45 50 55 60 Заявлений винахід стосується модифікованих білків Mycobacterium tuberculosis Rv3616c, асоційованих полінуклеотидів та застосування таких білків та полінуклеотидів у лікуванні або у попередженні туберкульозу, зокрема застосування у лікуванні або у попередженні латентного туберкульозу та у попередженні або для затримки реактивування туберкульозу. Туберкульоз (TB) є хронічним інфекційним захворюванням, спричиненим інфекцією з Mycobacterium tuberculosis та іншими видами Mycobacterium. Туберкульоз є основним захворюванням у країнах, що розвиваються та являє собою зростаючу проблему у розвинених регіонах світу. Вважається, що більш ніж 2 млрд. людей у світі інфіковано бацилами туберкульозу, щороку виникають біля 9.2 млн. нових випадків цієї хвороби та 1.7 млн. випадків смерті через туберкульоз. Активна форма туберкульозу розвивається у 10 % інфікованих бацилами TB людей та кожна особа з активною формою TB інфікує в середньому 10-15 інших осіб протягом року. У той час, як щорічна захворюваність досягла свого піку в глобальному масштабі, число смертей та випадків хвороби, як і раніше, зростає через зростання населення (World Health Organisation Tuberculosis Facts 2008). Інфекція Mycobacterium tuberculosis передається дихальним шляхом. Альвеолярні макрофаги поглинають бактерію, але вона здатна вижити та розмножитися інгібуванням злиття фагосоми з кислими лізосомами. Комплексна імунна відповідь, що виникає за участю CD4+ та CD8+T клітин, в кінцевому рахунку, веде до утворення гранульоми. Головним фактором успіху Mycobacterium tuberculosis як патогена, є те, що ізольована, але не знищена бактерія може зберігатися протягом тривалого періоду, що робить пацієнтів уразливими для подальшого розвитку активного туберкульозу. У перші декілька років після інфікування, активний туберкульоз розвивається у менш, ніж 5 % інфікованих осіб. Гранульоми можуть зберігатися протягом десятиліть, та, як вважають, містять живі Mycobacterium tuberculosis у стані спокою, позбавленому кисню, поживних речовин тощо. Однак, нещодавно було висловлено припущення, що більшість бактерій у стані спокою локалізовано у немакрофагових типах клітин, що поширюються по всьому тілу (Locht et al, Expert Opin. Biol. Ther. 2007 7(11):1665-1677). Розвиток активного TB виникає, коли змінюється баланс між природним імунітетом хазяя та патогеном, наприклад, у результаті імуносупресивної події (Anderson P Trends in Microbiology 2007 15(1):7-13; Ehlers S Infection 2009 37(2):87-95). Також запропоновано динамічну гіпотезу, що описує баланс між латентним та активним TB (Cardana P-J Inflammation & Allergy – Drug Targets 2006 6:27-39; Cardana P-J Infection 2009 37(2):80-86). Хоча, протягом значного періоду часу реакція може бути безсимптомною, активне захворювання найбільш часто проявляється у вигляді гострого запалення легенів, що веде до втоми, втрати ваги, лихоманці та постійного кашлю. При відсутності лікування, це звичайно веде до серйозних ускладнень та смерті. Звичайно, туберкульоз можна контролювати з застосуванням тривалої антибіотичної терапії, хоча такого лікування буде недостатньо для запобігання поширення захворювання. Активно інфіковані особи можуть деякий час не мати симптомів, але бути заразними. Додатково, хоча дотримання режиму лікування є критичним, поведінку пацієнта дуже важко контролювати. Деякі пацієнти не проходять до кінця курс лікування, що може привести до безуспішності лікування та розвитку стійкості до ліків. Стійкій до багатьох ліків туберкульоз (MDR-TB) є формою, на яку не в змозі дати відповідь препарати першої лінії. MDR-TB складає 5 % всіх випадків на туберкульоз та, за оцінками, щороку трапляється 490,000 нових випадків на MDR-TB. Туберкульоз з широкою лікарською стійкістю (XDR-TB) виникає на піці MDR-TB при розвитку стійкості до препаратів другої лінії. За оцінками, щороку трапляється 40,000 нових випадків на XDR-TB, що практично не піддаються лікуванню (World Health Organisation Tuberculosis Facts 2008). Навіть при закінченні повного антибіотичного курсу лікування у інфікованого пацієнта, інфекція M. tuberculosis може бути до кінця не винищеною та може зберігатися у якості латентної інфекції, що може бути реактивованою. Для контролю поширення туберкульозу, величезне значення мають ефективна програма вакцинації та точна рання діагностика захворювання. На даний час, найбільш широко застосованим способом отримання захисного імунітету є вакцинація живою бактерією. Найбільш поширеною бактерією роду Mycobacterium, що застосовують з цією метою, є Bacillus Calmette-Guerin (BCG), авірулентний штам M. Bovis, що був вперше розроблений ще понад 60 років тому. Однак, безпечність та ефективність BCG є джерелом суперечок - в той час, як він захищає проти тяжких проявів захворювання у дітей, він не запобігає утворенню латентного TB або реактивуванню хвороби легень у дорослих. Крім того, деякі країни, як то Сполучені Штати, не вакцинують населення цим агентом. Майже все нові покоління туберкульозних вакцин, що на даний час знаходяться в стадії клінічної розробки, створюють у вигляді вакцин попереднього впливу. Вони охоплюють субодиничні вакцини, що особливо ефективні для індукування 1 UA 110103 C2 5 10 15 20 25 30 35 40 45 50 55 60 підвищеного імунітету перед вакцинацією BCG та розвинуті живі мікобактеріальні вакцини, що спрямовані замінити BCG більш ефективними та /або безпечними штамами. Хоча метою цих вакцин є підвищення стійкості до інфекції, вони, ймовірно, будуть менш ефективними у якості вакцин попереднього впливу або терапевтичних вакцин у випадках латентного TB (Lin MY et al Endocrine, Metabolic & Immune Disorders – Drug Targets 2008 8:15-29). Приклад 2 у US20080269151 стосується клонування, отримання та експресії деяких модифікованих білків Rv3616c, в тому числі: ΔTM-1, поліпептиду Rv3616c, з делецією залишків 150-160 (SEQ ID No: 22 у US20080269151); ΔTM-2, поліпептиду Rv3616c, з делецією залишків 101-203 (SEQ ID No: 24 у US20080269151); та послідовності, де залишки Rv3616c 150-160 заміщені антигеном TbH9 (SEQ ID No: 60 у US20080269151). Заявлений винахід головним чином стосується застосування модифікованих поліпептидів Rv3616c або полінуклеотиду, що їх кодує, у галузі дослідження латентних мікобактеріальних інфекцій. Крім того, заявлений винахід стосується окремих модифікованих білків Rv3616c. Винахідники несподівано відкрили, що порушення гідрофобності окремого регіону послідовності Rv3616c може привести до підвищеної експресії без негативного впливу на імуногенні властивості. Модифіковані білки Rv3616c застосовують у якості TB антигенів, зокрема, антигенів латентного TB. У самому широкому аспекті, заявлений винахід стосується модифікованого білка Rv3616c, де порушена гідрофобність амінокислотних залишків, що відповідають залишкам 134-183 послідовності H37Rv, відповідно, модифікованого білка Rv3616c, де порушена гідрофобність амінокислотних залишків, що відповідають залишкам 135-154 послідовності H37Rv. У одному аспекті винаходу, передбачено модифікований білок Rv3616c, де вищезгаданий модифікований білок Rv3616c містить перший поліпептид та другий поліпептид, де перший поліпептид розміщений по напрямку до С-кінця модифікованого білку Rv3616c відносно другого поліпептиду та: (i) перший поліпептид є послідовністю, що має принаймні 90 % тотожності до залишків 1133 SEQ ID No:1; та (ii) другий поліпептид є послідовністю, що має принаймні 90 % тотожності до залишків 184392 SEQ ID No:1; де перший та другий поліпептиди є безпосередньо або небезпосередньо зв'язаними. У другому аспекті винаходу передбачено модифікований білок Rv3616c, де вищезгаданий модифікований білок Rv3616c містить перший та другий поліпептиди, де перший поліпептид розміщений по напрямку до С-кінця модифікованого білку Rv3616c відносно до другого поліпептиду та де: (i) перший поліпептид є безперервною послідовністю у принаймні 100 амінокислот у межах залишків 1-133 SEQ ID No:1; та (ii) другий поліпептид є безперервною послідовністю у принаймні 155 амінокислот у межах залишків 184-392 SEQ ID No:1; де перший та другий поліпептиди є безпосередньо або небезпосередньо зв'язаними. У третьому аспекті винаходу передбачено модифікований білок Rv3616c, вищезгаданий білок, що містить, або, альтернативно, головним чином складається або складається з послідовності Rv3616c, у якій принаймні одна амінокислота (наприклад, принаймні дві) видалена з регіону, що відповідає залишкам 134-183 у SEQ ID No:1. Четвертий аспект винаходу передбачає модифікований білок Rv3616c, вищезгаданий білок, що містить перший поліпептид та другий поліпептиди, де перший поліпептид розміщений по напрямку до N-кінця відносно другого поліпептиду та: (i) перший поліпептид є безперервною послідовністю у принаймні 100 амінокислот у межах залишків 1-133 SEQ ID No:1; та (ii) другий поліпептид є безперервною послідовністю у принаймні 155 амінокислот у межах залишків 184-392 SEQ ID No:1; де перший та другий поліпептиди є безпосередньо або небезпосередньо зв'язаними через третій поліпептид та вказаний третій поліпептид відповідає залишкам 134-183 у SEQ ID No:1, де видалена принаймні одна амінокислота (наприклад, принаймні дві). П'ятий аспект винаходу передбачає модифіковані білки Rv3616c, що містять перший та другий поліпептиди, де перший поліпептид розміщений по напрямку до N-кінця відносно другого поліпептиду та: (i) перший поліпептид є безперервною послідовністю у принаймні 100 амінокислот у межах залишків 1-134 SEQ ID No:1; та (ii) другий поліпептид є безперервною послідовністю у принаймні 175 амінокислот у межах залишків 155-392 SEQ ID No:1; 2 UA 110103 C2 5 10 15 20 25 30 35 40 45 50 55 60 де перший та другий поліпептиди є або безпосередньо зв'язаними між собою або небезпосередньо зв'язаними через третій поліпептид, де вказаний третій поліпептид відповідає залишкам 135-154 у SEQ ID No:1, де видалена принаймні одна амінокислота (наприклад, принаймні дві). Шостий аспект винаходу передбачає модифікований білок Rv3616c, де вказаний білок містить перший та другий поліпептиди, де перший поліпептид розміщений по напрямку до Nкінця відносно другого поліпептиду та де: (i) перший поліпептид є послідовністю, що має принаймні 90 % тотожності до залишків 1133 SEQ ID No:1; та (ii) другий поліпептид є послідовністю, що має принаймні 90 % тотожності до залишків 184392 SEQ ID No:1; де перший та другий поліпептиди є безпосередньо зв'язаними між собою або небезпосередньо зв'язаними через третій поліпептид, де вказаний третій поліпептид має принаймні 90 % тотожності до послідовності, відповідній залишкам 134-183 у SEQ ID No:1, де видалена суміжна частина з принаймні трьох амінокислот (наприклад, принаймні чотири амінокислоти). Сьомий аспект винаходу передбачає модифіковані білки Rv3616c, що містять перший та другий поліпептиди, де перший поліпептид розміщений по напрямку до N-кінця відносно другого поліпептиду та: (i) перший поліпептид є послідовністю, що має принаймні 90 % тотожності до залишків 1134 SEQ ID No:1; та (ii) другий поліпептид є послідовністю, що має принаймні 90 % тотожності до залишків 155392 SEQ ID No:1; де перший та другий поліпептиди або безпосередньо зв'язаними між собою або небезпосередньо зв'язаними через третій поліпептид та вказаний третій поліпептид має принаймні 80 % тотожності до послідовності, відповідній залишкам 135-154 у SEQ ID No:1, де видалена суміжна частина з принаймні трьох амінокислот (наприклад, принаймні чотири амінокислоти). Восьмим аспектом винаходу передбачено модифікований білок Rv3616c, де вказаний білок містить послідовність Rv3616c, де суміжна частина з принаймні трьох амінокислот (наприклад, принаймні чотири амінокислоти) з регіону, відповідному залишкам 134-183 у SEQ ID No:1 заміщена гідрофільними залишками. Модифіковані білки Rv3616c можуть бути на основі послідовності білку дикого типу Rv3616c будь-якого штаму M. Tuberculosis, наприклад, будь-яку з послідовностей SEQ ID Nos: 3-7, зокрема, будь-яку з послідовностей SEQ ID Nos: 3-6, можна застосувати замість SEQ ID No:1 у попередніх втіленнях. Зразковими модифікованими білками Rv3616c, відповідно до заявленого винаходу є такі білки, що містять амінокислотні послідовності, наведені, як SEQ ID Nos: 161-169, 179 та 180 (наприклад, що складаються з амінокислотних послідовностей, вказаних, як SEQ ID Nos: 161-169, 179 та 180). Особливий інтерес викликають білки, що містять амінокислотні послідовності, вказані, як SEQ ID Nos: 161, 163-169, 179 та 180 (наприклад, що складаються з амінокислотних послідовностей, вказаних, як SEQ ID Nos: 161, 163-169, 179 та 180). Також передбачено модифіковані білки Rv3616c для застосування в якості лікарських засобів. Подальший аспект винаходу стосується способу індукування імунної відповіді у суб'єкті, що полягає у введенні модифікованого білку Rv3616c. Подальший аспект винаходу стосується способу лікування, поліпшення стану або запобіганню TB, що полягає у введенні суб'єкту у разі потреби ефективної кількості модифікованого білку Rv3616c, де вищезгаданий поліпептид викликає імунну відповідь. У іншому аспекті, спосіб додатково полягає у викликанні імунної відповіді проти Mycobacterium tuberculosis. Застосування модифікованого білку Rv3616c у виробництві лікарського засобу для лікування, поліпшення стану або запобігання TB, являє собою інший аспект винаходу. Заявлений винахід стосується полінуклеотиду, що містить послідовність нуклеїнової кислоти, що кодує модифікований білок Rv3616c. Зразковими полінуклеотидами, що містять послідовність нуклеїнової кислоти, що кодує модифікований білок Rv3616c є ті, що містять нуклеотидні послідовності, що відповідають SEQ ID Nos: 170-178, як то ті, що складаються з нуклеотидних послідовностей, що відповідають SEQ ID Nos: 170-178. Іншими типовими полінуклеотидами, що містять послідовності нуклеїнової кислоти, що кодують модифіковані білки Rv3616c є ті, що містять (наприклад, складаються з) нуклеотидні послідовності, що кодують амінокислотні послідовності, що надані у SEQ ID Nos: 161-169, 179 або 180, як то SEQ ID Nos: 161, 163-169, 179 або 180. 3 UA 110103 C2 5 10 15 20 25 30 35 40 45 50 55 60 Також передбачено полінуклеотид, що містить послідовність нуклеїнової кислоти, що кодує модифікований білок Rv3616c для застосування у якості лікарського засобу. Подальший аспект винаходу стосується способу, що викликає у суб'єкта імунну відповідь та полягає у введенні полінуклеотиду, що містить послідовність нуклеїнової кислоти, що кодує модифікований білок Rv3616c. Подальший аспект винаходу стосується способу лікування, поліпшення стану, затримування або попередження реактивування туберкульозу, що полягає у введенні суб'єкту у разі потреби ефективної кількості полінуклеотиду, що містить послідовність нуклеїнової кислоти, що кодує модифікований білок Rv3616c, де вищезгаданий поліпептид викликає імунну відповідь. У іншому аспекті, спосіб додатково полягає у викликанні імунної відповіді проти Mycobacterium tuberculosis. Застосування полінуклеотиду, що містить послідовність нуклеїнової кислоти, що кодує поліпептид, що містить модифікований білок Rv3616c у виробництві лікарського засобу для лікування, поліпшення стану або запобігання TB, являє собою інший аспект винаходу. Крім того, передбачено фармацевтичну композицію, що містить: (a) модифікований білок Rv3616c; або (b) полінуклеотид, що містить послідовність нуклеїнової кислоти, що кодує модифікований білок Rv3616c; та (c) фармацевтично прийнятний носій або наповнювач. Передбачено імуногенну композицію, що містить: (a) модифікований білок Rv3616c; або (b) полінуклеотид, що містить послідовність нуклеїнової кислоти, що кодує модифікований білок Rv3616c; та (c) підсилювач неспецифічної імунної відповіді. Також, передбачено вектор експресії, що містить послідовність нуклеїнової кислоти, що кодує модифікований білок Rv3616c. Наступним аспектом винаходу є клітина-хазяїн, трансформована вищезгаданим вектором експресії. Крім того, передбачено клітину - хазяїна, що рекомбінантно експресує модифікований білок Rv3616c. Далі, передбачено спосіб отримання модифікованого білку Rv3616c, де вищезгаданий спосіб полягає у застосуванні стадії рекомбінантної експресії вказаного поліпептиду у клітині - хазяїні. Також передбачено діагностичні набори, що містять: (a) модифікований білок Rv3616c; (b) обладнання, необхідне для контакту вказаного модифікованого білку Rv3616c зі зразком (наприклад, цільної крові або більш прийнятних МКПК (мононуклеарних клітин периферичної крові)) суб'єкта; та (c) засоби для кількісного аналізу Т - клітинної відповіді зразка. Інший аспект винаходу стосується діагностичного набору, що містить: (a) модифікований білок Rv3616c; та (b) обладнання, необхідне для контакту вказаного модифікованого білку Rv3616c з клітинами шкіри пацієнта. Подальший аспект винаходу стосується способу визначення інфекції Mycobacterium tuberculosis у суб'єкті, що полягає у: (a) контакті зразка з вищезгаданим суб'єктом з модифікованим білком Rv3616c; та (b) визначення у біологічному зразку присутності антитіл, що зв'язуються з модифікованим білком Rv3616c. Винаходом також передбачено діагностичний набор, що містить: (a) модифікований білок Rv3616c, що вибірково іммобілізований на твердій поверхні; та (b) реагент для виявлення. У одному втіленні, суб'єкт отримання модифікованого білку Rv3616c, полінуклеотиду або композиції відповідно до винаходу може мати активну форму туберкульозу (наприклад, активну інфекцію M. tuberculosis). У другому втіленні, суб'єкт може мати латентний туберкульоз (наприклад, дрімаючу інфекцію M. tuberculosis). У третьому втіленні, суб'єкт може бути вільним від туберкульозу (наприклад, не мати інфекцію M. tuberculosis). Суб'єкт отримання модифікованого білку Rv3616c, полінуклеотиду або композиції відповідно до винаходу може попередньо бути вакцинованим проти туберкульозу (наприклад, вакцинованим проти інфекції M. tuberculosis), наприклад, може бути вакцинованим Bacillus Calmette-Guerin (BCG). Альтернативно, суб'єкт отримання поліпептиду, полінуклеотиду або композиції винаходу може не бути попередньо вакцинованим проти туберкульозу (наприклад, може не бути вакцинованим проти інфекції M. tuberculosis), як то, може не бути вакцинованим Bacillus Calmette-Guerin (BCG). 4 UA 110103 C2 5 10 15 20 25 30 35 40 45 50 55 60 Модифікований білок Rv3616c, полінуклеотид або композиція відповідно до винаходу можуть бути надані з метою: - лікування активного туберкульозу; - запобігання активного туберкульозу (як то введенням неінфікованому суб'єкту або, альтернативно, суб'єкту, що має латентну інфекцію); - лікування латентного туберкульозу; - запобігання латентного туберкульозу; або запобігання або затримування реактивування туберкульозу (особливо, затримування реактивування туберкульозу, наприклад, на кілька місяців, років або навіть на невизначений строк). Також передбачено спосіб лікування латентного туберкульозу, що полягає у застосуванні етапів: (i) ідентифікування суб'єкта на наявність латентної туберкульозної інфекції (наприклад, за допомогою PPD або аналізів з T - клітинами); та (ii) введення вищезгаданому суб'єкту безпечної та ефективної кількості модифікованого білку Rv3616c або полінуклеотиду, що кодує модифікований білок Rv3616c (як то, у вигляді фармацевтичної або імуногенної композиції). Також запропоновано застосування поліпептиду заявленого винаходу у виробництві діагностичного набору для ідентифікації туберкульозу (наприклад, латентного туберкульозу) у піддослідного суб'єкта. Опис фігур Фіг. 1: Вирівнювання пептиду Rv3616c штаму повнорозмірною послідовністю. Фіг. 2: МКПК, відповідні пептидам Rv3616c. Фіг. 3: Відсоток CD4 та CD8 клітин від імунізованих мишей CB6F1, що експресують гамма - інтерферон та/або інтерлейкін - 2 (IL-2) та/або TNF - альфа цитокіни на 21 день (тобто, через 7 днів після другої імунізації). Фіг. 4: Цитокіновий профіль на 21 день (тобто, через 7 днів після другої імунізації) відповіді антиген - специфічних клітин CD4 у імунізованих мишей CB6F1. Фіг. 5: Цитокіновий профіль на 21 день (тобто, через 7 днів після другої імунізації) відповіді антиген - специфічних клітин CD8 у імунізованих мишей CB6F1. Фіг. 6: Відсоток клітин CD4 та CD8 від імунізованих мишей CB6F1, що експресують гамма-інтерферон та/або IL-2 та/або TNF- альфа цитокіни на 35 день (тобто, через 7 днів після третьої імунізації). Фіг. 7: Цитокіновий профіль на 35 день (тобто, через 7 днів після третьої імунізації) відповіді антиген - специфічних клітин CD4 у імунізованих мишей CB6F1. Фіг. 8 Цитокіновий профіль на 35 день (тобто, через 7 днів після третьої імунізації) відповіді антиген - специфічних клітин CD8 у імунізованих мишей CB6F1. Фіг. 9: Відсоток клітин CD4 та CD8 від імунізованих мишей C57BL/6, що експресують гамма-інтерферон та/або IL-2 та/або TNF- альфа цитокіни на 21 день (тобто, через 7 днів після другої імунізації). Фіг. 10: Цитокіновий профіль на 21 день (тобто, через 7 днів після другої імунізації) відповіді антиген - специфічних клітин CD4 у імунізованих мишей C57BL/6. Фіг. 11: Відсоток клітин CD4 та CD8 від імунізованих мишей C57BL/6, що експресують гамма-інтерферон та/або IL-2 та/або TNF- альфа цитокіни на 35 день (тобто, через 7 днів після третьої імунізації). Фіг. 12: Цитокіновий профіль на 35 день (тобто, через 7 днів після третьої імунізації) відповіді антиген - специфічних клітин CD4 у імунізованих мишей C57BL/6. Фіг. 13: Цитокіновий профіль на 35 день (тобто, через 7 днів після третьої імунізації) відповіді антиген - специфічних клітин CD8 у імунізованих мишей C57BL/6. Фіг. 14: Т- клітинні відповіді антиген - специфічних клітин CD4 у інтактних (без імуносупресивного лікування) та латентно інфікованих людей. Фіг. 15: Вирівнювання послідовностей білку дикого типу Rv3616c. Фіг. 16A та 16B: Вирівнювання типових послідовностей модифікованого білку Rv3616c. Фіг. 17: Результати перших експериментів по експресії антигену, отримані за допомогою електрофорезу в поліакриламідному гелі в присутності додецилсульфату натрію (SDS-PAGE). Фіг. 18: Результати подальших експериментів по експресії антигену, отримані за допомогою електрофорезу в поліакриламідному гелі в присутності додецилсульфату натрію (SDS-PAGE). Фіг. 19: Результати додаткових експериментів по експресії антигену, отримані за 5 UA 110103 C2 5 10 15 20 25 30 35 40 45 50 55 60 допомогою електрофорезу в поліакриламідному гелі в присутності додецилсульфату натрію (SDS-PAGE). Фіг. 20: Відсоток CD4 клітин від імунізованих мишей, що експресують гаммаінтерферон та/або IL-2 та/або TNF- альфа цитокіни через 7 днів після другої та через 7 днів після третьої імунізації з Rv3616Δ138-145. Фіг. 21: Цитокіновий профіль Rv3616 специфічної CD4 T - клітинної відповіді через 7 днів після другої імунізації з Rv3616Δ138-145. Фіг. 22: Цитокіновий профіль Rv3616 специфічної CD4 T - клітинної відповіді через 7 днів після третьої імунізації з Rv3616Δ138-145. Фіг. 23: Відсоток клітин CD8 від імунізованих мишей, що експресують гаммаінтерферон та/або IL-2 та/або TNF- альфа цитокіни через 7 днів після другої та через 7 днів після третьої імунізації з Rv3616Δ138-145. Фіг. 24: Цитокіновий профіль Rv3616 специфічної CD8 T - клітинної відповіді через 7 днів після другої імунізації з Rv3616Δ138-145. Фіг. 25: Цитокіновий профіль Rv3616 специфічної CD8 T - клітинної відповіді через 7 днів після третьої імунізації з Rv3616Δ138-145. Опис перелічених послідовностей. SEQ ID No:1: поліпептидна послідовність Rv3616c штаму H37Rv M. tuberculosis. SEQ ID No: 2: полінуклеотидна послідовність Rv3616c штаму H37Rv M. tuberculosis. SEQ ID No: 3: поліпептидна послідовність Rv3616c штаму CDC1551 M. tuberculosis. SEQ ID No: 4: поліпептидна послідовність Rv3616c штаму F11 M. tuberculosis. SEQ ID No:5: поліпептидна послідовність Rv3616c штаму Haarlem A M. tuberculosis. SEQ ID No: 6: поліпептидна послідовність Rv3616c штаму С M. tuberculosis. SEQ ID No: 7: поліпептидна послідовність Rv3616c BCG. SEQ ID No: 8: поліпептидна послідовність Mtb8.4. SEQ ID No: 9: поліпептидна послідовність Mtb9.8. SEQ ID No:10: поліпептидна послідовність Mtb9.9. SEQ ID No:11: поліпептидна послідовність Ra12. SEQ ID No:12: поліпептидна послідовність Ra35. SEQ ID No:13: поліпептидна послідовність TbH9. SEQ ID No:14: поліпептидна послідовність Mtb41. SEQ ID No:15: поліпептидна послідовність ESAT-6. SEQ ID No:16: поліпептидна послідовність Ag85A. SEQ ID No:17: поліпептидна послідовність Ag85B. SEQ ID No:18: поліпептидна послідовність альфа - кристаліну. SEQ ID No:19: поліпептидна послідовність MPT64. SEQ ID No: 20: поліпептидна послідовність Mtb32A. SEQ ID No: 21: поліпептидна послідовність Ser/Ala мутованих зрілих Mtb32A. SEQ ID No: 22: поліпептидна послідовність TB10.4. SEQ ID No: 23: поліпептидна послідовність Mtb72f. SEQ ID No: 24: поліпептидна послідовність M72. SEQ ID No: 25: поліпептидна послідовність Mtb71f. SEQ ID No: 26: поліпептидна послідовність гібриду (злиття) M92. SEQ ID No: 27: поліпептидна послідовність гібриду M103. SEQ ID No: 28: поліпептидна послідовність гібриду M114. SEQ ID No: 29: передбачуваний епітоп 1 клітин людини CD4. SEQ ID No: 30: передбачуваний епітоп 2 клітин людини CD4. SEQ ID No: 31: передбачуваний епітоп 3 клітин людини CD4. SEQ ID No: 32: передбачуваний епітоп 4 клітин людини CD4. SEQ ID No: 33: передбачуваний епітоп 5 клітин людини CD4. SEQ ID No: 34: передбачуваний епітоп 6 клітин людини CD4. SEQ ID No: 35: передбачуваний епітоп 7 клітин людини CD4. SEQ ID No: 36: передбачуваний епітоп 8 клітин людини CD4. SEQ ID No: 37: передбачуваний епітоп 9 клітин людини CD4. SEQ ID No: 38: передбачуваний епітоп 10 клітин людини CD4. SEQ ID No: 39: передбачуваний епітоп 11 клітин людини CD4. SEQ ID No: 40: передбачуваний епітоп 12 клітин людини CD4. SEQ ID No: 41: передбачуваний епітоп 13 клітин людини CD4. SEQ ID No: 42: передбачуваний епітоп 14 клітин людини CD4. SEQ ID No: 43: передбачуваний епітоп 15 клітин людини CD4. 6 UA 110103 C2 5 10 15 20 25 30 35 40 45 50 55 60 SEQ ID No: 44: передбачуваний епітоп 16 клітин людини CD4. SEQ ID No: 45: передбачуваний епітоп 17 клітин людини CD4. SEQ ID No: 46: передбачуваний епітоп 18 клітин людини CD4. SEQ ID No: 47: передбачуваний епітоп 19 клітин людини CD4. SEQ ID No: 48: передбачуваний епітоп 1 клітин людини CD8. SEQ ID No: 49: передбачуваний епітоп 2 клітин людини CD8. SEQ ID No: 50: передбачуваний епітоп 3 клітин людини CD8. SEQ ID No: 51: передбачуваний епітоп 4 клітин людини CD8. SEQ ID No: 52: передбачуваний епітоп 5 клітин людини CD8. SEQ ID No: 53: передбачуваний епітоп 6 клітин людини CD8. SEQ ID No: 54: передбачуваний епітоп 7 клітин людини CD8. SEQ ID No: 55: передбачуваний епітоп 8 клітин людини CD8. SEQ ID No: 56: передбачуваний епітоп 9 клітин людини CD8. SEQ ID No: 57: передбачуваний епітоп 10 клітин людини CD8. SEQ ID No: 58: передбачуваний епітоп 11 клітин людини CD8. SEQ ID No: 59: передбачуваний епітоп 12 клітин людини CD8. SEQ ID No: 60: передбачуваний епітоп 13 клітин людини CD8. SEQ ID No: 61: передбачуваний епітоп 14 клітин людини CD8. SEQ ID No: 62: передбачуваний епітоп 15 клітин людини CD8. SEQ ID No: 63: передбачуваний епітоп 16 клітин людини CD8. SEQ ID No: 64: передбачуваний епітоп 17 клітин людини CD8. SEQ ID No: 65: передбачуваний епітоп 18 клітин людини CD8. SEQ ID No: 66: передбачуваний епітоп 19 клітин людини CD8. SEQ ID No: 67: передбачуваний епітоп 20 клітин людини CD8. SEQ ID No: 68: передбачуваний епітоп 21 клітин людини CD8. SEQ ID No: 69: передбачуваний епітоп 22 клітин людини CD8. SEQ ID No: 70: передбачуваний епітоп 23 клітин людини CD8. SEQ ID No: 71: передбачуваний епітоп 24 клітин людини CD8. SEQ ID No: 72: передбачуваний епітоп 25 клітин людини CD8. SEQ ID No: 73: передбачуваний епітоп 26 клітин людини CD8. SEQ ID No: 74: передбачуваний епітоп 27 клітин людини CD8. SEQ ID No: 75: передбачуваний епітоп 28 клітин людини CD8. SEQ ID No: 76: передбачуваний епітоп 29 клітин людини CD8. SEQ ID No: 77: передбачуваний епітоп 30 клітин людини CD8. SEQ ID No: 78: передбачуваний епітоп 31 клітин людини CD8. SEQ ID No: 79: передбачуваний епітоп 32 клітин людини CD8. SEQ ID No: 80: передбачуваний епітоп 33 клітин людини CD8. SEQ ID No: 81: передбачуваний епітоп 34 клітин людини CD8. SEQ ID No: 82: передбачуваний епітоп 35 клітин людини CD8. SEQ ID No: 83: передбачуваний епітоп 36 клітин людини CD8. SEQ ID No: 84: передбачуваний епітоп 37 клітин людини CD8. SEQ ID No: 85: передбачуваний епітоп 38 клітин людини CD8. SEQ ID No: 86: передбачуваний епітоп 39 клітин людини CD8. SEQ ID No: 87: передбачуваний епітоп 40 клітин людини CD8. SEQ ID No: 88: передбачуваний епітоп 41 клітин людини CD8. SEQ ID No: 89: передбачуваний епітоп 42 клітин людини CD8. SEQ ID No: 90: передбачуваний епітоп 43 клітин людини CD8. SEQ ID No: 91: передбачуваний епітоп 44 клітин людини CD8. SEQ ID No: 92: передбачуваний епітоп 45 клітин людини CD8. SEQ ID No: 93: передбачуваний епітоп 46 клітин людини CD8. SEQ ID No: 94: передбачуваний епітоп 47 клітин людини CD8. SEQ ID No: 95: передбачуваний епітоп 48 клітин людини CD8. SEQ ID No: 96: передбачуваний епітоп 49 клітин людини CD8. SEQ ID No: 97: передбачуваний епітоп 50 клітин людини CD8. SEQ ID No: 98: передбачуваний епітоп 51 клітин людини CD8. SEQ ID No: 99: передбачуваний епітоп 52 клітин людини CD8. SEQ ID No:100: передбачуваний епітоп 53 клітин людини CD8. SEQ ID No:101: передбачуваний епітоп 54 клітин людини CD8. SEQ ID No:102: передбачуваний епітоп 55 клітин людини CD8. SEQ ID No:103: передбачуваний епітоп 56 клітин людини CD8. 7 UA 110103 C2 5 10 15 20 25 30 35 40 45 50 55 60 SEQ ID No:104: передбачуваний епітоп 57 клітин людини CD8. SEQ ID No:105: передбачуваний епітоп 58 клітин людини CD8. SEQ ID No:106: передбачуваний епітоп 59 клітин людини CD8. SEQ ID No:107: передбачуваний епітоп 60 клітин людини CD8. SEQ ID No:108: передбачуваний епітоп 61 клітин людини CD8. SEQ ID No:109: передбачуваний епітоп 62 клітин людини CD8. SEQ ID No:110: передбачуваний епітоп 63 клітин людини CD8. SEQ ID No:111: передбачуваний епітоп 64 клітин людини CD8. SEQ ID No:112: передбачуваний епітоп 65 клітин людини CD8. SEQ ID No:113: передбачуваний епітоп 66 клітин людини CD8. SEQ ID No:114: передбачуваний епітоп 67 клітин людини CD8. SEQ ID No:115: передбачуваний епітоп 68 клітин людини CD8. SEQ ID No:116: передбачуваний епітоп 69 клітин людини CD8. SEQ ID No:117: передбачуваний епітоп 70 клітин людини CD8. SEQ ID No:118: передбачуваний епітоп 71 клітин людини CD8. SEQ ID No:119: передбачуваний епітоп 72 клітин людини CD8. SEQ ID No:120: передбачуваний епітоп 73 клітин людини CD8. SEQ ID No:121: передбачуваний епітоп 74 клітин людини CD8. SEQ ID No:122: передбачуваний епітоп 75 клітин людини CD8. SEQ ID No:123: передбачуваний епітоп 76 клітин людини CD8. SEQ ID No:124: передбачуваний епітоп 77 клітин людини CD8. SEQ ID No:125: передбачуваний епітоп 78 клітин людини CD8. SEQ ID No:126: передбачуваний епітоп 79 клітин людини CD8. SEQ ID No:127: пептид 1. SEQ ID No:128: пептид 2. SEQ ID No:129: пептид 3. SEQ ID No:130: пептид 4. SEQ ID No:131: пептид 5. SEQ ID No:132: пептид 6. SEQ ID No:133: пептид 7. SEQ ID No:134: пептид 8. SEQ ID No:135: пептид 9. SEQ ID No:136: пептид 10. SEQ ID No:137: пептид 11. SEQ ID No:138: пептид 12. SEQ ID No:139: пептид 13. SEQ ID No:140: пептид 14. SEQ ID No:141: пептид 15. SEQ ID No:142: пептид 16. SEQ ID No:143: пептид 17. SEQ ID No:144: пептид 18. SEQ ID No:145: пептид 19. SEQ ID No:146: пептид 20. SEQ ID No:147: пептид 21. SEQ ID No:148: пептид 22. SEQ ID No:149: пептид 23. SEQ ID No:150: пептид 24. SEQ ID No:151: пептид 25. SEQ ID No:152: пептид 26. SEQ ID No:153: пептид 27. SEQ ID No:154: пептид 28. SEQ ID No:155: пептид 29. SEQ ID No:156: пептид 30. SEQ ID No:157: поліпептидна послідовність Rv1753c штаму H37Rv M.tuberculosis SEQ ID No:158: поліпептидна послідовність Rv2386c штаму H37Rv M. tuberculosis SEQ ID No:159: поліпептидна послідовність Rv2707c штаму H37Rv M. tuberculosis SEQ ID No:160: E. coli кодон - оптимізована полінуклеотидна послідовність для Rv3616c штаму H37Rv M. tuberculosis SEQ ID No:161: поліпептидна послідовність Rv3616cΔ136-183, що походить від штаму H37Rv M. tuberculosis 8 UA 110103 C2 5 10 15 20 25 30 35 40 45 50 55 60 SEQ ID No:162: поліпептидна послідовність Rv3616cΔ150-160, що походить від штаму H37Rv M. tuberculosis SEQ ID No:163: поліпептидна послідовність Rv3616cΔ136-154, що походить від штаму H37Rv M. tuberculosis SEQ ID No:164: поліпептидна послідовність Rv3616cΔ166-182, що походить від штаму H37Rv M. tuberculosis SEQ ID No:165: поліпептидна послідовність Rv3616cΔ135-139, що походить від штаму H37Rv M. tuberculosis SEQ ID No:166: поліпептидна послідовність Rv3616cΔ142-145, що походить від штаму H37Rv M. tuberculosis SEQ ID No:167: поліпептидна послідовність Rv3616cΔ138-145, що походить від штаму H37Rv M. tuberculosis SEQ ID No:168: поліпептидна послідовність Rv3616cΔ145-152, що походить від штаму H37Rv M. tuberculosis SEQ ID No:169: поліпептидна послідовність Rv3616cΔ149-154, що походить від штаму H37Rv M. tuberculosis SEQ ID No:170: E. coli кодон - оптимізована полінуклеотидна послідовність, що кодує Rv3616cΔ136-183, що походить від штаму H37Rv M. tuberculosis SEQ ID No:171: E. coli кодон - оптимізована полінуклеотидна послідовність, що кодує Rv3616cΔ150-160, що походить від штаму H37Rv M. tuberculosis SEQ ID No:172: E. coli кодон - оптимізована полінуклеотидна послідовність, що кодує Rv3616cΔ136-154, що походить від штаму H37Rv M. tuberculosis SEQ ID No:173: E. coli кодон - оптимізована полінуклеотидна послідовність, що кодує Rv3616cΔ166-182, що походить від штаму H37Rv M. tuberculosis SEQ ID No:174: E. coli кодон - оптимізована полінуклеотидна послідовність, що кодує Rv3616cΔ135-139, що походить від штаму H37Rv M. tuberculosis SEQ ID No:175: E. coli кодон - оптимізована полінуклеотидна послідовність, що кодує Rv3616cΔ142-145, що походить від штаму H37Rv M. tuberculosis SEQ ID No:176: E. coli кодон - оптимізована полінуклеотидна послідовність, що кодує Rv3616cΔ138-145, що походить від штаму H37Rv M. tuberculosis SEQ ID No:177: E. coli кодон - оптимізована полінуклеотидна послідовність, що кодує Rv3616cΔ145-152, що походить від штаму H37Rv M. tuberculosis SEQ ID No:178: E. coli кодон - оптимізована полінуклеотидна послідовність, що кодує Rv3616cΔ149-154, що походить від штаму H37Rv M. tuberculosis SEQ ID No:179: поліпептидна послідовність модифікованого білку Rv3616c на основі розділення та перебудування навколо залишків 137-139 штаму H37Rv M. tuberculosis, в тому числі делеції Cys138. SEQ ID No:180: поліпептидна послідовність модифікованого білку Rv3616c на основі розділення та перебудування навколо залишків 152-153 штаму H37Rv M. tuberculosis. Заявлений винахід звичайно стосується застосування модифікованих поліпептидів Rv3616c або полінуклеотидів, що їх кодують, у сфері латентних інфекцій, спричинених мікобактеріями. Крім того, заявлений винахід стосується окремих модифікованих білків Rv3616c. Винахідники несподівано відкрили, що порушення гідрофобності окремого регіону послідовності білка Rv3616c може привести до підвищення експресії без істотного негативного впливу на імуногенні властивості. Модифіковані білки Rv3616c застосовують в якості TB антигенів, зокрема в якості антигенів латентного TB. Було показано, що деякі з білків, що проявляють сильну експресію протягом ранніх стадій мікобактеріальної інфекції забезпечують сильну захисну ефективність у тваринних моделях вакцинації. Однак, вакцинація з антигенами, що сильно експресуються протягом ранніх стадій може не забезпечити оптимальну імунну відповідь на більш пізніх стадіях інфекції. Адекватний контроль протягом латентної інфекції може потребувати T - клітин, що експресуються на цих стадіях та специфічні для окремих антигенів. Вакцини попереднього впливу, що безпосередньо спрямовані до стійких у сплячому стані бактерій можуть допомогти у захисті проти реактивування ТВ та тим самим посилити контроль за TB або навіть усунути інфекцію. Тому вакцина, що орієнтована до латентного TB може суттєво та економічно скоротити глобальні розміри TB інфекцій. Субодиничні вакцини на основі антигенів пізньої стадії також можуть бути застосовані у комбінації з антигенами ранній стадії для отримання мультифазної вакцини. Альтернативно, антигени пізньої стадії можуть бути застосовані для доповнення та поліпшення вакцинації BCG (або за рахунок підвищення відповіді BCG або через розвиток розвинених рекомбінантних 9 UA 110103 C2 5 10 15 20 25 30 35 40 45 50 55 60 штамів BCG). В той час, як було показано, що макрофаги діють у якості головних ефекторів імунітету Mycobacterium, T клітини є головними індукторами такого імунітету. Суттєва роль T - клітин у захисті проти туберкульозу ілюструється підвищеними відсотками реактивування TB у осіб, інфікованих на ВІЛ через пов'язане з ним скорочення кількості CD4+T клітин. Крім того, було показано, що адаптивне перенесення CD4+T клітин, що здійснюється на максимумі первинної імунної відповіді до M. Tuberculosis, забезпечує захист проти M. tuberculosis у мишей з дефіцитом T - клітин (Orme et al J. Exp. Med. 1983 158:74-83). Було показано, що Mycobacteriumреактивні CD4+T - клітини є потужними виробниками γ- інтерферону (IFN-γ), що, як в свою чергу було показано, викликає анти-мікобактеріальні дії макрофагів у мишей (Flynn et al. J. Exp. Med. 1993 178:2249-2254). В той час, як роль IFN-γ у людей є менш ясною, дослідження показали, що 1,25-дигідрокси-вітамін D3, взятий окремо або у комбінації з IFN-γ або альфа-фактором некрозу пухлин, активує макрофаги людини для інгібування інфекції M. tuberculosis. Більш того, відомо, що IFN-γ стимулює макрофаги людини виробляти 1,25-дигідрокси-вітамін D3. Аналогічно було показано, що інтерлейкін -12 (IL-12) відіграє важливу роль у стимулюванні стійкості до інфекції M. tuberculosis. Для огляду імунології інфекції M. tuberculosis, див. Chan & Kaufmann, Tuberculosis: Pathogenesis, Protection and Control (Bloom ed., 1994), Tuberculosis (2nd ed., Rom and Garay, eds., 2003), and Harrison's Principles of Internal Medicine, Chapter 150, pp. 953-966 (16th ed., Braunwald, et al., eds., 2005). Діагностику інфекції латентного туберкульозу звичайно здійснюють з застосуванням туберкулінового шкірного тесту (реакція Манту), що полягає у внутрішньошкірній реакції на очищену похідну туберкулінового білку (PPD). Антиген - специфічні T - клітинні відповіді приводять до виникнення через 48-72 годин після ін'єкції затвердіння у місці ін'єкції, що можна виміряти та що свідчить про реакцію до мікобактеріальних антигенів. Проблемою цього тесту, однак, є чутливість та вибірковість та осіб, вакцинованих BCG не завжди можна легко розрізнити від інфікованих (що особливо важливо у світлі того факту, що BCG не в змозі захистити від латентної інфекції). Головним чином, особи, що отримали BCG, але не інфіковані M. tuberculosis мають реакцію PPD, що нижче 10 мм у діаметрі, у той час, як вважається, що особи, що мають реакцію PPD вищу, ніж 10 мм у діаметрі, є інфікованими M. tuberculosis. Проте, це правило не застосовується для осіб з імуносупресією через інфекцію ВІЛ, що можуть показати реакцію PPD нижче 10 мм у діаметрі); або, у ендемічних країнах, де люди інфіковані не туберкульозними мікобактеріями, вони можуть показувати реакцію PPD вищу, ніж 10 мм у діаметрі. Досягнутий за останні роки прогрес спостерігається у розвитку in vitro T - клітинних аналізів на основі вивільнення гамма-інтерферону та з застосуванням більш специфічних до M. Tuberculosis, ніж PPD антигенів ESAT-6 та CFP-10. Ці високоспецифічні тести здаються, принаймні, такими ж чутливими, як туберкуліновий шкірний тест та також демонструють меншу перехресну реактивність через вакцинацію BCG. Стосовно сучасного огляду діагностики латентного туберкульозу див. Pai M et al Expert Rev. Mol. Diagn. 2006 6(3):413-422. Однак, оскільки ESAT-6/CFP-10 є антигенами ранній стадії, аналізи на основі ESAT-6/CFP-10 можуть оптимально бути проведені тільки у нещодавно інфікованих осіб. Тому ідентифікація специфічно асоційованих з латентним туберкульозом антигенів може допомогти у розвитку більш чутливих аналізів, що можуть забезпечити виявлення довгострокових латентних інфекцій. Залишається потреба у ефективних стратегіях лікування та профілактики туберкульозу, зокрема лікування та запобігання латентного туберкульозу та запобігання реактивування TB. Останнім часом запропоновано ряд вакцин - кандидатів M. tuberculosis на основі біоінформаційного аналізу повного генома M. tuberculosis (Zvi et al. BMC Medical Genetics 2008 1:18) та тестування білків, що по-різному експресуються у активно та латентно інфікованих осіб (Schuck SD et al. PLoS ONE 2009 4(5):e5590). Rv3616c, також відомий, як Mtb40, HTCC1 та EspA, бере участь у системі секреції Mycobacterium tuberculosis ESX-1 (Woodsworth et al. Infection and Immunity 2008 76(9):41994205). Rv3616c раніше був залучений до імунних відповідей, пов'язаних з туберкульозом (див., наприклад, WO98/53075). Al-Attiyah et al. Clin. Exp. Іmmunol. 2004 138:139-144 показали, що Rv3616c можна добре розпізнати (через PMBC проліферацію та продукування IFN- гамма) у пацієнтів з легеневим туберкульозом. Mustafa et al. Infect. Immun. 2006 74(8):4566-4572 винайшли спосіб розпізнавання Rv3616c з застосуванням великої рогатої худоби, що була інфікована M. bovis та вакцинована BCG. Міжнародна патентна заявка PCT/EP2009/059580, опублікована, як WO2010/010177, описує ідентифікацію Rv3616c у якості антигену, пов'язаного з латентною стадією TB інфекції. Міжнародна патентна заявка WO2010/121618 пропонує застосування білків, що постійно 10 UA 110103 C2 5 10 15 20 25 30 35 40 45 50 55 60 експресуються та генів, що їх кодують, для імунологічних композицій, як то вакцин, в тому числі EspA (тобто Rv3616c). Бажаним є отримання вакцинних антигенів, що мають їх послідовності дикого типу, таким чином гарантуючи, що потрібні від вакцини імунологічні відповіді будуть точно відповідати тим, що необхідні для протидії інфекції патогена. Тим не менше, ефективне отримання антигенів є важливим фактором у скороченні коштів, що пов'язано з виробництвом вакцин. Тому можуть мати істотну користь модифіковані антигени, що постійно експресуються на високому рівні але без будь-якого шкідливого впливу на їх імуногенність. Заявлений винахід прагне запропонувати модифіковані антигени Rv3616c, що спрямовані до вирішення цих та інших питань. Без теоретичного обмеження вважається, що амінокислотні залишки 134-183 штаму H37Rv Mycobacterium tuberculosis Rv3616c відповідають за потенційний трансмембранний регіон, регіон низької складності та суперспираль. Порушення одного, двох або трьох цих структурних елементів дозволяє отриманій модифікованій послідовності білка Rv3616c експресуватися на підвищеному рівні. Тому, у поширеному аспекті, заявлений винахід стосується модифікованого білка Rv3616c, де порушена гідрофобність амінокислотних залишків, що відповідають залишкам 134-183 послідовності H37Rv, відповідно, модифікованого білка Rv3616c, де порушена гідрофобність амінокислотних залишків, що відповідають залишкам 135-154 послідовності H37Rv. Під терміном ‘ порушення гідрофобності ’ мається на увазі модифікація послідовності, що веде до суттєвого зменшення гідрофобності таким чином, що модифікована послідовність білка Rv3616c може більш ефективно експресуватися. Бажано, щоб ступінь змінень в порівнянні з послідовністю дикого типу повинна була зведена до мінімуму, щоб зменшити ймовірність будь-якого небажаного впливу на імуногенність. Як тут застосовано, ‘ прямий пептидний зв'язок ’ є пептидним зв'язком, де два пептиди з'єднані пептидними зв'язками безпосередньо один до іншого та без проміжних амінокислотних послідовностей. ‘ Непрямим пептидним зв'язком ’ є пептидний зв'язок, де два пептиди приєднані пептидними зв'язками до третього, проміжного пептиду. У контексті заявленого винаходу, існують чотири головних підходу до порушення гідрофобності, а саме: відокремлення гідрофобних залишків, видалення гідрофобних залишків, заміщення гідрофобних залишків гідрофільними залишками та додавання гідрофільних залишків. Досвідченому фахівцю зрозуміло, що також може бути застосована комбінація таких підходів. Однак, як вже згадувалося раніше, ступень модифікацій послідовності в ідеалі повинна бути мінімізованою для уникнення небажаного шкідливого впливу на імуногенність. Відокремлення гідрофобних залишків може бути досягнуто шляхом розщеплення послідовності білка Rv3616c у позиції між амінокислотами, що відповідні залишкам 133-184 SEQ ID No:1 у N-термінальному та C-термінальному фрагменті, після чого слідує перебудова цих ділянок таким чином, що N-термінальний фрагмент розміщують у C-термінальному регіоні модифікованого білка Rv3616c та C-термінальний фрагмент розміщують у N-термінальному регіоні модифікованого білка Rv3616c. У одному аспекті винаходу, передбачено модифікований білок Rv3616c, де вищезгаданий модифікований білок Rv3616c містить перший та другий поліпептиди, де перший поліпептид розміщений по напрямку до С-кінця модифікованого білку Rv3616c відносно другого поліпептиду та де: (i) перший поліпептид є послідовністю, що має принаймні 90 % тотожності до залишків 1133 SEQ ID No:1; та (ii) другий поліпептид є послідовністю, що має принаймні 90 % тотожності до залишків 184392 SEQ ID No:1; де перший та другий поліпептиди є безпосередньо або небезпосередньо зв'язаними. У деяких втіленнях, модифікований білок Rv3616c головним чином або альтернативно складається з першого поліпептиду та другого поліпептиду, де перший поліпептид розміщений по напрямку до С-кінця модифікованого білку Rv3616c відносно другого поліпептиду та де: (i) перший поліпептид є послідовністю, що має принаймні 90 % тотожності до залишків 1133 SEQ ID No:1; та (ii) другий поліпептид є послідовністю, що має принаймні 90 % тотожності до залишків 184392 SEQ ID No:1; де перший та другий поліпептиди є безпосередньо або небезпосередньо зв'язаними. Перший поліпептид може бути послідовністю, що має принаймні 95 % тотожності до залишків 1-133 SEQ ID No:1, як то принаймні 97 % тотожності, принаймні 98 % тотожності, принаймні 99 % тотожності або навіть 100 % тотожності. Другий поліпептид може бути послідовністю, що має принаймні 95 % тотожності до залишків 11 UA 110103 C2 5 10 15 20 25 30 35 40 45 50 55 60 184-392 SEQ ID No:1, як то принаймні 97 % тотожності, принаймні 98 % тотожності, принаймні 99 % тотожності або навіть 100 % тотожності. Відповідно, перший поліпептид може бути послідовністю, що має принаймні 90 % тотожності до залишків 1-134 SEQ ID No:1, зокрема принаймні 95 % тотожності, як то принаймні 97 % тотожності, принаймні 98 % тотожності, принаймні 99 % тотожності або навіть 100 % тотожності. Відповідно, другий поліпептид може бути послідовністю, що має принаймні 90 % тотожності до залишків 155-392 SEQ ID No:1, зокрема принаймні 95 % тотожності, як то принаймні 97 % тотожності, принаймні 98 % тотожності, принаймні 99 % тотожності або навіть 100 % тотожності. Відповідно, модифікований білок Rv3616c першого аспекту не містить послідовність, що має принаймні 90 % тотожності до повнорозмірної SEQ ID No:1. Відповідно, модифікований білок Rv3616c першого аспекту є меншим, ніж 500 амінокислот у довжину, як то меншим, ніж 450 амінокислот у довжину, зокрема, меншим, ніж 400 амінокислот у довжину. Пептидний зв'язок може бути прямим або, альтернативно, бути непрямим. У другому аспекті винаходу передбачено модифікований білок Rv3616c, де вищезгаданий модифікований білок Rv3616c містить перший та другий поліпептиди, де перший поліпептид розміщений по напрямку до С-кінця модифікованого білку Rv3616c відносно до другого поліпептиду; де: (iii) перший поліпептид є безперервною послідовністю у принаймні 100 амінокислот у межах залишків 1-133 SEQ ID No:1; та (iv) другий поліпептид є безперервною послідовністю у принаймні 155 амінокислот у межах залишків 184-392 SEQ ID No:1; перший та другий поліпептиди є безпосередньо або небезпосередньо зв'язаними. У деяких втіленнях, модифікований білок Rv3616c головним чином містить або альтернативно складається з першого поліпептиду та другого поліпептиду, де перший поліпептид розміщений по напрямку до С-кінця модифікованого білку Rv3616c відносно до другого поліпептиду, де: (i) перший поліпептид є безперервною послідовністю у принаймні 100 амінокислот у межах залишків 1-133 SEQ ID No:1; та (ii) другий поліпептид є безперервною послідовністю у принаймні 155 амінокислот у межах залишків 184-392 SEQ ID No:1; де перший та другий поліпептиди є безпосередньо або небезпосередньо зв'язаними. Перший поліпептид може бути суміжною послідовністю у принаймні 110 амінокислот у межах залишків 1-133 SEQ ID No:1, як то у принаймні 120 амінокислот або у принаймні 130 амінокислот, наприклад, залишки 1-133. Другий поліпептид може бути суміжною послідовністю у принаймні 180 амінокислот у межах залишків 184-392 SEQ ID No:1, як то у принаймні 190 амінокислот або у принаймні 200 амінокислот, наприклад, залишки 184-392. Відповідно, перший поліпептид може бути суміжною послідовністю у принаймні 100 амінокислот у межах залишків 1-134 SEQ ID No:1, зокрема, у принаймні 110 амінокислот, як то у принаймні 120 амінокислот або у принаймні 130 амінокислот, наприклад, залишки 1-134. Відповідно, другий поліпептид може бути суміжною послідовністю у принаймні 175 амінокислот у межах залишків 155-392 SEQ ID No:1, зокрема, у принаймні 200 амінокислот, як то у принаймні 210 амінокислот або у принаймні 220 амінокислот, наприклад, залишки 155-392. Також викликають інтерес втілення, де другий поліпептид є безперервною послідовністю у принаймні 235 амінокислот у межах залишків 155-392 SEQ ID No:1. Відповідно, модифікований білок Rv3616c другого аспекту не містить суміжної послідовності у більш, ніж 259 амінокислот з SEQ ID No:1. Альтернативно, модифікований білок Rv3616c другого аспекту не містить суміжної послідовності у більш, ніж 257 амінокислот, суміжної послідовності у більш, ніж 255 амінокислот або суміжної послідовності у більш, ніж 253 амінокислот. Відповідно, модифікований білок Rv3616c другого аспекту має менший розмір, ніж 500 амінокислот у довжину, як то менше, ніж 450 амінокислот у довжину, зокрема, менше, ніж 400 амінокислот у довжину. Пептидний зв'язок може бути прямим або, альтернативно, бути непрямим. Приклади першого та другого аспектів охоплюють модифіковані білки Rv3616c, де перший та другий поліпептиди, що відповідають N-термінальному та C-термінальному фрагментам, походять від розщеплення послідовності Rv3616c у позиції між амінокислотами, що відповідають залишкам 135-154 у SEQ ID No:1, наприклад, залишкам 138-139 або 152-153, наприклад, залишкам 138-139 або 152-153, де пептидний зв'язок є прямим. Відповідно, при перебудуванні першого та другого поліпептидів, початковий (стартовий) метіонін залишається на N- кінці модифікованого білку Rv3616c. Див, наприклад, SEQ ID No:179, 180, що ілюструє цей 12 UA 110103 C2 5 10 15 20 25 30 35 40 45 50 55 60 тип розташування. Видалення гідрофобних залишків може бути досягнуто шляхом видалення принаймні однієї амінокислоти, відповідній залишкам 134-183 SEQ ID No:1. Видалені залишки можуть бути несуміжними та/або суміжними. Відповідно, видалення гідрофобних залишків може бути досягнуто шляхом видалення принаймні двох амінокислот, відповідних залишкам 134-183 SEQ ID No:1.Видалення гідрофобних залишків також може бути досягнуто шляхом видалення принаймні трьох амінокислот, відповідних залишкам 134-183 SEQ ID No:1. Видалені залишки можуть бути суміжними та/або несуміжними. Слід зазначити, що послідовності Rv3616c дикого типу містять цистеїновий залишок у позиції 138. Відповідно, цей цистеїновий залишок є видаленим або переміщеним (наприклад, C138Q). У третьому аспекті винаходу передбачено модифікований білок Rv3616c, вищезгаданий білок, що містить, або, альтернативно, головним чином складається або складається з послідовності Rv3616c, у якій принаймні одна амінокислота (наприклад, принаймні 2) є видаленою з регіону, що відповідає залишкам 134-183 у SEQ ID No:1. Модифікований білок Rv3616c може містити, або, альтернативно, головним чином складатися або складатися з послідовності Rv3616c, де суміжна частина з принаймні трьох амінокислот (наприклад, принаймні чотири амінокислоти) видалена з регіону, що відповідає залишкам 134-183 у SEQ ID No:1. Окремий інтерес викликають модифіковані білки Rv3616c, що містять послідовність Rv3616c, де принаймні одна амінокислота (наприклад, принаймні дві) видалена з регіону, відповідному залишкам 135-154 у SEQ ID No:1. Інші інтересуючі послідовності є модифікованими білками Rv3616c, що містять послідовність Rv3616c, де суміжна частина з принаймні трьох амінокислот (наприклад, принаймні чотири амінокислоти) видалена з регіону, що відповідає залишкам 135-154 у SEQ ID No:1. Видалена суміжна частина може складатися принаймні з 5 амінокислот (наприклад, 5-30, 520 або 5-15), головним чином, принаймні з 6 амінокислот (наприклад, 6-30, 6-20 або 6-15), зокрема, принаймні з 7 амінокислот (наприклад, 7-30, 7-20 або 7-15), принаймні з 8 амінокислот (наприклад, 8-30, 8-20 або 8-15) або принаймні з 10 амінокислот (наприклад, 10-30, 10-20 або 10-15). У певних втіленнях, видалена суміжна частина може складатися з: - 4 амінокислот, що відповідають залишкам 142-145 у SEQ ID No:1; -5 амінокислот, що відповідають залишкам 135-139 у SEQ ID No:1; -6 амінокислот, що відповідають залишкам 149-154 у SEQ ID No:1; -8 амінокислот, що відповідають залишкам 138-145 у SEQ ID No:1 або залишкам 145-152 у SEQ ID No:1; - 11 амінокислот, що відповідають залишкам 150-160 у SEQ ID No:1; - 17 амінокислот, що відповідають залишкам 166-182 у SEQ ID No:1; - 19 амінокислот, що відповідають залишкам 136-154 у SEQ ID No:1; - 31 амінокислот, що відповідають залишкам 136-166 у SEQ ID No:1; або - 48 амінокислот, що відповідають залишкам 136-183 у SEQ ID No:1. У інших втіленнях, видалена суміжна частина може складатися з 3-10 амінокислотних залишків, як то з 4-10, наприклад, з 4-8. Певна кількість видалених амінокислот може дорівнювати 3, 4, 5, 6, 7, 8, 9 або 10, головним чином, 4, 5, 6 або 8. У інших втіленнях, видалена частина може відповідати залишкам 135-138 у SEQ ID No:1, залишкам 136-138 у SEQ ID No:1, залишкам 137-138 у SEQ ID No:1, залишкам 138-140 у SEQ ID No:1, залишкам 138-141 у SEQ ID No:1, залишкам 152-154 у SEQ ID No:1 або видаленню залишків 149-151 у SEQ ID No:1. Четвертий аспект винаходу передбачає модифікований білок Rv3616c, де вказаний білок містить перший та другий поліпептиди, де перший поліпептид розміщений по напрямку до N-кінця відносно другого поліпептиду та: (iii) перший поліпептид є безперервною послідовністю у принаймні 100 амінокислот у межах залишків 1-133 SEQ ID No:1; (iv) та другий поліпептид є безперервною послідовністю у принаймні 155 амінокислот у межах залишків 184-392 SEQ ID No:1; де перший та другий поліпептиди є безпосередньо або небезпосередньо зв'язаними через третій поліпептид та вказаний третій поліпептид відповідає залишкам 134-183 у SEQ ID No:1, де видалена принаймні одна амінокислота (наприклад, принаймні дві). У деяких втіленнях, модифікований білок Rv3616c головним чином містить або альтернативно складається з першого та другого поліпептиду, де перший розміщений по напрямку до N-кінця відносно до другого поліпептиду, та: (i) перший поліпептид є безперервною послідовністю у принаймні 100 амінокислот у межах залишків 1-133 SEQ ID No:1; та 13 UA 110103 C2 5 10 15 20 25 30 35 40 45 50 55 60 (ii) другий поліпептид є безперервною послідовністю у принаймні 155 амінокислот у межах залишків 184-392 SEQ ID No:1; перший та другий поліпептиди є безпосередньо або небезпосередньо зв'язаними через третій поліпептид, де вказаний третій поліпептид відповідає залишкам 134-183 у SEQ ID No:1 де видалена принаймні одна амінокислота (наприклад, принаймні дві). Окремий інтерес викликають білки, що містять або, альтернативно, головним чином складаються або складаються з першого та другого поліпептиду, де перший розміщений по напрямку до N-кінця відносно другого поліпептиду та: (i) перший поліпептид є безперервною послідовністю у принаймні 100 амінокислот у межах залишків 1-133 SEQ ID No:1; та (ii) другий поліпептид є безперервною послідовністю у принаймні 155 амінокислот у межах залишків 184-392 SEQ ID No:1; де перший та другий поліпептиди є безпосередньо або небезпосередньо зв'язаними через третій поліпептид та вказаний третій поліпептид відповідає залишкам 134-183 у SEQ ID No:1, де видалена принаймні суміжна частина з щонайменш трьох амінокислот (наприклад, принаймні чотири амінокислоти). Перший поліпептид може бути суміжною послідовністю у принаймні 110 амінокислот у межах залишків 1-133 SEQ ID No:1, як то у принаймні 120 або 130 амінокислот (наприклад, залишки 1-133). Другий поліпептид може бути суміжною послідовністю у принаймні 180 амінокислот у межах залишків 184-392 SEQ ID No:1, як то у принаймні 190 або 200 амінокислот (наприклад, залишки 184-392). Видалена суміжна частина з залишків, що відповідні 134-183 у SEQ ID No:1 може сягати принаймні 5 амінокислот (наприклад, 5-30, 5-20 або 5-15), головним чином, принаймні 6 амінокислот (наприклад, 6-30, 6-20 або 6-15), зокрема, принаймні 7 амінокислот (наприклад, 730, 7-20 або 7-15), принаймні 8 амінокислот (наприклад, 8-30, 8-20 або 8-15) або принаймні 10 амінокислот (наприклад, 10-30, 10-20 або 10-15). У деяких втіленнях, видалена суміжна частина з залишків, що відповідні 134-183 у SEQ ID No:1 може дорівнювати: - 4 амінокислотам, що відповідають залишкам 142-145 у SEQ ID No:1; - 5 амінокислотам, що відповідають залишкам 135-139 у SEQ ID No:1; - 6 амінокислотам, що відповідають залишкам 149-154 у SEQ ID No:1; - 8 амінокислотам, що відповідають залишкам 138-145 у SEQ ID No:1 або залишкам 145-152 у SEQ ID No:1; - 11 амінокислотам, що відповідають залишкам 150-160 у SEQ ID No:1; - 17 амінокислотам, що відповідають залишкам 166-182 у SEQ ID No:1; - 19 амінокислотам, що відповідають залишкам 136-154 у SEQ ID No:1; - 31 амінокислотам, що відповідають залишкам 136-166 у SEQ ID No:1; або - 48 амінокислотам, що відповідають залишкам 136-183 у SEQ ID No:1. У інших втіленнях видалена суміжна частина з залишків, що відповідні 134-183 у SEQ ID No:1 може бути 3-10 амінокислотними залишками, наприклад, 4-10 або 4-8. Певна кількість видалених амінокислот може дорівнювати 3, 4, 5, 6, 7, 8, 9 або 10, головним чином, 4, 5, 6 або 8. У інших втіленнях, видалена суміжна частина з залишків, що відповідні 134-183 у SEQ ID No:1 може бути відповідною залишкам 135-138 у SEQ ID No:1, залишкам 136-138 у SEQ ID No:1, залишкам 137-138 у SEQ ID No:1, залишкам 138-140 у SEQ ID No:1, залишкам 138-141 у SEQ ID No:1, залишкам 152-154 у SEQ ID No:1 або видаленню залишків 149-151 у SEQ ID No:1. У деяких втіленнях, перший та другий поліпептиди є безпосередньо зв'язаними між собою. У інших втіленнях, перший поліпептид та другий поліпептид є безпосередньо зв'язаними через третій поліпептид. Третій поліпептид може бути відповідним залишкам 134-183 у SEQ ID No:1, де виникла делеція у одиничній суміжній частині принаймні трьох амінокислот (наприклад, принаймні чотирьох амінокислот). Крім того, третій поліпептид може бути відповідним залишкам 134-183 у SEQ ID No:1, де виникли делеції в кількох окремих місцях (наприклад, у 1-10, 1-5 місцях, зокрема, у одному або у двох місцях), де кожна делеція виникає у 1-10, наприклад, 1-5 амінокислотних залишків. Відповідно, третій поліпептид дорівнює 48 амінокислотам або менше (наприклад, 10-48, 20-48 або 30-48 залишків), як то 46 амінокислотам або менше (наприклад, 10-46, 20-46 або 30-46 залишків), 44 амінокислотам або менше (наприклад, 10-44, 20-44 або 3044 залишків) або 42 амінокислотам або менше (наприклад, 10-42, 20-42 або 30-42 залишків). П'ятий аспект винаходу передбачає модифіковані білки Rv3616c, що містять перший та другий поліпептиди, де перший розміщений по напрямку до N-кінця відносно другого поліпептиду та: 14 UA 110103 C2 5 10 15 20 25 30 35 40 45 50 55 60 (iii) перший поліпептид є безперервною послідовністю у принаймні 100 амінокислот у межах залишків 1-134 SEQ ID No:1; та (iv) другий поліпептид є безперервною послідовністю у принаймні 175 амінокислот у межах залишків 155-392 SEQ ID No:1; де перший та другий поліпептиди є або безпосередньо зв'язаними між собою або небезпосередньо зв'язаними через третій поліпептид, де вказаний третій поліпептид відповідає залишкам 135-154 у SEQ ID No:1 де видалена принаймні одна амінокислота (наприклад, принаймні дві). У деяких втіленнях, модифікований білок Rv3616c головним чином містить або альтернативно складається з першого та другого поліпептиду, де перший розміщений по напрямку до N-кінця відносно другого поліпептиду та: (i) перший поліпептид є безперервною послідовністю у принаймні 100 амінокислот у межах залишків 1-134 SEQ ID No:1; та (ii) другий поліпептид є безперервною послідовністю у принаймні 175 амінокислот у межах залишків 155-392 SEQ ID No:1; де перший та другий поліпептиди є або безпосередньо зв'язаними між собою або небезпосередньо зв'язаними через третій поліпептид, де вказаний третій поліпептид відповідає залишкам 135-154 у SEQ ID No:1 де видалена принаймні одна амінокислота (наприклад, принаймні дві). Окремий інтерес викликають білки, що містять або, альтернативно, головним чином складаються або складаються з першого та другого поліпептиду, де перший розміщений по напрямку до N-кінця відносно другого поліпептиду та: (i) перший поліпептид є безперервною послідовністю у принаймні 100 амінокислот у межах залишків 1-134 SEQ ID No:1; та (ii) другий поліпептид є безперервною послідовністю у принаймні 175 амінокислот у межах залишків 155-392 SEQ ID No:1; де перший та другий поліпептиди є або безпосередньо зв'язаними між собою або небезпосередньо зв'язаними через третій поліпептид, де вказаний третій поліпептид відповідає залишкам 135-154 у SEQ ID No:1, де видалення відбулося в одиничній суміжній частині принаймні трьох амінокислот (наприклад, принаймні чотирьох амінокислот). Перший поліпептид може також бути суміжною послідовністю у принаймні 110 амінокислот у межах залишків 1-134 SEQ ID No:1, як то у принаймні 120 амінокислот або у принаймні 130 амінокислот, наприклад, залишки 1-134. Другий поліпептид може також бути суміжною послідовністю у принаймні 200 амінокислот у межах залишків 155-392 SEQ ID No:1, як то у принаймні 210 амінокислот або у принаймні 220 амінокислот, наприклад, залишки 155-392. Також, викликають інтерес втілення, де другий поліпептид є безперервною послідовністю у принаймні 235 амінокислот у межах залишків 155392 SEQ ID No:1. Видалена суміжна частина з залишків, що відповідні 135-154 у SEQ ID No:1 може дорівнювати принаймні 5 амінокислотам (наприклад, 5-20, 5-15 або 5-10), головним чином, принаймні 6 амінокислотам (наприклад, 6-20, 6-15 або 6-10), зокрема, принаймні 7 амінокислотам (наприклад, 7-20, 7-15 або 7-10), як то принаймні 8 амінокислотам (наприклад, 820, 8-15 або 8-10) або принаймні 10 амінокислотам (наприклад, 10-20, 10-15). У деяких втіленнях, видалена суміжна частина з залишків, що відповідні 135-154 у SEQ ID No:1 може дорівнювати: - 4 амінокислотам, що відповідають залишкам 142-145 у SEQ ID No:1; - 6 амінокислотам, що відповідають залишкам 149-154 у SEQ ID No:1; - 8 амінокислотам, що відповідають залишкам 138-145 у SEQ ID No:1 або залишкам 145-152 у SEQ ID No:1; - 11 амінокислотам, що відповідають залишкам 150-160 у SEQ ID No:1; або - 19 амінокислотам, що відповідають залишкам 136-154 у SEQ ID No:1. У інших втіленнях видалена суміжна частина з залишків, що відповідні 135-154 може дорівнювати 3-10 амінокислотних залишків, як то, 4-10, наприклад, 4-8. Певна кількість видалених амінокислот може дорівнювати 3, 4, 5, 6, 7, 8, 9 або 10, головним чином 4, 5, 6 або 8. У інших втіленнях, видалена суміжна частина з залишків, що відповідні 135-154 у SEQ ID No:1 може бути відповідною залишкам 135-138 у SEQ ID No:1, залишкам 136-138 у SEQ ID No:1, залишкам 137-138 у SEQ ID No:1, залишкам 138-140 у SEQ ID No:1, залишкам 138-141 у SEQ ID No:1, залишкам 152-154 у SEQ ID No:1 або видаленню залишків 149-151 у SEQ ID No:1. У деяких втіленнях, перший та другий поліпептиди є безпосередньо зв'язаними між собою. У інших втіленнях, перший поліпептид та другий поліпептид є безпосередньо зв'язаними через 15 UA 110103 C2 5 10 15 20 25 30 35 40 45 50 55 60 третій поліпептид, де третій поліпептид може бути відповідним залишкам 135-154 у SEQ ID No:1, де видалення відбулося в одиничній суміжній частині принаймні трьох амінокислот (наприклад, принаймні чотирьох амінокислот). Крім того, третій поліпептид може бути відповідним залишкам 135-154 у SEQ ID No:1 де виникли делеції в кількох окремих місцях (наприклад, у 1-10, 1-5 місцях, зокрема, у одному або у двох місцях), де кожна делеція виникає у 1-10, наприклад, у 1-5 амінокислотних залишків. Відповідно, третій поліпептид дорівнює 20 амінокислот або менше (наприклад, 5-20, як то 10-20 залишків), 18 амінокислот або менше (наприклад, 5-18, як то 10-18 залишків), 16 амінокислот або менше (наприклад, 5-16, як то 10-16 залишків) або 14 амінокислот або менше (наприклад, 5-14, як то 10-14 залишків). Шостий аспект винаходу передбачає модифікований білок Rv3616c, де вказаний білок містить перший та другий поліпептиди, де перший поліпептид розміщений по напрямку до Nкінця відносно до другого поліпептиду та: (iii) перший поліпептид є послідовністю, що має принаймні 90 % тотожності до залишків 1133 SEQ ID No:1; та (iv) другий поліпептид є послідовністю, що має принаймні 90 % тотожності до залишків 184392 SEQ ID No:1; де перший та другий поліпептиди є безпосередньо зв'язаними між собою або не є безпосередньо зв'язаними через третій поліпептид, вищезгаданий третій поліпептид має принаймні 90 % тотожності до послідовності, відповідній залишкам 134-183 у SEQ ID No:1 де видалена суміжна частина з принаймні трьох амінокислот (наприклад, принаймні чотири амінокислоти). У деяких втіленнях модифікований білок Rv3616c головним чином містить або альтернативно складається з першого та другого поліпептиду, де перший поліпептид розміщений по напрямку до N-кінця відносно до другого поліпептиду та: (i) перший поліпептид є послідовністю, що має принаймні 90 % тотожності до залишків 1133 SEQ ID No:1; та (ii) другий поліпептид є послідовністю, що має принаймні 90 % тотожності до залишків 184392 SEQ ID No:1; де перший та другий поліпептиди є безпосередньо зв'язаними між собою або не є безпосередньо зв'язаними через третій поліпептид, де вказаний третій поліпептид має принаймні 90 % тотожності до послідовності, відповідній залишкам 134-183 у SEQ ID No:1, де видалена суміжна частина з принаймні трьох амінокислот (наприклад, принаймні чотири амінокислоти). Перший поліпептид може бути послідовністю, що має принаймні 95 % тотожності до залишків 1-133 SEQ ID No:1, як то принаймні 97 % тотожності, принаймні 98 % тотожності, принаймні 99 % тотожності або навіть 100 % тотожності. Другий поліпептид може бути послідовністю, що має принаймні 95 % тотожності до залишків 184-392 SEQ ID No:1, як то принаймні 97 % тотожності, принаймні 98 % тотожності, принаймні 99 % тотожності або навіть 100 % тотожності. У деяких втіленнях, перший та другий поліпептид можуть бути безпосередньо зв'язаними між собою. У інших втіленнях, перший поліпептид та другий поліпептид можуть бути небезпосередньо зв'язаними через третій поліпептид. Третій поліпептид може бути послідовністю, що має принаймні 95 % тотожності до послідовності, відповідній залишкам 134183 у SEQ ID No:1, де видалена суміжна частина принаймні трьох амінокислот (наприклад, принаймні чотири амінокислоти), як то принаймні 97 % тотожності, принаймні 98 % тотожності, принаймні 99 % тотожності або навіть 100 % тотожності. Суміжна частина, що виділена з залишків, відповідних 134-183 у SEQ ID No:1 може дорівнювати принаймні 5 амінокислот (наприклад, 5-30, 5-20 або 5-15), головним чином, принаймні 6 амінокислот (наприклад, 6-30, 620 або 6-15), зокрема, принаймні 7 амінокислот (наприклад, 7-30, 7-20 або 7-15), як то принаймні 8 амінокислот (наприклад, 8-30, 8-20 або 8-15) або принаймні 10 амінокислот (наприклад, 10-30, 10-20 або 10-15). У деяких втіленнях, суміжна частина, що виділена з залишків, відповідних 134-183 у SEQ ID No:1 може дорівнювати: - 4 амінокислотам, що відповідають залишкам 142-145 у SEQ ID No:1; - 5 амінокислотам, що відповідають залишкам 135-139 у SEQ ID No:1; - 6 амінокислотам, що відповідають залишкам 149-154 у SEQ ID No:1; - 8 амінокислотам, що відповідають залишкам 138-145 у SEQ ID No:1 або залишкам 145-152 у SEQ ID No:1; - 11 амінокислотам, що відповідають залишкам 150-160 у SEQ ID No:1; - 17 амінокислотам, що відповідають залишкам 166-182 у SEQ ID No:1; - 19 амінокислотам, що відповідають залишкам 136-154 у SEQ ID No:1; 16 UA 110103 C2 5 10 15 20 25 30 35 40 45 50 55 60 - 31 амінокислотам, що відповідають залишкам 136-166 у SEQ ID No:1; або - 48 амінокислотам, що відповідають залишкам 136-183 у SEQ ID No:1. У інших втіленнях, видалена суміжна частина може дорівнювати 3-10 амінокислотних залишків, як то 4-10, наприклад, 4-8. Певна кількість видалених амінокислот може дорівнювати 3, 4, 5, 6, 7, 8, 9 або 10, головним чином, 4, 5, 6 або 8. У інших втіленнях, суміжна частина, що виділена з залишків, відповідних 134-183 у SEQ ID No:1 може бути відповідною залишкам 135-138 у SEQ ID No:1, залишкам 136-138 у SEQ ID No:1, залишкам 137-138 у SEQ ID No:1, залишкам 138-140 у SEQ ID No:1, залишкам 138-141 у SEQ ID No:1, залишкам 152-154 у SEQ ID No:1 або видаленню залишків 149-151 у SEQ ID No:1. Відповідно, третій поліпептид має розмір 48 амінокислот або менше (наприклад, 10-48, 20-48 або 30-48 залишків), 46 амінокислот або менше (наприклад, 10-46, 20-46 або 30-46 залишків), 44 амінокислоти або менше (наприклад, 10-44, 20-44 або 30-44 залишків) або 42 амінокислоти або менше (наприклад, 10-42, 20-42 або 30-42 залишків). Сьомий аспект винаходу передбачає модифіковані білки Rv3616c, що містять перший та другий поліпептиди, де перший розміщений по напрямку до N-кінця відносно другого поліпептиду та: (i) перший поліпептид є послідовністю, що має принаймні 90 % тотожності до залишків 1134 SEQ ID No:1; та (ii) другий поліпептид є послідовністю, що має принаймні 90 % тотожності до залишків 155392 SEQ ID No:1; де перший та другий поліпептиди є або безпосередньо зв'язаними між собою або небезпосередньо зв'язаними через третій поліпептид, де вищезгаданий третій поліпептид має принаймні 80 % тотожності до послідовності, відповідній залишкам 135-154 у SEQ ID No:1, де видалена суміжна частина з принаймні трьох амінокислот (наприклад, принаймні чотири амінокислоти). У деяких втіленнях, модифікований білок Rv3616c головним чином містить або альтернативно складається з першого та другого поліпептиду, де перший поліпептид розміщений по напрямку до N-кінця відносно до другого поліпептиду та: (i) перший поліпептид є послідовністю, що має принаймні 90 % тотожності до залишків 1134 SEQ ID No:1; та (ii) другий поліпептид є послідовністю, що має принаймні 90 % тотожності до залишків 155392 SEQ ID No:1; де перший та другий поліпептиди є або безпосередньо зв'язаними між собою або небезпосередньо зв'язаними через третій поліпептид та де вказаний третій поліпептид має принаймні 80 % тотожності до послідовності, відповідній залишкам 135-154 у SEQ ID No:1, де видалена суміжна частина з принаймні трьох амінокислот (наприклад, принаймні чотири амінокислоти). Перший поліпептид може бути послідовністю, що має принаймні 95 % тотожності до залишків 1-134 SEQ ID No:1, як то принаймні 97 % тотожності, принаймні 98 % тотожності, принаймні 99 % тотожності або навіть 100 % тотожності. Другий поліпептид може бути послідовністю, що має принаймні 95 % тотожності до залишків 155-392 SEQ ID No:1, як то принаймні 97 % тотожності, принаймні 98 % тотожності, принаймні 99 % тотожності або навіть 100 % тотожності. У деяких втіленнях, перший поліпептид та другий поліпептид можуть бути безпосередньо зв'язаними між собою. У інших втіленнях, перший поліпептид та другий поліпептид можуть бути небезпосередньо зв'язаними через третій поліпептид. Третій поліпептид може бути послідовністю, що має принаймні 90 % тотожності до послідовності, відповідній залишкам 135154 у SEQ ID No:1 де видалена суміжна частина принаймні трьох амінокислот (наприклад, принаймні чотири амінокислоти), як то принаймні 95 % тотожності, принаймні 98 % тотожності, принаймні 99 % тотожності або навіть 100 % тотожності. Суміжна частина, що виділена з залишків, відповідних 135-154 у SEQ ID No:1 може дорівнювати принаймні 5 амінокислот (наприклад, 5-20, 5-15 або 5-10), головним чином, принаймні 6 амінокислот (наприклад, 6-20, 615 або 6-10), зокрема, принаймні 7 амінокислот (наприклад, 7-20, 7-15 або 7-10), принаймні 8 амінокислот (наприклад, 8-20, 8-15 або 8-10) або принаймні 10 амінокислот (наприклад, 10-20, 10-15). У деяких втіленнях, суміжна частина видаленої суміжної частини з залишками, відповідними 135-154 у SEQ ID No:1 може дорівнювати: - 4 амінокислотам, що відповідають залишкам 142-145 у SEQ ID No:1; - 6 амінокислотам, що відповідають залишкам 149-154 у SEQ ID No:1; - 8 амінокислотам, що відповідають залишкам 138-145 у SEQ ID No:1 або залишкам 145-152 17 UA 110103 C2 5 10 15 20 25 30 35 40 45 50 55 60 у SEQ ID No:1; - 11 амінокислотам, що відповідають залишкам 150-160 у SEQ ID No:1; або - 19 амінокислотам, що відповідають залишкам 136-154 у SEQ ID No:1. У інших втіленнях, видалена суміжна частина може дорівнювати 3-10 амінокислотних залишків, як то 4-10, наприклад, 4-8. Певна кількість видалених амінокислот може дорівнювати 3, 4, 5, 6, 7, 8, 9 або 10, головним чином, 4, 5, 6 або 8. У деяких втіленнях, суміжна частина видаленої суміжної частини з залишками,відповідними 135-154 у SEQ ID No:1 може бути відповідною залишкам 135-138 у SEQ ID No:1, залишкам 136138 у SEQ ID No:1, залишкам 137-138 у SEQ ID No:1, залишкам 138-140 у SEQ ID No:1, залишкам 138-141 у SEQ ID No:1, залишкам 152-154 у SEQ ID No:1 або видаленню залишків 149-151 у SEQ ID No:1. Відповідно, третій поліпептид дорівнює 20 амінокислотам або менше (наприклад, 5-20, 1020 залишків), наприклад, 18 амінокислотам або менше (наприклад, 5-18, 10-18 залишків), 16 амінокислотам або менше (наприклад, 5-16, 10-16 залишків) або 14 амінокислотам або менше (наприклад, 5-14, 10-14 залишків). Заміщення гідрофобних залишків може бути досягнуто шляхом заміщення гідрофільним залишком принаймні однієї (наприклад, принаймні двох) амінокислоти, що відповідає залишкам 134-183 SEQ ID No:1. У зв'язку з цим, прийнятні гідрофільні залишки звичайно є Gln (Q), Asp (D), Glu (E), Asn (N), His (H), Lys (K), Arg (R), Ser (S) або Thr (T). Окремий інтерес викликає заміщення гідрофільним залишком принаймні однієї (наприклад, принаймні двох) амінокислоти, що відповідає залишкам 135-15 4 у SEQ ID No:1. У зв'язку з цим, прийнятні гідрофільні залишки звичайно є Gln (Q), Asp (D), Glu (E), Asn (N), His (H), Lys (K), Arg (R), Ser (S) або Thr (T). Заміщені залишки може бути несуміжними, хоча є, відповідно, суміжними. У восьмому аспекті винаходу передбачено модифікований білок Rv3616c, де вказаний білок містить послідовність Rv3616c, де суміжна частина з принаймні трьох амінокислот (наприклад, принаймні чотири амінокислоти) з регіону, що відповідає залишкам 134-183 у SEQ ID No:1 заміщена гідрофільними залишками. У деяких втіленнях, модифікований білок Rv3616c головним чином містить або альтернативно складається з послідовності Rv3616c, де суміжна частина з принаймні трьох амінокислот (наприклад, принаймні чотири амінокислоти) з регіону, що відповідає залишкам 134-183 у SEQ ID No:1 заміщена гідрофільними залишками. Окремий інтерес викликають модифіковані білки Rv3616c, що містять послідовність Rv3616c, де суміжна частина з принаймні трьох амінокислот (наприклад, принаймні чотири амінокислоти) з регіону, що відповідає залишкам 135-154 у SEQ ID No:1 заміщена гідрофільними залишками. Заміщена суміжна частина може дорівнювати принаймні 5 амінокислот (наприклад, 5-30, 520 або 5-15), головним чином, принаймні 6 амінокислот (наприклад, 6-30, 6-20 або 6-15), зокрема, принаймні 7 амінокислот (наприклад, 7-30, 7-20 або 7-15), принаймні 8 амінокислот (наприклад, 8-30, 8-20 або 8-15) або принаймні 10 амінокислот (наприклад, 10-30, 10-20 або 1015). У деяких втіленнях, заміщена суміжна частина може дорівнювати: - 4 амінокислотам, що відповідають залишкам 142-145 у SEQ ID No:1; - 5 амінокислотам, що відповідають залишкам 135-139 у SEQ ID No:1; - 6 амінокислотам, що відповідають залишкам 149-154 у SEQ ID No:1; - 8 амінокислотам, що відповідають залишкам 138-145 у SEQ ID No:1 або залишкам 145-152 у SEQ ID No:1; - 11 амінокислотам, що відповідають залишкам 150-160 у SEQ ID No:1; - 17 амінокислотам, що відповідають залишкам 166-182 у SEQ ID No:1; - 19 амінокислотам, що відповідають залишкам 136-154 у SEQ ID No:1; - 31 амінокислотам, що відповідають залишкам 136-166 у SEQ ID No:1; або - 48 амінокислотам, що відповідають залишкам 136-183 у SEQ ID No:1. У інших втіленнях, заміщена суміжна частина може дорівнювати 3-10 амінокислотних залишків, як то 4-10, наприклад, 4-8. Певна кількість заміщених амінокислот може дорівнювати 3, 4, 5, 6, 7, 8, 9 або 10, головним чином, 4, 5, 6 або 8. У інших втіленнях, заміщена частина може бути відповідною залишкам 135-138 у SEQ ID No:1, залишкам 136-138 у SEQ ID No:1, залишкам 137-138 у SEQ ID No:1, залишкам 138-140 у SEQ ID No:1, залишкам 138-141 у SEQ ID No:1, залишкам 152-154 у SEQ ID No:1 або видаленню залишків 149-151 у SEQ ID No:1. Порушення гідрофобності може також бути досягнуто 18 UA 110103 C2 5 10 15 20 25 30 35 40 45 50 55 60 додаванням гідрофільних залишків, наприклад, додаванням принаймні одного гідрофільного амінокислотного залишку (наприклад, принаймні двох, як то 2-10) до місця між цими залишками, що відповідає залишкам 133-184 SEQ ID No:1. Відповідно, може бути додано принаймні три гідрофільних залишка (наприклад, 3-20, 3-15, головним чином, 3-10), принаймні 4 залишка (наприклад, 4-20,4-15, головним чином, 4-10), зокрема, принаймні 5 залишків (наприклад, 5-20, 5-15, головним чином, 5-10), вибірково, принаймні 6 залишків (наприклад, 6-20, 6-15, головним чином, 6-10). У зв'язку з цим, прийнятні гідрофільні залишки звичайно є Gln (Q), Asp (D), Glu (E), Asn (N), His (H), Lys (K), Arg (R), Ser (S) або Thr (T). Додаткові гідрофільні залишки звичайно заходяться між залишками, що відповідають 133184 SEQ ID No:1, головним чином, між залишками 134-155 SEQ ID No:1 (як то, між залишками 135-154 SEQ ID No:1). Додаткові гідрофільні залишки можуть бути розподілені у різних позиціях між залишками 133-184 SEQ ID No:1 (наприклад, місця 1-10, як то 1-5, зокрема 1 або 2), де кожне місце має 110 додаткових гідрофільних залишків, як то 1-5 додаткових залишків. Додаткові гідрофільні залишки, відповідно, будуть розміщені у одній суміжній групі. У окремих втіленнях описаних у різних аспектах вище модифікованих білків Rv3616c, модифікований білок Rv3616c не є SEQ ID No:162 (Rv3616cΔ150-160). У інших втіленнях, модифікований білок Rv3616c не містить SEQ ID No:162 (Rv3616cΔ150-160). Модифіковані білки Rv3616c можуть бути отримані на основі послідовності білку дикого типу Rv3616c з будь-якого штаму M. tuberculosis. Наприклад, будь-яка послідовність SEQ ID Nos: 3-7, зокрема будь-яка послідовність SEQ ID Nos: 3-6 може бути заміщена на SEQ ID No:1 у попередніх втіленнях. В цій заявці, білки з різних обговорених вище аспектів в сукупності зазначені, як модифіковані білки Rv3616c. Також запропоновано модифіковані білки Rv3616c для застосування в якості лікарських засобів, як то медикаменту для лікування або запобігання TB. Подальший аспект винаходу стосується способу, що викликає у суб'єкта імунну відповідь, що полягає у введенні модифікованого білку Rv3616c. Подальший аспект винаходу стосується способу лікування, поліпшення стану або запобіганню TB, що полягає у введенні суб'єкту у разі потреби безпечної та ефективної кількості модифікованого білку Rv3616c, де вказаний поліпептид викликає імунну відповідь. У іншому аспекті, спосіб додатково полягає у викликанні імунної відповіді проти Mycobacterium tuberculosis. Подальший аспект винаходу стосується способу лікування, поліпшення стану, затримування або попередження реактивування туберкульозу, що полягає у введенні суб'єкту у разі потреби ефективної кількості модифікованого білку Rv3616c, де вказаний поліпептид викликає імунну відповідь. У іншому аспекті, спосіб додатково полягає у викликанні імунної відповіді проти Mycobacterium tuberculosis. Застосування модифікованого білку Rv3616c у виробництві лікарського засобу для лікування, поліпшення стану або запобігання TB, являє собою інший аспект винаходу. Заявлений винахід стосується полінуклеотиду, що містить послідовність нуклеїнової кислоти, що кодує модифікований білок Rv3616c. Також запропоновано полінуклеотид, що містить послідовність нуклеїнової кислоти, що кодує модифікований білок Rv3616c для застосування у якості лікарського засобу, як то медикаменту для лікування, поліпшення стану або запобігання TB. Подальший аспект винаходу стосується способу, що викликає у суб'єкта імунну відповідь, що полягає у введенні полінуклеотиду, що містить послідовність нуклеїнової кислоти, що кодує модифікований білок Rv3616c. Подальший аспект винаходу стосується способу лікування, поліпшення стану або запобігання TB, що полягає у введенні суб'єкту у разі потреби безпечної та ефективної кількості полінуклеотиду, що містить послідовність нуклеїнової кислоти, що кодує модифікований білок Rv3616c, де вищезгаданий полінуклеотид викликає імунну відповідь. У іншому аспекті, заявлений винахід стосується способу індукування імунної відповіді проти Mycobacterium tuberculosis. Подальший аспект винаходу стосується способу лікування, поліпшення стану, затримування або попередження реактивування туберкульозу, що полягає у введенні суб'єкту у разі потреби ефективної кількості полінуклеотиду, що містить послідовність нуклеїнової кислоти, що кодує модифікований білок Rv3616c, де вказаний поліпептид викликає імунну відповідь. У іншому аспект, спосіб додатково полягає у викликанні імунної відповіді проти Mycobacterium tuberculosis. Застосування полінуклеотиду, що містить послідовність нуклеїнової кислоти, що кодує 19 UA 110103 C2 5 10 15 20 25 30 35 40 45 50 55 60 поліпептид, що містить модифікований білок Rv3616c у виробництві лікарського засобу для лікування, поліпшення стану або запобігання TB являє собою інший аспект винаходу. Крім того, передбачено фармацевтичну композицію, що містить: (a) модифікований білок Rv3616c; або (b) полінуклеотид, що містить послідовність нуклеїнової кислоти, що кодує модифікований білок Rv3616c; та (c) фармацевтично прийнятний носій або наповнювач. Крім того, передбачено імуногенну композицію, що містить: (a) модифікований білок Rv3616c; або (b) полінуклеотид, що містить послідовність нуклеїнової кислоти, що кодує модифікований білок Rv3616c; та (c) підсилювач неспецифічної імунної відповіді. Також передбачено вектор експресії, що містить послідовність нуклеїнової кислоти, що кодує модифікований білок Rv3616c. Подальший аспект винаходу стосується клітини - хазяя, трансформованого з вищезгаданим вектором експресії. Крім того, передбачено клітину - хазяя, що рекомбінантно експресує модифікований білок Rv3616c. Крім того, передбачено спосіб отримання модифікованого білку Rv3616c, де вищезгаданий спосіб містить етап рекомбінантної експресії вказаного поліпептиду у клітині - хазяїні. Також передбачені діагностичні набори, що містять: (a) модифікований білок Rv3616c; (b) обладнання, достатнє для контакту вказаного модифікованого білкуRv3616c зі зразком (наприклад, цільної крові або, більш відповідно, МКПК) з суб'єктом; та (c) засоби для кількісної Т - клітинної відповіді зразка. Інший аспект винаходу стосується діагностичного набору, що містить: (a) модифікований білок Rv3616c; та (b) обладнання, достатнє для контакту вказаного модифікованого білкуRv3616c з клітинами шкіри пацієнта. Подальший аспект винаходу стосується способу визначення інфекції Mycobacterium tuberculosis у суб'єкті, що полягає у: (a) контакті зразка з вищезгаданим суб'єктом з модифікованим білком Rv3616c; та (b) визначення у біологічному зразку присутності антитіл, що зв'язують модифікований білок Rv3616c. Винахід також передбачає діагностичний набор, що містить: (a) модифікований білок Rv3616c, вибірково іммобілізований на твердій поверхні; та (b) реагент для виявлення. У одному втіленні, суб'єкт що отримує модифікований білок Rv3616c, полінуклеотид або композицію відповідно до винаходу може мати активний туберкульоз (наприклад, активну інфекцію M. tuberculosis). У другому втіленні, суб'єкт може мати латентний туберкульоз (наприклад, “ сплячу ” інфекцію M. tuberculosis). У третьому втіленні, суб'єкт може бути вільним від туберкульозу (наприклад, вільним від інфекції M. tuberculosis). Суб'єкт отримання модифікованого білку Rv3616c, полінуклеотиду або композиції відповідно до винаходу може попередньо бути вакцинованим проти туберкульозу (наприклад, вакцинованим проти інфекції M. tuberculosis), як то бути вакцинованим з Bacillus Calmette-Guerin (BCG). Альтернативно, суб'єкт отримання поліпептиду, полінуклеотиду або композиції винаходу може не бути попередньо вакцинованим проти туберкульозу (наприклад, не вакцинованим проти інфекції M. tuberculosis), як то не бути вакцинованим з Bacillus Calmette-Guerin (BCG). Модифікований білок Rv3616c, полінуклеотид або композиція відповідно до винаходу може бути надана з метою: - лікування активного туберкульозу; - запобігання активного туберкульоз (наприклад, шляхом введення неінфікованому суб'єкту або, альтернативно, суб'єкту, що має латентну інфекцію); - лікування латентного туберкульозу; - запобігання латентного туберкульозу; або запобігання або затримування реактивування туберкульозу (особливо затримування реактивування туберкульозу, наприклад, строком на декілька місяців, років або навіть на невизначений час). Також передбачено спосіб лікування латентного туберкульозу, що полягає у: (i) ідентифікації суб'єкту на наявність латентної TB інфекції (наприклад, застосуванням туберкулінового тесту або аналізів на основі T - клітин); та (ii) введенні вищезгаданому суб'єкту безпечної та ефективної кількості модифікованого білку Rv3616c або полінуклеотиду, що кодує модифікований білок Rv3616c (як то у вигляді 20 UA 110103 C2 5 10 15 20 25 30 35 40 45 50 55 60 фармацевтичної або імуногенної композиції). Також запропоновано застосування поліпептиду заявленого винаходу у виробництві діагностичного набору для ідентифікації туберкульозу (наприклад, латентного TB) у піддослідному суб'єкті. Термін "Види Mycobacterium туберкульозного комплексу" охоплює види, що традиційно вважається причиною захворювання на туберкульоз, а саме екзогенні та умовно-патогенні види Mycobacterium, що спричинюють туберкульоз та захворювання легень у пацієнтів з порушенням імунної системи, як то у пацієнтів з ВІЛ, наприклад, M. tuberculosis, M. bovis або M. africanum, BCG, M. avium, M. intracellulare, M. celatum, M. genavense, M. haemophilum, M. kansasii, M. simiae, M. vaccae, M. fortuitum, та M. scrofulaceum (див.,наприклад, Harrison's Principles of Internal Medicine, Chapter 150, pp. 953-966 (16th ed., Braunwald, et al., eds., 2005). Заявлений винахід особливо спрямований до інфекції M. tuberculosis. Термін "ктивна інфекція" стосується інфекції (наприклад, інфекції M. tuberculosis) з проявленням симптомів захворювання та/або ураженнями (відповідно з проявленням симптомів захворювання). Терміни "неактивна інфекція", "спляча інфекція" або "латентна інфекція" має відношення до інфекції (наприклад, інфекції M.tuberculosis) без проявлення симптомів захворювання та/або уражень (відповідно без проявлення симптомів захворювання). Суб'єкт з латентною інфекцією, відповідно, буде тест-позитивним на цю інфекцію (наприклад, за допомогою туберкулінової проби або аналізів на основі Т - клітин) але не буде проявляти симптомів захворювання та/або уражень, пов'язаних з активною інфекцією. Термін "первинний туберкульоз" стосується клінічних проявів хвороби (наприклад, проявлення симптомів захворювання) безпосередньо під час інфекції (наприклад, інфекції M. tuberculosis). Див., Harrison's Principles of Internal Medicine, Chapter 150, pp. 953-966 (16th ed., Braunwald, et al., eds., 2005). Терміни "вторинний туберкульоз" або "пост-первинний туберкульоз" має відношення до реактивування сплячої, неактивної або латентної інфекції (наприклад, інфекції M. tuberculosis). Див., Harrison's Principles of Internal Medicine, Chapter 150, pp. 953-966 (16th ed., Braunwald, et al., eds., 2005). Термін "реактивування туберкульозу" стосується пізнішого проявлення симптомів захворювання у тест-позитивному на інфекцію суб'єкті (наприклад, за допомогою туберкулінової проби або аналізів на основі Т - клітин), що не мав наявних симптомів захворювання. Відповідно, суб'єкт не може повторно бути уражений цією інфекцією. Позитивний діагностичний тест свідчить, що особа інфікована, однак, вона може мати або може не мати передчасного проявлення активних симптомів захворювання, яких буде достатньо лікувати для переведення туберкульозу у неактивний або латентний стан. Слід визнати, що способи запобігання, затримування або лікування реактивування туберкульозу можна розпочати застосовувати у суб'єкті, що проявляє активні симптоми захворювання. Термін "стійкий до ліків" туберкульоз стосується інфекції (наприклад, інфекції M. tuberculosis), де штам інфікування не підтримується в статичному стані або не знищується (тобто, є стійким до) одним або декількома так званими хіміотерапевтичними агентами першої лінії, ефективними у лікуванні туберкульозу (наприклад, ісоніазид, рифампін, етамбутол, стрептоміцин та піразинамід). Термін туберкульоз "з множинною стійкістю до ліків" стосується інфекції (наприклад, інфекції M. tuberculosis), де штам інфікування є стійким до двох або декількох хіміотерапевтичних агентів першої лінії, ефективних у лікуванні туберкульозу. "Хіміотерапевтичний агент" стосується відомого у цій галузі фармакологічного агента, якого застосовують для лікування туберкульозу (наприклад, інфекції M. tuberculosis). Зразкові фармакологічні агенти, що застосовують для лікування туберкульозу охоплюють, але без обмеження, амікацин, аміносаліцилову кислоту, капреоміцин, циклорсерин, етамбутол, етіонамід, ізоніазид, канаміцин, піразинамід, рифаміцини (тобто, рифампін, рифапентин та рифабутин), стрептоміцин, офлоксацин, ципрофлоксацин, кларитроміцин, азитроміцин та флуорохінолони. Хіміотерапевтичні агенти "першої лінії" або "переднього краю", що застосовують для лікування не стійкого до ліків туберкульозу, охоплюють ізоніазид, рифампін, етамбутол, стрептоміцин та піразинамід. Хіміотерапевтичні агенти "другої лінії", що застосовують для лікування туберкульозу, що проявляє стійкість до одного або до декількох ліків "першої лінії" охоплюють офлоксацин, ципрофлоксацин, етіонаміду, аміносаліцилову кислоту, циклосерин, амікацин, канаміцин та капреоміцин. Такі фармакологічні агенти розглядаються у Розділі 48 книги Goodman and Gilman's The Pharmacological Basis of Therapeutics, Hardman and Limbird eds., 2001. Терміни "поліпептид", "пептид" та "білок", що застосовані тут взаємозамінно, мають відношення до полімеру амінокислотних залишків. Амінокислоти, що зустрічаються в природі, кодуються генетичним кодом, так само, як і амінокислоти, що потім модифікують, наприклад, 21 UA 110103 C2 5 10 15 20 25 30 35 40 45 50 55 60 гідроксипролін, γ- карбоксиглютамат та O-фосфосерин. Отже, поліпептид, відповідно до заявленого винаходу, буде складатися тільки з амінокислотних залишків, що зустрічаються в природі, головним чином, амінокислот, що кодуються генетичним кодом. Під "нуклеїновою кислотою" розуміють дезоксирибо- або рибонуклеотиди та їх полімери у або одно- або двохспиральній формі. Цей термін застосовують взаємозамінне з геном, кДНК, мРНК, олігонуклеотидом та полінуклеотидом. Амінокислоти можуть бути тут зазначені або у загальновідомому трьохлітерному вигляді або у однолітерному вигляді, рекомендованому відповідно біохімічної номенклатурі комісії IUPACIUB. Нуклеотиди також можуть бути позначені відповідно до їх загальноприйнятного однолітерного кодування. Під застосованим тут терміном "послідовність білка Rv3616c" мається на увазі послідовність поліпептиду Rv3616c, наведена у SEQ ID No:1 або її гомологія від видів Mycobacterium туберкульозного комплексу, наприклад, від видів M. tuberculosis, M. Bovis, M. africanum або від екзогенних або умовно-патогенних видів Mycobacterium, що викликають умовно-патогенні інфекції, як то інфекції легенів у хазяїв з імунодефіцитом (наприклад, пацієнтів з ВІЛ), наприклад, BCG, M. avium, M. intracellulare, M. celatum, M. genavense, M. haemophilum, M. kansasii, M. simiae, M. vaccae, M. fortuitum та M. scrofulaceum (див.,наприклад, Harrison's Principles of Internal Medicine, Chapter 150, pp. 953-966, 16th ed., Braunwald, et al., eds., 2005). Для забезпечення високого рівня ефективності серед вакцинованих хазяїв, компоненти вакцини повинні добре зберігатися серед клінічнозначущих штамів. Відповідно, білок Rv3616c походить від M. tuberculosis H37Rv (тобто, поліпептидна послідовність, надана у SEQ ID No:1) або його гомологи з інших штамів M. tuberculosis (як то, штами CDC1551, F11, Haarlem A та C). Штами M. Tuberculosis, що пов'язані зі стійкістю до ліків (наприклад, MDR або, головним чином, XDR) є особливо цінною основою для послідовності Rv3616c білку дикого типу. Штами, що викликають інтерес охоплюють: CDC1551 - вірулентний штам, що може передаватися. Родину Haarlem (як то Haarlem A) – стійкі до ліків штами, знайдені у переповнених популяціях людини. Штами M. tuberculosis, що є членами цієї родини, зустрічаються у будь-якій частині світу. Першого представника родини відкрили у місті Гарлем, Нідерланди. KZN4207 – стійкий до ліків ізолят, вилучений у пацієнтів у KwaZulu-Natal, Південна Африка. KZN1435 - стійкий до багатьох ліків (MDR) ізолят, вилучений у пацієнтів у KwaZulu-Natal, Південна Африка. KZN605 – ізолят з широкою стійкістю до ліків (XDR), вилучений у пацієнтів у KwaZulu-Natal, Південна Африка. C – штам з високим ступенем передачі з Нью-Йорку. У одних дослідженнях було знайдено, що цей штам був більш розповсюдженим серед споживачів ін'єкційних наркотиків та був стійким до реакційних проміжних азоту (Friedman et al. J. Infect. Dis. 1997 176(2):478-84). 94_M4241A - виділений у Сан - Франциско у 1994 р. у пацієнта, що народився у Китаї. Цей штам було попередньо проаналізовано геномним делеційним аналізом (Gagneux et al., PNAS 2006 103(8):2869-2873). 02_1987 - виділений у Сан - Франциско у 2002 р. з пацієнта, що народився у Південній Кореї. Цей штам було попередньо проаналізовано геномним делеційним аналізом (Gagneux et al., PNAS 2006 103(8):2869-2873). T92 - виділений у Сан – Франциско у 1999 р. у пацієнта, народженого у Філіпінах. Про цей штам надруковано у Hirsh et al. PNAS 2004 101:4871–4876). T85 - виділений у Сан - Франциско у 1998 р. у пацієнта, народженого у Китаї. Про цей штам надруковано у Hirsh et al. PNAS 2004 101:4871–4876). EAS054 - виділений у Сан - Франциско у 1993 р. у пацієнта, що народився в Індії. Цей штам було попередньо проаналізовано геномним делеційним аналізом (Gagneux et al., PNAS 2006 103(8):2869-2873). Gagneux et al., PNAS 2006 103(8):2869-2873 та Herbert et al. Infect. Immun. 2007 75(12):57985805 наводять цінну довідкову інформацію про ряд відомих існуючих штамів M. tuberculosis. Найбільш відповідним чином, білок Rv3616c було вибрано від поліпептидних послідовностей, наведених у SEQ ID 1 та 3-7, зокрема, SEQ ID 1 та 3-6, наприклад, SEQ ID No:1. Вирівнювання SEQ ID 1 та 3-7 наведено у Фіг. 15. З модифікованих білків Rv3616c окремий інтерес викликають ті, що містять (наприклад, складаються з) SEQ ID No:161-169. Полінуклеотиди, що викликають окремий інтерес походять від послідовностей дикого типу, відповідних вищезазначеним штамам M. Tuberculosis, наприклад, що походять від SEQ ID No: 2 або від спорідненої з ними E. coli кодон - оптимізованою SEQ ID No:160. 22 UA 110103 C2 5 10 15 20 25 30 35 40 45 50 55 60 Послідовність, що містить модифіковані білки Rv3616c (або пов'язані з ними полінуклеотиди) заявленого винаходу може, крім того, містити інші компоненти, розроблені для підсилення їх імуногенності або для поліпшення цих антигенів в інших аспектах. Наприклад, поліпшеному виділенню поліпептидних антигенів можна сприяти додаванням відрізків гістидинових залишків (звичайно відомих, як his-tag) до одного кінця антигену. Термін “ his-tag ” має відношення до низки гістидинових залишків, типово у шість залишків, що вставлені у послідовність зразка. Для мінімізування порушення активності, пов'язаного з послідовністю зразка, звичайно his-tag вставляють до N-кінця, зазвичай безпосередньо після ініціювання метіонінового залишку або іншого на C - кінці. Вони звичайно є гетерологічними до нативній послідовності, але здатні до включення, оскільки сприяють виділенню шляхом поліпшення зв'язування білка з іммобілізованими смолами у афінній хроматографії з застосуванням іммобілізованих металів (IMAC). Звичайно, розмова про присутність або відсутність не має значення з точки зору виявлення бажаної імунної відповіді проти референсного білка. Однак, для уникнення ризику несприятливої реакції проти самих his-tag, вважається кращим звести до мінімуму їх довжину, наприклад, до чотирьох або менше залишків, зокрема, до двох залишків або взагалі повністю виключити застосування his-tag. Для підвищення величини та/або розмірів викликаної імунної відповіді, композиції, поліпептиди (та нуклеїнові кислоти, що їх кодують), можуть бути отримані у такому вигляді, щоб вони містили численні модифіковані послідовності Rv3616c та/або додаткові гетерологічні поліпептиди або полінуклеотиди, що їх кодують, отримані з видів Mycobacterium (зокрема, M. tuberculosis). Досвідченому фахівцю зрозуміло, що коли у комбінації застосовано декілька компонентів, то точне відтворення може змінюватись. Наприклад, модифікований компонент послідовності Rv3616c та додаткова копія антигену або додатковий гетерологічний антигенний компонент можуть бути відтворені у вигляді: (1) двох індивідуальних поліпептидних компонентів; (2) гібридного білку, що містить обидва поліпептидні компоненти; (3) одного поліпептидного та одного полінуклеотидного компонента; (4) двох індивідуальних полінуклеотидних компонентів; (5) одиничного полінуклеотиду, що кодує два індивідуальних поліпептидних (6) компонента; або одиничного полінуклеотиду, що кодує гібридний білок, що містить обидва поліпептидні компоненти. Така гнучкість в рівній мірі відноситься до ситуацій, де у комбінації застосовано три або більше компонентів. Однак, часто для зручності є бажаним, щоб при наявності кількох компонентів, вони були розміщені у одиничному гібридному білку або у полінуклеотиді, що кодує одиничний гібридний білок. У одному втіленні винаходу всі антигенні компоненти надано у вигляді поліпептидів (наприклад, у одиничному гібридному білку). У альтернативному втіленні винаходу всі антигенні компоненти надано у вигляді полінуклеотидів (наприклад, одиничного полінуклеотиду, що кодує одиничний гібридний білок). Термін "гетерологічний" при застосуванні з посиланням на частини нуклеїнової кислоти вказує на те, що нуклеїнова кислота містить дві або більше підпослідовностей, що не зустрічаються з подібним взаємним розташуванням одна до іншої у природі. Наприклад, нуклеїнова кислота, що типово є рекомбінантно отриманою, має дві або більше послідовностей з неспорідненими генами, розташованими, щоб створити нову функціональну нуклеїнову кислоту, наприклад, a промотором з одного джерела та з кодуючим регіоном з іншого джерела. Подібним чином, гетерологічний білок вказує на те, що білок містить дві або більше підпослідовностей, що не зустрічаються з подібним взаємним розташуванням одна до іншої у природі. (наприклад, гібридний білок). Термін "Гібридний (злитий) поліпептид" або "гібридний білок" (fusion protein) стосується білка, що має принаймні два гетерологічних поліпептиди (наприклад, принаймні два поліпептиди Mycobacterium sp.), ковалентно пов'язані між собою, або безпосередньо або крізь амінокислотний лінкер. Поліпептиди, що утворюють гібридний білок типово пов'язані С-кінцем до N-кінця, хоча вони також можуть бути пов'язані С-кінцем до C-кінця, N-кінцем до N-кінця або N-кінцем до C- кінця. Поліпептиди гібридного білку можуть бути розміщені в будь-якому порядку. Цей термін також стосується консервативно змінених варіантів, поліморфних варіантів, алелей, мутантів, імуногенних фрагментів та міжвидових гомологів антигену, що входять до складу гібридного білка. Антигени Mycobacterium tuberculosis описано у Cole et al., Nature 393:537 (1998), що висвітлює повний геном Mycobacterium tuberculosis. Антигени інших видів Mycobacterium, що відповідають антигенам M. tuberculosis можуть бути ідентифіковані, наприклад, з застосуванням, як тут описано, алгоритмів порівняння послідовності або інших 23 UA 110103 C2 5 10 15 20 25 30 35 40 45 50 55 60 відомих фахівцям способів, наприклад, гібридізації та зв'язування антитіл. Термін "злитий" стосується ковалентного зв'язку між двома поліпептидами у гібридному білку. Звичайно поліпептиди з'єднані пептидним зв'язком або безпосередньо один до іншого або через амінокислотний лінкер. Вибірково, пептиди можуть бути з'єднані непептидними ковалентними зв'язками, відомими фахівцям. Зразкові антигени M. Tuberculosis, що можуть бути скомбіновані з модифікованою послідовністю Rv3616c охоплюють один або декілька з (наприклад, 1-5, 1-3, зокрема 1) наступного: (i) послідовність поліпептиду Mtb8.4 (також відома, як DPV та Rv1174c), що описана у SEQ ID No:102 у WO97/09428 (кДНК у SEQ ID No:101) та у Coler et al Journal of Імуноlogy 1998 161:2356-2364. Окремий інтерес викликає зріла послідовність Mtb8.4, що позбавлена головного сигнального пептиду (тобто амінокислотних залишків 15-96 з SEQ ID No:102 °F WO97/09428). Повнорозмірна послідовність поліпептиду Mtb8.4 показана у SEQ ID No: 8; (ii) послідовність поліпептиду Mtb9.8 (також відома, як MSL та Rv0287), описана, як SEQ ID No:109 у WO98/53075 (фрагменти MSL є у SEQ ID Nos: 110-124 у WO98/53075, SEQ ID Nos: 119-120 також викликають окремий інтерес) та також у Coler et al Vaccine 2009 27:223-233 (зокрема, реагуючі фрагменти показано тут у Фіг. 2). Повнорозмірну поліпептидну послідовність для Mtb9.8 показано у SEQ ID No: 9; (iii) послідовність поліпептиду Mtb9.9 (також відома, як Mtb9.9A, MTI, MTI-A та Rv1793) що описана у SEQ ID No:19 °F WO98/53075 та у Alderson et al Journal of Experimental Medicine 2000 7:551-559 (фрагменти MTI виявлені у SEQ ID Nos: 17, 51-66 у WO98/53075, SEQ ID Nos: 17, 51, 52, 53, 56 та 62-65 також викликають окремий інтерес). Кілька поліпептидних варіантів MTI описано у SEQ ID Nos: 21, 23, 25, 27, 29, 31 у WO98/53075 та у Alderson et al Journal of Experimental Medicine 2000 7:551-559. Повнорозмірну послідовність поліпептиду для Mtb9.9 показано у SEQ ID No:10; (iv) послідовність поліпептиду Ra12 (також відома, як Mtb32A C-кінцевий антиген), що описана у SEQ ID No:10 у WO01/98460 та у Skeiky et al Journal of Immunology 2004 172:76187682. Повнорозмірну послідовність поліпептиду для Ra12 показано у SEQ ID No:11; (v) послідовність поліпептиду Ra35 (також відома, як Mtb32A N- кінцевий антиген), що описана у SEQ ID No: 8 °F WO01/98460 та у Skeiky et al Journal of Immunology 2004 172:76187682. Повнорозмірну послідовність поліпептиду для Ra35 показано у SEQ ID No:12; (vi) послідовність поліпептиду TbH9 (також відома, як Mtb39, Mtb39A, TbH9FL та Rv1196), що описана у SEQ ID No:107 у WO97/09428, та також у Dillon et al Infection and Immunity 1999 67(6):2941-2950 та Skeiky et al Journal of Immunology 2004 172:7618-7682. Повнорозмірну послідовність поліпептиду для TbH9 показано у SEQ ID No:13; (vii) послідовність поліпептиду Mtb41 (також відома, як MTCC2 та Rv0915c), що описана у SEQ ID No:142 у WO98/53075 (кДНК у SEQ ID No:140) та у Skeiky et al Journal of Immunology 2000 165:7140-7149. Повнорозмірну послідовність поліпептиду для Mtb41 показано у SEQ ID No:14; (viii) послідовність поліпептиду ESAT-6 (також відома, як esxA та Rv3875), що описана у SEQ ID No:103 у WO97/09428 (кДНК у SEQ ID No:104) та у Sorensen et al Infection and Immunity 1995 63(5):1710-1717. Повнорозмірну послідовність поліпептиду для ESAT-6 показано у SEQ ID No:15.L. Sorensen, S. Nagai, G. Houen, P. Andersen and A.B. Andersen, Purification and characterization of a low-molecular-mass T-cell antigen secreted by Mycobacterium tuberculosis, Infect Immun 63 (1995) (5), pp. 1710–1717; (ix) комплексні антигени Ag85 (наприклад, Ag85A, також відомий, як fbpA та Rv3804c; або Ag85B, також відомий, як fbpB та Rv1886c), що обговорювалися, наприклад, у Content et al Infection and Immunity 1991 59:3205-3212 та у Huygen et al Nature Medicine 1996 2(8):893-898. Повнорозмірну послідовність поліпептиду для Ag85A показано у SEQ ID No:16 (зрілий білок залишків 43-338, тобто з втраченим сигнальним пептидом, також викликає окремий інтерес). Повнорозмірну послідовність поліпептиду для Ag85B показано у SEQ ID No:17 (зрілий білок залишків 41-325, тобто з втраченим сигнальним пептидом, також викликає окремий інтерес); (x) альфа - кристалін (також відомий, як hspX та Rv2031c), що описаний у Verbon et al Journal of Bacteriology 1992 174:1352-1359 та у Friscia et al Clinical and Experimental Immunology 1995 102:53-57 (Окремий інтерес викликають фрагменти, що відповідають залишкам 71-91, 2140, 91-110 та 111-130)). Повнорозмірну послідовність поліпептиду для альфа-кристаліну показано у SEQ ID No:18; (xi) Mpt64 (також відома, як Rv1980c) що описана у Roche et al Scandinavian Journal of Immunology 1996 43:662-670. Повнорозмірну послідовність поліпептиду для MPT64 показано у SEQ ID No:19 (зрілий білок залишків 24-228, тобто з втраченим сигнальним пептидом, також викликає окремий інтерес): (xii) Mtb32A, що описана у SEQ ID No: 2 (повнорозмірна) та залишки 8-330 SEQ ID No: 4 24 UA 110103 C2 5 10 15 20 25 30 35 40 45 50 55 60 (зріла) у WO01/98460, головним чином, варіанти мають принаймні одну мутовану каталітичну тріаду (наприклад, каталітичний залишок серину, що може, наприклад, бути мутованим на аланін). Повнорозмірну послідовність поліпептиду для Mtb32A показано у SEQ ID No: 20. Зрілу форму Mtb32A, що має a Ser/Ala мутацію показано у SEQ ID No: 21; (xiii) TB10.4, повнорозмірну послідовність поліпептиду для TB10.4 показано у SEQ ID No: 22 .L. Sorensen, S. Nagai, G. Houen, P. Andersen and A.B. Andersen, Purification and characterization of a low-molecular-mass T-cell antigen secreted by Mycobacterium tuberculosis, Infect Immun 63 (1995) (5), pp. 1710–1717; (xiv) Rv1753c, повнорозмірну послідовність поліпептиду для Rv1753c з Mycobacterium tuberculosis H37Rv показано у SEQ ID No:157; (xv) Rv2386c, повнорозмірну послідовність поліпептиду для Rv2386c з Mycobacterium tuberculosis H37Rv показано у SEQ ID No:158; та/або (xvi) Rv2707c, повнорозмірну послідовність поліпептиду для Rv2707c з Mycobacterium tuberculosis H37Rv показано у SEQ ID No:159. Або їх комбінації, як то: (a) комбінація компонентів Ra12, TbH9 та Ra35, наприклад, у вигляді гібридного білку, як то Mtb72f. Послідовність поліпептиду Mtb72f показана у SEQ ID No: 6 у WO2006/117240 (кДНК у SEQ ID No: 5) та у Skeiky et al Journal of Immunology 2004 172:7618-7682 (де вона вибірково містить His-tag для сприяння очищення, при застосуванні у заявленому винаході, відповідно, Mtb72f позбавлена вибіркових гістидинових залишків). Послідовність поліпептиду для Mtb72f показана у SEQ ID No: 23; (b) комбінація компонентів Ra12, TbH9 та Ser/Ala мутованого Ra35 (тобто, де каталітичний сериновий залишок заміщено на аланін), наприклад, у вигляді гібридного білку, як то M72. Послідовність поліпептиду M72 показана у SEQ ID No: 4 у WO2006/117240 (кДНК у SEQ ID No: 3) де вона містить вибірковий подвійний гістидин для сприяння у виробництві, при застосуванні у заявленому винаході M72 може також включати подвійний гістидин, хоча, відповідно, у M72 вибірковий подвійний гістидин відсутній (тобто, залишки 4-725 з SEQ ID No: 4 у WO2006/117240 викликають окремий інтерес). Послідовність поліпептиду для M72 показано у SEQ ID No: 24; (c) комбінація компонентів Mtb8.4, Mtb9.8, Mtb9.9 та Mtb41, наприклад, у вигляді гібридного білку, як то Mtb71f. Послідовність поліпептиду Mtb71f показана у SEQ ID No:16 у WO99/051748 (кДНК у SEQ ID No:15), де вона містить вибірковий His-tag для сприяння очищення, при застосуванні у заявленому винаході, відповідно, Mtb71f відповідає амінокислотним залишкам 9710 у SEQ ID NO:16 з WO99/051748. Послідовність поліпептиду для Mtb71f показана у SEQ ID No: 25; (d) комбінація компонентів Mtb72f або M72 (відповідно, без вибіркових гістидинових залишків для сприяння експресії) з Mtb9.8 та Mtb9.9, наприклад, у гібридному білку. Послідовність поліпептиду для гібриду M72-Mtb9.9-Mtb9.8 показана у SEQ ID No: 26 (гібрид M92), при застосуванні у заявленому винаході, гібрид M72-Mtb9.9-Mtb9.8 може вибірково містити подвійний гістидин слідом за ініциаторним метіоніновим залишком для сприяння у виробництві; (e) комбінація компонентів Mtb72f або M72 (відповідно, без вибіркових гістидинових залишків для сприяння експресії) з Ag85B, наприклад, у вигляді гібридного білку, як-то Mtb103f. Послідовність поліпептиду Mtb103f описана у SEQ ID No:18 з WO03/070187 (кДНК у SEQ ID No:10), де вона містить вибірковий His-tag для сприяння очищення, при застосуванні у заявленому винаході, відповідно, Mtb103f відповідає амінокислотним залишкам 8-1016 у SEQ ID No:18 з WO03/070187. Також, окремий інтерес викликає M103, тобто Mtb103f, що містить Ser/Ala мутацію у Ra35 компоненті, при застосуванні у заявленому винаході, відповідно, M103 відповідає амінокислотним залишкам 8-1016 у SEQ ID No:18 з WO03/070187, де сериновий залишок у позиції 710 заміщений на аланін. Послідовність поліпептиду для M103 показана у SEQ ID No: 27, при застосуванні у даному винаході, гібрид M72-Mtb9.9-Mtb9.8 може вибірково містити подвійний гістидин слідом за ініциаторним метіоніновим залишком для сприяння у виробництві; (f) комбінація компонентів Mtb72f або M72 (відповідно, без вибіркових гістидинових залишків для сприяння експресії) з Mtb41, наприклад, у вигляді гібридного білку, як то Mtb114f. Послідовність поліпептиду Mtb114f описана у SEQ ID No:16 у WO03/070187 (кДНК у SEQ ID No: 9), де вона містить вибірковий His-tag для сприяння очищення, при застосуванні у заявленому винаході, відповідно, Mtb114f відповідає амінокислотним залишкам 8-1154 SEQ ID No:16 з WO03/070187. Також, окремий інтерес викликає M114, тобто Mtb114f incorporating a Ser/Ala мутаці у Ra35 компонент, при застосуванні у заявленому винаході, відповідно, M114 відповідає амінокислотним залишкам 8-1154 у SEQ ID No:16 з WO03/070187, де сериновий залишок у позиції 710 заміщений аланіном. Послідовність поліпептиду для M114 показана у SEQ ID No: 28, при застосуванні у заявленому винаході, гібрид M72-Mtb9.9-Mtb9.8 може вибірково подвійний 25 UA 110103 C2 5 10 15 20 25 30 35 40 45 50 55 60 гістидин слідом за ініциаторним метіоніновим залишком для сприяння виробництва; (g) комбінація компонентів Ag85B та ESAT-6, наприклад, у гібриді, описаному у Doherty et al Journal of Infectious Diseases 2004 190:2146–2153; та/або (h) комбінація компонентів Ag85B та TB10.4, наприклад, у гібриді, описаному у Dietrich et al Journal of Immunology 2005 174(10):6332-6339 190:2146–2153. Окремий інтерес викликають комбінації компонента модифікованої послідовності Rv3616c та компонента Rv1753c. Очевидно, що подібні комбінації можуть вибірково містити інші додаткові антигенні компоненти (наприклад, компоненті M72). Інші інтересуючі комбінації містять компонент модифікованої послідовності Rv3616c та компонент M72. Наступні інтересуючі комбінації містять компонент модифікованої послідовності Rv3616c та компонент Rv2386c. Інші інтересуючі комбінації охоплюють комбінації, що містять компонент модифікованої послідовності Rv3616c та компонент Rv2707c. Додаткові інтересуючі комбінації містять компонент модифікованої послідовності Rv3616c та альфа - кристаліновий компонент. Досвідченому фахівцю зрозуміло, що комбінації не повинні спиратися на специфічні послідовності, описані вище у (i)-(xvi) та (a)-(h) та що консервативно модифіковані варіанти (наприклад, що мають принаймні 70 % тотожності, як то принаймні 80 % тотожності, зокрема, принаймні 90 % тотожності та, головним чином, принаймні 95 % тотожності) або імуногенні фрагменти (наприклад, принаймні 20 % повнорозмірного антигену, як то принаймні 50 % антигену, зокрема, принаймні 70 % та, головним чином, принаймні 80 %) описаної послідовності можуть бути застосовані для досягнення того ж практичного ефекту. Кожна з вищезгаданих індивідуальних антигенних послідовностей також висвітлена у Cole et al Nature 1998 393:537-544 та Camus Microbiology 2002 148:2967-2973. Геном H37Rv M. tuberculosis є загальнодоступним, наприклад, на веб - сайті Welcome Trust Sanger Institute (www.sanger.ac.uk/Projects/M_tuberculosis/) та в інших джерелах. Багато вищезгаданих антигенів також описано у U.S. patent application №№ 08/523,435, 08/523,436, 08/658,800, 08/659,683, 08/818,111, 08/818,112, 08/942,341, 08/942,578, 08/858,998, 08/859,381, 09/056,556, 09/072,596, 09/072,967, 09/073,009, 09/073,010, 09/223,040, 09/287,849 та у PCT patent applications PCT/US98/10407, PCT/US98/10514, PCT/US99/03265, PCT/US99/03268, PCT/US99/07717, WO97/09428 та WO97/09429, WO98/16645, WO98/16646, кожна з яких включена тут в якості посилання. Композиції, поліпептиди та нуклеїнові кислоти винаходу також можуть містити додаткові поліпептиди з інших джерел. Наприклад, композиції та гібридні білки винаходу можуть містити поліпептиди або нуклеїнові кислоти, що кодують поліпептиди, де поліпептид підсилює експресію антигену, наприклад, NS1, білка вірусу грипу (див., наприклад, WO99/40188 та WO93/04175). Нуклеїнові кислоти винаходу можуть бути побудовані на основі невипадкового застосування кодонів (codon preference) у вибраних видах, наприклад, у людині (у випадку експресії in vivo) або у окремих бактеріях (у випадку продукування поліпептиду). SEQ ID No:160 наприклад, стосується кодон - оптимізованого полінуклеотиду для експресії Rv3616c від послідовності H37Rv у E. coli. Модифікований компонент послідовності Rv3616c може також бути введено з одним або декількома хіміотерапевтичними агентами, ефективними проти туберкульозу (наприклад, проти інфекції M. tuberculosis). Приклади таких хіміотерапевтичних агентів охоплюють, але без обмеження, амікацин, аміносаліцилову кислоту, капреоміцин, циклосерин, етамбутол, етіонамід, ізоніазид, канаміцин, піразинамід, рифаміцинів (тобто, рифампіцин, рифабутин та рифампентин), стрептоміцин, офлоксацин, ципрофлоксацин, кларитроміцин, азитроміцин та фторхінолони. Таку хіміотерапію призначають за рішенням лікаря з застосуванням найбільш прийнятної лікарської комбінації. Хіміотерапевтичні агенти першої лінії, застосовані для лікування нестійкого до ліків туберкульозу (наприклад, інфекції M. tuberculosis), охоплюють ізоніазид, рифампіцин, етамбутол, піразинамід та стрептоміцин. Хіміотерапевтичні агенти другої лінії, застосовані для лікування туберкульозу, (наприклад, інфекції M. tuberculosis), що проявляє стійкість до одного або декількох ліків першої лінії охоплюють офлоксацин, ципрофлоксацин, етіонамід, аміносаліцилову кислоту, циклосерин, амікацин, канаміцин та капреоміцин. Загальноприйнятні хіміотерапевтичні агенти звичайно вводять протягом відносно тривалого періоду (біля 9 місяців). Комбінація загальноприйнятних хіміотерапевтичних агентів з введенням компонента модифікованої послідовності Rv3616c відповідно до заявленого винаходу може дозволити скоротити період хіміотерапевтичного лікування (наприклад, до 8 місяців, 7 місяців, 6 місяців, 5 місяців, 4 місяців, 3 місяців або менше) без зниження ефективності. 26 UA 110103 C2 5 10 15 20 25 30 35 40 45 50 55 60 Окремий інтерес викликає застосування компонента модифікованої послідовності Rv3616c у поєднанні з Bacillus Calmette-Guerin (BCG), наприклад, у вигляді модифікованої BCG, що рекомбінантно експресує модифікований білок Rv3616c. Альтернативно, компонент модифікованої послідовності Rv3616c може бути застосований для підвищення відповіді суб'єкта до вакцинації з BCG або шляхом спільного введення або бустер - імунізації з попередньою вакцинацією з BCG. При застосуванні для підвищення відповіді суб'єкта до вакцинації з BCG, компонент модифікованої послідовності Rv3616c, звичайно, може бути надано у вигляді поліпептиду або полінуклеотиду (вибірково, у поєднанні з вищевказаними додатковими антигенними компонентами). Досвідченому фахівцю відомі комбінації компонентів, що не потребують спільного введення та яких можна застосувати окремо або у комбінації; в той же час, послідовно або протягом короткого періоду, одним або різними шляхами. Тим не менше, для зручності звичайно бажаним є (при сумісності режимів введення) вводити комбінацію компонентів у вигляді одиничної композиції. Поліпептиди, полінуклеотиди та композиції заявленого винаходу звичайно призначають людям але, очікується, що вони будуть ефективними для інших ссавців, в тому числі, для хатніх ссавців (наприклад, собак, кішок, кроликів, щурів, мишей, морських свинок, хом'яків, шиншил) та сільськогосподарських ссавців (наприклад, корів, свиней, овець, кіз, коней). T - клітинні епітопи є короткими суміжними послідовностями амінокислот, що впізнають T клітини (наприклад, T- клітини CD4+ або CD8+). Ідентифікація T - клітинних епітопів може бути досягнута за допомогою відомих фахівцям експериментів по картуванню епітопів (див.,наприклад, Paul, Fundamental Іmmunology, 3rd ed., 243-247 (1993); Beiβbarth et al Bioinformatics 2005 21(Suppl. 1):i29-i37). Альтернативно, епітопи можна передбачити та картувати з застосуванням підходів, розглянутих у Прикладах. У неодноманітній безпородній популяції, наприклад, людей, наявність різних типів HLA означає, що окремі епітопи можуть не розпізнаватися всіма членами популяції. В результаті вирішальної участі Т - клітинної відповіді у туберкульозі, для максимізування рівня впізнавання та шкали імунної відповіді, оптимально модифікований білок Rv3616c є тим, що містить більшість (або, відповідно, всі) T- клітинних епітопів в інтактному стані. "Варіанти" або "консервативно модифіковані варіанти" мають відношення до амінокислотних послідовностей та послідовностей нуклеїнових кислот. Відносно окремих послідовностей нуклеїнових кислот, консервативно модифіковані варіанти мають відношення до нуклеїнових кислот, що кодують ідентичні або суттєво ідентичні амінокислотні послідовності або, якщо нуклеїнові кислоти не кодують амінокислотну послідовність до суттєво ідентичних послідовностей. У зв'язку з виродженням генетичного коду, велика кількість функціонально ідентичних нуклеїнових кислот кодують будь-який обраний білок. Наприклад, кодони GCA, GCC, GCG та GCU всі кодують амінокислоту аланін. Отже, у кожній позиції, де аланін визначається кодоном, цей кодон може бути заміщено будь-яким з відповідних описаних кодонів без змінення закодованого поліпептиду. Такі змінення нуклеїнових кислот ведуть до появи "тихих" або "дегенеративних" варіантів, що є одним з видів консервативно модифікованих варіантів. Тут кожна послідовність нуклеїнової кислоти, що кодує поліпептид також описує кожне можливе "тихе" змінення нуклеїнової кислоти. Будь-якому фахівцю зрозуміло, що кожен кодон нуклеїнової кислоти (за виключенням AUG, що звичайно є тільки метіоніновим кодоном та TGG, що звичайно є тільки триптофановим кодоном) можна замінити з отриманням функціонально ідентичної молекули. Відповідно, кожне "тихе" змінення нуклеїнової кислоти, що кодує поліпептид передбачено у кожній описаній послідовності. "Не - тихі" змінення є такими, що ведуть до змінень у кодуючій амінокислотній послідовності (заміщенням, видаленням або додаванням амінокислотних залишків). Фахівцям зрозуміло, що певна полінуклеотидна послідовність може містити як "тихі", так і "не - тихі" консервативні змінення. Відносно заміщень білкової послідовності, то досвідченому фахівцю зрозуміло, що окремі заміщення, видалення або додавання до поліпептиду, що змінюють, видаляють або додають одиничні амінокислоти або невеликий відсоток амінокислот відноситься до "консервативно модифікованого варіанту", де змінення ведуть до заміни амінокислоти на функціонально подібну амінокислоту або до заміщення/видалення/додавання залишків, що суттєво не впливає на біологічну функцію варіанту. Таблиці консервативних заміщень, що стосуються подібних функціональних амінокислот є добре відомими. Подібні консервативно модифіковані варіанти також не виключають поліморфні варіанти, міжвидові гомологи та алелі винаходу. Головним чином, подібні консервативні заміни будуть припадати на одну з амінокислотних груп, зазначених нижче, хоча в деяких обставинах, можлива заміна без істотного впливу на імуногенні властивості антигену. З наступних восьми груп кожна містить амінокислоти, які є типовими 27 UA 110103 C2 5 10 15 20 25 30 35 40 45 50 55 60 консервативними заміщеннями одних на інші: 1) Аланін (A), Гліцин (G); 2) Аспарагінова кислота (D), Глютамінова кислота (Е); 3) Аспарагін (N), Глютамін (Q); 4) Аргінін (R), Лізин (K); 5) Ізолейцин (I), Лейцин (L), Метіонін (М), Валін (V); 6) Фенілаланін (F), Тирозин (Y), Триптофан (W); 7) Серин (S), Треонін (T); 8) Цистеїн (C), Метіонін (M) (див., наприклад, Creighton, Proteins 1984). Відповідно, такі заміщення не проводять у ділянці епітопа, отже, вони не мають значного впливу на імуногенні властивості антигену. Білкові варіанти можуть також охоплювати варіанти з вставленою додатковою амінокислотою порівняно з референсною послідовністю. Відповідно, подібні вставки не проводять у ділянці епітопа, отже, вони не мають значного впливу на імуногенні властивості антигену. Одним прикладом подібних вставок є короткі відрізки гістидинових залишків (наприклад, 2-6 залишків), що застосовують для сприяння експресі та/або очищення антигену. Білкові варіанти можуть також охоплювати варіанти з видаленою амінокислотою порівняно з референсною послідовністю. Відповідно, подібні видалення не проводять у ділянці епітопа, отже, вони не мають значного впливу на імуногенні властивості антигену. Досвідченому фахівцю зрозуміло, що певні білкові варіанти можуть містити заміщення, видалення та додавання (або їх будь-які комбінації). Терміни "ідентичність" або відсоток "ідентичності", у контексті двох або більше нуклеїнових кислот або послідовностей поліпептидів, має відношення до двох або більше послідовностей або суб-послідовностей що є схожими або мають певний відсоток однакових амінокислотних залишків або нуклеотидів (тобто, 70 % тотожності, вибірково 75 %, 80 %, 85 %, 90 %, 95 %, 98 % або 99 % тотожності у певному регіоні), що при порівнянні та вирівнюванні для максимальної відповідності через вікно порівняння або призначений регіон вимірюють за допомогою одного з наступних алгоритмів порівняння послідовності або вирівнюванням вручну та візуальним оглядом. Потім подібні послідовності вважаються "істотно ідентичними". Це визначення також стосується компліменту тестової послідовності. Вибірково, тотожність існує у регіоні, що має довжину, принаймні, біля 25-50 амінокислот або нуклеотидів або, вибірково, у регіоні, що має довжину, принаймні, біля 75-100 амінокислот або нуклеотидів. Відповідно, порівняння проводять у вікні, що відповідає всій довжині референсної послідовності (порівняно з варіантною послідовністю). Звичайно, для послідовного порівняння, одна послідовність є у якості референсної послідовності, до якої порівнюють тестові послідовності. При застосуванні алгоритму порівняння послідовності, до комп'ютера вводять тестові та референсні послідовності та, у разі необхідності, визначають координати послідовностей та програмні параметри алгоритму послідовності. Також можуть бути застосовані програмні параметри за замовчуванням або визначені альтернативн параметри. Далі, за допомогою алгоритму порівняння послідовності обчислюють відсоток тотожностей тестових послідовностей щодо референсної послідовності на основі програмних параметрів. "Вікно порівняння", як тут застосовано, має відношення до сегменту, у якому послідовність можна порівняти з референсною послідовністю з тією ж кількістю суміжних позицій після оптимального вирівнювання двох послідовностей. Способи вирівнювання послідовностей для порівняння добре відомі. Оптимальне вирівнювання послідовностей для порівняння може бути проведено, наприклад, за допомогою алгоритму місцевої гомології від Smith & Waterman, Adv. Appl. Math. 2:482 (1981), за допомогою алгоритму вирівнювання гомології від Needleman & Wunsch, J. Mol. Biol. 48:443 (1970), за допомогою способа пошуку подібностей від Pearson & Lipman, Proc. Nat'l. Acad. Sci. USA 85:2444 (1988), комп'ютеризованними втіленнями цих алгоритмів (GAP, BESTFIT, FASTA, TFASTA у Wisconsin Genetics Software Package, Genetics Computer Group, 575 Science Dr., Madison, WI) або вирівнюванням вручну та візуальним оглядом (див., наприклад, Current Protocols in Molecular Biology (Ausubel et al., eds. 1995 supplement)). Одним прикладом корисного алгоритму є PILEUP. PILEUP створює численні послідовні вирівнювання з групою споріднених послідовностей з застосуванням прогресивних, попарних вирівнювань для того, щоб показати спорідненість та відсоток ідентичності послідовностей. Він також дозволяє накреслити дерево або дендрограму, що показує застосовану для отримання вирівнювання кластеризацію спорідненостей. У PILEUP застосовано спрощення способу 28
ДивитисяДодаткова інформація
Назва патенту англійськоюModified tuberculosis antigen
Автори англійськоюBlais, Normand, Brown, James, Gelinas, Anne-Marie, Mettens, Pascal, Murphy, Dennis
Назва патенту російськоюМодифицированный туберкулезный антиген
Автори російськоюБлейс Норманд, Браун Джеймс, Гелинас Анн-Мари, Меттенс Паскаль, Мюрфи Деннис
МПК / Мітки
МПК: A61P 31/06, C07K 14/35, A61K 39/04
Мітки: антиген, модифікований, туберкульозний
Код посилання
<a href="https://ua.patents.su/182-110103-modifikovanijj-tuberkuloznijj-antigen.html" target="_blank" rel="follow" title="База патентів України">Модифікований туберкульозний антиген</a>
Попередній патент: Вторинні похідні 8-гідроксихінолін-7-карбоксаміду для їх застосування як протигрибкових засобів
Наступний патент: Сердечник для виробу у формі листа, намотаного на цей сердечник, і рулон, одержаний з таким сердечником
Випадковий патент: Поршневий дозатор