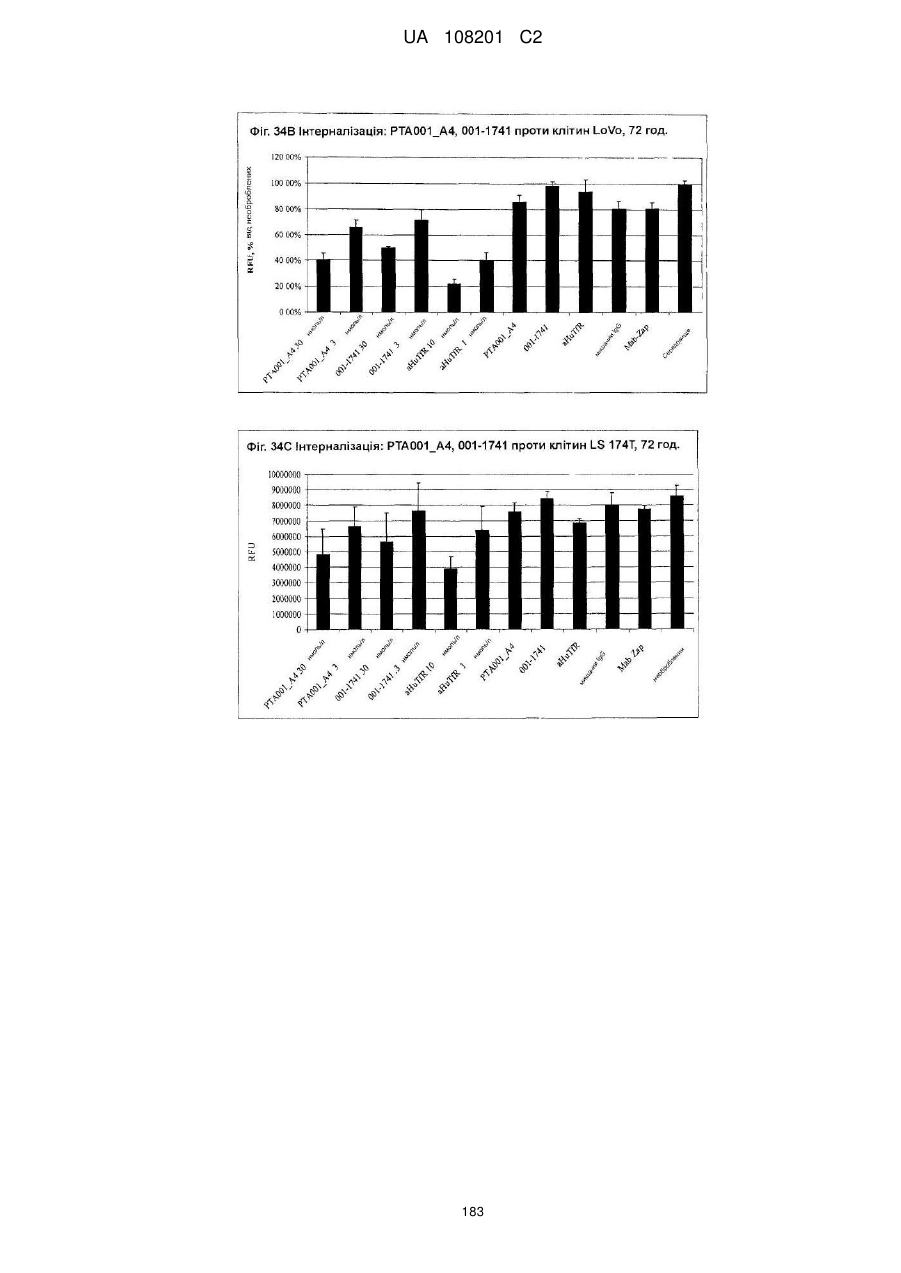
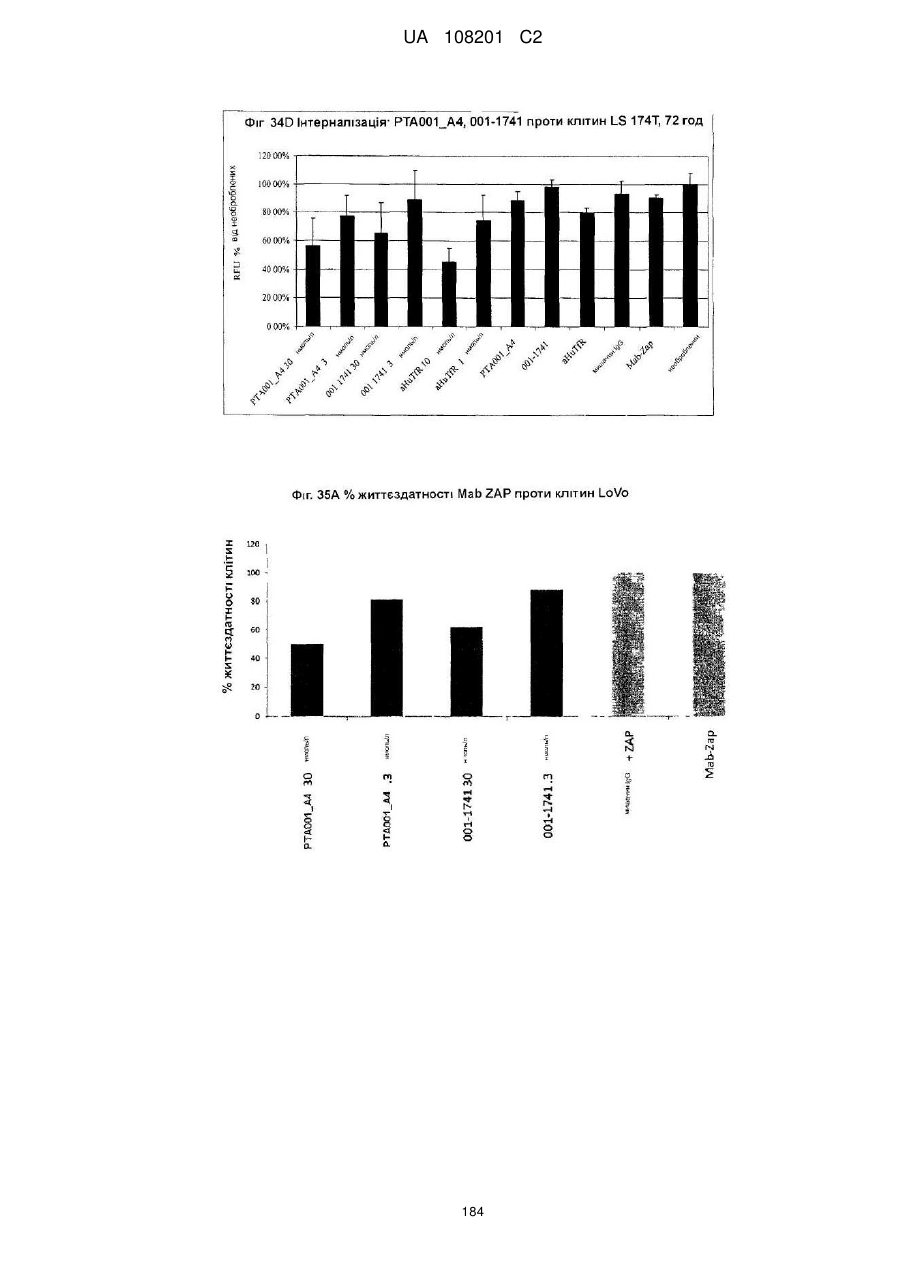
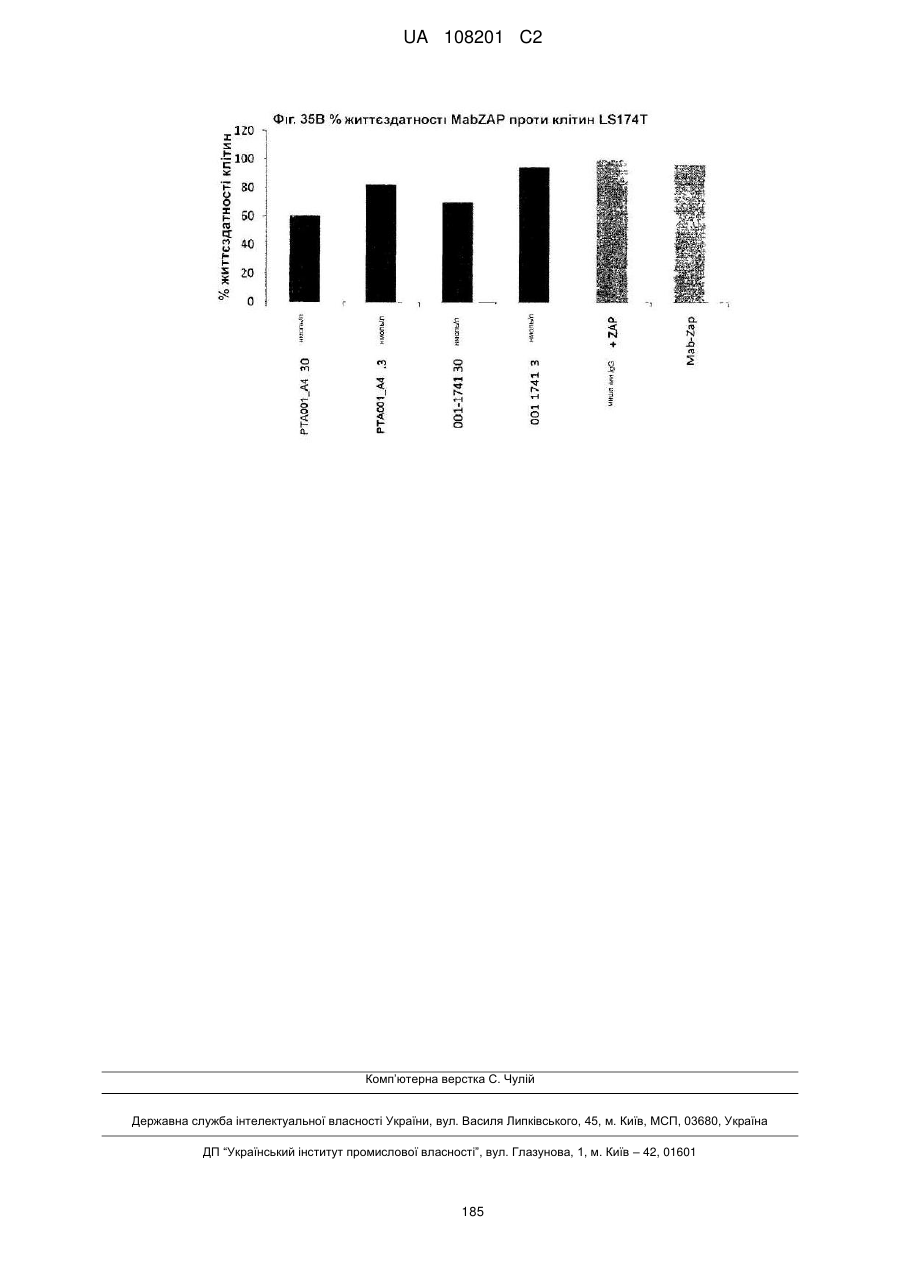
Антитіла, специфічні для кадгерину-17
Формула / Реферат
1. Ізольоване анти-кадгерин-17 антитіло, що містить:
варіабельну ділянку CDR1 важкого ланцюга, яка включає SEQ ID NO: 4;
варіабельну ділянку CDR2 важкого ланцюга, яка включає SEQ ID NO: 8;
варіабельну ділянку CDR3 важкого ланцюга, яка включає SEQ ID NO: 17;
варіабельну ділянку CDR1 легкого ланцюга, яка включає SEQ ID NO: 24;
варіабельну ділянку CDR2 легкого ланцюга, яка включає SEQ ID NO: 30 та
варіабельну ділянку CDR3 легкого ланцюга, яка включає SEQ ID NO: 34;
де необов'язково будь-яка з послідовностей SEQ ID NO: 4, 8, 17, 24, 30 або 34 незалежно містить одне або два консервативних амінокислотних заміщення.
2. Антитіло за пунктом 1, де зазначене антитіло являє собою непроцесоване антитіло ізотипу IgG1, IgG2, IgG3 або IgG4.
3. Антитіло за будь-яким одним з попередніх пунктів, де зазначене антитіло є вибраним із групи, яка складається із: цільного антитіла, моноклонального антитіла, фрагмента антитіла, гуманізованого антитіла, одноланцюгового антитіла, дефукозильованого антитіла, міметика антитіла та біспецифічного антитіла.
4. Антитіло за пунктом 3, де зазначений фрагмент є вибраним із групи, яка складається з: доменного антитіла та нанотіла.
5. Імунокон'югат, що включає антитіло за будь-яким з попередніх пунктів, кон'юговане з терапевтичним агентом.
6. Імунокон'югат за пунктом 5, де терапевтичний агент являє собою цитотоксин або радіоактивний ізотоп.
7. Композиція, що включає
(а) ізольоване антитіло або його антигензв'язувальну частину за будь-яким з пунктів 1-4 або імунокон'югат за пунктами 5 або 6, та
(б) фармацевтично прийнятний носій.
8. Молекула ізольованої нуклеїнової кислоти, що кодує важкий або легкий ланцюг антитіла або його антигензв'язувальну частину за будь-яким з пунктів 1-6.
9. Експресійний вектор, який включає молекулу нуклеїнової кислоти за пунктом 8.
10. Клітина-хазяїн, що включає;
(і) експресійний вектор за пунктом 9; або
(іі) перший експресійний вектор, що кодує важкий ланцюг антитіла або його антигензв'язувальну частину за будь-яким з пунктів 1-4, та другий експресійний вектор, що
кодує легкий ланцюг антитіла або його антигензв'язувальну частину за будь-яким з пунктів
1-4.
11. Спосіб одержання анти-кадгерин-17 антитіла, де зазначений спосіб включає стадії:
одержання клітини-хазяїна, яка містить одну або більше молекул нуклеїнової кислоти, що кодують антитіло за будь-яким з пунктів 1-4;
вирощування клітини-хазяїна в культурі клітин-хазяїв;
забезпечення умов культивування клітин-хазяїв, де експресується одна або більше молекул нуклеїнової кислоти; та
вилучення антитіла з клітини-хазяїна або з культури клітин-хазяїв.
12. Спосіб одержання анти-кадгерин-17 антитіла, що включає стадії:
імунізацію тварини за допомогою пептиду кадгерину-17;
вилучення мРНК з В-клітин зазначеної тварини;
перетворення зазначеної мРНК на кДНК;
експресію зазначеної кДНК у фагах, так, що анти-кадгерин-17 антитіла, які
кодуються зазначеною кДНК, присутні на поверхні зазначених фагів;
відбір фагів, що містять анти-кадгерин-17 антитіла;
вилучення молекули нуклеїнової кислоти із зазначених відібраних фагів, які кодують зазначені анти-кадгерин-17 імуноглобуліни;
експресію зазначеної вилученої молекули нуклеїнової кислоти в клітині-хазяїні, та
вилучення антитіл за пунктом 1, які зв'язуються з кадгерином-17, з вказаної клітини-хазяїна.
13. Спосіб лікування або запобігання раку, пов'язаного із цільовими клітинами, що експресують кадгерин-17, при цьому зазначений спосіб включає етап введення суб'єктові анти-кадгерин-17 антитіла або його антигензв'язувальної частини за будь-яким з пунктів 1-4 або імунокон'югату за пунктами 5 або 6, у кількості, ефективній для лікування або запобігання раку.
14. Спосіб за пунктом 13, де зазначеним раком є рак людини.
15. Спосіб за пунктом 14, де зазначеним раком є колоректальний рак.
Текст
Реферат: Винахід стосується антитіла, яке зв'язує епітоп на людському кадгерині-17, який розпізнається антитілом, що включає варіабельну ділянку важкого ланцюга, яка включає амінокислотну послідовність SEQ ID NO:38, та варіабельну ділянку легкого ланцюга, що включає амінокислотну послідовність SEQ ID NO:49. UA 108201 C2 (12) UA 108201 C2 UA 108201 C2 5 10 15 20 25 30 35 40 45 50 55 60 Перехресне посилання на споріднений опис Ця заявка заявляє відповідно до 35 USC 119(e) пріоритет заявки США № 61/170,980, поданої 20 квітня 2009 року, яка є введеною як посилання у своїй цілісності. Область, до якої відноситься винахід Даний винахід у загальному випадку відноситься до області імунології та молекулярної біології. Зокрема, у даній заявці забезпечуються антитіла та інші терапевтичні білки, спрямовані проти клітинної адгезивної молекули кадгерину-17, нуклеїнові кислоти, які кодують такі антитіла та терапевтичні білки, способи одержання моноклональних антитіл та інших терапевтичних білків відповідно до винаходу та способи лікування захворювань, таких, як різні види раку, опосередковані експресією/активністю кадгерину-17, та/або асоційовані з патологічною експресією/активністю його лігандів. Передумови створення винаходу Кадгерини являють собою залежні від кальцію молекули клітинної адгезії. Вони переважно взаємодіють один з одним гомофільним чином при сполученні клітин; кадгерини можуть, таким чином, здійснювати свій внесок у сортування гетерологічних типів клітин. Кадгеринова молекула кадгерин-17 є також відомою як печінково-кишковий кадгерин або кишковий асоційований з пептидом транпортер HPT-1. Кадгерин-17 може відігравати певну роль у морфологічній організації печінки та кишечнику. Він також є залученим у кишковий транспорт пептидів. Структура кадгерину-17 характеризується наявністю позаклітинного домену з 7 кадгериновими доменами, одного гідрофобного трансмембранного домену та короткого C-термінального цитоплазматичного хвоста. Є відомою тільки одна ізоформа людського кадгерину-17, депозитний номер Genbank NM_004063. Кадгерин-17 має номер доступу Q12864 у SWISSPROT та trembl базах даних (підтримується Швейцарським інститутом біоінформатики (SIB) та Європейським інститутом біоінформатики (EBI), бази є доступними на сайті www.expasy.com). Мишачий ортолог кадгерину-17 (Q9R100) демонструє 76 % ідентичності з людським кадгерином-17. Відповідно до SWISS-PROT кадгерин-17 експресується у шлунково-кишковому тракті та протоках підшлункової залози. Він не визначається в нирках, легенях, печінці, мозку, надниркових залозах або шкірі. Було повідомлено про експресію кадгерину-17 при раку шлунка (дивися, наприклад, Ito та ін., Virchows Arch. 2005 жовтень; 447(4):717-22; Su та ін., Mod Pathol. 2008, листопад;21(11):1379-86; Ko та ін., Biochem Biophys Res Commun. 2004, червень 25;319(2):562-8; та Dong та ін., Dig Dis Sci. 2007, лютий; 52(2):536-42), раку підшлункової залози та колоректальному раку (Su та ін., Mod Pathol. 2008, листопад;21(11):1379-86) та гепатоклітинній карциномі (Wong та ін., Biochem Biophys Res Commun. 2003, листопад, 21;311(3):618-24). Міжнародна патентна заявка WO2008/026008 розкриває кадгерин-17 як маркер для колоректального раку та як біологічну мішень для терапевтичних антитіл та інших фармацевтичних агентів. Короткий виклад суті винаходу Даний винахід забезпечує антитіла, спрямовані проти кадгерину-171, нуклеїнові кислоти, які кодують такі антитіла, способи одержання анти-кадгерин-17 моноклональних антитіл та інших терапевтичних білків та способи лікування захворювань, таких, як опосередковані кадгерином17 розлади, наприклад, різні види раку людину, включаючи колоректальний рак. Таким чином, даний винахід забезпечує ізольовані моноклональні антитіла, зокрема, мишачі, химерні, гуманізовані та повністю людські моноклональні антитіла, які зв'язуються з кадгерином-17, та такі, які демонструє одну або більше бажану функціональна властивість. Такі властивості включають, наприклад, специфічне зв'язування з високою афінністю з людським кадгерином-17. Також забезпечується способи лікування різних опосередкованих кадгерином17 захворювань при використанні антитіл, білків та композицій відповідно до даного винаходу. Даний винахід забезпечує ізольоване моноклональне антитіло або його антигензв'язувальну частину, фрагмент антитіла або міметик антитіла, які зв'язуються з епітопом людського кадгерину-17, який впізнається антитілом, що включає варіабельну ділянку важкого ланцюга, яка має амінокислотну послідовність, вибрану із групи, яка складається з SEQ ID NO: 38, 35, 36, 37, 39, 40, 41, 42, 43, 44, 45 та 46, та варіабельну ділянку легкого ланцюга, яка має амінокислотну послідовність, вибрану із групи, яка складається з SEQ ID NO: 49, 47, 48, 50, 51, 52, 53, 54, 55, 56, 57 та 58. У деяких втіленнях ізольоване антитіло являє собою антитіло повної довжини IgG1, IgG2, IgG3 або IgG4 ізотипу. У деяких втіленнях антитіло відповідно до даного винаходу є вибраним із групи, яка складається з: цільного антитіла, фрагмента антитіла, гуманізованого антитіла, одноланцюгового антитіла, імунокон'югату, дефукозильованого антитіла та біспецифічного антитіла. Фрагмент антитіла може бути вибраний із групи, яка складається з: унітіла, доменного 1 UA 108201 C2 5 10 15 20 25 30 35 40 45 50 55 60 антитіла та нанотіла. У деяких втіленнях імунокон'югати відповідно до винаходу включають терапевтичний агент. В іншому аспекті винаходу терапевтичний агент являє собою цитотоксин або радіоактивний ізотоп. У деяких втіленнях антитіло відповідно до даного винаходу є вибраним із групи, яка складається з: афітіла, Darpin, антикаліну, авімеру, версатіла та дуокаліну. В альтернативних втіленнях композиції відповідно до даного винаходу включають ізольоване антитіло або його антигензв'язувальну частину та фармацевтично прийнятний носій. В інших аспектах антитіло відповідно до даного винаходу являє собою композицію, яка включає ізольоване антитіло або його антигензв'язувальну частину відповідно до винаходу та фармацевтично прийнятний носій. У деяких втіленнях винахід включає ізольовану молекулу нуклеїнової кислоти, яка кодує важкий або легкий ланцюг ізольованого антитіла або його антигензв'язувальну частину, яка зв'язується з епітопом людського кадгерину-17. Інші аспекти відповідно до винаходу включають експресійні вектори, що містять такі молекули нуклеїнової кислоти, та хазяйські клітини, які містять такі експресійні вектори. У деяких втіленнях даний винахід забезпечує спосіб одержання анти-кадгерин-17 антитіла, при цьому зазначений спосіб включає етапи: одержання хазяйської клітини, яка містить одну або більш молекул нуклеїнової кислоти, що кодують антитіло відповідно до винаходу; вирощування хазяйської клітини в культурі хазяйських клітин; забезпечення умов культивування культури хазяйських клітин, де експресується одна або більш молекул нуклеїнової кислоти; та одержання антитіла з хазяйської клітини або з культури хазяйських клітин. В інших втіленнях винахід є спрямованим на спосіб лікування або запобігання захворювання, асоційованого із цільовими клітинами, які експресують кадгерин-17, при цьому зазначений спосіб включає етап введення суб'єктові анти-кадгерин-17 антитіла або його антигензв'язувальної частини в кількості, ефективній для лікування або запобігання захворювання. іУ деяких аспектах захворювання, яке лікується або запобігаєть за допомогою антитіла або його антигензв'язувальної частини відповідно до даного винаходу, являє собою людський рак. У деяких втіленнях захворювання, яке лікується або запобігається за допомогою антитіл відповідно до даного винаходу, являє собою колоректальний рак. В інших втіленнях винахід є спрямованим на анти-кадгерин-17 антитіло або його антигензв'язувальну частину для застосування в лікуванні або запобіганні захворювання, асоційованого із цільовими клітинами, які експресують кадгерин-17. У деяких аспектах захворювання, яке лікується або запобігається за допомогою антитіла або його антигензв'язувальної частини відповідно до даного винаходу, являє собою рак людини. У деяких втіленнях захворювання, яке лікується або запобігається за допомогою антитіл відповідно до даного винаходу, являє собою колоректальний рак. В інших втіленнях винахід є спрямованим на застосування анти-кадгерин-17 антитіла або його антигензв'язувальної частини для виробництва лікарського засобу для застосування у лікуванні або запобіганні захворювання, асоційованого із цільовими клітинами, які експресують кадгерин-17. У деяких аспектах захворювання, яке лікується або запобігається за допомогою лікарського засобу відповідно до винаходу, являє собою рак людини. У деяких втіленнях захворювання, яке лікується або запобігається за допомогою антитіл відповідно до даного винаходу представляє собою колоректальний рак. В інших втіленнях даний винахід являє собою ізольоване моноклональне антитіло або його антигензв'язувальну частина, фрагмент антитіла або міметик антитіла, що зв'язуються з епітопом на людському кадгерині-17, який впізнається антитілом, що включає варіабельну ділянку важкого ланцюга та варіабельну ділянку легкого ланцюга, вибрані із групи, яка складається з амінокислотної послідовності варіабельної ділянки важкого ланцюга, представленої в SEQ ID NO: 35, та амінокислотної послідовності варіабельної ділянки легкого ланцюга, представленої в SEQ ID NO: 47; амінокислотної послідовності варіабельної ділянки важкого ланцюга, представленої в SEQ ID NO: 36, та амінокислотної послідовності варіабельної ділянки легкого ланцюга, представленої в SEQ ID NO: 48; амінокислотної послідовності варіабельної ділянки важкого ланцюга, представленої в SEQ ID NO: 37, та амінокислотної послідовності варіабельної ділянки легкого ланцюга, представленої в SEQ ID NO: 48; амінокислотної послідовності варіабельної ділянки важкого ланцюга, представленої в SEQ ID NO: 38, та амінокислотної послідовності варіабельної ділянки легкого ланцюга, представленої в SEQ ID NO: 49; амінокислотної послідовності варіабельної ділянки важкого ланцюга, представленої в SEQ ID NO: 39, та амінокислотної послідовності варіабельної ділянки легкого ланцюга, представленої в SEQ ID NO: 50; амінокислотної послідовності варіабельної ділянки важкого ланцюга, представленої в SEQ ID NO: 40, та амінокислотної послідовності варіабельної 2 UA 108201 C2 5 10 15 20 25 30 35 40 45 50 55 60 ділянки легкого ланцюга, представленої в SEQ ID NO: 51; амінокислотної послідовності варіабельної ділянки важкого ланцюга, представленої в SEQ ID NO: 40, та амінокислотної послідовності варіабельної ділянки легкого ланцюга, представленої в SEQ ID NO: 54; амінокислотної послідовності варіабельної ділянки важкого ланцюга, представленої в SEQ ID NO: 40, та амінокислотної послідовності варіабельної ділянки легкого ланцюга, представленої в SEQ ID NO: 55; амінокислотної послідовності варіабельної ділянки важкого ланцюга, представленої в SEQ ID NO: 41, та амінокислотної послідовності варіабельної ділянки легкого ланцюга, представленої в SEQ ID NO: 52; амінокислотної послідовності варіабельної ділянки важкого ланцюга, представленої в SEQ ID NO: 42, та амінокислотної послідовності варіабельної ділянки легкого ланцюга, представленої в SEQ ID NO: 53; амінокислотної послідовності варіабельної ділянки важкого ланцюга, представленої в SEQ ID NO: 43, та амінокислотної послідовності варіабельної ділянки легкого ланцюга, представленої в SEQ ID NO: 56; амінокислотної послідовності варіабельної ділянки важкого ланцюга, представленої в SEQ ID NO: 44, та амінокислотної послідовності варіабельної ділянки легкого ланцюга, представленої в SEQ ID NO: 55; амінокислотної послідовності варіабельної ділянки важкого ланцюга, представленої в SEQ ID NO: 45, та амінокислотної послідовності варіабельної ділянки легкого ланцюга, представленої в SEQ ID NO: 57; амінокислотної послідовності варіабельної ділянки важкого ланцюга, представленої в SEQ ID NO: 46, та амінокислотної послідовності варіабельної ділянки легкого ланцюга, представленої в SEQ ID NO: 58. У додаткових аспектах антитіло є вибраним із групи, яка складається з: цільного антитіла, фрагмента антитіла, гуманізованого антитіла, одноланцюгового антитіла, імунокон'югату, дефукозильованого антитіла та біспецифічного антитіла. У додаткових аспектах відповідно до даного винаходу фрагмент антитіла є вибраним із групи, яка складається з: унітіла, доменного антитіла та нанотіла. У деяких втіленнях міметик антитіла є вибраним із групи, яка складається з: афітіла, Darpin, антикаліну, авімеру, версатіла та дуокаліну. У додаткових втіленнях композиція включає ізольоване антитіло або його антигензв'язувальну частина та фармацевтично прийнятний носій. У деяких втіленнях даний винахід являє собою ізольовану молекулу нуклеїнової кислоти, яка кодує важкий або легкий ланцюг ізольованого антитіла або антигензв'язувальну частина антитіла відповідно до винаходу, а в додаткових аспектах може включати експресійний вектор, що включає такі нуклеїнові кислоти, та хазяйські клітини, які включають такі експресійні вектори. Інше втілення відповідно до даного винаходу являє собою гібридому, яка експресує антитіло або антигензв'язувальну частину кожного з антитіл відповідно до винаходу. В інших аспектах винахід є спрямованим на способи створення антитіл відповідно до винаходу, які включають етапи: імунізації тварини за допомогою пептиду кадгерину-17; відновлення мРНК з B-клітин зазначеної тварини; перетворення зазначеної мРНК на кДНК; експресії зазначеної кДНК у фагах, так, що анти-кадгерин-17 антитіла, які кодуються зазначеною кДНК, презентуються на поверхні зазначених фагів; селекції фагів, які презентують анти-кадгерин-17 антитіла; вилучення молекули нуклеїнової кислоти із зазначених відібраних фагів, які кодують зазначені анти-кадгернин-17 імуноглобуліни; експресії зазначеної вилученої молекули нуклеїнової кислоти в хазяйській клітині; і відновлення антитіл, які зв'язуються з кадгерином-17. У деяких аспектах винаходу ізольоване моноклональне антитіло або його антигензв'язувальна частина зв'язується з епітопом на поліпептиді кадгерину-17, що має амінокислотну послідовність SEQ ID NO: 136 або 137, яка впізнається антитілом, що включає варіабельну ділянку важкого ланцюга, що містить амінокислотну послідовність, вибрану із групи, яка складається з SEQ ID NO: 38, 35, 36, 37, 39, 40, 41, 42, 43, 44, 45 або 46, та варіабельну ділянку легкого ланцюга, що містить амінокислотну послідовність, вибрану із групи, яка складається з SEQ ID NO: 49, 47, 48, 50, 51, 52, 53, 54, 55, 56, 57 або 58. Інші ознаки та переваги даного винаходу будуть зрозумілими з наступного докладного опису та прикладів, які не повинні трактуватися як такі, які обмежують даний винахід. Зміст усіх посилань, посилань на депозитні номери Genbank, патентів та опублікованих патентних заявок, які приводяться в цій заявці, є введеним у дану заявку тільки як посилання. Короткий опис рисунків Фігура 1 демонструє нуклеотидну послідовність (SEQ ID NO:59) та амінокислотну послідовність (SEQ ID NO:35) варіабельної ділянки важкого ланцюга PTA001_A1 моноклонального антитіла. CDR1 (SEQ ID NO:1), CDR2 (SEQ ID NO:5) та CDR3 (SEQ ID NO:14) ділянки є позначеними. 3 UA 108201 C2 5 10 15 20 25 30 35 40 45 50 55 60 Фігура 2 демонструє нуклеотидну послідовність (SEQ ID NO:60) та амінокислотну послідовність (SEQ ID NO:36) варіабельної ділянки важкого ланцюга PTA001_A2 моноклонального антитіла. CDR1 (SEQ ID NO:2), CDR2 (SEQ ID NO:6) та CDR3 (SEQ ID NO:15) ділянки є позначеними. Фігура 3 демонструє нуклеотидну послідовність (SEQ ID NO:61) та амінокислотну послідовність (SEQ ID NO:37) варіабельної ділянки важкого ланцюга PTA001_A3 моноклонального антитіла. CDR1 (SEQ ID NO:3), CDR2 (SEQ ID NO:7) та CDR3 (SEQ ID NO:16) ділянки є позначеними. Фігура 4 демонструє нуклеотидну послідовність (SEQ ID NO:62) та амінокислотну послідовність (SEQ ID NO:38) варіабельної ділянки важкого ланцюга PTA001_A4 моноклонального антитіла. CDR1 (SEQ ID NO:4), CDR2 (SEQ ID NO:8) та CDR3 (SEQ ID NO:17) ділянки є позначеними. Фігура 5 демонструє нуклеотидну послідовність (SEQ ID NO:63) та амінокислотну послідовність (SEQ ID NO:39) варіабельної ділянки важкого ланцюга PTA001_A5 моноклонального антитіла. CDR1 (SEQ ID NO:3), CDR2 (SEQ ID NO:7) та CDR3 (SEQ ID NO:18) ділянки є позначеними. Фігура 6 демонструє нуклеотидну послідовність (SEQ ID NO:64) та амінокислотну послідовність (SEQ ID NO:40) варіабельної ділянки важкого ланцюга PTA001_A6, PTA001_A9 та PTA001_A10 моноклональних антитіл. CDR1 (SEQ ID NO:3), CDR2 (SEQ ID NO:7) та CDR3 (SEQ ID NO:16) ділянки є позначеними. Фігура 7 демонструє нуклеотидну послідовність (SEQ ID NO:65) та амінокислотну послідовність (SEQ ID NO:41) варіабельної ділянки важкого ланцюга PTA001_A7 моноклонального антитіла. CDR1 (SEQ ID NO:3), CDR2 (SEQ ID NO:9) та CDR3 (SEQ ID NO:19) ділянки є позначеними. Фігура 8 демонструє нуклеотидну послідовність (SEQ ID NO:66) та амінокислотну послідовність (SEQ ID NO:42) варіабельної ділянки важкого ланцюга PTA001_A8 моноклонального антитіла. CDR1 (SEQ ID NO:3), CDR2 (SEQ ID NO:7) та CDR3 (SEQ ID NO:16) ділянки є позначеними. Фігура 9 демонструє нуклеотидну послідовність (SEQ ID NO:67) та амінокислотну послідовність (SEQ ID NO:43) варіабельної ділянки важкого ланцюга PTA001_A11 моноклонального антитіла. CDR1 (SEQ ID NO:3), CDR2 (SEQ ID NO:10) та CDR3 (SEQ ID NO:20) ділянки є позначеними. Фігура 10 демонструє нуклеотидну послідовність (SEQ ID NO:68) та амінокислотну послідовність (SEQ ID NO:44) варіабельної ділянки важкого ланцюга PTA001_A12 моноклонального антитіла. CDR1 (SEQ ID NO:3), CDR2 (SEQ ID NO:11) та CDR3 (SEQ ID NO:21) ділянки є позначеними. Фігура 11 демонструє нуклеотидну послідовність (SEQ ID NO:69) та амінокислотну послідовність (SEQ ID NO:45) варіабельної ділянки важкого ланцюга PTA001_A13 моноклонального антитіла. CDR1 (SEQ ID NO:3), CDR2 (SEQ ID NO:12) та CDR3 (SEQ ID NO:18) ділянки є позначеними. Фігура 12 демонструє нуклеотидну послідовність (SEQ ID NO:70) та амінокислотну послідовність (SEQ ID NO:46) варіабельної ділянки важкого ланцюга PTA001_A14 моноклонального антитіла. CDR1 (SEQ ID NO:2), CDR2 (SEQ ID NO:13) та CDR3 (SEQ ID NO:15) ділянки є позначеними. Фігура 13 демонструє нуклеотидну послідовність (SEQ ID NO:71) та амінокислотну послідовність (SEQ ID NO:47) варіабельної ділянки легкого ланцюга PTA001_A1 моноклонального антитіла. CDR1 (SEQ ID NO:22), CDR2 (SEQ ID NO:28) та CDR3 (SEQ ID NO:32) ділянки є позначеними. Фігура 14 демонструє нуклеотидну послідовність (SEQ ID NO:72) та амінокислотну послідовність (SEQ ID NO:48) варіабельної ділянки легкого ланцюга PTA001_A2 та PTA001_A3 моноклональних антитіл. CDR1 (SEQ ID NO:23), CDR2 (SEQ ID NO:29) та CDR3 (SEQ ID NO:33) ділянки є позначеними. Фігура 15 демонструє нуклеотидну послідовність (SEQ ID NO:73) та амінокислотну послідовність (SEQ ID NO:49) варіабельної ділянки легкого ланцюга PTA001_A4 моноклонального антитіла. CDR1 (SEQ ID NO:24), CDR2 (SEQ ID NO:30) та CDR3 (SEQ ID NO:34) ділянки є позначеними. Фігура 16 демонструє нуклеотидну послідовність (SEQ ID NO:74) та амінокислотну послідовність (SEQ ID NO:50) варіабельної ділянки легкого ланцюга PTA001_A5 моноклонального антитіла. CDR1 (SEQ ID NO:25), CDR2 (SEQ ID NO:31) та CDR3 (SEQ ID NO:33) ділянки є позначеними. 4 UA 108201 C2 5 10 15 20 25 30 35 40 45 50 55 60 Фігура 17 демонструє нуклеотидну послідовність (SEQ ID NO:75) та амінокислотну послідовність (SEQ ID NO:51) варіабельної ділянки легкого ланцюга PTA001_A6 моноклонального антитіла. CDR1 (SEQ ID NO:23), CDR2 (SEQ ID NO:29) та CDR3 (SEQ ID NO:33) ділянки є позначеними. Фігура 18 демонструє нуклеотидну послідовність (SEQ ID NO:76) та амінокислотну послідовність (SEQ ID NO:52) варіабельної ділянки легкого ланцюга PTA001_A7 моноклонального антитіла. CDR1 (SEQ ID NO:26), CDR2 (SEQ ID NO:29) та CDR3 (SEQ ID NO:33) ділянки є позначеними. Фігура 19 демонструє нуклеотидну послідовність (SEQ ID NO:77) та амінокислотну послідовність (SEQ ID NO:53) варіабельної ділянки легкого ланцюга PTA001_A8 моноклонального антитіла. CDR1 (SEQ ID NO:25), CDR2 (SEQ ID NO:31) та CDR3 (SEQ ID NO:33) ділянки є позначеними. Фігура 20 демонструє нуклеотидну послідовність (SEQ ID NO:78) та амінокислотну послідовність (SEQ ID NO:54) варіабельної ділянки легкого ланцюга PTA001_A9 моноклонального антитіла. CDR1 (SEQ ID NO:23), CDR2 (SEQ ID NO:29) та CDR3 (SEQ ID NO:33) ділянки є позначеними. Фігура 21 демонструє нуклеотидну послідовність (SEQ ID NO:79 та 81) та амінокислотну послідовність (SEQ ID NO:55) варіабельної ділянки легкого ланцюга PTA001_A10 та PTA001_A12 моноклональних антитіл. CDR1 (SEQ ID NO:25), CDR2 (SEQ ID NO:29) та CDR3 (SEQ ID NO:33) ділянки є позначеними. Фігура 22 демонструє нуклеотидну послідовність (SEQ ID NO:80) та амінокислотну послідовність (SEQ ID NO:56) варіабельної ділянки легкого ланцюга PTA001_A11 моноклонального антитіла. CDR1 (SEQ ID NO:27), CDR2 (SEQ ID NO:29) та CDR3 (SEQ ID NO:33) ділянки є позначеними. Фігура 23 демонструє нуклеотидну послідовність (SEQ ID NO:82) та амінокислотну послідовність (SEQ ID NO:57) варіабельної ділянки легкого ланцюга PTA001_A13 моноклонального антитіла. CDR1 (SEQ ID NO:25), CDR2 (SEQ ID NO:31) та CDR3 (SEQ ID NO:33) ділянки є позначеними. Фігура 24 демонструє нуклеотидну послідовність (SEQ ID NO:83) та амінокислотну послідовність (SEQ ID NO:58) варіабельної ділянки легкого ланцюга PTA001_A14 моноклонального антитіла. CDR1 (SEQ ID NO:23), CDR2 (SEQ ID NO:29) та CDR3 (SEQ ID NO:33) ділянки є позначеними. Фігура 25 демонструє вирівнювання нуклеотидних послідовностей CDR1 ділянки важкого ланцюга PTA001_A1 (SEQ ID NO:84) з нуклеотидами 240-269 VH 7-39 нуклеотидної послідовності мишачої ембріональної лінії (SEQ ID NO:125) та вирівнювання нуклеотидних послідовностей CDR1 ділянок важкого ланцюга PTA001_A2 та PTA001_A14 (SEQ ID NO:85); PTA001_A3, PTA001_A5, PTA001_A6, PTA001_A7, PTA001_A8, PTA001_A9, PTA001_A10, PTA001_A11, PTA001_A12 та PTA001_A13 (SEQ ID NO:86) та PTA001_A4 (SEQ ID NO:87) з нуклеотидами 67-96 нуклеотидної послідовності VH II гена H17 мишачої ембріональної лінії (SEQ ID NO:126). Фігура 26 демонструє вирівнювання нуклеотидних послідовностей CDR2 ділянок важкого ланцюга PTA001_A2 (SEQ ID NO:89); PTA001_A3, PTA001_A5, PTA001_A6, PTA001_A8, PTA001_A9 та PTA001_A10 (SEQ ID NO:90); PTA001_A4 (SEQ ID NO:91); PTA001_A7 (SEQ ID NO:92); PTA001_A11 (SEQ ID NO:93); PTA001_A12 (SEQ ID NO:94); PTA001_A13 (SEQ ID NO:95) та PTA001_A14 (SEQ ID NO:96) з нуклеотидами 1096-1146 нуклеотидної послідовності VH II ділянки VH105 мишачої ембріональної лінії (SEQ ID NO:127). Фігура 27 демонструє вирівнювання нуклеотидних послідовностей CDR1 ділянки легкого ланцюга PTA001_A1 (SEQ ID NO:105) з нуклеотидами 1738-1785 нуклеотидної послідовності VK 1-110 мишачої ембріональної лінії (SEQ ID NO:128), демонструє вирівнювання нуклеотидних послідовностей CDR1 ділянки легкого ланцюга PTA001_A4 (SEQ ID NO:107) з нуклеотидами 510-560 нуклеотидної послідовності VK 8-30 мишачої ембріональної лінії (SEQ ID NO: 130) та вирівнювання нуклеотидних послідовностей CDR1 ділянок легкого ланцюга PTA001_A2, PTA001_A3, PTA001_A6, PTA001_A9 та PTA001_A14 (SEQ ID NO:106); PTA001_A5 та PTA001_A13 (SEQ ID NO:108); PTA001_A7 (SEQ ID NO:109); PTA001_A8 (SEQ ID NO:110); PTA001_A10 (SEQ ID NO:111); PTA001_A11 (SEQ ID NO:112) та PTA001_A12 (SEQ ID NO:113) з нуклеотидами 1807-1854 нуклеотидної послідовності VK 24-140 мишачої ембріональної лінії (SEQ ID NO:133). Фігура 28 демонструє вирівнювання нуклеотидних послідовностей CDR2 ділянки легкого ланцюга PTA001_A4 (SEQ ID NO:116) з нуклеотидами 606-626 нуклеотидної послідовності VK 830 мишачої ембріональної лінії (SEQ ID NO:131) та вирівнювання нуклеотидних послідовностей 5 UA 108201 C2 5 10 15 20 25 30 35 40 45 50 55 60 CDR2 ділянок легкого ланцюга PTA001_A2, PTA001_A3, PTA001_A6, PTA001_A9 та PTA001_A14 (SEQ ID NO:115); PTA001_A5 та PTA001_A13 (SEQ ID NO:117); PTA001_A7, PTA001_A10, PTA001_A11 та PTA001_A12 (SEQ ID NO:118) та PTA001_A8 (SEQ ID NO:119) з нуклеотидами 1900-1920 нуклеотидної послідовності VK 24-140 мишачої ембріональної лінії (SEQ ID NO:134). Фігура 29 демонструє вирівнювання нуклеотидних послідовностей CDR3 ділянки легкого ланцюга PTA001_A1 (SEQ ID NO:120) з нуклеотидами 1948-1971 нуклеотидної послідовності VK 1-110 мишачої ембріональної лінії (SEQ ID NO:129), вирівнювання нуклеотидних послідовностей CDR3 ділянки легкого ланцюга PTA001_A4 (SEQ ID NO:122) з нуклеотидами 723-749 нуклеотидної послідовності VK 8-30 мишачої ембріональної лінії (SEQ ID NO:132) та вирівнювання нуклеотидних послідовностей CDR3 ділянок легкого ланцюга PTA001_A2, PTA001_A3, PTA001_A6, PTA001_A9, PTA001_A10, PTA001_A11, PTA001_A12 та PTA001_A14 (SEQ ID NO:121); PTA001_A5, PTA001_A8 та PTA001_A13 (SEQ ID NO:123) та PTA001_A7 (SEQ ID NO:124) з нуклеотидами 2017-2043 нуклеотидної послідовності VK 24-140 мишачої ембріональної лінії (SEQ ID NO:135). Фігура 30 демонструє Вестерн-блоттінг аналіз кадгерину-17 при використанні PTA001_A4 моноклонального антитіла. Фігура 31 демонструє результати FACS аналізу на PTA001_A4 у клітинах Lovo. Фігура 32 демонструє результати FACS аналізу на PTA001_A4 у клітинах Lovo та LS174T. Фігура 33A демонструє зв'язування PTA001_A4/ вторинне антитіло FITC кон'югатного комплексу з клітинами Lovo через 60 хвилин інкубації. Фігура 33B демонструє інтерналізацію PTA001_A4/ вторинне антитіло FITC кон'югатного комплексу через 120 хвилин інкубації з клітинами Lovo. Фігура 34A демонструє результати інтерналізації PTA001_A4 за допомогою MabZap аналізу в клітинах Lovo раку товстого кишечнику. Фігура 34B демонструє результати інтерналізації PTA001_A4 за допомогою MabZap аналізу в клітинах Lovo раку товстого кишечнику. Фігура 34C демонструє результати інтерналізації PTA001_A4 за допомогою MaZzap аналізу в клітинах LS174T раку товстого кишечнику. Фігура 34D демонструє результати інтерналізації PTA001_A4 за допомогою MabZap аналізу в клітинах LS174T раку товстого кишечнику. Фігура 35A демонструє результати інтерналізації PTA001_A4 за допомогою MabZap аналізу в клітинах Lovo раку товстого кишечнику. Фігура 35B демонструє результати інтерналізації PTA001_A4 за допомогою MabZap аналізу в клітинах LS174T раку товстого кишечнику. Докладний опис винаходу Даний винахід відноситься до ізольованих антитіл, але не обмежуючись такими, моноклональних антитіл, наприклад, таким, які специфічно зв'язуються з кадгерином-17 з високої афінністю. У деяких втіленнях антитіла відповідно до винаходу мають певні структурні характеристики, такі, як CDR ділянки, що включають певні амінокислотні послідовності. Винахід забезпечує ізольовані антитіла, дефукозильовані антитіла, імунокон'югати, біспецифічніі молекули, афітіла, доменні антитіла, нанотіла та унітіла, способи створення зазначених молекул та фармацевтичні композиції, які включають зазначені молекули та фармацевтичний носій. Винахід також відноситься до способів застосування молекул, таких, як для визначення кадгерину-17, а також для лікування захворювань, асоційованих з експресією кадгерину-17, таких, як колоректальний рак. Для того, щоб даний винахід був зрозумілим, насамперед, необхідно визначити деякі терміни. Додаткові визначення представлені в докладному описі винаходу. Терміни "кадгерин-17", "печінково-кишковий кадгерин", "Li-кадгерин", "асоційований з кишковим пептидом транспортер HPT-1" та "CDH17" використовуються почергово. Кадгерин-17 також був ідентифікований як OGTA001 у міжнародній патентній заявці WO2008/026008, яка є введеною в дану заявку як посилання у своїй цілісності. Людські антитіла згідно із цим розкриттям можуть у деяких випадках перехресно реагувати з кадгерином-17 з видів, відмінних від людини. У деяких втіленнях антитіла можуть бути повністю специфічними для одного або більше людських кадгеринів-17 та можуть не демонструвати видову або інші типи не-людської перехресної реактивності. Повна амінокислотна послідовність людського кадгерину-17 має номер доступу Genbank NM_004063. Термін "імунна відповідь" відноситься до дії, наприклад, лімфоцитів, клітин, що презентують антиген, фагоцитарних клітин, гранулоцитів та розчинних макромолекул, які продукуються 6 UA 108201 C2 5 10 15 20 25 30 35 40 45 50 55 зазначеними вище клітинами або печінкою (включаючи антитіла, цитокіни та комплемент), що приведе до селективному пошкодження, руйнування або усунення з людського організму инвазивних агентів, клітин або тканин, інфікованих патогенами, ракових клітин або, у випадках аутоиммунитета або патологічного запалення, нормальних людських клітин або тканин. "Шлях сигнальної трансдукції" відноситься до біохімічного зв'язку між різними молекулами сигнальної трансдукції, які відіграють певну роль у передачі сигналу від однієї частини клітини до іншої частини клітини. Як використовується в даній заявці, фраза "рецептор поверхні клітин" включає, наприклад, молекули та комплекси молекул, які є здатними до одержання сигналу та передачі такого сигналу через плазматичну мембрану клітини. Приклад "рецептора поверхні клітин" відповідно до даного винаходу являє собою рецептор кадгерину-17. Термін "антитіло", як використовується в даній заявці, включає цільне антитіло та будь-який антиген зв'язувальний фрагмент (тобто, "антигензв'язувальну частину") або один з його ланцюгів. "Антитіло" відноситься до глікопротеїну, який може включати принаймні два важкі (H) ланцюги та два легкі (L) ланцюги, які є взаємозв'язаними за допомогою дисульфідних зв'язків, або до його антигензв'язувальної частини. Кожний важкий ланцюг складається з варіабельної ділянки важкого ланцюга (у даній заявці позначається як VH) та константної ділянки важкого ланцюга. Константна ділянка важкого ланцюга складається із трьох доменів, CH1, CH2 та CH3. Кожний легкий ланцюг складається з варіабельної ділянки легкого ланцюга (у даній заявці позначається як VL або VK) та константної ділянки легкого ланцюга. Константна ділянка легкого ланцюга складається з одного домену, CL. VH та VL/VK ділянки можуть додатково розділятися на ділянки гіперваріабельності, які називаються ділянками, що визначають комплементарність (CDR), та які є вбудованими між ділянками, що є більш консервативними та називаються каркасними ділянками (FR). Кожна з VH та VL/VK складається із трьох CDR та чотирьох FR, які розміщаються від амінотермінального кінця до карбокситермінального кінця в наступному порядку: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4. Варіабельні ділянки важкого та легкого ланцюгів містять єсполучний домен, який взаємодіє з антигеном. Константні ділянки антитіла можуть опосередковувати зв'язування імуноглобуліну з хазяйськими тканинами або факторами, включаючи різні клітини імунної системи (наприклад, ефекторні клітини) та перший компонент (Clq) класичної системи комплементу. Визначення "антитіло" включає, але не є обмеженим такими, антитіла повної довжини, фрагменти антитіл, одноланцюгові антитіла, біспецифічні антитіла, мінітіла, доменні антитіла, синтетичні антитіла (іноді називаються в даній заявці "міметиками антитіла"), химерні антитіла, гуманізовані антитіла, продукти злиття антитіл (іноді називаються "кон'югатами антитіл"), і фрагменти кожного з них, відповідно. В одному втіленні антитіло являє собою фрагмент антитіла. Специфічні фрагменти антитіл включають, але не обмежені такими, (i) Fab фрагмент, який складається з VL, VH, CL та CH1 доменів, (ii) Fd фрагмент, який складається з VH та CH1 доменів, (iii) Fv фрагмент, який складається з VL та VH доменів одного антитіла, (iv) dab фрагмент, який складається з одного варіабельного домену, (v) ізольовані CDR ділянки, (vi) F(ab')2 фрагменти, бівалентний фрагмент, що включає два зв'язані Fab фрагменти (vii) одноланцюгові Fv молекули (scfv), де VH домен та VL домен є пов'язаними за допомогою пептидного лінкера, що дозволяє двом доменам асоціюватися з утворенням антигензв'язувального сайту, (viii) біспецифічні одноланцюгові Fv димери, та (ix) "діатіла" або "триатіла", мультивалентні або мультиспецифічні фрагменти, сконструйовані за допомогою генного злиття. Ці фрагменти антитіл можуть бути модифіковані. Наприклад, молекули можуть бути стабілізовані шляхом вбудовування дисульфідних містків, що зв'язують vh та VL домени. Приклади форматів антитіл та їх будови є описаними у Holliger & Hudson, 2006, Nature Biotechnology 23(9): 1126-1136, та Carter 2006, Nature Reviews Immunology 6: 343-357 та посиланнях, які там приводяться, усі є чітко введеними як посилання. В одному втіленні антитіла, розкриті в даній заявці, можуть бути мультиспецифічними антитілами та, зокрема, біспецифічними антитілами, які іноді називаються "діатілами". Такі являють собою антитіла, які зв'язуються із двома (або більше) різними антигенами. Діатіла можуть бути отримані різноманітними шляхами, відомими галузі техніки, наприклад, отримані хімічно або з гібридної гібридоми. В одному втіленні антитіло являє собою мінітіло. Мінітіла являють собою мінімізовані антитілоподібні білки, які включають scfv, з'єднаний з CH3 доменом. У деяких випадках scfv може з'єднуватися з Fc ділянкою та може включати частину або усю шарнірну ділянку. Для опису мультиспецифічних антитіл дивися Holliger та Hudson, 2006, Nature Biotechnology 23(9): 1126-1136 та посилання, які там наведені, усі є чітко введеними в дану заявку як посилання. 7 UA 108201 C2 5 10 15 20 25 30 35 40 45 50 55 60 Під "CDR", як використовується в даній заявці, розуміють ділянку, що визначає комплементарність варіабельного домену антитіла домен. Систематична ідентифікація залишків, які є включеними в ці CDR, була розроблена Kabat (Kabat та ін., 1991, Sequences of Proteins of Immunological Interest, 5-е вид., United States Public Health Service, National Institutes of Health, Bethesda) та альтернативно Chothia (Chothia & Lesk, 1987, J. Mol. Biol. 196: 901-917; Chothia та ін., 1989, Nature 342: 877-883; Al-Lazikani та ін., 1997, J. Mol. Biol. 273: 927-948). Для цілей даного винаходу CDR визначаються як трохи менший набір залишків, ніж CDR, які визначаються Chothia. VL CDR у даній заявці є призначеними для включення залишків у положеннях 27-32 (CDR1), 50-56 (CDR2) та 91-97 (CDR3), де нумерація є такою відповідно до Chothia. Оскільки VL CDR, як визначається Chothia та Kabat, є ідентичними, то нумерація цих положень VL CDR є також такою відповідно до Kabat. VH CDR у даній заявці є призначеними для включення залишків у положеннях 27-33 (CDR1), 52-56 (CDR2) та 95-102 (CDR3), де нумерація є такою відповідно до Chothia. Ці VH CDR положення відповідають положенням Kabat 27-35 (CDR1), 52-56 (CDR2) та 95-102 (CDR3). Як зможе оцінити фахівець у даній області техніки, CDR, розкриті в даній заявці, можуть також включати варіанти, наприклад, коли здійснюють зворотну мутацію CDR, розкритих у даній заявці, у різних каркасних ділянках. У загальному випадку амінокислотна ідентичність між індивідуальними варіантами CDR складає принаймні 80 % у порівнянні з послідовностями, представленими в даній заявці, та більш типово із бажаним підвищенням ідентичності до принаймні 85 %, 90 %, 91 %, 92 %, 93 %, 94 %, 95 %, 96 %, 97 %, 98 %, 99 % та навіть 100 %. Подібним чином, "відсоток (%) ідентичності послідовності нуклеїнової кислоти" стосовно послідовності нуклеїнової кислоти сполучних білків, ідентифікованих у даній заявці, визначається як відсоток нуклеотидних залишків у кандидатній послідовності, які є ідентичними з нуклеотидними залишками у кодуючій послідовності антигензв'язувального білка. Специфічний спосіб використовує BLASTN модуль WU-BLAST-2, установку параметрів за умовчанням, з установкою проміжків та частин, що перекриваються, 1 та 0,125, відповідно. У загальному випадку ідентичність послідовності нуклеїнової кислоти між нуклеотидними послідовностями, що кодують індивідуальні варіанти CDR та нуклеотидними послідовностями, представленими в даній заявці, складає принаймні, 80 %, та більш типово із переважним підвищенням ідентичності до принаймні 80 %, 81 %, 82 %, 83 %, 84 %, 85 %, 86 %, 87 %, 88 %, 89 %, 90 %, 91 %, 92 %, 93 %, 94 %, 95 %, 96 %, 97 %, 98 % або 99 %, та навіть 100 %. Таким чином, "варіант CDR" являє собою такий із зазначеною гомологією, подібністю або ідентичністю з вихідною CDR відповідно до винаходу, та такий, який має загальну біологічну функцію, включаючи, але без обмеження принаймні 80 %, 81 %, 82 %, 83 %, 84 %, 85 %, 86 %, 87 %, 88 %, 89 %, 90 %, 91 %, 92 %, 93 %, 94 %, 95 %, 96 %, 97 %, 98 % або 99 % специфічності та/або активності вихідного CDR. У той час як сайт або ділянка для введення варіації амінокислотної послідовності є попередньо встановленим, мутація сама по собі не повинна бути попередньо визначена. Наприклад, для того, щоб оптимізувати поведінку мутації в даному сайті, може здійснюватися випадковий мутагенез у цільовому кодоні або ділянці, та експресовані варіанти антигензв'язувального білка CDR зазнають скринінгу на оптимальну комбінацію бажаної активності. Методики для здійснення мутацій на основі замін у попередньо встановлених сайтах у ДНК, що має відому послідовність, є також добре відомими, наприклад, мутагенез M13 праймера та ПЛР мутагенез. Скринінг мутантів здійснюють при використанні аналізів активностей антигензв'язувального білка, як описано в даній заявці. Амінокислотні заміни типово відносяться до одиничних залишків; інсерції звичайно будуть мати порядок від приблизно одного (1) до приблизно двадцяти (20) амінокислотних залишків, незважаючи на те, що значно більші інсерції можуть бути прийнятними. Делеції в межах від приблизно одного (1) до приблизно двадцяти (20) амінокислотних залишків, незважаючи на те, що в деяких випадках делеції можуть бути значно більшими. Заміни, делеції, інсерції або будь-яка їх комбінація можуть використовуватися для одержання заключної похідної або варіанта. У загальному випадку ці зміни здійснюють на декількох амінокислотних залишках для мінімізації зміни молекули, зокрема, імуногенності та специфічності антигензв'язувального білка. Проте більші зміни можуть бути прийнятними за певних обставин. Під "Fab" або "ділянкою Fab", як використовується в даній заявці, розуміють поліпептид, який включає VH, CH1, VL та CL домени імуноглобуліну. Fab може відноситься до цієї ізольованої ділянки, узятої окремо, або до цієї ділянки в контексті антитіла повної довжини, фрагменту антитіла або Fab злитого білка, або до будь-якого іншого втілення антитіла, як описується в даній заявці. 8 UA 108201 C2 5 10 15 20 25 30 35 40 45 50 55 60 Під "Fv" або "Fv фрагментом" або "Fv ділянкою", як використовується в даній заявці, розуміють поліпептид, який включає VL та VH домени одного антитіла. Під "каркасом", як використовується в даній заявці, розуміють ділянку варіабельного домену антитіла за винятком тих ділянок, які визначаються як CDR. Кожний каркас варіабельного домену антитіла може додаткового розділятися на сусідні ділянки, розділені CDR (FR1, FR2, FR3 та FR4). Термін "антигензв'язувальна частина" антитіла (або просто "частина антитіла"), як використовується в даній заявці, відноситься до одного або більше фрагментів антитіла, які зберігають здатність специфічно зв'язуватися з антигеном (наприклад, кадгерином-17). Було продемонстровано, що функція зв'язування антигену може здійснюватися за допомогою фрагментів антитіла повної довжини. Приклади сполучних фрагментів, які охоплюються терміном "антигензв'язувальна частина" антитіла, включають (i) Fab фрагмент, моновалентний фрагмент, який складається з VL/VK, VH, CL та CH1 доменів; (ii) F(ab')2 фрагмент, бівалентний фрагмент, який включає два Fab фрагменти, зв'язані дисульфідним містком у шарнірній ділянці; (iii) Fab" фрагмент, який суттєво являє собою Fab із частиною шарнірної ділянки (див., FUNDAMENTAL IMMUNOLOGY (Paul ред., 3-е видання, 1993); (iv) Fd фрагмент, який складається з VH та CH1 доменів; (v) Fv фрагмент, який складається з V L та VH доменів одного плеча антитіла, (vi) dab фрагмент (Ward та ін., (1989) Nature 341: 544-546), який складається з VH домену; (vii) ізольованої ділянки, яка визначає комплементарність (CDR); та (viii) нанотіла, варіабельної ділянки важкого ланцюга, яка містить один варіабельний домен та два константні домени. Крім того, незважаючи на те, що домени Fv фрагмента, VL / VK та VH кодуються окремими генами, вони можуть поєднуватися при використанні рекомбінантних способів, за допомогою синтетичного лінкера, що дозволяє їм утворювати один білковий ланцюг, в якому VL/VK та VH ділянки попарно утворюють моновалентні молекули (є відомими як один ланцюг Fv (scАv); див. наприклад, Bird та ін. (1988) Science 242: 423-426; та Huston та ін. (1988) Proc. Natl. Acad. Sci. USA 85: 5879-5883). Такі одноланцюгові антитіла є також призначеними для того, щоб охоплюватися терміном "антигензв'язувальна частина" антитіла. Ці фрагменти антитіла одержують при використанні традиційних методик, відомих фахівцеві в даній області техніки, та фрагменти піддають скринінгу на корисність таким способом, що й інтактні антитіла. Термін "ізольоване антитіло", як використовується в даній заявці, є призначеним для позначення антитіла, яке є суттєво вільним від інших антитіл, які мають відмінну антигенну специфічність (наприклад, ізольоване антитіло, яке специфічно зв'язується з кадгерином-17, є суттєво вільним від антитіл, що специфічно зв'язуються з антигенами, відмінними від кадгерину17). Ізольоване антитіло, яке специфічно зв'язується з кадгерином-17, може однак мати перехресну реактивність із іншими антигенами, такими, як молекули кадгерину-17 з інших видів. Крім того та/або альтернативно, ізольоване антитіло може бути суттєво вільним від іншого клітинного матеріалу та/або хімічних реагентів у формі, яка в нормі не виявляється в природі. У деяких втіленнях антитіла відповідно до винаходу являють собою рекомбінантні білки, ізольовані білки або суттєво чисті білки. "Ізольований" білок супроводжується принаймні деякою кількістю матеріалу, з яким він у нормі є асоційованим у своєму природному стані, наприклад, кількістю, що складає принаймні приблизно 5 %, або принаймні приблизно 50 % від ваги загального білка в даному зразку. Є зрозумілим, що ізольований білок може становити від 5 дo 99,9 % від ваги загального вмісту білка залежно від обставин. Наприклад, білок може бути отриманий при значно більш високій концентрації при використанні індуцибельного промотору або промотору високої експресії, так, що цей білок одержують при підвищених рівнях концентрації. У випадку рекомбінантних білків визначення включає одержання антитіла в широкій різноманітності організмів та/або хазяйських клітин, які є відомими в області техніки, в яких він звичайно не виробляється. Терміни "моноклональне антитіло" або " композиція моноклонального антитіла", як використовується в даній заявці, відносяться до препарату молекули антитіла однієї молекулярної композиції. Композиція моноклонального антитіла демонструє одну сполучну специфічність та афінність для конкретного епітопу. Як використовується в даній заявці, термін "ізотип" відноситься до класу антитіл (наприклад, IgM або IgG1), який кодується генами константної ділянки важкого ланцюга. Фрази "антиген, який впізнається антитілом" та "антитіло, специфічне для антигену" використовуються по черзі в даній заявці з термінами "антитіло, яке специфічно зв'язується з антигеном". Термін "похідна людського антитіла" відноситься до будь-якої модифікованої форми людського антитіла, наприклад, до кон'югату антитіла та іншого агента або антитіла. Наприклад, антитіла відповідно до даного винаходу можуть бути кон'юговані з токсином, міткою і т.п. 9 UA 108201 C2 5 10 15 20 25 30 35 40 45 50 55 60 Антитіла відповідно до даного винаходу можуть бути не-людськими, химерними, гуманізованими або повністю людськими. Для опису моделей химерних та гуманізованих антитіл дивися Clark та ін., 2000, та посилання, які там приводяться (Clark, 2000, Immunol Today 21: 397-402). Химерні антитіла включають варіабельну ділянку нелюдського антитіла, наприклад, VH та VL домени, які мають походження від миші або пацюка, оперативно зв'язані з константною ділянкою людського антитіла (дивися, наприклад патент США № 4,816,567). У переважному втіленні антитіла відповідно до даного винаходу є гуманізованими. Під "гуманізованим" антитілом, як використовується в даній заявці, розуміють антитіло, яке включає людську каркасну ділянку (FR) та одну або більше ділянок, що визначають комплементарність (CDR) з нелюдського (звичайно щурячого або мишачого) антитіла. Нелюдське антитіло, що забезпечує CDR, називається "донором", а людський імуноглобулін, що забезпечує каркас, називається "aкцептором". Гуманізація принципово базується на прищепленні донорних CDR на акцепторні (людські) VL та VH каркаси (патент США № 5,225,539). Ця стратегія називається "CDR прищепленням". "Зворотна мутація" залишків вибраного акцепторного каркаса до відповідних донорних залишків часто необхідна для відновлення афінности, яка втрачається у вихідній прищепленій конструкції (US 5,530,101; US 5,585,089; US 5,693,761; US 5,693,762; US 6,180,370; US 5,859,205; US 5,821,337; US 6,054,297; US 6,407,213). Гуманізоване антитіло оптимально також буде включати принаймні частину константної ділянки імуноглобуліну, типово такого людського імуноглобуліну і, таким чином, буде типово включати людську Fc ділянку. Способи гуманізації нелюдських антитіл є добре відомими в області техніки та можуть суттєво здійснюватися відповідно до Winter та співавт. (Jones та ін., 1986, Nature 321: 522-525; Riechmann та ін., 1988, Nature 332: 323-329; Verhoeyen та ін., 1988, Science, 239: 1534-1536). Додаткові приклади гуманізованих мишачих моноклональних антитіл є також відомими в області техніки, наприклад, антитіла, які зв'язують людський білок C (O'Connor та ін., 1998, Protein Eng 11: 321-8), рецептор інтерлейкіну-2 (Queen та ін., 1989, Proc Natl Acad Sci, USA 86:10029-33), та рецептор епідермального фактора росту 2 (Carter та ін., 1992, Proc Natl Acad Sci USA 89:42859). В альтернативнім втіленні антитіла відповідно до даного винаходу можуть бути повністю людськими, тобто, послідовності антитіл є повністю або суттєво людськими. В області техніки є відомим ряд способів для одержання повністю людських антитіл, включаючи застосування трансгенних мишей (Bruggemann и др., 1997, Curr Opin Biotechnol 8:455-458) або бібліотек людських антитіл, асоційованих з методами селекції (Griffiths и др., 1998, Curr Opin Biotechnol 9:102-108). Термін "гуманізоване антитіло" є призначеним для позначення антитіла, в якому CDR послідовності, які походять від ембріональної лінії інших видів ссавців, таких, як миша, спочатку прищеплені на каркасні послідовності людини. Додаткові модифікації каркасної ділянки можуть бути зроблені в каркасних послідовностях людини. Термін "химерне антитіло" є призначеним для позначення антитіл, в яких послідовності варіабельної ділянки походять від одного виду, а послідовності константної ділянки походять від інших видів, таких, як антитіла, в яких послідовності варіабельної ділянки походять від мишачого антитіла, а послідовності константної ділянки походять від людського антитіла. Термін "специфічно зв'язується" (або "імуноспецифічно зв'язується") не є призначеним для вказівки на те, що антитіло зв'язується винятково зі своєю призначеною мішенню. Замість цього антитіло'специфічно зв'язується", якщо його афінність для його призначеної мішені є приблизно в 5 разів вищою у порівнянні з його афінністю для молекули, що не є мішенню. Переважно, не існує значимої перехресної реактивності з небажаними речовинами, зокрема, білками, що існують у природі, або тканинами здорових особин або тварин. Афінність антитіла буде, наприклад, принаймні приблизно у 5 разів, така, як у 10 разів, така, як у 25 разів, особливо у 50 разів, та зокрема, у 100 разів або більше, вищою для цільової молекули, ніж афінність для нецільової молекули. У деяких втіленнях специфічне зв'язування між антитілом або іншим 6 -1 сполучним агентом та антигеном означає сполучну афінність, яка становить принаймні 10 M . 7 -1 Антитіла можуть, наприклад, зв'язуватися з афінностями принаймні приблизно 10 M , такими, 8 -1 9 -1 9 -1 10 -1 як від приблизно 10 M до приблизно 10 M , від приблизно 10 M до приблизно 10 M , або 10 -1 11 -1 від приблизно 10 M до приблизно 10 M . Антитіла можуть, наприклад, зв'язуватися з EC50 50 нM або менше, 10 нM або менше, 1 нM або менше, 100 пM або менше, або більш переважно 10 пM або менше. Термін "суттєво не зв'язується" з білком або клітинами, як використовується в даній заявці, означає "суттєво не зв'язується" або "не зв'язується з високої афінністю" з білком або клітинами, -6 тобто, зв'язується з білком або клітинами зі значенням KD 1 × 10 M або більше, більш бажано -5 -4 -3 1 × 10 M або більше, більш бажано 1 × 10 M або більше, більш бажано 1 × 10 M або більше, -2 навіть більш бажано 1 × 10 M або більше. 10 UA 108201 C2 5 10 15 20 25 30 35 40 45 50 55 Термін "EC50", як використовується в даній заявці, є призначеним для позначення ефективності сполучення шляхом кількісної оцінки концентрації, яка приводить до одержання 50 % максимальної відповіді/ефекту. EC50 може визначатися за допомогою Scratchard або FACS. Термін "Kасоц." або "Kaс", як використовується в даній заявці, є призначеним для позначення швидкості асоціації певної взаємодії антитіло-антиген, у той час, як термін "Kдис." або "Kd", як використовується в даній заявці, є призначеним для позначення швидкості дисоціації певної взаємодії антитіло-антиген. Термін "KD", як використовується в даній заявці, є призначеним для позначення константи дисоціації, яку одержують зі співвідношення K d до Ka (тобто, Kd/Ka) та виражають як молярну концентрацію (M). KD значення для антитіла можуть бути визначені при використанні способів, добре відомих в області техніки. Бажаний спосіб для визначення KD антитіла є таким при використанні поверхневого плазмонного резонансу, бажано при використанні біосенсорної системи, такої, як Biacore® система. Як використовується в даній заявці, термін "висока афінність" для IgG антитіла відноситься -7 -8 до антитіла, яке має значення KD, що становить 1 × 10 M або менше, більш бажано 5 × 10 M -8 -9 або менше, навіть більш бажано 1 × 10 M або менше, навіть більш бажано 5 × 10 M або -9 менше та навіть більш бажано 1 × 10 M або менше для цільового антигену. Проте "висока афінність" зв'язування може варіювати для інших ізотипів антитіла. Наприклад, "висока -6 афінність" зв'язування для IgМ ізотипу відноситься до антитіла, яке має значення K D 10 M або -7 менше, більш бажано 10 M або менше, навіть більш бажано 10-8 M або менше. Термін "епітоп" або "антигенна детермінанта" відноситься до сайту на антигені, з яким імуноглобулін або антитіло специфічно зв'язується. Епітопи можуть утворюватися як з послідовних амінокислот, так і непослідовних амінокислот, з'єднаних у третинній структурі білка. Епітопи, утворені з послідовних амінокислот, типово зберігаються при впливі денатурируючих розчинників, у той час як епітопи, утворені третинною структурою, типово втрачаються при дії денатурируючих агентів. Епітоп типово включає принаймні 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 або 15 амінокислот в унікальній просторовій конформації. Способи визначення просторової конформації епітопів включають методики, відомі в області техніки, та такі, які описані в даній заявці, наприклад, рентгенівську кристалографію та двомірний ядерний магнітний резонанс (див., наприклад, Еpitope Mapping Protocols in Methods in Molecular Biology, том 66, G. E. Morris, ред. (1996)). Відповідно до цього даний винахід також охоплює антитіла, які зв'язуються з (тобто, впізнають) тим самим епітопом, що й антитіла, описані в даній заявці (тобто, PTA001_A1, PTA001_A2, PTA001_A3, PTA001_A4, PTA001_A5, PTA001_A6, PTA001_A7, PTA001_A8, PTA001_A9, PTA001_A10, PTA001_A11, PTA001_A12, PTA001_A13 та PTA001_A14). Антитіла, які зв'язуються з (тобто, впізнають) тим самим епітопом, можуть бути ідентифіковані за їх здатністю перехресно конкурувати з (тобто, конкурентно інгібувати зв'язування) референтним антитілом за цільовий антиген статистично значущим чином. Конкурентне інгібування може виникати тоді, наприклад, коли антитіло зв'язується з ідентичними або структурно подібними епітопами (наприклад, епітопами, які перекриваються), або із просторово близькими епітопами, які при зв'язуванні викликають блокування між антитілами. Конкурентне інгібування може визначатися при використанні звичайних аналізів, в яких імуноглобулін при умовах аналізу інгібує специфічне зв'язування референтного антитіла зі звичайним антигеном. Є відомим ряд типів аналізів конкурентного зв'язування, наприклад: безпосередній або опосередкований твердофазний імуноаналіз (RIA), безпосередній або опосередкований твердофазний ферментний імуноаналіз (EIA), сендвич аналіз конкуренції (див. Stahli та ін., Methods in Enzymology 9: 242 (1983)); безпосередній твердофазний біотинавідин EIA (див. Kirkland та ін., J. Immunol. 137: 3614 (1986)); безпосередній твердофазний аналіз із міткою, безпосередній твердофазний сендвич-аналіз з міткою (див. Harlow та Lane, Аntibodies: A Laboratory Manual, Cold Spring Harbor Press (1988)); безпосередній твердофазний RIA з міткою при використанні мітки I-125 (див. Morel та ін., Mol. Immunol. 25(1): 7 (1988)); безпосередній твердофазний біотин-авідин EIA (Cheung та ін., Virology 176: 546 (1990)); та безпосередній RIA з міткою. (Moldenhauer та ін., Scand. J. Immunol. 32:77 (1990)). Типово, такий аналіз передбачає застосування очищеного антигену, пов'язаного із твердою поверхнею або клітинами, які несуть антиген, немічений досліджуваний імуноглобулін та мічений референтний імуноглобулін. Конкурентне інгібування вимірюється шляхом визначення кількості мітки, яка зв'язалася із твердою поверхнею або клітинами в присутності досліджуваного імуноглобуліну. Звичайно, досліджуваний імуноглобулін є присутнім у надлишку. Звичайно, у тому випадку, коли антитіло, що конкурує, є присутнім у надлишку, воно буде інгібувати специфічне зв'язування 11 UA 108201 C2 5 10 15 20 25 30 35 40 45 50 55 референтного антитіла зі звичайним антигеном принаймні на 50-55 %, 55-60 %, 60-65 %, 6570 % 70-75 % або більше. Інші методики включають, наприклад, способи картування епітопов, такі, як рентгеноструктурні аналізи кристалів комплексів антиген:антитіло, які забезпечують атомне розрізнення епітопу. Інші методи моніторингу зв'язування антитіла із фрагментами антигену або мутованими варіантами антигену, наприклад, де втрата здатності до зв'язування відбувається завдяки амінокислотним залишкам у межах послідовності антигену, часто розглядаються як показові для компонента епітопу. Крім того, також можуть використовуватися обчислювальні комбінаторні методи для картування епітопов. Ці способи ґрунтуються на здатності антитіла, яке представляє інтерес, до афінної ізоляції специфічних коротких пептидів з комбінаторних пептидних бібліотек фагового дисплея. Ці пептиди потім передбачаються як такі, які приводять до визначення епітопу, який відповідає антитілу, використовуваному для скринінгу пептидної бібліотеки. Для картування епітопів можуть також були розроблені комп'ютерні алгоритми, які були показані як такі, що картують конформаційні безперервні епітопи. Як використовується в даній заявці, термін "суб'єкт" включає будь-яку людину або тварину, відмінну від людини. Термін "тварина, відмінна від людини" включає всіх хребетних, наприклад, ссавців, та тварин, відмінних від ссавців, таких, як примати, відмінні від людини, вівці, собаки, коти, коні, корови, кури, амфібії, рептилії і т.п. Різні аспекти відповідно до винаходу більш докладно описуються далі в наступних підрозділах. Анти-кадгерин-17 антитіла Антитіла відповідно до винаходу характеризуються певними функціональними ознаками або властивостями антитіла. Наприклад, антитіла специфічно зв'язуються з людським кадгерином17. Є бажаним, коли антитіло відповідно до винаходу зв'язується з кадгерином-17 з високої -7 -8 афінністю, наприклад, зі значенням KD 8 × 10 M або менше, навіть більш типово 1 × 10 M або менше. Анти-кадгерин-17 антитіла відповідно до винаходу переважно демонструють одну або більше із наступних характеристик: зв'язуються з людським кадгерином-17 зі значенням EC50 50 нМ або менше, 10 нМ або менше, 1 нM або менш, 100 пM або менш, або більш переважно 10 пM або менше; зв'язуються з людськими клітинами, які експресують кадгерин-17. В одному втіленні антитіла переважно зв'язуються з антигенним епітопом, який є присутнім у кадгерині-17, де епітоп не є присутнім в інших білках. Антитіла типово зв'язуються з кадгерином-17, але не зв'язуються з іншими білками, або зв'язується з білками з низкою -6 -5 афінністю, такою, як зі значенням KD 1 × 10 M або більше, більш бажано 1 × 10 M або більше, -4 -3 більш бажано 1 × 10 M або більше, більш бажано 1 × 10 M або більше, навіть більш бажано 1 -2 × 10 M або більше. Переважно, антитіла не зв'язуються з родинними білками, наприклад, антитіла суттєво не зв'язуються з іншими молекулами клітинної адгезії. В одному втіленні антитіло може бути интерналізованим у клітині, яка експресує кадгерин-17. Стандартні аналізи для оцінки інтерналізації антитіла є відомими в області техніки, включаючи, наприклад, HumZap аналіз інтерналізації. Стандартні аналізи для оцінки здатності антитіла до зв'язування з кадгерином-17 є відомими в області техніки, включаючи, наприклад, ELISA, Вестерн-блоттінг аналізи, RIA та аналіз проточної цитометрії. Прийнятні аналізи є докладно описаними в прикладах. Кінетики зв'язування (наприклад, зв'язувальна афінність) антитіла також можуть бути оцінені за допомогою стандартних аналізів, відомих в області техніки, таких, як Biacore® системний аналіз. Для оцінки зв'язування з Raji або Daudi B пухлинними В-клітинами, Raji (позначення ATCC CCL86) або Daudi (позначення ATCC CCL-213) клітини можуть бути отримані із загальнодоступних джерел, таких, як Американська колекція типових культур, та використовуються в стандартних аналізах, таких, як аналіз проточної цитометрії. Моноклональні антитіла відповідно до винаходу Бажані антитіла відповідно до винаходу являють собою моноклональні антитіла PTA001_A1, PTA001_A2, PTA001_A3, PTA001_A4, PTA001_A5, PTA001_A6, PTA001_A7, PTA001_A8, PTA001_A9, PTA001_A10, PTA001_A11, PTA001_A12, PTA001_A13 та PTA001_A14, ізольовані та структурно охарактеризовані так, як описано в Прикладах 1-6. Амінокислотні послідовності VH PTA001_A1, PTA001_A2, PTA001_A3, PTA001_A4, PTA001_A5, PTA001_A6, PTA001_A7, PTA001_A8, PTA001_A9, PTA001_A10, PTA001_A11, PTA001_A12, PTA001_A13 та PTA001_A14 є представленими в SEQ ID NO: 35-46. Амінокислотні послідовності VK PTA001_A1, PTA001_A2, PTA001_A3, PTA001_A4, PTA001_A5, PTA001_A6, PTA001_A7, PTA001_A8, PTA001_A9, PTA001_A10, PTA001_A11, PTA001_A12, PTA001_A13 та PTA001_A14 є представленими в SEQ ID NO: 47-58. 12 UA 108201 C2 5 10 15 20 25 30 35 40 45 50 55 Враховуючи той факт, що кожне із цих антитіл може зв'язуватися з кадгерином-17, VH та VK послідовності можуть бути "змішані та підібрані" для створення інших анти-кадгерин-17 cполучних молекул відповідно до даного винаходу. Кадгерин-17, який зв'язується з такими "змішаними та підібраними" антитілами, може піддаватися аналізу при використанні аналізів зв'язування, які описані вище та у Прикладах (наприклад, ELISA). Є бажаним, коли V H та VK ланцюги змішують та підбирають, при цьому VH послідовність із певної VH/VK пари замінюється структурно подібної VH послідовністю. Крім того, бажано, коли VK послідовність із конкретної VH/VK пари замінюється структурно подібної VK послідовністю. Відповідно до цього в одному аспекті винахід забезпечує антитіло, яке включає: варіабельну ділянку важкого ланцюга, що включає амінокислотну послідовність, вибрану із групи, яка складається з SEQ ID NO: 38, 35, 36, 37, 39, 40, 41, 42, 43, 44, 45 та 46, та варіабельну ділянку легкого ланцюга, що включає амінокислотну послідовність, вибрану із групи, яка складається з SEQ ID NO: 49, 47, 48, 50, 51, 52, 53, 54, 55, 56, 57 та 58; де антитіло специфічно зв'язується з кадгерином-17, переважно людським кадгерином-17. Переважні комбінації важкого та легкого ланцюгів включають: варіабельну ділянку важкого ланцюга, що включає амінокислотну послідовність SEQ ID NO: 35, та варіабельну ділянку легкого ланцюга, що включає амінокислотну послідовність SEQ ID NO: 47; або варіабельну ділянку важкого ланцюга, що включає амінокислотну послідовність SEQ ID NO: 36; та варіабельну ділянку легкого ланцюга, що включає амінокислотну послідовність SEQ ID NO: 48, або варіабельну ділянку важкого ланцюга, що включає амінокислотну послідовність SEQ ID NO: 37; та варіабельну ділянку легкого ланцюга, що включає амінокислотну послідовність SEQ ID NO: 48, або варіабельну ділянку важкого ланцюга, що включає амінокислотну послідовність SEQ ID NO: 38; та варіабельну ділянку легкого ланцюга, що включає амінокислотну послідовність SEQ ID NO: 49, або варіабельну ділянка важкого ланцюга, що включає амінокислотну послідовність SEQ ID NO: 39; та варіабельну ділянку легкого ланцюга, що включає амінокислотну послідовність SEQ ID NO: 50, або варіабельну ділянку важкого ланцюга, що включає амінокислотну послідовність SEQ ID NO: 40; та варіабельну ділянку легкого ланцюга, що включає амінокислотну послідовність SEQ ID NO: 51, або варіабельну ділянку важкого ланцюга, що включає амінокислотну послідовність SEQ ID NO: 41; та варіабельну ділянку легкого ланцюга, що включає амінокислотну послідовність SEQ ID NO: 52, або варіабельну ділянку важкого ланцюга, що включає амінокислотну послідовність SEQ ID NO: 42; та варіабельну ділянку легкого ланцюга, що включає амінокислотну послідовність SEQ ID NO: 53, або варіабельну ділянку важкого ланцюга, що включає амінокислотну послідовність SEQ ID NO: 40; та варіабельну ділянку легкого ланцюга, що включає амінокислотну послідовність SEQ ID NO: 54, або варіабельну ділянку важкого ланцюга, що включає амінокислотну послідовність SEQ ID NO: 40; та варіабельну ділянку легкого ланцюга, що включає амінокислотну послідовність SEQ ID NO: 55, або варіабельну ділянку важкого ланцюга, що включає амінокислотну послідовність SEQ ID NO: 43; та варіабельну ділянку легкого ланцюга, що включає амінокислотну послідовність SEQ ID NO: 56, або 13 UA 108201 C2 5 10 15 20 25 30 35 40 45 50 55 60 варіабельну ділянку важкого ланцюга, що включає амінокислотну послідовність SEQ ID NO: 44; та варіабельну ділянку легкого ланцюга, що включає амінокислотну послідовність SEQ ID NO: 55, або варіабельну ділянку важкого ланцюга, що включає амінокислотну послідовність SEQ ID NO: 45; та варіабельну ділянку легкого ланцюга, що включає амінокислотну послідовність SEQ ID NO: 57, або варіабельну ділянку важкого ланцюга, що включає амінокислотну послідовність SEQ ID NO: 46; та варіабельну ділянку легкого ланцюга, що включає амінокислотну послідовність SEQ ID NO: 58. В іншому аспекті винахід забезпечує антитіла, які включають CDR1, CDR2 та CDR3 важкого та легкого ланцюгів PTA001_A1, PTA001_A2, PTA001_A3, PTA001_A4, PTA001_A5, PTA001_A6, PTA001_A7, PTA001_A8,PTA001_A9, PTA001_A10, PTA001_A11, PTA001_A12, PTA001_A13 та PTA001_A14 або їх комбінації. Амінокислотні послідовності CDR1 VH PTA001_A1, PTA001_A2, PTA001_A3, PTA001_A4, PTA001_A5, PTA001_A6, PTA001_A7, PTA001_A8, PTA001_A9, PTA001_A10, PTA001_A11, PTA001_A12, PTA001_A13 та PTA001_A14 є показаними в SEQ ID NO: 1-4. Амінокислотні послідовності CDR2 VH PTA001_A1, PTA001_A2, PTA001_A3, PTA001_A4, PTA001_A5, PTA001_A6, PTA001_A7, PTA001_A8, PTA001_A9, PTA001_A10, PTA001_A11, PTA001_A12, PTA001_A13 та PTA001_A14 є показаними в SEQ ID NO: 5-13. Амінокислотні послідовності CDR3 VH PTA001_A1, PTA001_A2, PTA001_A3, PTA001_A4, PTA001_A5, PTA001_A6, PTA001_A7, PTA001_A8, PTA001_A9, PTA001_A10, PTA001_A11, PTA001_A12, PTA001_A13 та PTA001_A14 є показаними в SEQ ID NO: 14-21. Амінокислотні послідовності CDR1 VK PTA001_A1, PTA001_A2, PTA001_A3, PTA001_A4, PTA001_A5, PTA001_A6, PTA001_A7, PTA001_A8, PTA001_A9, PTA001_A10, PTA001_A11, PTA001_A12, PTA001_A13 та PTA001_A14 є показаними в SEQ ID NO: 22-27. Амінокислотні послідовності CDR2 VK PTA001_A1, PTA001_A2, PTA001_A3, PTA001_A4, PTA001_A5, PTA001_A6, PTA001_A7, PTA001_A8, PTA001_A9, PTA001_A10, PTA001_A11, PTA001_A12, PTA001_A13 та PTA001_A14 є показаними в SEQ ID NO: 28-31. Амінокислотні послідовності CDR3 VK PTA001_A1, PTA001_A2, PTA001_A3, PTA001_A4, PTA001_A5, PTA001_A6, PTA001_A7, PTA001_A8, PTA001_A9, PTA001_A10, PTA001_A11, PTA001_A12, PTA001_A13 та PTA001_A14 є показаними в SEQ ID NO:32-34. CDR ділянки є позначеними при використанні системи Kabat (Kabat, E. A., та ін. (1991) Sequences of Proteins of Immunological Interest, Fifth Edition, 5-е видання, Міністерство охорони здоров'я та соціального забезпечення США, NIH публікація № 91-3242). Беручи до уваги, що кожне із цих антитіл може зв'язуватися з кадгерином-17 та що антигензв'язувальна специфічність забезпечується, насамперед, за допомогою ділянок CDR1, CDR2 та CDR3, можна сказати, що послідовності CDR1, CDR2 та CDR3 V H та послідовності CDR1, CDR2 та CDR3 VK можуть "змішуватися та підбиратися" (тобто, CDR з різних антитіл можуть змішуватися та підбиратися, проте кожне антитіло в загальному випадку містить CDR1, CDR2 та CDR3 VH та CDR1, CDR2 та CDR3 VK) для створення інших анти-кадгерин-17 сполучних молекул відповідно до даного винаходу. Відповідно до цього, винахід специфічно включає кожну можливу комбінацію CDR важкого та легкого ланцюгів. Зв'язування кадгерину-17 такими "змішаними та підібраними" антитілами може піддаватися аналізу при використанні аналізів зв'язування, описаних вище та у Прикладах (наприклад, ELISA, Biacore® аналіз). Є бажаним, коли VH CDR послідовності змішують та підбирають, при цьому CDR1, CDR2 та/або CDR3 з певної VH послідовності замінюють структурно подібною(ими) CDR послідовністю(ями). Крім того, коли VK CDR послідовності змішують та підбирають, то CDR1, CDR2 та/або CDR3 послідовності їх конкретної VK послідовності переважно замінюють структурно подібною(ими) CDR послідовністю(ями). При цьому фахівцеві в даній області техніки буде зрозумілим, що нові VH та VK послідовності можуть бути створені шляхом заміни однієї або більше послідовностей VH та/або VL/VK CDR ділянками, структурно подібними до послідовностей з CDR послідовностями, розкритими в даній заявці для моноклональних антитіл PTA001_A1, PTA001_A2, PTA001_A3, PTA001_A4, PTA001_A5, PTA001_A6, PTA001_A7, PTA001_A8, PTA001_A9, PTA001_A10, PTA001_A11, PTA001_A12, PTA001_A13 та PTA001_A14. У відповідності із цим в іншому аспекті винахід забезпечує ізольоване моноклональне антитіло або його антигензв'язувальну частина, які включають: CDR1 варіабельної ділянки важкого ланцюга, що включає амінокислотну послідовність, вибрану із групи, яка складається з SEQ ID NO: 1-4; 14 UA 108201 C2 5 10 15 20 25 30 35 40 45 50 55 60 CDR2 варіабельної ділянки важкого ланцюга, що включає амінокислотну послідовність, вибрану із групи, яка складається з SEQ ID NO: 5-13; CDR3 варіабельної ділянки важкого ланцюга, що включає амінокислотну послідовність, вибрану з групи, яка складається з SEQ ID NO: 14-21; CDR1 варіабельної ділянки легкого ланцюга, що включає амінокислотну послідовність, вибрану із групи, яка складається з SEQ ID NO: 22-27; CDR2 варіабельної ділянки легкого ланцюга, що включає амінокислотну послідовність, вибрану із групи, яка складається з SEQ ID NO: 28-31; і CDR3 варіабельної ділянки легкого ланцюга, що включає амінокислотну послідовність, вибрану із групи, яка складається з SEQ ID NO: 32-34; з усіма можливими комбінаціями, де антитіло специфічно зв'язується з кадгерином-17, переважно людським кадгерином-17. У бажаному втіленні антитіло включає: CDR1 варіабельної ділянки важкого ланцюга, що включає SEQ ID NO: 1; CDR2 варіабельної ділянки важкого ланцюга, що включає SEQ ID NO: 5; CDR3 варіабельної ділянки важкого ланцюга, що включає SEQ ID NO: 14; CDR1 варіабельної ділянки легкого ланцюга, що включає SEQ ID NO: 22; CDR2 варіабельної ділянки легкого ланцюга, що включає SEQ ID NO: 28; і CDR3 варіабельного ділянки легкого ланцюга, що включає SEQ ID NO: 32. В іншому бажаному втіленні антитіло включає: CDR1 варіабельної ділянки важкого ланцюга, що включає SEQ ID NO: 2; CDR2 варіабельної ділянки важкого ланцюга, що включає SEQ ID NO: 6; CDR3 варіабельної ділянки важкого ланцюга, що включає SEQ ID NO: 15; CDR1 варіабельної ділянки легкого ланцюга, що включає SEQ ID NO: 23; CDR2 варіабельної ділянки легкого ланцюга, що включає SEQ ID NO: 29; і CDR3 варіабельної ділянки легкого ланцюга, що включає SEQ ID NO: 33. В іншому бажаному втіленні антитіло включає: CDR1 варіабельної ділянки важкого ланцюга, що включає SEQ ID NO: 3; CDR2 варіабельної ділянки важкого ланцюга, що включає SEQ ID NO: 7; CDR3 варіабельної ділянки важкого ланцюга, що включає SEQ ID NO: 16; CDR1 варіабельної ділянки легкого ланцюга, що включає SEQ ID NO: 23; CDR2 варіабельної ділянки легкого ланцюга, що включає SEQ ID NO: 29; і CDR3 варіабельної ділянки легкого ланцюга, що включає SEQ ID NO: 33. В іншому бажаному втіленні антитіло включає: CDR1 варіабельної ділянки важкого ланцюга, що включає SEQ ID NO: 4; CDR2 варіабельної ділянки важкого ланцюга, що включає SEQ ID NO: 8; CDR3 варіабельної ділянки важкого ланцюга, що включає SEQ ID NO: 17; CDR1 варіабельної ділянки легкого ланцюга, що включає SEQ ID NO: 24; CDR2 варіабельної ділянки легкого ланцюга, що включає SEQ ID NO: 30; і CDR3 варіабельної ділянки легкого ланцюга, що включає SEQ ID NO: 34. В іншому бажаному втіленні антитіло включає: CDR1 варіабельної ділянки важкого ланцюга, що включає SEQ ID NO: 3; CDR2 варіабельної ділянки важкого ланцюга, що включає SEQ ID NO: 7; CDR3 варіабельної ділянки важкого ланцюга, що включає SEQ ID NO: 18; CDR1 варіабельної ділянки легкого ланцюга, що включає SEQ ID NO: 25; CDR2 варіабельної ділянки легкого ланцюга, що включає SEQ ID NO: 31; і CDR3 варіабельної ділянки легкого ланцюга, що включає SEQ ID NO: 33. В іншому бажаному втіленні антитіло включає: CDR1 варіабельної ділянки важкого ланцюга, що включає SEQ ID NO: 3; CDR2 варіабельної ділянки важкого ланцюга, що включає SEQ ID NO: 9; CDR3 варіабельної ділянки важкого ланцюга, що включає SEQ ID NO: 19; CDR1 варіабельної ділянки легкого ланцюга, що включає SEQ ID NO:26; CDR2 варіабельної ділянки легкого ланцюга, що включає SEQ ID NO: 29; і CDR3 варіабельної ділянки легкого ланцюга, що включає SEQ ID NO: 33. В іншому бажаному втіленні антитіло включає: CDR1 варіабельної ділянки важкого ланцюга, що включає SEQ ID NO: 3; CDR2 варіабельної ділянки важкого ланцюга, що включає SEQ ID NO: 7; CDR3 варіабельної ділянки важкого ланцюга, що включає SEQ ID NO: 16; CDR1 варіабельної ділянки легкого ланцюга, що включає SEQ ID NO: 25; CDR2 варіабельної ділянки легкого ланцюга, що включає SEQ ID NO: 31; і 15 UA 108201 C2 5 10 15 20 25 30 35 40 45 50 55 CDR3 варіабельної ділянки легкого ланцюга, що включає SEQ ID NO: 33. В іншому бажаному втіленні антитіло включає: CDR1 варіабельної ділянки важкого ланцюга, що включає SEQ ID NO: 3; CDR2 варіабельної ділянки важкого ланцюга, що включає SEQ ID NO: 7; CDR3 варіабельної ділянки важкого ланцюга, що включає SEQ ID NO: 16; CDR1 варіабельної ділянки легкого ланцюга, що включає SEQ ID NO: 25; CDR2 варіабельної ділянки легкого ланцюга, що включає SEQ ID NO: 29; і CDR3 варіабельної ділянки легкого ланцюга, що включає SEQ ID NO: 33. В іншому бажаному втіленні антитіло включає: CDR1 варіабельної ділянки важкого ланцюга, що включає SEQ ID NO: 3; CDR2 варіабельної ділянки важкого ланцюга, що включає SEQ ID NO: 10; CDR3 варіабельної ділянки важкого ланцюга, що включає SEQ ID NO: 20; CDR1 варіабельної ділянки легкого ланцюга, що включає SEQ ID NO: 27; CDR2 варіабельної ділянки легкого ланцюга, що включає SEQ ID NO: 29; і CDR3 варіабельної ділянки легкого ланцюга, що включає SEQ ID NO: 33. В іншому бажаному втіленні антитіло включає: CDR1 варіабельної ділянки важкого ланцюга, що включає SEQ ID NO: 3; CDR2 варіабельної ділянки важкого ланцюга, що включає SEQ ID NO: 11; CDR3 варіабельної ділянки важкого ланцюга, що включає SEQ ID NO: 21; CDR1 варіабельної ділянки легкого ланцюга, що включає SEQ ID NO: 25; CDR2 варіабельної ділянки легкого ланцюга, що включає SEQ ID NO: 29; і CDR3 варіабельної ділянки легкого ланцюга, що включає SEQ ID NO: 33. В іншому бажаному втіленні антитіло включає: CDR1 варіабельної ділянки важкого ланцюга, що включає SEQ ID NO: 3; CDR2 варіабельної ділянки важкого ланцюга, що включає SEQ ID NO: 12; CDR3 варіабельної ділянки важкого ланцюга, що включає SEQ ID NO: 18; CDR1 варіабельної ділянки легкого ланцюга, що включає SEQ ID NO: 25; CDR2 варіабельної ділянки легкого ланцюга, що включає SEQ ID NO: 31; і CDR1 варіабельної ділянки легкого ланцюга, що включає SEQ ID NO: 33. В іншому бажаному втіленні антитіло включає: CDR1 варіабельної ділянки важкого ланцюга, що включає SEQ ID NO: 2; CDR2 варіабельної ділянки важкого ланцюга, що включає SEQ ID NO: 13; CDR3 варіабельної ділянки важкого ланцюга, що включає SEQ ID NO: 15; CDR1 варіабельної ділянки легкого ланцюга, що включає SEQ ID NO: 23; CDR2 варіабельної ділянки легкого ланцюга, що включає SEQ ID NO: 29; і CDR3 варіабельної ділянки легкого ланцюга, що включає SEQ ID NO: 33. В області техніки є добре відомим, що CDR3 домен, незалежно від CDR1 та/або CDR2 домену(ів), самостійно може визначати зв'язувальну специфічність антитіла для родинного антигену, та що безліч антитіл, які мають таку ж саму зв'язувальну специфічність, можуть бути із впевненістю отримані, базуючись на загальній послідовності CDR3. Дивіться, наприклад, Klimka та ін., British J. of Cancer 83(2): 252-260 (2000) (описує одержання гуманізованого анти-CD30 антитіла при використанні тільки варіабельного домену важкого ланцюга мишачого анти-CD30 антитіла Ki-4); Beiboer та ін., J. Mol. Biol. 296: 833-849 (2000) (описує одержання рекомбінантного антитіла до епітеліального глікопротеїну-2 (EGP-2) при використанні тільки CDR3 послідовності важкого ланцюга вихідного мишачого MOC-31 анти-EGP-2 антитіла); Rader та ін., Proc. Natl. Acad. Sci. U.S.A. 95: 8910-8915 (1998) (описує ряд гуманізованих анти-інтегринових αvβ3 антитіл при використанні варіабельного CDR3 домену важкого та легкого ланцюгів мишачого антиинтегринового αvβ3 антитіла LM609, де кожне антитіло включає відмінну послідовність за межами CDR3 домену та є здатним до зв'язування з тим самим епітопом, що й вихідне мишаче антитіло, з афінностями, які є такими ж високими або вище, ніж для вихідного мишачого антитіла); Barbas та ін., J. Am. Chem. Soc. 116: 2161-2162 (1994) (це джерело розкриває той факт, що CDR3 домен забезпечує найважливіший внесок у зв'язування антигену); Barbas та ін., Proc. Natl. Acad. Sci. U.S.A. 92: 2529-2533 (1995) (описує прищеплення CDR3 послідовності важкого ланцюга для трьох Fab (SI-1, SI-40 та SI-32) проти людської плацентарної ДНК на важкий ланцюг Fab, спрямованого проти токсоїда правця, що, таким чином, забезпечує заміну існуючого CDR3 важкого ланцюга та демонструє, що CDR3 домен, узятий самостійно, забезпечує сполучну специфічність); та Ditzel та ін., J. Immunol. 157: 739-749 (1996) (описує дослідження із прищеплення, де перенос тільки CDR3 важкого ланцюга вихідного поліспецифічного Fab LNA3 на важкий ланцюг моноспецифічного Fab p313 IgG антитіла, яке 16 UA 108201 C2 5 10 15 20 25 30 35 40 45 50 55 60 зв'язує токсоїд правця, був достатнім для збереження зв'язувальної специфічності вихідного Fab). Кожне із цих джерел є введеним у дану заявку як посилання у своїй цілісності. Відповідно до цього, даний винахід забезпечує моноклональні антитіла, які включають один або більше CDR3 доменів важкої та/або легкого ланцюга з антитіл, які мають походження від людини або тварини, відмінної від людини, де моноклональне антитіло є здатним до специфічного зв'язування з кадгерином-17. У деяких аспектах даний винахід забезпечує моноклональні антитіла, які включають один або більше CDR3 доменів важкого та/або легкого ланцюга з нелюдського антитіла, такого, як мишаче або щуряче антитіло, де моноклональне антитіло є здатним до специфічного зв'язування з кадгерином-17. У деяких втіленнях такі оригінальні антитіла, які включають один або більше CDR3 доменів важкого та/або легкого ланцюга з нелюдського антитіла, (a) є здатними конкурувати за зв'язування; (b) зберігати функціональні характеристики; (c) зв'язуватися з тим самим епітопом; та/або (d) мати подібну сполучну афінність із відповідним нелюдським антитілом. В інших аспектах даний винахід забезпечує моноклональні антитіла, які включають один або більше CDR3 доменів важкого та/або легкого ланцюга з людського антитіла, такого, як, наприклад, людське антитіло, отримане від тварини, відмінної від людини, де людське антитіло є здатним до специфічного зв'язування з кадгерином-17. В інших аспектах даний винахід забезпечує моноклональні антитіла, які включають один або більше CDR3 доменів важкого та/або легкого ланцюга з першого людського антитіла, такого, як, наприклад, людське антитіло, отримане від тварини, відмінної від людини, де перше людське антитіло є здатним до специфічного зв'язування з кадгерином-17, та де CDR3 домен з першого людського антитіла замінює CDR3 домен у людському антитілі, яке не має сполучної специфічності для кадгерину17, для одержання другого людського антитіла, яке є здатним до специфічного зв'язування з кадгерином-17. У деяких втіленнях такі оригінальні антитіла, які включають один або більше CDR3 доменів важкого та/або легкого ланцюга з першого людського антитіла (a) є здатними конкурувати за зв'язування; (b) зберігати функціональні характеристики; (c) зв'язуватися з тим самим епітопом; та/або (d) мати подібну сполучну афінність із відповідним вихідним першим людським антитілом. Антитіла, які мають певні послідовності ембріональної лінії У деяких втіленнях антитіло відповідно до винаходу включає варіабельну ділянку важкого ланцюга з гена важкого ланцюга імуноглобуліну конкретної ембріональної лінії та/або варіабельну ділянку легкого ланцюга з гена легкого ланцюга імуноглобуліну конкретної ембріональної лінії. Наприклад, у бажаному втіленні винахід забезпечує ізольоване моноклональне антитіло або його антигензв'язувальну частину, що включає варіабельну ділянку важкого ланцюга, який являє собою продукт або має походження від мишачого 7-39 гена, мишачої VH II ділянки VH105 гена або мишачого VH II гена H17, де антитіло специфічно зв'язується з кадгерином-17. Ще в одному бажаному втіленні винахід забезпечує ізольоване моноклональне антитіло або його антигензв'язувальну частина, що включає варіабельну ділянку легкого ланцюга, який являє собою продукт або має походження від мишачого VK 1-110 гена, мишачого VK 8-30 гена або мишачого VK 24-140 гена, де антитіло специфічно зв'язується з кадгерином-17. Ще в одному бажаному втіленні винахід забезпечує ізольоване моноклональне антитіло або його антигензв'язувальну частина, де антитіло: включає варіабельну ділянку важкого ланцюга, який є продуктом або має походження від мишачого VH 7-39 гена (ці гени кодують амінокислотну послідовність, представлену в SEQ ID NO: 125); включає варіабельну ділянкау легкого ланцюга, який є продуктом або має походження від мишачого VK 1-110 гена (ці гени кодують амінокислотні послідовності, представлені в SEQ ID NO: 128 та 129); та специфічно зв'язується з кадгерином-17, переважно людським кадгерином17. Приклади антитіл, що включають VH та VK з VH 7-39 та VK 1-110, відповідно, являють собою PTA001_A1. Ще в одному бажаному втіленні винахід забезпечує ізольоване моноклональне антитіло або його антигензв'язувальну частина, де антитіло: включає варіабельну ділянку важкого ланцюга, який є продуктом або має походження від мишачого VH II гена H17 або мишачої VH II ділянки VH105 гена (ці гени включають нуклеотидні послідовності, представлені в SEQ ID NO: 126 та 127, відповідно); включає варіабельну ділянку легкого ланцюга, який є продуктом або має походження від мишачого VK 8-30 гена (де ген включає нуклеотидні послідовності, представлені в SEQ ID NO: 130, 131 та 132); і специфічно зв'язується з кадгерином-17, переважно людським кадгерином-17. 17 UA 108201 C2 5 10 15 20 25 30 35 40 45 50 55 60 Приклади антитіл, які мають VH VH II гена H17 або VH II ділянку VH105 та VK VK 8-30, являють собою PTA001_A4. Ще в одному бажаному втіленні винахід забезпечує ізольоване моноклональне антитіло або його антигензв'язувальну частина, де антитіло: включає варіабельну ділянку важкого ланцюга, який є продуктом або має походження від мишачого VH II гена H17 або мишачої VH II ділянки VH105 гена (ці гени включають нуклеотидні послідовності, представлені в SEQ ID NO: 126 та 127, відповідно); включає варіабельну ділянку легкого ланцюга, який є продуктом або має походження від мишачого VK 24-140 гена (де ген включає нуклеотидні послідовності, представлені в SEQ ID NO: 133, 134 та 135); і специфічно зв'язується з кадгерином-17, переважно людським кадгерином-17. Приклади антитіл, що мають VH VH II гена H17 або VH II ділянку VH105 та VK VK 24-140, являють собою PTA001_A2, PTA001_A3, PTA001_A5, PTA001_A6, PTA001_A7, PTA001_A8, PTA001_A9, PTA001_A10, PTA001_A11, PTA001_A12, PTA001_A13 та PTA001_A14. Як використовується в даній заявці, антитіло включає варіабельні ділянки важкого або легкого ланцюга, тобто, являє собою "продукт" або "походить від" конкретної послідовності ембріональної лінії, якщо варіабельні ділянки антитіла одержують із системи, яка використовує мишачі гени імуноглобуліну ембріональної лінії. Такі системи включають скринінг бібліотеки генів мишачого імуноглобуліну на фаговому дисплеї при використанні антигену, який представляє інтерес. Антитіло, яке являє собою "продукт" або “ походить від" послідовності імуноглобуліну мишачої ембріональної лінії, може бути ідентифіковане як таке шляхом порівняння нуклеотидної або амінокислотної послідовності людського антитіла з нуклеотидними або амінокислотними послідовностями імуноглобулінів мишачої ембріональної лінії та селекції послідовності імуноглобуліну мишачої ембріональної лінії на таку, яка є найближчою за послідовністю (тобто, має найбільший % ідентичності) з послідовністю мишачого антитіла. Антитіло, яке є "продуктом" або "походить від певної послідовності" імуноглобуліну мишачої ембріональної лінії, може містити амінокислотні відмінності у порівнянні з послідовністю ембріональної лінії, завдяки, наприклад мутаціям, що виникають у природі, або навмисному введенню сайт-спрямованої мутації. Проте відібране антитіло типове є принаймні на 90 % ідентичним за амінокислотною послідовністю амінокислотній послідовності, яка кодується геном імуноглобуліну мишачої ембріональної лінії та містить амінокислотні залишки, які ідентифікують це антитіло як таке, яке є мишачим при порівнянні з амінокислотними послідовностями імуноглобуліну ембріональної лінії інших видів (наприклад, послідовностями людської ембріональної лінії). У деяких випадках антитіло може бути принаймні на 95 %, або навіть принаймн, на 96 %, 97 %, 98 % або 99 % ідентичним за амінокислотною послідовністю амінокислотній послідовності, яка кодується геном імуноглобуліну ембріональної лінії. Типово, антитіло, яке походить від певної послідовності мишачої ембріональної лінії, буде демонструвати не більше, ніж 10 амінокислотних відмінностей від амінокислотної послідовності, яка кодується геном імуноглобуліну мишачої ембріональної лінії. У деяких випадках антитіло може демонструвати не більше, ніж 5, або навіть не більше, ніж 4, 3, 2 або 1 амінокислотних відмінностей від амінокислотної послідовності, яка кодується геном імуноглобуліну ембріональної лінії. Гомологічні антитіла Ще в одному втіленні антитіло відповідно до винаходу включає варіабельні ділянки важкого та легкого ланцюгів, які включають амінокислотні послідовності, що є гомологічними амінокислотним послідовностям бажаного антитіла, описаного в даній заявці, та де антитіло зберігає бажані функціональні властивості анти-кадгерин-17 антитіла відповідно до даного винаходу. Наприклад, винахід забезпечує ізольоване моноклональне антитіло або його антигензв'язувальну частину, яка включає варіабельну ділянку важкого ланцюга та варіабельну ділянку легкого ланцюга, де: варіабельна ділянка важкого ланцюга включає амінокислотну послідовність, яка є принаймні на 80 % ідентичною амінокислотній послідовності, вибраній із групи, яка складається з SEQ ID NO: 35-46; варіабельна ділянка легкого ланцюга включає амінокислотну послідовність, яка є принаймні на 80 % ідентичною амінокислотній послідовності, вибраній із групи, яка складається з SEQ ID NO: 47-58; і антитіло зв'язується з людським кадгерином-17. Такі антитіла можуть зв'язуватися з людським кадгерином-17 з EC50 50 нM або менше, 10 нM або менше, 1 нM або менше, 100 пM або менше, або більш переважно 10 пM або менше. 18 UA 108201 C2 5 10 15 20 25 30 35 40 45 50 55 60 Антитіло може також зв'язуватися з CHO клітинами, трансфікованими за допомогою людського кадгерину-17. У різних втіленнях антитіло може бути, наприклад, людським антитілом, гуманізованим антитілом або химерним антитілом. В інших втіленнях VH та/або VK амінокислотні послідовності можуть бути на 85 %, 90 %, 95 %, 96 %, 97 %, 98 % або 99 % гомологічні послідовності, як представлено вище. Aнтитіло, яке містить VH та VK ділянки, що мають високу (тобто, 80 % або більше) ідентичність із VH та VK ділянками послідовності, як представлено в даній заявці, може бути отримане за допомогою мутагенезу (наприклад, сайт-спрямованого мутагенезу або опосередкованого ПЛР мутагенезу) молекул нуклеїнової кислоти, які кодують SEQ ID NO: 59-83, після чого проводять аналіз кодованого зміненого антитіла на збережену функцію при використанні функціональних аналізів, описаних у даній заявці. Відсоток ідентичності між двома послідовностями являє собою функцію кількості ідентичних положень, які розділяються цими послідовностями (тобто, % гомології = кількість ідентичних положень / загальна кількість положень x 100), беручи до уваги кількість пробілів та довжину кожного пробілу, який повинен бути введений для оптимального вирівнювання двох послідовностей. Порівняння послідовностей та визначення відсотка ідентичності між двома послідовностями може бути проведене при використанні математичного алгоритму, як описано в необмежуючих прикладах, наведених нижче. Відсоток ідентичності між двома амінокислотними послідовностями може бути визначений при використанні алгоритму E. Meyers та W. Miller (Comput. Appl. Biosci., 4: 11-17 (1988), який є введеним у програму ALIGN (версія 2.0), при використанні PAM120 таблиці значення залишку, штрафу за довжину пробілу 12 та штрафу за пробіл 4. Крім того, відсоток ідентичності між двома амінокислотними послідовностями може бути визначений при використанні алгоритму Needleman та Wunsch (J. Mol. Biol. 48: 444-453 (1970)), який є введеним у програму GAP в GCG пакеті програмного забезпечення (є доступним на http://www.gcg.com), при використанні або Blossum 62 матриці, або PAM250 матриці та значення пробілу 16, 14, 12, 10, 8, 6 або 4 та значення довжини 1, 2, 3, 4, 5 або 6. Додатково або альтернативно, білкові послідовності відповідно до даного винаходу можуть додатково використовуватися як "пошукові послідовності" для здійснення пошуку в загальнодоступних базах даних, наприклад, для ідентифікації родинних послідовностей. Такі пошуки можуть бути проведені при використанні XBLAST програми (версія 2.0) Altschul, та ін. (1990) J. Mol. Biol. 215: 403-10. BLAST білкові пошуки можуть бути проведені при використанні XBLAST програми, рахунок = 50, довжина слова = 3, для одержання амінокислотних послідовностей, гомологічних молекулі антитіла відповідно до даного винаходу. Для одержання вирівнювань, які містять пробіли, з метою порівняння, може використовуватися Gapped BLAST так, як описано в Altschul та ін., (1997) Nucleic Acid Res. 25(17): 3389-3402. При використанні BLAST та Gapped BLAST програм можуть використовуватися параметри за умовчанням відповідних програм (наприклад, XBLAST та NBLAST). Дивіться www.ncbi.nlm.nih.gov. Антитіла з консервативними модифікаціями У деяких втіленнях антитіло відповідно до винаходу включає варіабельну ділянку важкого ланцюга, який містить послідовності CDR1, CDR2 та CDR3, та варіабельну ділянку легкого ланцюга, який містить послідовності CDR1, CDR2 та CDR3, де одна або більше таких CDR послідовностей включають зазначені амінокислотні послідовності, які базуються на бажаних антитілах, описаних у даній заявці (наприклад, PTA001_A1, PTA001_A2, PTA001_A3, PTA001_A4, PTA001_A5, PTA001_A6, PTA001_A7, PTA001_A8, PTA001_A9, PTA001_A10, PTA001_A11, PTA001_A12, PTA001_A13 або PTA001_A14), або їх консервативні модифікації, та де антитіла зберігають бажані функціональні властивості анти-кадгерин-17 антитіла відповідно до даного винаходу. Відповідно до цього винахід забезпечує ізольоване моноклональне антитіло або його антигензв'язувальну частину, яке включає варіабельну ділянку важкого ланцюга, що включає послідовності CDR1, CDR2 та CDR3, та варіабельну ділянку легкого ланцюга, що включає послідовності CDR1, CDR2 та CDR3, де: послідовність CDR3 варіабельної ділянки важкого ланцюга включає амінокислотні послідовності, вибрані із групи, яка складається з амінокислотних послідовностей SEQ ID NO: 14-21 та їх консервативних модифікацій; послідовність CDR3 варіабельної ділянки легкого ланцюга включає амінокислотні послідовності, вибрані із групи, яка складається з амінокислотних послідовностей SEQ ID NO: 32-34 та їх консервативних модифікацій; і антитіло зв'язується з людським кадгерином-17 зі значенням EC50 50 нM або менше, 10 нM або менше, 1 нM або менше, 100 пM або менше, або більш переважно 10 пM або менше. 19 UA 108201 C2 5 10 15 20 25 30 35 40 45 50 55 60 Антитіло також зв'язується з CHO клітинами, трансфікованими за допомогою людського кадгерину-17. У бажаному втіленні послідовність CDR2 варіабельної ділянки важкого ланцюга включає амінокислотні послідовності, вибрані із групи, яка складається з амінокислотних послідовностей SEQ ID NO: 5-13 та їх консервативних модифікацій; а послідовність CDR2 варіабельної ділянки легкого ланцюга включає амінокислотні послідовності, вибрані із групи, яка складається з амінокислотних послідовностей SEQ ID NO: 28-31 та їх консервативних модифікацій. В іншому бажаному втіленні послідовність CDR1 варіабельної ділянки важкого ланцюга включає амінокислотні послідовності, вибрані із групи, яка складається з амінокислотних послідовностей SEQ ID NO: 1-4 та їх консервативних модифікацій; а послідовність CDR2 варіабельної ділянки легкого ланцюга включає амінокислотні послідовності, вибрані із групи, яка складається з амінокислотних послідовностей SEQ ID NO: 22-27 та їх консервативних модифікацій. У різних втіленнях антитіла можуть являти собою, наприклад, людські антитіла, гуманізовані антитіла або химерні антитіла. Як використовується в даній заявці, термін "консервативні модифікації послідовності" є призначеним для позначення амінокислотних модифікацій, які значним чином не впливають або не змінюють сполучних характеристик антитіла, яке містить амінокислотну послідовність. Такі консервативні модифікації включають амінокислотні заміни, доповнення або делеції. Модифікації можуть бути введені в антитіло відповідно до винаходу за допомогою стандартних методик, відомих з рівня техніки, таких, як сайт-спрямований мутагенез та опосередкований ПЛР мутагенез. Консервативні амінокислотні заміни є такими, при яких амінокислотний залишок замінюють за допомогою амінокислотного залишку, який має подібний бічний ланцюг. Родини амінокислотних залишків, які мають подібні бічні ланцюги, є визначеними в галузі техніки. Такі родини включають амінокислоти з основними бічними ланцюгами (наприклад, лізин, аргінін, гістидин), кислотними бічними ланцюгами (наприклад, аспарагінова кислота, глутамінова кислота), незарядженими полярними бічними ланцюгами (наприклад, гліцин, аспарагін, глутамін, серин, треонін, тирозин, цистеїн), неполярними бічними ланцюгами (наприклад, аланін, валін, лейцин, ізолейцин, пролін, фенілаланін, метіонін, триптофан), бетарозгалуженими бічними ланцюгами (наприклад, треонін, валін, ізолейцин) та ароматичними бічними ланцюгами (наприклад, тирозин, фенілаланін, триптофан, гістидин). Таким чином, один або більше амінокислотних залишків в CDR ділянках антитіла відповідно до винаходу можуть бути замінені іншими амінокислотними залишками з тієї ж родини бічних ланцюгів, та змінене антитіло може зазнати аналізу на збережену функцію при використанні функціональних аналізів, описаних у даній заявці. Послідовність CDR1 важкого ланцюга, представлена SEQ ID NO: 1-4, може включати одну або більше консервативних модифікацій послідовності, таких як одна, дві, три, чотири, п'ять або більшее амінокислотних замін, доповнень або делецій; послідовність CDR1 легкого ланцюга, представлена SEQ ID NO: 22-27, може включати одну або більше консервативних модифікацій послідовності, таких, як одна, дві, три, чотири п'ять або більшее амінокислотних замін, доповнень або делецій; послідовність CDR2 важкого ланцюга, представлена в SEQ ID NO: 5-13, може включати одну або більше консервативних модифікацій послідовності, таких, як одна, дві, три, чотири п'ять або більше амінокислотних замін, доповнень або делецій; послідовність CDR2 легкого ланцюга, представлена в SEQ ID NO: 28-31, може включати одну або більше консервативних модифікацій послідовності, таких, як одна, дві, три, чотири п'ять або більше амінокислотних замін, доповнень або делецій; послідовність CDR3 важкого ланцюга, представлена в SEQ ID NO: 14-21, може включати одну або більше консервативних модифікацій послідовності, таких, як одна, дві, три, чотири п'ять або більше амінокислотних замін, доповнень або делецій; та/або послідовність CDR3 легкого ланцюга, представлена в SEQ ID NO: 32-34, може включати одну або більше консервативних модифікацій послідовності, таких, як одна, дві, три, чотири п'ять або більше амінокислотних замін, доповнень або делецій. Антитіла, які зв'язуються з тими самими епітопами, що й анти-кадгерин-17 антитіла відповідно до даного винаходу В іншому втіленні винахід забезпечує антитіла, які зв'язуються з тим самим епітопом на людському кадгерині-17, що й будь-які кадгерин-17 моноклональні антитіла відповідно до винаходу (тобто, антитіла, які мають здатність до перехресного конкурування за зв'язування з кадгерином-17 з будь-якими моноклональними антитілами відповідно до даного винаходу). У бажаних втіленнях референтне антитіло для досліджень перехресної конкуренції може являти собою моноклональне антитіло PTA001_A1 (яке має V H та VK послідовності, як показано у SEQ ID NO: 37 та 48, відповідно), моноклональне антитіло PTA001_A4 (яке має VH та VK послідовності, як показано у SEQ ID NO: 38 та 49, відповідно), моноклональне антитіло 20 UA 108201 C2 5 10 15 20 25 30 35 40 45 50 55 60 PTA001_A5 (яке має VH та VK послідовності, як показано у SEQ ID NO: 39 та 50, відповідно), моноклональне антитіло PTA001_A6 (яке має VH та VK послідовності, як показано у SEQ ID NO: 40 та 51, відповідно), моноклональне антитіло PTA001_A7 (яке має V H та VK послідовності, як показано у SEQ ID NO: 41 та 52, відповідно), моноклональне антитіло PTA001_A8 (яке має V H та VK послідовності, як показано у SEQ ID NO: 42 та 53, відповідно), моноклональне антитіло PTA001_A9 (яке має VH та VK послідовності, як показано у SEQ ID NO: 40 та 54, відповідно), моноклональне антитіло PTA001_A10 (яке має VH та VK послідовності, як показано у SEQ ID NO: 40 та 55, відповідно), моноклональне антитіло PTA001_A11 (яке має VH та VK послідовності, як показано у SEQ ID NO: 43 та 56, відповідно), моноклональне антитіло PTA001_A12 (яке має V H та VK послідовності, як показано у SEQ ID NO: 44 та 55, відповідно), моноклональне антитіло PTA001_A13 (яке має VH та VK послідовності, як показано у SEQ ID NO: 45 та 57, відповідно) або моноклональне антитіло PTA001_A14 (яке має VH та VK послідовності, як показано у SEQ ID NO: 46 та 58, відповідно). Така перехресна конкуренція антитіл може бути ідентифікована на основі їх здатності до перехресної конкуренції з PTA001_A1, PTA001_A2, PTA001_A3, PTA001_A4, PTA001_A5, PTA001_A6, PTA001_A7, PTA001_A8, PTA001_A9, PTA001_A10, PTA001_A11, PTA001_A12, PTA001_A13 або PTA001_A14 у стандартних аналізах зв'язування кадгерину-17. Наприклад, Biacore аналіз, ELISA аналізи або проточна цитометрія можуть використовуватися для демонстрації перехресного конкурування з антитілами відповідно до даного винаходу. Здатність досліджуваного антитіла інгібувати зв'язування, наприклад, PTA001_A1, PTA001_A2, PTA001_A3, PTA001_A4, PTA001_A5, PTA001_A6, PTA001_A7, PTA001_A8, PTA001_A9, PTA001_A10, PTA001_A11, PTA001_A12, PTA001_A13 або PTA001_A14, з людським кадгерином-17 демонструє, що досліджуване антитіло може конкурувати з PTA001_A1, PTA001_A2, PTA001_A3, PTA001_A4, PTA001_A5, PTA001_A6, PTA001_A7, PTA001_A8, PTA001_A9, PTA001_A10, PTA001_A11, PTA001_A12, PTA001_A13 або PTA001_A14 за зв'язування з людським кадгерином-17 і, таким чином, зв'язуватися з тим самим епітопом на людському кадгерині-17, що й PTA001_A1, PTA001_A2, PTA001_A3, PTA001_A4, PTA001_A5, PTA001_A6, PTA001_A7, PTA001_A8, PTA001_A9, PTA001_A10, PTA001_A11, PTA001_A12, PTA001_A13 або PTA001_A14. Сконструйовані та модифіковані антитіла Антитіло відповідно до винаходу додатково може бути отримане при використанні антитіла, яке має одну або більше із послідовностей VH та/або VL, розкритих у даній заявці, які можуть використовуватися як вихідний матеріал для конструювання модифікованого антитіла, де модифіковане антитіло може мати змінені властивості у порівнянні з вихідним антитілом. Антитіло може бути сконструйоване шляхом модифікації однієї або більше амінокислот у межах однієї або обох варіабельних ділянок (тобто, VH та/або VL), наприклад, у межах однієї або більше CDR ділянок та/або в межах однієї або більше каркасних ділянок. Додатково або альтернативно, антитіло може бути сконструйоване шляхом модифікації залишків у межах константного(их) ділянки(ділянок), наприклад, для зміни ефекторної(их) функції(ій) антитіла. У деяких втіленнях прищеплення CDR може використовуватися для конструювання варіабельних ділянок антитіла. Антитіла взаємодіють із цільовими антигенами, головним чином, за допомогою амінокислотних залишків, які є розміщеними у шести ділянках, що визначають комплементарність, важкого та легкого ланцюгів (CDR). Із цієї причини амінокислотні послідовності в межах CDR є більш різноманітними між індивідуальними антитілами, ніж послідовності за межами CDR. Оскільки CDR послідовності є відповідальними за більшість взаємодій антитіло-антиген, є можливим експресувати рекомбінантні антитіла, які маскують властивості специфічних існуючих у природі антитіл шляхом конструювання експресійних векторів, які включають CDR послідовності зі специфічного існуючого в природі антитіла, прищепленого на каркасні послідовності відмінного антитіла з відмінними властивостями (див., наприклад, Riechmann, L. та ін. (1998) Nature 332: 323-327; Jones, P. та ін. (1986) Nature 321: 522-525; Queen, C. та ін. (1989) Proc. Natl. Acad. See. U.S.A. 86: 10029-10033; патент США № 5,225,539, який відноситься до Winter, та патенти США №№ 5,530,101; 5,585,089; 5,693,762 та 6,180,370, які відносяться до Queen та ін.) Відповідно до цього інше втілення відповідно до винаходу відноситься до ізольованого моноклонального антитіла або його антигензв'язувальної частини, що включає варіабельну ділянку важкого ланцюга, що містить CDR1, CDR2 та CDR3 послідовності, які включають амінокислотні послідовності, вибрані із групи, яка складається з SEQ ID NO: 1-4, SEQ ID NO: 513 та SEQ ID NO: 14-21, відповідно, та варіабельну ділянку легкого ланцюга, яка включає CDR1, CDR2 та CDR3 послідовності, що містять амінокислотні послідовності, вибрані із групи, яка складається з SEQ ID NO: 22-27, SEQ ID NO: 28-31 та SEQ ID NO: 32-34, відповідно. Таким чином, такі антитіла включають послідовності CDR VH та VK моноклональних антитіл 21 UA 108201 C2 5 10 15 20 25 30 35 40 45 50 55 60 PTA001_A1, PTA001_A2, PTA001_A3, PTA001_A4, PTA001_A5, PTA001_A6, PTA001_A7, PTA001_A8, PTA001_A9, PTA001_A10, PTA001_A11, PTA001_A12, PTA001_A13 або PTA001_A14, а також можуть включати різні каркасні послідовності із цих антитіл. Такі каркасні послідовності можуть бути отримані із загальнодоступних ДНК баз даних, опублікованих посилань, які включають генні послідовності мишачого антитіла ембріонального типу. Наприклад, ДНК послідовності генів для варіабельної ділянки важкого та легкого ланцюгів людських антитіл ембріонального типу можуть бути знайдені в IMGT (International ImMunoGeneTics) базі даних мишачих послідовностей ембріонального типу (є доступними на Інтернет-сайті imgt.cines.fr/), а також у Кабат, E. A., та ін. (1991) Sequences of Proteins of Immunological Interest, п'яте видання, міністерство охорони здоров'я та соціального забезпечення США, NIH публікація № 91-3242; Tomlinson, I. M., та ін. (1992) "The Repertoire of Human Germline VH Sequences Reveals about Fifty Groups of VH Segments with Different Hypervariable Loops" J. Mol. Biol. 227: 776-798; та Cox, J. P. L. та ін. (1994) "A Directory of Human Germ-line VH Segments Reveals a Strong Bias in their Usage" Eur. J. Immunol. 24: 827-836; зміст кожного з яких є введеним у дану заявку тільки як посилання. Як інший приклад, ембріональні послідовності ДНК для мишачих генів варіабельної ділянки важкого та легкого ланцюга можуть бути знайдені в базі даних Genbank. Білкові послідовності антитіла порівнюють із компільованою базою даних білкових послідовностей при використанні одного зі способів дослідження подібності послідовностей, який має назву Gapped BLAST (Altschul та ін. (1997) Nucleic Acids Research 25: 3389-3402) та є добре відомим фахівцеві в даній області техніки. BLAST являє собою евристичний алгоритм, оскільки значуще вирівнювання між послідовністю антитіла та послідовністю бази даних, ймовірно, містить пари сегментів з високим балом (HSP) слів, що вирівнюються. Пари сегментів, бали яких не можуть бути поліпшені шляхом подовження або укорочування, називаються хітом. Таким чином, нуклеотидні послідовності, які мають походження від цієї бази даних, піддаються трансляції, а ділянка між та включаючи фрагмент від FR1 до FR3 каркасної ділянки зберігається. Послідовності бази даних мають середню довжину 98залишків. Подвійні послідовності, які точно збігаються по всій довжині білка, видаляються. BLAST пошук на білки при використанні програми blastp з параметрами за умовчанням, стандартними параметрами за винятком низької ефективності фільтра, який вимикається, та матриці заміщення BLOSUM62, фільтра для верхніх 5 хітів, забезпечують підгонку послідовності. Нуклеотидні послідовності зазнають трансляції в усіх шести рамках, та рамка, яка не містить стоп-кодонів у погодженому сегменті послідовності бази даних, вважається потенційним хітом. Це, у свою чергу, підтверджується при використанні BLAST програми tblastx, яка транслює послідовність антитіла у всіх шести рамках та порівнює ці трансляції з нуклеотидними послідовностями бази даних, динамічно трансльованими в усіх шести рамках. Ідентичність являє собою точний збіг амінокислот між послідовністю антитіла та білком бази даних по всій довжині послідовності. Позитиви (ідентичність + сумісні заміни) не є ідентичними, проте амінокислотні заміни формуються відповідно до BLOSUM62 матриксу захв. Якщо послідовність антитіла збігається із двома послідовностями бази даних з тією самою ідентичністю, то хіт із найбільшою кількістю позитивів буде передбачатися як хіт співпадаючої послідовності. Бажані каркасні послідовності для застосування в антитілі відповідно до винаходу являють собою такі, які є структурно подібними до каркасної послідовності, використовуваної відібраним антитілом відповідно до даного винаходу, наприклад, подібні до V H 7-39 каркасної послідовності, VH II гена H17 каркасної послідовності, VH II ділянки VH105 каркасної послідовності, VK 1-110 каркасної послідовності, VK 8-30 каркасної послідовності та/або VK 24140 каркасним послідовностям, використовуваними бажаними моноклональними антитілами відповідно до даного винаходу. VH CDR1, CDR2 та CDR3 послідовності, а також VK CDR1, CDR2 та CDR3 послідовності можуть бути прищеплені на каркасні ділянки, які мають ідентичну послідовність із такою, яка виявлена в гені імуноглобуліну ембріонального типу, з якогопоходить каркасна послідовність, або CDR послідовності можуть бути прищеплені на каркасні ділянки, які містять одну або більш мутацій у порівнянні з послідовністю ембріонального типу. Наприклад, було виявлено, що в деяких випадках є бажаним піддавати залишки мутаціям у межах каркасних ділянок для підтримки або поліпшення антигензв'язувальної здатності антитіла (див. наприклад, патенти США №№ 5,530,101; 5,585,089; 5,693,762 та 6,180,370, які відносяться до Queen та ін.). Інший тип модифікацій варіабельної ділянки полягає в мутації амінокислотних залишків у межах VH та/або VK CDR1, CDR2 та/або CDR3 ділянок для поліпшення, таким чином, одного або більше зв'язувальних властивостей (наприклад, афінності) антитіл, які представляють інтерес. 22 UA 108201 C2 5 10 15 20 25 30 35 40 45 50 55 60 Сайт-направлений мутагенез або опосередкований ПЛР мутагенез може бути проведений для введення мутації(ій) та впливу на зв'язувальні властивості антитіла або на іншу функціональну властивість, яка пердставляє інтерес, такий вплив можна оцінити в аналізах in vitro або in vivo, як описується в даній заявці та забезпечується у Прикладах. У деяких втіленнях вводять консервативні модифікації (як обговорюється вище). Альтернативно, можуть бути здійснені неконсервативні модифікації. Мутації можуть бути амінокислотними замінами, приєднаннями або делеціями, проте переважно являють собою заміни. Крім того, типово піддають змінам не більше однієї, двох, трьох, чотирьох або п'яти залишків у межах CDR ділянок, хоча, як буде зрозумілим фахівцеві в даній області техніки, варіантів в інших ділянках (наприклад, у каркасних ділянках) може бути більше. Відповідно до цього в іншому втіленні дане розкриття забезпечує ізольовані анти-кадгерин17 моноклональні антитіла або їх антигензв'язувальни частини, які включають варіабельну ділянку важкого ланцюга, що містить: (a) VH CDR1 ділянку, яка включає амінокислотну послідовність, вибрану із групи, яка складається з SEQ ID NO: 1-4, або амінокислотну послідовність, яка має одну, дві, три, чотири, п'ять або більше амінокислотних замін, делецій або приєднань у порівнянні з SEQ ID NO: 1-4; (b) VH CDR2 ділянку, яка включає амінокислотну послідовність, вибрану із групи, яка складається з SEQ ID NO: 5-13, або амінокислотної послідовності, яка має одну, дві, три, чотири, п'ять або більше амінокислотних замін, делецій або приєднань у порівнянні з SEQ ID NO: 5-13; (c) VH CDR3 ділянку, яка включає амінокислотну послідовність, вибрану із групи, яка складається з SEQ ID NO: 14-21, або амінокислотну послідовність, яка має одну, дві, три, чотири, п'ять або більше амінокислотних замін, делецій або приєднань у порівнянні з SEQ ID NO: 14-21; (d) VK CDR1 ділянка, яка включає амінокислотну послідовність, вибрану із групи, яка складається з SEQ ID NO: 22-27, або амінокислотну послідовність, яка має одну, дві, три, чотири, п'ять або більше амінокислотних замін, делецій або приєднань у порівнянні з SEQ ID NO: 22-27; (e) VK CDR2 ділянку, яка включає амінокислотну послідовність, вибрану із групи, яка складається з SEQ ID NO: 28-31, або амінокислотну послідовність, яка має одну, дві, три, чотири, п'ять або більше амінокислотних замін, делецій або приєднань у порівнянні з SEQ ID NO: 128-31; та (f) VK CDR3 ділянку, яка включає амінокислотну послідовність, вибрану із групи, яка складається з SEQ ID NO: 32-34, або амінокислотну послідовність, яка має одну, дві, три, чотири, п'ять або більше амінокислотних замін, делецій або приєднань у порівнянні з SEQ ID NO: 32-34. Сконструйовані антитіла відповідно до винаходу включають ті, в яких модифікації були внесені в каркасні залишки в межах VH та/або VK, наприклад, для поліпшення властивостей антитіла. Типово, такі каркасні модифікації здійснюють для зниження імуногенності антитіла. Наприклад, один підхід полягає у внесенні "зворотної мутації" одного або більше каркасних залишків у відповідну ембріональну послідовність. Зокрема, антитіло, яке було піддано соматичній мутації, може містити каркасні залишки, які відрізняються від ембріональної послідовності, з якої походить це антитіло. Такі залишки можуть бути ідентифіковані шляхом порівняння каркасної послідовності антитіла з ембріональною послідовністю, з якої походить це антитіло. Інший тип каркасної модифікації втягує мутацію одного або більше залишків у межах каркасної ділянки, або навіть у межах однієї або більше CDR ділянок, для видалення Tклітинних епітопів, що забезпечує, таким чином, зниження потенційної імуногенності антитіла. Цей підхід також називається "деімунізацією" та є описаним більш докладно в публікації патентної заявки США № 2003/0153043, яка відноситься до Carr та ін. Додатково або альтернативно до модифікацій, які здійснюють у межах каркасної ділянки або CDR ділянки, антитіла відповідно до винаходу можуть бути сконструйовані для включення модифікацій у межах Fc ділянки, типово для зміни однієї або більше функціональних властивостей антитіла, таких, як період напіввиведення із сироватки, фіксація комплементу, Fc рецепторне зв'язування та/або залежна від антигену клітинна токсичність. Крім того, антитіло відповідно до винаходу може бути хімічно модифікованим (наприклад, одна або більше хімічних груп можуть бути приєднані до антитіла) або модифікованим для зміни його глікозилювання, для зміни одного або більше функціональних властивостей антитіла. Кожне із цих втілень описується більш докладно нижче. Нумерація залишків у Fc ділянці є такою відповідно до EU індексу Кабат. В одному втіленні шарнірна ділянка CH1 зазнає модифікації так, що кількість залишків цистеїну в шарнірній ділянці змінюється, наприклад, збільшується або зменшується. Цей підхід є описаним додатково у патенті США № 5,677,425, який відноситься до Bodmer та ін. Кількість залишків цистеїну в шарнірній ділянці CH1 змінюється, наприклад, для поліпшення складання легкого та важкого ланцюгів або для збільшення або зменшення стабільності антитіла. 23 UA 108201 C2 5 10 15 20 25 30 35 40 45 50 55 60 В іншому втіленні Fc шарнірна ділянку антитіла піддають мутації для зменшення періоду біологічного напіввиведення антитіла. Зокрема, одну або більшу амінокислотних мутацій вводять в CH2-CH3 домен ділянки границі Fc-шарнірний фрагмент, так, що антитіло має порушене зв'язування стафілококового білка A (Spa) у порівнянні зі зв'язуванням Spa за допомогою нативного комплексу Fc-шарнірний домен. Цей підхід є описаним додатково в патенті США № 6,165,745, який відноситься до Ward та ін. В іншому втіленні антитіло модифікують для збільшення його біологічного періоду напіввиведення. Є можливими різні підходи. Наприклад, можуть бути введені одна або більше із наступних мутацій: T252L, T254S, T256F, як описується в патенті США № 6,277,375, що відноситься до Ward. Альтернативно, для збільшення біологічного періоду напіввиведення антитіло може змінюватися в межах CH1 або CL ділянки для того, щоб містити епітоп для зв'язування резервного рецептора, узятого із двох петель CH2 домену Fc ділянки IgG, як описується в патентах США №№ 5,869,046 та 6,121,022, які відносяться до Presta та ін. В іншому втіленні антитіло виробляєтьчя у вигляді унітіла, як описується в публікації WO2007/059782, яка є введеною в дану заявку як посилання у своїй цілісності. Ще в інших втіленнях Fc ділянку змінюють шляхом заміни принаймні одного амінокислотного залишку відмінним амінокислотним залишком для зміни ефекторної(их) функції(ій) антитіла. Наприклад, одна або більше амінокислот, вибраних з амінокислотних залишків 234, 235, 236, 237, 297, 318, 320 та 322, можуть бути замінені відмінним амінокислотним залишком, так, що антитіло має змінену афінність для ефекторного ліганда, проте зберігає здатність до зв'язування антигену вихідного антитіла. Ефекторний ліганд, відносного якого змінюється афінність, може являти собою, наприклад, Fc рецептор або C1 компонент комплементу. Цей підхід описується більш докладно в патентах США №№ 5,624,821 та 5,648,260, які обоє відносяться до Winter та ін. В іншому прикладі одна або більше амінокислот, вибраних з амінокислотних залишків 329, 331 та 322, можуть бути замінені відмінним амінокислотним залишком, так, що антитіло має змінене C1q зв'язування та/або знижену або усунуту залежну від комплементу цитотоксичність (CDC). Цей підхід описується більш докладно в патенті США №№ 6,194,551, який відноситься до Idusogie та ін. В іншому прикладі один або більше амінокислотних залишків у положеннях амінокислот 231 та 239 змінюють, щоб у такий спосіб змінити здатність антитіла до фіксації комплементу. Цей підхід є додатково описаним у публікації РСТ WO 94/29351, яка відноситься до Bodmer та ін. Ще в одному прикладі Fc ділянку піддають модифікації для підвищення здатності антитіла опосередковувати залежну від антитіла цитотоксичність (ADCC) та/або підвищувати афінність антитіла для Fcγ рецептора шляхом модифікації однієї або більше амінокислот у наступних положеннях: 238, 239, 248, 249, 252, 254, 255, 256, 258, 265, 267, 268, 269, 270, 272, 276, 278, 280, 283, 285, 286, 289, 290, 292, 293, 294, 295, 296, 298, 301, 303, 305, 307, 309, 312, 315, 320, 322, 324, 326, 327, 329, 330, 331, 333, 334, 335, 337, 338, 340, 360, 373, 376, 378, 382, 388, 389, 398, 414, 416, 419, 430, 434, 435, 437, 438 або 439. Цей підхід є додатково описаним у публікації РСТ WO 00/42072, яка відноситься до Presta. Крім того, зв'язування сайтів на людському IgG1 для FcγR1, FcγRII, FcγRIII та FcRn було картоване, та були описані варіанти з поліпшеним зв'язуванням (див. Shields, R.L. та ін. (2001) J. Biol. Chem. 276: 6591-6604). Специфічні мутації в положеннях 256, 290, 298, 333, 334 та 339 останнього були продемонстровані як такі, що поліпшують зв'язування з FcγRII. Крім того наступні комбінації мутантів були продемонстровані як такі, що поліпшують зв'язування з FcγRII: T256A/S298A, S298A/E333A, S298A/K224A та S298A/E333A/K334A. Крім того, ADCC варіанти описуються, наприклад, у WO2006/019447. Ще в одному прикладі Fc ділянку модифікують для підвищення періоду напіввиведення антитіла, звичайно шляхом підвищення зв'язування з FcRn рецептором, як описується, наприклад, у PCT/US2008/088053, US 7,371,826, US 7,670,600 та WO 97/34631. Ще в одному втіленні модифікують глікозилювання антитіла. Наприклад, може бути отримане аглікозильоване антитіло (тобто, антитіло, в якому відсутнє глікозилювання). Глікозилювання можна змінити, наприклад, для підвищення афінності антитіла для антигену. Такі вуглеводні модифікації можуть бути проведені за допомогою, наприклад, зміни одного або більше сайтів глікозилювання в межах послідовності антитіла. Наприклад, можуть бути проведена одна або більше амінокислотних замін, які приводять до усунення одного або більше сайтів глікозилювання каркаса варіабельної ділянки для того, щоб усунути, таким чином, глікозилювання в цьому сайті. Таке глікозилювання може підвищувати афінність антитіла для антигену. Цей підхід описується більш докладно в патентах США №№ 5,714,350 та 6,350,861, які відносяться до Co та ін., це може здійснюватися шляхом видалення аспарагіну в положенні 297. 24 UA 108201 C2 5 10 15 20 25 30 35 40 45 50 55 60 Додатково або альтернативно, антитіло може бути створене так, що має змінений тип глікозилювання, наприклад, гіпофукозильоване антитіло, яке містить зменшену кількість залишків фукозилу, або антитіло, яке має підвищену кількість бісекторних GlcNac структур. Це іноді називається в області техніки сконструйованою глікоформою. Такі моделі зміненого глікозилювання були продемонстровані для підвищення ADCC здатності антитіла. Такі вуглеводні модифікації можуть у загальному випадку здійснюватися двома шляхами, наприклад, у деяких втіленнях антитіло експресують у хазяйській клітині зі зміненим механізмом глікозилювання. Клітини зі зміненим механізмом глікозилювання були описані в області техніки та можуть використовуватися як хазяйські клітини, у яких експресують рекомбінантні антитіла відповідно до винаходу, за допомогою чого одержують антитіло зі зміненим глікозилюванням. Може бути зроблене посилання на POTELLIGENT® методику. Наприклад, клітинні лінії Ms704, Ms705 та Ms709 не мають гена фукозилтрансферази, FUT8 (альфа (1,6) фукозилтрансфераза), так, що антитіла, які експресуються в клітинних лініях Ms704, Ms705 та Ms709 не мають фукози -/на своїх вуглеводах. Клітинні лінії Ms704, Ms705 та Ms709 FUT8 були створені шляхом націленого руйнування FUT8 гена в CHO/DG44 клітинах при використанні двох векторів для заміщення (див. патентну публікацію США № 2004/0110704, яка відноситься до Yamane та ін., патент США № 7,517,670 та Yamane-Ohnuki та ін. (2004) Biotechnol Bioeng 87: 614-22). Як інший приклад, патент EP 1,176,195, який відноситься до Hanai та ін., описує клітинну лінію з функціонально порушеним геном FUT8, який кодує фукозилтрансферазу, так, що антитіла, які експресуються в такій клітинній лінії, демонструють гіпофукозилювання шляхом зменшення або усунення ферменту, пов'язаного з альфа 1, 6-зв'язком. Hanai та ін. також описує клітинні лінії, які мають низьку ферментативну активність для приєднання фукози до N-ацетилглюкозаміну, який зв'язується з Fc ділянкою антитіла, або не мають ферментативної активності, наприклад, лінію клітин меланоми пацюків YB2/0 (ATCC CRL 1662). Публікація РСТ WO 03/035835, яка відноситься до Presta, описує варіант клітинної лінії CHO, Lec13 клітини зі зниженою здатністю до приєднання фукози до пов'язаних з Asn(297) вуглеводів, що також приводить до гіпофукозилювання антитіла, яке експресується в хазяйській клітині (див. також Shields, R.L. та ін. (2002) J. Biol. Chem. 277: 26733-26740). Публікація РСТ WO 99/54342, яка відноситься до Umana та ін., описує лінії клітин, сконструйовані для експресії, що модифікують глікопротеїн глікозилтрансфераз (наприклад, бета(1,4)-N-ацетилглюкозамінілтрансфераза III (GnTIII)), таких, що антитіла, які експресуються в цих лініях клітин, демонструють підвищену кількість бісекторіальних GlcNac структур, що приводить до підвищеної ADCC активності антитіл (див. також Umana та ін. (1999) Nat. Biotech. 17: 176-180). Альтернативно, залишки фукози антитіл можуть бути відщиплені при використанні ферменту фукозидази. Наприклад, фукозидаза, така, як альфа-1-фукозидаза, видаляє залишки фукозилу з антитіл (Tarentino, A.L. та ін. (1975) Biochem. 14: 5516-23). Альтернативно, сконструйовані глікоформи, зокрема, афукозильовані, можуть бути одержані при використанні малих молекул інгібіторів ферментів шляхів глікозилювання. Дивися, наприклад, Rothman та ін., Mol. Immunol. 26(12):113-1123 (1989); Elbein, FASEB J. 5:3055 (1991); PCT/US2009/042610 та патент США № 7,700,321. Інша модифікація антитіл, яка передбачається даним винаходом, являє собою ПЕГилювання. Антитіло може бути ПЕГильованим, наприклад, для підвищення біологічного періоду напіввиведення (наприклад, із сироватки) антитіл. Для ПЕГилювання антитіл, антитіло або його фрагмент типово піддають реакції з поліетиленгліколем (ПЕГ), таким, як реактивний естер або альдегідна похідна ПЕГ, за умов, при яких одна або більш груп ПЕГ стають приєднаними до антитіла або фрагмента антитіла. Переважно, ПЕГилювання здійснюють за допомогою реакції ацилювання або реакції алкілування з реактивною молекулою ПЕГ (або аналогічним реактивним водорозчинним полімером). Як використовується в даній заявці, термін "поліетиленгліколь" є призначеним для того, щоб охоплювати будь-які форми ПЕГ, які використовуються для дериватизації інших білків, таких, як моно (C1-C10) алкокси- або арилокси-поліетиленгліколь або поліетиленгліколь малеїмід. У деяких втіленнях антитіло, яке зазнає ПЕГилювання, являє собою аглікозильоване антитіло. Способи ПЕГилювання білків є відомими в області техніки та можуть застосовуватися до антитіла відповідно до даного винаходу. Див. наприклад, патент EP 0154316, який відноситься до Nishimura та ін., та EP 0401384, який відноситься до Ishikawa та ін. У додаткових втіленнях, наприклад, при використанні антитіла відповідно до винаходу для цілей діагностики або визначення, антитіла можуть включати мітку. Під "міченим" у даній заявці розуміють те, що сполука містить принаймні один елемент, ізотоп або хімічну сполуку, приєднані для того, щоб дозволити здійснювати визначення сполуки. У загальному випадку мітки входять у три класи: a) ізотопні мітки, які можуть бути радіоактивними або важкими 25 UA 108201 C2 5 10 15 20 25 30 35 40 45 50 55 60 ізотопами; b) магнітними, електричними, термальними; та c) забарвлювальними або люмінісцентніми мітками; хоча мітки також включають ферменти та частинки, такі, як магнітні частинки. Кращі мітки включають, але без обмеження, флуоресцентні комплекси лантанідів (включаючи такі європію та тербію) та флуоресцентні мітки, включаючи, але без обмеження, квантові домішки, флуоресцеїн, родамін, тетраметилродамін, еозин, еритрозин, кумарин, метилкумарини, пірен, малахітовий зелений, стилбен, сатанинський жовтий, Cascade Blue, техаський червоний, барвники Alexa, Cy барвники, та інші, описані у 6-ому вид. Molecular Probes Handbook, Richard P. Haugland, дане джерело є введеною в дану заявку як посилання. Фізичні властивості антитіл Антитіла відповідно до даного винаходу можуть бути додатково охарактеризовані за допомогою різних фізичних властивостей анти-кадгерин-17 антитіла. Різні аналізи можуть використовуватися для визначення та/або диференціації різних класів антитіл на основі їх фізичних властивостей. У деяких втіленнях антитіла відповідно до даного винаходу можуть містити один або більш сайтів глікозилювання у варіабельній ділянці або легкого, або важкого ланцюга. Присутність одного або більше сайтів глікозилювання у варіабельній ділянці може приводити до підвищеної імуногенності антитіла або до зміни рК антитіла завдяки зміненому зв'язуванню антигену (Marshall та ін. (1972) Annu Rev Biochem 41: 673-702; Gala FA та Morrison SL (2004) J Immunol 172: 5489-94; Wallick та ін. (1988) J Exp Med 168: 1099-109; Spiro RG (2002) Glycobiology 12:43R56R; Parekh та ін. (1985) Nature 316: 452-7; Mimura та ін. (2000) Mol Immunol 37: 697-706). Глікозилювання є відомим як таке, яке відбувається в мотивах, що містять N-X-S/T послідовність. Глікозилювання варіабельної ділянки може піддаватися аналізу при використанні Glycoblot аналізу, який розщеплює антитіло з утворенням Fab, після чого здійснюють аналізи на глікозилювання при використанні аналізу, який вимірює окиснення перйодату та утворення основи Шиффа. Альтернативно, глікозилювання варіабельної ділянки може піддаватися аналізу при використанні Dionex світлової хроматографії (Dionex-lc) при розщепленні сахаридів з Fab до моносахаридів, а також аналізу вмісту індивідуальних сахаридів. У деяких випадках є бажаним мати анти-кадгерин-17 антитіло, яке не має глікозилювання варіабельної ділянки. Цього можна досягти або за допомогою селекції антитіла, яке не містить мотиву глікозилювання у варіабельній ділянці, або шляхом мутації залишків у межах мотиву глікозилювання при використанні стандартних методик, добре відомих в області техніки. У бажаному втіленні антитіла відповідно до даного винаходу не містять сайтів ізомерії аспарагіну. Дезамінування або ефект аспарагінової кислоти може виникати на N-G або D-G послідовності, відповідно. Дезамінування або ефект аспарагінової кислоти приводять до утворення ізоаспарагінової кислоти, яка знижує стабільність антитіла шляхом утворення вигнутої структури за межами бічного ланцюга карбокситермінального кінця переважніше, ніж в основному ланцюзі. Утворення ізоаспарагінової кислоти може бути вимірюване при використанні ізоквантового аналізу, який використовує ВЕРХ зі зворотною фазою для аналізу на аспарагінову кислоту. Кожне антитіло буде мати унікальну ізоелектричну точку (pІ), однак у загальному випадку рІ антитіл будуть попадати в інтервал pН від 6 до 9,5. pІ для IgG1 антитіл типово лежить в інтервалі pН 7-9,5 а pІ для IgG4 антитіла типово лежить в інтервалі pН 6-8. Антитіла можуть мати значення pІ, яке виходить за межі цього інтервалу. Незважаючи на те, що ці ефекти в загальному випадку є невідомими, існує гіпотеза, що антитіла зі значенням pІ за межами нормального інтервалу, можуть піддаватися розкручуванню структури та бути нестабільними в умовах in vivo. Ізоелектричні точки можуть піддаватися аналізу при використанні аналізу капілярного ізоелектричного фокусування, який створює градієнт pН та може використовувати лазерне фокусування для підвищеної точності (Janini та ін. (2002) Electrophoresis 23: 1605-11; Ma та ін. (2001) Chromatographia 53: S75-89; Hunt та ін. (1998) J Chromatogr A 800: 355-67). У деяких випадках є бажаним мати анти-кадгерин-17 антитіло, яке має pІ значення, яке входить у нормальний інтервал. Цього можна досягти або шляхом селекції антитіла з pІ у нормальному інтервалі, або шляхом мутації заряджених поверхневих залишків при використанні стандартних методик, добре відомих в області техніки. Кожне антитіло буде мати температуру плавлення, яка є показовою для його термостабільності (Krishnamurthy R та Manning MC (2002) Curr Pharm Biotechnol 3: 361-71). Більш висока термостабільність свідчить про більшу високу загальну стабільність антитіла in vivo. Точка плавлення антитіла може вимірюватися при використанні методик, таких, як диференціальна сканувальна калориметрія (Chen та ін. (2003) Pharm Res 20: 1952-60; Ghirlando та ін. (1999) Immunol Lett 68: 47-52). TM1 показує температуру початкового розкручування антитіла. TM2 показує температуру повного розкручування антитіла. У загальному випадку є 26 UA 108201 C2 5 10 15 20 25 30 35 40 45 50 55 бажаним, щоб TM1 антитіла відповідно до даного винаходу було більше 60°C, переважно більше 65°C, навіть більш бажано більше 70°C. Альтернативно, термостабільність антитіла може вимірятися при використанні циркулярного дихроїзму (Murray та ін. (2002) J. Chromatogr Sci 40: 343-9). У бажаному втіленні відбирають антитіла, які не деградують швидко. Фрагментація антикадгерин-17 антитіла може вимірюватися при використанні капілярного електрофорезу (CE) та MALDI-MS, як є добре зрозумілим у даній області техніки (Alexander AJ та Hughes DE (1995) Anal Chem 67: 3626-32). В іншому бажаному втіленні відбирають антитіла, які мають мінімальні ефекти агрегації. Агрегація може приводити до стимуляції небажаної імунної відповіді та/або до змінених або несприятливих фармакокінетичних характеристик. У загальному випадку є прийнятними антитіла з агрегацією, яка становить 25 % або менше, переважно 20 % або менше, навіть більш бажано 15 % або менше, навіть більш бажано 10 % або менше та навіть більш бажано 5 % або менше. Агрегація може вимірюватися за допомогою декількох методик, які є добре відомими в області техніки, включаючи гель-фільтраційну колонку (SEC), високоефективну рідинну хроматографію (ВЕРХ), та розсіювання світла для ідентифікації мономерів, димерів, тримерів або мультимерів. Способи конструювання антитіл Як обговорювалося вище, анти-кадгерин-17 антитіла, які мають VH та VK послідовності, розкриті в даній заявці, можуть використовуватися для створення нових анти-кадгерин-17 антитіл шляхом модифікації VH та/або VK послідовності, або константного(их) ділянки(ділянок), які приєднуються до них. Таким чином, в іншому аспекті винаходу структурні ознаки антикадгерин-17 антитіла відповідно до даного винаходу, наприклад, PTA001_A1, PTA001_A2, PTA001_A3, PTA001_A4, PTA001_A5, PTA001_A6, PTA001_A7, PTA001_A8, PTA001_A9, PTA001_A10, PTA001_A11, PTA001_A12, PTA001_A13 або PTA001_A14, використовуються для створення структурно родинних анти-кадгерин-17 антитіл, які зберігають принаймні одну функціональну властивість антитіла відповідно до даного винаходу, таку, як зв'язування з людським кадгерином-17. Наприклад, одна або більше CDR ділянок PTA001_A1, PTA001_A2, PTA001_A3, PTA001_A4, PTA001_A5, PTA001_A6, PTA001_A7, PTA001_A8, PTA001_A9, PTA001_A10, PTA001_A11, PTA001_A12, PTA001_A13 або PTA001_A14, або їх мутантні форми можуть поєднуватися рекомбінантно з відомими каркасними ділянками та/або іншими CDR для створення додаткових, рекомбінантно сконструйованих анти-кадгерин-17 антитіл відповідно до даного винаходу, як обговорюється вище. Інші типи модифікацій включають ті, які описані в попередньому розділі. Вихідний матеріал для способу конструювання являє собою одну або більше VH та/або VK послідовностей, які забезпечуються в даній заявці, або одну або більше їх CDR ділянок. Для одержання сконструйованого антитіла не є необхідним фактично одержувати (тобто, експресувати білок) антитіло, яке має одну або більше VH та/або VK послідовностей, які забезпечуються в даній заявці, або одну або більше їх CDR ділянок. Замість цього, інформація, яка міститься у цій(цих) послідовності(ях), використовується як вихідний матеріал для створення "другого покоління" послідовності(ей), яка(і) має(ють) походження від оригінальної(их) послідовності(ей), а потім послідовність(послідовності) "другого покоління" одержують та експресують як білок. Відповідно до цього в іншому втіленні винахід забезпечує спосіб одержання анти-кадгерин17 антитіла, який включає: забезпечення: (i) послідовності варіабельної ділянки важкого ланцюга антитіла, що включає CDR1 послідовність, вибрану із групи, яка складається з SEQ ID NO:1-4, CDR2 послідовність, вибрану із групи, яка складається з SEQ ID NO:5-13, та/або CDR3 послідовність, вибрану із групи, яка складається з SEQ ID NO: 14-21; та/або (ii) послідовності варіабельної ділянки легкого ланцюга антитіла, який включає CDR1 послідовність, вибрану із групи, яка складається з SEQ ID NO: 22-27, CDR2 послідовність, вибрану із групи, яка складається з SEQ ID NO: 28-31, та/або CDR3 послідовність, вибрану із групи, яка складається з SEQ ID NO: 32-34; зміну принаймні одного амінокислотного залишку в межах послідовності варіабельної ділянки важкого ланцюга антитіла та/або послідовності варіабельної ділянки легкого ланцюга антитіла для створення принаймні однієї зміненої послідовності антитіла; та експресію зміненої послідовності антитіла як білка. Стандартні методики молекулярної біології можуть використовуватися для одержання та експресії зміненої послідовності антитіла. Бажано, коли антитіло, яке кодується зміненою(ими) послідовністю(послідовностями) антитіла, є таким, яке зберігає одну, кілька або всі функціональні властивості анти-кадгерин-17 27 UA 108201 C2 5 10 15 20 25 30 35 40 45 50 55 60 антитіла, описаного в даній заявці, де функціональні властивості включають, але без обмеження: -7 зв'язування з людським кадгерином-17 зі значенням KD 1 × 10 M або менше; зв'язування з людськими клітинами CHO, трансфікованими за допомогою кадгерину-17. Функціональні властивості зміненого антитіла можуть оцінюватися при використанні стандартних аналізів, доступних у даній області техніки та/або описаних у даній заявці, таких, як ті, що представлені в Прикладах (наприклад, проточна цитометрія, аналізи зв'язування). У деяких втіленнях способів конструювання антитіл відповідно до даного винаходу мутації можуть бути введені випадково або селективно у всю або у частину послідовності, що кодує, анти-кадгерин-17 антитіла, а отримане модифіковане анти-кадгерин-17 антитіло може піддаватися скринінгу на зв'язувальну активність та/або інші функціональні властивості так, як описується в даній заявці. Мутаційні способи були описані в області техніки. Наприклад, публікація РСТ WO 02/092780, яка відноситься до Short, описує способи створення та скринінгу мутацій антитіла при використанні насичувального мутагенезу, об'єднання за допомогою штучного лігування або їх комбінації. Альтернативно, публікація РСТ WO 03/074679, яка відноситься до Lazar та ін., описує способи при використанні методів комп'ютерного скринінгу для оптимізації фізико-хімічних властивостей антитіла. Молекули нуклеїнової кислоти, які кодують антитіла відповідно до даного винаходу Інший аспект відповідно до винаходу відноситься до молекули нуклеїнової кислоти, яка кодує антитіла відповідно до даного винаходу. Нуклеїнові кислоти можуть бути присутніми в цільних клітинах, у лізаті клітин або в частково очищеній або суттєво чистій формі. Нуклеїнова кислота є "ізольованої" або "є суттєво чистою", коли очищається від інших клітинних компонентів або інших забруднюючих речовин, наприклад, інших клітинних нуклеїнових кислот або білків, за допомогою стандартних методик, включаючи лужну/SDS обробку, нашаровування CsСl, колонкову хроматографію, електрофорез в агарозному гелі та інші методи, які є добре відомими в області техніки. Див., F. Ausubel, та ін., ред. (1987) Current Protocols in Molecular Biology, Greene Publishing та Wiley Interscience, New York. Нуклеїнова кислота відповідно до винаходу може являти собою, наприклад, ДНК або РНК та може містити або може не містити інтронні послідовності. У бажаному втіленні нуклеїнова кислота являє собою молекулу кднк. Нуклеїнові кислоти відповідно до винаходу можуть бути отримані при використанні стандартних методик молекулярної біології. Для антитіл, які експресуються гібридомами, кДНК, які кодують легкий та важкий ланцюги антитіла, отримані при використанні гібридоми, можуть бути отримані за допомогою стандартної ПЛР ампліфікації або методик клонування кДНК. Для антитіл, отриманих з генної бібліотеки імуноглобуліну (наприклад, при використанні методики фагового дисплея), нуклеїнові кислоти, які кодують антитіло, можуть бути одержані з такої бібліотеки. Бажані молекули нуклеїнової кислоти відповідно до винаходу є такими, які кодують V H та VL послідовності PTA001_A1, PTA001_A2, PTA001_A3, PTA001_A4, PTA001_A5, PTA001_A6, PTA001_A7, PTA001_A8, PTA001_A9, PTA001_A10, PTA001_A11, PTA001_A12, PTA001_A13 або PTA001_A14 моноклонального антитіла. ДНК послідовності, які кодують V H послідовності PTA001_A1, PTA001_A2, PTA001_A3, PTA001_A4, PTA001_A5, PTA001_A6, PTA001_A7, PTA001_A8, PTA001_A9, PTA001_A10, PTA001_A11, PTA001_A12, PTA001_A13 або PTA001_A14, є представленими в SEQ ID NO: 59-70, відповідно. ДНК послідовності, які кодують VK послідовності PTA021_A1, PTA021_A2 та PTA021_A3, є представленими в SEQ ID NO: 71-83, відповідно. Інші бажані нуклеїнові кислоти відповідно до винаходу являють собою нуклеїнові кислоти, які мають принаймні 80 % ідентичності послідовності, такі, як ті, що мають принаймні 85 % принаймні 90 % принаймні 95 % принаймні 98 % або принаймні 99 % ідентичності послідовності, з однієї з послідовностей, представлених у SEQ ID NO: 59-83, нуклеїнові кислоти яких кодують антитіло відповідно до даного винаходу або його антигензв'язувальну частину. Відсоток ідентичності між двома послідовностями нуклеїнової кислоти являє собою кількість положень у послідовності, в яких нуклеотиди є ідентичними, беручи до уваги кількість пробілів та довжину кожного пробілу, який необхідно ввести для оптимального вирівнювання двох послідовностей. Порівняння послідовностей та визначення відсотка ідентичності між двома послідовностями може бути проведене при використанні математичного алгоритму, такого, як алгоритм Meyers та Miller або програма XBLAST від Altschul, яка описана вище. Крім того, бажані нуклеїнові кислоти відповідно до винаходу включають одну або більше частин послідовностей нуклеїнової кислоти, які кодують CDR, представлені в SEQ ID NO: 59-83. У цих втіленнях нуклеїнова кислота може кодувати послідовність CDR1, CDR2 та/або CDR3 важкого ланцюга PTA001_A1, PTA001_A2, PTA001_A3, PTA001_A4, PTA001_A5, PTA001_A6, 28
ДивитисяДодаткова інформація
Назва патенту англійськоюAntibodies specific to cadherin-17
Автори англійськоюRohlff, Christian, Terret, Jonathan, Alexander
Автори російськоюРольфф Кристиан, Террет Джоанатан Александр
МПК / Мітки
МПК: C07K 16/28, A61P 35/00, A61K 39/395
Мітки: специфічні, кадгерину-17, антитіла
Код посилання
<a href="https://ua.patents.su/187-108201-antitila-specifichni-dlya-kadgerinu-17.html" target="_blank" rel="follow" title="База патентів України">Антитіла, специфічні для кадгерину-17</a>
Попередній патент: Лікарські форми та способи застосування ектопаразитоцидів
Наступний патент: Різцевий пристрій для струга і струг для стругових пристроїв
Випадковий патент: Спосіб ізоляції обмотки статора або ротора електричної машини