Фармацевтична композиція ібупрофену для ін’єкції
Номер патенту: 103290
Опубліковано: 25.09.2013
Формула / Реферат
1. Фармацевтична композиція ібупрофену для ін'єкції, що містить водний розчин ібупрофену і трометамол, в якій концентрація ібупрофену складає від 2 до 6 мг/мл, концентрація трометамолу складає від 1,8 до 5,8 мг/мл і значення рН яких складає від 7,0 до 9,5.
2. Фармацевтична композиція ібупрофену для ін'єкції за п. 1, в якій концентрація ібупрофену становить приблизно 4 мг/мл.
3. Фармацевтична композиція за п. 1 або 2, в якій концентрація трометамолу становить приблизно 3,8 мг/мл.
4. Фармацевтична композиція за будь-яким з попередніх пунктів 1-3, яка є такою, що стерилізується нагріванням шляхом автоклавування при температурі від 110 C до 130 C протягом періоду часу від 2 до 190 хвилин.
5. Фармацевтична композиція за п. 4, де композиція є такою, що стерилізується нагріванням шляхом автоклавування при температурі 121 °C протягом 15 хвилин.
6. Фармацевтична композиція ібупрофену для ін'єкції за будь-яким з попередніх пунктів 1-5, де ця композиція знаходиться в контейнерах зі скла і має значення рН від 7,0 до 9,5.
7. Фармацевтична композиція ібупрофену для ін'єкції за будь-яким з попередніх пунктів 1-5, де ця композиція знаходиться в контейнерах з поліетилену і має значення рН від 7,0 до 9,0.
8. Фармацевтична композиція ібупрофену для ін'єкції за будь-яким з попередніх пунктів 1-5, де ця композиція знаходиться в контейнерах з поліпропілену і має значення рН від 7,5 до 9,0.
9. Фармацевтична композиція ібупрофену для ін'єкції за будь-яким з попередніх пунктів 1-5, де ця композиція знаходиться в контейнерах з ПВХ і має значення рН від 8,0 до 9,0.
10. Фармацевтична композиція за будь-яким з попередніх пунктів, яка має значення рН приблизно 8,5.
11. Фармацевтична композиція за будь-яким з попередніх пунктів, що додатково містить сіль в кількості, необхідній для надання композиції осмоляльності, що дорівнює приблизно 300 мОсм/кг.
12. Фармацевтична композиція за п. 11, в якій сіль являє собою NaCl в концентрації приблизно 7,7 мг/мл.
13. Композиція за будь-яким з пунктів 1-12 для застосування для лікування болю, запалення або жару.
14. Композиція за п. 13, яка розфасована в контейнери ємністю 100 мл або 200 мл.
15. Застосування фармацевтичної композиції за будь-яким з пунктів 1-12 у виробництві лікарського препарату для лікування болю, запалення або жару.
Текст
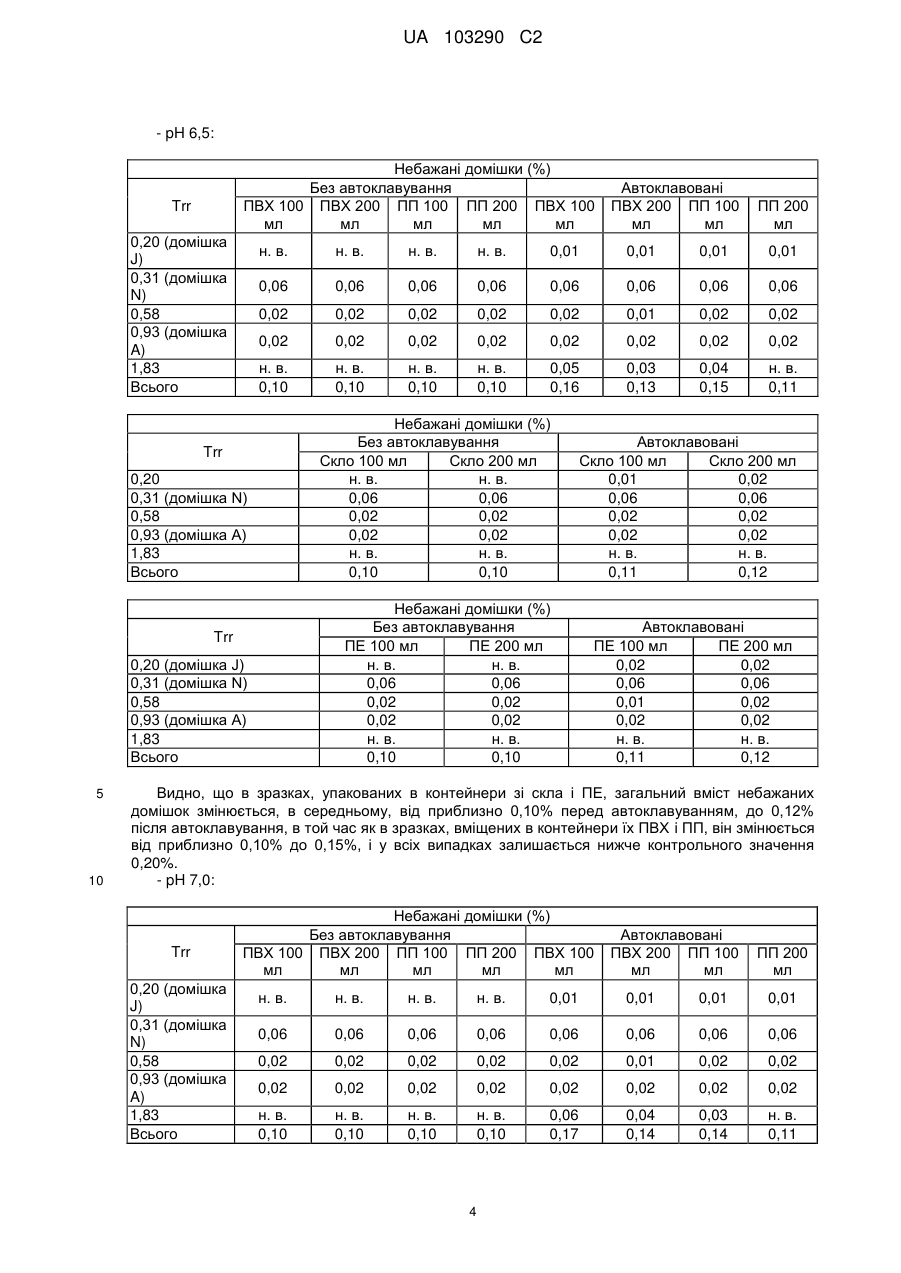
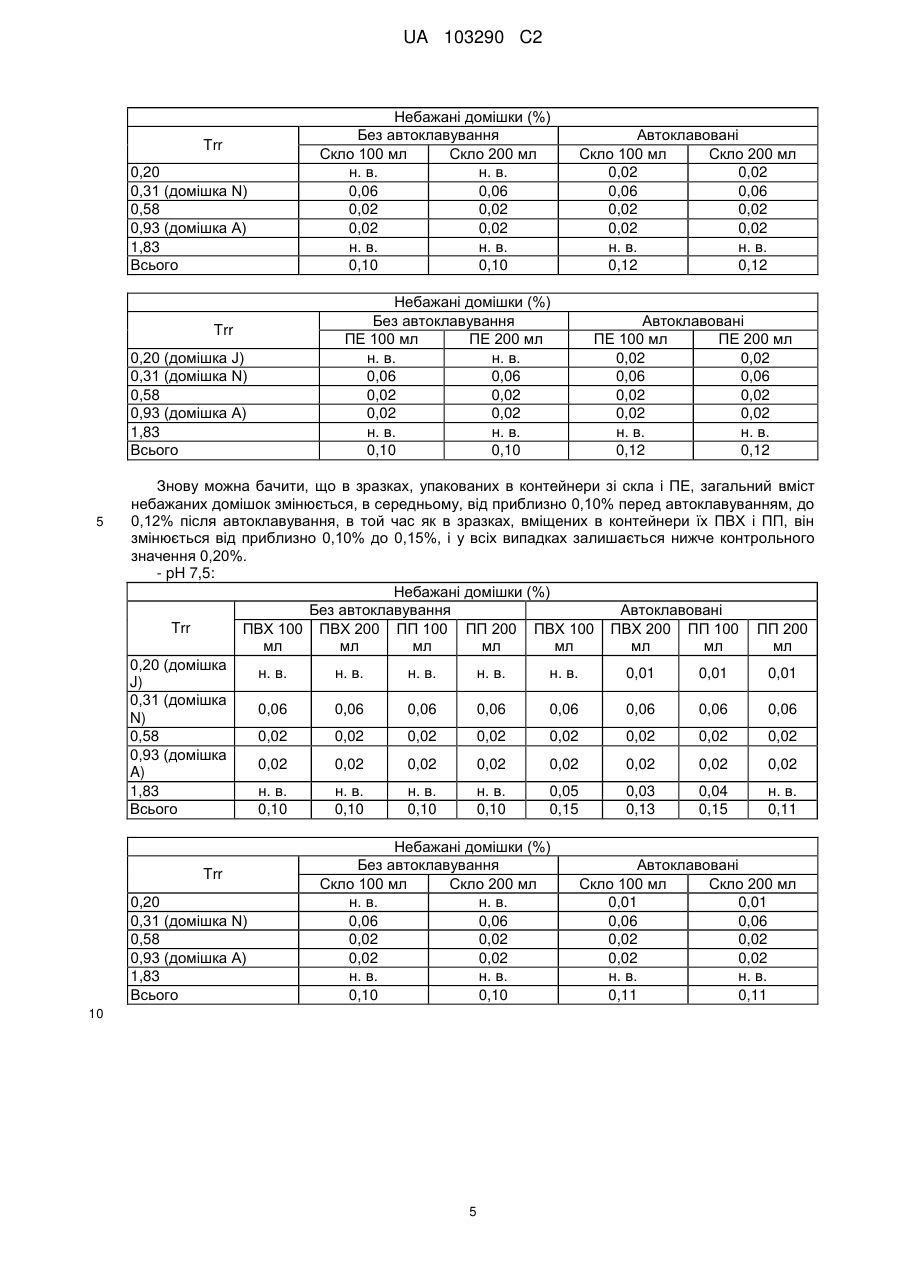
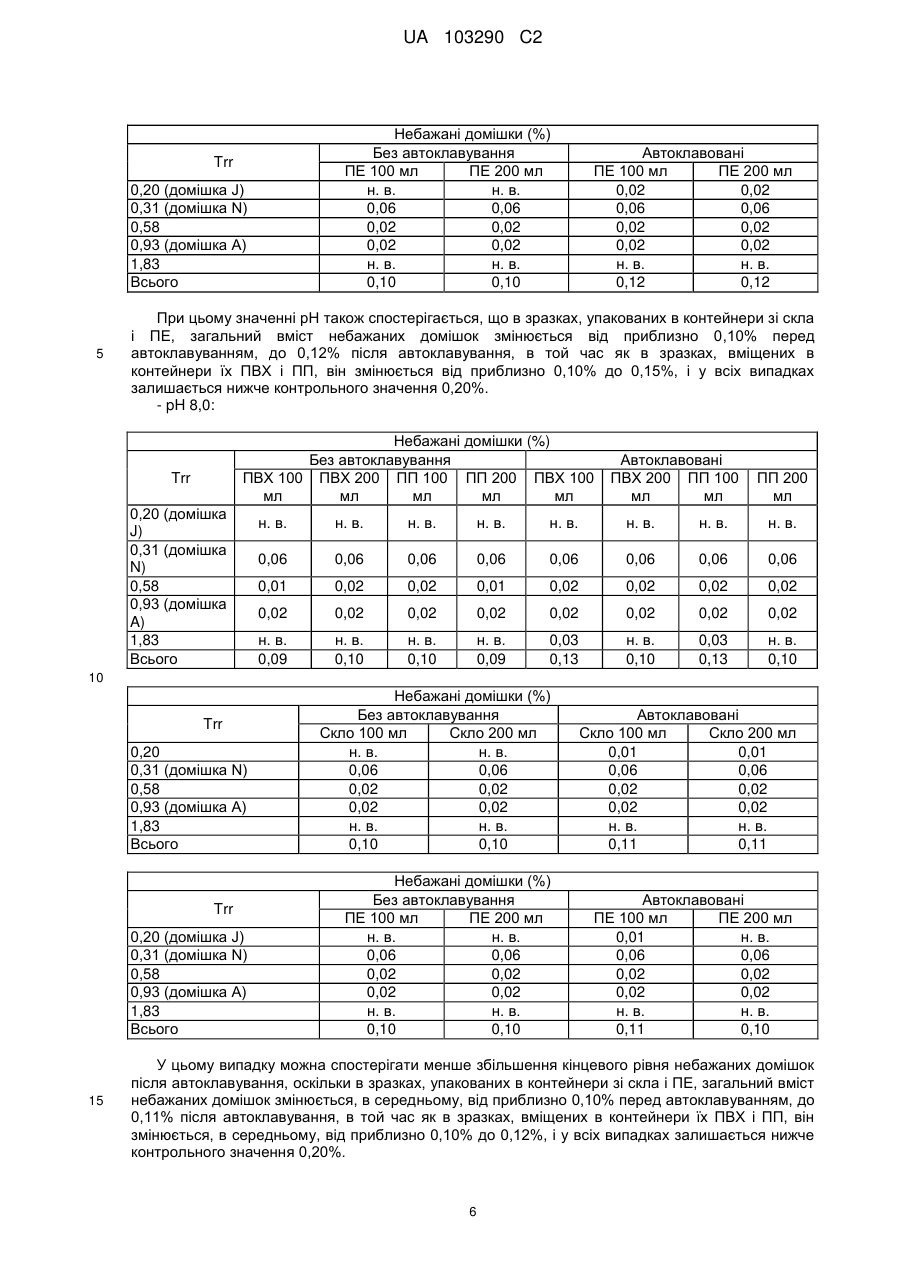
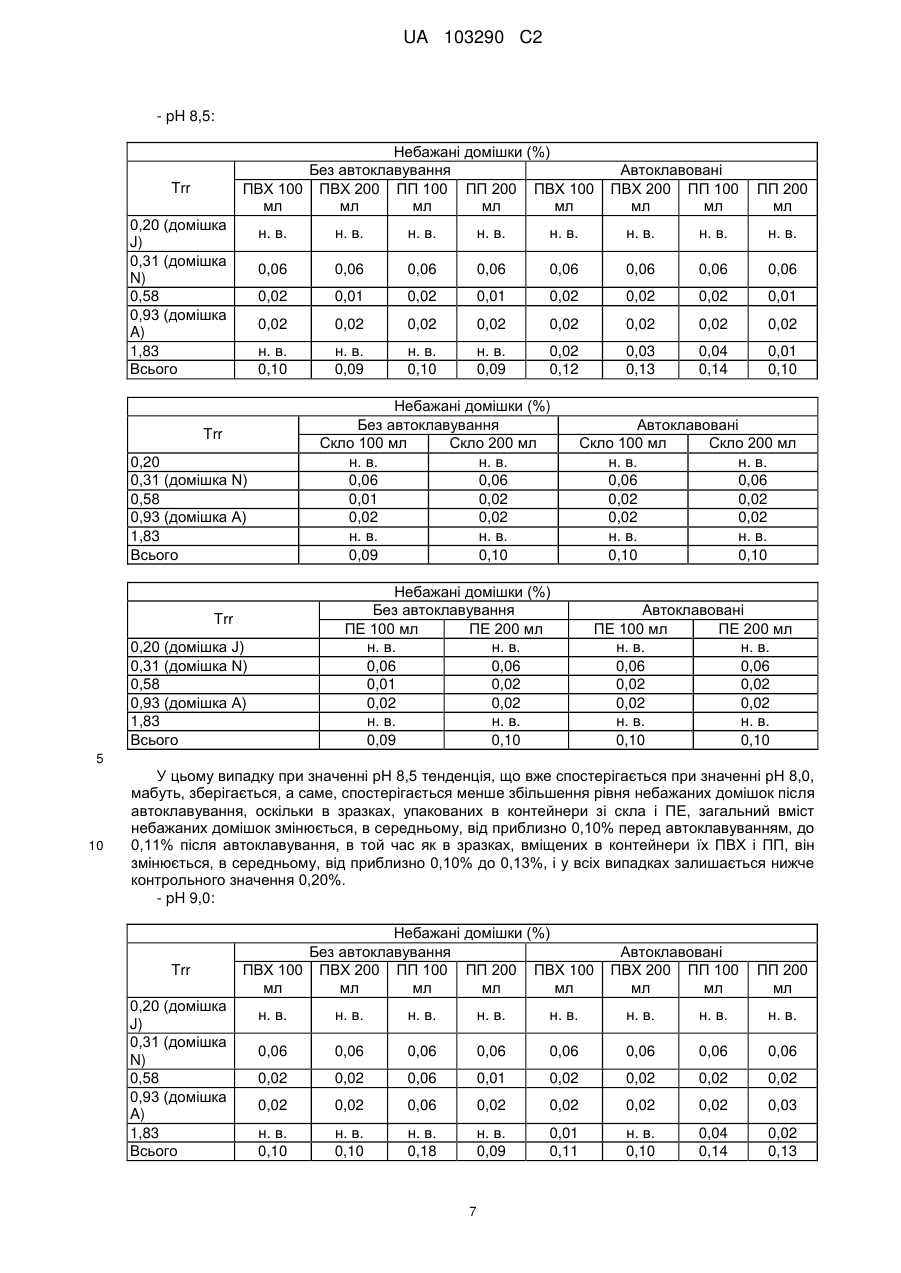
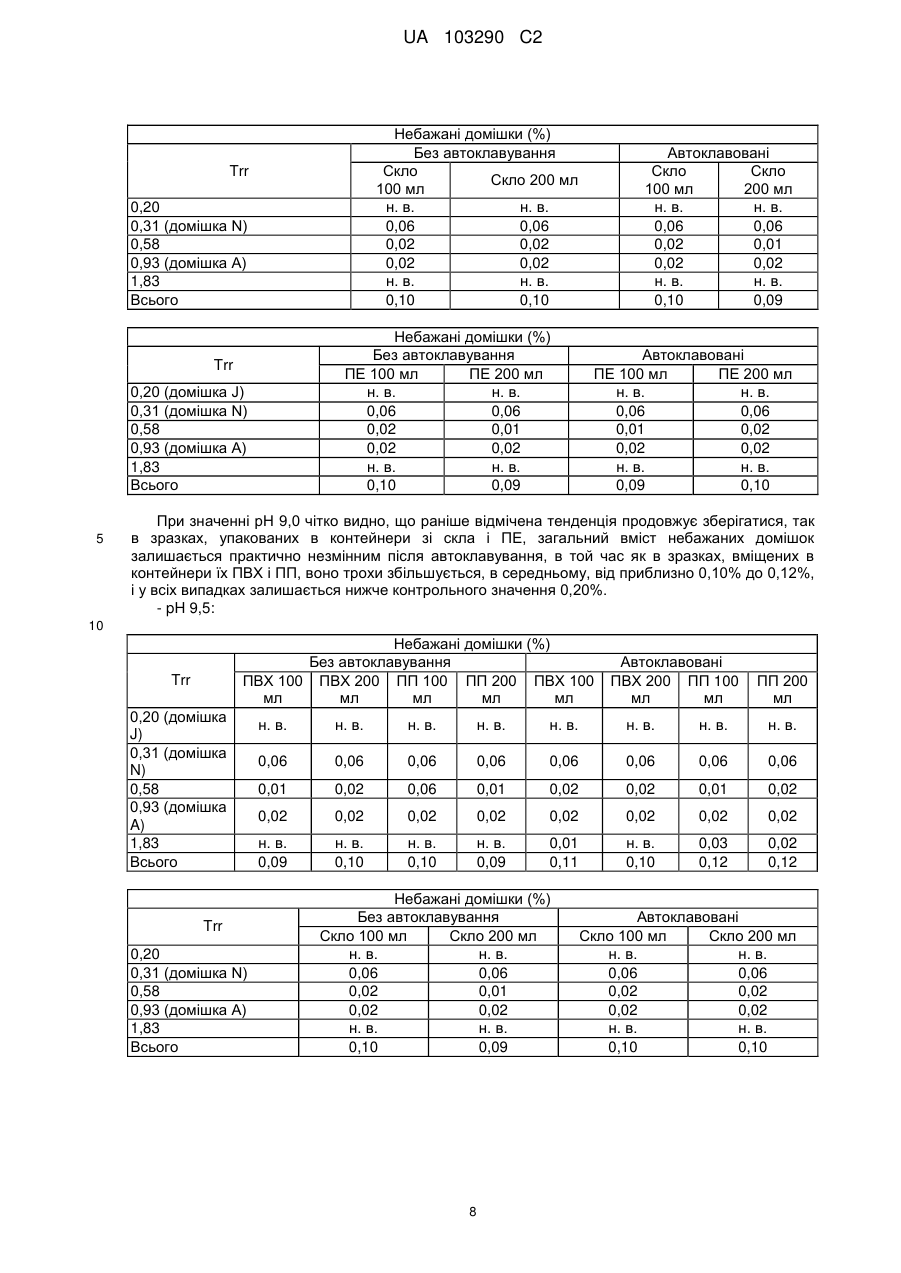
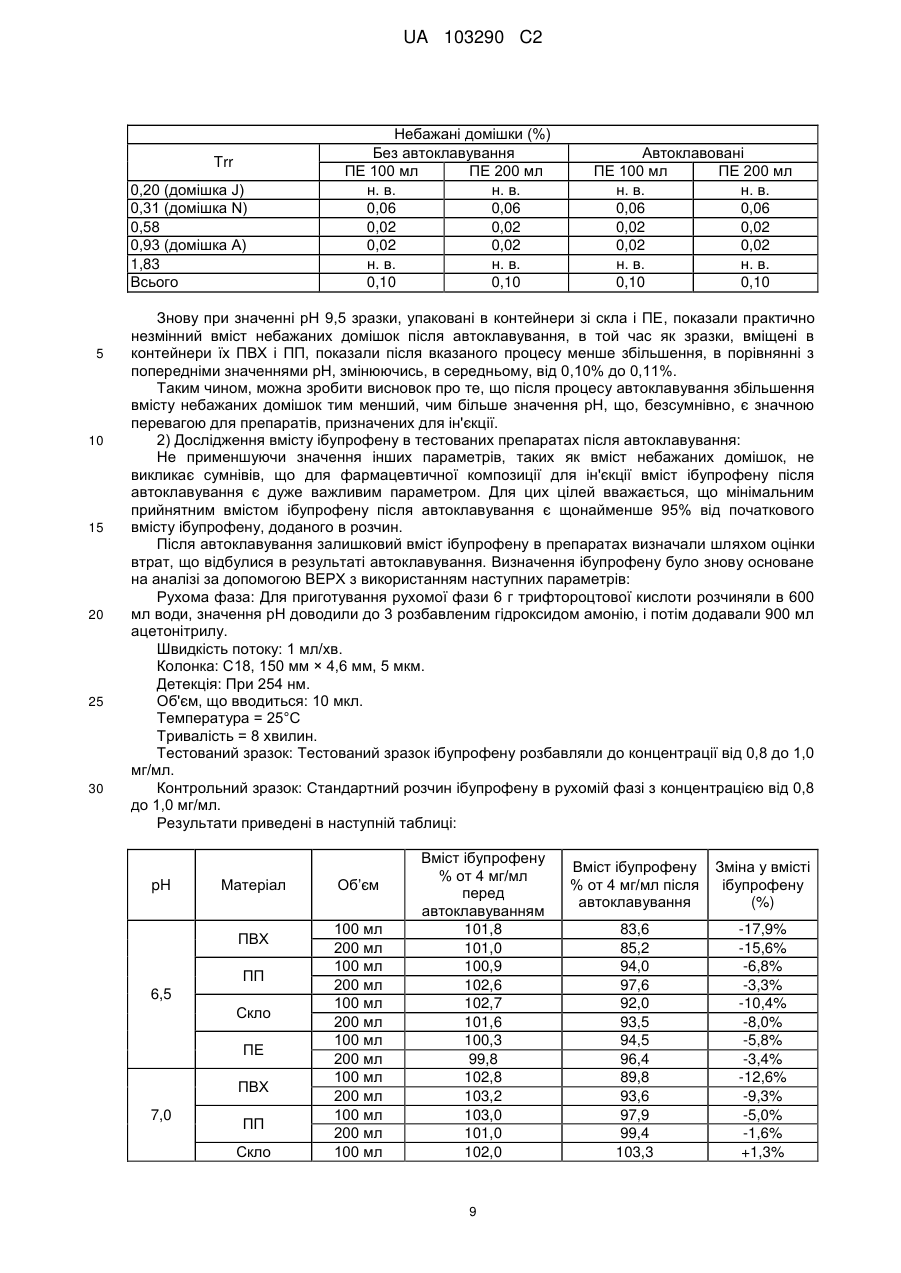
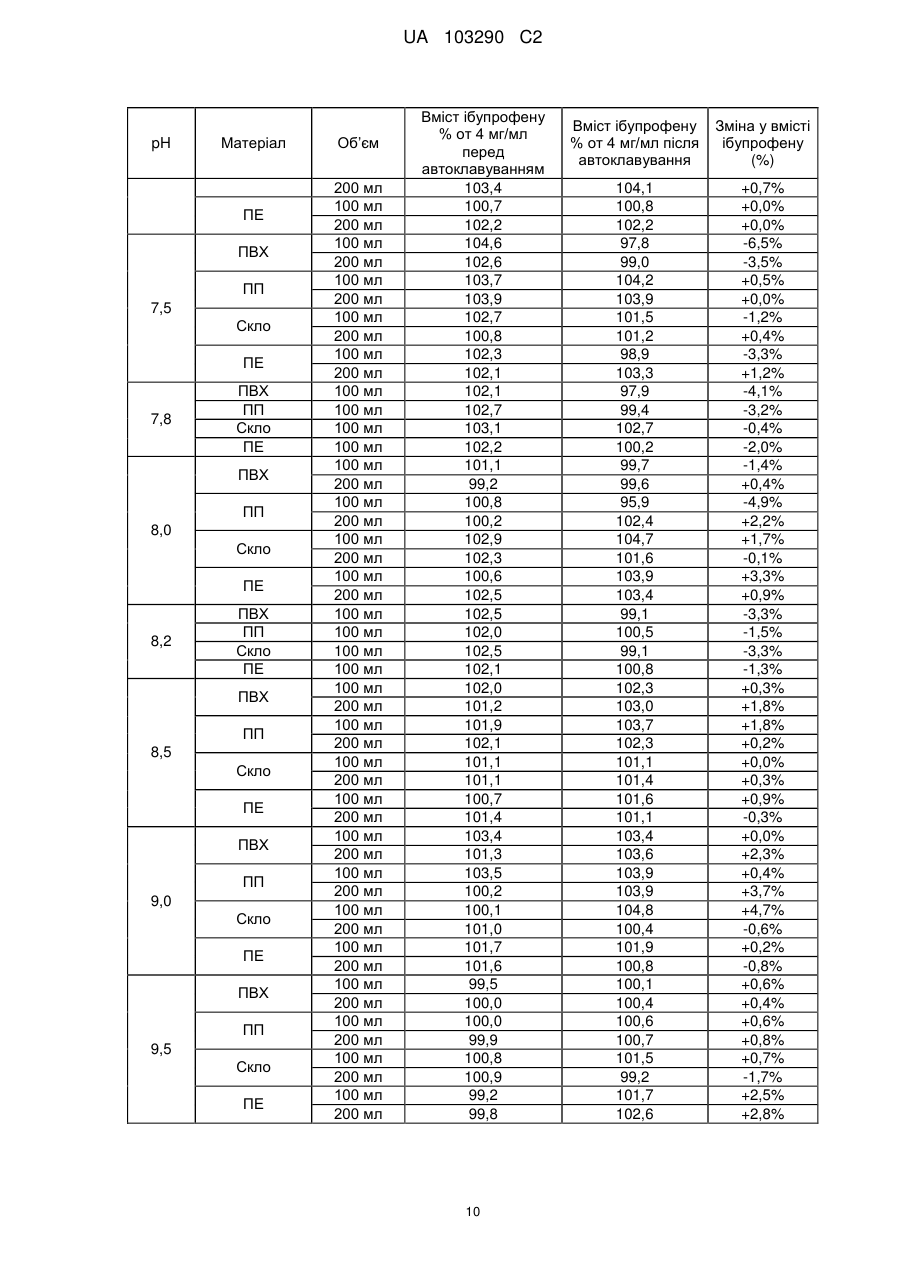
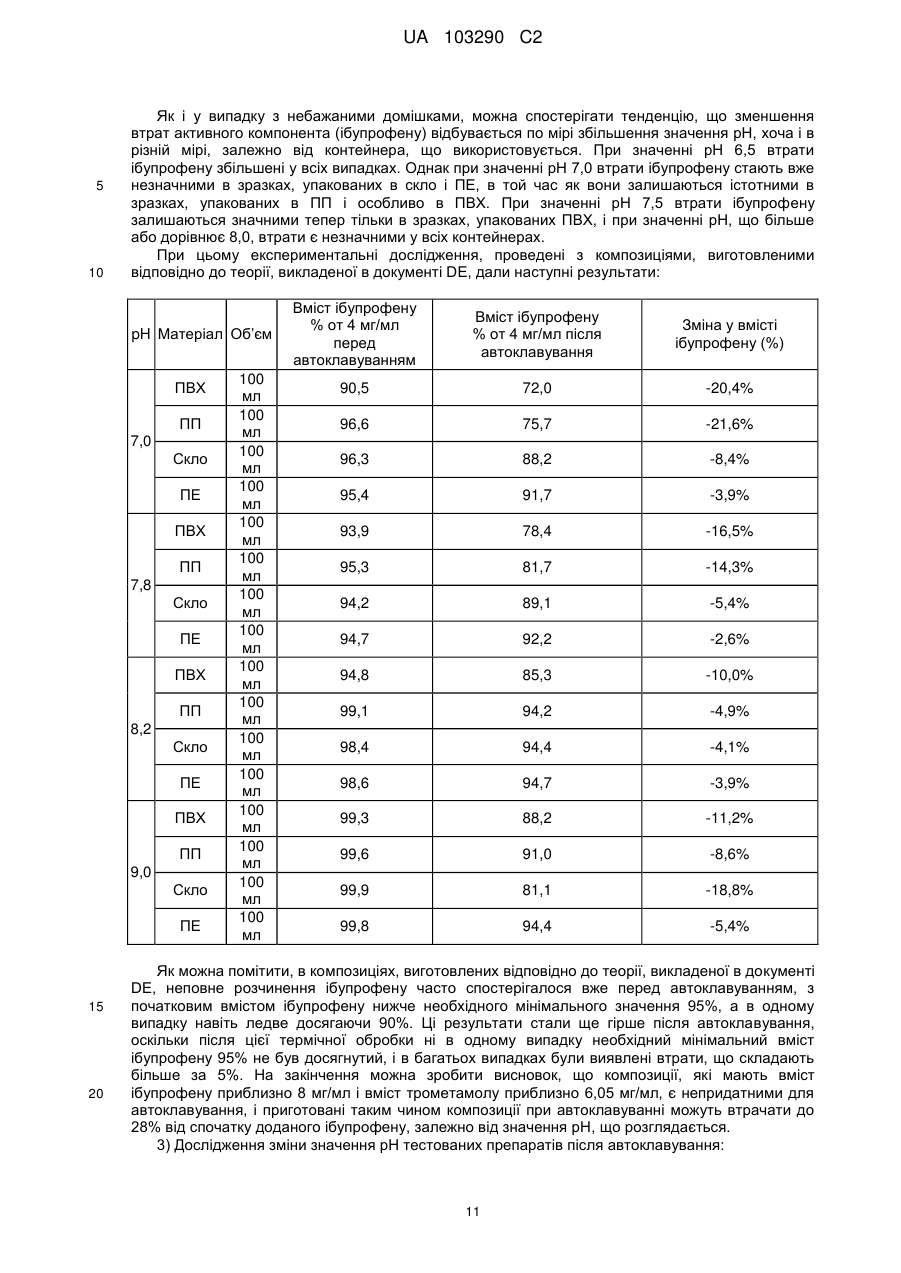
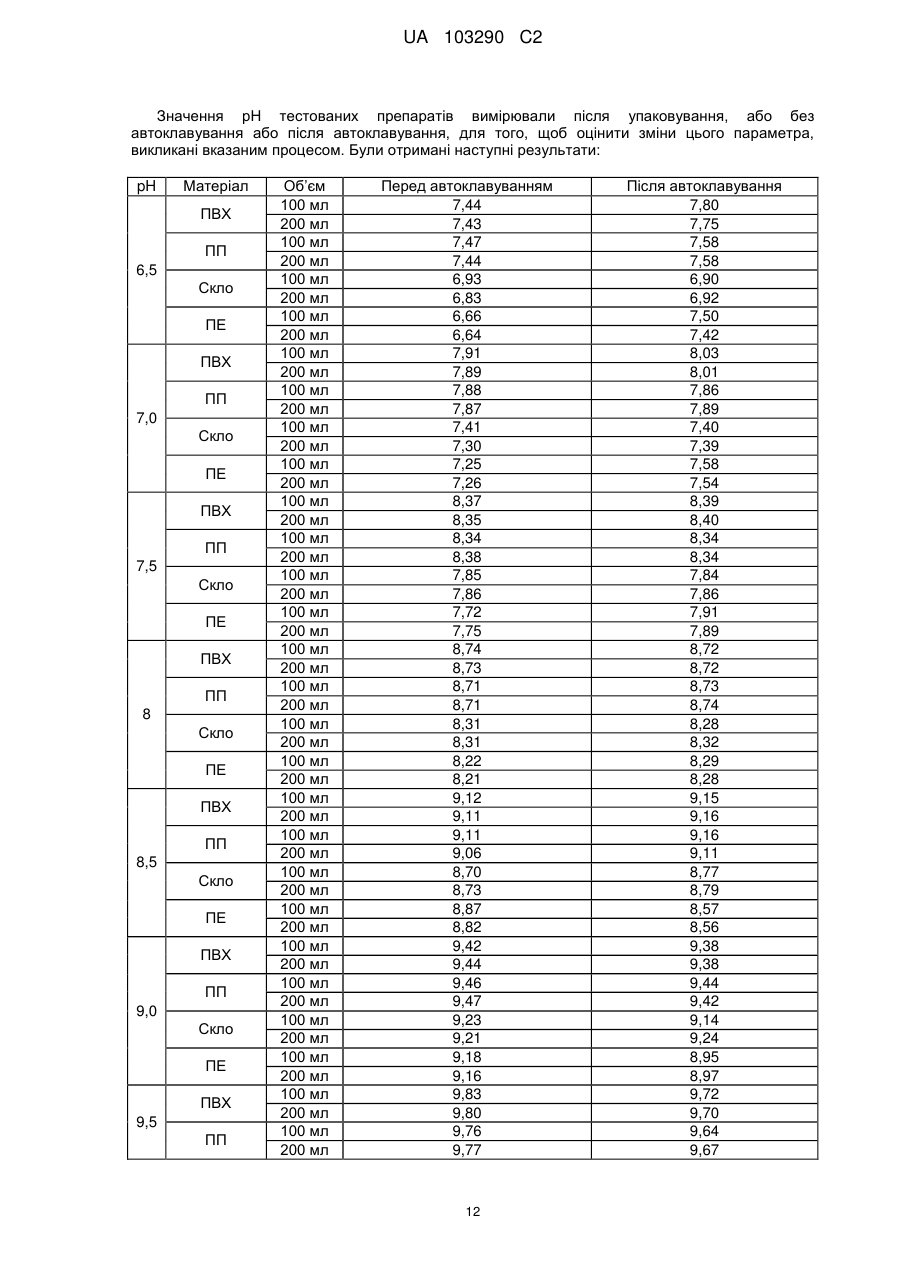
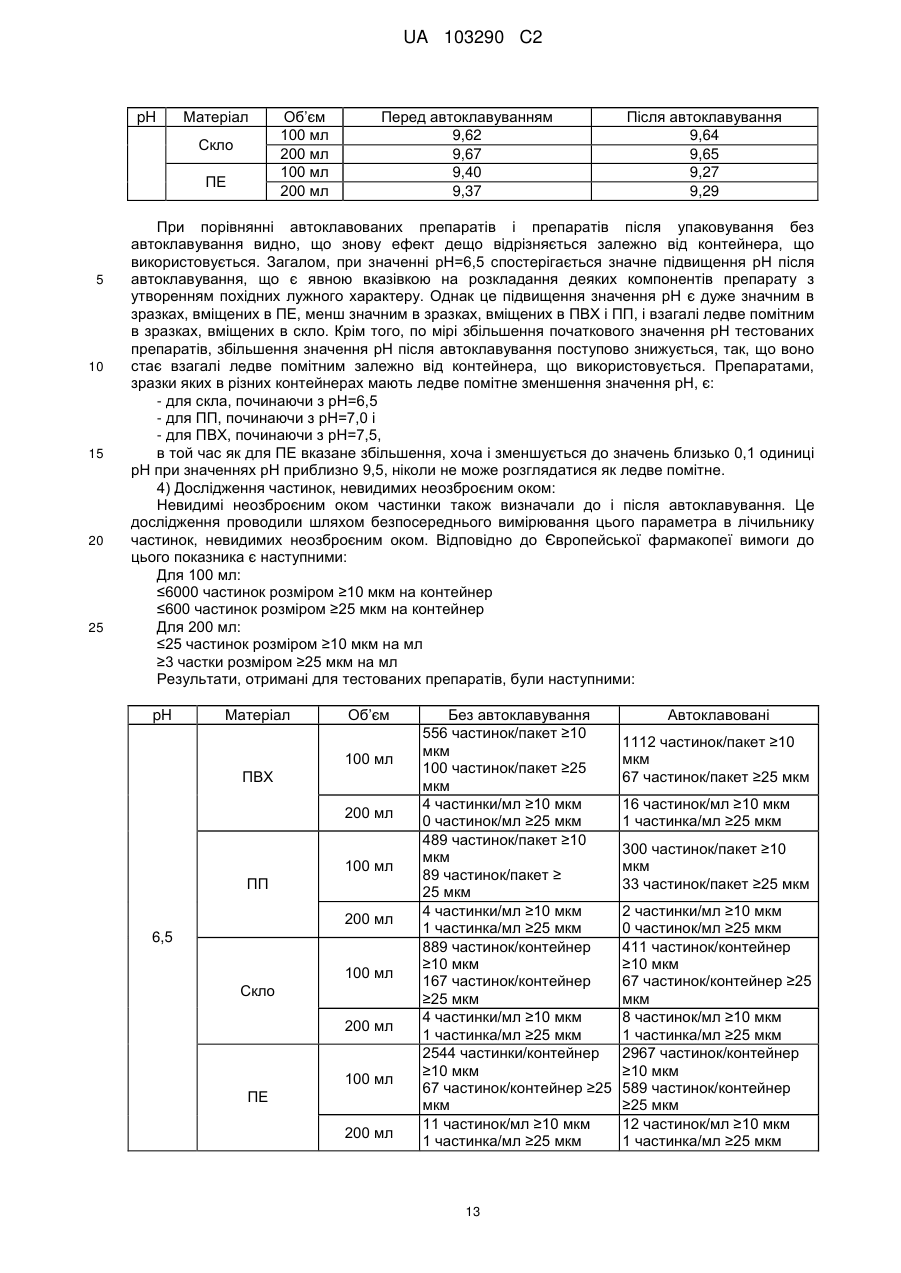
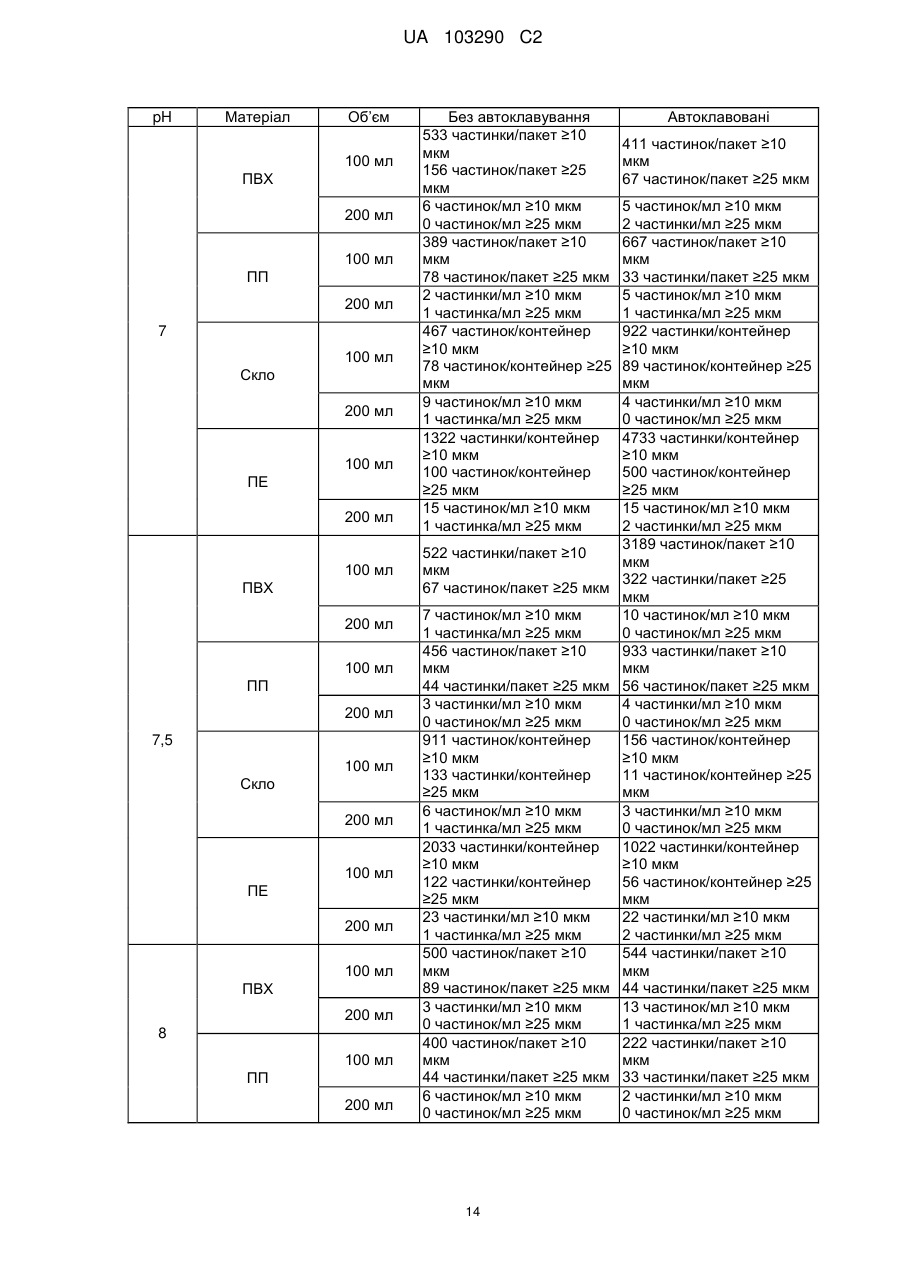
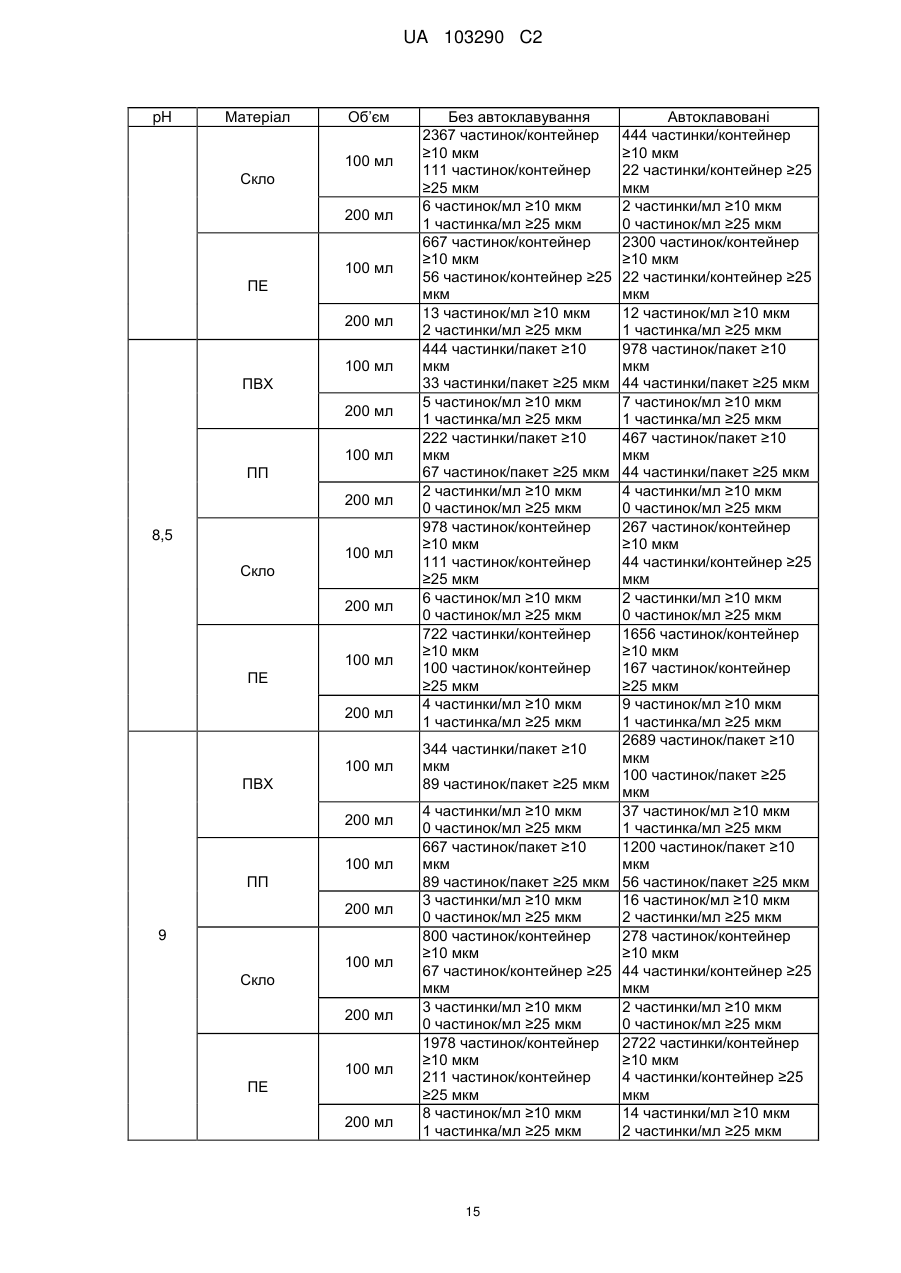
Реферат: Винахід стосується фармацевтичної композиції ібупрофену для ін'єкції, що містить водний розчин ібупрофену і трометамол. UA 103290 C2 (12) UA 103290 C2 UA 103290 C2 5 10 15 20 25 30 35 40 45 50 55 Галузь техніки, до якої належить винахід Даний винахід стосується фармацевтичної композиції для внутрішньовенного введення, яка включає в себе 2-(4-ізобутилфеніл)пропіонову кислоту (ібупрофен), трометамол і NaCl. Рівень техніки 2-(4-ізобутилфеніл)пропіонова кислота (ібупрофен) є знеболюючим, жарознижуючим, протизапальним лікарським засобом з наступною хімічною формулою: . Ібупрофен є лікарським засобом, який став дуже добре відомим з моменту свого винаходу в 1960-х роках, і в цей час він постачається на ринок для лікування болю, запалення і жару під різними торговими найменуваннями у вигляді фармацевтичних форм для перорального введення. Ібупрофен може існувати у вигляді (R) або (S) енантіомерів, і хоча біологічно активним є (S) енантіомер, більшість препаратів містять рацемічну суміш, оскільки (R)енантіомер перетворюється в активну (S) форму in vivo. Надалі в даній заявці термін «ібупрофен» використовується для позначення або одного з двох енантіомерів (R) або (S), або їх рацемічної суміші. Однак, незважаючи на багато переваг, одним з основних недоліків ібупрофену є його низька розчинність у воді. Ібупрофен є одноосновною кислотою зі значенням pKa=4,4. Тому його розчинність тісно пов'язана з pH і може коливатися від 78 мікрограм/мл при кислих значеннях pH, до 291 мг/мл при лужних значеннях pH. Внаслідок цього, створення деяких лікарських форм ібупрофену, зокрема, рідких лікарських форм, було проблематичним. Так, наприклад, в публікаціях міжнародних заявок WO 03/039532 A1 і WO 2005/065674 A1 описуються рідкі фармацевтичні композиції ібупрофену, які включають в себе амінокислоти, такі як аргінін, для поліпшення розчинності ібупрофену, і які мають значення pH нижче за 7,8. Однак ці препарати мають той недолік, що хоча вони можуть бути піддані термічній обробці до певної температури, вони не можуть бути автоклавовані, оскільки в умовах стерилізації автоклавуванням, тобто, як правило, протягом 15 хвилин при температурі 121°С, аргінін буде розкладатися з утворенням непрогнозованих небажаних домішок. Це означає, що такі препарати не можуть бути піддані вищезгаданій процедурі автоклавування, яка є способом стерилізації, який повинен застосовуватися як спосіб першого вибору, і є найбільш доцільним для будь-якого ін'єкційного фармацевтичного препарату. Ін'єкційна фармацевтична композиція ібупрофену вже існує на ринку під торговим найменуванням Caldolor, зі складом, що відповідає рецептурі, описаній у вищезазначених публікаціях міжнародних заявок, яка показана для лікування помірного і сильного болю і жару. Цей препарат містить на 1 мл розчину 100 мг ібупрофену у воді для ін'єкцій (тобто концентрація ібупрофену становить 100 мг/мл) і 78 мг аргініну при молярному співвідношенні аргінін:ібупрофен, що дорівнює 0,92:1, в скляних ампулах, що містять 400 або 800 мг ібупрофену при значенні pH приблизно 7,4. Однак цей препарат є дуже концентрованим для безпосереднього застосування і вимагає додаткового розбавлення до 100 або 200 мілілітрів. Крім того, як вже згадувалося, він не може бути автоклавований, що робить необхідним застосування дуже дорогої технології асептичного виробництва. Фармацевтичні препарати для парентерального введення, що містять ібупрофен в концентрації 8 мг/мл і трометамол (тріс-гідроксиметиламінометан) в концентрації 6,04 мг/мл, значення pH яких обмежується діапазоном від 7,8 до 8,2, також відомі з джерела DE 19912436 A1 і його подальшої міжнародної публікації WO 00/56325. Однак в цьому документі не описуються і не передбачаються препарати з іншими значеннями концентрацій вказаних компонентів, або зі значеннями pH за межами вказаного діапазону. Крім того, відносний високий вміст ібупрофену в композиціях, розкритих в цьому документі, може погіршувати розчинність ібупрофену при вказаних значеннях pH композиції, і додаткове вказування на те, що стерилізація цих композицій проводилася стерилізуючим фільтруванням дозволяє передбачити, що ці композиції можливо не придатні для стерилізації в автоклаві. У будь-якому випадку, така непридатність була показана за допомогою порівняльних експериментальних досліджень, описаних нижче. Суть винаходу Таким чином, проблемою, на вирішення якої спрямований даний винахід, є створення ін'єкційних рідких препаратів ібупрофену, які не мають недоліків композицій, розкритих в попередньому рівні техніці, зокрема, які можуть бути автоклавовані з мінімальними втратами 1 UA 103290 C2 5 10 15 20 25 30 35 40 45 50 55 60 ібупрофену і утворенням небажаних домішок, а також з іншими фармацевтично важливими параметрами, які після процесу автоклавування залишаються в прийнятних межах, встановлених фармакопеєю. Хоча певна кількість препаратів ібупрофену описана в попередньому рівні техніці, проте існує проблема, що не один з них не може бути автоклавований, оскільки їх рецептура включає в себе хімічні сполуки, які розкладаються під час автоклавування з утворенням непрогнозованих небажаних домішок, які виключають можливість їх застосування для ін'єкцій. Розв'язання цієї проблеми основане на тому, що автори даного винаходу виявили, що рідкі композиції ібупрофену, в яких цей активний компонент знаходиться в концентрації від 2 до 6 мг/мл, переважно, приблизно 4 мг/мл, які містять трометамол в концентрації від 1,8 до 5,8 мг/мл, і які мають значення pH більше 7, переважно від 8,0 до 9,0, несподівано можуть бути автоклавовані з мінімальними втратами активного компонента і невеликим збільшенням небажаних домішок, кількість яких залишається в прийнятних межах, і таким чином ці композиції є особливо придатними для застосування як ін'єкційний фармацевтичний препарат. Вищезазначені властивості цих препаратів, тобто те, що вони можуть бути автоклавовані з мінімальними втратами активного компонента і прийнятним утворенням небажаних домішок після автоклавування, були показані в різних типах контейнерів, таких як контейнери, виготовлені з пластик, таких як поліпропілен (ПП), ПВХ або поліетилен, а також в скляних контейнерах, хоча і в різній мірі в кожному з них. Тому в першому аспекті даний винахід стосується фармацевтичної композиції ібупрофену для ін'єкції, яка включає в себе водний розчин ібупрофену і трометамолу, в якому концентрація ібупрофену становить від 2 до 6 мг/мл, переважно, приблизно 4 мг/мл, і трометамол знаходиться в концентрації від 1,8 до 5,8 мг/мл, переважно, приблизно 3,8 мг/мл, і значення pH цієї композиції знаходиться в діапазоні від 7,0 до 9,5. Ці композиції є придатними для лікування болю, запалення або жару. У другому аспекті даний винахід стосується застосування вказаних композицій у виробництві лікарського препарату для лікування болю, запалення або жару. Докладний опис винаходу Таким чином, рідкі фармацевтичні композиції даного винаходу містять ібупрофен в концентрації від 2 до 6 мг/мл, переважно, приблизно 4 мг/мл, трометамол в концентрації від 1,8 до 5,8 мг/мл, переважно, приблизно 3,8 мг/мл, і обов'язкове NaCl для забезпечення необхідної ізотонічності, яка, як правило, становить приблизно 300 мОсм/кг, що вимагає концентрації NaCl, переважно, приблизно 7,7 мг/мл. Вважається, що трометамол сприяє підвищенню швидкості розчинення ібупрофену у водному розчиннику, а також допомагає підтримуванню стабільності ібупрофену в розчині. У композиціях даного винаходу трометамол доданий в концентрації від 1,5 до 5,8 мг/мл, переважно, приблизно 3,8 мг/мл. Значення pH композицій даного винаходу знаходиться в діапазоні від 7,0 до 12, переважно, від 7,0 до 9,5, більш переважно, від 7,5 до 9,0, ще більш переважно, від 8,0 до 9,0 і, найбільш переважно, приблизно 8,5, залежно від контейнера, в якому знаходяться вказані композиції. Значення pH може бути доведене до необхідного будь-яким прийнятним для цього способом, відомим фахівцеві в даній галузі техніки, хоча переважно, щоб це було зроблено шляхом додавання NaOH/HCl до досягнення бажаного значення pH. У даному описі термін «автоклавування» означає будь-який термічний спосіб, який робить можливою стерилізацію препарату, і, зокрема, процедуру, під час якої препарати піддаються впливу температури від 110 до 130°С протягом періоду часу від 2 до 190 хвилин, більш конкретно, впливу температури від 120 до 125°С протягом періоду часу від 15 до 20 хвилин. Також з даного опису буде зрозуміло, що розчин для ін'єкції є таким, що стерилізується нагріванням, або «автоклавованим», якщо після проходження процедури автоклавування відповідно до попереднього параграфа вміст в ньому ібупрофену становить щонайменше 95% від початкового вмісту доданого в розчин ібупрофену. Експериментальні дослідження Різні експериментальні дослідження препарату і автоклавування ібупрофену були проведені в різних пакувальних матеріалах: поліетилені (ПЕ), склі, полівінілхлориді (ПВХ) і поліпропілені (ПП), при різних значеннях pH. У зв'язку з цим потрібно зазначити, що коли в даному описі згадується пакувальний матеріал для композицій даного винаходу, то це потрібно розуміти як матеріал, що знаходиться в безпосередньому контакті зі вказаними композиціями. Очевидно, що контейнери, які містять композиції відповідно до даного винаходу, можуть складатися з шарів різних матеріалів, так що шари, які не знаходяться в безпосередньому контакті з композиціями відповідно до даного винаходу, можуть мати склад, відмінний від вказаних матеріалів. 2 UA 103290 C2 5 10 15 20 25 30 35 40 45 Використовуваний препарат мав наступний склад: - Ібупрофенова основа (BASF): 4 мг/мл - Трометамол (MercK): 3,8 мг/мл - NaCl (Esco): 7,7 мг/мл. Для приготування композицій, що використовуються в наступних експериментальних дослідженнях, спочатку у воду з температурою 50°С додавали наповнювачі. Потім при помішуванні додавали ібупрофен, після приблизно однієї години перемішування ібупрофен повністю розчинявся. На закінчення, pH доводили до бажаного значення за допомогою 1н HCl і/або 1н NaOH, залежно від конкретного випадку. На основі цієї рецептури були приготовані зразки, що мають наступні значення pH: 6,5, 7,0, 7,5, 7,8, 8,0, 8,2, 8,5, 9,0 і 9,5. Кожний з цих препаратів був упакований в скляні контейнери, пакети з поліпропілену (ПП), пакети з ПВХ і контейнери з поліетилену низької густини. У дослідженнях автоклавуванням скляні контейнери, поліпропіленові пакети і пакети з ПВХ автоклавували при температурі 121°С протягом 15 хвилин, як указано у вимогах до цього процесу в Європейській фармакопеї. Поліетиленові контейнери автоклавували при температурі 110°С протягом 3 годин. Паралельно готували серію порівняльних композицій, використовуючи такі ж умови, як указано вище, але по рецептурі, розкритій в джерелі DE 19912436 A1, а саме: - Ібупрофенова основа (BASF): 8 мг/мл - Трометамол (MercK): 6,05 мг/мл - NaCl (Esco): 5,4 мг/мл. У цьому разі pH композицій доводили до наступних значень: 7,8, 8,2 і 9,0, і досліджували тільки в контейнерах ємністю 100 мл, виготовлених з різних матеріалів. Отримані результати були наступними: 1) Дослідження вмісту небажаних домішок в тестованих препаратах після автоклавування: Визначення небажаних домішок проводили за допомогою ВЕРХ аналізу, використовуючи наступні параметри: Рухома фаза: Для приготування рухомої фази 3 мл аміаку розчиняли в 1920 мл води, значення pH доводили до 2,5 фосфорною кислотою, і потім додавали 1080 мл ацетонітрилу. Швидкість потоку: 2,3 мл/хв. Колонка: C18, 150 мм 4,6 мм, 5 мкм. Детекція: При 214 нм. Об'єм, що вводиться: 10 мкл. Температура = 25°С Тривалість = 40 хвилин. Тестований зразок: Пряме введення. Контрольний зразок: Стандартний розчин ібупрофену в рухомій фазі з концентрацією 0,04 мг/мл (1,0% відносно тестованого зразка). Придатність розчину: Придатний розчин містить 4 мкг/мл небажаних домішок і 4 мг/мл ібупрофену. Критерій придатності: Розрізнення між ібупрофеном і небажаними домішками складає більше ніж 2. Результати, отримані для різних препаратів в різних контейнерах, приведені в наступних таблицях, в яких небажані домішки, якщо вони були виявлені, позначені їх відповідним часом утримування (Trr) при ВЕРХ аналізі, ці домішки також позначені буквами (А, J, N і т. д.), які визначають вказані домішки згідно з відповідним сертифікатом аналізу відповідно до Європейської фармакопеї. 3 UA 103290 C2 - pH 6,5: Небажані домішки (%) Без автоклавування ПВХ 100 ПВХ 200 ПП 100 ПП 200 ПВХ 100 мл мл мл мл мл Trr 0,20 (домішка J) 0,31 (домішка N) 0,58 0,93 (домішка A) 1,83 Всього н. в. н. в. н. в. 0,01 0,01 0,01 0,01 0,06 0,06 0,06 0,06 0,06 0,06 0,06 0,06 0,02 0,02 0,02 0,02 0,02 0,01 0,02 0,02 0,02 0,02 0,02 0,02 0,02 0,02 0,02 0,02 н. в. 0,10 н. в. 0,10 н. в. 0,10 н. в. 0,10 0,05 0,16 0,03 0,13 0,04 0,15 н. в. 0,11 Небажані домішки (%) Без автоклавування Скло 100 мл Скло 200 мл н. в. н. в. 0,06 0,06 0,02 0,02 0,02 0,02 н. в. н. в. 0,10 0,10 Trr 0,20 (домішка J) 0,31 (домішка N) 0,58 0,93 (домішка A) 1,83 Всього Автоклавовані Скло 100 мл Скло 200 мл 0,01 0,02 0,06 0,06 0,02 0,02 0,02 0,02 н. в. н. в. 0,11 0,12 Небажані домішки (%) Без автоклавування ПЕ 100 мл ПЕ 200 мл н. в. н. в. 0,06 0,06 0,02 0,02 0,02 0,02 н. в. н. в. 0,10 0,10 0,20 0,31 (домішка N) 0,58 0,93 (домішка A) 1,83 Всього 10 ПП 200 мл н. в. Trr 5 Автоклавовані ПВХ 200 ПП 100 мл мл Автоклавовані ПЕ 100 мл ПЕ 200 мл 0,02 0,02 0,06 0,06 0,01 0,02 0,02 0,02 н. в. н. в. 0,11 0,12 Видно, що в зразках, упакованих в контейнери зі скла і ПЕ, загальний вміст небажаних домішок змінюється, в середньому, від приблизно 0,10% перед автоклавуванням, до 0,12% після автоклавування, в той час як в зразках, вміщених в контейнери їх ПВХ і ПП, він змінюється від приблизно 0,10% до 0,15%, і у всіх випадках залишається нижче контрольного значення 0,20%. - pH 7,0: Trr 0,20 (домішка J) 0,31 (домішка N) 0,58 0,93 (домішка A) 1,83 Всього Небажані домішки (%) Без автоклавування ПВХ 100 ПВХ 200 ПП 100 ПП 200 ПВХ 100 мл мл мл мл мл Автоклавовані ПВХ 200 ПП 100 мл мл ПП 200 мл н. в. н. в. н. в. н. в. 0,01 0,01 0,01 0,01 0,06 0,06 0,06 0,06 0,06 0,06 0,06 0,06 0,02 0,02 0,02 0,02 0,02 0,01 0,02 0,02 0,02 0,02 0,02 0,02 0,02 0,02 0,02 0,02 н. в. 0,10 н. в. 0,10 н. в. 0,10 н. в. 0,10 0,06 0,17 0,04 0,14 0,03 0,14 н. в. 0,11 4 UA 103290 C2 Trr 0,20 0,31 (домішка N) 0,58 0,93 (домішка A) 1,83 Всього Trr 0,20 (домішка J) 0,31 (домішка N) 0,58 0,93 (домішка A) 1,83 Всього 5 Небажані домішки (%) Без автоклавування Скло 100 мл Скло 200 мл н. в. н. в. 0,06 0,06 0,02 0,02 0,02 0,02 н. в. н. в. 0,10 0,10 Автоклавовані Скло 100 мл Скло 200 мл 0,02 0,02 0,06 0,06 0,02 0,02 0,02 0,02 н. в. н. в. 0,12 0,12 Небажані домішки (%) Без автоклавування ПЕ 100 мл ПЕ 200 мл н. в. н. в. 0,06 0,06 0,02 0,02 0,02 0,02 н. в. н. в. 0,10 0,10 Автоклавовані ПЕ 100 мл ПЕ 200 мл 0,02 0,02 0,06 0,06 0,02 0,02 0,02 0,02 н. в. н. в. 0,12 0,12 Знову можна бачити, що в зразках, упакованих в контейнери зі скла і ПЕ, загальний вміст небажаних домішок змінюється, в середньому, від приблизно 0,10% перед автоклавуванням, до 0,12% після автоклавування, в той час як в зразках, вміщених в контейнери їх ПВХ і ПП, він змінюється від приблизно 0,10% до 0,15%, і у всіх випадках залишається нижче контрольного значення 0,20%. - pH 7,5: Небажані домішки (%) Без автоклавування Автоклавовані Trr ПВХ 100 ПВХ 200 ПП 100 ПП 200 ПВХ 100 ПВХ 200 ПП 100 ПП 200 мл мл мл мл мл мл мл мл 0,20 (домішка н. в. н. в. н. в. н. в. н. в. 0,01 0,01 0,01 J) 0,31 (домішка 0,06 0,06 0,06 0,06 0,06 0,06 0,06 0,06 N) 0,58 0,02 0,02 0,02 0,02 0,02 0,02 0,02 0,02 0,93 (домішка 0,02 0,02 0,02 0,02 0,02 0,02 0,02 0,02 A) 1,83 н. в. н. в. н. в. н. в. 0,05 0,03 0,04 н. в. Всього 0,10 0,10 0,10 0,10 0,15 0,13 0,15 0,11 Trr 0,20 0,31 (домішка N) 0,58 0,93 (домішка A) 1,83 Всього Небажані домішки (%) Без автоклавування Скло 100 мл Скло 200 мл н. в. н. в. 0,06 0,06 0,02 0,02 0,02 0,02 н. в. н. в. 0,10 0,10 10 5 Автоклавовані Скло 100 мл Скло 200 мл 0,01 0,01 0,06 0,06 0,02 0,02 0,02 0,02 н. в. н. в. 0,11 0,11 UA 103290 C2 Небажані домішки (%) Без автоклавування ПЕ 100 мл ПЕ 200 мл н. в. н. в. 0,06 0,06 0,02 0,02 0,02 0,02 н. в. н. в. 0,10 0,10 Trr 0,20 (домішка J) 0,31 (домішка N) 0,58 0,93 (домішка A) 1,83 Всього 5 Автоклавовані ПЕ 100 мл ПЕ 200 мл 0,02 0,02 0,06 0,06 0,02 0,02 0,02 0,02 н. в. н. в. 0,12 0,12 При цьому значенні pH також спостерігається, що в зразках, упакованих в контейнери зі скла і ПЕ, загальний вміст небажаних домішок змінюється від приблизно 0,10% перед автоклавуванням, до 0,12% після автоклавування, в той час як в зразках, вміщених в контейнери їх ПВХ і ПП, він змінюється від приблизно 0,10% до 0,15%, і у всіх випадках залишається нижче контрольного значення 0,20%. - pH 8,0: Небажані домішки (%) Без автоклавування ПВХ 100 ПВХ 200 ПП 100 ПП 200 ПВХ 100 мл мл мл мл мл Trr 0,20 (домішка J) 0,31 (домішка N) 0,58 0,93 (домішка A) 1,83 Всього Автоклавовані ПВХ 200 ПП 100 мл мл ПП 200 мл н. в. н. в. н. в. н. в. н. в. н. в. н. в. н. в. 0,06 0,06 0,06 0,06 0,06 0,06 0,06 0,06 0,01 0,02 0,02 0,01 0,02 0,02 0,02 0,02 0,02 0,02 0,02 0,02 0,02 0,02 0,02 0,02 н. в. 0,09 н. в. 0,10 н. в. 0,10 н. в. 0,09 0,03 0,13 н. в. 0,10 0,03 0,13 н. в. 0,10 10 Trr 0,20 0,31 (домішка N) 0,58 0,93 (домішка A) 1,83 Всього Trr 0,20 (домішка J) 0,31 (домішка N) 0,58 0,93 (домішка A) 1,83 Всього 15 Небажані домішки (%) Без автоклавування Скло 100 мл Скло 200 мл н. в. н. в. 0,06 0,06 0,02 0,02 0,02 0,02 н. в. н. в. 0,10 0,10 Автоклавовані Скло 100 мл Скло 200 мл 0,01 0,01 0,06 0,06 0,02 0,02 0,02 0,02 н. в. н. в. 0,11 0,11 Небажані домішки (%) Без автоклавування ПЕ 100 мл ПЕ 200 мл н. в. н. в. 0,06 0,06 0,02 0,02 0,02 0,02 н. в. н. в. 0,10 0,10 Автоклавовані ПЕ 100 мл ПЕ 200 мл 0,01 н. в. 0,06 0,06 0,02 0,02 0,02 0,02 н. в. н. в. 0,11 0,10 У цьому випадку можна спостерігати менше збільшення кінцевого рівня небажаних домішок після автоклавування, оскільки в зразках, упакованих в контейнери зі скла і ПЕ, загальний вміст небажаних домішок змінюється, в середньому, від приблизно 0,10% перед автоклавуванням, до 0,11% після автоклавування, в той час як в зразках, вміщених в контейнери їх ПВХ і ПП, він змінюється, в середньому, від приблизно 0,10% до 0,12%, і у всіх випадках залишається нижче контрольного значення 0,20%. 6 UA 103290 C2 - pH 8,5: Небажані домішки (%) Без автоклавування ПВХ 100 ПВХ 200 ПП 100 ПП 200 ПВХ 100 мл мл мл мл мл Trr 0,20 (домішка J) 0,31 (домішка N) 0,58 0,93 (домішка A) 1,83 Всього Автоклавовані ПВХ 200 ПП 100 мл мл ПП 200 мл н. в. н. в. н. в. н. в. н. в. н. в. н. в. н. в. 0,06 0,06 0,06 0,06 0,06 0,06 0,06 0,06 0,02 0,01 0,02 0,01 0,02 0,02 0,02 0,01 0,02 0,02 0,02 0,02 0,02 0,02 0,02 0,02 н. в. 0,10 н. в. 0,09 н. в. 0,10 н. в. 0,09 0,02 0,12 0,03 0,13 0,04 0,14 0,01 0,10 Небажані домішки (%) Без автоклавування Скло 100 мл Скло 200 мл н. в. н. в. 0,06 0,06 0,01 0,02 0,02 0,02 н. в. н. в. 0,09 0,10 0,20 0,31 (домішка N) 0,58 0,93 (домішка A) 1,83 Всього Trr 0,20 (домішка J) 0,31 (домішка N) 0,58 0,93 (домішка A) 1,83 Всього Автоклавовані Скло 100 мл Скло 200 мл н. в. н. в. 0,06 0,06 0,02 0,02 0,02 0,02 н. в. н. в. 0,10 0,10 Небажані домішки (%) Без автоклавування ПЕ 100 мл ПЕ 200 мл н. в. н. в. 0,06 0,06 0,01 0,02 0,02 0,02 н. в. н. в. 0,09 0,10 Trr Автоклавовані ПЕ 100 мл ПЕ 200 мл н. в. н. в. 0,06 0,06 0,02 0,02 0,02 0,02 н. в. н. в. 0,10 0,10 5 10 У цьому випадку при значенні pH 8,5 тенденція, що вже спостерігається при значенні pH 8,0, мабуть, зберігається, а саме, спостерігається менше збільшення рівня небажаних домішок після автоклавування, оскільки в зразках, упакованих в контейнери зі скла і ПЕ, загальний вміст небажаних домішок змінюється, в середньому, від приблизно 0,10% перед автоклавуванням, до 0,11% після автоклавування, в той час як в зразках, вміщених в контейнери їх ПВХ і ПП, він змінюється, в середньому, від приблизно 0,10% до 0,13%, і у всіх випадках залишається нижче контрольного значення 0,20%. - pH 9,0: Trr 0,20 (домішка J) 0,31 (домішка N) 0,58 0,93 (домішка A) 1,83 Всього Небажані домішки (%) Без автоклавування ПВХ 100 ПВХ 200 ПП 100 ПП 200 ПВХ 100 мл мл мл мл мл Автоклавовані ПВХ 200 ПП 100 мл мл ПП 200 мл н. в. н. в. н. в. н. в. н. в. н. в. н. в. н. в. 0,06 0,06 0,06 0,06 0,06 0,06 0,06 0,06 0,02 0,02 0,06 0,01 0,02 0,02 0,02 0,02 0,02 0,02 0,06 0,02 0,02 0,02 0,02 0,03 н. в. 0,10 н. в. 0,10 н. в. 0,18 н. в. 0,09 0,01 0,11 н. в. 0,10 0,04 0,14 0,02 0,13 7 UA 103290 C2 Небажані домішки (%) Без автоклавування Скло Скло 200 мл 100 мл н. в. н. в. 0,06 0,06 0,02 0,02 0,02 0,02 н. в. н. в. 0,10 0,10 Trr 0,20 0,31 (домішка N) 0,58 0,93 (домішка A) 1,83 Всього Небажані домішки (%) Без автоклавування ПЕ 100 мл ПЕ 200 мл н. в. н. в. 0,06 0,06 0,02 0,01 0,02 0,02 н. в. н. в. 0,10 0,09 Trr 0,20 (домішка J) 0,31 (домішка N) 0,58 0,93 (домішка A) 1,83 Всього 5 Автоклавовані Скло Скло 100 мл 200 мл н. в. н. в. 0,06 0,06 0,02 0,01 0,02 0,02 н. в. н. в. 0,10 0,09 Автоклавовані ПЕ 100 мл ПЕ 200 мл н. в. н. в. 0,06 0,06 0,01 0,02 0,02 0,02 н. в. н. в. 0,09 0,10 При значенні pH 9,0 чітко видно, що раніше відмічена тенденція продовжує зберігатися, так в зразках, упакованих в контейнери зі скла і ПЕ, загальний вміст небажаних домішок залишається практично незмінним після автоклавування, в той час як в зразках, вміщених в контейнери їх ПВХ і ПП, воно трохи збільшується, в середньому, від приблизно 0,10% до 0,12%, і у всіх випадках залишається нижче контрольного значення 0,20%. - pH 9,5: 10 Небажані домішки (%) Без автоклавування ПВХ 100 ПВХ 200 ПП 100 ПП 200 ПВХ 100 мл мл мл мл мл Trr 0,20 (домішка J) 0,31 (домішка N) 0,58 0,93 (домішка A) 1,83 Всього Trr 0,20 0,31 (домішка N) 0,58 0,93 (домішка A) 1,83 Всього Автоклавовані ПВХ 200 ПП 100 мл мл ПП 200 мл н. в. н. в. н. в. н. в. н. в. н. в. н. в. н. в. 0,06 0,06 0,06 0,06 0,06 0,06 0,06 0,06 0,01 0,02 0,06 0,01 0,02 0,02 0,01 0,02 0,02 0,02 0,02 0,02 0,02 0,02 0,02 0,02 н. в. 0,09 н. в. 0,10 н. в. 0,10 н. в. 0,09 0,01 0,11 н. в. 0,10 0,03 0,12 0,02 0,12 Небажані домішки (%) Без автоклавування Скло 100 мл Скло 200 мл н. в. н. в. 0,06 0,06 0,02 0,01 0,02 0,02 н. в. н. в. 0,10 0,09 8 Автоклавовані Скло 100 мл Скло 200 мл н. в. н. в. 0,06 0,06 0,02 0,02 0,02 0,02 н. в. н. в. 0,10 0,10 UA 103290 C2 Trr 0,20 (домішка J) 0,31 (домішка N) 0,58 0,93 (домішка A) 1,83 Всього 5 10 15 20 25 30 Небажані домішки (%) Без автоклавування ПЕ 100 мл ПЕ 200 мл н. в. н. в. 0,06 0,06 0,02 0,02 0,02 0,02 н. в. н. в. 0,10 0,10 Автоклавовані ПЕ 100 мл ПЕ 200 мл н. в. н. в. 0,06 0,06 0,02 0,02 0,02 0,02 н. в. н. в. 0,10 0,10 Знову при значенні pH 9,5 зразки, упаковані в контейнери зі скла і ПЕ, показали практично незмінний вміст небажаних домішок після автоклавування, в той час як зразки, вміщені в контейнери їх ПВХ і ПП, показали після вказаного процесу менше збільшення, в порівнянні з попередніми значеннями pH, змінюючись, в середньому, від 0,10% до 0,11%. Таким чином, можна зробити висновок про те, що після процесу автоклавування збільшення вмісту небажаних домішок тим менший, чим більше значення pH, що, безсумнівно, є значною перевагою для препаратів, призначених для ін'єкції. 2) Дослідження вмісту ібупрофену в тестованих препаратах після автоклавування: Не применшуючи значення інших параметрів, таких як вміст небажаних домішок, не викликає сумнівів, що для фармацевтичної композиції для ін'єкції вміст ібупрофену після автоклавування є дуже важливим параметром. Для цих цілей вважається, що мінімальним прийнятним вмістом ібупрофену після автоклавування є щонайменше 95% від початкового вмісту ібупрофену, доданого в розчин. Після автоклавування залишковий вміст ібупрофену в препаратах визначали шляхом оцінки втрат, що відбулися в результаті автоклавування. Визначення ібупрофену було знову основане на аналізі за допомогою ВЕРХ з використанням наступних параметрів: Рухома фаза: Для приготування рухомої фази 6 г трифтороцтової кислоти розчиняли в 600 мл води, значення pH доводили до 3 розбавленим гідроксидом амонію, і потім додавали 900 мл ацетонітрилу. Швидкість потоку: 1 мл/хв. Колонка: C18, 150 мм × 4,6 мм, 5 мкм. Детекція: При 254 нм. Об'єм, що вводиться: 10 мкл. Температура = 25°С Тривалість = 8 хвилин. Тестований зразок: Тестований зразок ібупрофену розбавляли до концентрації від 0,8 до 1,0 мг/мл. Контрольний зразок: Стандартний розчин ібупрофену в рухомій фазі з концентрацією від 0,8 до 1,0 мг/мл. Результати приведені в наступній таблиці: pH Матеріал ПВХ ПП 6,5 Скло ПЕ ПВХ 7,0 ПП Скло Об’єм 100 мл 200 мл 100 мл 200 мл 100 мл 200 мл 100 мл 200 мл 100 мл 200 мл 100 мл 200 мл 100 мл Вміст ібупрофену % от 4 мг/мл перед автоклавуванням 101,8 101,0 100,9 102,6 102,7 101,6 100,3 99,8 102,8 103,2 103,0 101,0 102,0 9 Вміст ібупрофену % от 4 мг/мл після автоклавування Зміна у вмісті ібупрофену (%) 83,6 85,2 94,0 97,6 92,0 93,5 94,5 96,4 89,8 93,6 97,9 99,4 103,3 -17,9% -15,6% -6,8% -3,3% -10,4% -8,0% -5,8% -3,4% -12,6% -9,3% -5,0% -1,6% +1,3% UA 103290 C2 pH Матеріал ПЕ ПВХ ПП 7,5 Скло ПЕ 7,8 ПВХ ПП Скло ПЕ ПВХ ПП 8,0 Скло ПЕ 8,2 ПВХ ПП Скло ПЕ ПВХ ПП 8,5 Скло ПЕ ПВХ ПП 9,0 Скло ПЕ ПВХ ПП 9,5 Скло ПЕ Об’єм 200 мл 100 мл 200 мл 100 мл 200 мл 100 мл 200 мл 100 мл 200 мл 100 мл 200 мл 100 мл 100 мл 100 мл 100 мл 100 мл 200 мл 100 мл 200 мл 100 мл 200 мл 100 мл 200 мл 100 мл 100 мл 100 мл 100 мл 100 мл 200 мл 100 мл 200 мл 100 мл 200 мл 100 мл 200 мл 100 мл 200 мл 100 мл 200 мл 100 мл 200 мл 100 мл 200 мл 100 мл 200 мл 100 мл 200 мл 100 мл 200 мл 100 мл 200 мл Вміст ібупрофену % от 4 мг/мл перед автоклавуванням 103,4 100,7 102,2 104,6 102,6 103,7 103,9 102,7 100,8 102,3 102,1 102,1 102,7 103,1 102,2 101,1 99,2 100,8 100,2 102,9 102,3 100,6 102,5 102,5 102,0 102,5 102,1 102,0 101,2 101,9 102,1 101,1 101,1 100,7 101,4 103,4 101,3 103,5 100,2 100,1 101,0 101,7 101,6 99,5 100,0 100,0 99,9 100,8 100,9 99,2 99,8 10 Вміст ібупрофену % от 4 мг/мл після автоклавування Зміна у вмісті ібупрофену (%) 104,1 100,8 102,2 97,8 99,0 104,2 103,9 101,5 101,2 98,9 103,3 97,9 99,4 102,7 100,2 99,7 99,6 95,9 102,4 104,7 101,6 103,9 103,4 99,1 100,5 99,1 100,8 102,3 103,0 103,7 102,3 101,1 101,4 101,6 101,1 103,4 103,6 103,9 103,9 104,8 100,4 101,9 100,8 100,1 100,4 100,6 100,7 101,5 99,2 101,7 102,6 +0,7% +0,0% +0,0% -6,5% -3,5% +0,5% +0,0% -1,2% +0,4% -3,3% +1,2% -4,1% -3,2% -0,4% -2,0% -1,4% +0,4% -4,9% +2,2% +1,7% -0,1% +3,3% +0,9% -3,3% -1,5% -3,3% -1,3% +0,3% +1,8% +1,8% +0,2% +0,0% +0,3% +0,9% -0,3% +0,0% +2,3% +0,4% +3,7% +4,7% -0,6% +0,2% -0,8% +0,6% +0,4% +0,6% +0,8% +0,7% -1,7% +2,5% +2,8% UA 103290 C2 5 10 Як і у випадку з небажаними домішками, можна спостерігати тенденцію, що зменшення втрат активного компонента (ібупрофену) відбувається по мірі збільшення значення pH, хоча і в різній мірі, залежно від контейнера, що використовується. При значенні pH 6,5 втрати ібупрофену збільшені у всіх випадках. Однак при значенні pH 7,0 втрати ібупрофену стають вже незначними в зразках, упакованих в скло і ПЕ, в той час як вони залишаються істотними в зразках, упакованих в ПП і особливо в ПВХ. При значенні pH 7,5 втрати ібупрофену залишаються значними тепер тільки в зразках, упакованих ПВХ, і при значенні pH, що більше або дорівнює 8,0, втрати є незначними у всіх контейнерах. При цьому експериментальні дослідження, проведені з композиціями, виготовленими відповідно до теорії, викладеної в документі DE, дали наступні результати: pH Матеріал Об’єм ПВХ ПП 7,0 Скло ПЕ ПВХ ПП 7,8 Скло ПЕ ПВХ ПП 8,2 Скло ПЕ ПВХ ПП 9,0 Скло ПЕ 15 20 100 мл 100 мл 100 мл 100 мл 100 мл 100 мл 100 мл 100 мл 100 мл 100 мл 100 мл 100 мл 100 мл 100 мл 100 мл 100 мл Вміст ібупрофену % от 4 мг/мл перед автоклавуванням Вміст ібупрофену % от 4 мг/мл після автоклавування Зміна у вмісті ібупрофену (%) 90,5 72,0 -20,4% 96,6 75,7 -21,6% 96,3 88,2 -8,4% 95,4 91,7 -3,9% 93,9 78,4 -16,5% 95,3 81,7 -14,3% 94,2 89,1 -5,4% 94,7 92,2 -2,6% 94,8 85,3 -10,0% 99,1 94,2 -4,9% 98,4 94,4 -4,1% 98,6 94,7 -3,9% 99,3 88,2 -11,2% 99,6 91,0 -8,6% 99,9 81,1 -18,8% 99,8 94,4 -5,4% Як можна помітити, в композиціях, виготовлених відповідно до теорії, викладеної в документі DE, неповне розчинення ібупрофену часто спостерігалося вже перед автоклавуванням, з початковим вмістом ібупрофену нижче необхідного мінімального значення 95%, а в одному випадку навіть ледве досягаючи 90%. Ці результати стали ще гірше після автоклавування, оскільки після цієї термічної обробки ні в одному випадку необхідний мінімальний вміст ібупрофену 95% не був досягнутий, і в багатьох випадках були виявлені втрати, що складають більше за 5%. На закінчення можна зробити висновок, що композиції, які мають вміст ібупрофену приблизно 8 мг/мл і вміст трометамолу приблизно 6,05 мг/мл, є непридатними для автоклавування, і приготовані таким чином композиції при автоклавуванні можуть втрачати до 28% від спочатку доданого ібупрофену, залежно від значення pH, що розглядається. 3) Дослідження зміни значення pH тестованих препаратів після автоклавування: 11 UA 103290 C2 Значення pH тестованих препаратів вимірювали після упаковування, або без автоклавування або після автоклавування, для того, щоб оцінити зміни цього параметра, викликані вказаним процесом. Були отримані наступні результати: pH Матеріал ПВХ ПП 6,5 Скло ПЕ ПВХ ПП 7,0 Скло ПЕ ПВХ ПП 7,5 Скло ПЕ ПВХ ПП 8 Скло ПЕ ПВХ ПП 8,5 Скло ПЕ ПВХ ПП 9,0 Скло ПЕ ПВХ 9,5 ПП Об’єм 100 мл 200 мл 100 мл 200 мл 100 мл 200 мл 100 мл 200 мл 100 мл 200 мл 100 мл 200 мл 100 мл 200 мл 100 мл 200 мл 100 мл 200 мл 100 мл 200 мл 100 мл 200 мл 100 мл 200 мл 100 мл 200 мл 100 мл 200 мл 100 мл 200 мл 100 мл 200 мл 100 мл 200 мл 100 мл 200 мл 100 мл 200 мл 100 мл 200 мл 100 мл 200 мл 100 мл 200 мл 100 мл 200 мл 100 мл 200 мл 100 мл 200 мл 100 мл 200 мл Перед автоклавуванням 7,44 7,43 7,47 7,44 6,93 6,83 6,66 6,64 7,91 7,89 7,88 7,87 7,41 7,30 7,25 7,26 8,37 8,35 8,34 8,38 7,85 7,86 7,72 7,75 8,74 8,73 8,71 8,71 8,31 8,31 8,22 8,21 9,12 9,11 9,11 9,06 8,70 8,73 8,87 8,82 9,42 9,44 9,46 9,47 9,23 9,21 9,18 9,16 9,83 9,80 9,76 9,77 12 Після автоклавування 7,80 7,75 7,58 7,58 6,90 6,92 7,50 7,42 8,03 8,01 7,86 7,89 7,40 7,39 7,58 7,54 8,39 8,40 8,34 8,34 7,84 7,86 7,91 7,89 8,72 8,72 8,73 8,74 8,28 8,32 8,29 8,28 9,15 9,16 9,16 9,11 8,77 8,79 8,57 8,56 9,38 9,38 9,44 9,42 9,14 9,24 8,95 8,97 9,72 9,70 9,64 9,67 UA 103290 C2 pH Матеріал Скло ПЕ 5 10 15 20 25 Об’єм 100 мл 200 мл 100 мл 200 мл Перед автоклавуванням 9,62 9,67 9,40 9,37 Після автоклавування 9,64 9,65 9,27 9,29 При порівнянні автоклавованих препаратів і препаратів після упаковування без автоклавування видно, що знову ефект дещо відрізняється залежно від контейнера, що використовується. Загалом, при значенні pH=6,5 спостерігається значне підвищення pH після автоклавування, що є явною вказівкою на розкладання деяких компонентів препарату з утворенням похідних лужного характеру. Однак це підвищення значення pH є дуже значним в зразках, вміщених в ПЕ, менш значним в зразках, вміщених в ПВХ і ПП, і взагалі ледве помітним в зразках, вміщених в скло. Крім того, по мірі збільшення початкового значення pH тестованих препаратів, збільшення значення pH після автоклавування поступово знижується, так, що воно стає взагалі ледве помітним залежно від контейнера, що використовується. Препаратами, зразки яких в різних контейнерах мають ледве помітне зменшення значення pH, є: - для скла, починаючи з pH=6,5 - для ПП, починаючи з pH=7,0 і - для ПВХ, починаючи з pH=7,5, в той час як для ПЕ вказане збільшення, хоча і зменшується до значень близько 0,1 одиниці pH при значеннях pH приблизно 9,5, ніколи не може розглядатися як ледве помітне. 4) Дослідження частинок, невидимих неозброєним оком: Невидимі неозброєним оком частинки також визначали до і після автоклавування. Це дослідження проводили шляхом безпосереднього вимірювання цього параметра в лічильнику частинок, невидимих неозброєним оком. Відповідно до Європейської фармакопеї вимоги до цього показника є наступними: Для 100 мл: ≤6000 частинок розміром ≥10 мкм на контейнер ≤600 частинок розміром ≥25 мкм на контейнер Для 200 мл: ≤25 частинок розміром ≥10 мкм на мл ≥3 частки розміром ≥25 мкм на мл Результати, отримані для тестованих препаратів, були наступними: pH Матеріал Об’єм 100 мл ПВХ 200 мл 100 мл ПП 200 мл 6,5 100 мл Скло 200 мл 100 мл ПЕ 200 мл Без автоклавування 556 частинок/пакет ≥10 мкм 100 частинок/пакет ≥25 мкм 4 частинки/мл ≥10 мкм 0 частинок/мл ≥25 мкм 489 частинок/пакет ≥10 мкм 89 частинок/пакет ≥ 25 мкм 4 частинки/мл ≥10 мкм 1 частинка/мл ≥25 мкм 889 частинок/контейнер ≥10 мкм 167 частинок/контейнер ≥25 мкм 4 частинки/мл ≥10 мкм 1 частинка/мл ≥25 мкм 2544 частинки/контейнер ≥10 мкм 67 частинок/контейнер ≥25 мкм 11 частинок/мл ≥10 мкм 1 частинка/мл ≥25 мкм 13 Автоклавовані 1112 частинок/пакет ≥10 мкм 67 частинок/пакет ≥25 мкм 16 частинок/мл ≥10 мкм 1 частинка/мл ≥25 мкм 300 частинок/пакет ≥10 мкм 33 частинок/пакет ≥25 мкм 2 частинки/мл ≥10 мкм 0 частинок/мл ≥25 мкм 411 частинок/контейнер ≥10 мкм 67 частинок/контейнер ≥25 мкм 8 частинок/мл ≥10 мкм 1 частинка/мл ≥25 мкм 2967 частинок/контейнер ≥10 мкм 589 частинок/контейнер ≥25 мкм 12 частинок/мл ≥10 мкм 1 частинка/мл ≥25 мкм UA 103290 C2 pH Матеріал Об’єм 100 мл ПВХ 200 мл 100 мл ПП 200 мл 7 100 мл Скло 200 мл 100 мл ПЕ 200 мл 100 мл ПВХ 200 мл 100 мл ПП 200 мл 7,5 100 мл Скло 200 мл 100 мл ПЕ 200 мл 100 мл ПВХ 200 мл 8 100 мл ПП 200 мл Без автоклавування 533 частинки/пакет ≥10 мкм 156 частинок/пакет ≥25 мкм 6 частинок/мл ≥10 мкм 0 частинок/мл ≥25 мкм 389 частинок/пакет ≥10 мкм 78 частинок/пакет ≥25 мкм 2 частинки/мл ≥10 мкм 1 частинка/мл ≥25 мкм 467 частинок/контейнер ≥10 мкм 78 частинок/контейнер ≥25 мкм 9 частинок/мл ≥10 мкм 1 частинка/мл ≥25 мкм 1322 частинки/контейнер ≥10 мкм 100 частинок/контейнер ≥25 мкм 15 частинок/мл ≥10 мкм 1 частинка/мл ≥25 мкм 522 частинки/пакет ≥10 мкм 67 частинок/пакет ≥25 мкм 7 частинок/мл ≥10 мкм 1 частинка/мл ≥25 мкм 456 частинок/пакет ≥10 мкм 44 частинки/пакет ≥25 мкм 3 частинки/мл ≥10 мкм 0 частинок/мл ≥25 мкм 911 частинок/контейнер ≥10 мкм 133 частинки/контейнер ≥25 мкм 6 частинок/мл ≥10 мкм 1 частинка/мл ≥25 мкм 2033 частинки/контейнер ≥10 мкм 122 частинки/контейнер ≥25 мкм 23 частинки/мл ≥10 мкм 1 частинка/мл ≥25 мкм 500 частинок/пакет ≥10 мкм 89 частинок/пакет ≥25 мкм 3 частинки/мл ≥10 мкм 0 частинок/мл ≥25 мкм 400 частинок/пакет ≥10 мкм 44 частинки/пакет ≥25 мкм 6 частинок/мл ≥10 мкм 0 частинок/мл ≥25 мкм 14 Автоклавовані 411 частинок/пакет ≥10 мкм 67 частинок/пакет ≥25 мкм 5 частинок/мл ≥10 мкм 2 частинки/мл ≥25 мкм 667 частинок/пакет ≥10 мкм 33 частинки/пакет ≥25 мкм 5 частинок/мл ≥10 мкм 1 частинка/мл ≥25 мкм 922 частинки/контейнер ≥10 мкм 89 частинок/контейнер ≥25 мкм 4 частинки/мл ≥10 мкм 0 частинок/мл ≥25 мкм 4733 частинки/контейнер ≥10 мкм 500 частинок/контейнер ≥25 мкм 15 частинок/мл ≥10 мкм 2 частинки/мл ≥25 мкм 3189 частинок/пакет ≥10 мкм 322 частинки/пакет ≥25 мкм 10 частинок/мл ≥10 мкм 0 частинок/мл ≥25 мкм 933 частинки/пакет ≥10 мкм 56 частинок/пакет ≥25 мкм 4 частинки/мл ≥10 мкм 0 частинок/мл ≥25 мкм 156 частинок/контейнер ≥10 мкм 11 частинок/контейнер ≥25 мкм 3 частинки/мл ≥10 мкм 0 частинок/мл ≥25 мкм 1022 частинки/контейнер ≥10 мкм 56 частинок/контейнер ≥25 мкм 22 частинки/мл ≥10 мкм 2 частинки/мл ≥25 мкм 544 частинки/пакет ≥10 мкм 44 частинки/пакет ≥25 мкм 13 частинок/мл ≥10 мкм 1 частинка/мл ≥25 мкм 222 частинки/пакет ≥10 мкм 33 частинки/пакет ≥25 мкм 2 частинки/мл ≥10 мкм 0 частинок/мл ≥25 мкм UA 103290 C2 pH Матеріал Об’єм 100 мл Скло 200 мл 100 мл ПЕ 200 мл 100 мл ПВХ 200 мл 100 мл ПП 200 мл 8,5 100 мл Скло 200 мл 100 мл ПЕ 200 мл 100 мл ПВХ 200 мл 100 мл ПП 200 мл 9 100 мл Скло 200 мл 100 мл ПЕ 200 мл Без автоклавування 2367 частинок/контейнер ≥10 мкм 111 частинок/контейнер ≥25 мкм 6 частинок/мл ≥10 мкм 1 частинка/мл ≥25 мкм 667 частинок/контейнер ≥10 мкм 56 частинок/контейнер ≥25 мкм 13 частинок/мл ≥10 мкм 2 частинки/мл ≥25 мкм 444 частинки/пакет ≥10 мкм 33 частинки/пакет ≥25 мкм 5 частинок/мл ≥10 мкм 1 частинка/мл ≥25 мкм 222 частинки/пакет ≥10 мкм 67 частинок/пакет ≥25 мкм 2 частинки/мл ≥10 мкм 0 частинок/мл ≥25 мкм 978 частинок/контейнер ≥10 мкм 111 частинок/контейнер ≥25 мкм 6 частинок/мл ≥10 мкм 0 частинок/мл ≥25 мкм 722 частинки/контейнер ≥10 мкм 100 частинок/контейнер ≥25 мкм 4 частинки/мл ≥10 мкм 1 частинка/мл ≥25 мкм Автоклавовані 444 частинки/контейнер ≥10 мкм 22 частинки/контейнер ≥25 мкм 2 частинки/мл ≥10 мкм 0 частинок/мл ≥25 мкм 2300 частинок/контейнер ≥10 мкм 22 частинки/контейнер ≥25 мкм 12 частинок/мл ≥10 мкм 1 частинка/мл ≥25 мкм 978 частинок/пакет ≥10 мкм 44 частинки/пакет ≥25 мкм 7 частинок/мл ≥10 мкм 1 частинка/мл ≥25 мкм 467 частинок/пакет ≥10 мкм 44 частинки/пакет ≥25 мкм 4 частинки/мл ≥10 мкм 0 частинок/мл ≥25 мкм 267 частинок/контейнер ≥10 мкм 44 частинки/контейнер ≥25 мкм 2 частинки/мл ≥10 мкм 0 частинок/мл ≥25 мкм 1656 частинок/контейнер ≥10 мкм 167 частинок/контейнер ≥25 мкм 9 частинок/мл ≥10 мкм 1 частинка/мл ≥25 мкм 2689 частинок/пакет ≥10 344 частинки/пакет ≥10 мкм мкм 100 частинок/пакет ≥25 89 частинок/пакет ≥25 мкм мкм 4 частинки/мл ≥10 мкм 37 частинок/мл ≥10 мкм 0 частинок/мл ≥25 мкм 1 частинка/мл ≥25 мкм 667 частинок/пакет ≥10 1200 частинок/пакет ≥10 мкм мкм 89 частинок/пакет ≥25 мкм 56 частинок/пакет ≥25 мкм 3 частинки/мл ≥10 мкм 16 частинок/мл ≥10 мкм 0 частинок/мл ≥25 мкм 2 частинки/мл ≥25 мкм 800 частинок/контейнер 278 частинок/контейнер ≥10 мкм ≥10 мкм 67 частинок/контейнер ≥25 44 частинки/контейнер ≥25 мкм мкм 3 частинки/мл ≥10 мкм 2 частинки/мл ≥10 мкм 0 частинок/мл ≥25 мкм 0 частинок/мл ≥25 мкм 1978 частинок/контейнер 2722 частинки/контейнер ≥10 мкм ≥10 мкм 211 частинок/контейнер 4 частинки/контейнер ≥25 ≥25 мкм мкм 8 частинок/мл ≥10 мкм 14 частинки/мл ≥10 мкм 1 частинка/мл ≥25 мкм 2 частинки/мл ≥25 мкм 15 UA 103290 C2 pH Матеріал Об’єм 100 мл ПВХ 200 мл 100 мл ПП 200 мл 9,5 100 мл Скло 200 мл 100 мл ПЕ 200 мл (*1) 5 10 15 20 25 Без автоклавування 611 частинок/пакет ≥10 мкм 133 частинки/пакет ≥25 мкм Автоклавовані 28756 частинок/пакет ≥10 мкм 4456 частинок/пакет ≥25 (*1) мкм 721 частинка/мл ≥10 мкм 16 частинок/мл ≥10 мкм 119 частиноки/мл ≥25 2 частинки/мл ≥25 мкм (*1) мкм 789 частинок/пакет ≥10 3878 частинок/пакет ≥10 мкм мкм 100 частинок/пакет ≥25 878 частинок/пакет ≥25 (*1) мкм мкм 3 частинки/мл ≥10 мкм 18 частинок/мл ≥10 мкм (*1) 0 частинок/мл ≥25 мкм 3 частинки/мл ≥25 мкм 989 частинок/контейнер 389 частинок/контейнер ≥10 мкм ≥10 мкм 44 частинки/контейнер ≥25 0 частинок/контейнер ≥25 мкм мкм 6 частинок/мл ≥10 мкм 2 частинки/мл ≥10 мкм 1 частинка/мл ≥25 мкм 0 частинок/мл ≥25 мкм 1189 частинок/контейнер 1911 частинок/контейнер ≥10 мкм ≥10 мкм 144 частинки/контейнер 111 частинок/контейнер ≥25 мкм ≥25 мкм 10 частинок/мл ≥10 мкм 14 частинки/мл ≥10 мкм 1 частинка/мл ≥25 мкм 2 частинки/мл ≥25 мкм З’являється велика кількість частинок і ниток, видимих в суспензії. З даної таблиці можна бачити, що в препаратах, упакованих в скляні контейнери, у всіх випадках рівень невидимих неозброєним оком частинок знаходиться в межах вимог, з невеликою тенденцією до зниження рівня вказаних частинок по мірі підвищення значення pH препарату, зокрема, у випадку препаратів, підданих автоклавуванню, хоча, в будь-якому випадку, можна зробити висновок про те, що для скла прийнятний діапазон значень pH препаратів включає в себе всі протестовані значення pH, тобто від 6,5 до 9,5. Однак, у випадку препаратів, упакованих в ПП, ПВХ і ПЕ, при високих значеннях pH (pH=9,5) в автоклавованих препаратах відбувається збільшення кількості невидимих неозброєним оком частинок, зокрема, у випадку ПВХ, і в меншій мірі у випадку ПП і ПЕ. Тому, у випадку цих матеріалів прийнятний діапазон значень pH препаратів повинен включати в себе значення від 6,5 до 9,0. Таким чином, можна зробити висновок про те, що хоча препарати ібупрофену для ін'єкції відповідно до даного винаходу в більшості випадків можуть використовуватися в діапазоні значень pH від 7,0 до 9,5, найбільш переважними варіантами здійснення даного винаходу можуть бути, наприклад, наступні: - Коли препарат знаходиться в контейнерах зі скла, то значення pH препарату складає від 7,0 до 9,5, більш переважно, від 8,0 до 9,0 і найбільш переважно, приблизно 8,5; - Коли препарат знаходиться в контейнерах з ПЕ, то значення pH препарату складає від 7,0 до 9,0, більш переважно, від 8,0 до 9,0 і найбільш переважно, приблизно 8,5; - Коли препарат знаходиться в контейнерах з ПП, то значення pH препарату складає від 7,5 до 9,0, більш переважно, від 8,0 до 9,0 і найбільш переважно приблизно 8,5; - Коли препарат знаходиться в контейнерах з ПВХ, то значення pH препарату складає від 8,0 до 9,0 і більш переважно приблизно 8,5. Ці препарати здатні після автоклавування зберігати рівні концентрації активного компонента в прийнятних значеннях з прийнятною зміною інших важливих параметрів цих композицій, таких як збільшення вмісту небажаних домішок, зміна значення pH або збільшення кількості невидимих неозброєним оком частинок, коли препарати даного винаходу піддається автоклавуванню. 30 16 UA 103290 C2 ФОРМУЛА ВИНАХОДУ 5 10 15 20 25 30 1. Фармацевтична композиція ібупрофену для ін'єкції, що містить водний розчин ібупрофену і трометамол, в якій концентрація ібупрофену складає від 2 до 6 мг/мл, концентрація трометамолу складає від 1,8 до 5,8 мг/мл і значення рН яких складає від 7,0 до 9,5. 2. Фармацевтична композиція ібупрофену для ін'єкції за п. 1, в якій концентрація ібупрофену становить приблизно 4 мг/мл. 3. Фармацевтична композиція за п. 1 або 2, в якій концентрація трометамолу становить приблизно 3,8 мг/мл. 4. Фармацевтична композиція за будь-яким з попередніх пунктів 1-3, яка є такою, що стерилізується нагріванням шляхом автоклавування при температурі від 110 °C до 130 °C протягом періоду часу від 2 до 190 хвилин. 5. Фармацевтична композиція за п. 4, де композиція є такою, що стерилізується нагріванням шляхом автоклавування при температурі 121 °C протягом 15 хвилин. 6. Фармацевтична композиція ібупрофену для ін'єкції за будь-яким з попередніх пунктів 1-5, де ця композиція знаходиться в контейнерах зі скла і має значення рН від 7,0 до 9,5. 7. Фармацевтична композиція ібупрофену для ін'єкції за будь-яким з попередніх пунктів 1-5, де ця композиція знаходиться в контейнерах з поліетилену і має значення рН від 7,0 до 9,0. 8. Фармацевтична композиція ібупрофену для ін'єкції за будь-яким з попередніх пунктів 1-5, де ця композиція знаходиться в контейнерах з поліпропілену і має значення рН від 7,5 до 9,0. 9. Фармацевтична композиція ібупрофену для ін'єкції за будь-яким з попередніх пунктів 1-5, де ця композиція знаходиться в контейнерах з ПВХ і має значення рН від 8,0 до 9,0. 10. Фармацевтична композиція за будь-яким з попередніх пунктів, яка має значення рН приблизно 8,5. 11. Фармацевтична композиція за будь-яким з попередніх пунктів, що додатково містить сіль в кількості, необхідній для надання композиції осмоляльності, що дорівнює приблизно 300 мОсм/кг. 12. Фармацевтична композиція за п. 11, в якій сіль являє собою NaCl в концентрації приблизно 7,7 мг/мл. 13. Композиція за будь-яким з пунктів 1-12 для застосування для лікування болю, запалення або жару. 14. Композиція за п. 13, яка розфасована в контейнери ємністю 100 мл або 200 мл. 15. Застосування фармацевтичної композиції за будь-яким з пунктів 1-12 у виробництві лікарського препарату для лікування болю, запалення або жару. 35 Комп’ютерна верстка А. Крулевський Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 17
ДивитисяДодаткова інформація
Назва патенту англійськоюPharmaceutical composition of ibuprofen for injection
Автори англійськоюOrtuzar Andechaga, Ignacio, Ortuzar Gutierrez, Mario
Автори російськоюОртусар Андечага Игнасио, Ортусар Гутьеррес Марио
МПК / Мітки
МПК: A61K 47/18, A61P 29/00, A61K 9/10, A61K 31/19
Мітки: ібупрофену, фармацевтична, ін'єкції, композиція
Код посилання
<a href="https://ua.patents.su/19-103290-farmacevtichna-kompoziciya-ibuprofenu-dlya-inehkci.html" target="_blank" rel="follow" title="База патентів України">Фармацевтична композиція ібупрофену для ін’єкції</a>
Попередній патент: Спосіб мюллер-матричної діагностики біологічних тканин
Наступний патент: Селекційна молотарка соняшникова
Випадковий патент: Роздільник частотних каналів