Нові вакцинні композиції, що містять емульсію типу “масло у воді”
Номер патенту: 84024
Опубліковано: 10.09.2008
Автори: Де-Гуйє-Блеше Стефані Марі-Катрін, Нордгрен Роберт М., Парізо Алексіс Гі Андре, Шарер Катрін
Формула / Реферат
1. Вакцинна композиція, що включає емульсію для ін'єкцій типу "масло у воді"(М/В), яка включає:
(і) водний розчин, який містить щонайменше один імуноген;
(іі) мінеральне масло;
(ііі) неіонний ліпофільний детергент;
(iv) неіонний гідрофільний детергент із високим значенням гідрофільно-ліпофільного балансу (HLB) більшим за 13 і меншим за 40; і
(v) неіонний гідрофільний детергент із низьким значенням гідрофільно-ліпофільного балансу (HLB) більшим за 9 і меншим за 13.
2. Композиція за п. 1, у якій неіонний гідрофільний детергент із високим значенням HLB знаходиться в концентрації від 0,1 до 1,5 % при вираженні її за масою на об'єм емульсії (мас. %).
3. Композиція за п. 2, яка відрізняється тим, що в ній вміст детергентів складає від 4 % до 6 % мас.
4. Композиція за п. 1, яка відрізняється тим, що в ній неіонний гідрофільний детергент із низьким значенням HLB знаходиться в концентрації від 1 % до 8 % при вираженні її за масою на об'єм емульсії (мас. %).
5. Композиція за п. 1, яка відрізняється тим, що в ній неіонний ліпофільний детергент знаходиться в концентрації від 0,1 % до 2,5 % при вираженні її за масою на об'єм емульсії (мас. %).
6. Композиція за п. 1, яка відрізняється тим, що в ній мінеральне масло знаходиться в концентрації від 20 % до 40 % об.
7. Композиція за п. 1, яка відрізняється тим, що в ній емульсія має температуру інверсії фаз (PIT) від 33 до 66 °С.
8. Композиція за п. 1, яка відрізняється тим, що в ній неіонний гідрофільний детергент із низьким значенням HLB вибраний із групи, яка складається з етоксильованих жирнокислотних триефірів сорбіту, етоксильованих жирнокислотних діефірів сорбіту, етоксильованих жирнокислотних моноефірів сорбіту, етоксильованих жирних спиртів, етоксильованих жирних кислот, етоксильованої касторової олії та їх комбінацій.
9. Композиція за п. 8, яка відрізняється тим, що в ній ефір у даному етоксильованому жирнокислотному ефірі вибраний із групи, яка складається з олеату, пальмітату, стеарату, ізостеарату, лаурату та їх комбінацій.
10. Композиція за п. 1, яка відрізняється тим, що в ній неіонний ліпофільний детергент вибраний із групи, яка складається з жирнокислотних ефірів сорбіту, жирнокислотних ефірів маніту, діетоксильованих жирнокислотних ефірів маніту, триетоксильованих жирнокислотних ефірів маніту, тетраетоксильованих жирнокислотних ефірів маніту та їх комбінацій.
11. Композиція за п. 10, яка відрізняється тим, що в ній ефір у жирнокислотних ефірах вибраний із групи, яка складається з олеату, пальмітату, стеарату, ізостеарату, лаурату та їх комбінацій.
12. Композиція за п. 1, яка відрізняється тим, що в ній неіонний гідрофільний детергент із високим значенням HLB вибраний із групи, яка складається з етоксильованих жирнокислотних моноефірів сорбіту, етоксильованих жирних спиртів, етоксильованих жирних кислот, неіонних блок-співполімерів та їх комбінацій.
13. Композиція за п. 12, яка відрізняється тим, що етоксильований моноефір сорбіту вибраний із групи, яка складається з етоксильованих монолаурату сорбіту, етоксильованих монопальмітату сорбіту, етоксильованих моностеарату сорбіту, етоксильованих моноолеату сорбіту та їх комбінацій.
14. Композиція за п. 1, яка відрізняється тим, що в ній мінеральне масло вибране з групи, яка складається з парафінового масла, сквалену, пристану, поліізобутенового масла, гідрогенованого поліізобутенового масла, полідеценового масла, поліізопренового масла, поліізопропенового масла та їх комбінацій.
15. Композиція за п. 1, яка відрізняється тим, що включає парафінове масло, жирнокислотний моноефір сорбіту як неіонний ліпофільний детергент, етоксильований жирнокислотний триефір сорбіту як неіонний гідрофільний детергент з низьким значенням HLB та неіонний блок-співполімер як неіонний гідрофільний детергент з високим значенням HLB.
16. Композиція за п. 15, яка відрізняється тим, що в ній жирнокислотний моноефір сорбіту є моноолеатом сорбіту, етоксильований жирнокислотний триефір сорбіту є етоксильованим триолеатом сорбіту і неіонний блок-співполімер є полімером поліоксіетилен/поліоксипропілену (РОЕ-РОР).
17. Композиція за п. 16, яка відрізняється тим, що в ній парафінове масло знаходиться в концентрації від 10 % до 40 % об., моноолеат сорбіту знаходиться в концентрації від 0,2 % до 1,5 % мас., етоксильований триолеат сорбіту знаходиться в концентрації від 2 % до 5 % мас. і РОЕ-POP знаходиться в концентрації від 0,1 % до 0,5 % мас.
18. Композиція за п. 16, яка відрізняється тим, що в ній парафінове масло знаходиться в концентрації 29,3 об. %, моноолеат сорбіту знаходиться в концентрації 0,6 мас. %, етоксильований триолеат сорбіту знаходиться в концентрації 3,4 мас. % і РОЕ-РОР знаходиться в концентрації 0,25 мас. %.
19. Композиція за п. 1, яка відрізняється тим, що в ній імуноген вибраний із групи, яка складається з інактивованих патогенів, ослаблених патогенів, імуногенних субодиниць, рекомбінантних експресійних векторів і плазмід або їх комбінацій.
20. Композиція за п. 19, яка відрізняється тим, що в ній патоген вибраний із групи, яка складається з вірусів, бактерій, грибів, протозойних паразитів або їх комбінацій.
21. Композиція за п. 19, яка відрізняється тим, що в ній імуноген є інактивованим вірусом.
22. Композиція за п. 21, яка відрізняється тим, що в ній імуноген є інактивованим вірусом - свинячим цирковірусом 2-го типу (PCV-2).
23. Композиція за п. 19, яка відрізняється тим, що в ній імуноген є інактивованою бактерією Mycoplasma hyopneumoniae.
24. Спосіб індукування імунологічної відповіді у тварини проти патогена, який включає введення даній тварині вакцинної композиції за п. 19.
25. Спосіб за п. 24, який відрізняється тим, що імуноген вибраний із групи, яка складається з інактивованих патогенів, ослаблених патогенів, імуногенних субодиниць, рекомбінантних експресійних векторів і плазмід або їх комбінацій.
26. Спосіб за п. 25, який відрізняється тим, що в ньому імуноген вибраний із групи, яка складається з інактивованих бактерій Mycoplasma hyopneumoniae, інактивованого вірусу - свинячого цирковірусу 2-го типу (PCV-2) або їх комбінацій.
27. Спосіб за п. 25, який відрізняється тим, що вакцинна композиція вводиться за одноразовою схемою.
28. Спосіб за п. 24, який відрізняється тим, що тварина вибрана з групи, яка складається з великої рогатої худоби, свиней, коней, собак, кішок, курей, качок і індичок.
29. Спосіб за п. 27, який відрізняється тим, що введення є внутрішньом'язовою, інтрадермальною або підшкірною ін'єкцією.
30. Спосіб за п. 29, який відрізняється тим, що введення здійснюється за допомогою безголкового ін'єктора.
Текст
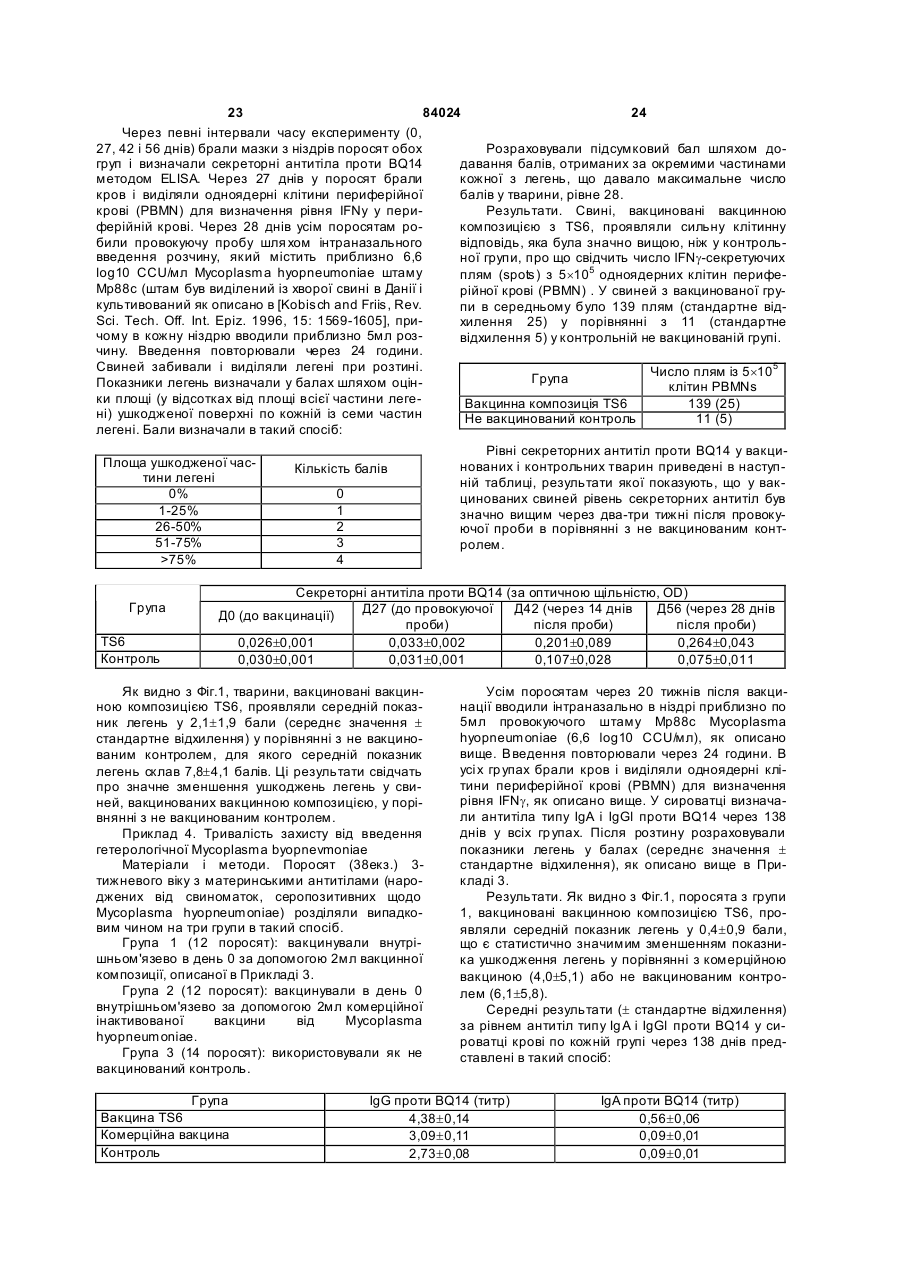
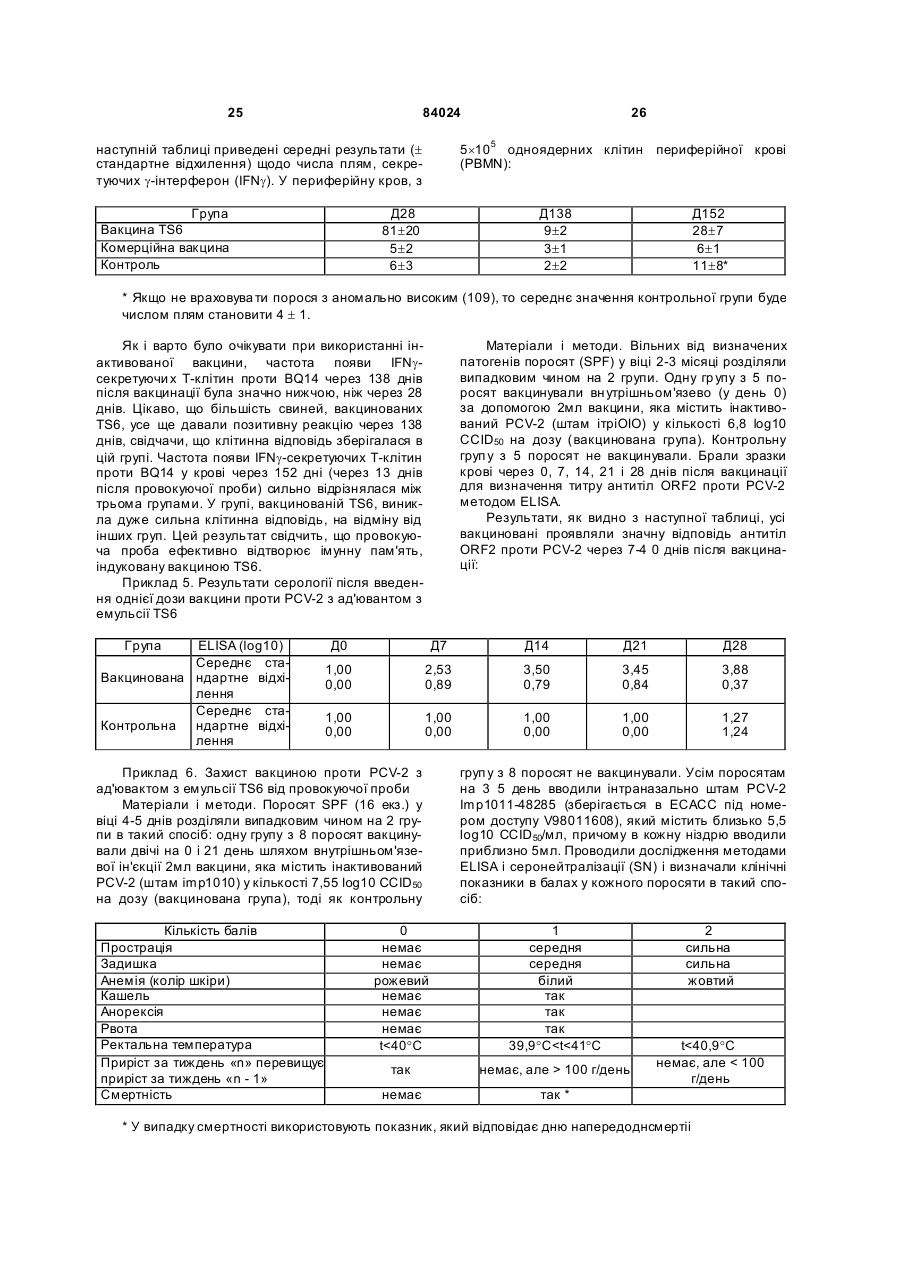
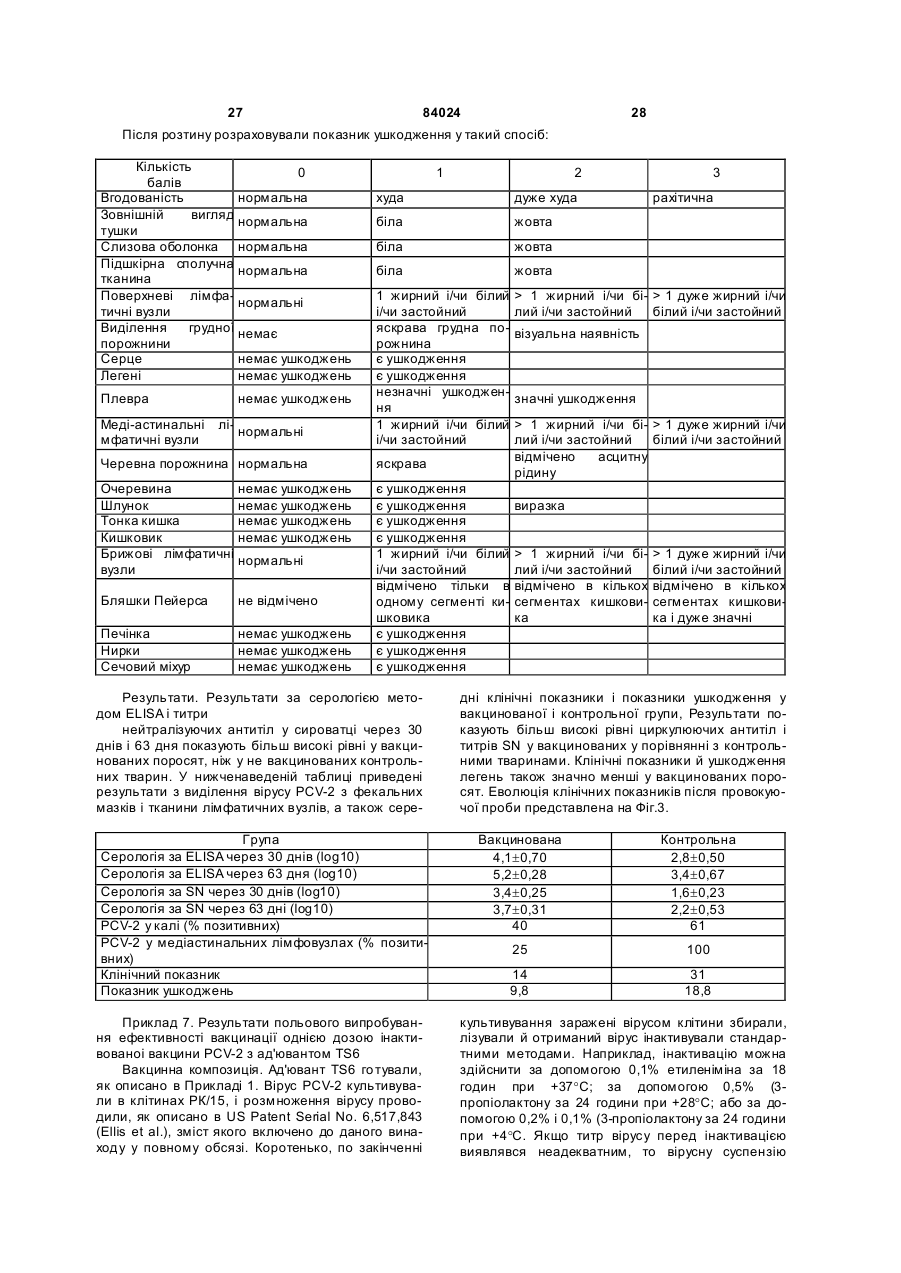
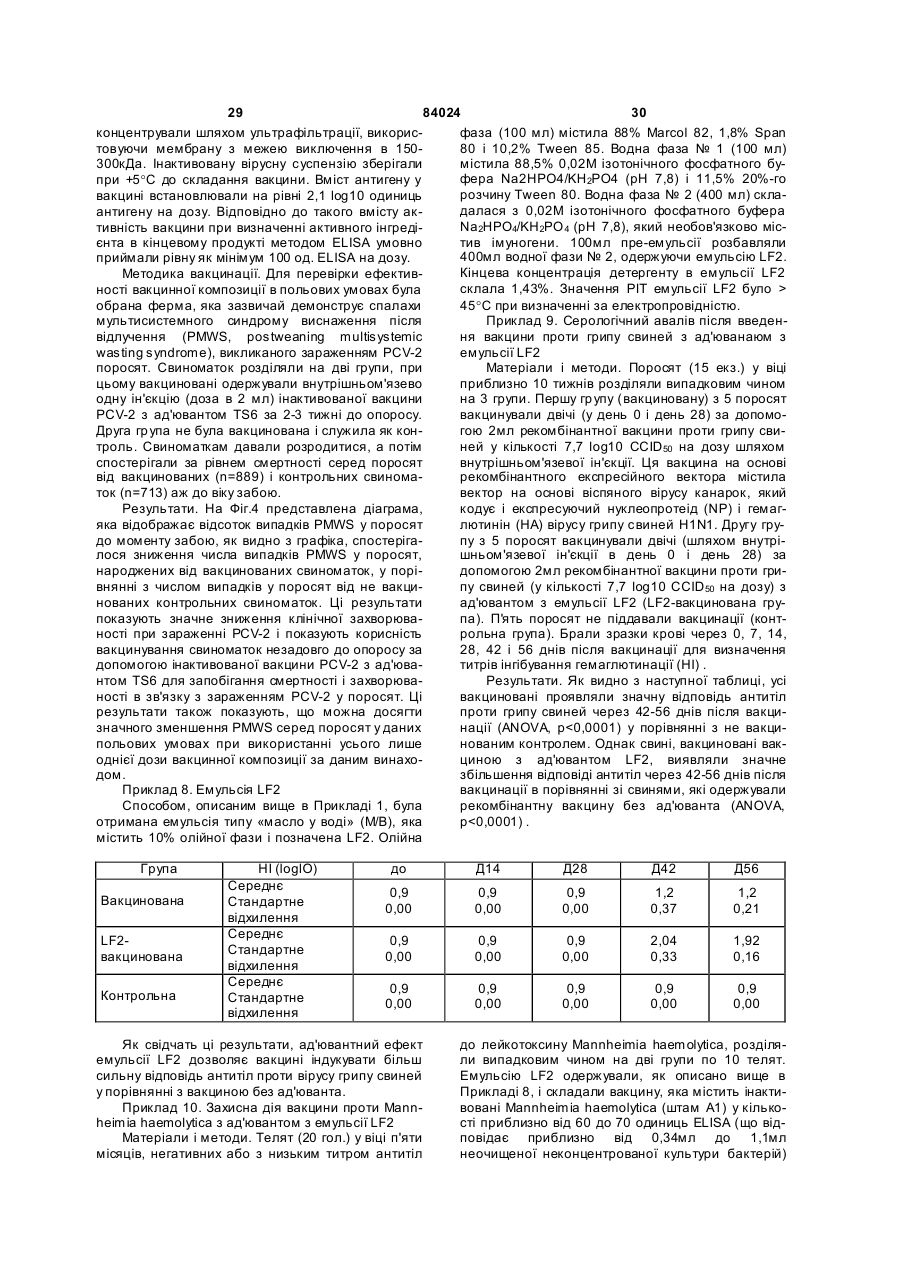
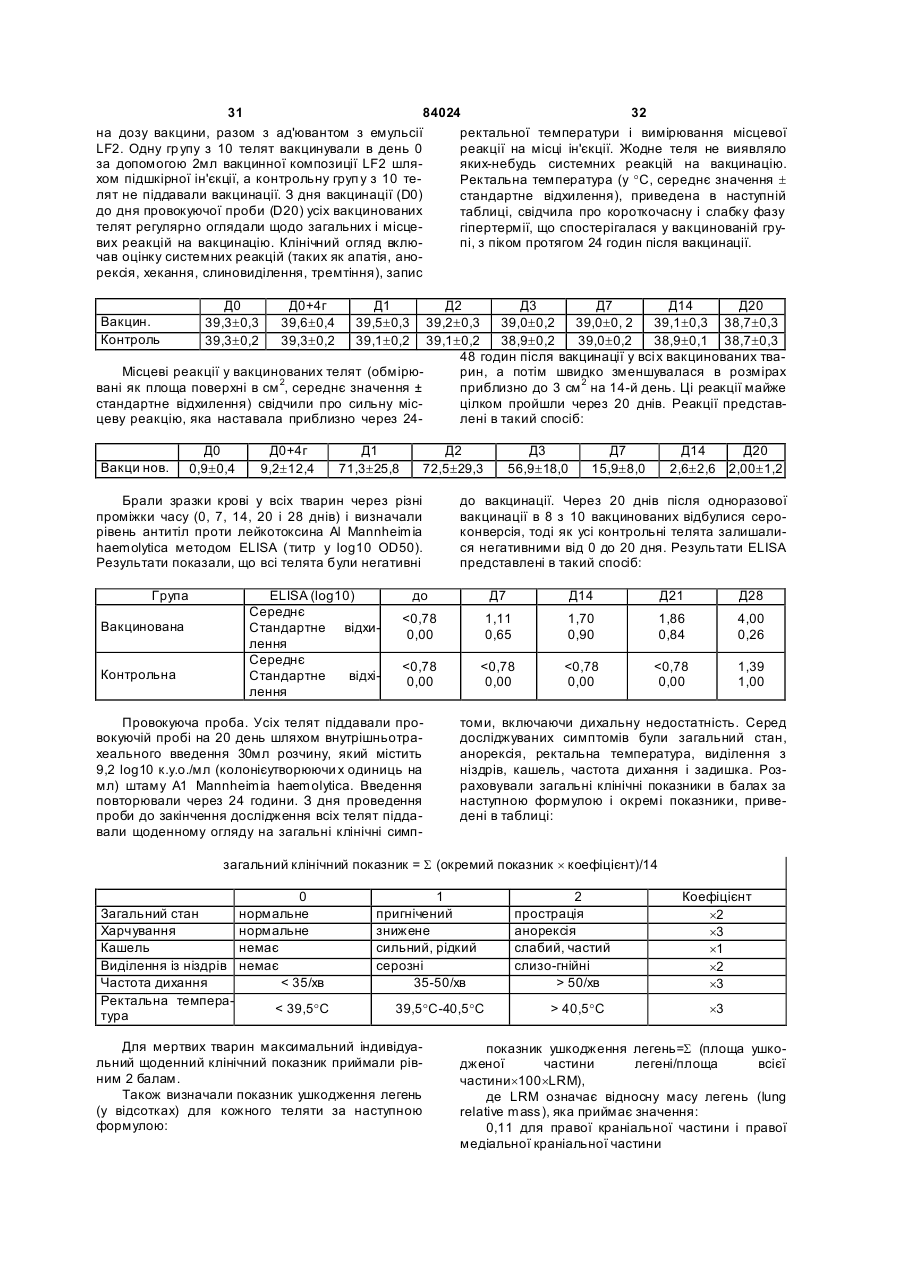
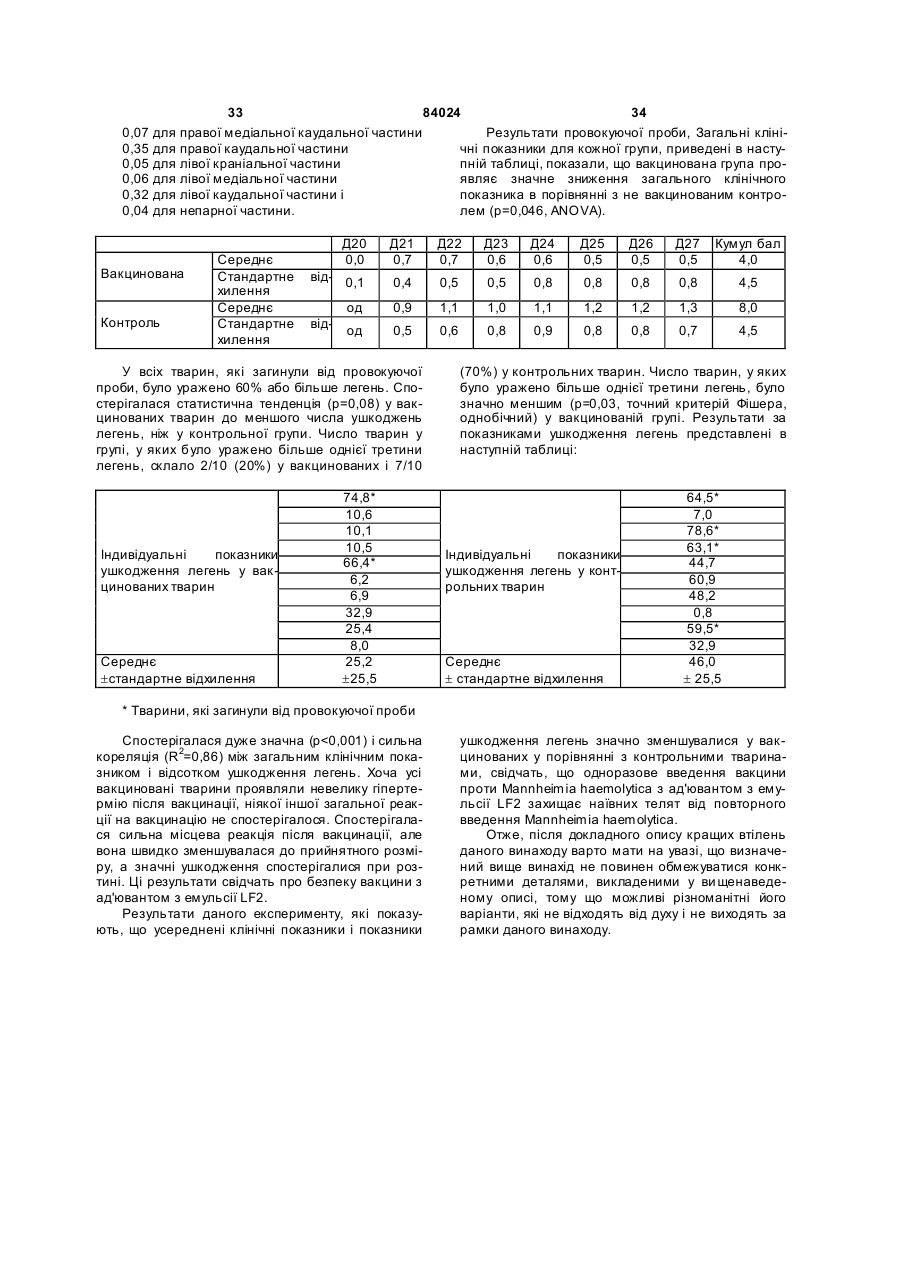
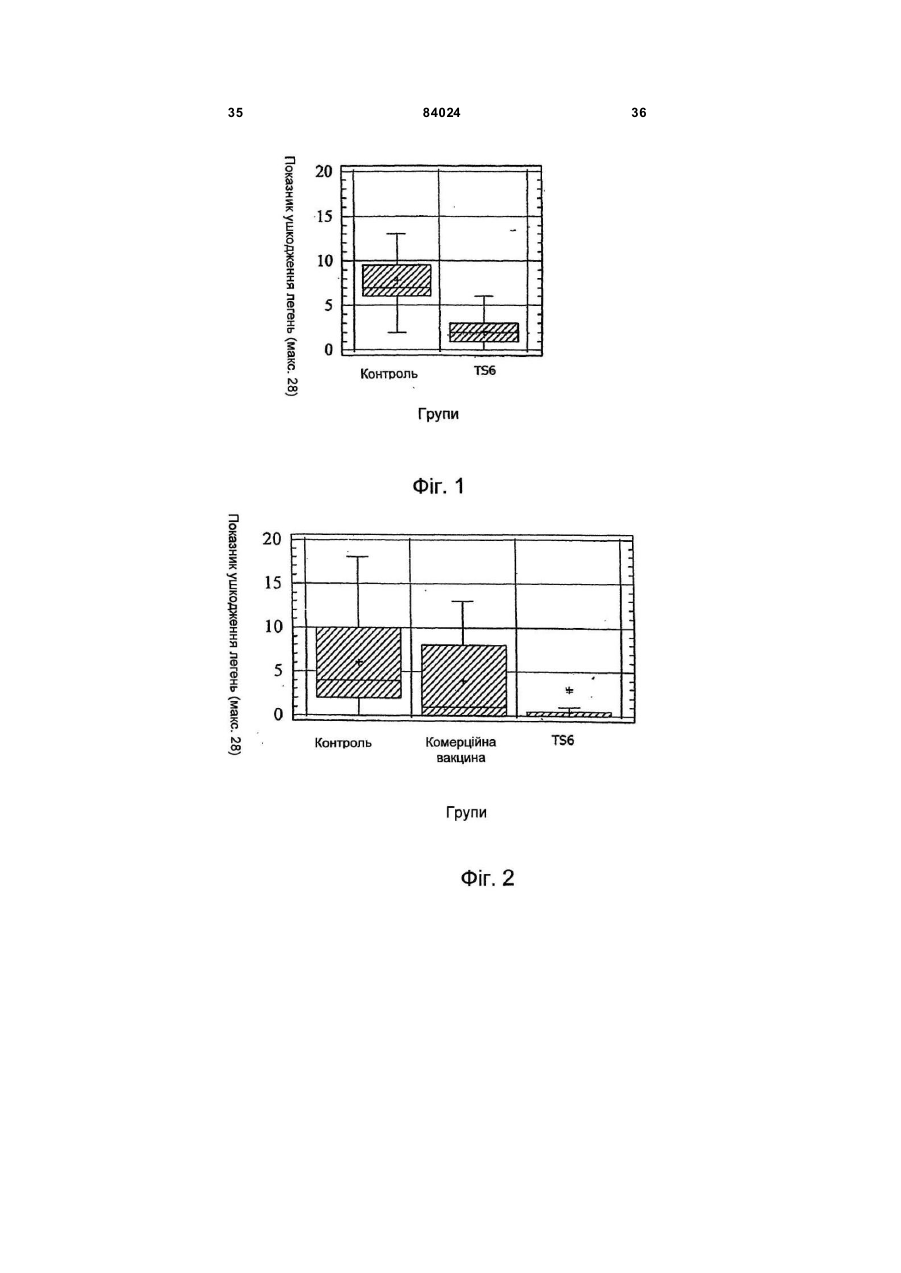
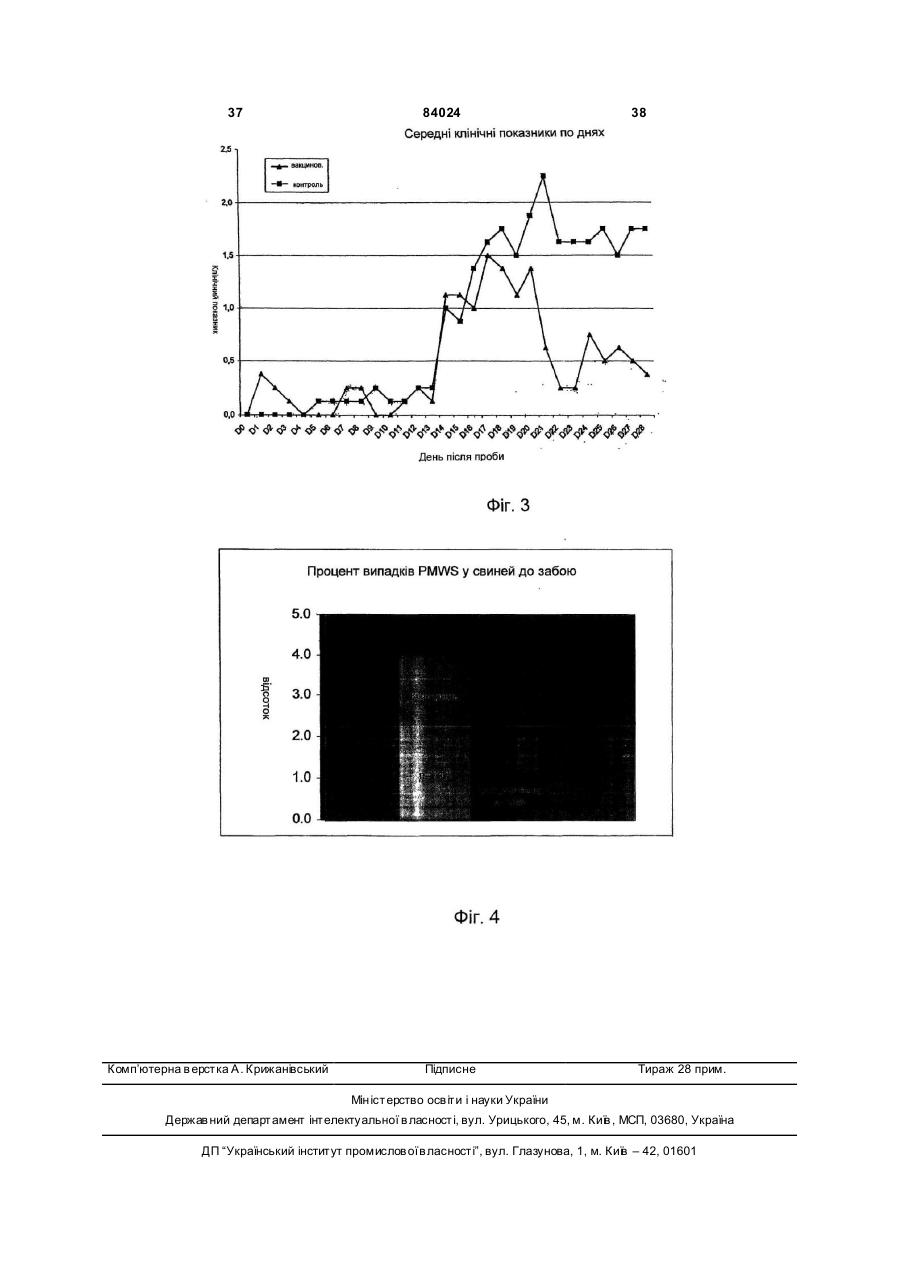
1. Вакцинна композиція, що включає емульсію для ін'єкцій типу "масло у воді"(М/В), яка включає: (і) водний розчин, який містить щонайменше один імуноген; (іі) мінеральне масло; (ііі) неіонний ліпофільний детергент; (iv) неіонний гідрофільний детергент із високим значенням гідрофільно-ліпофільного балансу (HLB) більшим за 13 і меншим за 40; і (v) неіонний гідрофільний детергент із низьким значенням гідрофільно-ліпофільного балансу (HLB) більшим за 9 і меншим за 13. 2. Композиція за п. 1, у якій неіонний гідрофільний детергент із високим значенням HLB знаходиться в концентрації від 0,1 до 1,5 % при вираженні її за масою на об'єм емульсії (мас. %). 3. Композиція за п. 2, яка відрізняється тим, що в ній вміст детергентів складає від 4 % до 6 % мас. 4. Композиція за п. 1, яка відрізняється тим, що в ній неіонний гідрофільний детергент із низьким значенням HLB знаходиться в концентрації від 1 % до 8 % при вираженні її за масою на об'єм емульсії (мас. %). 5. Композиція за п. 1, яка відрізняється тим, що в ній неіонний ліпофільний детергент знаходиться в 2 (19) 1 3 84024 4 ту сорбіту, етоксильованих монопальмітату сорбіімуногенних субодиниць, рекомбінантних експрету, етоксильованих моностеарату сорбіту, етоксисійних векторів і плазмід або їх комбінацій. льованих моноолеату сорбіту та їх комбінацій. 20. Композиція за п. 19, яка відрізняється тим, що 14. Композиція за п. 1, яка відрізняється тим, що в ній патоген вибраний із групи, яка складається з в ній мінеральне масло вибране з групи, яка склавірусів, бактерій, грибів, протозойних паразитів дається з парафінового масла, сквалену, пристаабо їх комбінацій. ну, поліізобутенового масла, гідрогенованого полі21. Композиція за п. 19, яка відрізняється тим, що ізобутенового масла, полідеценового масла, в ній імуноген є інактивованим вірусом. поліізопренового масла, поліізопропенового масла 22. Композиція за п. 21, яка відрізняється тим, що та їх комбінацій. в ній імуноген є інактивованим вірусом - свинячим 15. Композиція за п. 1, яка відрізняється тим, що цирковірусом 2-го типу (PCV-2). включає парафінове масло, жирнокислотний мо23. Композиція за п. 19, яка відрізняється тим, що ноефір сорбіту як неіонний ліпофільний детергент, в ній імуноген є інактивованою бактерією етоксильований жирнокислотний триефір сорбіту Mycoplasma hyopneumoniae. як неіонний гідрофільний детергент з низьким зна24. Спосіб індукування імунологічної відповіді у ченням HLB та неіонний блок-співполімер як нетварини проти патогена, який включає введення іонний гідрофільний детергент з високим значенданій тварині вакцинної композиції за п. 19. ням HLB. 25. Спосіб за п. 24, який відрізняється тим, що 16. Композиція за п. 15, яка відрізняється тим, що імуноген вибраний із групи, яка складається з інакв ній жирнокислотний моноефір сорбіту є монотивованих патогенів, ослаблених патогенів, імуноолеатом сорбіту, етоксильований жирнокислотний генних субодиниць, рекомбінантних експресійних триефір сорбіту є етоксильованим триолеатом векторів і плазмід або їх комбінацій. сорбіту і неіонний блок-співполімер є полімером 26. Спосіб за п. 25, який відрізняється тим, що в поліоксіетилен/поліоксипропілену (РОЕ-РОР). ньому імуноген вибраний із групи, яка складається 17. Композиція за п. 16, яка відрізняється тим, що з інактивованих бактерій Mycoplasma в ній парафінове масло знаходиться в концентраhyopneumoniae, інактивованого вірусу - свинячого ції від 10 % до 40 % об., моноолеат сорбіту знахоцирковірусу 2-го типу (PC V-2) або їх комбінацій. диться в концентрації від 0,2 % до 1,5 % мас., ето27. Спосіб за п. 25, який відрізняється тим, що ксильований триолеат сорбіту знаходиться в вакцинна композиція вводиться за одноразовою концентрації від 2 % до 5 % мас. і РОЕ-POP знасхемою. ходиться в концентрації від 0,1 % до 0,5 % мас. 28. Спосіб за п. 24, який відрізняється тим, що 18. Композиція за п. 16, яка відрізняється тим, що тварина вибрана з групи, яка складається з велив ній парафінове масло знаходиться в концентракої рогатої худоби, свиней, коней, собак, кішок, ції 29,3 об. %, моноолеат сорбіту знаходиться в курей, качок і індичок. концентрації 0,6 мас. %, етоксильований триолеат 29. Спосіб за п. 27, який відрізняється тим, що сорбіту знаходиться в концентрації 3,4 мас. % і введення є внутрішньом'язовою, інтрадермальною РОЕ-РОР знаходиться в концентрації 0,25 мас. %. або підшкірною ін'єкцією. 19. Композиція за п. 1, яка відрізняється тим, що 30. Спосіб за п. 29, який відрізняється тим, що в ній імуноген вибраний із групи, яка складається з введення здійснюється за допомогою безголкового інактивованих патогенів, ослаблених патогенів, ін'єктора. Даний винахід відноситься до емульсій типу «масло у воді», застосування їх як ад'ювантів і фармацевтичних, імунологічних або вакцинних композицій, що їх містять. Застосування ад'ювантів у вакцинах добре відоме. Ад'ювант - це сполука, яка, у поєднанні з антигеном вакцини, підвищує імунну відповідь на вакцинний антиген у порівнянні з відповіддю, викликаною одним тільки антигеном. Серед підходів, які підсилюють імуногенність антигенів, є такі, при. яких вакцинні антигени стають корпускулярними, при яких вакцинні антигени піддаються полімеризації або емульгуванню, до них також відносяться методи інкапсулювання вакцинних антигенів, способи підвищення властивих організму реакцій цитокінів і способи доставки вакцинних антигенів на антиген-презентуючі клітини [Nossal, 1999, In: Fundamental Immunology. Paul (Ed.), LippincottRaven Publishers, Philadelphia, Pa.; Vogel and Powell, 1995, In: Vaccine Design. The Subunit and Adjuvant Approach. Powell and Newman (Eds.), Plenum Press, NY, N.Y., p. 141]. Оскільки ад'юванти відіграють важливу роль у посиленні імуногенності вакцинних антигенів, застосування ад'ювантів при складанні вакцин стало фактично повсюдним [Nossal, 1999, supra; Vogel and Powell, 1995, supra; див. також РСТ publication WO 97/18837, основні положення якої включені в даний винахід як посилання]. Традиційні ад'юванти, добре відомі в даній галузі, різноманітні за природою. Наприклад, вони можуть складатися з водонерозчинних неорганічних солей, ліпосом, міцел або емульсій, як ад'ювант Фрейнда. Інші ад'юванти можна знайти в роботі Vogel and Powell, 1995, приведеній вище. Незважаючи на те, що єдиного механізму дії ад'ювантів не існує, основною характеристикою є їхня здатність до значного посилення імунної відповіді на антиген вакцини в порівнянні з відповіддю, викликаною одним тільки антигеном [Nossal, 1999, supra; Vogel and Powell, 1995, supra]. У цьому відношенні деякі ад'юванти більш ефективно підсилюють гуморальні імунні відповіді, інші ад'юванти більш ефективно посилюють клітинні імунні відповіді [Vogel and Powell, 1995, supra], а ще одна гру 5 84024 6 па ад'ювантів посилює як гуморальні, так і клітинні гому флаконі, причому ад'ювант повинний бути імунні відповіді на вакцинні антигени [Vogel and змішаний з імуногеном або іншим вакцинним проPowell, 1995, supra]. дуктом перед застосуванням. Звичайно емульсії, які використовують в складі В одному кращому втіленні даний винахід певакцин включають суміш з олії, водного розчину і редбачає емульсію для ін'єкцій типу «масло у водетергентів. Деякі емульсії містять ліпофільний ді» (М/В), що включає: детергент типу Span 80 і гідрофільний детергент (1) водний розчин, який містить імуноген; типу Tween 80. Ці емульсії можуть містити і такі (2) мінеральну олію; сполуки, як лецитин або сапонін, які, як відомо, (3) неіонний ліпофільний детергент; мають властивості іонних детергентів. (4) неіонний гідрофільний детергент із низьким Однак у емульсій, що їх використовують як значенням гідрофільно-ліпофільного балансу ад'юванти, можуть спостерігатися проблеми стабі(HLB, hydrophilic-lipophilic balance), що включає льності, зокрема, при зберіганні або транспортуетоксильовані жирнокислотні диефіри сорбіту ванні. Це особливо вірно в тому випадку, коли ці (Звичайно мають значення HLB між 11 і 13) . композиції містять концентровані імуногени, особУ наступному кращому втіленні даний винахід ливо неочищені концентровані імуногени. Як прапередбачає емульсію для ін'єкцій типу «масло у вило, це трапляється з ад'ювантами, які викорисводі» (М/В), яка включає: товуються в інактивованих (убити х) вакцинах. Ця (1) водний розчин, що містить імуноген; проблема є ще більш значною для мультивалент(2) неіонний гідрофільний детергент із високим них вакцинних композицій, тому що в ни х імуногезначенням HLB - більшим 13 і меншим 40, особлини більш сконцентровані в тому ж об'ємі розріджуво HLB³13,5 і бажано HLB³14; вача. (3) мінеральну олію; Інша проблема застосування ад'ювантів пов'я(4) неіонний ліпофільний детергент; зана з ризиком виникнення ускладнень, таких як (5) неіонний гідрофільний детергент із низьким токсичність або місцеве запалення на місці ін'єкції. значенням HLB (значення HLB від 9 до 13). Наприклад, після ін'єкції може виникнути місцева У наступному кращому втіленні даний винахід запальна реакція і/чи гранульома. Для того щоб передбачає вакцинну композицію, яка включає уникнути таких небажаних реакцій, можна зменшинову емульсію, що містить, щонайменше, один ти вміст детергентів і інши х компонентів в емульсії, імуноген, придатний для запуску імунологічної однак таке зменшення може привести до зниження реакції у вакцинованих. Винахід також передбачає стабільності вакцинної композиції. Отже, існує потакі композиції, у яких емульсія діє як ад'ювант для треба в нових ад'ювантах і вакцинних композиціях, підвищення імунної відповіді, викликаної імуногеякі містять такі ад'юванти, для яких характерна ном, зокрема, для підвищення клітинної відповіді, підвищена безпека використання і стійкість. гуморальної відповіді або, бажано, обох видів відУ першому втіленні даний винахід передбачає повідей. нові емульсії типу «масло у воді» (М/В) з підвищеУ наступному кращому втіленні даний винахід ною стійкістю в присутності бактеріальних або віпередбачає вакцинну композицію, у якій імуноген, русних суспензій, особливо концентрованих і неособливо імуноген у ліофілізованому вигляді або у очищених, або слабо очищених. водному розчині, змішують з ад'ювантом за даним Інше втілення даного винаходу передбачає винаходом. Імуноген можна вибрати з групи, яка стійкі, безпечні і такі, що легко вводяться, зокрема, складається з інактивованих патогенів, ослаблепридатні для ін'єкцій емульсії типу М/В , які діють як них патогенів, субодиничних антигенів, рекомбінаносії для доставки фармацевтичної композиції, що нтних експресійних векторів, у тому числі плазмід, включає, щонайменше, один активний інгредієнт, і т.і. Патоген може мати бактеріальне, вірусне, яким, зокрема, може бути імуногеном. протозойне або грибкове походження, або ж імуНаступне втілення даного винаходу передбаноген може бути антитоксином. чає стійкі, безпечні і придатні для ін'єкцій емульсії У наступному кращому втіленні даний винахід типу М/В, які діють як ад'юванти, для підвищення передбачає спосіб індукування імунної відповіді у імунної відповіді, викликаної імуногеном. Зокрема, вакцинованих проти патогена, який включає введаний винахід передбачає нові ад'юванти, які, при дення вакцинної композиції даного винаходу ваквикористанні їх у вакцинній композиції, що містить цинованим. імуноген, підвищують у вакцинованих клітинах У наступному кращому втіленні даний винахід імунну відповідь, гуморальну імунну відповідь або, передбачає набори, які включають, щонайменше, бажано, обидві відповіді на імуноген. два флакони, причому в першому флаконі місНаступне втілення даного винаходу передбатиться імуноген, а саме, імуноген у ліофілізованочає стійкі, безпечні й імуногенні композиції або му вигляді або в розчині у водному середовищі, а вакцини, які включають емульсію М/В. в другому флаконі - ад'ювант або емульсія за даНаступне втілення даного винаходу передбаним винаходом. чає спосіб одержання вакцинної композиції з викоСлід зазначити, що в даному описі, зокрема, у ристанням ад'юванта даного винаходу; отриману формулі винаходу, такі терміни, як «включає», при цьому вакцинну композицію; і способи її засто«включаючий» та їм подібні можуть мати значенсування. ня, які мають такі терміни у патентному законоНаступне втілення даного винаходу передбадавстві США, наприклад, вони можуть означати чає набір, що включає імуноген або інший фарма«містить у собі», «має в собі» і т.і.; а такий терміни, цевтичний продукт у першому флаконі, і ад'ювант, як «складається в основному з» мають значення, отриманий відповідно до даного винаходу, у друприписане їм у патентному законодавстві США, 7 84024 8 наприклад, вони дозволяють елементи, не зазнаДля зручності визначені терміни, застосовані в чені явно, але виключають елементи, які входять у описі, прикладах і прикладеній формулі винаходу, попередній рівень техніки або такі, що торкаються зібрані в одному місці. фундаментальної або нової особливості винаходу. У даному винаході термін «тварина» включає Ці та інші втілення винаходу розкриті в або вивсіх хребетних тварин, у тому числі людину. Він пливають з і охоплені нижченаведеним докладним також включає конкретних тварин на всіх стадіях описом. розвитку, включаючи ембріональні і зародкові стаПовне і всебічне розкриття даного винаходу, дії. Зокрема, термін «хребетна тварина» включає, включаючи найкращий спосіб його здійснення, для не обмежуючись цим, людину, собачих (наприрядових фахівців у цій галузі викладено більш конклад, собак), котячих (наприклад, кішок), конячих кретно в іншій частині опису, у тому числі з залу(наприклад, коней), порожнисторогих (наприклад, ченням прикладених фігур. велика рогата худоба), свинячих (наприклад, свиНа Фіг.1 представлені показники ушкодження ней), а також птахів. Термін «птах» у даному виналегень у поросят, яким робили провокуючу пробу ході відноситься до будь-яких видів або підвидів через 28 днів після вакцинації відповідно до Притаксономічного класу Aves, таких як кури (бридери, кладу 3. Середнє значення позначене хрестиком, бройлери і несучки), індички, качки, гуси, перепенижня квартиль (зона, у якій розташовано менше ли, фазани, папуги, зяблики, яструби, ворони і 25% значень перемінної), що спостерігаються, і безкільові, у тому числі страуси, ему і казуари, але верхня квартиль - рамкою, статистична медіана не обмежуючись цим. горизонтальною лінією в рамці, розмах від мінімаУ даному винаході термін «свиня» або «порольного до максимального значення - вертикалься» означає тварину з числа свинячих, тоді як ною лінією. «свиноматка» означає самку репродуктивного віку На Фіг.2 представлені показники ушкодження і здатності. легень у поросят, яким робили провокуючу пробу У даному винаході термін «вірулентний» означерез 20 тижнів після вакцинації відповідно до чає ізолят, який зберігає здатність до зараження Прикладу 4. Середнє значення позначене хреститварини-реципієнта. ком, нижня квартиль і верхня квартиль - рамкою, У даному винаході термін «інактивована вакстатистична медіана -горизонтальною лінією в цина» означає вакцинну композицію, яка містить рамці, розмах від мінімального до максимального заразний організм або патоген, що більше не здазначення - вертикальною лінією. тний до реплікації або росту. Патоген може мати На Фіг.3 представлений графік, який відобрабактеріальне, вірусне, протозойне або грибкове жає прогресування клінічного захворювання за походження. Інактивація може здійснюватися різклінічним показником після провокуючої проби ними методами, включаючи заморожуваннявідповідно до Прикладу 6. розтавання, хімічну обробку (наприклад, обробку На Фіг.4 представлені результати польового тимеросалом або формаліном), обробку ультрадосліду ефективності, у якому поросята (n=889), звуком, опромінення, нагрівання або у будь-який народжені від свиноматок, вакцинованих однораінший загальноприйнятий спосіб, достатній для зово до опоросу вакцинною композицією, отримаприпинення реплікації або росту організму зі збеною відповідно до даного винаходу, виявляли знареженням його імуногенності. чне зниження смертності (на 75%) від У даному винаході термін «імуногенність» мультисистемного синдрому виснаження після означає здатність викликати імунну відповідь у відлучення (PMWS, postweaning multisystem тварини-реципієнта проти антигену або антигенів. wasting syndrome) у порівнянні з контрольними Така імунна відповідь лежить в основі захисного поросятами (n=713), народженими від не вакциноімунітету, який індукується вакциною проти конкваних свиноматок. ретного заразного організму. Інші задачі, особливості й аспекти даного виУ даному винаході термін «імунна відповідь» находу розкриті в або випливають з наступного означає відповідь, викликана у тварини. Імунна докладного опису. Рядовий фахівець у цій галузі відповідь може відноситися до клітинного імунітеповинен розуміти, що даний опис є усього лише ту, гуморальному імунітету або він може включати описом типових втілень і не має на меті обмеженобидва різновиди. Даний винахід також передбаня більш широких аспектів даного винаходу, які чає відповідь, яка обмежується лише частиною втілені в типовій конструкції. Справді, фа хівцям у імунної системи. Наприклад, вакцинна композиція цій галузі повинно бути ясно, що в даному винаходаного винаходу може специфічно індукувати підді можна робити різні модифікації і різновиди, які вищення відповіді g-інтерферону. не виходять за рамки або не відходять від духу У даному винаході термін «анфиген» або винаходу. Наприклад, особливості, розкриті або «імуноген» означає речовину, яка викликає спеописані як частина одного втілення, можуть бути цифічну імунну відповідь у тварини-реципієнта. використані в іншому втіленні для одержання ще Антиген може включати цілий організм, убитий, одного втілення. Мають на увазі, що даний винахід ослаблений або живий; субодиницю або частину охоплює такі модифікації і різновиди як вхідні в організму; рекомбінантний вектор, що містить область дії прикладеної формули і її еквівалентів. вставку з імуногенними властивостями; або частиЗміст усіх посилань, опублікованих патентів і пану фрагмента ДНК, здатну викликати імунну відпотентів, цитованих у даній заявці, включені до дановідь після презентації тварині-реципієнту; білок, го винаходу як посилання у повному обсязі. поліпептид, пептид, епітоп, гаптен або будь-яку їх комбінацію. З іншого боку, імуноген або антиген може включати токсин або антитоксин. 9 84024 10 У даному винаході термін «мультивалентна» міші з відповідним носієм, розріджувачем або наозначає вакцину, яка містить більше одного антиповнювачем типу стерильної води, фізіологічного гену як того самого виду (наприклад, різних ізолярозчину, глюкози та т.і. Композиції можуть містити тів Mycoplasma hyopneumoniae) , так і різних видів допоміжні речовини, такі як змочуючі або емуль(наприклад, ізолятів Pasteurella hemolytica та гуючі речовини, рН-буфери, ад'юванти, желатинуPasteurella multocida), або ж вакцину, яка містить ючі або добавки, які підвищують в'язкість, консеркомбінацію антигенів різних родів (наприклад, вакванти, ароматизатори, барвники та ін., залежно від цину, яка включає антигени з Pasteurella multocida, способу застосування і необхідного препарату. Salmonella, Escherichia coli, Haemophilus somnus і Для одержання відповідних препаратів без зайвоClostridium) . го експериментування можна звернутися до станУ даному винаході термін «ад'ювант» означає дартних посібників з фармацевтики, таких як речовину, яка додається у вакцину для підвищен«ReMington's Pharmaceutical Sciences», 1990. ня її імуногенності. Механізм того, яким чином діє Даний винахід передбачає новий ад'ювант або ад'ювант, не цілком відомий. Вважають, що деякі емульсію типу «масло у воді» (М/В), яка включає: ад'юванти підсилюють імунну відповідь шляхом (1) водний розчин, який містить вакцинний анповільного виділення антигену, тоді як інші ад'ютиген або імуноген, здатний викликати імунну відванти сильно імуногенні самі по собі і діють синеповідь у реципієнта; ргічно. До відомих вакцинних ад'ювантів відно(2) неіонний гідрофільний детергент зі значенсяться, не обмежуючись цим, емульсії з олії і води ням гідрофільно-ліпофільного балансу (HLB) бі(наприклад, повний ад'ювант Фрейнда і неповний льшим 13 і меншим 40 (HLB >13, особливо ад'ювант Фрейнда), Corynebacterium parvum, баHLB³13,5 і бажано HLB³14); цила Calmette-Guerin (БЦЖ), гідрооксид алюмінію, (3) мінеральна масло; глкжан, декстрансульфат, оксид заліза, альгінат (4) неіонний ліпофільний детергент; і натрію, ад'ювант Bacto, певні синтетичні полімери (5) неіонний гідрофільний детергент із низьким типу поліамінокислот і співполімери амінокислот, значенням HLB (значення HLB між 9 і 13). сапонін, «Regressin» (Vetrepharm, Athens, Ga.), Емульсії, отримані за даним винаходом, ґрун«Avridine» [N,N-діоктадецил-N¢,N¢-біс(2туються на комбінації, щонайменше, з 3 детергенгідроксиетил)пропандиамін], парафінова масло, тів, обраних із представників трьох різних груп мураміловий дипептид та ін. детергентів, причому можна використовувати один У даному винаході термін «фармацевтично або декілька детергентів, які належать до однієї прийнятний носій» відноситься до рідкого носія групи. для вмісту вакцинних антигенів, який можна ввоУ кращому втіленні концентрація неіонного гідити реципієнту без небажаних ефектів. До придадрофільного детергенту (5) в емульсії (у даному тних фармацевтично прийнятних носіїв, відомих у описі це означає кінцеву емульсію, яка включає всі цій галузі, відносяться, не обмежуючись цим, стеінгредієнти, якщо не зазначено інакше) складає від рильна вода, фізрозчин, глюкоза, декстроза або 1% до 8%, зокрема від 1,5% до 6%, бажано від 2% буферні розчини. Носії можуть включати допоміжні до 5%, краще від 2,5% до 4% при вираженні у відречовини, у тому числі, але не обмежуючись цим, сотках за масою на об'єм емульсії («мас %» або розріджувачі, стабілізатори (наприклад, цукри й «% мас» при перерахуванні значень). амінокислоти), консерванти, змочуючі речовини, Дана група детергентів включає неіонні гідроемульгуючі речовини, рН-буфери, добавки, які фільні детергенти з низьким значенням HLB (знапідвищують в'язкість, барвники та ін. чення HLB між 9 і 13) . До цієї групи відносяться, У даному винаході термін «вакцинна композине обмежуючись цим, етоксильовані жирнокислотція» включає, щонайменше, один антиген або імуні моноефіри сорбіту (особливо 5 етоксигруп) (наноген у фармацевтично прийнятному носії, який приклад, етоксильований моноолеат сорбіту типу може бути застосований для індукування імунної Tween 80), етоксильовані жирнокислотні диефіри відповіді в реципієнта. Вакцинні композиції можна сорбіту, етоксильовані жирнокислотні триефіри вводити в таких дозах і у такі способи, які добре сорбіту (особливо 20 етоксигруп) (наприклад, етовідомі фахівцям в галузі медицини або ветеринаксильований триолеат сорбіту тип у Tween 85, еторії, з урахуванням таких факторів, як вік, стать, ксильований тристеарат сорбіту типу Tween 65), вага, біологічний вид і стан тварини-реципієнта, а етоксильовані жирні спирти (особливо 5-10 етокситакож спосіб застосування. Серед способів застогруп) (наприклад, Brij 76, Brij 56, Brij 96), етоксисування можуть бути введення крізь шкіру, крізь льовані жирні кислоти (особливо 5-10 етоксигруп) слизові оболонки (наприклад, перорально, наза(наприклад, Simulsol 2599, Myrj 45), етоксильована льно, анально, вагінально) або парентерально рицинова масло (особливо 25-35 етоксигруп) (на(інтрадермально, внутрішньом'язево, підшкірно, приклад, Arlatone 650, Arlatone G) та їхні комбінаабо внутрішньовенно внутрішньочеревно). Вакції. цинні композиції можуть вводитися кожна окремо Кращими є етоксильовані жирнокислотні диеабо разом, чи по черзі з іншими засобами терапії. фіри сорбіту і етоксильовані жирнокислотні триЛікарські форми можуть включати суспензії, сироефіри сорбіту, а також комбінації з обох різновидів. пи або еліксири, препарати для парентерального, Жирну кислоту переважно вибирають із групи, яка підшкірного, інтрадермального або внутрішньоскладається з олеату, пальмітату, стеарату, ізовенного введення (наприклад, шляхом ін'єкції) стеарату, ла урату та їх комбінацій. До кращих етотипу стерильних суспензій або емульсій. Вакцинні ксильованих жирнокислотних триефірів сорбіту композиції можуть вводитися у вигляді аерозолю відносяться етоксильований триолеат сорбіту типу або разом з їжею і/чи водою, або вводитися в су 11 84024 12 Tween 85 або етоксильований тристеарат сорбіту емульсії, від 1,2% до 10%, зокрема від 2% до 8%, типу Tween 65. бажано від 3% до 7%, ще краще від 4% до 6%. У кращому втіленні концентрація неіонного гіУ загальному випадку в емульсії за винаходом дрофільного детергенту (2) звичайно складає від температура інверсії фаз (PIT, phase inversion 0,1% до 1,5%, зокрема від 0,2% до 1,4%, бажано temperature) може складати ³33°С, зокрема від від 0,3% до 1,3%, краще від 0,4% до 1,2% при ви33°С до 65°С, краще від 36°С до 60°С, ще краще раженні у відсотках за масою на об'єм емульсії від 37°С до 55°С, найкраще від 38°С до 50°С. (мас %). Температура інверсії фаз (PIT) - це темпераДана друга група детергентів включає неіонні тура, за якої емульсія типу «вода в олії» перетвогідрофільні детергенти з високим значенням HLB рюється в емульсію типу «масло у воді», тобто (HLB >13, особливо HLB³13,5 і бажано HLB³14). дефазує (розпад емульсії і поділ на дві фази). До цієї групи відносяться етоксильовані жирнокисЗначення PIT можна виміряти різними способами, лотні моноефіри сорбіту (особливо 20 етоксигруп) приміром, за зовнішнім виглядом (наприклад, див. (наприклад, етоксильований монолаурат сорбіту Приклад 2) або за електропровідністю. Емульсію типу Tween 20, етоксильований монопальмітат поміщають на водяну баню за температури нижчої сорбіту типу Tween 40, етоксильований моностеаза значення PIT емульсії, приміром, - 25°С. Температ сорбіту типу Tween 60, етоксильований моноратур у поступово підвищують. Спостерігають за олеат сорбіту типу Tween 80), етоксильовані жирні зміною зовнішнього вигляду емульсії у порівнянні з спирти (особливо 15-30 етоксигруп) (наприклад, контрольною емульсією, відзначаючи плинність, Brij 78, Brij 98, Brij 721), етоксильовані жирні кислов'язкість, поділ на дві фази, зміну стан у поверхні ти (особливо 15-30 етоксигруп) (наприклад, Myrj унаслідок виходу олійної фази на поверхню. Тем49, Myrj 51, Myrj 52, Myrj 53), неіонні блокпература, за якої спостерігається ця зміна зовнішспівполімери [наприклад, співполімер поліоксиенього вигляду емульсії, і дає значення PIT емультилен/поліоксипропілен (РОЕ/РОР) типу Lutrol сії. Як альтернативу значення PIT визначають за F127, Lutrol F68] та їх комбінації. швидким переходом від значення електропровідДля неіонних блок-співполімерів вміст може ності близько 5-8 милісименсів/сантиметр бути нижчим, зокрема, від 0,1% до 0,5%, краще від (мСм/см) (емульсія типу «масло у воді») до зна0,2% до 0,4% мас. чення близько 0мСм/см (емульсія типу «вода в До кращих детергентів (2) відносяться етоксиолії») при вимірюванні зондом, поміщеним в емульовані жирнокислотні моноефіри сорбіту типу льсію поблизу від поверхні. Температура, за якої тих, котрі описані вище. спостерігається цей перехід, і дає значення PIT У кращому втіленні концентрація неіонного ліемульсії. Рядовий фахівець у цій галузі здатний пофільного детергенту (4) складає від 0,1% до визначити комбінації детергентів і олії, включаючи 2,5%, зокрема від 0,2% до 2%, бажано від 0,2% до їх концентрації, для одержання емульсій за вина1,5%, ще краще від 0,2% до 1,2% при вираженні у ходом, зокрема емульсій зі значенням PIT у зазнавідсотках за масою на об'єм емульсії (мас %). чених вище межах, без зайвого експериментуванДана група детергентів включає жирнокислотні ня. ефіри сорбіту (наприклад, монолаурат сорбіту У кращому втіленні даного винаходу, описані в типу Span 20, монопальмітат сорбіту типу Span 40, ньому емульсії, не містять яких-небудь іонних демоностеарат сорбіту типу Span 60, тристеарат тергентів або сполук, які мають властивості іонних сорбіту типу Span 65, моноолеат сорбіту типу Span детергентів, таких як лецитин або сапонін. У зага80, триолеат сорбіту типу Span 85, моноізостеарат льному випадку емульсії за даним винаходом мосорбіту тип у Arlacel 987, ізостеарат сорбіту типу жуть містити, за об'ємом на об'єм емульсії, від 3% Crill 6), жирнокислотні ефіри маніту (наприклад, до 55% олії, зокрема від 5% до 50% олії, бажано Montanide 80, моноолеат маніту типу Arlacel А, від 10% до 40% олії, ще краще від 20% до 40% діолеат маніту, триолеат маніту, тетраолеат маніолії. За визначенням інтервали значень у даному ту), етоксильовані жирнокислотні ефіри маніту (2, описі завжди включають границі інтервалу, якщо 3 або 4 етоксигрупи) (наприклад, Montanide 888, не зазначено інакше. Montanide 103, етоксильований моноолеат маніту, Масло, яка використовується, може бути мінеетоксильований діолеат маніту, етоксильований ральною олією, включаючи, але не обмежуючись триолеат маніту, етоксильований тетраолеат маніцим, парафінову олію типу ізопарафінової олії і/чи ту) та їх комбінації. нафтенової олії, сквалан, пристан, поліізобутенову Жирну кислоту переважно вибирають із групи, олію, гідрогеновану поліізобутенову олію, полідеяка складається з олеату, пальмітату, стеарату, ценову олію, поліізопренову олію, поліізопропеноізостеарату, ла урату та їх комбінацій. ву олію та ін. Одна з кращих мінеральних олій, яка До кращих детергентів (4) відносяться жирноможе бути застосованою у даному винаході, може кислотні ефіри сорбіту, зокрема ті, які описані вибути олією, що містить лінійний або розгалужений ще, та їх комбінації. вуглецевий ланцюг з числом атомів вуглецю більУ детергентів за винаходом жирні кислоти мошим 15, краще від 15 до 32, і вільною від ароматижуть мати тваринне або рослинне походження. чних сполук. До таких олій можна віднести, приміЗаміна одного джерела іншим (наприклад, тварини ром, олії, які випускаються під маркою «Marcol 52» Tween 80 на рослинний Tween 80) може здійснюабо « Marcol 82» (фірми Esso, Франція) або ватися усього лише з невеликою зміною сполуки «Drakeol 6VR» (фірми Penreco, США) . емульсії. Масло може бути і сумішшю олій, що включає, В емульсії за винаходом загальна концентращонайменше, 2 олії, обрані з поміж описаних ви ще ція детергентів може складати, за масою на об'єм олій, і в будь-якій пропорції. Суміш олій також мо 13 84024 14 же включати, щонайменше, одну олію, обрану з значенням HLB повен буде мати гідрофільну часпоміж описаних вище олій, і, щонайменше, одну тину, до складу якої входить етоксильований соррослинну олію, причому ця рослинна масло станобіт типу Tween 80. вить від 0,1% до 33% олійної фази, бажано від У загальному випадку, даний винахід перед10% до 25% об. Такі рослинні олії є ненасиченими бачає використання водних розчинів, які включамасломи, багатими олеїновою кислотою, для яких ють придатний ветеринарний або фармацевтично характерні біодеградація і які є переважно рідкими прийнятний носій, наповнювач або розріджувач, у тому числі, але не обмежуючись цим, стерильну за температури зберігання (біля +4°С) або, приводу, фізіологічний розчин, глюкозу, буфер і т.і. наймні, дають можливість одержати емульсії, які Носій, наповнювач або розріджувач може також будуть рідкими за цієї температури. Наприклад, включати поліоли, глюкозиди і рН-буферні речорослинна масло може бути арахісовою олією, горівини. Носій, наповнювач або розріджувач, приміховою олією, соняшниковою олією, сафлоровою олією, соєвою олією, онагровою олією та ін. ром, може також включати амінокислоти, пептиди, антиоксиданти, бактерицидні та бактеріостатичні У кращому втіленні гідрофільні детергенти (2) і сполуки. Водний розчин додають в олію і детерге(5) переважно включають детергенти, які мають нти в такій кількості, щоб одержати 100% об'єму однакову гідрофільну частину молекули. Наприемульсії за винаходом. клад, застосовуються етоксильовані жирнокислотні ефіри сорбіту для кожного з гідрофільних детерГідрофільно-ліпофільний баланс (HLB) емульсії дозволяє оцінити гідрофільність або ліпофільгентів (2) і (5) . Так, якщо як неіонний гідрофільний ність детергенту. Значення HLB амфіфільної модетергент з низьким значенням HLB обрано Tween лекули звичайно розраховують у такий спосіб: 85, то неіонний гідрофільний детергент із високим Значення HLB може коливатися від 0 (для найбільш ліпофільних молекул) до 20 (для найбільш гідрофільних молекул). Відповідно до хімічного складу детергенту (приміром, додаванням етоксигруп або алкеноксидів) ця оцінка може змі нюватись, і область значень HLB може зрости (наприклад, у Lutrol F68 значення HLB дорівнює 29). Для суміші детергентів значення HLB суміші визначається додаванням значень HLB кожного з детергентів, нормалізованих за масою: В одному втіленні емульсії відповідно до даного винаходу кінцеве значення HLB емульсії складає від 9 до 12, бажано від 9,5 до 11,5, краще від 10 до 11,5. Даний винахід передбачає емульсію, яка включає парафінову олію (зокрема, у концентрації від 10% до 40%, бажано від 20% до 40% при вираженні за об'ємом на об'єм емульсії - «об. %» або «% об.» при перерахуванні значень); жирнокислотний моноефір сорбіту (як неіонний ліпофільний детергент); етоксильований жирнокислотний триефір сорбіту (як неіонний гідрофільний детергент з низьким значенням HLB); і етоксильований жирнокислотний моноефір сорбіту (як неіонний гідрофільний детергент з високим значенням HLB). Зокрема, жирнокислотний моноефір сорбіту є моноолеатом сорбіту (зокрема, в концентрації від 0,2% до 1,5%, бажано від 0,2% до 1,2% при вираженні за масою на об'єм емульсії - мас %); етоксильований жирнокислотний триефір сорбіту є етоксильованим триолеатом сорбіту (зокрема, в концентрації від 2% до 5%, бажано від 2,5% до 4 % мас); і етоксильований жирнокислотний моноефір сорбіту є етоксильованим моноолеатом сорбіту (зокрема, в концентрації від 0,3% до 1,3%, бажано від 0,4% до 1,2% мас). Наприклад, емульсія включає парафінову олію в кількості 29,3% за об'ємом на об'єм емульсії, моноолеат сорбіту в кількості 0,6% за масою на об'єм емульсії, етоксильований триолеат сорбіту в кількості 3,4% за масою на об’єм емульсії і етоксильований моноолеат сорбіту в кількості 0,75% за масою на об'єм емульсії. В другому втіленні, відповідно до даного винаходу емульсія включає парафінову олію (зокрема, у концентрації від 10% до 40%, переважно від 20% до 40% об.); жирнокислотний моноефір сорбіт (як неіонний ліпофільний детергент); етоксильований жирнокислотний триефір сорбіту (як неіонний гідрофільний детергент з низьким значенням HLB); і неіонний блок-співполімер (як неіонний гідрофільний детергент з високим значенням HLB) . Зокрема, жирнокислотний моноефір сорбіту є моноолеатом сорбіту (зокрема, у концентрації від 0,2% до 1,5%, бажано від 0,2% до 1,2% мас); етоксильований жирнокислотний триефір сорбіту є етоксильованим триолеатом сорбіту (зокрема, у концентрації від 2% до 5%, бажано від 2,5% до 4% мас); і неіонний блок-співполімер є полімером поліоксиетилен/поліоксипропілен (РОЕ-РОР) (зокрема, у 15 84024 16 концентрації від 0,1% до 0,5%, бажано від 0,2% до кількість водного розчину додається після внесен0,4% мас). Наприклад, емульсія включає парафіня імуногенна. Імуноген або антиген може знахонову олію в кількості 29,3 об. %, моноолеат сорбіту дитися в ліофілізованому вигляді або в будь-якому в кількості 0,6 мас %, етоксильований триолеат іншому належному твердому вигляді, а потім його сорбіту в кількості 3,4 мас % і етоксильований мозмішують з емульсією, або альтернативно, антиген ноолеат сорбіту в кількості 0,25 мас %. може знаходитися в розчині, зокрема у водному У кращому втіленні винахід передбачає емурозчині, і цей розчин змішують з емульсією. льсію для ін'єкцій типу «масло у воді» (М/В), яка Детергенти переважно додають або в олію, включає: або у водний розчин відповідно до їхньої розчин(1) водний розчин, який містить активний інгності. Наприклад, неіонні ліпофільні детергенти редієнт типу лікарського препарату або імуногендодають в олію за винаходом, тоді як неіонні гідна, краще імуноген; рофільні детергенти з високим значенням HLB (2) мінеральну олію; додають у водний розчин. (3) неіонний ліпофільний детергент; і Емульгування може здійснюватися традицій(4) неіонний гідрофільний детергент із низьким ними методами, відомими рядовим фахівцям у цій значенням HLB, який включає етоксильований галузі. Наприклад, в одному втіленні даного винажирнокислотний диефір сорбіту (який може мати ходу емульсію одержують за температури нижче значення HLB між 11 і 13) . значення PIT емульсії, зокрема, за кімнатної темЕмульсія за цим втіленням включає етоксиператури, наприклад, приблизно при 25°С. Водну льовані жирнокислотні диефіри сорбіту, які можуть фазу і олійну фаз у змішують разом шляхом мехамістити до 20 етоксигруп. Жирні кислоти можуть нічного впливу, наприклад, за допомогою турбіни, мати тваринне або рослинне походження, і вони оснащеної ротором-статором, здатним створюваможуть бути обрані з групи, яка складається з ти високе ріжуче зусилля. Краще перемішування олеату, пальмітату, стеарату, ізостеарату, лаурату починати за низької швидкості обертання, повільта їх комбінацій. В одному втіленні етоксильована но підвищуючи її в міру поступового додавання, як жирна кислота переважно є олеатом. Інші інгредіправило, водного розчину в олію. Бажано, водний єнти, а також загальні властивості емульсії, такі як розчин поступово додавати в олію. СпіввідношенPIT, можуть мати такі ж характеристики, як у тих, ня масло/водний розчин можна підібрати таким що описані вище. чином, щоб одержати емульсію типу «вода в олії» Бажано детергент (4) включає етоксильовані (В/O), наприклад, при концентрації від 40% до 55% жирнокислотні диефіри сорбіту, такі як етоксильооб. олії. При припиненні перемішування емульсія ваний діолеат сорбіту, етоксильований дистеарат поступово перетворюється в емульсію типу М/В сорбіту або етоксильований диізостеарат сорбіту, (інверсія фаз). Після інверсії і при необхідності етоксильований дипальмітат сорбіту, етоксильоемульсію розбавляють додаванням водного розваний дилаурат сорбіту та їх комбінації. чину, щоб одержати потрібну концентрацію олії в Необов'язково в емульсію можна додавати й кінцевій емульсії. Емульсія може зберігатися приінші сполуки як коад'юванти, у тому числі, але не близно при 5°С. обмежуючись цим, квасці, олігонуклеотиди CpG В іншім втіленні емульсію можна одержати за (ODN), зокрема ODN 2006, 2007, 2059 або 2135 температури вищої за значення PIT емульсії. На [Pontarollo R.A. et al., Vet. Immunol, Immunopath., першій стадії водну фазу і олійну фазу змішують 2002, 84: 43-59; Wernette CM. et al., Vet. Immunol. разом за температури вищої за значення PIT емуImmunopath., 2002, 84: 223-236; Mutwiri G. et al., льсії. Переважно водний розчин поступово додаVet. Immunol. Immunopath., 2003, 91: 89-103], поють в олію. Співвідношення масло/водний розчин ліа-полі [«Vaccine Design: The Subunit and Adjuvant можна підібрати таким чином, щоб одержати емуApproach», edited by Michael F. Powell and Mark J. льсію типу «вода в олії» (В/О), наприклад, при Newman, Pharmaceutical Biotechnology, 6:03], диконцентрації від 40% до 55% об. олії. Емульгуванметилдіоктадециламоній бромід (DDA) [«Vaccine ня може здійснюватися шляхом перемішування Design: The Subunit and Adjuvant Approach», edited при низькому ріжучому зусиллі, або за відсутності by Michael F. Powell and Mark J. Newman, наприклад, за допомогою статичної мішалки або Pharmaceutical Biotechnology, 6: 157], N,Nшнека, або за допомогою турбіни при дуже низькій діоктадецил-N¢,N¢-біс(2-гідроксиетил)пропандиамін швидкості обертання. Отримана емульсія є емультипу Avridine (ibid, p. 148), карбомер, хітозан [як сією типу «вода в олії» (В/O). На другій стадії емуприклад, див. US Patent Serial No. 5,980,912]. льсію поступово охолоджують до температури Даний винахід також передбачає спосіб одернижчої за значення PIT. На цій стадії емульсія пежання вакцинної композиції або імунологічної комретворюється в емульсію типу М/В (інверсія фаз). позиції, яка включає, щонайменше, один антиген Після інверсії і при необхідності емульсію розбавабо імуноген і ад'ювант або емульсію, отриману ляють додаванням водного розчину, щоб одержавідповідно до даного винаходу. Імуноген може ти потрібну концентрацію олії в кінцевій емульсії. бути включений до складу при утворенні емульсії Емульсія може зберігатися приблизно при 5°С. або, в альтернативному втіленні, імуноген може Розмір краплин в емульсії може коливатися бути доданий в емульсію пізніше, наприклад, безвід 100нм до 500нм. Емульсію можна використопосередньо перед застосуванням. вувати, приміром, як ад'ювант для складання вакУся кількість використовуваного водного розцинної композиції або фармацевтичної композиції. чину може знаходитися в емульсії із самого початЕмульсію можна використовувати і як розчинник ку або ж тільки частина цього водного розчину для розчинення сухого препарату, особливо ліовикористовується для одержання емульсії, а інша філізованного препарату, який містить, наприклад, 17 84024 18 ослаблені мікроорганізми або живі рекомбінантні hyopneumoniae, Erysipelothrix rhusiopathiae, вектори. Pasteurella multocida, Bordetella bronchiseptica, У кращому втіленні одержують попередню Escherichia coli і ін., а також їх комбінацій. емульсію (пре-емульсию), використовуючи тільки Краще втілення винаходу передбачає вакцинні частину водного розчину. Таку пре-емульсию можкомпозиції, які включають, щонайменше, один імуна розбавити додаванням суспензії активного інгноген і емульсію у фармацевтично прийнятному редієнта типу лікарського препарату або імуногеносії. Імуногени, які містять віруси, бактерії, гриби на, бажано імуногена, для одержання кінцевої тощо, можуть бути о тримані методами культивукомпозиції. Як альтернативу можна розбавити вовання in vitro, використовуючи відповідні культурадним розчином і використовувати для розчинення льні середовища або клітинні лінії і стандартні сухого препарату, приміром, ліофілізованного преметоди, добре відомі в цій галузі. Наприклад, парату. PRRS можна культивувати у відповідній лінії кліІмуноген або антиген, придатний для застосутин типу клітинної лінії МА-104 [див. US Patent вання в даному винаході, може бути обраний із Serial Nos. 5,587,164; 5,866,401; 5,840,563; групи, яка складається з інактивованих патогенів, 6,251,404, серед інших]. Аналогічним чином PCV-2 ослаблених патогенів, імуногенних субодиниць можна культивува ти в клітинах лінії РК-15 [див. US (наприклад, білків, поліпептидів, пептидів, епітопів, Patent Serial No. 6,391,314]; SIV можна культивугаптенів) або рекомбінантних експресійних вектовати в яйцях [US Patent Serial No. 6,048,537]; і рів, у тому числі плазмід з імуногенними вставкаMycoplasma hyopneumoniae можна культивувати у ми. В одному втіленні даного винаходу імуноген є відповідному культуральному середовищі [US інактивованим або убитим мікроорганізмом. В інPatent Serial Nos. 5,968,525; 5,338,543; Ross R.F. et шому втіленні винаходу вакцинна композиція al., Am. J. Vet. Res., 1984, 45: 1899-1905]. включає імуноген, обраний із групи патогенів птаДля того щоб одержати інактивовану імунолохів, включаючи, але не обмежуючись цим, гічну вакцинну або композицію, патоген переважно Salmonella typhimurium, Salmonella enteritidis, вірус піддають інактивації після виділення і необов'язкоінфекційного бронхіту (IBV), вірус хвороби Ньюво піддають прояснюванню за допомогою хімічної касл (NDV), вірус синдрому зниження яйценосності обробки, використовуючи, приміром, формалін або (EDS, egg drop syndrome) або вірус інфекційного формальдегід, р-пропіолактон, етиленімін, бінарбурситу (IBDV), вір ус пта шиного грипу та ін., а таний етиленімін (ВЕІ), тимеросал та ін., і/чи фізичкож їх комбінацій. ної обробки (наприклад, нагрівання або обробки Альтернативно, вакцинна композиція включає ультразвуком). Методи інактивації добре відомі в імуноген, обраний з котячих патогенів, таких як цій галузі. Наприклад, вірус PRRS можна інактиву(але не обмежуючись цим) герпесвірус кішок вати при обробці (b-пропіолактоном [Plana-Duran (FHV), каліківірус кішок (FCV, feline calicivirus), віet al., Vet. Microbiol., 1997, 55: 361-370] або при рус лейкемії кішок (FeLV), вірус імунодефіциту обробці ВЕІ [US Patent Serial No. 5,587,164]; інаккішок (FIV), вірус сказу та ін., а також їх комбінацій. тивацію вірусу PC V-2 можна здійснити за допомоУ наступному втіленні вакцинна композиція гою обробки етиленіміном або обробки (bданого винаходу включає імуноген, обраний із сопропіолактоном [US Patent Serial No. 6,391,314]; бачих патогенів, включаючи, але не обмежуючись вірус грипу свиней можна інактивувати за допомоцим, вірус сказу, герпесвірус собак (CHV), парвовігою детергенту типу Triton або при обробці форрус собак (CPV), коронавірус собак, Leptospira мальдегідом [US Patent Serial No. 6,048,537]; бакcanicola, Leptospira icterohaemorragiae, Leptospira терії Mycoplasma hyopneumoniae можна grippotyphosa, Borrelia burgdorferif Bordetella інактивувати при обробці формальдегідом (Ross bronchiseptica і ін., а також їх комбінацій. R.F., supra), етиленіміном або ВЕІ [див. WO У наступному втіленні винаходу композиція 91/18627], або при обробці тимеросалом [US включає імуноген, обраний з кінських патогенів, Patent Serial Nos. 5,968,525 і 5,338,543]. таких як герпесвірус коней (1 або 4 типи), вірус Інактивований патоген можна сконцентрувати кінського грипу, правця, вірус Західного Нілу та ін. стандартними методами концентрування, зокрема або їх комбінацій. методом ультрафільтрації, і/чи піддати очищенню У наступному втіленні винаходу композиція стандартними методами очищення, зокрема метовключає імуноген, обраний з бичачих патогенів, дами хроматографії, включаючи, але не обмежуютаких як вірус сказу, бичачий ротавірус, вірус бичись цим, гель-фільтрацію, ультрацентрифугуванчачого парагрипу 3 типи (bPIV-3), бичачий коронаня у градієнті сахарози або вибірковим вірус, вірус бичачої вір усної діареї (BVDV), вірус осадженням, зокрема, у присутності поліетиленгліящура (FMD V), бичачий респіраторноколя (PEG). синцитіальний вірус (BRSV), вірус бичачого інфекДо імуногенів, що їх застосовують у вакцинних ційного ринотрахеіту (IBR), Escherichia coli, композиціях за даним винаходом, відносяться і Pasteurella multocida, Pasteurella haemolytica і ін., а експресійні вектори. До таких векторів відносяться, також їх комбінацій. не обмежуючись цим, рекомбінантні вектори для У наступному втіленні даного винаходу компоекспресії in vi vo, такі як полінуклеотидні вектори зиція включає імуноген, обраний з патогенів свиабо плазміди [ЕР-А2-1001025; Chaudhuri P., Res. ней, таких як (але не обмежуючись цим) вірус свиVet. Sci. 2001, 70: 255-256], вірусні вектори, такі як нячого грипу (SIV), цирковірус свиней 2 типи (PCV(не обмежуючись цим) аденовірусні вектори, покс2), вірус свинячого репродуктивно-респіраторного вірусні вектори типу векторів на основі вірусу віспи синдрому (PRRS), вірус псевдосказу (PRV), парвоптахів [US Patent Serial Nos. 5,174,993; 5,505,941 і вірус свиней (PPV), FMD V, Mycoplasma 5,766,599] або поксвіруса канарок [US Patent Serial 19 84024 20 No. 5,756,103], або бактеріальні вектори зиції. Критичним фактором є те, щоб дозування [Escherichia coli або Salmonella sp.]. забезпечувало принаймні частковий захисний Даний винахід також охоплює складання муефект проти даної інфекції, про який судять за льтивалентних композицій або комбінованих вакзниженням смертності і захворюваності в зв'язку з цинних композицій. Наприклад, до антигенів, які даною інфекцією. Рядовий фахівець у цій галузі можуть бути застосованими у комбінованих бичатакож легко встановити належний об'єм. Напричих бактеріальних вакцинах відповідно до даного клад, для різних видів птахів об'єм дози може винаходу, відносяться, не обмежуючись цим, складати від 0,1мл до 0,5мл, краще від 0,3мл до Mycoplasma bovis, Pasteurella sp., зокрема P. 0,5мл. Для різних видів кішок, собак і коней об'єм multocida і P. haemolytica, Haemophilus sp., зокредози може складати від 0,2мл до 3,0мл, бажано ма H. somnus, Clostridium sp., Salmonella, від 0,3мл до 2,0мл, краще від 0,5мл до 1,0мл. Для Corynebacterium, Streptococcus, Staphylococcus, різних видів великої рогатої худоби і свиней об'єм Moraxella, E. coli та ін. дози може складати від 0,2мл до 5,0мл, бажано Даний винахід також передбачає способи інвід 0,3мл до 3,0мл, краще від 0,5мл до 2,0мл. дукції імунної відповіді в реципієнта, наприклад, Можуть бути бажаними повторні вакцинації тварини, які включають введення реципієнту імучерез певні інтервали часу для посилення первіснологічної композиції або вакцинної композиції за ної імунної відповіді або через деякий тривалий винаходом. Імунні відповіді, викликані таким чиперіод часу після останньої дози. В одному втіном, є антитілом і/чи клітинними імунними відповіленні даного винаходу вакцинна композиція вводиться у вигляді парентеральної ін'єкції (підшкірно, дями, зокрема, відповіддю g -інтерферону. інтрадермально або внутрішньом'язево). КомпозиЗокрема, даний винахід передбачає способи цію можна вводити у вигляді однієї дози або, в імунізації проти, або попередження або зменшення симптомів, викликаних зараженням тварини інших втіленнях, у повторних дозах від двох до п'яти доз з інтервалом від двох до шести тижнів, патогенним організмом (наприклад, зараження бажано від двох до п'яти тижнів. Однак фахівці в вірусом, бактерією, грибком або протозойним пацій галузі повинні розуміти, що кількість доз і проразитом). Спосіб даного винаходу може бути заміжок часу між вакцинаціями залежать від ряду стосваний для хребетних тварин, включаючи, але не обмежуючись цим, людину, собачих (наприфакторів, включаючи, але не обмежуючись цим, вік вакцинованої тварини, стан тварини, спосіб клад, собак), котячих (наприклад, кішок), конячих імунізації, вміст антигену в дозі та ін. Для первин(наприклад, коней), бичачих (наприклад, велику ної вакцинації проміжок звичайно складає більше рогату худобу) і свинячих (наприклад, свиней) тватижня, переважно від двох до п'яти тижнів. Для рин, а також у птахів, включаючи, але не обмежуючись цим, курей, індичок, качок, гусей, перепераніше вакцинованих тварин може проводитися повторна вакцинація (бустер), до або під час вагітлиць, фазанів, папуг, зябликів, яструбів, ворон і ності, з річним інтервалом. бескільових (стра усів, ему, казуарів та ін.). Даний винахід також передбачає введення ваУ кращому аспекті винаходу ці способи полякцинної композиції за допомогою безголкового гають у вакцинації вагітних самок у допологовий період шляхом введення вакцинної композиції, ін'єктора типу Pigjet, Avijet, Dermojet або Biojector (Bioject, Oregon, CUIA) . Рядовий фахівець у даній отриманої відповідно до винаходу. Ці способи догалузі зможе підібрати технічні характеристики датково включають індукцію захисних антитіл, виін'єктора відповідно до таких факторів, як вид вакроблених внаслідок вакцинування, і передачу цих цинованої тварини, вік і вага тварини і так далі без захисних антитіл від вакцинованих вагітних самок їх потомству. Передача таких материнських антизайвого експериментування. В одному втіленні даного винаходу спосіб тіл згодом захищає потомство від захворювання. включає одноразове введення вакцинної композиДозування вакцинної композиції, отриманої ції, складеної з емульсією за винаходом. Напривідповідно до даного винаходу, залежить від виду, клад, в одному втіленні вакцинна композиція є породи, віку, розміру, попередніх вакцинацій і стану здоров'я вакцинованої тварини. Інші фактори інактивованою вакциною проти Mycoplasma hyopneumoniae, тоді як інше втілення передбачає типу концентрації антигену, додаткових компоненвакцину, яка містить композицію з інактивованим тів вакцини і способу застосування (підшкірного, вірусомPCV2. Для застосування за одноразовою інтрадермального, внутрішньом'язевого або внутсхемою придатні й інші імунологічні композиції або рішньовенного введення) також впливають на ефективну дозу. Дозування вакцини, що вводитьвакцини, включаючи, але не обмежуючись цим, інактивовані PRRS і SIV. Зокрема, у випадку вакся, легко визначається на підставі концентрації цинної композиції проти Mycoplasma антигену у вакцині, способу введення і віку та стаhyopneumoniae одноразову дозу можна вводити ну вакцинованої тварини. Кожну партію антигену між народженням і забоєм свині, зокрема, у віці від можна відкалібрувати індивідуально. З іншого боку, можна використовувати систематичні випробу3 до 56 днів, бажано у віці від 10 до 35 днів, ще краще у віці від 15 до 30 днів. Вакцину можна ввовання імуногенности при різних дозах, а також дити і за наявності вже існуючих антитіл. дослідження LD50 і інші процедури скринінга для Винахід також стосується способів лікування визначення ефективного дозування вакцинної реципієнта, наприклад, тварини, які включають композиції відповідно до даного винаходу без зайвого експериментування. З приведених нижче привведення реципієнту фармацевтичної композиції, отриманої за винаходом і яка містить, принаймні, кладів можна легко установити, яка приблизно один імуноген, обраний із групи, яка складається з доза і який приблизно об'єм будуть правильними білків або пептидів, антитіл, алергенів, олігонукледля застосування описаної нами вакцинної компо 21 84024 22 отидів CpG-ODN, факторів росту, ци токинів або Емульсія TS7 антибіотиків, зокрема CpG-ODN або цитокинів. Емульсія TS7 є емульсією типу «масло у воТакі фармацевтичні композиції можна використоді», що містить 33% олійної фази. Олійна фаза вувати для покращення показників росту для таких (120мл) містить 88% Marcol 82, 1,8% Span 80 і тварин, як кури, свині або корови. 10,2% Tween 85. Водна фаза №1 (120мл) містить Даний винахід також стосується набору, який 97,75% 0,02М ізотонічного фосфатного буфера включає один флакон, що містить такий інгредієнт, Na2HPO4/KH2PO 4 (рН 7,8), 1,5% 1%-го розчину як імуноген або фармацевтична композиція, а друThiomersal у воді і 0,75% Lutrol F127. Водна фаза гий флакон - емульсію відповідно до даного вина№2 (120мл) складається з 0,02М ізотонічного фоходу. Імуноген може знаходитися в ліофілізованосфатного буфера Na2HPO4/KH2PO4 (рН 7,8), що му вигляді, сухому вигляді або у водному розчині, необов'язково містить імуногени. Кінцева концентяк описано в даному винаході. рація детергенту в емульсії TS7 складає 4,25%. Далі винахід буде розкрито більш докладно за Емульсія TS8 допомогою наступних не обмежуючих прикладів. Емульсія TS8 є емульсією типу «масло у воПриклад 1. Спосіб приготування емульсії ді», яка містить 50% олійної фази. Олійна фаза Емульсію одержували в дві стадії, як описано (160мл) містить 92% Marcol 82, 1,8% Span 85 і нижче. Перша стадія. Для одержання сполук вико6,2% Brij 96. Водна фаза №1 (160мл) містить ристовували емульгатор Silverson типу ротор98,5% 0,02М ізотонічного фосфатного буфера статор з високим ріжучим зусиллям (марки L4RT з Na2HPO4/KH2PO 4 (рН 7,8), 1,0% 1%-го розчину розпорошуючою насадкою, діаметром 10мм) . Для Thiomersal у воді і 0,5% Lutrol F127 і необов'язково одержання емульсії один об'єм олійної фази емумістить імуногени. Кінцева концентрація детергенту в емульсії TS8 складає 4,25%. льгували при 25°С разом з одним об'ємом водної фази №1. Водну фазу додавали в олійну фазу з Емульсія TS9 Емульсія TS9 є емульсією типу «масло у воперемішуванням при 5000об./хв протягом 1хв. ді», яка містить 10% олійної фази. Олійна фаза Швидкість обертання поступово підвищували в (120мл) містить 60% Marcol 82, 17,2% Span 40 і міру зростання об'єму до 8300об./хв за 1хв. На цій 22,8% Arlatone 650. Водна фаза №1 (120мл) місстадії емульсія була емульсією типу «вода в олії». Для емульсії TS6 фази мали наступний склад: тить 97,75% 0,02М ізотонічного фосфатного буфера Na2HPO4/KH2PO4 (pH 7,8) і 2,5% Tween 20. ВоОлійна фаза (120мл) дну фазу №2 готували на 400мл 0,02М Моноолеат сорбіту (Span 80) 1,8% ізотонічного фосфатного буфера Na2HPO4/KH2PO4 Триолеат сорбіту (20 ОЕ) (Tween 85) 10,2 pH 7,8, що необов'язково містить імуногени. 100мл Парафінова масло (Магсої 82) 88% Водна фаза № 1 (120 мл) пре-емульсії розбавляли 400мл водної фази №2, одержуючи емульсію TS9. Кінцева концентрація 20% розчин моноолеату сорбіту (20 детергенту в емульсії TS9 складає 4,25%. ОЕ) (Tween 80) 11,25% Приклад 2. Визначення температури інверсії 0,02М ізотонічний буфер фаз (PIT) емульсії Na2HPO4/KH2PO 4 (pH 7,8) 85,75% 1% меркуротіолат натрію У скляну пробірку вносили 10мл емульсії TS6, (Thiomersal ®) у воді 1,5% на водяній бані за температури близько 25°С. Моноолеат сорбіту (Span 80) і триолеат сорбіЕмульсія TS6 мала вигляд білої гомогенної емульту (20 ОЕ) (Tween 85) вносили в олійну фазу. Мосії. Температуру водяної бані поступово підвищуноолеат сорбіту (20 ОЕ) (Tween 80) не змішувався вали. За змінами емульсії спостерігали візуально з парафіновою олією. 20% розчин Tween 80 готуемульсія розділялася на дві фази, що приводило вали в тому ж буфері, що і вакцину, наприклад, у до підйому жовто-коричневої олійної фази на по0,02М ізотонічному фосфатному буфері верхню. Така зміна характерна для розпаду емуNa2HPO4/KH2PO 4 (рН 7,8). Меркуротіолат натрію льсії. Температура, за якої спостерігається ця змідіє як консервант і не обов'язковий для емульсії. на, і дає значення PIT емульсії. Значення PIT для При припиненні перемішування емульсія пеемульсії TS6 становило 40-45°С, а для емульсії ретворилася в емульсію типу «масло у воді». ЕмуTS7 - 44-49°С. льсію ставили в холодну кімнату при 5°С як мініПриклад 3. Вакцинна композиція і гетерологічмум на 4 години. На цій стадії емульсія була прена проба на Mycoplasma hyopnevmoniaa емульсією, яка містить 50% олійної фази. Матеріали і методи. Була складена вакцинна Друга стадія. Водну фаз у № 2 готували на композиція, що містить емульсію TS6, отриману як 120мл 0,02М ізотонічного фосфатного буфера описано в Прикладі 1, і інактивований штам BQ14 Na2HPO4/KH2PO 4 рН 7,8 з імуногенами (інактивоMycoplasma hyopneumoniae [Kobisch et al., Алл. ваний імуноген Mycoplasma hyopneumoniae або Inst. Pasteur Immunol., 1987, 138, 693-705] у концеімуноген PCV-2, як описано нижче). Отриману на нтрації 8,7 log10 CCU (одиниць зміни забарвлення) першій стадії пре-емульсію охолоджували приблина 1мл вакцини. Поросят (22екз.) 3-тижневого віку, зно до 5°С, розбавляли додаванням половинного які мали материнські антитіла (народжених від об'єму водної фази № 2 за тієї ж температури і свиноматок, серопозитивних щодо Mycoplasma перемішували на магнітній мішалці протягом 1хв. hyopneumoniae) розділяли випадковим чином на Кінцева концентрація детергенту в емульсії TS6 дві групи. Одн у гр упу з 10 поросят в день 0 вакцисклала 4,75%. нували 2мл вакцинної композиції шляхом внутріОтримані у такий спосіб вакцини TS6 є стійкишньом'язевої ін'єкції, тоді як контрольну групу з 12 поросят не вакцинували. ми, принаймні, один рік при 5°С. У такий же спосіб можна одержати й інші емульсії, як описано нижче. 23 84024 24 Через певні інтервали часу експерименту (0, 27, 42 і 56 днів) брали мазки з ніздрів поросят обох Розраховували підсумковий бал шляхом догруп і визначали секреторні антитіла проти BQ14 давання балів, отриманих за окремими частинами методом ELISA. Через 27 днів у поросят брали кожної з легень, що давало максимальне число кров і виділяли одноядерні клітини периферійної балів у тварини, рівне 28. крові (PBMN) для визначення рівня IFNy у периРезультати. Свині, вакциновані вакцинною ферійній крові. Через 28 днів усім поросятам рокомпозицією з TS6, проявляли сильну клітинну били провокуючу пробу шля хом інтраназального відповідь, яка була значно вищою, ніж у контрольвведення розчину, який містить приблизно 6,6 ної групи, про що свідчить число IFNg-секретуючих log10 CCU/мл Mycoplasma hyopneumoniae штаму плям (spots) з 5´105 одноядерних клітин перифеМр88с (штам був виділений із хворої свині в Данії і рійної крові (PBMN) . У свиней з вакцинованої грукультивований як описано в [Kobisch and Friis, Rev. пи в середньому було 139 плям (стандартне відSci. Tech. Off. Int. Epiz. 1996, 15: 1569-1605], прихилення 25) у порівнянні з 11 (стандартне чому в кожну ніздрю вводили приблизно 5мл розвідхилення 5) у контрольній не вакцинованій групі. чину. Введення повторювали через 24 години. Свиней забивали і виділяли легені при розтині. Число плям із 5´105 Група Показники легень визначали у балах шляхом оцінклітин PBMNs ки площі (у відсотках від площі всієї частини легеВакцинна композиція TS6 139 (25) ні) ушкодженої поверхні по кожній із семи частин Не вакцинований контроль 11 (5) легені. Бали визначали в такий спосіб: Площа ушкодженої частини легені 0% 1-25% 26-50% 51-75% >75% Група TS6 Контроль Кількість балів 0 1 2 3 4 Рівні секреторних антитіл проти BQ14 у вакцинованих і контрольних тварин приведені в наступній таблиці, результати якої показують, що у вакцинованих свиней рівень секреторних антитіл був значно вищим через два-три тижні після провокуючої проби в порівнянні з не вакцинованим контролем. Секреторні антитіла проти BQ14 (за оптичною щільністю, OD) Д27 (до провокуючої Д42 (через 14 днів Д56 (через 28 днів Д0 (до вакцинації) проби) після проби) після проби) 0,026±0,001 0,033±0,002 0,201±0,089 0,264±0,043 0,030±0,001 0,031±0,001 0,107±0,028 0,075±0,011 Як видно з Фіг.1, тварини, вакциновані вакцинною композицією TS6, проявляли середній показник легень у 2,1±1,9 бали (середнє значення ± стандартне відхилення) у порівнянні з не вакцинованим контролем, для якого середній показник легень склав 7,8±4,1 балів. Ці результати свідчать про значне зменшення ушкоджень легень у свиней, вакцинованих вакцинною композицією, у порівнянні з не вакцинованим контролем. Приклад 4. Тривалість захисту від введення гетерологічної Mycoplasma byopnevmoniae Матеріали і методи. Поросят (38екз.) 3тижневого віку з материнськими антитілами (народжених від свиноматок, серопозитивних щодо Mycoplasma hyopneumoniae) розділяли випадковим чином на три групи в такий спосіб. Група 1 (12 поросят): вакцинували внутрішньом'язево в день 0 за допомогою 2мл вакцинної композиції, описаної в Прикладі 3. Група 2 (12 поросят): вакцинували в день 0 внутрішньом'язево за допомогою 2мл комерційної інактивованої вакцини від Mycoplasma hyopneumoniae. Група 3 (14 поросят): використовували як не вакцинований контроль. Група Вакцина TS6 Комерційна вакцина Контроль Усім поросятам через 20 тижнів після вакцинації вводили інтраназально в ніздрі приблизно по 5мл провокуючого штаму Мр88с Mycoplasma hyopneumoniae (6,6 log10 CCU/мл), як описано вище. Введення повторювали через 24 години. В усі х гр упах брали кров і виділяли одноядерні клітини периферійної крові (PBMN) для визначення рівня IFNg, як описано вище. У сироватці визначали антитіла типу ІgА і IgGl проти BQ14 через 138 днів у всіх гр упах. Після розтину розраховували показники легень у балах (середнє значення ± стандартне відхилення), як описано вище в Прикладі 3. Результати. Як видно з Фіг.1, поросята з групи 1, вакциновані вакцинною композицією TS6, проявляли середній показник легень у 0,4±0,9 бали, що є статистично значимим зменшенням показника ушкодження легень у порівнянні з комерційною вакциною (4,0±5,1) або не вакцинованим контролем (6,1±5,8). Середні результати (± стандартне відхилення) за рівнем антитіл типу Іg А і IgGl проти BQ14 у сироватці крові по кожній групі через 138 днів представлені в такий спосіб: IgG проти BQ14 (титр) 4,38±0,14 3,09±0,11 2,73±0,08 IgA проти BQ14 (титр) 0,56±0,06 0,09±0,01 0,09±0,01 25 84024 5´105 одноядерних клітин периферійної крові (PBMN): наступній таблиці приведені середні результати (± стандартне відхилення) щодо числа плям, секретуючих g-інтерферон (IFNg). У периферійну кров, з Група Вакцина TS6 Комерційна вакцина Контроль 26 Д28 81±20 5±2 6±3 Д138 9±2 3±1 2±2 Д152 28±7 6±1 11±8* * Якщо не враховува ти порося з аномально високим (109), то середнє значення контрольної групи буде числом плям становити 4 ± 1. Як і варто було очікувати при використанні інактивованої вакцини, частота появи IFNgсекретуючи х Т-клітин проти BQ14 через 138 днів після вакцинації була значно нижчою, ніж через 28 днів. Цікаво, що більшість свиней, вакцинованих TS6, усе ще давали позитивну реакцію через 138 днів, свідчачи, що клітинна відповідь зберігалася в цій групі. Частота появи IFNg-секретуючих Т-клітин проти BQ14 у крові через 152 дні (через 13 днів після провокуючої проби) сильно відрізнялася між трьома групами. У групі, вакцинованій TS6, виникла дуже сильна клітинна відповідь, на відміну від інших груп. Цей результат свідчить, що провокуюча проба ефективно відтворює імунну пам'ять, індуковану вакциною TS6. Приклад 5. Результати серології після введення однієї дози вакцини проти PCV-2 з ад'ювантом з емульсії TS6 Група ELISA (log10) Середнє стаВакцинована ндартне відхілення Середнє стаКонтрольна ндартне відхілення Матеріали і методи. Вільних від визначених патогенів поросят (SPF) у віці 2-3 місяці розділяли випадковим чином на 2 групи. Одну гр упу з 5 поросят вакцинували вн утрішньом'язево (у день 0) за допомогою 2мл вакцини, яка містить інактивований PCV-2 (штам ітріОІО) у кількості 6,8 log10 CCID50 на дозу (вакцинована група). Контрольну груп у з 5 поросят не вакцинували. Брали зразки крові через 0, 7, 14, 21 і 28 днів після вакцинації для визначення титру антитіл ORF2 проти PCV-2 методом ELISA. Результати, як видно з наступної таблиці, усі вакциновані проявляли значну відповідь антитіл ORF2 проти PCV-2 через 7-4 0 днів після вакцинації: Д0 Д7 Д14 Д21 Д28 1,00 0,00 2,53 0,89 3,50 0,79 3,45 0,84 3,88 0,37 1,00 0,00 1,00 0,00 1,00 0,00 1,00 0,00 1,27 1,24 Приклад 6. Захист вакциною проти PCV-2 з ад'ювактом з емульсії TS6 від провокуючої проби Матеріали і методи. Поросят SPF (16 екз.) у віці 4-5 днів розділяли випадковим чином на 2 групи в такий спосіб: одну групу з 8 поросят вакцинували двічі на 0 і 21 день шляхом внутрішньом'язевої ін'єкції 2мл вакцини, яка містить інактивований PCV-2 (штам imp1010) у кількості 7,55 log10 CCID50 на дозу (вакцинована група), тоді як контрольну Кількість балів Прострація Задишка Анемія (колір шкіри) Кашель Анорексія Рвота Ректальна температура Приріст за тиждень «n» перевищує приріст за тиждень «n - 1» Смертність груп у з 8 поросят не вакцинували. Усім поросятам на 3 5 день вводили інтраназально штам PCV-2 Imp1011-48285 (зберігається в ЕСАСС під номером доступу V98011608), який містить близько 5,5 log10 ССID50/мл, причому в кожну ніздрю вводили приблизно 5мл. Проводили дослідження методами ELISA і серонейтралізації (SN) і визначали клінічні показники в балах у кожного поросяти в такий спосіб: 0 немає немає рожевий немає немає немає t 1 жирний і/чи бі- > 1 дуже жирний і/чи лий і/чи застойний білий і/чи застойний відмічено асцитну рідину яскрава Очеревина немає ушкоджень Шлунок немає ушкоджень Тонка кишка немає ушкоджень Кишковик немає ушкоджень Брижові лімфатичні нормальні вузли є ушкодження є ушкодження є ушкодження є ушкодження 1 жирний і/чи білий і/чи застойний відмічено тільки в одному сегменті кишковика є ушкодження є ушкодження є ушкодження не відмічено Печінка Нирки Сечовий міхур немає ушкоджень немає ушкоджень немає ушкоджень Результати. Результати за серологією методом ELISA і титри нейтралізуючих антитіл у сироватці через 30 днів і 63 дня показують більш високі рівні у вакцинованих поросят, ніж у не вакцинованих контрольних тварин. У нижченаведеній таблиці приведені результати з виділення вірусу PCV-2 з фекальних мазків і тканини лімфатичних вузлів, а також сереГрупа Серологія за ELISA через 30 днів (log10) Серологія за ELISA через 63 дня (log10) Серологія за SN через 30 днів (log10) Серологія за SN через 63 дні (log10) PCV-2 у калі (% позитивних) PCV-2 у медіастинальних лімфовузлах (% позитивних) Клінічний показник Показник ушкоджень Приклад 7. Результати польового випробування ефективності вакцинації однією дозою інактивованоі вакцини PCV-2 з ад'ювантом TS6 Вакцинна композиція. Ад'ювант TS6 го тували, як описано в Прикладі 1. Вірус PCV-2 культивували в клітинах РК/15, і розмноження вірусу проводили, як описано в US Patent Serial No. 6,517,843 (Ellis et al.), зміст якого включено до даного винаходу у повному обсязі. Коротенько, по закінченні рахітична візуальна наявність Черевна порожнина нормальна Бляшки Пейерса 3 виразка > 1 жирний і/чи білий і/чи застойний відмічено в кількох сегментах кишковика > 1 дуже жирний і/чи білий і/чи застойний відмічено в кількох сегментах кишковика і дуже значні дні клінічні показники і показники ушкодження у вакцинованої і контрольної групи, Результати показують більш високі рівні циркулюючих антитіл і титрів SN у вакцинованих у порівнянні з контрольними тваринами. Клінічні показники й ушкодження легень також значно менші у вакцинованих поросят. Еволюція клінічних показників після провокуючої проби представлена на Фіг.3. Вакцинована 4,1±0,70 5,2±0,28 3,4±0,25 3,7±0,31 40 Контрольна 2,8±0,50 3,4±0,67 1,6±0,23 2,2±0,53 61 25 100 14 9,8 31 18,8 культивування заражені вірусом клітини збирали, лізували й отриманий вірус інактивували стандартними методами. Наприклад, інактивацію можна здійснити за допомогою 0,1% етиленіміна за 18 годин при +37°С; за допомогою 0,5% (3пропіолактону за 24 години при +28°С; або за допомогою 0,2% і 0,1% (3-пропіолактону за 24 години при +4°С. Якщо титр вірусу перед інактивацією виявлявся неадекватним, то вірусну суспензію 29 84024 30 концентрували шляхом ультрафільтрації, викорисфаза (100 мл) містила 88% Marcol 82, 1,8% Span товуючи мембрану з межею виключення в 15080 і 10,2% Tween 85. Водна фаза № 1 (100 мл) 300кДа. Інактивовану вірусну суспензію зберігали містила 88,5% 0,02М ізотонічного фосфатного буфера Na2HPO4/KH2PO4 (рН 7,8) і 11,5% 20%-го при +5°С до складання вакцини. Вміст антигену у розчину Tween 80. Водна фаза № 2 (400 мл) склавакцині встановлювали на рівні 2,1 log10 одиниць далася з 0,02М ізотонічного фосфатного буфера антигену на дозу. Відповідно до такого вмісту акNa2HPO4/KH2PO 4 (рН 7,8), який необов'язково містивність вакцини при визначенні активного інгредієнта в кінцевому продукті методом ELISA умовно тив імуногени. 100мл пре-емульсії розбавляли 400мл водної фази № 2, одержуючи емульсію LF2. приймали рівну як мінімум 100 од. ELISA на дозу. Кінцева концентрація детергенту в емульсії LF2 Методика вакцинації. Для перевірки ефективсклала 1,43%. Значення PIT емульсії LF2 було > ності вакцинної композиції в польових умовах була обрана ферма, яка зазвичай демонструє спалахи 45°С при визначенні за електропровідністю. мультисистемного синдрому виснаження після Приклад 9. Серологічний авалів після введенвідлучення (PMWS, postweaning multisystemic ня вакцини проти грипу свиней з ад'юванаюм з wasting syndrome), викликаного зараженням PCV-2 емульсії LF2 поросят. Свиноматок розділяли на дві групи, при Матеріали і методи. Поросят (15 екз.) у віці цьому вакциновані одержували внутрішньом'язево приблизно 10 тижнів розділяли випадковим чином одну ін'єкцію (доза в 2 мл) інактивованої вакцини на 3 групи. Першу гр упу (вакциновану) з 5 поросят PCV-2 з ад'ювантом TS6 за 2-3 тижні до опоросу. вакцинували двічі (у день 0 і день 28) за допомоДруга гр упа не була вакцинована і служила як конгою 2мл рекомбінантної вакцини проти грипу свитроль. Свиноматкам давали розродитися, а потім ней у кількості 7,7 log10 CCID50 на дозу шляхом спостерігали за рівнем смертності серед поросят внутрішньом'язевої ін'єкції. Ця вакцина на основі від вакцинованих (n=889) і контрольних свиномарекомбінантного експресійного вектора містила ток (n=713) аж до віку забою. вектор на основі віспяного вірусу канарок, який Результати. На Фіг.4 представлена діаграма, кодує і експресуючий нуклеопротеід (NP) і гемагяка відображає відсоток випадків PMWS у поросят лютинін (НА) вірусу грипу свиней H1N1. Другу грудо моменту забою, як видно з графіка, спостерігапу з 5 поросят вакцинували двічі (шляхом внутрілося зниження числа випадків PMWS у поросят, шньом'язевої ін'єкції в день 0 і день 28) за народжених від вакцинованих свиноматок, у порідопомогою 2мл рекомбінантної вакцини проти гривнянні з числом випадків у поросят від не вакципу свиней (у кількості 7,7 log10 CCID50 на дозу) з нованих контрольних свиноматок. Ці результати ад'ювантом з емульсії LF2 (LF2-вакцинована групоказують значне зниження клінічної захворювапа). П'ять поросят не піддавали вакцинації (контності при зараженні PCV-2 і показують корисність рольна група). Брали зразки крові через 0, 7, 14, вакцинування свиноматок незадовго до опоросу за 28, 42 і 56 днів після вакцинації для визначення допомогою інактивованої вакцини PCV-2 з ад'юватитрів інгібування гемаглютинації (НІ) . нтом TS6 для запобігання смертності і захворюваРезультати. Як видно з наступної таблиці, усі ності в зв'язку з зараженням PCV-2 у поросят. Ці вакциновані проявляли значну відповідь антитіл результати також показують, що можна досягти проти грипу свиней через 42-56 днів після вакцизначного зменшення PMWS серед поросят у даних нації (ANOVA, р
ДивитисяДодаткова інформація
Назва патенту англійськоюVaccine formulations comprising an oil-in-water emulsion
Автори англійськоюParisot Alexis Guy Andre, Des Gouilles-Blechet Stephanie Marie-Claire, Nordgren Robert M, Charreyre Catherine
Назва патенту російськоюНовые вакцинные композиции, которые содержат эмульсию типа "масло в воде"
Автори російськоюПаризо Алексис Ги Андре, Де-Гуйе-Блеше Стефани Мари-Катрин, Нордгрен Роберт М., Шарер Катрин
МПК / Мітки
МПК: A61P 31/00, A61K 39/39, A61K 9/107, A61P 11/00
Мітки: нові, емульсію, типу, води, містять, композиції, вакцинні, масло
Код посилання
<a href="https://ua.patents.su/19-84024-novi-vakcinni-kompozici-shho-mistyat-emulsiyu-tipu-maslo-u-vodi.html" target="_blank" rel="follow" title="База патентів України">Нові вакцинні композиції, що містять емульсію типу “масло у воді”</a>
Попередній патент: Насос шнековідцентровий
Наступний патент: Сполуки 2-(хіноксалін-5-ілсульфоніламіно)-бензаміду як модулятори сск2
Випадковий патент: Перев'язувальний плівковий матеріал