Система доставки лікарських засобів
Номер патенту: 84287
Опубліковано: 10.10.2008
Автори: руневеґен Рудолф Йоханнес Йосеф, Аут Генк Ян, де Графф Ваутер
Формула / Реферат
1. Система доставки лікарських засобів, яка має щонайменше одну камеру, що складається з (і) насиченого лікарським засобом ядра з термопластичного полімеру, (iі) насиченого лікарськими засобами проміжного шару з термопластичного полімеру і (ііі) ненасиченої ліками оболонки з термопластичного полімеру, що покриває проміжний шар, причому у зазначений проміжний шар введені (а) кристали першої фармацевтично активної сполуки та(b) друга фармацевтично активна сполука у розчиненому вигляді і у зазначене ядро введена зазначена друга сполука у розчиненому вигляді.
2. Система доставки лікарських засобів за п. 1, яка відрізняється тим, що є фізично стабільною приблизно при 18-30 °С.
3. Система доставки лікарських засобів за п. 1, яка відрізняється тим, що зазначена друга сполука представлена у ядрі у тій самій концентрації, що і в проміжному шарі.
4. Система доставки лікарських засобів за п. 1, яка відрізняється тим, що така система доставки, по суті, має кільцеподібну форму і призначена для введення у піхву.
5. Система доставки лікарських засобів за п. 1, яка відрізняється тим, що зазначеною першою активною сполукою є стероїд, і зазначеною другою активною сполукою є стероїд.
6. Система доставки лікарських засобів за п. 5, яка відрізняється тим, що зазначеною першою активною сполукою є прогестоген.
7. Система доставки лікарських засобів за п. 5, яка відрізняється тим, що зазначеною другою активною сполукою є естроген.
8. Система доставки лікарських засобів за п. 7, яка відрізняється тим, що естрогеном є етинілестрадіол.
9. Система доставки лікарських засобів за п. 6, яка відрізняється тим, що прогестогеном є етоногестрел.
10. Система доставки лікарських засобів за п. 1, яка відрізняється тим, що першою активною сполукою є етоногестрел, а другою активною сполукою є етинілестрадіол.
11. Система доставки лікарських засобів за п. 1, яка відрізняється тим, що у ній щонайменше оболонка, але, як варіант, також ядро і проміжний шар містять кополімер етилену і вінілацетату, як термопластичний полімер.
12. Система доставки лікарських засобів за п. 11, яка відрізняється тим, що у ній ядро і проміжний шар містять кополімер етилену і вінілацетату того ж самого типу, як термопластичний полімер.
13. Система доставки лікарських засобів за п. 11, яка відрізняється тим, що у ній ядро і проміжний шар мають тип кополімеру етилену і вінілацетату, відмінний від термопластичного полімеру.
14. Система доставки лікарських засобів за п. 1, яка відрізняється тим, що у ній в ядро додатково введена перша сполука.
15. Система доставки лікарських засобів за п. 8, яка відрізняється тим, що етинілестрадіол складає у проміжному шарі і ядрі від приблизно 0,05 до приблизно 1,5 мас.%.
16. Система доставки лікарських засобів за п. 15, яка відрізняється тим, що етинілестрадіол складає у проміжному шарі і ядрі від приблизно 0,08 до приблизно 0,5 мас.%.
17. Система доставки лікарських засобів за п. 16, яка відрізняється тим, що етинілестрадіол складає у проміжному шарі і ядрі від приблизно 0,09 до приблизно 0,18 мас.%.
18. Система доставки лікарських засобів за п. 17, яка відрізняється тим, що етинілестрадіол складає у проміжному шарі і ядрі від приблизно 0,09 до приблизно 0,15 мас.%.
19. Система доставки лікарських засобів за п. 16, яка відрізняється тим, що етинілестрадіол складає у проміжному шарі і ядрі від приблизно 0,09 до приблизно 0,20 мас.%.
20. Система доставки лікарських засобів за п. 9, яка відрізняється тим, що етоногестрел складає у проміжному шарі від приблизно 6 до приблизно 80 мас.%.
21. Система доставки лікарських засобів за п. 20, яка відрізняється тим, що етоногестрел складає у проміжному шарі від приблизно 6 до приблизно 70 мас.%.
22. Система доставки лікарських засобів за п. 21, яка відрізняється тим, що етоногестрел складає у проміжному шарі від приблизно 10 до приблизно 53 мас.%.
23. Система доставки лікарських засобів за п. 22, яка відрізняється тим, що етоногестрел складає у проміжному шарі від приблизно 10 до приблизно 30 мас.%.
24. Система доставки лікарських засобів за п. 23, яка відрізняється тим, що етоногестрел складає у проміжному шарі від приблизно 10 до приблизно 15 мас.%.
25. Система доставки лікарських засобів за п. 24, яка відрізняється тим, що етоногестрел складає у проміжному шарі від приблизно 10 до приблизно 12 мас.%.
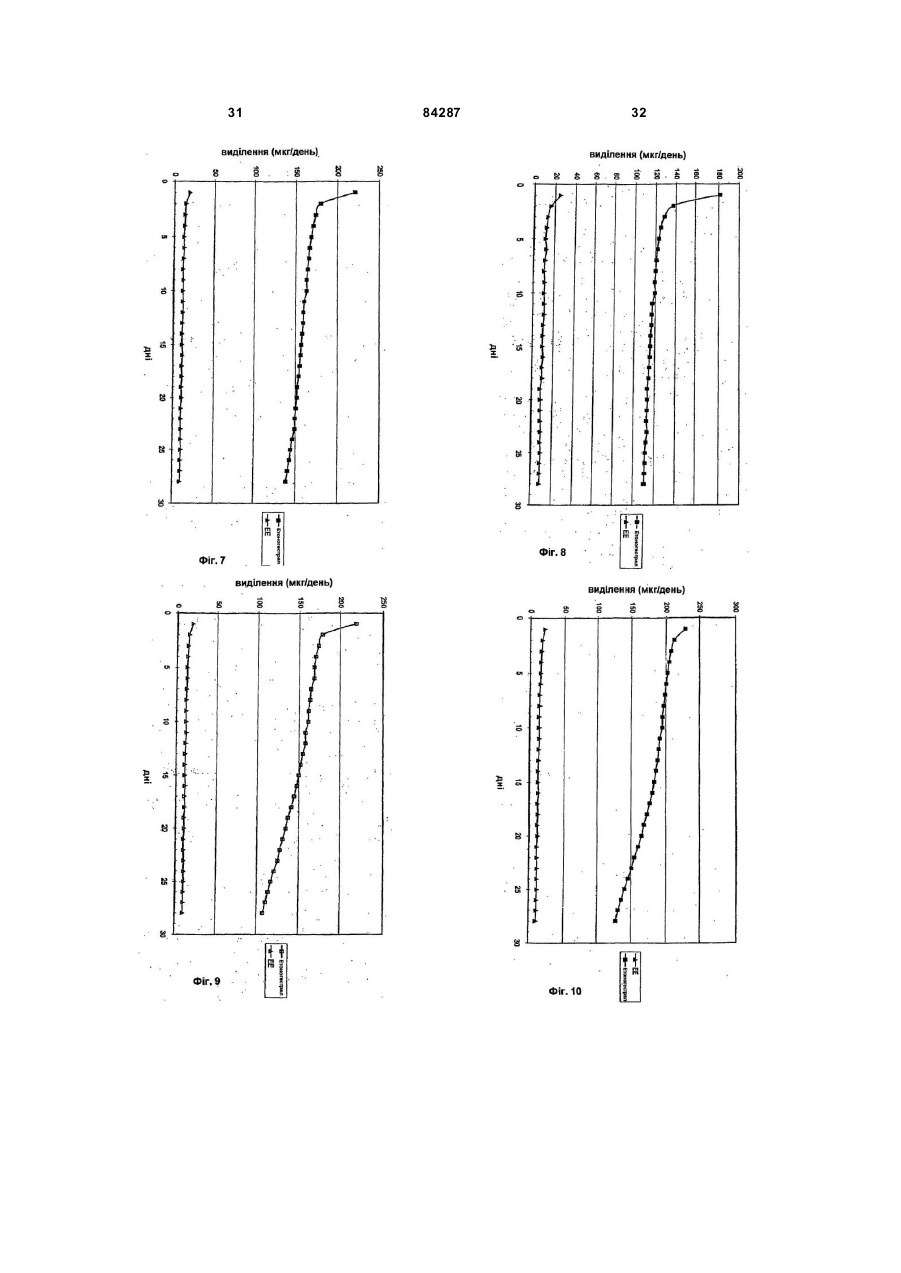
26. Система доставки лікарських засобів за п. 1, яка відрізняється тим, що відношення R1/R2, яке показано на фіг. 5, лежить між приблизно 1,0075 та приблизно 2,0000, і відношення R2/R3 лежить між приблизно 1,0075 та приблизно 2,0000.
27. Система доставки лікарських засобів за п. 26, яка відрізняється тим, що відношення R1/R2, яке показано на фіг. 5, лежить між приблизно 1,0100 та приблизно 1,5000, а відношення R2/R3 лежить між приблизно 1,0200 та приблизно 1,5000.
28. Система доставки лікарських засобів за п. 27, яка відрізняється тим, що відношення R1/R2, яке показано на фіг. 5, лежить між приблизно 1,0300 та приблизно 1,3000, а відношення R2/R3 лежить між приблизно 1,0200 та приблизно 1,5000.
29. Система доставки лікарських засобів за п. 28, яка відрізняється тим, що відношення R1/R2, яке показано на фіг. 5, лежить між приблизно 1,0400 та приблизно 1,1800, а відношення R2/R3 лежить між приблизно 1,0200 та приблизно 1,0500.
30. Система доставки лікарських засобів за п. 1, яка відрізняється тим, що відношення R1/R2, яке показано на фіг. 5, лежить між приблизно 1,0300 та приблизно 1,2000, а відношення R2/R3 лежить між приблизно 1,0100 та приблизно 1,0900.
31. Система доставки лікарських засобів за пп. 5-30, яка відрізняється тим, що у ній проміжний шар додатково містить антимікробний засіб.
32. Система доставки лікарських засобів за пп. 5-30, яка відрізняється тим, що у ній ядро додатково містить антимікробний засіб.
33. Система доставки лікарських засобів за будь-яким з попередніх пунктів, яка відрізняється тим, що вона містить дві камери.
34. Система доставки лікарських засобів за п.33, яка відрізняється тим, що друга камера містить антимікробний засіб.
35. Система доставки лікарських засобів за будь-яким з пп. 31-34, яка відрізняється тим, що антимікробним засобом є конденсаційний полімер мигдалевої кислоти.
36. Спосіб контрацепції, який включає операції (і) розміщення системи доставки лікарських засобів за будь-яким з пп. 1-30 у піхвовому тракті жінки і (іі) утримання системи у піхвовому тракті щонайменше приблизно 21 день.
37. Спосіб контрацепції, який включає операції (і) розміщення системи доставки лікарських засобів за будь-яким з пп. 1-30 у піхвовому тракті жінки, (іі) утримання системи у піхвовому тракті щонайменше приблизно 21 день і (ііі) видалення системи приблизно за один тиждень до менструації.
38. Спосіб супутнього забезпечення контрацепції і лікування або запобігання венеричним захворюванням, який включає операції (і) розміщення системи доставки лікарських засобів за будь-яким з пп. 31-35 у піхвовому тракті жінки і (іі) утримання системи у піхвовому тракті щонайменше приблизно 21 день.
39. Спосіб супутнього забезпечення контрацепції і лікування або запобігання венеричним захворюванням, який включає операції (і) розміщення системи доставки лікарських засобів за будь-яким з пп. 31-35 у піхвовому тракті жінки, (іі) утримання системи у піхвовому тракті щонайменше приблизно 21 день і (ііі) видалення системи приблизно за один тиждень до менструації.
40. Використання системи доставки лікарських засобів за будь-яким з пп. 1-30 для виготовлення контрацептивного комплекту.
41. Використання системи доставки лікарських засобів за будь-яким з пп. 1-30 для виготовлення медикаменту для гормонзамісної терапії.
42. Використання системи доставки лікарських засобів за будь-яким з пп. 31-35 для виготовлення комбінованого препарату, щоб забезпечити контрацепцію і лікування і/або запобігання венеричним захворюванням.
43. Використання за п.42, яке відрізняється тим, що захворюванням є СНІД.
44. Використання за п.42, яке відрізняється тим, що захворюванням є герпес.
45. Використання за п.42, яке відрізняється тим, що захворюванням є хламідіоз.
46. Використання за п.42, яке відрізняється тим, що захворюванням є гонорея.
47. Спосіб виготовлення тришарової системи доставки ліків за п. 1, який включає:
(і) виготовлення насиченого ядра з гранульованого гомогенного полімеру і насиченого проміжного шару з гранульованого гомогенного полімеру;
(іі) спільне екструдування гранульованого ядра і гранульованого проміжного шару з оболонкою з гранульованого полімеру у формі тришарової системи доставки лікарських засобів.
48. Спосіб за п. 47, який відрізняється тим, що операція (і) включає:
a) здрібнювання полімеру;
b) змішування здрібненого у порошок полімеру з активними сполуками, які будуть введені у проміжний шар;
c) змішування здрібненого у порошок полімеру з активною сполукою, яка буде введена у ядро;
d) змішане екструдування отриманих в результаті операцій (b) і (с) порошкових сумішей;
e) розрізання отриманої насиченої полімерної нитки на гранули, отримуючи таким чином гранульоване ядро і гранульований проміжний шар;
f) змазування обох - гранульованого ядра і гранульованого проміжного шару, мастилом, причому операції (b) і (с) є взаємозамінними.
49. Система доставки лікарських засобів, яка має щонайменше одну камеру, що складається з (і) насиченого лікарськими засобами ядра з термопластичного полімеру,
(іі) насиченого лікарськими засобами проміжного шару з термопластичного полімеру і
(ііі) ненасиченої ліками оболонки з термопластичного полімеру, що покриває проміжний шар, причому у зазначений проміжний шар введені кристали першої фармацевтично активної сполуки, а зазначене ядро насичене другою фармацевтично активною сполукою у розчиненому вигляді.
Текст
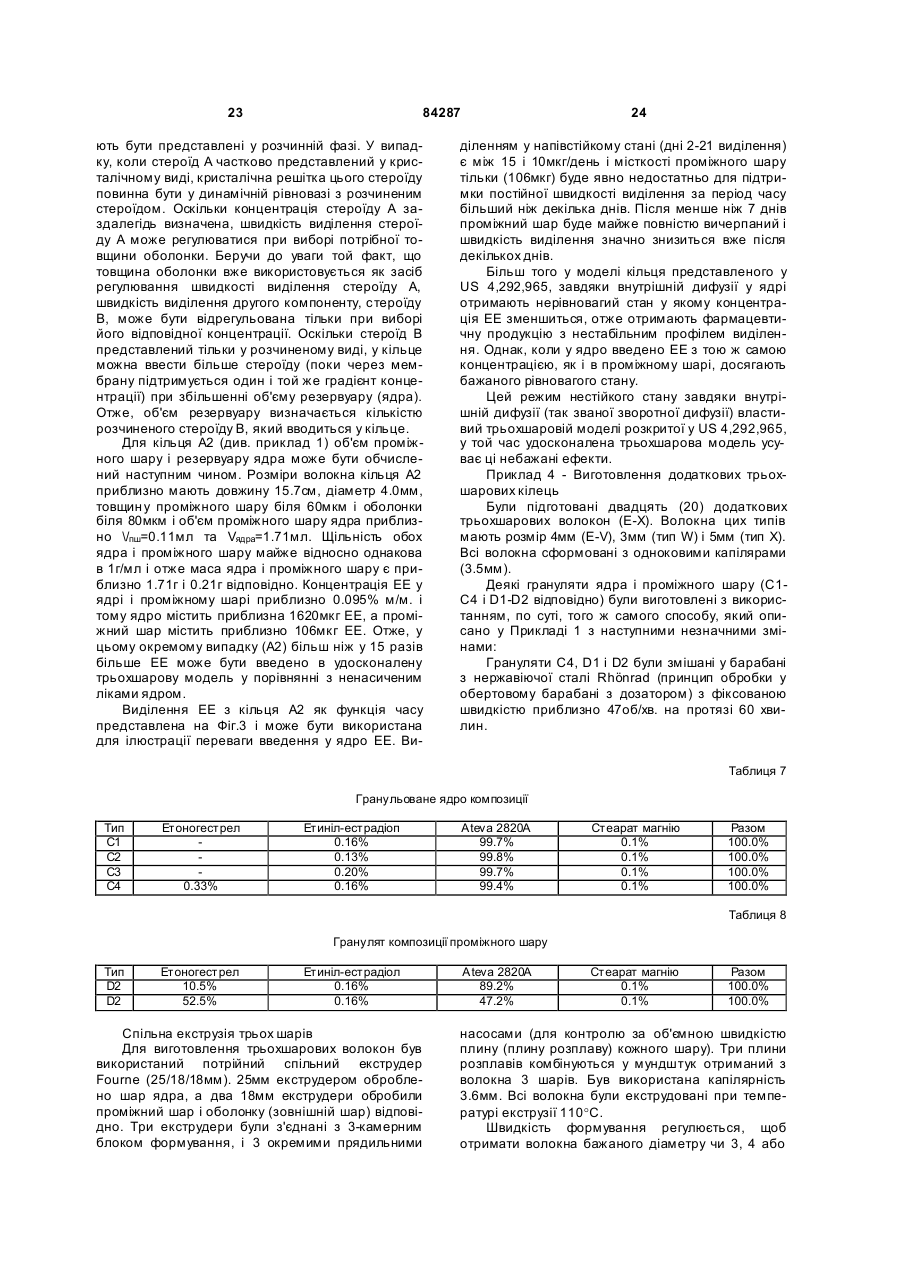
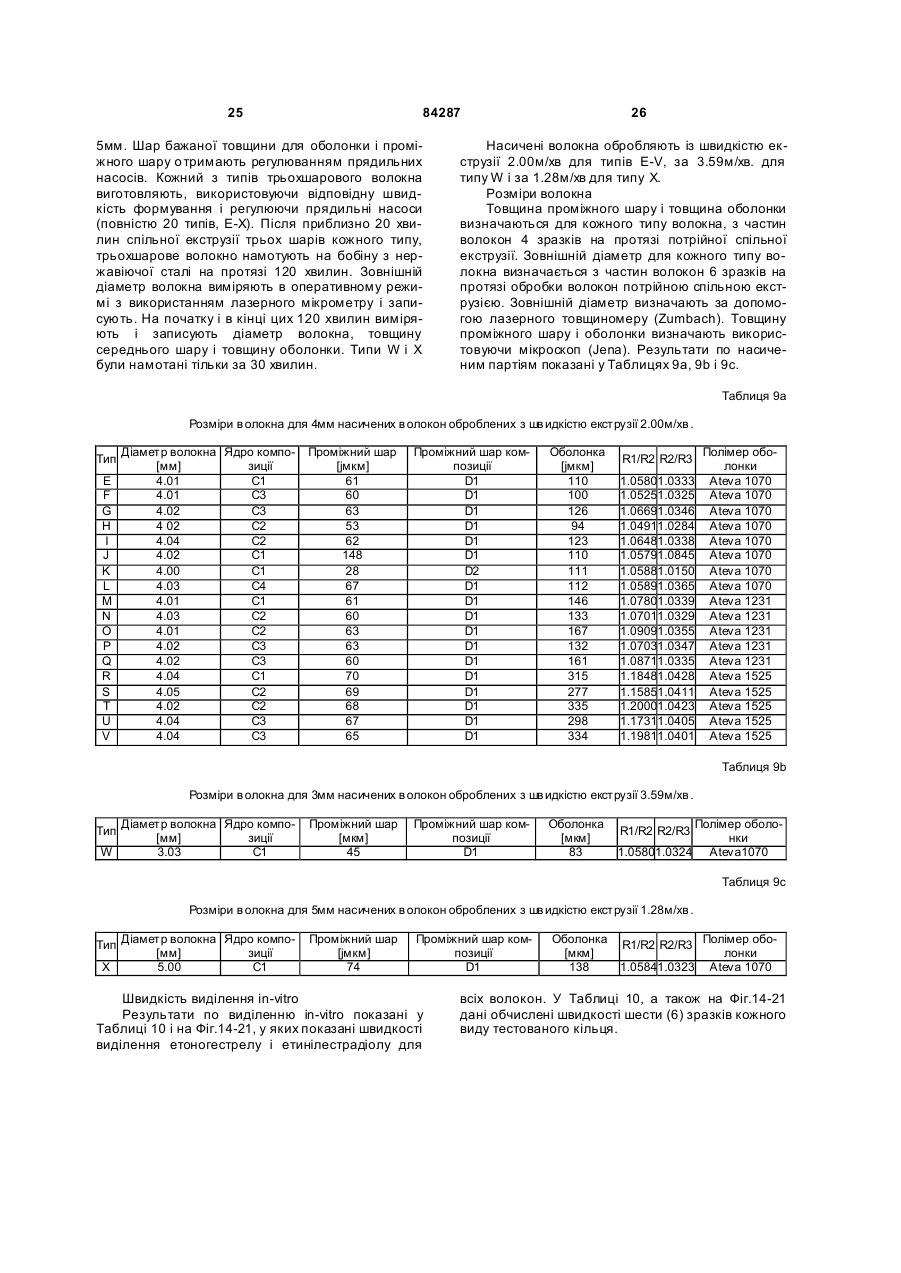
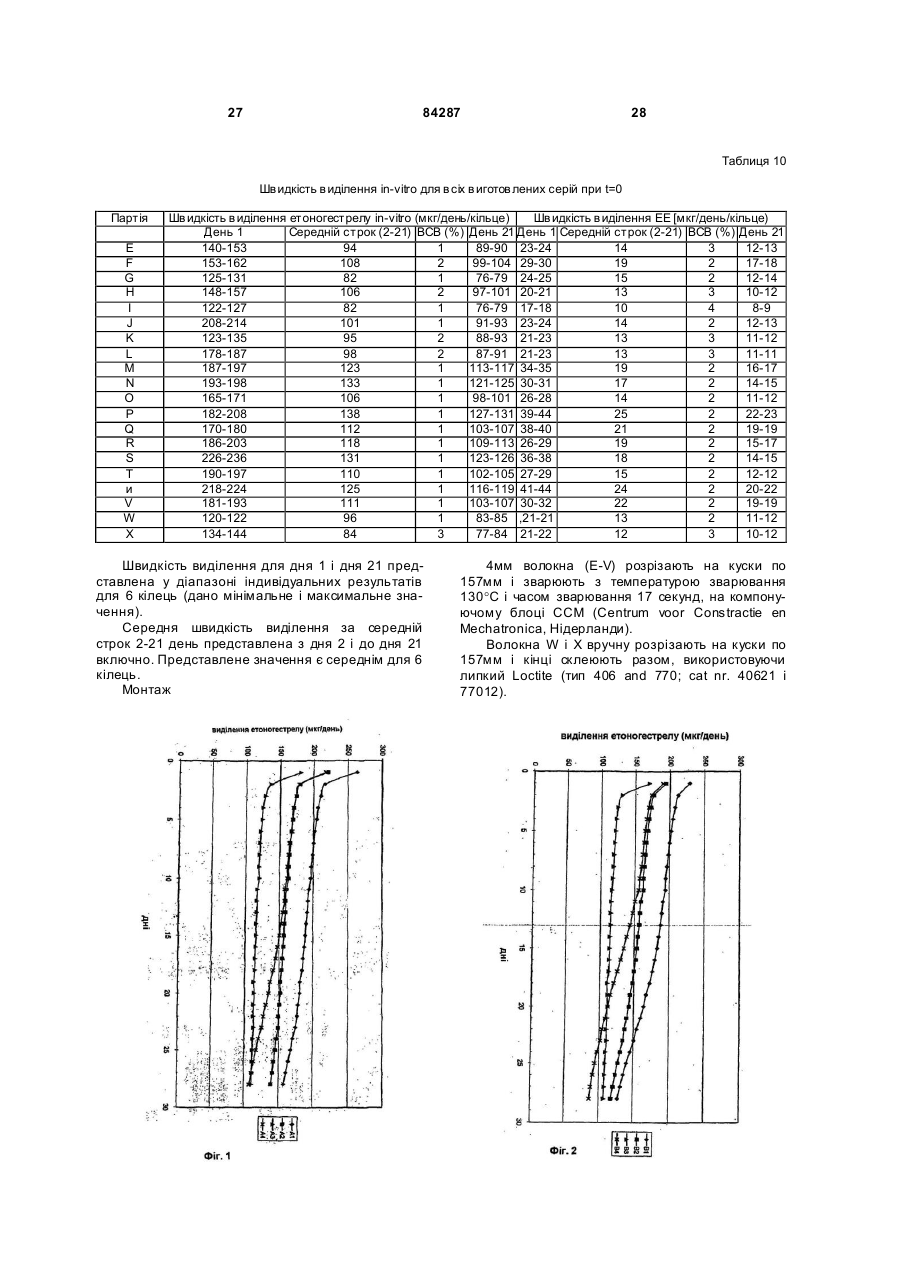
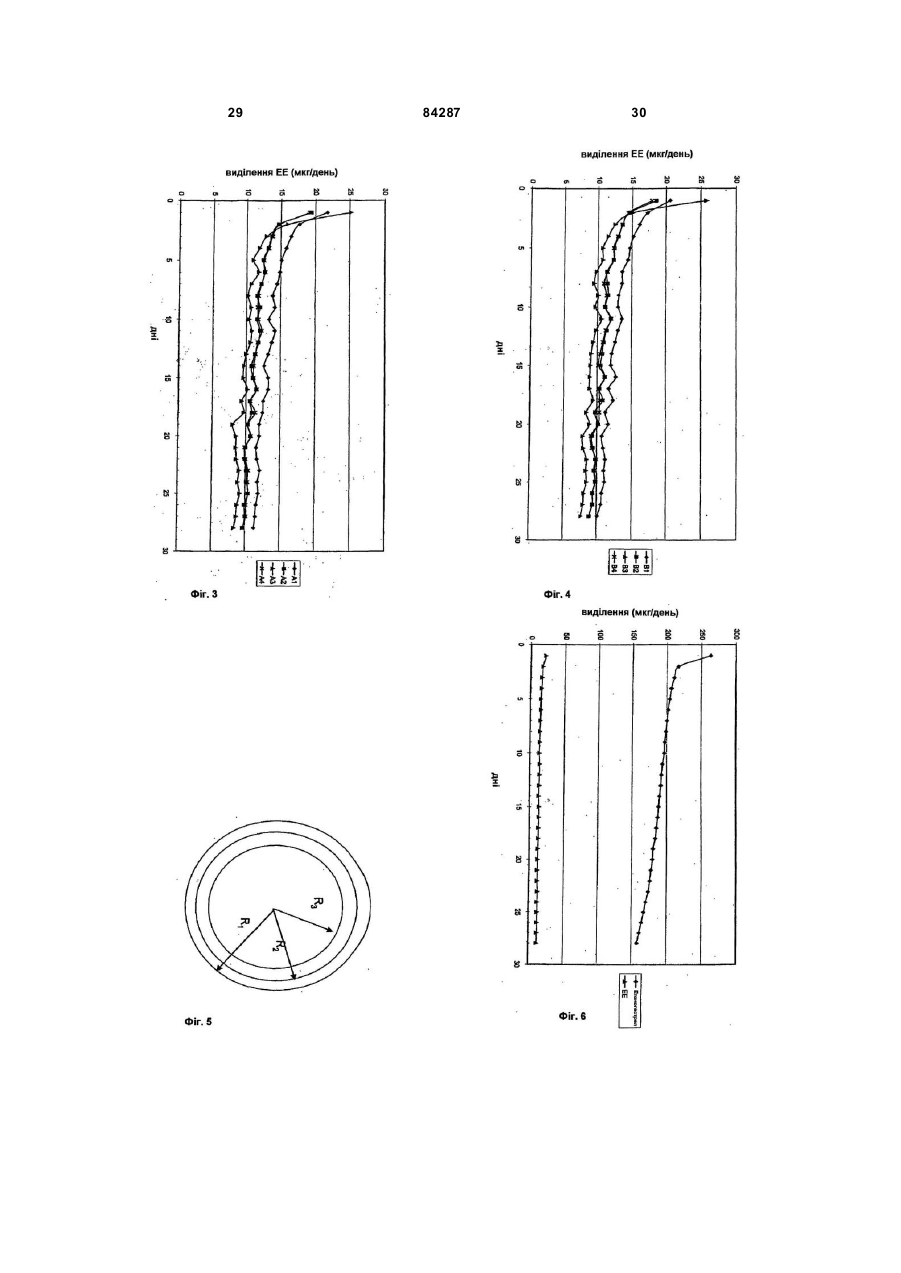
1. Система доставки лікарських засобів, яка має щонайменше одну камеру, що складається з (і) насиченого лікарським засобом ядра з термопластичного полімеру, (iі) насиченого лікарськими засобами проміжного шару з термопластичного полімеру і (ііі) ненасиченої ліками оболонки з термопластичного полімеру, що покриває проміжний шар, причому у зазначений проміжний шар введені (а) кристали першої фармацевтично активної сполуки та (b) друга фармацевтично активна сполука у розчиненому вигляді і у зазначене ядро введена зазначена друга сполука у розчиненому вигляді. 2. Система доставки лікарських засобів за п. 1, яка відрізняє ться тим, що є фізично стабільною приблизно при 18-30°С. 3. Система доставки лікарських засобів за п. 1, яка відрізняє ться тим, що зазначена друга сполука представлена у ядрі у тій самій концентрації, що і в проміжному шарі. 4. Система доставки лікарських засобів за п. 1, яка відрізняє ться тим, що така система доставки, по суті, має кільцеподібну форму і призначена для введення у піхву. 5. Система доставки лікарських засобів за п. 1, яка відрізняє ться тим, що зазначеною першою активною сполукою є стероїд, і зазначеною другою активною сполукою є стероїд. 6. Система доставки лікарських засобів за п. 5, яка відрізняє ться тим, що зазначеною першою активною сполукою є прогестоген. 2 (19) 1 3 84287 19. Система доставки лікарських засобів за п. 16, яка відрізняє ться тим, що етинілестрадіол складає у проміжному шарі і ядрі від приблизно 0,09 до приблизно 0,20мас.%. 20. Система доставки лікарських засобів за п. 9, яка відрізняється тим, що е тоногестрел складає у проміжному шарі від приблизно 6 до приблизно 80мас.%. 21. Система доставки лікарських засобів за п. 20, яка відрізняється тим, що е тоногестрел складає у проміжному шарі від приблизно 6 до приблизно 70мас.%. 22. Система доставки лікарських засобів за п. 21, яка відрізняється тим, що е тоногестрел складає у проміжному шарі від приблизно 10 до приблизно 53мас.%. 23. Система доставки лікарських засобів за п. 22, яка відрізняється тим, що е тоногестрел складає у проміжному шарі від приблизно 10 до приблизно 30мас.%. 24. Система доставки лікарських засобів за п. 23, яка відрізняється тим, що е тоногестрел складає у проміжному шарі від приблизно 10 до приблизно 15мас.%. 25. Система доставки лікарських засобів за п. 24, яка відрізняється тим, що е тоногестрел складає у проміжному шарі від приблизно 10 до приблизно 12мас.%. 26. Система доставки лікарських засобів за п. 1, яка відрізняється тим, що відношення R1/R2, яке показано на Фіг.5, лежить між приблизно 1,0075 та приблизно 2,0000, і відношення R2/R3 лежить між приблизно 1,0075 та приблизно 2,0000. 27. Система доставки лікарських засобів за п. 26, яка відрізняється тим, що відношення R1/R2, яке показано на Фіг.5, лежить між приблизно 1,0100 та приблизно 1,5000, а відношення R2/R3 лежить між приблизно 1,0200 та приблизно 1,5000. 28. Система доставки лікарських засобів за п. 27, яка відрізняється тим, що відношення R1/R2, яке показано на Фіг.5, лежить між приблизно 1,0300 та приблизно 1,3000, а відношення R2/R3 лежить між приблизно 1,0200 та приблизно 1,5000. 29. Система доставки лікарських засобів за п. 28, яка відрізняється тим, що відношення R1/R2, яке показано на Фіг.5, лежить між приблизно 1,0400 та приблизно 1,1800, а відношення R2/R3 лежить між приблизно 1,0200 та приблизно 1,0500. 30. Система доставки лікарських засобів за п. 1, яка відрізняється тим, що відношення R1/R2, яке показано на Фіг.5, лежить між приблизно 1,0300 та приблизно 1,2000, а відношення R2/R3 лежить між приблизно 1,0100 та приблизно 1,0900. 31. Система доставки лікарських засобів за пп. 530, яка відрізняється тим, що у ній проміжний шар додатково містить антимікробний засіб. 32. Система доставки лікарських засобів за пп. 530, яка відрізняється тим, що у ній ядро додатково містить антимікробний засіб. 33. Система доставки лікарських засобів за будьяким з попередніх пунктів, яка відрізняється тим, що вона містить дві камери. 34. Система доставки лікарських засобів за п.33, яка відрізняється тим, що друга камера містить антимікробний засіб. 4 35. Система доставки лікарських засобів за будьяким з пп. 31-34, яка відрізняється тим, що антимікробним засобом є конденсаційний полімер мигдалевої кислоти. 36. Спосіб контрацепції, який включає операції (і) розміщення системи доставки лікарських засобів за будь-яким з пп. 1-30 у піхвовому тракті жінки і (іі) утримання системи у піхвовому тракті щонайменше приблизно 21 день. 37. Спосіб контрацепції, який включає операції (і) розміщення системи доставки лікарських засобів за будь-яким з пп. 1-30 у піхвовому тракті жінки, (іі) утримання системи у піхвовому тракті щонайменше приблизно 21 день і (ііі) видалення системи приблизно за один тиждень до менструації. 38. Спосіб супутнього забезпечення контрацепції і лікування або запобігання венеричним захворюванням, який включає операції (і) розміщення системи доставки лікарських засобів за будь-яким з пп. 31-35 у піхвовому тракті жінки і (іі) утримання системи у піхвовому тракті щонайменше приблизно 21 день. 39. Спосіб супутнього забезпечення контрацепції і лікування або запобігання венеричним захворюванням, який включає операції (і) розміщення системи доставки лікарських засобів за будь-яким з пп. 31-35 у піхвовому тракті жінки, (іі) утримання системи у піхвовому тракті щонайменше приблизно 21 день і (ііі) видалення системи приблизно за один тиждень до менструації. 40. Використання системи доставки лікарських засобів за будь-яким з пп. 1-30 для виготовлення контрацептивного комплекту. 41. Використання системи доставки лікарських засобів за будь-яким з пп. 1-30 для виготовлення медикаменту для гормонзамісної терапії. 42. Використання системи доставки лікарських засобів за будь-яким з пп. 31-35 для виготовлення комбінованого препарату, щоб забезпечити контрацепцію і лікування і/або запобігання венеричним захворюванням. 43. Використання за п.42, яке відрізняється тим, що захворюванням є СНІД. 44. Використання за п.42, яке відрізняється тим, що захворюванням є герпес. 45. Використання за п.42, яке відрізняється тим, що захворюванням є хламідіоз. 46. Використання за п.42, яке відрізняється тим, що захворюванням є гонорея. 47. Спосіб виготовлення тришарової системи доставки ліків за п. 1, який включає: (і) виготовлення насиченого ядра з гранульованого гомогенного полімеру і насиченого проміжного шару з гранульованого гомогенного полімеру; (іі) спільне екструдування гранульованого ядра і гранульованого проміжного шару з оболонкою з гранульованого полімеру у формі тришарової системи доставки лікарських засобів. 48. Спосіб за п. 47, який відрізняється тим, що операція (і) включає: a) здрібнювання полімеру; b) змішування здрібненого у порошок полімеру з активними сполуками, які будуть введені у проміжний шар; 5 84287 6 c) змішування здрібненого у порошок полімеру з активною сполукою, яка буде введена у ядро; d) змішане екструдування отриманих в результаті операцій (b) і (с) порошкових сумішей; e) розрізання отриманої насиченої полімерної нитки на гранули, отримуючи таким чином гранульоване ядро і гранульований проміжний шар; f) змазування обох - гранульованого ядра і гранульованого проміжного шару, мастилом, причому операції (b) і (с) є взаємозамінними. 49. Система доставки лікарських засобів, яка має щонайменше одну камеру, що складається з (і) насиченого лікарськими засобами ядра з термопластичного полімеру, (іі) насиченого лікарськими засобами проміжного шару з термопластичного полімеру і (ііі) ненасиченої ліками оболонки з термопластичного полімеру, що покриває проміжний шар, причому у зазначений проміжний шар введені кристали першої фармацевтично активної сполуки, а зазначене ядро насичене другою фармацевтично активною сполукою у розчиненому вигляді. Даний винахід стосується області контрацепції жінки і гормонозаміняючої терапії. Представлений винахід стосується системи (пристрою) доставки лікарських засобів для одночасного виділення двох або більше активних речовин і, зокрема, кільцеподібної системи доставки лікарських засобів для піхви, за допомогою яких система вивільняє активні речовини, по суті, у постійному співвідношенні за тривалий проміжок часу. Оскільки винахід стосується доставки лікарських засобів при внутрішньопіховому використанні, він зазвичай використовується при таких медичних показниках жінки, як контрацепція або гормонозаміняюча терапія. Виріб згідно винаходу представлений у вигляді кільця, і в подальшому будемо називати його піховим кільцем. Піхові кільця є відомими і область техніки, що слугувала в цьому відношенні передумовою створення винаходу, включає наступні патенти. У U.S No3,995,633 і 3,995,634, розкрито окремі, переважно сферичні або циліндричні резервуари, що містять різні активні речовини, які змонтовані у спеціально сконструйовані обойми. У U.S No.4,237,885 розкрита канюля або спіраль з полімерного матеріалу, яка розділена на частини за допомогою сукупності "прокладок" вмонтованих в канюлю, після чого, кожна з розділених частин канюлі заповняється іншою активною речовиною із силіконовим маслом, а два кінці канюлі потім з'єднуються один з одним. Однак у цій системі виділення, через стінку канюлі активний матеріал проходить (дифузія) з одного резервуара в інший, особливо при тривалому зберіганні, так що заздалегідь задане фіксоване співвідношення вивільнення між активними речовинами є сумнівним і повинно через якийсь час змінюватися. У європейській публікації патенту 0,050,867 розкрито двошарове піхове кільце, яке має фармакологічно прийнятне опорне кільце покрите двома шарами переважно силіконових еластомерів, причому внутрішній шар із силіконового еластомеру насичений активною речовиною. У US No.4,292,965 описана кільцеподібна система доставки для піхви з трьома шарами зробленими із силіконових еластомерів. У US 4,596,576 розкрито піхове кільце з двома камерами, у якому кожна камера містить іншу активну речовину. Для отримання відповідного кільця з постійним співвідношенням виділення між різними активними речовинами кінцеві частини камер з'єднані скляною пробкою. У публікації патенту WO 97/02015 описано пристрій з двома камерами, перша камера містить ядро, насичений ліками середній шар і не насичений ліками зовнішній шар і друга камера містить насичене ліками ядро і не насичений ліками зовнішній шар. У ЕР 876815 розкрито піхове кільце (Nuvaring®), яке призначене для одночасного виділення прогестогенної стероїдної сполуки та естрогенної стероїдної сполуки у фіксованому фізіологічному співвідношенні за тривалий період часу. Система доставки лікарських засобів має одну камеру, що має ядро з термопластичного полімеру, яке містить суміш прогестогенної та естрогенної сполук і оболонку з термопластичного полімеру, прогестогенна сполука спочатку розчиняється у матеріалі полімеру ядра з відносно низьким ступенем перенасичення. З наведених вище розкриттів винаходів витікає, що, наприклад, матеріал, шари і камери в усіх відношеннях є спроектованим і розробленим кільцевим пристроєм. Все це зазвичай зроблено з метою отримання моделі постійного виділення, яка ускладнюється, коли застосовуються дві або більше активних речовини. Останнє - особливо важливо в області контрацепції, оскільки з цією метою часто застосовується комбінація прогестогену та естрогену. Також при заміні гормону бажано мати кільця, які доставляють комбінації лікарських засобів. Серед наведених вище розкриттів винаходів, EP 876815 чітко визначає стандарт; там використовують модель з одною камерою, уникають необхідності використовувати силастичний полімер при використанні комбінацій EBA і дві або більше активних речовини виділяються, по суті, з постійним співвідношенням одна до одної за тривалий проміжок часу. Як на будь-який виріб це технологія на всі часи, однак згодом також можна буде це ще удосконалити. Пристрій доставки лікарських засобів розкритий у EP 876815 є фізично стабільним тільки, коли зберігається при температурі нижче кімнатної. Він потребує зберігання і транспортування при температурі нижче кімнатної, що дорого коштує і потребує більшої уваги. Більш того, якщо він не зберігається при температурі нижче кімнатної, стероїд з часом кристалізується на оболонці при 7 84287 строю, що може привести до не контрольованого виділення і виділення при розриві. Удосконалена система доставки лікарських засобів вирішує цю проблему, оскільки вона є фізично стабільною при режимах кімнатної температури і отже не потребує спеціальних умов зберігання і транспортування. Більш того в удосконаленій системі доставки лікарських засобів можливо регулювання швидкості виділення більш ніж одної фармацевтично активної сполуки незалежно від іншої, доки підтримується фізична стабільність системи. Винахід представляє трьохшарове піхове кільце, фізично стабільне при кімнатній температурі, з якого можуть бути виділені незалежно одна від одної щонайменше дві фаормацевтично активні сполуки. Кільце має, щонайменше, одну камеру, яке має (і) насичене ліками ядро з термопластичного полімеру, (іі) насичений ліками проміжний шар з термопластичного полімеру і (ііі) не насичену ліками оболонку з термопластичного полімеру, що покриває проміжний шар. Проміжний шар насичений (заповнений) (а) кристалами першої активної речовини і (b) другої активної речовини у розчинному вигляді. Ядро заповнене другою активною речовиною, як варіант, у тій же концентрації, як і у проміжному шарі. Фіг.1: Швидкості виділення in vitro етоногестрелу (ЕНГ) для всіх 4.0мм партій. Фіг.2: Швидкості виділення in vitro етоногестрелу (ЕНГ) для всіх 3.5мм партій. Фіг.3: Швидкості виділення in vitro етинілестрадіолу (EE) для всіх 4.0мм партій. Фіг.4: Швидкості виділення in vitro етинілестрадіолу (EE) для всіх 3.5мм партій. Фіг.5: Схематичний опис піхового кільця. Фіг.6: Швидкості виділення in vitro етоногестрелу та етинілестрадіолу з одного кільця А1. Фіг.7: Швидкості виділення in vitro етоногестрелу та етинілестрадіолу з одного кільця А2. Фіг.8: Швидкості виділення in vitro етоногестрелу та етинілестрадіолу з одного кільця A3. Фіг.9: Швидкості виділення in vitro етоногестрелу та етинілестрадіолу з одного кільця А4. Фіг.10: Швидкості виділення in vitro етоногестрелу та етинілестрадіолу з одного кільця В1. Фіг.11: Швидкості виділення in vitro етоногестрелу та етинілестрадіолу з одного кільця В2. Фіг.12: Швидкості виділення in vitro етоногестрелу та етинілестрадіолу з одного кільця В3. Фіг.13: 8 Швидкості виділення in vitro етоногестрелу та етинілестрадіолу з одного кільця В4. Фіг.14: Швидкості виділення in vitro етоногестрелу для типів волокна E1 F, G, H і І. Фіг.15: Швидкості виділення in vitro етоногестрелу для типів волокна J, K, L, W і X. Фіг.16: Швидкості виділення in vitro етоногестрелу для типів волокна M, N, O 1 P та Q. Фіг.17: Швидкості виділення in vitro етоногестрелу для типів волокна R, S, T, U та V. Фіг.18: Швидкості виділення in vitro етинілестрадіолу для типів волокна E, F, G, H та І. Фіг.19: Швидкості виділення in vitro етинілестрадіолу для типів волокна J, K1 L, W та X. Фіг.20: Швидкості виділення in vitro етинілестрадіолу для типів волокна M1 N1 O 1 P та Q. Фіг.21: Швидкості виділення in vitro етинілестрадіолу для типів волокна R, S, T, U та V. Закон дифузії Фіка впливає на виділення з кільця сполук таких, як контрацептивні стероїди. Згідно цього закону об'єм маси, що переміщується через межу є зворотною функцією довжини від краю межі. У двошаровій моделі стероїд найближчий до зовнішнього шару (оболонки) повинен дифундувати першим і це призводить до зменшення зовнішньої поверхні ядра і тому дифузійна довжина збільшується. Зменшення зовнішнього шару ядра і в результаті цього збільшення дифузійної довжини призводить до зменшення швидкості виділення. Коли мова йде про швидкість виділення однієї лікарської субстанції, проблему зменшення або збільшення дифузійної довжини можна здолати концентруючи лікарську субстанцію у проміжному шарі між оболонкою з плацебо і ядром із плацебо. Оскільки, лікарська субстанція тоді сконцентрована відповідно у тонкому шарі, подовження дифузійної довжини протягом виділення є мінімальним, що призводить до більш постійної швидкості виділення на протязі досить довгого часу. Швидкістю виділення у моделі циліндричного резервуару/мембрани є: DM=27pLDрKp/s ΔC dt Ln(r0/r1) L=довжина циліндру Dp=коефіцієнт дифузії сполуки у полімерній оболонці Кр/s=коефіцієнт розподілу стероїду між оболонкою і ядром з полімеру ΔC=різниця у концентрації між ядром (або проміжним шаром) і стоком r0=сумарний радіус , тобто радіус циліндру, включаючи оболонку r1=радіус ядра З рівняння видно, що нульовий порядок виділення отримують, коли член рівняння справа дорівнює константі, тобто не є функцією часу. Подов 9 84287 ження дифузійної довжини завдяки зменшення ядра є незначним у трьохшаровій моделі, що містить одну лікарську субстанцію і член рівняння (r0/r1) може вважатися константою. У випадку присутності у розчинному вигляді стероїду, градієнт концентрації (ΔC) з часом монотонно убуває і тому швидкість виділення dM/dt зменшиться (відхилиться від кінетики виділення нульового порядку). Об'єкт винаходу представляє систему доставки лікарських засобів, яка має щонайменше дві лікарські субстанції. Об'єкт винаходу представляє систему доставки лікарських засобів, типово, головним чином, кільцеподібної форми, призначеної для введення у піхву, яка має, щонайменше, одну камеру, що містить (і) ядро з термопластичного полімеру, (іі) проміжний шар з термопластичного полімеру і (ііі) оболонку з термопластичного полімеру, що покриває проміжний шар, причому зазначений проміжний шар має (а) кристали першої фармацевтично активної сполуки і (b) другої фармацевтично активної сполуки у розчинному виді, а зазначене ядро має зазначену другу сполуку також, як варіант, такої ж концентрації, як у проміжному шарі. Суть об'єкта винаходу цього нового трьохшарового кільця полягає у забезпеченні можливості регулювати швидкість виділення більш ніж одної формацевтично активної сполуки незалежно одна від іншої доки при кімнатній температурі підтримується фізична стабільність кільця. Це досягається (1) введенням кристалічних резервуарів з (першої) сполукою у проміжний шар кільця, (2) наповненням обох проміжного шару і ядра кільця другою сполукою у розчинному виді, і таким чином збільшенням резервуару для сполуки і (3) визначенням товщини оболонки кільця. У конкретному втіленні об'єкту винаходу сполуками є стероїди. Для полегшення ми в подальшому будемо говорити про стероїди, хоча також будуть розглядатися і не стероїдні сполуки Молекули стероїду введені у кристалічну решітку перебувають у динамічній рівновазі із стероїдом розчинним у полімері проміжного шару. Коли немає дифузії, концентрація стероїду у полімері буде дорівнювати або буде близькою до рівноважної концентрації. Потім у кільце вставляють стік, стероїд повинен почати виливатися назовні кільця і концентрація стероїду розчиненого у полімерному проміжному шарі повинна незначно зменшитися. В результаті чого кристали стероїду повинні почати розчинятися. Таким чином, зменшення градієнта концентрації завдяки дифундивного переміщення назовні кільця урівноважується стероїдом у кристалічному резервуарі. Фіг.1 та 2 ілюструють цей ефект стабілізації кристалів у проміжному шарі. Спочатку нахил кривої виділення дуже невеликий, тобто вказує, що виділення майже нульового порядку до 10 днів. Потім, після 10 днів, крива виділення раптом стає більш крутішою, тобто швидкість виділення стає більш залежною від часу (менше нульового порядку). Імовірно цей момент співпадає з моментом у якому розмір і кількість кристалів у матриці полімеру має зменшитися з певної точки і з цієї точки втрата стероїду завдяки дифузії зовні кільця не може бути 10 більше пропорційно урівноважених кристалів, що продовжують розчинюватися. Коли більшість кристалів розчиниться, градієнт концентрації стабілізується ненадовго і тому крива стає крутішою. Градієнт концентрації стабілізується цими функціями технічного процесу, коли розчинення кристалів стероїду протікає швидко порівняно з втратою стероїду завдяки дифузії. Тому зниження концентрації обернено пропорційне певній величині і результуючий ефект повинен бути нульовим і забезпечується кристалами, що розчиняються відносно швидко у полімері. Іншими словами об'єкт винаходу є трьохшарове кільце, що має щонайменше одну камеру, що складається з (і) проміжного шару заповненого двома стероїдами, один (стероїд А) частково представляє кристалічну фазу і частково розчинний у полімері, а інший (стероїд В) повністю розчинний у полімері, (іі) ядра заповненого стероїдом В (повністю розчинним і, як варіант, у тій же концентрації, як у проміжному шарі) і (ііі) оболонки з плацебо. У трьохшаровому кільці стероїд В розміщується не тільки у проміжному шарі, але також і у ядрі. В одному з втілень винаходу концентрація стероїду В є однаковою, як у ядрі так і в проміжному шарі. При заповненні обох ядра і проміжного шару стероїдом В, резервуар для стероїду В є значно більшим, що дозволяє у певній мірі зробити постійною швидкість виділення цього стероїду на протязі тривалого проміжку часу (див. Фіг.3 і 4). В результаті цього швидкість виділення стероїду А і швидкість виділення стероїду В можуть регулюватися незалежно одна від одної. Крім того, при заповненні ядра стероїдом В, також можна запобігти зворотній дифузії стероїду В від проміжного шару назад до ядра. Зворотна дифузія стероїду В повинна приводити до монотонно убутної концентрації у проміжному шарі і отже зменшити профіль виділення при зберіганні (до рівномірного розподілу стероїду В у ядрі і проміжному шарі). Також стероїд А може зворотно дифундувати до ядра. Однак, це є менш критичним, оскільки концентрація стероїду А у проміжному шарі є стабільною, тому що він присутня у кристалічній формі. У конкретному втіленні об'єкту винаходу стероїд А, у розчинному виді, можна, однак, також ввести у ядро. Це повинно послабити (або усун ути) дію внутрішньої дифузії. Таким чином концепцією цього трьохшарового піхового кільця є збільшення концентрації стероїду у відносно тонкому проміжному шарі, причому частина його буде представлена у вигляді кристалів розосереджених у тонкому проміжному шарі. Бажану швидкість виділення стероїду А отримують регулюючи товщину оболонки. Тому стероїд А вводять у кристалічній формі, а стероїд В у розчинному виді таким чином роблячи можливим регулювання концентрації стероїду В у оболонці із заздалегідь заданою товщиною оболонки. Оскільки об'єм проміжного шару може бути відносно малим, це може привести до відносно малої місткості і він може відносно швидко спорожнятися. Можливо також запобігти швидкому спорожненню трьох 11 84287 шарового кільця, також заповнивши ядро другим стероїдом (В). У іншому втіленні винаходу системою доставки лікарських засобів є піхове кільце, що має щонайменше одну камеру, яке складається з (і) проміжного шару заповненого стероїдом А представленим у кристалічній фазі і частково розчиненого у полімері, (іі) ядра заповненого стероїдом В, який повністю розчинений у полімері і (ііі) оболонки з плацебо. Ця модель кільця хоча і містить у проміжному шарі тільки один стероїд (на противагу двом стероїдам у моделі кільця, описаній вище), повинна на протязі деякого часу перетворитися на ту ж саму модель кільця, описану вище, причому мати два стероїди у проміжному шарі. Тому що за якийсь проміжок часу стероїд В дифундує у проміжний шар і в певний момент часу повинен міститися у (і) проміжному шарі насиченому двома стероїдами, один (стероїд А) частково представлений у кристалічній фазі і частково розчинений у полімері, а інший (стероїд В) повністю розчинений у полімері, (іі) ядрі заповненому" стероїдом В (повністю розчиненим) (ііі) оболонці з плацебо. Піхове кільце може бути виготовлене за допомогою відомого процесу екструзії, такого як спільна екструзія і /або сумішна екструзія. Заповнене лікарськими засобами ядро, заповнений лікарськими засобами проміжний шар і ненасичений ліками зовнішній шар - всі спільно екструдуються. Волокна отримані таким способом розрізаються на куски потрібної довжини і кожний кусок вмонтовується у кільцеподібний пристрій у будь-який підходящий спосіб. Потім кільця запаковуються, наприклад, у підходящий маленький пакет і, як варіант, потім стерилізуються або дезінфікуються. Термопластичний полімер, який може бути застосований у винаході може в принципі бути будьяким термопластичним полімером або матеріалом з еластомеру придатним для фармацевтичного використання, таким як поліетилен з низькою щільністю, кополімери етилену і вінілацетату і кополімери стіролу і бутадієнстіролу. У конкретному втіленні використовується кополімер етилену і вінілацетату (полі-ЕВА) завдяки його відмінним механічним і фізичним властивостям (наприклад, розчинність стероїду у цій речовині). Матеріал з полі-ЕВА може бути використаний для ядра, проміжного шару, а також оболонки і може бути будьяким кополімером етилену і вінілацетату, що випускається серійно, таким як продукція, що випускається під торговими марками: Elvax, Evatane, Lupolen, Movriton, Ultrathene, Ateva and Vestypar. У одному з втілень обидва ядро і проміжний шар зроблені з одного і того ж типу полімеру. У іншому втіленні ядро і проміжний шар не зроблені з одного і того ж типу полімеру для того, щоб у подальшому передбачити еластичність кільця. При виборі інших типів полімеру для ядра і проміжного шару, можливо отримати кращу еластичність кільця. Піхове кільце згідно винаходу може бути виготовлене будь-якого розміру, що вимагається. В одному з втілень винаходу, кільце має зовнішній діаметр (зовнішню окружність) між 50 і 60мм а в 12 іншому втіленні між 52 і 56мм; діаметр поперечного перерізу між приблизно 2.5 і 5 мм, у конкретному втіленні між приблизно 3.0 і 4.5мм, і в іншому втіленні між приблизно 3.5 і 4.0м, а ще в одному втіленні складає 4.0мм. Об'єкт винаходу представляє собою удосконалене піхове кільце, у якому проміжний шар і/або ядро крім стероїдів для контрацепції або гормонозаміняючих включає також антимікробний препарат, наприклад, для супутнього лікування і/або для запобігання венеричних захворювань, таких як ВІЧ, герпес, хламиди і гонорея. У піхового кільця поверхня ядра складає більше ніж 800мм 2, а в іншому втіленні більш ніж 1000мм 2 і типово повинна бути порядку 17002200мм 2, .хоча, можливі значно більші поверхні, передбачено, що ця модель (фізичні розміри) піхового кільця запобігає незручностям. Можливо з часом буде потрібно додати другу камеру, яке є камерою з плацебо або камерою насиченою одним або більше інших лікарських засобів. Така додаткова камера може бути необхідною, наприклад, для застосування у гормонозаміняючий терапії, де співвідношення між прогестогеном і естрогеном відрізняється від співвідношення придатного для контрацепції. В таку додаткову камеру може також бути необхідним ввести додатково стероїди, антимікробні препарати для лікування і/або запобігання венеричних захворювань, таких як СПІД, хламиди, герпес і гонорея. Будь-який антимікробний препарат може бути включений у піхове кільце (у проміжний шар і/або у ядро і/або у додаткову камеру). Антимікробним препаратом можуть бути будь-які з антибактеріальних ліків такі, як будь-який антибіотик, будь-який противірусний засіб, будь-який протигрибковий засіб або будь-який протипротозойний засіб. Прикладом антимікробного препарату, який буде введено у піхове кільце є конденсаційний полімер мигдалевої кислоти (Zanefeld etal (2002), Fertility and Sterility 78(5): 1107-1115). Іншим прикладом є (4-[[4-[2,4,6-триметилфеніл)аміно-2піримідиніл]аміно]бензонітрил) дапівирин. На Фіг.5 показано схематичний опис піхового кільця. R1 - діаметр трьохшарового волокна. R2 радіус ядра разом з проміжним шаром і R3 - радіус ядра. Відношення R1/R2 і R2/R3 описані для цієї Фіг. визначені як: Діапазони Втілення 1 Втілення 2 Втілення 3 Втілення 4 Втілення 5 R1/R2 1.0075-2.0000 1.0100-1.5000 1.0300-1.3000 1.0400-1.1800 1.0300-1.2000 R2/R3 1.0075-2.0000 1.0200-1.5000 1.0200-1.5000 !1.0200-1.0500 1.0100-1.0900 Використана тут «кімнатна температура» знаходиться десь приблизно між 18°С і приблизно 30°C. Використана тут фізично стабільна система доставки лікарських засобів (кільце) є системою, яка може зберігатися при приблизно 18°С-30°С щонайменше приблизно півтора (1,5) року без утворення кристалів стероїду на поверхні оболонки піхового кільця. 13 84287 Піхове кільце згідно винаходу розроблене головним чином для контрацептивного використання, але, як зазначено вище, може бути також використано при певних умовах у ГЗТ (гормонозаміняючий терапії). Піхове кільце, як зазначено вище, може бути також використано для супутнього забезпечення контрацепції і боротьби з мікробними захворюваннями. Мікробною інфекцією, яка буде лікуватися і/або запобігати їй може бути будь-яка бактеріальна, вірусна, грибкова або протозойна інфекція. Особливо венеричні захворювання такі, як ВІЧ, хламиди, гонорея або герпес можуть бути вилікувані введенням антимікробного засобу у кільце. Крім того надається спосіб контрацепції, який включає операції розміщення системи доставки лікарських засобів у піховому тракті жінки і утримання її там щонайменше приблизно 21 день. У іншому втіленні надається спосіб супровідного забезпечення контрацепції і лікування або запобігання венеричним захворюванням, який включає операції розміщення системи доставки лікарських засобів у піховому тракті жінки і утримання її там щонайменше приблизно 21 день. В одному з втілень система доставки лікарських засобів видаляється приблизно після 21 дня приблизно за один тиждень до менструації. У іншому втіленні система доставки лікарських засобів видаляється приблизно після 42, 63, 84, 105, 126,147,186, 189, 210, 231, 252, 273, 294, 315, 336 або 357 днів приблизно за один тиждень до менструації. Приблизно після тижня, у який проходить менструація у піховий тракт жінки вставляється нова система доставки лікарських засобів, для забезпечення контрацепції у наступному циклі або циклах. Крім того, передбачається використання системи доставки лікарських засобів для виготовляння контрацептивного комплекту. Крім того, здійснюється використання системи доставки лікарських засобів для виготовляння медикаменту для гормонозаміняючої терапії. Також забезпечується використання системи доставки лікарських засобів для виготовлення комбінованого препарату, щоб забезпечити контрацепцію і лікування і/або запобігання венеричним захворюванням, таким як, наприклад, СПІД, герпес, хламиди і гонорея. Прогестогенною стероїдною сполукою може бути будь-який підходящий прогестоген, такий як дезогестрел, етоногестрел, левоноргестрел, норгестімат, гестоден або будь-яка інша стероїдна сполука з прогестогенною активністю. Естрогенною стероїдною сполукою може бути будь-який підходящий естроген, такий як естрадіол, естріол, местранол, етинілестрадіол. У конкретному втіленні винаходу, прогестогеном є етоногестрел. У конкретному втіленні винаходу естрогеном для контрацептивного використання є етинілестрадіол. У іншому втіленні винаходу естрадіолом є естроген, що використовується ГЗТ. В одному із втілень винаходу етинілестрадіол складає у проміжному шарі і у ядрі приблизно 0.05-1.5% маси. У інших втіленнях етинілестрадіол складає у проміжному шарі і у ядрі приблизно 14 0.08-0.5% маси, приблизно 0.09-0.20% маси, приблизно 0.09-0.18% маси або приблизно 0.09-0.15% маси. В одному з втілень винаходу етоногестрел складає у проміжному шарі приблизно 6-80% маси. У інших втіленнях етоногестрел складає у проміжному шарі приблизно 6-70% маси, приблизно 10-53% маси, приблизно 10-30% маси, приблизно 10-15% маси, або приблизно 10-12% маси. Винахід також надає спосіб виготовлення трьохшарової системи доставки лікарських засобів, що включає: (і) Виготовлення заповненого (насиченого ліками) ядра з гранульованого гомогенного полімеру і заповненого (насиченого ліками) проміжного шару з гранульованого гомогенного полімеру, (іі) Спільне екструдування гранульованого ядра і гранульованого проміжного шару з оболонкою з гранульованого полімеру у формі трьохшарової системи доставки лікарських засобів. Виробництво заповненого (насиченого ліками) ядра з гранульованого гомогенного полімеру і заповненого (насиченого ліками) проміжного шару з гранульованого гомогенного полімеру включає: a) здрібнювання полімеру; b) змішування здрібненого у порошок полімеру з активними сполуками, які будуть введені у проміжний шар; c) змішування здрібненого у порошок полімеру з активною сполукою, яка буде введена у ядро; d) сумішне екструдування отриманих в результаті операцій (b) і (с) порошкових сумішей; e) розрізання отриманої насиченої полімерної нитки на гранули, отримуючи таким чином гранульоване ядро і гранульований проміжний шар; f) змазування обох гранульованого ядра і гранульованого проміжного шару мастилом, причому операції (b) і (с) є взаємозамінними. Представлений винахід додатково описаний у наступних прикладах, які ні в який спосіб не обмежують об'єму заявленого винаходу. Приклади Приклад 1 - Виготовлення трьохшарового кільця Були підготовані вісім (8) трьохшарових волокон (А1-А4 і В1-В4). Волокна були витягн уті на 3.5mm (Bx) і 4.0mm (Ax) з однаковим капілярами (4.1мм). Для того щоб змішати активні інгредієнти етоногестрелу (стероїд А) і етинілестрадіолу (стероїд В) з полімером, щоб вони були повністю однорідними, виконуються наступні операції змішування. У першій операції порошкова суміш зроблена з тонкоздрібнених активних сполук і порошкового полімеру Ці тонкоздрібнені сполуки були змішані з порошковим полімером у барабані Rhönrad (принцип обробки у обертовому барабані з дозатором) з нержавіючої сталі з використанням фіксованої швидкості обертання приблизно 26об/хв. на протязі 60 хвилин. Перша операція змішування порошку була виконана, щоб змішати полімер і активні сполуки для обох ядра (полімерний порошок і тонкоздріблений етинілестрадіол) і для проміжного шару (полімерний порошок, тонкоздріблений етинілестрадіол і тонкоздріблений етоногестрел). 15 84287 Потім гомогенізована порошкова суміш була піддана сумішній екструзії з використанням сумішного екструдера (Berztorff ZE25) з обертовим в одному напрямку 25мм двозаходним шнеком і отримана полімерна нитка була розрізана на гранули з використанням гранулятора Scheer. Згідно цього процесу була виготовлена партія гранульованого яд 16 ра і партія гранульованого проміжного шару. Після грануляції ці партії були змащені стеаратом магнію для того, щоб полегшити наступн у операцію обробки (спільну екструзію). Композиція гранульованих партій, які були використані для виготовлення трьохшарового волокна з використання процесу спільної екструзії показана у таблиці 1 нижче Таблиця 1 Речов ина Етоногестрел Етинілестрадіол Ев атан 28-25 Стеарат магнію Разом Композиція Гранулят проміж ного шару 10.3% 0.092% 89.5% 0.1% 100.0% Гранулят ядра 0.095% 99.8% 0.1% 100.0% Спільна екструзія трьох шарів Для потрійної спільної екструзії були використані спільний екструдер Plastic Machinenbau (15/18мм) у комбінації з екструдером ЕХ10, Fourne (10мм). 18мм і 15мм екструдерами Plastic Machinenbau відповідно обробляли ядро і проміжний шар, а 10мм екструдер Fourne використався для обробки оболонки (зовнішнього шару). Три екструдери були з'єднані з 3-камерним блоком формування (Ankutec, Germany), і 3 окремими прядильними насосами (для контролю за об'ємною швидкістю плину (плину розплаву) кожного шару). Три плини розплавів комбінуються у мундштук отриманий з волокна 3 шарів. Був використаний капіляр 4.1мм. Всі волокна були екструдовані при температурі екструзії 110°C. Швидкість формування була пристосована для отримання волокна бажаного діаметру чи 3.5мм або 4.0мм, і шар бажаної товщини для оболонки і проміжного шару були отримані за допомогою регулювання прядильних насосів. Кожний з типів трьохшарового волокна виготовляють, використовуючи відповідну швидкість формування і регулюючи прядильні насоси (повністю 2x4 типи, А1-А4 і В1-В4). Після приблизно 20 хвилин спільної екструзії трьох шарів кожного типу, трьохшарове волокно намотують на бобіну з нержавіючої сталі на протязі 30 хвилин. Зовнішній діаметр волокна виміряють в оперативному режимі з використанням лазерного мікрометру і записують. На початку і в кінці 30-хвилинного періоду часу виміряють і записують діаметр волокна, товщину середнього шару і товщин у оболонки. Насичені волокна обробляють із швидкістю екструзії 3м/хв для типів А і 3.9м/хв. для типів В. За винятком типу 3, яке обробляють за 1.0м/хв для волокна A3 і 1.3м/хв для волокна ВЗ. Розміри волокна Розміри волокна (зовнішній діаметр, товщина проміжного шару і товщина оболонки визначаються безпосередньо після обробки і на 10 змонтованих кільцях. Зовнішній діаметр визначають за допомогою лазерного товщиномеру (Mitutoyo). Товщин у проміжного шару і оболонки визначають використовуючи мікроскоп (Jena). Результати по насиченим партіям показані у Таблицях 2а і 2b. Таблиця 2а Розміри в олокна для 4.0мм насичених в олокон оброблених із шв идкістю екструзії 3м/хв (за винятком типу A3, який обробляється із шв идкістю 1м/хв) Тип А1 А2 A3 А4 Діаметр волокна (мм) 4.00 4.00 3.99 4.00 Проміжний шар [jмкм] 67 61 67 51 Оболонка [jмкм] 66 81 294 80 Полімер ядра Ев атан 1020 VN3 Ев атан 1020 VN3 Ев атан 1040 VN4 Ев атан 1020 VN3 R1/R2 1.0341 1.0422 1.1728 1.0417 R2/R3 1.0359 1.0328 1.0410 1.0273 Таблиця 2b Розміри в олокна для 3.5мм насичених в олокон оброблених із шв идкістю екструзії 3.9м/хв (за винятком типу ВЗ, який обробляється із шв идкістю 1.3м/хв) Тип В1 В2 В3 В4 Діаметр волокна (мм) 3.49 3.51 3.50 3.50 Проміжний шар [jмкм] 54 52 59 48 Концентрація активних складових у ядрі і проміжному шарі ідентична для всіх кілець (10.3% Оболонка [jмкм] 58 73 261 70 Полімер ядра Ев атан 1020 VN3 Ев атан 1020 VN3 Ев атан 2040 VN4 Ев атан 1020 VN3 R1/R2 1.0344 1.0434 1.1753 1.0417 R2/R3 1.0331 1.0319 1.0413 1.0294 ЕНГ, 0.092% EE у проміжному шарі і 0.095 % EE у ядрі). Концентрація 0.092 і 0.095% для проміжного 17 84287 шару і ядра відповідно комбінується (практично) ідентично. Швидкості виділення in-vitro Результати для виділення in-vitro показані у Таблиці 3, на Фіг.1-4 і 6-13. Hа Фіг.1 і 2 показана швидкість виділення етоногестрелу з одного зразка кожного виду тестованого кільця. На Фіг.3 і 4 18 показана швидкість виділення етинілестрадіолу з одного зразка кожного виду тестованого кільця. На Фіг.6-13 також показані швидкості виділення етоногестрелу і етинілестрадіолу з одного зразка кожного виду тестованого кільця. (А1-А4 і B1-B4). У Таблиці 3 показані обчислені швидкості виділення шести (6) зразків кожного виду тестованого кільця. Таблиця 3 Шв идкості виділення in vitro для всіх в иготов лених партій при t=0 Партія Шв идкість в иділення етоногестрелу in-vitro (мкг/день/кільце) День 1 Середній строк (2-21) BCB (%) День 21 А1 А2 A3 А4 258-264 216-225 179-184 213-221 194 162 119 156 1 1 0 1 177-180 149-152 113-114 130-132 В1 В2 В3 В4 223-232 191-197 168-172 182-196 188 158 117 145 1 1 1 2 157-163 139-143 110-112 104-111 Швидкість виділення на день 1 і день 21 представлена як діапазон індивідуальних результатів для 6 кілець (надані максимальне і мінімальне значення). За середній строк 2-21 день виділення представлено середньою швидкістю виділення на день 2 до і включно до дня 21. Представлене значення є середнім для 6 кілець. Монтаж 4мм партії (Ax) розрізають на куски по 157мм і зварюють з температурою зварювання 130°C і часом зварювання 15 секунд, на монозварювальній установці TWI. 3.5мм волокна розрізають на куски по 157мм і кінці склеюють разом (Loctite, type 406 and 770; cat nr. 40621 and 77012). Отже модель нового трьохшарового кільця з шарами, що варіюються від 50 до 300мкм, обробляється з обмеженими відхиленнями по товщині оболонки і по товщині проміжного шару. Приклад 2 - Фізична стабільність Зберігання фізичної стабільності кільця NuvaRing® при нормальній кімнатній температурі (до 30°C) обмежене завдяки формуванню кристалів стероїду на поверхні оболонки піхового кільця, яке призводить до збільшення початкового виділення, інакше кажучи виділення при розриві і отже зменшення фізичної стабільності. Виділення при розриві (день 1 виділення) у 8 партіях кілець було прогестоване з початку відліку часу і після 12, 18 і Шв идкість в иділення EE (мкг/день/кільце) BCB День 1 Середній строк (2-21) День 21 (%) 22-22 14 1 11-12 19-20 12 1 10-10 25-25 11 0 8-9 19-20 12 1 10-10 19-21 18-19 26-26 17-19 13 11 10 11 2 1 1 2 10-11 9-10 8-8 9-9 24 місяців зберігання 30°С/75% BB (відносної вологості) у закритому алюмінієвому покритому фольгою маленькому пакеті. (WO 99/30976). Виділення при розриві у 3 представлених партій кільця NuvaRing® було прогестовано з початку відліку часу і після 12, 18 і 24 місяців зберігання 30°С/75% BB (відносної вологості) у зазначеному закритому алюмінієвому покритому фольгою маленькому пакеті. Швидкість виділення на початку відліку часу була визначена шляхом аналізу партії з 12 кілець, а швидкість виділення після 12, 18 і 24 місяців була визначена шляхом аналізу партії з 6 кілець. Результати цього аналізу показані у Таблицях 4, 5 і 6. З цього видно, що виділення при розриві для всіх трьох партій кілець NuvaRing® збільшилось при зберіганні вже після 12 місяців при 30°С. За виключенням варіанту A3, всі сім партій кілець показують постійне або знижене виділення при розриві після зберігання при 30°C. При візуальному спостереженні за кільцями з партії A3 визначено, що збільшення виділення при розриві відбувається не завдяки формуванню кристалів стероїду на поверхні кільця. Факт, що збільшення виділення при розриві у партії A3 відбувалося не завдяки утворення кристалів на поверхні кільця також показано з незначними розбіжностями, що спостерігалися між індивідуальними результатами тесту, які показані при низькому значенні BCB (відносного середнього відхилення). Таблиця 4 Шв идкість в иділення на початку в ідліку часу - день 1 і після 12 місяців зберігання при 30°С/75% BB Кільце NuvaRing® 1 N1 Індивідуальні результати t=0 2 186.4, 193.2, 186.6, 185.5, 189.9, 188.5, 187.8, 197.6, 189.6, 184.4, 188.3, 190.2 Початкове в иділення BCB (%) Індив ідуальні результати t=12 місяців 3 4 1.3 210.6 191.0, 179.5, 178.6, 171.8, 205.9 BCB (%) 5 8.3 19 84287 20 Продов ження таблиці 4 1 N2 2 197.4, 199.0, 199.3, 198.2, 199.7, 198.3, 205.1, 200.5, 200.4, 200.1, 200.3, 198.3 194.6, 197.5, 197.0, 193.8, 198.3, 197.5, 198.3, 199.4, 198.7, 204.5, 211.6, 201.8 N3 Кільце згідно в инаходу А1 А2 A3 А4 В1 В2 В3 В4 3 1.0 260.7, 264.9, 263.7, 260.3, 263.6, 261.6, 265.2, 264.7, 263.7, 261.7, 265.5, 258.4 219.5, 221.6, 219.5, 219.2, 219.4, 225.0, 222.5, 221.7, 215.8, 223.6, 218.0, 221.2 181.0, 180.8, 180.0, 182.2, 179.3, 180.7, 180.5, 181.5, 181.2, 182.1, 180.7,193.6 217.9, 213.4, 216.3, 216.9, 215.1, 219.2, 220.1, 220.6, 221.1, 218.0, 217.9, 219.2, 222.9, 230.0, 225.5, 227.8, 230.5, 229.4, 229.5, 226.8, 226.4, 231.9, 232.3, 226.6 194.8, 194.5, 194.3,197.4, 190.9, 195.2, 194.9, 192.8, 191.5, 192.6, 194.2, 194.0, 171.3, 171.3, 170.1, 171.4, 168.8, 172.0, 171.5, 171.5, 169.7, 169.7, 167.5, 167.9 188.2, 189.9, 195.8, 185.9, 189.9, 181.7, 194.3, 192.2, 191.5, 182.5, 189.7, 193.6 0.9 2.4 1.1 0.6 1,1 1.2 0.9 0.9 2/3 4 188.5, 190.5, 194.4, 195.4, 215.3, 200.1 255.1, 325.3, 276.3, 215,0, 505.9, 222.5 210.2, 207.1, 220.7, 217.2, 209.3, 209.2 184.2,181.1, 176.9, 179.9, 177.3, 177.0 198.7,194.0, 197.7, 202.5, 199.0, 199.5 169.1, 171.1, 176.6, 176.6, 175.0, 169.3 181.6, 178.4, 180.8, 181.8, 178.1,179.0 154.1, 152.5, 151.0, 154.3, 154.1,153.7 179.0, 177.8, 176.6, 183.2, 179.1, 178.9 155.1, 150.6, 148.8, 150.4, 151.6,148.3 5 4.9 36.6 2.5 1.6 1.4 2.0 0.9 0.8 1.2 1.6 Таблиця 5 Шв идкість в иділення на початку в ідліку часу - день 1 і після 18 місяців зберігання при 30°С/75% BB Кільце NuvaRing® 1 N1 N2 N3 Кільце згідно в инаходу А1 А2 A3 A4 B1 Індивідуальні результати t=0 2 186.4, 193.2, 186.6, 185.5, 189.9, 188,5, 187.8, 187.6, 189.6, 184.4, 188.3, 190.2 197.4, 199.0, 199.3, 198.2, 199.7, 198.3, 205.1, 200.5, 200.4, 200.1, 200.3, 198.3 194.6, 197.5, 197.0, 193.8 198.3, 197.5, 198.3, 199.4, 198.7, 204.5, 211.6, 201.8 260.7, 264.9, 263.7, 260.3, 263.6, 261.6, 265.2, 264.7, 263.7, 261.7, 265.5, 258.4 219.5, 221.6, 219.5, 219.2, 219.4, 225.0, 222.5, 221.7, 215.8, 223.6, 218.0, 221.2 181.0, 180.8, 180.0, 182.2, 179.3, 180.7, 180.5, 181.5, 181.2, 182.1, 180.7, 193.6 217.9, 213.4, 216.3, 216.9, 215.1, 219.2, 220.1, 220.6, 221.1, 218.0, 217.9, 219.2 222.9, 230.0, 225.5, 227.8, 230.5, 229.4, 229.5, 226.8, 226.4, 231.9, 232.3, 226.6 Початкове в иділення BCB (%) Індивідуальні результати t=18 місяців 3 4 1.3 188.6, 237.0, 301.8, 252.6, 234.0, 186.4 1.0 210.8, 183.0, 261.6, 202.1, 241.8, 249.4 2.4 479.6, 560.2, 510.2, 483.0, 579.4, 477.9 0.9 1.1 0.6 1.1 1.2 205.5, 209.1, 201.9, 207.5, 199.0, 198.3 172.5, 174.0, 174.0, 180.5, 177.0, 174.5 194.0, 203.4, 197.9, 201.5, 190.2, 197.9 166.9, 163.2, 165.7, 168.1, 159.4, 166.4 171.8, 169.7, 167.6, 173.7, 171.6, 169.4 BCB (%) 5 18.5 13.7 8.6 2.2 1.7 2.5 1.9 1.3 21 84287 22 Продов ження таблиці 5 1 В2 2 194.8, 194.5, 194.3, 197.4, 190.9, 195.2, 191.5, 194.9, 191.5, 192.6,194.2, 194.0, 171.3, 171.3, 170.1, 171.4, 168.8, 172.0, 171.5, 171.5, 169.7, 169.7, 167.5,167.9 188.2, 189.9, 195.8, 185.9, 189.9, 181.7, 194,3, 192.2, 194.3 182.5, 189.7, 193.6 В3 В4 3 0.9 0,9 2.3 4 147.6, 146.1, 14.6.0, 146.8, 142.9, 143.7 172.3, 170.9, 171.7, 172,0, 169.5, 177.1 147.5, 146.5, 142.4, 127.3, 145.6, 145.5 5 1.3 1.5 5.4 Таблиця 6 Шв идкість в иділення на початку в ідліку часу - день 1 і після 24 місяців зберігання при 30°С/75% BB Кільце NuvaKing® N1 N2 N3 Індивідуальні результати t=0 186.4, 193.2, 186.6, 185.5, 189.9, 188.5, 187.8, 187.6, 189.6, 184.4, 188.3, 190.2 197.4, 199.0, 199.3,198.2, 199.7,198.3,205.1,200.5, 200.4,200.1,200.3,198.3 194.6, 197.5, 197.0, 193,8 198.3, 197.5, 198.3, 199.4, 198.7, 204.5, 211.6, 201.8 Початкове в иділення BCB (%) Індивідуальні результати t=24 місяці 1.3 199.0, 175.9, 219.9, 188.9, 206.9, 184.8 1.0 247.0, 275.7, 297.3, 371.9, 215.6, 269.0 2.4 271.3, 262.2, 268.1, 247.2, 436.6, 329.4 BCB (%) 8.2 19.0 23.6 Кільце згідно в инаходу А1 А2 A3 А4 В1 В2 В3 B4 260.7, 264.9, 263.7, 260.3, 263.6, 261.6, 265.2, 264.7, 263.7, 261.7, 265.5, 258.4 219.5, 221.6, 219.5, 219.2, 219.4, 225.0, 222.5, 221.7, 215.8, 223.6, 218.0, 221.2 181.0, 180.8, 180.0, 182.2, 179.3, 180.7, 180.5, 181.5, 181.2, 182.1, 180.7, 193.6 217.9, 213.4, 216.3, 216.9, 215.1, 219.2, 220.1, 220.6, 221.1, 218.0, 217.9, 219.2, 222.9, 230.0, 225.5, 227.8, 230.5, 229.4, 229.5, 226.8, 226.4, 231.9, 232.3, 226.6 194.8, 194.5, 194.3, 197.4, 190.9, 195.2, 194.9, 192.3, 191.5, 192.6, 7942, 194.0, 171.3, 171.3, 170.1, 171.4, 168.8, 172.0, 171.5, 171.5, 169.7, 169.7, 167.5, 167.9 188.2, 189.9, 195.8, 185.9, 189.9, 181.7, 194.3, 192.2, 191.5, 182.5, 189.7, 193.6 Приклад 3 - Удосконалене трьохшарове кільце у порівнянні з кільцем описаним у US 4.292.965 Цей приклад ілюструє переваги удосконаленого трьохшарового кільця відносно трьохшарового кільця описаного US 4,292,965. У US 4,292,965 два стероїди розміщені у проміжному шарі, але немає стероїду у ядрі. Суттю удосконалення трьохшарового кільця є те, що швидкість виділення одного або більше стероїдів може регулюватися незалежно одна ввід одної і, що кільце пристосовано підтримувати цю швидкість виділення більш тривалий проміжок 0.9 1.1 0.6 1.1 1.2 0.9 0.9 2.3 206.4, 208.6, 201.8,203.7, 209.9,213.7 179.1, 172.1, 173.4,179.8, 179.8,172.8 197.7,195.8, 196.8, 197.8, 197.7, 204.9 170.1, 163.6, 163.5, 168.2, 164.6,166.9 171.3,170.3, 172.1, 175.9, 163.2, 171.8 143.5, 145.8, 146.8,148.0, 150.0, 148.8 173.9, 173.0, 173.9, 177.4, 175.4,175.9 145.0, 145.6, 144.9, 143.9, 142.6, 143.4 2.1 2.0 1.6 1.6 1.5 1.6 0.9 0.8 часу поки підтримується фізична стабільність у режимах кімнатної температури. Цей приклад демонструє перевагу удосконаленого трьохшарового кільця, яке також має заповнене ядро відносно моделі кільця з ненасиченим ліками ядром, описаним у US 4,292,965. Неможливо заповнити проміжний шар більш ніж одним стероїдом у кристалічному виді і мати незалежне виділення. Для того, щоб регулюва ти швидкість виділення двох (або більше) стероїдів з одної камери, тільки один стероїд може бути представлений у кристалічній фазі, а інший (інші) ма 23 84287 ють бути представлені у розчинній фазі. У випадку, коли стероїд А частково представлений у кристалічному виді, кристалічна решітка цього стероїду повинна бути у динамічній рівновазі з розчиненим стероїдом. Оскільки концентрація стероїду А заздалегідь визначена, швидкість виділення стероїду А може регулюватися при виборі потрібної товщини оболонки. Беручи до уваги той факт, що товщина оболонки вже використовується як засіб регулювання швидкості виділення стероїду А, швидкість виділення другого компоненту, стероїду В, може бути відрегульована тільки при виборі його відповідної концентрації. Оскільки стероїд В представлений тільки у розчиненому виді, у кільце можна ввести більше стероїду (поки через мембрану підтримується один і той же градієнт концентрації) при збільшенні об'єму резервуару (ядра). Отже, об'єм резервуару визначається кількістю розчиненого стероїду В, який вводиться у кільце. Для кільця А2 (див. приклад 1) об'єм проміжного шару і резервуару ядра може бути обчислений наступним чином. Розміри волокна кільця А2 приблизно мають довжину 15.7см, діаметр 4.0мм, товщин у проміжного шару біля 60мкм і оболонки біля 80мкм і об'єм проміжного шару ядра приблизно \/пш=0.11мл та Vядра=1.71мл. Щільність обох ядра і проміжного шару майже відносно однакова в 1г/мл і отже маса ядра і проміжного шару є приблизно 1.71г і 0.21г відповідно. Концентрація EE у ядрі і проміжному шарі приблизно 0.095% м/м. і тому ядро містить приблизна 1620мкг EE, а проміжний шар містить приблизно 106мкг EE. Отже, у цьому окремому випадку (А2) більш ніж у 15 разів більше EE може бути введено в удосконалену трьохшарову модель у порівнянні з ненасиченим ліками ядром. Виділення EE з кільця А2 як функція часу представлена на Фіг.3 і може бути використана для ілюстрації переваги введення у ядро EE. Ви 24 діленням у напівстійкому стані (дні 2-21 виділення) є між 15 і 10мкг/день і місткості проміжного шару тільки (106мкг) буде явно недостатньо для підтримки постійної швидкості виділення за період часу більший ніж декілька днів. Після менше ніж 7 днів проміжний шар буде майже повністю вичерпаний і швидкість виділення значно знизиться вже після декількох днів. Більш того у моделі кільця представленого у US 4,292,965, завдяки внутрішній дифузії у ядрі отримають нерівновагий стан у якому концентрація EE зменшиться, отже отримають фармацевтичну продукцію з нестабільним профілем виділення. Однак, коли у ядро введено EE з тою ж самою концентрацією, як і в проміжному шарі, досягають бажаного рівновагого стану. Цей режим нестійкого стану завдяки внутрішній дифузії (так званої зворотної дифузії) властивий трьохшаровій моделі розкритої у US 4,292,965, у той час удосконалена трьохшарова модель усуває ці небажані ефекти. Приклад 4 - Виготовлення додаткових трьохшарових кілець Були підготовані двадцять (20) додаткових трьохшарових волокон (E-X). Волокна цих типів мають розмір 4мм (E-V), 3мм (тип W) і 5мм (тип X). Всі волокна сформовані з одноковими капілярами (3.5мм). Деякі грануляти ядра і проміжного шару (С1С4 і D1-D2 відповідно) були виготовлені з використанням, по суті, того ж самого способу, який описано у Прикладі 1 з наступними незначними змінами: Грануляти С4, D1 і D2 були змішані у барабані з нержавіючої сталі Rhönrad (принцип обробки у обертовому барабані з дозатором) з фіксованою швидкістю приблизно 47об/хв. на протязі 60 хвилин. Таблиця 7 Гранульоване ядро композиції Тип С1 С2 С3 С4 Етоногестрел 0.33% Етиніл-естрадіоп 0.16% 0.13% 0.20% 0.16% Ateva 2820A 99.7% 99.8% 99.7% 99.4% Стеарат магнію 0.1% 0.1% 0.1% 0.1% Разом 100.0% 100.0% 100.0% 100.0% Таблиця 8 Гранулят композиції проміжного шару Тип D2 D2 Етоногестрел 10.5% 52.5% Етиніл-естрадіол 0.16% 0.16% Спільна екструзія трьох шарів Для виготовлення трьохшарових волокон був використаний потрійний спільний екструдер Fourne (25/18/18мм). 25мм екструдером оброблено шар ядра, а два 18мм екструдери обробили проміжний шар і оболонку (зовнішній шар) відповідно. Три екструдери були з'єднані з 3-камерним блоком формування, і 3 окремими прядильними Ateva 2820A 89.2% 47.2% Стеарат магнію 0.1% 0.1% Разом 100.0% 100.0% насосами (для контролю за об'ємною швидкістю плину (плину розплаву) кожного шару). Три плини розплавів комбінуються у мундштук отриманий з волокна 3 шарів. Був використана капілярність 3.6мм. Всі волокна були екструдовані при температурі екструзії 110°C. Швидкість формування регулюється, щоб отримати волокна бажаного діаметру чи 3, 4 або 25 84287 5мм. Шар бажаної товщини для оболонки і проміжного шару о тримають регулюванням прядильних насосів. Кожний з типів трьохшарового волокна виготовляють, використовуючи відповідну швидкість формування і регулюючи прядильні насоси (повністю 20 типів, E-X). Після приблизно 20 хвилин спільної екструзії трьох шарів кожного типу, трьохшарове волокно намотують на бобіну з нержавіючої сталі на протязі 120 хвилин. Зовнішній діаметр волокна виміряють в оперативному режимі з використанням лазерного мікрометру і записують. На початку і в кінці цих 120 хвилин виміряють і записують діаметр волокна, товщину середнього шару і товщину оболонки. Типи W і X були намотані тільки за 30 хвилин. 26 Насичені волокна обробляють із швидкістю екструзії 2.00м/хв для типів E-V, за 3.59м/хв. для типу W і за 1.28м/хв для типу X. Розміри волокна Товщина проміжного шару і товщина оболонки визначаються для кожного типу волокна, з частин волокон 4 зразків на протязі потрійної спільної екструзії. Зовнішній діаметр для кожного типу волокна визначається з частин волокон 6 зразків на протязі обробки волокон потрійною спільною екструзією. Зовнішній діаметр визначають за допомогою лазерного товщиномеру (Zumbach). Товщину проміжного шару і оболонки визначають використовуючи мікроскоп (Jena). Результати по насиченим партіям показані у Таблицях 9а, 9b і 9с. Таблиця 9а Розміри в олокна для 4мм насичених в олокон оброблених з шв идкістю екструзії 2.00м/хв . Тип E F G H І J K L M N O P Q R S T U V Діаметр волокна Ядро компо[мм] зиції 4.01 С1 4.01 С3 4.02 С3 4 02 С2 4.04 С2 4.02 С1 4.00 С1 4.03 С4 4.01 С1 4.03 С2 4.01 С2 4.02 С3 4.02 С3 4.04 С1 4.05 С2 4.02 С2 4.04 С3 4.04 С3 Проміжний шар [jмкм] 61 60 63 53 62 148 28 67 61 60 63 63 60 70 69 68 67 65 Проміжний шар композиції D1 D1 D1 D1 D1 D1 D2 D1 D1 D1 D1 D1 D1 D1 D1 D1 D1 D1 Оболонка [jмкм] 110 100 126 94 123 110 111 112 146 133 167 132 161 315 277 335 298 334 R1/R2 R2/R3 1.05801.0333 1.05251.0325 1.06691.0346 1.04911.0284 1.06481.0338 1.05791.0845 1.05881.0150 1.05891.0365 1.07801.0339 1.07011.0329 1.09091.0355 1.07031.0347 1.08711.0335 1.18481.0428 1.15851.0411 1.20001.0423 1.17311.0405 1.19811.0401 Полімер оболонки Ateva 1070 Ateva 1070 Ateva 1070 Ateva 1070 Ateva 1070 Ateva 1070 Ateva 1070 Ateva 1070 Ateva 1231 Ateva 1231 Ateva 1231 Ateva 1231 Ateva 1231 Ateva 1525 Ateva 1525 Ateva 1525 Ateva 1525 Ateva 1525 Таблиця 9b Розміри в олокна для 3мм насичених в олокон оброблених з шв идкістю екструзії 3.59м/хв . Діаметр волокна Ядро компо[мм] зиції W 3.03 C1 Тип Проміжний шар [мкм] 45 Проміжний шар композиції D1 Оболонка [мкм] 83 Полімер оболонки 1.05801.0324 Ateva1070 R1/R2 R2/R3 Таблиця 9с Розміри в олокна для 5мм насичених в олокон оброблених з шв идкістю екструзії 1.28м/хв . Діаметр волокна Ядро компо[мм] зиції X 5.00 С1 Тип Проміжний шар [jмкм] 74 Проміжний шар композиції D1 Швидкість виділення in-vitro Результати по виділенню in-vitro показані у Таблиці 10 і на Фіг.14-21, у яких показані швидкості виділення етоногестрелу і етинілестрадіолу для Оболонка Полімер обоR1/R2 R2/R3 [мкм] лонки 138 1.05841.0323 Ateva 1070 всіх волокон. У Таблиці 10, а також на Фіг.14-21 дані обчислені швидкості шести (6) зразків кожного виду тестованого кільця. 27 84287 28 Таблиця 10 Шв идкість в иділення in-vitro для в сіх в иготов лених серій при t=0 Партія E F G H І J K L M N O P Q R S T и V W X Шв идкість в иділення етоногестрелу in-vitro (мкг/день/кільце) Шв идкість в иділення EE [мкг/день/кільце) День 1 Середній строк (2-21) BCB (%) День 21 День 1 Середній строк (2-21) BCB (%) День 21 140-153 94 1 89-90 23-24 14 3 12-13 153-162 108 2 99-104 29-30 19 2 17-18 125-131 82 1 76-79 24-25 15 2 12-14 148-157 106 2 97-101 20-21 13 3 10-12 122-127 82 1 76-79 17-18 10 4 8-9 208-214 101 1 91-93 23-24 14 2 12-13 123-135 95 2 88-93 21-23 13 3 11-12 178-187 98 2 87-91 21-23 13 3 11-11 187-197 123 1 113-117 34-35 19 2 16-17 193-198 133 1 121-125 30-31 17 2 14-15 165-171 106 1 98-101 26-28 14 2 11-12 182-208 138 1 127-131 39-44 25 2 22-23 170-180 112 1 103-107 38-40 21 2 19-19 186-203 118 1 109-113 26-29 19 2 15-17 226-236 131 1 123-126 36-38 18 2 14-15 190-197 110 1 102-105 27-29 15 2 12-12 218-224 125 1 116-119 41-44 24 2 20-22 181-193 111 1 103-107 30-32 22 2 19-19 120-122 96 1 83-85 ,21-21 13 2 11-12 134-144 84 3 77-84 21-22 12 3 10-12 Швидкість виділення для дня 1 і дня 21 представлена у діапазоні індивідуальних результатів для 6 кілець (дано мінімальне і максимальне значення). Середня швидкість виділення за середній строк 2-21 день представлена з дня 2 і до дня 21 включно. Представлене значення є середнім для 6 кілець. Монтаж 4мм волокна (E-V) розрізають на куски по 157мм і зварюють з температурою зварювання 130°C і часом зварювання 17 секунд, на компонуючому блоці CCM (Centrum voor Constractie en Mechatronica, Нідерланди). Волокна W i X вручну розрізають на куски по 157мм і кінці склеюють разом, використовуючи липкий Loctite (тип 406 and 770; cat nr. 40621 і 77012). 29 84287 30 31 84287 32 33 84287 34 35 84287 36 37 Комп’ютерна в ерстка А. Рябко 84287 Підписне 38 Тираж 28 прим. Міністерство осв іт и і науки України Держав ний департамент інтелектуальної в ласності, вул. Урицького, 45, м. Київ , МСП, 03680, Україна ДП “Український інститут промислов ої в ласності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюDrug delivery system
Автори англійськоюGroenewegen Rudolf Johannes Joseph, de Graaff Wouter, Out Henk Jan
Назва патенту російськоюСистема доставки лекарственных средств
Автори російськоюруневеґен Рудолф Йоханнес Йосеф, де Графф Ваутер, Аут Генк Ян
МПК / Мітки
МПК: A61P 15/18, A61K 31/56, A61K 9/00
Мітки: лікарських, доставки, засобів, система
Код посилання
<a href="https://ua.patents.su/19-84287-sistema-dostavki-likarskikh-zasobiv.html" target="_blank" rel="follow" title="База патентів України">Система доставки лікарських засобів</a>
Попередній патент: Спосіб видалення аденоми паращитовидної залози
Наступний патент: Фармацевтичний продукт
Випадковий патент: Зубчасте колесо