Біологічно активні наночастинки карбонат-заміщеного гідроксіапатиту, спосіб їх одержання і композиції, що їх містять
Номер патенту: 93994
Опубліковано: 25.03.2011
Автори: Гуаланді Паоло, Гаццаніга Джанкарло, Палаццо Барбара, Ровері Норберто, Яфіско Мікелє, Рімондіні Ліа
Формула / Реферат
1. Біологічно активні наночастинки карбонат-заміщеного нестехіометричного гідроксіапатиту, який має:
a) ступінь кристалізації CD нижче 40 %, причому ступінь кристалізації визначається як
![]() ,
,
де: ![]() = висота дифракційного максимуму при
= висота дифракційного максимуму при ![]() ,
, ![]() = висота дифракційного фону при
= висота дифракційного фону при ![]() на рентгенограмі наночастинок;
на рентгенограмі наночастинок;
b) довжину L від 20 до 200 нм і ширину W від 5 до 30 нм; і
c) відношення висоти до ширини (аспектне відношення) від 2 до 40, яке визначається формулою
AR = L/W.
2. Біологічно активні наночастинки за п. 1, які містять від 1 % до 15 мас. % карбонатного заміщення у гідроксіапатитовій структурі.
3. Біологічно активні наночастинки за п. 1, де співвідношення А/В між карбонатним заміщенням на гідроксильному сайті (А) і карбонатним заміщенням на фосфатному сайті (В) гідроксіапатиту становить від 0,05 до 0,5.
4. Біологічно активні наночастинки за п. 1 або 3, де карбонатне заміщення на фосфатному сайті (В) гідроксіапатиту більше або дорівнює 65 мас. % від загальної маси карбонату в гідроксіапатиті.
5. Біологічно активні наночастинки за п. 1, які мають ступінь кристалізації CD від 25 % до 35 %.
6. Біологічно активні наночастинки за п. 1, які мають площу поверхні від 30 до 60 м2/г.
7. Біологічно активні наночастинки за п. 1, які мають по суті гостроконечну або пластинчасту форму і які мають довжину L від 50 до 150 нм і ширину W від 5 до 20 нм.
8. Біологічно активні наночастинки за будь-яким з пп. 1-7, які додатково містять ефективну кількість антибактеріального іона.
9. Біологічно активні наночастинки за п. 8, які містять від 0,1 до 20 мас. % від загального вмісту Са-іона антибактеріального металу М, заміщеного у структурі гідроксіапатиту.
10. Біологічно активні наночастинки за п. 9, де вказаний метал М вибирають із групи, яка включає Zn, Cu, Ag і їх суміші.
11. Біологічно активні наночастинки за п. 9, які мають молярне відношення (Са + М)/Р вище 1,7.
12. Біологічно активні наночастинки за п. 9, які мають формулу:
Са10-хМх(РО4)6-у(СО3)у+z(ОН)2-z,
де х являє собою число від 0,0055 до 0,6, у являє собою число від 0,065 до 0,9, a z являє собою число від 0 до 0,32.
13. Композиція, яка містить біологічно активні наночастинки за будь-яким з попередніх пунктів.
14. Композиція за п. 13 у формі, придатній для догляду за порожниною рота.
15. Композиція за п. 13 або 14 у формі суспензії, олії, гелю або твердої речовини.
16. Композиція за п. 15 у формі суспензії, яка містить від 1 % до 40 мас. % біологічно активних наночастинок.
17. Композиція за п. 15, яка має рН від 7 до 8.
18. Композиція за п. 15 у формі зубної пасти, зубного порошку, жувальної гумки для догляду за порожниною рота і зубами, мазі для ясен, засобу для полоскання рота і концентрату для ванночок та засобу для полоскання горла.
19. Композиція за п. 14, яка містить комбінацію біологічно активних наночастинок, які включають ефективну кількість антибактеріального іона і біологічно активні наночастинки без такого іона.
20. Спосіб одержання водної суспензії, що містить біологічно активні наночастинки за п. 1, який включає стадії:
a) одержання водного розчину або суспензії, яка містить сполуку Са;
b) одержання наночастинок карбонат-заміщеного гідроксіапатиту шляхом додавання РО43- іонів до водного розчину або суспензії стадії а) при їх одночасному перемішуванні протягом від 30 хвилин до 8 годин, підтримуючи температуру розчину або суспензії нижче або рівною 60 °С;
c) перемішування суспензії наночастинок, одержаної на стадії b) протягом щонайменше двох годин при температурі, яка нижча або дорівнює 60 °С.
21. Спосіб за п. 20, у якому такою сполукою Са є сіль кальцію, вибрана з групи, що включає гідроксид кальцію, карбонат кальцію, ацетат кальцію, оксалат кальцію, нітрат кальцію і їх суміші.
22. Спосіб за п. 20, у якому стадію а) здійснюють за відсутності неприйнятних для перорального застосування аніонів.
23. Спосіб за п. 20, у якому стадію b) здійснюють шляхом барботування повітря, СО2-вмісного газу або їх суміші через водний розчин або суспензію зі стадії а).
24. Спосіб за п. 20, у якому стадію b) здійснюють шляхом додавання водного розчину, що містить іони РО43-, до водного розчину або суспензії стадії а).
25. Спосіб за п. 24, у якому такий водний розчин, що містить РО43- іони, додатково містить НСО3- іони.
26. Спосіб за п. 25, у якому такий водний розчин, що містить НСО3- і РО43- іони, одержують барботуванням повітря, СО2 або їх суміші через воду з одержанням розчину вугільної кислоти і наступним додаванням до нього Н3РО4.
27. Спосіб за п. 24, у якому стадію b) здійснюють шляхом одночасного додавання першого розчину, який містить СО32- іони, і другого розчину, який містить РО43- іони, до водного розчину або суспензії стадії а).
28. Спосіб за п. 20, у якому водний розчин або суспензія зі стадії а) має рН від 8 до 12.
29. Спосіб за п. 20, у якому стадію b) здійснюють, підтримуючи такий розчин або суспензію при температурі від 25 °С до 40 °С.
30. Спосіб за п. 20, у якому суспензія, одержана на стадії с), має рН від 7 до 8.
31. Спосіб за п. 20, у якому стадію с) здійснюють, підтримуючи суспензію наночастинок при тій самій температурі, що і на стадії b).
32. Спосіб за будь-яким з пп. 20-31, у якому водний розчин або суспензія зі стадії а) додатково містить оксид або сіль антибактеріального металу М.
33. Спосіб за п. 32, у якому така сіль металу є придатною для перорального застосування органічною або неорганічною сіллю, вибраною з групи, яка включає лактати, глюконати, цитрати, ацетати і гідроксиди.
34. Спосіб за будь-яким з пп. 32 або 33, у якому стадію b) здійснюють таким чином, що співвідношення іонів Са і металу М, які містяться у розчині або суспензії із стадії а), і іонів РО43-, що додаються до них, є вище 1,7.
35. Спосіб одержання біологічно активних наночастинок за будь-яким з пп. 1-12, який включає стадії:
a) одержання водної суспензії, яка містить такі наночастинки з допомогою способу за будь-яким з пп. 20-34;
b) відділення твердих наночастинок від суспензії, одержаної на стадії а);
c) висушування отриманих таким чином вологих наночастинок.
36. Спосіб за п. 35, у якому таку стадію відділення b) здійснюють шляхом декантування, центрифугування або фільтрування.
37. Спосіб за п. 35, у якому таку стадію висушування с) здійснюють шляхом сушіння вологих твердих наночастинок заморожуванням при температурі нижче 0 °С до досягнення сталої маси.
38. Спосіб за п. 35, який додатково включає стадію
d) промивання відділених твердих наночастинок водою або основним розчином перед здійсненням стадії висушування с).
39. Спосіб одержання зубної пасти, що містить біологічно активні наночастинки за будь-яким з пп. 1-12, який включає стадії:
a) одержання водної суспензії, яка містить такі наночастинки з допомогою способу за будь-яким з пп. 20-34;
b) змішування такої водної суспензії з іншими інгредієнтами зубної пасти.
40. Спосіб за п. 39, у якому стадію змішування b) здійснюють у міксері, який підтримують в умовах заданого ступеня вакууму.
41. Спосіб одержання зубної пасти, що містить біологічно активні наночастинки за будь-яким з пп. 1-12, який включає стадії:
a) одержання твердих наночастинок з допомогою способу за будь-яким з пп. 35-38;
b) змішування твердих наночастинок з іншими інгредієнтами зубної пасти.
42. Спосіб за п. 41, у якому стадію змішування b) здійснюють у міксері, який підтримують в умовах заданого ступеня вакууму.
43. Спосіб за п. 39, у якому стадію змішування b) здійснюють шляхом
b1) перемішування водної суспензії із стадії а) з іншими інгредієнтами зубної пасти, за винятком будь-якої поверхнево-активної речовини;
b2) включення до складу отриманої таким чином суміші щонайменше одної поверхнево-активної речовини.
44. Спосіб місцевої ремінералізації зубів, який включає контактування зубів із композицією за будь-яким з пп. 14-19.
45. Композиція, яка містить сукупність біологічно активних наночастинок за п. 1
46. Композиція за п. 45 у формі зубної пасти, зубного порошку, жувальної гумки для догляду за порожниною рота і зубами, мазі для ясен, засобу для полоскання рота і концентрату для ванночок та засобу для полоскання горла.
Текст
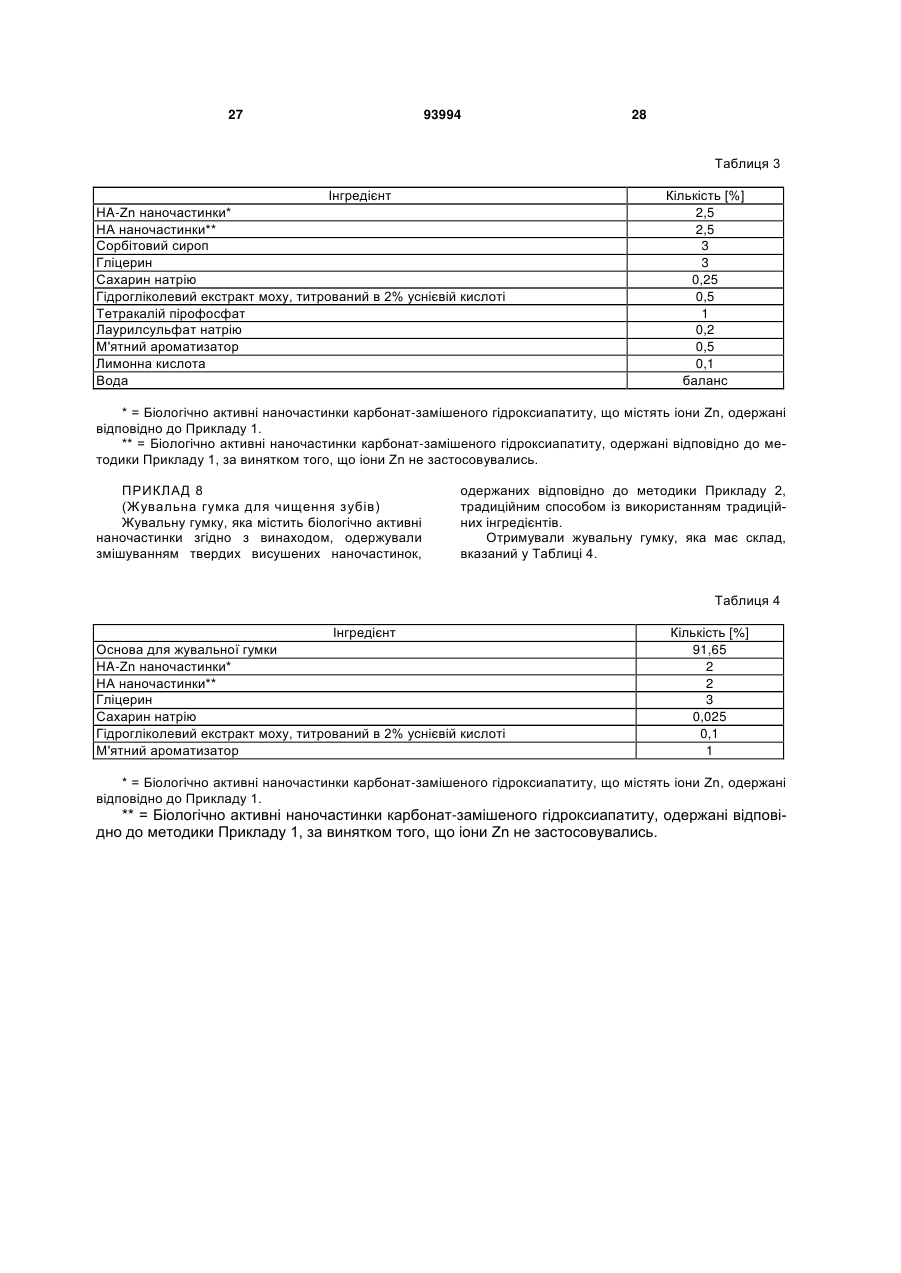
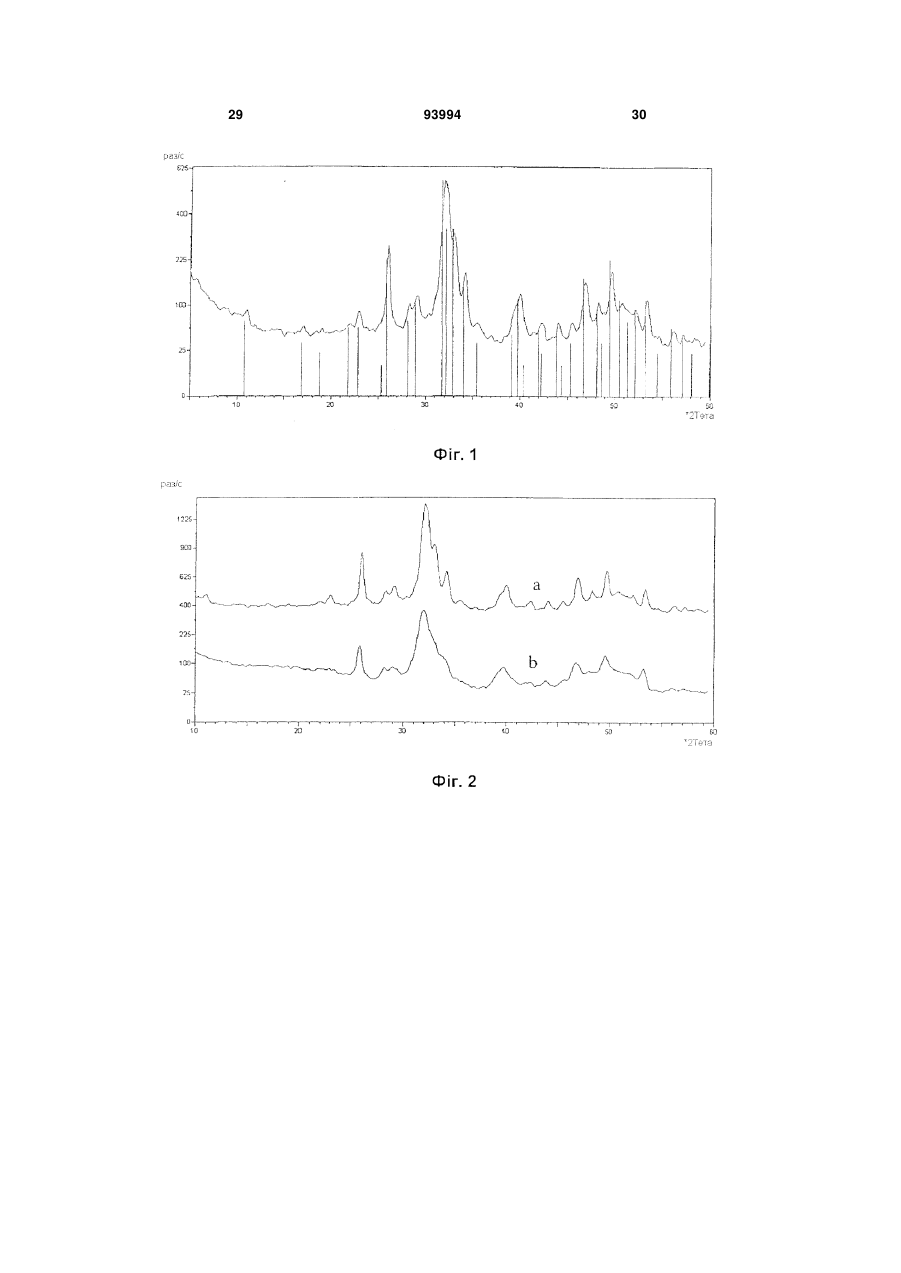
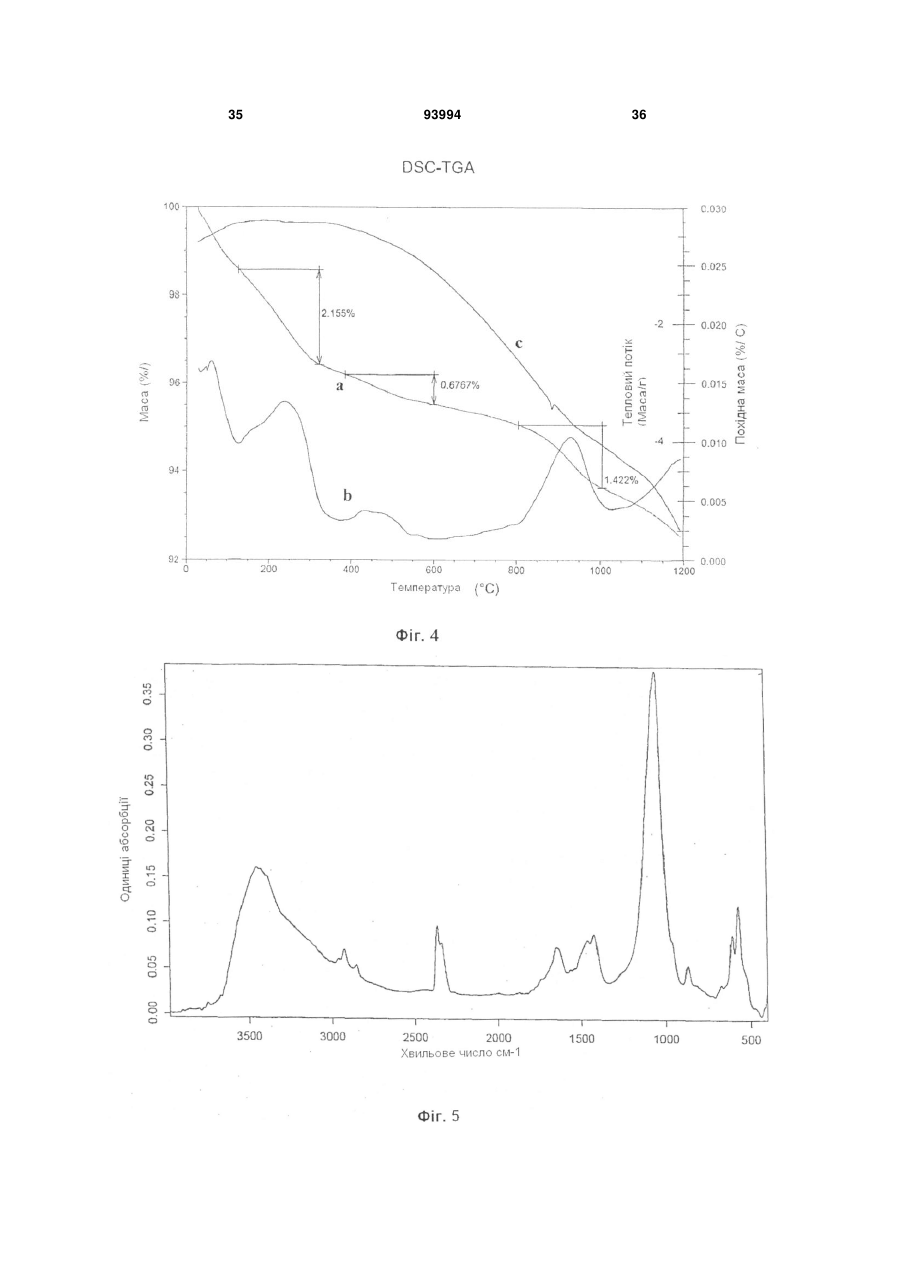
1. Біологічно активні наночастинки карбонатзаміщеного нестехіометричного гідроксіапатиту, який має: a) ступінь кристалізації CD нижче 40 %, причому ступінь кристалізації визначається як CD (1 X / Y) 100 , де: Y = висота дифракційного максимуму при 2 33 , X = висота дифракційного фону при 2 33 на рентгенограмі наночастинок; b) довжину L від 20 до 200 нм і ширину W від 5 до 30 нм; і c) відношення висоти до ширини (аспектне відношення) від 2 до 40, яке визначається формулою AR = L/W. 2. Біологічно активні наночастинки за п. 1, які містять від 1 % до 15 мас. % карбонатного заміщення у гідроксіапатитовій структурі. 3. Біологічно активні наночастинки за п. 1, де співвідношення А/В між карбонатним заміщенням на гідроксильному сайті (А) і карбонатним заміщенням на фосфатному сайті (В) гідроксіапатиту становить від 0,05 до 0,5. 4. Біологічно активні наночастинки за п. 1 або 3, де карбонатне заміщення на фосфатному сайті (В) 2 (19) 1 3 ефективну кількість антибактеріального іона і біологічно активні наночастинки без такого іона. 20. Спосіб одержання водної суспензії, що містить біологічно активні наночастинки за п. 1, який включає стадії: a) одержання водного розчину або суспензії, яка містить сполуку Са; b) одержання наночастинок карбонат-заміщеного гідроксіапатиту шляхом додавання РО43- іонів до водного розчину або суспензії стадії а) при їх одночасному перемішуванні протягом від 30 хвилин до 8 годин, підтримуючи температуру розчину або суспензії нижче або рівною 60 °С; c) перемішування суспензії наночастинок, одержаної на стадії b) протягом щонайменше двох годин при температурі, яка нижча або дорівнює 60 °С. 21. Спосіб за п. 20, у якому такою сполукою Са є сіль кальцію, вибрана з групи, що включає гідроксид кальцію, карбонат кальцію, ацетат кальцію, оксалат кальцію, нітрат кальцію і їх суміші. 22. Спосіб за п. 20, у якому стадію а) здійснюють за відсутності неприйнятних для перорального застосування аніонів. 23. Спосіб за п. 20, у якому стадію b) здійснюють шляхом барботування повітря, СО2-вмісного газу або їх суміші через водний розчин або суспензію зі стадії а). 24. Спосіб за п. 20, у якому стадію b) здійснюють шляхом додавання водного розчину, що містить іони РО43-, до водного розчину або суспензії стадії а). 25. Спосіб за п. 24, у якому такий водний розчин, що містить РО43- іони, додатково містить НСО3іони. 26. Спосіб за п. 25, у якому такий водний розчин, що містить НСО3- і РО43- іони, одержують барботуванням повітря, СО2 або їх суміші через воду з одержанням розчину вугільної кислоти і наступним додаванням до нього Н3РО4. 27. Спосіб за п. 24, у якому стадію b) здійснюють шляхом одночасного додавання першого розчину, який містить СО32- іони, і другого розчину, який містить РО43- іони, до водного розчину або суспензії стадії а). 28. Спосіб за п. 20, у якому водний розчин або суспензія зі стадії а) має рН від 8 до 12. 29. Спосіб за п. 20, у якому стадію b) здійснюють, підтримуючи такий розчин або суспензію при температурі від 25 °С до 40 °С. 30. Спосіб за п. 20, у якому суспензія, одержана на стадії с), має рН від 7 до 8. 31. Спосіб за п. 20, у якому стадію с) здійснюють, підтримуючи суспензію наночастинок при тій самій температурі, що і на стадії b). 32. Спосіб за будь-яким з пп. 20-31, у якому водний розчин або суспензія зі стадії а) додатково містить оксид або сіль антибактеріального металу М. 33. Спосіб за п. 32, у якому така сіль металу є придатною для перорального застосування органічною або неорганічною сіллю, вибраною з групи, яка включає лактати, глюконати, цитрати, ацетати і гідроксиди. 34. Спосіб за будь-яким з пп. 32 або 33, у якому 93994 4 стадію b) здійснюють таким чином, що співвідношення іонів Са і металу М, які містяться у розчині або суспензії із стадії а), і іонів РО43-, що додаються до них, є вище 1,7. 35. Спосіб одержання біологічно активних наночастинок за будь-яким з пп. 1-12, який включає стадії: a) одержання водної суспензії, яка містить такі наночастинки з допомогою способу за будь-яким з пп. 20-34; b) відділення твердих наночастинок від суспензії, одержаної на стадії а); c) висушування отриманих таким чином вологих наночастинок. 36. Спосіб за п. 35, у якому таку стадію відділення b) здійснюють шляхом декантування, центрифугування або фільтрування. 37. Спосіб за п. 35, у якому таку стадію висушування с) здійснюють шляхом сушіння вологих твердих наночастинок заморожуванням при температурі нижче 0 °С до досягнення сталої маси. 38. Спосіб за п. 35, який додатково включає стадію d) промивання відділених твердих наночастинок водою або основним розчином перед здійсненням стадії висушування с). 39. Спосіб одержання зубної пасти, що містить біологічно активні наночастинки за будь-яким з пп. 1-12, який включає стадії: a) одержання водної суспензії, яка містить такі наночастинки з допомогою способу за будь-яким з пп. 20-34; b) змішування такої водної суспензії з іншими інгредієнтами зубної пасти. 40. Спосіб за п. 39, у якому стадію змішування b) здійснюють у міксері, який підтримують в умовах заданого ступеня вакууму. 41. Спосіб одержання зубної пасти, що містить біологічно активні наночастинки за будь-яким з пп. 1-12, який включає стадії: a) одержання твердих наночастинок з допомогою способу за будь-яким з пп. 35-38; b) змішування твердих наночастинок з іншими інгредієнтами зубної пасти. 42. Спосіб за п. 41, у якому стадію змішування b) здійснюють у міксері, який підтримують в умовах заданого ступеня вакууму. 43. Спосіб за п. 39, у якому стадію змішування b) здійснюють шляхом b1) перемішування водної суспензії із стадії а) з іншими інгредієнтами зубної пасти, за винятком будь-якої поверхнево-активної речовини; b2) включення до складу отриманої таким чином суміші щонайменше одної поверхнево-активної речовини. 44. Спосіб місцевої ремінералізації зубів, який включає контактування зубів із композицією за будь-яким з пп. 14-19. 45. Композиція, яка містить сукупність біологічно активних наночастинок за п. 1 46. Композиція за п. 45 у формі зубної пасти, зубного порошку, жувальної гумки для догляду за порожниною рота і зубами, мазі для ясен, засобу для полоскання рота і концентрату для ванночок та засобу для полоскання горла. 5 Винахід стосується біологічно активних наночастинок карбонат-заміщеного гідроксиапатиту, способу їх одержання та композицій, що їх містять. Зокрема, винахід стосується біологічно активних наночастинок, які переважно використовуються для догляду за порожниною рота та зубами, але не обмежуються таким використанням, з також композицій для догляду за порожниною рота і зубами, які містять такі наночастинки, наприклад у вигляді розчинів, суспензій, олій та інших твердих продуктів. Відповідно до інших аспектів винахід стосується способу одержання суспензії для догляду за порожниною рота і зубами, способу одержання зубної пасти, яка містить вищезгадані біологічно активні наночастинки, а також способу місцевої ремінералізації зубів, який включає взаємодію зубів з наночастинками. Відомо, що за оцінками стоматологів значний відсоток населення, що становить 20-25% від його загальної кількості, страждають від гіперчутливості або гіперестезії зубів, інакше кажучи від болю, який викликається механічними, хімічними або термічними подразниками, без будь-яких видимих захворювань зубів, що вимагають лікування, таких як карієс. Гіперчутливість проявляється головним чином біля шийки зуба у випадку, коли м'який дентин між межею емалі та яснами оголюється внаслідок рецесії ясен. Дія лактобактерій, що утворюють молочну кислоту, або механічна дія ортодонтичних скоб (навіть у дітей), або ж ділянки зубного ряду, що змикаються під час жування, також можуть пошкоджувати захисну емаль, внаслідок чого дентинові канальці, які таким чином оголюються, передають будь-яке механічне, хімічне або термальне подразнення у вигляді больового сигналу до пульпи зуба. Відомо, що регулярна дія неорганічних солей, зокрема бікарбонату натрію, хлориду натрію або хлориду стронцію у високих концентраціях у присутності гліцерину десенсибілізує чутливі ділянки зуба, але така десенсибілізація є зворотною, внаслідок чого біль знову повертається незадовго після завершення лікування. Для забезпечення більш постійного результату щодо таких больових станів у процесі рутинного догляду за зубами у індивіда, який страждає від чутливості зубів, було запропоновано оральні або дентальні препарати, здатні посилювати десенсибілізуючий ефект за рахунок забезпечення довготривалої ремінералізації зубів. Так, наприклад, у патенті Канади CA 999 238 списаний оральний або дентальний препарат, що містить від 5 до 90 мас.% дрібнодисперсного гідроксиапатиту із середнім розміром частинок менше ніж 10 мкм, зокрема в діапазоні приблизно від 6 до 8 мкм. Відповідно до цього джерела при повторюваній взаємодії такого дрібнодисперсного гідроксиапатиту з чутливими зубами протягом тривалого часу, наприклад під час чищення зубів або жування гумки, може бути досягнута довготривала 93994 6 ремінералізація зубів завдяки дифузії гідроксиапатиту в оголені дентинові канальці внаслідок його слабкої розчинності у воді та слині завдяки гідролізу. Відповідно, такий слабкорозчинний гідроксиапатит накопичується у мікроскопічних порожнинах, присутніх у його структурі в органічній матриці, внаслідок чого дентинові канальці поступово закриваються, та досягається постійне знеболення. Також відомо, що окрім вищезгаданої проблеми гіперчутливості або гіперестезії зубів, багато людей страждають від хронічної кровоточивості ясен, що є наслідком гінгівіту, відкладення секрету з ясенних борозен та ураження зубного ложа, яке на ранніх стадіях призводить до розхитування зубів та руйнування зубного ложа. Анаеробні гнилісні бактерії, що викликають неприємний запах з рота, здатні швидко розмножуватися у сприятливому середовищі запаленої тканини, що відкладає секрет, завдяки чому легко викликається запалення слизової оболонки ротової порожнини та навіть порожнини глотки. З метою забезпечення лікування таких захворювань зубів та ясен, а також для загального поліпшення гігієни рота, що забезпечується шляхом рутинного чищення зубів, у рівні техніки пропонувалися оральні та дентальні препарати, здатні забезпечувати антибактеріальний ефект. Таким чином, наприклад, у європейському патенті EP 0 539 651 описаний засіб для чищення зубів (зубна паста або порошок), в якому антибактеріальний матеріал (метал-іонний агент) знаходиться на носії, який входить до складу такого засобу. Більш конкретно, у цьому документі описаний засіб для чищення зубів, що містить кальцієву сполуку, таку як гідроксиапатит, у формі порошку, що містить антибактеріальний метал на кальцієвому носії, який має високу стабільність, для запобігання токсичності, що є результатом утворення іонів металу під час лікування зубів, та для надання такому засобу властивостей, що роблять його придатним для тривалого зберігання. Виходячи з того, що кісткова тканина зуба головним чином складається з нестехіометричного гідроксиапатиту, що містить специфічні заміщуючі іони в катіонних та аніонних ретикулярних сайтах, недавнім часом було запропоновано використовувати наночастинки гідроксиапатиту для лікування кісткових дефектів у галузі реконструктивної кісткової хірургії, хірургічної стоматології, травматології, ортопедії і стоматології. Так, наприклад, у європейському патенті EP 0 664 133 описаний препарат для стимулювання росту кісткової тканини на основі гідроксиапатиту, в якому гідроксиапатит використовується у формі водної пасти з концентрацією 18-36 мас.% та розміром частинок від 15 до 60 нм. Відповідно до цього джерела такий препарат при його нанесенні та залишенні на поверхні з метою взаємодії з кістковою тканиною, що підлягає відновленню, на тривалий час діє як стимуля 7 тор проліферативної і біосинтетичної активності остеобластів. З іншого боку, у міжнародній патентній заявці WO 2005/05815 описаний магній-вмісний карбонований матеріал у формі висушуваного заморожуванням грануляту, придатний для кісткових імплантатів, зокрема в галузі стоматології, що містить згаданий модифікований гідроксиапатит та органічний полімер, переважно альгінат. Відповідно до цього джерела композиційний матеріал, що містить такий модифікований гідроксиапатит, здатний ефективно усувати дефекти кісткової тканини після його нанесення у необхідній кількості залежно від наявної дірки та його взаємодії із кістковою тканиною протягом тривалого проміжку часу. Винахідниками було встановлено, що сполуки гідроксиапатиту і композиції, відомі з рівня техніки, мають обмежену ефективність у лікуванні гіперчутливості зубів при їх застосуванні у рутинному щоденному догляді за зубами. Самі операції з чищення зубів з допомогою зубної пасти або операції з полоскання із застосуванням рідини для полоскання рота або розчину для полоскання горла, навіть якщо їх тривалість продовжена, можуть тривати протягом часу, який не є достатнім для того, щоб відомі сполуки гідроксиапатиту та факультативні додаткові компоненти повністю проявили свою десенсибілізуючу і необов'язково антимікробну дію. Відповідно до одного аспекту цей винахід стосується біологічно активної сполуки гідроксиапатиту, здатної ефективно підвищувати десенсибілізацію зубів і їх ремінералізацію навіть протягом обмеженого проміжку часу під час рутинного щоденного догляду за зубами. Біологічно активні наночастинки карбонатзаміщеного гудроксиапатиту згідно з винаходом розкриті у пункті 1 формули винаходу. Більш точно, біологічно активні наночастинки згідно з винаходом є наночастинками карбонатзаміщеного нестехіометричного гідроксиапатиту, який має: a) ступінь кристалізації CD нижче 40%, причому ступінь кристалізації визначається як CD = (1-X/Y)100 де: Y = висота дифракційного максимуму при 2 = 33°, X = висота дифракційного фонову при 2 = 33° на рентгенограмі наночастинок; b) довжину L від 20 до 200 нм і ширину W від 5 до 30 нм; і c) відношення висоти до ширини (аспектне відношення) від 2 до 40, яке визначається формулою AR = L/W. Винахідниками було встановлено, що наночастинки карбонат-заміщеного гідроксиапатиту, які мають вищевказані властивості, мають високу афінність з мінеральними компонентами зубного дентину та емалі і здатні "імітувати" структуру цих компонентів такою мірою, що наночастинки можуть ефективно взаємодіяти з дентином і поверхнею емалі. Винахідниками також було встановлено, що наночастинки карбонат-заміщеного гідроксиапати 93994 8 ту згідно з винаходом водночас досягають посиленої реактивності відносно дентину і поверхні зубної емалі, що ефективно використовується, навіть незважаючи на обмежений проміжок часу, що відводиться на рутинний догляд за зубами. Хоча винахідники не бажають бути прив'язаними до певної теорії, вважається, що така підвищена активність є наслідком поєднання факторів, які імітують біогенні наночастинки гідроксиапатиту, такі як придатний нестехіометричний склад гідроксиапатиту, значно зменшений розмір (наношкала) і, як наслідок, сильно розвинена поверхня нестехіометричної гідроксиапатитової сполуки, її низький ступінь кристалізації та видовжена форма (що визначається аспектним відношенням), які одночасно сприяють підвищенню розчинності та афінності з мінеральними компонентами зубного дентину і емалі. Більш конкретно вважається, що головну роль у підвищенні реактивності наночастинок згідно з винаходом відіграє підвищений поверхневий безлад на їх зовнішній поверхні, на якій більше не підтримується іонна стехіометрія у більшості цих частинок. У описі та формулі винаходу (див. нижче) термін «наночастинка» означає частинку з розміром, як правило, менше 1 мкм; переважно наночастинки згідно з винаходом мають сплющену гострокінечну форму, яка є найбільш пристосованою до взаємодії з дентином та поверхнею зубної емалі. У описі та формулі винаходу (див. нижче) вираз «біологічно активний» означає здатність речовини або композиції взаємодіяти з зубним дентином і/або емаллю, і/або яснами або іншою тканиною у порожнині рота. У описі та формулі винаходу (див. нижче) вираз «ступінь кристалізації» означає відсоток сполуки гідроксиапатиту, яка присутня у кристалічній формі. Для цілей цього винаходу ступінь кристалізації може визначатися з допомогою відомих методик, таких як, наприклад, з допомогою рентгеноструктурного аналізу. У контексті вищенаведених визначень ступінь кристалізації CD визначають відповідно до методу, описаного у Landi, E., Tampieri, A., Celotti, G., Sprio, S., "Densification behaviour and mechanisms of synthetic hydroxyapatites", J. Eur. Ceram. Soc, 2000, 20, 2377-2387 («Поведінка згущення та механізми дії синтетичного гідроксиапатиту», далі скорочено: метод Landi et аl.). Ступінь кристалізації наночастинок також може оцінюватися з допомогою альтернативної методики, описаної у Z. Е. Erkmen "The effect of heat treatment on the morphology of D-Gun Sprayed Hydroxyapatite coatings", J. Biomed Mater Res (Appl Biomaterial) 48,861-868, 1999 («Дія теплової обробки на морфологію покриттів із розпиленого з допомогою приладу D-Gun гідроксиапатиту», далі скорочено метод Erkmen). Відповідно до альтернативного методу ступінь кристалізації CD' може бути визначений як CD'=(X/Y)100 де: Y = площа піків + фонова площа, 9 X = площа піків дифракції на рентгенограмі наночастинок. Числові значення ступеня кристалізації CD', отримані відповідно до методики Erkmen, відрізняються від значень, отриманих методом Landi et аl.; у цьому випадку насправді ступінь кристалізації CD' наночастинок згідно з винаходом нижчий за 70%. У описі та формулі винаходу (див. нижче) вираз «нижче за», що вживається перед будь-яким числовим значенням означає, що таке числове значення виключається, а діапазон величин охоплює лише ті величини, які нижчі за це значення. У описі та формулі винаходу (див. нижче) термін довжина L наночастинок означає міру величини наночастинки, що вимірюється вздовж її головної вісі, тоді як термін ширина W наночастинок означає міру величини наночастинки, що вимірюється вздовж її малої вісі. Для цілей цього винаходу довжина L і ширина W наночастинок можуть визначатися з допомогою відомих методик, таких як, наприклад, з допомогою трансмісійної електронної мікроскопії (ТЕМ). У описі та формулі винаходу (див. нижче), окрім випадків, коли зазначено інакше, всі числові значення, які визначають параметри, такі як кількість, маса, температура, відсоток і т.д., можуть змінюватися у всіх випадках, що відображається через термін «приблизно». Також всі діапазони значень включають будь-яку комбінацію максимального і мінімального значень і включають будь-які проміжні інтервали, які можуть визначатися конкретно, а можуть і не вказуватися. Як зазначалося вище, наночастинки згідно з винаходом є наночастинками карбонатзаміщеного нестехіометричного гідроксиапатиту, який містить карбонатні іони в структурі апатиту. Така властивість переважно посилює біологічну активність наночастинок, оскільки карбонатний іон також виявлений у структурі природного гідроксиапатиту. У зв'язку з цим спостерігається присутність карбонатного іона у двох різних сайтах у структурі природного гідроксиапатиту, а саме він може частково заміщувати ОН-іон (сайт А) і/або PO43- іон (сайт В). Як загальний вміст карбонату (в діапазоні 3-8 мас. %), так і відносні кількості сатурації типу А і типу В (А/В в діапазоні 0,7-0,9), що виявляються у природному карбонат-заміщеному гідроксиапатиті, залежать від віку особи та від біологічної локалізації тканини, що зазнала кальцинозу. У наночастинок згідно з винаходом сатурація переважно відбувається на сайті В, оскільки це призводить до зниження ступеня кристалізації та підвищення розчинності апатитової фази. Відповідно до переважного варіанту винаходу наночастинки гідроксиапатиту містять від 1 до 15 мас.% і більш переважно від 1 до 10 мас.% від загальної маси наночастинок карбонату, заміщених в структурі гідроксиапатиту. Таким чином, біологічна активність наночастинок переважно посилюється, оскільки їх структура більше нагадує структуру природного апатиту, присутнього у зубній тканині. Відповідно до переважного варіанту винаходу 93994 10 співвідношення А/В між карбонатним заміщенням на гідроксильному сайті (А) і карбонатним заміщенням на фосфатному сайті (В) гідроксиапатиту становить від 0,05 до 0,5, і ще більш переважно від 0,18 до 0,33. Відповідно до ще одного переважного варіанту винаходу карбонатне заміщення на фосфатному сайті (В) гідроксиапатиту більше або дорівнює 65 мас. % і більш переважно становить від 90 до 100 мас.% від загальної маси карбонату, присутнього у складі гідроксиапатиту. Такі переважні схеми карбонатного заміщення у структурі гідроксиапатиту переважно дозволяють підвищувати розчинність наночастинок у біологічному середовищі. Крім того, карбонатне заміщення на фосфатному сайті (В) переважно індукує більш високу афінність наночастинок гідроксиапатиту з остеобластоцитами, підвищуючи клітинну адгезію і вироблення колагену. Відповідно до переважного варіанту винаходу наночастинки мають ступінь кристалізації CD від 25% до 35%, визначений відповідно до методу Landi et аl., що відповідає ступеню кристалізації CD' від 40% до 60%, визначеному відповідно до методу Erkmen. Таким чином, біологічна активність наночастинок може переважно посилюватися, оскільки їх низький ступінь кристалізації сприяє як підвищенню розчинності, так і підвищенню афінності до мінеральних компонентів зубного дентину і емалі. Відповідно до переважного варіанту винаходу наночастинки мають площу поверхні від 30 до 60 м2/г. Таким чином, біологічна активність наночастинок з точки зору їх реакційної здатності відносно мінеральних компонентів зубного дентину і емалі може переважно посилюватися. Для цілей цього винаходу площа поверхні сполуки гідроксиапатиту може визначатися з допомогою відомих методик, таких як, наприклад, метод БЕТ. Щодо цього параметра, то винахідники встановили, що середні значення площі поверхні наночастинок можуть змінюватися в межах зазначеного інтервалу як функція загальної кількості наночастинок, синтезованих у кожній серійній партії, причому більш високі значення досягаються тим легше, чим менша партія. Як зазначалося вище, наночастинки згідно з винаходом мають зменшений розмірі (довжину L в діапазоні від 20 до 200 нм і ширину W в діапазоні від 5 до 20 нм), що визначається з допомогою методик ТЕМ, та видовжену форму, що визначається аспектним співвідношенням AR в діапазоні від 2 до 40. Відповідно до переважного варіанту винаходу наночастинки мають по суті гострокінечну форму або форму пластинки з довжиною L від 50 до 150 нм і шириною W від 5 до 20 нм. Більше того, переважно наночастинки мають товщину Т, що визначається з допомогою методики ТЕМ, в діапазоні від 2 до 15 нм. Аспектне відношення AR наночастинок переважно становить від 2 до 16, і ще більше переважно від 5 до 10. Таким чином, біологічна активність наночастинок може переважно посилюватися, оскільки по 11 єднання видовженої форми і меншого розміру допомагає ефективно закривати дентинові канальці та досягати постійного ефекту знеболення навіть за рахунок обмеженого часу, що відводиться на щоденний рутинний догляд за зубами. Відповідно до переважного варіанту винаходу він стосується сполуки біологічно активного гідроксиапатиту, здатної ефективно проявляти антибактеріальну дію і, відповідно, ефективно лікувати захворювання зубів та ясен та загалом підвищувати гігієну ротової порожнини, навіть враховуючи обмежений час, що відводиться на звичайний догляд за зубами. Відповідно до такого переважного варіанту наночастинки додатково містять ефективну кількість антибактеріального іона. Більш переважно наночастинки згідно з винаходом містять від 0,1% до 20 мас.% від загального вмісту Ca іону антибактеріального металу М, заміщеного у структурі гідроксиапатиту. За цей рахунок антибактеріальна дія іона металу M може бути оптимізована до бажаних результатів. Переважно метал M з антибактеріальними властивостями вибирають із групи, що включає Zn, Cu, Ag і їх суміші. Найбільш переважно вищевказані іони металу ефективно реалізують антибактеріальну активність, запобігаючи розвитку карієсу та захворюванню ясен, таких як альвеолярна бленорея, та послаблюючи прояви галітозу. Відповідно до такого переважного варіанту наночастинки мають молярне відношення (Ca + М)/Р більше, ніж 1,7, і більш переважно від 1,7 до 1,8. Таким чином, можна забезпечити карбонатне заміщення у структурі гідроксиапатиту головним чином на сайті В, оскільки молярне відношення (Ca + M)/P для незаміщених гідроксиапатитів приблизно становить 1,67. Відповідно до цього переважного варіанту наночастинки згідно з винаходом суто з описовою метою можуть бути представлені наступною формулою: Ca10-x Mx (РO4)6-у(СO3)y+z(ОН)2-z де x представляє собою число від 0,0055 до 0,6, у представляє собою число від 0,065 до 0,9, і z представляє собою число від 0 до 0,32. Відповідно до іншого аспекту винахід стосується композиції, що містить біологічно активні наночастинки, описані в цій заявці. Відповідно до одного з переважних варіантів така композиція має форму, придатну для гігієни порожнини рота і здатну ефективно покращувати десенсибілізацію зубів та їх ремінарелізацію, навіть в обмеженому проміжку часу, який відводиться для нормального рутинного догляду за зубами. Якщо такі наночастинки також містять іон металу, що має антибактеріальну дію, така композиція може ефективно забезпечувати антибактеріальну дію і відповідно ефективно лікувати захворювання зубів і ясен та загалом підвищувати рівень гігієни, навіть в обмеженому проміжку часу, який відводиться для нормального рутинного догляду за зубами. Зокрема, спостерігалося, що антибактеріальна 93994 12 дія іонів металу може безпосередньо забезпечуватися in situ на поверхні емалі і дентину під час повторної солюбілізації наночастинок, що відкладаються на них, внаслідок чого забезпечується пролонговане вивільнення іонів металу, навіть після видалення засобу для чищення зубів. Для цілей цього винаходу композиція, що містить наночастинки згідно з винаходом, може бути у будь-якій фізичній формі, придатній для догляду за порожниною рота, такій як суспензія, олія, гель або інший твердий продукт. Відповідно до переважного варіанту винаходу композиція має форму суспензії, що містить від 1% до 40 мас. %, більш переважно від 10% до 20 мас. %, біологічно активних наночастинок. Найбільш переважно така суспензія може бути одержана з допомогою досить простого і економічного методу, що буде детально описано далі, і може безпосередньо використовуватися, наприклад, як засіб для полоскання горла, засіб для полоскання рота, для лікування зубів і ясен або може змішуватися з іншими інгредієнтами для одержання твердого або рідкого продукту, такого як зубна паста або засіб для полоскання рота. Відповідно до переважного варіанту винаходу така суспензія має рН від 7 до 8, і більш переважно від 7 до 7.4. Таким чином, така суспензія може використовуватися безпосередньо або змішуватися з іншими інгредієнтами у складі ефективних композицій для догляду за порожниною рота. У будь-якому випадку і відповідно до переважного варіанту винаходу було доведено, що бажано додавати придатні консерванти, такі як парабени або інші консерванти, придатні для перорального застосування, відомі із рівня техніки, з метою продовження строку зберігання суспензії і уникнення ураження її пліснявою або бактеріями. Винахідниками було несподівано виявлено, що суспензія згідно з винаходом залишається стабільною протягом тривалого часу навіть у випадку, коли до неї не додаються стабілізатори. Зокрема, було встановлено, що така суспензія згідно з винаходом залишається стабільною щонайменше протягом 30 днів і загалом протягом приблизно двох-трьох місяців без застосування будь-яких стабілізаторів. Відповідно до альтернативного варіанту винаходу композиція може бути у формі зубної пасти, зубного порошку, жувальної гумки для догляду за порожниною рота і зубами, мазі для ясен, рідини для полоскання рота, концентрату для ванночок і рідини для полоскання горла. Відповідно до переважного варіанту винаходу композиція може містити комбінацію біологічно активних наночастинок, що містять ефективну кількість антибактеріального іона і біологічно активні наночастинки без такого іона. Таким чином, той антибактеріальний ефект, що забезпечується іоном металу, який переноситься до дентину і поверхні емалі, може регулюватися відповідно до найрізноманітніших вимог. Відповідно до ще одного переважного варіанту винаходу в пероральній композиції згідно з винаходом кількість біологічно активних наночастинок 13 загалом змінюється від 3% до 30 мас. % від маси композиції. Якщо пероральна композиція містить комбінацію біологічно активних наночастинок, що містять ефективну кількість антибактеріального іона і біологічно активні наночастинки без такого іона, кількість кожного типу наночастинок загалом змінюється від 1,5% до 15 мас. % від маси композиції. Пероральна композиція згідно з винаходом звичайно також міститиме інші інгредієнти, які традиційно використовуються в рівні техніки для одержання таких продуктів залежно від форми перорального продукту. Наприклад, у випадку з пероральним продуктом у формі крему або пасти для чищення зубів такий продукт переважно містить подрібнений абразивний агент, рідку фазу, що містить змочувач, і зв'язуючу речовину або загущувач, що підтримує абразивний агент у стійкій суспензії у рідкій фазі. Також традиційними переважними компонентами для комерційних засобів для догляду за зубами є поверхнево активна речовина і смаковий агент. Для цілей цього винаходу придатний подрібнений абразивний агент може бути вибраний із групи, яка включає кремній, алюміній, гідратований алюміній, карбонат кальцію, безводний дикальцію фосфат, дигідрат дикальцію фосфат і нерозчинний у воді метафосфат натрію. Кількість подрібненого абразивного агента загалом змінюється від 0,5% до 40 мас. % від маси зубної пасти. Традиційні змочувачі включають гліцерин і сорбітів сироп (який зазвичай містить приблизно 70% розчин). Проте, фахівцям у цій галузі техніки відомі інші змочувачі, які включають пропіленгліколь, лактитол і гідрогенізований кукурудзяний сироп. Кількість змочувача змінюється від 10% до 85 мас. % від маси зубної пасти. Ріжка фаза може бути водною або безводною. Подібним чином у засобах для чищення зубів рекомендується використовувати різні зв'язуючі агенти та загущувачі. Переважні зв'язуючі агенти та загущувачі включають натрій карбоксиметилцелюлозу і ксантанову смолу. Інші зв'язуючі агенти включають натуральні смоли, такі як трагакантова смола, смола карая і гуміарабік, альгінати і карагінани. Загущувані на основі кремнію включають силікагелі і різні осаджені діоксини кремнію. Можуть застосовуватися суміші зв'язуючих агентів. Кількість зв'язуючого агента, що міститься у засобі для чищення зубів, загалом становить від 0,1% до 5 мас. %. Традиційно до складу засобу для чищення зубів входить поверхнево-активна речовина. При цьому в літературі розкритий цілий ряд придатних матеріалів. Поверхнево-активні речовини, які знайшли широке практичне застосування. Включають лаурилсульфат натрію і лауроїлсаркозинат натрію. Також можуть використовуватися інші аніонні поверхнево-активні речовини, а також інші їх типи, такі як катіонні, амфотерні і неіонні поверхнево-активні речовини. Поверхнево-активні речовини зазвичай присутні у кількості від 0,5% до 5 мас. % від маси засобу для чищення зубів. Смакові добавки, які традиційно використовуються у засобах для чищення зубів, включають добавки на основі масел м'яти колосової і м'яти 93994 14 перцевої. Приклади інших смакових добавок, що використовуються в цих засобах, включають ментол, гвоздику, вінтергреневу олію, евкаліпт та аніс. Кількість від 0,1% до 5 мас. % є придатною кількістю смакової добавки, що входить до складу засобу для чищення зубів. Пероральна композиція згідно з винаходом може містити широкий спектр інших необов'язкових компонентів. У випадку перорального продукту у формі зубної пасти такі необов'язкові інгредієнти можуть включати засіб проти утворення нальоту, такий як екстракт моху, засіб проти утворення зубного каменя, такий як конденсований фосфат, наприклад пірофосфат лужного металу, гексаметафосфат або поліфосфат; підсолоджувач, такий як сахарин і його солі; опалесціювальний компонент, такий як діоксин титану; консервант, такий як формалін; барвник; рН-регулюючий агент, такий як кислота, основа або буфер, такий як лимонна кислота. Придатні кількості таких необов'язкових інгредієнтів може легко вибиратися фахівцем у цій галузі техніки як функція певних властивостей, які мають бути надані зубній пасті. У випадку перорального продукту у формі жувальної гумки композиція, окрім вищезазначених компонентів, містить придатну основу, яку легко підбере фахівець у цій галузі техніки. У випадку перорального продукту у формі рідини для полоскання рота або рідини для полоскання горла композиція містить придатні інгредієнти у рідкій або розчинній формі, відомій фахівцю у цій галузі техніки, такі як сорбіт, гліцерин, масла і смакові добавки, солюбілізуючі агенти, такі як гідрогенізована і етоксильована рицинова олія, поверхнево-активні речовини, такі як лаурилсульфат натрію і лауроїлсаркозинат натрію, консерванти, регулятори в'язкості та інші придатні інгредієнти, відомі фахівцям у цій галузі техніки. Для більш повного опису складу пероральних композицій робиться посилання на Harry's Cosmeticology, Seventh Edition, 1982, Edited by J.В. Wilkinson and R.J. Moore. Відповідно до іншого аспекту винахід стосується удосконаленого способу одержання водної суспензії, що містить біологічно активну сполуку гідроксиапатиту, який низько затратним з точки зору затрат на його реалізацію. Спосіб одержання водної суспензії, що містить біологічно активні наночастинки карбонатзамішеного гідроксиапатиту згідно з винаходом описаний у пункті 20. А саме, спосіб згідно з винаходом включає стадії: a) одержання водного розчину або суспензії, яка містить сполуку Ca; b) одержання наночастинок карбонатзамішеного гідроксиапатиту шляхом додавання PO43- іонів до водного розчину або суспензії стадії а) при їх одночасному перемішуванні протягом від 30 хвилин до 8 годин, підтримуючи температуру розчину або суспензії нижче або рівною 60°С; c) перемішування суспензії, отриманої на стадії b), протягом щонайменше двох годин при температурі, яка нижча або дорівнює 60°С. Найбільш переважно цей спосіб дозволяє за 15 короткий час і з низькими затратами одержати суспензію на основі біологічно активних наночастинок, яка може використовуватися як композиція для догляду за порожниною рота або як складова разом з іншими інгредієнтами для одержання композицій для догляду за порожниною рота. Більше того, найбільш переважно такий спосіб дозволяє одержати суспензію на основі біологічно активних наночастинок, яка залишається стабільною протягом тривалого часу навіть без додавання до неї стабілізаторів. Як зазначалося вище, було встановлено, що отримана у такий спосіб суспензія залишається стабільною щонайменше протягом 30 днів і, як правило, протягом двох-трьох місяців без додавання до неї стабілізаторів . Для цілей цього винаходу вищевказана стадія а) одержання водного розчину або суспензії, яка містить сполуку Ca може здійснюватися у традиційний спосіб, такий як розчинення або суспендування сполуки Ca у воді. Відповідно до переважного варіанту винаходу сполука Ca представляє собою кальцієву сіль, вибрану з групи, що включає гідроксид кальцію, карбонат кальцію, ацетат кальцію, оксалат кальцію, нітрат кальцію та їх суміші. Таким чином, вартість способу може бути суттєво знижена, оскільки такі сполуки Ca є товарами широкого вжитку, що доступні на ринку за дуже низькими цінами. Крім того, такі сполуки Ca легкі у використанні та добре зберігаються, що також сприяє спрощенню виробничих операцій. У способі згідно з винаходом стадію а) переважно здійснюють з метою одержання суспензії наночастинок з основним рН. Переважно водний розчин або суспензія із стадії а) має рН від 8 до 12. Відповідно до переважного варіанту винаходу вищевказану стадію а) здійснюють за відсутності неприйнятних для перорального застосування аніонів. Таким чином, може бути одержана суспензія наночастинок, яка не потребує будь-якої додаткової обробки для видалення небажаних речовин і яка може безпосередньо використовуватись, завдяки необов'язковому регулюванню рівня рН з допомогою придатного агента, такого як лимонна кислота. У способі згідно з винаходом наночастинки карбонат-заміщеного гідроксиапатиту одержують на стадії b) шляхом додавання PO43- іонів до водного розчину або суспензії стадії а) і шляхом одночасного перемішування такого розчину або суспензії для захоплення присутнього в атмосфері вуглекислого газу і досягнення бажаного карбонатного заміщення на фосфатному сайті (В) одержуваної сполуки гідроксиапатиту. Таким чином, карбонатне заміщення може переважно здійснюватися шляхом простого перемішування розчину або суспензії, наприклад, з допомогою механічної мішалки. Відповідно до альтернативного варіанту необхідне перемішування розчину або суспензії може досягатися за рахунок барботування повітря, СO2вмісного газу або їх суміші у рідку фазу або шля 93994 16 хом поєднання механічного перемішування з барботуванням газом. Для цілей цього винаходу PO43- іони додають до водного розчину або суспензії із стадії а) протягом проміжку часу, який загалом залежить від кількості фосфорного розчину, що використовується відносно кількості основного кальцієвого розчину або суспензії, і який може бути легко встановлений фахівцем у цій галузі техніки. Переважно стадію b) здійснюють протягом від 30 хвилин до 2 годин для максимально можливого скорочення часу та затрат на виробництво. Згідно з винаходом стадію b) здійснюють, підтримуючи температуру розчину або суспензії нижче або рівною 60°С. Винахідниками було встановлено, що таким чином ступінь кристалізації CD наночастинок може підтримуватися нижче від вищевказаного максимального значення 40% (70% у випадку CD'). Відповідно до переважного варіанту винаходу стадію b) здійснюють, підтримуючи температуру розчину або суспензії нижче або рівною 40°С і більш переважно від 25° до 40°C. Таким чином, ступінь кристалізації CD наночастинок може підтримуватися в інтервалі вищезазначених переважних значень (CD = 25-35%; CD' = 40-60%). Відповідно до переважного варіанту винаходу стадію b) здійснюють шляхом додавання, переважно крапельно, водного розчину, що містить PO43іони, до водного розчину або суспензії стадії а). Відповідно до альтернативного варіанту винаходу водний розчин, що містить PO43- іони, який додається на стадії b), може додатково містити HCO3- іони. Таким чином, можна регулювати ступінь карбонатного заміщення на фосфатному сайті (В) одержуваної сполуки гідроксиапатиту до бажаного рівня. Відповідно до цього переважного варіанту вищевказаний водний розчин, що містить іони HCO3 3і PO4 , може бути одержаний шляхом барботування повітря, CO2 або їх суміші через воду з метою одержання розчину карбонової кислоти і після цього додавання до неї H3PO4. Відповідно до ще одного альтернативного переважного варіанту винаходу стадія b) може здійснюватися шляхом одночасного додавання першого розчину, що містить іони CO32-, і другого розчину, що містить PO43- іони до водного розчину або суспензії стадії а). Відповідно до переважного варіанту винаходу спосіб здійснюють таким чином, що суспензія наночастинок, одержана на стадії с), має рН від 7 до 8 і більш переважно від 7 до 7,4. Таким чином і як зазначалося вище, спосіб згідно з винаходом дозволяє одержати суспензію, яка переважно може безпосередньо використовуватися як така або у суміші з іншими інгредієнтами у складі рецептури для ефективних композицій для догляду за ротовою порожниною, при цьому помітно спрощуючи виробничі операції під час їх одержання і забезпечуючи значну економію коштів. Як зазначалося вище, суспензія наночастинок, 17 одержана таким способом, також демонструє високі показники стабільності та має термін зберігання щонайменше 30 днів і, як правило, приблизно два-три місяці, навіть без додавання до неї стабілізаторів. Відповідно до переважного варіанту винаходу водний розчин або суспензія зі стадії а) може додатково містити оксид або сіль антибактеріального металу М. Переважно антибактеріальний метал M вибирають із групи, яка включає Zn, Cu, Ag, і їх суміші. Таким чином, може бути одержана суспензія наночастинок, яка також демонструє антибактеріальний ефект, що посилює корисні гігієнічні властивості суспензії або інших продуктів (рідких або твердих), до складу яких входить така суспензія. Відповідно до переважного варіанту вищевказана сіль металу є придатною для перорального застосування органічною або неорганічною сіллю, вибраною з групи, що включає лактати, глюконати, цитрати, ацетати і гідроксиди. Таким чином, може бути одержана суспензія наночастинок, яка не потребує будь-якої додаткової обробки для видалення небажаних речовин і яка може безпосередньо використовуватись за вищевказаним призначенням. Відповідно до переважного варіанту стадію b) здійснюють таким чином, що співвідношення іонів Ca і М, які містяться у розчині або суспензії із стадії а), та PO43- іонів, які до неї додаються, більше, ніж 1,7. Таким чином, можна бути певним, що карбонатне заміщення у структурі гідроксиапатиту відбулося головним чином на сайті В, і може бути одержана суспензія наночастинок, яка переважно має антибактеріальну дію і здатна запобігати розвитку карієсу та периодонту, таких як альвеолярна бленорея, а також послаблювати прояв галітозу. У способі згідно з винаходом ріст наночастинок карбонат-замішеного гідроксиапатиту досягається на стадії с) шляхом перемішування суспензії, отриманої на стадії b) (під час чого відбувається лише нуклеїзація наночастинок) протягом щонайменше двох годин при температурі, яка нижча або дорівнює 60°C. Переважно стадію с) здійснюють протягом від 2 до 24 годин і більш переважно від 2 до 12 годин, залежно від обставин для забезпечення часу росту наночастинок, достатнього для досягнення бажаного розміру і для одержання єдиної фази. Відповідно до переважного варіанту винаходу стадію с) здійснюють, підтримуючи суспензію наночастинок при температурі від 25° до 40°C. Відповідно до переважного варіанту винаходу стадію с) здійснюють, підтримуючи суспензію наночастинок при тій самій температурі, що і на стадії b). Таким чином, спосіб може переважно здійснюватися при спрощеному контролі і з меншими затратами. Відповідно до іншого аспекту винахід стосується удосконаленого способу одержання біологічно активної сполуки гідроксиапатиту, який потребує менших виробничих затрат. Спосіб одержання біологічно активних наночастинок карбонат-замішеного гідроксиапатиту згідно 93994 18 з винаходом розкритий у пункті 35. Більш конкретно, спосіб згідно з винаходом включає стадії: a) одержання водної суспензії, що містить такі наночастинки, з допомогою описаного способу; b) відділення твердих наночастинок від суспензії, одержаної на стадії а); c) висушування отриманих таким чином вологих наночастинок. Відповідно до переважного варіанту стадію розділення b) здійснюють шляхом декантування, центрифугування або фільтрування з допомогою пристроїв і методик, відомих з рівня техніки. Відповідно до переважного варіанту стадію висушування с) здійснюють шляхом заморожування вологих твердих наночастинок при температурі нижче 0°C до досягнення сталої ваги. Відповідно до цього переважного варіанту стадію висушування с) переважно здійснюють шляхом сушки вологих твердих наночастинок заморожуванням при температурі від -20° до -50°С, найбільш переважно при -40°C. Відповідно до переважного варіанту спосіб може також додатково включати стадію d) промивання відділених твердих наночастинок водою або основним розчином перед здійсненням стадії висушування с). Переважно ця додаткова стадія промивання d) виконує важливу функцію видалення будь-яких кислотних залишків, які могли абсорбуватися або захопитися наночастинками. Відповідно до іншого аспекту винахід стосується удосконаленого способу одержання зубної пасти, що містить біологічно активну сполуку гідроксиапатиту, яка потребує менших виробничих затрат. Перший спосіб одержання зубної пасти, що містить біологічно активні наночастинки карбонатзамішеного гідроксиапатиту згідно з винаходом розкритий у пункті 39 і включає стадії: a) одержання водної суспензії, що містить такі наночастинки, з допомогою описаного способу; b) змішування такої водної суспензії з іншими інгредієнтами зубної пасти. Як вже зазначалося вище, цей спосіб дозволяє переважно включати наночастинки до складу зубної пасти прости і зручним способом, використовуючи корисні властивості, зокрема стабільність показників рН суспензії наночастинок, одержаних згідно з винаходом. Більш переважно спосіб одержання зубної пасти згідно з винаходом не вимагає будь-якого розділення або висушування наночастинок, що помітно спрощує виробництво, скорочує виробничі затрати і втрати під час виробництва, а також відходів. Крім того, стадія змішування водної суспензії наночастинок з іншими інгредієнтами зубної пасти може здійснюватися з кращим температурним контролем, оскільки водна суспензія знижує тертя і сприяє відведенню тепла, що виробляється у змішувальному апараті. Альтернативний другий спосіб одержання зубної пасти, що містить біологічно активні наночастинки карбонат-заміщеного гідроксиапатиту згідно з винаходом розкритий у пункті 40 і включає стадії: 19 a) одержання твердих наночастинок з допомогою описаного способу; b) змішування твердих наночастинок з іншими інгредієнтами зубної пасти. Цей альтернативний спосіб дозволяє отримувати зубну пасту у всіх випадках, в яких використання вищеописаної суспензії наночастинок не може бути бажаним з точки зору логістики або інших міркувань. Відповідно до переважного варіанту вищеописаного способу одержання стадію змішування b) здійснюють у перемішувальному апараті, який підтримують в умовах вакууму, який може бути легко вибраний фахівцем у галузі техніки з метою одержання однорідної суміші інгредієнтів, що досягається за рахунок використання традиційних вакуумних насосів. Відповідно до переважного варіанту першого способу одержання стадію перемішування b) здійснюють шляхом b1) перемішування водної суспензії із стадії а) з іншими інгредієнтами зубної пасти за винятком будь-якої поверхнево-активної речовини; b2) включення до складу отриманої таким чином суміші щонайменше одної поверхневоактивної речовини, таким чином зменшуючи піноутворення під час процесу перемішування. Відповідно до цього варіанту включення стадії b2) переважно здійснюють в умовах вакууму з використанням традиційного обладнання для мінімізації піноутворення. Відповідно до іншого аспекту винахід стосується способу місцевої ремінералізації зубів, який включає контактування зубів із композицією, що містить описані біологічно активні наночастинки. Найбільш переважно і завдяки описаним характеристикам наночастинок такий спосіб дозволяє ефективно ремінералізувати зуби навіть протягом обмеженого проміжку часу, що відводиться на рутинний догляд за зубами. Стадія контактування у способі ремінералізації може здійснюватися різними способами залежно від форми композиції, що містить наночастинки. Наприклад, якщо композиція має форму зубної пасти, контактування може здійснюватися шляхом простого чищення зубів, тоді як коли композиція представляє собою засіб для полоскання рота, контактування здійснюють шляхом затримання рідини у ротовій порожнині протягом необхідного проміжку часу, наприклад декілька хвилин. Згідно з винаходом і як буде більш детально проілюстровано далі, фактично наночастинки згідно з винаходом мають настільки високу ремінералізуючу активність, що їх ефект може бути помітний навіть при контакті наночастинок із зубами у короткому проміжку часу. Додаткові ознаки і переваги даного винаходу будуть більш очевидними із нижченаведених прикладів деяких переважних варіантів реалізації різних об'єктів цього винаходу, які наведені з метою ілюстрації і не обмежують об'єму правової охорони. Суть таких об'єктів буде більш зрозумілою із посиланням на нижчевказані креслення. На кресленнях: На Фіг. 1 показана рентгенограма одного при 93994 20 кладу біологічно активних наночастинок згідно з винаходом; На Фіг. 2 показана дифракційна рентгенограма одного прикладу біологічно активних наночастинок згідно з винаходом (а) і наночастинок природного (дентинового) апатиту (b); На Фіг. 3а, 3b, 3С І 3d показані ТЕМ зображення деяких прикладів біологічно активних наночастинок згідно з винаходом, які відображають нанометрів розмір частинок; На Фіг. 4 показаний термогравіметричний графік для одного прикладу біологічно активних наночастинок згідно з винаходом; На Фіг. 5 представлений інфрачервоний Фур'єспектр для одного прикладу біологічно активних наночастинок згідно з винаходом; На Фіг. 6а, 6b і 6с представлені отримані скандувальною електронною мікроскопією (CEM) зображення шматка кореневого дентину із щойно отриманого зуба від великої рогатої худоби у де мінералізованому стані (Фіг. 6а), після контакту протягом 1 хвилини (Фіг. 6b) і після контакту протягом 10 хвилин (Фіг. 6с) із суспензією біологічно активних наночастинок згідно з винаходом. У нижченаведених Прикладах під відсотками і частками маються на увазі масові відсотки і масові частки, якщо не буде зазначено інакше. ПРИКЛАД 1 (Одержання водної суспензії наночастинок) 2184 г водної суспензії біологічно активних наночастинок згідно з винаходом одержували відповідно до нижчеописаного методу. На першій стадії водну суспензію, яка містить 356,2 г Ca(OH)2, 48,8 г ZnO і 45 г Ca(CO3) в 1060 г H2O одержували у традиційній реакційній посудині при перемішуванні інгредієнтів механічною мішалкою. Під час цієї стадії одержану суспензію доводили до температури 40°2°C за рахунок електричного опору або з допомогою будь-якого іншого придатного нагрівного елемента, такого як, наприклад, термостатований кожух, в якому циркулює нагрівна рідина, така як масло або пара. Як тільки досягалась бажана температура, одержували наночастинки карбонат-замішеного гідроксиапатиту шляхом додавання по краплях PO43- іонів до водної суспензії із попередньої стадії при їх одночасному перемішуванні. У цьому випадку додавали 674 г розчину кислоти, що складався із суміші 70/30 Н3РO4(75%)/Н2O, із швидкістю капання 22 гхв-1 (0,4 гсек-1) при постійному перемішування і підтриманні сталої температури у хімічному реакторі. Через приблизно 30' і 30" одержували суспензію наночастинок, яку після цього перемішували протягом приблизно двох годин при температурі 40°±2°C, після чого одержували суспензію із загальним вмістом наночастинок приблизно 30-31 мас. % і з рН приблизно 7±0,2. Суспензія наночастинок була придатною для безпосереднього використання або в якості активного інгредієнта для наступного одержання зубної пасти, засобу для полоскання рота або іншої композиції для догляду за порожниною рота або зу 21 бами згідно з винаходом. ПРИКЛАД 2 (Одержання твердих наночастинок) 670 г біологічно активних наночастинок згідно з винаходом одержували одержанням спочатку 2184 г водної суспензії відповідно до методики і з використанням тих самих інгредієнтів, що і в попередньому Прикладі 1, і здійсненням після цього наступних додаткових стадій. Спочатку тверді наночастинки відділяли від рідини фільтруванням на фільтрувальному папері Millipore з діаметром пор 45 мкм і після цього повторно промивали розведеним водним розчином CaCO3 для видалення кислотних залишків. Отримані таким чином тверді наночастинки після цього висушували заморожуванням при -40°С, доки вони не досягали сталої маси, просівалися при (0 = 120-20 мікрон) і зберігалися при температурі 0-4°С. Отримані таким чином наночастинки, які мали аспект білого порошку, після цього аналізувались наступним чином. 1) Дифракція рентгенівських променів (ДРП) Порошкові рентгенограми отримували з допомогою порошкового дифрактометра Philips PW 1710, оснащеного допоміжним графітовим монохроматором, в якому використовується Cu K випромінення, що генерується при 40 кВ і 40 мА. Прилад настроювали із розходженням 1° і з приймальними прорізами в 0,2 мм. Зразки отримували з допомогою фронтального завантаження через стандартні алюмінієві тримачі зразка, які мають глибину 1 мм, висоту 20 мм і ширину 15 мм. Діапазон 20 був від 5° до 60° із кроком (20) 0,05° та часом (с) 3. На Фіг. Показана ДРП рентгенограма наночастинок, яка дозволяє визначити їх ступінь кристалізації. На ФІГ. 1 інтенсивність ЛІНІЇ відноситься до інтенсивності у відсотках (умовні одиниці), враховуючи найвищу інтенсивність лінії 100. Ступінь кристалізації оцінювали з допомогою вищезгаданого методу Landi et аl. і методу Erkmen. Відповідно до методу Landi et аl. ступінь кристалізації наночастинок, визначений з допомогою ДРП рентгенограми, представленої на Фіг., становив приблизно 30%. Відповідно до методу Erkmen ступінь кристалізації наночастинок, визначений з допомогою ДРП рентгенограми, представленої на Фіг., становив приблизно 52%. Щодо природи наночастинок карбонатзаміщеного гідроксиапатиту і, як також видно із зображень на Фіг. 2, де крива а відображає модель біологічно активних наночастинок гідроксиапатиту згідно з винаходом, а крива b відображає модель наночастинок природного гідроксиапатиту, то можна спостерігати подібність між наночастинками природного (дентинового) гідроксиапатиту і наночастинками гідроксиапатиту згідно з винаходом. 2) Морфологічна характеристика з допомогою трансмісійної електронної мікроскопії (ТЕМ) Аналізи шляхом трансмісійної електронної мікроскопії (ТЕМ) проводили з допомогою приладу Philips CM 100. Порошкові зразки диспергували 93994 22 ультразвуком в ультрачистій воді, і після цього декілька крапель крапали на вуглеводневу фольгу з отворами, розміщену на традиційних мідних мікрорешітках. Отримані з допомогою ТЕМ зображення біологічно активних наночастинок згідно з винаходом показані на Фіг. 3а, 3b, 3с і, відповідно, 3d, де можна побачити видовжену форму наночастинок з гостроконечною і пластинчастою морфологією, дуже схожою з морфологією кристалів кісткового апатиту. Такі наночастинки мали середню довжину L приблизно 100 нм, середню ширину W приблизно 10 нм і середню товщину T приблизно 5 нм. Середнє аспектне співвідношення A/R було 10. 3) Термічний аналіз (TGA-DSC) Термогравіметричні дослідження наночастинки здійснювали з допомогою апарату Thermal Analysis SDT Q 600. Нагрівання здійснювали у потоці азоту (100 мл/хв) із використанням алюмінієвого тримача зразка при швидкості нагрівання 10°С/хв. до 1000°С. Маса зразка становила приблизно 10 мг. На Фіг. 4 представлені результати термогравіметричного аналізу наночастинок, де видно зниження маси відносно декомпозиції неорганічної фази. Лінія а відповідає відсотковому вираженню втрати маси як функція температури обробки, а лінія b відповідає похідні й залежності втрати маси від температури. Лінія с відповідає тепловому потоку, який бере участь у переході фаз, які відсутні у зразках наночастинок. Лінія b відповідає широкому піку від 150°C до 300°C внаслідок втрати фізично абсорбованої води (втрата маси 2.2±0.5%), широкому піку від 400°C до 600°C як внаслідок втрати хімічно абсорбованої води, так і процесу декарбонізації (втрата маси 0.7±0.3%). Пік між 800°С і 1000°С може бути пов'язаний з процесом дегідроксилювання (втрата маси 1.5±0.5%). Ширина піку, зокрема, пов'язана з низьким ступенем кристалізації наночастинок. 4) Аналіз площі поверхні (БЕТ) Специфічна площа поверхні наночастинок оцінювалась з допомогою методу Брунауера, Еммета, Теллера (БЕТ) [S. Brunauer, Р.Н. Emmet, Е. Teller, Adsorption of gases in multimolecular layers. J. Am. Chem. Soc. 60 (1938) 309- 319], [ S.J; Greg, K.S. Sing (Eds.), Adsorption, Площа поверхні and Porosity, Academic Press, 1997 O. Gauthir, J.M. Boiler, E. Aguado, P. Piletand, G. Daculsi], який здійснювали з використанням приладу Carlo-Erba Sorpty 1750 і N2 в якості адсорбуючого газу. Аналізи проводили на зразках масою 300 мг. Перед газовою абсорбцією зразки сушили у вакуумі (2 мбар) при підвищенні температури зі швидкістю нагрівання 10°C/min, від 25°С до 100°С. Після цього здійснювали адсорбцію в N2, утримуючи зразок у рідкому N2. Кожне значення площі поверхні, яке видає прилад, відповідає середньому арифметичному з трьох величин. Середня площа поверхні наночастинок становила приблизно 30 м2/г. 5) Хімічний склад: Аналіз індуктивно-зв'язаної плазми - оптична емісійна спектрометрія (ІЗПОЕС) 23 93994 Кількість кальцію, цинку і фосфору у зразках наночастинок визначали з допомогою методики індуктивно-зв'язаної плазми - оптичної емісійної спектрометрії (ІЗП-ОЕС). Вимірювання ІЗП-ОЕС здійснювали з допомогою приладу Perkin Elmer Optima 4200 DV. Зразки попередньо розчиняли в ультрачистій азотній кислоті 1% з досягненням концентрації елементів від 1 до 8 ч./млн. Наночастинки демонстрували загальне молярне відношення (Са+М)/Р приблизно 1,98 і вміст цинку приблизно 18 мас. % відносно загального вмісту Ca. 6) ІЧ-спектроскопія з перетворенням Фур'є (Фур'є-ІЧС) Інфрачервоний спектр реєстрували від 4000 до 400 см-1 при роздільній здатності 2 см-1 з допомогою спектрометра Bruker IFS 66v/S. Гранули (KBr) отримували у вакуумі шляхом обережного перемішування порошкового зразка (1 мг) з KBr (вміст за ІЧ 200 мг). Фур'є-ІЧС наночастинок представлений на Фіг. 5. Цей спектр показує сигнали, що відносяться до груп PO43- (1037 СМ-1), HPO42- (955 см-1), ОН- (3444 см-1 і 1630 СМ-1), CO32- (870 см-1). Порівняння між площею піку при 870 см-1 наночастинок і площею піку CaCO3 в якості референтного стандарту при 870 см-1 дало змогу оцінити кількість CO32- на рівні приблизно 3 мас. % від загальної маси наночастинок. Смуга при 870 см-1 дає інформацію про тип карбонування апатиту. Профіль деконволюції карбонатного піку при -1 870 см дозволяє зробити висновок, що карбонування у структурі гідроксиапатину переважно відноситься до типу В (відношення А/В приблизно 0,05). Відповідні характеристики наночастинок узагальнені у нижченаведеній Таблиці 1. ПРИКЛАД 3 2124 г біологічно активних наночастинок згідно з винаходом одержували одержанням спочатку 1449,5 г водної суспензії відповідно до методики і з використанням тих самих інгредієнтів, що і в попередньому Прикладі 1, за винятком того, що кількість води становила приблизно 1000 г, кількість ZnO становила 4,5 г, кількість CaCO3 становила 24 22,5 г, кількість Ca(OH)2 становила 422,5 г. Під час цієї стадії одержану суспензію доводили до температури 40°±2°С з допомогою того самого методу, що і в Прикладі 1. Як тільки досягалась бажана температура, наночастинки карбонат-замішеного гідроксиапатиту одержували шляхом додавання по краплях PO43іонів у той самий спосіб і у тій же кількості, що і в Прикладі 1. Після приблизно 30' і 30" отримували суспензію наночастинок, яку після цього обробляли у той самий спосіб, що і в Прикладі 1. Після цього наночастинки відділяли від отриманої таким чином водної суспензії відповідно до методики розділення, описаної у попередньому Прикладі 2. Отримані у такий спосіб наночастинки аналізували відповідно до методик, описаних у Прикладі 2. Відповідні характеристики наночастинок узагальнені у нижченаведеній Таблиці 1. ПРИКЛАД 4 2184 г біологічно активних наночастинок згідно з винаходом одержували одержанням спочатку 1510 г водної суспензії відповідно до методики і з використанням тих самих інгредієнтів, що і в попередньому Прикладі 1, за винятком того, що кількість Ca(OH)2 становила приблизно 405 г, і що до суспензії не додавали такий інгредієнт, як іон металу. Під час цієї стадії одержану суспензію доводили до температури 40°±2°С з допомогою того самого методу, що і в Прикладі 1. Як тільки досягалась бажана температура, наночастинки карбонат-замішеного гідроксиапатиту одержували шляхом додавання по краплях PO43іонів у той самий спосіб і у тій же кількості, що і в Прикладі 1. Після приблизно 30' і 30" отримували суспензію наночастинок, яку після цього обробляли у той самий спосіб, що і в Прикладі 1. Після цього наночастинки відділяли від отриманої таким чином водної суспензії відповідно до методики розділення, описаної у попередньому Прикладі 2. Отримані у такий спосіб наночастинки аналізували відповідно до методик, описаних у Прикладі 2. Відповідні характеристики наночастинок узагальнені у нижченаведеній Таблиці 1. Таблиця 1 Параметр Ступінь кристалізації CD Ступінь кристалізації CD' Довжина L [нм] Ширина W [нм] Аспектне відношення AR Товщина T [нм] Площа поверхні [м2/г] Молярне відношення Вміст металу [мас. %]* Вміст CO32' [мас. %]** Відношення А/В Приклад 2 30 52 100 10 10 5 30 1,98 18 4% 0,05 * = мас. % відносно загального вмісту Ca. ** = мас. % відносно загальної маси наночастинок. *** = у цьому випадку лише Ca був присутній Приклад 3 35 60 150 20 7.5 5 40 1,8 1,5 2% 0,1 Приклад 4 30 60 150 15 10 10 30 1,98*** 0 4% 0,05 25 ПРИКЛАД 5 (Оцінка активності водної суспензії нан очастинок щодо ремінералізації зубів) Для оцінки активності водної суспензії наночастинок щодо ремінералізації зубів так суспензію одержували відповідно до Прикладу 1 І проводили наступний ДОСЛІД. Отримували свіжий зуб корови і з допомогою алмазної пилки вирізали шматок кореневого дентину. Видаляли периодонтальну зв'язку з допомогою сталевої кюретажної ложки, а кореневий цемент видаляли з допомогою алмазного бура при охолодженні водою. Дентин протравлювали ортофосфорною кислотою протягом 1 хвилини для видалення змащеного шару та оголення дентинових канальців. Кислоту вимивали з допомогою водорозприскувача протягом 1 хвилини, і зразки залишали вологими. Після цього аліквоту суспензії наночастинок відповідно до попереднього Прикладу 1 наносили на шматки дентину з допомогою щітки. Такі шматки залишали вологими в інкубаторі при 37°C приблизно на 1 хвилину, після чого зразки промивали водою з пульверизатора протягом 1 хвилини і готували до скандувальної електронної мікроскопії (СЕМ). На Фіг. 6а, 6b і 6с представлені ознаки дентину по базовій лінії (Фіг. 6а - де мінералізований стан) і ремінералізованих зразків після нанесення наночастинок протягом 1 хвилини (Фіг. 6b) і протягом 10 хвилин (Фіг. 6с). На Фіг. 6b показане помітне утворення криста 93994 26 лів і наступна облітерація відкритих дентинових канальців навіть при контакті протягом обмеженого проміжку часу (1 хвилина) між дентином і суспензією наночастинок. На Фіг. 6с представлене посилене відкладення наночастинок на дентиновому субстраті як функція часу контактування. ПРИКЛАД 6 (Зубна паста) Зубну пасту, яка містить біологічно активні наночастинки згідно з винаходом одержували відповідно до нижчеописаного методу і з використанням наступних інгредієнтів. На першій стадії одержували водну суспензію, що містить біологічно активні наночастинки (загальний вміст твердої речовини: 30 мас. %) у той самий спосіб і з використанням тих самих інгредієнтів, що і в Прикладі 1. Таким чином отриману водну суспензію після цього перемішували з іншими інгредієнтами зубної пасти як показано у нижченаведеній таблиці, за винятком поверхнево-активних речовин. Перемішування здійснювали у традиційному міксері, який підтримували в умовах придатного ступеня вакууму, визначеного на основі стандартних величин, які відомі фахівцям у цій галузі техніки. Як тільки отримували гомогенну суміш, у міксер додавали поверхнево-активну речовину, підтримуючи заданий ступінь вакууму, визначений на основі стандартних величин, які відомі фахівцям у цій галузі техніки. Таким чином, отримували зубну пасту, яка має склад, вказаний у нижченаведеній Таблиці 2. Таблиця 2 Інгредієнт Натрій карбоксиметилцелюлоза HA-Zn наночастинки* НА наночастинки** Сорбітовий сироп Гліцерин Натрій сахарин Гідрогліколевий екстракт моху, титрований у 2% уснієвій кислоті Кремнієвий загущувач Кремнієвий абразивний засіб Тетракалій пірофосфат Діоксид титану Лаурилсульфат натрію М'ятний ароматизатор Лимонна кислота Вода Кількість [%] 1,0 7,5 7,5 15,0 15,0 0,25 0,5 1,0 18,0 3,0 0,9 0,5 1,3 0,25 баланс * = Біологічно активні наночастинки карбонат-замішеного гідроксиапатиту, що містять іони Zn, одержані відповідно до Прикладу 1. ** = Біологічно активні наночастинки карбонат-замішеного гідроксиапатиту, одержані відповідно до методики Прикладу 1, за винятком того, що іони Zn не застосовувались. ПРИКЛАД 7 (Засіб для полоскання рота) Засіб для полоскання рота, що містить біологічно активні наночастинки згідно з винаходом, одержували змішуванням суспензії, одержаної відпо відно до вищенаведеного Прикладу 1, традиційним способом із використанням традиційних інгредієнтів. Отримували засіб для полоскання рота, який має склад, вказаний у Таблиці 3. 27 93994 28 Таблиця 3 Інгредієнт HA-Zn наночастинки* НА наночастинки** Сорбітовий сироп Гліцерин Сахарин натрію Гідрогліколевий екстракт моху, титрований в 2% уснієвій кислоті Тетракалій пірофосфат Лаурилсульфат натрію М'ятний ароматизатор Лимонна кислота Вода Кількість [%] 2,5 2,5 3 3 0,25 0,5 1 0,2 0,5 0,1 баланс * = Біологічно активні наночастинки карбонат-замішеного гідроксиапатиту, що містять іони Zn, одержані відповідно до Прикладу 1. ** = Біологічно активні наночастинки карбонат-замішеного гідроксиапатиту, одержані відповідно до методики Прикладу 1, за винятком того, що іони Zn не застосовувались. ПРИКЛАД 8 (Жувальна гумка для чищення зубів) Жувальну гумку, яка містить біологічно активні наночастинки згідно з винаходом, одержували змішуванням твердих висушених наночастинок, одержаних відповідно до методики Прикладу 2, традиційним способом із використанням традиційних інгредієнтів. Отримували жувальну гумку, яка має склад, вказаний у Таблиці 4. Таблиця 4 Інгредієнт Основа для жувальної гумки HA-Zn наночастинки* НА наночастинки** Гліцерин Сахарин натрію Гідрогліколевий екстракт моху, титрований в 2% уснієвій кислоті М'ятний ароматизатор Кількість [%] 91,65 2 2 3 0,025 0,1 1 * = Біологічно активні наночастинки карбонат-замішеного гідроксиапатиту, що містять іони Zn, одержані відповідно до Прикладу 1. ** = Біологічно активні наночастинки карбонат-замішеного гідроксиапатиту, одержані відповідно до методики Прикладу 1, за винятком того, що іони Zn не застосовувались. 29 93994 30 31 93994 32 33 93994 34 35 93994 36 37 Комп’ютерна верстка А. Крулевський 93994 Підписне 38 Тираж 23 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюBiologically active nanoparticles of a carbonate-substituted hydroxyapatite, process for their preparation and compositions incorporating the same
Автори англійськоюGAZZANIGA GIANCARLO, ROVERI NORBERTO, RIMONDINI LIA, PALAZZO BARBARA, IAFISCO MICHELE, GUALANDI PAOLO
Назва патенту російськоюБиологически активные наночастицы карбонат-замещенного гидроксиапатита, способ их получения и композиции, содержащие их
Автори російськоюГаццанига Джанкарло, Ровери Норберто, Римондини Лиа, Палаццо Барбара, Яфиско Микеле, Гуаланди Паоло
МПК / Мітки
МПК: A61Q 11/00, A61K 8/24, C01B 25/32
Мітки: наночастинки, гідроксіапатиту, біологічно, містять, спосіб, активні, одержання, карбонат-заміщеного, композиції
Код посилання
<a href="https://ua.patents.su/19-93994-biologichno-aktivni-nanochastinki-karbonat-zamishhenogo-gidroksiapatitu-sposib-kh-oderzhannya-i-kompozici-shho-kh-mistyat.html" target="_blank" rel="follow" title="База патентів України">Біологічно активні наночастинки карбонат-заміщеного гідроксіапатиту, спосіб їх одержання і композиції, що їх містять</a>
Попередній патент: Спосіб та пристрій для регульованої подачі повітря
Наступний патент: Фармацевтична композиція для лікування опіків (варіанти) та спосіб її отримання
Випадковий патент: Неінвазійна приставка-глюкометр до мобільного телефону