Антитіло, що зв’зується з cd22, імунокон’югат та їх застосування
Номер патенту: 95958
Опубліковано: 26.09.2011
Автори: Лян Вей-Чін, Грей Алан М., У Янь, Юй Шан-Фань, Ебенс Аллен Дж., мол.
Формула / Реферат
1. Антитіло, що зв'язується з CD22, яке містить (a) HVR-L1, що містить амінокислотну послідовність, вибрану з SEQ ID NО:9, 10, 19-23, 32 і 33, і (b) щонайменше одну, дві, три, чотири або п'ять HVR, вибраних з
(1) HVR-H1, що містить амінокислотну послідовність SEQ ID NО:2;
(2) HVR-H2, що містить амінокислотну послідовність SEQ ID NО:4;
(3) HVR-H3, що містить амінокислотну послідовність SEQ ID NО:6;
(4) HVR-L2, що містить амінокислотну послідовність SEQ ID NО:12; і
(5) HVR-L3, що містить амінокислотну послідовність SEQ ID NО:14.
2. Антитіло за п. 1, яке містить HVR-L1, що містить амінокислотну послідовність, яка відповідає консенсусній послідовності SEQ ID NО:10.
3. Антитіло за п. 2, яке додатково містить HVR-H1, що містить амінокислотну послідовність SEQ ID NО:2; HVR-H2, що містить амінокислотну послідовність SEQ ID NО:4; і HVR-H3, що містить амінокислотну послідовність SEQ ID NО:6.
4. Антитіло за п. 1, де HVR-L1 містить SEQ ID NО:9, і антитіло додатково містить HVR-H1, що містить амінокислотну послідовність SEQ ID NО:2; HVR-H2, що містить амінокислотну послідовність SEQ ID NО:4; і HVR-H3, що містить амінокислотну послідовність SEQ ID NО:6.
5. Антитіло за п. 1, де HVR-L1 містить SEQ ID NО:19, і антитіло додатково містить HVR-H1, що містить амінокислотну послідовність SEQ ID NО:2; HVR-H2, що містить амінокислотну послідовність SEQ ID NО:4; і HVR-H3, що містить амінокислотну послідовність SEQ ID NО:6.
6. Антитіло за п. 1, де HVR-L1 містить SEQ ID NО:20, і антитіло додатково містить HVR-H1, що містить амінокислотну послідовність SEQ ID NО:2; HVR-H2, що містить амінокислотну послідовність SEQ ID NО:4; і HVR-H3, що містить амінокислотну послідовність SEQ ID NО:6.
7. Антитіло за п. 1, де HVR-L1 містить SEQ ID NО:21, і антитіло додатково містить HVR-H1, що містить амінокислотну послідовність SEQ ID NО:2; HVR-H2, що містить амінокислотну послідовність SEQ ID NО:4; і HVR-H3, що містить амінокислотну послідовність SEQ ID NО:6.
8. Антитіло за п. 1, де HVR-L1 містить SEQ ID NО:22, і антитіло додатково містить HVR-H1, що містить амінокислотну послідовність SEQ ID NО:2; HVR-H2, що містить амінокислотну послідовність SEQ ID NО:4; і HVR-H3, що містить амінокислотну послідовність SEQ ID NO:6.
9. Антитіло за п. 1, де HVR-L1 містить SEQ ID NО:23, і антитіло додатково містить HVR-H1, що містить амінокислотну послідовність SEQ ID NО:2; HVR-H2, що містить амінокислотну послідовність SEQ ID NО:4; і HVR-H3, що містить амінокислотну послідовність SEQ ID NО:6.
10. Антитіло за п. 1, де HVR-L1 містить SEQ ID NО:32, і антитіло додатково містить HVR-H1, що містить амінокислотну послідовність SEQ ID NО:2; HVR-H2, що містить амінокислотну послідовність SEQ ID NО:4; і HVR-H3, що містить амінокислотну послідовність SEQ ID NО:6.
11. Антитіло за п. 1, де HVR-L1 містить SEQ ID NО:33, і антитіло додатково містить HVR-H1, що містить амінокислотну послідовність SEQ ID NО:2; HVR-H2, що містить амінокислотну послідовність SEQ ID NО:4; і HVR-H3, що містить амінокислотну послідовність SEQ ID NО:6.
12. Антитіло за п. 1, яке додатково містить щонайменше один каркас, вибраний з консенсусного каркаса підгрупи III VH і консенсусного каркаса підгрупи І VL.
13. Антитіло за п. 1, яке додатково містить варіабельний домен важкого ланцюга щонайменше з 90 % ідентичності послідовності з амінокислотною послідовністю, вибраною з SEQ ID NО:16.
14. Антитіло за п. 1, яке містить варіабельний домен легкого ланцюга щонайменше з 90 % ідентичності послідовності з амінокислотною послідовністю, вибраною з SEQ ID NО:17.
15. Антитіло за п. 1, яке містить варіабельний домен легкого ланцюга щонайменше з 90 % ідентичності послідовності з амінокислотною послідовністю, вибраною з SEQ ID NО:18.
16. Антитіло за п. 1, яке містить варіабельний домен важкого ланцюга, що містить одну, дві, три або чотири каркасні амінокислотні послідовності, вибрані з SEQ ID NО:1, 3, 5 і 7.
17. Антитіло за п. 1, яке містить варіабельний домен легкого ланцюга, що містить одну, дві, три або чотири каркасні амінокислотні послідовності, вибрані з SEQ ID NО:8, 11, 13 і 15.
18. Антитіло за п. 13, яке додатково містить варіабельний домен легкого ланцюга, який щонайменше на 90 % ідентичний послідовності з амінокислотною послідовністю, вибраною з SEQ ID NО:17.
19. Антитіло за п. 13, яке додатково містить варіабельний домен легкого ланцюга, який щонайменше на 90 % ідентичний послідовності з амінокислотною послідовністю, вибраною з SEQ ID NО:18.
20. Антитіло за п. 1, що містить важкий ланцюг, який щонайменше на 90 % ідентичний послідовності з амінокислотною послідовністю, вибраною з SEQ ID NО:88.
21. Антитіло за п. 1, що містить легкий ланцюг, який щонайменше на 90 % ідентичний послідовності з амінокислотною послідовністю, вибраною з SEQ ID NО:87.
22. Антитіло за п. 1, що містить важкий ланцюг з амінокислотною послідовністю SEQ ID NО:88 і легкий ланцюг з амінокислотною послідовністю SEQ ID NО:87.
23. Антитіло, яке зв'язується з CD22, що містить варіабельний домен важкого ланцюга, який щонайменше на 90 % ідентичний послідовності з амінокислотною послідовністю SEQ ID NО:16.
24. Антитіло за п. 23, що додатково містить варіабельний домен легкого ланцюга, який щонайменше на 90 % ідентичний послідовності з амінокислотною послідовністю SEQ ID NО:17.
25. Антитіло за п. 23, що додатково містить варіабельний домен легкого ланцюга, який щонайменше на 90 % ідентичний послідовності з амінокислотною послідовністю SEQ ID NО:18.
26. Антитіло за п. 1, що містить одну, дві, три, чотири, п'ять або шість з HVR з антитіла, яке одержують за допомогою гібридоми з АТСС з інвентарним номером РТА-7621 (10F4.4.1).
27. Антитіло, що містить одну, дві, три, чотири, п'ять або шість з HVR з антитіла, яке одержують за допомогою гібридоми ATGC з інвентарним номером РТА-7620 (5Е8.1.8).
28. Антитіло за п. 1, яке є гуманізованим.
29. Антитіло за п. 23, яке є гуманізованим.
30. Антитіло за п. 1, де CD22 являє собою CD22 ссавця.
31. Антитіло за п. 30, де CD22 вибраний з CD22 гризунів і CD22 приматів.
32. Антитіло за п. 31, де CD22 являє собою CD22 людини.
33. Антитіло за п. 23, де CD22 являє собою CD22 ссавця.
34. Антитіло за п. 33, де CD22 вибраний з CD22 гризунів і CD22 приматів.
35. Антитіло за п. 34, де CD22 являє собою CD22 людини.
36. Полінуклеотид, який кодує антитіло за п. 1.
37. Полінуклеотид, який кодує антитіло за п. 23.
38. Вектор, що містить полінуклеотид за п. 36.
39. Вектор, що містить полінуклеотид за п. 37.
40. Клітина-хазяїн, що містить вектор за п. 38.
41. Клітина-хазяїн, що містить вектор за п. 39.
42. Клітина-хазяїн за п. 40, що є еукаріотичною.
43. Клітина-хазяїн за п. 42, що є клітиною СНО.
44. Клітина-хазяїн за п. 41, що є еукаріотичною.
45. Клітина-хазяїн за п. 44, що є клітиною СНО.
46. Спосіб одержання антитіла до CD22, що включає а) культивування клітини-хазяїна за п. 38 в умовах, придатних для експресії полінуклеотиду, що кодує антитіло, і b) виділення антитіла.
47. Спосіб одержання антитіла до CD22, що включає а) культивування клітини-хазяїна за п. 39 в умовах, придатних для експресії полінуклеотиду, що кодує антитіло, і b) виділення антитіла.
48. Антитіло за п. 28, де CD22 експресується на поверхні клітини.
49. Антитіло за п. 48, де клітина являє собою В-клітину.
50. Антитіло за п. 29, де CD22 експресується на поверхні клітини.
51. Антитіло за п. 50, де CD22 являє собою В-клітину.
52. Антитіло за п. 1, що зв'язується з епітопом в області CD22 від амінокислоти 22 до амінокислоти 240 SEQ ID NО:27.
53. Антитіло за п. 23, що зв'язується з епітопом в області CD22 від амінокислоти 22 до амінокислоти 240 SEQ ID NО:27.
54. Антитіло за п. 49, де В-клітина асоційована з В-клітинним проліферативним порушенням.
55. Антитіло за п. 54, де В-клітинне проліферативне порушення являє собою злоякісну пухлину.
56. Антитіло за п. 54, де В-клітинне проліферативне порушення вибране з лімфоми, неходжкінської лімфоми (NHL), агресивної NHL, рецидивуючої агресивної NHL, рецидивуючої повільно зростаючої NHL, рефракторної NHL, рефракторної повільно зростаючої NHL, хронічного лімфолейкозу (CLL), дрібноклітинної лімфоми, лейкозу, волосатоклітинного лейкозу (HCL), гострого лімфоцитарного лейкозу (ALL) і лімфоми мантійних клітин.
57. Антитіло за п. 51, де В-клітина асоційована з В-клітинним проліферативним порушенням.
58. Антитіло за п. 57, де В-клітинне проліферативне порушення являє собою злоякісну пухлину.
59. Антитіло за п. 57, де В-клітинне проліферативне порушення вибране з лімфоми, неходжкінської лімфоми (NHL), агресивної NHL, рецидивуючої агресивної NHL, рецидивуючої повільно зростаючої NHL, рефракторної NHL, рефракторної повільно зростаючої NHL, хронічного лімфолейкозу (CLL), дрібноклітинної лімфоми, лейкозу, волосатоклітинного лейкозу (HCL), гострого лімфоцитарного лейкозу (ALL) і лімфоми мантійних клітин. Антитіло за будь-яким з пп. 1-14, 16-23 або 30-33, що являє собою моноклональне антитіло.
60. Антитіло за п. 1, що являє собою моноклональне антитіло.
61. Антитіло за п. 60, що являє собою фрагмент антитіла, вибраний з фрагментів Fab, Fab'-SH, Fv, scFv або (Fab')2.
62. Антитіло за п. 60, що є гуманізованим.
63. Антитіло за п. 60, що являє собою антитіло людини.
64. Антитіло за п. 23, що являє собою моноклональне антитіло.
65. Антитіло за п. 64, що являє собою фрагмент антитіла, вибраний з фрагментів Fab, Fab'-SH, Fv, scFv або (Fab')2.
66. Антитіло за п. 64, що є гуманізованим.
67. Антитіло за п. 64, що являє собою антитіло людини.
68. Антитіло за п. 1, що зв'язується з тим же епітопом, що і антитіло, вибране з АТСС РТА-7621 (10F4.4.1); АТСС РТА-7620 (5Е8.1.8); і антитіло, що містить послідовність важкого ланцюга SEQ ID NО:88 і послідовність легкого ланцюга SEQ ID NО:87.
69. Антитіло за п. 23, що зв'язується з тим же епітопом, що і антитіло, вибране з АТСС РТА-7621 (10F4.4.1); АТСС РТА-7620 (5Е8.1.8); і антитіло, що містить послідовність важкого ланцюга SEQ ID NО:88 і послідовність легкого ланцюга SEQ ID NО:87.
70. Спосіб визначення присутності CD22 у біологічному зразку, де спосіб включає приведення біологічного зразка у контакт з антитілом за п. 1 в умовах, які допускають зв'язування антитіла з CD22, і визначення того, чи формується комплекс між антитілом і CD22.
71. Спосіб за п. 70, де біологічний зразок взятий від пацієнта, у якого підозрюють наявність В-клітинного проліферативного порушення.
72. Спосіб за п. 71, де В-клітинне проліферативне порушення вибране з лімфоми, неходжкінської лімфоми (NHL), агресивної NHL, рецидивуючої агресивної NHL, рецидивуючої повільно зростаючої NHL, рефракторної NHL, рефракторної повільно зростаючої NHL, хронічного лімфолейкозу (CLL), дрібноклітинної лімфоми, лейкозу, волосатоклітинного лейкозу (HCL), гострого лімфоцитарного лейкозу (ALL) і лімфоми мантійних клітин.
73. Спосіб визначення присутності CD22 у біологічному зразку, де спосіб включає приведення біологічного зразка у контакт з антитілом за п. 23 в умовах, які допускають зв'язування антитіла з CD22, і визначення того, чи формується комплекс між антитілом і CD22.
74. Спосіб за п. 73, де біологічний зразок взятий від пацієнта, у якого підозрюють наявність В-клітинного проліферативного порушення.
75. Спосіб за п. 74, де В-клітинне проліферативне порушення вибране з лімфоми, неходжкінської лімфоми (NHL), агресивної NHL, рецидивуючої агресивної NHL, рецидивуючої повільно зростаючої NHL, рефракторної NHL, рефракторної повільно зростаючої NHL, хронічного лімфолейкозу (CLL), дрібноклітинної лімфоми, лейкозу, волосатоклітинного лейкозу (HCL), гострого лімфоцитарного лейкозу (ALL) і лімфоми мантійних клітин.
76. Імунокон'югат, що містить антитіло за п. 1, ковалентно зв'язане з цитотоксичним засобом.
77. Імунокон'югат, що містить антитіло за п. 23, ковалентно зв'язане з цитотоксичним засобом.
78. Імунокон'югат за п. 76, де цитотоксичний засіб вибраний з токсину, хіміотерапевтичного засобу, молекули лікарського засобу, антибіотика, радіоактивного ізотопу і нуклеази.
79. Імунокон'югат за п. 78, де імунокон'югат має формулу Ab-(L-D)p, де
(a) Аb являє собою антитіло за п. 1;
(b) L являє собою лінкер;
(c) D являє собою молекулу лікарського засобу.
80. Імунокон'югат за п. 79, де L вибраний з 6-малеімідокапроїлу (МС), малеімідопропаноїлу (МР), валіну-цитруліну (val-cit), аланіну-фенілаланіну (аlа-phe), п-амінобензилоксикарбонілу (РАВ), N-сукцинімідил-4-(2-піридилтіо)пентаноату (SPP), N-сукцинімідил-4-(N-малеімідометил)циклогексан-1-карбоксилату (SMCC) і N-сукцинімідил-(4-йодацетил)амінобензоату (SIAB).
81. Імунокон'югат за п. 79, де D вибраний з ауристатину і доластатину.
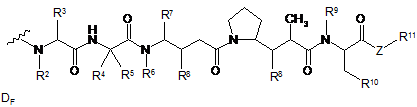
82. Імунокон'югат за п. 81, де D являє собою молекулу лікарського засобу формули DE або DF:
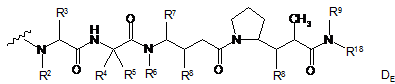 ,
,
 ,
,
і де кожний R2 і R6 являє собою метил, кожний R3 і R4 являє собою ізопропіл, R7 являє собою втор-бутил, кожний R8 незалежно вибраний з СН3, О-СН3, ОН і Н; R9 являє собою Н; R10 являє собою арил; Z являє собою -О- або -NH-; R11 являє собою Н, С1-С8-алкіл або -(СН2)2-О-(СН2)2-О-(СН2)2-О-СН3; і R18 являє собою -C(R8)2-C(R8)2-арил; і (d) р знаходиться у діапазоні приблизно від 1 до 8.
83. Імунокон'югат за п. 76 з дією, що знищує клітину, in vitro або in vivo.
84. Імунокон'югат за п. 79, де лінкер зв'язаний з антитілом через тіольну групу на антитілі.
85. Імунокон'югат за п. 79, де лінкер є розщеплюваним протеазою.
86. Імунокон'югат за п. 80, де лінкер містить дипептид val-cit.
87. Імунокон'югат за п. 79, де лінкер містить п-амінобензильну одиницю.
88. Імунокон'югат за п. 80, де лінкер містить 6-малеімідокапроїл.
89. Імунокон'югат за п. 82, де лікарський засіб вибраний з ММАЕ і MMAF.
90. Імунокон'югат за п. 89, де лікарський засіб являє собою ММАЕ.
91. Імунокон'югат за п. 89, де лікарський засіб являє собою MMAF.
92. Імунокон'югат за п. 77, де цитотоксичний засіб вибраний з токсину, хіміотерапевтичного засобу, молекули лікарського засобу, антибіотика, радіоактивного ізотопу і нуклеази.
93. Імунокон'югат за п. 92, де імунокон'югат має формулу Ab-(L-D)p, де
(a) Аb являє собою антитіло за п. 23;
(b) L являє собою лінкер;
(c) D являє собою молекулу лікарського засобу.
94. Імунокон'югат за п. 93, де L вибраний з 6-малеімідокапроїлу (МС), малеімідопропаноїлу (МР), валіну-цитруліну (val-cit), аланіну-фенілаланіну (аlа-phe), п-амінобензилоксикарбонілу (РАВ), N-сукцинімідил-4-(2-піридилтіо)пентаноату (SPP), N-сукцинімідил-4-(N-малеімідометил)циклогексан-1-карбоксилату (SMCC) і N-сукцинімідил-(4-йодацетил)амінобензоату (SIAB).
95. Імунокон'югат за п. 93, де лінкер L є розщеплюваним протеазою.
96. Імунокон'югат за п. 94, де L містить дипептид val-cit.
97. Імунокон'югат за п. 93, де L містить п-амінобензильну одиницю.
98. Імунокон'югат за п. 97, де п-амінобензильна одиниця являє собою п-амінобензилоксикарбоніл (РАВ).
99. Імунокон'югат за п. 94, де L містить 6-малеімідокапроїл (МС).
100. Імунокон'югат за п. 94, де лінкер містить 6-малеімідокапроїл і п-амінобензилоксикарбоніл.
101. Імунокон'югат за п. 79, де імунокон'югат має формулу
Ab-(L-MMAE)p,
де L являє собою лінкер, а р знаходиться у діапазоні від 2 до 5.
102. Імунокон'югат за п. 101, де L містить val-cit.
103. Імунокон'югат за п. 101, де L містить МС.
104. Імунокон'югат за п. 101, де L містить РАВ.
105. Імунокон'югат за п. 101, де L містить МС-РАВ.
106. Імунокон'югат за п. 93, де імунокон'югат має формулу
Ab-(L-MMAE)p,
де L являє собою лінкер і р знаходиться у діапазоні від 2 до 5.
107. Імунокон'югат за п. 106, де L містить val-cit.
108. Імунокон'югат за п. 106, де L містить МС.
109. Імунокон'югат за п. 106, де L містить РАВ.
110. Імунокон'югат за п. 106, де L містить МС-РАВ.
111. Імунокон'югат за п. 79, де імунокон'югат має формулу
Ab-(L-MMAF)p,
де L являє собою лінкер, а р знаходиться у діапазоні від 2 до 5.
112. Імунокон'югат за п. 111, де L містить val-cit.
113. Імунокон'югат за п. 111, де L містить МС.
114. Імунокон'югат за п. 111, де L містить РАВ.
115. Імунокон'югат за п. 111, де L містить МС-РАВ.
116. Імунокон'югат за п. 93, де імунокон'югат має формулу
Ab-(L-MMAF)p,
де L являє собою лінкер, а р знаходиться у діапазоні від 2 до 5.
117. Імунокон'югат за п. 116, де L містить val-cit.
118. Імунокон'югат за п. 116, де L містить МС.
119. Імунокон'югат за п. 116, де L містить РАВ.
120. Імунокон'югат за п. 116, де L містить МС-РАВ.
121. Імунокон'югат за п. 79, де D являє собою майтанзиноїд.
122. Імунокон'югат за п. 121, де D вибраний з DM1, DM3 і DM4.
123. Імунокон'югат за п. 121 з дією, що знищує клітину, in vitro або in vivo.
124. Імунокон'югат за п. 121, де лінкер зв'язаний з антитілом через тіольну групу на антитілі.
125. Імунокон'югат за п. 121, де лінкер L вибраний з N-сукцинімідил-4-(2-піридилтіо)пентаноату (SPP), N-сукцинімідил-4-(N-малеімідометил)циклогексан-1-карбоксилату (SMCC) і N-сукцинімідил-(4-йодацетил)амінобензоату (SIAB).
126. Імунокон'югат за п. 122, де лікарський засіб являє собою DM1.
127. Імунокон'югат за п. 122, де L містить SPP.
128. Імунокон'югат за п. 122, де L містить SMCC.
129. Імунокон'югат за п. 122, де р складає від 2 до 4.
130. Імунокон'югат за п. 122, де р складає від 3 до 4.
131. Імунокон'югат за п. 93, де D являє собою майтанзиноїд.
132. Імунокон'югат за п. 131, де D вибраний з DM1, DM3 і DM4.
133. Імунокон'югат за п. 131 з дією, що знищує клітину, in vitro або in vivo.
134. Імунокон'югат за п. 131, де лінкер зв'язаний з антитілом через тіольну групу на антитілі.
135. Імунокон'югат за п. 131, де лінкер L вибраний з N-сукцинімідил-4-(2-піридилтіо)пентаноату (SPP), N-сукцинімідил-4-(N-малеімідометил)циклогексан-1-карбоксилату (SMCC) і N-сукцинімідил-(4-йодацетил)амінобензоату (SIAB).
136. Імунокон'югат за п. 132, де лікарський засіб являє собою DM1.
137. Імунокон'югат за п. 136, де L містить SPP.
138. Імунокон'югат за п. 136, де L містить SMCC.
139. Імунокон'югат за п. 136, де р складає від 2 до 4.
140. Імунокон'югат за п. 136, де р складає від 3 до 4.
141. Фармацевтична композиція, що містить імунокон'югат за п. 79 і фармацевтично прийнятний носій.
142. Спосіб лікування В-клітинного проліферативного порушення, що включає введення індивідууму ефективної кількості фармацевтичної композиції за п. 141.
143. Спосіб за п. 142, де В-клітинне проліферативне порушення вибране з лімфоми, неходжкінської лімфоми (NHL), агресивної NHL, рецидивуючої агресивної NHL, рецидивуючої повільно зростаючої NHL, рефракторної NHL, рефракторної повільно зростаючої NHL, хронічного лімфолейкозу (CLL), дрібноклітинної лімфоми, лейкозу, волосатоклітинного лейкозу (HCL), гострого лімфоцитарного лейкозу (ALL) і лімфоми мантійних клітин.
144. Фармацевтична композиція, що містить імунокон'югат за п. 93 і фармацевтично прийнятний носій.
145. Спосіб лікування В-клітинного проліферативного порушення, що включає введення індивідууму ефективної кількості фармацевтичної композиції за п. 144.
146. Спосіб за п. 145, де В-клітинне проліферативне порушення вибране з лімфоми, неходжкінської лімфоми (NHL), агресивної NHL, рецидивуючої агресивної NHL, рецидивуючої повільно зростаючої NHL, рефракторної NHL, рефракторної повільно зростаючої NHL, хронічного лімфолейкозу (CLL), дрібноклітинної лімфоми, лейкозу, волосатоклітинного лейкозу (HCL), гострого лімфоцитарного лейкозу (ALL) і лімфоми мантійних клітин.
147. Фармацевтична композиція, що містить імунокон'югат за п. 76, 77, 78 або 92 і фармацевтично прийнятний носій.
148. Спосіб лікування В-клітинного проліферативного порушення, що включає введення індивідууму ефективної кількості фармацевтичної композиції за п. 147.
149. Спосіб за п. 148, де В-клітинне проліферативне порушення вибране з лімфоми, неходжкінської лімфоми (NHL), агресивної NHL, рецидивуючої агресивної NHL, рецидивуючої повільно зростаючої NHL, рефракторної NHL, рефракторної повільно зростаючої NHL, хронічного лімфолейкозу (CLL), дрібноклітинної лімфоми, лейкозу, волосатоклітинного лейкозу (HCL), гострого лімфоцитарного лейкозу (ALL) і лімфоми мантійних клітин.
150. Спосіб інгібування В-клітинної проліферації, що включає вплив на клітини імунокон'югата за п. 79 в умовах, що дозволяють зв'язування імунокон'югата з CD22.
151. Спосіб за п. 150, де В-клітинна проліферація асоційована з порушенням, вибраним з лімфоми, неходжкінської лімфоми (NHL), агресивної NHL, рецидивуючої агресивної NHL, рецидивуючої повільно зростаючої NHL, рефракторної NHL, рефракторної повільно зростаючої NHL, хронічного лімфолейкозу (CLL), дрібноклітинної лімфоми, лейкозу, волосатоклітинного лейкозу (HCL), гострого лімфоцитарного лейкозу (ALL) і лімфоми мантійних клітин.
152. Спосіб за п. 150, де В-клітина являє собою ксенотрансплантат.
153. Спосіб за п. 150, де вплив відбувається in vitro.
154. Спосіб за п. 150, де вплив відбувається in vivo.
155. Антитіло за п. 1, що являє собою модифіковане цистеїном антитіло, яке містить одну або декілька амінокислот вільного цистеїну зі значенням тіолової реакційноздатності у діапазоні від 0,6 до 1,0, де модифіковане цистеїном антитіло одержують способом, що включає заміну одного або декількох амінокислотних залишків вихідного антитіла цистеїном.
156. Модифіковане цистеїном антитіло за п. 155, що є більш реакційноздатним з реагентом, що реагує з тіолами, ніж вихідне антитіло.
157. Модифіковане цистеїном антитіло за п. 155, де спосіб додатково містить визначення реакційноздатності тіолових груп модифікованого цистеїном антитіла за допомогою проведення реакції модифікованого цистеїном антитіла з реагентом, що реагує з тіолами;
де модифіковане цистеїном антитіло є більш реакційноздатним з реагентом, що реагує з тіолами, ніж вихідне антитіло.
158. Модифіковане цистеїном антитіло за п. 155, де один або декілька амінокислотних залишків вільного цистеїну розташовані у легкому ланцюгу.
159. Модифіковане цистеїном антитіло за п. 155, де антитіло являє собою імунокон'югат, що містить модифіковане цистеїном антитіло, ковалентно зв'язане з цитотоксичним засобом.
160. Модифіковане цистеїном антитіло за п. 159, де цитотоксичний засіб вибраний з токсину, хіміотерапевтичного засобу, молекули лікарського засобу, антибіотика, радіоактивного ізотопу і нуклеази.
161. Модифіковане цистеїном антитіло за п. 155, де антитіло ковалентно зв'язане із захоплюючою міткою, детекційною міткою або твердою основою.
162. Модифіковане цистеїном антитіло за п. 161, де антитіло ковалентно зв'язане із захоплюючою міткою біотином.
163. Модифіковане цистеїном антитіло за п. 161, де антитіло ковалентно зв'язане з детекційною міткою флуоресцентним барвником.
164. Модифіковане цистеїном антитіло за п. 163, де флуоресцентний барвник вибраний з флуоресцеїнового типу, родамінового типу, дансилу, лісаміну, ціаніну, фікоеритрину, техаського червоного і їх аналогів.
165. Модифіковане цистеїном антитіло за п. 161, де антитіло ковалентно зв'язане з радіонуклідною детекційною міткою, вибраною з 3Н, 11С, 14С, 18F, 32P, 35S, 64Cu, 68Ga, 86Y, 99Тс, 111Іn, 123I,124I,125І, 131І, 133Хе, 177Lu, 211At і 213Вi.
166. Модифіковане цистеїном антитіло за п. 161, де антитіло ковалентно зв'язане з детекційною міткою хелатуючим лігандом.
167. Модифіковане цистеїном антитіло за п. 166, де хелатуючий ліганд вибраний з DOTA, DOTP, DOTMA, DTPA і ТЕТА.
168. Антитіло за п. 23, де антитіло являє собою модифіковане цистеїном антитіло, що містить одну або декілька амінокислот вільного цистеїну зі значенням тіолової реакційноздатності у діапазоні від 0,6 до 1,0, де модифіковане цистеїном антитіло одержують способом, що включає заміну одного або декількох амінокислотних залишків вихідного антитіла цистеїном.
169. Модифіковане цистеїном антитіло за п. 168, де модифіковане цистеїном антитіло є більш реакційноздатним з реагентом, що реагує з тіолами, ніж вихідне антитіло.
170. Модифіковане цистеїном антитіло за п. 168, де спосіб додатково містить визначення реакційноздатності тіолових груп модифікованого цистеїном антитіла за допомогою проведення реакції модифікованого цистеїном антитіла з реагентом, що реагує з тіолами;
де модифіковане цистеїном антитіло є більш реакційноздатним з реагентом, що реагує з тіолами, ніж вихідне антитіло.
171. Модифіковане цистеїном антитіло за п. 168, де один або декілька амінокислотних залишків вільного цистеїну розташовані у легкому ланцюгу.
172. Модифіковане цистеїном антитіло за п. 168, де антитіло являє собою імунокон'югат, що містить модифіковане цистеїном антитіло, ковалентно зв'язане з цитотоксичним засобом.
173. Модифіковане цистеїном антитіло за п. 172, де цитотоксичний засіб вибраний з токсину, хіміотерапевтичного засобу, молекули лікарського засобу, антибіотика, радіоактивного ізотопу і нуклеази.
174. Модифіковане цистеїном антитіло за п. 168, де антитіло ковалентно зв'язане із захоплюючою міткою, детекційною міткою або твердою основою.
175. Модифіковане цистеїном антитіло за п. 174, де антитіло ковалентно зв'язане із захоплюючою міткою біотином.
176. Модифіковане цистеїном антитіло за п. 174, де антитіло ковалентно зв'язане з детекційною міткою флуоресцентним барвником.
177. Модифіковане цистеїном антитіло за п. 176, де флуоресцентний барвник вибраний з флуоресцеїнового типу, родамінового типу, дансилу, лісаміну, ціаніну, фікоеритрину, техаського червоного і їх аналогів.
178. Модифіковане цистеїном антитіло за п. 174, де антитіло ковалентно зв'язане з радіонуклідною детекційною міткою, вибраною з 3Н, 11С, 14С, 18F, 32Р, 35S, 64Cu, 68Ga, 86Y, 99Тс, 111In, 123І, 124І, 125І, 131І, 133Хе, 177Lu, 211At і 213Bi.
179. Модифіковане цистеїном антитіло за п. 178, де антитіло ковалентно зв'язане з детекційною міткою хелатуючим лігандом.
180. Модифіковане цистеїном антитіло за п. 179, де хелатуючий ліганд вибраний з DOTA, DOTP, DOTMA, DTPA і ТЕТА.
181. Імунокон'югат за п. 93, де лінкер зв'язаний з антитілом через тіольну групу на антитілі.
182. Антитіло за п. 1, що містить альбумінзв'язувальний пептид.
183. Антитіло за п. 182, де альбумінзв'язувальний пептид вибраний з SEQ ID NО:42-46.
184. Антитіло за п. 23, що містить альбумінзв'язувальний пептид.
185. Антитіло за п. 184, де альбумінзв'язувальний пептид вибраний з SEQ ID NО:42-46.
186. Антитіло за п. 1, де антитіло додатково містить цистеїн в одному або декількох положеннях, вибраних з 15, 43, 110, 144, 168 і 205 легкого ланцюга за правилами нумерації Kabat і 41, 88, 115, 118, 120, 171, 172, 282, 375 і 400 важкого ланцюга за правилами нумерації EU.
187. Антитіло за п. 186, де цистеїн знаходиться у положенні 205 легкого ланцюга.
188. Антитіло за п. 186, де цистеїн знаходиться у положенні 118 важкого ланцюга.
189. Антитіло за п. 186, де цистеїн знаходиться у положенні 400 важкого ланцюга.
190. Антитіло за п. 186, де антитіло вибране з моноклонального антитіла, біспецифічного антитіла, химерного антитіла, антитіла людини і гуманізованого антитіла.
191. Антитіло за п. 186, яке являє собою фрагмент антитіла.
192. Антитіло за п. 191, де фрагмент антитіла являє собою фрагмент Fab.
193. Антитіло за п. 186, яке вибране з химерного антитіла, антитіла людини або гуманізованого антитіла.
194. Антитіло за п. 186, яке одержують у бактеріях.
195. Антитіло за п. 186, яке одержують у клітинах СНО.
196. Спосіб визначення наявності білка CD22 у зразку, що передбачувано містить вказаний білок, де вказаний спосіб включає вплив на вказаний зразок антитіла за п. 186 і визначення зв'язування вказаного антитіла з вказаним білком CD22 у вказаному зразку, де зв'язування антитіла з вказаним білком вказує на присутність вказаного білка у вказаному зразку.
197. Спосіб за п. 196, де вказаний зразок містить клітини, які передбачувано експресують вказаний білок CD22.
198. Спосіб за п. 196, де вказана клітина являє собою В-клітину.
199. Спосіб за п. 196, де антитіло ковалентно зв'язане з міткою, вибраною з флуоресцентного барвника, радіоактивного ізотопу, біотину або ліганду, що утворює комплекси з металами.
200. Фармацевтичний препарат, що містить антитіло до CD22 за п. 186 і фармацевтично прийнятний розріджувач, носій або ексципієнт.
201. Антитіло за п. 186, де антитіло ковалентно зв'язане з ауристатином або молекулою майтанзиноїдного лікарського засобу, внаслідок чого утворюється кон'югат антитіло-лікарський засіб.
202. Кон'югат антитіло-лікарський засіб за п. 201, що містить антитіло (Аb) і ауристатин або молекулу майтанзиноїдного лікарського засобу (D), де модифіковане цистеїном антитіло зв'язане через одну або декілька амінокислот вільного цистеїну за допомогою лінкерної групи (L) з D; де сполука має формулу І:
Ab-(L-D)p, I
де р являє собою 1, 2, 3 або 4.
203. Сполука кон'югата антитіло-лікарський засіб за п. 201, де р являє собою 2.
204. Сполука кон'югата антитіло-лікарський засіб за п. 201, де L має формулу:
-Аа-W w-Yу-,
де
А являє собою подовжувач, ковалентно зв'язаний з тіолом цистеїну модифікованого цистеїном антитіла (Аb);
а являє собою 0 або 1;
кожний W незалежно являє собою амінокислотну одиницю;
w являє собою ціле число у діапазоні від 0 до 12;
Y являє собою спейсерну одиницю, ковалентно зв'язану з молекулою лікарського засобу; і
у являє собою 0, 1 або 2.
205. Сполука кон'югата антитіло-лікарський засіб за п. 204 з формулою:
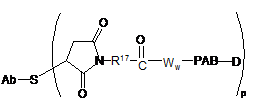 ,
,
де РАВ являє собою пара-амінобензилкарбамоїл, a R17 являє собою бівалентний радикал, вибраний з (СН2)r-, С3-С8-карбоциклілу, О-(СН2)r-, арилену, (СН2)r-арилену, -арилен-(СН2)r-, (СН2)r-(С3-С8-карбоциклілу), (С3-С8-карбоциклілу)-(СН2)r-, С3-С8-гетероциклілу, (СН2)r-(С3-С8-гетероциклілу), -(С3-С8-гетероцикліл)-(CH2)r, -(CH2)rC(O)NRb(CH2)r, -(СН2СН2О)r-, -(СН2СН2О)r-СН2-, (CH2)rC(O)NRb(CH2CH2O)r-, -(CH2)rC(O)NRb(CH2CH2O)r-CH2-, (CH2CH2O)rC(O)NRb(CH2CH2O)r-, -(CH2CH2O)rC(O)NRb(CH2CH2O)r-CH2- і -(CH2CH2O)rC(O)NRb(CH2)r-; де Rb являє собою Н, С,-С6-алкіл, феніл або бензил; і r незалежно являє собою ціле число у діапазоні від 1 до 10.
206. Сполука кон'югата антитіло-лікарський засіб за п. 204, де Ww являє собою валін-цитрулін.
207. Сполука кон'югата антитіло-лікарський засіб за п. 204, де R17 являє собою (СН2)5 або (СН2)2.
208. Сполука кон'югата антитіло-лікарський засіб за п. 204 з формулою:
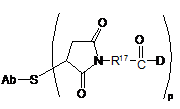 .
.
209. Сполука кон'югата антитіло-лікарський засіб за п. 208, де R17 являє собою (СН2)5 або (СН2)2.
210. Сполука кон'югата антитіло-лікарський засіб за п. 204 з формулою:
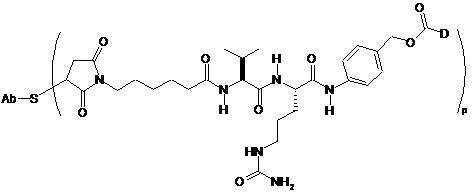 .
.
211. Сполука кон'югата антитіло-лікарський засіб за п. 202, де L являє собою SMCC, SPP або ВМРЕО.
212. Сполука кон'югата антитіло-лікарський засіб за п. 202, де D являє собою ММАЕ, зі структурою:
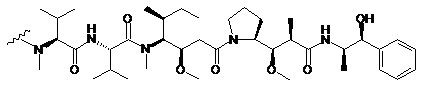 ,
,
де хвиляста лінія вказує ділянку зв'язування з лінкером L.
213. Сполука кон'югата антитіло-лікарський засіб за п. 202, де D являє собою MMAF, зі структурою:
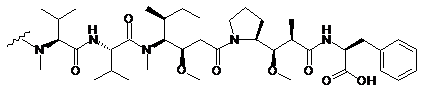 ,
,
де хвиляста лінія вказує ділянку зв'язування з лінкером L.
214. Сполука кон'югата антитіло-лікарський засіб за п. 202, де D являє собою DM1, зі структурою:
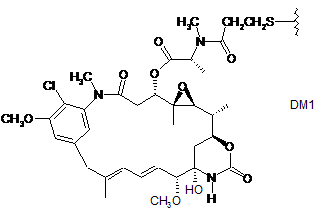 ,
,
де хвиляста лінія вказує ділянку зв'язування з лінкером L.
215. Сполука кон'югата антитіло-лікарський засіб за п. 201, де вихідне антитіло до CD22 вибране з моноклонального антитіла, біспецифічного антитіла, химерного антитіла, антитіла людини, гуманізованого антитіла і фрагмента антитіла.
216. Сполука кон'югата антитіло-лікарський засіб за п. 201, де фрагмент антитіла являє собою фрагмент Fab.
217. Сполука кон'югата антитіло-лікарський засіб, вибрана зі структур:
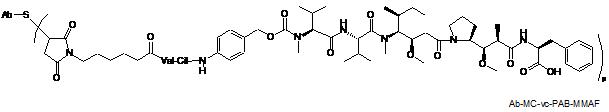 ,
,
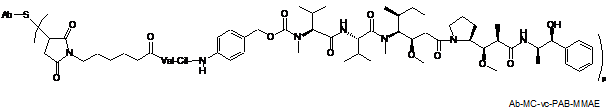 ,
,
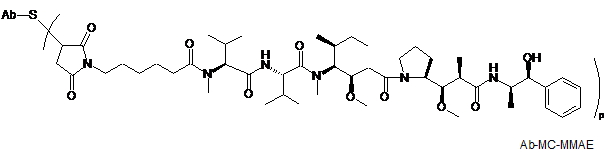 ,
,
 ,
,
 ,
,
де Val являє собою валін; Cit являє собою цитрулін; р являє собою 1, 2, 3 або 4; і Аb являє собою антитіло до CD22 за п. 186.
218. Кон'югат антитіло-лікарський засіб за п. 201, де ауристатин являє собою ММАЕ або MMAF.
219. Кон'югат антитіло-лікарський засіб за п. 202, де L являє собою MC-val-cit-PAB або МС.
220. Аналіз для детектування В-клітин, що включає
(a) вплив на клітини сполуки кон'югата антитіло-лікарський засіб за п. 199 і
(b) визначення ступеня зв'язування сполуки кон'югата антитіло-лікарський засіб з клітинами.
221. Спосіб інгібування клітинної проліферації, що включає обробку злоякісних В-клітин ссавців у середовищі для культивування клітин зі сполукою кон'югата антитіло-лікарський засіб за п. 201, внаслідок чого проліферація злоякісних В-клітин інгібується.
222. Фармацевтичний препарат, що містить кон'югат антитіло-лікарський засіб за п. 201 і фармацевтично прийнятний розріджувач, носій або ексципієнт.
223. Спосіб лікування злоякісної пухлини, що включає введення пацієнту фармацевтичного препарату за п. 222.
224. Спосіб за п. 223, де злоякісна пухлина вибрана з групи, що складається з лімфоми, неходжкінської лімфоми (NHL), агресивної NHL, рецидивуючої агресивної NHL, рецидивуючої повільно зростаючої NHL, рефракторної NHL, рефракторної повільно зростаючої NHL, хронічного лімфолейкозу (CLL), дрібноклітинної лімфоми, лейкозу, волосатоклітинного лейкозу (HCL), гострого лімфоцитарного лейкозу (ALL) і лімфоми мантійних клітин.
225. Спосіб за п. 223, де пацієнту вводять цитотоксичний засіб у поєднанні зі сполукою кон'югата антитіло-лікарський засіб.
226. Промисловий виріб, що містить
- фармацевтичний препарат за п. 220;
- контейнер і
- вкладиш в упаковку або ярлик, який вказує, що сполуку можна використовувати для лікування злоякісної пухлини, що характеризується надекспресією поліпептиду CD22.
227. Промисловий виріб за п. 226, де злоякісна пухлина вибрана з групи, що складається з лімфоми, неходжкінської лімфоми (NHL), агресивної NHL, рецидивуючої агресивної NHL, рецидивуючої повільно зростаючої NHL, рефракторної NHL, рефракторної повільно зростаючої NHL, хронічного лімфолейкозу (CLL), дрібноклітинної лімфоми, лейкозу, волосатоклітинного лейкозу (HCL), гострого лімфоцитарного лейкозу (ALL) і лімфоми мантійних клітин.
228. Спосіб одержання сполуки кон'югата антитіло-лікарський засіб, що містить антитіло до CD22 (Аb) за п. 186 і ауристатин або молекулу майтанзиноїдного лікарського засобу (D), де антитіло через одну або декілька одержаних внаслідок конструювання амінокислот цистеїну за допомогою лінкерної групи (L) зв'язане з D; де сполука має формулу І:
Ab-(L-D)p, I
де р являє собою 1, 2, 3 або 4; де спосіб включає в себе стадії:
(a) реакції одержаної внаслідок конструювання групи цистеїну антитіла з лінкерним реагентом з утворенням проміжного продукту антитіло-лінкер Ab-L; і
(b) реакції Ab-L з активованою молекулою лікарського засобу D; внаслідок чого утворюється кон'югат антитіло-лікарський засіб;
або де спосіб включає стадії:
(c) реакції нуклеофільної групи молекули лікарського засобу з лінкерним реагентом з утворенням проміжної сполуки лікарський засіб-лінкер D-L; і
(d) реакції D-L з одержаною внаслідок конструювання групою цистеїну антитіла; внаслідок чого утворюється кон'югат антитіло-лікарський засіб.
229. Спосіб за п. 228, що додатково включає стадію експресії антитіла у клітинах яєчника китайського хом'ячка (СНО).
230. Спосіб за п. 229, що додатково включає стадію обробки експресованого антитіла відновником.
231. Спосіб за п. 230, де відновник вибраний з ТСЕР і DTT.
232. Спосіб за п. 230, що додатково включає стадію обробки експресованого антитіла окисником після обробки відновником.
233. Спосіб за п. 232, де окисник вибраний з сульфату міді, дегідроаскорбінової кислоти і повітря.
234. Антитіло за п. 186, де антитіло містить послідовність важкого ланцюга, вибрану з будь-якої однієї з SEQ ID NО:88, 92 або 93.
235. Антитіло за п. 186, де антитіло містить послідовність легкого ланцюга, вибрану з SEQ ID NО:87 або 91.
236. Антитіло за п. 186, де антитіло містить послідовність легкого ланцюга SEQ ID NО:87 і послідовність важкого ланцюга SEQ ID NO:92.
237. Антитіло за п. 186, де антитіло містить послідовність легкого ланцюга SEQ ID NО:87 і послідовність важкого ланцюга SEQ ID NО:93.
238. Антитіло за п. 186, де антитіло містить послідовність легкого ланцюга SEQ ID NО:91 і послідовність важкого ланцюга SEQ ID NO:88.
Текст
1. Антитіло, що зв'язується з CD22, яке містить (a) HVR-L1, що містить амінокислотну послідовність, вибрану з SEQ ID NО:9, 10, 19-23, 32 і 2 (19) 1 3 SEQ ID NО:4; і HVR-H3, що містить амінокислотну послідовність SEQ ID NО:6. 8. Антитіло за п. 1, де HVR-L1 містить SEQ ID NО:22, і антитіло додатково містить HVR-H1, що містить амінокислотну послідовність SEQ ID NО:2; HVR-H2, що містить амінокислотну послідовність SEQ ID NО:4; і HVR-H3, що містить амінокислотну послідовність SEQ ID NO:6. 9. Антитіло за п. 1, де HVR-L1 містить SEQ ID NО:23, і антитіло додатково містить HVR-H1, що містить амінокислотну послідовність SEQ ID NО:2; HVR-H2, що містить амінокислотну послідовність SEQ ID NО:4; і HVR-H3, що містить амінокислотну послідовність SEQ ID NО:6. 10. Антитіло за п. 1, де HVR-L1 містить SEQ ID NО:32, і антитіло додатково містить HVR-H1, що містить амінокислотну послідовність SEQ ID NО:2; HVR-H2, що містить амінокислотну послідовність SEQ ID NО:4; і HVR-H3, що містить амінокислотну послідовність SEQ ID NО:6. 11. Антитіло за п. 1, де HVR-L1 містить SEQ ID NО:33, і антитіло додатково містить HVR-H1, що містить амінокислотну послідовність SEQ ID NО:2; HVR-H2, що містить амінокислотну послідовність SEQ ID NО:4; і HVR-H3, що містить амінокислотну послідовність SEQ ID NО:6. 12. Антитіло за п. 1, яке додатково містить щонайменше один каркас, вибраний з консенсусного каркаса підгрупи III VH і консенсусного каркаса підгрупи І VL. 13. Антитіло за п. 1, яке додатково містить варіабельний домен важкого ланцюга щонайменше з 90 % ідентичності послідовності з амінокислотною послідовністю, вибраною з SEQ ID NО:16. 14. Антитіло за п. 1, яке містить варіабельний домен легкого ланцюга щонайменше з 90 % ідентичності послідовності з амінокислотною послідовністю, вибраною з SEQ ID NО:17. 15. Антитіло за п. 1, яке містить варіабельний домен легкого ланцюга щонайменше з 90 % ідентичності послідовності з амінокислотною послідовністю, вибраною з SEQ ID NО:18. 16. Антитіло за п. 1, яке містить варіабельний домен важкого ланцюга, що містить одну, дві, три або чотири каркасні амінокислотні послідовності, вибрані з SEQ ID NО:1, 3, 5 і 7. 17. Антитіло за п. 1, яке містить варіабельний домен легкого ланцюга, що містить одну, дві, три або чотири каркасні амінокислотні послідовності, вибрані з SEQ ID NО:8, 11, 13 і 15. 18. Антитіло за п. 13, яке додатково містить варіабельний домен легкого ланцюга, який щонайменше на 90 % ідентичний послідовності з амінокислотною послідовністю, вибраною з SEQ ID NО:17. 19. Антитіло за п. 13, яке додатково містить варіабельний домен легкого ланцюга, який щонайменше на 90 % ідентичний послідовності з амінокислотною послідовністю, вибраною з SEQ ID NО:18. 20. Антитіло за п. 1, що містить важкий ланцюг, який щонайменше на 90 % ідентичний послідовності з амінокислотною послідовністю, вибраною з SEQ ID NО:88. 21. Антитіло за п. 1, що містить легкий ланцюг, який щонайменше на 90 % ідентичний послідовно 95958 4 сті з амінокислотною послідовністю, вибраною з SEQ ID NО:87. 22. Антитіло за п. 1, що містить важкий ланцюг з амінокислотною послідовністю SEQ ID NО:88 і легкий ланцюг з амінокислотною послідовністю SEQ ID NО:87. 23. Антитіло, яке зв'язується з CD22, що містить варіабельний домен важкого ланцюга, який щонайменше на 90 % ідентичний послідовності з амінокислотною послідовністю SEQ ID NО:16. 24. Антитіло за п. 23, що додатково містить варіабельний домен легкого ланцюга, який щонайменше на 90 % ідентичний послідовності з амінокислотною послідовністю SEQ ID NО:17. 25. Антитіло за п. 23, що додатково містить варіабельний домен легкого ланцюга, який щонайменше на 90 % ідентичний послідовності з амінокислотною послідовністю SEQ ID NО:18. 26. Антитіло за п. 1, що містить одну, дві, три, чотири, п'ять або шість з HVR з антитіла, яке одержують за допомогою гібридоми з АТСС з інвентарним номером РТА-7621 (10F4.4.1). 27. Антитіло, що містить одну, дві, три, чотири, п'ять або шість з HVR з антитіла, яке одержують за допомогою гібридоми ATGC з інвентарним номером РТА-7620 (5Е8.1.8). 28. Антитіло за п. 1, яке є гуманізованим. 29. Антитіло за п. 23, яке є гуманізованим. 30. Антитіло за п. 1, де CD22 являє собою CD22 ссавця. 31. Антитіло за п. 30, де CD22 вибраний з CD22 гризунів і CD22 приматів. 32. Антитіло за п. 31, де CD22 являє собою CD22 людини. 33. Антитіло за п. 23, де CD22 являє собою CD22 ссавця. 34. Антитіло за п. 33, де CD22 вибраний з CD22 гризунів і CD22 приматів. 35. Антитіло за п. 34, де CD22 являє собою CD22 людини. 36. Полінуклеотид, який кодує антитіло за п. 1. 37. Полінуклеотид, який кодує антитіло за п. 23. 38. Вектор, що містить полінуклеотид за п. 36. 39. Вектор, що містить полінуклеотид за п. 37. 40. Клітина-хазяїн, що містить вектор за п. 38. 41. Клітина-хазяїн, що містить вектор за п. 39. 42. Клітина-хазяїн за п. 40, що є еукаріотичною. 43. Клітина-хазяїн за п. 42, що є клітиною СНО. 44. Клітина-хазяїн за п. 41, що є еукаріотичною.45. Клітина-хазяїн за п. 44, що є клітиною СНО. 46. Спосіб одержання антитіла до CD22, що включає а) культивування клітини-хазяїна за п. 38 в умовах, придатних для експресії полінуклеотиду, що кодує антитіло, і b) виділення антитіла. 47. Спосіб одержання антитіла до CD22, що включає а) культивування клітини-хазяїна за п. 39 в умовах, придатних для експресії полінуклеотиду, що кодує антитіло, і b) виділення антитіла. 48. Антитіло за п. 28, де CD22 експресується на поверхні клітини. 49. Антитіло за п. 48, де клітина являє собою Вклітину. 50. Антитіло за п. 29, де CD22 експресується на поверхні клітини. 5 51. Антитіло за п. 50, де CD22 являє собою Вклітину. 52. Антитіло за п. 1, що зв'язується з епітопом в області CD22 від амінокислоти 22 до амінокислоти 240 SEQ ID NО:27. 53. Антитіло за п. 23, що зв'язується з епітопом в області CD22 від амінокислоти 22 до амінокислоти 240 SEQ ID NО:27. 54. Антитіло за п. 49, де В-клітина асоційована з Вклітинним проліферативним порушенням. 55. Антитіло за п. 54, де В-клітинне проліферативне порушення являє собою злоякісну пухлину. 56. Антитіло за п. 54, де В-клітинне проліферативне порушення вибране з лімфоми, неходжкінської лімфоми (NHL), агресивної NHL, рецидивуючої агресивної NHL, рецидивуючої повільно зростаючої NHL, рефракторної NHL, рефракторної повільно зростаючої NHL, хронічного лімфолейкозу (CLL), дрібноклітинної лімфоми, лейкозу, волосатоклітинного лейкозу (HCL), гострого лімфоцитарного лейкозу (ALL) і лімфоми мантійних клітин. 57. Антитіло за п. 51, де В-клітина асоційована з Вклітинним проліферативним порушенням. 58. Антитіло за п. 57, де В-клітинне проліферативне порушення являє собою злоякісну пухлину. 59. Антитіло за п. 57, де В-клітинне проліферативне порушення вибране з лімфоми, неходжкінської лімфоми (NHL), агресивної NHL, рецидивуючої агресивної NHL, рецидивуючої повільно зростаючої NHL, рефракторної NHL, рефракторної повільно зростаючої NHL, хронічного лімфолейкозу (CLL), дрібноклітинної лімфоми, лейкозу, волосатоклітинного лейкозу (HCL), гострого лімфоцитарного лейкозу (ALL) і лімфоми мантійних клітин. Антитіло за будь-яким з пп. 1-14, 16-23 або 30-33, що являє собою моноклональне антитіло. 60. Антитіло за п. 1, що являє собою моноклональне антитіло. 61. Антитіло за п. 60, що являє собою фрагмент антитіла, вибраний з фрагментів Fab, Fab'-SH, Fv, scFv або (Fab')2. 62. Антитіло за п. 60, що є гуманізованим. 63. Антитіло за п. 60, що являє собою антитіло людини. 64. Антитіло за п. 23, що являє собою моноклональне антитіло. 65. Антитіло за п. 64, що являє собою фрагмент антитіла, вибраний з фрагментів Fab, Fab'-SH, Fv, scFv або (Fab')2. 66. Антитіло за п. 64, що є гуманізованим. 67. Антитіло за п. 64, що являє собою антитіло людини. 68. Антитіло за п. 1, що зв'язується з тим же епітопом, що і антитіло, вибране з АТСС РТА-7621 (10F4.4.1); АТСС РТА-7620 (5Е8.1.8); і антитіло, що містить послідовність важкого ланцюга SEQ ID NО:88 і послідовність легкого ланцюга SEQ ID NО:87. 69. Антитіло за п. 23, що зв'язується з тим же епітопом, що і антитіло, вибране з АТСС РТА-7621 (10F4.4.1); АТСС РТА-7620 (5Е8.1.8); і антитіло, що містить послідовність важкого ланцюга SEQ ID NО:88 і послідовність легкого ланцюга SEQ ID NО:87. 95958 6 70. Спосіб визначення присутності CD22 у біологічному зразку, де спосіб включає приведення біологічного зразка у контакт з антитілом за п. 1 в умовах, які допускають зв'язування антитіла з CD22, і визначення того, чи формується комплекс між антитілом і CD22. 71. Спосіб за п. 70, де біологічний зразок взятий від пацієнта, у якого підозрюють наявність Вклітинного проліферативного порушення. 72. Спосіб за п. 71, де В-клітинне проліферативне порушення вибране з лімфоми, неходжкінської лімфоми (NHL), агресивної NHL, рецидивуючої агресивної NHL, рецидивуючої повільно зростаючої NHL, рефракторної NHL, рефракторної повільно зростаючої NHL, хронічного лімфолейкозу (CLL), дрібноклітинної лімфоми, лейкозу, волосатоклітинного лейкозу (HCL), гострого лімфоцитарного лейкозу (ALL) і лімфоми мантійних клітин. 73. Спосіб визначення присутності CD22 у біологічному зразку, де спосіб включає приведення біологічного зразка у контакт з антитілом за п. 23 в умовах, які допускають зв'язування антитіла з CD22, і визначення того, чи формується комплекс між антитілом і CD22. 74. Спосіб за п. 73, де біологічний зразок взятий від пацієнта, у якого підозрюють наявність Вклітинного проліферативного порушення. 75. Спосіб за п. 74, де В-клітинне проліферативне порушення вибране з лімфоми, неходжкінської лімфоми (NHL), агресивної NHL, рецидивуючої агресивної NHL, рецидивуючої повільно зростаючої NHL, рефракторної NHL, рефракторної повільно зростаючої NHL, хронічного лімфолейкозу (CLL), дрібноклітинної лімфоми, лейкозу, волосатоклітинного лейкозу (HCL), гострого лімфоцитарного лейкозу (ALL) і лімфоми мантійних клітин. 76. Імунокон'югат, що містить антитіло за п. 1, ковалентно зв'язане з цитотоксичним засобом. 77. Імунокон'югат, що містить антитіло за п. 23, ковалентно зв'язане з цитотоксичним засобом. 78. Імунокон'югат за п. 76, де цитотоксичний засіб вибраний з токсину, хіміотерапевтичного засобу, молекули лікарського засобу, антибіотика, радіоактивного ізотопу і нуклеази. 79. Імунокон'югат за п. 78, де імунокон'югат має формулу Ab-(L-D)p, де (a) Аb являє собою антитіло за п. 1; (b) L являє собою лінкер; (c) D являє собою молекулу лікарського засобу. 80. Імунокон'югат за п. 79, де L вибраний з 6малеімідокапроїлу (МС), малеімідопропаноїлу (МР), валіну-цитруліну (val-cit), аланінуфенілаланіну (аlа-phe), памінобензилоксикарбонілу (РАВ), N-сукцинімідил4-(2-піридилтіо)пентаноату (SPP), N-сукцинімідил4-(N-малеімідометил)циклогексан-1-карбоксилату (SMCC) і N-сукцинімідил-(4йодацетил)амінобензоату (SIAB). 81. Імунокон'югат за п. 79, де D вибраний з ауристатину і доластатину. 82. Імунокон'югат за п. 81, де D являє собою молекулу лікарського засобу формули DE або DF: 7 95958 R3 N O R2 R4 R3 H N N R2 O R4 R7 O H N CH3 N N R5 R6 CH3 N N R5 R6 R8 6 O R9 N R8 R18 O R8 R7 O R9 N O R8 DF 2 8 O DE, O R11 Z R10 , 3 і де кожний R і R являє собою метил, кожний R і 4 7 R являє собою ізопропіл, R являє собою втор8 бутил, кожний R незалежно вибраний з СН3, О9 10 СН3, ОН і Н; R являє собою Н; R являє собою 11 арил; Z являє собою -О- або -NH-; R являє собою Н, С1-С8-алкіл або -(СН2)2-О-(СН2)2-О-(СН2)2-О18 8 8 СН3; і R являє собою -C(R )2-C(R )2-арил; і (d) р знаходиться у діапазоні приблизно від 1 до 8. 83. Імунокон'югат за п. 76 з дією, що знищує клітину, in vitro або in vivo. 84. Імунокон'югат за п. 79, де лінкер зв'язаний з антитілом через тіольну групу на антитілі. 85. Імунокон'югат за п. 79, де лінкер є розщеплюваним протеазою. 86. Імунокон'югат за п. 80, де лінкер містить дипептид val-cit. 87. Імунокон'югат за п. 79, де лінкер містить памінобензильну одиницю. 88. Імунокон'югат за п. 80, де лінкер містить 6малеімідокапроїл. 89. Імунокон'югат за п. 82, де лікарський засіб вибраний з ММАЕ і MMAF. 90. Імунокон'югат за п. 89, де лікарський засіб являє собою ММАЕ. 91. Імунокон'югат за п. 89, де лікарський засіб являє собою MMAF. 92. Імунокон'югат за п. 77, де цитотоксичний засіб вибраний з токсину, хіміотерапевтичного засобу, молекули лікарського засобу, антибіотика, радіоактивного ізотопу і нуклеази. 93. Імунокон'югат за п. 92, де імунокон'югат має формулу Ab-(L-D)p, де (a) Аb являє собою антитіло за п. 23; (b) L являє собою лінкер; (c) D являє собою молекулу лікарського засобу. 94. Імунокон'югат за п. 93, де L вибраний з 6малеімідокапроїлу (МС), малеімідопропаноїлу (МР), валіну-цитруліну (val-cit), аланінуфенілаланіну (аlа-phe), памінобензилоксикарбонілу (РАВ), N-сукцинімідил4-(2-піридилтіо)пентаноату (SPP), N-сукцинімідил4-(N-малеімідометил)циклогексан-1-карбоксилату (SMCC) і N-сукцинімідил-(4йодацетил)амінобензоату (SIAB). 95. Імунокон'югат за п. 93, де лінкер L є розщеплюваним протеазою. 96. Імунокон'югат за п. 94, де L містить дипептид val-cit. 97. Імунокон'югат за п. 93, де L містить памінобензильну одиницю. 98. Імунокон'югат за п. 97, де п-амінобензильна одиниця являє собою п-амінобензилоксикарбоніл (РАВ). 99. Імунокон'югат за п. 94, де L містить 6малеімідокапроїл (МС). 100. Імунокон'югат за п. 94, де лінкер містить 6малеімідокапроїл і п-амінобензилоксикарбоніл. 101. Імунокон'югат за п. 79, де імунокон'югат має формулу Ab-(L-MMAE)p, де L являє собою лінкер, а р знаходиться у діапазоні від 2 до 5. 102. Імунокон'югат за п. 101, де L містить val-cit. 103. Імунокон'югат за п. 101, де L містить МС. 104. Імунокон'югат за п. 101, де L містить РАВ. 105. Імунокон'югат за п. 101, де L містить МС-РАВ. 106. Імунокон'югат за п. 93, де імунокон'югат має формулу Ab-(L-MMAE)p, де L являє собою лінкер і р знаходиться у діапазоні від 2 до 5. 107. Імунокон'югат за п. 106, де L містить val-cit. 108. Імунокон'югат за п. 106, де L містить МС. 109. Імунокон'югат за п. 106, де L містить РАВ. 110. Імунокон'югат за п. 106, де L містить МС-РАВ. 111. Імунокон'югат за п. 79, де імунокон'югат має формулу Ab-(L-MMAF)p, де L являє собою лінкер, а р знаходиться у діапазоні від 2 до 5. 112. Імунокон'югат за п. 111, де L містить val-cit. 113. Імунокон'югат за п. 111, де L містить МС. 114. Імунокон'югат за п. 111, де L містить РАВ. 115. Імунокон'югат за п. 111, де L містить МС-РАВ. 116. Імунокон'югат за п. 93, де імунокон'югат має формулу Ab-(L-MMAF)p, де L являє собою лінкер, а р знаходиться у діапазоні від 2 до 5. 117. Імунокон'югат за п. 116, де L містить val-cit. 118. Імунокон'югат за п. 116, де L містить МС. 119. Імунокон'югат за п. 116, де L містить РАВ. 120. Імунокон'югат за п. 116, де L містить МС-РАВ. 121. Імунокон'югат за п. 79, де D являє собою майтанзиноїд. 122. Імунокон'югат за п. 121, де D вибраний з DM1, DM3 і DM4. 123. Імунокон'югат за п. 121 з дією, що знищує клітину, in vitro або in vivo. 9 124. Імунокон'югат за п. 121, де лінкер зв'язаний з антитілом через тіольну групу на антитілі. 125. Імунокон'югат за п. 121, де лінкер L вибраний з N-сукцинімідил-4-(2-піридилтіо)пентаноату (SPP), N-сукцинімідил-4-(N-малеімідометил)циклогексан1-карбоксилату (SMCC) і N-сукцинімідил-(4йодацетил)амінобензоату (SIAB). 126. Імунокон'югат за п. 122, де лікарський засіб являє собою DM1. 127. Імунокон'югат за п. 122, де L містить SPP. 128. Імунокон'югат за п. 122, де L містить SMCC. 129. Імунокон'югат за п. 122, де р складає від 2 до 4. 130. Імунокон'югат за п. 122, де р складає від 3 до 4. 131. Імунокон'югат за п. 93, де D являє собою майтанзиноїд. 132. Імунокон'югат за п. 131, де D вибраний з DM1, DM3 і DM4. 133. Імунокон'югат за п. 131 з дією, що знищує клітину, in vitro або in vivo. 134. Імунокон'югат за п. 131, де лінкер зв'язаний з антитілом через тіольну групу на антитілі. 135. Імунокон'югат за п. 131, де лінкер L вибраний з N-сукцинімідил-4-(2-піридилтіо)пентаноату (SPP), N-сукцинімідил-4-(N-малеімідометил)циклогексан1-карбоксилату (SMCC) і N-сукцинімідил-(4йодацетил)амінобензоату (SIAB). 136. Імунокон'югат за п. 132, де лікарський засіб являє собою DM1. 137. Імунокон'югат за п. 136, де L містить SPP. 138. Імунокон'югат за п. 136, де L містить SMCC. 139. Імунокон'югат за п. 136, де р складає від 2 до 4. 140. Імунокон'югат за п. 136, де р складає від 3 до 4. 141. Фармацевтична композиція, що містить імунокон'югат за п. 79 і фармацевтично прийнятний носій. 142. Спосіб лікування В-клітинного проліферативного порушення, що включає введення індивідууму ефективної кількості фармацевтичної композиції за п. 141. 143. Спосіб за п. 142, де В-клітинне проліферативне порушення вибране з лімфоми, неходжкінської лімфоми (NHL), агресивної NHL, рецидивуючої агресивної NHL, рецидивуючої повільно зростаючої NHL, рефракторної NHL, рефракторної повільно зростаючої NHL, хронічного лімфолейкозу (CLL), дрібноклітинної лімфоми, лейкозу, волосатоклітинного лейкозу (HCL), гострого лімфоцитарного лейкозу (ALL) і лімфоми мантійних клітин. 144. Фармацевтична композиція, що містить імунокон'югат за п. 93 і фармацевтично прийнятний носій. 145. Спосіб лікування В-клітинного проліферативного порушення, що включає введення індивідууму ефективної кількості фармацевтичної композиції за п. 144. 146. Спосіб за п. 145, де В-клітинне проліферативне порушення вибране з лімфоми, неходжкінської лімфоми (NHL), агресивної NHL, рецидивуючої агресивної NHL, рецидивуючої повільно зростаючої NHL, рефракторної NHL, рефракторної повільно зростаючої NHL, хронічного лімфолейкозу 95958 10 (CLL), дрібноклітинної лімфоми, лейкозу, волосатоклітинного лейкозу (HCL), гострого лімфоцитарного лейкозу (ALL) і лімфоми мантійних клітин. 147. Фармацевтична композиція, що містить імунокон'югат за п. 76, 77, 78 або 92 і фармацевтично прийнятний носій. 148. Спосіб лікування В-клітинного проліферативного порушення, що включає введення індивідууму ефективної кількості фармацевтичної композиції за п. 147. 149. Спосіб за п. 148, де В-клітинне проліферативне порушення вибране з лімфоми, неходжкінської лімфоми (NHL), агресивної NHL, рецидивуючої агресивної NHL, рецидивуючої повільно зростаючої NHL, рефракторної NHL, рефракторної повільно зростаючої NHL, хронічного лімфолейкозу (CLL), дрібноклітинної лімфоми, лейкозу, волосатоклітинного лейкозу (HCL), гострого лімфоцитарного лейкозу (ALL) і лімфоми мантійних клітин. 150. Спосіб інгібування В-клітинної проліферації, що включає вплив на клітини імунокон'югата за п. 79 в умовах, що дозволяють зв'язування імунокон'югата з CD22. 151. Спосіб за п. 150, де В-клітинна проліферація асоційована з порушенням, вибраним з лімфоми, неходжкінської лімфоми (NHL), агресивної NHL, рецидивуючої агресивної NHL, рецидивуючої повільно зростаючої NHL, рефракторної NHL, рефракторної повільно зростаючої NHL, хронічного лімфолейкозу (CLL), дрібноклітинної лімфоми, лейкозу, волосатоклітинного лейкозу (HCL), гострого лімфоцитарного лейкозу (ALL) і лімфоми мантійних клітин. 152. Спосіб за п. 150, де В-клітина являє собою ксенотрансплантат. 153. Спосіб за п. 150, де вплив відбувається in vitro. 154. Спосіб за п. 150, де вплив відбувається in vivo. 155. Антитіло за п. 1, що являє собою модифіковане цистеїном антитіло, яке містить одну або декілька амінокислот вільного цистеїну зі значенням тіолової реакційноздатності у діапазоні від 0,6 до 1,0, де модифіковане цистеїном антитіло одержують способом, що включає заміну одного або декількох амінокислотних залишків вихідного антитіла цистеїном. 156. Модифіковане цистеїном антитіло за п. 155, що є більш реакційноздатним з реагентом, що реагує з тіолами, ніж вихідне антитіло. 157. Модифіковане цистеїном антитіло за п. 155, де спосіб додатково містить визначення реакційноздатності тіолових груп модифікованого цистеїном антитіла за допомогою проведення реакції модифікованого цистеїном антитіла з реагентом, що реагує з тіолами; де модифіковане цистеїном антитіло є більш реакційноздатним з реагентом, що реагує з тіолами, ніж вихідне антитіло. 158. Модифіковане цистеїном антитіло за п. 155, де один або декілька амінокислотних залишків вільного цистеїну розташовані у легкому ланцюгу. 159. Модифіковане цистеїном антитіло за п. 155, де антитіло являє собою імунокон'югат, що містить 11 модифіковане цистеїном антитіло, ковалентно зв'язане з цитотоксичним засобом. 160. Модифіковане цистеїном антитіло за п. 159, де цитотоксичний засіб вибраний з токсину, хіміотерапевтичного засобу, молекули лікарського засобу, антибіотика, радіоактивного ізотопу і нуклеази. 161. Модифіковане цистеїном антитіло за п. 155, де антитіло ковалентно зв'язане із захоплюючою міткою, детекційною міткою або твердою основою. 162. Модифіковане цистеїном антитіло за п. 161, де антитіло ковалентно зв'язане із захоплюючою міткою біотином. 163. Модифіковане цистеїном антитіло за п. 161, де антитіло ковалентно зв'язане з детекційною міткою флуоресцентним барвником. 164. Модифіковане цистеїном антитіло за п. 163, де флуоресцентний барвник вибраний з флуоресцеїнового типу, родамінового типу, дансилу, лісаміну, ціаніну, фікоеритрину, техаського червоного і їх аналогів. 165. Модифіковане цистеїном антитіло за п. 161, де антитіло ковалентно зв'язане з радіонуклідною 3 11 14 18 детекційною міткою, вибраною з Н, С, С, F, 32 35 64 68 86 99 111 123 124 125 131 P, S, Cu, Ga, Y, Тс, Іn, I, I, І, І, 133 177 211 213 Хе, Lu, At і Вi. 166. Модифіковане цистеїном антитіло за п. 161, де антитіло ковалентно зв'язане з детекційною міткою хелатуючим лігандом. 167. Модифіковане цистеїном антитіло за п. 166, де хелатуючий ліганд вибраний з DOTA, DOTP, DOTMA, DTPA і ТЕТА. 168. Антитіло за п. 23, де антитіло являє собою модифіковане цистеїном антитіло, що містить одну або декілька амінокислот вільного цистеїну зі значенням тіолової реакційноздатності у діапазоні від 0,6 до 1,0, де модифіковане цистеїном антитіло одержують способом, що включає заміну одного або декількох амінокислотних залишків вихідного антитіла цистеїном. 169. Модифіковане цистеїном антитіло за п. 168, де модифіковане цистеїном антитіло є більш реакційноздатним з реагентом, що реагує з тіолами, ніж вихідне антитіло. 170. Модифіковане цистеїном антитіло за п. 168, де спосіб додатково містить визначення реакційноздатності тіолових груп модифікованого цистеїном антитіла за допомогою проведення реакції модифікованого цистеїном антитіла з реагентом, що реагує з тіолами; де модифіковане цистеїном антитіло є більш реакційноздатним з реагентом, що реагує з тіолами, ніж вихідне антитіло. 171. Модифіковане цистеїном антитіло за п. 168, де один або декілька амінокислотних залишків вільного цистеїну розташовані у легкому ланцюгу. 172. Модифіковане цистеїном антитіло за п. 168, де антитіло являє собою імунокон'югат, що містить модифіковане цистеїном антитіло, ковалентно зв'язане з цитотоксичним засобом. 173. Модифіковане цистеїном антитіло за п. 172, де цитотоксичний засіб вибраний з токсину, хіміотерапевтичного засобу, молекули лікарського засобу, антибіотика, радіоактивного ізотопу і нуклеази. 95958 12 174. Модифіковане цистеїном антитіло за п. 168, де антитіло ковалентно зв'язане із захоплюючою міткою, детекційною міткою або твердою основою. 175. Модифіковане цистеїном антитіло за п. 174, де антитіло ковалентно зв'язане із захоплюючою міткою біотином. 176. Модифіковане цистеїном антитіло за п. 174, де антитіло ковалентно зв'язане з детекційною міткою флуоресцентним барвником. 177. Модифіковане цистеїном антитіло за п. 176, де флуоресцентний барвник вибраний з флуоресцеїнового типу, родамінового типу, дансилу, лісаміну, ціаніну, фікоеритрину, техаського червоного і їх аналогів. 178. Модифіковане цистеїном антитіло за п. 174, де антитіло ковалентно зв'язане з радіонуклідною 3 11 14 18 детекційною міткою, вибраною з Н, С, С, F, 32 35 64 68 86 99 111 123 124 125 131 Р, S, Cu, Ga, Y, Тс, In, І, І, І, І, 133 177 211 213 Хе, Lu, At і Bi. 179. Модифіковане цистеїном антитіло за п. 178, де антитіло ковалентно зв'язане з детекційною міткою хелатуючим лігандом. 180. Модифіковане цистеїном антитіло за п. 179, де хелатуючий ліганд вибраний з DOTA, DOTP, DOTMA, DTPA і ТЕТА. 181. Імунокон'югат за п. 93, де лінкер зв'язаний з антитілом через тіольну групу на антитілі. 182. Антитіло за п. 1, що містить альбумінзв'язувальний пептид. 183. Антитіло за п. 182, де альбумінзв'язувальний пептид вибраний з SEQ ID NО:42-46. 184. Антитіло за п. 23, що містить альбумінзв'язувальний пептид. 185. Антитіло за п. 184, де альбумінзв'язувальний пептид вибраний з SEQ ID NО:42-46. 186. Антитіло за п. 1, де антитіло додатково містить цистеїн в одному або декількох положеннях, вибраних з 15, 43, 110, 144, 168 і 205 легкого ланцюга за правилами нумерації Kabat і 41, 88, 115, 118, 120, 171, 172, 282, 375 і 400 важкого ланцюга за правилами нумерації EU. 187. Антитіло за п. 186, де цистеїн знаходиться у положенні 205 легкого ланцюга. 188. Антитіло за п. 186, де цистеїн знаходиться у положенні 118 важкого ланцюга. 189. Антитіло за п. 186, де цистеїн знаходиться у положенні 400 важкого ланцюга. 190. Антитіло за п. 186, де антитіло вибране з моноклонального антитіла, біспецифічного антитіла, химерного антитіла, антитіла людини і гуманізованого антитіла. 191. Антитіло за п. 186, яке являє собою фрагмент антитіла. 192. Антитіло за п. 191, де фрагмент антитіла являє собою фрагмент Fab. 193. Антитіло за п. 186, яке вибране з химерного антитіла, антитіла людини або гуманізованого антитіла. 194. Антитіло за п. 186, яке одержують у бактеріях. 195. Антитіло за п. 186, яке одержують у клітинах СНО. 196. Спосіб визначення наявності білка CD22 у зразку, що передбачувано містить вказаний білок, де вказаний спосіб включає вплив на вказаний зразок антитіла за п. 186 і визначення зв'язування 13 95958 вказаного антитіла з вказаним білком CD22 у вказаному зразку, де зв'язування антитіла з вказаним білком вказує на присутність вказаного білка у вказаному зразку. 197. Спосіб за п. 196, де вказаний зразок містить клітини, які передбачувано експресують вказаний білок CD22. 198. Спосіб за п. 196, де вказана клітина являє собою В-клітину. 199. Спосіб за п. 196, де антитіло ковалентно зв'язане з міткою, вибраною з флуоресцентного барвника, радіоактивного ізотопу, біотину або ліганду, що утворює комплекси з металами. 200. Фармацевтичний препарат, що містить антитіло до CD22 за п. 186 і фармацевтично прийнятний розріджувач, носій або ексципієнт. 201. Антитіло за п. 186, де антитіло ковалентно зв'язане з ауристатином або молекулою майтанзиноїдного лікарського засобу, внаслідок чого утворюється кон'югат антитіло-лікарський засіб. 202. Кон'югат антитіло-лікарський засіб за п. 201, що містить антитіло (Аb) і ауристатин або молекулу майтанзиноїдного лікарського засобу (D), де модифіковане цистеїном антитіло зв'язане через одну або декілька амінокислот вільного цистеїну за допомогою лінкерної групи (L) з D; де сполука має формулу І: Ab-(L-D)p, I де р являє собою 1, 2, 3 або 4. 203. Сполука кон'югата антитіло-лікарський засіб за п. 201, де р являє собою 2. 204. Сполука кон'югата антитіло-лікарський засіб за п. 201, де L має формулу: -Аа-W w-Yу-, де А являє собою подовжувач, ковалентно зв'язаний з тіолом цистеїну модифікованого цистеїном антитіла (Аb); а являє собою 0 або 1; кожний W незалежно являє собою амінокислотну одиницю; w являє собою ціле число у діапазоні від 0 до 12; Y являє собою спейсерну одиницю, ковалентно зв'язану з молекулою лікарського засобу; і у являє собою 0, 1 або 2. 14 205. Сполука кон'югата антитіло-лікарський засіб за п. 204 з формулою: O O N Ab R17 Ww C PAB D S O p , де РАВ являє собою пара-амінобензилкарбамоїл, 17 a R являє собою бівалентний радикал, вибраний з (СН2)r-, С3-С8-карбоциклілу, О-(СН2)r-, арилену, (СН2)r-арилену, -арилен-(СН2)r-, (СН2)r-(С3-С8карбоциклілу), (С3-С8-карбоциклілу)-(СН2)r-, С3-С8гетероциклілу, (СН2)r-(С3-С8-гетероциклілу), -(С3b С8-гетероцикліл)-(CH2)r, -(CH2)rC(O)NR (CH2)r, (СН2СН2О)r-, -(СН2СН2О)r-СН2-, b (CH2)rC(O)NR (CH2CH2O)r-, b (CH2)rC(O)NR (CH2CH2O)r-CH2-, b (CH2CH2O)rC(O)NR (CH2CH2O)r-, b (CH2CH2O)rC(O)NR (CH2CH2O)r-CH2і b b (CH2CH2O)rC(O)NR (CH2)r-; де R являє собою Н, С,-С6-алкіл, феніл або бензил; і r незалежно являє собою ціле число у діапазоні від 1 до 10. 206. Сполука кон'югата антитіло-лікарський засіб за п. 204, де W w являє собою валін-цитрулін. 207. Сполука кон'югата антитіло-лікарський засіб 17 за п. 204, де R являє собою (СН2)5 або (СН2)2. 208. Сполука кон'югата антитіло-лікарський засіб за п. 204 з формулою: O O N Ab R17 C D S O p . 209. Сполука кон'югата антитіло-лікарський засіб 17 за п. 208, де R являє собою (СН2)5 або (СН2)2. 210. Сполука кон'югата антитіло-лікарський засіб за п. 204 з формулою: O O O O N Ab S O H N N H O D O N H p HN O 211. Сполука кон'югата антитіло-лікарський засіб за п. 202, де L являє собою SMCC, SPP або ВМРЕО. NH2 . 212. Сполука кон'югата антитіло-лікарський засіб за п. 202, де D являє собою ММАЕ, зі структурою: 15 95958 O H N N O O N O де хвиляста лінія вказує ділянку зв'язування з лінкером L. 214. Сполука кон'югата антитіло-лікарський засіб за п. 202, де D являє собою DM1, зі структурою: CH2CH2S N Cl O O N O O O OH , де хвиляста лінія вказує ділянку зв'язування з лінкером L. 215. Сполука кон'югата антитіло-лікарський засіб за п. 201, де вихідне антитіло до CD22 вибране з моноклонального антитіла, біспецифічного антитіла, химерного антитіла, антитіла людини, гуманізованого антитіла і фрагмента антитіла. 216. Сполука кон'югата антитіло-лікарський засіб за п. 201, де фрагмент антитіла являє собою фрагмент Fab. 217. Сполука кон'югата антитіло-лікарський засіб, вибрана зі структур: O O H3 C H N N O H3C O O O O O , 213. Сполука кон'югата антитіло-лікарський засіб за п. 202, де D являє собою MMAF, зі структурою: де хвиляста лінія вказує ділянку зв'язування з лінкером L. H N OH H N N N O N 16 DM1 CH3O O CH3O Ab HO N O H , O S H N O O O N N N O Val-Cit- N H O O H N N O O O O O OH p Ab-MC-vc-PAB-MMAF Ab O S H N O O O N O Val-Cit- N H N O O N H N N O O O , OH O p Ab-MC-vc-PAB-MMAE , 17 Ab S 95958 18 O O N O H N N N O O H N N O O O OH O p Ab-MC-MMAE Ab S , O O N O H N N N O O H N N O O O O O p OH Ab-MC-MMAF , O O O N O n S N Ab p O O H3 C O CH2 CH2S N O Cl O H3 C N O O CH3O O CH3O HO N O H де Val являє собою валін; Cit являє собою цитрулін; р являє собою 1, 2, 3 або 4; і Аb являє собою антитіло до CD22 за п. 186. 218. Кон'югат антитіло-лікарський засіб за п. 201, де ауристатин являє собою ММАЕ або MMAF. 219. Кон'югат антитіло-лікарський засіб за п. 202, де L являє собою MC-val-cit-PAB або МС. 220. Аналіз для детектування В-клітин, що включає (a) вплив на клітини сполуки кон'югата антитілолікарський засіб за п. 199 і (b) визначення ступеня зв'язування сполуки кон'югата антитіло-лікарський засіб з клітинами. 221. Спосіб інгібування клітинної проліферації, що включає обробку злоякісних В-клітин ссавців у середовищі для культивування клітин зі сполукою кон'югата антитіло-лікарський засіб за п. 201, внаслідок чого проліферація злоякісних В-клітин інгібується. Ab-BMPEO-DM1 , 222. Фармацевтичний препарат, що містить кон'югат антитіло-лікарський засіб за п. 201 і фармацевтично прийнятний розріджувач, носій або ексципієнт. 223. Спосіб лікування злоякісної пухлини, що включає введення пацієнту фармацевтичного препарату за п. 222. 224. Спосіб за п. 223, де злоякісна пухлина вибрана з групи, що складається з лімфоми, неходжкінської лімфоми (NHL), агресивної NHL, рецидивуючої агресивної NHL, рецидивуючої повільно зростаючої NHL, рефракторної NHL, рефракторної повільно зростаючої NHL, хронічного лімфолейкозу (CLL), дрібноклітинної лімфоми, лейкозу, волосатоклітинного лейкозу (HCL), гострого лімфоцитарного лейкозу (ALL) і лімфоми мантійних клітин. 225. Спосіб за п. 223, де пацієнту вводять цитотоксичний засіб у поєднанні зі сполукою кон'югата антитіло-лікарський засіб. 226. Промисловий виріб, що містить 19 95958 20 - фармацевтичний препарат за п. 220; - контейнер і - вкладиш в упаковку або ярлик, який вказує, що сполуку можна використовувати для лікування злоякісної пухлини, що характеризується надекспресією поліпептиду CD22. 227. Промисловий виріб за п. 226, де злоякісна пухлина вибрана з групи, що складається з лімфоми, неходжкінської лімфоми (NHL), агресивної NHL, рецидивуючої агресивної NHL, рецидивуючої повільно зростаючої NHL, рефракторної NHL, рефракторної повільно зростаючої NHL, хронічного лімфолейкозу (CLL), дрібноклітинної лімфоми, лейкозу, волосатоклітинного лейкозу (HCL), гострого лімфоцитарного лейкозу (ALL) і лімфоми мантійних клітин. 228. Спосіб одержання сполуки кон'югата антитіло-лікарський засіб, що містить антитіло до CD22 (Аb) за п. 186 і ауристатин або молекулу майтанзиноїдного лікарського засобу (D), де антитіло через одну або декілька одержаних внаслідок конструювання амінокислот цистеїну за допомогою лінкерної групи (L) зв'язане з D; де сполука має формулу І: Ab-(L-D)p, I де р являє собою 1, 2, 3 або 4; де спосіб включає в себе стадії: (a) реакції одержаної внаслідок конструювання групи цистеїну антитіла з лінкерним реагентом з утворенням проміжного продукту антитіло-лінкер Ab-L; і (b) реакції Ab-L з активованою молекулою лікарського засобу D; внаслідок чого утворюється кон'югат антитіло-лікарський засіб; або де спосіб включає стадії: (c) реакції нуклеофільної групи молекули лікарського засобу з лінкерним реагентом з утворенням проміжної сполуки лікарський засіб-лінкер D-L; і (d) реакції D-L з одержаною внаслідок конструювання групою цистеїну антитіла; внаслідок чого утворюється кон'югат антитіло-лікарський засіб. 229. Спосіб за п. 228, що додатково включає стадію експресії антитіла у клітинах яєчника китайського хом'ячка (СНО). 230. Спосіб за п. 229, що додатково включає стадію обробки експресованого антитіла відновником. 231. Спосіб за п. 230, де відновник вибраний з ТСЕР і DTT. 232. Спосіб за п. 230, що додатково включає стадію обробки експресованого антитіла окисником після обробки відновником. 233. Спосіб за п. 232, де окисник вибраний з сульфату міді, дегідроаскорбінової кислоти і повітря. 234. Антитіло за п. 186, де антитіло містить послідовність важкого ланцюга, вибрану з будь-якої однієї з SEQ ID NО:88, 92 або 93. 235. Антитіло за п. 186, де антитіло містить послідовність легкого ланцюга, вибрану з SEQ ID NО:87 або 91. 236. Антитіло за п. 186, де антитіло містить послідовність легкого ланцюга SEQ ID NО:87 і послідовність важкого ланцюга SEQ ID NO:92. 237. Антитіло за п. 186, де антитіло містить послідовність легкого ланцюга SEQ ID NО:87 і послідовність важкого ланцюга SEQ ID NО:93. 238. Антитіло за п. 186, де антитіло містить послідовність легкого ланцюга SEQ ID NО:91 і послідовність важкого ланцюга SEQ ID NO:88. Дана заявка являє собою непопередню заявку, подану відповідно до 37 CFR розділ 1.53(b), за якою заявляється про пріоритет відповідно до 35 USC розділ 119(е) попередніх заявок США з серійними номерами 60/809328, поданої 30 травня 2006 року, 60/908941, поданої 29 березня 2007 року, і 60/911829, поданої 13 квітня 2007 року, повний зміст яких, таким чином, наведений в описі як посилання у повному обсязі. Галузь винаходу Даний винахід стосується антитіл до CD22 та їх імунокон’югатів. Винахід, крім того, стосується способів застосування антитіл до CD22 та їх імунокон’югатів. Передумови винаходу Лімфоцити являють собою один з багатьох типів лейкоцитів, що утворюються у кістковому мозку у процесі гемопоезу. Існують дві популяції лімфоцитів: В-лімфоцити (В-клітини) і Т-лімфоцити (Тклітини). У даній заявці лімфоцитами, що представляють особливий інтерес, є В-клітини. В-клітини дозрівають у кістковому мозку і залишають кістковий мозок, експресуючи на своїй поверхні антигензв’язувальне антитіло. Коли наївна В-клітина вперше зустрічає антиген, до якого специфічне її зв'язане з мембраною антитіло, клітина починає швидко ділитися і її потомство ди ференціюється у В-клітини пам'яті і ефекторні клітини, які називають "плазматичні клітини". Вклітини пам'яті мають більш довгу тривалість життя і продовжують експресувати зв'язане з мембраною антитіло з тією ж специфічністю, що і вихідна батьківська клітина. Плазматичні клітини не продукують зв'язане з мембраною антитіло, але замість цього продукують антитіло у формі, яку можна секретувати. Антитіла, що секретуються, є основними ефекторними молекулами гуморального імунітету. Пов'язані з В-клітинами порушення включають, як необмежувальні приклади, злоякісну лімфому (неходжкінська лімфома, NHL), множинну мієлому і хронічний лімфолейкоз (CLL, В-клітинний лейкоз (CD5+ В-лімфоцити)). Неходжкінські лімфоми (NHL), гетерогенна група злоякісних пухлин, що переважно виникають з В-лімфоцитів, являють собою приблизно 4% всіх знову діагностованих злоякісних пухлин (Jemal, А. et al., CA-Cancer J. Clin., 52: 23-47, (2002)). Агресивна NHL включає приблизно 30-40% дорослих NHL (Harris, N.L. et al., Hematol. J. 1: 53-66 (2001)) і включає дифузну великоклітинну В-клітинну лімфому (DLBCL), лімфому мантійних клітин (MCL), лімфому периферичних Т-клітин і анапластичну великоклітинну лімфому. Передова сукупна хіміотерапія виліковує 21 менш ніж половину пацієнтів з агресивною NHL, і більшість пацієнтів, зрештою, помирає від цього захворювання (Fisher, R.I. Semin. Oncol. 27(suppl. 12): 2-8 (2000)). Пов'язані з В-клітинами порушення також включають аутоімунні захворювання. Аутоімунні захворювання залишаються клінічно важливими захворюваннями у людей. Як видно з назви, аутоімунні захворювання впливають за допомогою власної імунної системи організму. Хоча у конкретних типів аутоімунних захворювань патологічні механізми відрізняються, один з основних механізмів включає зв’язування визначених антитіл (які називають у даному документі як аутореактивні антитіла або аутоантитіла) з ендогенними білками організму. Лікарі і вчені ідентифікували більше 70 клінічно визначених аутоімунних захворювань, включаючи ревматоїдний артрит, розсіяний склероз, васкуліт, імуноопосередкований діабет і вовчак, такий як системний червоний вовчак. Хоча багато аутоімунних захворюваньє рідкими - уражуючи менше 200000 індивідуумів - загалом ці захворювання уражують мільйони американців, приблизно п'ять процентів населення, де більшість захворювань непропорційно уражує жінок. Хронічний характер цих захворювань приводить до величезного соціального і фінансового навантаження. Цитотоксичні засоби, націлені на поверхневі антигени В-клітин, являють собою важливий фокус лікування пов'язаної з В-клітинами злоякісної пухлини. Один такий поверхневий антиген В-клітин являє собою CD20. Першим терапевтичним антитілом, схваленим United States Food and Drug Administration для лікування рецидивуючої або стійкої низькодиференційованої або фолікулярної NHL, був ритуксимаб (ритуксан; Genentech, Inc. (South San Francisco, CA) та IDEC Pharmaceutical Corp. (San Diego, CA)), химерне (миша/людина) моноклональне антитіло до CD20 (Leonard, J.P. et al., Clin. Cane. Res. 10: 5327-5334 (2004)). Інші В-клітинні антигени, такі як CD19, CD22 і CD52, представляють мішені терапевтичного потенціалу для лікування лімфоми (Grillo-Lopez A.J. et al., Curr. Pharm. Biotechnol., 2: 301-11, (2001)). CD22 являє собою 135 кДа рестриктований Вклітинами сіалоглікопротеїн, що експресується тільки на поверхні В-клітин на пізніх стадіях диференціювання (Dorken, В. et al., J. Immunol. 136: 4470-4479 (1986)). Переважаючою формою CD22 у людей є CD22-бета, який містить у позаклітинному домені сім доменів імуноглобулінового суперсімейства (Фіг. 1) (Wilson, G.L. et al., J. Exp. Med. 173: 137-146 (1991)). У іншої форми, CD22-альфа, відсутні домени імуноглобулінового суперсімейства 3 і 4 (Stamenkovic, I. and Seed, В., Nature 345: 74-77 (1990)). Показано, що зв’язування лігандів з CD22 людини асоційоване з доменами імуноглобулінового суперсімейства 1 і 2 (що також позначаються як епітопи 1 і 2) (Engel, Р. et al., J. Exp. Med. 181: 1581-1586, 1995). При В-клітинній NHL експресія CD22 знаходиться у діапазоні від 91% до 99% в агресивній і повільно зростаючій популяціях, відповідно (Cesano, А. et al., Blood 100: 350a (2002)). CD22 95958 22 може функціонувати як компонент активаційного комплексу В-клітини (Sato, S. et al., Semin. Immunol. 10: 287-296 (1998)) і як молекула адгезії (Engel, Pl et al., J. Immunol. 150:4719-4732 (1993)). В-клітини мишей з відсутністю CD22 мають більш коротку тривалість життя і посилений апоптоз, що свідчить про ключову роль цього антигену у життєздатності В-клітин (Otipoby, K.L. et al., Nature (Lond) 384: 634-637 (1996)). Після зв’язування з її природним лігандом(ами) або антитілами CD22 швидко інтерналізується, забезпечуючи потужний костимулюючий сигнал у первинних В-клітинах і проапоптотичні сигнали у неопластичних Вклітинах (Sato, S. et al., Immunity 5: 551-562 (1996)). Антитіла до CD22 досліджували як потенційні лікарські засоби для В-клітинних злоякісних пухлин та інших В-клітинних проліферативних захворювань. Такі антитіла до CD22 включають RFB4 (Mansfield, Е. et al., Blood 90: 2020-2026 (1997)), CMC-544 (DiJoseph, J.F., Blood 103: 1807-1814 (2004)) і LL2 (Pawlak-Byczkowska, E.J. et al., Cancer Res. 49: 4568-4577 (1989)). Антитіло LL2 (яке раніше називали HPB-2) являє собою моноклональне антитіло IgG2a миші, направлене до антигену CD22 (Pawlak-Byczkowska, E.J. et al., (1989), вище). Імуногістохімічні аналізи in vitro продемонстрували реактивність антитіла LL2 стосовно 50 з 51 зразка, що тестуються, В-клітинної NHL, але не стосовно інших злоякісних пухлин або нормальних лімфоїдних тканин (Pawlak-Byczkowska (1989), вище; Stein, R. et al., Cancer Immunol. Immunother. 37: 293-298 (1993)). Застосування кон’югатів антитіло-лікарський засіб для локальної доставки цитотоксичних або цитостатичних засобів, тобто лікарських засобів для знищення або інгібування пухлинних клітин при лікуванні злоякісної пухлини (Syrigos and Epenetos (1999) Anticancer Research 19:605-614; Niculescu-Duvaz and Springer (1997) Adv. Drg Del. Rev. 26: 151-172; патент США 4975278), забезпечує направлену доставку молекули лікарського засобу до пухлин і накопичення всередині них, коли системне введення цих некон’югованих лікарських засобів може приводити до неприйнятних рівнів токсичності для нормальних клітин, також як і для пухлинних клітин, які необхідно усунути (Baldwin et al., (1986) Lancet pp. (Mar. 15, 1986): 603-05; Thorpe, (1985) "Antibody Carriers Of Cytotoxic Agents In Cancer Therapy: А Review", у Monoclonal Antibodies '84: Biological And Clinical Applications, A. Pinchera et al., (ed.), pp. 475-506). Таким чином досягають максимальної ефективності з мінімальною токсичністю. Як про придатні при цих стратегіях повідомлялося і про поліклональні антитіла, і про моноклональні антитіла (Rowland et al., (1986) Cancer Immunol. Immunother., 21: 18387). Лікарські засоби, що застосовуються у цих способах, включають дауноміцин, доксорубіцин, метотрексат і віндезин (Rowland et al., Cancer Immunol. Immunother. 21: 183-87 (1986)). Токсини, що застосовуються у кон’югатах антитіло-токсин, включають бактеріальні токсини, такі як дифтерійний токсин, рослинні токсини, такі як рицин, низькомолекулярні токсини, такі як гелданаміцин (Kerr et al., (1997) Bioconjugate Chem. 8(6): 781-784; 23 Mandler et al., (2000) Journal of the Nat. Cancer Inst. 92(19): 1573-1581; Mandler et al., (2000) Bioorganic & Med. Chem. Letters 10: 1025-1028; Mandler et al., (2002) Bioconjugate Chem. 13: 786-791), майтанзиноїди (EP 1391213; Liu et al., (1996) Proc. Natl. Acad. Sci. USA 93: 8618-8623) і каліхіміцин (Lode et al., (1998) Cancer Res. 58: 2928; Hinman et al., (1993) Cancer Res. 53: 3336-3342). Токсини можуть здійснювати свою цитотоксичну і цитостатичну дію за допомогою механізмів, що включають зв’язування тубуліну, зв’язування ДНК або інгібування топоізомерази (Meyer, D.L. and Senter, P.D. "Recent Advances in Antibody Drug Conjugates for Cancer Therapy" в Annual Reports in Medicinal Chemistry, Vol. 38 (2003) Chapter 23, 229-237). Деякі цитотоксичні лікарські засоби при кон’югації з великими антитілами або білковими лігандами рецепторів мають тенденцію ставати неактивними або менш активними. ZEVALIN (зевалін) (ібритумомаб тіуксетан, Biogen/Idec) являє собою кон’югат антитілорадіоактивний ізотоп, що складається з моноклонального антитіла IgG1 каппа миші, направленого до антигену CD20, що знаходиться на поверхні нормальних і злоякісних В-лімфоцитів, і радіоакти111 90 вного ізотопу In або Y, зв'язаного за допомогою тіосечовинного лінкера-хелатора (Wiseman et al., (2000) Eur. Jour. Nucl. Med. 27(7): 766-77; Wiseman et al., (2002) Blood 99(12): 4336-42; Witzig et al., (2002) J. Clin. Oncol. 20(10): 2453-63; Witzig et al., (2002) J. Clin. Oncol. 20(15): 3262-69). Хоча зевалін має активність проти В-клітинної неходжкінської лімфоми (NHL), введення у більшості пацієнтів приводить до тяжких і тривалих цитопеній. У 2000 році для лікування гострого мієлолейкозу за допомогою ін'єкції схвалений MYLOTARG (мілотарг) (гемтузумаб озогаміцин, Wyeth Pharmaceuticals), кон’югат антитіло-лікарський засіб, що складається з антитіла CD33 людини, зв'язаного з каліхіміцином (Drugs of the Future (2000) 25(7):686; патенти США № 4970198; 5079233; 5585089; 5606040; 5693762; 5739116; 5767285; 5773001). Для лікування злоякісних пухлин, які експресують антиген CanAg, таких як злоякісна пухлина товстого кишечнику, підшлункової залози, шлунку та інших, розроблений кантузумаб мертанзин (Immunogen, Inc.), кон’югат антитілолікарський засіб, що складається з антитіла huC242, зв'язаного за допомогою дисульфідного лінкера SPP з молекулою майтанзиноїдного лікарського засобу, DM1. У розробці для потенційного лікування пухлин передміхурової залози знаходиться MLN-2704 (Millennium Pharm., BZL Biologies, Immunogen Inc.), кон’югат антитілолікарський засіб, що складається з моноклонального антитіла до специфічного мембранного антигену простати (PSMA), зв'язаного з молекулою майтанзиноїдного лікарського засобу, DM1. Ту ж молекулу майтанзиноїдного лікарського засобу, DM1, за допомогою недисульфідного лінкера, SMCC, зв'язали з моноклональним антитілом миші, TA.1 (Chari et al., (1992) Cancer Research 52: 127-131). Повідомлялося, що цей кон’югат у 200 разів менш ефективний, ніж відповідний кон’югат з дисульфідним лінкером. У наведеному документі є 95958 24 припущення, що лінкер SMCC був "нерозщеплюваним". З морського молюска, Dolabella auricularia, виділено декілька коротких пептидних сполук і виявлено, що вони мають біологічну активність (Pettit et al., (1993) Tetrahedron 49: 9151; Nakamura et al., (1995) Tetrahedron Letters 36: 5059-5062; Sone et al., (1995) Journal Org. Chem. 60: 4474). Також одержані аналоги цих сполук і для деяких з них виявлено, що вони мають біологічну активність (для ознайомлення, див. Pettit et al., (1998) Anti-Cancer Drug Design 13: 243-277). Наприклад, ауристатин Е (US 5635483) являє собою синтетичний аналог природного морського продукту доластатину 10, засобу, що інгібує полімеризацію тубуліну за допомогою зв’язування тієї ж ділянки на тубуліні, що і протираковий лікарський засіб вінкристин (G.R. Pettit, (1997) Prog. Chem. Org. Nat. Prod. 70: 1-79). Доластатин 10, ауристатин PE і ауристатин Е являють собою лінійні пептиди з чотирьох амінокислот, три з яких є унікальними для сполук класу доластатину, і С-кінцевий амід. Ауристатинові пептиди, ауристатин Е (AE) і монометилауристатин (MMAE), синтетичні аналоги доластатину, кон’югували з (i) химерними моноклональними антитілами cBR96 (специфічними до антигенів Lewis Y на карциномах); (ii) cAC10, специфічним до CD30 на злоякісних новоутвореннях гематологічного походження (Klussman, et al. (2004), Bioconjugate Chemistry 15(4): 765-773; Doronina et al. (2003) Nature Biotechnology 21(7): 778-784; "Monometylvaline Compounds Capable of Conjugation to Ligands"; Francisco et al. (2003) Blood 102(4): 1458-1465; US 2004/0018194); (iii) антитілами до CD20, такими як Rituxan (ритуксан, ритуксимаб) (WO 04/032828), для лікування таких, що експресують CD20, злоякісних пухлин та імунних порушень; (iv) антитілами до EphB2 2H9 і антитілами до IL-8 для лікування колоректального раку (Mao, et al. (2004) Cancer Research 64(3):781788); (v) антитілом до Е-селектину (Bhaskar et al. (2003) Cancer Res. 63: 6387-6394) та (vi) іншими антитілами до CD30 (WO 03/043583). Монометилауристатин (MMAE) також кон’югували з 2H9, антитілом до EphB2R, який являє собою т/м тирозинкіназний рецептор 1 типу з великою гомологією у миші і людини, і який надекспресований у клітинах колоректального раку (Mao et al. (2004) Cancer Res. 64: 781-788). Монометилауристатин MMAF, варіант ауристатину Е (MMAE) з фенілаланіном на С-кінці (патент США № 5767237; патент США № 6124431), є менш сильнодіючим, ніж MMAE, але більш сильнодіючим при кон’югації з моноклональними антитілами (Senter et al., Proceedings of the American Association for Cancer Research, Volume 45, реферат номер 623, представлений 28 березня 2004 року). Ауристатин F фенілендіамін (AFP); варіант MMAE з фенілаланіном з'єднували з mAb до CD70, 1F6, за допомогою С-кінця 1F6 через фенілендіаміновий спейсер (Law et al., Proceedings of the American Association for Cancer Research, Volume 45, реферат номер 625, представлений 28 березня 2004 року). Як можливі терапевтичні сполуки також дослі 25 джували кон’югати антитіло до CD22-токсину. Наприклад, у попередніх публікаціях як протиракові засоби описані імунотоксини, що містять ланцюг рицину А, направлені до анти-CD22 (May, R.D. et al., Chemical Abstracts 106(21): 168656x pages 3536 (1987); Ghetie, M.A. et al., Cancer Research 48: 2610-2617 (1988); і Amlot, P.L. et al., Blood 82(9):2624-2633 (1993)). У випадку, якщо токсин являв собою радіоактивний ізотоп, для епратузумабу, гуманізованої версії (прищеплена на CDR) IgG1 LL2, показана наявність терапевтичної активності радіоімунокон’югату (Juweid, M.E. et al., Clin. Cancer Res. 5 (Suppl 10): 3292s-3303s (1999); Griffiths, G.L. et al., J. Nucl. Med. 44: 77-84 (2003); Linden, О. et al., Clin. Cancer Res. 5(suppl 10): 3287s-3291s (1999)). У даній галузі існує необхідність у додаткових лікарських засобах для лікування різних пов'язаних з В-клітинами злоякісних пухлин, таких як лімфоми, така як неходжкінська лімфома та інші Вклітинні проліферативні порушення. Особливо придатні для даної мети лікарські засоби включають направлені до В-клітин проти CD22 кон’югати антитіло-лікарський засіб, що мають значно меншу токсичність, при прийнятній терапевтичній ефективності. Даний винахід стосується цих та інших обмежень і проблем минулого. Наведення у даній заявці будь-якого посилання не є визнанням того, що посилання стосується відомого рівня техніки для даної заявки. Всі посилання, що цитуються у даному документі, включаючи патенти, патентні заявки і публікації, у повному обсязі включені як посилання. Суть винаходу Винахід стосується антитіл до CD22 і способів їх використання. В одному з аспектів надане антитіло, що зв'язується з CD22, де антитіло містить щонайменше одну, дві, три, чотири, п'ять або шість HVR, вибраних з (1) HVR-H1, що містить амінокислотну послідовність SEQ ID NO:2; (2) HVR-H2, що містить амінокислотну послідовність SEQ ID NO:4; (3) HVR-H3, що містить амінокислотну послідовність SEQ ID NO:6; (4) HVR-L1, що містить амінокислотну послідовність SEQ ID NO:10; (5) HVR-L2, що містить амінокислотну послідовність SEQ ID NO:12; і (6) HVR-L3, що містить амінокислотну послідовність SEQ ID NO:14. В іншому аспекті антитіло, що зв'язується з CD22, містить (a) HVR-L1, що містить амінокислотну послідовність SEQ ID NO:10, і (b) щонайменше одну, дві, три, чотири або п'ять HVR, вибраних з (1) HVR-H1, що містить амінокислотну послідовність SEQ ID NO:2; (2) HVR-H2, що містить амінокислотну послідовність SEQ ID NO:4; (3) HVR-H3, що містить амінокислотну послідовність SEQ ID NO:6; (4) HVR-L2, що містить амінокислотну послідовність SEQ ID NO:12; і (6) HVR-L3, що містить амінокислотну послідо 95958 26 вність SEQ ID NO:14. В іншому аспекті антитіло, що зв'язується з CD22, містить (a) HVR-L1, що містить амінокислотну послідовність SEQ ID NO:9, і (b) щонайменше одну, дві, три, чотири або п'ять HVR, вибраних з (1) HVR-H1, що містить амінокислотну послідовність SEQ ID NO:2; (2) HVR-H2, що містить амінокислотну послідовність SEQ ID NO:4; (3) HVR-H3, що містить амінокислотну послідовність SEQ ID NO:6; (4) HVR-L2, що містить амінокислотну послідовність SEQ ID NO:12; і (6) HVR-L3, що містить амінокислотну послідовність SEQ ID NO:14. В іншому аспекті антитіло, що зв'язується з CD22, містить (a) HVR-H3, що містить амінокислотну послідовність SEQ ID NO:6, і (b) щонайменше одну, дві, три, чотири або п'ять HVR, вибраних з (1) HVR-H1, що містить амінокислотну послідовність SEQ ID NO:2; (2) HVR-H2, що містить амінокислотну послідовність SEQ ID NO:4; (3) HVR-L1, що містить амінокислотну послідовність SEQ ID NO:9; (4) HVR-L2, що містить амінокислотну послідовність SEQ ID NO:12; і (5) HVR-L3, що містить амінокислотну послідовність SEQ ID NO:14. В іншому аспекті антитіло, що зв'язується з CD22, містить (a) HVR-H3, що містить амінокислотну послідовність SEQ ID NO:6, і (b) щонайменше одну, дві, три, чотири або п'ять HVR, вибраних з (1) HVR-H1, що містить амінокислотну послідовність SEQ ID NO:2; (2) HVR-H2, що містить амінокислотну послідовність SEQ ID NO:4; (3) HVR-L1, що містить амінокислотну послідовність SEQ ID NO:10; (4) HVR-L2, що містить амінокислотну послідовність SEQ ID NO:12; і (5) HVR-L3, що містить амінокислотну послідовність SEQ ID NO:14. В одному з варіантів здійснення антитіло містить HVR-L1, що містить амінокислотну послідовність SEQ ID NO:10. В одному з варіантів здійснення антитіло додатково містить HVR-H1, що містить амінокислотну послідовність SEQ ID NO:2, і HVR-H2, що містить амінокислотну послідовність SEQ ID NO:4. В одному з варіантів здійснення антитіло додатково містить HVR-L2, що містить амінокислотну послідовність SEQ ID NO:12, і HVR-L3, що містить амінокислотну послідовність SEQ ID NO:14. У визначених варіантах здійснення будь-яке з вказаних вище антитіл додатково містить щонайменше один каркас, вибраний з консенсусного каркасу підгрупи III VH і консенсусного каркасу підгрупи I VL. В одному з аспектів надане антитіло, що зв'язується з CD22, де антитіло містить варіабельний домен важкого ланцюга з послідовністю щонайменше на 90% щонайменше на 91% щонайменше на 92% щонайменше на 93% щонайменше на 94% щонайменше на 95% щонайменше на 96% що 27 найменше на 97% щонайменше на 98% або щонайменше на 99% ідентичною амінокислотній послідовності SEQ ID NO:16. В одному з варіантів здійснення антитіло містить варіабельний домен важкого ланцюга SEQ ID NO:16. В одному з аспектів антитіло додатково містить варіабельний домен легкого ланцюга з послідовністю щонайменше на 90% щонайменше на 91% щонайменше на 92% щонайменше на 93% щонайменше на 94% щонайменше на 95% щонайменше на 96% щонайменше на 97% щонайменше на 98% або щонайменшена 99% ідентичною амінокислотній послідовності SEQ ID NO:17. В одному з варіантів здійснення антитіло містить варіабельний домен легкого ланцюга SEQ ID NO:17. В одному з аспектів антитіло додатково містить варіабельний домен легкого ланцюга з послідовністю щонайменше на 90% щонайменше на 91% щонайменше на 92% щонайменше на 93% щонайменше на 94% щонайменше на 95% щонайменше на 96% щонайменше на 97% щонайменше на 98% або щонайменше на 99% ідентичною амінокислотній послідовності SEQ ID NO:18. В одному з варіантів здійснення антитіло містить варіабельний домен легкого ланцюга SEQ ID NO:18. В одному з варіантів здійснення антитіло містить варіабельний домен важкого ланцюга з послідовністю щонайменше на 90% щонайменше на 91% щонайменше на 92% щонайменше на 93% щонайменше на 94% щонайменше на 95% щонайменше на 96% щонайменше на 97% щонайменше на 98% щонайменше на 99% або на 100% ідентичною амінокислотній послідовності SEQ ID NO:16 і варіабельний домен легкого ланцюга з послідовністю щонайменше на 90% щонайменше на 91% щонайменше на 92% щонайменше на 93% щонайменше на 94% щонайменше на 95% щонайменше на 96% щонайменше на 97% щонайменше на 98% щонайменше на 99% або на 100% ідентичною амінокислотній послідовності SEQ ID NO:17. В одному з варіантів здійснення антитіло містить варіабельний домен важкого ланцюга з послідовністю щонайменше на 90% щонайменше на 91% щонайменше на 92% щонайменше на 93% щонайменше на 94% щонайменше на 95% щонайменше на 96% щонайменше на 97% щонайменше на 98% щонайменше на 99% або на 100% ідентичною амінокислотній послідовності SEQ ID NO:16 і варіабельний домен легкого ланцюга з послідовністю щонайменше на 90% щонайменше на 91% щонайменше на 92% щонайменше на 93% щонайменше на 94% щонайменше на 95% щонайменше на 96% щонайменше на 97% щонайменше на 98% щонайменше на 99% або на 100% ідентичною амінокислотній послідовності SEQ ID NO:18. В одному з варіантів здійснення варіабельний домен важкого ланцюга містить амінокислотну послідовність SEQ ID NO:16, а варіабельний домен легкого ланцюга містить амінокислотну послідовність SEQ ID NO:17. В одному з варіантів здійснення варіабельний домен важкого ланцюга містить амінокислотну послідовність SEQ ID NO:16, а варіабельний домен легкого ланцюга 95958 28 містить амінокислотну послідовність SEQ ID NO:18. У визначених варіантах здійснення наданий полінуклеотид, що кодує будь-яке з вказаних вище антитіл. В одному з варіантів здійснення наданий вектор, що містить полінуклеотид. В одному з варіантів здійснення надана клітина-хазяїн, що містить вектор. В одному з варіантів здійснення клітина-хазяїн є еукаріотичною. В одному з варіантів здійснення клітина-хазяїн являє собою клітину яєчника китайського хом'яка (CHO). В одному з варіантів здійснення наданий спосіб одержання антитіла до CD22, де спосіб включає культивування клітини-хазяїна в умовах, придатних для експресії полінуклеотиду, що кодує антитіло, і виділення антитіла. В одному з аспектів надане антитіло, яке зв'язується з CD22, що експресується на поверхні клітини. В одному з варіантів здійснення антитіло зв'язується з епітопом в області CD22 людини або миші, що містить домен 1 або домен 2, або домени 1 і 2. В одному з варіантів здійснення клітина являє собою клітину ссавця. В одному з варіантів здійснення клітина являє собою клітину людини. В одному з варіантів здійснення клітина являє собою злоякісну клітину. В одному з варіантів здійснення клітина являє собою В-клітину. В одному з варіантів здійснення злоякісна клітина являє собою Вклітину. У визначених варіантах здійснення будь-яке з вказаних вище антитіл являє собою моноклональне антитіло. В одному з варіантів здійснення антитіло являє собою фрагмент антитіла, вибраний з фрагментів Fab, Fab'-SH, Fv, scFv або (Fab')2. В одному з варіантів здійснення антитіло є гуманізованим. В одному з варіантів здійснення антитіло являє собою антитіло людини. В одному з аспектів наданий спосіб виявлення присутності CD22 у біологічному зразку, де спосіб включає приведення біологічного зразка у контакт з будь-яким з вказаних вище антитіл в умовах, що дозволяють зв’язування антитіла з CD22, і виявлення того, чи утворився комплекс між антитілом і CD22. В одному з варіантів здійснення біологічний зразок містить В-клітини. В одному з варіантів здійснення біологічний зразок одержаний у ссавця з В-клітинним порушенням і/або з В-клітинним проліферативним порушенням, включаючи як необмежувальні приклади лімфому, неходжкінську лімфому (NHL), агресивну NHL, рецидивуючу агресивну NHL, рецидивуючу повільно зростаючу NHL, рефракторну NHL, рефракторну повільно зростаючу NHL, хронічний лімфолейкоз (CLL), дрібноклітинну лімфому, лейкоз, волосатоклітинний лейкоз (HCL), гострий лімфоцитарний лейкоз (ALL) і лімфому мантійних клітин, або у ссавця з підозрою на це порушення. В одному з аспектів наданий спосіб діагностики клітинного проліферативного порушення, асоційованого зі збільшеною експресією CD22, де спосіб включає приведення клітини, що тестується, у контакт з будь-яким з вказаних вище антитіл; визначення рівня експресії CD22 за допомогою визначення зв’язування антитіла з CD22; і порівняння рівня експресії CD22 клітиною, що тестується, з 29 рівнем експресії CD22 контрольною клітиною, де більш високий рівень експресії CD22 клітиною, що тестується, у порівнянні з контрольною клітиною вказує на наявність клітинного проліферативного порушення, асоційованого зі збільшеною експресією CD22. В одному з варіантів здійснення клітина, що тестується, являє собою клітину пацієнта з підозрою на наявність клітинного проліферативного порушення, такого як В-клітинне проліферативне порушення. В одному з варіантів здійснення клітинне проліферативне порушення вибране з Вклітинних порушень, що включають як необмежувальні приклади лімфому, неходжкінську лімфому (NHL), агресивну NHL, рецидивуючу агресивну NHL, рецидивуючу повільно зростаючу NHL, рефракторну NHL, рефракторну повільно зростаючу NHL, хронічний лімфолейкоз (CLL), дрібноклітинну лімфому, лейкоз, волосатоклітинний лейкоз (HCL), гострий лімфоцитарний лейкоз (ALL) і лімфому мантійних клітин. В одному з варіантів здійснення спосіб включає визначення рівня експресії CD22 на поверхні клітини, що тестується, і порівняння рівня експресії CD22 на поверхні клітини, що тестується, з рівнем експресії CD22 на поверхні контрольної клітини. В одному з аспектів наданий спосіб діагностики клітинного проліферативного порушення, асоційованого зі збільшенням кількості клітин, таких як В-клітини, що експресують CD22, де спосіб включає приведення клітин, що тестуються, у біологічному зразку у контакт з будь-яким з вказаних вище антитіл; визначення рівня антитіла, зв'язаного з клітинами, що тестуються, у зразку за допомогою визначення зв’язування антитіла з CD22; і порівняння з рівнем антитіла, зв'язаного з клітинами у контрольному зразку, де рівень зв'язаного антитіла у зразку, що тестується, і контрольному зразку нормалізований на кількість клітин, що експресують CD22, і де більш високий рівень зв'язаного антитіла у зразку, що тестується, у порівнянні з контрольним зразком вказує на наявність клітинного проліферативного порушення, асоційованого з клітинами, які експресують CD22. В одному з аспектів наданий спосіб визначення розчинного CD22 у крові або сироватці, де спосіб включає приведення зразка, що тестується, крові або сироватки ссавця з підозрою на наявність В-клітинного проліферативного порушення у контакт з антитілом до CD22 за винаходом і визначення збільшення розчинного CD22 у зразку, що тестується, відносно контрольного зразка крові або сироватки нормального ссавця. У визначеному варіанті здійснення спосіб визначення придатний як спосіб діагностики В-клітинного проліферативного порушення, асоційованого зі збільшенням розчинного CD22 у крові або сироватці ссавця. В одному з аспектів антитіла за винаходом включають модифіковані цистеїном антитіла, де одна або декілька амінокислот вихідного антитіла заміщені амінокислотою вільного цистеїну, як описано у WO 2006/034488 (включеній у цей документ як посилання у повному обсязі). Так можна модифікувати, тобто піддати мутації, будь-яку форму антитіла до CD22. Наприклад, можна модифікувати вихідний Fab-фрагмент антитіла так, щоб одер 95958 30 жати модифікований цистеїном Fab, позначений у цьому документі як "ThioFab". Подібним чином можна модифікувати вихідне моноклональне антитіло з одержанням "ThioMab". Потрібно зазначити, що внаслідок димерної природи антитіла IgG одноділянкова мутація у тіофаб дає один одержаний внаслідок конструювання цистеїновий залишок, тоді як одноділянкова мутація у тіомаб дає два одержаних внаслідок конструювання цистеїнових залишки. Модифіковані цистеїном антитіла до CD22 за винаходом включають моноклональні антитіла, гуманізовані або химерні моноклональні антитіла і антигензв’язувальні фрагменти антитіл, злиті поліпептиди і аналоги, які переважно зв'язують зв'язані з клітинами поліпептиди CD22. Модифіковане цистеїном антитіло може альтернативно містити антитіло, що містить цистеїн у положенні, що описується у цьому документі, в антитілі або Fab, одержаний внаслідок конструювання послідовності і/або відбору антитіла, без обов'язкової зміни вихідного антитіла, такої як за допомогою конструювання і відбору антитіла за допомогою фагового дисплею або за допомогою конструювання каркасних послідовностей і константних областей легких ланцюгів і/або важких ланцюгів de novo. Модифіковане цистеїном антитіло містить одну або декілька амінокислот вільного цистеїну зі значенням реакційноздатності тіолових груп у діапазонах від 0,6 до 1,0; від 0,7 до 1,0 або від 0,8 до 1,0. Амінокислота вільного цистеїну являє собою залишок цистеїну, що одержаний внаслідок конструювання у вихідному антитілі і не є частиною дисульфідного містка. Модифіковані цистеїном антитіла придатні для приєднання цитотоксичних і/або візуалізуючих сполук у ділянці вбудованого цистеїну, наприклад, за допомогою малеіміду або галогенацетилу. Нуклеофільна реакційноздатність тіолової функціональної групи залишку Cys відносно малеімідної групи приблизно у 1000 разів більша, ніж у будь-якої іншої функціональної групи амінокислот у білці, такої як аміногрупа залишків лізину або N-кінцева аміногрупа. Специфічна для тіолів функціональна група в йодацетильних і малеімідних реагентах може реагувати з аміногрупами, але необхідні більш високий pH (>9,0) і більш тривалий час реакції (Garman, 1997, NonRadioactive Labelling: А Practical Approach, Academic Press, London). В одному з варіантів здійснення модифіковане цистеїном антитіло до CD22 за винаходом містить одержаний внаслідок конструювання цистеїн у будь-якому з наступних положень, де положення являє собою номер за Kabat et al. у легкому ланцюгу (див. Kabat et al., (1991) Sequences of Proteins th of Immunological Interest, 5 Ed. Public Health Service, National Institutes of Health, Bethesda, MD) і за нумерацією EU у важкому ланцюгу (включаючи Fc-область) (див. Kabat et al., (1991), вище), де константна область легкого ланцюга, позначена підкресленням на Фіг. 17A, починається у положенні 108 (нумерація Kabat), а константна область важкого ланцюга, позначена підкресленням на Фіг. 17B і 17C, починається у положенні 118 (нумерація EU). Положення також можна вказати у вигляді його положення у послідовній нумерації амінокис 31 лот повнорозмірних легкого ланцюга або важкого ланцюга, представлених на Фіг. 17A-17C. За одним з варіантів здійснення винаходу антитіло до CD22 містить одержаний внаслідок конструювання цистеїн в LC-V205C (нумерація Kabat: Val 205; послідовний номер 210 на Фіг. 17A модифікований так, щоб у цьому положенні знаходився Cys). Одержаний внаслідок конструювання цистеїн у легкому ланцюгу на Фіг. 17A показаний напівжирним шрифтом з подвійним підкресленням. За одним з варіантів здійснення антитіло до CD22 містить одержаний внаслідок конструювання цистеїн в HCA118C (номер EU: Ala 118; послідовний номер 121 на Фіг. 17B модифікований так, щоб у цьому положенні знаходився Cys). Одержаний внаслідок конструювання цистеїн у важкому ланцюгу наведений напівжирним шрифтом з подвійним підкресленням на Фіг. 17B. За одним з варіантів здійснення антитіло до CD22 містить одержаний внаслідок конструювання цистеїн Fc-S400C (номер EU: Ser 400; послідовний номер 403 на Фіг. 17C модифікований так, щоб у цьому положенні знаходився Cys). Одержаний внаслідок конструювання цистеїн у Fc-області важкого ланцюга наведений на Фіг. 17C напівжирним шрифтом з подвійним підкресленням. В інших варіантах здійснення одержаний внаслідок конструювання цистеїн важкого ланцюга (включаючи Fc-область) знаходиться у будь-якому з вказаних положень: (за нумерацією EU): 41, 88, 116, 118, 120, 171, 282, 375 або 400. Таким чином, зміни амінокислот у цих положеннях у вихідному антитілі до CD22 за винаходом являють собою: A41C, A88C, S116C, A118C, T120C, A171C, V282C, S375C або S400C. В інших варіантах здійснення одержаний внаслідок конструювання цистеїн легкого ланцюга знаходиться у будь-якому з вказаних положень (за нумерацією Kabat): 15, 43, 110, 144, 168, 205. Таким чином, зміни амінокислот у цих положеннях у вихідному антитілі до CD22 за винаходом являють собою: V15C, A43C, V110C, A144C, S168C або V205C. Модифіковане цистеїном антитіло до CD22 містить одну або декілька амінокислот вільного цистеїну, де модифіковане цистеїном антитіло до CD22 зв'язується з поліпептидом CD22 і одержане способом, що включає заміну одного або декількох амінокислотних залишків вихідного антитіла до CD22 цистеїном, де вихідне антитіло містить щонайменше одну послідовність HVR, вибрану з (a) послідовності HVR-L1 RSSQSIVHSNGNTFLE (SEQ ID NO:9) або послідовності HVR-L1 RSSQSIVHSVGNTFLE (SEQ ID NO:10) (Фіг. 2B); (b) послідовності HVR-L2 KVSNRFS SEQ ID NO:12 (Фіг. 2B); (с) послідовності HVR-L3 FQGSQFPYT (SEQ ID NO:14) (Фіг. 2B); (d) послідовності HVR-H1 GYEFSRSWMN (SEQ ID NO:2) (Фіг. 2A); (е) послідовності HVR-H2 GRIYPGDGDTNYSGKFKG (SEQ ID NO:4 (Фіг. 2A) і (f) послідовності HVR-H3 DGSSWDWYFDV (SEQ ID NO:6) (Фіг. 2A). У визначеному аспекті винахід стосується модифікованого цистеїном антитіла до CD22, що 95958 32 містить амінокислотну послідовність щонайменше приблизно з 80% ідентичністю амінокислотних послідовностей, альтернативно щонайменше приблизно з 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% або 100% ідентичністю амінокислотних послідовностей з модифікованим цистеїном антитілом з повнорозмірною амінокислотною послідовністю, як описано у цьому документі, або з амінокислотною послідовністю модифікованого цистеїном антитіла без сигнального пептиду, як описано у цьому документі. У ще одному додатковому аспекті винахід стосується виділеного модифікованого цистеїном антитіла до CD22, що містить амінокислотну послідовність, що кодується нуклеотидною послідовністю, яка гібридизується з комплементарною молекулою ДНК, що кодує (a) модифіковане цистеїном антитіло з повнорозмірною амінокислотною послідовністю, як описано у цьому документі, (b) амінокислотну послідовність модифікованого цистеїном антитіла без сигнального пептиду, як описано у цьому документі, (с) позаклітинний домен білка трансмембранного модифікованого цистеїном антитіла, з сигнальним пептидом або без нього, як описано у цьому документі, (d) амінокислотну послідовність, що кодується будь-якою з послідовностей нуклеїнової кислоти, що описуються у цьому документі, або (е) будь-який інший конкретно визначений фрагмент повнорозмірної амінокислотної послідовності модифікованого цистеїном антитіла, як описано у цьому документі. У конкретному аспекті винахід стосується виділеного модифікованого цистеїном антитіла до CD22 без N-кінцевої сигнальної послідовності і/або без ініціюючого метіоніну і кодованого нуклеотидною послідовністю, що кодує таку амінокислотну послідовність, як описано у цьому документі. Способи їх одержання також описані у цьому документі, де ці способи включають культивування клітини-хазяїна, що містить вектор, який містить відповідну кодуючу молекулу нуклеїнової кислоти, в умовах, придатних для експресії модифікованого цистеїном антитіла, і відновлення модифікованого цистеїном антитіла з клітинної культури. Інший аспект винаходу стосується виділеного модифікованого цистеїном антитіла до CD22 з видаленим трансмембранним доменом або інактивованим трансмембранним доменом. Способи їх одержання також описані у цьому документі, де ці способи включають культивування клітинихазяїна, що містить вектор, який містить відповідну кодуючу молекулу нуклеїнової кислоти, в умовах, придатних для експресії модифікованого цистеїном антитіла, і відновлення модифікованого цистеїном антитіла з клітинної культури. В інших варіантах здійснення винахід стосується виділених химерних модифікованих цистеїном антитіл до CD22, що містять будь-яке з описаних у цьому документі модифікованих цистеїном антитіл, злитих з гетерологічним (що не є CD22) поліпептидом. Приклад таких химерних молекул включає будь-яке з описаних у цьому документі модифікованих цистеїном антитіл, злите з гетерологічним поліпептидом, наприклад, таким як кінце 33 ва послідовність епітопу або Fc-область імуноглобуліну. Модифіковане цистеїном антитіло до CD22 може являти собою моноклональне антитіло, фрагмент антитіла, химерне антитіло, гуманізоване антитіло, одноланцюжкове антитіло або антитіло, яке конкурентно інгібує зв’язування антитіла до поліпептиду CD22 з його відповідним антигенним епітопом. Антитіла за даним винаходом необов'язково можуть бути кон’юговані з засобом, що інгібує ріст, або цитотоксичним засобом, таким як токсин, включаючи, наприклад, ауристатин, антибіотик, радіоактивний ізотоп, нуклеазу або т.п. Антитіла за даним винаходом необов'язково можна одержувати у клітинах CHO або бактеріальних клітинах, і вони переважно інгібують ріст або проліферацію, або індукують загибель клітини, з якою вони зв'язуються. Для діагностичних цілей антитіла за даним винаходом можна мітити міткою, що детектується, приєднувати до твердої основи або т.п. В інших варіантах здійснення даного винаходу винахід стосується векторів, які містять ДНК, що кодує будь-яке з описаних у цьому документі антитіл до CD22 і модифікованих цистеїном антитіл до CD22. Також надані клітини-хазяїни, що містять будь-який такий вектор. Як приклад клітинихазяїни можуть являти собою клітини CHO, клітини E.coli або дріжджові клітини. Додатково наданий спосіб одержання будь-якого з описаних у цьому документі поліпептидів, і він включає культивування клітин-хазяїнів в умовах, придатних для експресії описаного поліпептиду, і відновлення бажаного поліпептиду з клітинної культури. Модифіковані цистеїном антитіла можуть бути придатними при лікуванні злоякісної пухлини і вони включають антитіла, специфічні для клітинної поверхні і трансмембранних рецепторів, і пухлиноспецифічних антигенів (TAA). Такі антитіла можна використовувати у вигляді вільних антитіл (некон’югованих з лікарським засобом або молекулою-міткою) або у вигляді кон’югатів антитілолікарський засіб (ADC). Модифіковані цистеїном антитіла за винаходом можуть бути сайтспецифічно і ефективно зв'язані з реагентом, що реагує з тіолами. Реагент, що реагує з тіолами, може являти собою поліфункціональний лінкер, мітку захоплення, флуорофор або проміжну сполуку лікарський засіб-лінкер. Модифіковане цистеїном антитіло можна мітити міткою, що детектується, іммобілізувати на твердофазовій підкладці і/або кон’югувати з молекулою лікарського засобу. Реакційноздатність тіолових груп може бути загальною для будь-якого антитіла, де можна провести заміну амінокислот реакційноздатними амінокислотами цистеїну у діапазонах у легкому ланцюгу, вибраних з діапазонів амінокислот: від L-10 до L20; від L-38 до L-48; від L-105 до L-115; від L-139 до L-149; від L-163 до L-173; і у діапазонах у важкому ланцюгу, вибраних з діапазонів амінокислот: від Н-35 до Н-45; від Н-83 до Н-93; від Н-114 до Н127 і від Н-170 до Н-184, та у Fc-області у діапазонах, вибраних з діапазонів від Н-268 до Н-291; від Н-319 до Н-344; від Н-370 до Н-380 і від Н-395 до Н-405, де нумерація положень амінокислот починається у положенні 1 за системою нумерації 95958 34 Kabat (Kabat et al., (1991) Sequences of Proteins of th Immunological Interest, 5 Ed. Public Health Service, National Institutes of Health, Bethesda, MD), а потім послідовно продовжується, як описано у WO 2006034488. Реакційноздатність тіолових груп також може бути загальною для визначених доменів антитіла, таких як константний домен легкого ланцюга (CL) і константні домени важких ланцюгів, CH1, CH2 і CH3. Можна проводити заміни на цистеїн, що приводять до значень реакційноздатності тіолових груп 0,6 і вище у константних доменах , , , і важких ланцюгів вихідних антитіл: IgA, IgD, IgE, IgG і IgM, відповідно, включаючи підкласи IgG: IgG1, IgG2, IgG3, IgG4, IgA і IgA2. Такі антитіла і їх використання описані у WO 2006/034488. Модифіковані цистеїном антитіла за винаходом переважно зберігають антигензв’язувальну здатність їх варіантів вихідних антитіл дикого типу. Таким чином, модифіковані цистеїном антитіла здатні до зв’язування, переважно специфічного, з антигенами. Такі антигени включають, наприклад, пухлиноспецифічні антигени (TAA), білки рецепторів клітинної поверхні та інші молекули клітинної поверхні, трансмембранні білки, сигнальні білки, фактори, що регулюють життєздатність клітин, фактори, що регулюють клітинну проліферацію, молекули, асоційовані (наприклад, відомі або такі, що можливо функціонально сприяють) з розвитком або диференціюванням тканин, лімфокіни, цитокіни, молекули, залучені до регуляції клітинного циклу, молекули, залучені до ангіогенезу, і молекули, асоційовані (наприклад, відомі або такі, що можливо функціонально сприяють) з ангіогенезом. Пухлиноспецифічний антиген може являти собою фактор кластера диференціювання (тобто білок CD, включаючи як необмежувальні приклади CD22). Модифіковані цистеїном антитіла до CD22 за винаходом зберігають здатність зв'язувати антиген їх варіантів вихідних антитіл до CD22 дикого типу. Таким чином, модифіковані цистеїном антитіла до CD22 за винаходом здатні до зв’язування, переважно специфічного, з антигенами CD22, включаючи ізоформи анти-CD22-бета і/або -альфа людини, включаючи варіанти, коли такі антигени експресовані на поверхні клітин, включаючи як необмежувальні приклади В-клітини. Антитіло за винаходом можна кон’югувати з іншими засобами, що реагують з тіолами, в яких реактивна група являє собою, наприклад, малеімід, йодацетамід, піридилдисульфід, або інший партнер з кон’югації, що реагує з тіолами (Haugland, 2003, Molecular Probes Handbook of Fluorescent Probes and Research Chemicals, Molecular Probes, Inc.; Brinkley, 1992, Bioconjugate Chem. 3:2; Garman, 1997, Non-Radioactive Labelling: А Practical Approach, Academic Press, London; Means (1990) Bioconjugate Chem. 1:2; Hermanson, G. у Bioconjugate Techniques (1996) Academic Press, San Diego, pp. 40-55, 643-671). Партнер може являти собою цитотоксичний засіб (наприклад, токсин, такий як доксорубіцин або токсин коклюшу), флуорофор, такий як флуоресцентний барвник, подібно до флуоресцеїну або родаміну, хелатуючий засіб для візуалізації або радіотерапевтичний метал, пептидну або непеп 35 тидну мітку або мітку, що детектується, або засіб, що вимірює кліренс, такий як різні ізомери поліетиленгліколю, пептид, який зв'язує третій компонент, або інший вуглеводний або ліпофільний засіб. В одному з аспектів антитіла за винаходом можна кон’югувати з будь-якою молекулою-міткою, яку можна ковалентно приєднати до антитіла за допомогою реакційноздатної групи, групи, що активується, або реакційноздатної тіолової групи цистеїну (Singh et al., (2002) Anal. Biochem. 304: 147-15; Harlow E. and Lane, D. (1999) Using Antibodies: А Laboratory Manual, Cold Springs Harbor Laboratory Press, Cold Spring Harbor, NY; Lundblad R.L. (1991) Chemical Reagents for Protein nd Modification, 2 ed. CRC Press, Boca Raton, FL). Приєднана мітка може функціонувати для (i) забезпечення сигналу, що детектуєтся; (ii) взаємодії з другою міткою для модифікації сигналу, що детектується, який забезпечується першою або другою міткою, наприклад, для одержання FRET (резонансного перенесення енергії флуоресценції); (iii) стабілізації взаємодій або збільшення афінності зв’язування з антигеном або лігандом; (iv) впливу на рухомість, наприклад, електрофоретичну рухомість або клітинну проникність, за допомогою заряду, гідрофобності, форми або інших фізичних параметрів, або (v) забезпечення захоплюючої групи для модуляції афінності ліганду, зв’язування антитіла/антигену або іонного комплексоутворення. Мічені модифіковані цистеїном антитіла можуть бути придатними у діагностичних аналізах, наприклад, для детектування експресії антигену, що представляє інтерес, у конкретних клітинах, тканинах або сироватці. Для діагностичних додатків антитіло, як правило, мітять групою, що детектується. Доступна множина міток, які, як правило, можна згрупувати у наведені нижче категорії: 3 Радіоактивні ізотопи (радіонукліди), такі як H, 11 14 18 32 35 64 68 86 99 111 123 C, C, F, P, S, Cu, Ga, Y, Tc, In, I, 124 125 131 133 177 211 213 I, I, I, Xe, Lu, At або Bi. Мічені радіоактивними ізотопами антитіла придатні для експериментів, направлених на візуалізацію рецепторів. Антитіло можна мітити реагентами лігандів, які зв'язують, хелатують або іншим чином утворюють комплекс з радіоактивним ізотопом металу, де реагент здатний до реакції з тіолом одержаного внаслідок конструювання цистеїну в антитілі, з використанням способів, описаних у Current Protocols in Immunology, Volumes 1 and 2, Coligen et al., Ed. Wiley-Interscience, New York, NY, Pubs. (1991). Хелатуючі ліганди, які можуть утворювати комплекс з іоном металу включають DOTA, DOTP, DOTMA, DTPA і TETA (Macrocyclics, Dallas, TX). Радіонукліди можна направляти за допомогою утворення комплексів з кон’югатами антитілолікарський засіб за винаходом (Wu et al., (2005) Nature Biotechnology 23(9): 1137-1146). Лінкерні реагенти, такі як DOTA-малеімід (4малеімідобутирамідобензил-DOTA) можна одержувати реакцією амінобензил-DOTA з 4малеімідомасляною кислотою (Fluka), активованою ізопропілхлорформіатом (Aldrich) за способом Axworthy et al., (2000) Proc. Natl. Acad. Sci. USA 95958 36 97(4): 1802-1807. Реагенти DOTA-малеімід вступають у реакцію з амінокислотами вільного цистеїну модифікованих цистеїном антитіл і утворюють на антитілі ліганд, що утворює комплекси з металами (Lewis et al., (1998) Bioconj. Chem. 9: 72-86). Хелатуючі лінкерні реагенти, що мітять, такі як DOTA-NHS (моно (N-гідроксисукцинімідний складний ефір) 1,4,7,10-тетраазациклододекан-1,4,7,10тетраоцтової кислоти) є комерційно доступними (Macrocyclics, Dallas, TX). Направлена на рецептори візуалізація міченими радіонуклідами антитілами може забезпечити маркер активації каскадів реакцій за допомогою детектування і кількісного визначення зростаючого накопичення антитіл у пухлинній тканині (Albert et al., (1998) Bioorg. Med. Chem. Lett. 8: 1207-1210). Кон’юговані радіоактивні метали після лізосомальної деградації можуть залишатися всередині клітин. Метал-хелатні комплекси, придатні як мітки антитіл для візуалізуючих експериментів, описані у патенті США 5342606; патенті США 5428155; патенті США 5316757; патенті США 5480990; патенті США 5462725; патенті США 5428139; патенті США 5385893; патенті США 5739294; патенті США 5750660; патенті США 5834456; Hnatowich et al., (1983) J. Immunol. Methods 65: 147-157; Meares et al., (1984) Anal. Biochem. 142: 68-78; Mirzadeh et al., (1990) Bioconjugate Chem. 1:59-65; Meares et al., (1990) J. Cancer 1990, Suppl. 10: 21-26; Izard et al., (1992) Bioconjugate Chem. 3: 346-350; Nikula et al., (1995) Nucl. Med. Biol. 22: 387-90; Camera et al., (1993) Nucl. Med. Biol. 20: 955-62; Kukis et al., (1998) J. Nucl. Med. 39: 2105-2110; Verel et al., (2003) J. Nucl. Med. 44: 1663-1670; Camera et al., (1994) J. Nucl. Med. 21: 640-646; Ruegg et al., (1990) Cancer Res. 50: 4221-4226; Verel et al., (2003) J. Nucl. Med. 44: 1663-1670; Lee et al., (2001) Cancer Res. 61: 4474-4482; Mitchell, et al., (2003) J. Nucl. Med. 44: 1105-1112; Kobayashi et al., (1999) Bioconjugate Chem. 10: 103-111; Miederer et al., (2004) J. Nucl. Med. 45: 129-137; DeNardo et al., (1998) Clinical Cancer Research 4: 2483-90; Blend et al., (2003) Cancer Biotherapy & Radiopharmaceuticals 18:355-363; Nikula et al., (1999) J. Nucl. Med. 40: 166-76; Kobayashi et al., (1998) J. Nucl. Med. 39: 829-36; Mardirossian et al., (1993) Nucl. Med. Biol. 20: 65-74; Roselli et al., (1999) Cancer Biotherapy & Radiopharmaceuticals, 14: 209-20. (b) Флуоресцентні мітки, такі як рідкоземельні хелати (хелати європію), класи флуоресцеїну, включаючи FITC, 5-карбоксифлуоресцеїн, 6карбоксифлуоресцеїн; класи родаміну, включаючи TAMRA; дансил; лісамін; ціаніни; фікоеритрини; техаський червоний і їх аналоги. Флуоресцентні мітки можна кон’югувати з антитілами з використанням способів, описаних, наприклад, у Current Protocols in Immunology, вище. Флуоресцентні барвники і реагенти флуоресцентних міток включають флуоресцентні барвники і реагенти флуоресцентних міток, які комерційно доступні в Invitrogen/Molecular Probes (Eugene, OR) і Pierce Biotechnology, Inc. (Rockford, IL). (с) Доступні або описані різні мітки ферментсубстрат (патент США 4275149). Фермент, як пра 37 вило, каталізує хімічну модифікацію хромогенного субстрату, яку можна вимірювати різними способами. Наприклад, фермент може каталізувати зміну забарвлення субстрату, яку можна вимірювати спектрофотометрично. Альтернативно, фермент може змінювати флуоресценцію або хемілюмінесценцію субстрату. Способи кількісної оцінки зміни флуоресценції описані вище. Хемілюмінесцентний субстрат при хімічній реакції стає електронно-збудженим, а потім може випромінювати світло, яке можна вимірювати (наприклад, із застосуванням хемілюмінометра), або передавати енергію флуоресцентному акцептору. Приклади ферментативних міток включають люциферази (наприклад, люциферазу світляка і бактеріальну люциферазу; патент США 4737456), люциферин, 2,3-дигідрофталазиндіони, малатдегідрогеназу, уреазу, пероксидазу, таку як пероксидаза хрону (HRP), лужну фосфатазу (AP), -галактозидазу, глюкоамілазу, лізоцим, оксидази цукрів (наприклад, глюкозооксидаза, галактозооксидаза і глюкозо-6-фосфатдегідрогеназа), оксидази гетероциклів (такі як уриказа і ксантиноксидаза), лактопероксидазу, мікропероксидазу і т.п. Способи кон’югації ферментів з антитілами описані в O'Sullivan et al., (1981) "Methods for the Preparation of EnzymeAntibody Conjugates for use in Enzyme Immunoassay", в Methods in Enzym. (ed J. Langone & Н. Van Vunakis), Academic Press, New York, 73: 147-166. Приклади поєднань фермент-субстрат включають, наприклад, (i) пероксидазу хрону (HRP) з перекисом водню як субстратом, де перекис водню окиснює попередник барвника (наприклад, ортофенілендіамін (OPD) або 3,3',5,5'-гідрохлорид тетраметилбензидину (TMB)); (ii) лужну фосфатазу (AP) з паранітрофенілфосфатом як хромогенним субстратом; і (iii) -D-галактозидазу (-D-Gal) з хромогенним субстратом (наприклад, п-нітрофеніл--Dгалактозидаза) або флуорогенним субстратом 4метилум-беліферил--D-галактозидаза. Фахівцям у даній галузі доступна множина інших поєднань фермент-субстрат. Для загального огляду див. патент США 4275149 і патент США 4318980. Мітку можна непрямим способом кон’югувати з бічним ланцюгом амінокислот, з активованим бічним ланцюгом амінокислот, з модифікованим цистеїном антитілом і т.п. Наприклад, антитіло можна кон’югувати з біотином, а будь-яку з трьох широких категорій міток, вказаних вище, можна кон’югувати з авідином або стрептавідином, або навпаки. Біотин селективно зв'язується зі стрептавідином і, таким чином, мітку можна кон’югувати з антитілом таким непрямим способом. Альтернативно, для здійснення непрямої кон’югації мітки з варіантом поліпептиду, варіант поліпептиду кон’югують з невеликим гаптеном (наприклад, дигоксином), а один з різних типів міток, вказаних вище, кон’югують з варіантом поліпептиду проти гаптену (наприклад, антитіло до дигоксину). Таким чином, можна здійснити непряму кон’югацію мітки з варіа 95958 38 нтом поліпептиду (Hermanson, G. (1996) у Bioconjugate Techniques Academic Press, San Diego). Антитіло за даним винаходом можна застосовувати у будь-якому відомому способі аналізу, такому як ELISA, аналізи конкурентного зв’язування, прямий і непрямий сендвіч-аналізи і аналізи імуноосадження (Zola, (1987) Monoclonal Antibodies: А Manual of Techniques, pp. 147-158, CRC Press, Inc.). Мітка, що детектується, може бути придатною для локалізації, візуалізації і кількісного визначення події зв’язування або пізнавання. Міченими антитілами за винаходом можна визначати рецептори клітинної поверхні. Інше використання детектовано мічених антитіл являє собою спосіб імунозахоплення на основі гранул, що включає кон’югацію гранул з флуоресцентно міченим антитілом і детектування флуоресцентного сигналу після зв’язування ліганду. У подібних способах детектування використовують ефект поверхневого плазмонного резонансу (SPR) для вимірювання і детектування взаємодій антитіло-антиген. Мітки, що детектуються, такі як флуоресцентні барвники і хемілюмінесцентні барвники (Briggs et al., (1997) "Synthesis of Functionalised Fluorescent Dyes and Their Coupling to Amines and Amino Acids", J. Chem. Soc., Perkin-Trans. 1: 1051-1058) забезпечують сигнал, що детектується, і, як правило, застосовні для мічених антитіл, переважно з наведеними нижче властивостями: (i) мічене антитіло повинно давати дуже високий сигнал з низьким фоном так, щоб невеликі кількості антитіл можна було з високою чутливістю детектувати у безклітинних аналізах і аналізах, що базуються на клітинах; і (ii) мічене антитіло повинно бути фотостабільним так, щоб флуоресцентний сигнал можнабуло спостерігати, вимірювати і записувати без значного фотознебарвлювання. Для застосувань, що включають зв’язування клітинної поверхні мічених антитіл з мембранами або клітинними поверхнями, зокрема, живих клітин, мітки переважно (iii) мають хорошу розчинність у воді для досягнення ефективної концентрації кон’югатів і чутливості детектування, і (iv) є нетоксичними для живих клітин так, щоб не порушувати нормальні метаболічні процеси у клітинах або не викликати передчасну загибель клітин. Пряме кількісне визначення інтенсивності клітинної флуоресценції і підрахунок подій флуоресцентного мічення, наприклад, зв’язування кон’югатів пептид-барвник з клітинною поверхнею, можна проводити у системі (FMAT 8100 HTS System, Applied Biosystems, Foster City, Calif.), яка автоматизує змішування і зчитування, нерадіоактивні аналізи з живими клітинами або гранулами (Miraglia, "Homogeneous cell- and bead-based assays for high throughput screening using fluorometric microvolume assay technology", (1999) J. of Biomolecular Screening 4: 193-204). Використання мічених антитіл також включає аналізи зв’язування поверхневих рецепторів, аналізи імунозахоплення, твердофазовий імунофлуоресцентний аналіз (FLISA), розщеплення каспазою (Zheng, "Caspase-3 controls both cytoplasmic and nuclear 39 events associated with Fas-mediated apoptosis in vivo", (1998) Proc. Natl. Acad. Sci. USA 95: 618-23; патент США 6372907), апоптоз (Vermes, "А novel assay for apoptosis. Flow cytometric detection of phosphatidylserine expression on early apoptotic cells using fluorescein labelled Annexin V" (1995) J. Immunol. Methods 184: 39-51) і цитотоксичний аналіз. Для ідентифікації позитивної або негативної регуляції молекулою, яка має мішень на клітинній поверхні, можна використовувати спосіб флуориметричного аналізу у мікрооб’ємах (Swartzman, "А homogeneous and multiplexed immunoassay for high-throughput screening using fluorometric microvolume assay technology", (1999) Anal. Biochem. 271: 143-51). Мічені антитіла за винаходом придатні як біомаркери і зонди для візуалізації різними способами і засобами біомедичної і молекулярної візуалізації, такими як (i) MRI (магнітно-резонансна томографія); (ii) MicroCT (комп'ютерна томографія); (iii) SPECT (однофотонна емісійна комп'ютерна томографія); (iv) PET (позитронно-емісійна томографія) Chen et al., (2004) Bioconjugate Chem. 15: 41-49; (v) біолюмінесценція; (vi) флуоресценція і (vii) ультразвук. Імуносцинтиграфія являє собою спосіб візуалізації, при якому антитіла, мічені радіоактивними речовинами, вводять пацієнту, тварині або людині, і одержують зображення ділянки в організмі, де локалізується антитіло (патент США 6528624). Візуалізуючі біомаркери можна об'єктивно вимірювати і оцінювати як індикатор нормальних біологічних процесів, патогенетичних процесів або фармакологічної відповіді на терапевтичне втручання. Біомаркери можуть бути декількох типів: тип 0 являють собою природні історичні маркери захворювання і лонгітудинально корелює з відомими клінічними індексами, наприклад, обстеження MRI синовіального запалення при ревматоїдному артриті; маркери типу I виявляють ефект втручання відповідно до механізму дії, навіть якщо механізм може не бути асоційованим з клінічним кінцем; маркери типу II функціонують як замісні кінцеві точки, де зміна біомаркеру або сигнал від нього передбачає клінічну перевагу для "підтвердження" заданої відповіді, такої як вимірювання ерозії кісток при ревматоїдному артриті за допомогою CT. Таким чином, візуалізуючі біомаркери можуть надати фармакодинамічну (PD) терапевтичну інформацію: (i) про експресію цільового білка, (ii) про зв’язування терапевтичного засобу з цільовим білком, тобто про селективність, і (iii) про фармакокінетичні дані кліренсу і час напівжиття. Переваги візуалізуючих біомаркерів in vivo відносно лабораторних біомаркерів включають неінвазивний вплив, кількісну оцінку у всьому організмі, повторне дозування і оцінку, тобто декілька часових точок і потенційно переносимий вплив від передклінічних (невелика тварина) до клінічних (людина) результатів. Для деяких застосувань біовізуалізація заміняє або мінімізує кількість експериментів на тваринах при передклінічних дослідженнях. Способи мічення пептидів добре відомі. Див. Haugland, 2003, Molecular Probes Handbook of Fluorescent Probes and Research Chemicals, Molecular Probes, Inc.; Brinkley, 1992, Bioconjugate 95958 40 Chem. 3:2; Garman, (1997) Non-Radioactive Labelling: А Practical Approach, Academic Press, London; Means (1990) Bioconjugate Chem. 1:2; Glazer et al., (1975) Chemical Modification of Proteins. Laboratory Techniques in Biochemistry and Molecular Biology (T.S. Work and E. Work, Eds.) American Elsevier Publishing Co., New York; Lundblad, R.L. and Noyes, C.M. (1984) Chemical Reagents for Protein Modification, Vols. I and II, CRC Press, New York; Pfleiderer, G. (1985) "Chemical Modification of Proteins", Modern Methods in Protein Chemistry, H. Tschesche, Ed., Walter DeGryter, Berlin and New York; and Wong (1991) Chemistry of Protein Conjugation and Cross-linking, CRC Press, Boca Raton, Fla.); De Leon-Rodriguez et al., (2004) Chem. Eur. J. 10: 1149-1155; Lewis et al., (2001) Bioconjugate Chem. 12: 320-324; Li et al., (2002) Bioconjugate Chem. 13: 110-115; Mier et al., (2005) Bioconjugate Chem. 16: 240-237. Пептиди і білки, мічені двома різними молекулами, флуоресцентним репортером і гасником, достатньо близько, піддаються резонансному перенесенню енергії флуоресценції (FRET). Репортерні групи, як правило, є флуоресцентними барвниками, які збуджуються світловим випромінюванням при визначеній довжині хвилі і переносять енергію на акцептор або гасник, групу, з відповідним зсувом Стокса для емісії при максимальній яскравості. Флуоресцентні барвники включають молекули з великим ступенем ароматизації, такі як флуоресцеїн і родамін, і їх похідні. Флуоресцентний репортер у вихідному пептиді може бути частково або значною мірою погашений молекулою гасника. Після розщеплення пептиду пептидазою або протеазою, можна вимірювати збільшення флуоресценції, що детектується (Knight, С. (1995) "Fluorimetric Assays of Proteolytic Enzymes", Methods in Enzymology, Academic Press, 248: 18-34). Мічені антитіла за винаходом також можна використовувати як афінний очищувальний засіб. У даному способі мічене антитіло іммобілізоване на твердій фазі, такій як смола сефадекс або фільтрувальний папір, добре відомими у даній галузі способами. Іммобілізоване антитіло контактує зі зразком, що містить антиген, який очищають, а потім основу промивають придатним розчинником, що видаляє по суті всю речовину у зразку за винятком антигену, який очищають, що зв'язаний з іммобілізованим варіантом поліпептиду. Нарешті основу відмивають іншим придатним розчинником, таким як гліциновий буфер, pH 5,0, який вивільняє антиген від варіанту поліпептиду. Реагенти, що мітять, як правило, несуть реакційноздатну функціональну групу, яка може реагувати (i) безпосередньо з тіолом цистеїну модифікованого цистеїном антитіла з формуванням міченого антитіла, (ii) з лінкерним реагентом з формуванням проміжного продукту лінкер-мітка або (iii) з лінкерним антитілом з формуванням міченого антитіла. Реакційноздатна функціональна група реагентів, що мітять, включає малеімід, галогенацетил, сукцинімідиловий складний ефір йодацетаміду (наприклад, NHS, N-гідроксисукцинімід), ізотіоціанат, сульфонілхлорид, 2,6-дихлортриазиніл, 41 пентафлуореніловий складний ефір і фосфорамідит, хоча також можна використовувати інші функціональні групи. Ілюстративною реакційноздатною функціональною групою є складний Nгідроксисукцинімідильний ефір (NHS) замісника карбоксильної групи мітки, що детектується, наприклад біотину або флуоресцентного барвника. Складний NHS ефір мітки можна заздалегідь одержувати, виділяти, очищати і/або характеризувати, або його можна одержувати in situ і піддавати реакції з нуклеофільною групою антитіла. Як правило, карбоксильна форма мітки активується за допомогою реакції з визначеним поєднанням карбодіімідного реагенту, наприклад дициклогексилкарбодііміду, діізопропілкарбодііміду або уронієвого реагенту, наприклад TSTU (тетрафторборат О-(Nсукцинімідил)-N,N,N',N'-тетраметилуронію), HBTU (гексафторфосфат О-бензотриазол-1-іл)-N,N,N',N'тетраметилуронію) або HATU (гексафторфосфат О-(7-азабензотриазол-1-іл)-N,N,N',N'тетраметилуронію); активатора, такого як 1гідроксибензотриазол (HOBt) і Nгідроксисукциніміду з одержанням складного NHS ефіру мітки. У деяких випадках мітку і антитіло можна зв'язувати за допомогою активації і реакції мітки з антитілом in situ з формуванням кон’югату мітка-антитіло в одну стадію. Інші активуючі і зв'язувальні реагенти включають TBTU (гексафторфосфат 2-(1H-бензотриазо-1їл)-1-1,3,3-тетраметилуронію), TFFH (2-фторгексафторфосфат N,N',N'',N'''-тетраметилуронію), PyBOP (гексафторфосфат бензотриазол-1-іл-окситрис-піролідинофосфонію, EEDQ (2-етоксі-1етоксикарбоніл-1,2-дигідрохінолін), DCC (дициклогексилкарбодіімід); DIPCDI (діізопропілкарбодіімід), MSNT (1-(мезитилен-2-сульфоніл)-3-нітро-1H1,2,4-триазол і арилсульфонілгалогеніди, наприклад, триізопропілбензолсульфонілхлорид. Сполуки альбумінзв’язувальний пептид-Fab за винаходом: CDKTHTGGGSQRLMEDICLPRWGCLWEDDF QRLMEDICLPRWGCLWEDDF QRLIEDICLPRWGCLWEDDF RLIEDICLPRWGCLWEDD DICLPRWGCLW Кон’югати антитіло-лікарський засіб В іншому аспекті винахід стосується імунокон’югатів або кон’югатів антитіло-лікарський засіб (ADC), що містять антитіло, кон’юговане з цитотоксичним засобом, таким як хіміотерапевтичний засіб, лікарський засіб, засіб, що інгібує ріст, токсин (наприклад, ферментативно активний токсин бактеріального, грибкового, рослинного або тваринного походження або їх фрагменти) або радіоактивний ізотоп (тобто радіокон’югат). В іншому аспекті винахід додатково стосується способів застосування імунокон’югатів. В одному з аспектів імунокон’югат містить будь-яке з вказаних вище антитіл до CD22, ковалентно приєднане до цитотоксичного засобу або засобу, що детектується. Використання кон’югатів антитіло-лікарський засіб для локальної доставки цитотоксичних або 95958 42 В одному з аспектів, антитіло за винаходом злите з альбумінзв’язувальним білком. Зв’язування білками плазми може являти собою ефективний спосіб поліпшення фармакокінетичних властивостей короткоживучих молекул. Альбумін являє собою найбільш представлений білок у плазмі. Альбумінзв’язувальні пептиди (ABP), що зв'язують сироватковий альбумін, можуть змінювати фармакодинаміку злитих білків з активними доменами, включаючи зміну захоплення, проникнення і дифузії у тканинах. Ці фармакодинамічні параметри можна змінювати за допомогою конкретного вибору відповідної послідовності пептиду, що зв'язує сироватковий альбумін (патент США 20040001827). Ряд альбумінзв’язувальних пептидів визначений скринінгом за допомогою фагового дисплею (Dennis et al., (2002) "Albumin Binding As А General Strategy For Improving The Pharmacokinetics Of Proteins" J. Biol. Chem. 277: 35035-35043; WO 01/45746). Сполуки за винаходом включають ABP послідовності вказані в (i) Dennis et al., (2002) J. Biol. Chem. 277: 35035-35043 у таблицях III і IV, сторінка 35038; (ii) патент США 20040001827 в [0076] SEQ ID NO:9-22 і (iii) WO 01/45746 на сторінках 12-13, всі з яких включені у цей документ як посилання у повному обсязі. Альбумінзв’язувальні (ABP)-Fab конструюють за допомогою злиття альбумінзв’язувального пептиду з С-кінцем важкого ланцюга Fab у стехіометричному співвідношенні 1:1 (1 ABP/1 Fab). Показано, що асоціація цих ABP-Fab з альбуміном збільшувала час напівжиття антитіла у кроликів і мишей більш ніж у 25 разів. Таким чином, описані вище реакційноздатні залишки Cys можна вводити у ці ABP-Fab і використовувати для сайт-специфічної кон’югації з цитотоксичними лікарськими засобами з подальшим вивченням на тваринах in vivo. Ілюстративні послідовності альбумінзв’язувальних пептидів включають як необмежувальні приклади амінокислотні послідовності, перераховані у SEQ ID NO:42-46: SEQ ID NO:42 SEQ ID NO:43 SEQ ID NO:44 SEQ ID NO:45 SEQ ID NO:46 цитостатичних засобів, тобто лікарських засобів для знищення або інгібування пухлинних клітин при лікуванні злоякісної пухлини (Syrigos and Epenetos (1999) Anticancer Research 19:605-614; Niculescu-Duvaz and Springer (1997) Adv. Drg Del. Rev. 26:151-172; патент США 4975278) забезпечує направлену доставку молекули лікарського засобу до пухлин і внутрішньоклітинне накопичення у них там, де системне введення цих некон’югованих лікарських засобів, крім пухлинних клітин, які треба видалити, може привести до неприйнятних рівнів токсичності для нормальних клітин (Baldwin et al., (1986) Lancet pp. (Mar. 15, 1986):603-05; Thorpe, (1985) "Antibody Carriers Of Cytotoxic Agents In Cancer Therapy: А Review", у Monoclonal Antibodies '84: Biological And Clinical Applications, A. Pinchera et al., (ed.s), pp. 475-506). Таким чином, 43 бажаною є максимальна ефективність при мінімальній токсичності. Повідомлялося, що для цих способів придатні і поліклональні антитіла, і моноклональні антитіла (Rowland et al., (1986) Cancer Immunol. Immunother., 21:183-87). Лікарські засоби, що використовуються у цих способах, включають дауноміцин, доксорубіцин, метотрексат і віндезин (Rowland et al., (1986) вище). Токсини, що використовуються у кон’югатах антитіло-токсин, включають бактеріальні токсини, такі як дифтерійний токсин, рослинні токсини, такі як рицин, низькомолекулярні токсини, такі як гелданаміцин (Mandler et al., (2000) Jour. of the Nat. Cancer Inst. 92(19): 1573-1581; Mandler et al., (2000) Bioorganic & Med. Chem. Letters 10:1025-1028; Mandler et al., (2002) Bioconjugate Chem. 13:786-791), майтанзиноїди (EP 1391213; Liu et al., (1996) Proc. Natl. Acad. Sci. USA 93:8618-8623) і каліхіміцин (Lode et al., (1998) Cancer Res. 58:2928; Hinman et al., (1993) Cancer Res. 53:3336-3342). Токсини можуть проявляти їх цитотоксичну і цитостатичну дію за допомогою механізмів, що включають зв’язування тубуліну, зв’язування ДНК або інгібування топоізомерази. Деякі цитотоксичні лікарські засоби, як правило, інактивуються або стають менш активними при кон’югації з великими антитілами або лігандами рецепторних білків. ZEVALIN (ібритумомаб тіуксетан, Biogen/Idec) являє собою кон’югат антитілорадіоактивний ізотоп, що складається з моноклонального антитіла IgG1 каппа миші, направленого до антигену CD20, що знаходиться на поверхні нормальних і злоякісних В-лімфоцитів, і радіоакти111 90 вного ізотопу In або Y, зв'язаного тіосечовинним лінкером-хелатором (Wiseman et al., (2000) Eur. Jour. Nucl. Med. 27(7):766-77; Wiseman et al., (2002) Blood 99(12):4336-42; Witzig et al., (2002) J. Clin. Oncol. 20(10):2453-63; Witzig et al., (2002) J. Clin. Oncol. 20(15):3262-69). Хоча зевалін має активність стосовно В-клітинної неходжкінської лімфоми (NHL), введення приводить до тяжких і тривалих цитопеній у більшості пацієнтів. У 2000 році для лікування гострого мієлолейкозу за допомогою ін'єкції схвалений MILOTARG (гемтузумаб озогаміцин, Wyeth Pharmaceuticals), кон’югат антитілолікарський засіб, складений з антитіла до huCD33, зв'язаного з каліхіміцином (Drugs of the Future (2000) 25(7):686; патенти США № 4970198; 5079233;5585089; 5606040; 5693762; 5739116; 5767285; 5773001). Фазу II випробувань для лікування злоякісних пухлин, що експресують CanAg, таких як злоякісна пухлина товстого кишечнику, підшлункової залози, шлунку та ін., проходить кантузумаб мертанзин (Immunogen, Inc.), кон’югат антитіло-лікарський засіб, складений з антитіла huC242, зв'язаного через дисульфідний лінкер SPP з молекулою майтанзиноїдного лікарського засобу, DM1. У розробці для можливого лікування пухлин передміхурової залози знаходиться MLN2704 (Millennium Pharm., BZL Biologiсs, Immunogen Inc.), кон’югат антитіло-лікарський засіб, складений з моноклонального антитіла до специфічного мембранного антигену простати (PSMA), зв'язаного з молекулою майтанзиноїдного лікарського засобу, DM1. Ауристатинові пептиди, ауристатин Е (AE) і 95958 44 монометилауристатин (MMAE), синтетичні аналоги доластатину, кон’юговані з химерними моноклональними антитілами cBR96 (специфічними до Lewis Y на карциномах) і cACIO (специфічними до CD30 у гематологічних злоякісних утворень) (Doronina et al., (2003) Nature Biotechnology 21(7):778-784) і знаходяться у стадії терапевтичної розробки. У цьому документі описані хіміотерапевтичні засоби, придатні для одержання імунокон’югатів. Ферментативно активні токсини і їх фрагменти, які можна використовувати, включають ланцюг А дифтерійного токсину, активні фрагменти дифтерійного токсину, що не зв’язуються, ланцюг А екзотоксину (з Pseudomonas aeruginosa), ланцюг А рицину, ланцюг А абрину, ланцюг А модецину, альфа-сарцин, білки Aleurites fordii, діантинові білки, білки Phytolaca americana (PAPI, PAPII і PAPS), інгібітор Momordica charantia, курцин, кротин, інгібітор Sapaonaria officinalis, гелонін, мітогелін, рестриктоцин, феноміцин, еноміцин і трихотецени. Див., наприклад, WO 93/21232, опубліковану 28 жовтня 1993 року. Для одержання радіокон’югованих антитіл доступна множина радіонук212 131 131 90 лідів. Приклади включають Bi, I, In, Y і 186 Re. Кон’югати антитіла з цитотоксичним засобом одержують із застосуванням множини біфункціональних засобів, що зв'язують білки, таких як Nсукцинімідил-3-(2-піридилдитіол)пропіонат (SPDP), імінотіолан (IT), біфункціональні похідні імідоефірів (такі як диметиладипімідат HCL), активні складні ефіри (такі як дисукцинімідилсуберат), альдегіди (такі як глутаральдегід), біс-азидо сполуки (такі як біс-(п-азидобензоїл)гександіамін), похідні бісдіазонію (такі як біс-(пдіазонійбензоїл)етилендіамін), діізоціанати (такі як толуол-2,6-діізоціанат) і біс-сполуки активного фтору (такі як 1,5-дифтор-2,4-динітробензол). Наприклад, рициновий імунотоксин можна одержувати, як описано у Vitetta et al., (1987) Science, 238:1098. Ілюстративним хелатуючим засобом для кон’югації радіонукліду з антитілом є мічена по вуглецю-14 1-ізотіоціанатбензил-3метилдіетилентриамінпентаоцтова кислота (MXDTPA) (WO 94/11026). Також у цьому документі розглядають кон’югати антитіла і одного або декількох низькомолекулярних токсинів, таких як каліхіміцин, майтанзиноїди, доластатини, ауристатини, трихотецен і CC1065 і похідні цих токсинів, які мають токсичну активність. Майтанзин і майтанзиноїди У деяких варіантах здійснення імунокон’югат містить антитіло (повнорозмірне або фрагменти) за винаходом, кон’юговане з однією або декількома молекулами майтанзиноїдів. Майтанзиноїди являють собою інгібітори мітозу, які діють, інгібуючи полімеризацію тубуліну. Майтанзин вперше виділили зі східноафриканського чагарнику Maytenus serrata (патент США № 3896111). Згодом виявили, що визначені мікроорганізми також продукують майтанзиноїди, такі як майтанзинол і складні ефіри майтанзинолу по С-3 (патент США № 4151042). Також описані синтетичний майтанзинол і його похідні і аналоги, наприклад, у патентах США № 4137230; 4248870; 45 4256746; 4260608; 4265814; 4294757; 4307016; 4308268; 4308269; 4309428; 4313946; 4315929; 4317821; 4322348; 4331598; 4361650; 4364866; 4424219; 4450254; 4362663 і 4371533. Молекули майтанзиноїдних лікарських засобів є привабливими молекулами у кон’югатах антитіло-лікарський засіб тому, що вони (i) відносно доступні для одержання за допомогою ферментації або хімічної модифікації, дериватизації продуктів ферментації, (ii) піддаються дериватизації функціональними групами, придатними для кон’югації через недисульфідні лінкери до антитіл, (iii) стабільні у плазмі і (iv) ефективні проти ряду ліній пухлинних клітин. Майтанзинові сполуки, придатні для використання як молекули майтанзиноїдних лікарських засобів, добре відомі у даній галузі, і їх можна виділяти з природних джерел відомими способами, одержувати способами генетичної інженерії (див. Yu et al., (2002) PNAS 99:7968-7973), або майтанзинол і аналоги майтанзинолу відомими способами одержують синтетично. Ілюстративні молекули майтанзиноїдних лікарських засобів включають молекули з модифікованим ароматичним кільцем, таким як С-19дехлоро (патент США 4256746) (одержаним за допомогою відновлення ансамітоцину P2 гідридом алюмінію літію); С-20-гідрокси (або С-20-деметил) +/- С-19-дехлоро (патенти США № 4361650 і 95958 46 4307016) (одержаним деметилуванням з використанням Streptomyces або Actinomyces або дехлоруванням із застосуванням LAH); і С-20деметокси, С-20-ацилокси (-OCOR), +/- дехлоро (патент США № 4294757) (одержаним за допомогою ацилювання із застосуванням ацилхлоридів) і молекули з модифікаціями в інших положеннях. Ілюстративні молекули майтанзиноїдних лікарських засобів також включають молекули з такими модифікаціями як С-9-SH (патент США 4424219) (одержана за допомогою реакції майтанзинолу з H2S або P2S5); С-14алкоксиметил(деметокси/CH2OR) (патент США 4331598); С-14-гідроксиметил або ацилоксиметил (CH2OH або CH2OAc) (патент США 4450254) (одержані з Nocardia); С-15-гідрокси/ацилокси (патент США 4364866) (одержана за допомогою конверсії майтанзинолу Streptomyces); С-15-метокси (патенти США № 4313946 і 4315929) (виділена з Trewia nudlflora); С-18-N-деметил (патенти США № 4362663 і 4322348) (одержана за допомогою деметилування майтанзинолу Streptomyces) і 4,5дезокси (патент США 4371533) (одержана за допомогою відновлення майтанзинолу трихлоридом титану/LAH). Ілюстративні варіанти здійснення молекул майтанзиноїдних лікарських засобів включають DM1; DM3 і DM4, з наведеними нижче структурами: 47 95958 48 , де хвиляста лінія означає ковалентне приєднання атома сірки лікарського засобу до лінкера (L) кон’югату антитіло-лікарський засіб. Повідомлялося про HERCEPTIN (герцептин, трастузумаб, антитіло до HER2), зв'язаний за допомогою SMCC з DM1 (WO 2005/037992, яка у повному обсязі включена у цей документ як посилання). Кон’югат антитіло-лікарський засіб за даним винаходом можна одержувати описаними у ній способами. Інші ілюстративні кон’югати антитілолікарський засіб з майтанзиноїдами мають наведені нижче структури і позначення (де Ab являє собою антитіло, а р являє собою число від 1 до приблизно 8): Ілюстративні кон’югати антитіло-лікарський засіб, де DM1 зв'язаний через лінкер BMPEO з тіольною групою антитіла, мають наведені нижче структуру і позначення: 49 95958 50 , де Ab являє собою антитіло; n являє собою 0, 1 або 2; а р являє собою 1, 2, 3 або 4. Імунокон’югати, що містять майтанзиноїди, способи їх одержання і їх терапевтичне застосування описані, наприклад, у патентах США № 5208020; 5416064; 6441163 і європейському патенті EP 0425235 B1, описи яких включені у цей документ як посилання у повному обсязі. У Liu et al., Proc. Natl. Acad. Sci. USA 93:8618-8623 (1996) описані імунокон’югати, що містять майтанзиноїд, позначений DM1, зв'язаний з моноклональним антитілом C242, направленим проти колоректального раку людини. Виявлено, що кон’югат високоцитотоксичний для клітин, що культивуються, раку товстого кишечнику і показана протипухлинна активність в аналізі росту пухлини in vivo. У Chad et al., Cancer Research 52:127-131 (1992) описані імунокон’югати, в яких майтанзиноїд через дисульфідний лінкер кон’югований з мишачим антитілом A7, зв'язуючись з антигеном клітинних ліній раку товстого кишечнику людини, або з іншим моноклональним антитілом миші TA.1, яке зв'язується з онкогеном HER-2/neu. Цитотоксичність кон’югату TA.1майтанзиноїд тестували in vitro на клітинній лінії раку молочної залози людини SK-BR-3, яка екс5 пресує 3х10 поверхневих антигенів HER-2 на клітину. Лікарський кон’югат досягав ступеня цитотоксичності, подібного до ступеня цитотоксичності вільного майтанзиноїдного лікарського засобу, який можна збільшити, збільшуючи кількість майтанзиноїдних молекул на молекулу антитіла. Кон’югат A7-майтанзиноїд продемонстрував низьку системну цитотоксичність у мишей. Кон’югати антитіло до CD22-майтанзиноїд одержують за допомогою хімічного зв’язування антитіла з молекулою майтанзиноїду без значного зниження біологічної активності антитіла або молекули майтанзиноїду. Див., наприклад, патент США № 5208020 (опис якого, таким чином, включений у даний опис як посилання у повному обсязі). У середньому 3-4 молекули майтанзиноїду, кон’юговані з однією молекулою антитіла, продемонстрували ефективність стосовно посилення цитотоксичності для клітин-мішеней без негативного впливу на функцію або розчинність антитіла, хоча можна очікувати, що навіть одна молекула токсину/антитіла збільшує цитотоксичність у порівнянні із застосуванням одного антитіла. Майтанзиноїди добре відомі у даній галузі і їх можна син тезувати відомими способами або виділяти з природних джерел. Придатні майтанзиноїди описані, наприклад, у патенті США № 5208020 і в інших патентних і непатентних публікаціях, на які наводяться посилання вище у даному документі. Переважними майтанзиноїдами є майтанзинол і аналоги майтанзинолу, модифіковані по ароматичному кільцю або по інших положеннях молекули майтанзинолу, такі як різні складні ефіри майтанзинолу. Існує множина відомих у даній галузі лінкерних груп для одержання кон’югатів антитіломайтанзиноїд, що включають, наприклад, лінкерні групи, описані у патентах США № 5208020, 6441163 або європейському патенті 0425235 B1, Chari et al., Cancer Research 52:127-131 (1992) і патенті США 2005/0169933 A1, описи яких включені у цей документ як посилання у повному обсязі. Кон’югати антитіло-майтанзиноїд, що містять лінкерний компонент SMCC, можна одержувати, як описано у патентній заявці США № 11/141344, зареєстрованій 31 травня 2005 року, "Antibody Drug Conjugates and Methods". Лінкерні групи включають дисульфідні групи, тіоефірні групи, кислотолабільні групи, фотолабільні групи, пептидазолабільні групи або естеразолабільні групи, як описано у вказаних вище патентах. Додаткові лінкерні групи описані і проілюстровані у цьому документі. Кон’югати антитіла і майтанзиноїду можна одержувати із застосуванням множини біфункціональних засобів, що зв'язують білки, таких як Nсукцинімідил-3-(2-піридилдитіо)пропіонат (SPDP), сукцинімідил-4-(N-малеімідо-метил)циклогексан-1карбоксилат (SMCC), імінотіолан (IT), біфункціональні похідні складних імідоефірів (такі як диметиладипімідат HCl), активні складні ефіри (такі як дисукцинімідилсуберат), альдегіди (такі як глутаральдегід), біс-азидо сполуки (такі як біс-(пазидобензоїл)гександіамін), похідні біс-діазонію (такі як біс-(п-діазонійбензоїл)етилендіамін), діізоціанати (такі як толуол-2,6-діізоціанат) і біссполуки активного фтору (такі як 1,5-дифтор-2,4динітробензол). Особливо переважні зв'язувальні засоби включають N-сукцинімідил-3-(2піридилдитіо)пропіонат (SPDP) (Carlsson et al., Biochem. J. 173:723-737 (1978)) і N-сукцинімідил-4(2-піридилтіо)пентаноат (SPP) для утворення дисульфідного зв'язку. Лінкер можна приєднувати до молекули май 51 95958 52 танзиноїду у різних положеннях в залежності від типу зв'язку. Наприклад, складноефірний зв'язок можна формувати за допомогою реакції з гідроксильною групою із застосуванням традиційних способів зв’язування. Реакція може проходити по положенню С-3, в якому знаходиться гідроксильна група, по положенню С-14, модифікованому гідроксиметилом, по положенню С-15, модифікованому гідроксильною групою, і по положенню С-20, в якому знаходиться гідроксильна група. У переважному варіанті здійснення зв'язок формують по положенню С-3 майтанзинолу або аналога майтанзинолу. В одному з варіантів здійснення будь-яке антитіло за винаходом (повнорозмірне або фрагмент) кон’юговане з однією або декількома молекулами майтанзиноїдів. В одному з варіантів здійснення імунокон’югату цитотоксичний засіб D являє собою майтанзиноїд DM1. В одному з варіантів здійснення імунокон’югату лінкер являє собою SMCC. В одному з варіантів здійснення кон’югат антитіло-лінкер-лікарський засіб являє собою антитіло до CD22, як описано у цьому документі, до якого через лінкер SMCC ковалентно приєднаний цитотоксичний засіб DM1. Ауристатини і доластатини У деяких варіантах здійснення імунокон’югат містить антитіло за винаходом, кон’юговане з доластатинами або пептидними аналогами і похідними доластатинів, ауристатинами (патенти США № 5635483; 5780588). Показано, що доластатини і ауристатини перешкоджають активності мікротрубочок, гідролізу ГТФ і поділу ядра і клітини (Woyke et al., (2001) Antimicrob. Agents and Chemother. 45(12):3580-3584) і мають протипухлинну (патент США 5663149) і протигрибкову активність (Pettit et al., (1998) Antimicrob. Agents Chemother. 42:29612965). Молекулу лікарського засобу доластатину або ауристатину можна зв'язувати з антитілом через N-кінець (аміно) або С-кінець (карбоксильний) пептидної групи лікарського засобу (WO 02/088172). Ілюстративні варіанти здійснення ауристатину включають приєднані по N-кінцю групи лікарського засобу монометилауристатину DE і DF, описані у Senter et al., Proceedings of the American Association for Cancer Research, Volume 45, Abstract Number 623, представленій 28 березня 2004 року, опис якої наведений як посилання у повному обсязі. Ілюстративний варіант здійснення ауристатину являє собою MMAE (де хвиляста лінія вказує ковалентний зв'язок з лінкером (L) кон’югату антитіло-лікарський засіб). Інший ілюстративний варіант здійснення ауристатину являє собою MMAF, де хвиляста лінія вказує ковалентний зв'язок з лінкером (L) кон’югату антитіло-лікарський засіб (патент США 2005/0238649): Додаткові ілюстративні варіанти здійснення, що містять MMAE або MMAF, і різні лінкерні компоненти (описані далі у даному документі) мають наведені нижче структури і скорочення (де Ab означає антитіло, а р являє собою число від 1 до приблизно 8): 53 Як правило, пептидні групи лікарських засобів можна одержувати за допомогою формування пептидного зв'язку між двома або більше амінокислотами і/або пептидними фрагментами. Такі пептидні зв'язки можна одержувати, наприклад, способом синтезу у рідкій фазі (див. Е. Schröder and K. Lübke, "The Peptides", volume 1, pp 76-136, 1965, Academic Press), який добре відомий у галузі пептидної хімії. Ауристатинові/доластатинові групи лікарських засобів можна одержувати способами за патентом США 5635483; патентом США 5780588; Pettit et al., (1989) J. Am. Chem. Soc. 111:5463-5465; Pettit et al., (1998) Anti-Cancer Drug Design 13:243-277; Pettit, G.R., et al., Synthesis, 1996, 719-725; Pettit et al., (1996) J. Chem. Soc. Perkin Trans. 1 5:859-863 і Doronina (2003) Nat. Biotechnol. 21(7):778-784. Каліхіміцин В інших варіантах здійснення імунокон’югат містить антитіло за винаходом, кон’юговане з однією або декількома молекулами каліхіміцину. Каліхіміцинове сімейство антибіотиків здатне до утворення двохланцюжкових розривів у ДНК у субпікомолярних концентраціях. Для одержання кон’югатів каліхіміцинового сімейства див. патенти США № 5712374, 5714586, 5739116, 5767285, 5770701, 5770710, 5773001, 5877296 (всі видані American Cyanamid Company). Структурні аналоги каліхіміцину, які можна використовувати, включаI I I ють як необмежувальні приклади 1 , 2 , 3 , NI I ацетил-1 , PSAG і 1 (Hinman et al., Cancer Research 53:3336-3342 (1993), Lode et al., Cancer Research 58:2925-2928 (1998) і вказані вище патенти США, видані American Cyanamid). Іншим протипухлинним лікарським засобом, з яким можна кон’югувати антитіло, є QFA, що являє собою антифолат. І каліхіміцин, і QFA містять внутрішньоклітинні ділянки дії і тяжко проходять через плазматичну мембрану. Таким чином, клітинне захоплення цих засобів, внаслідок опосередкованої антитілом інтерналізації значно посилює їх дію. Інші цитотоксичні засоби Інші протипухлинні засоби, які можна кон’югувати з антитілами за винаходом, включать BCNU, стрептозоїцин, вінкристин і 5-фторурацил, сімейство засобів, у сукупності відомих як комплекс LL-E33288, описаний у патентах США 5053394, 5770710, а також еспераміцини (патент 95958 54 США 5877296). Ферментативно активні токсини і їх фрагменти, які можна використовувати, включають ланцюг А дифтерійного токсину, активні фрагменти дифтерійного токсину, що не зв’язуються, ланцюг А екзотоксину (з Pseudomonas aeruginosa), ланцюг А рицину, ланцюг А абрину, ланцюг А модецину, альфа-сарцин, білки Aleurites fordii, діантинові білки, білки Phytolaca americana (PAPI, PAPII і PAPS), інгібітор Momordica charantia, курцин, кротин, інгібітор Sapaonaria officinalis, гелонін, мітогелін, рестриктоцин, феноміцин, еноміцин і трихотецени. Див., наприклад, WO 93/21232, опубліковану 28 жовтня 1993 року. Даний винахід додатково стосується імунокон’югату, утвореного антитілом і сполукою з нуклеолітичною активністю (наприклад, рибонуклеазою або ДНК-ендонуклеазою, такою як дезоксирибонуклеаза; ДНКаза). Для вибірного руйнування пухлини антитіло може містити високорадіоактивний атом. Для одержання радіокон’югованих антитіл доступна множина радіоактивних ізотопів. Приклади включають 211 131 125 90 186 188 153 212 32 At , I , I , Y , Re , Re , Sm , Bi , P , 212 Pb і радіоактивні ізотопи Lu. Коли кон’югат застосовують для детектування, він може містити радіоактивний атом для сцинтиграфічних дослі99m 123 джень, наприклад tc або I , або спінову мітку для одержання зображення ядерно-магнітного резонансу (ЯМР) (також відомого як магнітнорезонансна томографія, МРТ), таку як знову йод123, йод-131, індій-111, фтор-19, вуглець-13, азот15, кисень-17, гадоліній, марганець або залізо. Радіоактивні або інші мітки можна вводити у кон’югат відомими способами. Наприклад, пептид можна біосинтезувати або синтезувати за допомогою хімічного синтезу амінокислот із застосуванням придатних попередників амінокислот, що містять, наприклад, фтор-19 замість водню. Мітки, 99m 123 186 188 111 такі як tc або I , Re , Re і In можна приєднати через цистеїновий залишок у пептиді. Ітрій90 можна приєднувати за допомогою лізинового залишку. Для введення йоду-123 можна використовувати спосіб IODOGEN (Fraker et al (1978) Biochem. Biophys. Res. Commun. 80:49-57). У "Monoclonal Antibodies in Immunoscintigraphy" (Chatal, CRC Press 1989) детально описані інші способи. 55 Кон’югати антитіла і цитотоксичного засобу можна одержувати із застосуванням різних засобів, які зв'язують білки, таких як N-сукцинімідил-3(2-піридилдитіол)пропіонат (SPDP), сукцинімідил4-(N-малеімідометил)циклогексан-1-карбоксилат (SMCC), імінотіолан (IT), біфункціональні похідні складних імідоефірів (такі як диметиладипімідат HCl), активні складні ефіри (такі як дисукцинімідилсуберат), альдегіди (такі як глутаральдегід), бісазидо сполуки (такі як біс-(пазидобензоїл)гександіамін), похідні біс-діазонію (такі як біс-(п-діазонійбензоїл)етилендіамін), діізоціанати (такі як толуол 2,6-діізоціанат) і біс-сполуки активного фтору (такі як 1,5-дифтор-2,4динітробензол). Наприклад, рициновий імунотоксин можна одержувати, як описано у Vitetta et al. Science, 238:1098 (1987). Мічена по вуглецю-14 1ізотіоціанатбензил-3метилдіетилентриамінпентаоцтова кислота (MXDTPA) являє собою ілюстративний хелатуючий засіб для кон’югації радіонуклеотиду з антитілом. Див. WO 94/11026. Лінкер може являти собою "лінкер, що розщеплюється", який полегшує вивільнення цитотоксичного лікарського засобу у клітині. Наприклад, можна використовувати кислотолабільний лінкер, пептидазочутливий лінкер, фотолабільний лінкер, диметильний лінкер або лінкер, що містить дисульфід (Chari et al., Cancer Research 52:127-131 (1992); патент США № 5208020). Сполуки за винаходом включають як необмежувальні приклади ADC, одержані з перехреснозшиваючими реагентами: BMPS, EMCS, GMBS, HBVS, LC-SMCC, MBS, MPBH, SBAP, SIA, SIAB, SMCC, SMPB, SMPH, сульфо-EMCS, сульфоGMBS, сульфо-KMUS, сульфо-MBS, сульфо-SIAB, сульфо-SMCC і сульфо-SMPB і SVSB (сукцинімідил-(4-вінілсульфон)бензоат), які є комерційно доступними (наприклад, у Pierce Biotechnology, Inc., Rockford, IL., U.S.A). Див. сторінки 467-498, 2003-2004 Applications Handbook and Catalog. Одержання кон’югатів антитіло-лікарський засіб: У кон’югатах антитіло-лікарський засіб (ADC) за винаходом, антитіло (Ab) кон’юговане з однією або декількома молекулами лікарського засобу (D), наприклад, з молекулами лікарського засобу у кількості від приблизно 1 до приблизно 20 на антитіло, за допомогою лінкера (L). ADC формули I можна одержувати декількома способами із засто 95958 56 суванням реакцій органічної хімії, умов і реагентів, відомих фахівцям у даній галузі, включаючи (1) реакцію нуклеофільної молекули антитіла з бівалентним лінкерним реагентом, з формуванням AbL за допомогою ковалентного зв'язку з подальшою реакцією з молекулою лікарського засобу D; і (2) реакцію нуклеофільної групи з молекули лікарського засобу з бівалентним лінкерним реагентом з формуванням D-L за допомогою ковалентного зв'язку з подальшою реакцією з нуклеофільною групою антитіла. У цьому документі описані додаткові способи одержання ADC. Ab-(L-D)р Формула I Лінкер може складатися з одного або декількох лінкерних компонентів. Ілюстративні лінкерні компоненти включають 6-малеімідокапроїл ("MC"), малеімідопропаноїл ("MP"), валін-цитрулін ("valcit"), аланін-фенілаланін ("ala-phe"), памінобензилоксикарбоніл ("PAB"), N-сукцинімідил4-(2-піридил-тіо)пентаноат ("SPP"), Nсукцинімідил-4-(N-малеімідометил)циклогексан-1карбоксилат ("SMCC") і N-сукцинімідил(4йодацетил)амінобензоат ("SIAB"). Додаткові лінкерні компоненти відомі у даній галузі і деякі описані у цьому документі. У деяких варіантах здійснення лінкер може містити амінокислотні залишки. Ілюстративні амінокислотні лінкерні компоненти включають дипептид, трипептид, тетрапептид або пентапептид. Ілюстративні дипептиди включають валін-цитрулін (vc або val-cit), аланін-фенілаланін (af або ala-phe). Ілюстративні трипептиди включають гліцин-валінцитрулін (gly-val-cit) і гліцин-гліцин-гліцин (gly-glygly). Амінокислотні залишки, що містяться в амінокислотному лінкерному компоненті, включають залишки, що зустрічаються у природі, а також мінорні амінокислоти і аналоги амінокислот, що не зустрічаються у природі, такі як цитрулін. Амінокислотні лінкерні компоненти можна конструювати і оптимізувати за їх селективністю для ферментативного розщеплення конкретними ферментами, наприклад, асоційованою з пухлиною протеазою, катепсином В, С і D або плазміновою протеазою. Ілюстративні структури лінкерних компонентів представлені нижче (де хвиляста лінія вказує ділянки ковалентного приєднання до інших компонентів ADC): 57 95958 58 Додаткові ілюстративні лінкерні компоненти і скорочення включають (де антитіло (Ab) і лінкер зображені, а р являє собою число від 1 до приблизно 8): Нуклеофільні групи антитіл включають як необмежувальні приклади (i) N-кінцеві аміногрупи, (ii) аміногрупи бічного ланцюга, наприклад, лізину, (iii) тіольні групи бічного ланцюга, наприклад цистеїну, і (iv) гідроксильні або аміногрупи цукрів, коли антитіло глікозильоване. Аміногрупи, тіольні і гідроксильні групи є нуклеофільними і здатні до реакції з формуванням ковалентних зв'язків з електрофільними групами на лінкерних молекулах і лінкерних реагентах, включаючи (i) активні складні ефіри, такі як складні ефіри NHS, складні ефіри HOBt, галогенформіати і галогенангідриди; (ii) алкілгалогеніди і бензилгалогеніди, такі як галогенацетаміди; (iii) альдегідні, кетонові, карбоксильні і малеімідні групи. Визначені антитіла містять міжланцюжкові дисульфіди, що відновлюються, тобто цистеїнові містки. Антитіла можна зробити реакційноздатними для кон’югації з лінкерними реагентами за допомогою обробки відновником, таким як DTT (дитіотреїтол). Таким чином, кожний цистеїновий місток, теоретично, буде формувати два реакційноздатних тіолових нуклеофіли. Додаткові нуклеофільні групи можна вводити в антитіла за допомогою реакції лізинів з 2-імінотіоланом (реагент Трота), що приводить до перетворення аміну у тіол. Реакційноздатні тіольні групи можна вводити в антитіло (або в його фрагмент) за допомогою введення одного, двох, трьох, чотирьох або більше залишків цистеїну (наприклад, одержуючи мутантні антитіла, що містять один або декілька неприродних амінокислотних залишків цистеїну). Кон’югати антитіло-лікарський засіб за винаходом можна також одержувати за допомогою модифікації антитіла з введенням електрофільних груп, які можуть реагувати з нуклеофільними замісниками на лінкерному реагенті або лікарському засобі. Цукри глікозильованих антитіл можна окиснювати, наприклад, за допомогою періодатних 59 95958 окиснювальних реагентів з формуванням альдегідних або кетонових груп, які можуть реагувати з аміногрупами лінкерних реагентів або молекул лікарського засобу. Одержані групи імінових основ Шиффа можуть формувати стабільний зв'язок або їх можна відновлювати, наприклад, боргідридними реагентами з формуванням стабільних амінових зв'язків. В одному з варіантів здійсненням реакція вуглеводної частини глікозильованого антитіла з оксидазою галактози або з метаперіодатом натрію може приводити до утворення у білці карбонільних груп (альдегіду і кетону), які можуть реагувати з відповідними групами на лікарському засобі (Hermanson, Bioconjugate Techniques). В іншому варіанті здійснення білки, що містять N-кінцеві залишки серину або треоніну, можуть реагувати з метаперіодатом натрію, приводячи до одержання альдегіду замість першої амінокислоти (Geoghegan & Stroh, (1992) Bioconjugate Chem. 3:138-146; US 5362852). Такі альдегіди можуть реагувати з молекулою лікарського засобу або нуклеофілом лінкера. Подібним чином, нуклеофільні групи на молекулі лікарського засобу включають як необмежувальні приклади аміногрупи, тіольні, гідроксильні, гідразидні, оксимні, гідразинові, тіосемікарбазонові, гідразинкарбоксилатні і арилгідразидні групи, здатні до реакції з формуванням ковалентних зв'язків з електрофільними групами на лінкерних молекулах і лінкерних реагентах, включаючи (i) активні складні ефіри, такі як складні ефіри NHS, складні ефіри HOBt, галогенформіати і галогенангідриди; (ii) алкіл- і бензилгалогеніди, такі як галогенацетаміди; (iii) альдегідні, кетонові, карбоксильні і малеімідні групи. У ще одному аспекті антитіло містить один або декілька залишків лізину, які можна хімічно модифікувати з введенням однієї або декількох сульфгідрильних груп. Антитільна частина молекули зв'язується з лінкерною частиною молекули через атом сірки сульфгідрильної групи. Реагенти, які можна використовувати для модифікації лізину, включають як необмежувальні приклади Nсукцинімідил S-ацетилтіоацетат (SATA) і гідрохлорид 2-імінотіолану (реагент Трота). В іншому варіанті здійснення антитіло може містити одну або декілька вуглеводних груп, які можна хімічно модифікувати так, щоб вони містили 2 6 і де кожний з R і R являє собою метил, кож3 4 7 ний з R і R являє собою ізопропіл, R являє со8 бою втор-бутил, кожний R незалежно вибраний з 60 одну або декілька сульфгідрильних груп. Антитільна частина молекули зв'язується з лінкерною частиною молекули, такою як елемент Stretcher, за допомогою атома сірки сульфгідрильної групи, як описано у цьому документі. В іншому варіанті здійснення антитіло може містити одну або декілька вуглеводних груп, які можна окиснювати з одержанням альдегідної (CHO) групи (див., наприклад, Laguzza, et al., J. Med. Chem. 1989, 32(3), 548-55). Відповідний альдегід може формувати зв'язок з реактивним центром на елементі Stretcher. Реактивні центри на елементі Stretcher, який може реагувати з карбонільною групою на антитілі, включають як необмежувальні приклади гідразин і гідроксиламін. Інші протоколи для модифікації білків з приєднанням або асоціацією елементів лікарських засобів описані у Coligan et al., Current Protocols in Protein Science, vol. 2, John Wiley & Sons (2002), включеній у цей документ як посилання у повному обсязі. Способи кон’югації молекул лінкер-лікарський засіб з направленими до клітин білками, такими як антитіла, імуноглобуліни або їх фрагменти, знаходяться, наприклад, в US5208020; US6441163; WO 2005037992; WO 2005081711 і WO 2006/034488, які, таким чином, всі включені у даний опис як посилання у повному обсязі. Альтернативно можна одержувати злитий білок, що містить антитіло і цитотоксичний засіб, наприклад, рекомбінантними способами або пептидним синтезом. Відрізок ДНК може містити відповідні області, що кодують дві частини кон’югату, які прилягають одна до одної або розділені областю, що кодує лінкерний пептид, який не порушує бажаних властивостей кон’югату. В іншому варіанті здійснення антитіло можна кон’югувати з "рецептором" (таким як стрептавідин) для використання у попередньому націлюванні, де кон’югат антитіло-рецептор вводять пацієнту з подальшим видаленням незв'язаного кон’югату з циркуляції із застосуванням очищувального засобу, а потім вводять "ліганд" (наприклад, авідин), який кон’югований з цитотоксичним засобом (наприклад, радіонуклеотидом). В одному з варіантів здійснення імунокон’югату цитотоксичний засіб, D, являє собою ауристатин формули DE або DF 9 10 CH3, O-CH3, OH і Н; R являє собою Н; R являє 11 собою арил; Z являє собою -O- або -NH-; R являє собою Н, C1-C8-алкіл, або -(CH2)2-О-(CH2)2-О
ДивитисяДодаткова інформація
Назва патенту англійськоюAntibody that binds to cd22, immunoconjugates and uses therefor
Автори англійськоюEbens Allen J. Jr, Gray Alane M., Liang, Wei-Ching, Wu, Yan, Yu Shang-Fan
Назва патенту російськоюАнтитело, которое связывается с cd22, иммуноконьюгат и их применение
Автори російськоюЭбенс Аллен Дж., мл., Грей Алан М., Лян Вей-Чин, В Янь, Юй Шан-Фань
МПК / Мітки
МПК: C12N 15/13, A61K 39/395, C07K 16/28, C12P 21/08, A61P 35/00
Мітки: cd22, антитіло, застосування, зв'зується, імунокон'югат
Код посилання
<a href="https://ua.patents.su/192-95958-antitilo-shho-zvzuehtsya-z-cd22-imunokonyugat-ta-kh-zastosuvannya.html" target="_blank" rel="follow" title="База патентів України">Антитіло, що зв’зується з cd22, імунокон’югат та їх застосування</a>
Попередній патент: Проникна для пари та водонепроникна підошва для взуття, взуття, виготовлене з такою підошвою, та спосіб виготовлення підошви та взуття
Наступний патент: Похідні лептоміцину
Випадковий патент: Профіль для рамного кріплення підземних виробок