Спосіб лікування запальних захворювань та пов’язаних з ними розладів та спосіб покращення рівня показників крові з використанням очищеної дріжджової рнк
Формула / Реферат
1. Спосіб лікування запалення та пов'язаних з запаленням захворювань за рахунок стабілізації клітинних мембран, який відрізняється тим, що ссавцям, які потребують такого лікування, призначають очищену дріжджову рибонуклеїнову кислоту в ефективній кількості, здатній покращувати симптоми запалення або пов'язаних з запаленням захворювань, та в фармакологічно придатних наповнювачах, носіях та розчинах.
2. Спосіб згідно з п. 1, який відрізняється тим, що ссавцям, які мають пошкодження клітинних мембран, призначають очищену дріжджову рибонуклеїнову кислоту в ефективній кількості, здатній стабілізувати пошкоджені клітинні мембрани, та в фармакологічно придатних наповнювачах, носіях та розчинах.
3. Спосіб згідно з п. 1, який відрізняється тим, що ссавцям, які потребують такого лікування, призначають очищену дріжджову рибонуклеїнову кислоту в ефективній кількості, здатній пригнічувати окиснення компонентів клітинних мембран тварин, та в фармакологічно придатних наповнювачах, носіях та розчинах.
4. Спосіб згідно з п. 1, який відрізняється тим, що ссавцям, які потребують такого лікування, призначають очищену дріжджову рибонуклеїнову кислоту в ефективній кількості, здатній нормалізувати NO-синтетазну активність, та в фармакологічно придатних наповнювачах, носіях та розчинах.
5. Спосіб згідно з п. 1, який відрізняється тим, що ссавцям, які потребують такого лікування, призначають очищену дріжджову рибонуклеїнову кислоту в ефективній кількості, здатній пригнічувати агрегацію тромбоцитів, та в фармакологічно придатних наповнювачах, носіях та розчинах.
6. Спосіб згідно з п. 1, який відрізняється тим, що ссавцям, які потребують такого лікування, призначають очищену дріжджову рибонуклеїнову кислоту в ефективній кількості, здатній запобігати або лікувати цитопенію крові, та в фармакологічно придатних наповнювачах, носіях та розчинах.
7. Спосіб згідно з будь-яким з пунктів 1-6, який відрізняється тим, що очищену рибонуклеїнову кислоту призначають інтрадермально, підшкірнo, перорально, інтраабдомінально, внутрішньом'язово або внутрішньовенно, або ж призначають за місцем запалення або вогнища пов'язаного із запаленням захворювання.
8. Спосіб згідно з будь-яким з пунктів 1-6, який відрізняється тим, що очищену рибонуклеїнову кислоту призначають у формі капсул.
9. Спосіб згідно з будь-яким з пунктів 1-6, який відрізняється тим, що очищену рибонуклеїнову кислоту призначають у формі супозиторіїв.
10. Спосіб згідно з п. 1, який відрізняється тим, що пов'язаним із запаленням захворюванням є інфаркт.
11. Спосіб згідно з п. 1, який відрізняється тим, що пов'язаним із запаленням захворюванням є інсульт.
12. Спосіб згідно з п. 1, який відрізняється тим, що пов'язаним із запаленням захворюванням є артрит.
13. Спосіб згідно з п. 1, який відрізняється тим, що пов'язаним із запаленням захворюванням є алергія.
14. Спосіб згідно з будь-яким з пунктів 1-13, який відрізняється тим, що очищену рибонуклеїнову кислоту призначають у вигляді фармацевтичної композиції, яка містить ефективну кількість очищеної рибонуклеїнової кислоти у фармакологічно придатних наповнювачах, носіях та розчинах.
15. Спосіб покращення рівня не менше одного показника крові за рахунок стабілізації мембран клітин крові, який відрізняється тим, що ссавцям, які потребують такого лікування, призначають очищену дріжджову рибонуклеїнову кислоту в ефективній кількості, здатній покращувати рівень не менше одного показника крові, та в фармакологічно придатних наповнювачах, носіях та розчинах.
16. Спосіб згідно з п. 15, який відрізняється тим, що показник крові вибирають з відповідних рівнів лейкоцитів, еритроцитів, тромбоцитів, гемоглобіну, нейтрофілів, еозинофілів та гематокритів.
17. Спосіб згідно з п. 15, який відрізняється тим, що ссавцю, який потребує профілактики або лікування анемії, призначають ефективну кількість очищеної рибонуклеїнової кислоти у придатних наповнювачах, носіях і розчинах.
18. Спосіб згідно з п. 15, який відрізняється тим, що ссавцю, який потребує профілактики або лікування тромбоцитопенії, призначають ефективну кількість очищеної рибонуклеїнової кислоти у придатних наповнювачах, носіях і розчинах.
19. Спосіб згідно з п. 15, який відрізняється тим, що ссавцю, який потребує профілактики або лікування нейтропенії, призначають ефективну кількість очищеної рибонуклеїнової кислоти у придатних наповнювачах, носіях і розчинах.
20. Спосіб згідно з будь-яким з пунктів 15-19, який відрізняється тим, що очищену рибонуклеїнову кислоту призначають інтрадермально, підшкірнo, перорально, інтраабдомінально, внутрішньом'язово або внутрішньовенно.
21. Спосіб згідно з будь-яким з пунктів 15-19, який відрізняється тим, що очищену рибонуклеїнову кислоту призначають у формі капсул.
22. Спосіб згідно з будь-яким з пунктів 15-19, який відрізняється тим, що очищену рибонуклеїнову кислоту призначають у формі супозиторіїв.
23. Спосіб згідно з будь-яким з пунктів 15-22, який відрізняється тим, що очищену рибонуклеїнову кислоту призначають у вигляді фармацевтичної композиції, яка містить ефективну кількість очищеної рибонуклеїнової кислоти у фармакологічно придатних наповнювачах, носіях та розчинах.
24. Спосіб виділення дріжджової рибонуклеїнової кислоти, який відрізняється тим, що виділену рибонуклеїнову кислоту очищають від білків та ДНК при допомозі багаторазової інкубації з прийнятними ферментами, зокрема панкреатином.
25. Спосіб згідно з п. 24, який відрізняється тим, що рибонуклеїнову кислоту одержують з Saccharomyces cerevisiaе.
26. Спосіб згідно з п. 24, який відрізняється тим, що рибонуклеїнову кислоту одержують з Candida utilis.
27. Спосіб згідно з п. 24, який відрізняється тим, що очищена рибонуклеїнова кислота має вміст азоту, що становить більше 14,5 мас. %.
28. Спосіб згідно з п. 24, який відрізняється тим, що очищена рибонуклеїнова кислота має вміст фосфору, що становить більше 8,5 мас. %.
Текст
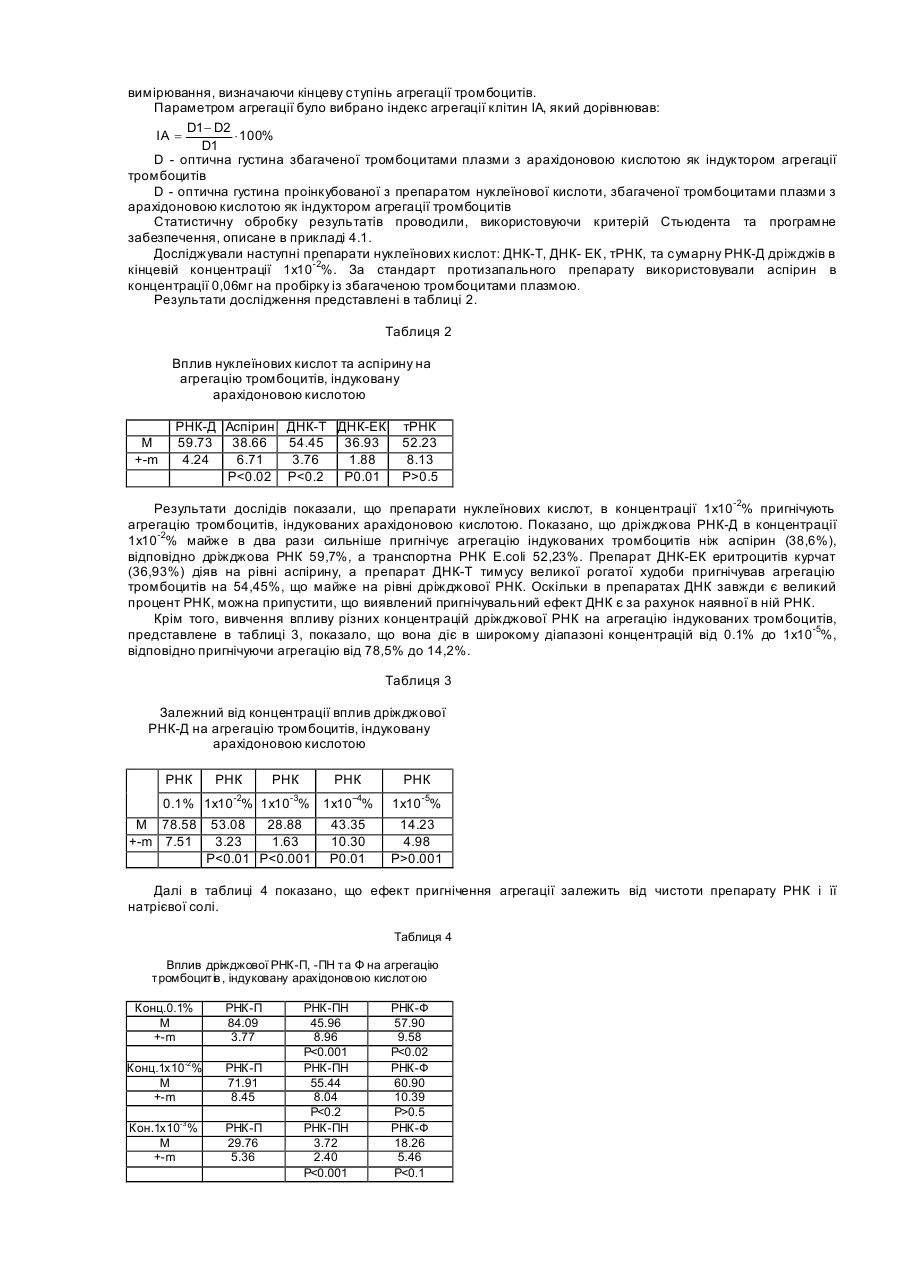
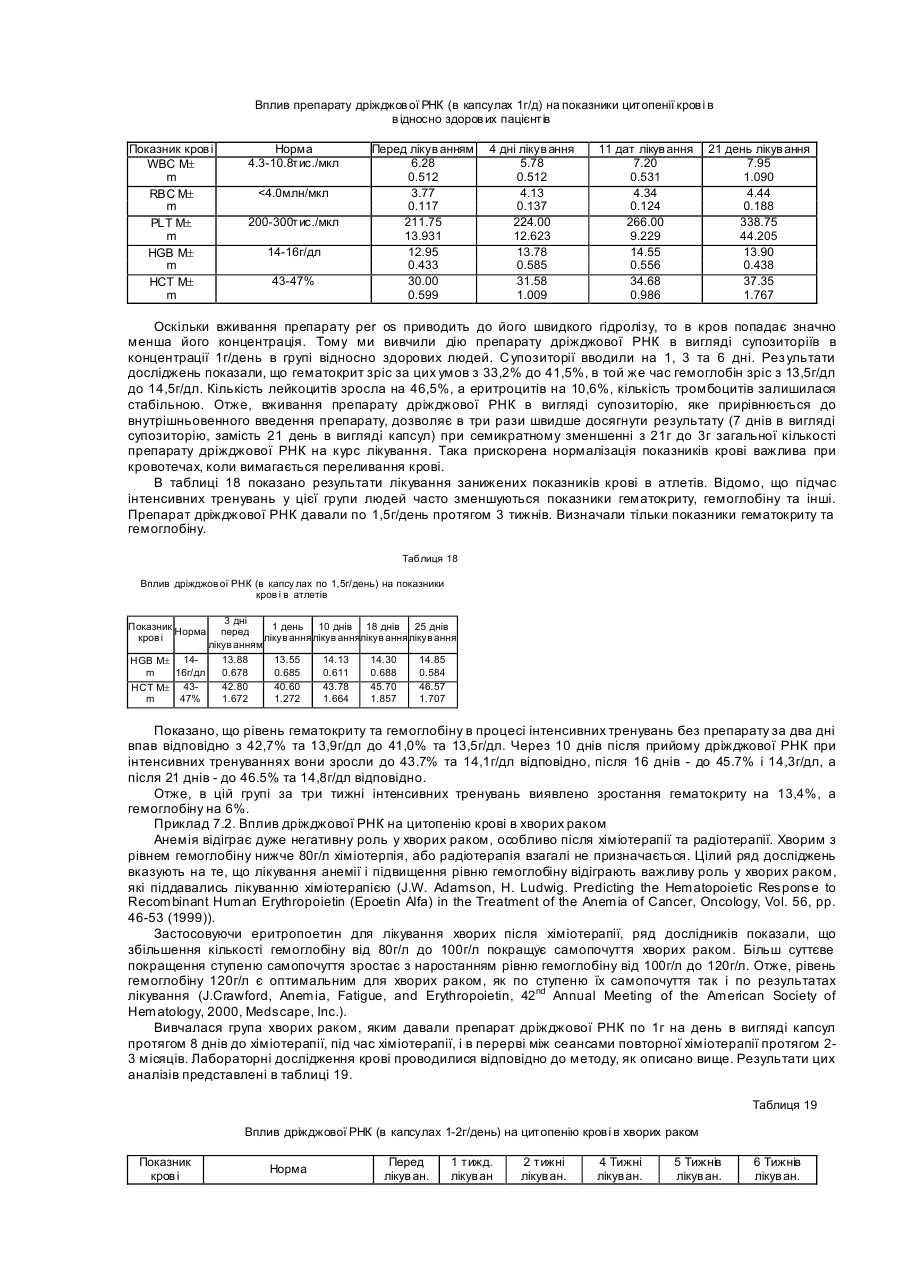
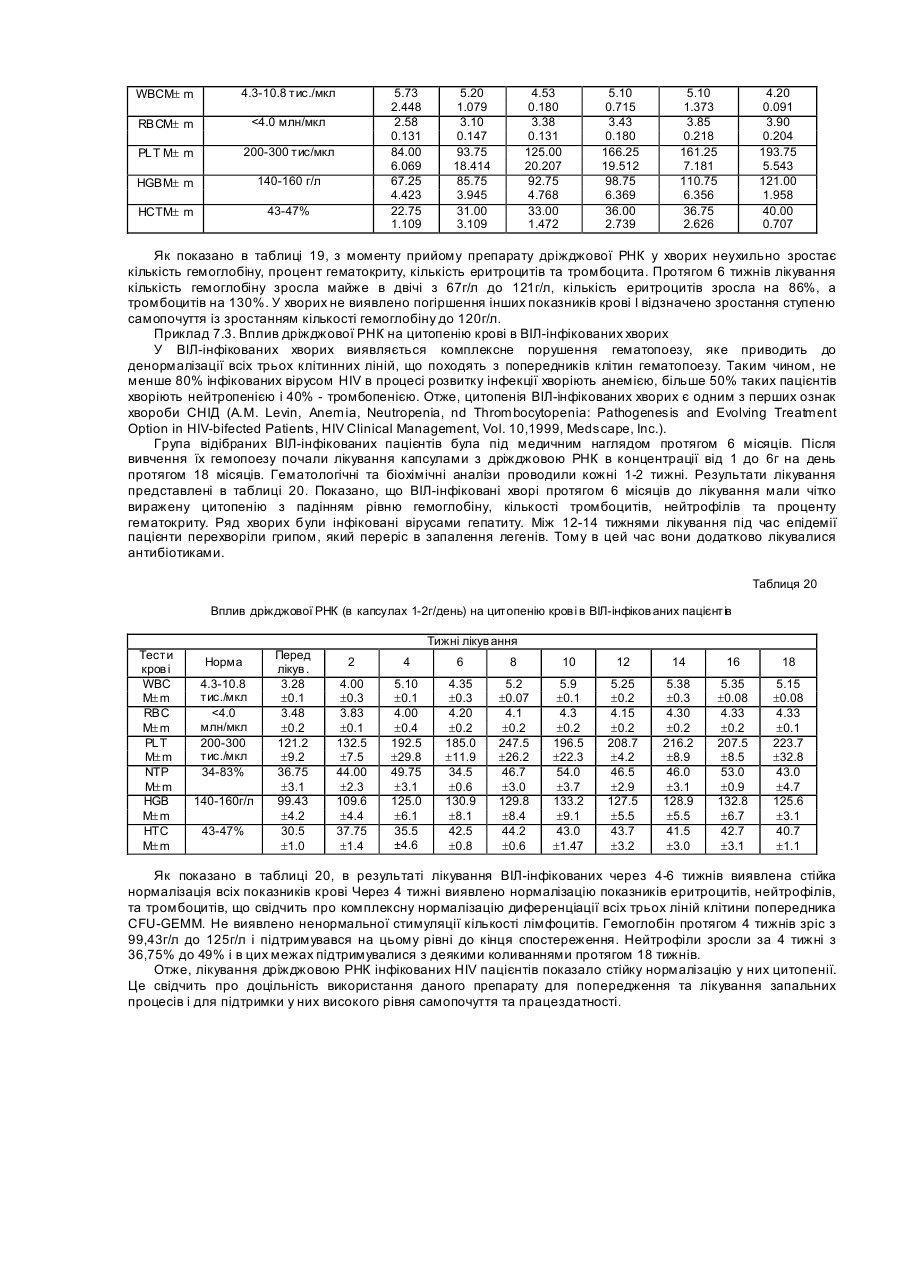
Даний винахід описує сполуку та фармацевтичну композицію для лікування запалення та хвороб, які супроводжують запальний процес, зокрема запалення, яке впливає на клітинну мембрану. Даний винахід також описує терапевтичні способи для покращення, або попередження запалення. Запалення Запалення завжди супроводжується змінами в обміні арахідонової кислоти, обміні оксиду азоту та утворенням вільних радикалів. Протизапальні нестероїдні препарати (ПЗНП), такі як аспірин, можуть блокувати певні етапи запального процесу, але вони не можуть стабілізувати клітинні мембрани, що обмежує їх вплив на запальний процес і робить цей вплив малоефективним. Запалення - це локалізована реакція живої тканини на пошкодження, яке виникає під впливом різних факторів екзогенного та ендогенного походження. Серед екзогенних факторів розрізняють фізичні, хімічні та біологічні. Серед ендогенних факторів виділяють медіатори запалення, антигени та антитіла. Ендогенні фактори часто утворюються під впливом екзогенних пошкоджень. Запальна реакція обов'язково супроводжується порушенням будови та проникненням клітинної мембрани. На рівні тканин та органів запалення проявляється болями, почервонінням, підвищенням температури, опухлістю, а деколи втратою функції. Запалення починається з сублетального пошкодження і закінчується або повним одужанням, або тривалим руйнуванням тканини. Без запалення неможливе одужання після поранення. У результаті ушкодження тканини виникає негайна відповідь, яка реалізується через медіатори, які виділяються внаслідок екзоцитозису, або лізису клітини. Головними медіаторами при запаленні є сполуки кінінової та фібринолітичної системи, системи компліменту, метаболіти арахідонової кислоти, судиноактивні аміни та інші хімічні речовини. До хімічних медіаторів запалення відносяться гістамін, серотонін, простагландини, білок, який відноситься до гену кальцитоніну, оксид азоту та ін. Важливу роль в запаленні відіграють також різноманітні види реактивного кисню. Ці сполуки синтезуються, коли кисень перетворюється у сполуки із сильно вираженими руйнівними властивостями, утворюючи вільні радикали. Це такі атоми або молекули, які мають неспарені електрони. Різноманітні вільні радикали мають різні рівні реактивності. Запуск запалення відбувається під впливом екзогенних і ендогенних агентів. За участю ендогенних факторів, а саме медіаторів, антигенів і аутоантигенів визначається вираженість та характер запальної реакції, особливості її протікання в місці ушкодження. Коли пошкодження обмежується утворенням медіаторів, розвивається гостре запалення. Коли ж в процес включаються імунологічні реакції, а саме послідуючі взаємодії антигенів, антитіл та аутоантигенів, це приводить до тривалого хронічного запального процесу. Різні агенти, наприклад, інфекція, травма, радіація, пошкоджуючи клітинну мембрану, запускають біохімічні реакції, які забезпечують протікання запального процесу на молекулярному рівні. В основі запальних процесів лежить метаболізм арахідонової кислоти, яка перетворюється в простагландини (PG), тромбоксани (ТХ) та лейкотриєни (LT). Простагландини, тромбоксани та лейкотриєни є головними учасниками усіх запальних процесів. Відомі два шляхи каскаду перетворень арахідонової кислоти. Перший шлях веде до утворення простагландинів G2 та Н2. Цей процес каталізується простагландинциклооксигеназою. Циклооксигеназа каталізує утворення PGA2, PGE2, PGD2, PGF2a, а тромбоксан-синтетаза з PGH2 утворює тромбоксан А2 (ТХА2) Найкраще вивченими метаболітичними шляхами є каскад перетворень арахідонової кислоти, яка утворюється з фосфоліпідів мембран з допомогою фосфоліпази А2. Через циклогеназний і ліпоксигеназні каскади арахідонова кислота перетворюється відповідно в простагландини та лейкотриєни. Циклооксигеназний шлях приводить до двох біологічно активних продуктів простациклину (PGI2) та тромбоксану (ТХА2). Ці продукта задіяні в багатьох різноманітних проявах запалення: звуження бронхів, розширення та звуження судин, агрегації тромбоцитів, аналгезії, піроксії і т.д. Інший шлях метаболізму арахідонової кислоти з допомогою 5-ліпоксигенази веде до утворення лейкотриєнів: LTA4, LTB4 , LTC4, LTD4 , LTE4 та LTF 4, які мають сильну протизапальну та звужуючу судини бронхів дію, разом з тим вони відіграють важливу роль в судинній проникливості. Лейкотриєни відіграють важливу роль як потенційно хемоактивні фактори, збільшують міграцію лімфоцитів та відповідають за багато дій речовин, які повільно виділяються при анафілаксисі (SRS-A). Простагландини можуть відігравати значну роль в розвитку системних запальних реакцій. При ревматоїдному артриті великі кількості простагландинів та лейкотриєнів в синовіальній рідині сприяють розвитку запального процесу і деміралізації навколосполучної кісткової тканини. Лейкотриєни вважаються основними патофізіологічними медіаторами запальних реакцій. Вони значно сильніше ніж простагландини впливають на проникність судин та адгезію лейкоцитів зі стінками судин, а також на розвиток набряку. Простагландини ефективно регулюють агрегацію тромбоцитів. PGE1-потужний інгібітор агрегації тромбоцитів, тоді як PGE2, який в нормі вивільняється з тромбоцитів, стимулює цей процес. Однак, головну роль у згортанні крові відіграє PGI2, або простациклін, який синтезується в стінках кровоносних судин з арахідонової кислоти. Це найпотужніший інгібітор агрегації тромбоцитів, що має судинорозширювальну дією. Синтезований в тромбоцитах тромбоксан має протилежну дію. При пошкодженні ендотелію відбувається адгезія тромбоцитів з субендотеліальною сполучною тканиною та агрегація тромбоцитів. Основну роль в цьому процесі відіграє тромбоксан А2. Навпаки, простагландин І2 інгібує агрегацію тромбоцитів. Тому від співвідношення простагландину І 2 та тромбоксану А2 залежить, чи буде нормально проткати процес коагуляції. Крім того, особливу роль в процесі одужання від запалення відіграє оксид азоту(NO). Цей газ дуже швидко проникає в різні органи та тканини і як вільний радикал він має високу реактивність. Оксид азоту має активність вазодилатора, нейротрансміттера та медіатора, тому він відіграє виключну роль при астматичному запаленні. Оксид азоту виробляється ендогенно з амінокислоти L-аргініну з допомогою NO-синтетази. Відомі три форми NO-синтетази. Дві форми є конститутивними, а третя індуцибельною. Індуцибельна NO-синтетаза, яка експресується в епітеліальних клітинах, швидко піднімає свою активність при виділенні протизапальних цитокінів, таких як інтерлейкін 1 бета (IL-1бета) та фактор некрозу пухлин (TNF-альфа). Оксид азоту має позитивні і негативні властивості відносно запального процесу. Дуже важливою потенційно позитивною властивістю NО є здатність розслаблювати бронхіальний гладенький м'яз, що зумовлює бронходиляцію. Серед несприятливих властивостей, виділяється його здатність сприяти запальному процесу шляхом збільшення хемотаксису нейтрофілів, моноцитів та еозинофілів, з допомогою гуанозин-монофосфат залежного механізму. Вважають, що він інгібує адгезію лейкоцитів до судинного ендотелію та бронхіального епітелію. NО відіграє виключну роль при астматичному запаленні. NО відіграє особливо важливу біологічну роль у визначенні базального судинного тонусу, регулює скорочуваність міокарду та модулює взаємодію між тромбоцитами та судинною стінкою (Zhou Q., Hellermann G.R., Solomonson L.P., Nitric oxide release from resting human platelets, Thromb.Res., 1;77(1):87-86; 1995). Відома участь NO в тромбоцитарній активації при патогенезі різноманітних судинних тромботичних захворювань людини, а також є дані, що NО-опосередковані ефекти знижені при гіпертонії (Calver Α., Collier J., Moncada S., Vallance P., Effect of local intra-arterial NG-monomethyl-L-arginin in patients with hypertension: the nitric oxide dilator mechanism appears abnormal, J.Hypertens., 10(9):1025-1031; 1990), діабеті (Calver Α., Collier J., Valance P., Inhibition and stimulation of nitric oxide synthesis in the human foream arterial bed of patients with insulin-dependent diabet, J.Clin.Invest., 90(6):2548-2554; 1992), та атеросклерозі (Drexler Η., Zeiher A.M., Meinzer K., Just H., Correction of endotelial dysfunction in coronary microcirculation of hypercholesterolaemic patient by Larginine, Lancet., 21-28; 338(8782-8783); 1546-1550; 1991). Ці дані вказують на можливість успішного лікування хворих з допомогою препаратів, які можуть підвищувати активність NO-синтетази. Тромбоцити людини здатні синтезувати оксид азоту. В високих кількостях, таких як це можуть робити ендотеліальні клітини, він може синтезуватися як інтактними тромбоцитами, так і стимульованими тромбоцитами, тому оксид азоту тромбоцитарного походження відіграє важливу роль в підтримці судинного гомеостазу та інших NO-чутливи х процесах (Zhou et al., 1995). Разом з спільними рисами, в кожному конкретному захворюванні запальний процес має свою специфіку, яка пов'язана з особливостями функціювання органу, чинниками, які спричиняють пошкодження: віруси, мікроорганізми, поранення, отруєння і т.д. Наприклад, спільним механізмом захворювань серця є порушення структури та функції мембрани клітин серця. Внаслідок цього, зростає синтез лейкотриєнів, тромбоксанів, яким притаманна коронароконстрикторна та проагрегатна дія. (Bangham A.D., Hill M.W., Miller N., Preparation and use of liposom as model of biological membranes, Methods in MembraneBiology, Acad. Press, V.1, N.Y., P.1-68, 1974). Важливим фактором патогенезу уражень серця є коронароконстрикторна та хемоатрактивна щодо нейтрофілів дія лейкотриєнів LTC4, LTD4, LTB4 (Hoshida S, Kuzuya Т., Nishida Μ., et al., Amer.J.Cardiol, 7; 63(10): 24E-2E; 1989; Lam B.K., Gagnon L., Austen K.F. et at, J.Biol.Chem., 15; 265(23): 13438-1341; 1990; Svendsen J.N., Hansen P.R., Ali S. et al., Cardiovasc.Res., 27(7): 1288-1294; 1993). Речовини, які зможуть блокувати цей процес, в свою чергу зможуть зменшувати розміри некрозу при гострому інфаркті і таким чином суттєво зменшити летальність при тяжких випадках захворювання серця, наприклад, при обширних інфарктах. Одночасно такі речовини повинні стабілізувати мембрани клітин серця. Відомо, що коронароконстрикторні та хемоаттрактивні ефекти при інфаркті супроводжуються зростанням агрегації тромбоцитів, тому блокування цього процесу теж буде приводити до зменшення розмірів ураження. Крім того, порушення агрегатного стану крові відіграють важливу роль в патогенезі багатьох захворювань, особливо це проявляється в патогенезі різних судинних тромботичних захворювань людини. Встановлено, що одним з ключових факторів розладу регуляції агрегатного стану крові є порушення тромбоцитарносудинної ланки гомеостазу. Вони приводять до зміни реологічних властивостей крові, сприяючи утворенню судинних агрегатів. Тромбоцитарні пошкодження приводять до порушення процесів мікроциркуляції, виникненню дефіциту притоку крові до тканин. Початковим етапом тромбоутворення є активація тромбоцитів, з їх наступною адгезією на пошкодженому ендотелію та агрегація з утворенням первинного тромбоцитарного тромба. Зараз існує достатньо доказів на користь тісної взаємодії між запальними порушеннями агрегатного стану крові та серцево-судинними розладами (Anderson J.L. Carlqist J.L., et al., Evaluation of C-reactive protein an inflammatory marker, and infectious serology as risk factors for coronary artery disease and myocardial infarction, J.Am. Coll. Card., 32: 35-41; 1998). Пошкодження клітинних мембран, або запальні процеси в організмі часто супроводжуються цитопенією. У багатьох випадках такі пацієнти мають анемію, тромбоцитопенію, або нейтропенію. Анемія супроводжується зменшенням кількості еритроцитів та гемоглобіну, яка супроводжується втратою крові, порушенням синтезу еритроцитів, збільшенням їх руйнування, або комбінацією цих факторів. В випадку тромбоцитопенії кількість тромбоцитів в крові зменшується, що приводить до порушення тромбогенезу та наступним крововиливом. Нейтропенія характеризується зменшенням кількості нейтрофілів в крові, яка часто веде до збільшення чутливості таких хворих до різноманітних інфекцій. Нормальне утворення клітин крові, або гемопоез, розпочинається з кровотворних стовбурових клітин попередників кісткового мозку, які називаються CFU-GEMM. Ці клітини в дорослих людей та тварин формуються в кістковому мозку та під впливом факторів росту перетворюються в спеціалізовані клітини крові. Наприклад, еритроцити утворюються з CFU-GEMM під впливом еритропоетину. Під впливом тромбопоетину CFU-GEMM перетворюються в тромбоцити. Відповідно, під впливом гранулоцит-макрофаг-колоній стимулюючого фактору CFU-GEMM перетворюється в гранулоцити та моноцити. В той же час лімфоцити походять з лімфоїдних стовбурови х клітин. Найбільш різко виражена цитопенія з тяжкими наслідками проходить в хворих раком, особливо після хіміотерапії, або радіотерапії, в хворих СНЩОМ та інфікованих вірусом HIV (J. Crawford, J.L. Gabrilove, Therapeutic Option for Anemia and Fatigue, Medscape, Oncology Treatment Update, 2000, Medscape, Inc.). Роль клітинних мембран при запаленні Функції клітинних мембран та їх взаємозв'язок з запаленням добре вивчено. Відомо, що плазматична мембрана клітин займає особливе місце серед мембранних стр уктур, виконуючи ряд найбільш важливих функцій: бар’єрну, транспортну, забезпечення контакту клітини із зовнішнім середовищем, бере участь в регуляції гомеостазу клітин, забезпечує сигнальні механізми цієї регуляції, визначає індивідуальність і цілісність клітин. Структурна організація, динаміка, функції мембран еритроцитів і закономірності різних типів гемолізу - осмотичного, окисного, імунного (викликаного гемолітичними вірусами, токсинами, комплементом), гемолізу детергентами, фотогемолізу та інших досліджені достатньо детально Bashford C.L., Alder G.M., Menestrina G.,et al., Membrane damage by hemolytic viruses, toxins, complement, and other cytotoxic agents. A common mechanism blocked by divalent cation. J. Biol. Chem., 15; 261(20): 9300-9308,1986; Osorie e Castro V.R., Ashwood E.R., Wood S.G., Vernon KP., Hemolysis of erythrocytes and fluorescence polarization changes elicited by peptide toxins, aliphatic alcohols, related glycols and benzylidene derivatives, Biochim. Biophys. Acta., 16; 1029(2): 252-258; 1990). Було показано, що варіювання рН зовнішнього середовища порушує баланс діючих на мембрані сил, що призводить до змін структурного стану і ступеню агрегації мембранних білків. При цьому виділяють структурну перебудову мембрани в діапазоні рН 7,0-6,0 і при зменшенні рН нижче 4,5 (Zavodnik I.B., Pileckaya Т.Р., Acid lysis of human erythrocytes, Biophizika., V.42, N.5, P.1106-1112, 1997). Внаслідок другого переходу відбувається дестабілізація мембрани з наступним лізисом еритроцитів. Відомо, що при рН 4,7 в еритроцитарній мембрані спостерігаються порушення глікокаліксу, що трансформуються в пори (Arvinte Т., Cudd Α., Schuk В., Nicolau С, Biochim. Biophys. Acta., 19; 981(1): 61; 1989). Зменшення рН середовища змінює конформацію, спосіб упаковки та рухливість фосфоліпідш модельних мембран. Агрегація денатурованих зниженням рН мембранних білків є причиною мембранних пошкоджень і кислотного лізису еритроцитів. Запропонована схема процесу гемолізу еритроцитів НС1, що зводиться до кооперативного протонування деякого центру в стромі або на мембрані еритроциту з наступним утворенням пор, достатніх для виходу гемоглобіну. Дослідження механізмів і закономірностей процесу кислотного гемолізу дозволяє отримати інформацію про структурн у організацію мембрани і взаємодіях, що її стабілізують. Найбільш відомими ендогенними стабілізаторами гемолізу еритроцитів (в основному досліджено осмотичний гемоліз) є альбумін плазми крові, іони металів К+, Na+, Mg2+ та особливо Са2+, що модулюють канали плазматичної мембрани еритроцитів, в тому числі, можливо, і протонний канал (Anderson D.R., Davis J.L., Carraway K.L., Calcium-promoted changes of the human erythrocyte membrane. Involvement of spectrin, transglutaminase, and a membrane-bound protease. J. Biol. Chem., 10; 252(19): 6617-6623, 1977), холестерол, адсорбований на поверхні еритроцитів (Hui S.W., Stewart С.М., Carpenter M.P., Stewart T.P. Effects of cholesterol on lipid organization in human erythrocyte membrane, J. Cell. Biol., 85(2): 283-291; 1980), та поліаміни, що зв'язуються з жирокислотними залишками фосфоліпідів мембран (Rennert O.M., Shukla J.B., Polyamines in health and disease Advances in Polyamine research, Raven Press, V.2, N.Y, P.195-21, 1978). Найбільш відомими активаторами ендогенного гемолізу еритроцитів є довголанцюгові жирні кислоти та (Rybszynska Μ., Csordas Α., Chain length-dependent interaction of free fatty acids with the erythrocyte membrane, Life Sci., 44(9): 625-632; 1989), особливо, вільні радикали кисню та азоту (Sato Y., Kamato S., Takahashi Т. et al., Mechanism of free radical-induced hemolysis of human erythrocytes: hemolysis by water-soluble radical initiator. 18; 34(28): 8940-8949; 1955; Sen T.,Ghosh Т.К., Chaudhuri A.K. Glucose oxidase-induced lysis of erythrocytes. J,Exp.Biol., 33;(1): 75-76; 1995; Wollny Т., Yacoviello L. Propogation of bleeding time by acute hemolysis in rats: a role for nitric oxide. Am. J. Physiol. 272(6): 2875-2884; 1997). Таким чином, є достатньо доказів, які свідчать, що структура мембрани змінюється в процесі запалення. Однак, модель порушення мембрани при запаленні не використовувалася для скрінінгу ліків, здатних лікувати та попереджувати запалення, або пов'язаних з запаленням захворювань. Незадовільний стан наявних протизапальних ліків Наявні протизапальні препарати не задовільняють сучасні вимоги, оскільки складність та різномаїття біохімічних реакцій при запаленні, відсутність точних даних про патогенез запалення, в значній мірі ускладнює відбір в експерименті фармакологічних препаратів, здатних регулювати запалення. Наявні препарати можуть впливати тільки на окремі етапи запального процесу. Досі не отримано препарату, здатного однаковою мірою регулювати більшість компонентів будь-якої запальної реакції. Більшість відомих нестероїдних протизапальних препаратів (NSAIDS) вибірково впливають на ті або інші фази цього патологічного процесу. Перш за все вони впливають на порушення проникливості через судини, які характерні при гострому запаленні та на різноманітні клітинні реакції, які властиві для хронічного запалення. До того ж, багато NSAIDS впливають на метаболізм через механізм вільних радикалів. Для первинного скринінгу протизапальних процесів використовують три основні групи методів. Спочатку вивчають вплив препаратів на ознаки запалення, які легко визначити. Це опухлість, гіперемія, некроз і т.д. Для більш поглибленого вивчення застосовують методи експериментальної терапії, моделі артритів, кардитів і т.д., які нагадують хвороби людей. На третьому етапі вивчають механізми впливу препаратів на конкретні метаболітичні шляхи. Внаслідок детального вивчення метаболізму арахідонової кислоти було запропоновано багато протизапальних препаратів, дія яких направлена на регуляцію утворення продуктів його метаболізму. Частіше всього такі речовини володіють активністю інгібіторів ферментів метаболізму арахідонової кислоти. Прикладом може бути запропонована як протизапальна фармакологічна комбінація інгібітора циклооксигенази 2 та інгібітора лейкотриєн А. суб.4 гідролази (Isakson, P.C., Anderson G.D., Gregory, S.A., Treatment of inflammation and inflammation-related disorders with a combination of a cyclooxygenase-2 inhibitor and a leukotriene A.sub.4 hydrolase inhibitor, United States Patent No. 5,990,148, Nov. 1999). Подібний підхід запропоновано на базі аналогів піримідину - складника нуклеїнових кислот (Connor D.T., Kostlan C.R., Unangst P.C., 2-heterocydic5-hydroxy-1,3-pyrimidines useful as antiinflammatory agents, United States Patent No. 5,240,929, Aug. 1993). Оскільки ці сполуки виявилися інгібіторами ключових ферментів метаболізму арахідонової кислоти 5ліпоксигенази та циклооксигенази, автори запропонували використати їх. як протизапальні препарати, для лікування дуже широкого спектру захворювань від алергічних захворювань та ревматоїдного артриту до атеросклерозу, інфаркту міокарда та інсульту (Haslanger M.F., Prostacyclin analogs and their use in inhibition of arachidonic acid-induced platelet aggregation and bronchoconstriction, United States Patent No. 4,192,891, Mar. 1980). Однак, оскільки запальний процес запускає дуже велику кількість метаболічних каскадів, використання інгібіторів, або аналогів метаболізму арахідонової кислоти не дає змоги збалансувати всі реакції і таким чином комплексно регулювати проходження запального процесу. Більше того, аспірин, який використовується в практичній медицині тривалий час, теж був запропонований для блокування ферментів метаболізму арахідонової кислоти. Інгібитори простагландинів, такі як аспірин, досить ефективно впливають на запальний процес. З цієї причини вони успішно використовуються в клініці для лікування ревматоїдного артриту, остеоартриту та інших запальних процесів. Аспірин має антикоагулятивну дію, оскільки він інгібує синтез ТХА2, проте хоч частково він діє на синтез PGl2. Щоденний прийом аспірину в дозах до 3г на добу дуже широко застосовують при профілактиці стенокардії та в постінсультному періоді, а також у людей з високим ризиком розвитку серцево-судинних захворювань. Однак, вивчення синтезів ТХА2 та PGI2 in vivo показало, що одне пероральне вживання 0,5-1г аспірину зменшує виділення PGl2 тільки на 2-3 години, тоді як виділення тромбоксану затримує на 10 днів (Vesterqvist О., Measurements of the in vivo synthesis of thromboxane and prostacyclin in humans, Scand. J. din. Lab. Invest 48(5): 401-407; 1988). Ця та інші роботи, Lorenz R.L., Boehlin В., Uedelhoven Μ. W., Weber P.C., Superior antiplatelet action of alternate day pulsed dosing versus split dose administration of aspirin, Am. J. Cardiol. 15; 64(18): 1185-1188; 1989), не тільки показують труднощі в призначенні дози аспірину, але й експериментально обґрунтовують ті часті побічні ефекти, які викликає аспірин при його тривалому застосуванні. Зокрема, аспірин, та інші нестероїдні протизапальні засоби, можуть бути причиною анафілактоїдних реакцій у чутливих до них людей. В їх основі лежить залежний від дози токсично-ідіосанкратичний, а не імунологічний механізм. Аспірин є причиною найбільш розповсюджених випадкових отруєнь, великому ризику піддаються діти, які перед отруєнням лікувались аспірином. Часто трапляються передозування аспірину, які складніше піддаються корекції. Ефективні дози аспірину при багатьох захворюваннях, наприклад, при ревматоїдному артриті становлять від 3 до 6,5г на день, що крім проявів токсичності, викликає подразнення шлунково-кишкового тракту. Аспірин важко переноситься хворими на шлунково-кишкові захворювання. Аспірин викликає ерозії та кровотечі виразки шлунку, діарею, виразку дванадцятипалої кишки. Аспірин широко застосовується завдяки своїй антитромбоцитичній активності, але він тяжко переноситься через свою властивість викликати побічні ефекти при використанні упродовж тривалого часу. Більше того, неспецифічно інгібуючи циклооксигеназу, аспірин впливає на синтез тромбоксану, який є сильним агрегатом та судинозвужуючим препаратом та вазоконстриктором, і може приводити до зменшення рівня простацикліну, який має одночасно антиагрегантні та судинорозширюючі властивості. Всі ці негативні прояви аспірину та інши х нестероїдних протизапальних лікарських засобів спонукають до пошуку нови х препаратів, які б, маючи протизапальну дію аспірину, були нетоксичними в широкому спектрі концентрацій, не викликали побічних проявів протягом дуже тривалого вживання, зупиняли та попереджували виникнення запальних вогнищ. Для лікування цитопенії використовують кровотворні фактори росту (J. Crawford, Hematopoietic Growth factor: Current Practice and Future Directions, 42-nd Annual Meeting of the American Society of Hematology, 2000, Medscape, Inc.). Однак, таке лікування досить складне та дороге. Наприклад, для лікування цитопенії у ВІЛінфікованих хворих в залежності від наявних порушень використовують фактори росту. У таких хворих для лікування анемії використовують еритропоетин, тромбопоетин використовують для лікування тромбопенії, a G-CSF використовують для лікування нейтропенії. Однак, лікування цитопенії у ВІЛ-інфікованих хворих вимагає дуже дорогих діагностичних досліджень ендогенного рівню зазначених факторів росту та дуже дорогих ліків цих факторів росту, у виробництві яких широко використовують рекомбінантну технологію. Тому досить важливим є пошук недорогих ліків, які можуть нормалізувати анемію, тромбопенію та нейтропенію хворих. Фармацевтичне використання нуклеїнових кислот Нуклеїнові кислоти широко використовуються як фармакологічні препарати. (Rothenberg Μ., Jonson G., Laughlin С. et al. Oligodeoxynucleotides as anti-sense inhibitors of gene expression: therapeutic implications, J. Natl. Cancer Inst., 18; 81(20): 1539-1544; 1989; Zon G., Oligonucleotides analogues as potential chemotherapeutic agents, Pharm. Res,, 5; (9): 539-549; 1988). Однак, фармакологічне використання нуклеїнових кислот не включає запалення та хвороби, які супроводжуються запаленням. Наприклад Anderson et al., запропонували метод лікування цитомегаловірусної інфекції у людей з допомогою олігонуклеотиду, який зв’язуючись з мРНК цитомегаловірусу модулює е фект даної інфекції. (Anderson К., Draper К., Baker В., Oligonucleotides for modulating the effects of cytomegalovirus infections, United States Patent No. 5,442,049, August 15, 1995). На основі специфічної нуклеїнової кислоти, яка кодує послідовність 3 нетрансльованого регіону протеїн кінази С, Boggs et al., запропонував метод діагностики та лікування захворювань, які асоційовані з протеїн кіназою С альфа. (Boggs R.T., Dean. N.M., Nucleic acid sequences encoding protein kinase С and antisense inhibition of expression thereof, United States Patent No. 5,681,747, Oct. 1997). Так, Yano et al., запатентували ДНК сполуку, отриману з Mycobacterium bovis та Bacillus subtilis для лікування виразки шлунку (Yаnо О., Kitano Т., Method for the treatment of digestive ulcers, United States Patent No. 4,657,896, Apr. 1987). Зокрема відомо, що рибонуклеїнова кислота (RNA), продукти її часткового гідролізу та синтетичні полінуклеотиди мають широкий спектр біологічної активності. (Kordyum V.A., Kirilova V.S., Likhachova L.I., Biological action of exogenous nucleic acids, Visnyk ASC USSR, V.41, N.6, P.67-78, 1977). Вони активують протеїновий синтез в клітинах (Sved S.C., The metabolism of exogenous ribonucleic acids injected into mice, Canad.J.Biochem.,V.43, N.7, P.949, 1965) та мають протипухлинну активність (Niu М.С., Effect of ribonucleic acid on mouse acids cells, Sciens., N.131, P.1321, 1960). Препарати РНК можуть збільшувати антитілоутворення та скорочують індуктивну фазу антитілогенезу (Johnson A.G., Schmidtke I., Merrit K. et al., Enhancement of antibody formation by nucleic acids and their derivatives, in Nucleic acid in immunology, Berlin, P.379,1968; Merrit K., Johnson A.G., Studies on the adjuvant of bacterial endotoxins on antibody formation, 6. Enhancement of antibody formation by nucleic acids, J.Immunol., V.94, N.3, P.416, 1965; Brown W., Nakono M., Influence of oligodeoxyribonucleotides on early events in antibody formation, Proc Soc. Exper. Biol. Med., 5, V.119, N.3, P.701,1967). Було показано, що деякі занижені або підвищені імунологічні показники під впливом дріжджової РНК нормалізувалися. Перш за все, це стосувалося Т-лімфоцитів, кооперації Τ та В-лімфоцитів, активації функції макрофагів і тд. Більше того, екзогенна РНК при поділі клітин використовується для синтезу ДНК, а при метаболізмі клітини для синтезу РНК. Показано, що через 2 години після введення екзогенна РНК включається в РНК лімфоцитів та макрофагів (Enesco N.E., Fate of 14C-RNA infected into mice, Exper. Cell Res., V.42, N.3, P.640, 1966). Отримано докази, які дозволяють припускати, що дріжджова тРНК може включатися в клітини у формі інтактних молекул. (Herrera F., Adarason R.H., Gallo R.C., Uptake of transfer ribonucleic acid by normal and leucemic cells, Proc. NatAcad. Sci. USA, 67(4): 1943-1950; 1970). Аналітичними методами показано, що РНК, зокрема, присутня в усіх мембранах тваринних клітин (в мембранах ендоплазматичного ретикулуму, мітохондрій, ядра, та плазматичних мембранах). В залежності від типу тканини, та методу виділення, вміст РНК коливається в межах від 0,5 до 4% сухої ваги мембран. Експериментальні дані свідчать, що в мембранах наявна особлива мембранна РНК. (Shapot V.S., Davidova S.Y., Liponucleoprotein as an integral part of animal cell membrans. Prog. Nucleic Acid Res. 11: 81-101; 1971; Rodionova N.P., Shapot V.S. Ribonucleic acid of the endoplasmatic reticulum of animal cells. Biochim et Biophis Acta, 24; 129(1); 206-209; 1966). Функції такої мембранної РНК до кінця не ясні. Функції рибосомальної РНК мембран краще вивчені. (Cundliffe E., Intracellular distribution of ribosoms and poliribosomes in Bacillus megaterriium. J.Mol.Biol., 28; 52(3): 467-481; 1970) Рибосомальна РНК міститься в бактеріальних мембранах, в інших мембранах ядра, внутрішні х та зовнішніх мембранах мітохондрій, внутрішніх мембранах апарату Гольджі, який прилягає до плазматичної мембрани, в шороховатому ендоплазматичному ретикулумі, в різноманітних тканинах тварин, людей, рослин, мікроорганізмів та простіших. Вважають, що гліколіпіди та глікопротеїни мембран, які містять N-ацетилнеурамінову кислоту, зв'язують рибосомальну РНК з рибосомами, оскільки мембрани, які оброблені неуронідазою, втрачають здатність зв'язуватися з рибосомами (Scott-Burden Т., Hawtrey А.О., Preparation of ribosome free membranes from rat liver microsomes by means of lithium chloride. Biochem. J. 115(5): 1063-1069; 1969. Крім того можливо, що місця зв'язування рибосом з мембранами активуються статевими гормонами, причому канцерогени пошкоджують цей фізіологічний механізм. На користь цього висновку свідчить зменшення рівня мембранозв'язаної РНК в процесі старіння.(Mainwarhig W.J. The effect of age on protein synthesis in mouse liver. Biochem J. 113(5): 869-878; 1969) та після кастрації тварин (Tata J.R., The formation, distribution and function of ribosomes and microsomal membranes during induced amphibian metamorphosis. Biochem J. 105(2): 783-801, 1967). Видалення з мембрани сперміну веде до відокремлення від мембрани частини зв’язаної з нею РНК (Khawaja J.A. Interaction of ribosomes and ribosomal subparticles with endoplasmic reticulum membranes in vitro: eifect of spermine and magnesium. Biochim. Biophis. Acta., 29; 254(1): 117-128); 1971). При обробці мембран РНК-азою нативних малих рибосом клітин мієломи, вони відщеплюються від мембрани, тоді як великі нативні субодиниці рибосом залишаються зв'язаними з мембраною (Mechler B., Vassalli P., Membrane-bound ribosomes of myeloma cells.I.Preparation of free and membrane-bound ribosomal fractions. Assessment of the methods and properties of ribosomes. J.Cell.BioI. 67(1): 1-15; 1975. До того ж, нуклеотидні компоненти різноманітних мембранних ферментів, наприклад поліА-РНК фосфофр уктокинази, складає можливий пул мембранної РНК. (Hofer H.W., Pette D. The complex nature of phosphofructokinase - a nucleic acid countaining enzyme, life Sci. 4(16): 1591-1596; 1965). Однак, нуклеїнові кислоти і особливо РЫК або ш сполуки до сих пір не використовуються для лікування, чи попереджування запалення, або пов'язаних з запаленням захворювань. Більшість досліджень з РНК виконувалися раніше на рівні in vitro. Більше того, ні один з цих методів не дозволяє безпосередньо використовува ти РНК для лікування, або попередження запалення, чи пов'язаних з запаленням захворювань. Потреба нових ліків Таким чином, зараз є потреба в нових протизапальних препаратах, які будуть регулювати розлади агрегатного стану крові і будуть мати менше негативних ефектів ніж аспірин та інші нестероїдні протизапальні лікарські засоби. Більше того, оскільки запальний процес у своїй початковій стадії супроводжується змінами в структурі та функції мембран багатьох клітин, які беруть участь у запальному процесі, потрібні ліки, які б не тільки регулювали всі компоненти запального метаболічного каскаду, але також стабілізували структур у та функцію мембрани цих клітин. Зокрема, оскільки традиційна терапія є малоефективною при обширних інфарктах, які ускладнені кардіогенним шоком, існує потреба в нових ліках, здатних зупинити руйнування кардіоцитів. Даний винахід пропонує сполуку, фармацевтичну композицію та спосіб лікування, попередження запалення та пов'язаних з ним процесів. Сполука - це активний інградієнт, який складається з РНК, зокрема РНК, виділеної з дріжджів. Дріжджова РНК є гетерогенною сполукою низькомолекулярної РНК, яка включає різну кількість нуклеотидів, в основному від 5 до 25 нуклеотидів, полімерів нуклеотидів. В дріжджовій РНК переважають олігонуклеотиди та транспортна РНК з великою кількістю мінорних основ. Оскільки, головною властивістю всіх запальних процесів на молекулярному рівні є зміна проникливості та структури мембрани, даний винахід використовував метод відбору ліків, який грунтується на їх здатності стабілізувати клітинну мембрану при запаленні. Таким чином, аналізуючи руйнівні механізми, індуковані в плазматичних мембранах різними факторами, та вивчаючи структурні елементи їх взаємодії, які забезпечують оптимальну організацію клітини, можна відібрати для практичної медицини ліки, які мають мембраностабілізуючу дію. Так як зараз встановлено, що мембрани мають низькомолекулярну РНК, яка ймовірно відіграє мембрано-стабілізуючу роль, введення в організм екзогенної низькомолекулярної РНК приведе до стабілізації пошкодженої мембрани, наприклад, тих клітинних мембран, які перебувають в запальному процесі. Стабілізація клітинної мембрани сполукою даного винаходу, приводить до нормалізації метаболізму арахідонової кислоти та обміну оксиду азоту, що має значну протизапальну дію, та є головним учасником запальних процесів, наприклад ревматоїдного артриту, остеоартриту, алергій (таких як астма), та інших запальних проявів, таких як біль, набряк, жар, псоріаз, запалення кишечника, шлунково-кишкові виразки, серцево-судинні захворювання, включно з ішемічним захворюванням серця, атеросклерозом, частковим пошкодженням мозку, викликаним інсультом, захворювання шкіри (екзема, сонячна еритема, вугрі), лейкотриєн- опосередковані запалення легень, нирок, гастрокишкого тракту, шкіри, простатити та парадонтози. Дріжджова РНК є ефективною при зменшенні активності iNOS під час аутоімунних процесів, як на початку хвороби, так і в хронічній стадії. Ці властивості дають змогу використовувати дріжджову РНК при патологічних процесах, які супроводжуються індукцією iNOS: діабет, рак, гепатит, інфекційні хвороби, нейродегенеративні хвороби (хвороби Паркінсона, Альцгеймера, розсіяний склероз, енцефаліт), та інші. Більше того, використання природних молекул нуклеїнових кислот, таких як сполуки даного винаходу в високих концентраціях як фармакологічні препарати, не приводить навіть до незначної побічної дії, особливо маючи на увазі той факт, що ці сполуки постійно вводяться в людські та тваринні організми разом з їжею. Крім того, даний винахід пропонує спосіб лікування запалення та пов'язаних з запаленням захворювань, що передбачає введення ссавцям, які потребують такого лікування, дріжджової рибонуклеїнової кислоти в ефективній кількості, та в фармакологічно придатних наповнювачах, носіях та розчинах, для покращення симптомів запалення, або пов'язаних з запаленням захворювань. Більше того, даний винахід пропонує спосіб стабілізації пошкодження клітинних мембран, що передбачає введення ссавцям, які мають пошкодження клітинних мембран, дріжджової рибонуклеїнової кислоти в ефективній кількості, та в фармакологічно придатних наповнювачах, носіях та розчинах. Більше того, даний винахід пропонує спосіб нормалізації NO-синтетазної здатності, що передбачає введення ссавцям, які потребують такого лікування, дріжджової рибонуклеїнової кислоти в ефективній кількості, та в фармакологічно придатних наповнювачах, носіях та розчинах. Більше того, даний винахід пропонує спосіб пригнічення окиснення компонентів клітинних мембран тварин, що передбачає введення ссавцям, які потребують пригнічення окиснення компонентів клітинних мембран тварин, дріжджової рибонуклеїнової кислоти в ефективній кількості, та в фармакологічно придатних наповнювачах, носіях та розчинах. Більше того, даний винахід пропонує спосіб пригнічення агрегації тромбоцитів, що передбачає введення ссавцям, які потребують такого лікування, дріжджової рибонуклеїнової кислоти в ефективній кількості для пригнічення агрегації тромбоцитів, та в фармакологічно придатних наповнювачах, носіях та розчинах. Більше того, даний винахід пропонує спосіб покращення рівня не менше одного показника крові, що передбачає введення ссавцям, які потребують такого лікування, дріжджової рибонуклеїнової кислоти в ефективній кількості та в фармакологічно придатних наповнювачах, носіях та розчинах для покращення рівню не менше одного показника крові. Показником крові є будь-який показник, що представляє рівні лейкоцитів, еритроцитів, тромбоцитів, гемоглобіну, нейтрофіли та гематокрит. Більше того, даний винахід пропонує спосіб попередження та лікування будь-якої цитопенії, анемії, тромбоцитопенії, нейтропенії, що передбачає введення ссавцям, які потребують такого лікування, дріжджової рибонуклеїнової кислоти в ефективній кількості та в фармакологічно придатних наповнювачах, носіях та розчинах. Рибонуклеїнова кислота вводиться в кількості в межах приблизно 0,1мг до приблизно 1г на кг ссавців, наприклад, в межах від 0,1 до 1г, частіше від 250 до 350мг. Разом з тим, даний винахід пропонує сполуку рибонуклеїнової кислоти, виділеної з дріжджів, наприклад з Saccharomyces cerevisiae або з Candida utilis. Бажано, щоб рибонуклеїнова кислота мала вміст азоту більше ніж 14.5% від ваги, кількість фосфору більше ніж 8.5% від ваги, більш бажано, щоб кількість азоту була більше ніж 14.7%, а кількість фосфору більше 8.6% від ваги, ще більш бажано, щоб кількість азоту була більше 15.0%, а кількість фосфору більше 9.0% від ваги. Більше того, даний винахід пропонує фармацевтичну композицію, для лікування та попередження запалення та пов'язаних з запаленням захворювань, що передбачає введення ссавцям дріжджової рибонуклеїнової кислоти в фармакологічно придатних наповнювачах, носіях та розчинах. Проведено комплексне вивчення відомих нуклеїнових кислот, використовуючи різноманітні моделі in vitro та in vi vo. Відібрані моделі відповідали певному типу запального процесу, або звичайного або імунологічного походження. Вивчення впливу рибонуклеїнової кислоти (РНК), а саме дріжджової РНК, порівнювали до дії відомих протизапальніх ліків в широкому діапазоні протизапальної активності. Резюме експериментальних моделей та результатів 1. Модель агрегації тромбоцитів in Vitro Первинний скринінг препаратів екзогенних нуклеїнових кислот проводили in vitro на моделі агрегації тромбоцитів людини, індукованих арахідоновою кислотою. (Born L.V.R. The aggregation of blood platelets by difosfate and its reversal, Nature, V.94, P.327, 1962). Вивчали екзогенні ДНК і РНК прокаріотів та еукаріотів. За стандарт ми брали широко відомий протизапальний препарат аспірин. Показано, що аспірин пригнічував агрегацію тромбоцитів, індукованих арахідоновою кислотою до певного рівню. Дезоксирибонуклеїнова кислота еритроцитів курчат ДНК-ЕК фірми "Reanal" (Угорщина) пригнічувала агрегацію тромбоцитів в межах дії аспірину. В той же час, ДНК тимусу великої рогатої худоби (ДНК-Т) та транспортна РНК E.coli (тРНК) виробництва "Serva" (США) пригнічували агрегацію індукованих тромбоцитів майже в два рази. Найвищий пригнічувальний ефект виявила сумарна РНК дріжджів, яка суттєво пригнічувала агрегацію тромбоцитів в широкому діапазоні концентрацій. РНК-Ф, забруднена білком, діє на третину слабше. Пригнічення агрегації тромбоцитів дріжджовою РНК залежить від того, чи перебуває вона у вигляді кислоти або у вигляді натрієвої солі, від рівня її чистоти та наявності білку. Натрієва сіль дріжджової РНК-ПН в високій концентрації активна тільки на половину, а в низькій концентрації не діє. Оскільки, модель агрегації тромбоцитів, індукованих арахідоновою кислотою, використовується для відбору протизапальних препаратів, можна вважати, що препарати нуклеїнових кислот, і особливо дріжджова РНК має сильно виражені протизапальні властивості. 2. Модель кислотної резистентності мембран еритроцитів in Vitro Виходячи з визнання, що головним проявом запального процесу є порушення мембрани клітини, ми застосували модель кислотної резистентності мембрани еритроцитів in vitro для скринінгу мембранопротекторних і таким чином протизапальних властивостей цих препаратів. Для вивчення імуностабілізуючої дії екзогенних нуклеїнових кислот вибрали еритроцити щурів. Вивчали реакцію мембран еритроцитів на пошкоджуючу дію нітрит аніону. За допомогою визначення кислотної резистентності еритроцитів кінетичним методом оцінювали мембрано-стабілізуючу дію екзогенних нуклеїнових кислот та пошкоджуючу дію екзогенного і ендогенного нітрит аніону (Terskov I.A., Hittelzon I.I., Chemical (acid) erythrogram method, Biophizika, 2(2): 259-266; 1957). Суть методу полягає у визначенні динамки зміни кількості клітин, що гемолізують під дією слабкої кислоти за певний проміжок часу. Лізис еритроцитів в кислому середовищі включає три основних стадії: проникнення іонів водню (протонів, Н+) через плазматичну мембрану еритроцитів, протонування гемоглобіну та білку мембрани і, як наслідок останнього, осмотичне руйнування еритроцитів. Використовуючи цей метод, ми оцінювали вплив екзогенних нуклеїнових кислот на кінетику проходження протону через плазматичну мембрану еритроцитів, що залежить від стану її нативності. Швидкість проникнення протону в цитозоль клітини в великій мірі залежить від стану окиснення як ліпідних (Kellogg E.W., Fridovich I., Liposome oxidation and erythrocyte lysis by enzymically generated superoxide and hydrogen peroxide J. Biol. Chem. 10; 252(19): 6721-6728; 1977) так і білкових компонентів, особливо білку полоси 3 окиснення плазматичної мембрани та визначається як активністю [Н+]-АТФ-аз так і різного типу обмінників (Sato Y., Kamo S., Takahashi Т., Su zuki Υ., Mechanism of free radical- induced hemorysis of human erythrocytes: hemolysis by water-soluble radical initiator, Biochemistry, 18; 34(28): 8940-8949; 1995; Lukacs G.L., Kapus Α., Nanda A. et al, Proton conductance of the plasma membrane: properties, regulation, and functional role, Am. J. Physiol, 265(1 Pt 1): C.3-C.14; 1993). Кінетичним методом записували кислотні еритрограми. В дослідах in vitro, записували кислотні еритрограми в присутності нітриту натрію (пошкоджуючий чинник) та різних концентрацій екзогенних нуклеїнових кислот. Використовуючи модель окисного руйнування еритроцитів нітрит аніоном, в дослідах in vitro показано стабілізуючу та мембрано-протекторну дію екзогенних нуклеїнових кислот. На цій моделі кислотної резистентності мембрани еритроцитів вивчали набір тих же препаратів, що і на моделі агрегації тромбоцитів. Показано, що препарати дріжджової РНК в широкому спектрі концентрацій володіють мембранопротекторними властивостями. Більш детальне вивчення показало, що мембранопротекторна дія дріжджової РНК залежить від форми її перебування (кислота чи сіль), її чистоти, наявності білку. Найбільш ефективнішою виявилася особливо очищена рибонуклеїнова кислота РНК-П, характер еритрограми якої в концентрації 10 та 100mκτ був аналогічним нормі. Натрієва сіль дріжджової РНК-ПН виявилася менш ефективною, особливо в концентрації 10mκτ. Забруднення дріжджової РНК-Ф білком взагалі приводило до втрати мембраностабілізуючої дії. Інші препарати, тРНК, ДНК-Т, ДНК-ЕК в вивчених концентраціях приводили до дестабілізації мембрани еритроцитів, тому, незважаючи на їх деякі протизапальні властивості на інших моделях, їх не можна застосовувати як протизапальні препарати. 3. Еритроцита модель автоімунної реакції в щурів Ми використовували модель окисного пошкодження плазматичних мембран еритроцитів для дослідження мембраностабілізуючої дії екзогенних нуклеїнових кислот. Окисне пошкодження білкових та ліпідних компонентів плазматичної мембрани еритроцитів мало місце в дослідах in vivo в процесі розвитку автоімунної реакції (адювантний артрит), за якої значно активувався біосинтез оксиду азоту, що є активним окислюючим агентом, особливо гемоглобіну еритроцитів (Eich R.F., Li Т., Lemon D.D. Mechanism of NO-induced oxidation of myoglobin and hemoglobin. Biochemistry, 4; 35(22): 6976-6983; 1966; Huot A.E., Kruszyna H., Kruszyna R et al., Formation of nitric oxide hemoglobin in erythrocytes co-cultured with alveolar macrophages taken from bleomycintreated rats. Biochem.-Biophys. Res. Commun., 15; 182(1); 151-158; 1992; Kosaka H., Harada N., Watanabe M. et al. Synergistic stimulation of nitric oxide hemoglobin production in rats by recombinant interleukin 1 and tumor necrosis factor. Biochem. Byophis. Res. Commun. 30; 189(1): 392-398; 1992). Оксид азоту, так як і пероксид водню відіграють критичну роль в пошкодженні клітин, в тому числі клітин крові, в процесі розвитку автоімунної реакції. Протизапальні цитокіни (гама-інтерферон, IL-1) індукують експресію індуцибельної форми NOсинтетази (iNOS). Досліджували зміни активності NOS в крові щурів в динаміці розвитку аутоімунної реакції (ад'ювантного артриту), для того щоб оцінити імуномодулюючий ефект препарату а також отримати інформацію про можливі рівні одного з найбільш активних окисних гемолітиків - оксиду азоту ( у вигляді його стабільного метаболіту нітрит-аніону). Визначали активність ферменту NO-синтетази (NOS), яка виробляє ендогенний нітрит аніон. Ці показники характеризують захисну дію екзогенних нуклеїнових кислот від руйнівного впливу нітрит аніону щодо мембрани еритроцитів. Особливий інтерес до змін стабільності еритроцитів в процесі розвитку автоімунних реакцій з нашого боку викликаний великою кількістю даних щодо наявності імуномодуляторних властивостей у еритроцитів (Karalnik B.V., Erythrocytes, their receptors, and immunity, Uspekhi Sovremennoy Biologii., V.112, N.1, P.52-61, 1992; Prokopenko L.H., Siplivaya L.E., Erythrocytes as modulators of immunologic reactions, Uspekhi Phiziologicheskikh Nauk., V.23, N.4, P.89-106, 1992), що дало можливість навіть використовува ти поняття "еритроцитарна імунна система". Розвиток аутоімунного процесу супроводжувався значним зниженням кислотної резистентності еритроцитів в ранній період і, навпаки, значним перевищенням нормальної стабільності в завершальний період. Дріжджова РНК підвищувала стабільність мембрани, нормалізуючи процес транспорту протонів, що обумовлюється станом білкових та ліпідних компонентів плазматичної мембрани еритроцитів в ранній період і підтримувала на стабільному рівні, близькому до рівня норми, в наступний період аутоімунної реакції. Отже показано, що за розвитку аутоімунного процесу активність NOS в крові щурів змінюється. Доказано збільшення активності NOS в крові щурів і на початковій і в кінцевій стадіях розвитку цього процесу. Дріжджова РНК так зменшує активність NOS, що в прикінцевій стадії процесу вона практично нормальна. Разом з тим, розвиток аутоімунного процесу супроводжується значним зниженням кислотної резистентності еритроцитів на ранній стадії і, навпаки, суттєвим надлишком щодо норми на завершальній стадії, в порівнянні зі стійкістю нормальних еритроцитів. Дріжджова РНК збільшувала стабільність мембран на початковій стадії процесу, нормалізуючи транспорт протонів, який залежить від стану білкових і ліпідних компонентів еритроцитарної плазматичної мембрани і підтримував на стабільному рівні, близькому до рівня норми, в наступний період розвитку аутоімунної реакції. Приймаючи до уваги вищесказане, захисні властивості дріжджової РНК, як показано на моделі аутоімунного процесу, доказують здатність її лікувати не тільки алергічні хвороби, а також інші хронічні запальні процеси, такі як артрит, атеросклероз, а також інші захворювання, які включають аутоімунні реакції. 4. Модель набряку у мишей, викликаного карагеніном Для відбору препаратів нуклеїнових кислот з протизапальною дією, використовували відому модель запального набряку ніжки мишей, спричиненого підшкірним введенням карагеніну. Викликаний карагеніном набряк чутливий до дії препаратів, які зменшують капілярну проникливість. На початку карагенінзалежного антизапального процесу важливу роль відіграє кінін, а на пізніх стадіях більш важливими є протеолітичні ферменти і простагландини. Карагенінова модель - це поступовий процес, що дає достатньо часу, для дослідження біохімічних механізмів протизапальної дії ліків. Тому ми використовували дану модель, для вивчення впливу дріжджової РНК на синтез тромбоксану та лейкотриєну. Разом з тим, ми вивчали вплив дріжджової РНК на NO-синтетазну активність. Вивчення протизапальної дії препаратів нуклеїновихкислот на карагеніновій моделі показало, що вони мають значну протизапальну активність. Однак, тільки дріжджова РНК в концентрації 10мг на мишку дає 50% пригнічення набряку. На мишах вивчали дріжджову РНК в концентраціях від 1 до 15мг на мишку. В концентраціях нижче 1мг на мишку препарат дріжджової РНК не проявив видимої активності, натомість в концентрації більше 15мг, набряк зменшувався на 53-55%. Більше того, біохімічні тести показали стабілізуючий вплив дріжджової РНК на активність NO-синтетази, а також кількість тромбоксану та лейкотриєну, які змінюються протягом утворення набряку. Аспірин, який вивчали в рекомендованій терапевтичній дозі 20мг/кг, навпаки, значно слабше впливав на збільшення набряку та не показав стабілізуючого впливу на рівень біохімічного метаболізму. 5. Модель гострої ішемії в щурів Подальше вивчення дріжджової РНК виконали на моделі гострої ішемії-реперфузії міокарда в щурів. Дана модель базується на загальних фундаментальних механізмах в розвитку порушень різних серцевих захворювань, які включають руйнування структури та функції мембран в ендотеліоцитах, кардіоцитах та інших клітинах серця. Ці зміни приводять до деградації фосфоліпідів мембрани та утворення дуже ефективних біоактивних сполук, таких як лейкотриєни, або тромбоксани, які володіють судинозвужуючою, аритмогенною, хемоактивною та проагрегатною дією (Bangham A.D., Hill M.W., Miller N., Preparation and use of liposom as model of biological membranes, Method in Membrane Biology, Acad.Press, V.1, N.Y, P.1-16,1974). Як показали результати вивчення, дріжджова РНК, введена внутрішньовенно щурам в концентрації 40мг на щура, нормалізує функцію серця при гострому інфаркті. Це було показано в чітко вираженій протиаритмічній дії препарату та значному зменшенні зони некрозу в і шемізованому міокарді серця. Ліки також повністю нормалізували NO-синтетазну активність в крові та пограничній зоні ішемізованого серця. Ін’єкція дріжджової РНК нормалізувала до звичайного рівня кількість арахідонової кислоти в крові та серці тварин при гострому інфаркті, а також повністю нормалізувала рівень ейкозаноїдів в крові щурів при ішемії. В тварин, яких лікували дріжджовою РНК, активність мієлопероксидази, маркерного ферменту нейтрофілів, що допомагає оцінити антиоксидантні властивості препарату, зменшувалася в два рази. Вивчення активності дріжджової РНК на моделі ішемії-реперфузії дозволило визначити, що препарат має значну стабілізуючу активність на різних етапах запального процесу в ішемізованому серці, яка проявляється в тривалій анти-інфарктній дії і зменшенні розміру інфарктної зони в міокарді. На основі вивчення активності дріжджової РНК в ішемізовано-перфузійному серці тварин, ми можемо зробити висновок, що дріжджова РНК має антиінфарктну дію, або протизапальною дією при інфаркті, завдяки стабілізації структури та функції мембран в ендотеліоцитах, кардіоцитах та інших клітинах серця. 6. Вплив дріжджової РНК на показники крові Вивчали зразки крові, відібрані у груп пацієнтів перед та після лікування препаратом дріжджової РНК, визначаючи кількість лейкоцитів [WBC], еритроцитів [RBC], та тромбоцитів [PLT] в 1 мікролітрі крові, кількість гемоглобіну [HGB] в г/дл, нейтрофілів (NTP) та гематокрит [НСТ] у відсотках. Препарат дріжджової РНК давали або в вигляді капсул, в концентрації 250мг дріжджової РНК на капсулу, або в супозитаріях, в концентрації 1г дріжджової РНК на супозитарій. Для дослідження впливу дріжджової РНК відбирали групи відносно здорових пацієнтів, спортсменів, хворих раком, та інфікованих ВІЛ-пацієнтів. Результати вивчення показали, що лікування дріжджовою РНК приводило до стабілізації", або покращення показників крові. Зокрема, лікування хворих раком та ВІЛінфікованих пацієнтів препаратом дріжджової РНК приводило до стабільної нормалізації цитопенії. Експериментальні методи та результати досліджень Приклад 1. Метод виділення дріжджової РНК Приклад 1.1. Виділення РНК З Saccharomyces cerevisiae була отримана РНК-Д, а з Candida utilis виділили РНК-П, РНК-ПН, та РНК-Ф. Екстракцію дріжджової РНК проводили з допомогою 10-12% розчину хлористого натрію при температурі 100 110°С. РНК відділяли від дріжджових залишків, охолоджували до 0°С та підкислювали соляною кислотою до рН 1-2. Після випадання в осад, РНК промивали етиловим спиртом, висушували та розчиняли в воді. Гідроокисом натрію розчин доводили до рН 8.0-8.2. До розчину додавали панкреатин та витримували біля 1 години при температурі 37-40°С. Фермент інактивували кип’ятінням, після чого розчин фільтрували. РНК осаджували охолодженим етиловим спиртом, підкисленим соляною кислотою до рН 1-2 та висушували. Таким чином була отримана РНК-Ф. Далі осад РНК фільтрували, промивали етиловим спиртом та розчиняли в воді, додаючи гідроокис натрію до рН 6.2-6.5. РНК-ПН осаджували етиловим спиртом, осад фільтрували та сушили. РНК-П отримували з РНК-Ф шля хом додаткової очистки від білків з допомогою повторної інкубації з панкреатином при 37-40°С. Потім фермент інактивували кип’ятінням протягом 10хв. Розчин РНК-П фільтрували та осаджували підкисленим до рН 1-2 спиртом. Осад РНК-П фільтрували, промивали етиловим спиртом та сушили. Кінцевий продукт мав жовто-сірий кольор. Таблиця 1 Хімічний аналіз препаратів дріжджової РНК Тип Вміст азоту в % Вміст фосфору в% Біуретов а реакція Вміст ДНК в % РНК-П 15.49 РНК-Д 15.16 РНК-Ф 14.16 РНК-ПН 14.65 9.05 8.6 8.2 8.54 (-) (-) (+) (-) 1 1.1 1.2 1.1 Як показано в таблиці 1, аналізована РНК (РНК-П та РНК-Д) мала наступні властивості: N ³ 14.7%, Р(тотальний) ³ 8.6%, білок (біуретова реакція) - негативно, ДНК (колометрично) - 2.0%, цукор (хроматографічно) - негативно, полісахариди (біологічне визначення) - негативно. Приклад 1.2. Відсутність токсичності Ми встановили що РНК-П та РНК-Д є нетоксичними. Одинарне або багаторазове введення дріжджової РНК внутрішньочеревно в біоактивних концентраціях (від 250 до 500мг на 1кг ваги тіла) не приводить до суттєвих змін кількості периферійних лімфоцитів в мишей. Суттєві зміни цього показника свідчать про наявність ендотоксинів. Аналогічні результати були отримані при внутрішньовенному введенні нуклеїнових кислот. Ми визначали зміни кількості периферійних лейкоцитів в кроликів 1-3 години після ін’єкції всередину вени розчину 100мг дріжджових РНК-П, або РНК-Д. В якості контролю нетоксичності використовували внутрішньовенну ін’єкцію 0.85% розчину NaCl. Показано, що аналогічно до стандарту, ін’єкція дріжджових РНК-П, або РНК-Д через три години після введення не викликала зміни в кількості лейкоцитів. В тварин, які отримали 0,85%- розчин NaCL, кількість лейкоцитів відповідала 13000±980, тоді як тварини, які отримали РНК-П, або РНК-Д, показали відповідно 12700±850 та 12900±980 лейкоцитів, що є нормою. Коли кролі отримали ін’єкцію 10мг полісахаридів протея, кількість лейкоцитів через одну годину зменшувалася з 13050±1100 до 2900±210, та залишалася на цьому рівні протягом 3 годин. Отримані результати свідчать про нетоксичність дріжджової РНК. Більше того, при введенні кролям внутрішньовенно 100мг дріжджової РНК-П, або РНК-Д на 1кг ваги тіла, в таких тварин не визначався гострофазний С-реактивний білок, який є свідченням ендотоксичної дії. Зокрема, дріжджова РНК є непірогенною сполукою, як це було показано на кролях. В гр упі кролів протягом двох днів, 4 рази на день з двох годинним інтервалом, вивчали температур у тіла. На третій день кролям ввели ін’єкцією 0.85%-розчин NaCl, і продовжували визначати температуру тіла 1, 2 та 3 години після ін’єкції. На шостий день кролі були розділені на 3 групи, дві з яких отримали внутрішньовенно 100мг РНК-П та РНК-Д, відповідно. Знову в тварин визначали температуру тіла. Контрольні тварини показали температурні коливання в межах від 0,1 до 0,4°С. Піддослідні тварини, які отримували препарати РНК мали зміни температури в ти х же межах, що і контрольні: від 0.1 до 0.4°С. Ці результати підтверджують непірогенність дріжджової РНК. Приклад 2. Вивчення протизапальної дії препаратів нуклеїнових кислот на моделі агрегації тромбоцитів in Vitro Протизапальну дію препаратів нуклеїнових кислот вивчали на моделі агрегації тромбоцитів in vitro за методом Born (Born L.V.R. The aggregation of blood platelets by diphosphate and its reversal, Nature, V.94, P.327,1962). Венозну кров людей збирали в селіконові пробірки фірми (Becton Dickson), які мали 3,8% розчин цитрату натрію. Щоб отримати плазму багату тромбоцитами, цитратну кров центрифугували при 1500об/хв протягом 7хв. Безтромбоцитну плазму отримували шляхом центрифугування протягом 15хв при 3000об/хв відібраних 2,0мл з середніх шарів плазми. В тромбоцитарній плазмі підраховували кількість тромбоцитів, потім вони розводилися безтромбоцитарною плазмою до кінцевої концентрації 200,0-300,0x109/л. Агрегацію тромбоцитів проводили з допомогою агрегометра фірми “Тromlite” (Польща). Для індукції агрегації використовували розчин арахідонової кислоти фірми ICN (США), яку розчиняли в буфері Міхаеліса з розрахунку 1мг/мл. В агрегометр поміщали дві пробірки, одну з 0,2мл тромбоцитарної плазми та другу з 0,2мл безтромбоцитарної плазми та 0,1мл ізотонічного розчину хлориду натрію. Після включення приладу в пробірку з тромбоцитарною плазмою додавали 0,1мл арахідонової кислоти. Потім, протягом 5хв. реєстрували світлопропускаючу здатність тромбоцитарної плазми, що віповідало ступеню агрегації тромбоцитів. В дослідних варіантах, коли вивчали дію препаратів нуклеїнових кислот на агрегацію тромбоцитів, перед початком вимірювання розчин тромбоцитарної сироватки піддавали попередній інкубації 5хв при 37°С з 0.1мл розчину відповідної концентрації препарату. В паралельну пробірку з безтромбоцитарною плазмою відповідно додавали 0,2мл ізотонічного розчину хлориду натрію. Після закінчення інкубації включали прилад і в пробірку з тромбоцитарною плазмою та препаратом додавали 0,1мл арахідонової кислоти і через 5 хвилин закінчували вимірювання, визначаючи кінцеву ступінь агрегації тромбоцитів. Параметром агрегації було вибрано індекс агрегації клітин ІА, який дорівнював: D1- D2 IA = × 100% D1 D - оптична густина збагаченої тромбоцитами плазми з арахідоновою кислотою як індуктором агрегації тромбоцитів D - оптична густина проінкубованої з препаратом нуклеїнової кислоти, збагаченої тромбоцитами плазми з арахідоновою кислотою як індуктором агрегації тромбоцитів Статистичну обробку результатів проводили, використовуючи критерій Стьюдента та програмне забезпечення, описане в прикладі 4.1. Досліджували наступні препарати нуклеїнових кислот: ДНК-Т, ДНК- ЕК, тРНК, та сумарну РНК-Д дріжджів в кінцевій концентрації 1x10-2%. За стандарт протизапального препарату використовували аспірин в концентрації 0,06мг на пробірку із збагаченою тромбоцитами плазмою. Результати дослідження представлені в таблиці 2. Таблиця 2 Вплив нуклеїнових кислот та аспірину на агрегацію тромбоцитів, індуковану арахідоновою кислотою Μ +-m РНК-Д Аспірин ДНК-Т ДНК-ЕК 59.73 38.66 54.45 36.93 4.24 6.71 3.76 1.88 Р
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod for treating inflammatory and inflammatory-related disorders and normalizing metabolic parameters in blood with the aid of compound consisting of purified yeast rna
Назва патенту російськоюСпособ лечения воспалительных процессов и способ нормализации показателей крови с использованием очищенной дрожжевой рнк
МПК / Мітки
МПК: A61P 7/00, A61P 9/00, C07H 21/02, A61P 37/00, C12N 15/10, A61K 31/7105, C12P 19/34
Мітки: ними, покращення, спосіб, захворювань, використанням, крові, дріжджової, рнк, рівня, розладів, очищеної, пов'язаних, лікування, показників, запальних
Код посилання
<a href="https://ua.patents.su/21-66416-sposib-likuvannya-zapalnikh-zakhvoryuvan-ta-povyazanikh-z-nimi-rozladiv-ta-sposib-pokrashhennya-rivnya-pokaznikiv-krovi-z-vikoristannyam-ochishheno-drizhdzhovo-rnk.html" target="_blank" rel="follow" title="База патентів України">Спосіб лікування запальних захворювань та пов’язаних з ними розладів та спосіб покращення рівня показників крові з використанням очищеної дріжджової рнк</a>
Попередній патент: Вітамінно-мінеральний препарат для лікування остеопорозу “кальмівід”
Наступний патент: Рекомбінантний аденовірус родини псових, фармацевтична композиція
Випадковий патент: Рушій транспортних засобів з ручним приводом