Спосіб лікування запальних захворювань ока і засіб для лікування запальних захворювань ока
Формула / Реферат
1. Способ лечения воспалительных заболеваний глаза, включающий введение иммунодепрессивных средств, отличающийся тем, что используют рапамицин, который вводят в дозах от 0,01 до 50мг/кг массы тела в сутки.
2. Способ по п.1, отличающийся тем, что используют рапамицин, который вводят в дозах от 0,1 до 35мг/кг массы тела в сутки.
3. Способ по любому из пп.1 - 2, отличающийся тем, что используют рапамицин, который вводят в дозах от 0,7 до 25мг/кг массы тела в сутки.
4. Способ по п.1, отличающийся тем, что рапамицин вводят одним из следующих путей: посредством инъекций, местно, через кожный покров или прямую кишку.
5. Применение рапамицина в качестве средства для лечения воспалительных заболеваний глаза.
Текст
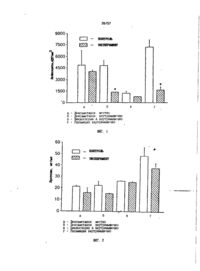
Способ лечения воспалительных заболеваний глаза, включаюЧций введение иммунодепрессивных средств, о т л и ч а ю щ и й с я тем, что используют рапамицин, который вводят в дозах от 0,01 до 50 мг/кг массы тела в сутки. 2. Способ по п. 1, о т л и ч а ю щ и й с я тем, что используют рапамицин, который вводят в дозах от 0,1 до 35 мг/кг массы тела в сутки. 3. Способ по любому из пп. 1-2, о тл и ч а ю щ и й с я тем, что используют рапамицин, который вводят в дозах от 0,7 до 25 мг/кг массы тела в сутки. 4 Способ по п. 1, о т л и ч а ю щ и й с я- тем, что рапамицин вводят одним из следующих путей: посредством инъекций, местно, через кожный покров или прямую кишку. 5. Применение рапамицина в качестве средства для лечения воспалительных заболеваний глаза. Настоящее изобретение относится к способам лечения глазного воспаления, в частности лечения глазного воспаления назначением рапамицина. Глазное воспаление может протекать в виде различных заболеваний глаза той или иной степени тяжести в зависимости от конкретной локализации воспаления. К глазным воспалениям относятся такие заболевания как увеит, конъюнктевйт, эписклерит, склерит, оптический неврит, ретробульбарный неврит, кератит, блефарит и т.п. Многие из этих заболеваний возникают вследствие бактериальной или вирусной инфекции. При глазной бактериальной инфекции эндотоксин, а именно липополисахаридный компонент грамотрицательных бактерий вызывает глазное воспаление, прояв ляющееся в виде гиперемии слизистой и радужной оболочек, в виде разрушения кровеводного барьера, а также в виде полиморфоядерной нейтрофильной инфильтрации в водную телесную вытяжку и цилиарное тело радужки. Установлено, что при воспалении подобного рода в качестве посредников воспалительного процесса выступают некоторые арахидоно-кислотные метаболиты простагландинов и лейкотриенов. Другие исследования также показали, что воспаление может быть также вызвано влиянием экспрессии гена главного комплекса гистосовместимости Class II (1а) в цилиарном теле радужки. Глазное воспаление, кроме того, может представлять собой осложнение после хирургической операции или же являться результатом глазной травмы, 4 О 26757 вызванной физическим повреждением глаза. Типичным для указанных глазных воспалительных заболеваний является увеит, характеризующийся воспалением увеального тракта, охватывающего радужную оболочку, цилиарное тело и хороид. Воспаление сетчатки также считают разновидностью увеита. Среди анатомических разновидностей увеита можно выделить переднесторонний (иритит и иридоциклит), промежуточный (циклит и периферийный узел), заднесторонний (хороидит и ретинит) увеиты, а также рассеянный увеит (ирит в сочетании с промежуточным увейтом и хориоретинитом). Например, повторяющиеся рецидивы переднестороннего увеита могут повлечь постоянное серьезное поражение внутренних структур глаза с тяжелыми последствиями. Так, например, возвратный переднесторонний увеит может привести к возникновению заметной периферийной переднесторонней синекии и вторичной глаукомы. Кроме того, хронический переднее торонний увеит может привести к дисфункции эндотелия роговой оболочки глаза и даже к образованию катаракты. Воспаление задних отделов глаза может вызвать стойкое патологическое изменение стекловидного тела и дисфункцию сетчатки, причем каждое из этих расстройств способно повлечь неизлечимую потерю зрения. Хорошо известно, что и при остром и при хроническом воспалениях появляются так называемые посредники воспаления, выделяемые воспалившимися тканями и лейкоцитами. Концентрации указанных посредников, а также самих лейкоцитов показывают уровень (степень) воспаления, и наоборот, понижение концентрации упомянутых посредников и лейкоцитов характеризует эффективность лекарства при лечении воспаления. В настоящее время главным лекарством при лечении увеита и других воспалительных заболеваний глаза служат противовоспалительные стероидные рецептуры, например, на основе кортикостероидов. Несмотря на наличие целого ряда и других доступных противовоспалительных лекарств, в последнее время наиболее подходят для лечения глазного воспаления лишь кортикостероиды. Считают, что противовоспалительное действие кортикостероиов основано на их участии в метаболизме арахидоновой кислоты, например, благодаря ингибированию фосфолипазы А2, вызывающей выс 5 10 15 20 25 30 35 40 45 50 55 4 вобождение арахидоновой кислоты из набора фосфолипидов в ткани. Хотя стероиды довольно эффективны при лечений* глазного воспаления, их активное применение осложнено рядом серьезных эффектов. Следовательно, было бы крайне желательно разработать новые, нестероидные лекарства с высокой терапевтической эффективностью, но без проявления побочных эффектов, свойственных стероидам. Ранее было показано, что дексаметазон (кортикостероид), циклоспорин А (действенный иммуноподавляющий агент) и рапамицин (противогрибковый и иммуноподавляющий агент) подавляют процесс отслоения пересаживаемой роговицы в гетероламмеларной модели пересадки роговицы в организме кролика. В этом исследовании было также установлено, что рапамицин является еще более действенным, нежели циклоспорин А в отношении продления периода выживания пересаженной ткани по прекращении операции. Предварительные клинические исследования показали, что циклоспорин А может быть эффективным в отношении смягчения воспалительных симптомов у пациентов с хроническим *щиопатическим увеитом, причем организм некоторых из них оказался невосприимчивым к лечению кортикостероидом. Однако в случае циклоспорина А наблюдался ряд различных цитотоксических эффектов вследствие больших доз циклоспорина А, требуемых для достижения терапевтического эффекта, В основу изобретения положена задача разработать способ и композицию * для лечения глазного воспаления млекопитающего, которые были бы лишены вредных побочных эффектов кортикастероидов или циклоспорина А, в частности не оказывающего цитотоксического воздействия. Сущность заявляемого способа лечения глазного воспаления у млекопитающего, в частности увеита, конъюнктивита, эписклерита, склерита, оптического неврита, ретробульбарного неврита, воспаления, являющегося осложнением после хи» рургической операции или вызванного физической травмой глаза, заключается в том, что в качестве лекарственного препарата млекопитающему назначают рапамицин в количестве, оказывающем эффективное противовоспалительное действие. При этом млекопитающему целесообразно назначать рапамицин в количестве 26757 от 0,01 до 50 мг на 1 кг живого веса в сутки, предпочтительно в количестве от 0,1 до 35 мг на 1 кг живого веса в сутки, а наиболее эффективно - в количестве от 0,7 до 25 мг на 1 кг живого веса в сутки. Согласно заявляемому способу назначенное количество рапамицина вводят млекопитающему орально, посредством инъекций, местно, через кожный покров или прямую кишку. Предметом настоящего изобретения является также композиция для лечения глазного воспаления у млекопитающего, в частности увеита, конъюнктивита, элисклерита, склерита, оптического неврита, ретробульбарного неврита, воспаления, являющегося осложнением после хирургической операции или вызванного физической травмой глаза, содержащая фармацевтический носитель и рапамицин в качестве активного ингредиента. Еще одним объектом изобретения, связанным с первыми двумя единым изобретательским замыслом, является применение рапамицина в качестве лекарственного препарата для лечения глазного воспаления у млекопитающего, в частности увеита, конъюнктивита, эписклерита, склерита, оптического неврита, ретробульбарного неврита, воспаления, являющегося осложнением после хирургической операции или вызванного физической травмой глаза. В частности, рапамицин применяют для обеспечения диагностического выявления, предотвращения прогрессирования или решительного устранения глазного воспаления, которое можно описать, например, как увеит, конъюнктивит, эписклерит, склерит, оптический неврит, ретробульбарный неврит, кератит, блефарит и т.п. (или которое связано с этим заболеванием или вызвано ими), а также глазного воспаления, предотвращающего собой осложнение после хирургической операции или вызванного физической травмой глаза. Рапамицин, макролитический триеновый антибиотик, вырабатываемый микроорганизмом Streptomyces hydrosscopiues, предотвращает образование гуморальных антител типа IgE в телесной вытяжке в ответ на аллергическое изменение альбумина. На фиг. 1 представлена гистограмма, показывающая изменение уровня лейкоцитов в водной вытяжке после лечения рядом препаратов, дексаметазоном, циклоспорином А и рапамицином в сравнении с контрольными данными. 5 10 15 20 25 ЗО 35 40 45 50 55 6 На фиг. 2 представлена гистограмма, показывающая уровень протеина в водной вытяжке после лечения рядом препаратов: дексаметазоном, циклоспорином А и рапамицином в сравнении с контрольными данными. На фиг. ЗА и ЗБ представлены гистограммы, показывающие изменение уровней pGE2 и LTB4 в водной вытяжке соответственно после тех или иных курсов лечения дексаметазоном, циклоспорином А и рапамицином в сравнении с контрольными данными. На фиг. 4А и 4Б представлены гистограммы, показывающие изменение уровней pGE2 и LTB4 в цилиарном теле радужки соответственно после тех или иных курсов лечения дексаметазоном, цикл ос-" порином А и рапамицином в сравнении с контрольными данными. На фиг. 5 представлена гистограмма, показывающая изменение уровней активности миелопероксидазы в цилиарном теле радужки после тех или иных курсов лечения дексаметазоном, циклоспорином А и рапамицином в сравнении с контрольными данными. Для изучения противовоспалительного действия стероидных и нестероидных лекарственных препаратов был использован ряд стандартных фармакологических моделей глазного воспаления. Сюда относятся: 1) увеит, вызванный эндотоксином и представляющий собой неиммуногенную модель острого неиммуногенного заболевания; 2) увеит, вызываемый альбумином бычьей сыворотки и представляющий собой неиммуногенную модель; 3) модель с повреждением роговицы; гетероламмеларная модель с пересадкой роговицы. Эффект рапамицина при лечении воспаления' глаза был установлен в ходе эксперимента на живом организме (in vivo) с модельным использованием увеита, вызываемого эндотоксином и по характеру протекания соперничающего с воспалительными заболеваниями глаза, наблюдающимися у млекопитающих. Методика и результаты испытаний изложены ниже. П р и м е р 1. Данный эксперимент демонстрирует действие дексаметазона, циклоспорина А и рапамицина в случае, вызываемого эндотоксином увеита у кроликов. Для проведения испытания были взяты тридцать два новозеландских кроликов-самцов с массой тела 1,5-2,0 кг. Этих кроликов разделили на 4 группы согласно числу лекарств, использованных для 26757 лечения (с учетом контрольной группы). Кроликов подвергали лечебным процедурам в соответствии с предписаниями по использованию животных в научных исследованиях, утвержденными Ассоциацией исследования зрения (Assotiation of Research in Vision, ARV), а также в соответствии с постановлением ее офтальмологического отделения (ARVO). Каждую группу сравнивали с ее собственной контрольной группой, животных которой обрабатывали только растворителем, так как известно, что степень развития увеита от одного эксперимента к другому варьируется. За час до инъекции эндотоксина в стекловидное тело глаза всем кроликам каждой группы предварительно вводили их лекарство. Эндотоксин бактерии E.coli (LPS), поставляемой фирмой "Сигма", г.Сент-Луис, шт.Миссури, США, растворяли в стерильном физиологическом солевом растворе при концентрации 10 нг/мкл. После промывки каждого глаза (у всех кроликов) с последующим анестезированием путем местного назначения алкаина, а именно, пропаракаина HCL, в стекловидное гело обоих глаз каждого кролика посредством инъекции вводили 10 мкл (100 нг) эндотоксина LPS, для чего применяли иглу номер 30 G, прикрепленную к гамильтоновскому шприцу фиксированного объема. Спустя 24 часа после инъекции LPS всех кроликов умерщвляли дозой пентабарбитала натрия, превосходящей смертельную. За указанное время развивалось максимальное воспаление. Водную вытяжку отбирали сразу же после парасентазиса с использованием игольчатого шприца 22-го калибра, содержащего 50 мкл солевого гепаринизированного раствора. Готовили комплекты проб войной вытяжки из глаз каждого кролика. Затем глаза извлекали из их орбит, разрезали по экватору, после чего аккуратно выдавливали вверх цилиарное тело радужки, далее разделяемое на две части, предназначенное для радиоиммунного испытания (РИИ), а также миелопироксидазного испытания (МПИ). Для проведения РИИ и МПИ цилиарные тела радужки из обоих глаз каждого кролика были объединены в комплекты. После этого в пробах водной вытяжки подсчитывали число клеток и определяли содержание протеина, а также уровня PGE2 и LTB4, а в пробах цилиарных тел радужки анализировали синтез PGE2 и ЦТВ4и определяли активность миелопероксидазы. В каждой группе число проб для каждого испыты 5 10 15 20 25 30 35 40 45 50 55 8 ваемого объекта, а также для подсчета клеток и определения протеина равнялось четырем. Соответственно лечению тем или иным препаратом были разделены на четыре группы следующим образом. Группа I. Контроль: местное назначение стерильного 0,9% солевого раствора через каждые четыре часа. Испытания: Местное назначение 0,1% дексаметазона через каждые четыре часа. Группа II. Контроль: внутримышечная инъекция 0,9% t.i.d. солевого раствора. Испытания: 2 мг дексаметазона на 1 кг живого веса внутримышечно. Группа III. Контроль: касторовое масло b.i.d., внутримышечно. Испытания: 25 мг циклоспорина А (внутримышечно) b.i.d. на 1 кг живого веса внутримышечно. Группа IV. Контроль: карбоксиметилцеллюлоза (внутримышечно). Испытания: 10 мг рапамицина (внутримышечно) b.i.d. на 1 кг живого веса. Абсолютные значения для каждого из проходящих лечение и для контрольных животных соответственно сравнивали по методике непарного t-испытания Стьюдента с целью статистической оценки. Дексаметазон растворяли в стерильном 0,9% физиологическом солевом растворе, тогда как циклоспорин А готовили в виде суспензии в касторовом масле, а рапамицин - в виде суспензии в карбоксиметилцеллюлозе. Все кролики получали первую дозу своего соответствующего препарата за час до инъекции эндотоксина в стекловидное тело, а последнюю дозу - за час до умерщвления. Группа, которой дексаметазон назначали внутримышечно, получала лекарственные препараты в три приема, включая первый, последний и промежуточный, тогда как группы, которым назначали рапамицин и циклоспорин А внутримышечно, имели лишь два приема лекарства: первый и последний. Все внутримышечные инъекции производились в бедренную мышцу кролика. Число лейкоцитов в водной вытяжке подсчитывали, смешивая 5 мкл водной вытяжки, извлеченной при помощи микрошприца производства фирмы "Гамильтон", г.Рено, шт.Невада, США, с 5 мкл раствора Тэрка, представляющего собой краситель "фиолетовый из горечавки" в ледяной уксусной кислоте, с последующим помещением этой смеси в гемоцитометр. 26757 Указанные клетки подсчитывали под микроскопом в видимом спектре. Концентрацию протеина в водной вытяжке определяли с использованием 5 мкл водной вытяжки. Для определения концентрации протеина проводили биорадиационное испытание на протеин в биорадиационной лаборатории, г.Ричмонд, США (BioRad Labs, Richmond, CA). Это биорадиационное испытание основано на сдвиге поглощения, свойственного синему красителю Goomassie Brilliant Blue G-250 от 465 до 595 им, когда имеется связывание с протеином. Показатели поглощения считывались с использованием спектрофотометра Beckmam DU64. Измерение степени выделения HGE и LTB в водную вытяжку. Концентрацию эйкозаноидов PGE2 и LPB4, представляющих собой активные вещества, производные от арахидоновой кислоты, в водной вытяжке, а также в инкубированном препарате цилиарного тела радужки измеряли с использованием соответствующего прибора для радиоимунного испытания (RIA) производства фирмы "Amersham", г.Арлингтон-Хайтс, шт.Иллинойс, США. Указанные эйкозаноиды извлекали из подкисленных (рН=3) растворов водной вытяжки в растворителе, представляющем собой смесь хлороформа с метиловым спиртом в соотношении 1:1. Образовавшуюся органическую фазу обезвоживали в газовой среде азота, после чего производили замену жидкостной среды проб с использованием буферного раствора, предусмотренного в упомянутом выше приборе RIA. Активность миелоперодоксидазы (МРО) в цилиарном теле радужки измеряли по методике, которую разработал Блэдли [8]. Согласно этой методике энзим МРО, обнаруживаемый в межклеточных гранулах или нейтрофилах, используют в качестве маркера при определении содержания тканевых нейтрофилов. Эффект, оказываемый лечением тем или иным препаратом на воспалительные клетки в водной вытяжке, показан на фиг. 1. Дексаметазол, вводимый внутримышечно, давал резкое снижение (до Р < 0,05 или 72%) содержания лейкоцитов в водной вытяжке по сравнению с соответствующей контрольной группой, тогда как местное назначение дексаметазона вызывало снижением числа подсчитываемых клеток лишь на 17%. Соответственно внутримышечное назначение циклоспорина А снижало подсчитываемое число лейкоцитов на 36%, тогда как внутримышечное 5 10 15 20 25 30 35 40 45 50 55 10 назначение рапамицина приводило к весьма значительному снижению (на 77%) числа лейкоцитов в водной вытяжке. Эффект, оказываемый лекарственными препаратами на концентрацию протеина в водной вытяжке, показан на фиг. 2. Отсутствие назначения лекарства приводило к значительному снижению концентрации протеина в водной вытяжке. Внутримышечное и местное назначение дексаметазона снижали содержание протеина в водной вытяжке на 3 1 % и 24% соответственно. Рапамицин, назначаемый внутримышечно, снижал уровень протеина на 22%, тогда как циклоспорин А, назначаемый внутримышечно, по-видимому, не оказывал существенного влияния на уровень протеина, показывая лишь 43%ное его снижение. На фиг. 3 и 4 показан эффект, который оказывает лекарственный препарат на выделение PGE2 и LTB4 в водную вытяжку и на их синтез в цилиарное тело радужки. Дексаметазон, назначаемый внутримышечно, в значительной степени (до Р < 0,05) подавлял выделение свободного PGE2 в водную вытяжку и в цилиарное тело радужки: соответственно на 54% и 47%. Однако он не давал заметного эффекта по отношению к уровням LTB4, показывая в водной вытяжке лишь 30%ное подавление. Дексаметазон, назначаемый внутримышечно, никак не влиял на синтез LTB4 в цилиарное тело радужки. Местное назначение дексаметазона заметно влияло (Р < 0,05) на уровень эйкозаноидов в водной вытяжке из организма, вызывая в ней 89%-ное ингибирование PGE2 и 67%-ное ингибирввание LTB4. Однако в этом случае дексаметазон не оказывал заметного влияния на уровни в цилиарном теле радужки. Внутримышечное назначение рапамицина значительно (на 61%) ослабляло выделение свободного PGE2 в водную вытяжку и в то же время на 30% понижало уровень LTB4 в водной вытяжке. Рапамицин не оказывал влияние на уровни эйкозаноидов в циллиарном теле радужки. Микроспории А, вводимый внутримышечно, не оказал никакого существенного влияния (Р < 0,05) на уровни эйкозаноидов в водной вытяжке. В цилиарном теле радужки он понижал уровни PGE2 на 10%, а уровень LTB4 лишь на 7%. На фиг, 5 в качестве характеристики активности миелопероксидазы представлена инфильтрация полиморфоядерного нейтрофила в цилиарное тело радужки. Дексаметазон, циклоспорин А и рапамицин, вводимые внутримышечно, сущест 11 26757 венно (Р < 0,05) понижали активность МРО в цилиарном теле радужки, а именно, на 73%, 6 9 % и 6 3 % соответственно, тогда как местное назначение дексаметазона снижало активность МРО в цилиарном теле радужки лишь на 30%. В настоящем исследовании, несмотря на более частое назначение дозировок, местное назначение дексаметазона не оказывало существенного влияния на подсчитываемое число лейкоцитов в водной вытяжке. В то же время оно заметно подавляло лишь выделение свободного 1ДВ4 в водную вытяжку, но не синтез этого фактора в цилиарном теле радужки. Местное назначение дексаметазона не подавляло в сколько-нибудь заметной степени ни уровня протеина в водной вытяжке, ни активности МРО в цилиарном теле радужки. Однако дексаметазон, вводимый внутримышечно, в 'значительной степени подавлял инфильтрацию лейкоцитов в водную вытяжку. При этом концентрация протеина в водной вытяжке понижалась, но не существенно. Внутримышечное назначение дексаметазона заметно подавляло как выделение свободного PGE2 в водную вытяжку, так и синтез этого фактора в цилиарном теле радужки, причем на уровне LTB4 как в водной вытяжке, так и в цилиарном теле радужки оно влияния не оказывало. И рапамицин, и циклоспорин А оказались эффективными в отношении ослабления лейкоцитной реакции в водной вытяжке. Подсчитываемое число лейкоцитов в группе, подвергаемой лечению циклоспорином А, было гораздо меньше соответствующего числа лейкоцитов у других групп. Скорее всего это зависит от используемой жидкой среды (касторовое масло). Считают, что касторовое масло оказывает некоторое, хотя и слабое противовоспалительное действие на глаз животного после извлечения попавшего туда инородного тела. В данных модельных условиях противовоспалительный эффект рапамицина и циклоспорина А во всех случаях был меньше, чем у дексаметазона. Однако в настоящем исследовании рапамицин оказал* ся по крайней мере втрое более эффективным, нежели циклоспорин А, Было установлено также, что в случаях сердечной, кожной и желудочной моделей рапамицин в 3-50 раз эффективнее циклоспорина А подавляет пересадочное отторжение тканей. Итак, рапамицин, вводимый внутримышечно е дозировке 10 мг на 1 кг живого 5 10 15 20 25 30 35 40 45 50 55 12 веса (b.i.d), снижал число лейкоцитов в водной вытяжке на 67%, уровень PGE2 на 7 5 % и активность миелопероксидазы в цилиарном теле радужки на 59%. Циклоспорин А, вводимый внутримышечно в дозировке 25 мг на 1 кг живого веса, понижал число лейкоцитов в водной вытяжке на 36%, уровень PGE2 в цилиарном теле радужки на 3 0 % и активность миелопероксидазы на 68%. Эти результаты показывают, что рапамицин пригоден для предотвращения или лечения воспалительных глазных заболеваний. Когда рапамицин применяют для лечения воспалительных глазных заболеваний, его можно включать в рецепты, назначаемые нуждающемуся в лечении млекопитающему, как с фармацевтическим веществом-носителем, так и без него. Фармацевтический носитель может быть твердым или жидким. Твердый носитель может включать одно или более веществ, в том числе ароматизирующие добавки, смазки, добавки, способствующие растворению и образованию суспензий, наполнители, добавки, облегчающие проглатывание, добавки, способствующие спрессовыванию, связующие, добавки, способствующие распаду таблетки при ее приеме. Кроме того, твердый носитель может также включать капсулообразующее вещество. В порошках носитель представляет собой тонко измельченное твердое вещество, подмешивавмое к столь же тонко измельченному активному ингредиенту. В таблетках активный ингредиент смешан с носителем, обладающим необходимыми свойствами при спрессовывании. Этот ингредиент и носитель смешивают в подходящем соотношении и спрессовывают до желательных конфигураций размеров. Порошки и таблетки предпочтительно содержат до 9 9 % активного ингредиента. Подходящие твердые носители включают, например, фосфат кальция, стеарат магния, тальк, сахар, лактозу, декстрин, крахмал, желатин, целлюлозу, метилцеллюлозу, натриевую карбоксиметилцеллюлозу, поливинилпирролидин, легкоплавкие воски и ионообменные смолы. Жидкие носители применяют для приготовления растворов, суспензий, эмульсий, микстур, эликсиров и аэрозольных упаковок. Раствор или суспензию активного ингредиента можно приготовить с использованием такого фармацевтически приемлемого носителя, как вода, органический растворитель или их смесь, а также фармацевтически приемлемые масла 13 26757 или жиры. Жидкий носитель может содержать и другие подходящие фармацевтические добавки, например, способствующие растворению и образованию эмульсий, а также буферные растворы, консерванты, подщелачивающие и ароматизирующие добавки, обеспечивающие достаточную продолжительность хранения. Подходящие примеры жидких носителей для приема внутрь через полость рта и для назначения извне включают воду (в особенности содержащую указанные выше добавки, например, производные целлюлозы, предпочтительно раствор натрийкарбоксиметилцеллюлозы), спирты (включая как одноатомные, так и многоатомные, например гликоли), и их производные, а также масла, например фракционированные кокосовое масло и арахисовое масло. Для назначения извне (посредством инъекций) носитель может также представлять собой маслянистый эфир, такой как этиловый олеат и изопропиловый мифигтат. Стерильные жидкие носители пригодны для приготовления стерильных жидких рецептур для назначения извне. Жидкий носитель для рецептур аэрозольных упаковок может представлять собой галогенированный углеводород или другой фармацевтически приемлемый диспергатор. Жидкие фармацевтические рецептуры, представляющие собой стерильные растворы или суспензии, можно применять, например, посредством внутримышечных и подкожных инъекций или инъекций в брюшную полость. Стерильные растворы можно также назначать для применения через -полость рта как в жидкой, так и в твердой рецептурных формах. Рапамицин можно также назначать через прямую кишку в виде подходящих для этой цели свечей. Кроме того, рапамицин можно назначить через кожу посредством использования кожного пластыря, содержащего активное соединение и носитель, инертный по отношению к активному соединению, нетоксичный по отношению к коже и обеспечивающий регулируемое выделение активного агента в кроветок через кожу. Носитель можно взять в самых разнообразных формах: в виде кремов, мазей, паст, гелей или запирающих устройств. Кремы и мази могут представлять собой вязкие жидкости или полутвердые эмульсии масло-водного или водно-мас 5 10 15 20 25 30 35 40 45 50 55 14 ляного типов. Могут также оказаться пригодными пасты, состоящие из поглотительных порошков, диспергированных в петролеуме, или из гидрофильного петролеума, содержащего активный ингредиент. Для выделения активного ингредиента в кроветок можно также использовать целый ряд запирающих устройств, таких, например, как полупроницаемая мембрана, перекрывающая сосуд с активным ингредиентом (в сочетании с носителем или без него), или же композиционный состав с активным ингредиентом. В литературе описаны и другие разновидности запирающих приспособлений. Допускается местное назначение рапамицина в виде раствора, крема или лосьона, приготовленных по рецепту с исполь-, зованием фармацевтически приемлемой жидкой среды, содержащей 0 , 1 - 5 % , предпочтительно 2%, активного соединения. Назначаемая дозировка может быть различной в зависимости от конкретного применяющегося состава, от режима назначения, серьезности проявления симптомов и от конкретного существа, подлежащего лечению. На основании данных, полученных в результате проведения фармацевтического испытания по стандартной методике, предписываемые суточные дозы активного соединения могут составлять 0,01-50 мг на 1 кг массыизлечиваемого организма, предпочтительно 0,3-25 мг/кг. В общем случае лечение предпочтительно начинать с малых доз, меньших, чем оптимальная доза соединения. Затем дозировку увеличивали до тех пор, пока для данных условий не был достигнут оптимальный эффект. Точные дозировки для приема внутрь через полость рта, для введения извне через инъекции, для местного назначения, через кожный покров или прямую кишку устанавливал лечащий врач опытным путем в ходе лечения данного конкретного существа. Как правило, желательнее всего назначить рапамицин в концентрации, в большинстве случаев обеспечивающей эффективные результаты лечения, но не вызывающей губительных или вредных побочных эффектов. Рапамицин можно назначать либо в виде разовой дозы, либо, при желании, дозировку можно, разделить на удобное число дробных доз, назначаемых через подходящие интервалы времени в течение суток. 26757 9000 1 7500 I— КОНТРОЛЬ ЭКСПЕРИМЕНТ 600045003000 15000 a б в г a - Дексаметазон местно - Дексаметазон внутримышечно - Циклоспорин А внутримышечно - Рапамицин внутримышечно ФИГ. 1 60 I—| — КОНТРОЛЬ ESS 50 — ЭКСЗШРЙМЕНТ § 40 1 | 3020100 a б в г Дексаметазон местно Дексаметазон внутримышечно Циклоспорин А внутримышечно Рапамицин внутримышечно ФИГ. 2 26757 20 л 1 k\\N 15 І 10 15 5 0 a б Е г Дексаметазон местно Дексаметазон внутримышечно Циклоспорин А внутримышечно Рапамицин внутримышечно ФИГ. ЗА cm ES3 КОНТРОЛЬ ЭКСПЕРИМЕНТ 3 2 4 1 а б в г - Дексаметазон местно - Дексаметазон внутримышечно - Циклоспорин А внутримышечно - Рапамицин внутримышечно ФИГ. ЗБ I — КОНТРОЛЬ — ЭКСПЕРИМЕНТ 26757 20I І 15Н 1 — КОНТРОЛЬ — ЭКСПЕРИМЕНТ 5 І 0 a б в г 1 Дексаметазон местно Дексаметазон внутримышечно Циклоспорин А внутримышечно Рапамицин внутримышечно ФИГ. 4А 0.300 1 0.250 J 63 Й . 1 — ^ KOHTPOJb ЭКСПЕРИМЕНТ 0.2000.1500.1000.0500.000 а б в г Дексаметазон местно Дексаметазон внутримышечно Циклоспооин А внутримышечно Рапамицин внутримышечно ФИГ. 4 Б 26757 0.600-і 0.500 КОНТРОЛЬ ES3 ЭКСПЕРИМЕНТ 0.400 0.300 0.200 0.100 0.000 а б в г Дексаметазон местно Дексаметазон внутримышечно Циклоспорин А внутримышечно Рапамицин внутримышечно ФИГ. Упорядник Техред М. Келемеш Коректор Т. Лазоренко Замовлення 528 Тираж Підписне Державне патентне відомство України, 254655, ГСП, Київ-53, Львівська пл., 8 Відкрите акціонерне товариство "Патент", м. Ужгород, вул. Гагаріна, 101 і См и I
ДивитисяДодаткова інформація
МПК / Мітки
МПК: A61K 31/395, A61K 31/40, A61K 31/70
Мітки: лікування, спосіб, захворювань, ока, запальних, засіб
Код посилання
<a href="https://ua.patents.su/12-26757-sposib-likuvannya-zapalnikh-zakhvoryuvan-oka-i-zasib-dlya-likuvannya-zapalnikh-zakhvoryuvan-oka.html" target="_blank" rel="follow" title="База патентів України">Спосіб лікування запальних захворювань ока і засіб для лікування запальних захворювань ока</a>
Попередній патент: Пристрій для інгаляції
Наступний патент: Спосіб об’ємного розширення тютюну
Випадковий патент: Пристрій, що трансформується з упаковки у тримач для ємності з рідиною