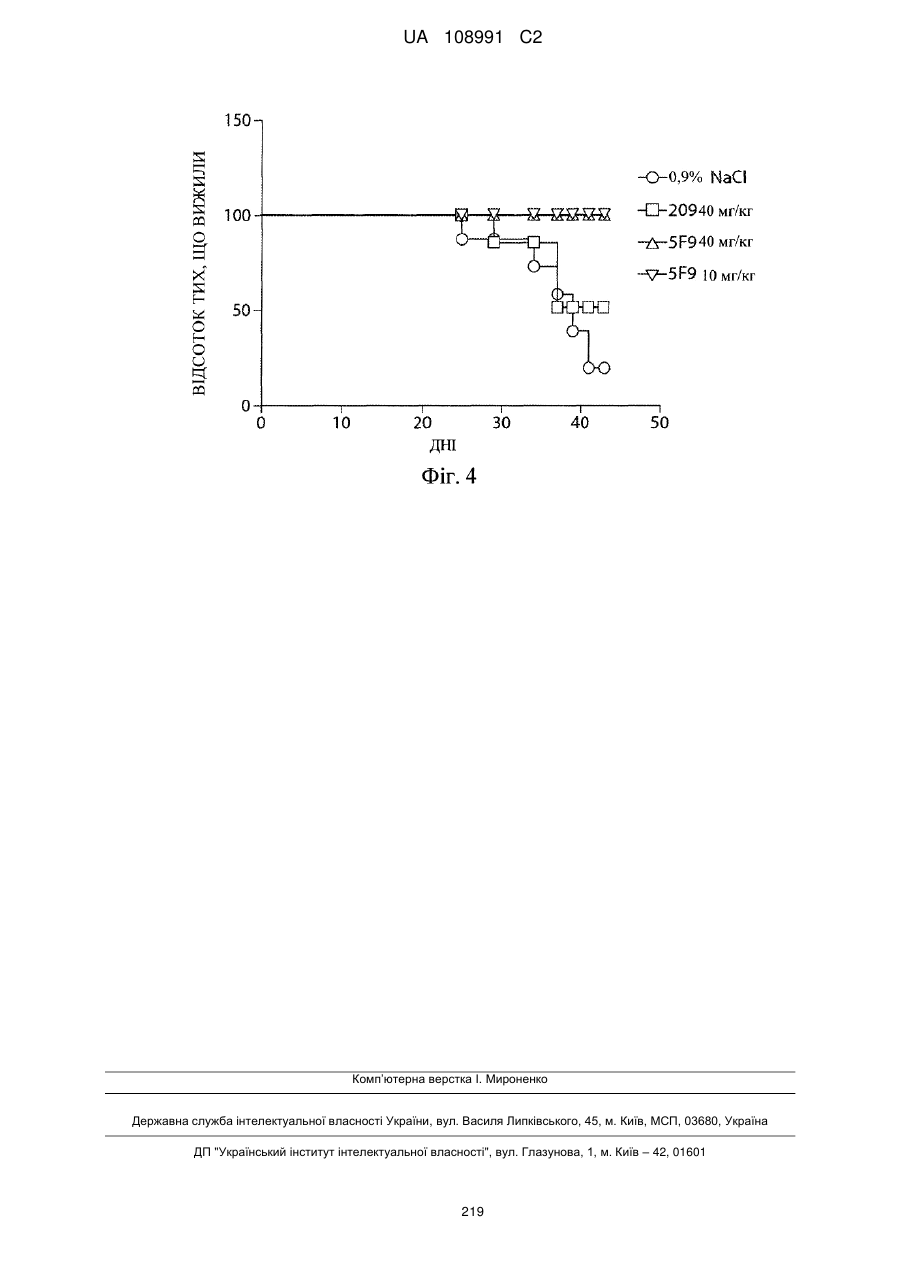
Молекула антитіла до gcc і пов’язані композиції та способи лікування раку
Номер патенту: 108991
Опубліковано: 10.07.2015
Автори: Бабкук Джон, О'Кіф Тереза, Цин Шисинь, Грінфілд Едвард А., Нам Семьюел С.
Формула / Реферат
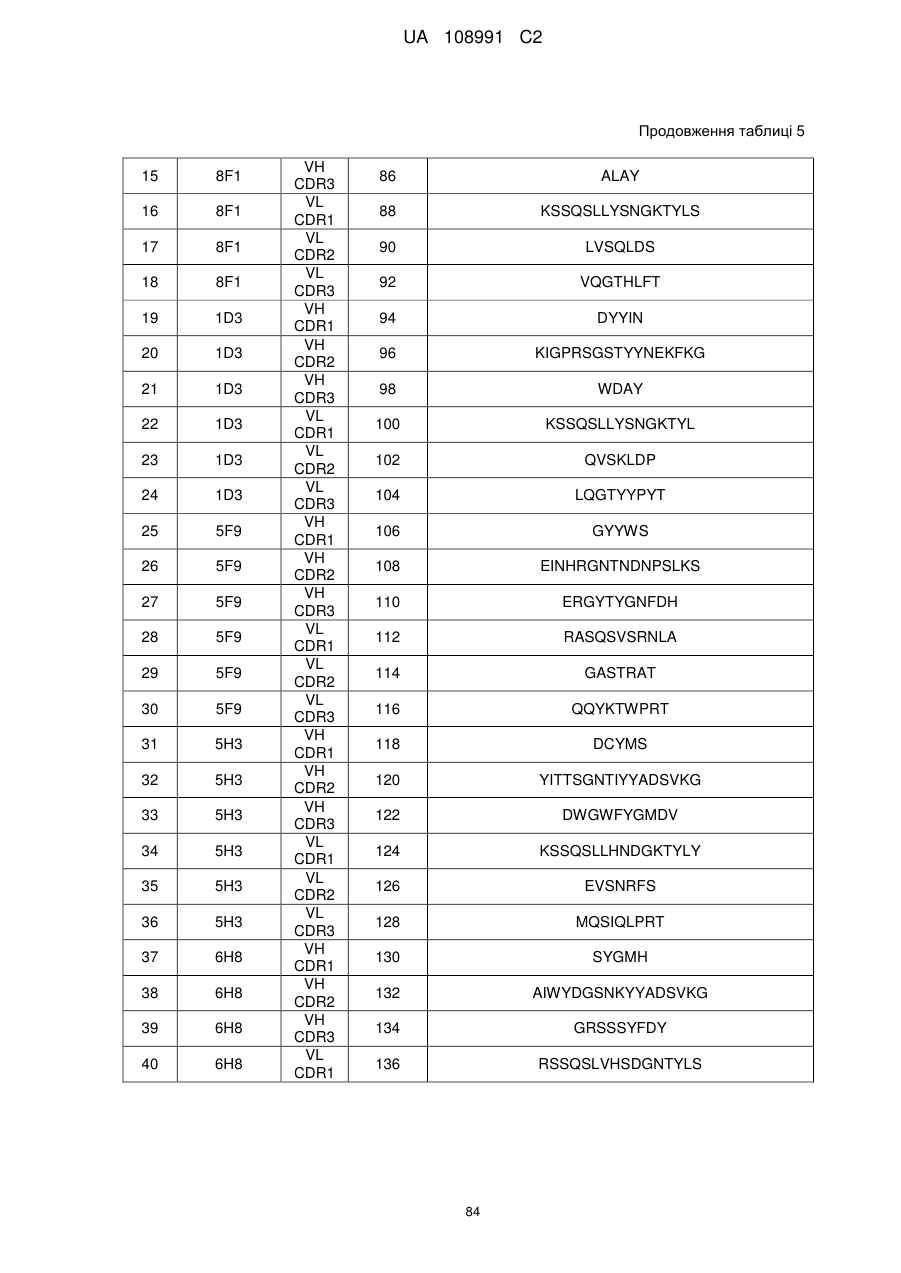
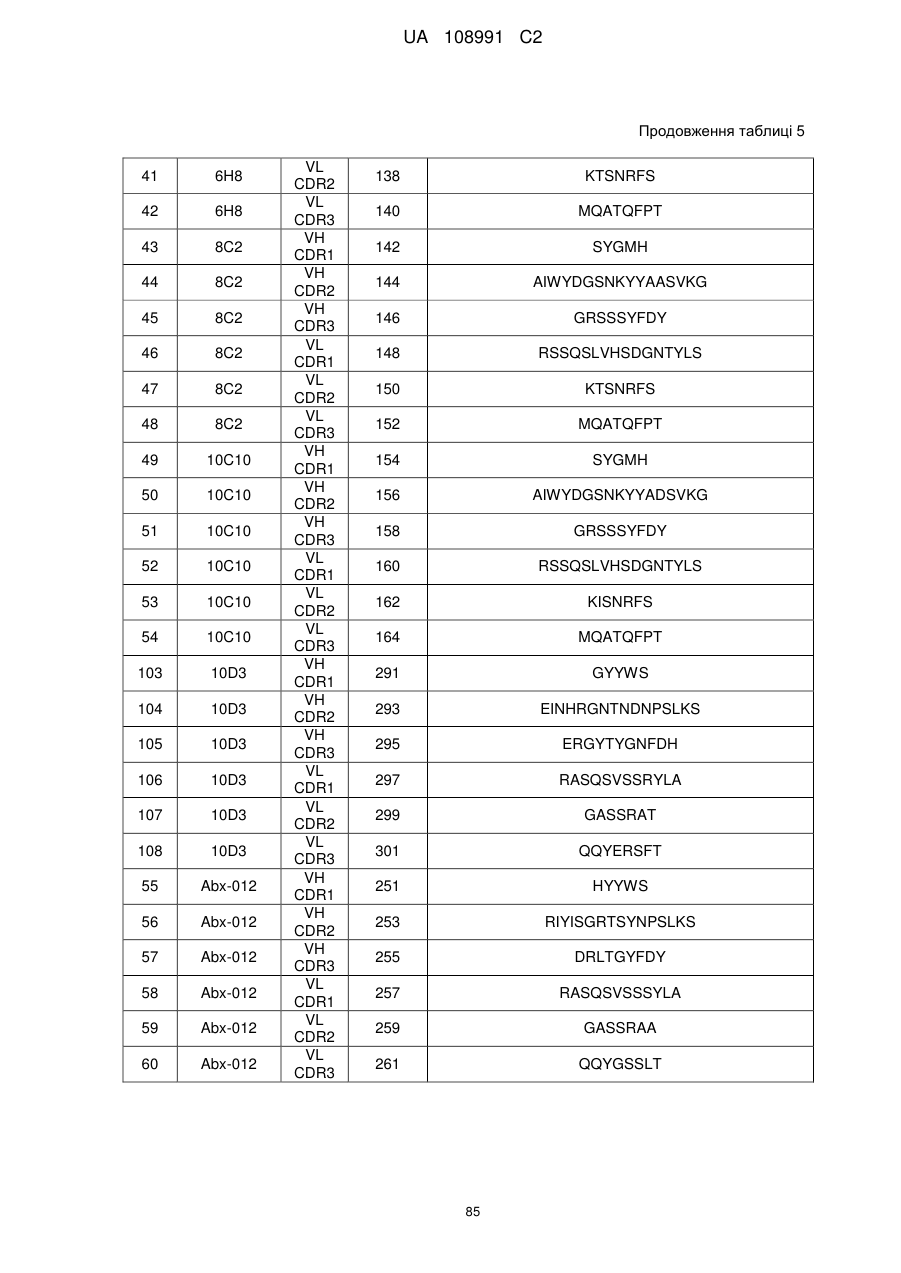
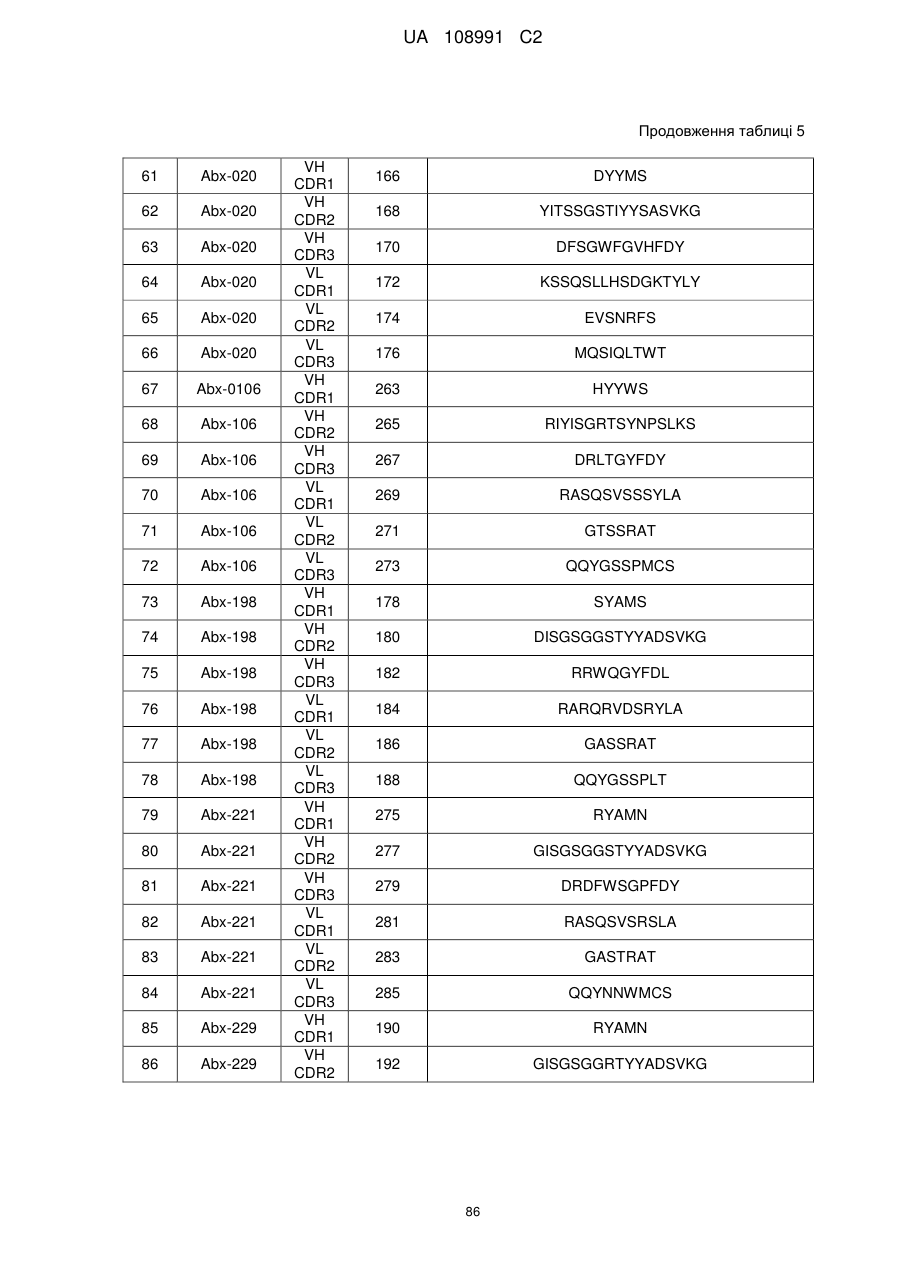
1. Молекула антитіла проти гуанілілциклази С (анти-GCC антитіла), що містить варіабельну ділянку легкого ланцюга і варіабельну ділянку важкого ланцюга, де варіабельна ділянка легкого ланцюга містить три ділянки, які визначають компліментарність, легкого ланцюга (LCDR1, LCDR2 і LCDR3, і три ділянки, які визначають компліментарність, важкого ланцюга (HCDR1, HCDR2 і HCDR3), де варіабельнa ділянкa легкого ланцюга містить: LCDR1, що містить амінокислотну послідовність SEQ ID NO: 112, LCDR2, що містить амінокислотну послідовність SEQ ID NO: 114, і LCDR3, що містить амінокислотну послідовність SEQ ID NO: 116; LCDR1, що містить амінокислотну послідовність SEQ ID NO: 64, LCDR2, що містить амінокислотну послідовність SEQ ID NO: 66, і LCDR3, що містить амінокислотну послідовність SEQ ID NO: 68; або LCDR1, що містить амінокислотну послідовність SEQ ID NO: 196, LCDR2, що містить амінокислотну послідовність SEQ ID NO: 198, і LCDR3, що містить амінокислотну послідовність SEQ ID NO: 200; і де варіабельнa ділянка важкого ланцюга містить: HCDR1, що містить амінокислотну послідовність SEQ ID NO: 106, HCDR2, що містить амінокислотну послідовність SEQ ID NO: 108, і HCDR3, що містить амінокислотну послідовність SEQ ID NO: 110; HCDR1, що містить амінокислотну послідовність SEQ ID NO: 58, HCDR2, що містить амінокислотну послідовність SEQ ID NO: 60, і HCDR3, що містить амінокислотну послідовність SEQ ID NO: 62; або HCDR1, що містить амінокислотну послідовність SEQ ID NO: 190, HCDR2, що містить амінокислотну послідовність SEQ ID NO: 192, і HCDR3, що містить амінокислотну послідовність SEQ ID NO: 194.
2. Молекула анти-GCC антитіла за п. 1, що додатково містить каркасні області варіабельних ділянок легкого і важкого ланцюгів людини або які отримані від людини.
3. Молекула анти-GCC антитіла за п. 1 або 2, де зазначене анти-GCC антитіло являє собою антитіло IgG1.
4. Молекула анти-GCC антитіла за п. 1, де варіабельна ділянка легкого ланцюга містить амінокислотну послідовність SEQ ID NO: 20, і варіабельна ділянка важкого ланцюга містить амінокислотну послідовність SEQ ID NO: 18; варіабельна ділянка легкого ланцюга містить амінокислотну послідовність SEQ ID NO: 4, і варіабельна ділянка важкого ланцюга містить амінокислотну послідовність SEQ ID NO: 2; або варіабельна ділянка легкого ланцюга містить амінокислотну послідовність SEQ ID NO: 48, і варіабельна ділянка важкого ланцюга містить амінокислотну послідовність SEQ ID NO: 46.
5. Імунокон'югат формули (I):
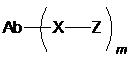 (I)
(I)
або його фармацевтично придатна сіль, де:
Ab являє собою молекулу анти-GCC антитіла за будь-яким з пп. 1-4;
X являє собою лінкерну частину, яка зв'язує Ab і Z;
Z являє собою терапевтичний засіб або мітку; та
m являє собою ціле число від 1 до 15.
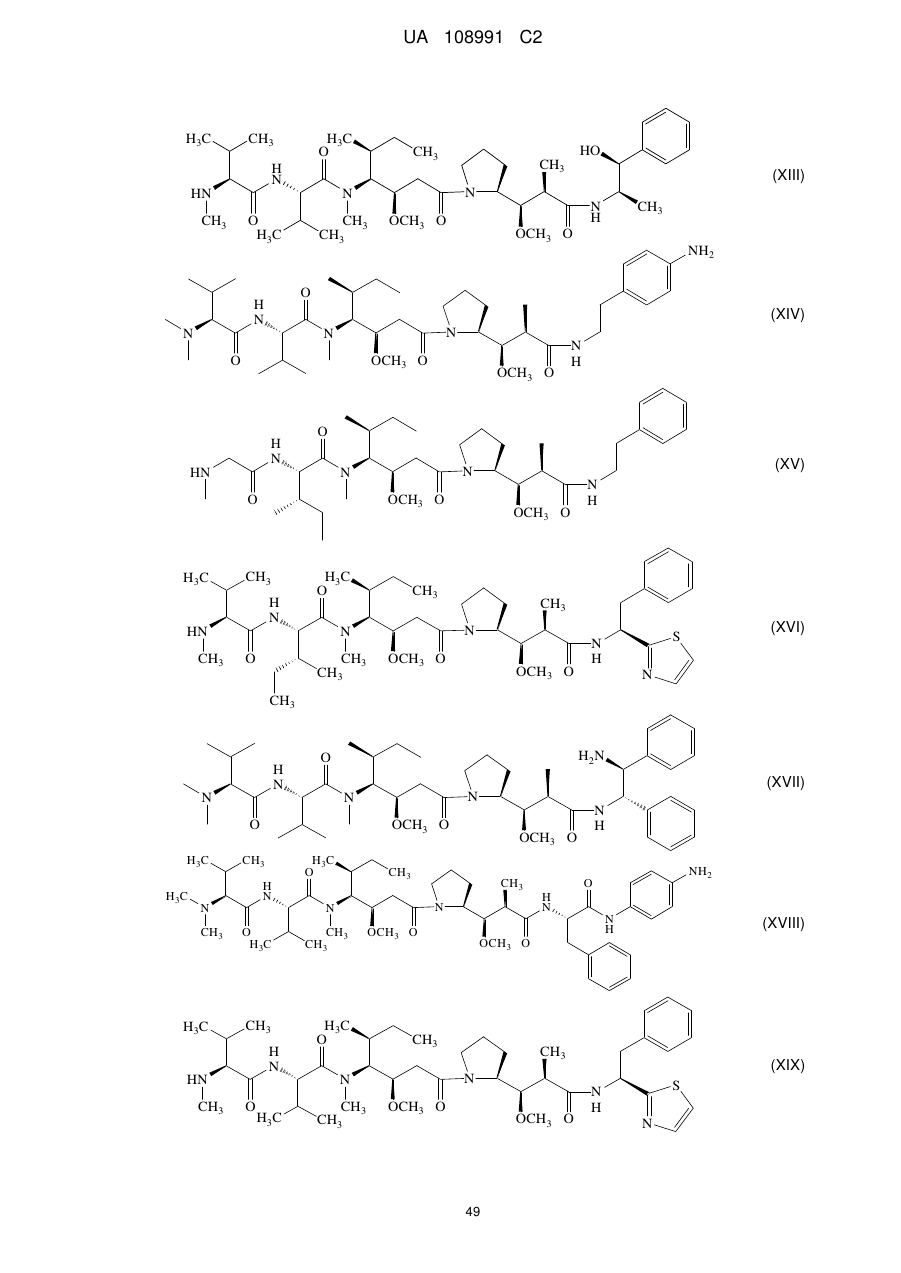
6. Імунокон'югат за п. 5, де Z являє собою детектовану мітку, майтансин, ауристатин, DM1, DM4, MMAE або MMAF.
7. Імунокон'югат за п. 5, де
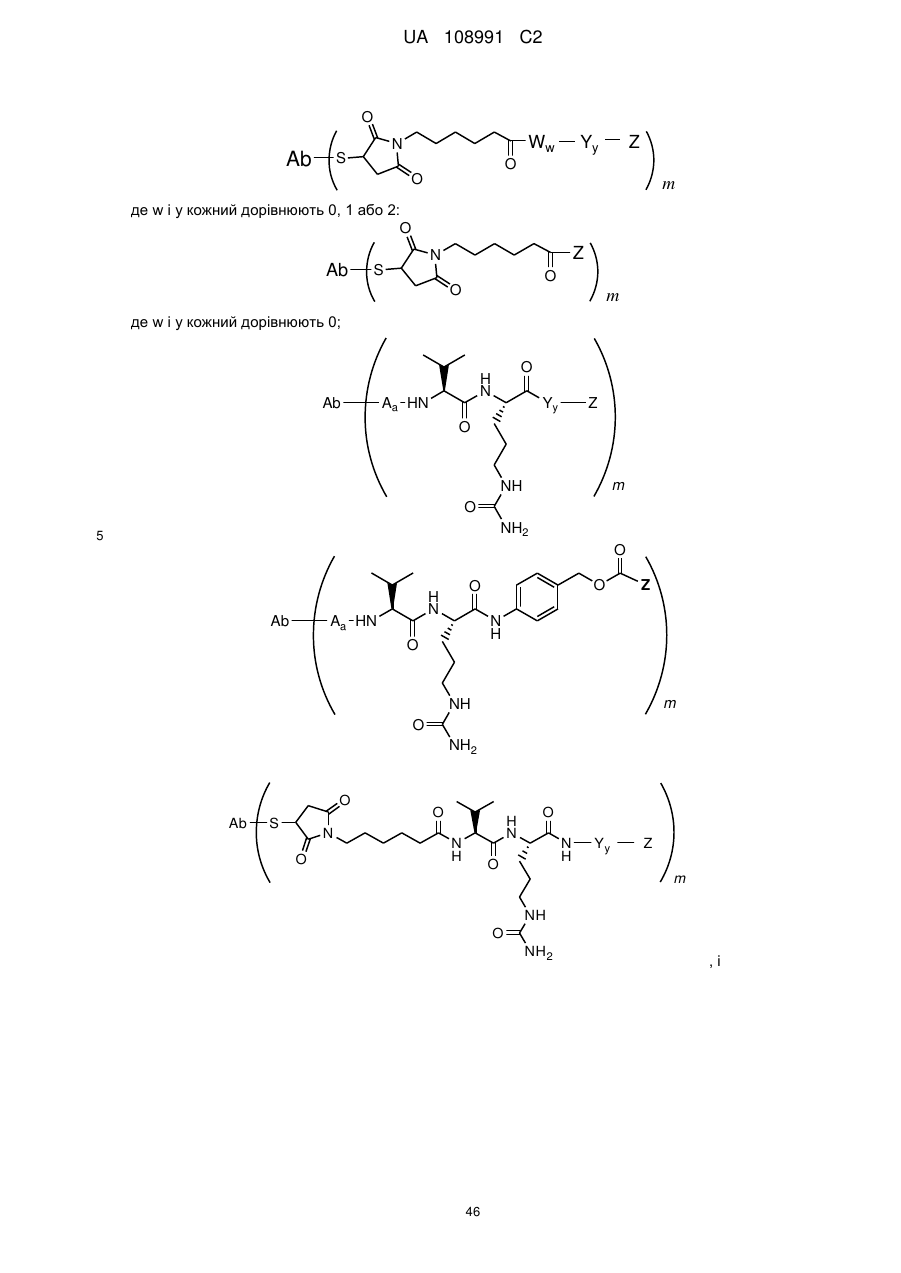
(а) лінкер -X- має формулу -Aa-Ww-Yy- та імунокон'югат характеризується формулою (II):
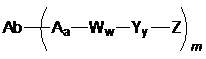 , (II)
, (II)
або його фармацевтично придатна сіль, де:
-A- являє собою розтяжку;
a дорівнює 0 або 1;
кожний -W- незалежно являє собою амінокислотну одиницю;
w являє собою ціле число в діапазоні від 0 до 12;
-Y- являє собою спейсер, що самовидаляється;
y дорівнює 0, 1 або 2;
Z являє собою терапевтичний засіб або мітку; і
m знаходиться в діапазоні від приблизно 1 до приблизно 15, або
(b) імунокон'югат має формулу (I-4):
 , (I-4)
, (I-4)
або його фармацевтично придатна сіль, де m являє собою ціле число від 1 до 8, або
(c) імунокон'югат має формулу (I-5):
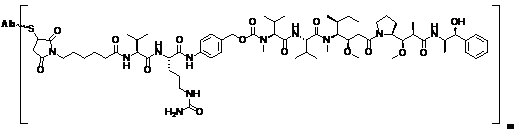 , (I-5)
, (I-5)
або його фармацевтично придатна сіль, де m являє собою ціле число від 1 до 8, або
(d) імунокон'югат має формулу (I-7):
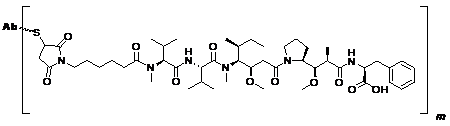 , (I-7)
, (I-7)
або його фармацевтично придатна сіль, де:
m являє собою ціле число від 1 до 8.
8. Імунокон'югат за п. 7, де m становить від 1 до 3 або від 3 до 5.
9. Фармацевтична композиція, що містить молекулу анти-GCC антитіла за будь-яким з пп. 1-4 або імунокон'югат за пп. 5-8 і фармацевтично прийнятний носій.
10. Фармацевтична композиція за п. 9 для застосування в лікуванні порушення, вибраного з групи, яка складається з раку, раку шлунково-кишкового тракту або його метастатичних уражень, первинного і метастатичного раку товстої кишки, раку шлунка, раку стравоходу, раку підшлункової залози або раку легенів.
11. Фармацевтична композиція за п. 9 для застосування в комбінації з одним або більше додатковими терапевтичними засобами.
12. Фармацевтична композиція за п. 11, де один або більше додаткових терапевтичних засобів містять 5-фторурацил (5-FU), капецитибін, лейковорин, іринотекан, оксаліплатин, бевацизумаб, цетуксимаб, панітумум або їх комбінації, наприклад, оксаліплатин/капецитибін (XELOX), 5-FU/лейковорин/оксаліплатин (FOLFOX), 5-фторурацил/лейковорин/іринотекан (FOLFIRІ), FOLFOX плюс бевацизумаб або FOLFIRІ плюс бевацизумаб.
13. Фармацевтична композиція за п. 11, де один або більше додаткових терапевтичних засобів містять один або більше хіміотерапевтичних засобів, вибраних з ушкоджуючих ДНК засобів, інгібіторів топоізомерази І (наприклад, іринотекану, топотекану, камптотецину і їх аналогів або метаболітів, і доксорубіцину); інгібіторів топоізомерази II (наприклад, етопозиду, тенінозиду і даунорубіцину); агентів алкілування (наприклад, мелфалану, хлорамбуцилу, бусульфану, тіотепи, іфосфаміду, кармустину, ломустину, семустину, стрептозоцину, декарбазину, метотрексату, мітоміцину С і циклофосфаміду); ДНК-інтеркаляторів (наприклад, цисплатину, оксаліплатину і карбоплатину); вільнорадикальних генераторів, таких як блеоміцин; нуклеозидних міметиків (5-фторурацилу, капецитибіну, гемцитабіну, флударабіну, цитарабіну, меркаптопурину, тіогуаніну, пентостатину і гідроксисечовини), засобів, які руйнують клітинну реплікацію, паклітакселу, доцетакселу і споріднених аналогів; вінкристину, вінбластину, і споріднених аналогів; талідоміду, леналідоміду і споріднених аналогів (наприклад, СС-5013 і СС-4047); інгібіторів протеїнтирозинкінази (наприклад, іматинібу мезилату і гефітинібу); інгібіторів протеасоми (наприклад, бортезомібу); інгібіторів NF-KB, включаючи інгібітори ІκВ кінази; антитіл, які зв'язують білки, які надекспрсуються в ракових пухлинах, і таким чином знижують клітинну реплікацію (наприклад, трастузумабу, ритуксимабу, цетуксимабу і бевацизумабу); і інших інгібіторів білків або ферментів, відомих як підвищуючі, надекспресуючі або активуючі в ракових пухлинах, інгібування яких знижує клітинну реплікацію.
14. Контейнер, що містить фармацевтичну композицію за будь-яким з пп. 9-13.
15. Набір, що містить молекулу анти-GCC антитіла за будь-яким з пп. 1-4 або імунокон'югат за будь-яким з пп. 5-8.
16. Застосування молекули антитіла за будь-яким з пп. 1-4 або імунокон'югата за пп. 5-8 для виготовлення лікарського засобу для лікування порушення у суб'єкта, вибраного з групи, що складається з раку, раку шлунково-кишкового тракту або його метастатичних уражень, первинного і метастатичного раку товстої кишки, раку шлунка, раку стравоходу, раку підшлункової залози або раку легенів.
17. Застосування за п. 16 в комбінації з одним або більше додатковими терапевтичними засобами.
18. Застосування за п. 17, де один або більше додаткових терапевтичних засобів містять 5-фторурацил (5-FU), капецитибін, лейковорин, іринотекан, оксаліплатин, бевацизумаб, цетуксимаб, панітумум або їх комбінації, наприклад, оксаліплатин/капецитибін (XELOX), 5-FU/лейковорин/оксаліплатин (FOLFOX), 5-фторурацил/лейковорин/іринотекан (FOLFIRІ), FOLFOX плюс бевацизумаб або FOLFIRІ плюс бевацизумаб.
19. Застосування за п. 17, де один або більше додаткових терапевтичних засобів містять один або більше хіміотерапевтичних засобів, вибраних з ушкоджуючих ДНК засобів, інгібіторів топоізомерази І (наприклад, іринотекану, топотекану, камптотецину і їх аналогів або метаболітів, і доксорубіцину); інгібіторів топоізомерази II (наприклад, етопозиду, тенінозиду і даунорубіцину); агентів алкілування (наприклад, мелфалану, хлорамбуцилу, бусульфану, тіотепи, іфосфаміду, кармустину, ломустину, семустину, стрептозоцину, декарбазину, метотрексату, мітоміцину С і циклофосфаміду); ДНК-інтеркаляторів (наприклад, цисплатину, оксаліплатину і карбоплатину); вільнорадикальних генераторів, таких як блеоміцин; нуклеозидних міметиків (наприклад, 5-фторурацилу, капецитибіну, гемцитабіну, флударабіну, цитарабіну, меркаптопурину, тіогуаніну, пентостатину і гідроксисечовини), засобів, які руйнують клітинну реплікацію, паклітакселу, доцетаксслу, і споріднених аналогів; вінкристину, вінбластину і споріднених аналогів; талідоміду, леналідоміду і споріднених аналогів (наприклад, СС-5013 і СС-4047); інгібіторів протеїнтирозинкінази (наприклад, іматинібу мезилату і гефітинібу); інгібіторів протеасоми (наприклад, бортезомібу); інгібіторів NF-KB, включаючи інгібітори ІκВ кінази; антитіл, які зв'язують білки, які надекспрсуються в ракових пухлинах, і таким чином знижують клітинну реплікацію (наприклад, трастузумабу, ритуксимабу, цетуксимабу і бевацизумабу); і інших інгібіторів білків або ферментів, відомих як підвищуючі, надекспресуючі або активуючі в ракових пухлинах, інгібування яких знижує клітинну реплікацію.
20. Застосування за будь-яким з пп. 16-19, де застосування додатково включає детектування молекули GCC, включаючи контактування зазначеної молекули з молекулою антитіла та визначення, чи зв'язується зазначена молекула антитіла з вказаною GCC-молекулою.
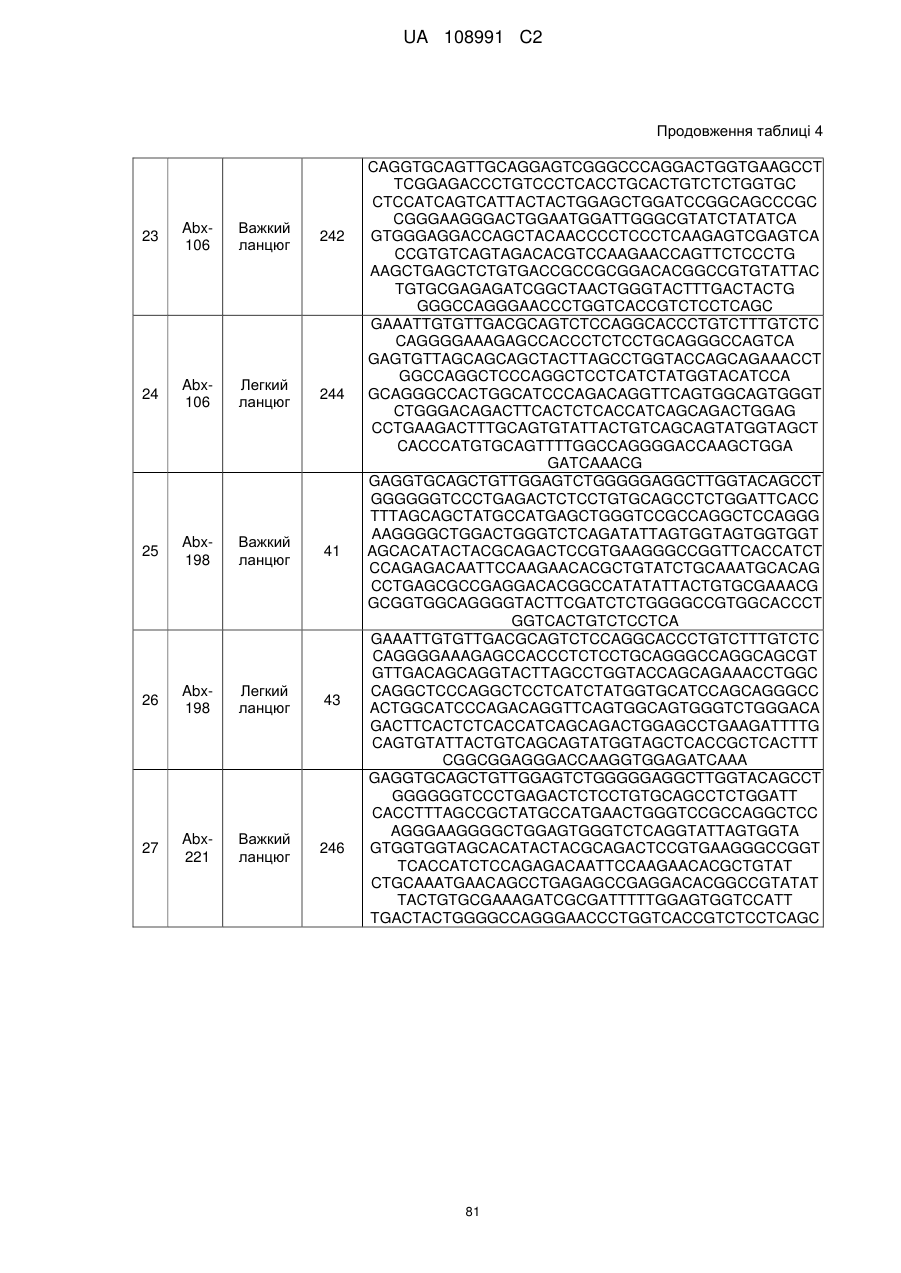
21. Виділена послідовність нуклеїнових кислот, яка кодує молекулу антитіла за будь-яким з пп. 1-4 або варіабельну ділянку молекули антитіла за будь-яким з пп. 1-4.
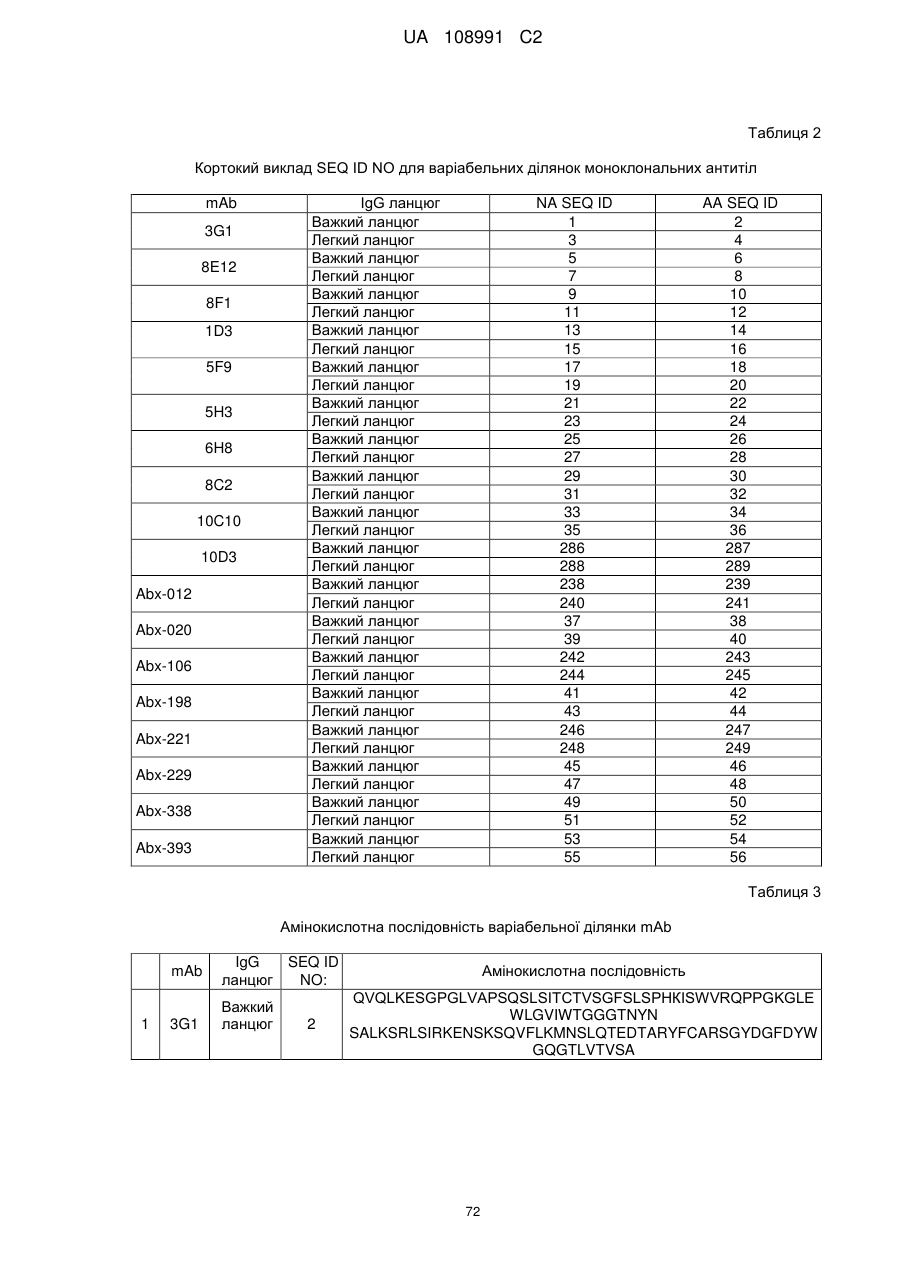
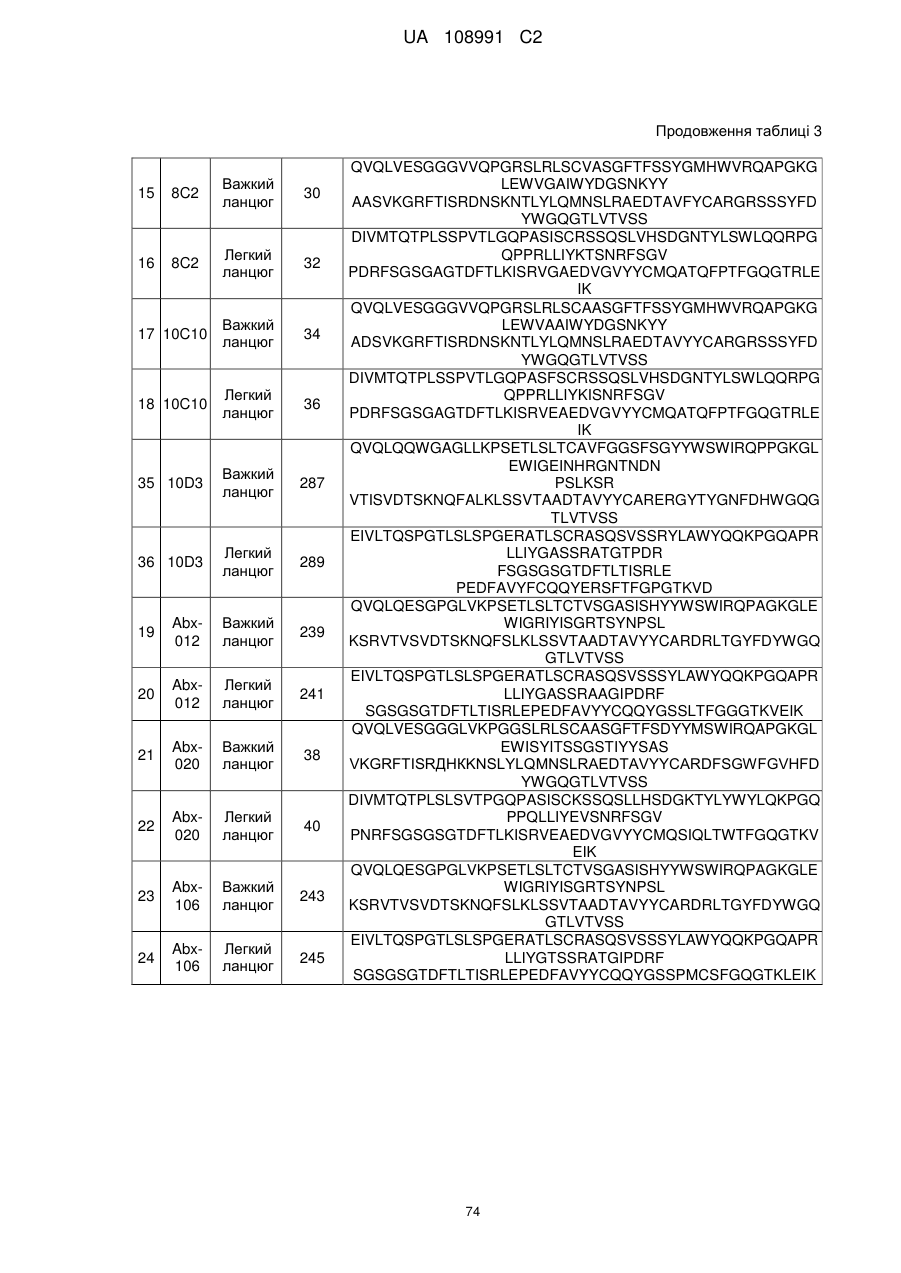
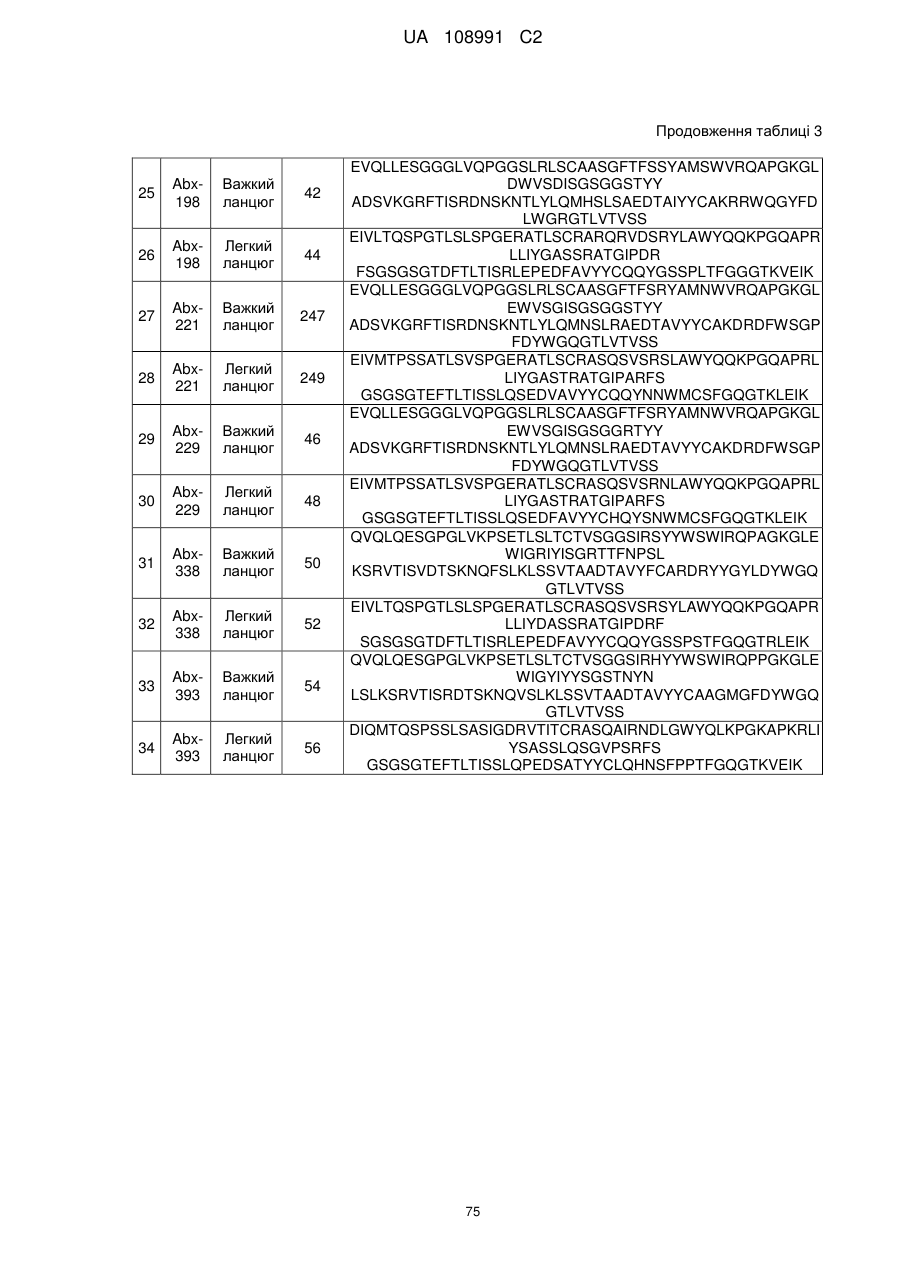
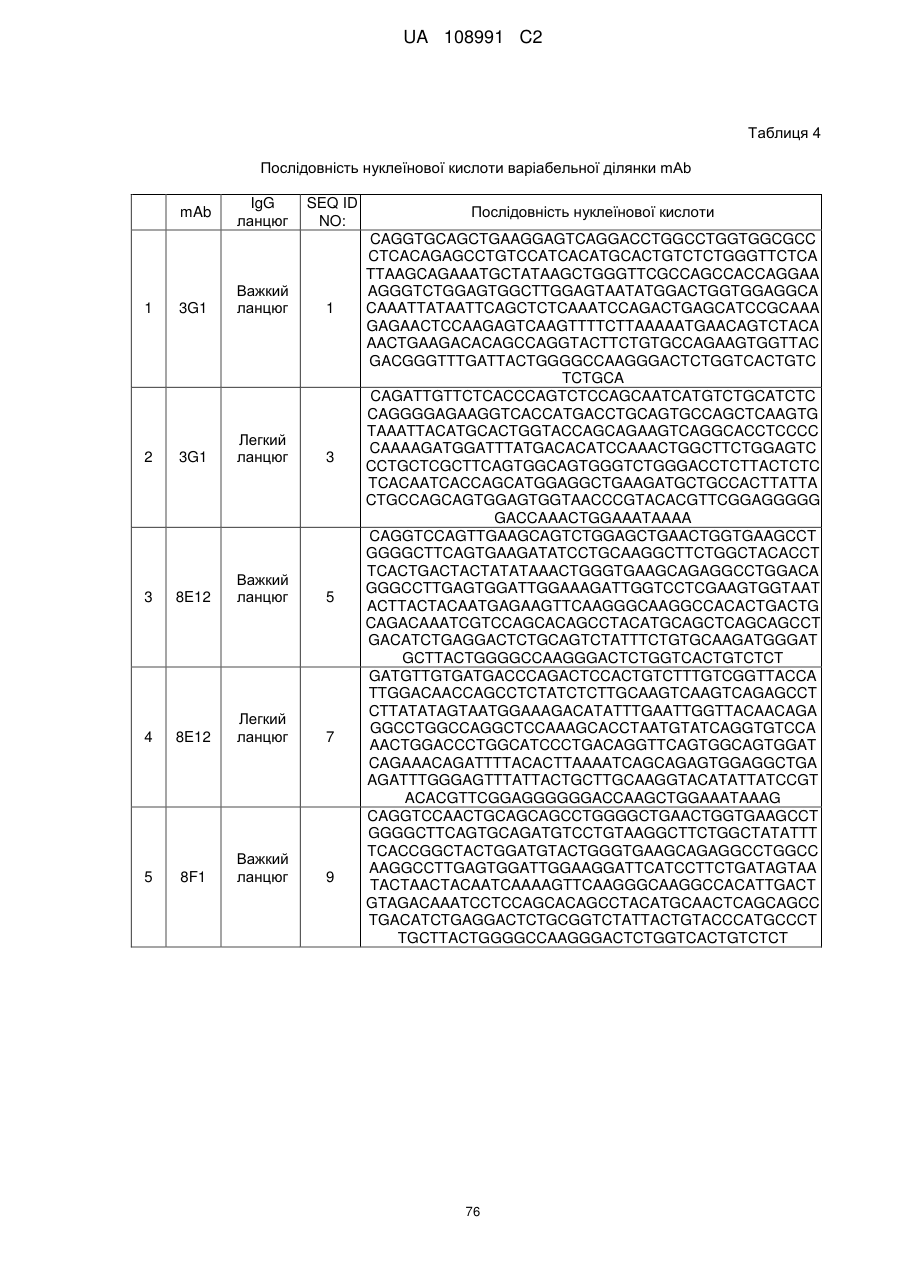
22. Виділена послідовність нуклеїнових кислот за п. 21, що містить послідовність нуклеїнових кислот будь-якої з SEQ ID NO: 17, 19, 1, 3, 45 або 47.
23. Вектор, що містить послідовність нуклеїнових кислот за п. 21 або п. 22.
24. Клітина, що містить виділену послідовність нуклеїнових кислот за п. 21 або п. 22 або вектор за п. 23.
25. Спосіб отримання молекули антитіла за будь-яким з пп. 1-4, що включає культивування клітини за п. 24 в умовах, що надають можливість продукції молекули антитіла, таким чином отримуючи молекулу антитіла за будь-яким з пп. 1-4.
26. Спосіб виявлення молекули GCC, що включає введення в контакт даної молекули з молекулою антитіла за будь-яким з пп. 1-4 і визначення того, чи зв'язується молекула антитіла з зазначеною молекулою GCC.
27. Спосіб лікування порушення у суб'єкта, що включає введення вказаному суб'єкту терапевтично ефективної кількості молекули антитіла за будь-яким з пп. 1-4 або імунокон’югата за будь-яким з пп. 5-8, таким чином здійснюючи лікування зазначеного суб'єкта, де порушення вибирають з групи, що складається з раку, раку шлунково-кишкового тракту або його метастатичних уражень, первинного і метастатичного раку товстої кишки, раку шлунка, раку стравоходу, раку підшлункової залози або раку легень.
28. Спосіб за п. 27, який додатково включає введення вказаному суб'єкту одного або більше додаткових терапевтичних засобів.
29. Спосіб за п. 28, де один або більше додаткових терапевтичних засобів містять 5-фторурацил (5-FU), капецитибін, лейковорин, іринотекан, оксаліплатин, бевацизумаб, цетуксимаб, панітумум або їх комбінації, наприклад, оксаліплатин/капецитибін (XELOX), 5-FU/лейковорин/оксаліплатин (FOLFOX), 5-фторурацил/лейковорин/іринотекан (FOLFIRІ), FOLFOX плюс бевацизумаб або FOLFIRІ плюс бевацизумаб.
30. Спосіб за п. 28, де один або більше додаткових терапевтичних засобів містять один або більше хіміотерапевтичних засобів, вибраних з ушкоджуючих ДНК засобів, інгібіторів топоізомерази І (наприклад, іринотекану, топотекану, камптотецину і їх аналогів або метаболітів, і доксорубіцину); інгібіторів топоізомерази II (наприклад, етопозиду, тенінозиду і даунорубіцину); агентів алкілування (наприклад, мелфалану, хлорамбуцилу, бусульфану, тіотепи, іфосфаміду, кармустину, ломустину, семустину, стрептозоцину, декарбазину, метотрексату, мітоміцину С і циклофосфаміду); ДНК інтеркаляторів (наприклад, цисплатину, оксаліплатину і карбоплатину); вільнорадикальних генераторів, таких як блеоміцин; нуклеозидних міметиків (наприклад, 5-фторурацилу, капецитибіну, гемцитабіну, флударабіну, цитарабіну, меркаптопурину, тіогуаніну, пентостатину і гідроксисечовини), засобів, які руйнують клітинну реплікацію, паклітакселу, доцетакселу, і споріднених аналогів; вінкристину, вінбластину і споріднених аналогів; талідоміду, леналідоміду і споріднених аналогів (наприклад, СС-5013 і СС-4047); інгібіторів протеїнтирозинкінази (наприклад, іматинібу мезилату і гефітинібу); інгібіторів протеасоми (наприклад, бортезомібу); інгібіторів NF-KB, включаючи інгібітори ІκВ кінази; антитіл, які зв'язують білки, які надекспрсуються в ракових пухлинах, і таким чином знижують клітинну реплікацію (наприклад, трастузумабу, ритуксимабу, цетуксимабу і бевацизумабу); і інших інгібіторів білків або ферментів, відомих як підвищуючі, надекспресуючі або активуючі в ракових пухлинах, інгібування яких знижує клітинну реплікацію.
Текст
Реферат: UA 108991 C2 (12) UA 108991 C2 Розкриваються антитіла та антиген-зв'язувальні фрагменти антитіл, що зв'язуються з GCC. Антитіла зв'язуються з позаклітинним доменом GCC і можуть бути інтерналізовані. В деяких варіантах здійснення антитіла є гуманізованими, химерними або належать людині. Також розкриваються нуклеїнові кислоти та вектори, що кодують антитіла або їх частини, рекомбінантні клітини, що містять нуклеїнові кислоти, та композиції, що містять антитіла або антиген-зв'язувальні фрагменти. Винахід також забезпечує терапевтичні та діагностичні способи застосування антитіл і антиген-зв'язувальних фрагментів, забезпечених в даному документі. UA 108991 C2 5 10 15 20 25 30 35 40 45 50 55 60 Родинні заявки [001] Дана заявка заявляє пріоритет попередньої заявки США з серійним номером 61/254474, поданої 23 жовтня 2009 року. Повний зміст попередньої заявки США з серійним номером 61/254474 включено в даний документ цим посиланням. Галузь винаходу [002] Дійсний винахід стосується молекул антитіла, які зв’язуються з GCC, а також пов’язаних молекул, наприклад, нуклеїнових кислот, які кодують такі молекули антитіла, композицій і пов’язаних способів, наприклад, терапевтичних і діагностичних способів. Передумови винаходу [003] Гуанілілциклаза C (GCC) являє собою трансмембранний рецептор клітинної поверхні, який функціонує для підтримки кишкового соку, електролітного гомеостазу та клітинної проліферації, дивись, наприклад, Carrithers et al., Proc. Natl. Acad. Sci. USA 100:3018-3020 (2003). GCC експресується на слизових клітинах, що вистеляють тонкий кишечник, товстий кишечник і пряму кишку (Carrithers et al., Dis Colon Rectum 39: 171-181 (1996)). Експресія GCC зберігається при неопластичній трансформації епітеліальних клітин кишечника з експресією в усіх первинних і метастатичних пухлинах товстої кишки (Carrithers et al., Dis Colon Rectum 39: 171-181 (1996); Buc et al. Eur J Cancer 41: 1618-1627 (2005); Carrithers et al., Gastroenterology 107: 1653-1661(1994)). Короткий опис винаходу [004] Винахідники відкрили різні антитіла до GCC, включаючи як антитіла людини, так і мишачі антитіла. Відповідно, в одному аспекті дійсний винахід являє собою молекулу антитіла до GCC, яка розкривається в даному документі. Молекули антитіла до GCC придатні в якості "голих" молекул антитіл та в якості компонентів імунокон’югатів. Відповідно, в іншому аспекті дійсний винахід описує імунокон’югати, що містять молекулу антитіла до GCC і терапевтичний засіб або мітку. Дійсний винахід також описує фармацевтичні композиції, що містять молекули антитіла до GCC та імунокон’югати, описані в даному документі. Дійсний винахід також описує способи застосування молекул антитіла до GCC і імунокон’югатів, описаних в даному документі, для визначення GCC і клітин або тканин, що експресують GCC; для діагностики, прогнозу, візуалізації, або визначення стадії GCC-опосередкованого захворювання; для модуляції активності або функції GCC-білка; та для лікування GCC-опосередкованого захворювання, як описано в даному документі. В іншому аспекті дійсний винахід також описує виділені та/або рекомбінантні нуклеїнові кислоти, що кодують амінокислотні послідовності молекули антитіла до GCC, а також вектори та клітини-хазяїни, що містять такі нуклеїнові кислоти, та способи отримання молекул антитіла до GCC. [005] Всі публікації, патентні заявки, патенти та інші посилання, що згадуються в цьому документі, включені посиланням в їх повному об’ємі. [006] Інші ознаки, об’єкти та переваги дійсного винаходу(ів), розкритого в даному документі, будуть очевидними з опису винаходу та графічних матеріалів і з формули винаходу. Опис фігур [007] Фігура 1 відображає ріст пухлини у SCID мишей, що несуть 293-GCC#2, яких лікували за допомогою 5F9vc-MMAF, -DM1, і -DM4 за графіком введення один раз кожні 14 днів. [008] Фігура 2 відображає ріст пухлини мишей, яких лікували за допомогою 0,9%NaCl; 209 антитіла в дозі 40мг/кг; або 5F9 антитілом в дозі 10 або 40 мг/кг. [009] Фігура 3 відображає вагу легень мишей, яких лікували за допомогою 0,9%NaCl; 209 антитіла в дозі 40мг/кг; або 5F9 антитілом в дозі 10 або 40 мг/кг на день 41 p.i. (інтраперитонеально). [010] Фігура 4 відображає криву виживання мишей, що несуть CT26-hGCC пухлину, яких лікували 5F9 антитілом. Детальний опис винаходу Гуанілілциклаза C [011] Гуанілілциклаза C (GCC) (також відома як STAR, ST Рецептор, GUC2C, і GUCY2C) являє собою трансмембранний рецептор клітинної поверхні, що функціонує в підтримці кишкового соку, електролітного гомеостазу та клітинної проліферації (Carrithers et al., Proc Natl Acad Sci U S A 100: 3018-3020 (2003); Mann et al., Biochem Biophys Res Commun 239: 463-466 (1997); Pitari et al., Proc Natl Acad Sci U S A 100: 2695-2699 (2003)); інвентарній номер GenBank NM_004963, кожна з яких включена в даний документ посиланням). Ця функціяопосередковується через зв’язування гуаніліну (Wiegand et al. FEBS Lett. 311:150-154 (1992)). GCC також є рецептором для термостабільного ентеротоксину (ST, наприклад, що має амінокислотну послідовність NTFYCCELCCNPACAGCY, SEQ ID NO:316), який є пептидом, що продукується E. coli, а також іншими інфекційними організмами (Rao, M.C. Ciba Found. Symp. 112:74-93 (1985); Knoop F.C. і Owens, M. J. Pharmacol. Toxicol. Methods 28:67-72 (1992)). Зв’язування ST з GCC активує сигнальний 1 UA 108991 C2 5 10 15 20 25 30 35 40 45 50 55 60 каскад, що приводить до кишкового захворювання, наприклад, діареї. [012] Нуклеотидна послідовність для GCC людини (інвентарний номер GenBank NM_004963): 1 atgaagacgt tgctgttgga cttggctttg tggtcactgc tcttccagcc cgggtggctg 61 tcctttagtt cccaggtgag tcagaactgc cacaatggca gctatgaaat cagcgtcctg 121 atgatgggca actcagcctt tgcagagccc ctgaaaaact tggaagatgc ggtgaatgag 181 gggctggaaa tagtgagagg acgtctgcaa aatgctggcc taaatgtgac tgtgaacgct 241 actttcatgt attcggatgg tctgattcat aactcaggcg actgccggag tagcacctgt 301 gaaggcctcg acctactcag gaaaatttca aatgcacaac ggatgggctg tgtcctcata 361 gggccctcat gtacatactc caccttccag atgtaccttg acacagaatt gagctacccc 421 atgatctcag ctggaagttt tggattgtca tgtgactata aagaaacctt aaccaggctg 481 atgtctccag ctagaaagtt gatgtacttc ttggttaact tttggaaaac caacgatctg 541 cccttcaaaa cttattcctg gagcacttcg tatgtttaca agaatggtac agaaactgag 601 gactgtttct ggtaccttaa tgctctggag gctagcgttt cctatttctc ccacgaactc 661 ggctttaagg tggtgttaag acaagataag gagtttcagg atatcttaat ggaccacaac 721 aggaaaagca atgtgattat tatgtgtggt ggtccagagt tcctctacaa gctgaagggt 781 gaccgagcag tggctgaaga cattgtcatt attctagtgg atcttttcaa tgaccagtac 841 tttgaggaca atgtcacagc ccctgactat atgaaaaatg tccttgttct gacgctgtct 901 cctgggaatt cccttctaaa tagctctttc tccaggaatc tatcaccaac aaaacgagac 961 tttgctcttg cctatttgaa tggaatcctg ctctttggac atatgctgaa gatatttctt 1021 gaaaatggag aaaatattac cacccccaaa tttgctcatg ctttcaggaa tctcactttt 1081 gaagggtatg acggtccagt gaccttggat gactgggggg atgttgacag taccatggtg 1141 cttctgtata cctctgtgga caccaagaaa tacaaggttc ttttgaccta tgatacccac 1201 gtaaataaga cctatcctgt ggatatgagc cccacattca cttggaagaa ctctaaactt 1261 cctaatgata ttacaggccg gggccctcag atcctgatga ttgcagtctt caccctcact 1321 ggagctgtgg tgctgctcct gctcgtcgct ctcctgatgc tcagaaaata tagaaaagat 1381 tatgaacttc gtcagaaaaa atggtcccac attcctcctg aaaatatctt tcctctggag 1441 accaatgaga ccaatcatgt tagcctcaag atcgatgatg acaaaagacg agatacaatc 1501 cagagactac gacagtgcaa atacgacaaa aagcgagtga ttctcaaaga tctcaagcac 1561 aatgatggta atttcactga aaaacagaag atagaattga acaagttgct tcagattgac 1621 tattacaacc tgaccaagtt ctacggcaca gtgaaacttg ataccatgat cttcggggtg 1681 atagaatact gtgagagagg atccctccgg gaagttttaa atgacacaat ttcctaccct 1741 gatggcacat tcatggattg ggagtttaag atctctgtct tgtatgacat tgctaaggga 1801 atgtcatatc tgcactccag taagacagaa gtccatggtc gtctgaaatc taccaactgc 1861 gtagtggaca gtagaatggt ggtgaagatc actgattttg gctgcaattc cattttacct 1921 ccaaaaaagg acctgtggac agctccagag cacctccgcc aagccaacat ctctcagaaa 1981 ggagatgtgt acagctatgg gatcatcgca caggagatca tcctgcggaa agaaaccttc 2041 tacactttga gctgtcggga ccggaatgag aagattttca gagtggaaaa ttccaatgga 2101 atgaaaccct tccgcccaga tttattcttg gaaacagcag aggaaaaaga gctagaagtg 2161 tacctacttg taaaaaactg ttgggaggaa gatccagaaa agagaccaga tttcaaaaaa 2221 attgagacta cacttgccaa gatatttgga ctttttcatg accaaaaaaa tgaaagctat 2281 atggatacct tgatccgacg tctacagcta tattctcgaa acctggaaca tctggtagag 2341 gaaaggacac agctgtacaa ggcagagagg gacagggctg acagacttaa ctttatgttg 2401 cttccaaggc tagtggtaaa gtctctgaag gagaaaggct ttgtggagcc ggaactatat 2461 gaggaagtta caatctactt cagtgacatt gtaggtttca ctactatctg caaatacagc 2521 acccccatgg aagtggtgga catgcttaat gacatctata agagttttga ccacattgtt 2581 gatcatcatg atgtctacaa ggtggaaacc atcggtgatg cgtacatggt ggctagtggt 2641 ttgcctaaga gaaatggcaa tcggcatgca atagacattg ccaagatggc cttggaaatc 2701 ctcagcttca tggggacctt tgagctggag catcttcctg gcctcccaat atggattcgc 2761 attggagttc actctggtcc ctgtgctgct ggagttgtgg gaatcaagat gcctcgttat 2821 tgtctatttg gagatacggt caacacagcc tctaggatgg aatccactgg cctccctttg 2881 agaattcacg tgagtggctc caccatagcc atcctgaaga gaactgagtg ccagttcctt 2941 tatgaagtga gaggagaaac atacttaaag ggaagaggaa atgagactac ctactggctg 3001 actgggatga aggaccagaa attcaacctg ccaacccctc ctactgtgga gaatcaacag 3061 cgtttgcaag cagaattttc agacatgatt gccaactctt tacagaaaag acaggcagca 3121 gggataagaa gccaaaaacc cagacgggta gccagctata aaaaaggcac tctggaatac 3181 ttgcagctga ataccacaga caaggagagc acctattttt aa (SEQ ID NO:227) [013] Амінокислотна послідовність для GCC людини (інвентарний номер GenPept NP_004954): 2 UA 108991 C2 5 10 15 20 25 30 35 40 45 50 55 60 1 mktllldlal wsllfqpgwl sfssqvsqnc hngsyeisvl mmgnsafaep lknledavne 61 gleivrgrlq naglnvtvna tfmysdglih nsgdcrsstc egldllrkis naqrmgcvli 121 gpsctystfq myldtelsyp misagsfgls cdyketltrl msparklmyf lvnfwktndl 181 pfktyswsts yvykngtete dcfwylnale asvsyfshel gfkvvlrqdk efqdilmdhn 241 rksnviimcg gpeflyklkg dravaedivi ilvdlfndqy fednvtapdy mknvlvltls 301 pgnsllnssf srnlsptkrd falaylngil lfghmlkifl engenittpk fahafrnltf 361 egydgpvtld dwgdvdstmv llytsvdtkk ykvlltydth vnktypvdms ptftwknskl 421 pnditgrgpq ilmiavftlt gavvllllva llmlrkyrkd yelrqkkwsh ippenifple 481 tnetnhvslk idddkrrdti qrlrqckydk krvilkdlkh ndgnftekqk ielnkllqid 541 yynltkfygt vkldtmifgv ieycergslr evlndtisyp dgtfmdwefk isvlydiakg 601 msylhsskte vhgrlkstnc vvdsrmvvki tdfgcnsilp pkkdlwtape hlrqanisqk 661 gdvysygiia qeiilrketf ytlscrdrne kifrvensng mkpfrpdlfl etaeekelev 721 yllvkncwee dpekrpdfkk iettlakifg lfhdqknesy mdtlirrlql ysrnlehlve 781 ertqlykaer dradrlnfml lprlvvkslk ekgfvepely eevtiyfsdi vgfttickys 841 tpmevvdmln diyksfdhiv dhhdvykvet igdaymvasg lpkrngnrha idiakmalei 901 lsfmgtfele hlpglpiwir igvhsgpcaa gvvgikmpry clfgdtvnta srmestglpl 961 rihvsgstia ilkrtecqfl yevrgetylk grgnettywl tgmkdqkfnl ptpptvenqq 1021 rlqaefsdmi anslqkrqaa girsqkprrv asykkgtley lqlnttdkes tyf (SEQ ID NO:228) [014] GCC-білок має декілька загально придатих доменів, кожний з яких забезпечує окрему функцію в молекулі GCC. Частини GCC включають сигнальну послідовність (для спрямування білка до клітинної поверхні) від амінокислотного залишку 1 до приблизно залишку 23, або від залишку 1 до приблизно залишку 21 SEQ ID NO:228 (вирізається під час дозрівання з отриманням функціонально зрілого білка від приблизно амінокислотних залишків 22 або 24 до 1073 SEQ ID NO:228), позаклітинний домен для зв’язування ліганду, наприклад, гуаніліну або ST, від приблизно амінокислотного залишку 24 до приблизно залишку 420 або від приблизно залишку 54 до приблизно залишку 384 SEQ ID NO:228, трансмембранний домен від приблизно амінокислотного залишку 431 до приблизно залишку 454 або від приблизно залишку 436 до приблизно залишку 452 SEQ ID NO:228, кіназа-гомологічний домен, який, як передбачається, має тирозинкіназну активність від приблизно амінокислотного залишку 489 до приблизно залишку 749 або від приблизно залишку 508 до приблизно залишку 745 SEQ ID NO:228, і гуанілілциклазний каталітичний домен від приблизно залишку 750 до приблизно залишку 1007 або від приблизно залишку 816 до приблизно залишку 1002 SEQ ID NO:228. [015] В нормальних тканинах людини GCC експресується в слизових клітинах, наприклад, на апікальних мембранах щіткової облямівки, що вистилають тонкий кишечник, товстий кишечник і пряму кишку (Carrithers et al., Dis Colon Rectum 39: 171-181 (1996)). Експресія GCC зберігається при неопластичній трансформації епітеліальних клітин кишечника з експресією в усіх первинних і метастатичних пухлинах товстої кишки (Carrithers et al., Dis Colon Rectum 39: 171-181 (1996); Buc et al. Eur J Cancer 41: 1618-1627 (2005); Carrithers et al., Gastroenterology 107: 16531661(1994)). Неопластичні клітини зі шлунка, стравоходу та гастроезофагеального з’єднання також експресують GCC (дивись, наприклад, патент США № 6767704; Debruyne et al. Gastroenterology 130:1191-1206 (2006)). Тканино-специфічна експресія та асоціація з раком, наприклад, шлунково-кишкового походження, (наприклад, рак товстої кишки, рак шлунка або рак стравоходу), може бути застосована для застосування GCC в якості діагностичного маркера для цього захворювання (Carrithers et al., Dis Colon Rectum 39: 171-181 (1996); Buc et al. Eur J Cancer 41: 1618-1627 (2005)). [016] Як білок клітинної поверхні GCC може також слугувати в якості терапевтичної мішені для білків, що зв’язуються з рецептором, таких як антитіла або ліганди. В нормальній тканині кишечника GCC експресується на апікальному боці щільних контактів епітеліальних клітин, що формують непроникний бар’єр між середовищем просвіту та судинним компартментом (Almenoff et al., Mol Microbiol 8: 865-873); Guarino et al., Dig Dis Sci 32: 1017-1026 (1987)). В зв’язку з цим, систематичне внутрішньовенне введення терапевтичного засобу GCCзв’язувального білка буде мати мінімальний ефект на кишкові GCC-рецептори, при цьому маючи доступ до неопластичних клітин шлунково-кишкової системи, включаючи клітини інвазивного або метастатичного раку товстої кишки, екстраінтестинальні або метастатичні пухлини товстої кишки, езофагеальні пухлини або пухлини шлунка, аденокарцинома на гастроезофагеальному з’єднанні. До того ж, GCC інтерналізується через опосередкований рецептором ендоцитоз при зв’язуванні ліганду (Buc et al. Eur J Cancer 41: 1618-1627 (2005); Urbanski et al., Biochem Biophys Acta 1245: 29-36 (1995)). [017] Поліклональні антитіла, що виникають проти позаклітинного домену GCC (Nandi et al. 3 UA 108991 C2 5 10 15 20 25 30 35 40 45 50 55 60 Protein Expr. Purif. 8:151-159 (1996)), були здатні інгібувати зв’язування ST пептиду з GCC людини та щура та інгібувати ST-опосередковану продукцію cGMP завдяки GCC людини. [018] GCC була охарактеризована як білок, що залучений в різновиди раку, включаючи раки товстої кишки. Дивись також, Carrithers et al., Dis Colon Rectum 39: 171-181 (1996); Buc et al. Eur J Cancer 41: 1618-1627 (2005); Carrithers et al., Gastroenterology 107: 1653-1661(1994); Urbanski et al., Biochem Biophys Acta 1245: 29-36 (1995). Терапевтичні засоби на основі молекул антитіла, спрямовані на GCC, можуть бути використані окремо в некон’югованій формі для того, щоб, таким чином, інгібувати ракові клітини, що експресують GCC. Молекули антитіла до GCC дійсного винаходу можуть зв’язуватися з GCC людини. В деяких варіантах здійснення молекула антитіла до GCC дійсного винаходу може інгібувати зв’язування ліганду, наприклад, гуаніліну або термостабільного ентеротоксину, з GCC. В інших варіантах здійснення молекула антитіла до GCC дійсного винаходу не інгібує зв’язування ліганду, наприклад, гуаніліну або термостабільного ентеротоксину з GCC. [019] Моноклональні антитіла, специфічні до GCC, включають GCC:B10 (Nandi et al., J. Cell. Biochem. 66:500-511 (1997)), GCC:4D7 (Vijayachandra et al. Biochemistry 39:16075-16083 (2000)) і GCC:C8 (Bakre et al. Eur. J. Biochem. 267:179-187 (2000)). GCC:B10 має каппа-легкий ланцюг і IgG2a ізотип і дає перехресну реакцію з GCC щура, свині та мавпи. GCC:B10 зв’язується з першими 63 амінокислотами внутрішньоклітинного домену GCC, конкретно з залишками 470480 SEQ ID NO:228 (Nandi et al. Protein Sci. 7:2175-2183 (1998)). GCC:4D7 зв’язується з кіназагомологічним доменом, в межах залишків 491-568 GCC (Bhandari et al. Biochemistry 40:91969206 (2001)). GCC:C8 зв’язується з білковим кіназа-подібним доменом в цитоплазматичній частині GCC. Визначення та способи [020] Якщо інше не визначено в даному документі, наукові та технічні вирази, використані у зв’язку з дійсним винаходом, мають значення, що є загально зрозумілими фахівцями в даній галузі техніки. В цілому, номенклатура, використовувана в зв’язку з клітинною та тканинною культурою, молекулярною біологією, та білковою та оліго- або полінуклеотидною хімією та гібридизацією, та пов’язані з ними техніки, описані в даному документі, є відомими в рівні техніки. Інвентарні номери GenBank або GenPept і придатні послідовності нуклеїнових кислот і пептидні послідовності можуть бути знайдені на веб-сайті, що підтримується Національним центром біотехнологічної інформації, Бетесда, Меріленд. Стандартні техніки використовуються для рекомбінантної ДНК, олігонуклеотидного синтезу, і тканинної культури і трансформації і трансфекції (наприклад, електропорація, ліпофекція). Ферментні реакції і техніки очищення проводяться відповідно до інструкцій виробника, або як загально придато в даній галузі техніки, або як описано в даному документі. Вищезгадані техніки та процедури загалом проводяться відповідно до способів, відомих в рівні техніки, наприклад, як описано в різних загальних і більш детальних оглядах, що цитуються і обговорюються скрізь в даному описі винаходу. Дивись наприклад, Sambrook et al. Molecular Cloning: A Laboratory Manual (3rd ed., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. (2000)) або дивись в цілому, Harlow, E. і Lane, D. (1988) Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY. Номенклатури, використовувані в зв’язку з і лабораторні процедури і техніки аналітичної хімії, синтетичної органічної хімії і медичної і фармацевтичної хімії, описані в даному документі, є відомими в рівні техніки. Стандартні техніки використовуються для хімічних синтезів, хімічних аналізів, фармацевтичного препарату, складу та доставки і лікування пацієнтів. Більш того, якщо інше не вимагається контекстом, вирази в формі однини повинні включати форми множини, та вирази у формі множини повинні включати форму однини. [021] Як використовують в даному документі, вираз "молекула антитіла" стосується антитіла, пептида(ів) антитіла або імуноглобуліна або антиген-зв’язувального фрагмента будь-якого з вищезгаданого, наприклад, антитіла. Молекули антитіла включають одноланцюгові молекули антитіла, наприклад, scFv, дивись. наприклад, Bird et al. (1988) Science 242:423-426; і Huston et al. (1988) Proc. Natl. Acad. Sci. USA 85:5879-5883), і однодоменні молекули антитіла, дивись, наприклад, WO9404678. Хоча не включено у вираз "молекули антитіла," дійсний винахід також включає " аналог(и) антитіла," інші білкові кістяки молекули, що не є антитілом, наприклад, злиті білки і/або імунокон’югати, що використовують CDR для забезпечення специфічного зв’язування антигену. [022] "Молекула антитіла до GCC" стосується молекули антитіла (а саме, антитіла, антигензв’язувального фрагмента антитіла або аналогу антитіла), яка взаємодіє з або розпізнає, наприклад, зв’язується (наприклад, зв’язується специфічно) з GCC, наприклад, GCC людини. Ілюстративні молекули антитіла до GCC є такими, як ті, що підсумовані в Таблицях 1 і 2. [023] Як використовують в даному документі, вираз "антитіло", " пептид(и) антитіла" або 4 UA 108991 C2 5 10 15 20 25 30 35 40 45 50 55 60 "імуноглобулін" стосується одноланцюгових, дволанцюгових і багато-ланцюгових білків і глікопептидів. Вираз антитіло включає поліклональні, моноклональні, химерні, CDR-прищеплені та антитіла людини або гуманізовані антитіла, всі з яких обговорюються більш детально в іншому місці в цьому документі. Також включені у вираз антитіла верблюда, дивись, наприклад, US2005/0037421, і нанотіла, наприклад, IgNAR (антитіла акули), дивись, наприклад, WO03/014161. Вираз "антитіло" також включає синтетичні та генетично сконструйовані варіанти. [024] Як використовують в даному документі, вираз "фрагмент антитіла" або "антигензв’язувальний фрагмент" антитіла стосується, наприклад, Fab, Fab', F(ab') 2, і Fv фрагментів, одноланцюгових антитіл, функціональних антитіл на основі важкого ланцюга (нанотіла), а також будь-якої частини антитіла, що має специфічність щонайменше до одного бажаного епітопа, що конкурує з інтактним антитілом за специфічне зв’язування (наприклад, фрагмент, що має достатні CDR-послідовності та має достатні послідовності каркасної частини так, щоб специфічно зв’язуватися з епітопом). Наприклад, антиген-зв’язувальний фрагмент може конкурувати за зв’язування з епітопом, який зв’язується з антитілом, від якого походить фрагмент. Отриманий, як використовують в цьому та подібному контекстах, не припускає будьякого конкретного способу або процесу отримання, але може стосуватися виключно подібності послідовностей. Антиген-зв’язувальні фрагменти можуть бути отримані за допомогою рекомбінантних технік або ферментного або хімічного відщеплення інтактного антитіла. Вираз, антиген-зв’язувальний фрагмент, якщо використовується з одним ланцюгом, наприклад, важким ланцюгом, антитіла, що має легкий і важкий ланцюг, означає, що фрагмент ланцюга є достатнім так, щоб коли він спарений з повною варіабельною ділянкою іншого ланцюга, наприклад, легкого ланцюга, він буде забезпечувати зв’язування щонайменше 25, 50, 75, 85 або 90% того, що спостерігається з повною важкою і легкою варіабельною ділянкою). [025] Вираз "антиген-зв’язувальна констеляція CDR" або "число CDR, достатнє, щоб забезпечити зв’язування" (і подібний вираз), як використовують в даному документі, стосується достатніх CDR ланцюга, наприклад, важкого ланцюга, так, щоб коли вони розміщені в каркасній частині та спаровані з повною варіабельною ділянкою іншого ланцюга, або з частиною варіабельної ділянки іншого ланцюга подібної довжини і такою, що має таке ж число CDR, наприклад, легкого ланцюга, буде забезпечувати зв’язування, наприклад, щонайменше 25, 50, 75, 85 або 90% того, що спостерігається з повною важкою і легкою варіабельною ділянкою. [026] Як використовують в даному документі, вираз " антитіло людини " включає антитіло, що має послідовність, яка походить з послідовності імуноглобуліну ембріонального типу людини, таке як антитіло, отримане з трансгенних мишей, що мають гени імуноглобуліну TM людини (наприклад, генетично сконструйовані миші XENOMOUSE (Abgenix, Фримонт, Каліфорнія), бібліотек фагового дисплею людини, мієломні клітини людини або B-клітини людини. [027] Як використовують в даному документі, вираз "гуманізоване антитіло" стосується антитіла, яке походить від антитіла, що не належить людині, наприклад, гризуна (наприклад, мишаче), що зберігає або по суті зберігає антиген-зв’язувальні властивості батьківського антитіла, але є менш імуногенним у людей. Передбачається, що гуманізоване, як використовують в даному документі, включає деімунізовані антитіла. Типово гуманізовані антитіла включають CDR, що не належать людині та каркасні та константні ділянки людини або що отримані від людини. [028] Вираз "модифіковане" антитіло, як використовують в даному документі, стосується антитіла, що отримано, експресовано, створено або виділено за допомогою рекомбінантного засобу, наприклад антитіла, експресовані з використанням рекомбінантного вектора експресії, трансфектованого в клітину-хазяїна, антитіла, виділені з рекомбінантної, комбінаторної бібліотеки антитіл, антитіла, виділені з тварини (наприклад, миші, вівці або цапа), що є трансгенними для генів імуноглобуліну людини, або антитіла, отримані, експресовані, створені або виділені за допомогою будь-якого іншого засобу, що включає сплайсинг послідовностей гена імуноглобуліну людини з іншими ДНК-послідовностями. Такі модифіковані антитіла включають гуманізовані, CDR-прищеплені (наприклад, антитіло, що має CDR від першого антитіла та каркасну ділянку від іншого джерела, наприклад, другого антитіла або консенсусної каркасної частини), химерні, in vitro утворені (наприклад, за допомогою фагового дисплея) антитіла, і можуть необов’язково включати варіабельні або константні ділянки, що отримані з послідовностей імуноглобуліну ембріонального типу людини або генів імуноглобуліну людини або антитіла, що були отримані, експресовані, створені або виділені за допомогою будь-якого засобу, що включає сплайсинг послідовностей гена імуноглобуліну людини з альтернативними імуноглобуліновими послідовностями. В варіантах здійснення модифікована молекула антитіла включає молекулу антитіла, що має зміну послідовності від еталонного антитіла. 5 UA 108991 C2 5 10 15 20 25 30 35 40 45 50 55 60 [029] Вираз "моноспецифічне антитіло" стосується антитіла або препарату антитіла, що виявляє одиничну специфічність зв’язування та афінність до конкретного епітопа. Цей вираз включає "моноклональне антитіло" або "композицію моноклональних антитіл". [030] Вираз "біспецифічне антитіло" або "біфункціональне антитіло" стосується антитіла, що виявляє двоїсту специфічність зв’язування для двох епітопів, де кожний сайт зв’язування відрізняє і розпізнає різний епітоп. [031] Вирази "некон’юговане антитіло" та "голе антитіло" використовується взаємозамінно для позначення молекули антитіла, що є не кон’югованою з частиною, що не є антитілом, наприклад, терапевтичним засобом або міткою. [032] Вирази "імунокон’югат", " кон’югат антитіла", "кон’югат антитіла з лікарським засобом" і "ADC" використовуються взаємозамінно та означають антитіло, що кон’юговано з частиною, що не є антитілом, наприклад, терапевтичним засобом або міткою. [033] Вираз "засіб" використовується в даному документі для позначення хімічної сполуки, суміші хімічних сполук, біологічної макромолекули або екстракту, виготовленого з біологічних матеріалів. Вираз "терапевтичний засіб" стосується засобу, що має біологічну активність. [034] Вираз "протираковий засіб" або "хіміотерапевтичний засіб" використовується в даному документі для позначення засобів, що мають функціональну властивість інгібувати розвиток або прогресію новоутворення у людини, особливо злоякісного (ракового) ураження, такого як карцинома, саркома, лімфома або лейкемія. Інгібування метастазу або ангіогенезу є часто властивістю протиракових або хіміотерапевтичних засобів. Хіміотерапевтичний засіб може бути цитотоксичним або цитостатичним засобом. Вираз "цитостатичний засіб" стосується засобу, який інгібує або придушує клітинний ріст і/або розмноження клітин. [035] "Цитотоксичні засоби" стосуються сполук, які викликають клітинну смерть в першу чергу шляхом впливу безпосередньо на клітинне функціонування, включаючи, але не обмежуючись, алкілюючі засоби, інгібітори фактору некрозу пухлин, інтеркалятори, інгібітори мікротрубочок, інгібітори кінази, інгібітори протеасоми та інгібітори топоізомерази. "Токсичний вантаж", як використовують в даному документі, стосується достатньої кількості цитотоксичного засобу, який, при доставці до клітини, призводить до клітинної смерті. Доставка токсичного вантажу може бути здійснена шляхом введення достатньої кількості імунокон’югату, що включає антитіло або антиген-зв’язувальний фрагмент дійсного винаходу і цитотоксичний засіб. Доставка токсичного вантажу може також бути здійснена шляхом введення достатньої кількості імунокон’югату, що включає цитотоксичний засіб, де імунокон’югат містить вторинне антитіло або його антиген-зв’язувальний фрагмент, який розпізнає та зв’язується з антитілом або антиген-зв’язувальним фрагментом дійсного винаходу. [036] Як використовують в даному документі фраза послідовність, "отримана з" або "специфічна до зазначеної послідовності" стосується послідовності, що містить безперервну послідовність приблизно щонайменше 6 нуклеотидів або щонайменше 2 амінокислоти, щонайменше приблизно 9 нуклеотидів або щонайменше 3 амінокислоти, щонайменше приблизно 10-12 нуклеотидів або 4 амінокислоти, або щонайменше приблизно 15-21 нуклеотидів або 5-7 амінокислот, що відповідає, а саме, ідентична або комплементарна, наприклад, безперервній ділянці зазначеної послідовності. В певних варіантах здійснення послідовність містить всю з зазначеної нуклеотидної або амінокислотної послідовності. Послідовність може бути комплементарною (у випадку полінуклеотидної послідовності) або ідентичною до ділянки послідовності, що є унікальною для конкретної послідовності, що визначається за допомогою технік, відомих в рівні техніки. Ділянки, з яких можуть бути отримані послідовності, включають, але не обмежуючись, наступні: ділянки, що кодують специфічні епітопи, ділянки, що кодують CDR, ділянки, що кодують послідовності каркасної частини, ділянки, що кодують ділянки константного домену, ділянки, що кодують ділянки варіабельного домену, а також ділянки, що не транслюються і/або не транскрибуються. Отримана послідовність не обов’язково буде фізично отриманою з послідовності інтересу дослідження, але може бути утворена в будь-який спосіб, включаючи, але не обмежуючись, наступне: хімічний синтез, реплікація, зворотна транскрипція або транскрипція, що базується на інформації, забезпеченій послідовністю основ в ділянці(ках), з яких отримано полінуклеотид. Фактично, вона може представляти або сенсову, або антисенсову орієнтацію вихідного полінуклеотиду. Крім того, комбінації ділянок, що відповідають таким зазначеної послідовності, можуть бути модифіковані або комбіновані способами, відомими в рівні техніки, щоб бути відповідними до передбаченого застосування. Наприклад, послідовність може містити дві або більше безперервні послідовності, кожна з яких містить частину зазначеної послідовності, і переривається ділянкою, яка не є ідентичною зазначеній послідовності, але передбачається, щоб представляти послідовність, що отримана із зазначеної послідовності. Стосовно молекул 6 UA 108991 C2 5 10 15 20 25 30 35 40 45 50 55 60 антитіла, "отримана з нього" включає молекулу антитіла, яка є функціонально або структурно пов’язана із антитілом для порівняння, наприклад, "отримана з нього" включає молекулу антитіла, що має подібну або по суті таку ж послідовність або структуру, наприклад, що має однакові або подібні CDR, каркасну частину або варіабельні ділянки. "Отриманий з нього" для антитіла також включає залишки, наприклад, один або декілька, наприклад, 2, 3, 4, 5, 6 або більше залишків, які можуть бути або можуть не бути суміжними, але визначені або ідентифіковані відповідно до схеми нумерації або гомології до загальної структури антитіла або тривимірної близькості, а саме, всередині CDR або каркасної ділянки, послідовності порівняння. Вираз "отриманий з нього" не обмежується фізично отриманим з нього, але включає утворення в будь-який спосіб, наприклад, шляхом використання інформації про послідовність з антитіла для порівняння для розробки іншого антитіла. [037] Як використовують в даному документі, фраза "кодований за допомогою" стосується послідовність нуклеїнової кислоти, що кодує поліпептидну послідовність, де поліпептидна послідовність або її частина містить амінокислотну послідовність з щонайменше 3 - 5 амінокислот, щонайменше 8 - 10 амінокислот, або щонайменше 15 - 20 амінокислот з поліпептиду, кодованого за допомогою послідовності нуклеїнової кислоти. [038] Розрахунки "гомології" між двома послідовностями можуть бути проведені наступним чином. Послідовності вирівнюють для цілей оптимального порівняння (наприклад, гепи можуть бути введені в одну або обидві з першої і другої послідовності амінокислоти або нуклеїнової кислоти для оптимального вирівнювання, і негомологічні послідовності можуть бути не враховані для цілей порівняння). Довжина еталонної послідовності, вирівняної для цілей порівняння, становить щонайменше 30%, 40%, або 50%, щонайменше 60%, або щонайменше 70%, 80%, 90%, 95%, 100% від довжини еталонної послідовності. Амінокислотні залишки або нуклеотиди на відповідних положеннях амінокислот або нуклеотидних положеннях потім порівнюють. Якщо положення в першій послідовності зайнято таким самим амінокислотним залишком або нуклеотидом, що і відповідне положення в другій послідовності, то молекули є ідентичними в цьому положенні (викристовувана в даному документі амінокислотна "ідентичність" або "ідентичність" нуклеїнової кислоти є еквівалентною до аміноксилотної "гомології" або "гомології" нуклеїнової кислоти). Відсоток ідентичності між двома послідовностями являє собою функцію числа ідентичних положень, розділених послідовностями, беручи до уваги число гепів і довжину кожного гепу, який необхідно було ввести для оптимального вирівнювання двох послідовностей. [039] Порівняння послідовностей і визначення відсотку гомології між двома послідовностями може бути здійснене, використовуючи математичний алгоритм. Відсоток гомології між двома амінокислотними послідовностями може бути визначений, використовуючи будь-який спосіб, відомий в рівні техніки. Наприклад, Needleman and Wunsch, J. Mol. Biol. 48:444-453 (1970), алгоритм, який був включений в GAP програму в GCG пакеті програмного забезпечення, використовуючи або Blossum 62 матрицю, або PAM250 матрицю, і вагу гепу 16, 14, 12, 10, 8, 6 або 4 і вагу довжини 1, 2, 3, 4, 5, або 6. Відсоток гомології між двома нуклеотидними послідовностями може також бути визначений, використовуючи GAP програму в GCG пакеті програмного забезпечення (Accelerys, Inc. Сан-Дієго, Каліфорнія), використовуючи матрицю NWSgapdna.CMP і вагу гепу 40, 50, 60, 70, або 80 і вагу довжини 1, 2, 3, 4, 5 або 6. Ілюстративний набір параметрів для визначення гомології являє собою матриця оцінювання Blossum 62 зі штрафом за геп 12, штрафом за подовження гепу 4 і штрафом за зсув рамки зчитування гепу 5. [040] Як використовують в даному документі, вираз "гібридизується при жорстких умовах" описує умови для гібридизації і відмивки. Посібник для проведення реакції гібридизації можна знайти в Current Protocols in Molecular Biology, John Wiley & Sons, N.Y. (1989), 6,3,1-6,3,6. Водні та неводні способи описані в цьому посиланні і може бути використаний будь-який. Специфічні умови гібридизації, про які йшлася мова в даному документі, є наступними: 1) умови гібридизації низької жорсткості в 6X хлориду натрію/цитрату натрію (SSC) при приблизно 45C, з наступними двома відмиваннями в 0,2X SSC, 0,1% SDS щонайменше при 50C (температуру відмивань можна підвищити до 55C для умов низької жорсткості); 2) умови гібридизації помірної жорсткості в 6X SSC при приблизно 45C, з наступним одним або більше відмиваннями в 0,2X SSC, 0,1% SDS при 60C; 3) умови гібридизації високої жорсткості в 6X SSC при приблизно 45C, з наступним одним або більше відмиваннями в 0,2X SSC, 0,1% SDS при 65C; і 4) умови гібридизації дуже високої жорсткості є наступними 0,5 M фосфату натрію, 7% SDS при 65C, з наступним одним або більше відмиваннями при 0,2X SSC, 1% SDS при 65C. Дуже жорсткі умови (4) часто є переважними умовами і такими, що повинні застосовуватися, якщо не зазначено інше. 7 UA 108991 C2 5 10 15 20 25 30 35 40 45 50 55 60 [041] Зрозуміло, що антитіла і їх антиген-зв’язувальний фрагмент дійсного винаходу можуть мати додаткові консервативні або несуттєві амінокислотні заміни, які не мають суттєвого ефекту на поліпептидні функції. Буде чи ні конкретна заміна припустимою, а саме, не буде несприятливо впливати на бажані біологічні властивості, такі як активність зв’язування, можна визначити, як описано в Bowie, JU et al. Science 247:1306-1310 (1990) або Padlan et al. FASEB J. 9:133-139 (1995). "Консервативна амінокислотна заміна" є такою заміною, в якій амінокислотний залишок заміщений на амінокислотний залишок, що має подібний боковий ланцюг. Родини амінокислотних залишків, що мають подібні бокові ланцюги, були визначені в рівні техніки. Ці родини включають амінокислоти з основними боковими ланцюгами (наприклад, лізин, аргінін, гістидин), кислотними боковими ланцюгами (наприклад, аспарагінова кислота, глютамінова кислота), незарядженими полярними боковими ланцюгами (наприклад, аспарагін, глютамін, серин, треонін, тирозин, цистеїн), неполярними боковими ланцюгами (наприклад, гліцин, аланін, валін, лейцин, ізолейцин, пролін, фенілаланін, метіонін, триптофан), бета-розгалуженими боковими ланцюгами (наприклад, треонін, валін, ізолейцин) і ароматичними боковими ланцюгами (наприклад, тирозин, фенілаланін, триптофан, гістидин). [042] "Несуттєвий" амінокислотний залишок являє собою залишок, що може бути змінений від послідовності дикого типу засобу зв’язування, наприклад, антитіла, без скасування або, без суттєвої зміни біологічної активності, тоді як "суттєвий" амінокислотний залишок призводить до такої зміни. В антитілі суттєвий амінокислотний залишок може бути залишком, що визначає специфічність (SDR). [043] Як використовують в даному документі, вираз "виділений" стосується матеріалу, видаленого з його вихідного оточення (наприклад, природного оточення, якщо він є таким, що існує в природі). Наприклад, існуючий в природі полінуклеотид або поліпептид, присутній в живій тварині, є не виділеним, але такий самий полінуклеотид, або ДНК, або поліпептид, відділений від деяких або усіх сумісно існуючих матеріалів в природній системі, є виділеним. Такий полінуклеотид може бути частиною вектора і/або такий полінуклеотид або поліпептид може бути частиною композиції, наприклад, суміші, розчину або суспензії, або таким, що містить виділену клітину або культивовану клітину, яка містить полінуклеотид або поліпептид, і також є виділеним в тому відношенні, що вектор або композиція не є частиною його природного оточення. [044] Як використовують в даному документі, вираз "реплікон" стосується будь-якого генетичного елементу, такого як плазміда, хромосома або вірус, що поводиться як автономна одиниця полінуклеотидної реплікації в клітині. [045] Як використовують в даному документі, вираз "функціонально зв’язаний" стосується ситуації, де описані компоненти знаходяться у взаємовідносинах, що дозволяють їм функціонувати в їх передбачений спосіб. Таким чином, наприклад, контрольна послідовність, "функціонально зв’язана" з кодуючою послідовністю, лігована таким чином, що експресія кодуючої послідовність досягається за умов, що сумісна з контрольною послідовністю. [046] Як використовують в даному документі, вираз "вектор" стосується реплікону, до якого прикріплений інший полінуклеотидний сегмент так, щоб привести до реплікації та/або експресії прикріпленого сегмента. [047] Як використовують в даному документі, вираз "контрольна послідовність" стосується полінуклеотидної послідовності, що є необхідною, щоб здійснити експресію кодуючої послідовності, до якої вона лігована. Природа таких контрольних послідовностей відрізняється в залежності від організму-хазяїна. У прокаріот такі контрольні послідовності, як правило, включають промотор, сайт зв’язування рибосоми та термінатори та, в деяких випадках, енхансери. Вираз "контрольна послідовність", таким чином, як передбачається, включає, як мінімум, всі компоненти, присутність яких є необхідною для експресії, а також може включати додаткові компоненти, присутність яких є переважною, наприклад, лідерні послідовності. [048] Як використовують в даному документі, вираз "очищений продукт" стосується отримання продукту, який був виділений від клітинних компонентів, з якими продукт в нормі асоційований і/ або від інших типів клітин, що можуть бути присутніми у зразку інтересу. [049] Як використовують в даному документі, вираз "епітоп" стосується білкової детермінанти, здатної до специфічного зв’язування з антитілом. Епітопні детермінанти звичайно складаються з хімічно активних поверхневих угруповань молекул, таких як амінокислоти або бокові ланцюги цукру, і звичайно мають специфічні тривимірні структурні характеристики, а також специфічні характеристики заряду. Деякі епітопи є лінійними епітопами, тоді як інші є конформаційними епітопами. Лінійний епітоп являє собою епітоп, де суміжна амінокислотна первинна послідовність містить розпізнаний епітоп. Лінійний епітоп типово включає щонайменше 3, і більш звичайно, щонайменше 5, наприклад, приблизно 8 до приблизно 10 8 UA 108991 C2 5 10 15 20 25 30 35 40 45 50 55 60 суміжних амінокислот. Конформаційний епітоп може бути результатом щонайменше двох ситуацій, таких як: a) лінійна послідовність, яка підлягає зв’язуванню з антитілом тільки в певних білкових конформаціях, наприклад, в залежності від зв’язування ліганду, або в залежності від модифікації (наприклад, фосфорилювання) за допомогою сигнальних молекул; або b) комбінація структурних ознак від більш ніж однієї частини білка, або в мультисубодиничних білках, від більш ніж однієї субодиниці, де ознаки є в достатньо щільній близькості в 3вимірному просторі для того, щоб брати участь в зв’язуванні. [050] Як використовують в даному документі, "ізотип" стосується класу антитіла (наприклад, IgM або IgGl), який кодується за допомогою генів константної ділянки важкого ланцюга. [051] Як використовують в даному документі, вирази "засіб, що можна виявити", "мітка" або "мічений" використовуються так, що стосуються введення маркера, що можна виявити, на поліпептид або глікопептид. Різні способи мічення поліпептидів і глікопептидів є відомими в рівні техніки та можуть бути застосовувані. Приклади міток для поліпептидів включають, але не 111 131 обмежуючись, наступні: радіоізотопи або радіонуклеїди (наприклад, індій ( In), йод ( I або 125 90 177 225 212 213 35 14 I), ітрій ( Y), лютецій ( Lu), актиній ( Ac), вісмут ( Bi або Bi), сірка ( S), вуглець ( C), 3 188 99 32 тритій ( H), родій ( Rh), технецій ( mTc), празеодимій, або фосфор ( P), або радіонуклеїд, що 11 40 13 15 випускає позитрони, наприклад, вуглець-11 ( C), калій-40 ( K), азот-13 ( N), кисень-15 ( O), 18 121 фтор-18 ( F) і йод-121 ( I)), флюоресцентні мітки (наприклад, FITC, родамін, люмінофори на основі лантанидів), ферментні мітки (наприклад, пероксидаза хріну, бета-галактозидаза, люцифераза, лужна фосфатаза), хемілюмінесцентні, бітинільні групи (які можуть бути визначені за допомогою маркованого авідину, наприклад, молекули, що містить функціональну групу стрептавідину і флюоресцентного маркера або ферментної активності, що може бути виявлена за допомогою оптичних або калориметричних способів), і попередньо визначені поліпептидні епітопи, розпізнані за допомогою вторинного репортера (наприклад, парні послідовності лейцинової "блискавки", сайти зв’язування для вторинних антитіл, домени зв’язування металу, епітопні мітки). В деяких варіантах здійснення мітки прикріплюються за допомогою фрагментів спейсера різних довжин для зменшення потенційної стеричної перешкоди. [052] Як використовують в даному документі, "специфічне зв’язування," "зв’язуються(ється) специфічно" або " специфічність зв’язування " означає, для молекули антитіла до GCC, що молекула антитіла зв’язується з GCC, наприклад, GCC-білком людини, з більшою афінністю, ніж вона зв’язується з не-GCC-білком, наприклад, BSA. Типово молекула до GCC буде мати K d для не-GCC-білка, наприклад, BSA, яка є більше ніж у 2, більше ніж у 10, більше ніж у 100, більше 4 5 6 ніж у 1000 разів, більше ніж у 10 , більше ніж у 10 , або більше ніж у 10 разів, ніж його Kd для GCC, наприклад, GCC-білка людини. При визначенні Kd, Kd для GCC і не-GCC-білка, наприклад, BSA, повинно бути проведено при однакових умовах. [053] Як використовують в даному документі, вираз "лікувати" або "лікування" визначається як введення молекули антитіла до GCC суб’єкту, наприклад, пацієнту, або введення, наприклад, шляхом застосування, до виділеної тканини або клітини від суб’єкта, яку повертають суб’єкту. Молекула антитіла до GCC може бути введена окремо або в комбінації з іншим засобом. Лікування може бути для того, щоб вилікувати, загоїти, полегшити, зменшити, змінити, виправити, підвищити якість, пом’якшити, покращити або вплити на порушення, симптоми порушення або схильність до порушення, наприклад, раку. Без бажання бути зв’язаним теорією, лікування, як вважають, викликає інгібування, деструкцію або знищення клітини in vitro або in vivo, або іншим чином зменшення здатності клітини, наприклад, аберантної клітини, опосередкувати порушення, наприклад, порушення, як описано в даному документі (наприклад, рак). [054] Як використовують в даному документі, передбачається, що вираз "суб’єкт" включає ссавців, приматів, людей та інших тварин. Наприклад, суб’єкт може бути пацієнтом (наприклад, людиною пацієнтом або ветеринарним пацієнтом), що має рак, наприклад, шлунково-кишкового походження (наприклад, рак товстої кишки), симптом раку, наприклад, шлунково-кишкового походження (наприклад, рак товстої кишки), при якому принаймні деякі клітини експресують GCC, або схильність до раку, наприклад, шлунково-кишкового походження (наприклад, рак товстої кишки), при якій принаймні деякі клітини експресують GCC. Вираз "інші тварини" винаходу включає всіх хребетних, окрім людей, наприклад, ссавців, окрім людей, і не ссавців, таких як примати, окрім людей, вівця, собака, корова, курчата, амфібії, рептилії і т.і., якщо не зазначено інше. У варіанті здійснення суб’єкт виключає один, або декілька, або всіх з миші, щура, кролика або цапа. [055] Як використовують в даному документі, кількість молекули антитіла до GCC "ефективна" або "достатня" для лікування порушення, або "терапевтично ефективна кількість" або "терапевтично достатня кількість" стосується кількості молекули антитіла, яка є ефективною 9 UA 108991 C2 5 10 15 20 25 30 35 40 45 50 55 60 при однодозовому або багатодозовому введенні суб’єкту при лікуванні клітини, наприклад, ракової клітини (наприклад, GCC-експресуюючої пухлинної клітини), або при продовженні лікування, полегшення, зменшення або покращення суб’єкта з порушенням, як описано в даному документі, окрім того, що очікується за відсутності такого лікування. Як використовують в даному документі, "інгібування росту" пухлини або раку стосується уповільнення, обривання, затримки або зупинки його росту та/або метастазів і необов’язково вказує на повне усунення росту пухлини. [056] Як використовують в даному документі, "GCC," також відомий як білок "STAR", "GUC2C", "GUCY2C" або "ST-рецептор" стосується GCC ссавця, переважно GCC-білка людини. GCC людини стосується білка, показаного в SEQ ID NO:228, і його існуючих в природі алельних білкових варіантів. Алель в SEQ ID NO: 228 може кодуватися за допомогою послідовності нуклеїнової кислоти GCC, показаної в SEQ ID NO:227. Інші варіанти є відомими в рівні техніки. Дивись, наприклад, інвентарний номер Ensp0000261170, Ensembl Database, Європейський інститут біоінформатики (European Bioinformatics Institute) та інституту Сенгера (Wellcome Trust Sanger Institute), який має лейцин на залишку 281; SEQ ID NO: 14 опублікованої заявки на патент США № US 20060035852; або інвентарний номер GenBank AAB19934. Типово, існуючий в природі алельний варіант має амінокислотну послідовність щонайменше на 95%, 97% або 99% ідентичну до GCC-послідовності SEQ ID NO:228. Транскрипт кодує білковий продукт з 1073 амінокислот, і описаний в GenBank, інвентарний номер: NM_004963. GCC-білок характеризується як трансмембранний рецепторний білок клітинної поверхні та, як вважається, відіграє ключову роль в підтримці кишкового соку, електролітного гомеостазу та клітинної проліферації. [057] Якщо не зазначено інше, вираз "алкіл" стосується насиченого нерозгалуженого або розгалуженого вуглеводню, що має від приблизно 1 до приблизно 20 атомів вуглецю (і всі комбінації і підкомбінації діапазонів і певні кількості атомів вуглецю в них), причому від приблизно 1 до приблизно 8 атомів вуглецю є переважними. Приклади алкільних груп є наступними: метил, етил, n-пропіл, ізо-пропіл, n-бутил, ізо-бутил, втор-бутил, трет-бутил, nпентил, 2-пентил, 3-пентил, 2-метил-2-бутил, n-гексил, n-гептил, n-октил, n-ноніл, n-децил, 3метил-2-бутил, 3-метил-1-бутил, 2-метил-1-бутил, 1-гексил, 2-гексил, 3-гексил, 2-метил-2пентил, 3-метил-2-пентил, 4-метил-2-пентил, 3-метил-3-пентил, 2-метил-3-пентил, 2,3-диметил2-бутил і 3,3-диметил-2-бутил. [058] Алкільні групи, або окремо, або як частина іншої групи, можуть бути названі "заміщеними". Заміщена алкільна група являє собою алкільну групу, що є заміщеною однією або декількома групами, переважно 1 - 3 групами (і будь-якими додатковими замісниками, вибраними з галогену), включаючи, але не обмежуючись, наступне: -галоген, -O-(C1-C8 алкіл), O-(C2-C8 алкеніл), -O-(C2-C8 алкініл), -арил, -C(O)R’, -OC(O)R’, -C(O)OR’, -C(O)NH2, -C(O)NHR’, C(O)N(R’)2, -NHC(O)R’, -SR’, -SO3R’, -S(O)2R’, -S(O)R’, -OH, =O, -N3, -NH2, -NH(R’), -N(R’)2 і -CN, де кожний R’ являє собою незалежно вибраний з наступного: -H, -C1-C8 алкіл, -C2-C8 алкеніл, C2-C8 алкініл або -арил, і де зазначені групи -O-(C1-C8 алкіл), -O-(C2-C8 алкеніл), -O-(C2-C8 алкініл), -арил, -C1-C8 алкіл, -C2-C8 алкеніл і -C2-C8 алкініл можуть бути необов’язково додатково заміщені однією або декількома групами, включаючи, але не обмежуючись, наступне: -C1-C8 алкіл, -C2-C8 алкеніл, -C2-C8 алкініл, -галоген, -O-(C1-C8 алкіл), -O-(C2-C8 алкеніл), -O-(C2-C8 алкініл), -арил, -C(O)R’’, -OC(O)R’’, -C(O)OR’’, -C(O)NH2, -C(O)NHR’’, -C(O)N(R’’)2, -NHC(O)R’’, SR’’, -SO3R’’, -S(O)2R’’, -S(O)R’’, -OH, -N3, -NH2, -NH(R’’), -N(R’’)2 і -CN, де кожний R’’ являє собою незалежно вибраний з наступного: -H, -C1-C8 алкіл, -C2-C8 алкеніл, -C2-C8 алкініл або -арил. [059] Якщо не зазначено інше, вирази "алкеніл" і "алкініл" стосуються нерозгалужених і розгалужених вуглецевих ланцюгів, що мають від приблизно 2 до приблизно 20 атомів вуглецю (і всі комбінації і підкомбінації діапазонів і певні кількості атомів вуглецю в них), причому від приблизно 2 до приблизно 8 атомів вуглецю є переважними. Алкенільний ланцюг має щонайменше один подвійний зв’язок в ланцюга і алкінільний ланцюг має щонайменше один потрійній зв’язок в ланцюга. Приклади алкенільних груп включають, але не обмежуючись, наступне: етилен або вініл, аліл, -1-бутеніл, -2-бутеніл, -ізобутиленіл, -1-пентеніл, -2-пентеніл, 3-метил-1-бутеніл, -2-метил-2-бутеніл і -2,3-диметил-2-бутеніл. Приклади алкінільних груп включають, але не обмежуючись, наступне: ацетіленова, пропаргіл, ацетіленіл, пропініл, 1-бутиніл, -2-бутиніл, -1-пентиніл, -2-пентиніл і -3-метил-1 бутиніл. [060] Як і з алкільними групами, алкенільні і алкінільні групи, можуть бути заміщеними. "Заміщена" алкенільна або алкінільна група є такою, що заміщена однією або декількома групами, переважно 1 - 3 групами (і будь-які додаткові замісники, вибрані з галогену), включаючи, але не обмежуючись, наступне: -галоген, -O-(C1-C8 алкіл), -O-(C2-C8 алкеніл), -O(C2-C8 алкініл), -арил, -C(O)R’, -OC(O)R’, -C(O)OR’, -C(O)NH2, -C(O)NHR’, -C(O)N(R’)2, -NHC(O)R’, 10 UA 108991 C2 5 10 15 20 25 30 35 40 45 50 55 60 -SR’, -SO3R’, -S(O)2R’, -S(O)R’, -OH, =O, -N3, -NH2, -NH(R'), -N(R’)2 і -CN, де кожний R’ являє собою незалежно вибраний з наступного: -H, -C1-C8 алкіл, -C2-C8 алкеніл, -C2-C8 алкініл, або арил, і де зазначені групи -O-(C1-C8 алкіл), -O-(C2-C8 алкеніл), -O-(C2-C8 алкініл), -арил, -C1-C8 алкіл, -C2-C8 алкеніл, і -C2-C8 алкініл можуть бути необов’язково додатково заміщені одним або декількома замісниками, включаючи, але не обмежуючись, наступне: -C1-C8 алкіл, -C2-C8 алкеніл, -C2-C8 алкініл, -галоген, -O-(C1-C8 алкіл), -O-(C2-C8 алкеніл), -O-(C2C8 алкініл), -арил, C(O)R’’, -OC(O)R’’, -C(O)OR’’, -C(O)NH2, -C(O)NHR’’, -C(O)N(R’’)2, -NHC(O)R’’, -SR’’, -SO3R’’, S(O)2R’’, -S(O)R’’, -OH, -N3, -NH2, -NH(R’’), -N(R’’)2 і -CN, де кожний R’’ являє собою незалежно вибраний з наступного: -H, -C1-C8 алкіл, -C2-C8 алкеніл, -C2-C8 алкініл або -арил. [061] Якщо не зазначено інше, вираз "алкілен" стосується вуглеводневого радикалу з насиченим розгалуженим або нерозгалуженим ланцюгом, що має від приблизно 1 до приблизно 20 атомів вуглецю (і всі комбінації та підкомбінації діапазонів і певні кількості атомів вуглецю в них), причому від приблизно 1 до приблизно 8 атомів вуглецю є переважними, і таким, що має два одновалентні радикальні центри, які отримані шляхом видалення двох атомів водню від однакових або двох різних атомів вуглецю батьківського алкану. Типові алкілени включають, але не обмежуючись, наступне: метилен, етилен, пропілен, бутилен, пентилен, гексилен, гептилен, октилен, нонілен, декален, 1,4-циклогексилен і подібне. Алкіленові групи, або окремо, або як частина іншої групи, можуть бути необов’язково заміщені однією або декількома групами, переважно 1 - 3 групами (і будь-якими додатковими замісниками, вибраними з галогену), включаючи, але не обмежуючись, наступне: -галоген, -O-(C1-C8 алкіл), -O-(C2-C8 алкеніл), -O(C2-C8 алкініл), -арил, -C(O)R’, -OC(O)R’, -C(O)OR’, -C(O)NH2, -C(O)NHR’, -C(O)N(R’)2, NHC(O)R’, -SR’, -SO3R’, -S(O)2R’, -S(O)R’, -OH, =O, -N3, -NH2, -NH(R’), -N(R’)2 і -CN, де кожний R’ являє собою незалежно вибраний з наступного: -H, -C1-C8 алкіл, -C2-C8 алкеніл, -C2-C8 алкініл або -арил, і де зазначені групи -O-(C1-C8 алкіл), -O-(C2-C8 алкеніл), -O-(C2-C8 алкініл), -арил, -C1C8 алкіл, -C2-C8 алкеніл і -C2-C8 алкініл можуть бути додатково необов’язково заміщені одним або декількома замісниками, включаючи, але не обмежуючись, наступне: -C1-C8 алкіл, -C2-C8 алкеніл, -C2-C8 алкініл, -галоген, -O-(C1-C8 алкіл), -O-(C2-C8 алкеніл), -O-(C2-C8 алкініл), -арил, C(O)R’’, -OC(O)R’’, -C(O)OR’’, -C(O)NH2, -C(O)NHR’’, -C(O)N(R’’)2, -NHC(O)R’’, -SR’’, -SO3R’’, S(O)2R’’, -S(O)R’’, -OH, -N3, -NH2, -NH(R’’), -N(R’’)2 і -CN, де кожний R’’ являє собою незалежно вибраний з наступного: -H, -C1-C8 алкіл, -C2-C8 алкеніл, -C2-C8 алкініл або -арил. [062] Якщо не зазначено інше, вираз "алкенілен" стосується необов’язково заміщеної алкіленової групи, що містить щонайменше один подвійний зв’язок вуглець-вуглець. Ілюстративні алкеніленові групи включають, наприклад, етенілен (-CH=CH-) і пропенілен (CH=CHCH2-). [063] Якщо не зазначено інше, вираз "алкінілен" стосується необов’язково заміщеної алкіленової групи, що містить щонайменше один потрійний зв’зок вуглець-вуглець. Ілюстративні алкініленові групи включають, наприклад, ацетилен (-CC-), пропаргіл (-CH2CC-) і 4-пентиніл (-CH2CH2CH2CCH-). [064] Якщо не зазначено інше, вираз "арил" стосується одновалентного ароматичного вуглеводневого радикалу з 6-20 атомів вуглецю (і всі комбінації і підкомбінації діапазонів і певні кількості атомів вуглецю в них), що отримано за допомогою видалення одного атому водню від одного атому вуглецю батьківської ароматичної кільцевої системи. Деякі арильні групи представлені в ілюстративних структурах як "Ar". Типові арильні групи включають, але не обмежуючись наступним, радикали що отримані з наступного: бензол, заміщений бензол, феніл, нафталін, антрацен, біфеніл і подібне. [065] Арильна група, або окремо, або як частина іншої групи, може бути необов’язково заміщеною однією або декількома, переважно 1 - 5 або, навіть, 1 - 2 групами, включаючи, але не обмежуючись, наступне: -галоген, -C1-C8 алкіл, -C2-C8 алкеніл, -C2-C8 алкініл, -O-(C1-C8 алкіл), -O-(C2-C8 алкеніл), -O-(C2-C8 алкініл), -арил, -C(O)R’, -OC(O)R’, -C(O)OR’, -C(O)NH2, -C(O)NHR’, C(O)N(R’)2, -NHC(O)R’, -SR’, -SO3R’, -S(O)2R’, -S(O)R’, -OH, -NO2, -N3, -NH2, -NH(R’), -N(R’)2 і -CN, де кожний R’ являє собою незалежно вибраний з наступного: -H, -C1-C8 алкіл, -C2-C8 алкеніл, C2-C8 алкініл або –арил, і де зазначені групи -C1-C8 алкіл, -C2-C8 алкеніл, -C2-C8 алкініл, O-(C1-C8 алкіл), -O-(C2-C8 алкеніл), -O-(C2-C8 алкініл) і –арил можуть бути додатково необов’язково заміщені одним або декількома замісниками, включаючи, але не обмежуючись, наступне: -C1-C8 алкіл, -C2-C8 алкеніл, -C2-C8 алкініл, -галоген, -O-(C1-C8 алкіл), -O-(C2-C8 алкеніл), -O-(C2-C8 алкініл), -арил, -C(O)R’’, -OC(O)R’’, -C(O)OR’’, -C(O)NH2, -C(O)NHR’’, -C(O)N(R’’)2, -NHC(O)R’’, SR’’, -SO3R’’, -S(O)2R’’, -S(O)R’’, -OH, -N3, -NH2, -NH(R’’), -N(R’’)2 і -CN, де кожний R’’ являє собою незалежно вибраний з наступного: -H, -C1-C8 алкіл, -C2-C8 алкеніл, -C2-C8 алкініл або -арил. [066] Якщо не зазначено інше, вираз "арилен" стосується необов’язково заміщеної арильної групи, яка є двовалентною (а саме, отримана шляхом видалення двох атомів водню від 11 UA 108991 C2 однакових або двох різних атомів вуглецю батьківської ароматичної кільцевої системи) і може бути в орто, мета або пара конфігураціях, як показано в наступних структурах з фенілом в якості ілюстративної арильної групи: , 5 10 15 20 25 30 35 40 45 50 55 , , Типові групи "-(C1-C8 алкілен)арил", "-(C2-C8 алкенілен)арил" і " -(C2-C8 алкінілен)арил" включають, але не обмежуючись, наступне: бензил, 2-фенілетан-1-іл, 2-фенілетен-1-іл, нафтилметил, 2-нафтилетан-1-іл, 2-нафтилетен-1-іл, нафтобензил, 2-нафтофенілетан-1-іл і подібне. [067] Якщо не зазначено інше, вираз "гетероцикл" стосується моноциклічної, біциклічної або поліциклічної кільцевої системи, що має від 3 до 14 кільцевих атомів (що також мають назву кільцеві члени), де щонайменше один кільцевий атом в щонайменше одному кільці являє собою гетероатом, вибраний з N, O, P або S (і всі комбінації і підкомбінації діапазонів і певні кількості атомів вуглецю і гетероатомів в них). Гетероцикл може мати від 1 до 4 гетерокільцевих атомів, незалежно вибраних з N, O, P або S. Один або декілька атомів N, C або S в гетероциклі може бути окислені. Моноциклічний гетероцикл переважно має 3 - 7 кільцевих членів (наприклад, 2 - 6 атомів вуглецю та 1 - 3 гетероатомів, незалежно вибраних з N, O, P або S), а біциклічний гетероцикл переважно має 5 - 10 кільцевих членів (наприклад, 4 - 9 атомів вуглецю і 1 - 3 гетероатомів, незалежно вибраних з N, O, P або S). Кільце, що включає гетероатом, може бути ароматичним або неароматичним. Якщо не зазначено інше, гетероцикл прикріплюється до його бокової групи на будь-якому гетероатомі або атомі вуглецю, що дає в результаті стабільну структуру. [068] Гетероцикли описані в Paquette, "Principles of Modern Heterocyclic Chemistry" (W.A. Benjamin, New York, 1968), особливо розділах 1, 3, 4, 6, 7 і 9; " The Chemistry of Heterocyclic Compounds, A series of Monographs" (John Wiley & Sons, New York, 1950 до тепер), зокрема тома 13, 14, 16, 19 і 28; і J. Am. Chem. Soc. 82:5566 (1960). [069] Якщо не зазначено інше, вираз "гетероцикло" стосується необов’язково заміщеної гетероциклічної групи, як визначено вище, що є двовалентною (а саме, отриманою шляхом видалення двох атомів водню від однакових або двох різних атомів вуглецю батьківської гетероциклічної кільцевої системи). [070] Приклади "гетероциклічних" груп включають, для прикладу, а не для обмеження, наступне: піридил, дигідропіридил, тетрагідропіридил (піперидил), тіазоліл, піримідиніл, фураніл, тієніл, піроліл, піразоліл, імідазоліл, тетразоліл, бензофураніл, тіанафталініл, індоліл, індоленіл, хінолініл, ізохінолініл, бензімідазоліл, піперидиніл, 4-піперидоніл, піролідиніл, 2піролідоніл, піролініл, тетрагідрофураніл, біс-тетрагідрофураніл, тетрагідропіраніл, бістетрагідропіраніл, тетрагідрохінолініл, тетрагідроізохінолініл, декагідрохінолініл, октагідроізохінолініл, азоциніл, триазиніл, 6H-1,2,5-тіадіазиніл, 2H,6H-1,5,2-дитіазиніл, тієніл, тіантреніл, піраніл, ізобензофураніл, хроменіл, ксантеніл, феноксатиніл, 2H-піроліл, ізотіазоліл, ізоксазоліл, піразиніл, піридазиніл, індолізиніл, ізоіндоліл, 3H-індоліл, 1H-індазоліл, пуриніл, 4Hхінолізиніл, фталазиніл, нафтиридиніл, хіноксалініл, хіназолініл, цинолініл, птеридиніл, 4Hкарбазоліл, карбазоліл, β-карболініл, фенантридиніл, акридиніл, піримідиніл, фенантролініл, феназиніл, фенотіазиніл, фуразаніл, феноксазиніл, ізохроманіл, хроманіл, імідазолідиніл, імідазолініл, піразолідиніл, піразолініл, піперазиніл, індолiніл, ізоіндолiніл, хінуклідиніл, морфолініл, оксазолiдиніл, бензотриазоліл, бензизоксазоліл, оксиндоліл, бензоксазолініл і ізатиноїл. Переважні "гетероциклічні" групи включають, але не обмежуючись, наступне: бензофураніл, бензотіофеніл, індоліл, бензопіразоліл, кумариніл, ізохінолініл, піроліл, тіофеніл, фураніл, тіазоліл, імідазоліл, піразоліл, триазоліл, хінолініл, піримідиніл, піридиніл, піридоніл, піразиніл, піридазиніл, ізотіазоліл, ізоксазоліл і тетразоліл. [071] Гетероциклічна група, або окремо, або як частина іншої групи, може бути необов’язково заміщена однією або декількома групами, переважно 1 - 2 групами, включаючи, але не обмежуючись, наступне: -C1-C8 алкіл, -C2-C8 алкеніл, -C2-C8 алкініл, -галоген, -O-(C1-C8 алкіл), -O-(C2-C8 алкеніл), -O-(C2-C8 алкініл), -арил, -C(O)R’, -OC(O)R’, -C(O)OR’, -C(O)NH2, C(O)NHR’, -C(O)N(R’)2, -NHC(O)R’, -SR’, -SO3R’, -S(O)2R’, -S(O)R’, -OH, -N3, -NH2, -NH(R’), -N(R’)2 і -CN, де кожний R’ являє собою незалежно вибраний з наступного: -H, -C1-C8 алкіл, -C2-C8 алкеніл, -C2-C8 алкініл або -арил, і де зазначені групи -O-(C1-C8 алкіл), -O-(C2-C8 алкеніл), -O-(C2C8 алкініл), -C1-C8 алкіл, -C2-C8 алкеніл, -C2-C8 алкініл і –арил можуть бути додатково необов’язково заміщені одним або декількома замісниками, включаючи, але не обмежуючись, 12 UA 108991 C2 5 10 15 20 25 30 35 40 45 50 55 60 наступне: -C1-C8 алкіл, -C2-C8 алкеніл, -C2-C8 алкініл, -галоген, -O-(C1-C8 алкіл), -O-(C2-C8 алкеніл), -O-(C2-C8 алкініл), -арил, -C(O)R’’, -OC(O)R’’, -C(O)OR’’, -C(O)NH2, -C(O)NHR’’, -C(O)N(R’’)2, -NHC(O)R’’, -SR’’, -SO3R’’, -S(O)2R’’, -S(O)R’’, -OH, -N3, -NH2, -NH(R’’), -N(R’’)2 і -CN, де кожний R’’ являє собою незалежно вибраний з наступного: -H, -C1-C8 алкіл, -C2-C8 алкеніл, C2-C8 алкініл або арил. [072] Для прикладу, а не для обмеження, зв’язані з вуглецем гетероцикли можуть бути зв’язані на наступних положеннях: положення 2, 3, 4, 5 або 6 піридину; положення 3, 4, 5 або 6 піридазину; положення 2, 4, 5 або 6 піримідину; положення 2, 3, 5 або 6 піразину; положення 2, 3, 4 або 5 фурану, тетрагідрофурану, тіофурану, тіофену, піролу або тетрагідропіролу; положення 2, 4 або 5 оксазолу, імідазолу або тіазолу; положення 3, 4 або 5 ізоксазолу, піразолу або ізотіазолу; положення 2 або 3 азиридину; положення 2, 3 або 4 азетидину; положення 2, 3, 4, 5, 6, 7 або 8 хіноліну; або положення 1, 3, 4, 5, 6, 7 або 8 ізохіноліну. Ще більш типово, зв’язані з вуглецем гетероцикли включають 2-піридил, 3-піридил, 4-піридил, 5-піридил, 6піридил, 3-піридазиніл, 4-піридазиніл, 5-піридазиніл, 6-піридазиніл, 2-піримідиніл, 4-піримідиніл, 5-піримідиніл, 6-піримідиніл, 2-піразиніл, 3-піразиніл, 5-піразиніл, 6-піразиніл, 2-тіазоліл, 4тіазоліл або 5-тіазоліл. [073] Для прикладу, а не для обмеження, зв’язані з азотом гетероцикли можуть бути зв’язані на положенні 1 азиридину, азетидину, піролу, піролідину, 2-піроліну, 3-піроліну, імідазолу, імідазолідину, 2-імідазоліну, 3-імідазоліну, піразолу, піразоліну, 2-піразоліну, 3-піразоліну, піперидину, піперазину, індолу, індоліну або 1H-індазолу; положенні 2 ізоіндолу або ізоіндоліну; положенні 4 морфоліну; і положенні 9 карбазолу або β-карболіну. Ще більш типово, зв’язані з азотом гетероцикли включають 1-азиридил, 1-азетедил, 1-піроліл, 1-імідазоліл, 1-піразоліл і 1піперидиніл. [074] Якщо не зазначено інше, вираз "карбоцикл" стосується насиченої або ненасиченої неароматичної моноциклічної, біциклічної або поліциклічної кільцевої системи, що має від 3 до 14 кільцевих атомів (і всі комбінації і підкомбінації діапазонів і певні кількості атомів вуглецю в них), де всі кільцеві атоми є атомами вуглецю. Моноциклічні карбоцикли переважно мають 3 - 6 кільцевих атомів, ще більш переважно 5 або 6 кільцевих атомів. Біциклічні карбоцикли переважно мають 7 - 12 кільцевих атомів, наприклад, розташованих як біцикло [4,5], [5,5], [5,6] або [6,6] система, або 9 або 10 кільцевих атомів, розташованих як біцикло [5,6] або [6,6] система. Вираз "карбоцикл" включає, наприклад, моноциклічне карбоциклічне кільце, злите з арильним кільцем (наприклад, моноциклічне карбоциклічне кільце, злите з бензольним кільцем). Карбоцикли переважно мають 3 - 8 кільцевих атомів вуглецю. [075] Карбоциклічні групи, або окремо, або як частина іншої групи, може бути необов’язково заміщені, наприклад, однією або декількома групами, переважно 1 або 2 групами (і будь-якими додатковими замісниками, вибраними з галогену), включаючи, але не обмежуючись, наступне: галоген, -C1-C8 алкіл, -C2-C8 алкеніл, -C2-C8 алкініл, -O-(C1-C8 алкіл), -O-(C2-C8 алкеніл), -O-(C2-C8 алкініл), -арил, -C(O)R’, -OC(O)R’, -C(O)OR’, -C(O)NH2, -C(O)NHR’, -C(O)N(R’)2, -NHC(O)R’, -SR’, SO3R’, -S(O)2R’, -S(O)R’, -OH, =O, -N3, -NH2, -NH(R’), -N(R’)2 і -CN, де кожний R’ являє собою незалежно вибраний з наступного: -H, -C1-C8 алкіл, -C2-C8 алкеніл, -C2-C8 алкініл або -арил, і де зазначені групи -C1-C8 алкіл, -C2-C8 алкеніл, -C2-C8 алкініл, -O-(C1-C8 алкіл), -O-(C2-C8 алкеніл), O-(C2-C8 алкініл) і –арил можуть бути додатково необов’язково заміщені одним або декількома замісниками, включаючи, але не обмежуючись, наступне: -C1-C8 алкіл, -C2-C8 алкеніл, -C2-C8 алкініл, -галоген, -O-(C1-C8 алкіл), -O-(C2-C8 алкеніл), -O-(C2-C8 алкініл), -арил, -C(O)R’’, OC(O)R’’, -C(O)OR’’, -C(O)NH2, -C(O)NHR’’, -C(O)N(R’’)2, -NHC(O)R’’, -SR’’, -SO3R’’, -S(O)2R’’, S(O)R’’, -OH, -N3, -NH2, -NH(R’’), -N(R’’)2 і -CN, де кожний R’’ являє собою незалежно вибраний з наступного: -H, -C1-C8 алкіл, -C2-C8 алкеніл, -C2-C8 алкініл або -арил. [076] Приклади моноциклічних карбоциклічних замісників включають -циклопропіл, -циклобутил, -циклопентил, -1-циклопент-1-еніл, -1-циклопент-2-еніл, -1-циклопент-3-еніл, циклогексил, -1-циклогекс-1-еніл, -1-циклогекс-2-еніл, -1-циклогекс-3-еніл, -циклогептил, -циклооктил. -1,3-циклогексaдієніл, -1,4-циклогексaдієніл, -1,3-циклогептадієніл, -1,3,5циклогептатриєніл і –циклооктадієніл. [077] "Карбоцикло", використовуваний або окремо, або як частина іншої групи, стосується необов’язково заміщеної карбоциклічної групи, як визначено вище, що є двовалентною (а саме, що отримана шляхом видалення двох атомів водню від однакових або двох різних атомів вуглецю батьківської карбоциклічної кільцевої системи). [078] Якщо інше не зазначено контекстом, дефіс (-) означає точку прикріплення до бокової молекули. Відповідно, вираз "-(C1-C8 алкілен)арил" або "-C1-C8 алкілен(арил)" стосується C1-C8 алкіленового радикалу, як визначено в даному документі, де алкіленовий радикал прикріплений до бокової молекули на будь-якому з атомів вуглецю алкіленового радикалу, та один з атомів 13 UA 108991 C2 5 10 15 20 25 30 35 40 45 50 55 60 водню, зв’язаний з атомом вуглецю алкіленового радикалу, заміщений на арильний радикал, як визначено в даному документі. [079] Коли конкретна група є "заміщеною", то ця група може мати один або декілька замісників, переважно від одного до п’яти замісників, більш переважно від одного до трьох замісників, найбільш переважно від одного до двох замісників, незалежно вибраних зі списку замісників. Група може, проте, як правило, мати будь-яку кількість замісників, вибраних з галогену. Групи, що заміщені, позначають таким чином. [080] Передбачається, що визначення будь-якого замісника або змінної в конкретному положенні в молекулі є незалежним від його визначення будь-де в іншому місці в цій молекулі. Зрозуміло, що замісники та патерни заміщення на сполуки цього винаходу можуть бути вибрані фахівцем в даній галузі техніки для забезпечення сполук, що є хімічно стабільними і що можуть бути легко синтезовані за допомогою технік, відомих в рівні техніки, а також ці способи викладені в даному документі. [081] Захисні групи, як використовують в даному документі, стосуються груп, які вибірково блокують, або тимчасово, або перманентно, один реакційно-здатний сайт в поліфункціональній сполуці. Придатні гідроксі-захисні групи для використання в дійсному винаході є фармацевтично придатними та можуть вимагати або не вимагати бути відщепленими від батьківської сполуки після введення суб’єкту для того, щоб сполука стала активною. Відщеплення вважається нормальним метаболічним процесом в організмі. Гідроксі-захисні групи є добре відомими в рівні техніки, дивись, PROTECTIVE GROUPS IN ORGANIC SYNTHESIS T. W. Greene і P. G. M. Wuts d (John Wiley & sons, 3 edition), включену в даний документ посиланням в її повноті та для всіх цілей, і включають, наприклад, простий ефір (наприклад, алкілові прості ефіри та силілові прості ефіри, включаючи, наприклад, діалкілсилілефір, триалкілсилілефір, діалкілалкоксисилілефір), складний ефір, карбонат, карбамати, сульфатні та фосфатні захисні групи. Приклади гідроксізахисних груп включають, але не обмежуючись, наступне: метиловий ефір; метоксиметиловий ефір, метилтіометиловий ефір, (фенілдиметилсиліл)метоксиметиловий ефір, бензилоксиметиловий ефір, p-метоксибензилоксиметиловий ефір, p-нітробензилоксиметиловий ефір, o-нітробензилоксиметиловий ефір, (4-метоксифеноксі)метиловий ефір, метоксифенолметиловий ефір, t-бутоксиметиловий ефір, 4-пентенілоксиметиловий ефір, силоксиметиловий ефір, 2-метоксіетоксиметиловий ефір, 2,2,2-трихлоретоксиметиловий ефір, біс(2-хлоретокси)метиловий ефір, 2-(триметилсиліл)етоксиметиловий ефір, ментоксиметиловий ефір, тетрагідропіраніловий ефір, 1-метоксициклогексиловий ефір, 4метокситетрагідротіопіраніловий ефір, 4-метокситетрагідротіопіраніловий ефір S,S-діоксид, 1[(2-хлор-4-метил)феніл]-4-метоксипіперидин-4-іловий ефір, 1-(2-фторфеніл)-4метоксипіперидин-4-іловий ефір, 1,4-діоксан-2-іловий ефір, тетрагідрофураніловий ефір, тетрагідротіофураніловий ефір; заміщені етилові ефіри, такі як 1-етоксіетиловий ефір, 1-(2хлоретоксі)етиловий ефір, 1-[2-(триметилсиліл)етоксі]етиловий ефір, 1-метил-1метоксіетиловий ефір, 1-метил-1-бензилоксіетиловий ефір, 1-метил-1-бензилоксі-2фторетиловий ефір, 1-метил-1-феноксіетиловий ефір, 2-триметилсиліловий ефір, t-бутиловий ефір, аліловий ефір, пропаргілові ефіри, p-хлорфеніловий ефір, p-метоксифеніловий ефір, бензиловий ефір, p-метоксибензиловий ефір 3,4-диметоксибензиловий ефір, триметилсиліловий ефір, триетилсиліловий ефір, трипропілсилілефір, диметилізопропілсиліловий ефір, діетилізопропілсиліловий ефір, диметилгексилсиліловий ефір, t-бутилдиметилсиліловий ефір, дифенілметилсиліловий ефір, складний ефір бензоїлформату, складний ефір ацетату, складний ефір хлорацетату, складний ефір дихлорацетату, складний ефір трихлорацетату, складний ефір трифторацетату, складний ефір метоксіацетату, складний ефір трифенілметоксіацетату, складний ефір фенілацетату, складний ефір бензоату, алкілметилкарбонат, алкіл 9-фторенілметилкарбонат, алкілетилкарбонат, алкіл 2,2,2,трихлоретилкарбонат, 1,1,-диметил-2,2,2-трихлоретилкарбонат, алкілсульфат, метансульфат, бензилсульфат, тозилат, метиленацеталь, етиліденацеталь і t-бутилметиліденкеталь. Переважні захисні групи представлені формулами -R, -Si(R)(R)(R), -C(O)R, -C(O)OR, C(O)NH(R), -S(O)2R, -S(O)2OH, P(O)(OH)2 і -P(O)(OH)OR, де R являє собою C1-C20 алкіл, C2-C20 алкеніл, C2-C20 алкініл, -C1-C20 алкілен(карбоцикл), -C2-C20 алкенілен(карбоцикл), -C2-C20 алкінілен(карбоцикл), -C6-C10 арил, -C1-C20 алкілен(арил), -C2-C20 алкенілен(арил), -C2-C20 алкінілен(арил), -C1-C20 алкілен(гетероцикл), -C2-C20 алкенілен(гетероцикл) або -C2-C20 алкінілен(гетероцикл), де зазначені радикали алкіл, алкеніл, алкініл, алкілен, алкенілен, алкінілен, арил, карбоцикл і гетероцикл, або окремо, або як частина іншої групи, є необов’язково заміщеними. [082] Скорочення "AFP" стосується диметилвалін-валін-долаізолейцин- долапроїнфенілаланін-p-фенілендіаміну (дивись Формулу (XVIII) нижче). 14 UA 108991 C2 5 10 15 20 25 30 35 40 45 50 55 60 [083] Скорочення "MMAE" стосується монометилметил ауристатину E (дивись Формулу (XIII) нижче). [084] Скорочення "AEB" стосується складного ефіру, отриманого шляхом реакції ауристатину E з параацетилбензойною кислотою (дивись Формулу (XXII) нижче). [085] Скорочення "AEVB" стосується складного ефіру, отриманого шляхом реакції ауристатину E з бензоїлвалеріановою кислотою (дивись Формулу (XXIII) нижче). [086] Скорочення "MMAF" стосується монометилауристатину F (дивись Формулу (XXI) нижче). Антитіла [087] В певних аспектах винахід стосується молекул антитіла до GCC з ознаками, такими як ті, що підсумовані в Таблицях 1 і 2. В інших аспектах дійсний винахід стосується молекул антитіла до GCC з ознаками, такими як ті, що підсумовані в Таблицях 3, 4, 5 і/або 6. [088] У варіанті здійснення молекула антитіла до GCC являє собою гібридомне антитіло людини та є одним з антитіла 5F9, 5H3, 6H8, 8C2, 10C10, 10D3 і 1D3. У варіанті здійснення молекула антитіла до GCC походить від антитіла 5F9, 5H3, 6H8, 8C2, 10C10, 10D3 або 1D3. У варіанті здійснення молекулу антитіла до GCC отримують за допомогою гібридомного 5F9 (PTA8132). [089] У варіанті здійснення молекула антитіла до GCC являє собою вибране лімфоцитне антитіло та є одним з антитіла Abx-12, Abx-020, Abx-106, Abx-198, Abx-221, Abx-229, Abx-338 і Abx-393. У варіанті здійснення молекула антитіла до GCC походить від антитіла Abx-12, Abx020, Abx-106, Abx-198, Abx-221, Abx-229, Abx-338 і Abx-393. [090] У варіанті здійснення молекула антитіла до GCC являє собою мишаче антитіло та є одним з антитіла mAb 3G1, mAb 8E12, mAb10B8 і mAb 8F1. У варіанті здійснення молекула антитіла до GCC походить від антитіла mAb 3G1, mAb 8E12, і mAb 8F1. [091] У варіанті здійснення молекула антитіла до GCC буде мати афінність для GCC, наприклад, яку вимірюють за допомогою аналізів прямого зв’язування або конкурентного зв’язування, в діапазоні, описаному в даному документі. У варіанті здійснення молекула -6 -7 -8 -9 антитіла до GCC має Kd менше 1x10 M, менше 1x10 M, менше 1x10 M, менше 1x10 M, -10 -11 -12 -13 менше 1x10 M, менше 1x10 M, менше 1x10 M або менше 1x10 M. У варіанті здійснення молекула антитіла являє собою IgG або його антиген-зв’язувальний фрагмент і має Kd менше -6 -7 -8 -9 1x10 M, менше 1x10 M, менше 1x10 M або менше 1x10 M. У варіанті здійснення молекула антитіла до GCC, наприклад, 5F9 антитіло або антитіло, що походить від нього, має Kd від приблизно 80 до приблизно 200 пМ, переважно від приблизно 100 до приблизно 150 пМ або приблизно 120 пМ. У варіанті здійснення молекула антитіла до GCC, наприклад, 5F9 антитіло 5 -1 -1 або антитіло, що походить від нього, має ka від приблизно 0,9 до приблизно 1,25 x10 M с , 5 -1 -1 переважно приблизно 1,1 x10 M с . У варіанті здійснення молекула антитіла являє собою ScFv -6 -7 -8 -9 -10 і має Kd менше 1x10 M, менше 1x10 M, менше 1x10 M, менше 1x10 M, менше 1x10 M, -11 -12 -13 менше 1x10 M, менше 1x10 M або менше 1x10 M. [092] В варіантах здійснення молекули антитіла не є імунокон’югатами, а саме, є "голими" і в варіантах здійснення викликають клітинну реакцію при зв’язуванні з GCC. В пов’язаних варіантах здійснення клітинна реакція виконується клітиною, що експресує GCC, з якою зв’язується антитіло. Така клітинна реакція може бути передачею сигналу, опосередкованою GCC, наприклад, якщо молекула антитіла являє собою агоніст GCC (дивись, наприклад, публікацію заявки на патент США № US20040258687). В інших варіантах здійснення клітинна реакція виконується іншою клітиною, наприклад, імунною ефекторною клітиною (наприклад, клітиною натуральним кілером), яка розпізнає молекулу антитіла, зв’язану з GCC на першій клітині. В деяких варіантах здійснення молекули нагляду, наприклад, молекули комплементу, контактують з GCC-зв’язаною молекулою антитіла перед клітинною реакцією. Клітинні реакції в цих варіантах здійснення можуть викликати загибель клітини, що експресує GCC. [093] В додаткових варіантах здійснення молекули антитіла, які є імунокон’югатами, можуть як викликати клітинну реакцію при зв’язуванні з GCC, так і інтерналізуватися для доставки засобу до клітини, що експресує GCC, з якою вона зв’язується. [094] В деяких варіантах здійснення молекула антитіла до GCC дійсного винаходу може блокувати зв’язування ліганда з GCC. [095] У варіанті здійснення молекула антитіла до GCC не демонструє суттєвої перехресної реакції з одним або обома GCC щура і мишачим GCC. [096] У варіанті здійснення молекула антитіла не є GCC:B10, GCC:4D7 або GCC:C8. В іншому варіанті здійснення молекула антитіла до GCC не зв’язується з внутрішньоклітинним доменом GCC, приблизно 455 - 1073 амінокислотний залишок SEQ ID NO:228. Наприклад, в цьому варіанті здійснення молекула антитіла до GCC не зв’язується з кіназа-гомологічним 15 UA 108991 C2 5 10 15 20 25 30 35 40 45 50 55 60 доменом або гуанілілциклазним доменом GCC. [097] Структурну одиницю існуючих в природі антитіл ссавця типовано тетрамером. Кожний тетрамер складається із двох пар поліпептидних ланцюгів, де кожна пара має один "легкий" (близько 25 кДа) і один "важкий" ланцюг (близько 50-70 кДа). Аміно-кінцева частина кожного ланцюга включає варіабельну ділянку з приблизно 100 - 110 або більше амінокислот, яка в першу чергу відповідає за розпізнавання антигену. Карбоксі-кінцева частина кожного ланцюга визначає константну ділянку, що в першу чергу відповідає за ефекторну функцію. Легкі ланцюги людини можуть бути класифіковані як каппа та лямбда легкі ланцюги. Важкі ланцюги можуть бути класифіковані як мю, дельта, гамма, альфа або епсилон, і визначають ізотип антитіла як IgM, IgD, IgG, IgA і IgE, відповідно. Всередині легкого і важкого ланцюгів, варіабельні та константні ділянки об’єднуються за допомогою "J" ділянки з приблизно 12 або більше амінокислот, причому важкий ланцюг також включає "D" ділянку з приблизно 10 або більше амінокислот. Дивись в цілому, Fundamental Immunology Ch. 7 (Paul, W., ed., 2nd ed. Raven Press, N.Y. (1989)). Варіабельні ділянки кожної пари легкого/важкого ланцюгів формують сайт зв’язування антитіла. Переважні ізотипи для молекул антитіла до GCC являють собою IgG імуноглобуліни, які можуть бути класифіковані в чотири підкласи IgG1, IgG2, IgG3 і IgG4, що мають різні гамма важкі ланцюги. Більшість терапевтичних антитіл є антитілами людини, химерними або гуманізованими антитілами IgG1 типу. В конкретному варіанті здійснення молекула антитіла до GCC має IgG1 ізотип. [098] Варіабельні ділянки кожної пари важкого і легкого ланцюгів формують сайт зв’язування антигену. Таким чином, інтактне IgG антитіло має два сайти зв’язування, які є однаковими. Проте, біфункціональні або біспецифічні антитіла є штучними гібридними конструктами, які мають дві різні пари важкого/легкого ланцюгів, що дає в результаті два різні сайти зв’язування. [099] Всі ланцюги виявляють однакову загальну структуру відносно консервативних каркасних ділянок (FR), об’єднаних трьома гіперваріабельними ділянками, що також мають назву гіперваріабельні ділянки або CDR. CDR від двох ланцюгів кожної пари вирівнюються каркасними ділянками, забезпечуючи зв’язування зі специфічним епітопом. Від N-кінця до Cкінця, як легкий, так і важкий ланцюги містять домени FR1, CDR1, FR2, CDR2, FR3, CDR3 і FR4. Розподіл амінокислот до кожного домену знаходиться у відповідності до визначень Kabat Sequences of Proteins of Immunological Interest (Національний інститут охорони здоров’я (National Institutes of Health), Бетесда, Меріленд. (1987 і 1991)), або Chothia & Lesk J. Mol. Biol. 196:901-917 (1987); Chothia et al. Nature 342:878-883 (1989). Як використовують в даному документі, CDR називають для кожного з важкого (HCDR1, HCDR2, HCDR3) і легкого (LCDR1, LCDR2, LCDR3) ланцюгів. [0100] Молекула антитіла до GCC може містити всі або антиген-зв’язувальну субпопуляцію CDR одного або обох важкого та легкого ланцюга, одного з вищеназваних: гібридоми людини, селективних лімфоцитних або мишачих антитіл. Амінокислотні послідовності частини гібридоми людини, селективного лімфоцитного та мишачого антитіла, включаючи варіабельні ділянки і CDR, можна знайти в Таблиці 3 і Таблиці 5. [0101] Таким чином, в варіанті здійснення молекула антитіла включає один або обидва з наступного: (a) один, два, три, або антиген-зв’язувальне число, CDR легкого ланцюга (LCDR1, LCDR2 і/або LCDR3) одного з вищеназваних: гібридоми людини, селективних лімфоцитних або мишачих антитіл. В варіантах здійснення CDR може(можуть) включати амінокислотну послідовність однієї або декількох або всіх LCDR1-3 наступним чином: LCDR1, або модифікована LCDR1, де одна-сім амінокислот є консервативно заміщеними) LCDR2, або модифікована LCDR2, де одна або дві амінокислоти є консервативно заміщеними); або LCDR3, або модифікована LCDR3, де одна або дві амінокислоти є консервативно заміщеними; та (b) один, два, три, або антиген-зв’язувальне число, CDR важкого ланцюга (HCDR1, HCDR2 і/або HCDR3) одного з вищеназваних: гібридоми людини, селективних лімфоцитних або мишачих антитіл. В варіантах здійснення CDR може(можуть) містити амінокислотну послідовність однієї або декількох або всіх HCDR1-3 наступним чином: HCDR1, або модифікована HCDR1, де одна або дві амінокислоти є консервативно заміщеними; HCDR2, або модифікована HCDR2, де одна-чотири амінокислоти є консервативно заміщеними; або HCDR3, або модифікована HCDR3, де одна або дві амінокислоти є консервативно заміщеними. [0102] Придатні імуногени для продукції антитіл до GCC включають GCC, наприклад, клітини людини, що експресують GCC, (наприклад, лінія пухлинних клітин, наприклад, T84 клітини, або свіжі або заморожені пухлинні клітини товстої кишки, рекомбінантні клітини, що експресують GCC); мембранні фракції клітин, що експресують GCC (наприклад, лінія пухлинних клітин товстої кишки, наприклад, T84 клітини, або свіжі або заморожені пухлинні клітини товстої кишки, 16 UA 108991 C2 5 10 15 20 25 30 35 40 45 50 55 60 рекомбінантні клітини, що експресують GCC, наприклад, HT-29-GCC#2 клітини, які експресують GCC повної довжини, або її частину, наприклад, CHO GCC #27 клітини, які експресують частину, що містить позаклітинний домен GCC, наприклад, SEQ ID NO:318); виділена або очищена GCC, наприклад, GCC-білок людини (наприклад, біохімічно виділена GCC, наприклад, виділена з клітин шлунково-кишкової пухлини або рекомбінантних клітин, що експресують GCC або її варіант), або її частина (наприклад, позаклітинний домен GCC, кіназа-гомологічний домен GCC або гуанілілциклазний каталітичний домен GCC або пептид, що відповідає її частині, наприклад, що містить щонайменше приблизно 8, 10, 12, 14, 16, 20, 24, 28 або 32 амінокислотних залишків SEQ ID NO:228); або імуноген, що містить SEQ ID NO:229, або що містить його зрілу частину без сигнальної послідовності (а саме, без амінокислотних залишків від 1 до приблизно 21 або 23 SEQ ID NO:229), наприклад, зрілий білок TOK107-hIgG, SEQ ID NO:317. [0103] Імуногени можуть бути злиті з гетерологічними послідовностями для полегшення біохімічної маніпуляції, очищення, імунізації або вимірювання титру антитіл. Такі імуногени можуть містити частину GCC, наприклад, позаклітинний домен, і частину, що містить не-GCC поліпептид. Існує багато додаткових можливостей для конструювання білка злиття для полегшення очищення або іммобілізації на твердому субстраті, наприклад, афінній колонці або мікротитрувальному планшеті або іншому придатному субстраті /чипі для аналізу. Наприклад, частина злиття може додавати домен, наприклад, глутатіон-S-трансфераза/кіназа (GST), який може зв’язувати глутатіон; Fc ділянку імуноглобуліну, яка може зв’язуватися з білком A або білком G; амінокислотні залишки, наприклад, два, три, чотири, п’ять, переважно шість залишків гістидину, які можуть зв’язувати нікель або кобальт на афінній колонці; епітопну мітку, наприклад, частину c-myc онкогену (myc-мітка), FLAG мітку (патент США № 4703004), мітку гемаглютиніну (HA), T7 гена 10 мітку, V5 мітку, HSV мітку або VSV-G мітку, яка може зв’язувати специфічне до мітки антитіло; або кофактор, наприклад, біотин, який може зв’язувати стрептавідин. [0104] Імуногени, які містять Fc частину імуноглобуліну, можуть нести GCC, або в розчині, або прикріплену до клітини, в конфігурації, яка забезпечує структурний доступ до епітопів GCC за допомогою компонентів імунного нагляду хазяїна для ефективного утворення антитіла. Оскільки важкі ланцюги імуноглобуліну, що містять Fc ділянки, асоційовані в димери через міжланцюгові дисульфідні зв’язки, то імуногени, отримані від злиття з Fc ділянками, є димерами. Валентність білків злиття може відображати тип імуноглобуліну, що дає Fc ділянку. Наприклад, злиття з IgG білками можуть бути димерами, IgA-злиття можуть утворювати тетрамерні імуногени та IgM-злиття можуть утворювати декамерні імуногени, останні два полегшуються кo-трансфекцією J-ланцюга. Ілюстративний імуноглобулін для Fc білка злиття являє собою IgG1. Використана частина типово має IgG1 шарнір, CH2 і CH3 домени, кодовані за допомогою одного екзону. Оскільки цей екзон також має частину CH1 ділянки, яка має цистеїн, орієнтований на дисульфідний зв’язок з цистеїном від легкого ланцюга, то придатна модифікація являє собою мутацію CH1 цистеїну, наприклад, на серин, для забезпечення того, щоб не було неспарованого цистеїну в білка злиття. Така мутація також підвищує гнучкість шарніра. [0105] Fc частина, отримана від виду, що не є хазяїном, наприклад Fc ділянка, Ig людини, для злиття з імуногеном для імунізації у виді-хазяїні, наприклад, миші, щурі, кролику, цапі, діє як ад’ювант. Ця функція ад’юванта може запускати специфічні антитіла проти як Fc, так і GCC епітопів. Fc-реактивні антитіла можуть бути визначені та відбраковані в ході скринінгу. Fc частина може мати послідовність дикого типу або послідовність, яка мутована для модифікації ефекторної функції. Наприклад, мутована константна ділянка (варіант) може бути включена в білок злиття для мінімізації зв’язування з Fc рецепторами та/або здатності фіксувати комплемент. (дивись, наприклад, Winter et al., GB 2,209,757 B; Morrison et al., WO 89/07142; Morgan et al., WO 94/29351). В переважному прикладі лізин 235 і гліцин 237, пронумеровані відповідно до стандартів Fc ділянки, є мутованими, наприклад, на аланін. Імуноген/білок злиття з Fc-мутованим IgG може мати зменшену взаємодію з Fc рецепторами у хазяїна. Переважний розчинний імуногенний білок злиття (після дозрівання з відщепленням сигнального пептиду та секреції) являє собою TOK-107-hIgG (альтернативна назва hGCC-ECD/hIgG1 Fc), який складається з амінокислотних залишків 24 - 430 SEQ ID NO:228, злитий з мутованою Fc імуноглобуліну IgG1 людини (SEQ ID NO:317). [0106] Для отримання експресованого в клітині імуногену, імуноглобулінова частина може бути структурована для того, щоб імітувати імуноглобулінову частину B-клітинного рецептора. Наприклад, імуноглобулінова Fc ділянка може бути додатково злита з поліпептидом, що містить трансмембранну ділянку від імунного рецептора, такого як Fc рецептори, Fc рецептори, Fc/µ 17 UA 108991 C2 5 10 15 20 25 30 35 40 45 50 55 60 рецептор або Fcε рецептори. Правильна орієнтація такого Fc рецепторного клітинно-зв’язаного імуногену з адекватним представленням на клітинній поверхні може бути покращена, якщо клітина, що експресує імуногенний білок злиття, до того ж містить додаткові компоненти антигенного рецепторного комплексу, наприклад, B клітинний IgM-рецептор або IgD-рецептор. Придатні компоненти комплексу включають імуноглобулінові (Ig) оболонкові білки, такі як MB-1 і B29 (CD79A і CD79B; Hombach et al. Eur. J. Immunol. 20:2795-2799 (1990) для IgM-рецептора), які формують гетеродимер. Ig оболонкові білки можуть бути забезпечені ендогенно за допомогою трансфектованої клітини, наприклад, при трансфекції B-клітинної лімфомної клітинної лінії; або за допомогою ко-трансфекції імуногену з оболонковими білками, наприклад, в окремому векторі або в одному векторі. Переважними IgG оболонковими білками для імунізації у миші є мишачі CD79a і CD79b (інвентарні номери GenBank №№ NM_007655 і NM_008339, відповідно). Переважний клітинно-зв’язаний імуногенний білок злиття (після дозрівання з відщепленням сигнального пептиду та транслокації на клітинну поверхню) являє собою TOK111 продукт, що складається з TOK-107hIgG (hGCC-ECD/hIgG1 Fc), злитого з трансмембранним і внутрішньоклітинним доменами мишачого IgG2a (наприклад, інвентарний номер GenPept AAB59661) (SEQ ID NO:318). [0107] Придатні епітопи, наприклад, еталонні епітопи, від GCC-молекули, з якими молекули антитіла до GCC, наприклад, моноклональні антитіла, антитіла людини або гуманізовані антитіла, як описано в даному документі, можуть зв’язуватися, можна знайти на позаклітинній частині GCC. Такі епітопи GCC можуть зв’язувати молекули антитіла на поверхні клітин, наприклад, на зовнішній частині клітини. [0108] Наприклад, епітоп для молекули антитіла до GCC може знаходитися в межах або включати залишок(залишки) від залишків 1-50 SEQ ID NO:228, або її фрагмент, що зв’язується з молекулою антитіла до GCC дійсного винаходу, наприклад, її 5F9-зв’язуючий фрагмент. Такі фрагменти можуть містити залишки 1-25, 5-30, 10-35, 15-40, 20-45, 25-50, 5-45, 10-40, 15-35, 2030 або 33-50 SEQ ID NO:228. В деяких варіантах здійснення епітоп для молекули антитіла до GCC, наприклад, 5F9-антитіла, являє собою конформаційний епітоп, що додатково містить один або декілька додаткових амінокислотних залишків в амінокислотній послідовності GCC, крім залишку 50, а саме, вибраних з приблизно залишку 50 - 1073 SEQ ID NO:228. [0109] В іншому прикладі епітоп для молекули антитіла до GCC може знаходитися в межах або включати залишок(залишки) від SEQ ID NO:225, або залишки 271-300 SEQ ID NO:228, або їх фрагмент, що зв’язується з молекулою антитіла до GCC дійсного винаходу, наприклад, їх ABX-198-, 3G1-, 8F1- або 10B8-зв’язуючий фрагмент. Такі фрагменти можуть містити залишки 281-290 SEQ ID NO:228, або залишки 281-290 SEQ ID NO:228, де залишок 281 є лейцином, або залишки 281-300, або залишки 271-290 SEQ ID NO:228. В деяких варіантах здійснення епітоп для молекули антитіла до GCC, наприклад, ABX-198-, 3G1-, 8F1- або 10B8-антитіла, являє собою конформаційний епітоп, що додатково містить один або декілька додаткових амінокислотних залишків, а саме, не-SEQ ID NO:225 залишків в амінокислотній послідовності GCC, наприклад, вибраних з приблизно 1 - 270 залишку та/або приблизно 301 - 1073 SEQ ID NO:228. [0110] В іншому прикладі епітоп для молекули антитіла до GCC може знаходитися в межах або включати залишок(залишки) від SEQ ID NO:226, або залишки 351-375 SEQ ID NO:228, або її фагмент, що зв’язується з молекулою антитіла до GCC дійсного винаходу, наприклад, її ABX012-, ABX-338- або ABX-106-зв’язуючий фрагмент. Такі фрагменти можуть містити 356-370 SEQ ID NO:228, або залишки 351-370 SEQ ID NO:228, або залишки 356-375 SEQ ID NO:228. В деяких варіантах здійснення епітоп для молекули антитіла до GCC, наприклад, ABX-012-, ABX-338- або ABX-106 антитіла, являє собою конформаційний епітоп, що додатково містить один або декілька додаткових амінокислотних залишків, а саме, не-SEQ ID NO:226 залишків в амінокислотній послідовності GCC, наприклад, вибраних з приблизно 1 - 350 залишку та/або приблизно 376 – 1073 SEQ ID NO:228. [0111] Антитіла, що виникають проти таких епітопів або позаклітинного домену, наприклад, епітопів, що знаходяться в межах нього, або включають залишок(залишки) від амінокислотних залишків 24 - 420 SEQ ID NO:228, або їх еталонна частина, наприклад, залишки 24 - 75, 75 150, 150 - 225, 225 - 300, 300 - 375 або 375 - 420 GCC, або молекули антитіла, що походять від них, можуть бути придатні як терапевтичні або діагностичні антитіла, як описано в даному документі. [0112] У варіанті здійснення молекула антитіла до GCC мають одну або декілька з наступних властивостей: a) вона конкурує за зв’язування, наприклад, зв’язування з GCC клітинної поверхні або очищеною GCC, з однією з вищеназваних молекул антитіл до GCC, що підсумовані в Таблицях 18 UA 108991 C2 5 10 15 20 25 30 35 40 45 50 55 60 1 і 2, наприклад, антитіла гібридоми людини (наприклад, 5F9), селективного лімфоцитного антитіла (наприклад, Abx-229) або мишачі антитіла (наприклад, 3G1); b) вона зв’язується з таким самим, або по суті таким самим, епітопом на GCC, як і одна з вищеназваних молекул антитіла до GCC, узагальнених в Таблицях 1 і 2, наприклад, антитіла гібридоми людини (наприклад, 5F9), селективного лімфоцитного антитіла (наприклад, Abx-229) або мишачі антитіла (наприклад, 3G1). У варіанті здійснення антитіло зв’язується з таким самим, як визначається за допомогою одного або декількох аналізів з застосуванням пептидних наборів або за допомогою зв’язування із процесованими мутантами, химерами або точковими мутантами, експресованими на клітинній поверхні або мембранних препаратах, наприклад, як ці аналізи, які описуються в даному документі; c) вона зв’язується з епітопом, який має щонайменше 1, 2, 3, 4, 5, 8, 10, 15 або 20 суміжних амінокислотних залишків подібно до епітопу одної з вищеназваних молекул антитіла до GCC, підсумованих в Таблицях 1 і 2, наприклад, антитіла гібридоми людини (наприклад, 5F9), селективного лімфоцитного антитіла (наприклад, Abx-229) або мишачі антитіла (наприклад, 3G1); d) вона зв’язується з ділянкою GCC людини, що зв’язана антитілом до GCC дійсного винаходу, де ділянка, наприклад, позаклітинна або цитоплазматична ділянка, має 10-15, 10-20, 20-30 або 20-40 залишків завдовжки, та зв’язування визначене, наприклад, за допомогою зв’язування з процесованими мутантами. У варіанті здійснення молекула антитіла до GCC зв’язується з позаклітинною ділянкою GCC людини. У варіанті здійснення молекула антитіла до GCC може зв’язувати частину позаклітинного домену GCC людини, визначену амінокислотними залишками 24 - 420 SEQ ID NO:228. У варіанті здійснення молекула антитіла до GCC може зв’язувати гуанілатциклазний характерний сайт на амінокислотних залишках 931 - 954 SEQ ID NO:228; або e) вона зв’язується з еталонним епітопом, описаним в даному документі. [0113] У варіанті здійснення молекула антитіла до GCC зв’язується з GCC-послідовністю ILVDLFNDQYFEDNVTAPDYMKNVLVLTLS (SEQ ID NO:225). [0114] У варіанті здійснення молекула антитіла до GCC зв’язується з GCC-послідовністю FAHAFRNLTFEGYDGPVTLDDWGDV (SEQ ID NO:226). [0115] У варіанті здійснення молекула антитіла зв’язується з конформаційним епітопом. В інших варіантах здійснення молекула антитіла зв’язується з лінійним епітопом. [0116] Молекули антитіла до GCC можуть бути поліклональними антитілами, моноклональними антитілами, моноспецифічними антитілами, химерними антитілами (дивись патент США № 6020153), або антитілами людини, або гуманізованими антитілами, або фрагментами антитіл, або їх похідними. Синтетичні і генетично сконструйовані варіанти (дивись патент США № 6331415) будь-якого з вищезгаданого також розглядаються в даному винаході. Моноклональні антитіла може бути отримані різними техніками, включаючи традиційну методику мишачих моноклональних антитіл, наприклад, стандартну техніку гібридизації соматичних клітин Kohler і Milstein, Nature 256: 495 (1975). Дивись, в цілому, Harlow, E. і Lane, D. (1988) Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY. [0117] Імунізація білком, наприклад, GCC або розчинною частиною, або білком злиття, що містить частину GCC (наприклад, TOK107-hIg), або клітинами, або мембранними фракціями з них, наприклад, клітинами, що експресують виставлену на поверхні GCC або її частину (наприклад, продукт pLKTOK4 або продукт pLKTOK111), може бути проведена з імуногеном, отриманим для ін’єкції в такий спосіб, щоб індукувати відповідь, наприклад, з ад’ювантом, наприклад, повним ад’ювантом Фрейнда. Інші придатні ад’юванти включають ад’ювант TITERMAX GOLD® (CYTRX Corporation, Лос-Анджелес, Каліфорнія) і алюміній. Невеликі пептидні імуногени можуть бути зв’язані з більшою молекулою, такою як гемоціанін фісурели. Мишам може бути введена ін’єкція декількома способами, наприклад, підшкірна, внутрішньовенна або внутрішньом’язова в декілька місць, наприклад, в очеревину (i.p.), основу хвоста, або подушечку стопи, або в комбінацію місць, наприклад, iP і основу хвоста (BIP). Бустерні ін’єкції можуть включати один і той самий або інший імуноген і можуть додатково включати ад’ювант, наприклад, неповний ад’ювант Фрейнда. Імунізація за допомогою ДНК, наприклад, ДНК, що кодує GCC або її частину або білок злиття, що містить GCC або його частину (наприклад, такої, що кодує TOK107-hIg), може бути введена ін’єкцією, використовуючи технологію генної гармати. Наприклад, ДНК завантажують на мікроскопічні золоті частинки та вводять ін’єкцією мишам з частими інтервалами протягом короткого проміжку часу. [0118] В цілому, якщо бажаним є моноклональне антитіло, то гібридому отримують шляхом злиття придатної клітини від іморталізованої клітинної лінії (наприклад, лінії клітин мієломи, 19 UA 108991 C2 5 10 15 20 25 30 35 40 45 50 55 60 такої як SP2/0, P3X63Ag8,653, або гетеромієломи) з клітинами, що продукують антитіло. Клітини, що продукують антитіло, можуть бути отримані з периферійної крові або, переважно селезінки або лімфатичних вузлів, людей, трансгенних тварин з антитілом людини або інших придатних тварин, імунізованих антигеном інтересу. Клітини, що продукують антитіла людського походження (наприклад, антитіло людини) можуть бути отримані, використовуючи придатні способи, наприклад, злиття клітини, що продукує антитіло людини і гетеромієломи або триоми або іморталізація активованої B-клітини людини через зараження вірусом Епштейна-Барра. (Дивись, наприклад, патент США № 6197582 (Trakht); Niedbala et al., Hybridoma, 17:299-304 (1998); Zanella et al., J Immunol Methods, 156:205-215 (1992); Gustafsson et al., Hum Antibodies Hybridomas, 2:26-32 (1991)). Злиті або іморталізовані клітини, що продукують антитіло, (гібридоми) можуть бути виділені, використовуючи умови селективної культури, і клоновані шляхом обмежуючого розведення. Клітини, які продукують антитіла з бажаною специфічністю, можуть бути визначені, використовуючи придатний аналіз (наприклад, ELISA (наприклад, з імуногеном, наприклад, TOK107-hIgG, іммобілізованим на мікротитрувальному планшеті) або за допомогою FACS на клітині, що експресує GCC або її частину, наприклад, клітині, що експресує продукт pLKTOK111). Наприклад, якщо GCC-імуноген містить частину злиття, що являє собою афінний реагент, ця частина може забезпечувати, щоб білок злиття, що містить GCC або її частину, був зв’язаний з матрицею, наприклад, мікротитрувальними планшетами або чипами для аналізу, що покриті білком G, стрептавідином, дериватизовані глутатіоном або покриті антитілом, які потім комбінують з імунною сироваткою або кондиційованим середовищем від гібридоми або рекомбінантної клітини, що експресує антитіло, і суміш інкубують при умовах, що сприяють формуванню комплексу (наприклад, при фізіологічних умовах за соллю і pH). Після інкубації лунки мікротитрувального планшету або лунки чипу відмивають для видалення будьяких незв’язаних компонентів і вимірюють зв’язування антитілом до GCC. [0119] У варіантах здійснення для терапевтичних застосувань антитіла дійсного винаходу є антитілами людини або гуманізованими антитілами. Перевага антитіл людини або гуманізованих антитіл полягає в тому, що вони потенційно зменшують або усувають імуногенність антитіла у реципієнта-хазяїна, таким чином, роблячи можливим збільшення біодоступності та зменшення можливості небажаної імунної реакції, таким чином, потенційно забезпечуючи багаторазові введення антитіла. [0120] Модифіковані антитіла включають гуманізовані, химерні або CDR-прищеплені антитіла. Відповіді анти-мишачого антитіла людини (HAMA) привели до розробки химерних або іншим чином гуманізованих антитіл. В той час як химерні антитіла мають константну ділянку людини і мишачу варіабельну ділянку, передбачається, що будуть спостерігатися певні відповіді анти-химерного антитіла людини (HACA), особливо при хронічних або багатодозових застосуваннях антитіла. Присутність таких отриманих від мишей або щурів білків може приводити до швидкого кліренсу антитіл або може приводити до утворення імунної відповіді проти антитіла пацієнтом. Для того, щоб уникнути використання отриманих від мишей або щурів антитіл, гуманізовані антитіла, де послідовності вводять в послідовність антитіла, щоб зробити її близькою до послідовності антитіла людини, або повністю людські антитіла, утворені шляхом введення функціональної частини антитіла людини гризуну, були розроблені так, щоб гризун продукував антитіла, що мають повністю людські послідовності. Антитіла людини запобігають певних проблем, пов’язаних з антитілами, що мають варіабельні та/або константні ділянки мишей, кроликів або щурів. Антитіла людини [0121] Молекули повністю людського антитіла можуть мінімізувати імуногенні та алергійні відповіді, притаманні мишачим або дериватизованим від мишачих моноклональним антитілам і, таким чином, збільшити ефективність і безпечність введених антитіл. Використання молекул повністю людського антитіла може забезпечити суттєву перевагу при лікуванні хронічних і рецидивуючих захворювань людини, таких як запалення, аутоімунне захворювання та рак, які потребують повторних введень антитіла. Також, молекули антитіла людини можуть бути отримані, використовуючи генетично сконструйовані штами тварин, в яких генна експресія антитіла тварини придушується та функціонально заміщається генною експресією молекули антитіла людини. [0122] Способи утворення антитіл людини є відомими в рівні техніки. Один спосіб отримання антитіл людина застосовує використання трансгенних тварин, таких як трансгенна миша. Ці трансгенні тварини містять суттєву частину геному, що продукує антитіло людини, наприклад, локус імуноглобуліну людини, що може піддаватися функціональній перебудові, вставлений в їх власний геном, і продукування власного ендогенного антитіла тварини стає дефіцитним відносно продукування антитіл. Способи утворення таких трансгенних тварин є 20 UA 108991 C2 5 10 15 20 25 30 35 40 45 50 55 60 відомими в рівні техніки. Такі трансгенні тварини можуть бути утворені, використовуючи TM технологію XENOMOUSE , або шляхом використання "мінілокусного" підходу. Способи TM утворення XENOMICE описані в патентах США №№ 6162963, 6150584, 6114598 і 6075181, які включені в даний документ посиланням. Способи утворення трансгенних тварин із застосуванням "мінілокусного" підходу описані в патентах США №№ 5545807, 5545806 і 5625825; також дивись міжнародну публікацію № WO93/12227, кожна з яких включена в даний документ посиланням. Інші трансгенні миші, що продукують антитіло людини, включають HUMAB-MOUSE ®, трансхромосомні миші KIRIN TC MOUSE™, KM-MOUSE® (MEDAREX, Принстон, Нью-Джерсі). [0123] Використовуючи технологію трансгенних тварин з антитілом людини, наприклад, TM технологію XENOMOUSE , антитіла людини можуть бути отримані шляхом імунізації миші TM XENOMOUSE (Abgenix, Фримонт, Каліфорнія) з антигеном інтересу. Лімфатичні клітини (такі як B-клітини) виділяють (наприклад, виділяють із тканини селезінки) з мишей, що експресують антитіла. Ці виділені клітини можуть бути злиті з клітинною лінією мієлоїдного типу для отримання безсмертних гібридомних клітинних ліній за допомоги стандартної методології. Ці гібридомні клітинні лінії можуть бути піддані скринінгу та вибрані для визначення гібридомних клітинних ліній, що продукують антитіла, специфічні до антигену інтересу. [0124] Трансгенні тварини з антитілом людини є джерелом нуклеїнових кислот, що можуть бути збагачені нуклеїновими кислотами, які кодують антитіла, що мають бажані властивості, такі як специфічність і афінність. Наприклад, нуклеїнові кислоти, що кодують антитіла або варіабельні ділянки антитіла, можуть бути виділені з трансгенних мишей з антитілом людини, що були імунізовані за допомогою GCC-білка або його варіанта або частини. Виділені нуклеїнові кислоти або їх частини (наприклад, частини, що кодують варіабельні ділянки, CDR, каркасні ділянки) можуть бути експресовані, використовуючи будь-який придатний спосіб (наприклад, фаговий дисплей), з отриманням бібліотеки антитіл або антиген-зв’язувальних фрагментів антитіл (наприклад, одноланцюгових антиген-зв’язувальних фрагментів, дволанцюгових антиген-зв’язувальних фрагментів), що збагачені на антитіла або антиген-зв’язувальні фрагменти, що зв’язують GCC-білок. Така бібліотека може виявляти підвищену різноманітність (наприклад, комбінаторну різноманітність через спарованість варіабельних ділянок важкого ланцюга і варіабельних ділянок легкого ланцюга) відносно репертуару антитіл, що продукуються в імунізованій трансгенній тварині з антитілом людини. Бібліотека можна піддавати скринінгу, використовуючи будь-який придатний аналіз (наприклад, аналіз зв’язування GCC-білка) для визначення антитіл або антиген-зв’язувальних фрагментів, що мають бажані властивості (наприклад, специфічність, афінність). Нуклеїнові кислоти, що кодують антитіло або антиген-зв’язувальні фрагменти, що мають бажані властивості, можуть бути виділені за допомоги будь-якого придатного способу. (дивись, наприклад, патент США № 5871907 (Winter і співавт.) і патент США № 6057098 (Buechler і співавт.).) [0125] Альтернативно, антитіла можуть бути експресовані в клітинних лініях, відмінних від гібридомних клітинних ліній. Конкретніше, послідовності, що кодують конкретні антитіла, можуть бути клоновані з клітин, що продукують антитіла, і використані для трансформації придатної клітини-хазяїна ссавця. В переважному способі лімфоцити селезінки та/або лімфатичного вузла від імунізованих мишей виділяють з мишей і поміщають на планшети для аналізів бляшкоутворення, як описано раніше в Babcook et al., Proc Natl Acad Sci U S A. 93: 7843-8 (1996), яка включена в даний документ посиланням. Коротко, клітини поміщають на планшет в агар з еритроцитами вівці, покривають GCC-антигеном і клітини, що секретують моноклональні антитіла проти GCC антигену, будуть фіксувати комплемент і лізувати негайно еритроцити, які оточують клітини, що продукують моноклональні антитіла. Клітини всередині очищених бляшок виймали для секвенування імуноглобулінових послідовностей і субклонування в вектори експресії. Супернатанти від тимчасово трансфекованих клітин, що містять GCC специфічне моноклональне антитіло, потім піддавали скринінгу за допомогою ELISA і на зв’язування з клітинами за допомогою проточної цитометрії. Варіабельні послідовності, або їх частина з отриманих антитіл людини, що містять CDR, які зв’язують конкретні епітопи, можуть бути застосовані для продукції модифікованих антитіл. Наприклад, варіабельні ділянки отриманих антитіл, можуть бути сплайсовані в касету експресії для спрощення переносу конструктів, збільшеної експресії конструктів і/або включення конструктів в вектори, здатні до експресії антитіл повної довжини, дивись, наприклад, патентну заявку US20060147445. В конкретних варіантах здійснення касета експресії містить константну ділянку важкого ланцюга ізотипу IgG1. [0126] Спосіб селективного лімфоцитного антитіла (SLAM, дивись патент США № 5627052, Babcook et al. Proc. Natl. Acad. Sci. U.S.A. 93:7843-7848 (1996)) може також бути використаний для визначення клітин, які можуть забезпечувати антитіло інтересу. В SLAM B-клітини 21 UA 108991 C2 5 10 15 20 25 30 35 40 45 50 55 60 культивують безпосередньо, таким чином, обходячи гібридомну технологію, яка типово охоплює лише невелику долю антитіл, первинно утворених мишею. Використовуючи мікропланшетні аналізи, B-клітини швидко аналізують протягом періоду часу в декілька днів. Типово, тисячі клонів антиген-реактивних клітин визначаються, представляючи тисячі окремих антигенспецифічних, наприклад, GCC-специфічних, моноклональних антитіл. Кількість різних антигенреактивних моноклональних антитіл, визначених в окремому експерименті, типово збільшуються в багато разів. Після застосування додаткових швидких мікропланшетних аналізів для вимірювання та ранжирування антитіл за афінністю і функцією, можуть бути добирані окремі B-клітинні клони, що продукують антитіла дуже високої якості. Крім того, минуючи етап гібридомного утворення, продукція може йти швидко в рекомбінантній промисловій клітинній лінії. Виділяють окремі B клітини, добирані із застосуванням даної технології, та гени антитіла можуть бути безпосередньо вводитися в промислову клітинну лінію. Отримана клітинна лінія потім може бути розроблена для тестування клінічного випробування по суті за однакову тривалість, як це необхідно для розробки гібридомної клітинної лінії. [0127] Моноклональне антитіло 5F9 (IgG2, каппа) людини може бути отримане за допомогою гібридоми 5F9, що також має назву гібридома 46.5F9.8.2, яка розміщена в дипозитарій 10 січня 2007 року, від Millennium Pharmaceuticals Inc., 40 Landsdowne Street, Кембридж, Массачусетс, 02139, США, в Американській колекції типових культур, 10801 University Boulevard, Манассас, Вірджинія 20110, США, під інвентарним номером PTA-8132. (Депозит був зроблений на основі та відповідно до вимог Будапештського договору про міжнародне визнання депонування мікроорганізмів для цілей патентної процедури.) Дійсний винахід стосується гібридоми 5F9, антитіла, що вона продукує, його антиген-зв’язувальних фрагментів і нуклеїнових кислот, що кодують антитіло та його частини (наприклад, важкий ланцюг, варіабельна ділянка важкого ланцюга, легкий ланцюг, варіабельна ділянка легкого ланцюга, CDR). Як описано в даному документі, гібридома 5F9 продукує IgG2, каппа антитіло. Технології гуманізації та дисплею і модифікації антитіл [0128] Як обговорюється вище, існують переваги для продукування антитіл зі зменшеною імуногенністю. Це можна здійснити у зв’язку з техніками гуманізації та техніками дисплею, використовуючи придатні бібліотеки. Треба розуміти, що мишачі антитіла або антитіла від іншого виду можуть бути гуманізовані або приматизовані, використовуючи техніки, відомі в рівні техніки. Дивись, наприклад, Winter and Harris Immunol Today 14:43-46 (1993) і Wright et al. Crit. Reviews in Immunol. 12125-168 (1992). Антитіло інтересу може бути сконструйовано за допомогою технік рекомбінантних ДНК для заміщення CH1, CH2, CH3, шарнірних доменів і/або каркасного домену на відповідну послідовність людини (дивись WO 92/02190 і патенти США №№ 5530101, 5585089, 5693761, 5693792, 5714350 і 5777085). Також, використання кДНК Ig для побудови генів химерного імуноглобуліну є відомим в рівні техніки (Liu et al. Proc Natl Acad Sci USA. 84:3439 (1987) і J. Immunol. 139:3521 (1987)). мРНК виділяють з гібридоми або іншої клітини, що продукує антитіло і використовують для отримання кДНК: кДНК інтересу може бути ампліфікована за допомогою полімеразної ланцюгової реакції, використовуючи специфічні праймери (патенти США №№ 4683195 і 4683202). [0129] Альтернативно, технологія фагового дисплею (дивись, наприклад, McCafferty et al, Nature, 348:552- 553 (1990)) може бути використана для отримання антитіл людини та фрагментів антитіл in vitro з генів варіабельного (V) домену імуноглобуліну, наприклад, з репертуарів від неімунізованих донорів. Відповідно до цієї техніки, гени V домену антитіла клонують всередині рамки зчитування в або головний, або мінорний ген оболонкового білка ниткоподібного бактеріофага, такого як M13 або fd, і виводять як функціональні фрагменти антитіла на поверхню фагової частинки. Оскільки ниткоподібна частинка містить одноланцюгову ДНК копію фагового геному, то добори на основі функціональних властивостей антитіла, також дає в результаті добір гена, що кодує антитіло, яке виявляє ці властивості. Таким чином, фаг імітує деякі властивості B-клітини. Фаговий дисплей може бути проведений в різних форматах; для їх огляду дивись, наприклад, Johnson and Chiswell, Current Opinion in Structural Biology, 3:564-571 (1993). Декілька джерел сегментів V-гену можуть бути використані для фагового дисплею. Clackson et al., Nature, 352:624-628 (1991) виділили різноманітну серію антиоксазолонових антитіл з невеликої випадкової комбінаторної бібліотеки V генів, отриманих із селезінок імунізованих мишей. Може бути сконструйовано репертуар V-генів від неімунізованих донорів –людей і антитіла для різноманітної серії антигенів (включаючи само-антигени) можуть бути виділені по суті за допомогою технік, описаних Marks et al., J. MoI. Biol., 222:581- 597 (1991), або Griffith et al, EMBO J., 12:725-734 (1993). Дивись, також, патенти США №№ 5565332 і 5573905. Дисплейні бібліотеки можуть містити антитіла або антиген-зв’язувальні фрагменти антитіл, що містять штучні амінокислотні послідовності. Наприклад, бібліотека може містити Fab 22 UA 108991 C2 5 10 15 20 25 30 35 40 45 50 55 60 фрагменти, які містять штучні CDR (наприклад, випадкові амінокислотні послідовності) і каркасні ділянки людини. (Дивись, наприклад, патент США № 6300064 (Knappik і співавт.).) [0130] Антитіла людини можуть також бути утворені за допомогою in vitro активованих Bклітин (дивись патенти США №№ 5567610 і 5229275). [0131] Послідовності генів константної ділянки людини можна знайти в Kabat et al. (1991) Sequences of Proteins of Immunological Interest, N.I.H. номер публікації 91-3242. Гени C ділянки людини легко доступні від відомих клонів. Вибір ізотипу буде керуватися бажаною ефекторною функцією, такою як фіксація комплементу або активність в залежній від антитіла клітинній цитотоксичності. Ізотипами можуть бути IgG1, IgG2, IgG3 або IgG4. В конкретних варіантах здійснення молекули антитіла винаходу являють собою IgG1 і IgG2. МОЖУТЬ бути використані будь-які константні ділянки легкого ланцюга людини, каппа або лямбда. Химерне, гуманізоване антитіло потім експресується завдяки традиційним способам. [0132] В деяких варіантах здійснення молекула антитіла до GCC дійсного винаходу може викликати залежну від антитіла клітинну цитотоксичність (ADCC) у клітині, що експресує GCC, наприклад, пухлинній клітині. Антитіла з IgG1 і IgG3 ізотипами є придатними для посилення ефекторної функції в залежній від антитіла цитотоксичній здатності, через їх здатність зв’язуватися з Fc рецептором. Антитіла з IgG2 і IgG4 ізотипами є придатними для мінімізації ADCC відповіді через їх низьку здатність зв’язуватися з Fc рецептором. В пов’язаних варіантах здійснення заміни в Fc ділянці або зміни в композиції глікозилювання антитіла, наприклад, шляхом росту в модифікованій еукаріотичній клітинній лінії, можуть бути зроблені для посилення здатності Fc рецепторів розпізнавати, зв’язувати та/або опосередковувати цитотоксичність клітин, з якими зв’язуються антитіла до GCC (дивись, наприклад, патент США № 7317091, 5624821 і публікації, включаючи WO 00/42072, Shields, et al. J. Biol. Chem. 276:65916604 (2001), Lazar et al. Proc. Natl. Acad. Sci. U.S.A. 103:4005-4010 (2006), Satoh et al. Expert Opin Biol. Ther. 6:1161-1173 (2006)). В певних варіантах здійснення антитіло або антигензв’язувальний фрагмент (наприклад, антитіло людського походження, антитіло людини) можуть включати амінокислотні заміни або заміщення, що змінюють або пристосовують функцію (наприклад, ефекторну функцію). Наприклад, константна ділянка людського походження (наприклад, 1 константна ділянка, 2 константна ділянка) може бути розроблена для зменшення активації комплементу та/або зв’язування з Fc рецептором. (Дивись, наприклад, патенти США №№ 5648260 (Winter і співавт.), 5624821 (Winter і співавт.) і 5834597 (Tso і співавт.), ідеї яких в повному обсязі включені в даний документ посиланням.) Переважно, амінокислотна послідовність константної ділянки людського походження, що містить такі амінокислотні заміни або заміщення є щонайменше приблизно на 95% ідентичною по всій довжині з амінокислотною послідовністю незміненої константної ділянки людського походження, більш переважно щонайменше приблизно на 99% ідентичною по всій довжині з амінокислотною послідовністю незміненої константної ділянки людського походження. [0133] В ще іншому варіанті здійснення ефекторні функції можуть також бути змінені шляхом модуляції патерну глікозилювання антитіла. Під зміною розуміють видалення однієї або декількох вуглеводних частин, знайдених в антитілі, і/або додавання одного або декількох сайтів глікозилювання, що не є присутніми в антитілі. Наприклад, антитіла з посиленими ADCCактивностями зі зрілою вуглеводною структурою, що не містить фукози, прикріпленої до Fc ділянки антитіла, описані в публікації заявки на патент США № 2003/0157108 (Presta). Дивись також публікації заявки на патент США № 2004/0093621 (Kyowa Hakko Kogyo Co., Ltd). Glycofi також розробив дріжджові клітинні лінії, здатні продукувати специфічні глікоформи антитіл. [0134] Додатково або альтернативно, може бути утворено антитіло, що має змінений тип глікозилювання, таке як гіпофукозильоване антитіло, що має зменшені кількості фукозильних залишків, або антитіло, що має збільшені серединні GlcNac структури. Такі змінені патерни глікозилювання, як було показано, збільшують ADCC-здатність антитіл. Такі вуглеводні модифікації можуть бути здійснені шляхом, наприклад, експресії антитіла в клітині-хазяїні зі зміненим механізмом глікозилювання. Клітини зі зміненим механізмом глікозилювання були описані в рівні техніки і можуть бути використані як клітини-хазяїни, які конструюють для експресії рекомбінантних антитіл винаходу для отримання, таким чином, антитіла із зміненим глікозилюванням. Наприклад, європейський патент EP 1176195 від Hang і співавт. описує клітинну лінію з функціонально розірваним FUT8 геном, який кодує фукозилтрансферазу, так що антитіла, експресовані в такій клітинній лінії, виявляють гіпофукозилювання. PCT публікація WO 03/035835 від Presta описує варіант CHO клітинної лінії, Lec13 клітини, зі зменшеною здатністю прикріпляти фукозу до Asn(297)-зв’язаних вуглеводів, що також приводить до гіпофукозилювання антитіл, експресованих в такій клітині-хазяїні (дивись також Shields, R. L. et al., 2002 J. Biol. Chem. 277:26733-26740). PCT публікація WO 99/54342 від Umana і співавт. 23 UA 108991 C2 5 10 15 20 25 30 35 40 45 50 55 60 описує клітинні лінії, сконструйовані для експресії глікопептид-модифікуючих глікозилтрансфераз (наприклад, бета(1,4)-N ацетилглюкозамінілтрансфераза III (GnTIII)), так що антитіла, експресовані в сконструйованих клітинних лініях виявляють збільшені серединні GlcNac структури, що приводить до збільшеної ADCC активності антитіл (дивись також Umana et al., 1999 Nat. Biotech. 17:176-180). [0135] Гуманізовані антитіла можуть також бути утворені, використовуючи прийом CDRприщеплювання. Техніки утворення таких гуманізованих антитіл є відомими в рівні техніки. В цілому, гуманізовані антитіла утворюють шляхом отримання послідовностей нуклеїнових кислот, що кодують варіабельні важкі і варіабельні легкі послідовності антитіла, що зв’язується з GCC, визначаючи гіперваріабельну ділянку або "CDR" у варіабельних важких і варіабельних легких послідовностей і прищеплюючи CDR-послідовності нуклеїнових кислот на послідовності нуклеїнових кислот каркасної частини людини. (Дивись, наприклад, патенти США №№ 4816567 і 5225539). Можна визначити розташування залишків CDR і каркасної частини (дивись, Kabat, E.A., et al. (1991) Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH публікація № 91-3242, і Chothia, C. et al. J. Mol. Biol. 196:901-917 (1987)). Молекули антитіла до GCC, описані в даному документі, мають амінокислотні послідовності CDR і послідовності нуклеїнових кислот, що кодують CDR, наведені в Таблицях 5 і 6. В деяких варіантах здійснення послідовності з Таблиць 5 і 6 можуть бути включені в молекули, які розпізнають GCC, для використання в терапевтичних або діагностичних способах, описаних в даному документі. Каркасна частина людини, яку вибирають, є такою, що придатна для in vivo введення, означаючи, що вона не виявляє імуногенності. Наприклад, таке визначення може бути здійснено перед випробуванням з in vivo використанням таких антитіл і дослідженнями амінокислотних подібностей. Придатна каркасна ділянка може бути вибрана з антитіла людського походження, що має щонайменше приблизно 65% ідентичність амінокислотних послідовностей, і переважно щонайменше приблизно 70%, 80%, 90% або 95% ідентичність амінокислотних послідовностей по всій довжині каркасної ділянки в амінокислотній послідовності еквівалентної частини (наприклад, каркасної ділянки) антитіла-донора, наприклад, молекули антитіла до GCC (наприклад, 3G1). Ідентичність амінокислотних послідовностей може бути визначена, використовуючи придатний алгоритм вирівнювання амінокислотних послідовностей, такий як CLUSTAL W, використовуючи параметри за замовчуванням. (Thompson J.D. et al., Nucleic Acids Res. 22:4673-4680 (1994).). [0136] Як тільки визначають CDR і FR клонованого антитіла, що повинні бути гуманізованими, визначають амінокислотні послідовності, що кодують CDR і відповідні послідовності нуклеїнових кислот прищеплюють на вибрані FR людини. Це може бути здійснено, використовуючи відомі праймери та лінкери, вибір яких є відомим в рівні техніки. Всі CDR конкретного антитіла людини можуть бути заміщені принаймні на частину CDR, що не належить людині або тільки деякі з CDR можуть бути заміщені на CDR, що не належать людині. Необхідно тільки замістити кількість CDR, необхідних для зв’язування гуманізованого антитіла з попередньо визначеним антигеном. Після того, як CDR прищеплені на вибрані FR людини, отримані "гуманізовані" варіабельні важкі та варіабельні легкі послідовності експресують для отримання гуманізованого Fv або гуманізованого антитіла, яке зв’язується з GCC. Переважно, CDR-прищеплене (наприклад, гуманізоване) антитіло зв’язується з GCC білком з афінністю, подібною до, по суті однаковою з, або кращою ніж антитіло-донор. Типово, гуманізовані варіабельні важкі і легкі послідовності експресуються як білок злиття з послідовностями константного домену людини, таким чином, отримують інтактне антитіло, що зв’язується з GCC. Проте, може бути отримано гуманізоване Fv антитіло, що не містить константні послідовності. [0137] Також в обсязі винаходу знаходяться гуманізовані антитіла, в яких специфічні амінокислоти були заміщені, видалені або додані. Зокрема, гуманізовані антитіла можуть мати амінокислотні заміни в каркасній ділянці, щоб покращити зв’язування з антигеном. Наприклад, вибрана невелика кількість залишків акцепторної каркасної частини ланцюга гуманізованого імуноглобуліну може бути заміщена на відповідні донорські амінокислоти. Розташування замін включають амінокислотні залишки, відрегульовані відносно CDR, або які здатні взаємодіяти з CDR (дивись наприклад, патенти США №№ 5585089 або 5859205). Акцепторна каркасна частина може бути зрілою послідовністю каркасної частини антитіла людини або консенсусною послідовністю. Як використовують в даному документі, вираз "консенсусна послідовність" стосується послідовності, що спостерігається найчастіше, або походить з найпоширеніших залишків в кожному положенні в послідовності в ділянці серед пов’язаних членів родини. Доступна низка консенсусних послідовностей антитіла людини, включаючи консенсусні послідовності для різних підгруп варіабельних ділянок людини (дивись, Kabat, E.A., et al., Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, U.S. 24 UA 108991 C2 5 10 15 20 25 30 35 40 45 50 55 60 Government Printing Office (1991)). База даних Kabat та її програмне забезпечення знаходяться у вільному доступі онлайн, наприклад, через IgBLAST в Національному центрі біотехнологічної інформації, Бетезда, Меріленд (також дивись, Johnson, G. and Wu, T.T., Nucleic Acids Research 29:205-206 (2001)). [0138] Інші техніки для гуманізації антитіл описані в Padlan і співавт. EP 519596 A1, опублікованому 23 грудня 1992 року. [0139] Молекула антитіла до GCC включає інші гуманізовані антитіла, які можуть також бути модифіковані специфічним видаленням епітопів T-клітини людини або "деімунізацією" за допомогою способів, розкритих в PCT публікаціях №№ WO 98/52976 і WO 00/34317, зміст яких включений в даний документ посиланням. Коротко, мишачі варіабельні ділянки важкого і легкого ланцюгів антитіла до GCC можна проаналізувати щодо пептидів, які зв’язуються з MHC (головний комплекс гістосумісності) класу II; ці пептиди представляють потенційні T-клітинні епітопи. Для визначення потенційних T-клітинних епітопів може бути застосований прийом комп’ютерного моделювання, що має назву "пептидне нанизування", і крім того база даних пептидів, що зв’язують MHC класу II людини, може бути досліджена щодо мотивів, присутніх в мишачих VH і VL послідовностях, як описано в PCT публікаціях №№ WO 98/52976 і WO 00/34317. Ці мотиви зв’язуються з будь-яким з 18 головних MHC класу II DR алотипів, і таким чином, складають потенційні T-клітинні епітопи. Визначені потенційні T-клітинні епітопи можуть бути усунені шляхом заміщення невеликих кількостей амінокислотних залишків у варіабельних ділянках, або переважно, шляхом замін однієї амінокислоти. Наскільки це можливо, здійснюють консервативні заміни, часто, але не виключно, може бути використана амінокислота, звичайна для цього положення в послідовностей антитіла ембріонального типу людини. Послідовності ембріонального типу людини розкриті в Tomlinson, I.A. et al., J. Mol. Biol. 227:776-798(1992); Cook, G. P. et al., Immunol. Today Vol. 16 (5): 237-242(1995); Chothia, D. et al., J. Mol. Bio. 227:799817(1992). Каталог V BASE забезпечує вичерпний каталог послідовностей варіабельних ділянок імуноглобуліну людини (складений Tomlinson, I.A. et al. MRC MRC Centre for Protein Engineering, Кембридж, Великобританія). Після того, як деімунізовані VH і VL антитіла до GCC сконструйовані за допомогою мутагенезу мишачих VH і VL генів, піддана мутагенезу варіабельна послідовність може, необов’язково, бути злита з константною ділянкою людини, наприклад, IgG1 людини або константними ділянками. [0140] В інших варіантах здійснення зменшення імуногенної відповіді CDR-прищепленим антитілом може бути досягнуто шляхом змін, наприклад, делецій, замін амінокислотних залишків в CDR (Kashmiri et al. Methods 36:25-34 (2005), патент США № 6818749, Tan et al. J. Immunol. 169:1119-1125 (2006)). Наприклад, залишки на положеннях, залучених в контакт з антигеном, переважно не будуть змінені. Типово, такі залишки, SDR, знаходяться в положеннях, які виявляють високі рівні варіативності серед антитіл. Консенсусні послідовності (наприклад, SEQ ID NO:302-307, Таблиця 5), що отримані, наприклад, за допомогою способу Clustal (Higgins D. G. et al., Meth. Enzymol. 266:383-402 (1996)), з молекул антитіла до GCC, наприклад, з антитіл, описаних в даному документі, сприяють визначенню SDR. В молекулах антитіла до GCC людини, описаних в даному документі, SDR йдуть після щонайменше першого залишку або, в деяких варіантах здійснення, перших чотирьох залишків CDR1 важкого ланцюга; принаймні N-кінцевої частини, наприклад, перші сім, десять або 13 залишків CDR2-важкого ланцюга; приблизно всього CDR3-важкого ланцюга; C-кінцевої частини, наприклад, після залишку шість, вісім або дев’ять CDR1-легкого ланцюга; приблизно першого, середнього і/або останнього залишку CDR2-легкого ланцюга; і більшості CDR3-легкого ланцюга, або принаймні після залишку два або три. Відповідно, для підтримки зв’язування з GCC-білком після гуманізації або модифікації молекули антитіла до GCC, такі SDR-залишки в CDR молекул антитіла до GCC є менш схильними до змін, наприклад, з мишачих залишків на консенсусні залишки людини, ніж є залишки в інших залишках CDR або каркасних ділянках. Навпаки, може бути переважним змінити залишки в CDR, що не належить людині, наприклад, мишачих CDR, на залишки, визначені як консенсусні в CDR людини, наприклад, CDR молекул антитіла до GCC, описаних в даному документі (наприклад, послідовності, наведені в Таблиці 5). Наприклад, серин може представляти залишок людини для C-кінця CDR1 важкого ланцюга, і/або тирозин може представляти залишок людини для другого і/або третього залишків CDR1 важкого ланцюга; CDR2 важкого ланцюга може закінчуватися в S-(L/V)-K-(S/G) (SEQ ID NO:312), щоб представляти CDR людини; щоб представляти CDR3 людини, може бути гліцин після чотирьох-шести залишків і/або аспартат шість-дев’ять залишків в CDR3 важкого ланцюга; CDR1 легкого ланцюга може починатися з (K/R)-(A/S)-SQS-(V/L)-(S/L) (SEQ ID NO:313), щоб представляти CDR людини; CDR2 легкого ланцюга може мати серин в третьому залишку і/або аргінін в п’ятому залишку, представляючи CDR людини; і/або CDR3 легкого ланцюга може мати 25 UA 108991 C2 5 10 15 20 25 30 35 40 45 50 55 60 глютамін в другому залишку і/або тирозин або серин в третьому залишку, представляючи CDR людини. [0141] Антитіла до GCC, що не є інтактними антитіла, є також придатними в цьому винаході. Такі антитіла можуть походити від будь-якого з антитіл, описаних вище. Придатні молекули антитіла цього типу включають наступне: (i) Fab фрагмент, одновалентний фрагмент, що складається з VL, VH, CL і CH1 доменів; (ii) F(ab') 2 фрагмент, двовалентний фрагмент, що містить два Fab фрагменти, зв’язані дисульфідним мостиком на шарнірній ділянці; (iii) Fd фрагмент, що складається з VH і CH1 доменів; (iv) Fv фрагмент, що складається з VL і VH доменів одного фрагмента антитіла, (v) dAb фрагмент (Ward et al., Nature 341:544-546 (1989)), який складається з VH домену; (vii) антитіло з однодоменним функціональним важким ланцюгом, яке складається з VHH домену (відомого як нанотіло), дивись, наприклад, CortezRetamozo, et al., Cancer Res. 64: 2853-2857(2004), і посилання, процитовані в ній; і (vii) виділена CDR, наприклад, одна або декілька виділених CDR разом із достатньою каркасною частиною для забезпечення антиген-зв’язувального фрагмента. Більш того, хоча два домени Fv фрагмента, VL і VH, кодуються окремими генами, вони можуть бути поєднані, використовуючи рекомбінантні способи, синтетичним лінкером, що забезпечує те, що вони можуть бути отримані як окремий білковий ланцюг, в якому VL і VH ділянки спарюються для формування одновалентних молекул (відомих як одноланцюговий Fv (scFv); дивись наприклад, Bird et al. Science 242:423-426 (1988); і Huston et al. Proc. Natl. Acad. Sci. USA 85:5879-5883 (1988). Як розуміють, такі одноланцюгові антитіла є також включеними у вираз "антиген-зв’язувальний фрагмент" антитіл. Ці фрагменти антитіла отримують, використовуючи традиційні техніки, відомі фахівцям в даній галузі техніки, і фрагменти піддають скринінгу для застосування в такий же спосіб, як й інтактні антитіла. Фрагменти антитіла, такі як Fv, F(ab') 2 і Fab можуть бути отримані шляхом відщеплення інтактного білка, наприклад, за допомогою протеазного або хімічного відщеплення. [0142] В варіантах здійснення деякі з CDR послідовностей або всі CDR послідовності одного або обох важкого і легкого ланцюга можуть бути використані в іншій молекулі антитіла, наприклад, в CDR-прищепленій, гуманізованій або химерній молекулі антитіла. [0143] Варіанти здійснення включають молекулу антитіла, що містить достатні CDR, наприклад, всі шість CDR з одного з вищеназваного: гібридома людини, селективні лімфоцитні або мишачі антитіла, щоб забезпечити зв’язування з GCC клітинної поверхні. [0144] У варіанті здійснення CDR, наприклад, всі з HCDR, або всі з LCDR, або всі шість, є вставленими в каркасну ділянку(и) людини або отриману від людини. Приклади каркасних ділянок людини включають каркасні послідовності ембріонального типу людини, послідовності ембріонального типу людини, що були афінно дозрілими (або in vivo, або in vitro), або синтетичні послідовності людини, наприклад, консенсусні послідовності. У варіанті здійснення каркасна частина важкого ланцюга являє собою каркасну частину IgG1 або IgG2. У варіанті здійснення каркасна частина легкого ланцюга являє собою каппа каркасну частину. [0145] У варіанті здійснення молекула антитіла до GCC, наприклад, CDR-прищеплена або гуманізована молекула антитіла, містить достатні CDR, наприклад, всі шість CDR з одного з антитіл, описаних в даному документі, наприклад, послідовності, наведені в Таблиці 5, щоб забезпечити зв’язування з GCC. (Ілюстративні послідовності нуклеїнових кислот, які можуть кодувати CDR амінокислотні послідовності, наведені в Таблиці 5, забезпечуються в Таблиці 6 в даному документі). В конкретних варіантах здійснення молекула антитіла до GCC може містити CDR з 5F9 або Abx-229. [0146] Фрагменти антитіла для in vivo терапевтичного або діагностичного використання можуть скористуватися модифікаціями, які покращують їх час напівжиття в сироватці. Придатні органічні частини, як передбачено, збільшують in vivo час напівжиття антитіла в сироватці можуть включати одну, дві або більше лінійних або розгалужених частин, вибраних з гідрофільної полімерної групи (наприклад, лінійний або розгалужений полімер (наприклад, поліалкангліколь, такий як поліетиленгліколь, монометоксі-поліетиленгліколь і подібне), вуглевод (наприклад, декстран, целюлоза, полісахарид і подібне), полімер гідрофільної амінокислоти (наприклад, полілізин, поліаспартат і подібне), оксид поліалкану та полівінілпіролідон), група жирної кислоти (наприклад, монокарбонова кислота або дикарбонова кислота), група складного ефіру жирної кислоти, ліпідна група (наприклад, група діацилгліцеролу, група сфінголіпіду (наприклад, церамідил)) або фосфоліпідна група (наприклад, група фосфатидилетаноламіну). Переважно, органічна частина зв’язана з попередньо визначеним сайтом, де органічна частина не впливає на функцію (наприклад, зменшує афінність зв’язування антигену) отриманого імунокон’югату в порівнянні з частиною некон’югованого антитіла. Органічна частина може мати молекулярну вагу від приблизно 500 26 UA 108991 C2 5 10 15 20 25 30 35 40 45 50 55 60 Да до приблизно 50000 Да, переважно приблизно 2000, 5000, 10000 або 20000 Да. Приклади та способи модифікації поліпептидів, наприклад, антитіл, з органічними частинами можна знайти, наприклад, в патентах США №№ 4179337 і 5612460, PCT публікаціях №№ WO 95/06058 і WO 00/26256 і публікації заявки на патент США № 20030026805. [0147] Молекула антитіла до GCC може містити весь, або антиген-зв’язувальний фрагмент варіабельної ділянки, одного або обох важкого та легкого ланцюгів, одного з вищеназваного: гібридома людини, селективні лімфоцитні або мишачі антитіла. [0148] У варіанті здійснення амінокислотна послідовність легкого ланцюга (a) може відрізнятися від однієї з еталонних амінокислотних послідовностей, на яку посилаються в (a)(i-ii) на не більше ніж 1, 2, 3, 4, 5, 10 або 15 залишків. У варіантах здійснення відмінності являють собою консервативні заміни. В варіантах здійснення відмінності знаходяться в каркасних ділянках. У варіанті здійснення амінокислотна послідовність важкого ланцюга (b) може відрізнятися від однієї з еталонних амінокислотних послідовностей, на яку посилаються в (b)(i-ii) на не більше ніж 1, 2, 3, 4, 5, 10 або 15 залишків. В варіантах здійснення відмінності являють собою консервативні заміни. В варіантах здійснення відмінності знаходяться в каркасних ділянках. [0149] У варіанті здійснення молекула антитіла до GCC містить одну або обидві з наступного: (a) амінокислотна послідовність легкого ланцюга всієї, або антиген-зв’язувального фрагмента, або (i) амінокислотної послідовності варіабельної ділянки легкого ланцюга з Таблиці 3, наприклад, SEQ ID NO:20, або (ii) амінокислоти варіабельної ділянки легкого ланцюга, кодованої за допомогою нуклеотидної послідовності з Таблиці 4, наприклад, SEQ ID NO:19; і (b) амінокислотна послідовність важкого ланцюга всієї, або антиген-зв’язувального фрагмента, або (i) амінокислотної послідовності варіабельної ділянки важкого ланцюга з Таблиці 3, наприклад, SEQ ID NO:18, або (ii) амінокислотної послідовності важкого ланцюга, кодованої за допомогою нуклеотидної послідовності з Таблиці 4, наприклад, SEQ ID NO:17. [0150] У варіанті здійснення молекула антитіла до GCC містить одну або обидві з наступного: (a) варіабельна ділянка легкого ланцюга, або її антиген-зв’язувальний фрагмент, що має щонайменше 85, 90, 95, 97 або 99 % гомологію з варіабельною ділянкою легкого ланцюга молекули антитіла до GCC дійсного винаходу, наприклад, одного з вищеназваного: гібридома людини, селективні лімфоцитні або мишачі антитіла; та (b) варіабельна ділянка важкого ланцюга, або її антиген-зв’язувальний фрагмент, що має щонайменше 85, 90, 95, 97 або 99 % гомологію з варіабельною ділянкою важкого ланцюга молекули антитіла до GCC дійсного винаходу, наприклад, одного з вищеназваного: гібридома людини, селективні лімфоцитні або мишачі антитіла. [0151] Амінокислотні послідовності варіабельних ділянок гібридоми людини, селективних лімфоцитних і мишачих антитіл можна знайти в Таблиці 3. [0152] У варіанті здійснення молекула антитіла до GCC являє собою 5F9 молекулу антитіла та включає одну або обидві з наступного: a) весь або фрагмент константної ділянки важкого ланцюга з SEQ ID NO: 231; і b) весь або фрагмент константної ділянки легкого ланцюга з SEQ ID NO: 233. [0153] В іншому варіанті здійснення молекула антитіла до GCC являє собою Abx-229 молекулу антитіла і включає одну або обидві з наступного: a) весь або GCC-зв’язувальний фрагмент варіабельної ділянки важкого ланцюга з SEQ ID NO: 46; і b) весь або GCCзв’язувальний фрагмент варіабельної ділянки легкого ланцюга з SEQ ID NO: 48. [0154] В одному підході консенсусні послідовності, що кодують J ділянки важкого і легкого ланцюгів можуть бути використані для розробки олігонуклеотидів для використання в якості праймерів для введення придатних сайтів рестрикції в J ділянку для наступного зв’язування сегментів V ділянки з сегментами C ділянки людини. кДНК C ділянки може бути модифікована шляхом сайт-спрямованого мутагенезу для розміщення сайтів рекстрикції в аналогічному положенні в послідовності людини. [0155] Вектори експресії включають плазміди, ретровіруси, косміди, YAC (штучні дріжджові хромосоми), епісоми, отримані з EBV (вірус Епштейна-Барра), і подібне. Традиційний вектор є вектором, який кодує функціонально повну послідовність CH або CL імуноглобуліну людини, з відповідними сайтами рестрикції, сконструйованими так, що будь-яка VH або VL послідовність могла бути легко вставлена та експресована. В таких векторах сплайсинг звичайно відбувається між донорських сайтів сплайсингу у вставленій J ділянці та акцепторним сайтом сплайсингу, що передує C ділянці людини, і також на ділянках сплайсингу, що виникають всередині CH екзонів людини. Придатні вектори експресії можуть містити низку компонентів, 27 UA 108991 C2 5 10 15 20 25 30 35 40 45 50 55 60 наприклад, точку початку реплікації, селективний маркерний ген, один або декілька елементів контролю експресії, такі як елемент контролю транскрипції (наприклад, промотор, енхансер, термінатор) і/або один або декілька трансляційних сигналів, сигнальну послідовність або лідерну послідовність і подібне. Поліаденілювання і термінація транскрипції мають місце на нативних хромосомних сайтах за ходом транскрипції кодуючих ділянок. Отримане химерне антитіло може бути об’єднано з будь-яким сильним промотором. Приклади придатних векторів, які можуть бути використані, включають ті, що є придатними для хазяїнів-ссавців і базуються на системах вірусної реплікації, таких як мавпячий вірус 40 (SV40), вірус саркоми Рауса (RSV), аденовірус 2, вірус бичачої папіломи (BPV), мутант паповавірусу BK (BKV) або мишачий і людський цитомегаловірус (CMV) і вірус мишачої лейкемії Молоні (MMLV), нативні Ig-промотори тощо. Різноманітність придатних векторів є відомою в рівні техніки, включаючи вектори, які зберігаються в одній копії або багатьох копіях, або які стають інтегрованими в хромосому клітини-хазяїна, наприклад, через LTR, або через штучні хромосоми, сконструйовані з множинними сайтами інтеграції (Lindenbaum et al. Nucleic Acids Res. 32:e172 (2004), Kennard et al. Biotechnol. Bioeng. Онлайн 20 травня 2009 року). Додаткові приклади придатних векторів наведені в розділі нижче. [0156] Таким чином, винахід забезпечує вектор експресії, що містить нуклеїнову кислоту, що кодує антитіло, антиген-зв’язувальний фрагмент антитіла (наприклад, антитіло людини, гуманізоване, химерне антитіло або антиген-зв’язувальний фрагмент будь-якого з вищезгаданого), ланцюг антитіла (наприклад, важкий ланцюг, легкий ланцюг) або антигензв’язуючу частину ланцюга антитіла, що зв’язується з GCC-білком. [0157] Експресія в еукаріотичних клітинах-хазяїнах є придатною, тому що такі клітини більш ймовірно, ніж прокаріотичні клітини, збирають і секретують правильно згорнуте та імунологічно активне антитіло. Проте, будь-яке отримане антитіло, що є неактивним через неправильне згортання, може бути ренатуровано відповідно до відомих способів (Kim and Baldwin, "Specific Intermediates in the Folding Reactions of Small Proteins and the Mechanism of Protein Folding", Ann. Rev. Biochem. 51, pp. 459-89 (1982)). Можливо, що клітини-хазяїни будуть продукувати частини інтактних антитіл, такі як димери легкого ланцюга або димери важкого ланцюга, які також є гомологами антитіла відповідно до дійсного винаходу. [0158] Додатково, як описано в іншому місці в цьому документі, антитіла людини або антитіла від іншого виду можуть бути утворені за допомогою технологій дисплейного типу, включаючи, без обмеження, фаговий дисплей, ретровірусний дисплей, рибосомний дисплей та інші техніки, використовуючи техніки, добре відомі в рівні техніки, та отримані молекули можуть бути піддані додатковому дозріванню, такому як афінне дозрівання, такі техніки є відомими в рівні техніки. Winter and Harris Immunol Today 14:43-46 (1993) і Wright et al. Crit. Reviews in Immunol. 12125-168 (1992), Hanes and Plucthau PNAS USA 94:4937-4942 (1997) (рибосомний дисплей), Parmley and Smith Gene 73:305-318 (1988) (фаговий дисплей), Scott TIBS 17:241-245 (1992), Cwirla et al. Proc Natl Acad Sci USA 87:6378-6382 (1990), Russel et al. Nucl. Acids Research 21:1081-1085 (1993), Hoganboom et al. Immunol. Reviews 130:43-68 (1992), Chiswell and McCafferty TIBTECH 10:80-84 (1992) і патент США № 5733743. Якщо технології дисплею використовують для отримання антитіл, що не належать людині, то такі антитіла можуть бути гуманізовані, як описано вище. [0159] Треба розуміти, що антитіла, що утворюються, не повинні первісно мати конкретний бажаний ізотип, але, скоріше антитіло, як воно утворено, може мати будь-який ізотип. Наприклад, антитіло, отримане за допомогою 5F9 гібридоми (ATCC, депозитарний номер PTA8132), має ізотип IgG2. Ізотип антитіла може бути змінений після цього, наприклад, на IgG1 або IgG3, для підвищення відповіді ADCC, коли антитіло зв’язується з GCC на клітині, використовуючи звичайні техніки, що є відомими в рівні техніки. Такі техніки включають використання прямих рекомбінантних технік (дивись наприклад, патент США № 4816397), технік злиття клітини з клітиною (дивись наприклад, патент США № 5916771), серед інших. В техніці злиття клітини з клітиною отримують мієломну або іншу клітинну лінію, що має важкий ланцюг з будь-яким бажаним ізотипом, і отримують іншу мієломну або іншу клітинну лінію, що має легкий ланцюг. Такі клітини після цього можуть бути злиті та може бути виділена клітинна лінія, що експресує інтактне антитіло. [0160] В певних варіантах здійснення молекула антитіла до GCC являє собою IgG1-антитіло до GCC людини. Оскільки такі антитіла мають бажанє зв’язування з GCC-молекулою, то в будьякому з таких антитіл може бути легко змінено ізотип з утворенням, наприклад, IgG4-ізотипу людини, при цьому зберігаючи таку ж варіабельну ділянку (яка визначає специфічність і афінність антитіла певною мірою). Відповідно, як тільки утворюють кандидати антитіла, які відповідають бажаним "структурним" ознакам, як обговорювалось вище, вони можуть в цілому 28
ДивитисяДодаткова інформація
Назва патенту англійськоюAnti-gcc antibody molecules and related compositions and methods
Автори англійськоюNam, Samuel, S., Greenfield, Edward, A., Babcook, John, O'Keffe, Theresa, Qin, Shixin
Автори російськоюНам Семьюел С., Гринфилд Эдвард А., Бабкук Джон, О'Киф Тереза, Цин Шисинь
МПК / Мітки
МПК: A61K 39/395, A61P 35/00
Мітки: антитіла, лікування, композиції, пов'язані, молекула, способи, раку
Код посилання
<a href="https://ua.patents.su/221-108991-molekula-antitila-do-gcc-i-povyazani-kompozici-ta-sposobi-likuvannya-raku.html" target="_blank" rel="follow" title="База патентів України">Молекула антитіла до gcc і пов’язані композиції та способи лікування раку</a>
Наступний патент: Реактор синтезу озону
Випадковий патент: Пристрій для виймання капсулів з гільз стрілецьких патронів