Біспецифічне антитіло, яке специфічно зв’язується з il17 та baff
Формула / Реферат
1. Біспецифічне антитіло, яке містить два перші поліпептиди і два другі поліпептиди, при цьому амінокислотна послідовність першого поліпептиду являє собою послідовність SEQ ID NO: 1, і амінокислотна послідовність другого поліпептиду являє собою послідовність SEQ ID NO: 2.
2. Біспецифічне антитіло за п. 1, яке відрізняється тим, що між залишком цистеїну 507 послідовності SEQ ID NO: 1 і залишком цистеїну 707 послідовності SEQ ID NO: 1 утворений внутрішньоланцюговий дисульфідний зв'язок.
3. Молекула ДНК, яка містить полінуклеотидну послідовність, що кодує поліпептид, який має амінокислотну послідовність SEQ ID NO: 1, і яка містить полінуклеотидну послідовність, що кодує поліпептид, який має амінокислотну послідовність SEQ ID NO: 2.
4. Клітина ссавця, що містить молекулу ДНК, яка містить полінуклеотидну послідовність, що кодує поліпептид, який має амінокислотну послідовність SEQ ID NO: 1, і молекулу ДНК, яка містить полінуклеотидну послідовність, що кодує поліпептид, який має амінокислотну послідовність SEQ ID NO: 2, причому згадана клітина здатна експресувати біспецифічне антитіло, яке містить перший поліпептид, який має амінокислотну послідовність SEQ ID NO: 1, і другий поліпептид, який має амінокислотну послідовність SEQ ID NO: 2.
5. Клітина ссавця, трансформована молекулою ДНК за п. 3, причому згадана клітина здатна експресувати біспецифічне антитіло, яке містить перший поліпептид, амінокислотна послідовність якого являє собою послідовність SEQ ID NO: 1, і другий поліпептид, амінокислотна послідовність якого являє собою послідовність SEQ ID NO: 2.
6. Клітина ссавця за п. 4 або п. 5, яка являє собою клітину яєчника китайського хом'ячка (СНО).
7. Спосіб продукування біспецифічного антитіла, яке містить перший поліпептид, амінокислотна послідовність якого являє собою послідовність SEQ ID NO: 1, і другий поліпептид, амінокислотна послідовність якого являє собою послідовність SEQ ID NO: 2, який включає культивування клітини ссавця за п. 4 або клітини ссавця за п. 5, за таких умов, за яких згадане біспецифічне антитіло експресується, і виділення експресованого біспецифічного антитіла.
8. Біспецифічне антитіло, продуковане способом за п. 7.
9. Спосіб лікування системного червоного вовчака, вовчакового нефриту, ревматоїдного артриту, псоріазу, анкілозивного спондилоартриту, псоріатичного артриту, первинного синдрому Шегрена або множинної мієломи, який включає введення пацієнту, який цього потребує, ефективної кількості біспецифічного антитіла за п. 1 або п. 8.
10. Біспецифічне антитіло за п. 1 або п. 8 для застосування в терапії.
11. Біспецифічне антитіло за п. 1 або п. 8 для застосування в лікуванні системного червоного вовчака, вовчакового нефриту, ревматоїдного артриту, псоріазу, анкілозивного спондилоартриту, псоріатичного артриту, первинного синдрому Шегрена або множинної мієломи.
12. Фармацевтична композиція, яка містить біспецифічне антитіло за п. 1 або п. 8, і один(ну) або декілька фармацевтично прийнятний(их) носій(їв), розріджувач(ів) або допоміжну(их) речовину(ин).
Текст
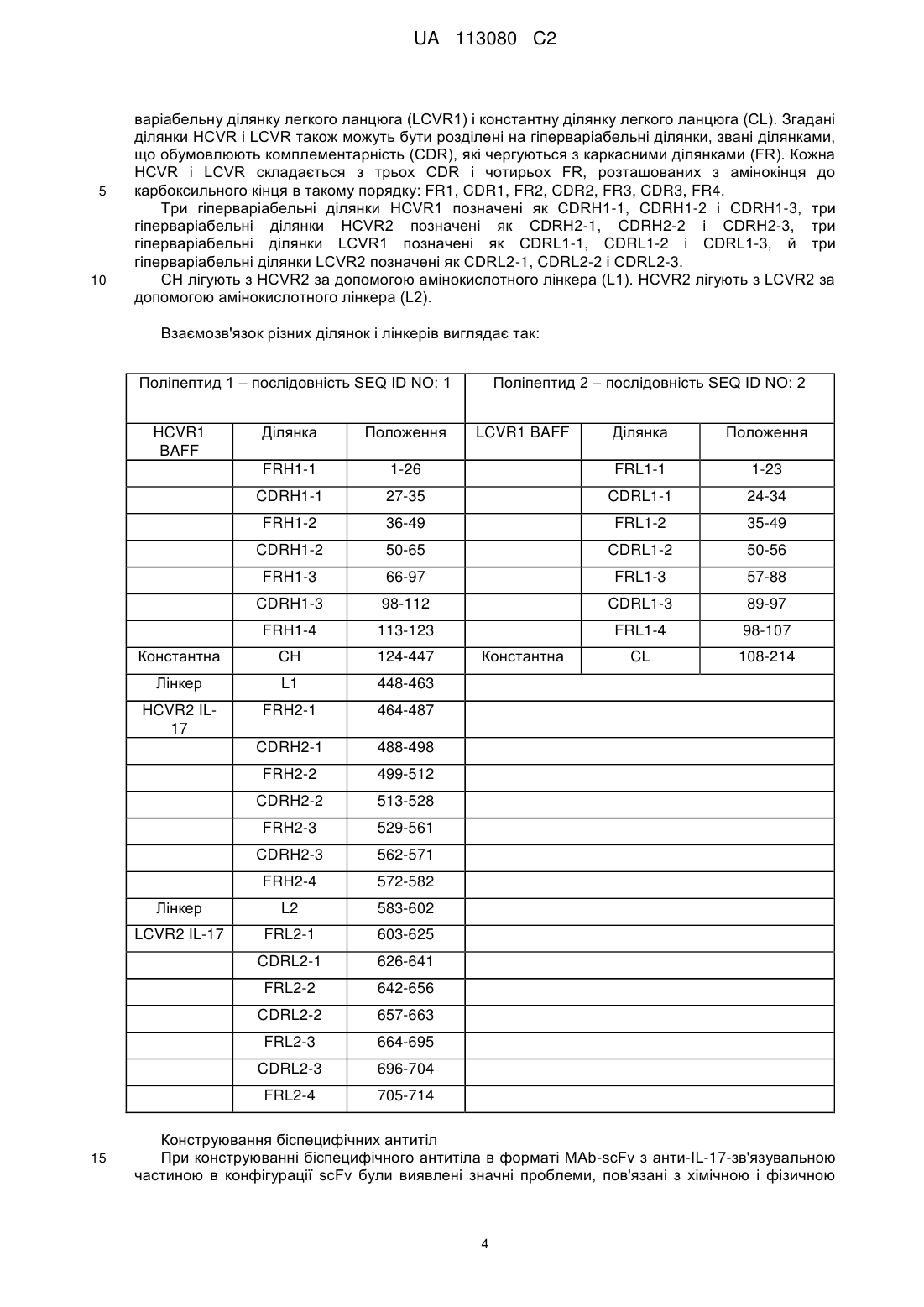
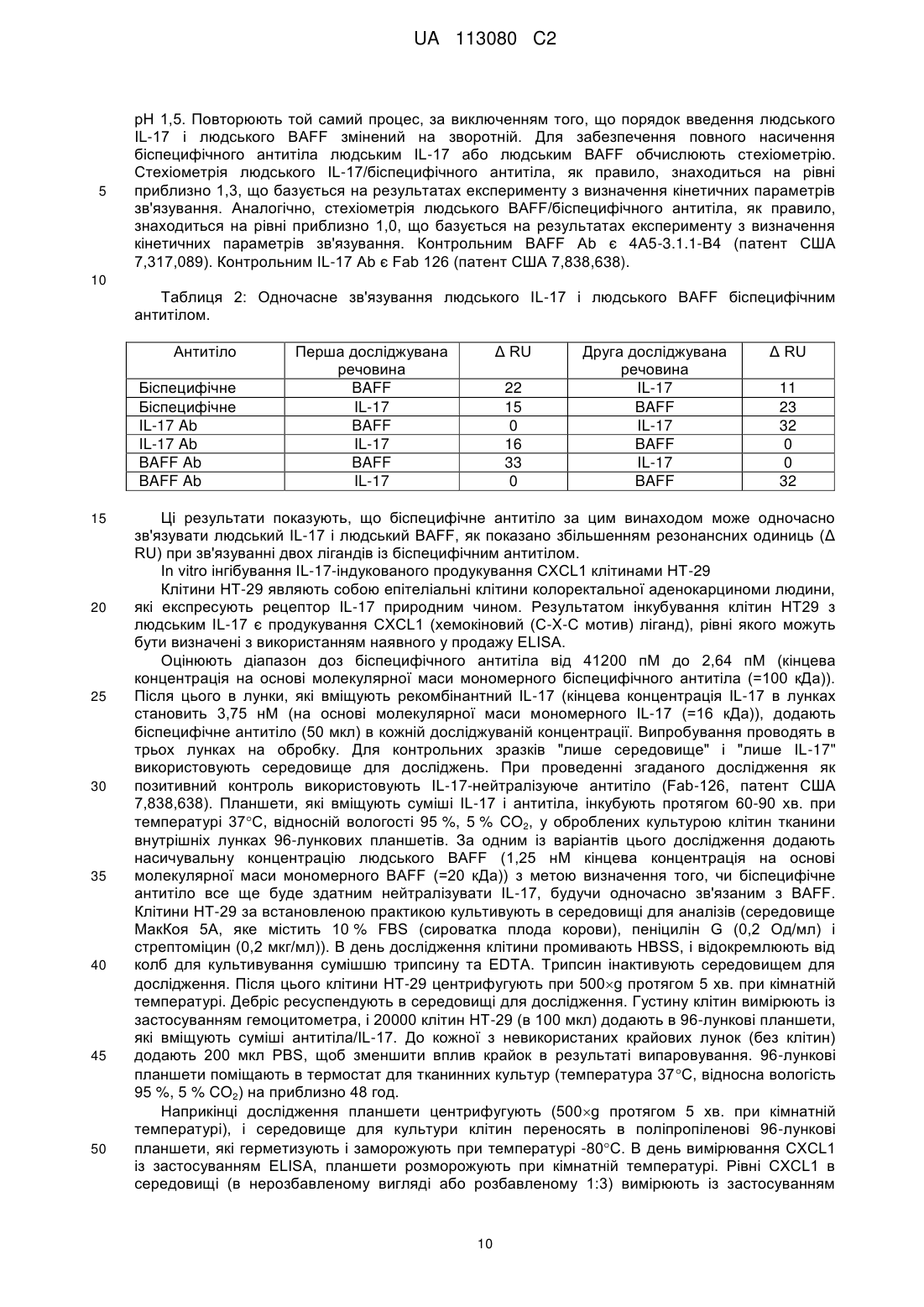
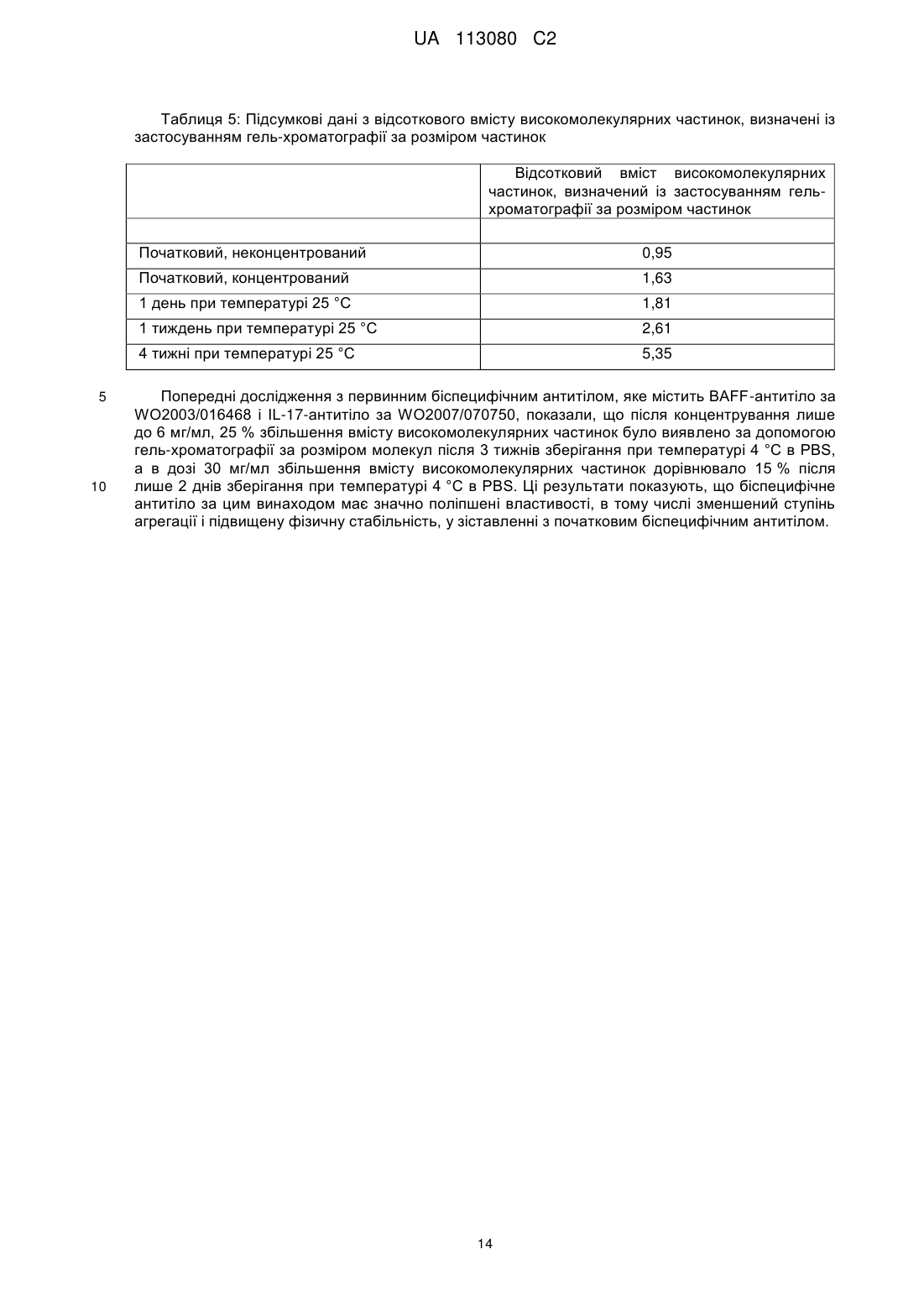
Реферат: Винахід стосується біспецифічного антитіла, яке специфічно зв'язується з фактором активування В-клітин родини TNF (BAFF) та інтерлейкіном-17А (IL-17). Винахід також стосується молекули ДНК, що містить нуклеотидну послідовність, що кодує заявлене антитіло, клітини-ссавця, що містить ДНК, способу продукування антитіла, фармацевтичної композиції, що містить антитіло, та способу лікування вовчакового нефриту (LN), системного червоного вовчака (SLE), ревматоїдного артриту (RA), псоріазу (Ps), анкілозивного спондилоартриту (AS), псоріатичного артриту (РА), первинного синдрому Шегрена (pSS) або множинної мієломи (MM) за допомогою вказаного біоспецифічного антитіла. UA 113080 C2 (12) UA 113080 C2 UA 113080 C2 5 10 15 20 25 30 35 40 45 50 55 60 Цей винахід належить до галузі медицини, зокрема, до нової галузі біспецифічних антитіл, спрямованих проти фактора активування В-клітин родини TNF (BAFF) та інтерлейкіну-17A (IL17). Очікується, що біспецифічні антитіла за цим винаходом будуть корисними в лікуванні вовчакового нефриту (LN), системного червоного вовчака (SLE), ревматоїдного артриту (RA), псоріазу (Ps), анкілозивного спондилоартриту (AS), псоріатичного артриту (PA), первинного синдрому Шегрена (pSS) або множинної мієломи (ММ). Підвищені рівні IL-17 пов'язують з декількома хворобливими станами, захворюваннями або розладами, включаючи запалення дихальних шляхів, ревматоїдний артрит, остеоартрит, ерозію кісток, внутрішньоочеревинні абсцеси і спайки, запальний розлад кишечнику, відторгнення алотрансплантата, псоріаз, певні види раку, ангіогенез, атеросклероз і розсіяний склероз. IL-17 та рецептор IL-17 активуються в синовіальній тканині пацієнтів, що страждають на ревматоїдний артрит. В різних тваринних моделях артриту блокування біологічної активності IL17 зменшує запалення і ерозію кісток. Крім того, незважаючи на те, що IL-17 діє синергічно з TNF-, підсилюючи запалення, IL-17 чинить IL-1β-незалежну дію на руйнування і запалення колагенової матриці та пошкодження суглобів. Тому, враховуючи його локалізоване розповсюдження на місці запалення, IL-17, як видається, може стати мішенню для лікування ревматоїдного артриту та інших запальних або автоімунних захворювань, яке має потенційно поліпшений профіль безпеки, ніж лікування лікарськими засобами, які впливають на системну циркуляцію прозапальних цитокінів, таких як TNF-. Участь фактора активування В-клітин (BAFF) у патогенезі автоімунних захворювань ілюструється надекспресією BAFF в мишачих моделях, яка призводить до виникнення автоімунного захворювання, яке імітує ревматоїдний артрит, системний червоний вовчак і первинний синдром Шегрена, а також до дворазового збільшення частоти виникнення Вклітинної лімфоми. Щодо людини, численні повідомлення свідчать про підвищені рівні сироваткового BAFF у пацієнтів, що страждають на системний червоний вовчак, ревматоїдний артрит, первинний синдром Шегрена і системний склероз. Було показано, що BAFF сприяє експансії клітин Th17, а IL-17 являє собою ключовий ефекторний цитокін для BAFFопосередкованого прозапального впливу під час розвитку колаген-індукованого артриту. Було показано також, що IL-17 діє у синергії з BAFF, впливаючи на біологію B-клітин і патофізіологію системного червоного вовчака. Є також свідчення того, що як BAFF, так і IL-17 відіграють роль в патології, пов'язаній з вовчаковим нефритом; фактично було повідомлено, що пацієнти з вовчаковим нефритом мають підвищені рівні IL-17 і BAFF. Системний червоний вовчак є дуже неоднорідним і мультисистемним автоімунним захворюванням, яке характеризується розвитком аутоантитіл і формуванням імунних комплексів. Приблизно 30-60 % пацієнтів із системним червоним вовчаком мають ураження нирок на певному етапі в ході їх захворювання. Вовчаковий нефрит є складним багатофакторним аутоімунним захворюванням. Якщо його не лікувати, 5-річна виживаність пацієнтів, що хворіють на вовчаковий нефрит, становить 0-20 %. Введення імуносупресивної терапії значно покращило цю ситуацію, і сьогочасна 10-річна виживаність становить 88 %. Тим не менш, це покращення відбувається на шкоду пацієнту, оскільки багато із цих методів лікування мають серйозні шкідливі наслідки, зокрема тому, що таке лікування необхідно здійснювати постійно. Крім того, реакція є повільною і часто буває неповною, і лише у 25-50 % пацієнтів настає ремісія. Сумісне введення анти-BAFF і анти-IL-17 антитіл вимагає або ін'єкції двох окремих продуктів або однієї ін'єкції спільної композиції двох різних антитіл. Дві ін'єкції забезпечують гнучкість щодо величини дози і часу введення, але є незручними для пацієнтів як через складність додержання схеми лікування, так і внаслідок болю. Спільна композиція може також забезпечувати деяку гнучкість щодо величини дози, але часто досить складним або неможливим виявляється знаходження умов виготовлення композицій, які б забезпечували хімічну і фізичну стабільність обох антитіл у зв'язку з різними молекулярними характеристиками цих двох різних антитіл. У WO199509917 розкритий спосіб виробництва біспецифічних тетравалентних антитіл (MAB-scFv) з використанням технології рекомбінантних ДНК шляхом продукування одноланцюгового Fv-фрагмента антитіла, злитого з повним антитілом, яке має іншу специфічність. Цей злитий ген експресують шляхом трансфекції, і одержують тетравалентне антитіло, яке має подвійну специфічність. У WO2003/016468 розкриті анти-BAFF антитіла, які зв'язують і нейтралізують як розчинні, так і зв'язані з мембраною форми людського BAFF. У WO2007/070750 розкриті анти-IL-17 антитіла, які зв'язують і нейтралізують людський IL-17. Однак при дотриманні ідеї WO199/509917 щодо створення первинного біспецифічного антитіла, яке містить анти-BAFF антитіла WO2003/016468 і анти-IL-17 антитіла WO2007/070750, автори 1 UA 113080 C2 5 10 15 20 25 30 35 40 45 цього винаходу виявили значні проблеми, пов'язані з хімічною і фізичною стабільністю. Для достатньо ефективного подолання цих проблем необхідним виявилось здійснення численних амінокислотних замін у первинному біспеціфічному антитілі. Відомий рівень техніки не вказує на потребу здійснення і не пропонує фактичних замін. Крім того, деякі заміни не є тривіальними або такими, що можуть бути визначені зі звичайного загального рівня знань. Крім того, окремі антитіла самі по собі не мають цих проблем, що дозволяє зробити припущення про те, що локальне оточення навколо цих ділянок відрізнялось в контексті біспецифічних антитіл. Таким чином, необхідним є фармакологічне втручання з біспецифічним антитілом, яке нейтралізує як BAFF, так і IL-17. Цей винахід пропонує біспецифічне антитіло, яке містить два перші поліпептиди і два другі поліпептиди. Цей винахід також пропонує молекулу ДНК, яка містить полінуклеотидну послідовність, що кодує перший поліпептид. Цей винахід також пропонує молекулу ДНК, яка містить полінуклеотидну послідовність, що кодує другий поліпептид. Цей винахід також пропонує молекулу ДНК, яка містить полінуклеотидну послідовність, що кодує перший поліпептид і другий поліпептид. Цей винахід також пропонує клітину ссавця, трансформовану молекулою(-ами) ДНК, при цьому згадана клітина здатна експресувати біспецифічне антитіло, яке містить перший поліпептид і другий поліпептид. Цей винахід також пропонує спосіб продукування біспецифічного антитіла, яке містить перший поліпептид і другий поліпептид, який включає культивування клітини ссавця за умов, за яких згадане біспецифічне антитіло експресується. Цей винахід також пропонує біспецифічне антитіло, продуковане згаданим способом. Цей винахід також пропонує спосіб лікування системного червоного вовчака, вовчакового нефриту, ревматоїдного артриту, псоріазу, анкілозивного спондилоартриту, псоріатичного артриту, первинного синдрому Шегрена або множинної мієломи, який включає введення пацієнту, який цього потребує, ефективної кількості біспецифічного антитіла. Цей винахід також пропонує біспецифічне антитіло для застосування в терапії. Цей винахід також пропонує біспецифічне антитіло для застосування в лікуванні системного червоного вовчака, вовчакового нефриту, ревматоїдного артриту, псоріазу, анкілозивного спондилоартриту, псоріатичного артриту, первинного синдрому Шегрена або множинної мієломи. Цей винахід також пропонує фармацевтичну композицію, яка містить біспецифічне антитіло і один або декілька фармацевтично прийнятних носіїв, розріджувачів або допоміжних речовин. Слід розуміти, що термін "людський IL-17" означає гомодимерний білок, який містить два людські білки IL-17A. Гетеродимер людського IL-17A/F являє собою білок людського IL-17A і білок людського IL-17F. Слід розуміти, що термін "біспецифічне антитіло" означає молекулу імуноглобуліну з чотирма антигензв'язувальними ділянками, яка зв'язує два різні антигени зі специфічністю до кожного антигену в форматі MAb-scFv. Це біспецифічне антитіло є здатним до зв'язування кожного антигену поодинці або кожного антигену одночасно. Згадане біспецифічне антитіло за цим винаходом містить два перші поліпептиди і два другі поліпептиди. Кожен зі згаданих перших поліпептидів утворює міжланцюговий дисульфідний зв'язок з кожним зі згаданих других поліпептидів, а згаданий перший поліпептид утворює два міжланцюгові дисульфідні зв'язки зі згаданим іншим першим поліпептидом, й кожен зі згаданих перших поліпептидів утворює декілька внутрішньоланцюгових дисульфідних зв'язків. Взаємне розташування поліпептидів і дисульфідних зв'язків показане на наведеному нижче схематичному зображенні: 2 UA 113080 C2 Другий поліпептид Перший поліпептид Перший поліпептид Другий поліпептид 5 10 15 20 25 30 35 40 45 Амінокислотна послідовність першого поліпептиду виглядає так: QVQLQQWGAG LLKPSETLSL TCAVYGGSFS GYYWSWIRQP PGKGLEWIGE 50 INHSGSTNYN PSLKSRVTIS VDTSKNQFSL KLSSVTAADT AVYYCARGYY 100 DILTGYYYYF DYWGQGTLVT VSSASTKGPS VFPLAPCSRS TSESTAALGC 150 LVKDYFPEPV TVSWNSGALT SGVHTFPAVL QSSGLYSLSS VVTVPSSSLG 200 TKTYTCNVDH KPSNTKVDKR VESKYGPPCP PCPAPEFLGG PSVFLFPPKP 250 KDTLMISRTP EVTCVVVDVS QEDPEVQFNW YVDGVEVHNA KTKPREEQFN 300 STYRVVSVLT VLHQDWLNGK EYKCKVSNKG LPSSIEKTIS KAKGQPREPQ 350 VYTLPPSQEE MTKNQVSLTC LVKGFYPSDI AVEWESNGQP ENNYKTTPPV 400 LDSDGSFFLY SRLTVDKSRW QEGNVFSCSV MHEALHNHYT QKSLSLSPGG 450 GGSGGGGTGG GGSQVQLVQS GAEVKKPGSS VKVSCKASGY KFTDYHIHWV 500 RQAPGQCLEW MGVINPTYGT TDYNQRFKGR VTITADESTS TAYMELSSLR 550 SEDTAVYYCA RYDYFTGTGV YWGQGTLVTV SSGGGGSGGG GSGGGGSGGG 600 GSDIVMTQTP LSLSVTPGQP ASISCRSSRS LVHSRGETYL HWYLQKPGQS 650 PQLLIYKVSN RFIGVPDRFS GSGSGTDFTL KISRVEAEDV GVYYCSQSTH 700 LPFTFGCGTK LEIK 714 (SEQ ID NO: 1). Амінокислотна послідовність другого поліпептиду виглядає так: EIVLTQSPAT LSLSPGERAT LSCRASQSVS RYLAWYQQKP GQAPRLLIYD 50 ASNRATGIPA RFSGSGSGTD STLTISSLEP EDFAVYYCQQ RSNWPRTFGQ 100 GTKVEIKRTV AAPSVFIFPP SDEQLKSGTA SVVCLLNNFY PREAKVQWKV 150 DNALQSGNSQ ESVTEQDSKD STYSLSNTLT LSKADYEKHK VYACEVTHQG 200 LSSPVTKSFN RGEC 214 (SEQ ID NO: 2). Міжланцюговий дисульфідній зв'язок кожного зі згаданих перших поліпептидів і кожного зі згаданих других поліпептидів утворюється між залишком цистеїну 137 послідовності SEQ ID NO: 1 і залишком цистеїну 214 послідовності SEQ ID NO: 2. Перший поліпептид утворює два міжланцюгові дисульфідні зв'язки з іншим першим поліпептидом. Перший міжланцюговий дисульфідний зв'язок утворюється між залишком цистеїну 229 першого поліпептиду з послідовністю SEQ ID NO: 1 і залишком цистеїну 229 іншого першого поліпептиду з послідовністю SEQ ID NO: 1. Другий міжланцюговий дисульфідній зв'язок утворюється між залишком цистеїну 232 першого поліпептиду з послідовністю SEQ ID NO: 1 і залишком цистеїну 232 іншого першого поліпептиду з послідовністю SEQ ID NO: 1. У межах scFv, сконструйований внутрішньоланцюговий дисульфідний зв'язок утворюється між залишком цистеїну 507 послідовності SEQ ID NO: 1 і залишком цистеїну 707 послідовності SEQ ID NO: 1. Крім того, внутрішньоланцюговий дисульфідній зв'язок утворюється між залишком цістеїну 625 послідовності SEQ ID NO: 1 і залишком цистеїну 695 послідовності SEQ ID NO: 1. У межах Mab, внутрішньоланцюгові дисульфідні зв'язки, які зазвичай виникають в антитілі IgG4, утворюються між залишком цистеїну 22 послідовності SEQ ID NO: 1 і залишком цистеїну 95 послідовності SEQ ID NO: 1, між залишком цистеїну 150 послідовності SEQ ID NO: 1 і залишком цистеїну 206 послідовності SEQ ID NO: 1, між залишком цистеїну 264 послідовності SEQ ID NO: 1 і залишком цистеїну 324 послідовності SEQ ID NO: 1, між залишком цистеїну 370 послідовності SEQ ID NO: 1 і залишком цистеїну 428 послідовності SEQ ID NO: 1, між залишком цистеїну 485 послідовності SEQ ID NO: 1 і залишком цистеїну 559 послідовності SEQ ID NO: 1, між залишком цистеїну 23 послідовності SEQ ID NO: 2 і залишком цистеїну 88 послідовності SEQ ID NO: 2, і між залишком цистеїну 134 послідовності SEQ ID NO: 2 та залишком цистеїну 194 послідовності SEQ ID NO: 2. Перший поліпептид містить першу варіабельну ділянку важкого ланцюга (HCVR1), константну ділянку важкого ланцюга (CH), другу варіабельну ділянку важкого ланцюга (HCVR2) і другу варіабельну ділянку легкого ланцюга (LCVR2). Другий поліпептид містить першу 3 UA 113080 C2 5 10 варіабельну ділянку легкого ланцюга (LCVR1) і константну ділянку легкого ланцюга (CL). Згадані ділянки HCVR і LCVR також можуть бути розділені на гіперваріабельні ділянки, звані ділянками, що обумовлюють комплементарність (CDR), які чергуються з каркасними ділянками (FR). Кожна HCVR і LCVR складається з трьох CDR і чотирьох FR, розташованих з амінокінця до карбоксильного кінця в такому порядку: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4. Три гіперваріабельні ділянки HCVR1 позначені як CDRH1-1, CDRH1-2 і CDRH1-3, три гіперваріабельні ділянки HCVR2 позначені як CDRH2-1, CDRH2-2 і CDRH2-3, три гіперваріабельні ділянки LCVR1 позначені як CDRL1-1, CDRL1-2 і CDRL1-3, й три гіперваріабельні ділянки LCVR2 позначені як CDRL2-1, CDRL2-2 і CDRL2-3. СН лігують з HCVR2 за допомогою амінокислотного лінкера (L1). HCVR2 лігують з LCVR2 за допомогою амінокислотного лінкера (L2). Взаємозв'язок різних ділянок і лінкерів виглядає так: Поліпептид 1 – послідовність SEQ ID NO: 1 Ділянка Положення 1-26 FRL1-1 1-23 CDRH1-1 27-35 CDRL1-1 24-34 FRH1-2 36-49 FRL1-2 35-49 CDRH1-2 50-65 CDRL1-2 50-56 FRH1-3 66-97 FRL1-3 57-88 CDRH1-3 98-112 CDRL1-3 89-97 FRH1-4 113-123 FRL1-4 98-107 Константна CH 124-447 CL 108-214 Лінкер L1 448-463 HCVR2 IL17 FRH2-1 464-487 CDRH2-1 488-498 FRH2-2 499-512 CDRH2-2 513-528 FRH2-3 529-561 CDRH2-3 562-571 FRH2-4 572-582 Лінкер L2 583-602 LCVR2 IL-17 FRL2-1 603-625 CDRL2-1 626-641 FRL2-2 642-656 CDRL2-2 657-663 FRL2-3 664-695 CDRL2-3 696-704 FRL2-4 15 Положення FRH1-1 705-714 HCVR1 BAFF Ділянка Поліпептид 2 – послідовність SEQ ID NO: 2 LCVR1 BAFF Константна Конструювання біспецифічних антитіл При конструюванні біспецифічного антитіла в форматі MAb-scFv з анти-IL-17-зв'язувальною частиною в конфігурації scFv були виявлені значні проблеми, пов'язані з хімічною і фізичною 4 UA 113080 C2 5 10 15 20 25 30 35 40 45 50 55 60 стабільністю. Ділянки CDRL2-1 і CDRH2-2 біспецифічного антитіла були піддані хімічним модифікаціям, які поліпшили фізичну стабільність і зменшили залежну від концентрації агрегацію. Численні дослідження стабільності і розчинності білка визначили хімічно нестабільні залишки в CDRL2-1 і CDRH2-2. Ці нестійкі залишки були замінені на нейтральні за зарядом амінокислоти з використанням цільових бібліотек, сконструйованих шляхом вичерпання кодонів. Крім того, була обчислена електростатична поверхня біспецифічного антитіла, й визначенні заряджені ділянки. Руйнування цих заряджених ділянок scFv призвело до зниження самоасоціації білка. Проте на ділянці CDRH2-1 біспецифічного антитіла була виявлена мутація, яка відновлювала рівновагу поверхневого розподілу електростатичного заряду, а також поліпшувала фізичну стабільність і розчинність при високій концентрації. Жодної з перелічених вище проблем у первинних окремих антитіл не виникало. Ці проблеми були виявлені лише при конструюванні біспецифічного антитіла в форматі MAb-scFv, що дозволяє зробити припущення про те, що локальне оточення навколо мутованих ділянок цього окремого антитіла відрізнялось в тому, що стосується біспецифічного антитіла. Для стабілізації поверхні розділу HCVR2/LCVR2 в частині IL-17 біспецифічного антитіла і для зниження агрегації біспецифічних антитіл були здійснені подальші хімічні модифікації. Дослідження, проведені для визначення агрегації, показали, що спостережувана самоасоціація білка стимулювалась не конформаційною нестабільністю окремих ділянок HCVR2 або LCVR2, а скоріше відкриттям або "диханням" поверхні розділу HCVR2/LCVR2, що призводить до міжмолекулярних білкових взаємодій. Тому в поверхню розділу HCVR2/LCVR2 частини IL-17 біспецифічного антитіла були введені різні внутрішньоланцюгові зв'язки. Один із таких внутрішньоланцюгових дисульфідних зв'язків існує в кожному з перших поліпептидів між залишком цистеїну 507 послідовності SEQ ID NO: 1 і залишком цистеїну 707 послідовності SEQ ID NO: 1. Цей дисульфідний зв'язок ковалентно з'єднує поверхню розділу HCVR2/LCVR2 частини IL-17 біспецифічного антитіла, що стабілізує згадану поверхню розділу HCVR2/LCVR2 і зменшує міжмолекулярні білкові взаємодії, які можуть призвести до фізичної нестабільності і несприятливих обмежень композиції. З дев'яти різних випробуваних дисульфідних зв'язків, 8 з яких експресували функціональний білок, величина втрати спорідненості коливалась у межах від приблизно 2 разів до приблизно 35 разів. Згаданий внутрішньоланцюговий дисульфідній зв'язок в кожному з перших поліпептидів між залишком цистеїну 507 послідовності SEQ ID NO: 1 і залишком цистеїну 707 послідовності SEQ ID NO: 1 найкраще стабілізував поверхню розділу HCVR2/LCVR2 при збереженні оптимальної спорідненості зв'язування з IL-17. Крім того, дослідження показали, що довжина лінкера для L1 впливає на кінетику зв'язування. Кінетичний аналіз (за допомогою поверхневого плазмонного резонансу) показав, що лінкер довжиною в 10 амінокислот спричинював у 2 рази повільнішу швидкість K on у порівнянні з лінкерами довжиною в 15 амінокислот і в 20 амінокислот. Тому в біспецифічне антитіло за цим винаходом був введений лінкер довжиною в 15 амінокислот. Зв'язування біспецифічних антитіл Біспецифічні антитіла за цим винаходом зв'язують як людський BAFF, так і людський IL-17, і нейтралізують щонайменше одну біологічну активність людського BAFF і щонайменше одну біологічну активність людського IL-17 in vitro або in vivo. Біспецифічні антитіла за цим винаходом є сильнодіючими інгібіторами IL-17 у присутності і за відсутності BAFF in vitro. Біспецифічні антитіла за цим винаходом є сильнодіючими інгібіторами як розчинного, так і зв'язаного з мембраною BAFF в присутності або за відсутності IL-17 in vitro. Біспецифічні антитіла за цим винаходом також характеризуються як такі, що мають спорідненість зв'язування (K D) з людським BAFF в діапазоні від 150 пМ до 1 пМ і з людським IL-17 в діапазоні від 50 пМ до 1 пМ. Біспецифічні антитіла мають спорідненість зв'язування з людським гетеродимером IL-17A/F на рівні приблизно 90 пМ. Біспецифічні антитіла ефективно нейтралізують як розчинний, так і зв'язаний з мембраною BAFF, і на це нейтралізування не впливає присутність насичувальних кількостей людського IL17. Згадані біспецифічні антитіла ефективно нейтралізують людський IL-17, і на це нейтралізування не впливає присутність насичувальних кількостей людського BAFF. Експресія біспецифічних антитіл Вектори експресії, здатні спрямовувати експресію генів, з якими вони функціонально пов'язані, добре відомі в цій галузі. Вектори експресії можуть кодувати сигнальний пептид, який полегшує секрецію поліпептиду(-ів) з клітини-хазяїна. Згаданий сигнальний пептид може бути сигнальним пептидом імуноглобуліну або гетерологічним сигнальним пептидом. Перший поліпептид і другий поліпептид можуть бути експресовані незалежно від різних промоторів, з якими вони функціонально пов'язані в одному векторі, або альтернативно перший поліпептид і другий поліпептид можуть бути експресовані незалежно від різних промоторів, з якими вони 5 UA 113080 C2 5 10 15 20 25 30 35 40 45 50 55 60 функціонально пов'язані в двох векторах, - один експресує перший поліпептид і один експресує другий поліпептид. До клітин-хазяїв належать клітини, стабільно або тимчасово трансфіковані, трансформовані, трансдуковані або інфіковані одним або декількома векторами експресії, що експресують перший поліпептид, другий поліпептид або обидва, перший поліпептид і другий поліпептид, за цим винаходом. Створення і виділення ліній клітин-хазяїв, які продукують біспецифічне антитіло за цим винаходом, можна здійснювати із застосуванням стандартних методів, відомих в цій галузі. Клітинами-хазяями для експресії біспецифічних антитіл, яким віддається перевага, є клітини ссавців. Конкретними клітинами ссавців є НЕК 293, NS0, DG-44 і СНO. За варіантом, якому віддають перевагу, біспецифічні антитіла секретують в середовище, в якому клітини-хазяї культивуються і з якого біспецифічні антитіла можуть бути виділені або від якого вони можуть бути очищені. В цій галузі добре відомо, що експресія антитіл клітинами ссавців призводить до глікозилування. Як правило, глікозилування відбувається на Fc-ділянці антитіла на висококонсервативному сайті N-глікозилування. N-глікани, зазвичай, приєднують до аспарагіну. Кожен з перших поліпептидів глікозилується на залишку аспарагіну 300 послідовності SEQ ID NO: 1. Конкретна полінуклеотидна послідовність ДНК, що кодує перший поліпептид, який має амінокислотну послідовність SEQ ID NO: 1, виглядає так: CAGGTGCAACTACAGCAGTGGGGCGCAGGACTGTTGAAGCCTTCGGAGACCCTGTCCCTCA CCTGCGCTGTCTATGGTGGGTCCTTCAGTGGTTACTACTGGAGCTGGATTCGCCAGCCCCCAGG GAAGGGGCTGGAGTGGATTGGGGAAATCAATCATAGTGGAAGCACCAACTACAACCCGTCCCTC AAGAGTCGAGTCACCATATCAGTAGACACGTCCAAGAACCAGTTCTCCCTGAAACTGAGCTCTGT GACCGCCGCGGACACGGCTGTGTATTACTGTGCGAGAGGGTATTACGATATTTTGACTGGTTATT ATTACTACTTTGACTACTGGGGCCAGGGAACCCTGGTCACCGTCTCCTCAGCCTCCACCAAGGG CCCATCGGTCTTCCCGCTAGCGCCCTGCTCCAGGAGCACCTCCGAGAGCACAGCCGCCCTGGG CTGCCTGGTCAAGGACTACTTCCCCGAACCGGTGACGGTGTCGTGGAACTCAGGCGCCCTGAC CAGCGGCGTGCACACCTTCCCGGCTGTCCTACAGTCCTCAGGACTCTACTCCCTCAGCAGCGTG GTGACCGTGCCCTCCAGCAGCTTGGGCACGAAGACCTACACCTGCAACGTAGATCACAAGCCCA GCAACACCAAGGTGGACAAGAGAGTTGAGTCCAAATATGGTCCCCCATGCCCACCCTGCCCAGC ACCTGAGTTCCTGGGGGGACCATCAGTCTTCCTGTTCCCCCCAAAACCCAAGGACACTCTCATG ATCTCCCGGACCCCTGAGGTCACGTGCGTGGTGGTGGACGTGAGCCAGGAAGACCCCGAGGTC CAGTTCAACTGGTACGTGGATGGCGTGGAGGTGCATAATGCCAAGACAAAGCCGCGGGAGGAG CAGTTCAACAGCACGTACCGTGTGGTCAGCGTCCTCACCGTCCTGCACCAGGACTGGCTGAACG GCAAGGAGTACAAGTGCAAGGTCTCCAACAAAGGCCTCCCGTCCTCCATCGAGAAAACCATCTC CAAAGCCAAAGGGCAGCCCCGAGAGCCACAGGTGTACACCCTGCCCCCATCCCAGGAGGAGAT GACCAAGAACCAGGTCAGCCTGACCTGCCTGGTCAAAGGCTTCTACCCCAGCGACATCGCCGTG GAGTGGGAAAGCAATGGGCAGCCGGAGAACAACTACAAGACCACGCCTCCCGTGCTGGACTCC GACGGCTCCTTCTTCCTCTACAGCAGGCTAACCGTGGACAAGAGCAGGTGGCAGGAGGGGAAT GTCTTCTCATGCTCCGTGATGCATGAGGCTCTGCACAACCACTACACACAGAAGAGCCTCTCCCT GTCTCCTGGAGGCGGAGGATCCGGGGGAGGGGGTACCGGAGGAGGGGGCTCGCAGGTGCAG CTGGTGCAGTCTGGGGCTGAGGTGAAGAAGCCTGGGTCCTCAGTGAAGGTTTCCTGCAAGGCA TCTGGTTACAAGTTCACTGACTACCATATTCATTGGGTGCGACAGGCCCCTGGACAATGCCTTGA GTGGATGGGAGTAATTAATCCTACTTATGGTACTACTGACTACAATCAGCGGTTCAAAGGCCGTG TCACCATTACCGCGGACGAATCCACGAGCACAGCCTACATGGAGCTGAGCAGCCTGAGATCTGA GGACACGGCCGTGTATTACTGTGCGAGATATGATTACTTTACTGGGACGGGTGTGTACTGGGGC CAAGGAACCCTGGTCACCGTCTCCTCAGGTGGCGGAGGATCTGGTGGAGGTGGCTCAGGAGGT GGCGGAAGCGGCGGAGGTGGAAGTGATATTGTGATGACTCAGACTCCACTCTCCCTGTCCGTCA CCCCTGGACAGCCGGCCTCCATCTCCTGCAGATCTAGTAGGAGCCTTGTACACAGTCGTGGAGA AACCTATTTACATTGGTATCTGCAGAAGCCAGGCCAATCTCCACAGCTCCTAATTTATAAAGTTTC CAACCGGTTTATTGGGGTCCCAGACAGATTCAGCGGCAGTGGGTCAGGCACAGATTTCACACTG AAAATCAGCAGGGTGGAGGCCGAAGATGTTGGGGTTTATTACTGCTCTCAAAGTACACATCTTCC ATTCACGTTTGGCTGCGGGACCAAGCTGGAGATCAAA (SEQ ID NO: 3). Конкретна полінуклеотидна послідовність ДНК, що кодує другий поліпептид, який має амінокислотну послідовність SEQ ID NO: 2, виглядає так: GAAATTGTGTTGACGCAGTCTCCAGCCACCCTGTCTTTGTCTCCAGGGGAAAGAGCCACCCT CTCCTGCAGGGCCAGTCAGAGTGTTAGCCGCTACTTAGCCTGGTACCAGCAGAAACCTGGCCAG GCTCCCAGGCTCCTCATCTATGATGCATCCAACAGGGCCACTGGCATCCCAGCCAGGTTCAGTG GCAGTGGGTCTGGGACAGACTCCACTCTCACCATCAGCAGCCTAGAGCCTGAAGATTTTGCAGT TTATTACTGTCAGCAGCGTAGCAACTGGCCTCGGACGTTCGGCCAAGGGACCAAGGTGGAAATC 6 UA 113080 C2 5 10 15 20 25 30 35 40 45 50 55 60 AAACGAACTGTGGCGGCGCCATCTGTCTTCATCTTCCCGCCATCTGATGAGCAGTTGAAATCCG GAACTGCCTCTGTTGTGTGCCTGCTGAATAACTTCTATCCCAGAGAGGCCAAAGTACAGTGGAAG GTGGATAACGCCCTCCAATCGGGTAACTCCCAGGAGAGTGTCACAGAGCAGGACAGCAAGGAC AGCACCTACAGCCTCAGCAACACCCTGACGCTGAGCAAAGCAGACTACGAGAAACACAAAGTCT ACGCCTGCGAAGTCACCCATCAGGGCCTGAGCTCGCCCGTCACAAAGAGCTTCAACAGGGGAG AGTGC (SEQ ID NO: 4). Середовище, в яке секретують біспецифічне антитіло, може бути очищене звичайними методами. Наприклад, це середовище може бути завантажене до колонки з білком А або G, і елюйоване з неї із застосуванням звичайних способів. Розчинний агрегат і мультимери можуть бути ефективно видалені звичайними методами, в тому числі шляхом гель-хроматографії за розміром молекул, гідрофобної хроматографії, іонообмінної хроматографії або хроматографії на гідроксилапатитній адсорбційній колонці. Одержаний продукт може бути негайно заморожений, наприклад, при температурі -70C, або ліофілізований. Може виникнути необхідність зниження рівня помилково укладеного біспецифічного антитіла, присутнього в середовищі. Помилково укладене біспецифічне антитіло також відоме як діатіло. Помилкове укладення є наслідком неправильного утворення одного або декількох міжланцюгових або внутрішньоланцюгових дисульфідних зв'язків. Помилково укладене біспецифічне антитіло може бути очищене звичайними методами. Наприклад, середовище, що містить помилково укладене біспецифічне антитіло, може бути завантажене до колонки з сильною катіонообмінною смолою, і елюйоване з цієї колонки. Наприклад, для очищення правильно укладеного біспецифічного антитіла від діатіла, використовують сильну катіонообмінну смолу SP-Sepharose HP. Значення рН середовища, що містить діатіло, доводять до рН 8, використовуючи 1М розчин трис-основи. Середовище завантажують у колонку SPSepharose HP, промивають 20 мМ трис-буфера, рН 8, у кількості, що дорівнює 2 об'ємам колонки, і елююють 20 мМ розчином трис-буфера, 100 мМ NaCl, pH 8, у кількості, що дорівнює 30 об'ємам колонки (0-70 мМ NaCl). Зібрані пули можуть бути оцінені на високу молекулярну масу в порівнянні з головним піком. Типовим результатом є зменшення вмісту діатіла з 10 % до 1 %, при цьому вихід продукту становить 71 %. У іншому прикладі для очищення правильно укладеного біспецифічного антитіла від діатіла використовують сильну катіонообмінну смолу Poros HS 50. Значення рН середовища, що містить діатіло, доводять до рН 8, використовуючи 1М розчин трис-основи. Середовище завантажують у колонку SP-Sepharose HP, і елююють 20 мМ розчином трис-буфера, 100 мМ NaCl, pH 8, у кількості, що дорівнює 15 об'ємам колонки (15-50 мМ NaCl). Зібрані пули можуть бути оцінені на високу молекулярну масу в порівнянні з головним піком. Типовим результатом є зменшення вмісту діатіла з 10 % до 1 %, при цьому вихід продукту становить 57 %. Терапевтичне застосування Термін "пацієнт" означає ссавця, переважно людину, із захворюванням, розладом або хворобливим станом, для якого було б корисним зниження рівня BAFF та/або IL-17 чи зниження біологічної активності BAFF та/або IL-17. Термін "лікування" призначений для позначення всіх процесів, результатом яких може бути уповільнення, переривання, затримування, усунення або зупинення прогресування розладів, згаданих в цьому описі, але цей термін не обов'язково означає повне усунення всіх симптомів розладу. Гадають, що біспецифічні антитіла за цим винаходом виявляться корисними для лікування системного червоного вовчака, вовчакового нефриту, ревматоїдного артриту, псоріазу, анкілозивного спондилоартриту, псоріатичного артриту, первинного синдрому Шегрена або множинної мієломи. Фармацевтична композиція Біспецифічне антитіло за цим винаходом може бути включене до складу фармацевтичної композиції, придатної для введення пацієнту. Такі фармацевтичні композиції розробляють так, щоб вони були придатними для вибраного способу введення, і відповідно використовують фармацевтично прийнятні розріджувачі, носії і/або допоміжні речовини, такі як диспергувальні речовини, буфери, поверхнево-активні речовини, консерванти, солюбілізувальні речовини, речовини, що змінюють ізотонічність, стабілізувальні речовини тощо. Згадані композиції можуть бути розроблені відповідно до традиційних методів, описаних, наприклад, в Remington, The th Science and Practice of Pharmacy, 19 Edition, Gennaro, Ed., Mack Publishing Co., Easton, PA 1995, де наданий стислий опис методів одержання препаратів, які є відомими практикуючим лікарям. До прийнятних носіїв для фармацевтичних композицій належить будь-який матеріал, який, в поєднанні з біспецифічним антитілом за цим винаходом, зберігає активність молекули і не реагує з імунною системою пацієнта. Фармацевтична композиція за цим винаходом містить біспецифічне антитіло і один(-у) або декілька фармацевтично прийнятний(-их) носій(-їв), 7 UA 113080 C2 5 10 15 20 25 30 35 40 45 50 55 60 розріджувач(-ів) або допоміжну(-их) речовину(-ин). Фармацевтична композиція, яка містить біспецифічне антитіло за цим винаходом, може бути введена пацієнту з підвищеним ризиком розвитку захворювань або розладів або пацієнту, який демонструє такі захворювання або розлади, як описано тут, із застосуванням стандартних методів введення. Фармацевтична композиція за цим винаходом містить ефективну кількість біспецифічного антитіла за цим винаходом. Термін "ефективна кількість" означає кількість, необхідну (у дозах і протягом періодів часу для певних засобів введення) для досягнення бажаного терапевтичного результату. Ефективна кількість біспецифічного антитіла може варіювати в залежності від таких факторів як стан захворювання, вік, стать та маса індивідуума, і здатності антитіла або частини антитіла викликати бажану відповідь у індивідуума. Ефективною кількістю також є кількість, при застосуванні якої будь-яка токсична або негативна дія біспецифічного антитіла переважується терапевтично сприятливою дією. Біспецифічне антитіло з наведеного нижче прикладу експресії і демонстрації властивостей складається з двох перших поліпептидів, які мають амінокислотні послідовності SEQ ID NO: 1, і двох других поліпептидів, які мають амінокислотні послідовності SEQ ID NO: 2, де кожен з перших поліпептидів утворює міжланцюговий дисульфідній зв'язок з кожним з других поліпептидів між залишком цистеїну 137 послідовності SEQ ID NO: 1 і залишком цистеїну 214 послідовності SEQ ID NO: 2, і перший поліпептид утворює два міжланцюгові дисульфідні зв'язки з іншим першим поліпептидом між залишком цистеїну 229 першого поліпептиду з послідовністю SEQ ID NO: 1 і залишком цистеїну 229 іншого першого поліпептиду з послідовністю SEQ ID NO: 1 та між залишком цистеїну 232 першого поліпептиду з послідовністю SEQ ID NO: 1 і залишком цистеїну 232 іншого першого поліпептиду з послідовністю SEQ ID NO: 1, і кожен зі згаданих перших поліпептидів утворює внутрішньоланцюговий дисульфідний зв'язок між залишком цистеїну 22 і залишком цистеїну 95 послідовності SEQ ID NO: 1, між залишком цистеїну 150 послідовності SEQ ID NO: 1 і залишком цистеїну 206 послідовності SEQ ID NO: 1, між залишком цистеїну 264 послідовності SEQ ID NO: 1 і залишком цистеїну 324 послідовності SEQ ID NO: 1, між залишком цистеїну 370 послідовності SEQ ID NO: 1 і залишком цистеїну 428 послідовності SEQ ID NO: 1, між залишком цистеїну 485 послідовності SEQ ID NO: 1 і залишком цистеїну 559 послідовності SEQ ID NO: 1, між залишком цистеїну 507 послідовності SEQ ID NO: 1 і залишком цистеїну 707 послідовності SEQ ID NO: 1, і між залишком цистеїну 625 послідовності SEQ ID NO: 1 і залишком цистеїну 695 послідовності SEQ ID NO: 1, і кожен з других поліпептидів утворює внутрішньоланцюговий дисульфідний зв'язок між залишком цистеїну 23 послідовності SEQ ID NO: 2 і залишком цистеїну 88 послідовності SEQ ID NO: 2, і між залишком цистеїну 134 послідовності SEQ ID NO: 2 і залишком цистеїну 194 послідовності SEQ ID NO: 2, і при цьому кожен з перших поліпептидів є глікозилованим на залишку аспарагіну 300 послідовності SEQ ID NO: 1. Відношення правильно укладеного біспецифічного антитіла до помилково укладеного діатіла становить приблизно 90:10. Експресія біспецифічного антитіла Біспецифічне антитіло може бути експресоване і очищене загалом як описано нижче. Експресійний вектор на основі глутамінсинтетази (GS), який містить ДНК послідовності SEQ ID NO: 3 (яка кодує перший поліпептид, який має амінокислотну послідовність SEQ ID NO: 1) і послідовності SEQ ID NO: 4 (яка кодує амінокислотну послідовність SEQ ID NO: 2 легкого ланцюга), використовують для трансфекції лінії клітин яєчника китайського хом'ячка, CHOK1SV (Lonza Biologics PLC, Slough, Великобританія) шляхом електропорації. Цей експресійний вектор кодує ранній промотор SV (мавпячий вірус 40E) і ген GS. Експресія GS надає можливість біохімічного синтезу глутаміну, амінокислоти, необхідної для клітин CHOK1SV. Після трансфекції клітини піддають змішаній селекції 50 мкМ розчином L-метіонінсульфоксиміну (MSX). Інгібування GS метіонінсульфоксиміном використовують для підвищення жорсткості селекції. Клітини з інтеграцією кДНК експресійного вектора в транскрипційно активні ділянки геному клітини-хазяїна можуть бути піддані селекції проти клітин CHOK1SV дикого типу, які експресують ендогенний рівень GS. Трансфіковані пули висівають з низькою густиною для забезпечення можливості близького до клонального росту стабільно експресуючих клітин. Головні лунки піддають скринінгу на експресію біспецифічних антитіл з подальшим масштабуванням в безсироваткових суспензійних культурах, призначених для продукування. Просвітлене середовище, в яке секретують біспецифічні антитіла, завантажують у афінну колонку з білком А, яка була врівноважена сумісним буфером, таким як забуферений фосфатом фізіологічний розчин (рН 7,4). Цю колонку промивають для видалення неспецифічних зв'язувальних компонентів. Зв'язане біспецифічне антитіло елююють, наприклад, градієнтом рН (наприклад, від 0,1 М розчину натрійфосфатного буфера, рН 6,8 до 0,1 М розчину 8 UA 113080 C2 5 10 15 20 25 30 35 натрійцитратного буфера, рН 2,5). Фракції біспецифічного антитіла виявляють, наприклад, за допомогою SDS-PAGE (електрофорез у поліакриламідному гелі у присутності додецилсульфату натрію) або аналітичної гель-хроматографії за розміром молекул, з подальшим об'єднанням. Розчинний агрегат і мультимери можуть бути ефективно видалені із застосуванням звичайних методів, в тому числі гель-хроматографії за розміром молекул, гідрофобної хроматографії, іонообмінної хроматографії або хроматографії на гідроксилапатитній адсорбційній колонці. Біспецифічне антитіло можна концентрувати і/або фільтрувати за стерильних умов із застосуванням звичайних методів. Чистота біспецифічного антитіла після цих стадій хроматографування є більше ніж 98 %. Біспецифічне антитіло можна негайно заморожувати при температурі -70 °C або зберігати при температурі 4 °C протягом декількох місяців. Зв'язувальна спорідненість до IL-17 і BAFF Зв'язувальну спорідненість і зв'язувальну стехіометрію біспецифічного антитіла до людського IL-17 і людського BAFF визначають із застосуванням дослідження поверхневого плазмонного резонансу на апараті Biacore 2000, праймованому протоковим буфером HBS-EP+ (GE Healthcare, 10 мМ Hepes, рН 7,4, + 150 мМ NaCl+3 мМ EDTA+0,05 % поверхнево-активної речовини Р20) при температурі проведення дослідження, встановленій на рівні 25 °C. Для здійснення методу захоплення на всіх чотирьох протокових кюветах (Fc) використовують чіп CM5, що містить іммобілізований білок А (одержаний за допомогою стандартного методу сполучення аміногруп із застосуванням активування за допомогою NHS-EDC (Nгідроксисукцинімід-1-(3-диметиламінопропіл)-3-етилкарбодіімід)). Зразки антитіл з концентрацією 10 мкг/мл одержують шляхом розведення в протоковому буфері. Зразки людського IL-17 або людського BAFF одержують з кінцевими концентраціями 20,0 нМ, 10,0 нМ, 5,0 нМ, 2,5 нМ, 1,25 нМ і 0 нМ (контрольний зразок) шляхом розведення в протоковому буфері. Кожен аналітичний цикл складається з (1) захоплення зразків антитіл на окремих протокових кюветах (Fc2, Fc3 і Fc4), (2) введення 250 мкл (300 с) людського IL-17 або людського BAFF в усі Fc (50 мкл/хв.), (3) повернення до введення потоку буфера протягом 20 хв для моніторингу фази дисоціації, (4) регенерації поверхонь чіпів шляхом введення гліцину (5 мкл, 30 с, pH 1,5), (5) урівноваження поверхонь чіпів шляхом введення HBS-EP+ (10 мкл, 60 с). Дані обробляють із застосуванням стандартного методу подвійного стандарту, і підганяють до моделі зв'язування 1:1 з використанням програмного забезпечення Biacore 2000 Evaluation, версія 4.1, для -1 -1 -1 визначення швидкості асоціації (k on, М с одиниць), швидкості дисоціації (Koff, с одиниць) і Rmax (RU (резонансних одиниць)). Константу рівноважної дисоціації (KD) обчислюють як відношення KD=koff/kon в молярних одиницях. Таблиця 1: Зв'язувальна спорідненість біспецифічного антитіла до людського IL-17 і людського BAFF Антиген Людський IL-17 kon Avg±SD -1 -1 6 M с (10 ) 2,5±0,4 Людський BAFF 2,3±0,9 koff Avg±SD -1 с -5 3,7 (±1,8)10 -4 1,2 (±0,5)10 KD Avg±SD пM 14±5 n 60±50 3 3 Avg – середнє; SD – середнє квадратичне відхилення 40 45 50 Ці результати показують, що біспецифічне антитіло за цим винаходом зв'язує людський IL17 і людський BAFF. Одночасне зв'язування IL-17 і BAFF Для визначення можливості одночасного зв'язування людського IL-17 і людського BAFF з біспецифічним антитілом застосовують апарат BIAcore 2000. За винятком зазначеного, все реагенти і матеріали закуповують від компанії BIAcore AB (Upsala, Швеція). Всі вимірювання здійснюють при температурі 25C. Буфер HBS-EP+ (150 мМ хлорид натрію, 3 мМ EDTA, 0,05 % (маса/об'єм) поверхнево-активної речовини Р-20 і 10 мМ HEPES, pH 7,4) використовують як протоковий буфер і буфер для зразка. Білок А іммобілізують на протокових кюветах 1 і 2 сенсорного чіпу CM4 з використанням набору для зв'язування аміну. Біспецифічне антитіло спочатку захоплюють на протоковій кюветі 2 з подальшим введенням людського IL-17 (20 нМ) протягом 5 хв для насичення сайту зв'язування IL-17. Після зв'язування IL-17 здійснюють введення людського BAFF (20 нМ) протягом 5 хв, і спостерігають додатковий сигнал зв'язування. Після цього поверхню чіпа регенерують з використанням 10 мМ розчину гліцину, 9 UA 113080 C2 5 рН 1,5. Повторюють той самий процес, за виключенням того, що порядок введення людського IL-17 і людського BAFF змінений на зворотній. Для забезпечення повного насичення біспецифічного антитіла людським IL-17 або людським BAFF обчислюють стехіометрію. Стехіометрія людського IL-17/біспецифічного антитіла, як правило, знаходиться на рівні приблизно 1,3, що базується на результатах експерименту з визначення кінетичних параметрів зв'язування. Аналогічно, стехіометрія людського BAFF/біспецифічного антитіла, як правило, знаходиться на рівні приблизно 1,0, що базується на результатах експерименту з визначення кінетичних параметрів зв'язування. Контрольним BAFF Ab є 4A5-3.1.1-В4 (патент США 7,317,089). Контрольним IL-17 Abє Fab 126 (патент США 7,838,638). 10 Таблиця 2: Одночасне зв'язування людського IL-17 і людського BAFF біспецифічним антитілом. Антитіло Біспецифічне Біспецифічне IL-17 Ab IL-17 Ab BAFF Ab BAFF Ab 15 20 25 30 35 40 45 50 Перша досліджувана речовина BAFF IL-17 BAFF IL-17 BAFF IL-17 Δ RU 22 15 0 16 33 0 Друга досліджувана речовина IL-17 BAFF IL-17 BAFF IL-17 BAFF Δ RU 11 23 32 0 0 32 Ці результати показують, що біспецифічне антитіло за цим винаходом може одночасно зв'язувати людський IL-17 і людський BAFF, як показано збільшенням резонансних одиниць (Δ RU) при зв'язуванні двох лігандів із біспецифічним антитілом. In vitro інгібування IL-17-індукованого продукування CXCL1 клітинами НТ-29 Клітини HT-29 являють собою епітеліальні клітини колоректальної аденокарциноми людини, які експресують рецептор IL-17 природним чином. Результатом інкубування клітин НТ29 з людським IL-17 є продукування CXCL1 (хемокіновий (C-X-C мотив) ліганд), рівні якого можуть бути визначені з використанням наявного у продажу ELISA. Оцінюють діапазон доз біспецифічного антитіла від 41200 пМ до 2,64 пМ (кінцева концентрація на основі молекулярної маси мономерного біспецифічного антитіла (=100 кДа)). Після цього в лунки, які вміщують рекомбінантний IL-17 (кінцева концентрація IL-17 в лунках становить 3,75 нМ (на основі молекулярної маси мономерного IL-17 (=16 кДа)), додають біспецифічне антитіло (50 мкл) в кожній досліджуваній концентрації. Випробування проводять в трьох лунках на обробку. Для контрольних зразків "лише середовище" і "лише IL-17" використовують середовище для досліджень. При проведенні згаданого дослідження як позитивний контроль використовують IL-17-нейтралізуюче антитіло (Fab-126, патент США 7,838,638). Планшети, які вміщують суміші IL-17 і антитіла, інкубують протягом 60-90 хв. при температурі 37C, відносній вологості 95 %, 5 % CO2, у оброблених культурою клітин тканини внутрішніх лунках 96-лункових планшетів. За одним із варіантів цього дослідження додають насичувальну концентрацію людського BAFF (1,25 нМ кінцева концентрація на основі молекулярної маси мономерного BAFF (=20 кДа)) з метою визначення того, чи біспецифічне антитіло все ще буде здатним нейтралізувати IL-17, будучи одночасно зв'язаним з BAFF. Клітини HT-29 за встановленою практикою культивують в середовищі для аналізів (середовище МакКоя 5А, яке містить 10 % FBS (сироватка плода корови), пеніцилін G (0,2 Од/мл) і стрептоміцин (0,2 мкг/мл)). В день дослідження клітини промивають HBSS, і відокремлюють від колб для культивування сумішшю трипсину та EDTA. Трипсин інактивують середовищем для дослідження. Після цього клітини HT-29 центрифугують при 500g протягом 5 хв. при кімнатній температурі. Дебріс ресуспендують в середовищі для дослідження. Густину клітин вимірюють із застосуванням гемоцитометра, і 20000 клітин НТ-29 (в 100 мкл) додають в 96-лункові планшети, які вміщують суміші антитіла/IL-17. До кожної з невикористаних крайових лунок (без клітин) додають 200 мкл PBS, щоб зменшити вплив крайок в результаті випаровування. 96-лункові планшети поміщають в термостат для тканинних культур (температура 37C, відносна вологість 95 %, 5 % CO2) на приблизно 48 год. Наприкінці дослідження планшети центрифугують (500g протягом 5 хв. при кімнатній температурі), і середовище для культури клітин переносять в поліпропіленові 96-лункові планшети, які герметизують і заморожують при температурі -80C. В день вимірювання CXCL1 із застосуванням ELISA, планшети розморожують при кімнатній температурі. Рівні CXCL1 в середовищі (в нерозбавленому вигляді або розбавленому 1:3) вимірюють із застосуванням 10 UA 113080 C2 5 10 15 20 25 30 35 40 45 50 55 60 CXCL1 сендвіч-ELISA (R&D Systems DuoSet № DY275), відповідно до інструкцій виробника, використовуючи такі буфери і модифікації: промивний буфер 1 ELISA від компанії BioFX Labs (від 10, № WSHW-1000-01); зразок і стандартний об'єм 50 мкл на лунку; субстрат від компанії BioFX Labs (однокомпонентний HRP (пероксидаза хрону) субстрат, № TMBW-1000-01); розчин для гальмування реакції від компанії BioFX Labs (№ LSTP-1000-01; 100 мкл на лунку). Наприкінці реакції ELISA планшети зчитують при 450 нм на мікропланшет-рідері (Spectramax 190, Molecular Devices). Дані збирають як відсотки від максимальної кількості продукованого CXCL1 (тільки IL-17 становить 100 %). Концентрацію, при якій 50 % IL-17-індукованої реакції інгібується (IC50) біспецифічним антитілом або позитивним контролем, обчислюють з використанням 4-параметричної сигмоїдальної підгонки даних (GraphPad Prism). Результати показують, що біспецифічне антитіло за цим винаходом інгібує IL-17-індуковану секрецію CXCL1 клітинами НТ-29 в залежності від концентрації. Інгібування у цьому разі є порівнянним з інгібуванням, яке спостерігається з позитивним контрольним антитілом (при IC 50 для біспецифічного антитіла 2,000,21 нМ в порівнянні з 1,860,22 нМ для позитивного контрольного антитіла (середнє 3 незалежних експериментів SEM (середня квадратична помилка середнього))), тоді як негативне контрольне антитіло не інгібує проліферацію. Більш того, подібне інгібування спостерігається у присутності насичувальної кількості BAFF, при IC 50 для біспецифічного антитіла 1,570,45 нМ в порівнянні з 1,410,50 нМ для позитивного контрольного антитіла (середнє 3 незалежних експериментів SEM). Біспецифічне антитіло за цим винаходом ефективно нейтралізує IL-17, і на це нейтралізування не впливає присутність насичувальних кількостей BAFF. In vitro інгібування BAFF-індукованої проліферації клітин T1165 T1165.17 являє собою лінію клітин плазмоцитоми мишей, виживання і ріст якої залежить від зовнішніх чинників (IL-1 бета або BAFF). Ці клітини природним чином експресують рецептор BAFF, і їх реакцію на людський BAFF вимірюють шляхом моніторингу проліферації. Діапазон доз біспецифічного антитіла від 1 нМ до 4,1 пМ (кінцева концентрація на основі молекулярної маси мономерного біспецифічного антитіла (=100 кДа)) оцінюють за здатністю нейтралізувати розчинний BAFF (кінцева концентрація розчинного BAFF в дослідженні становить 150 пМ на основі молекулярної маси мономерного BAFF (=20 кДа)). Біспецифічне антитіло у різних концентраціях інкубують з розчинним BAFF протягом 30-60 хв при температурі 37C у внутрішніх лунках плоскодонного 96-лункового планшета для культури клітин тканини в загальному об'ємі 50 мкл. При проведенні згаданого дослідження як позитивний контроль використовують BAFF-нейтралізуюче антитіло (4A5-3.1.1-В4, патент США № 7,317,089). Випробування за кожних умов здійснюють тричі. За одним із варіантів цього дослідження випробують здатність біспецифічного антитіла нейтралізувати мембранний BAFF. Біспецифічне антитіло у різних концентраціях інкубують з мембранною фракцією клітин HEK293, які експресують нерозщеплювану форму BAFF (одержують шляхом мутації сайту розщеплення фурину BAFF, результатом чого є постійна експресія BAFF на клітинній мембрані). За іншим варіантом цього дослідження додають насичувальну концентрацію людського IL-17 (15,6 нМ кінцева концентрація на основі молекулярної маси мономерного IL-17 (=16 кДа)) з метою визначення того, чи біспецифічне антитіло все ще буде здатним нейтралізувати розчинний або мембранний BAFF, будучи одночасно зв'язаним з IL-17. Клітини T1165 за звичайною практикою культивують в середовищі для дослідження -5 (RPMI1640, що містить 10 % FBS, HEPES, L-глутамін, 1 мМ піруват натрію, 510 М 2меркаптоетанол, 1 антибіотик-протигрибковий препарат), доповненому 2 нг/мл рекомбінантного людського IL-1бета. В день дослідження клітини тричі промивають 5 середовищем для аналізу, і ресуспендують (110 клітин/мл) в середовищі для дослідження. В 96-лунковий планшет, що містить суміш антитіла і BAFF, додають 50 мкл клітинної суспензії. До кожної з невикористаних крайових лунок (без клітин) додають 100 мкл середовища для аналізу, щоб зменшити вплив крайок в результаті випаровування. Планшети вміщують в термошафу для тканинних культур (температура 37C, відносна вологість 95 %, 5 % CO2) на приблизно 44 год. Наприкінці дослідження в кожну лунку додають 20 мкл водного розчину Promega Cell Titer 96 Aqueous One Solution, і інкубують протягом 1-4 год. при температурі 37C. Планшети зчитують при 490 нм на мікропланшет-рідері (Spectramax 190, Molecular Devices). Дані збирають як відсоток інгібування, використовуючи лунки без BAFF як мінімальні, а лунки з 150 пМ BAFF як максимальні відповіді. Концентрацію з 50 % інгібуванням (IC50) BAFF-індукованої відповіді біспецифічним антитілом або позитивним контролем обчислюють із застосуванням 4параметричної сигмоїдальної підгонки даних (SigmaPlot). Результати показують, що біспецифічне антитіло інгібує BAFF-індуковану проліферацію клітин T1165 в залежності від концентрації. Інгібування у цьому разі є порівнянним з 11 UA 113080 C2 5 10 15 20 25 30 інгібуванням, яке спостерігається з позитивним контрольним антитілом (при IC50 для біспецифічного антитіла 0,0640,021 пМ в порівнянні з 0,0710,002 пМ для позитивного контрольного антитіла (середнє 2 незалежних експериментів SEM (середня квадратична помилка середнього))), в той час як негативне контрольне антитіло не інгібує проліферацію. Більш того, подібне інгібування спостерігається у присутності насичувальної кількості IL-17, при IC50 для біспецифічного антитіла 0,0600,014 пМ в порівнянні з 0,0730,012 пМ для позитивного контрольного антитіла (середнє 2 незалежних експериментів SEM). Біспецифічне антитіло ефективно нейтралізує BAFF, і на це нейтралізування не впливає присутність насичувальних кількостей IL-17. Демонструється також здатність біспецифічного антитіла інгібувати проліферацію клітин T1165, індуковану зв'язаним з мембраною BAFF. Біспецифічне антитіло за цим винаходом ефективно інгібує проліферацію, індуковану зв'язаним з мембраною BAFF аналогічно позитивному контрольному BAFF антитілу (4A5-3.1.1-В4, патент США № 7,317,089). Більш того, подібне інгібування спостерігається у присутності насичувальної кількості IL-17. In vivo інгібування продукування CXCL1, індукованого людським IL-17 Ін'єкція людського IL-17 призводить до швидкого і минущого підвищення рівня мишачого CXCL1 у системі кровообігу. Звичайним мишам-самицям лінії C57BL6 (n=8 на групу) підшкірно вводять біспецифічне антитіло (66 мкг на мишу), або позитивне контрольне анти-IL-17 антитіло (Fab 126, патент США № 7,838,638, 50 мкг на мишу), або негативне контрольне антитіло (huIgG4, 50 мкг на мишу). Через два дні мишам вводять людський IL-17 (разова внутрішньоочеревинна ін'єкція, 3 мкг на мишу), через 2 год. сироватку збирають, і зберігають при температурі -80C до проведення дослідження. Концентрацію CXCL1 визначають із застосуванням ELISA. Титраційні мікропланшети сенсибілізують антитілом, яке захоплює людський Fc (Jackson ImmunoResearch 109-005-098, 1 мкг/мл), і інкубують протягом ночі при температурі 4C. Планшети промивають, блокують казеїном, і додають 100 мкл сироватки (розведення 1:1000). Планшети інкубують протягом 2 год. при кімнатній температурі, промивають, і додають мічене HRP (пероксидаза хрону) ідентифікуюче антитіло (анти-людський IgG, Jackson ImmunoResearch 709-035-149). Планшети інкубують протягом 1 год. при кімнатній температурі, промивають, проявляють з використанням субстрату ТМВ (3,3,5,5тетраметилбензидин), і зчитують із застосуванням планшет-рідера. Концентрацію обчислюють, базуючись на відповідних стандартних кривих. Таблиця 3: IL-17-індуковані рівні CXCL1 під впливом біспецифічного антитіла Введене антитіло Негативний контроль PBS Негативний контроль IL-17 Позитивний контроль IL-17 Біспецифічне антитіло IL-17 Середнє пг CXCL1/мл 45,06 1071,17 482,73 387 Середня квадратична помилка середнього p-значення 45,06 141,67 263,7 175,11
ДивитисяДодаткова інформація
Назва патенту англійськоюAnti-baff-anti-il-17 bispecific antibodies
Автори англійськоюAllan, Barrett, Benschop, Robert Jan, Lu, Jirong
Автори російськоюАллан Барретт, Бэнсоп Роберт Ян, Лу Цзижон
МПК / Мітки
МПК: C07K 16/46, C07K 16/24, A61K 39/395, C07K 16/28
Мітки: біспецифічне, антитіло, зв'язується, яке, специфічно
Код посилання
<a href="https://ua.patents.su/23-113080-bispecifichne-antitilo-yake-specifichno-zvyazuehtsya-z-il17-ta-baff.html" target="_blank" rel="follow" title="База патентів України">Біспецифічне антитіло, яке специфічно зв’язується з il17 та baff</a>
Попередній патент: Пристрій для транспортування та очистки коренебульбоплодів
Наступний патент: Суха будівельна суміш для улаштування підлоги
Випадковий патент: Плющилка зерна