Антимікробний білок, рекомбінантна днк, що містить послідовність, яка кодує антимікробний білок, антимікробна композиція
Номер патенту: 41278
Опубліковано: 17.09.2001
Автори: Міккельсен Йорн Далгор, Нієльсен Клаус К., Бойсен Кірстен, Крагх Карстен М., Нієльсен Йохн Є.
Формула / Реферат
1. Антимикробный белок, отличный от хитиназ и глюканаз, выделенный из сахарной свеклы, где указанный белок выбран из группы, состоящей из:
и
или их функционально эквивалентных аналогов в который одна или несколько аминокислот добавлены, заменены или удалены с существенным сохранением антимикробной активности белка, или смесей таких белков или аналогов, или где указанный белок состоит из
или
или
или их функционально эквивалентный аналог, в которых одна или несколько аминокислот добавлены, заменены или удалены с существенным сохранением антимикробной активности белка, или смесей таких белков или аналогов.
2. Антимикробный белок по п. 1, отличающийся тем, что выделен из сахарной свеклы, которая инфицирована грибком рода Cercospora.
3. Антимикробный белок по п. 1, отличающийся тем, что выбран из группы белков, приведенных в
и
или их функционально эквивалентных аналогов в который одна или несколько аминокислот добавлены, заменены или удалены с существенным сохранением антимикробной активности белка, или смесей таких белков или аналогов.
4, Антимикробный белок по п.3, отличающийся тем, что состоит из
или
или
или их функционально эквивалентных аналогов в которых одна или несколько аминокислот добавлены, заменены или удалены с существенным сохранением антимикробной активности белка, или смесей таких белков или аналогов.
5. Антимикробный белок по.п.1, отличающийся тем, что имеет аминокислотную последовательность, по крайней мере, на 55% сходную с последовательностями белков, охарактеризованных в пп.1, 2, З или 4.
6. Антимикробный белок по любому из пп.1, 2, 3, 4 или 5, отличающийся тем, что
дополнительно содержит белок, которий является основным контрагентом кислых белков группы 4, ассоциированных с патогенезом, где
указанный белок, который является основным контрагентом указанных ассоциированных с патогенезом белков, представляет собой связывающий хитин белок WIN, содержащий аминокислотную последовательность, приведенную в
или его функционально эквивалентный аналог, в котором одна или несколько аминокислот добавлены, заменены., или удалены с существенным сохранением антимикробной или хитин -связывающей активности белка.
7. Рекомбинантная ДНК, содержащая последовательность, кодирующую антимикробный белок, отличный от хитиназ и глюканаз и выделенный из сахарной свеклы, где указанная последовательность гибридизуется с ДНК, содержащей последовательность, кодирующую белок, охарактеризованный в любом из п.п. 1-4 при температуре от 50°С до 60°С в 2х цитратном буфере (SSC), содержащем 0,1% ДСН, с последующим промыванием при той же температуре в 0,5х буфере SSC, содержащем 0,1% ДСН.
8. Рекомбинантная ДНК по п.7, отличающаяся тем, что содержит нуклеотидную последовательность, выбранную из группы, состоящей из SEQ ID No.1
или содержит нуклеотидную последовательность, гибридизующуюся с любой из нуклеотидных последовательностей, приведенных выше, при температуре от 50°С до 60°С в 2х нитратном буфере (SSC), содержащем 0,1% ДСН, с последующим промыванием при той же температуре в 0,5х буфере SSC, содержащем 0,1% ДСН.
9. Рекомбинантная ДНК по п. 7 или 8, отличающаяся тем, что дополнительно содержит последовательность ДНК, кодирующую белок, который является основным контрагентом кислых белков группы 4, ассоциированных с патогенезом, где указанный белок, который является основным контрагентом указанных ассоциированных с патогенезом белков, представляет собой связывающий хитин белок WIN, содержащий аминокислотную последовательность, приведенную
в
10. Антимикробная композиция, содержащая один или несколько антимикробных белков по любому из пп.1-6,отличных от хитиназ и глюканаз, выделенных из сахарной свеклы.
Текст
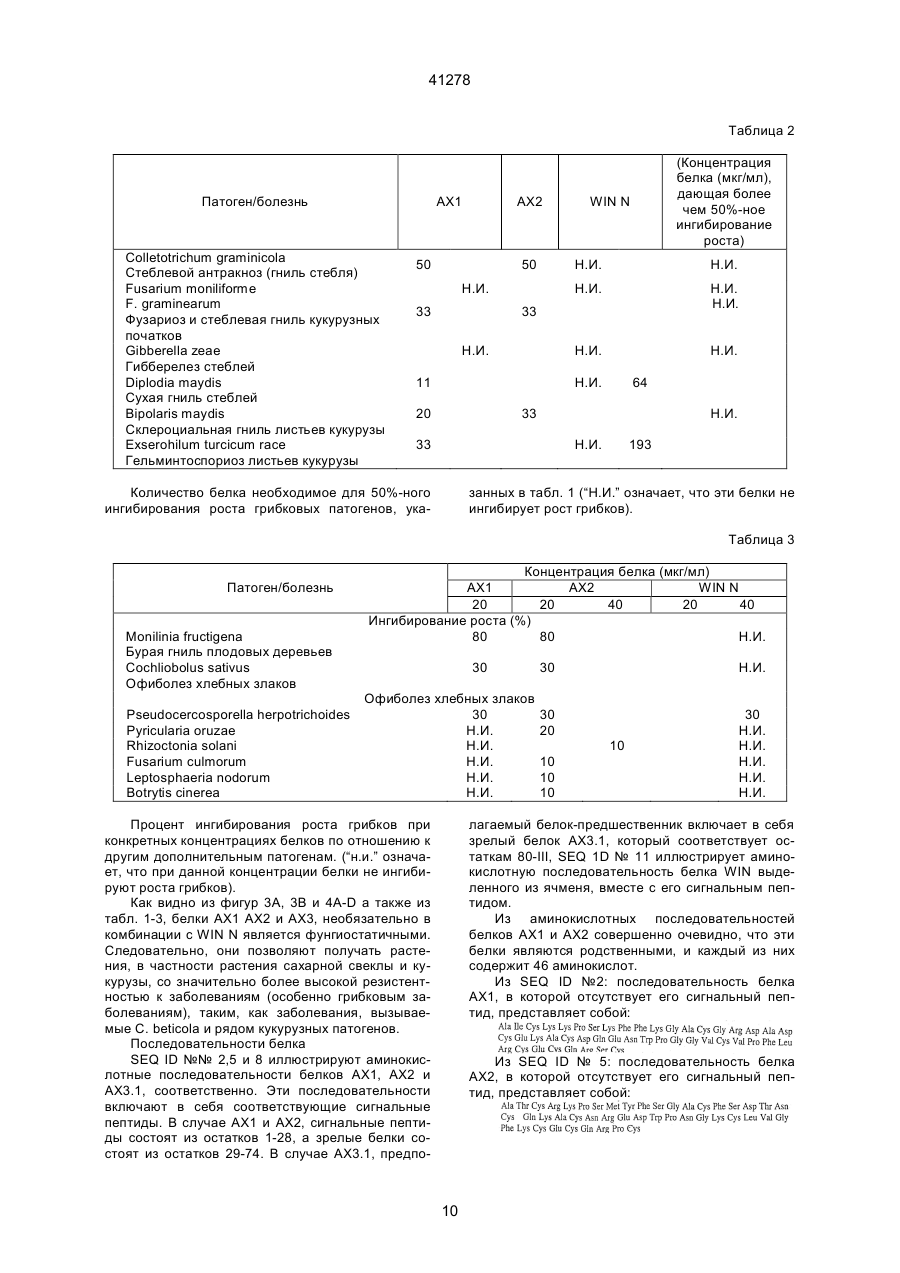
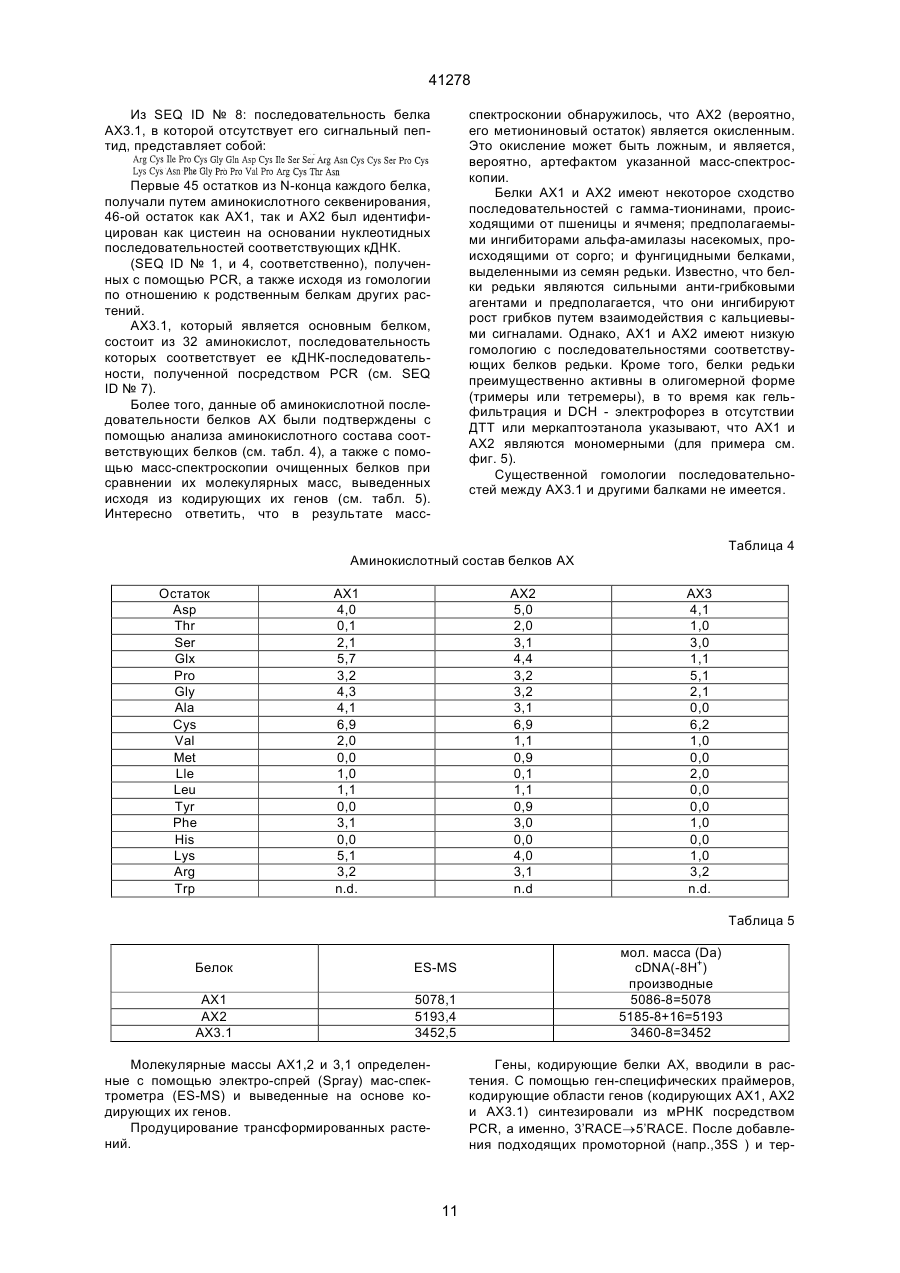
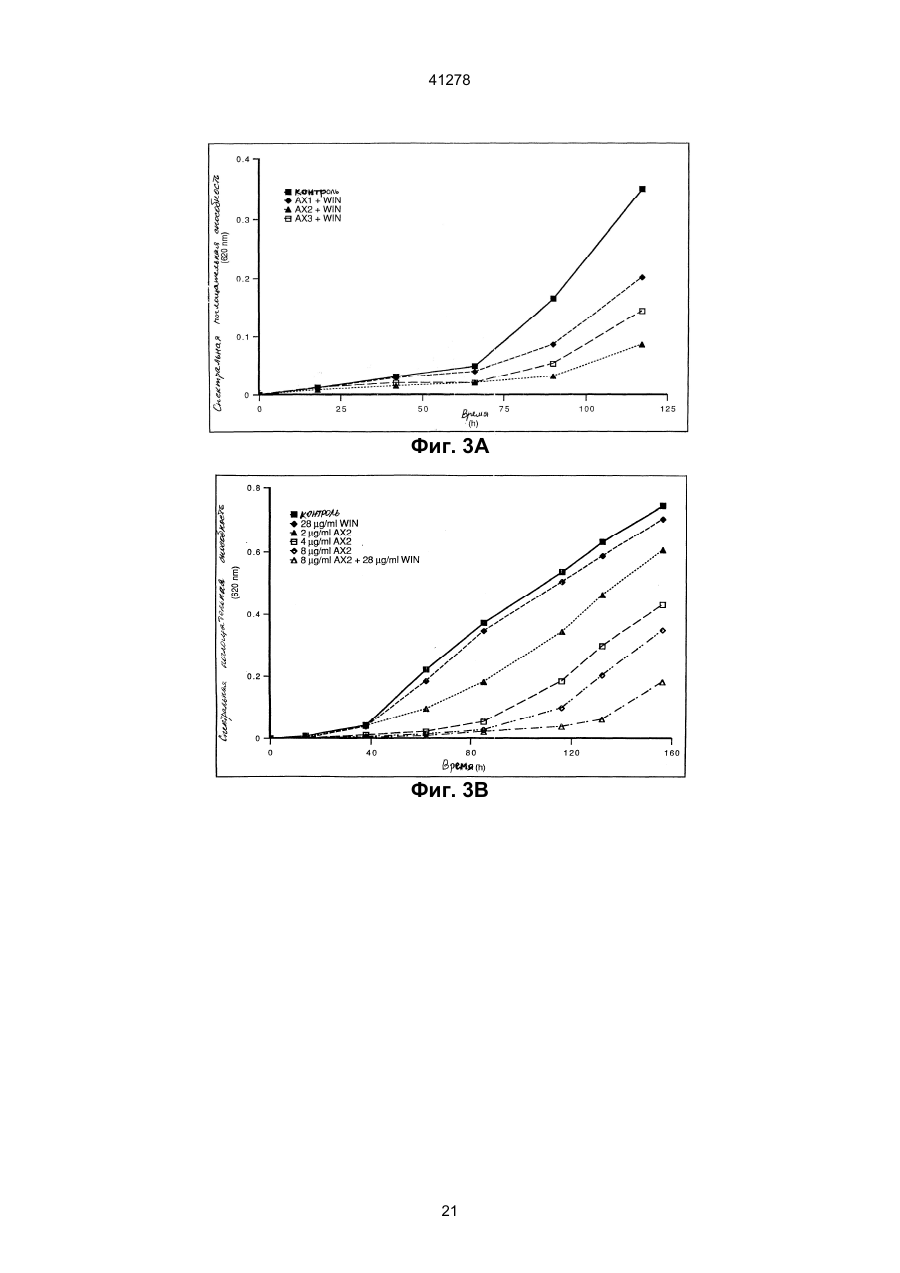
1. Антимикробный белок, отличный от хитиназ и глюканаз, выделенный из сахарной свеклы, где указанный белок выбран из группы, состоящей из C2 (54) АНТИМІКРОБНИЙ БІЛОК, РЕКОМБІНАНТНА ДНК, ЩО МІСТИТЬ ПОСЛІДОВНІСТЬ, ЯКА КОДУЄ АНТИМІКРОБНИЙ БІЛОК, АНТИМІКРОБНА КОМПОЗИЦІЯ или их функционально эквивалентных аналогов, в которых одна или несколько аминокислот добавлены, заменены или удалены с существенным сохранением антимикробной активности белка, или смесей таких белков или аналогов. 41278 4. Антимикробный белок по п. 3, отличающийся тем, что состоит из щий аминокислотную последовательность, приведенную в или или или его функционально эквивалентный аналог, в котором одна или несколько аминокислот добавлены, заменены или удалены с существенным сохранением антимикробной или хитинсвязывающей активности белка. 7. Рекомбинантная ДНК, содержащая последовательность, кодирующую антимикробный белок, отличный от хитиназ и глюканаз и выделенный из сахарной свеклы, где указанная последовательность гибридизуется с ДНК, содержащей последовательность, кодирующую белок, охарактеризованный в любом из пп. 1-4, при температуре от 50°С до 60°С в 2х цитратном буфере (SSC), содержащем 0,1% ДСН, с последующим промыванием при той же температуре в 0,5х буфере SSC, содержащем 0,1% ДСН. 8. Рекомбинантная ДНК по п. 7, отличающаяся тем, что содержит нуклеотидную последовательность, выбранную из группы, состоящей из или их функционально эквивалентных аналогов, в которых одна или несколько аминокислот добавлены, заменены или удалены с существенным сохранением антимикробной активности белка, или смесей таких белков или аналогов. 5. Антимикробный белок по п. 1, отличающийся тем, что имеет аминокислотную последовательность, по крайней мере, на 55% сходную с последовательностями белков, охарактеризованных в пп. 1, 2, 3 или 4. 6. Антимикробный белок по любому из пп. 1, 2, 3, 4 или 5, отличающийся тем, что дополнительно содержит белок, который является основным контрагентом кислых белков группы 4, ассоциированных с патогенезом, где указанный белок, который является основным контрагентом указанных ассоциированных с патогенезом белков, представляет собой связывающий хитин белок WIN, содержа 2 41278 и 3 41278 или содержит нуклеотидную последовательность, гибридизующуюся с любой из нуклеотидных последовательностей, приведенных выше, при температуре от 50°С до 60°С в 2х цитратном буфере (SSC), содержащем 0,1% ДСН, с последующим промыванием при той же температуре в 0,5х буфере SSC, содержащем 0,1% ДСН. 9. Рекомбинантная ДНК по п. 7 или 8, отличающаяся тем, что дополнительно содержит последовательность ДНК, кодирующую белок, который является основным контрагентом кислых белков группы 4, ассоциированных с патогенезом, где указанный белок, который является основным контрагентом указанных ассоциированных с патогенезом белков, представляет собой связывающий хитин белок WIN, содержащий аминокислотную последовательность, приведенную в 10. Антимикробная композиция, содержащая один или несколько антимикробных белков по любому из пп. 1-6, отличных от хитиназ и глюканаз, выделенных из сахарной свеклы. Антимикробный белок, рекомбикантная ДНК, содержащая последовательность, кодирующую ан тимикробный белок, антимикробная композиция, сожержащая один или несколько антимикробных белков. Настоящее изобретение относится к антимикробным белкам, выделенным из сахарной свеклы. К антимикробным белкам относится белок (взятый отдельно или в комбинации с другими материалами), который при любых обстоятельствах является токсичным или обладает ингибирующим действием по отношению к любому микроорганизму, включая бактерии, вирусы, а особенно, грибки. Такими антимикробными белками являются белки, антимикробная активность которых проявляется при их контакте с микроорганизмом, а также белки, которые являются антимикробными вследствие их ассимиляции или преобразования в процессе дыхания микроорганизма. Настоящее изобретение относится к антимикробным белкам, выделенным из сахарной свеклы, за исключением хитиназ и глюканаз. При этом, предпочтительно, чтобы эта сахарная свекла была инфицирована грибком рода Cercospora а особенно предпочтительно, чтобы указанные белки были выделены из листьев сахарной свеклы, инфицированной Cercospora betikola. Нестоящее изобретение также относится к очищенному белку, выбранному из белков, последовательности которых изображены в SEQ 1D №№ 2,5 и 8, либо к его Функционально эквивалентному аналогу, в котором были добавлены, заменены или удалены одна или несколько аминокислот без существенного снижения его анти микробной активности; либо к смесям указанных белков или аналогов. Настоящее изобретение также относится к очищенному белку, состоящему из аминокислотных остатков 80-111 последовательности SEQ 1D 8, или остатков 29-74 последовательности SEQ 1D № 2, или последовательности SEQ 1D № 5, либо к его функционально эквивалентному аналогу, в котором были добавлены, заменены или удалены одна или несколько аминокислот без сущест-венного снижения его антимикробной активности; либо к смесям указанных белков или аналогов. В дальнейшем, белки, имеющие аминокислотные последовательности, состоящие из остатков 29-74 в SEQ 1D №№ 2 и 5, будут обозначаться АХ1 и АХ2, соответственно, а белок, имеющий аминокислотную последовательность, состоящую из остатков 80-111 в SEQ 1D № 8, будет обозначаться АХ3.1. Инфицирование растений грибковыми или вирусными патогенами может индуцировать синтез около 10 семейств гомологичных связанных с патогенезом белков (PR-белков) в растительных тканях. Указанные PR-белки были разделены на 5 групп. Например, к группам PR-2, PR-3, и PR-5 относятся такие белки, как 1,3-глюканаза, хитиназы, и таумаин-подобные белки, соответственно. Белкам групп PR-1 и PR-4 не отводится какойлибо специфической функциональной роли. Белки группа PR-4 аналогичны С-концевым доменам прогевеина и предполагаемым белкам картофеля, связанным с нарушением целостности тканей (WIN), то есть, белкам, в которых отсутствует N концевой домен гевеина. Таким образов, понятие “основный эквивалент кислотных патогенез 4 41278 ассоциированных белков группы 4" означает основный аналог белков, аналогичных С-концевым доменам предшественника гевеина (прогевеина) и предполагаемым белкам картофеля WIN связанные с нарушением целостности тканей. Предпочтительно, если указанным основным аналогов белков, ассоциированных с патогенезом, является WIN-белок, связывающийся с хитином; а наиболее предпочтительно, если таким основным аналогом является белок, который может быть выделен из семян ячменя или из листьев ячменя, выращиваемого в условиях стресса. В предпочтительном варианте своего осуществления, настоящее изобретение относится к одному или нескольким из вышеуказанных белков или их аналогам в сочетании с белком, представляющим собой основный эквивалент кислотных ассоциированных с патогенезом белков группы 4, а в частности, WIN-белок, связывающийся с хитинов, и состоящий из аминокислотной последовательности, показанной в SEQ ID № 11, или его функционально эквивалентный аналог, в последовательности которого были добавлены, заменены, или удалены одна или несколько аминокислот без значительного снижения антимикробной и/или хитин-связывающей активности данного белка. Кроме того, настоящее изобретение относится к вышеописанным белкам, которые могут быть синтезированы in vitro на основании имеющихся данных о их аминокислотных последовательностях. Настоящее изобретение также относится к очищенным белкам, имеющим аминокислотную последовательность, которая, по крайней мере, на 55% имеет сходство с одной из последовательностей белков АХ настоящего изобретения. При этом предпочтительно, чтобы степень указанного сходства составляла, по крайней мере, 60%, более предпочтительно, - по крайней мере, 70%, а наиболее предпочтительно, чтобы степень этого сходства составляла, по крайней мере, 80%. В контексте настоящего описания подразумевается, что две аминокислотные последовательности имеют, по крайней мере, 55% сходства между собой, если в этих последовательностях имеется, по крайней мере, 55% идентичных или аналогичных аминокислотных остатков в том же самом положении; причем, в оптимальном варианте, это сходство, при сравнительном анализе первичной структуры, допускает наличие до 4 пробелов, при условии, что в целом затрагивается не более 10 аминокислотных остатков. При этом, в целях настоящего изобретения, принимается, что: Аланин, серин и треонин являются аналогичными. Глутаминовая кислота и аспарагиновая кислота являются аналогичными. Аспарагин и глутамин являются аналогичными. Аргинин и лизин являются аналогичными. Изолейцин, лейцин, метионин и валин являются аналогичными. Фенилаланин, тирозин и триптофан являются аналогичными. Настоящее изобретение также относится к рекомбинантным ДНК, имеющим, например, одну из последовательностей, изображенных в SEQ 1D № 1, 3, 4, 6, 7 или 9, и кодирующих один или несколько из вышеуказанных антимикробных белков или их аналогов. Последовательностью рекомби нантной ДНК может быть, но необязательно, последовательность, кодирующая белок, который представляет собой основный эквивалент кислотных патогенез-ассоциированных белков группы 4, описанных выше. Кроме того, настоящее изобретение относится к ДНК-последовательности, которая в жестких условиях гибридизации, способна гибридизироваться с ДНК-последовательностью, описанной в предыдущем абзаце. Понятие "жесткие условия гибридизации" означает такие условия, при которых гибридизацию осуществляют при 50-60°С в 2Х цитратно-солевом буфере, содержащем 0,1% ДСН, с последующим обыкновенным прерыванием при той жe температуре, но с использованием буфера, который имеет более низкую концентрацию SSC и не влияет на гибридизацию, если она имеет место. В качестве буферов с пониженной концентрацией SSС могут служить, соответственно: (a) I x SSC 0,1% ДСН; или (в) 0,5 x SS С, 0,1 ДСН; или (с) 0,1 x SS С, 0,1% ДСН. Настоящее изобретение также относится к вектору, содержащему указанные последовательности рекомбинантной ДНК. Эти последовательности находятся под контролем соответствующих промотора и терминатора, включая промотор и терминатор, регулирующие транскрипцию термолабильных белков. Кроме того, настоящее изобретение относится к биологической системе, в частности, к растению или микроорганизму, которые содержат вышеуказанную ДНК, или способны к экспрессии этой ДНК. Настоящее изобретение также относится к растениям, трансформированным указанной рекомбинантной ДНК. Способы получения таких растений хорошо известны специалистам, и включают в себя регенерацию растительных клеток или протопластов, трансформированных с использованием ДНК настоящего изобретения в соответствии с известными методами (такими, как использование плазмид агробактерий Tі и Rі, электропорация, микроинъекция, микровыстреливание с использованием специального ружья и т.п.). В некоторых случаях, если это необходимо, трансформированные клетки могут быть регенерированы в целые растения, в которых рекомбинантная ДНК является стабильно внедренной в геной. Таким способом могут быть получены как однодольные, так и двудольные растения, хотя, следует отметить, что двудольные растения гораздо легче подвергаются регенерации. В соответствии с настоящим изобретением, примерами растений, подходящих для генетической модификации, являются плодовые растения, например, томаты, манго, персики, яблони, груши, клубника, бананы, и дыни; полевые культуры, например, canola подсолнечник, табак, сахарная свекла, мелкозерные злаки, такие, как пшеница, ячмень, и рис, кукуруза, и хлопчатник; а также овощные культуры, такие, как картофель, морковь, латук-салат, капуста и лук. Особенно предпочтительными растениями являются сахарная свекла и кукуруза. Указанные растения могут быть трансформированы с помощью рекомбинантной ДНК-последовательности, включающей в себя область, ко 5 41278 дирующую белок АХ1 (остатки 29-74 в SEQ ID № 2), или его функционально эквивалентный аналог, в котором одна или несколько аминокислот добавлены, заменены или удалены без значительного снижения его антимикробной активности; либо с помощью рекомбинантной ДНК-последовательности, включающей в себя область, кодирующую белок АХ2 (остатки 29-74 в SEQ ID № 5), или его функционально эквивалентный аналог, в котором одна или несколько аминокислот добавлены, заменены, или удалены без значительного снижения его антимикробной активности; либо с помощью рекомбинантной ДНК-последовательности, включающей в себя область, кодирующую белок АХ3.1 (остатки 80-111 в SEQ ID № 8) или его функционально эквивалентный аналог, в которое одна или несколько аминокислот добавлены, заменены или удалены без значительного снижения его антимикробной активности; либо с помощью ДНК-последовательности, включающей в себя область, которая кодирует комбинацию из двух или нескольких указанных белков АХ или их аналогов. Настоящее изобретение также относится к растениям, трансформированным с помощью ДНК-последовательности; причем, оказанная ДНКпоследовательность, кроме того, кодирует белок, который представляет собой основный эквивалент кислотных, ассоциированных с патогенезом белков группы 4, а в частности, связывающийся с хитином белок WIN (остатки 22-146 в SEQ ID № 11), который может быть выделен из семян ячменя или листьев ячменя, находящихся в условиях стресса. Кроме того, настоящее изобретение относится к потомству оказанных трансформированных растений, обладающему способностью зкспрессировать указанные рекомбинантные ДНК-последовательности; а также к семенам указанных растений и их потомства. Настоящее изобретение также относится к белку, продуцируемому в результате экспрессии указанной рекомбинантной ДНК, например, к антимикробному белку, продуцируемому с помощью экспрессии рекомбинантной ДНК, содержащейся в указанном растении. Настоящее изобретение, кроме того, относится к антимикробной композиции, содержащей один или несколько антимикробных белков. Кроме того, настоящее изобретение относится к способу борьбы с грибками или бактериями, который заключается в том, что указанные грибки или бактерии подвергают воздействию антимикробных белков или композиции, содержащей эти белки. Настоящее изобретение также относится к способу экстракции антимикробных белков из содержащих эти белки органических материалов, а в частности, к способу, который заключается в том, что указанный материал подвергают мацерации и экстракции растворителем. Антимикробные белки могут быть затем последовательно очищены путем центрифугирования и хроматографии, например, такой как гидрофобная хроматография; атионообменная хроматография; катионообменная хроматография; гель-фильтрация; и обращеннофазовая хроматография. Предпочтительно, если указанную процедуру экстракции осуществляет на органическом материале, например, на листьях сахарной свеклы, инфицированной Cercospora beticola или микроорганизмом, содержащим рекомбинантную ДНК, последовательность которой кодирует антимикробный белок или его аналог согласно настоящему изобретение, либо такую рекомбинантную ДНК, которая, кроме того, включает в себя ДНК-последовательность, кодирующую белок, представляющий собой основный эквивалент кислотных связанных с патогенезом белков группы 4. При этом следует отметить, что антимикробный белок оказывает незначительное (если вообще оказывает) действие на микроорганизм, который является источником органического материала, определенного в предыдущем предложении. Для лучшего понимания изобретения, настоящее описание сопровождается нижеописанными списком последовательностей и рисунками. Описание рисунков. На фиг. 1 показана элюция белков AX1, AX2 и AX3 с катионной колонки Monоs при возрастающей концентрации хлорида натрия (пунктирная линия). На фиг. 2 показан окрашенный серебром полиакриламидный гель очищенных белков AX1, AX2, АХ3 и WIN подвергнутых электрофорезу в присутствии ДСН и восстанавливающего агента, дитиотреитола (ДТТ): низкомолекулярные маркерные белки изобретены в крайней правой и крайней левой дорожках геля, белок WIN был выделен из семян ячменя. На фиг. 3А и 3В показано противогрибковая активность белков AX1, AX2, и АХ3, каждый из которых использовался (но необязательно) в сочетании с белком WIN выделенным из семян ячменя. На фиг. 4 показана морфология С. beticola полученного в результате его обработки белком WIN при 28 мкг/мл (фиг. В); белком AX2 при 8 мкг/мл (фиг. С); и комбинацией AX2 при 8 мкг/мл и WIN при 28 мкг/мл (фиг. D). На фиг. 4А показана морфология С. beticola культивированного в отсутствии белков WIN и AX2. На фиг. 5 показан окрашенный серебром полиакриламидный гель очищенных белков AX1, AX2 и АХ3, подвергнутых электрофорезу в присутствии ДСН и в присутствии или отсутствии восстановительного агента дитиотреитола (ДТТ). В противоположность белкам AX1 и АХ2, электрофоретическая подвижность двух изоформ АХ3: AX3.1 и АХ3.2, в значительной степени зависит от присутствия ДТТ, что свидетельствует о том, что AX3.1 и АХ3.2, вероятно, присутствуют в виде димеров, если не тримеров. Относительно высокое фоновое окрашивание в геле, которое само по себе появляется по соседству с полосами белка в виде ярких пятен, обусловлено артефактным окислением белка в процессе электрофореза, тогда, как фоновое окрашивание верхних частей геля обусловлено артефактным окрашиванием ДТТ. Небольшой сдвиг кажущейся молекулярной массы для белков АХ1 и АХ2 в присутствии ДТТ, вероятно, обусловлен разворачиванием структуры белка, происходящие в результате разрыва внутримолекулярных дисульфидных связей, что приво 6 41278 дит к усилению связывания ДСН по сравнению с теми же белками, денатурированными ДСН в отсутствие ДТТ. Как и на фиг. 2, в гелях присутствуют низкомолекулярные маркерные белки (обозначенные на фигуре как LMW). Описание последовательностей SEQ 1D № 1 иллюстрирует РСR-генерированную кДНК-последовательность, кодирующую белок АХ1 вместе с его сигнальным пептидом. Инициирующий кодон для сигнального пептида соответствует нуклеотидам 40-42, а стоп-кодон для белка АХ1 соответствует положениям 262-264. SEQ 1D № 2 иллюстрирует аминокислотную последовательность белка АХ1 вместе с его сигнальным пептидом. Сигнальный пептид состоит из остатков 1-28, а зрелый белок состоит из остатков 29-74. SEQ 1D № 3 иллюстрирует РСR-генерированную кДНК-последовательность, включающую в себя SEQ 1D № 1, за исключением того, что фрагмент усиления трансляции (состоящий из нуклеотидов 13-79) расположен впереди инициирующего кодона (нуклеотиды 82-84) для сигнального пептида. Указанная последовательность содержит Р st I-рекстрикционный сайт (нуклеотиды 1-6) и BamHI-сайт (нуклеотиды 7-12). NcoI-сайт соответствует нуклеотидам 80-86. Стоп-кодон для белка АХ1 соответствует нуклеотидам 304-306. S all – и Sph1 - сайты рестрикции присутствуют в нуклеотидах 338-343 и 344-349, соответственно. SEQ 1D № 4 иллюстрирует РСR-генерированную кДНК-последовательность, кодирующую белок АХ2 вместе с его сигнальным пептидом. Инициирующий кодон для сигнального пептида соответствует нуклеотидам 53-55, а стоп-кодон для белка АХ2 соответствует нуклеотидам 275-277. SEQ 1D № 5 иллюстрирует аминокислотную последовательность белка АХ2 вместе с его сигнальным пептидом. Этот сигнальный пептид состоит из остатков 1-28, а зрелый белок состоит из остатков 29-74. SEQ 1D № 6 иллюстрирует РСR-генерированную кДНК-последовательность, включающую в себя SEQ 1D № 4, за исключением того, что фрагмент усиления трансляции (состоящий из нуклеотидов 13-79) расположен впереди инициирующего кодона (нуклеотиды 82-84) для сигнального пептида. Указанная последовательность содержит Pst-сайт рестрикции (нуклеотиды 1-6) и BamH1сайт рестрикций (нуклеотиды 7-12). Ncol-сайт соответствует нуклеотидам 80-86. Стоп-кодон для белка АХ2 соответствует нуклеотидам 304-306. Sall – и Shp1 -сайты рестрикции присутствуют в нуклеотидах 352-357 и 358-363, соответственно. SEQ 1D № 7 иллюстрирует PCR-генерированную кДНК-последовательность, кодирующую белок АХ3.1 вместе с предполагаемым его сигнальным пептидом. Инициирующий кодон для сигнального пептида соответствует нуклеотидам 2325, а стоп-кодон для белка АХ3.1 соответствует положениям 356-358. SEQ 1D № 8 иллюстрирует аминокислотную последовательность непроцессированного продукта трансляции, кодированного кдНК, имеющей. последовательность SEQ 1D № 7. Этот предполагаемый белок-предшественник включает в себя зрелый белок АХ3.1, соответствующий остаткам 80-111. SEQ 1D № 9 иллюстрирует РСR-генерированную кДНК-последовательность, включающую в себя SEQ 1D № 7 за исключением того, что фрагмент усиления трансляции (состоящий, из нуклеотидов 13-79) расположен перед инициирующим кодоном (нуклеотиды 82-84) для сигнального пептида. Указанная последовательность содержит. Pst1-cайт рестрикции (нуклеотиды. 1-6) и BamH1-сайт рестрикции (нуклеотиды 7-12). NcoIcaйт соответствует нуклеотидам 80-86. Стоп-кодон для белка АХ3.1 соответствует нуклеотидам 415-417. SaІl и Shp1-сайты рестрикции присутствует в нуклеотидах 473-478 и 479-484, соответственно. SEQ 1D № 10 иллюстрирует кДНК, содержащую ген, который кодирует белок WlN ячменя. SEQ 1D № 11 иллюстрирует аминокислотную последовательность белка WIN ячменя вместе и ее сигнальным пептидом. Этот сигнальный пептид состоит из остатков 1-21, а зрелый белок состоит из остатков 22-146. SEQ 1D № 12 иллюстрирует РСR-генерированную нуклеотидную последовательность белка WIN ячменя. 5’-область этой после-довательности содержит Pst1, BamH1 и Nco1-сайты рестрикции. В положении 62 исходного клона находится С, а не G, как показано ниже. Замена С на G но меняет аминокислотную последовательность белка, и была проведена для удаления Ncol-сайта в этом положении. Инициирующий кодон для белка WIN соответствует нуклеотидам 12-14, а стопкодон соответствует нуклеотидам 450-452. SEQ 1D № 13 иллюстрирует, в основном, нуклеотидную последовательность, показанную SEQ ID № 12, за исключением того, что фрагмент усиления трансляции (состоящий из нуклеотидов 1379 в ID № 13) расположен перед инициирующим кодоном (нуклеотиды 82-84) гена WlN Стоп-кодон соответствует нуклеотидам 520-522. Очистка белков АХІ-3 из листьев сахарной свеклы, инфицированной Cercospora beticola. АХІ-3 выделяли из листьев сахарной свеклы cvs Turbo или Rhizor естественным образом инфицированных C. beticola. Листья, имеющие 50 или более некротических поражений, собирали в поле (в Италии), и до экстракции хранили при 4°С. Все стадии осуществляли при 4°С. Во время процедуры очистки, центрифугирование проводили при 20000 г в течение 20 минут на центрифуге модели Centrikon H-40IB. Получение бесклеточных экстрактов. 2 кг C. beticola - инфицированных листьев сахарной свеклы гомогенизировали в 4 литрах Nацитратного буфера (рН 5,0), содержащего 1 мМ ДТТ, 1 мМ бензамидина (стартовый буфер), и 200 г Dowex 1х2 (размер сита 100 мкм). Перед центрифугированием, гомогенат отжимали через двойной слой найлонового газового материала (размер сита 31 мкм). Осаждение нагревом и сульфатом аммония. Супернатантную фракцию, полученную после центрифугирования, нагревали при 50°С в течение 20 минут; и после охлаждения до 4°С, осадок собирали путем центрифугирования и удаляли. К 7 41278 супернатанту добавляли твердый сульфат аммония до получения 30%-ного насыщения. После центрифугирования, осажденные белки растворяли в стартовом буфере (1 мл буфера на 10 г исходного материала). AXI, AX2 и АХЗ очищали из белковой фракции, осажденной сульфатом аммония. После солюбилизации, белковый раствор диализовали против 10 мМ Трис (РН 8,0), содержащего 1 мМ ДТТ и 1 мМ бензамидина. Денатурированные белки удаляли путем центрифугирования, а супернатант загружали в колонку быстрого действия с сафарозой Q (Fast Flow, 50 мл) и колонку с хитином (полученную как описано в W092/17591); причем, указанное колонки были соединены последовательно. До загрузки, колонки уравновешивали Триc-буфером. Несвязанные белки удаляли путем тщательного промывания Трио-буферов. Фракцию несвязанного белка (200 мл на один кг экстрагированного материала листьев) дополняли буфером Н: 1М сульфата аммония, 10% (по объему) глицерина, 1 мМ ДТТ, 0,1 M KH2PO4(рН 7,5). Раствор белка инкубировали с 50 мл .фенил-сефарозы (Pharmacia) в буфере Н, в течение 2 часов при комнатной температуре. Полученную суспензию загружали в верхнюю часть колонки, упакованной дополнительными 50 миллилитрами фенил-сефарозы, уравновешенной в буфере Н. Было обнаружено, что поток, идущий из колонки, содержал фунгицидную активность, тогда, как белки, элюированные с колонки буферов Н в отсутствие сульфата аммония, такой активности не показали. Все процедуры; по очистке осуществляли при 4°С, за исключением стадий с использованием фенил-сефарозы. Поток, идущий из колонки с фенил-сефарозой. (400 мл), обильно диализовали против 20 мМ ацетата натрия, I мМ ДТТ (рН 5,0), а затеи загружали в колонку с сефарозом СМ-СL6В (Pharmacia). Эту колонку промывали буфером 1:50 мМ ацетата натрия, 10% (по объему) глицерина, 1 мМ ДТТ (рН 5,0), а затем элюировали 0,25 M NаСІ в буфере I. Фракции, содержащие белок, собирали, и половину собранных фракций подвергали гель-фильтрации на колонке и Сефадексом G-75 (Pharmacia; 2,5х70 см), уравновешенной в 50 мМ MES (рН 6,0). 10 мл-фракции собирали. Фракции 26-30 обнаруживали высокую фунгицидную активность, и кроме того, содержали 5% (масс./объем) бетаина. Фракций 26-30 из колонки с Сефадексом С-75 подвергали ионообменной FPLC-хроматографии (быстрой хроматографии высокого разрешения) на катионообменной колонке (MonoS H/R 5/5; Pharmacia) уравновешенной в буфере А: 50 мМ MES при рН 6,0, содержащей 5% (масс./объем) бетаина. Связанные белки элюировали градиентом 0-0,3 М NаСІ в 15 мл буфера А. Элюировали три пика мажорного белка, все из которых содержали фунгицидную активность (фиг. 1). Указанные пики последовательно обозначены AХІ, AX2 и АХ3. Очистка белков WIN из ячменя. Белок WIN(WIN N) очищали из семян ячменя или из листьев ячменя, находящихся в условиях стресса, как описано Kragh et al. (Plant Sci. 71: 6568 (1990) или Hejgaard etal. (Febs Letter 307, 389392 (1992)). На фиг. 2 показан окрашенный серебром полиакриламидный ДСН гель белка WIN-N выделенного из семян ячменя, вместе с белками AХI, AX2 и АХ3, элюированными с колонки MonoS. Каждый из белков АХ элюировали в виде фракции, которая при электрофазе давала одну полосу (даже, если она была слегка смазана, как в случае белка АХ3). Секвенирование белков АХ. Каждый из белков АХ подвергали карбоксиметилированию и обращенно-фазовой ВЭЖХ на колонке (Supelco Inc; 150х4,6 мм) с Progel TSK. Октадецил-4PW. Система растворителей А содержала: 0,1% ТFА в воде, а система растворителей В содержала 0,1% ТFА в ацитонитриле, АХ1 и AX2 элюировали как одиночные симметричные пики, а АХ3 как два пика, причем, за мажорным пиком следует очень близко расположенный от него минорньй пик, что свидетельствует о том, что эти пики соответствуют формам АХ3.1 и АХ3.2. После этого, белки АХ1, AX2 и АХ3.1 секвенировали в соответствии со стандартными методами, хорошо известными специалистам. Антимикробная активность АХІ-АХ3. Степень ингибирования роста грибков измеряли с использованием 96-луночного планшета для микротитрования при 620 нм, в основном, так, как описано в WO/92/17591. Белки AXI, AX2 и AX3, взятые отдельно или в комбинации с WIN N (которые были очищены из семян ячменя или листьев ячменя в условиях стресса, как описано Hejgard et al. (FEBS Letters 307, 389-392 (1992)), инкубировали со спорами C. beticola. Смесь для анализа (240 мкл или 260 мкл) содержала 100 мкл бульона из картофельной декстрозы (Dufco) 40 мкл или 60 мкл образца белка (или буферного контроля) в 100 мМ Трис и 20 мМ NаСI (рН 8,0), и приблизительно 400 спор в 100 мкл воды. Планшеты для микротитрования герметично заклеивали липкой лентой во избежание испарения и загрязнения, а затем инкубировали при комнатной температуре на ротационном шейкере, работающим при 200 об/мин. Как показано на фиг. 3В, оптическую плотность при 620 нм измеряли каждый день в течение 8 дней, и для каждой концентрации белка строили график зависимости оптической плотности от времени. Затем определяли концентрацию (мкг белка/мл конечной аналитическое смеси), которая дает 50%-ное ингибирование роста через 72 часа, и эту концентрацию обозначали. Как видно из фиг. 3А и 3В, каждый из белков АХ способствует значительному снижению in vitro роста C. beticol. Противогрибковая активность белка AX2 была особенно явно выражена, то есть, 2 мкг/мл (около 0,5 мкМ) было достаточно, чтобы достичь 50%-ного ингибирования роста (I50) после 72 часового инкубирования. Белок WIN N взятый отдельно, обнаруживает умеренную противогрибковую активность при 160 мкг/мл (около 11 мкМ), необходимую для 50%-ного ингибирования C. Beticola после 72-часового инкубирования (данные не приводятся). Комбинация АХ2 и WIN N дает значительное и пролонгированное подавление роста грибков. Как видно из фиг. 3А, ингибирующая активность АХ2 против C. beticola выше, чем активность АХ1. 8 41278 АХ2 и WIN N по всей вероятности, не обладают фунгицидной активностью против C. beticola а скорее всего, они просто сильно замедляют скорость распространения гиф грибка, по сравнению с контролем. В результате обработки белками АХ2 и/или WIN N морфология грибков также заметно меняется (см. фиг. 4). Кроме того, белки АХ1, АХ2 и АХ3 (и их смеси) (необязательно в присутствии WIN N обнаруживают небольшое (если вообще обнаруживают), но значимое неблагоприятное действие на прорастстание пыльцы сахарной свеклы при использовании их в концентрации, которая является эффективной для борьбы против C. beticola что свидетельствует о том, что данные белки являются нетоксичными для клеток растения. Фунгицидная активность белков АХ против кукурузных патогенов. Белки АХ настоящего изобретения анализировали на их фунгицидную активность против ряда патогенов кукурузы. Анализ (результаты которого приводятся в табл. 1 и 2) белков АХ на их активность против патогенов кукурузы проводили следующим образов. 5 мкл раствора, содержащего балки в указанных концентрациях, в условиях требуемой асептики переносили в лунки стерильного круглодонного планшета для микротитрования. Все обработки делали в дубликате. Неинокулированную среду и инокулированную среду, но не содержащую раствора испытуемых белков, традиционно использовали как контрольные. В условиях асептики, к каждому образцу в 5,0 мклаликвоте бульона с двойной концентрацией картофельной декстрозы добавляли споры (100-150). После легкого размешивания для получения суспензии белкового образца и спор, место соединения планшета с крышечкой обертывали двойным слоем парафильма во избежание высыхания, и обернутый таким образом планшет инкубировали при 19±0,2°С и фотопериоде 16 час. Отдельные лунки оценивали на прорастание спор и рост мицелия каждые 24 часа. Через 120 часов определяли уровень противогрибковой активности. Результаты представлены в табл. 1 и 2. В табл. 1 показаны минимальные концентрации белка, необходимые для ингибирования роста грибков, в табл. 2 показаны концентрации белка, необходимые для 50%-ного ингибирования роста грибков по сравнению с контрольными культурами в которых грибки культивировались в отсутствие испытуемых белков. Таблица 1 Минимальная ингибирующая концентрация (мкг/мл) WIN N AX1 AX2 Н.И. 20 30 Патоген/болезнь Bipоlaris maydis Склероциальная гниль листьев кукурузы Cercospora zeae maydis Серая пятнистость листьев Colletotrichum graminicola Стеблевой антракноз Diplodia maydis Гниль початков и стеблей Exserohilum turcicum race 1 Гельминтоспориоз листьев кукурузы 1 Exserohilum turcicum race 2 Гельминтоспориоз листьев кукурузы 2 Fusarium graminearum Фузариоз и стеблевая гниль кукурузных початков Fusarium moniliforme Фузариоз и стеблевая гниль кукурузных початков Gibberella zeae Гибберелез стеблей Н.И. 50 50 11 ni 11 98 33 ni Н.И. 33 33 Н.И. Н.И. Н.И. Н.И. Н.И. Н.И. 64 Н.И. 193 Анализ белков AX и WlN N их ингибирующую активность по отношению к конкретным патогенам (результаты которого представлены в табл. 3) осуществляли следующим образом. Мицелий от рассматриваемых патогенов диспергировали в капле расплавленного агара, который затем отверждали. Твердые агаровые капли, содержащие инкапсулированный мицелий, затем покрывали испытуемым белком, взятом в определенном кон Н.И. Н.И. кретном количестве. После 5-дневного инкубирования в условиях влажности, определяли степень роста мицелия по сравнению с контролем, где агаровые капли, содержавшие мицелий грибка, не были покрыты испытуемым белком. Полученные результаты, представленные в таблице 3, указывают на количество белка, которое необходимо для 50%-ного Ингибирования роста грибковых патогенов. 9 41278 Таблица 2 Патоген/болезнь АХ1 Colletotrichum graminicola Стеблевой антракноз (гниль стебля) Fusarium moniliforme F. graminearum Фузариоз и стеблевая гниль кукурузных початков Gibberella zeae Гибберелез стеблей Diplodia maydis Сухая гниль стеблей Bipоlaris maydis Склероциальная гниль листьев кукурузы Exserohilum turcicum race Гельминтоспориоз листьев кукурузы АХ2 50 50 WIN N Н.И. Н.И. Н.И. Н.И. Н.И. Н.И. Н.И. 33 (Концентрация белка (мкг/мл), дающая более чем 50%-ное ингибирование роста) Н.И. 33 Н.И. 11 Н.И. 20 64 33 Н.И. 33 Н.И. Количество белка необходимое для 50%-ного ингибирования роста грибковых патогенов, ука 193 занных в табл. 1 (“Н.И.” означает, что эти белки не ингибирует рост грибков). Таблица 3 Патоген/болезнь Monilinia fructigena Бурая гниль плодовых деревьев Cochliobolus sativus Офиболез хлебных злаков Pseudocercosporella herpotrichoides Pyricularia oruzae Rhizoctonia solani Fusarium culmorum Leptosphaeria nodorum Botrytis cinerea Концентрация белка (мкг/мл) АХ1 АХ2 WIN N 20 20 40 20 40 Ингибирование роста (%) 80 80 Н.И. 30 Офиболез хлебных злаков 30 Н.И. Н.И. Н.И. Н.И. Н.И. Процент ингибирования роста грибков при конкретных концентрациях белков по отношению к другим дополнительным патогенам. (“н.и.” означает, что при данной концентрации белки не ингибируют роста грибков). Как видно из фигур 3А, 3В и 4А-D а также из табл. 1-3, белки AХ1 АХ2 и АХ3, необязательно в комбинации с WIN N является фунгиостатичными. Следовательно, они позволяют получать растения, в частности растения сахарной свеклы и кукурузы, со значительно более высокой резистентностью к заболеваниям (особенно грибковым заболеваниям), таким, как заболевания, вызываемые C. beticola и рядом кукурузных патогенов. Последовательности белка SEQ ID №№ 2,5 и 8 иллюстрируют аминокислотные последовательности белков АХ1, АХ2 и АХ3.1, соответственно. Эти последовательности включают в себя соответствующие сигнальные пептиды. В случае АХ1 и АХ2, сигнальные пептиды состоят из остатков 1-28, а зрелые белки состоят из остатков 29-74. В случае АХ3.1, предпо 30 Н.И. 30 20 30 Н.И. Н.И. Н.И. Н.И. Н.И. 10 10 10 10 лагаемый белок-предшественник включает в себя зрелый белок АХ3.1, который соответствует остаткам 80-ІІІ, SEQ 1D № 11 иллюстрирует аминокислотную последовательность белка WIN выделенного из ячменя, вместе с его сигнальным пептидом. Из аминокислотных последовательностей белков АХ1 и АХ2 совершенно очевидно, что эти белки являются родственными, и каждый из них содержит 46 аминокислот. Из SEQ ID №2: последовательность белка АХ1, в которой отсутствует его сигнальный пептид, представляет собой: Из SEQ ID № 5: последовательность белка АХ2, в которой отсутствует его сигнальный пептид, представляет собой: 10 41278 Из SEQ ID № 8: последовательность белка АХ3.1, в которой отсутствует его сигнальный пептид, представляет собой: спектросконии обнаружилось, что АХ2 (вероятно, его метиониновый остаток) является окисленным. Это окисление может быть ложным, и является, вероятно, артефактом указанной масс-спектроскопии. Белки АХ1 и АХ2 имеют некоторое сходство последовательностей с гамма-тионинами, происходящими от пшеницы и ячменя; предполагаемыми ингибиторами альфа-амилазы насекомых, происходящими от сорго; и фунгицидными белками, выделенными из семян редьки. Известно, что белки редьки являются сильными анти-грибковыми агентами и предполагается, что они ингибируют рост грибков путем взаимодействия с кальциевыми сигналами. Однако, АХ1 и АХ2 имеют низкую гомологию с последовательностями соответствующих белков редьки. Кроме того, белки редьки преимущественно активны в олигомерной форме (тримеры или тетремеры), в то время как гельфильтрация и DCН - электрофорез в отсутствии ДТТ или меркаптоэтанола указывают, что АХ1 и АХ2 являются мономерными (для примера см. фиг. 5). Существенной гомологии последовательностей между АХ3.1 и другими балками не имеется. Первые 45 остатков из N-конца каждого белка, получали путем аминокислотного секвенирования, 46-ой остаток как АХ1, так и АХ2 был идентифицирован как цистеин на основании нуклеотидных последовательностей соответствующих кДНК. (SEQ ID № 1, и 4, соответственно), полученных с помощью РСR, а также исходя из гомологии по отношению к родственным белкам других растений. АХ3.1, который является основным белком, состоит из 32 аминокислот, последовательность которых соответствует ее кДНК-последовательности, полученной посредством РСR (см. SEQ ID № 7). Более того, данные об аминокислотной последовательности белков АХ были подтверждены с помощью анализа аминокислотного состава соответствующих белков (см. табл. 4), а также с помощью масс-спектроскопии очищенных белков при сравнении их молекулярных масс, выведенных исходя из кодирующих их генов (см. табл. 5). Интересно ответить, что в результате масс Таблица 4 Аминокислотный состав белков АХ Остаток Asp Thr Ser Glx Pro Gly Ala Cys Val Met Lle Leu Tyr Phe His Lys Arg Trp АХ1 4,0 0,1 2,1 5,7 3,2 4,3 4,1 6,9 2,0 0,0 1,0 1,1 0,0 3,1 0,0 5,1 3,2 n.d. АХ2 5,0 2,0 3,1 4,4 3,2 3,2 3,1 6,9 1,1 0,9 0,1 1,1 0,9 3,0 0,0 4,0 3,1 n.d АХ3 4,1 1,0 3,0 1,1 5,1 2,1 0,0 6,2 1,0 0,0 2,0 0,0 0,0 1,0 0,0 1,0 3,2 n.d. Таблица 5 Белок ES-MS АХ1 АХ2 АХ3.1 5078,1 5193,4 3452,5 Молекулярные массы АХ1,2 и 3,1 определенные с помощью электро-спрей (Spray) мас-спектрометра (ES-MS) и выведенные на основе кодирующих их генов. Продуцирование трансформированных растений. мол. масса (Da) cDNA(-8H+) производные 5086-8=5078 5185-8+16=5193 3460-8=3452 Гены, кодирующие белки АХ, вводили в растения. С помощью ген-специфических праймеров, кодирующие области генов (кодирующих AX1, AX2 и АХ3.1) синтезировали из мРНК посредством PCR, а именно, 3’RACE®5’RАСЕ. После добавления подходящих промоторной (напр.,35S ) и тер 11 41278 минаторной (напр., 35S) последовательностей, гены, кодирующие белки АХ, вводили в растениетрансформирующих вектор. При этом, предпочтительно, чтобы последовательность усиления трансляции была введена в вектор в 5'-участок белоккодирующей области (см. SEQ ID № 3, 6 и 9). Этот вектор также содержит подходящие маркерные гены, хорошо известные специалистам. Указанный вектор может содержать, но необязательно, ген, кодирующий белок WIN - например, такой, как белок, происходящий из листьев ячменя в условиях стресса или из семян ячменя (если необходимо, то вместо с последовательностью усиления трансляции, см., например, SEQ ID № 13), и/или ген, кодирующий хитиназу и/или глюканазу. В случае хитиназы, предпочтительной является хитиназа 4, описанная, в заявке на патент РСТ № РСТ/DK92/00108 (Публикация № W092/17591). С использованием указанных векторов могут быть например, трансформированы агробактерии Agrobacterium tumefaciens. Затем растительные клетки обрабатывают этими трансформированными агробактериями, и трансформированные таким образом растительные клетки регенерируют с получением целых растений, в которых новый нуклеарный материал является стабильно вставленным в геном. Однако, следует ответить при этом, что ДНК, кодирующая белок АХ (или комбинацию таких белков) и кроме того, но необязательно, кодирующая белок WIN и/или хитиназу, и/или глюканазу (или комбинацию этих белков), может быть введена в растительные клетки другими известными методами, например, с использованием специального выстреливающего аппарата для микроинъекций, с помощью электропорации, электротрансформации, и микроинъецирования, и т.п.; а регенерация трансформированных клеток растения может быть осуществлена стандартными методами, хорошо известными специалистам, например, с помощью обработки клеток цитокининами, которая является необходимой или желательной для улучшения частоты регенерации. Таким образом, продуцировали растения картофеля и сахарной свеклы, которые являются трансгенными, в отношении белков АХ. Рекомбинантные ДНК-последовательности, содержащие, например, последовательность, выбранною из SEQ ID № 3, 6 или 9, вводили стандартными способами (включая котрансформацию) в растения картофеля или сахарной свеклы. При этом, следует отметить, что альтернативно могут быть использованы рекомбинантные дНК, включающие в себя последовательности, изображенные в SEQ ID №№ 1, 4 или 7, хотя в них отсутствует элемент усиления трансляции, вводимый в 5' конец до инициирующего кодона кодирующей области различных сигнальных пептидов белка АХ. Экспрессию гена, кодирующего АХ2, определяли путем идентификации АХ2-генного продукта транскрипции. Присутствие белка в растении подтверждали, кроме того, посредством иммунохимического анализа с использованием антител, продуцированных против, аутентичного образца белка. Перед инъецированием кроликам, этот белок может быть свя зан с бактерионосителем токсоида дифтерии, либо с полилизином в целях повышения его иммуногенности. Получали экстракты трансгенных растений сахарной свеклы и картофеля, затем частично очищали и анализировали их на способность к ингибированию роста Cercospora путем микротитрования, как описано выше. Экстракты, полученные от растений, являющихся трансгенными в отношении белка АХ, обладали значительным ингибирующим действием на рост грибков по сравнению с аналогичными экстрактами, полученными от нетрансгенных контрольных растений картофеля или сахарной свеклы. Более того, подходящие микроорганизмы (т.е., организмы, которые не оказывают значительного токсического действияка продуцируемые белки АХ) могут быть трансформированы вектором, содержащим ген (или гены), кодирующий белок АХ (или комбинацию АХ-белков), так, чтобы трансформированные микроорганизмы обладали способностью продуцировать указанный белок. Эти микроорганизмы могут, кроме того, содержать ген, кодирующий другие белки, такие, как белок типа WIN описанный в SEQ ID № 11, и/или различные хитиназы и/или глюканазы. Особенно предпочтительно, чтобы указанным другим белком была хитиназа 4, описанная в заявке на патент РCT/DK92/00108 (Публикация № 092 17591). Указанные микроорганизмы могут быть затем использованы в целях борьбы с растительными патогенами. Например, трансформированные микроорганизмы могут быть осушены и нанесены путем распыления на растения, инфицированные патогенами, или на растения, которые могут быть инфицированы данными патогенами. Число последователь- 13 ностей Тип машинного считывания Тип носителя гибкий диск Компьютер РС совместный с IBM Операцион. система PC-DOS/MS-DOS Patentin Release #1.0 Програмное обеспече- Версия № 1,25 ние (ЕРО) Данные последова- SEQ ID № 1 тельности Характеристики последовательности Длинна 437 пар оснований Тип нуклеиновая кислота Цепочечность двухцепочечная Топология неизвестна Тип молекулы кДНК Гипотетичность нет Антисмысловая нет Источник происхождения Организм Сахарная свекла Отличительная особенность Название/ключ CDS Локализация 40,,,264 (xi) Sequence Description: SEQ ID № 1 Описание последовательности 12 41278 7 Данные последовательности SEQ ID № 2 Характеристики последовательности Длина 74 аминокислоты Тип аминокислотная Топология линейная Тип молекулы белок Описание последовательности SEQ ID № 2 Данные последовательности SEQ ID № 3 Характеристики последовательности Длина 349 пар оснований Тип нуклеиновая кислота Цепочечность двуцепочечная Топология неизвестная Тип молекулы кДНК Гипотетичность нет Антисмысловая нет Источник происхождения Организм сахарная свекла Описание последовательности SEQ ID № 3 13 41278 Данные последовательности Характеристики последовательности Длина 492 пары оснований Тип нуклеиновая кислота Цепочечность двухцепочечная Топология неизвестна Тип молекулы кДНК Гипотетичность нет Антисмысловая нет Источник происхождения Организм сахарная свекла Отличительная особенность Название/ключ CDS Локализация 53,,,277 Описание последовательности SEQ ID № 4 Данные последовательности SEQ ID № 5 Характеристики последовательности Длина 74 аминокислоты Тип аминокислотная Топология линейная Тип молеклы белок Описание последовательности SEQ ID № 5 14 41278 Данные последовательности SEQ ID № 6 Характеристики последовательности Длина 363 пары оснований Тип нуклеиновая кислота Цепочечность двухцепочечная Топология неизвестна Тип молекулы кДНК Гипотетичность нет Антисмысловая нет Источник происхождения Организм сахарная свекла Описание последовательности SEQ ID № 6 Данные последовательности SEQ ID № 7 Характеристики последовательности Длина 596 пар оснований Тип нуклеиновокислотная Цепочечность двухцепочечная Топология неизвестна Тип молекулы кДНК Гипотетичность нет Антисмысловая нет Источник происхождения Организм сахарная свекла Отличительная особенность Название/ключ CDS Локализация 23,,,358 Описание последовательности SEQ ID № 7 15 41278 Данные последовательности SEQ ID № 8 Характеристики последовательности Длина 111 аминокислоты Тип аминокислотная Топология линейная Тип молекулы белок Описание последовательности SEQ ID № 8 16 41278 Данные последовательности SEQ ID № 9 Характеристики последовательности Длина 484 пары оснований Тип нуклеиновокислотная Цепочечность двухцепочечная Топология неизвестна Тип молекулы кДНК Гипотетичность нет Антисмысловая нет Источник происхождения Организм сахарная свекла (xi) Sequence Description: SEQ ID № 9 Описание последовательности Данные последовательности SEQ ID № 10 Характеристики последовательности Длина 504 пары оснований Тип Нуклеиновокислотная Цепочечность двухцепочечная Топология неизвестна Тип молекулы КДНК Гипотетичность Нет Антисмысловая нет Источник происхождения Организм ячмень обыкновенный Отличительная особенность Название/ключ CDS Локализация 1,,,441 (xi) Sequence Description: SEQ ID № 10 Описание последовательности 17 41278 Данные последовательности SEQ ID № 11 Характеристики последовательности Длина 146 аминокислоты Тип аминокислотная Топология линейная Тип молекулы белок Описание последовательности SEQ ID № 11 18 41278 Данные последовательности SEQ ID № 12 Характеристики последовательности Длина 515 пары оснований Тип нуклеиновокислотная Цепочечность двухцепочечная Топология неизвестна Тип молекулы кДНК Гипотетичность нет Антисмысловая нет Источник происхождения Организм ячмень обыкновенный Описание последовательности SEQ ID № 12 Данные последовательности SEQ ID № 13 Характеристики последовательности Длина 585 пары оснований Тип нуклеиновокислотная Цепочечность двухцепочечная Топология неизвестна Тип молекулы кДНК Гипотетичность нет Антисмысловая нет Источник происхождения Организм ячмень обыкновенный Описание последовательности SEQ ID № 13 19 41278 Фиг. 1 Фиг. 2 20 41278 Фиг. 3А Фиг. 3В 21 41278 Фиг. 4 Фиг. 5 22 41278 __________________________________________________________ ДП "Український інститут промислової власності" (Укрпатент) Україна, 01133, Київ-133, бульв. Лесі Українки, 26 (044) 295-81-42, 295-61-97 __________________________________________________________ Підписано до друку ________ 2001 р. Формат 60х84 1/8. Обсяг ______ обл.-вид. арк. Тираж 50 прим. Зам._______ ____________________________________________________________ УкрІНТЕІ, 03680, Київ-39 МСП, вул. Горького, 180. (044) 268-25-22 ___________________________________________________________ 23
ДивитисяДодаткова інформація
МПК / Мітки
МПК: A01N 65/00, C12P 21/02, C07K 14/37, C12N 5/10, C07K 14/415, C12N 15/82, C07K 14/41, C07K 1/20, A01H 5/00, C12N 15/09, C12N 9/24, C12N 15/29, C07K 19/00, C07K 14/00
Мітки: антимікробний, кодує, білок, послідовність, містить, антимікробна, днк, композиція, яка, рекомбінантна
Код посилання
<a href="https://ua.patents.su/23-41278-antimikrobnijj-bilok-rekombinantna-dnk-shho-mistit-poslidovnist-yaka-kodueh-antimikrobnijj-bilok-antimikrobna-kompoziciya.html" target="_blank" rel="follow" title="База патентів України">Антимікробний білок, рекомбінантна днк, що містить послідовність, яка кодує антимікробний білок, антимікробна композиція</a>
Попередній патент: Завантажувальний агрегат для подавання твердого матеріалу /варіанти/
Наступний патент: Установка і спосіб для отримання розплавів заліза
Випадковий патент: Човникова швейна машина