Фрагмент геномної днк, що кодує фітазу aspergillus niger,фрагмент кднк, що кодує фітазу aspergillus niger, рекомбінантна плазмідна днк для експресії фітази в aspergillus (варіанти), штам aspergillus-продуцент ф
Номер патенту: 27702
Опубліковано: 16.10.2000
Автори: Лейтен Рудольф Гейсбертус Марі, ван Хартінгсвелдт Віллем, ван Горком Роберт Франціскус Марія, Венстра Аннемарі Евелін, Селтен Герардус Корнеліс Марія, ван Парідон Петрус Андреас
Формула / Реферат
(57) 1. Фрагмент геномной ДНК, кодирующий фитазу Aspergillus niger и имеющий следующую нуклеотидную последовательность:
2. Фрагмент кДНК, кодирующий фитазу Aspergiilus следовательность: niger и имеющий следующую нуклеотидную поcледовательность
3. Рекомбинантная плазмидная ДНК pFYT3 для экспрессии фитазы в Aspergillus, имеющая размер приблизительно 15,3 т.п.о., состоящая из вектора pTZ18 и фрагмента ДНК по п.1, оперативно связанного промотором глюкоамилазы Aspergilius niger и содержащая ген amdS Aspergillus nidulans в качестве селективного маркера, который подтверждает фенотип amdS4 хозяйского штамма.
4. Рекомбинантная плазмидная ДНК pAF-2-2S для экспрессии фитазы в Aspergillus, имеющая размер приблизительно 13,4 т.п.о., состоящая из вектора pUC19 и pVUII фрагмента размером 6,1 т.п.о., содержащего ДНК фрагмент по п.1 и включающая ген amdS Aspergillus nidulans в качестве селективного маркера, который подтверждает фенотип amdS+ хозяйского штамма.
5. Штамм Aspergillus niger CBS513.88, трансформированный рекомбинантной плазмидой pFYT3 - продуцент фитазы Aspergillus.
6. Штамм Aspergillus niger CBS513.88, трансфор мированный рекомбинантной плазмидой pAF-2-2S - продуцент фитазы Aspergillus.
7. Штамм Aspergillus ficuum NRRL 3135, трансформированный рекомбинантной плазмидой pFYT3 - продуцент фитазы Aspergillus.
8. Способ получения фитазы, предусматривающий культивирование клеток-продуцентов назван ного фермента, выделение фитазы из культуры, отличающийся тем, что в качестве клеток-продуцентов используют Aspergillus niger по п 5 или 6, или Aspergillus ficuum по п.7.
9. Рекомбинантная фитаза Aspergillus niger (E С. 31.3 8 миоинозитол гексафосфат фосфогидрола- за), получаемая в клетках Aspergillus ficuum NRRL 3135 или Aspergillus niger CBS513.88, кодируемая фрагментом ДНК по п.1 или п.2 и характеризую щаяся следующими свойствами: N-концевой по следовательностью Leu-Ala- Val-Pro-Ala-Ser-Arg- Asn-Gln-Ser-Ser-Gly-Asp-Thr-Val-Asp, удельной активностью примерно 100 ед./мг, оптимумом рН 5,5 и температурным оптимумом 50°С, молекулярной массой 85 кД, определяемой с помощью SDS- PAGE.
Текст
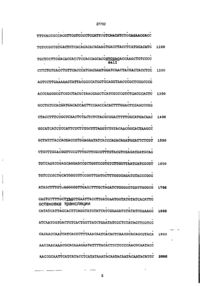
1. Фрагмент геномной ДНК, кодирующий фитазу Aspergillus niger и имеющий следующую нуклеотидную последовательность: GTCGACTTCCCGTCCTATTCGGCCTCGTCCGCTGAAGATCCATCCCACCA Sail • • • • » TTGCACGTGGGCCACCTTTGTGAGCTTCTAACCTGAACTGGTAGAGTATC 100 ^ О ACACACCATGCCAAGGTGGGATGAAGGGGTTATATGAGACCGTCCGGTCC GGCGCGATGGCCGTAGCTGCCACTCGCTGCTGTGCAAGAAATTACTTCTC £ 200 ATAGGCATCMSGGCGTCTCTGCTGTTCTACTTCCTTTGTATCTCCTGTC ^ начало трансляции £ TGGGTATGCTAAGCACCACAATCAAAGTCTAATAAGGACCCTCCCTTCCG 300 AGGGCCCCTGAAGCTCGGACTGTGTGGGACTACTGATCGCTGACTATCTG ""интрон » • • * TGCAGAGTCACCTCCGGACTGGCAGTCCCCGCCTCGAGAAATCAATCCAG > ~ конец о 400 OOOT YYDDOYYODXODDYXYDDDDDXXYYSDDYDYDYYSDXXOXOXDYDDXDDY 006 ODXYDYYODODDXOOXYYDDDDDDDDYDDDOXDDXOOiYSDYYDXD^YYO GOt ODXOODXOXDDXYODOXYOXXYDDXXDDXYDYYDOYYDYOXOODXYYDDY • • • • • X3DD0YODYX0XXOYYDXYDDDDDXDYY3XDVX00YDf)YDYYOYOD3XXD • » • » « ООL DOXDYSXDDYOXYSYDDXDODXXDDYOYXDYYDYXYDYOYYOXODXXOOO • * » m ш XYXYYYYDOOYOXXXDDYODYDOSDYYDYDOYDOXYSYDDYOXXYDXDXD • • • • » 009 300XOYXYYY9YY009DYYDOXOYOODYOODXYXOf)D009YOOXYDXODD OOS DXYOXOODXYYODYYYDDOXOXDXDXXOXXDODYDODYXYYOXODDOXXX « » • • * 3XYODOXXOY0YDOOXDXXDOXYYOXYXODODY0XYDDX003YXYD2DXX ZOllZ 27702 в • • • • TTTCACCGCCACGTTCGTCCCCTCCATTCGTCAACGTCTGGAGAACGACC • • • • • TGTCCGGTGTGACTCTCACAGACACAGAAGTGACCTACCTCATGGACATG 1100 » • • • • TGCTCCTTCGACACCATCTCCACCAGCACCGTCGACACCAAGCTGTCCCC sail a « • • • CTTCTGTG ACCTGTTCACCCATGACGAATGGATCAACTACGACTACCTCC 1200 • • • • « AGTCCTTGAAAAAGTATTACGGCCATGGTGCAGGTAACCCGCTCGGCCCG • • • • • ACCCAGGGCGTCGGCTACGCTAACGAGCTCATCGCCCGTCTGACCCACTC • щ • • 13 00 • GCCTGTCCACGATGACACCAGTTCCAACCACACTTTGGACTCGAGCCCGG » • * » « CTACCTTTCCGCTCAACTCTACTCTCTACGCGGACTTTTCGCATGACAAC 1400 • * • • • GGCATCATCTCCATTCTCTTTGCTTTAGGTCTGTACAACGGCACTAAGCC • • • • • GCTATCTACCACGACCGTGGAGAATATCACCCAGACAGATGGATTCTCGT • • • • 1500 • CTGCTTGGACGGTTCCGTTTGCTTCGCGTTTGTACGTCGAGATGATGCAG • * • a • TGTCAGGCGGAGCAGGAGCCGCTGGTCCGTGTCTTGGTTAATGATCGCGT 1600 • • • * • TGTCCCGCTGCATGGGTGTCCGGTTGATGCTTTGGGGAGATGTACCCGGG • • • m « ATAGCTTTGTviAGGGGGTTGAGCTTTGCTAGATCTGGGGGTGATTGGGCG 1700 • » • * • GAGTGTTTTGCTTAGCTGAATTACCTTGATGAATGGTATGTATCACATTG остановка трансляции CATATCATTAGCACTTCAGGTATGTATTATCGAAG ATGTATATCGAAAGG 18 00 ATCAATGGTGACTGTCACTGGTTATCTGAATATCCCTCTATACCTCGTCC CACAACCAATCATCACCCTTTAAACAAtCACACTCAACGCACAGCGTACA 19 00 AAC3AACAAACGCACAAAGAATATTTTACACTCCTCCCCAACGCAATACC AACCGCAATTCATCATACCTCATATAAATACAATACAATACAATACATCC 2000 27702 , • • « ATCCCTACCCTCAAGTCCACCCATCCTATAATCAATCCCTACTTACTTAC , • » • • TTCTCCCCCTCCCCCTCACCCTTCCCAGAACTCACCCCCGAAGTAGTAAT 2100 , • « • • AGTAGTAGTAGAAGAAGCAGACGACCTCTCCACCAATCTCTTCGGCCTCT » « • • • TATCCCCATACGCTACACAAAACCCCCACCCCGTTAGCATGCACTCAGAA 2200 AATAATCAAAAATAACTAAGAAGGAAAAAAAAGAAGAAGAAAGGTTACAT ACTCCTCTCATACAAACTCCAAG ACGTATACATCAAGATGGGCAATCCCA 2300 . • » • • CCATTACTGATATCCATCTATGAACCCATTCCCATCCCACGTTAGTTGAT « • • • * TACTTTACTTAGAAGAAG AAAAAGGG AAGGG AAGGGAAAGAAGTGGATGG 2400 • • • • > GATTGAGTTAGTGCTCACCGTCTCGCAGCAAGTTTATATTCTTTTGTTTG • » • * • GCGGATATCTTTCACTGCTCCTGCTGGACGTTGTCACGGGGTGGTAGTGG • • • Ф 2500 • TTGGCGGTGGTGAGGGTCCATGATCACTCTTGGTTTGGGGGGTTGTTGTT GTCGTTGTTGTTGTTGTTGGGTGGGCATTTTCTTTTCTTCACTTGGGGAT 2600 TATTATTTGGAATTGGTTAGTTTGAGTGAGTGGGTAATATTGAATGGGTG ATTATTGGGAATGAAGTAG ATTTGGCTATGAATGGTTGATGGGATGGAAT • • • • 2700 a GAATGGATGGATGAATAGATGGAGGCGGAAAAGTCAGGTGGTTTGAGGTT CGGATTATTATCTTTGTGCCTGAGGCATCACTCTCCATCTATGTTGTTCT 2800 TTCTATACCGATCTACCAGAGCTAAGTTGACTGATTCTACCACAGTGCAC . . . . , AATAAGTATGT ACTTATTTCATTTAGAGTATTTAGATTAACCCGCTGTGC 2900 TATTTGCCGTAGCTTTCCACCCAATTTCGAAGTTCGAAGAATTAAAACTC ATCCTACAGTACAGAATAG AAGTAAAAGGAGAAGAGAAAAACAAG AT AAT 3000 27702 ACAACCAGTCCAGGTCCATTCTAGATCTCGAATGACCACCAAATAAGAAA GCAACAAGCAAGTAAGCAAAGCATAAGTCTAAATGAACGCCAATAACTTC • * • * 3100 * ATCGCCTGCCTTTGAAACTGAACGCTATGCACGAATGGCTCGAAATGA1T CCCTTAACTCCGTAGTATTGAGAGTGAGAGGAAAAGAAAAAAAG AGACAG « • * • • 3200 AAAAGCTGACCATGGGAAAGAAGCATGATCAGTCGGGAATGGATCTGCGG GTTGAGATAGATATGAGTTGCCTCGCAGATCCGGTGACAAGATAAGAGAA • « m * 3300 • TTGGGAGATGTGATCAGCCACTGTAACTTCATCAAGCATCGACATTCAAC • » • » » CGTCGGGTCTGCGGGTTGAGATGCAAGTTGAGATGCCACGCAGACCCGAA 3400 • * * • * CAGAGTGAGAGATGTGAGACTTTTGAACCACTGTGACTTCATCAAGCATC • • • • * AA^ACACACTCCATGGTCAATCGGTTAGGGTGTGAGGGTTGATATGCCAG 3500 • # * • * GTTCGATGCCACGCAGACCCGAACCGACTGAGAAATATGAAAAGTTGGAC » • * • • AGCCACriCATCTTCATCAAGCGTAAAACCCCAATCAATGGTAAATCGAA • • m • 3600 • AACGAATCTGCGGGCTGATGTGGAAATGAGACGAA1GCCTCGCAGATTCG • * * m » AAG ACACGTAAATCGAG ATGAACAATCACTTTAACTTCATCAAAGCCTTA 3700 « • » • • AATCACCCfiATGGCCAGTCTATTCGGGTCTGCGGGTTGAGGTTCCTGTTG AGATGCCACGCAGACTGCGAACATGCGATGCATTATAAGTTGGACGAGTG • • • • 3800 • TAGACTGACCATTGATAACCGAGATAAACAATCACTTCAACTTCATCAAA • * • • л GCCTTAAATCACTCAATGGCCAGTCTGTTTGCGGTCTGCGGGCTGATACC 3900 С AAGTTG CG ATG CCACGCAG ACTGCAAAC ATTGATCG AG AGACG AG AAAA ACAACGCACTTTAACTTCAACAAAAGCCTTTCAATCAGTCAATGGCCAGT 4-000 27702 CTGTTCGCGGTCTGCGGGCTGATATGCGAGTTGAGGTGCCTCGCAGACCG CGAACATGCGATGTAATTTCTTAGTTAGACGAGTGCCTGGCCATTGAGAA 4100 ACGAGAGAAACAACCACTTTAACTTCATGAAAGCCTTGAACTACTCAATG • • • • • 4200 ACCCGTCTGTTGGCGGTCTGCGGGCTGATATTCGAGTTGAG ATGCCACGC « • • « • AGACCGCCAACATGCGATGTATCATGTAAGTTAGATGAGTGACTGGCCAT « • * * • TGAGAAACGAGAGAAACAACCACACTTCATGAGAGCCTTAAATTATTCAA • • • • 4 300 p TGACCAGTCTGTTCACGGTCTGCGGGTTGGTATGCGAGTCGAGGTGCCTC • * • * • GCAGACCGCGAACATGCGATGTTTTCGATGGACGAGTGAAGCCTGACGAT • » » щ 4400 т CGAGAACTATCTCAGTTGGGTTGGCCATTCGGCTGGCCGTTGGGTTTAGT • • « • • ATTAGGATCGTCAGGTTTGTCCGATGGAACGTTCCGTTTGCGTGCGTTGG 4500 • • • • * CGCGACGAGCCCTCTCCTCGGCGTGATTCTGAAATTCTGCAATCAGGGCA • • • • * GCCGCAGCACGGCG ACGGGACGTCCTCCAGGAGCTGTGTTGAAGTTTCGG 4600 • » * » • GGTGGCGGTCCAGAAGGGGGAGTTACATTAAAAGCCTCATAGATGTCTTT GGGTGGTTCCGGGGGGCCCATCGCAAGATCTTCTGGAGTTGTGCGTCTGA • • • • 4700 • TCATCTCTTGAGTGTAATTGCGACGCAGACCGAGCTTCAGGATTTTGGAA GGGCTGGATCGCTCCTGCTGACTCTTTCCCTCAGCGGGCTTCGTCTCGGC AGTCTTCATTTCGGCGGGCTGATCTTCCATCTCAGAATGGGATCGCTTTC • • • • • TGGTCGCTGCACCCGCTCCTCCCTTCAAGGTCAGCTTGATGCGCAGCGTC • ч • * 4800 4900 • TTGGGCGGCTCAGCTGGTGGAGTTGGTTCCGGCTCTGGCTCCCTCCGGCG TCGCTTGGGCACTTGAGTAGTCTCTGAGGCTTCGCCGCGGCGCCGTTTGC 5000 27702 • » • GAGTCGGCTCCTTGGTCTCTTTGGCCTCTTTCACTTCACCTGGACCGTCT * • • • * TTCGGGGCGGTTTCATCGTGCTGAGCGATCAAGGTTTGGATGTAGGCAGC 5100 CGGCATCATTCGATCAACGGCAATTCCTCTCTTGCGGGCCTCCTCCCGAG CCTTGATTGTCGCCTTGACCTCGTCCACGTTTTCGAAGAAGAAAGGCATC 5200 • • • • • TTGTTATCCTGAGGCAAGTTGCGCTCTCCCATGCGTGGGGATATCCGAAG * * • • • ATGCGGTCCTTCTCGAACTGTTCATGAGACTTCAGACGAATTGGAGGCTG 5300 • « • • » GGGGAGCAATTTGTCTCCGTAGGTGTTGTTAGGGCGGAACCAAGAATAGC CTTCGCCTACAACGACAAGCTCTTCGCCAAATTTATTTTTTTGGCCTGTA 54 00 • * * • » AAAACGAACCCATCCTCGTCAGTCCACCGGTGCGTCTCGGACGTAGAGAT # • * • Ф TGGCTTACTTATTCCCTCAACGCCGATCTCTGCCTGGGGCTGCGCTTCGG 5500 • » • • • ATGCGGCCTCGGTCACGGCTCCGCCTCGGACTGCACCGCTGGAGTTTCGG TCTTCTTCTCCTGCTTCXCCAGGTACTCCTTGCGTAACTCTTCGATCAGC m * • • 5600 • CTCGGCTTCCGATGACTGCTCAAATTCTGGAGCAACAGCTGCCGCGGCCA * * * • « GGTCAAGCAGGCGGTTTGCTAAAACTGCCCATTTTCCATCGACACCTGCC > < • • 5700 • TCC3ACGCCTGTGCAAAACCAGCTGTTTTCGCATTGGCCTGTTTGTTGGC ACGCGTCTTCTTGACTGCTGCCTTGCCCTTTACTTCCTTGAGAGCAGACT 5800 CTG-3CTTAGATGATGGTGCACGGTTTCTGCGGAAGCGCCGCTCAGATTCC AAAGATTCCATAGCTTTAATGGTAGGCTTTCTGGTTCTTCCAGAAGTGCG 5900 CGCAGCTGACGTAGTGGTTGAGTAGCTGGCAGTTGGGGATCCTGGGCCCT • » • • » CATTGGAACCATCAAGACCAAATTTGTTTCCATACATATCAGCATGGTAT 6000 27702 • • • » • TCAAAAGGAAAACTTTCGCCGTACGGAGTACTGCGTTCGATTCCGGGTGT • • • • • ATCCAAGTCGTATCCAGACATGGTGTCGAATTCAGCCTTGCTGTCAAGAG 6100 торная зона окончания транскрипции) в считываемую об-ласть рядом с б'-облаетъю путем замещения всего или части гена-мишени сконструированной еди-ницей экспрессии, или внедрением последней между регуляторной зоной инициирования транскрипции локуса-мишени и открытой считываемой последовательностью. Как уже указывалось, в случае гомологичности регуляторной зоны окончания транскрипции и зоны локусамишени, длина З1 - фланкирующей области должна быть значительно больше чем длина регуляторной зоны окончания транскрипции, имеющейся в трансформированном геноме. Предметом настоящего изобретения является также исходный материал для конструирования фитаз "второго поколения", т. е. ферментов с фитазной активностью, которые по своим свойствам отличаются от выделенных до сих пор ферментов. Фитазы "второго поколения" могут характеризоваться измененными оптимумами рН, температуры, специфической активности или сродства к субстратам, а также другими отличиями, которые повышают пригодность ферментов для использования в тех или иных процессах Е coli является наилучшим объектом для получения таких мутаций, в том числе направленных. Е coli не имеет механизма, обеспечивающего удаление интронов, которые могут присутствовать в гене фитазы. Для экспрессии в этих организмах предпочтительно использовать клонированную кДНК фитазы. Клонированная последовательность кДНК легко поддается мутациям хорошо известными способами после чего мутантный ген может быть введен в желаемый геном для экспрессии. Вновь сконструированный блок можно трансформировать в качестве клонирующего вектора в клетку-хозяин либо линейно, либо в форме циклической структуры, а при необходимости он может быть удален из клонирующего вектора. Предпочтительным клонирующим вектором является плазмида, которую обычно переводят в линейную форму в пределах примерно 1 килооснования используемого гена. Желательно интегрировать блок экспрессии фитазы, получаемый согласно настоящему изобретению, в геном строго определенного вида микроорганизмов. Существует множество методов трансформи 17 27702 рования нитчатых грибов. Среди этих методов следует отметить слияние или трансформацию протопластов, электроперфорацию или микробомбардировку клеток Особенно хорошие результаты дает трансформация протопластов, применение которой имеет ряд преимуществ. Сначала мицелий гриба требуемого штамма переводят в протопласты посредством ферментативного переваривания клеточной стенки в присутствии таких стабилизаторов осмотического давления, как KCI или сорбитол. Добавление СаСІг способствует более интенсивному включению ДНК в протопласты. Аналогичным эффектом обладает концентрированный ретвор полизтиленгликоля, вызывающий к TOIUV же агрегацию протопластов, в процессе которой происходит включение ДНК в агрегаты с последующим захватом трансформирующего фактора протопластами. Затем протопласты регенерируют на твердой среде, содержащей стабилизатор осмотического давления, и, в случае необходимости, фактор селективности, резистентность к которому кодируется трансформирующей ДНК. После отбора трансформированных клеток присутствие требуемого гена можно установить различными способами. При синтезе продукта, гетерологичного хозяину, наличие экспрессии гена устанавливается с помощью антител. Другим способом является применение одной из разновидностей гибридизации, которая позволяет обнаруживать присутствие встроенного гена или продукта его транскрипции. Амплификация нукпеотидной последовательности или экспрессия трансформированного генома достигаются с помощью стандартных методов, таких как введение в трансформирующий вектор множественных копий трансформанта или ис-пользование в качестве маркера избирательности гена amdS (см , например, Weinans et al., 1985, Current Genetics, 9, 361-368). Подлежащая амплификации последовательность ДНК может представлять собой, как указано выше, либо гомологичную, либо гетерологичную клетке-хозяину ДНК. После завершения всех этих операций клетки можно выращивать в обычной питательной среде. При этом используют невысокие концентрации протеазных ингибиторов, таких как фторофенилметилсульфонил, альфа-2- макроглобулины, пепстатин и другие Обычно это концентрации порядка 1 мкг/мл - 1 мг/мл. Ген(ы) протеазы можно инактивировать, чтобы избежать разрушения белкового продукта или уменьшить его. Трансформированные клетки можно выращивать в ферментерах для непрерывного или периодического культивирования, с последующей изоляцией питательной среды и экстракцией конечного продукта. При необходимости очистки конечного продукта можно применять самые разнообразные методы, включая хроматофафию (в частности, ВЭЖХ), экстракцию растворителя, электрофорез, а также другие методы и их сочетание. Предметом настоящего изобретения является также способ нисходящего процессинга, при котором фильтрация ферментационного бульона (при необходимости предварительно очищенного) сопровождается повторной фильтрацией в стерильных условиях, после которой отфильтрованный раствор подвергают концентрированию. Полученный таким образом жидкий концентрат можно использовать для следующих целей: а) осаждения из него фитазы и других белков путем добавления ацетона до конечной концентрации 60% (в объемном соотношении) при непрерывном перемешивании. Осадок можно высушивать под вакуумом при температуре 35°С. После измельчения сухого порошка ферментативный продукт используют как таковой в опытах по его практическому применению. Выход конечного продукта составляет при этом 90%. б) высушивания в форме аэрозоля с помощью обычно применяемых для этой цели методов с выходом 80-99%; в) смешивания с носителями, например, с пшеничными отрубями Получаемые при этом смеси можно высушивать в оросительных колоннах или над слоем жидкости. г) для осмотической стабилизации соответствующими агентами, например, сорбитолом. Для предотвращения загрязнения микроорганизмами можно добавлять консерванты, в частности, бензойную кислоту. Все четыре описанные формы конечного продукта могут поступать на рынок для продажи изготовителям полуфабрикатов, предприятиям по изготовлению комбикормов, другим потребителям и фермерам. Нижеследующие примеры служат для иллюстрации изобретения и не ограничивают сферу его применения. Специалистам в данной области не составляет труда понять, что ген фитазы согласно настоящему изобретению можно использовать в экспериментах по гетерологичной гибридизации, проводимых с целью выделения кодирующего фитазу гена из других видов микроорганизмов. Пример 1. Ферментация A. ficuum NRRL 3155. Штамм NRRL 3133 Aspergillus ficuum получали из лаборатории Northern Region Research Lab. USDA, 1815 Nortern Univ. str. Peoria, США. Препараты грибных спор готовили с помощью стандартной методики. Споры, а затем и клетки многократно пассировали в колбах Эрленмейера и переносили в ферментер на 10 л. После циклического культивирования содержимое ферментера использовали в качестве инокулята для конечной ферментации в объеме 500 л. Состав использовавшейся среды: 91 г/л кукурузного крахмала (BDH Chemicals, Ltd.), 38 г/л глюкозы, Н2О, 0,6 г/л MgSO4»7H2O, 0,6 г/л KCI, 0,2 г/л FeSO4«4H2O и 12 г/л КЫОз. Величина рН поддерживалась на уровне 4,6±0,3 системой автоматического титрования с использованием 4Н NaOH или 4Н H2SO4. Клетки выращивали при 28°С и автоматически регулируемой концентрации растворенного кислорода, эквивалентной 25%-ному насыщению воздуха. Максимальную продукцию фитазы от 5 до 10 ед/мл регистрировали через 10 дней после начала ферментации. Пример 2. Очистка и свойства фитазы А. ficuum. 18 27702 А. Определение активности фитазы A ficuum. 100 мкл ферментационного бульона после фильтрации (в случае необходимости - разведения) или супернатанта, или разбавителя (в качестве контроля) добавляли в инкубационную смесь следующего состава: 0,25 М натрий - ацетатный буфер рН 5,5 или глициновый HCI - буфер рН 2,5 1 мМ фиговая кислота, натриевая соль разбавитель до конечного объема 900 мкл Полученную смесь инкубировали при 37°С в течение 30 мин. Реакцию останавливали добавлением 1 мл 10% ТХК (трихлоруксусной кислоты) После прекращения реакции добавляли 2 мл реактива (3,66 г FeSOWhbO в 50 мл раствора молибдата аммония /2,5 г (МНгОєМогОг^НгО и 8 мл H2SO4, разведенных в 250 мл разбавителя/). Интенсивность синей окраски измеряли спектрофотометрически при длине волны 750 нм Результаты измерения свидетельствуют о том, что количество фосфата, выделяемого в результате реакции, составляет 0-1 ммоль/л (в сопоставлении с калибровочной кривой фосфата). Окрашивание на фосфатазу. Компоненты, обладающие фосфатазной активностью, определяли методом изоэлектрофокусировки с использованием обычного красителя. Гель инкубировали в присутствии раствора альфа-нафтил-фосфата и соли Fast Garnet GBC, Sigma (соответственно 0,1 и 0,2% (вес/объем)) в 0,6 М натрийацетатном буфере рН 5,5. Реакцию, в результате которой появлялся осадок черного цвета, останавливали смесью метанола с уксусной кислотой в объемном соотношении 30:10% или, при необходимости получения в дальнейшем белка с фитазной активностью, промывкой дистиллированной водой. Б. Очистка фитазы A ficuum. Фитазу очищали А ^ гомогенного состояния из культуральной среды A. ficuum NRRL 3135. Предварительно бульон стерилизовали фильтрованием Затем полученный фильтрат концентрировали в ультрафильтровальной установке nitron с фильтрами 30 кД. Ионную силу и рН проб доводили до необходимой для очистки величины, промывая их 10 мМ натрий-ацетатный буфером рН 4,5. Процедура очистки обеспечивала 20-кратную концентрацию проб. После концентрации пробы наносили на катионообменник (колонка HR 16/10, 20 мл, из Sсефарозы Fast-Flow фирмы Pharmacia) и хроматографировали в системе для ускоренной очистки белков (Waters Preparative 650 Advanced Protein Purification System). Связанные белки элюировали в градиенте 0-1 М натрий-ацетатного буфера, а фитазу в 250 мМ NaCI. Фракции, содержавшие фитазную активность, объединяли, концентрировали и обессоливали с помощью ультрацентрифугирования. Полученный раствор наносили на колонку ионообменника (катионообменная Q-сефароза Fast-How, HR 16/10, 20 мл, фирмы Pharmacia), после чего белки повторно элюировали в градиенте 0-1 М хлористого натрия в ацетатном буфере, как описано выше. С этой колонки фитазу элюировали в 200 мМ растворе хлористого натрия. Продуктом этих стадий очистки был очищен ный препарат фитазы с удельной активностью порядка 40-50 ед/мг белка, что свидетельствует о 25-кратной очистке. Анализ чистоты частично очищенной фитазы выявил присутствие одного основного загрязняющего компонента с молекулярной массой примерно 100 кДа (фиг. 2, последовательность Е). С помощью методов изоэлектрофокусировки показано присутствие нескольких ферментов, обладающих фосфатазной активностью, в том числе 34 форм фитазы, изоэлектрические точки которых колебались от 5,0 до 5,4 (фиг. 1, последовательности А и В). Чтобы получить гомогенный препарат фитазы, осуществляли дальнейшую двукратную очистку посредством разделения компонентов частично очищенного фермента методом изоэлектрофокусировки в системе LKB Multiphor на пластинах Ampholine PAG (в диапазоне рН от 4,0 до 6,5) Белки с фосфатазной активностью (в том числе фитаза) определяли окрашиванием на общую фосфатазу, как описано выше. Соответствующие полосы вырезали из геля и элюировали активный белок посредством инкубации срезов в 10 мМ натрий-ацетатном буфере рН 5,5 в течение 16 ч. Белковые фракции анализировали с целью определения удельной активности фитазы, как описано в примере 2, тем самым дифференцируя содержащие фитазу фракции от остальных кислых фосфатаз. Конечный коэффициент очистки фитазы достигал 60-кратной величины (удельная активность очищенного белка равнялась 100 ед/мг). На этом заключительном этапе очистки удавалось также выделять различные подформы фитазы (фиг. 1, последовательности А и В). Эффективность процедуры очистки обеспечивалась использованием монокпональных антител к A ficuum. Антитела иммобилизировали на активированной цианоген-бромидом сефарозе 4В (5 мг/мл геля) и использовали полученный матрикс в колонках для иммуноаффинной хроматографии. Связывающая способность матрикса составляла примерно 1 мг фитазы/мл. Фитазу элюировали с колонки буфером с рН 2,5 (100 мМ НСІ-глицина, 500 мМ NaCI) без потери активности. Эту процедуру можно использовать для выделения гомогенной фитазы из неочищенных фильтратов культуральной среды в одну стадию с выходом 80% при 60-кратной степени очистки. В. Дегликозилирование фитазы Фитазу A. ficuum (70 мкг белка) инкубировали с 2,5 ед N-гликаназы (Genzyme) в 0,2 М натрийфосфатной буфере рН 6,8 и 10 мМ 1,10-фенантролине, в общем объеме 30 мкл. Через 16 ч после начала инкубации при 37°С степень дегликозилирования оценивали с помощью электрофореза в системе Phast System (Pharmacia). Молекулярная масса фитазы уменьшалась с 85 кДа до примерно 56,5 кДа. Окраска на сахаре реактивом Шиффа, применяемая для идентификации гликопротеиновой природы нативной фитазы, не выявила остаточных углеводных компонентов в белковом материале Полное отсутствие углеводов было дополнительно подтверждено с помощью высоко чувствительной методики блоттинга в пектине. Нативную и дегликозилированную фитазы (по 1,5 мкг) подвергали 19 27702 ской методики оценивали степень фрагментации. Для аналитического электрофореза в полиакриламидном геле использовали аппарат Phast System (Pharmacia) и 20%-гель с додецилсульфатом натрия. С целью повышения эффективности разделения малых пептидов предварительно проводили электрофорез без анализируемых проб, получая непрерывную буферную систему для данного геля (в соответствии с инструкцией). Пептиды определяли методом окрашивания серебром, который широко используется в аналогичных случаях, поскольку окраска кумасси бриллиантовым синим не позволяла выявлять самые мелкие пептиды. Результатом описанной процедуры была полная деградация фитазы, распадавшейся на пептиды с молекулярной массой менее 2,5, 36, 57 и 80 кДа. Эти пептиды выделяли методом газофазового секвенирования в условиях электрофореза в поли-акриламидном геле с трицином и додецилсульфатом натрия, как описано Schagger & Jagow (1987, Anal. Biochem. 166, 368-379), после чего проводили электроблоттинг в соответствии с ранее описанной процедурой. N-концевая последовательность фрагмента с молекулярной массой 57 кДа оказалась идентичной такой же последовательности фитазы, как она была описана Lilian (1968b, Supra), с тем исключением, что в указанном фрагменте отсутствовали первые четыре аминокислотных остатка (фиг. 1, последовательность В). N-концевые последовательности пептидов с молекулярными массами 2,5 кДа и 36 «Да показаны на фиг. 2 (последовательности А и В). В. Олигонуклеотидные зонды. Конструирование олигонуклеотидных зондов осуществляли на основании данных о последовательности аминокислотных остатков (фиг. 1,2). Их получали в синтезаторе ДНК Applied Biosystems ABI 380 В. Эти олигонуклеотиды показаны на фиг. 4-7. Пример 4. Гибридизация геномных комплексов и геномных библиотек с первым набором олигонуклеотидных зондов. Геномные ДНК A. ficuum выделяли после измельчения мицелия в жидком озоне, используя стандартные методики (в частности, методику Yelton et al., 1984, Proc. Natl. Acad. США. 14701474). Геномную библиотеку конструировали в векторе-бактериофаге лямбда EMBL 3, используя частично переваренную Sau3A хромосомную ДНК штамма NRRL 3135 A. ficuum (в соответствии со стандартной процедурой, описанной в Руководстве по лабораторному клонированию молекул /Maniatis et al., Molecular Cloning: A Laboratory Manual. Gold Spring Harbor Lab. №4, 1982/). Полученная таким образом геномная библиотека содержала 60-70-кратное количество генома А. ficuum. Контроль библиотеки на наличие бляшек без вставки осуществляли посредством гибридизации с более закрытым фрагментом фага лямбда EMBL ЗА Гибридизация бляшек с зондом лямбда EMBL ЗА не превышала 1%. Размер вставки составлял 13-17 килооснований. Для выяснения условий и свойств зондов, необходимых для скрининга геномной библиотеки, геномную ДНК переваривали несколькими рест электрофорезу в стандартном полиакриламидном геле с додецилсупьфатом натрия для переноса на мембрану PVDF (Immobilon МШіроге)в 25 мМ трисглициновом буфере рН 8,3 и 20% метаноле, в течение 16 ч. при 30 В После этого мембрану инкубировали с 1 % сывороточным альбумином крупного рогатого скота в фосфатном буферном растворе, а затем с конканавалин-А-пероксидазой (Sigma) в том же буфере (10 мкг/мл). После этого пероксидазу окрашивали 4-хлоро-1-нафтолом фирмы Sigma. Этот чувствительный метод также не выявил остаточных углеводов в дегликозилированной фитазе. После дегликозилирования фермент полностью утрачивал активность, вероятно вследствие агрегации его молекул. Пример 3. Определение аминокислотной последовательности фитазы и конструирование олигонуклеотидных зондов. А. Определение N-концевой аминокислотной последовательности. Фитазу электрофоретическим методом переносили из полиакриламидного геля с додецилсульфатом натрия или такого же геля для изоэлектрофокусировки на мембрану. Электробпоттинг осуществляли в 10 мМ ЦАРК (3-циклогексиламино-пропансульфоновой кислоте) в форме буферного раствора с рН 11,0 в присутствии метанола (10% в объемном соотношении) на протяжении 16 ч. при 30 В и 4°С. Локализацию белка определяли с помощью окраски кумасси бриллиантовым синим. Соответствующую полосу вырезали из геля, обесцвечивали в метаноле и подвергали газофазовому секвенированию. Эту процедуру повторяли несколько раз, используя несколько отдельных образцов. Полученные в этом исследовании результаты приведены на рисунке 1А (последовательности А и В). Одновременно определяли аминокислотную последовательность белка с молекулярной массой 100 кДа, который присутствовал в неочищенных препаратах. Эти данные представлены на фиг. 22, 23. Расшифрованная таким образом последовательность аминокислотных остатков характеризуется значительной степенью гомологичности последовательности кислой фосфатазы, которая была выделена из Aspergillus niger (MacRae et al., 1988, Gene, 71, 339-648). Б. Определение внутренних аминокислотных последовательностей. Фрагментация белка цианоген-бромидом. Очищенную до гомогенного состояния фитазу с помощью ультрацентрифугирования переносили в 100 мМ №НСОз, используя микроконцентратор Centricon 30 (Amicon). После этого белок лиофилизировали, разводили в 70%-ной трифторуксусной кислоте (объемное соотношение) и инкубировали с 300-кратным молярным избыточным количеством CNBr в течение 6 ч. Реакцию останавливали, разбавляя инкубационную систему водой. Полученные фрагменты снова лиофилизировали. После этого пробу разводили в буфере для электрофореза в полиакриламидном геле с додецилсульфатом натрия, содержавшем ДТТ (дитиотреитол), и с помощью указанной электрофоретиче 20 27702 рикционными ферментами, разделяли на агарозе и подвергали блоттмнгу на Genescreen в соответствии с указаниями предприятия-изготовителя. Полученные препараты гибридизировались со всеми олигонуклеотидными зондами Гибридизацию проводили в условиях, отличавшихся степенью лимитированное (6xSSC, от 40 до 60°С для гибридизации и до 0,2xSSC при 65°С для промывания). Для скрининга геномной библиотеки были выбраны зонды 1068 и 1024 (фиг. 4,5), хотя общие фрагменты ДНК, которые специфически гибридизировались бы с обоими зондами, не обнаружены. Зонд 1025 для кислой фосфатазы (фиг. 8) давал специфический дискретный сигнал гибридизации, в связи с чем он был выбран для скрининга геномной библиотеки кислой фосфатазы Применение всех трех зондов позволило выявить в геномной библиотеке гибридизирующиеся бляшки. Гибридизационный сигнал, соответствующий зонду 1025 (кислой фосфатазе), характеризовался высокими интенсивностью и воспроизводимостью. Зонды 1024 и 1068 давали гибридизационные сигналы переменной интенсивности, характеризовавшие свойства фитазы Перекрестные реакции между обеими сериями не наблюдались. Был проведен повторный скрининг всех трех серий бляшек, из восьми одиночных, способных к гибридизации бляшек, были выделены ДНК (Maniatis et at., supra) В каждой серии были идентифицированы клоны, содержавшие идентичные гибридизирующиеся фрагменты. Это свидетельствует о том, что вставки, имеющиеся в этих клонах, могут частично перекрываться в пределах одной и той же области геномной ДНК. Однако и в этом случае перекрестная гибридизация отсутствовала (при использовании двух серий специфических зондов фитазы 1024 и 1068). Таким образом, несмотря на то, что оба зонда, использовавшиеся для выделения двух серий клонов, были получены из N-концевой последовательности белка, идентифицировались и клонировались разные фрагменты геномной ДНК Все три серии клонов гибридизировались с бляшками, содержавшими мРНК, выделенными из активированного и не активированного мицелия (Northern blots, пример 6). Клоны, специфичные для кислой фосфатазы, а также выделенный из этих клонов внутренний фрагмент Sal 1 длиной 3,1 килооснований, гибридизировался исключительно с образцами индуцированной мРНК. Идентифицированная с помощью специфичных для кислой фосфатазы зондов мРНК имела длину приблизительно 1800 оснований, что согласуется с известными размерами белка (68 «Да по данным Ullah & Cummins 1987, Prep. Biochem., 17.397-422). Гибридизация специфичных для фитазы клонов со специфическими мРНК отсутствовала. В связи с этим мы пришли к выводу о том, что вышеописанная методика не позволяла клонировать ген, коди-рующий фитазу. Другой вывод состоял в том, что невозможность использования этого метода для этой цели не была связана с его несостоятельностью, поскольку его с успехом использовали для клонирования гена, кодирующего кислую фосфатазу. Клон лямбда, содержащий ген кислой фосфатазы, был передан на хранение в Центральное бюро грибковых культур в Варне, Ни дерланды (Centraal Bureaen voor Schimmeicultures, Baarn, Netherlands) 24 апреля 1989 г., где ему был присвоен входящий номер CBS 214.89. Из бляшки ZI, был выделен фрагмент Bam HI длиной 10 килооснований, который клонировали в pUC19. Этот подклон включает полный ген, кодирующий кислую фосфатазу Подклон, закодированный как 1-1 (фиг), был передан на хранение 24 апреля 1989г и получил номер CBS 213.89. Пример 5 Выделение гена, кодирующего фитазу, с использованием второго набора олигонуклеотидных зондов. Зонды конструировали на основании данных о последовательности N-концевых аминокислотных остатков в пептидных фрагментах, полученных посредством переваривания CNBr (фиг. 6, 7, зонды 1295, 1296 и 1297), и гибридизировали с геномной ДНК, как описано выше. Приемлемость этих зондов для выделения кодирующего фитазу гена снова оценивали посредством их гибридизации с геномными комплексами (Southern hybridization). На этот раз, при использовании всех трех зондов были получены гибридизационные фрагменты соответствующей длины, несмотря на то, что зонды были сконструированы на основании последовательностей неперекрывающихся областей. Гибридизация между новым набором зондов и клонами, выделенными с помощью первого набора, отсутствовала (пример 4). Поэтому были проведены специальные эксперименты с целью повторного скрининга геномной библиотеки с использованием всех трех зондов. Установлена также гибридизация подгруппы клонов (лямбда AF201, 219, 241 и 243), выделенных с помощью одного из зондов, с каждым из двух других зондов. Это говорит о том, что при использовании трех различных зондов были выделены клоны из одной и той же области генома Была предпринята попытка провести гибридизацию вновь выделенных клонов с зондами 1024 и 1083. В обоих случаях гибридизация с новыми клонами отсутствовала в условиях, при которых оба зонда давали гибриды с клонами, выделенными с их помощью (см. пример 4). Это показывает, что вновь изолированные клоны были негомологичны зондам из N-концевой последовательности фитазы. Клон лямбда - EMBL 3, который гибридизовался со всеми тремя зондами (1295, 1298 и 1297), получил наименование лямбда - AF201 (фиг. 9). Он был передан на хранение 9 марта 1969 г и получил номер CBS 155 89 Фрагмент Bam HI клона AF201 длиной 5,1 килооснований, субкпонированный в pUC19 и обозначенный как pAF 2-3 (см. фиг. 9), давал гибриды со всеми тремя олигонуклеотидными зондами и был использован для блоттинга. В этих экспериментах была выделена дискретная мРНК длиной 1800 килооснований. Эта мРНК присутствовала только в активированном мицелии. Сходные результаты были получены при использовании в качестве зондов олигонуклеотидов. Поэтому, используя новый набор зондов, идентифицировали общий фрагмент ДНК, который специфически гибридизируется с индуцированной мРНК Длина этой РНК (1800 оснований) достаточна для кодирования белка с молекулярной массой порядка 60 кДа, т. е. примерно того же размера, что и негликози 21 27702 прессии, этот ген субклонировали в соответствующем векторе и трансформировали в A. niger 402 (АТСС 9092). С этой целью выделяли ген фитазы из клона лямбда AF201 в форме фрагмента Nrul длиной 10 килооснований и проводили его клонирование в сайте Stul вектора pAN 1-8, который в качестве маркера селективности содержит ген Ые, обеспечивающий устойчивость к флеомицину (Mattem J. E and Punt P. J. , 1988, Fungal Genetics Newsletter, 35, 25). Полученный материал получил наименование pAF 28-1 (фиг. 9) и был трансформирован в A. niger 402 с помощью методики, описанной в примере 9, с тем исключением, что протопласты наслаивали на минимальную питательную среду для Aspergillus, в которую добавляли 30 мкг флеомицина/мл, и отверждали примесью 0,75%-ного агара. Отдельные трансформанты после выделения подвергали очистке и оценивали их продуктивность во встряхиваемых колбах, как описано в примерах 1 и 2. В качестве контроля использовали трансформанты, содержавшие только вектор, или нетрансформированные клетки-хозяева (табл. 3). Было установлено, что фитаза, реагировавшая со специфическими моноклональными антителами к фитазе A. ffcuum. синтезировалась только A. niger 402, содержащими pAF 28-1. Фермент, дававший реакцию с указанными антителами, элюировали с колонки для иммунно-аффинной хроматографии при рН 2,5. По молекулярной массе, степени гликозилирования, изоэлектрической точке и удельной активности он был неотличим от фитазы из A. ficuum. Эти данные со всей очевидностью подтверждают, что в клетках A. niger 402, трансформированных pAF 28-1, имеет место экспрессия фитазы, практически идентичной ферменту из A. ficuum. Аналогичная экспрессия в обоих типах клеток, служивших контролем, не зарегистрирована. лированный белок Очевидно, что выделенные фрагменты содержат по крайней мере часть гена, кодирующего фитазу. Пример 6. Выделение "индуцированной" и "неиндуцированной" мРНК. Из литературы известно, что биосинтез фитазы в клетках A. ficuum строго контролируется зависимым от фосфата механизмом (Han and Callagher, 1987, J. Indust. Mecrobiol., 1, 295-301). В связи с этим мы считали, что, показав наличие сходного механизма регуляции выделенного гена, мы получим доказательство клонирования этого гена. Для того, чтобы выделить мРНК, синтезированную в продуктивных и непродуктивных условиях, клетки A. ficuum (штамм NRRL 3135) выращивали следующим образом. Сначала в течение ночи споры проращивали в неиндуцирующей среде. На следующий день собирали мицелий, отмывали его стерильной водой и инокулировали в активирующую или неактивирующую среды следующего состава: 20 г/л кукурузного крахмала; 7,5 г/л глюкозы; 0,5 г/л MgSO4»7H2O; 0,2 г/л FeSCV •7НгО и 7,2 г/л КНОз. Для индукции фитазы в среду добавляли до 2 г/л кукурузной вытяжки, тогда как неиндуцированная среда содержала 2 г/л К2НРО4. Мицелий выращивали на протяжении по меньшей мере еще 100 ч., отбирая пробы через определенные промежутки времени. Продукцию фитазы контролировали с помощью методики ее определения, описанной в примере 2А. Денатурированную мРНК отделяли посредством электрофореза и использовали для блоттинга на Genescreen plus. Полученные пятна гибридизировали с меченным 32 Р pAF 2-3 или с изолированным из pAF 1-1 фрагментом Sail длиной 3,1 килооснований из примера 4 (для кислой фосфатазы). Результаты этого эксперимента представлены в табл. 2 Штаммы грибов выращивали в активирующей среде (пример 6). Пробы отбирали через 96 ч после начала культивирования. Пример 8- Характеристика гена фитазы. Клоны лямбда, содержавшие ген фитазы, анализировали посредством переваривания различными рестрикционными ферментами. Карта геномной области, включающей ген фитазы, представлена на фиг. 9. Ранее (пример 5) было показано, что присутствующий в pAF 2-3 фрагмент Bam HI длиной 5,1 килооснований, содержит по крайней мере часть гена фитазы. Более того, олигонуклеотидные зонды 1295 и 1297 оказались способными гибридизироваться со вставкой Sail pAF 2-7 (см. фиг. 6, 7; положения клонов pAF 2 показаны на фиг. 9), тогда как зонд 1296, по-видимому, соединяется ссайтом Sail между фрагментами pAF 2-6 и pAF 2-7. Результаты этих экспериментов показывают, что кодирующая фитазу последовательность локализована в левосторонней части вставки Ват НІ в pAF 2-3. В ходе последующих исследований была полностью расшифрована нуклеотидная последовательность вставок плазмид pAF 2-3, pAF 2-6 и pAF 2-7. Для этой цели использовали методику прерывания дидезокси-цепей (Sanger et al., 1977, Proc. Natl. Acad. Sci. USA, 74, 5463-5467) и мето Положительную гибридизацию специфичного для фитазы фрагмента BamHI длиной 5,1 килооснований и специфичного для кислой фосфатазы фрагмента Sail длиной 3,1 килооснований с изолированной мРНК наблюдали только в тех случаях, когда клетки выращивались в условиях, индуцирующих биосинтез фитазы и кислой фосфатазы. На основании этих результатов был сделан вывод о том, что выделенные гены регулируются постулированными для фитазы и кислой фосфатазы механизмами. Гибридизация пятен со специфичным для фитазы фрагментом Bam HI длиной 5,1 килооснований (А) или специфичным для кислой фосфатазы фрагментом Sail длиной 3,1 килооснований (В), использовавшимися в качестве зондов. Знак +а указывает на присутствие мРНК фитазы длиной 1800 оснований или мРНК кислой фосфатазы длиной 1800 оснований. Относительную фитазную активность определяли в пробах, полученных через 24 ч. после начала культивирования. В активированных культурах фитазная активность была в 10 раз выше, чем в неактивированных. Пример 7. Доказательство клонирования гена фитазы. Для получения бесспорного доказательства успешного выделения кодирующего фитазу гена и изучения возможности повышения уровня его экс 22 27702 дику бомбардировки, описанную Messing et a!. (Nucl. Acids Res. 1981, 9, 309-321). Специфические олигонуклеотиды синтезировали на основании данных о нуклеотидной последовательности, полученных в процессе секвенирования. Полная нукпеотидная последовательность клонов pAF 2-3, pAF 2-8 и pAF 2-7, включающая хромосомный локус гена фитазы, представлена на фиг. 11-17, а схематическое изображение локусана фиг 18 Анализ способности полной последовательности кодировать белок показал, что N-концевая последовательность аминокислотных остатков в сформировавшейся молекуле белка кодируется нуклеотидным участком, начинающимся в положении 381 (по данным Ullah N-конец локализован в положении 369). Установлено также, что Nконцевые последовательности внутренних пептидных фрагментов с молекулярными массами 38 кДа и 2,5 кДа (см. фиг. 2, последовательности В и А) кодируются нуклеотидными последовательностями, которые начинаются в положениях соответственно 1101 и 1548 Открытая считываемая последовательность заканчивается нуклеотидом в положении 1713. Эти результаты со всей очевидностью подтверждают наличие кодирующей фитазу последовательности ДНК й описанном выше хромосомном локусе. В считываемой последовательности, примыкающей к считываемой последовательности зрелого белка, в восходящем направлении от хромосомной нукпеотидной последовательности, которая кодирует полную молекулу фитазы, не обнаружен стартовый ATG кодон. Тем не менее, на основании свойств пограничной между интроном и экзоном зоны можно постулировать присутствие интрона между нуклеотидами в положениях 254 и 355. Это позволяет предположить наличие ATG кодона в положении 210 последовательности, включающей последовательность для кодирования зрелой фитазы. Расчетная последовательность аминокислотных остатков в N-концевом участке полностью соответствует закономерностям строения последовательности, ответственной за секреторный сигнал, которая была установлена von Heyne (Eur. J. Biochem., 1963,133,17-21). Для подтверждения высказанных гипотез была предпринята попытка выделить «ДНК фитазы с помощью амплификации специфической затравкой, с использованием в качестве матрицы общей популяции мРНК/ДНК Процедура выделения описана ниже. Выделение поли-А+ РНК из Aspergilius ficuum. Общую РНК выделяли из штамма NHHL 3135 А. ficuum, культивировавшегося в активирующей среде, как описано в примере 6. Сухой мицелий замораживали в жидком азоте и измельчали. После этого порошок гомогенизировали в гомогенизаторе uetra-Furrax в течение 1 мин при максимальной скорости в 3 М ZiCI и 6 М мочевине при 0°С. Гомогенат оставляли на ночь при 4°С, как описано Auffrey and Rougeon (Eur J. Biochem., 107, 303-314, 1980). Общую клеточную РНК получали после центрифугирования при 16000 g в течение 30 мин и двух последовательных экстракций смесью фенола, хлороформа и изоамилового спирта (50:48:2), РНК осаждали этанолом и разводили в 1 мл 10 мМ трис-НСІ буфера (рН 7,4) с 0,5% додецилсульфатом натрия. Для отбора поли-А+ РНК общую РНК прогревали при 60°С в течение 5 мин, доводили до 0 5 М раствором NaCI и наносили на колонку из олиго (йТ)-целлюлозы. После нескольких промывок раствором, содержащим 10 мМ трис-НСІ буфер рН 7,4 с 0,5% додецилсульфата натрия и 0,1 М NaCI, поли-А+ РНК элюировали 10 мМ трис-НСІ буфером рН 7,4 и 0,5%-ным додецилсульфатом натрия. Получение комплекса мРНК/кДНК. Для синтеза первой нити кДНК 5 мкг поли-А+| РНК разводили в 16,5 мкл Нго и добавляли в полученный раствор следующие компоненты. 2,5 мкл РНазииа (30 ед/мкл), 10 мкл буферного раствора с 50 мМ трис-НСІ рН 7,6, 6 мМ MgCi2 и 40 мМ KCI; 2 мкл 1 М KCI, 5 мкп 0,1 М ДТТ, 0,5 мкп олиго (dT)i21 (2,5 мг/мл), 5 мкп 8 мМ dNTP-mix, 5 мкп сыворо8 точного альбумина крупного рогатого скота (1 мг/мл) и 2,5 мкл ревертивной транскриптазы Моloney MLV (200 ед/мл). Смесь инкубировали в течение 30 мин при 37°С, реакцию останавливали добавлением 10 мкл 0,2 М ЭДТА и 50 мкл НгО. Для экстракции использовали хлороформ, а после центрифугирования к супернатанту последовательно добавляли 110 мкл 5 М NH4AC и 440 мкл этанола. Комплекс мРНК/кДНК осаждали смесью этанола с сухим льдом в течение 30 мин. Осажденный комплекс собирали посредством центрифугирования, отмывали 70%-ным этанолом, охлажденным до 0°С, и разбавляли 20 мкл НгО. Клонирование фрагментов кДНК фитазы. Последовательности кДНК, кодирующие фитазу, выделяли с помощью цепной полимеразной реакции (ЦПР) в составе двух фрагментов. Исходя из кодирующей фитазу геномной последовательности, показанной на фиг. 11-17, конструировали оли-гонуклеотидные затравки: Oligo 1 : 5 ' - GGG. TAG. ААТ. ТСА ААА ATG. GGC. GTC. ТСТ. GCT. GTT. СТА-31 Oligo 2- 5' - ACT. GAC. GAA TTC. GTG. CTG. GTG. GAG. ATG. GTG. TCG-3' Oligo 3: 51 - GAG. CAC. CAA GCT. GAA GGA TCC-3' Oligo 4: 51 - AAA CTG. CAG. GCG. TTG. AGT. GTG. ATT. GTT. TAA. AGG. G-3f Олиго 1 содержит нуклеотидную последовательность, расположенную в нисходящем направлении от стартового кодона ATG (в положениях 210-231) и фланкированную по б'-границе сайтом EcoRI. Олиго 2 содержит нуклеотидную последовательность, непосредственно примыкающую к восходящему концу сайга Sail (положения 1229-1109) и также фланкированную дополнительным сайтом EcoRI. Олиго 3 содержит нуклеотидную последовательность, локализованную рядом с сайтом Bam HI (положения 845-866). Олиго 4 содержит нуклеотидную последовательность, расположенную в нисходящем от стоп-кодона фитазы направлении (в положениях 1890-1867) и фланкированную дополнительным сайтом Pst 1. Цепную полимеразную реакцию осуществляли в соответствии с рекомендациями фирмы-изготовителя Tag-полимеразы (Cetus). В качестве матрицы использовали раствор (1,5 мкл), содержащий вышеописанные гибриды мРНК/кДНК, а в 23 27702 качестве затравок - олиго 1 и 2 (по 0,3 мкг каждой) в реакции амплификации N-концевой части кДНК фитазы и олиго 3 и 4 в реакции амплификации Сконцевой части той же кДНК (см. фиг. 19,20). После денатурации в течение 7 мин при 100°С и добавления 2 ед Tag-полимеразы реакционную смесь подвергали 25 циклам амплификации в ДНК -амплификаторе модели Perkin-Elmer/Cetus (каждый цикл по 21 при 55°С, 3 при 72°С, 1' при 94°С. В последнем цикле стадию денатурации опускали. После переваривания (Eco RI для N-концевой части кДНК и Bam HI и Pst І для С-концевой части кДНК) оба фрагмента кДНК клонировали в соответствующие сайты pTZ18R (Promega). Нуклеотидные последовательности обоих полученных фрагментов определяли методом прерывания дидезокси-цепей (Sanger, supra), используя синтетические олигонуклеотиды, сконструированные на основании данных о последовательности хромосомного гена фитазы. Эти олигонуклеотиды служили затравками, а в качестве матрицы применяли общую амплифицированную ДНК, а также клонированные фрагменты кДНК. Последовательность области кДНК, кодирующей фитазу, и расчетная аминокислотная последовательность этого фермента показаны на фиг. 19,20. Анализ последовательности кДНК подтвердил постулированную ранее локализацию интрона и показал отсутствие в пределах хромосомной генной последовательности других интронов. Ген фитазы кодирует первичный продукт трансляции, состоящий из 467 аминокислотных остатков, с молекулярной массой 51091. Процессинг первичного продукта с отщеплением сигнального пептида, приводит к образованию зрелого белка с фитазной активностью, который построен из 444 аминокислотных остатков при молекулярной массе 48851 или из 448 остатков (включая 4 первые остатка, о которых сообщал Ullah) при молекулярной массе порядка 49232. Пример 9. Сверхэкспрессия фитазы в грибах рода Aspergillus после введения дополнительных геномных последовательностей ДНК фитазы. Конструирование вектора экспрессии. Все векторы конструировали с помощью стандартных методов молекулярной биологии, как описано в Руководстве по лабораторному клонированию молекул (Maniatis et al., Molecular cloning: A Laboratory manual. Celd spring Harbor Laboratory, NY. 1982). Вектор экспрессии pAF 2-2S получали посредством субкпонирования фрагмента ДНК pVUII длиной 6 килооснований из геномного клона фитазы лямбда AF201 в сайт Sma I pUC19. Полученная таким образом плазмида была обозначена шифром pAF. 2-2 (фиг. 9). В качестве маркера селекции для трансформирования Aspergillus использовали фрагмент ДНК EcoRI/. Kpn1 плазмиды pGW 325 (Wernarsk. Thesis, Agr. Univ. Wageningen, Netherlands, 1986), содержащий гомологичный ген amdS aspergiiius nidulans. Этот фрагмент вставляли в сайты EcoRI/Kpn1 pAF2-2. Синтезированный таким образом вектор экспрессии получил обозначение pAF2-2S. Он показан на фиг. 21. А. Сверхзкспрессия фитазы в A. ficuum NRRL 3135. Плазмиду pAF2-2S интродуцировали в клетки штамма NRRL 3135 A. ficuum с помощью методики трансформации, описанной Tilburn J. et al., (Gene, 1983,26, 205-221) и Kelly J. and Hynes M. (EMBO, J., 1985, 4, 457-479) со следующими изменениями: - мицелий выращивали на минимальной питательной среде для грибов Aspergillus (Cove D., Biochem. Biophys. Acta., 1966, 113, 51-56), обогащенной 10 мМ аргинина и 10 мМ пролина, при 30°С на протяжении 16 ч в колбе, встряхиваемой с частотой 300 оборотов/мин, -для формирования протопластов вместо хеликазы применяли Novozym 234 (NOVO Industri) - через 90 мин после образования протопластов в суспензию добавляли 1 объем буфера STC (1,2 М сорбитол, 10 мМ трис-НСІ рН 7,5, 50 мМ СаСЬ) и центрифугировали ее при 2500д и 4°С в течение 10 мин во вращающемся роторе; затем протопласты отмывали и ресуспендировали в буфере STC до получения концентрации 108 клеток/мл, - к 100 мкл суспензии протопластов добавляли плазмидную ДНК в 10 мкп буфера ТЕ (10 мМ трисНСІ рН 7,5 и 0,1 мМ ЭДТА); - после инкубации суспензии протопластов и ДНК при 0°С в течение 25 мин в нее по каплям добавляли 200 мкл раствора полиэтиленгликоля (25% полиэтиленгликоль 4000 фирмы Merck) и 10 мМ трис-НСІ рН 7,5 с 50 мМ СаСЬ- Затем доливали еще 1 мл раствора полиэтиленгликоля (60% полиэтиленгликоля 4000 в 10 мМ трис-НСІ рН 7,5 с 50 мМ СаСІг), медленно и при непрерывном перемешивании. После инкубации при комнатной температуре суспензию разбавляли буфером STC и перемешивали посредством взбалтывания и последующего центрифугирования при 2000д и 4СС в течение 10 мин. Протопласты осторожно ресуспендировали в 200 мкл буфера STC и наслаивали на минимальную питательную среду для грибов Aspergillus, содержавшую 20 мМ ацетамида в качестве единственного источника азота, а также 15 мМ CSCI и 1 М сахарозы, и отверждавшуюся 0,75%-ным бактериологическим агаром #1 (Oxoid). Рост продолжался при 35°С в течение 6-10 дней. Выделяли отдельные трансформанты, обозначавшиеся как SP4, SP7 и SP8, очищали их и анализировали на способность продуцировать фитазу во встряхиваемых колбах, используя процедуру, описанную в примерах 1 и 2 Аналогичные операции проводили с трансформантами, содержавшими только вектор (ген amdS в pUC 19), или с нетрансформированными хозяевами (контрольные эксперименты). Штамм грибов выращивали в условиях активации (см. пример 6), пробы для анализа отбирали спустя 96 ч после начала культивирования. Анализы включали определение фитазной активности (табл. 4) и изоэлектрическую фокусировку в полиакриламидном геле. Пробы, полученные из ферментированных культур A. ficuum и A. ficuum pAF2-2S SP7, выращивавшихся в идентичных условиях, в равных объемах наносили на полиакриламидный гель для изоэлектрофокусировки (Phast System, Pharmacia) в диапазоне рН от 4,5 до 6,0. Электрофорез проводили в соответствии с указаниями предприятияизготовителя системы. Затем гель окрашивали кумасси бриллиантовым синим на общие белки 24 27702 (фиг-23) или красителем, выявлявшим общую фосфатазную активность, как описано в примере 2 (фиг. 22). Кроме того, использовали образец фитазы А ficuum, очищенной до гомогенного состояния посредством иммунноаффинной хроматографии, как описано в примере 7, либо как таковой, либо в смеси с культуральной жидкостью. Как отмечалось ранее, фитаза присутствует в отдельных пробах в разных изоформах (указаны звездочками). Очищенная фитаза при обоих способах окраски дает хорошо видимые полосы 3 и 4, соответствующие двум основным изоферментам (А и В). Аналогичные полосы едва заметны при окраске фитазы из родительского штамма А. ficuum В трансформированном штамме pAF 2-2S SP7 они значительно более интенсивны Б. Сверхэкспрессия фитазы в грибах A niger CBS 513.88 Вектор экспрессии pAF 2-2 интродуцировали в клетки A. niger CBS 513.88 в процессе трансформации, как описано для A. ficuum Отдельные трансформаты выделяли, очищали и определяли их способность продуцировать фитазу во встряхиваемых колбах в условиях индуцированного роста, как описано в примере 6. Уровень экспрессии фитазы в отдельных трансформантах, обозначенных как pAF 2-2S*8, *20 и *33, а также в контрольных штаммах определяли, как описано в примере 9А и показано в табл. 5. Уровень экспрессии фитазы в трансформированных клетках. A. niger был сопоставим с ее уровнем в трансформированных A ficuum. Кроме того, полученные результаты показывают, что промотор фитазы A ficuum а»сгивен в A. niger. Дальнейшие гь'ализ проводили с использованием культуральной с ^ г ч ^ трансформированных клеток pAF 2-2S*8, которую подвергали электрофорезу в полиакриламидном геле с рН 4,5-6,0 для изоэлектрофокусировки (Phast System, Pharmacia) в соответствии с ранее описанной процедурой Равные объемы супернатанта культуральной жидкости родительского штамма и трансформированных клеток pAF 2-2S*8, выращивавшихся в идентичных условиях, наносили на гель, который окрашивали по завершении электрофореза, как описано выше. Родительский штамм A. niger синтезировал очень небольшие количества фитазы и ее не удавалось выявлять методом гелевого электрофореза. Штамм pAF 2-2S*8 продуцировал примерно в 90 раз больше фермента, чем родительский штамм. Это различие хорошо видно на фиг. 24, 25. Выявлено несколько изоформ фермента (обозначены звездочками). Окрашивание на общие белки показало, что интенсивность соответствующих полос резко увеличивается, тогда как полосы других белков отсутствуют. Пример 10. Экспрессия фитазы в A. niger, трансформированных векторами экспрессии, содержащими ген фитазы A. ficuum, слитый с промотором и/или сигнальной последовательностью гена амилоглюкозидазы (AG) A. niger. Конструирование векторов экспрессии. Для достижения сверхэкспрессии фитазы в А. niger были получены дополнительные блоки экспрессии, в которых ген фитазы A. ficuum контролируется промотором амилоглюкозилазы (AG) А. niger в сочетании с различными сигнальными последовательностям*/ В p18FYT3 и p24FYT3 соответствующие 18 и 24 - членные лидирующие аминокислотные последовательности (аа) гена AG из A. niger слиты с фрагментом гена фитазы, который кодирует зрелый белок В векторе экспрессии pFYT3 последовательность промотора AG слита с последовательностью, кодирующей фитазу, которая включает лидирующую последовательность для биосинтеза этого белка. Конструирование p18FYT3. Слияние промотора AG и 18 аа AG - лидирующей последовательности с последовательностью, кодирующей полностью сформированную фитазу, осуществляли с помощью цепной полимеразной реакции. При этом использовали две различные матрицы: pAF 2-2S, содержащую, как указано выше, полный ген фитазы, и рАВ6-1плазмиду, включающую полный локус AG из А. niger, которая была выделена из плазмидной библиотеки A. niger, содержащей фрагменты Hindlll длиной 13-15 килооснований в pUC19. Для выделения использовали AG - специфичные олигонуклеотиды: AG-1: 5-GACAATGGCTACACCAGCACCGCAACGGACATTGRRRGGCCC-3' AG-2: 5-AAGCAGCCATTGCCCGAAGCCGAT-31 Оба олигонуклеотида получены на основании нуклеотидной последовательности для A. niger (Boel et at., 1984. EMBOJ., 3., 1097-1102: Boel et al., 1984, Мої. & Cell. Biol., 4, 2306-15). Олигонуклеотидные зонды конструировались, исходя из строения последовательностей, окружающих интрон 2: олиго AG-1 локализован в положении З1 по отношению к интрону и имеет такую же полярность, как AG мРНК, а олиго AG-2 расположен вверх от интрона 2 и антипараллелен AG мРНК. Плазмида рАВ6-1 содержит ген AG во фрагменте Hind Ш длиной 14,5 килооснований. В качестве затравок для амплификации цепной полимеразной реакции применяли четыре синте-тические олигонуклеотида, имеющих показанное ниже строение: Oligo 1: 5-CTCTGCAGGAATTCAAGCTAG-31 (AG-специфичная последовательность вокруг EcoRi - сайта, примерно на 250 килооснований вверх от ATG - стартового кодона Oligo 18-2: 5-CGAGGCGGGCACTGCCAGTGCCAACCCTGTGCAGAC-31 зрелая фитаза ^ 18 АА AG-лидиру-ющая последовательность Oligo 18-3: 5-GTCTGCACAGGGTTGGCACTGG-CAGTCCCCGCCTCG-3' 18 аа AG-лидирующая последовательность - зрелая фитаза Oligo 4: 5-GGCACGAGGATCCTTCAGCTT-31 . (специфичная для фитазы последовательность, локализованная на сайге BamHI в положении 861). Цепную полимеразную реакцию осуществляли в соответствии с методикой Saiki et a!., 1988, Science 239, 487-491), с небольшими изменениями (см. пример 8). Для слияния последовательностей AG с последовательностями, кодирующими фитазу, ставили две отдельные цепные полимеразные реакции. 25 27702 последовательность - зрелая фитаза Проводили две разные цепные полимеразные реакции. В первой из них в качестве матрицы использовали рАВ 6-1, а олигонукпеотиды 1 и 24-2 применяли в качестве затравок для амплификации фрагмента ДНК длиной 318 пар оснований, который содержал З'-участок промотора AG и 24 аа AG-лидирующую последовательность, фланкированную по З'-границе 18 нукпеотидами гена фитазы. Во второй реакции в качестве матрицы применяли pAF 2-2S, а олигонукпеотиды 24-3 и 4 использовали для затравки при амплификации фрагмента ДНК, содержащего 5'-участок гена фитазы, фланки-рованный по 5'-границе 18 нуклеотидами 24 аа AG - лидирующей последовательности Процедура амплификации в схематическом виде представлена на фиг. 29. На заключительном этапе конструирования вектора экспрессии p24FYT3 с использованием плазмид p25FYT1 и p24FYT2, применяли ту же методику клонирования, которая описана для случая получения вектора p18FYT3 через промежуточные стадии конструирования p18FYT1 и P18FYT2 (фиг. 29-31). Конструирование pFYT3. Слияние AG - промотора с последовательностью гена фитазы, включавшего лидирующую последовательность, осуществляли в процессе амплификации цепной полимеразной реакции, как описано выше при конструировании p18FYT3, с тем отличием, что применяли следующие олигонуклеотиды: Oligo fyt-2: 5-AACAGCAGAGACGCCCATTGCTGAGGTGTAATGATG-3' лидирующая последовательность « » AG-промотор • Oligo fyt-3: 5-CATCATTACACCTCAGCAATGGGCGTCTCTGCTGTT-31 AG - промотор « » лидирую• щая последовательность Ставили две разные цепные полимеразные реакции. В первой из них в качестве матрицы использовали рАВ 6-1, а олигонуклеотиды 1 и fyt-2 служили в качестве затравок при амплификации фрагмента ДНК длиной 282 пары оснований, содержащего З'-участок AG-промотора, фланкированного по З'-границе 18 нуклеотидами лидирующей последовательности фитазы. Во второй реакции в качестве матрицы использовали рАГ 2-2S, а олигонукпеотиды fyt-2 и 4 служили для затравки при амплификации фрагмента ДНК, содержащего 5'-участок гена фитазы (включая ли-дирующую последовательность фитазы) и флан-кированного по 5'-границе 18 нукпеотмдами AG-промотора. Процедура амплификации в схемати-ческом виде представлена на фиг. 29. На заключительном этапе конструирования вектора экспрессии pFYT3 через промежуточные плазмиды pFYT1 и pFYT2, применяли методику кпонирования, описанную при конструировании p18FYT1 и p18FYT2 для получения блока экспрессии p18FYT3 (фиг. 29-31). Экспрессия гена фитазы под контролем промотора AG В A. niger Из описанных выше блоков экспрессии фитазы посредством переваривания Hind III удаляли последовательности Е coli. После этого штамм CBS 513.88 A. niger (передан на хранение 10 ок В первой из них для амплификации фрагмента ДНК длиной 300 пар оснований, содержащего 3'участок AG - промотора и 18 аа AG-лидирующую последовательность, фланкированную по З'-границе нуклеотидами гена фитазы, использовали в качестве затравок олигонукпеотиды 1 и 18-2, а в качестве матрицы - рАВ 6-1. Во второй реакции использовали матрицу pAF 2-2 и олигонукпеотиды 18-3 и 5 в качестве затравок для амплификации фрагмента ДНК длиной 600 пар оснований, содержащего 5'-участок гена фитазы, фланкированный по 5'-границе 18 нукпеотидами сигнального пептида AG. Процедура амплификации в схематическом виде показана на фиг. 27. Полученные таким образом два фрагмента ДНК очищали посредством электрофореза в полиак-риламидном геле и преципитации этанолом, а затем использовали в качестве матриц в третьей цепной полимеразной реакции с олигонукпеотидами 1 и 4 для затравки при слиянии AGфитазы. Образовавшийся при этом фрагмент ДНК переваривали EcoRI и BamHI и субкпонировали в pTZ18R. Полученный комплекс секвенировали и обозначали как P18FYT1. Остальная, восходящая часть промотора AG длиной 3,5 килооснований была получена посредством переваривания рАВ 6-1 Крп1 и частично EcoRI, а затем присоединена к фрагменту EcoRI/BamHI p18FVTI длиной 1,1 килооснования и клонирована в сайты Kpnl/MamHI pTZ18R. Полученная описанным способом плазмида показана на фиг. 29-31. Дополнительный рестрикционный участок Hind III индродуцировали, используя вставку синтетического фрагмента 5' AATTCAAGCTTG 3" 3' GTTCGAACTTAA 51 в сайт EcoRI, фланкирующий ген amdS pAF22S. Полученной таким образом плазмиде присваивали обозначение pAF2-2S (фиг. 28) и использовали ее в качестве стартовой плазмиды для замены последовательностей промотора фитазы фрагментами ДНК, полученными в результате слияния AG-фитазы в цепной полимеразной реакции. На заключительном этапе конструирования плазмиды p18FYT2 и pAF2-2S переваривали Крп! и частично BamHI. Фрагмент ДНК p18FYT2 длиной 4,6 килооснований и фрагмент ДНК pAF 2-2S длиной 11 килооснований после выделения подвергали очистке посредством гелевого электрофореза, а затем лигировали и переносили в Е coli. Полученный этим способом вектор экспрессии получил обозначение p18FYT3 (фиг. 29-31). Конструирование p24FYT3. Слияние - промотора и 24 аа AG-лидирующей последовательности с последовательностью, кодирующей зрелую фитазу, осуществляли в процессе амплификации цепной полимеразной реакции по методике, описанной выше для конструирования p18FYT3, с тем отличием, что в качестве затравок использовали другие олигонукпеотиды: Oligo 24-2: 5-CGAGCCGGGGACTGCCAGGCGCTTGGAAATCACATT-3' зрелая фитаза 24 АА AG-лидирующая последовательность Oligo 24-3: 5-AATGTGARRRCCAAGCGCCTGGCAGTCCCCGCCTCG-31 24 аа AG-лидирующая 26 27702 тября 1988 г.) трансформировали фрагментом ДНК в количестве 10 мкг, как описано в примере 9. Из каждого блока экспрессии выделяли индивидуальные трансформаты A. niger Споры высевали на селективные ацетамид-агаровые пластины. Споры каждого трансформанта собирали после выращивания клеток на пластинах, покрытых агаром с 0,4% картофельной декстрозой (Oxoid, England), при 37°С в течение 3 дней. Продукцию фитазы оценивали во встряхиваемых колбах при следующих условиях культивирования. Примерно 108 спор вносили в 100 мл исходной среды, содержавшей 1 г/л КН2РО4, 30 г/л мальтозы, 5 г/л дрожжевого экстракта, 10 г/л казеинового гидролизата, 0,5 г/л MgSCWI^O и 3 г/л твина 80, рН полученной смеси доводили до 5,5. После культивирования во вращающемся сосуде при 34°С в течение ночи 1 мл растущей культуры переносили в 100 мл основной среды: 2 г/л КН2РО4, 70 г/л мальтодекстрина (Maidex MDO3, Amylum), 12,5 г/л дрожжевого экстракта, 25 г/л казеинового гидролизата, 2 г/л K2SO4; 0,5 г/л MgSCWH 2 O; 0,03 г/л ZnCI2; 0,02 г/л CaCI2, 0,05 г/л MnSO4«4H2O и FeSO4, рН полученной смеси доводили до 5,6. Мицелий выращивали на протяжении по меньшей мере 140 ч. Продукцию фитазы оценивали, как описано в примере 2. Результаты этой оценки с использованием нескольких произвольно выбранных трансформантов из каждого блока экспрессии, показаны в табл. 6. Продукция фитазы несколькими штаммами А. niger CBS 513 88, трансформированными плазмидами, которые содержат ген фитазы A. ficuum, контролируемый промотором AG A. niger в сочетании с различными лидирующими последовательностями. Эти данные убедительно свидетельствуют о высоком уровне экспрессии фитазы в трансформированных клетулу А і) г,ол в которых ген фитазы контролируется AG - прело гором A niger. Они показывают также, что максимальная продукция фитазы достигается при использовании вектора экспрессии pFYT3, который включает лидирующую последовательность фитазы. При использовании сходных векторов экспрессии, в которых имеется безинтронный ген фитазы (после трансформации в A. niger), экспрессия фитазы была сопоставима с таковой в A. niger, трансформированных. Дополнительно супернатанты культур клеток, трансформированных pFYT3 # 205 и # 282, подвергали электрофорезу в полиакриламидном геле для изоэлектрофокусировки в диапазоне рН от 4,5 до 6,0. Равные объемы супернатантов из культур родительского штамма A. niger и обоих трансформантов, выращивавшихся в идентичных условиях, наносили на гель и по окончании электрофореза окрашивали, как описано в примере 9. Родительский штамм A. niger синтезировал очень небольшие количества фитазы, которую не удавалось определить использовавшимся методом. Штаммы pFYT3 # 205 и # 282 синтезировали соответственно в 250 и 1400 раз больше фитазы по сравнению с родительским штаммом (сравните продукцию фитазы по сравнению с родительским штаммом и сравните продукцию фитазы по данным табл. 4 и 5). Это различие особенно хорошо иллюстрируется фиг 24, 25. Идентифицированы несколько изоформ фитазы (обозначены звездочками). Окраска на общие белки сопровождалась появлением чрезвычайно интенсивных полос фитазы, тогда как полосы, соответствующие другим основным белкам, отсутствовали. Пример 11 Сверхэкспрессия фитазы в А. ficuum и A. n.ger при культивировании в промышленных масштабах A A. ficuum Штаммы pAR 2-2S # 4 и NRRL 3135 A. ficuum культивировали, как описано в примере 1. Оба типа трансформированных клеток синтезировали примерно в 50 раз больше фитазы чем клетки дикого штамма того же гриба. Сверхэкспрессия фитазы трансформированными клетками A. ficuum, содержащими множественный ген фитазы. Клетки культивировали, как описано в примере 1 Б. A. niger Штамм A. niger pAF2-2S # 8, трансформированный штамм A. niger CBS 513.88 и родительский штамм A. niger культивировали, как описано в примере 1. Трансформированные клетки синтезировали примерно в 1000 раз больше фитазы по сравнению с исходным родительским штаммом А. niger (табл. 8). Сверхэкспрессия фитазы трансформированными клетками A. niger (CBS 513.88), содержащими множественный ген фитазы. Клетки культивировали, как описано в примере 1. Пример 12. Для конструирования вектора pREPFYT3, с помощью которого достигались одновременно экспрессия фитазы и замена гена AG, плазмиду pFYT3 переваривали Крп1. Полученный линейный фрагмент ДНК Крп1 использовали для лигирования в двух разных случаях Лигирование 1 с использованием адаптера Kpnl-Hindlll: 5' CGGGGG - 3' 3 ' - CTAGGCCCCCTCGA - 5 ' Kpnl Hindlll Лигирование 2 с использованием адаптера Kpn1-Hindlll* , в котором рестрикционный участок Hind Hi не сохраняется после лигирования: 5'CGGGA -3' 3 ' - CATGGCCCCTTCGA КрШ - 5'. HindiII Последовательность, полученную при лигировании 1. частично переваривали Hindlll После удаления фрагмента, содержащего ген amdS, посредством гелевого электрофореза, остаточный фрагмент ДНК переводили посредством лигирования в кольцеобразную форму и переносили в Е colt. Полученную таким образом плазмиду обозначали как pFYT3 amdS (см. фиг. 32). Последовательность, полученную в результате лигирования 2, также переваривали H/ndlll, фрагмент ДНК Hind Ill/Hind 111* длиной 4 килооснования, содержащий ген amdS, выделяли с помощью электрофореза и лигировали с частично переваренной Hind ill плазмидой Hindlll/Hindlll*, после чего ее переносили в Е соїі. Плазмида, у 27 27702 которой на З'-конце гена фитазы имелся ген amdS, получила обозначение pFYT31NT (см. фиг. 33). Для интродуцирования фрагмента Sall/Hindiil ДНК плазмиды рАВ6-1 длиной 6 килооснований, содержащего З'-фланкирующую AG - область, плазмиду pFYT3INT частично переваривали Hind III иприсоединяли сначала к адаптеру 5 ' -AGCTAGGGGG -3' 3' Пример 13. Консервация гена фитазы в разных видах микроорганизмов. Для выяснения степени консервативности гена фитазы в микроорганизмах проводили гибридизационныи анализ хромосомных ДнК десяти различных видов, используя в качестве зонда кДНК фитазы A. ficuum. Хромосомные ДНК для анализа получали из нитчатых грибов, дрожжей и бактерии Из каждой группы организмов отбирали ограниченное число видов, в частности: нитчатые грибы Penicillium chrysogenium и Aspergillus niger, дрожжи Saccharomyces cerevisiae и Kluyveromyces betis, такие прокариотные организмы, как грам-положительные формы, Bacillus subtilis, Clostridium Tnermocellum, Streptomyces lividans, а также грам-отрицательные бактерии Pseudomonas aerugmosa. Высокомолекулярные хромосомные ДНК этих видов переваривали pVU II и Bam HI (раздельно) и подвергали электрофорезу в 0,7%-ном агарозном геле. После переноса на нитроцеллюлозные фильтры проводили гибридизацию в нелимитирующих условиях (6xSSC при 50°С в течение ночи) с меченным 32 Р фрагментом 5' кДНК фитазы (как описано в примере 8). Комплексы отмывали в 6xSSC при комнатной температуре и на протяжении 18 ч подвергали воздействию рентгеновского облучения. Как показано на фиг. 35, 36, практически на каждой электрофореграмме имеются дискретные полосы, свидетельствующие о высокой степени гомологичности генов фитазы из различных видов микроорганизмов. -5' TCCCCAGCT Hindlll* Sail (в котором рестрикционный участок Hind III* не сохраняется после лигирования), а затем к фрагменту Sall/Hindlll плазмиды рАВ6-1. После трансформации в Е coli получали искомую плазмиду pREPFYT3, содержащую 3-фланкирующую последовательность AG в требуемом положении Экспрессия фитазы в A. niger посредством замещения гена AG. Перед трансформаций A. niger плазмидой pREPFYT3 из последней удаляли последовательности Е coli (путем переваривания Hind III и гелевого электрофореза). Штамм CBS 513.88 A. niger трансформировали 10 мкг фрагмента ДНК, используя процедуру, описанную в примере 9. Селекцию и культивирование трансформированных клеток осуществляли, как описано в примере 9. Лишь незначительное количество отобранных трансформантов (приблизительно 20%) утрачивало AG-активность. Гибрида ционный анализ хромосомной ДНК в AG-отрицательных и положительных по фитазе трансформантах использовали для контроля замены гена AG геном фитазы. Биохимические параметры очищенной фитазы из дикого штамма A. ficuum Параметр Удельная активное* Степень очистки по данным электрофореза" -" - изоэлектрофокус: Км (константа сродства) Специфичность для Настоящее исследование 100 ед/мг белка 85кДа Исследование Ullan 50 ед/мг белка 85/100 кДа 3 или 4 полосы 250 мкМ не определялась 40мкМ ИНОЗИТОЛ-1-Р не активна Км=3,3 мМ 2,5 и 5,5 50 85 56,5 5,0-5,4 Таблица 1 не активна 5% активность 2,5 и 5.5 58 85 и 100 61,7 4,5 инозитол-2-Р оптимум рН оптимальная т-ра ° мол масса, кДа + + мол. масса (чегликозил.)++ изоэлектрич. точка +++ + Ullan определял активность фитазы при 58°, а не при 37°. За единицу фитазной активности принимается количество фермента, которое необходимо для освобождения неорганического фосфата из 1,5 мМ фитата натрия со скоростью 1 мкмоль/мин при 37° и рН 5,50. Для сравнения интенсивности ферментации и удельных активностей, активности, рассчитанные Ullan, были скорректированы на разницу температур. Эта поправка основывалась на разнице активностей фитазы, измерявшихсяи при 37 и 58°, как показано в табл. 3 из работы Ullan (1988в). ++ Молекулярная масса рассчитана по результатам электрофореза в полиакриламидном геле с додецилсульфатом натрия. + + По результатам изоэлектрофокусировки и электрофореза в полиакриламидном геле. 28 27702 Таблица 2 А В Время после введения 24ч 24ч Активированная культура + + Неактивированная культура Таблица 3 Штамм Фитазная активность ед/мл A. niger 402 A. niger 402 pAF 28-1 A. niger 402 pAN 8-1 0,5 0,7 0,5 % фитазной активности, адсорбированной на колонке 0 10 о Таблица 4 Усиление продукции фитазы после трансформации штамма Штамм A. ficuum A. ficuum+control plasmid A. ficuum pAF 2-25 SP.8 A. ficuum pAF 2-25 SP.7 A. ficuum pAF 2-25 SP.4 Фитазная активность ед/мл 0,6 0,6 7,6 6,7 43 Таблица 5 Продукция фитазы трансформированными клетками A. niger CBS 513.88 с pA-F 2-25 Штамм A. niger A. niger+control plasmid A. niger pAF 2-25 # 8 A. niger pAF 2-25 # 33 A. niger pAF 2-25 # 20 Фитазная активность, ед/мл 0,2 0,2 14 5 4 Таблица 6 Вектор экспрессии P18F4T3 (AG-промотор/ 18 аа AG -лидир. последовательность Трансформант p18F4T3#240 p18F4T3#242 p18F4T3#243 p18F4T3#244 p18F4T3#245 p18F4T3#246 p18F4T3#250 P24F4T3 (AG-промотор/ 24 аа AG - лидир. последовательность p p p p p p p p PF4T3 (AG-промотор/ лидир. последовательность фитазы "~* 24 F4T3 # 256 24 F4T3 # 257 24 F4T3 # 258 24 F4T3 # 259 24 F4T3 # 260 24 F4T3 # 261 24 F4T3 # 262 24 F4T3 # 265 p F4T3 # 205 -' p F4T3 # 282 p F4T3 # 299 p F4T3 # 302 p F4T3 # 303 p F4T3 # 304 p F4T3 # 305 pF4T3#312 29 Фитазная активность 82 84 62 43 80 82 110 8 ЗО 13 33 17 28 18 12 50 280 96 220 175 150 150 140 27702 Таблица 7 Время после (часы) 0 24 92 141 Фитазная активность (ед/мл ферментационного бульона) A.ficuumNRRL3135 A.ficuumpAF2-25#4 0 0 0 0 2 142 270 5 Таблица 8 Время после (часы) 0 24 92 141 Фитазная активность (ед/мл ферментационного бульона) A. nigerCBS513.88 A. niger pAF 2-25 # 8 0 0 5 0 65 0,1 95 0,1
ДивитисяДодаткова інформація
Назва патенту англійськоюFragment of genomic dna coding phytase aspergillus niger, fragment of cdna coding phytase aspergillus niger, recombinant plasmid dna for expression of phytase in aspergillus (variants), strain aspergillus producent of aspergillus (variants), process for praparation
Автори англійськоюvan Gorcom Robert Franciscus Maria, van Hartingsveldt Willem, van Paridon Petrus Andreas, Veenstra Annemarie Eveline, Luiten Rudolf Gijsbertus Marie, Selten Gerardus Cornelis Maria
Назва патенту російськоюФрагмент геномной днк, которая кодирует фитазу aspergillus niger, фрагмент кднк, которая кодирует фитазу aspergillus niger, рекомбинантная плазмидная днк для экспрессии фитазы в aspergillus (варианты), штамм aspergillus продуцент фитазы aspergillus (варианты), способ получения
Автори російськоюван Горком Роберт Францискус Мария, ван Хартингсвелдт Виллем, ван Паридон Петрус Андреас, Венстра Аннемари Эвелин, Лейтен Рудольф Гейсбертус Мари, Селтен Герардус Корнелис Мария
МПК / Мітки
МПК: C12N 1/21, C12N 9/16, C12N 15/09, C07K 14/005, C12N 15/55, C07K 14/37, C12N 1/19, C12N 1/15, C07K 14/195, C07K 14/41, A23K 1/165
Мітки: штам, niger, фітази, aspergillus-продуцент, експресії, геномної, фрагмент, плазмідна, варіанти, днк, niger,фрагмент, aspergillus, фітазу, рекомбінантна, кднк, кодує
Код посилання
<a href="https://ua.patents.su/60-27702-fragment-genomno-dnk-shho-kodueh-fitazu-aspergillus-nigerfragment-kdnk-shho-kodueh-fitazu-aspergillus-niger-rekombinantna-plazmidna-dnk-dlya-ekspresi-fitazi-v-aspergillus-varianti.html" target="_blank" rel="follow" title="База патентів України">Фрагмент геномної днк, що кодує фітазу aspergillus niger,фрагмент кднк, що кодує фітазу aspergillus niger, рекомбінантна плазмідна днк для експресії фітази в aspergillus (варіанти), штам aspergillus-продуцент ф</a>
Попередній патент: Регулятор гальма
Випадковий патент: Спосіб ендоскопічної холедоходуоденостомії