Спосіб лікування, полегшення і/або попередження колоректального раку
Номер патенту: 107998
Опубліковано: 10.03.2015
Автори: Сміт Семюель, де Вріс Корінне, Плессль Йорг, Стейн Пітер, Джонс Лейтон, Кокс Іен, Чарлтон Речел
Формула / Реферат
1. Спосіб лікування, полегшення і/або попередження колоректального раку у людини, який включає прийом у складі композиції 800¸2365 г поліетиленгліколю (ПЕГ) протягом 18¸36 календарних місяців, що слідують один за одним.
2. Спосіб за п. 1, в якому здійснюють прийом від 0,1 г до 6,0 г поліетиленгліколю (ПЕГ) на день.
3. Спосіб за п. 1, в якому здійснюють полегшення колоректального раку у людини, переважно за допомогою зниження частоти виникнення і/або зростання осередків аберантних крипт (ACF).
4. Спосіб за п. 1, в якому здійснюють попередження колоректального раку у людини.
5. Спосіб за п. 1, в якому одночасно з лікуванням, полегшенням і/або попередженням колоректального раку у людини здійснюють профілактику констипації та/або підтримання нормального часу проходження їжі шлунково-кишковим трактом у людини.
6. Спосіб за п. 1, в якому здійснюють прийом від 266 до 1181 г, переважно від 400,3 до 787,5 г, поліетиленгліколю (ПЕГ) протягом 12 календарних місяців, що слідують один за одним.
7. Спосіб за п. 1, в якому здійснюють прийом від 22 до 98 г поліетиленгліколю (ПЕГ) протягом одного місяця.
8. Спосіб за п. 1, в якому здійснюють прийом від 5,1 до 22,7 г поліетиленгліколю (ПЕГ) протягом одного тижня.
9. Спосіб за п. 1, в якому здійснюють прийом від 0,73 до 3,22 г поліетиленгліколю протягом одного дня.
10. Спосіб за п. 1, в якому в зазначену композицію включають від 1,5 до 2,5 г, переважно від 2,0 до 2,5 г, поліетиленгліколю (ПЕГ).
11. Спосіб за п. 10, в якому зазначену композицію приймають щоденно або з перервами протягом 24 або 36 календарних місяців, що слідують один за одним.
12. Спосіб за п. 1, в якому здійснюють прийом поліетиленгліколю (ПЕГ) з середньою молекулярною масою від 1000 до 8000 Да, переважно з середньою молекулярною масою від 3000 до 8000 Да і переважно з середньою молекулярною масою, вибраною з групи середніх молекулярних мас, що включає 3350, 4000, 6000 і 8000 Да.
13. Спосіб за п. 1, в якому людина є схильною до розвитку колоректального раку, переважно внаслідок сімейного анамнезу і/або історії хвороби, переважно внаслідок попередньої події колоректального раку або поліпів товстої кишки, синдрому Лінча, сімейного поліпозу і/або стану здоров'я або способу життя.
14. Спосіб за п. 1, в якому зазначена людина має вік принаймні 50 років, переважно принаймні 55 років і переважно принаймні 60 років, і переважно 60¸75 років або 65¸75 років.
15. Спосіб за п. 1, в якому здійснюють прийом поліетиленгліколю (ПЕГ) у складі композиції, причому зазначену композицію виконують у лікарській формі для перорального застосування.
16. Спосіб за п. 1, в якому зазначену композицію виконують у формі таблетки, капсули, таблетки у вигляді капсули, пастилки, порошку, гранул або рідини.
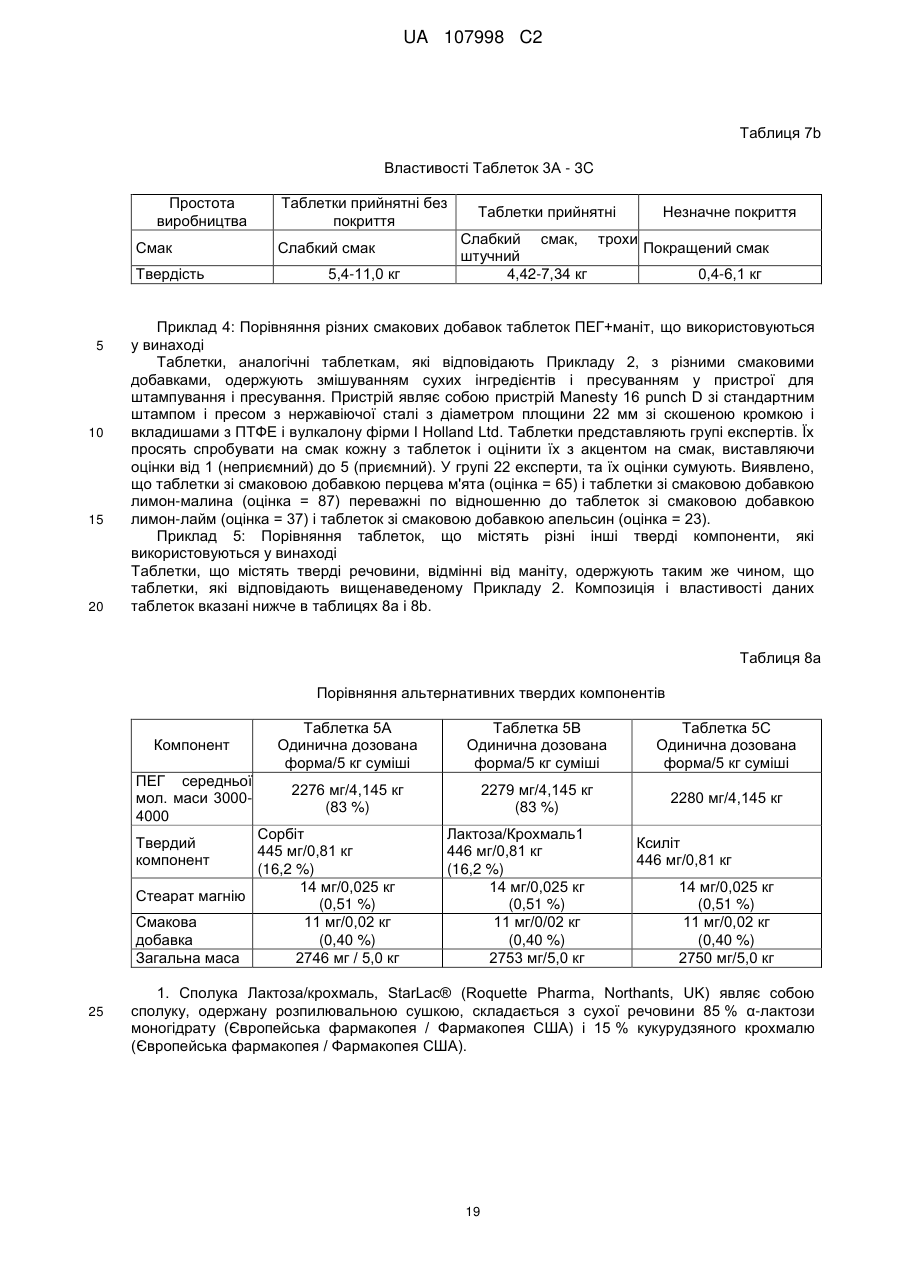
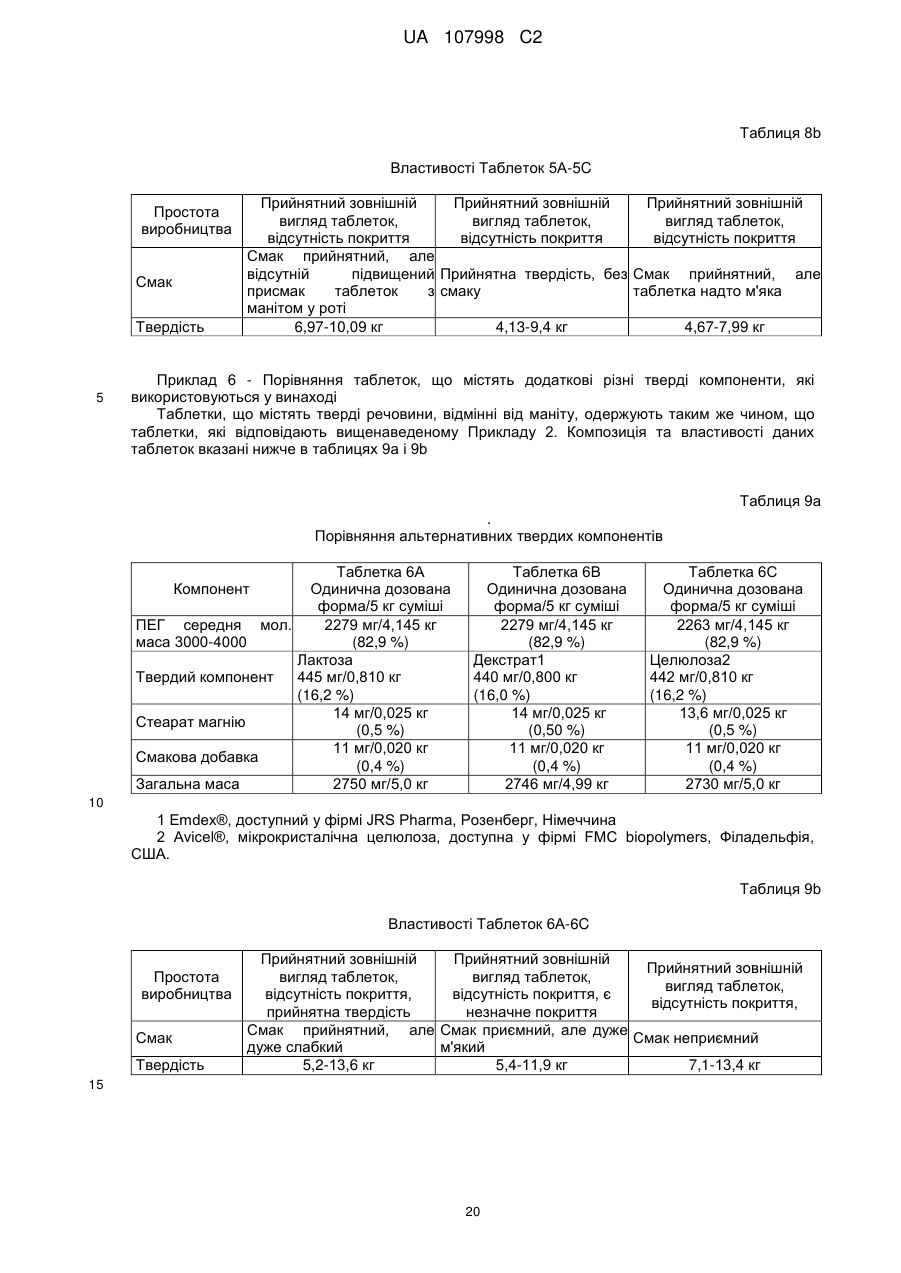
17. Спосіб за п. 1, в якому здійснюють прийом поліетиленгліколю (ПЕГ) у складі композиції, причому в зазначену композицію включають 50¸90 мас. % поліетиленгліколю (ПЕГ) з середньою молекулярною масою від 2000 до 10000 Да, 10¸40 мас. % твердої речовини, вибраної з групи твердих речовин, що включає сорбіт, лактозу, лактозу та крохмаль, декстрат, целюлозу, ксиліт, мальтит і маніт, і необов'язково принаймні один наповнювач, вибраний з групи, яка включає смакову добавку, підсолоджувач і ковзну речовину.
18. Спосіб за п. 17, в якому зазначену композицію виконують у вигляді твердої форми для прийому перорально.
19. Спосіб за п. 17, в якому до зазначеної композиції включають 70¸90 мас. % поліетиленгліколю (ПЕГ) з середньою молекулярною масою від 2000 до 10000 Да, 10¸20 мас. % твердої речовини у вигляді маніту, 0¸2,0 мас. % ковзної речовини та 0¸2,0 мас. % смакової добавки.
20. Спосіб за п. 17, в якому зазначена композиція є по суті вільною від електролітів.
21. Спосіб за п. 17, в якому зазначена композиція є композицією з масою від 2,0 до 3,5 г, причому до композиції включають 1,00¸3,15 г поліетиленгліколю (ПЕГ) з середньою молекулярною масою від 2000 до 10000 Да і 0,20¸1,40 г маніту.
22. Спосіб за п. 1, в якому поліетиленгліколь приймають щоденно або з перервами у кількості 1,5¸2,5 г, при цьому приблизно принаймні 800 г поліетиленгліколю приймають протягом від 24 до 36 календарних місяців, що слідують один за одним.
Текст
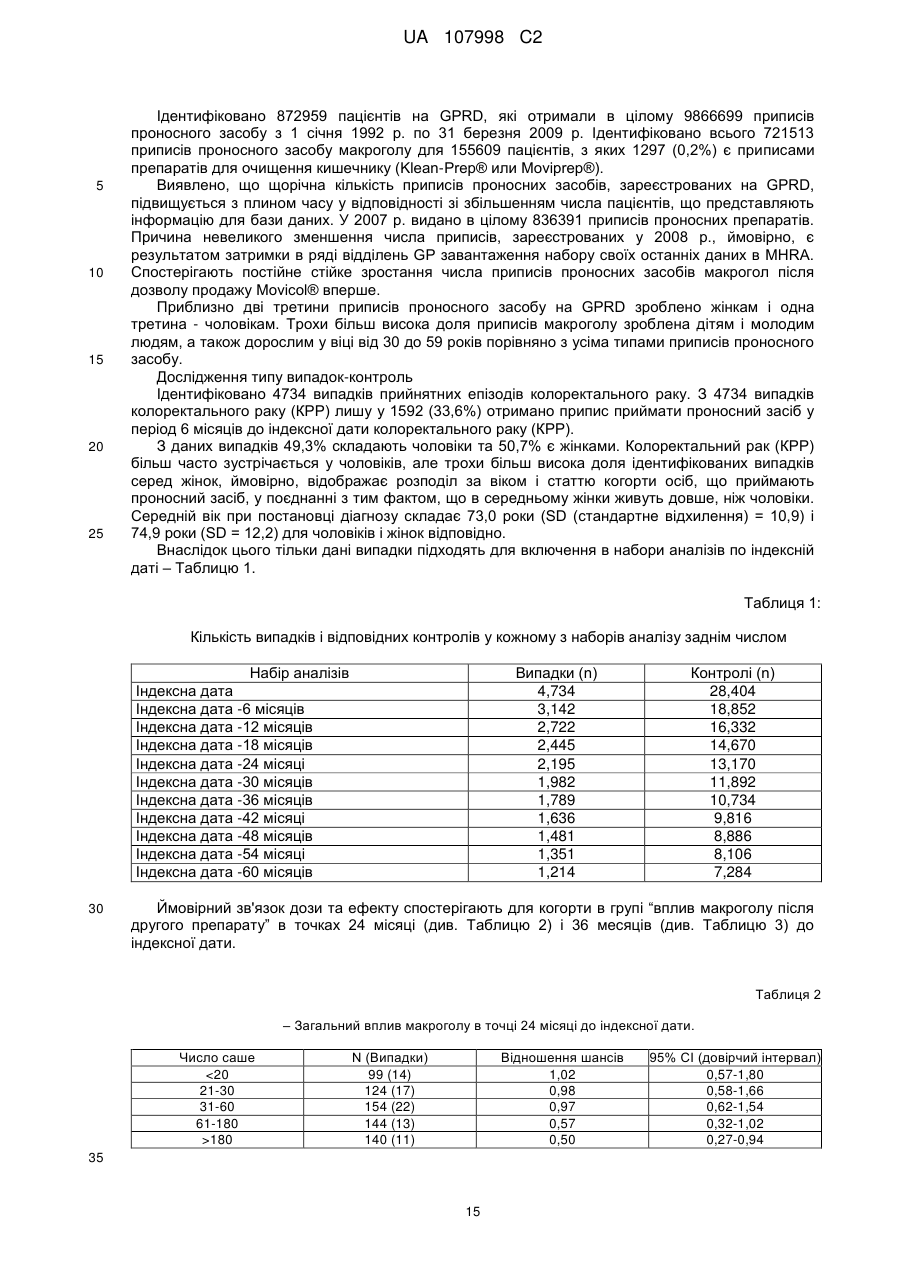
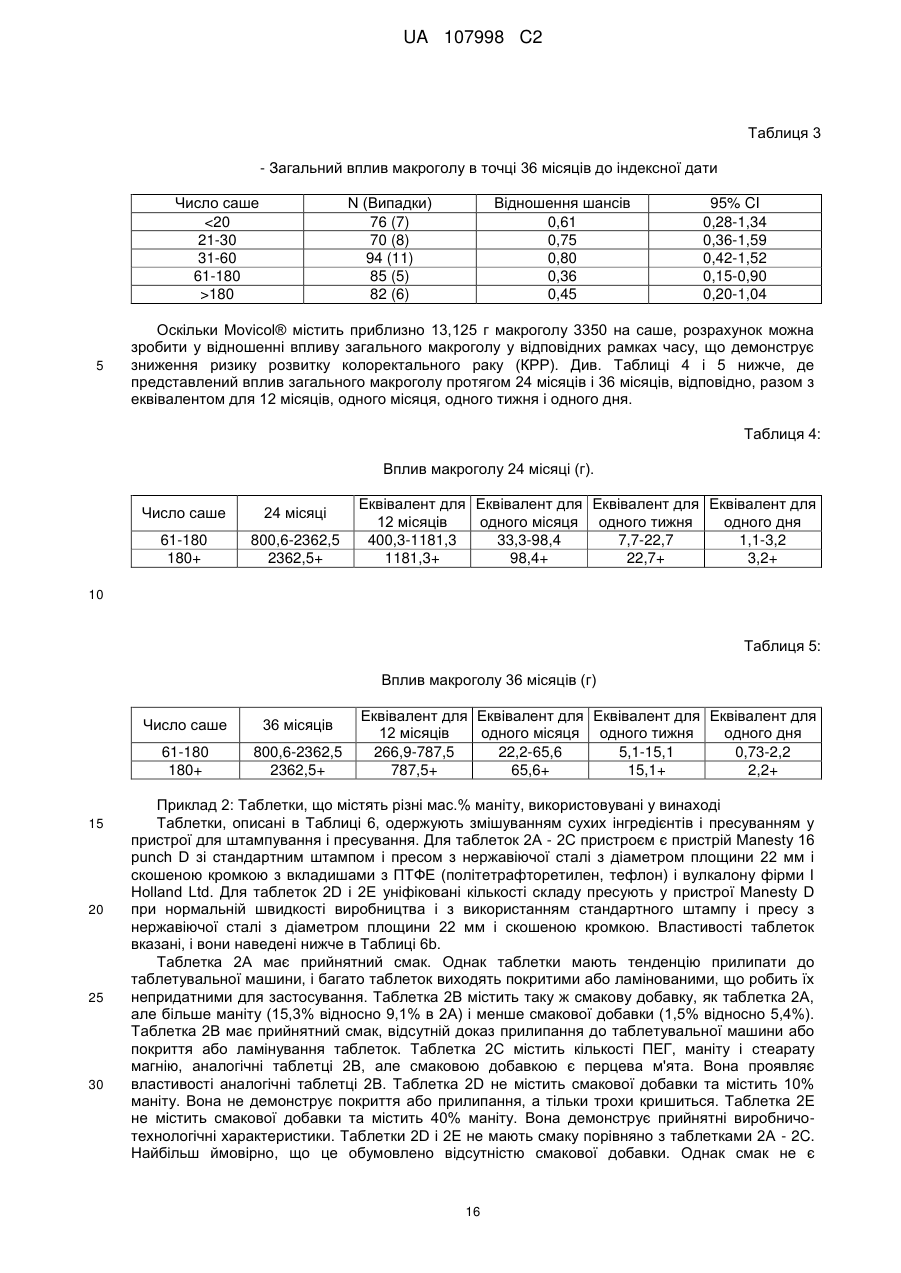
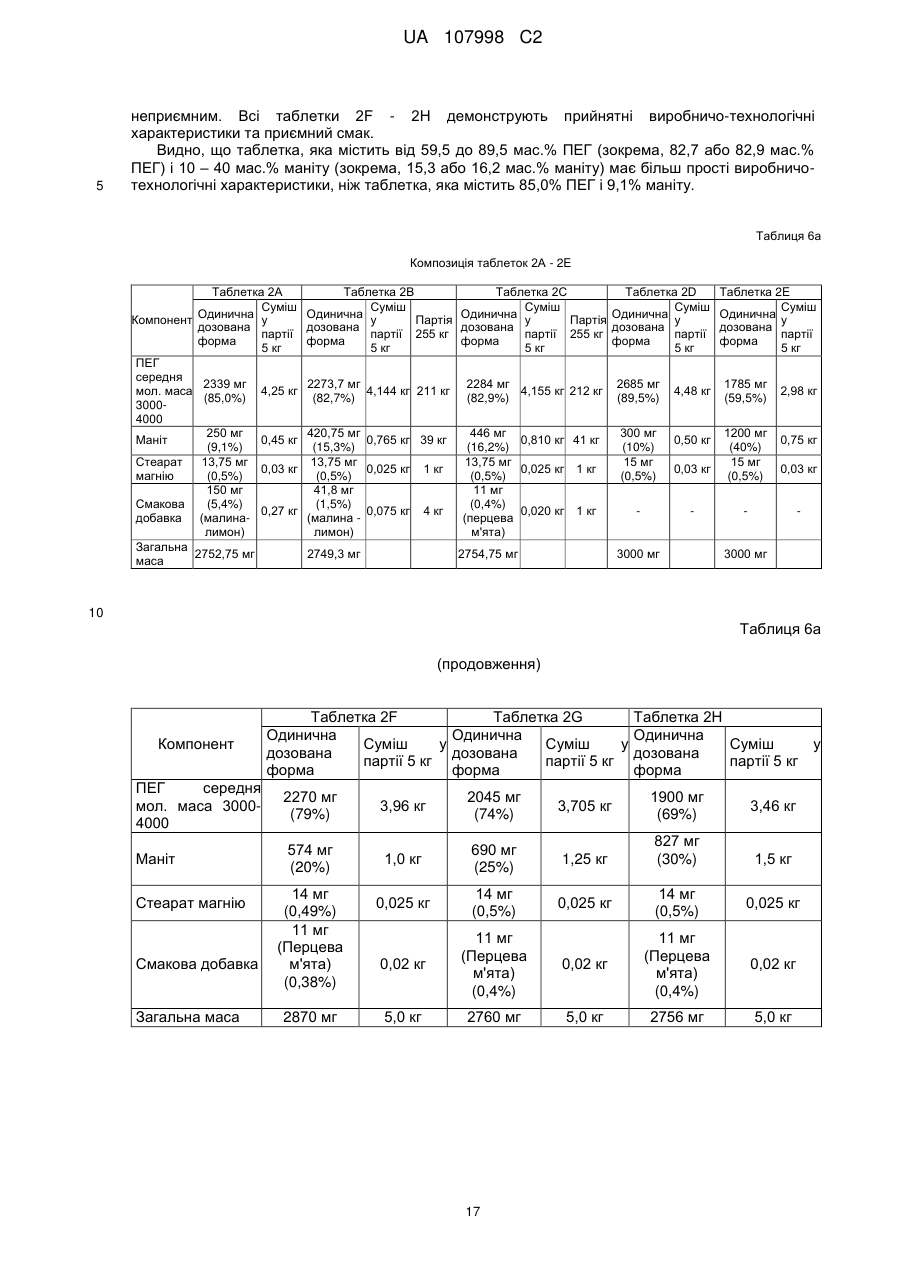
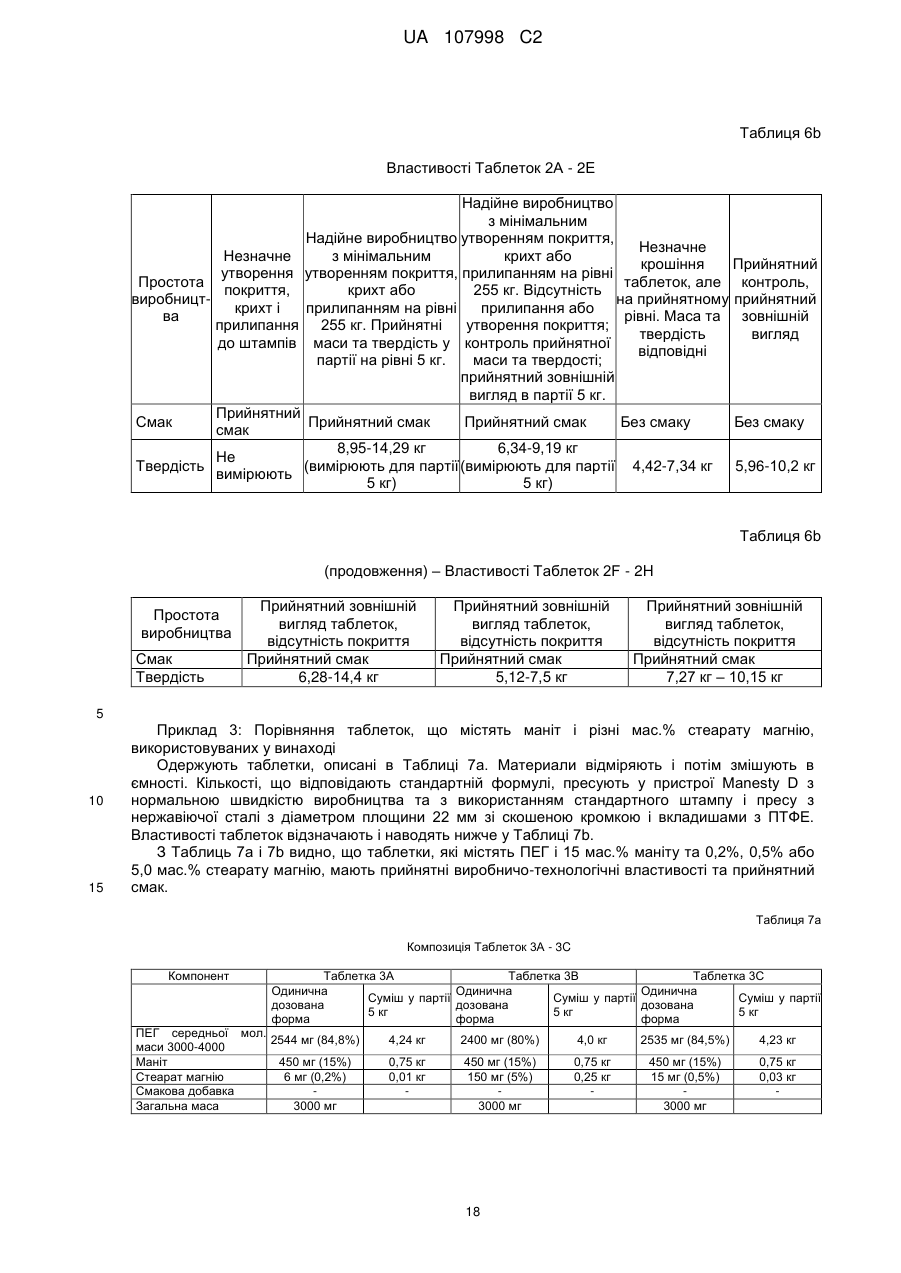
Реферат: Винахід стосується способу лікування, полегшення або попередження колоректального раку (КРР) у людини при використанні поліетиленгліколю (ПЕГ). UA 107998 C2 (12) UA 107998 C2 UA 107998 C2 5 10 15 20 25 30 35 40 45 50 55 Даний винахід стосується способів лікування, полегшення і/або попередження колоректального раку (КРР) у людини. Даний винахід стосується також композицій, призначених для застосування у даних способах. Колоректальний рак є основною причиною смерті в популяції людини, особливо в Північній Америці та Європі. Конче необхідний спосіб запобігання, і, внаслідок цього, описані різні стратегії, включаючи контроль харчування та інші модифікації образу життя, в тому числі хімічні втручання. У Міжнародній патентній заявці № WO00/24407 розкрито застосування неферментованого осмотичного проносного засобу, такого як поліетиленгліколь (ПЕГ), для лікування і попередження колоректального раку. Дані результати основані на дослідженні, проведеному на моделі раку прямої кишки з використанням азоксиметану (AOM) на щурах Fischer F344. Воно дає можливість припустити, що дози, використовувані для щурів, можна перевести в добову дозу для людини від 10 до 80 г. Однак не описані ні прямий доказ того, що існує лікувальний ефект ПЕГ щодо людських форм колоректального раку (КРР), ні в яких часових рамках даний вплив необхідний для досягнення зазначеного ефекту. Dorval E. et al (див. Gastro Clin Biol, 30:1196-1199 (2006)) в дослідженні на людській популяції вивчили розповсюдження колоректальних аденом у зв'язку зі споживанням ПЕГ в їжі. Хворим з повторними жалобами, які відвідували лікарню з метою регулярної загальної колоноскопії, задавали питання, чи приймали вони раніше проносний засіб або нестероїдний протизапальний лікарський препарат (НПЛП). Грунтуючись на отриманих відповідях, автори зробили висновок про те, що використання Forlax®, що містить ПЕГ препарат для готування кишечнику до хірургічного втручання, асоційовано з більш низькою частотою колоректальних пухлин, хоча інші проносні засоби на основі ПЕГ або сполуки, подібні ПЕГ, включаючи MOVICOL®, Transipeg® і Idrocol®, не давали суттєвих результатів. Автори стверджують, що одна з причин може полягати в тому, що “доза ПЕГ варіює у різних торговельних марках і, мабуть, знаходиться у числі найвищих у Forlax®. Як відзначено у статті, оскільки дослідження основане на запитальнику для пацієнтів, “дане опитування не давало достовірної інформації щодо тривалості, кількості, регулярності або вибору часу прийому ПЕГ”. На доповнення до вищезгаданих посилань проведені інші дослідження з використанням гризунів, основані на роботі, описаній вище, які взагалі схиляються до тієї точки зору, що відносно висока доза ПЕГ у відносно коротких часових рамках може знизити долю ACF (осередок аберантних крипт) і рівні EGFR (рецептору епідермального фактору росту), які, як вважають, є маркерами раку товстої кишки. Відсутня відпрацьована позиція відносно вибору часу прийому ПЕГ, щоб він був ефективним в плані зниження рівня сурогатного маркера(ів), і рівня дози ПЕГ, якщо масштабування застосовно до людини приведе в результаті до діареї. Необхідність високої дози повторюється у посиланні на працю Dorval (2006), де показують у таблиці II, що MOVICOL® (ПЕГ з композицією електролітів) неефективний; аналогічно у праці показано, що об'єднані результати по проносним засобам, що містять ПЕГ, недостовірні. У даний час ця праця, мабуть, є єдиним опублікованим дослідженням, що відноситься до застосування ПЕГ у людини в контексті колоректального раку, хоча вона не виключає даних, одержаних для пацієнтів, у яких констипація (і причина, з якої вони приймають проносний засіб, такий як Forlax® або MOVICOL®) викликана колоректальним раком або є його симптомом. Несподівано, коли автори даного винаходу ініціювали дослідження General Practice Research Database (бази даних досліджень загальної лікарської практики) (GPRD), з метою опису ймовірності виникнення колоректального раку в популяції людини після впливу проносних засобів різних типів шляхом порівняння з контрольними даними, взятими з популяції групи дослідження того ж проносного засобу, але які не мають діагнозу колоректального раку, вони виявили можливий зв'язок дози та ефекту у пацієнтів, що приймають бальше 60 саше MOVICOL®, як за 24, так і за 36 місяців до самої ранньої дати, коли їм було надано підтвердження діагнозу колоректального раку (КРР). MOVICOL представлений у саше, що містять 13,8 г порошку для приготування розчину для перорального прийому. Кожне саше містить: 13,1250 г макроголу (поліетиленгліколю (ПЕГ)) 3350, 0,3507 г хлориду натрію, 0,1785 г бікарбонату натрію і 0,0466 г хлориду калію. Це є стандартна доза MOVICOL. Препарат може також містити смакову добавку і підсолоджувач. MOVICOL є у продажу з 1995 г. Внаслідок цього, відповідно до даного винаходу представлена композиція, призначена для застосування у способі лікування, полегшення та/або попередження колоректального раку (КРР) у людини, що передбачає введення людині приблизно 800 грамів або більше (наприклад, 2362 грамів або більше) ПЕГ або блоксополімеру ПЕГ протягом 36 календарних місяців, що слідують один за одним. 1 UA 107998 C2 5 10 15 20 25 30 35 40 45 50 55 60 Відповідно до даного винаходу представлена композиція, призначена для застосування у способі лікування, полегшення і/або попередження колоректального раку (КРР) у людини, що передбачає введення людині приблизно 800 грамів або більше (наприклад, 2362 грамів або більше) ПЕГ або блоксополімеру ПЕГ протягом 24 календарних місяців, що слідують один за одним. Відповідно до даного винаходу представлена композиція, призначена для застосування у способі лікування, полегшення і/або попередження колоректального раку (КРР) у людини, що передбачає введення людині ефективної та субпроносної кількості ПЕГ або блоксополімеру ПЕГ. В одному аспекті винаходу композиція, що відповідає винаходу, призначена для застосування при лікуванні колоректального раку (КРР) у людини. В іншому аспекті композиція, що відповідає винаходу, призначена для полегшення колоректального раку (КРР) у людини. В іншому аспекті композиція, що відповідає винаходу, призначена для застосування з метою попередження колоректального раку (КРР) у людини. В іншому аспекті винаходу представлений спосіб лікування, полегшення і/або попередження колоректального раку (КРР) у людини, який передбачає введення людині ефективної та субпроносної дози ПЕГ або блоксополімеру ПЕГ. В іншому аспекті винаходу представлений спосіб лікування, полегшення і/або попередження колоректального раку (КРР) у людини, який передбачає введення людині ефективної кількості та субпроносної дози ПЕГ або блоксополімеру ПЕГ. В іншому аспекті винаходу представлений спосіб (a) попередження констипації та (b) попередження колоректального раку (КРР) у людини, який передбачає введення ефективної та субпроносної дози ПЕГ або блоксополімеру ПЕГ. В іншому аспекті винаходу представлений спосіб (a) попередження констипації та (b) призначений для попередження колоректального раку (КРР) у людини, який передбачає введення ефективної та субпроносної дози ПЕГ або блоксополімеру ПЕГ. В іншому аспекті винаходу представлений спосіб (a) попередження констипації та (b) полегшення колоректального раку (КРР) у людини, який передбачає введення людині ефективної та субпроносної дози ПЕГ або блоксополімеру ПЕГ. В іншому аспекті винаходу представлений спосіб (a) попередження констипації та (b) лікування колоректального раку (КРР) у людини, який передбачає введення людині ефективної та субпроносної дози ПЕГ або блоксополімеру ПЕГ. В іншому аспекті представлена композиція, придатна для введення людині, що містить у якості уніфікованої (одиничної) дози субпроносну кількість ПЕГ або блоксополімеру ПЕГ. В іншому аспекті представлена композиція, призначена для застосування у вищеописаному способі, що відповідає винаходу, яка містить в якості уніфікованої дози субпроносну кількість ПЕГ або блоксополімеру ПЕГ. Термін “субпроносна кількість” означає кількість, яка не збільшує середнє число дефекацій на тиждень у людини, яка розглядається. Термин “субпроносна доза” означає дозу, яка не збільшує середнє число дефекацій на тиждень у людини, яка розглядається. Термін “ПЕГ” означає поліетиленгликоль, що має загальну формулу H-(O-CH2-CH2)n -OH. Термін “блоксополіимер ПЕГ” відноситься до сополімеру поліетиленгліколю з поліпропіленгліколем, а саме, поліетиленполіпропіленгліколю. Приклади блоксополимерів ПЕГ включають доступні під торговельною назвою “Pluronic® F68” або “полоксамер 188”. Термін “лікування” і його граматичні варіанти призначені для позначення того, що способи та композиції, що відповідають винаходу, можуть лікувати та/або реверсувати нормальний перебіг захворювання при колоректальному раку (КРР), особливо колоректальних патологій ранньої стадії, асоційованих з розвитком колоректального раку (КРР), наприклад, шляхом лікування поліпів товстої кишки. Термін “полегшення” і його граматичні варіанти призначені для позначення того, що способи та композиції, що відповідають винаходу, можуть уповільнити або зупинити прогресування колоректальних патологій ранньої стадії до розвитку колоректального раку (КРР), наприклад, уповільнити або зупинити подальший розвиток поліпів товстої кишки і/або осередків аберантних крипт (ACF) при колоректальному раку (КРР). Термін “попередження” та його граматичні варіанти призначені для позначення того, що способи та композиції, що відповідають винаходу, можуть зменшити ризик розвитку колоректального раку (КРР) і/або (у можливому випадку) констипації. Термін “колоректальний рак” або “КРР” відноситься до колоректального раку, раку товстої та/або прямої кишки у людини. 2 UA 107998 C2 5 10 15 20 25 30 35 40 45 50 55 60 Термін “один місяць” означає період 30 днів, що слідують один за одним. Вираз “спосіб втілення” призначений для позначення цільового способу. В ряді вищеописаних варіантів втілення винаходу дозу (наприклад, ефективну та субпроносну дозу) вводять, щоб одержати приблизно 800 г або більше (наприклад 2362 г або більше) ПЕГ або блоксополімеру ПЕГ за період 36 календарних місяців, що слідують один за одним. В ряді інших вищеописаних варіантів втілення винаходу дозу (наприклад, ефективну та субпроносну дозу) вводять, щоб одержати від 800 до 2365 (наприклад, 800,6 – 2362,5) г ПЕГ або блоксополімеру ПЕГ за період 36 календарних місяців, що слідують один за одним. В ряді вищеописаних варіантів втілення винаходу дозу (наприклад, ефективну та субпроносну дозу) вводять, щоб одержати приблизно 800 г або більше (наприклад, 2362 г або більше) ПЕГ або блоксополімеру ПЕГ за період 24 календарних місяців, що слідують один за одним. В ряді інших вищеописаних варіантів втілення винаходу дозу (наприклад, ефективну та субпроносну дозу) вводять, щоб одержати від 800 до 2365 (наприклад, 800,6 – 2362,5) г ПЕГ або блоксополімеру ПЕГ за період 24 календарних місяців, що слідують один за одним. В інших вищеописаних варіантах втілення винаходу дозу (наприклад, ефективну та субпроносну дозу) вводять, щоб одержати 266 г або більше (наприклад, 400 г або більше; 787 г або більше; 1181 г або більше) ПЕГ або блоксополімеру ПЕГ за період 12 місяців, що слідують один за одним. В ряді вищеописаних варіантів втілення винаходу дозу (наприклад, ефективну та субпроносну дозу) вводять, щоб одержати від 266 г до 1181 г (наприклад, від 266,9 г до 787,5 г; від 400,3 г до 1181,3 г; від 400,3 г до 787,5 г) ПЕГ або блоксополімеру ПЕГ за період 12 календарних місяців, що слідують один за одним. В інших вищеописаних варіантах втілення винаходу дозу (наприклад, ефективну та субпроносну дозу) вводять, щоб одержати 22 г або більше (наприклад, 33 г або більше; 65 г або більше; 98 г або більше) ПЕГ або блоксополімеру ПЕГ за період один місяць. В ряді вищеописаних варіантів втілення винаходу дозу (наприклад, ефективну та субпроносну дозу) вводять, щоб одержати від 22,2 г до 98,4 г (наприклад, від 33,3 г до 98,4 г; 22,2 г – 65,6 г; 65,6 г – 98,4 г) ПЕГ або блоксополімеру ПЕГ за період один місяць. В інших вищеописаних варіантах втілення винаходу дозу (наприклад, ефективну та субпроносну дозу) вводять, щоб одержати 5,1 г або більше (наприклад, 7,7 г або більше; 15,1 г або більше; 22,7 г або більше) ПЕГ або блоксополімеру ПЕГ протягом одного тижня. В ряді вищеописаних варіантів втілення винаходу, дозу (наприклад, ефективну та субпроносну дозу) вводять, щоб одержати від 5,1 г до 22,7 г (наприклад, від 7,7 г до 22,7 г; 5,1 г – 15,1 г; 15,1 г 22.7 г) ПЕГ або блоксополімеру ПЕГ протягом одного тижня. В інших вищеописаних варіантах втілення винаходу дозу (наприклад, ефективну та субпроносну дозу) вводять, щоб одержати 0,73 г або більше (наприклад, 1,1 г або більше; 2,2 г або більше; 3,2 г або більше) ПЕГ або блоксополімеру ПЕГ протягом одного дня. В ряді вищеописаних варіантів втілення способу, що відповідає винаходу, дозу (наприклад, ефективну та субпроносну дозу) вводять, щоб одержати від 0,73 г до 3,22 г (наприклад, від 1,1 г до 3,2 г; 0,73 г – 2,2 г; 2,2 г – 3,2 г) ПЕГ або блоксополімеру ПЕГ протягом одного дня. Дані дози можна вводити щоденно в період 24 або 36 календарних місяців, що слідують один за одним. Альтернативно дані дози можна вводити з перервами в період 24 або 36 календарних місяців, що слідують один за одним. В усіх варіантах втілення, описаних у даному контексті, для читача даного опису буде очевидно, що інтервали, визначені як “від і до” або “в рамках” двох величин слід розуміти як такі, що включають дані величини, наприклад, інтервал “від 1,1 г до 3,2 г” включає 1,1 г і 3,2 г, відповідно. В інших варіантах втілення винаходу передбачають композиції, призначені для застосування у способі (такому, як вищеописані способи) лікування, полегшення і/або попередження колоректального раку (КРР) у людини, що містять кількість (наприклад, ефективну та субпроносну) ПЕГ або блоксополімеру ПЕГ. У ряді варіантів втілення композиція, що відповідає винаходу, перебуває у формі таблетки (наприклад, жувальної або смоктальної таблетки), капсули, таблетки у вигляді капсули, пастилки, рідини, порошку (наприклад, порошку для одержання розчину або суспензії) та гранул. Переважно, коли вона перебуває у формі твердої композиції для перорального прийому. Вона може являти собою тверду таблетку, наприклад, жувальну або смоктальну таблетку. У деяких варіантах втілення винаходу ПЕГ має середню молекулярну масу принаймні 400 або принаймні 1000 або від 2000 до 10000 Дальтон (наприклад, 2500 - 8500, переважно 3000 8000 (наприклад, 6000 або 8000), більш прийнятно 2500 - 4500, наприклад, 3350 або 4000). У ряді варіантів втілення передбачають суміш молекул ПЕГ різної молекулярної маси, щоб 3 UA 107998 C2 5 10 15 20 25 30 35 40 45 50 55 60 одержати необхідну загальну середню молекулярну масу (наприклад, середню молекулярну масу 3350 або приблизно таку або середню молекулярну масу 4000 або приблизно таку). Прикладами продуктів ПЕГ є макрогол 3350, макрогол 4000, макрогол 6000, макрогол 8000, і вони комерційно доступні. У деяких варіантах втілення композиція, що відповідає винаходу, призначена для лікування колоректального раку (КРР). У деяких варіантах втілення композиція, що відповідає винаходу, призначена для полегшення колоректального раку (КРР). В деяких варіантах втілення композиція, що відповідає винаходу, призначена для попередження колоректального раку (КРР). Відповідно, даний винахід передбачає тверду композицію для перорального застосування в якості твердого препарату для лікування, полегшення і/або попередження колоректального раку (КРР), яка містить: (a) 50 – 90 мас.% поліетиленгліколю (ПЕГ), що має середню молекулярну масу в інтервалі 2000 - 10000 Да; і (b) 10 – 40 мас.% твердої речовини (яка інколи позначається у даному контексті як “тверда речовину компоненту (b)”). Винахід передбачає тверду композицію для перорального застосування в якості твердого препарату для лікування, полегшення і/або попередження колоректального раку (КРР), яка містить: (a) 50 – 90 мас.% поліетиленгліколю (ПЕГ), що має середню молекулярну масу в інтервале 2000 - 10000 Да; (b) 10 – 40 мас.% твердої речовини та, необов'язково, (c) за необхідності до 100 мас.% інших наповнювачів, таких як смакові добавки, підсолоджувачі та ковзні речовини. У даному контексті мають на увазі, що “мас.%” компоненту означає долю у відсотках, яку маса відповідного компоненту складає від загальної маси твердої композиції. Даний винахід, крім того, передбачає тверду композицію для перорального застосування в якості твердого препарату для лікування, полегшення і/або попередження колоректального раку (КРР), яка містить: (a) 50 – 90 мас.% поліетиленгліколю (ПЭГ), що має середню молекулярну масу в інтервалі 2000 - 10000 Да; і (b) 10 – 40 мас.% твердої речовини, вибраної з групи: сорбіт, лактоза, декстрати, целюлоза, ксиліт, мальтит, маніт. Даний винахід, крім того, передбачає тверду композицію для перорального застосування в якості твердого препарату для лікування, полегшення і/або попередження колоректального раку (КРР), яка містить: (a) 50 – 90 мас.% поліетиленгліколю (ПЕГ), що має середню молекулярну масу в інтервалі 2000 - 10000 Да; і (b) 10 – 40 мас.% твердої речовини, вибраної з групи: сорбіт, лактоза, лактоза і крохмаль (наприклад, сполука, що містить лактозу моногідрат і кукурудзяний (маїсовий) крохмаль, така як Starlac®), декстрати, целюлоза (наприклад, мікрокристалічна целюлоза), ксиліт, мальтит і маніт. Переважно, коли тверда речовина компоненту (b) перевищує 10 мас.%, переважно перевищує 12 мас.%, більш прийнятно перевищує 15% (наприклад, 15% - 17%) твердої композиції. Переважно, коли масове співвідношення компоненту (a) і компоненту (b) складає 1,25:1 - 9:1, переважно 2:1 - 7:1, переважно 4:1 - 6:1. У переважних варіантах втілення співвідношення компоненту (a) і компоненту (b) складає приблизно 5:1. Переважно, коли тверда композиція є жувальною або смоктальною. Композиція може являти собою таблетку, наприклад, жувальну або смоктальну таблетку. Несподівано виявлено, що тверду композицію, що відповідає винаходу, яка містить компонент ПЕГ (a) і твердий компонент (b), приємно жувати або смоктати, вона має гарний смак, структурну цілісність і вигідні виробничі характеристики. Термін “жувальна” або “смоктальна” у даному контексті означає, що тверда композиція призначена для перорального застосування и може пережовуватися або розсмоктуватися в роті, так що перша стадія процесу травлення починається у защічній порожнині. Композиції, що відповідають винаходу, можуть, крім того, містити електроліти. Переважно, коли композиції, що відповідають винаходу, у суттєвій мірі вільні від електролітів. Наприклад, переважно, коли вони в суттєвій мірі вільні від хлориду натрію, хлориду калію і бікарбонату натрію. Переважно, коли вони в суттєвій мірі вільні від сульфатів або фосфатів, наприклад, особливо переважно, коли вони в суттєвій мірі вільні від сульфату натрію. Переважно, коли композиції, що відповідають винаходу, в суттєвій мірі вільні від карбонатів, 4 UA 107998 C2 5 10 15 20 25 30 35 40 45 50 55 60 бікарбонатів, іонів лужних металів та іонів галоїдів. Найбільш прийнятно, коли композиції, що відповідають даному винаходу, в суттєвій мірі вільні від іонів натрвю, калію, хлориду, бікарбонату, карбонату і/або сульфату. В багатьох випадках смакові добавки, ковзні речовини та підсолоджувачі можуть містити невеликі кількості електролітів. Дані кількості в даному контексті не вважають “суттєвими”. Переважно, коли композиції, що відповідають винаходу, у суттєвій мірі вільні від альгінатів і/або аскорбатів і/або цитратів. Вираз “в суттєвій мірі вільні від” у даному контексті означає також, що інгредієнт не додають до композиції під час одержання або виготовлення. У деяких варіантах втілення композиції, що відповідають даному винаходу, в суттєвій мірі від будь-якого осмотичного компоненту, що відрізняється від ПЕГ або блоксополімеру ПЕГ. Переважно, коли поліетиленгліколь (ПЕГ), призначений для використання в твердій композиції, що відповідає винаходу, має середню молекулярну масу (наприклад, середньомасову молекулярну масу) в Дальтонах у інтервалі 2000 – 10000, переважно 2500 – 8500, переважно 3000 – 8000, більш прийнятно 3000 – 6000, більш прийнятно 2500 – 6500, більш прийнятно 2500 – 4500, наприклад, 3000 – 4500, наприклад, 3000 – 4100, наприклад, 3000 - 4000. ПЕГ може мати середню молекулярну масу в інтервалі 6000 – 10000, наприклад, 7000 9000. Наприклад, ПЕГ може являти собою або містити ПЕГ 3350, ПЕГ 4000 або ПЕГ 8000, як визначено в національних або регіональних фармакопеях. Наступні приклади прийнятних ПЕГ, визнаних рядом національних фармакопей, включають макроголи (ПЕГи), наприклад, Macrogol 4000 (ПЕГ з молекулярною масою 4000 Да). ПЕГ, використовуваний у композиціях, що відповідають винаходу, необов'язково може містити два або більше різних компонентів ПЕГ. ПЕГ, використовуваний у композиціях, необов'язково може мати принаймні дві різних середніх молекулярних маси. ПЕГ відповідних молекулярних мас у формі, придатній для застосування у людини, комерційно доступний. У переважному варіанті втілення ПЕГ перебуває у твердій композиції в кількості 60 - 90 мас.%, переважно 70 - 90 мас.%, більш прийнятно 70 - 89 мас.%, наприклад, 75 - 89 мас.%. У наступному варіанті втілення ПЕГ перебуває в кількості 78 - 89 мас.%, наприклад, 80 - 85 мас.%, наприклад, 81 - 85 мас.%, наприклад, 80 - 84 мас.%, наприклад, 82 - 84 мас.%. У наступному варіанті втілення ПЕГ перебуває в кількості 50 - 80 мас.%, наприклад, 60 - 80 мас.%, наприклад, 70 - 80 мас.%, наприклад, 70 - 79 мас.%, наприклад, 75 - 79 мас.%. У деяких варіантах втілення композиція містить від 0,1 до 6,5 г (наприклад, 0,73 г - 3,2 г; 1,1 г - 3,2 г; 0,73 г - 2,2 г) ПЕГ або блоксополімеру ПЕГ. В інших варіантах втілення композиція містить 5 г або менше ПЕГ або блоксополімеру ПЕГ. В інших варіантах втілення композиція містить від 0,2 г до 6,5 г (наприклад, 0,3 г - 5,0 г) ПЕГ або блоксополімеру ПЕГ. В наступних варіантах втілення композиція містить від 1 до 4 г ПЕГ або блоксополімеру ПЕГ. В інших варіантах втілення композиція містить від 1,5 до 2,5 г ПЕГ або блоксополімеру ПЕГ. В інших варіантах втілення композиція містить від 2,0 г до 2,5 г ПЕГ або блоксополімеру ПЕГ, наприклад, 2,2 г або приблизно стільки. Переважно, коли тверду речовину компоненту (b) вибрано з групи, яка складається з сорбіту, лактози, лактози та крохмалю, декстратів, целюлози (наприклад, мікрокристалічної целюлози), ксиліту, мальтиту, маніту. Лактоза або подібні інгредієнти можуть перебувати у гідратованій формі. Коли тверда речовина компоненту (b) представляє собою лактозу і крохмаль, компонент лактози може перебувати у формі моногідрату. Компонент крохмалю може бути виділений з будь-якого прийнятного джерела, такого як пшеничний крохмаль, кукурудзяний крохмаль, картопляний крохмаль і рисовий крохмаль. Компонент лактози може складати 50% - 95% твердої речовини лактоза/крохмаль, наприклад, 60% - 90%, наприклад, 70 - 85%, зокрема, 85%. Переважно, коли тверді речовини компоненту (b) мають чистоту і якість, прийнятні для споживання, наприклад, людиною. Тверда речовина компоненту (b) складає до 10 - 40 мас.% від твердої композиції. В переважному варіанті втілення тверда речовина компоненту (b) складає до 10 - 30 мас.% твердої композиції, переважно більше 10 мас.% до (і включно) 30 мас.%. Наприклад, тверда речовина компоненту (b) складає до 10 - 25 мас.%, наприклад, 10 - 20 мас.%, переважно 12 - 20 мас.%, більш прийнятно 12 - 19 мас.%, 12 - 18 мас.% або 12 - 17 мас.%. Наприклад, тверда речовина компоненту (b) може складати до 14 - 20 мас.%, 14 - 19 мас.% або 14 - 18 мас.% 14 17 мас.% твердої композиції, наприклад, 15 – 16,5 мас.% твердої композиції, що відповідає винаходу. Переважно, коли тверда речовина компоненту (b) являє собою маніт. Показано, що тверда композиція, яка містить ПЕГ і маніт, більш приємна при споживанні, ніж тверда композиція, що містить ПЕГ і не містить маніт, навіть при введенні смакової добавки. Зокрема, виявлено, що 5 UA 107998 C2 5 10 15 20 25 30 35 40 45 50 55 60 таблетка, яка містить ПЕГ і маніт, має значно більш низькі вимоги до ковзної речовини або змащення при виготовленні таблеток, ніж таблетка, що містить ПЕГ, але не містить маніт. Високий рівень ковзної речовини у таблетці, як правило, надає таблетці неприйнятного смаку. Знижений рівень (або відсутність) ковзної речовини порівняно з таблеткою, що містить ПЕГ, але не містить маніт, підвищує смакову привабливість (смак і відчуття в роті) жувальної або смоктальної таблетки, що містить ПЕГ і маніт. Дані таблетки, таким чином, особливо підходять для застосування у даному винаході. Як правило, тверді композиції сухих інгредієнтів виготовляють з використанням сухої грануляції з наступним штампуванням за допомогою обладнання для штампування і пресування. У пристрої для штампування і пресування сухі інгредієнти пресують разом. Несподівано виявлено, що тверда композиція, яка містить ПЕГ і маніт у певних пропорціях, має підвищену структурну цілісність і є більш зручною для виготовлення, ніж тверда композиція, що містить ПЕГ і не містить маніт або містить більш низьку долю маніту. Тверді композиції даного типу менш чутливі до покриття і ламінування при виготовленні шляхом штампування і пресування, ніж тверді композиції, що містять більш низьку долю маніту або не містять маніт. Тверді композиції, які стають покритими або ламінованими під час штампування при пресуванні, не підходять для застосування і переходять у відходи. Виявлено, що тверда композиція, яка містить від 50 до 90 мас.% ПЕГ і 10 - 40 мас.% маніту, має поліпшені характеристики пресування таблеток порівняно з твердою композицією, що не містить маніт або містить 10 мас.% або менше маніту, наприклад, менше ніж 10% маніту. Дані композиції, таким чином, особливо підходять для застосування у даному винаході. Маніт може складати до 10 - 40 мас.% твердої композиції. У переважному варіанті втілення маніт складає до 10 - 30 мас.% твердої композиції. Наприклад, маніт складає до 10 - 25 мас.%, наприклад, 10 - 20 мас.%, переважно 12 - 20 мас.%, більш прийнятно 12 - 19 мас.%, 12 - 18 мас.% або 12 - 17 мас.%. Наприклад, маніт може складати до 14 - 20 мас.%, 14 - 19 мас.% або 14 - 18 мас.%, 14 - 17 мас.% твердої композиції, що відповідає винаходу. Маніт може бути представлений у різних фізичних формах. Наприклад, маніт комерційно доступний у гранульованій, порошковій формі, або у формі, одержаній розпилювальним сушінням. У переважному варіанті втілення маніт є гранульованим. Маніт комерційно доступний у ряду виробників, включаючи Merck, SPI Polyols Inc і Roquette. В одному варіанті втілення ПЕГ і маніт присутні у масовому співвідношенні ПЭГ:маніт 1,25:1 - 9:1 (наприклад 3:1 - 9:1 або 4:1 - 9:1), переважно 2:1 - 7:1, переважно 4:1 - 6:1 або 4:1 - 8:1, наприклад, 5:1 - 6:1. В переважних варіантах втілення співвідношення ПЕГ і маніту складає 5:1 або приблизно стільки. Структурна цілісність твердої композиції зберігається, коли маніт представляє собою гранульований маніт. Несподівано, що тверда композиція, яка відповідає винаходу, є настільки структурно міцною при використанні гранульованого маніту. В цілому виявлено, що гранульований маніт не може бути використаний з концентраціями інших матеріалів, що перевищують 25% у перерахунку на масу (див. Handbook of Pharmaceutical Excipients (Довідник з фармацевтичних наповнювачів), 5 вид., Pharmaceutical Press, 2006, стр. 452). Виявлено, що тверді композиції, призначені для використання у винаході, які містять 60 - 90 мас.% матеріалів, що відрізняються від маніту, легко виготовляти, і вони мають високу структурну цілісність. Крім того, несподівано виявлено, що тверда композиція, призначена для використання у винаході, яка містить ПЕГ і маніт у певних пропорціях, менше схильна до прилипання до обладнання для штампування і пресування, ніж тверда композиція, що містить ПЕГ і більш низьку долю маніту або не містить маніт. Цей факт особливо важливо, при виготовленні композицій, що відповідають даному винаходу, в комерційному масштабі, оскільки забруднення виготовляючого обладнання може привести до простою при виробництві з пов'язаним з цим підвищенням витрат. Ковзні речовини можуть бути включені в композиції таблеток для зниження ймовірності того, що вони прилипнуть до штампу або пресу після пресування через штамп. Приклади ковзних речовин включають стеарат магнію, стеарат калію, тальк, стеаринову кислоту, лаурилсульфат натрію і парафін. Можна використовувати суміші різних ковзних речовин. Виявлено, що тверда композиція, призначена для використання у винаході, яка містить ПЕГ і маніт у певних пропорціях, потребує більш низької долі ковзної речовини для того, щоб задовільним чином уникнути прилипання, ніж таблетка, що містить ПЕГ і більш низьку долю маніту або не містить маніт. Переважно, коли тверда композиція містить ковзну речовину в кількості 2,0 мас.% або менше, наприклад, 1,5 мас.% або менше або 1,0 мас.% або менше. Наприклад, композиція може містити ковзну речовину в кількості 0,1 - 0,9 мас.%, наприклад, 0,2 - 0,8 мас.%, переважно 0,3 - 0,7% мас.%. Наприклад, ковзна речовина присутня у співвідношенні тверда речовина 6 UA 107998 C2 5 10 15 20 25 30 35 40 45 50 55 компоненту (b) (така як маніт): ковзна речовина 170:1 - 16:1, наприклад, 57:1 - 20:1. Особливо переважною ковзною речовиною є стеарат магнію. Якщо ковзною речовиною є стеарат магнію, вона ефективна в плані задовільного уникнення прилипання при використанні на рівні менше 1 мас.%. Відповідно, в одному варіанті втілення таблетка, що відповідає винаходу, далі містить стеарат магнію в кількості 0,1 – 0,9 мас.%, наприклад, 0,2 – 0,8 мас.%, переважно 0,3 – 0,7 мас.%, більш прийнятно 0,5 мас.%. Несподівано показано, що стеарат магнію ефективний на даних рівнях, хоча, як правило, необхідно, щоб рівень стеарату магнію складав більше 1% в композиціях, що містять маніт (див. Handbook of Pharmaceutical Excipients (Довідник з фармацевтичних наповнювачів), 5 вид., Pharmaceutical Press, 2006, стор. 452). Таким чином, даний винахід передбачає тверду композицію, призначену для застосування у твердому вигляді для лікування, полегшення і/або попередження колоректального раку (КРР), яка містить: (a) 50 – 90 мас.% поліетиленгліколю (ПЕГ), що має середню молекулярну масу в інтервалі 2000 - 10000 Да; (b) 10 – 40 мас.% маніта і (c) 0,1 – 0,9% (наприклад 0,2 – 0,8%, 0,3 – 0,7%, наприклад, 0,5%) мас.% ковзної речовини, такої як стеарат магнію. У деяких варіантах втілення переважно, коли співвідношення маніт : ковзна речовина складає 10:1 або більше, переважно 20:1 або більше, наприклад, 25:1 або більше, наприклад, 30:1 або більше (наприклад 30:1 - 35:1, таке як 30.6:1 або 32.4:1). В одному варіанті втілення тверда композиція, що відповідає винаходу, не включає ніякої введеної смакової добавки. У переважному варіанті втілення тверда композиція, що відповідає винаходу, включає принаймні одну смакову добавку. Прийнятні смакові добавки доступні у різних виробників і постачальників смакових добавок, наприклад, International Flavours and Fragrances Inc. (Duddery Hill, Haverhill, Suffolk, CB9 8LG, United Kingdom), Ungerer & Company (Sealand Road, Chester, CH1 4LP, United Kingdom), Firmenich (Firmenich UK Ltd., Hayes Road, Southall, Middlesex, UB2 5NN, United Kingdom) або S. Black Ltd (Foxholes Business Park, John Tate Road, Hertford, Herts, SG13 7YH, United Kingdom). Приклади прийнятних смакових добавок включають апельсин, лимон-лайм, лимон, цитрус, шоколад, тропічні фрукти, алое вера, перцеву м'яту, чай, суницю, грейпфрут, чорну смородину, ананас і ваніль, малина-лимон, смак коли та їх комбінації. Переважними смаковими добавками є смакові добавки перцева м'ята і малина-лимон. Смакова добавка може бути включена до складу всієї твердої композиції або може бути нанесена на її поверхню. В одному варіанті втілення смакова добавка включена до складу всієї твердої композиції. В даній твердій композиції переважно, коли смакова добавка складає від 0,1 - 15 мас.% твердої композиції. Наприклад, смакова добавка може складати до 0,1 - 5 мас.% твердої композиції, наприклад, 0,1 – 2,0 мас.%, наприклад, 0,2 – 2,0 мас.%. Коли смаковою добавкою є перцева м'ята, переважно, щоб вона була присутня на рівні 0,1 – 1,0 мас.%, наприклад, 0,15 – 0,5 мас.%. Даний рівень особливо переважний, коли тверді речовина компоненту (b), наприклад, маніт, присутня на рівні 14 - 17 мас.% твердої композиції, що відповідає винаходу. Коли смакова добавка представляє собою малину-лимон, переважно, щоб вона була присутня на рівні 0,5 – 2,0 мас.%, наприклад, 1,0 – 2,0%, наприклад, 1,2 – 1,8 мас.%. Даний рівень особливо переважний, коли тверда речовина компоненту (b), наприклад, маніт, присутня на рівні 14 - 17 мас.% твердої композиції, що відповідає винаходу. В одному варіанті втілення тверда речовина компоненту (b), наприклад, маніт, і смакова добавка, присутні, наприклад, у співвідношенні тверда речовина : смакова добавка 170:1 - 3:1; коли смаковою добавкою є перцева м'ята, переважно, щоб тверда речовина компоненту (b), наприклад, маніт, і смакова добавка були присутні у співвідношенні тверда речовина : смакова добавка 113:1 - 28:1. Коли смаковою добавкою є малина-лимон, переважно, щоб тверда речовина компоненту (b), наприклад, маніт, і смакова добавка, були присутні у співвідношенні тверда речовина компоненту (b) : смакова добавка 14:1 - 7:1. Тверда композиція, що відповідає винаходу, може містити один або більше підсолоджувачів. Підсолоджувачі можуть бути на основі цукру. Переважно, коли вони не на основі цукру. Переважні підсолоджувачі включають аспартам, ацесульфам калію (ацесульфам K), сукралозу і сахарин або їх комбінації. Альтернативно може бути більш прийнятним, щоб композиції, які відповідають винаходу, були суттєвою мірою вільними від добавлених підсолоджувачів, наприклад, з метою мінімізації числа різних компонентів у композиціях. Коли вони присутні, підсолоджувачі можуть, наприклад, бути присутніми у кількості 0,01 - 1 мас.%. Більш прийнятно, коли підсолоджувач може бути присутнім у кількості 0,1 - 1 мас.%. Рівень підсолоджувача, 7 UA 107998 C2 5 10 15 20 25 30 35 40 45 50 55 60 необхідний для одержання задовільного смаку, може залежати від присутності, і особливостей, і кількості компонентів композиції. Взагалі необов'язково, щоб тверда композиція, яка відповідає винаходу, включала консерванти і антиоксиданти. Тим не менш, якщо потрібно, можуть бути включені низькі рівні антиоксидантів або консервантів. Переважно, коли композиції, що відповідають даному винаходу, також суттєвою мірою вільними від компонентів, що маскують “смак солі”, наприклад, компонентів, які маскують смак сульфату натрію (які відрізняються від смакових добавок, згаданих у даному контексті), і від солей нежирних кислот, таких як солі мінеральних кислот. Тверда композиція, що відповідає винаходу, може бути будь-якого зручного розміру. Як зазначено вище, таблетка має бути досить великою, щоб забезпечити необхідну кількість ПЕГ для пацієнта, але не настільки великою, щоб створювати незручності у роті, труднощі при жуванні або смоктанні або труднощі при пакуванні. Таблетка може, наприклад, мати масу 0,5 – 10 г, більш прийнятно 0,5 - 5 г, наприклад, 1,0 – 5,0 г, наприклад, 2,0 – 3,5 г, наприклад, 2,5 – 3,5 г. В одному варіанті втілення таблетка, що відповідає винаходу, має масу від 2,5 до 3,0 г, наприклад, 2,75 г. Для деяких варіантів використання, коли пацієнту слід доставити більшу кількість ПЕГ, може бути зручною більш крупна таблетка, наприклад, яка має масу 3 - 10 г, наприклад, 3 - 5 г, 3 – 7 г, 4 – 7 г або 5 – 8 г, наприклад, 4 – 7 г. Для деяких варіантів використання, коли пацієнту слід доставити меншу кількість ПЕГ, наприклад, для педіатричного застосування, може бути зручною таблетка меншого розміру, наприклад, яка має масу 0,5 – 2,0 г, наприклад, 1,0 – 1,75 г, наприклад, 1,25 – 1,50 г. Тверда композиція, що відповідає винаходу, призначена для лікування, полегшення і/або попередження колоректального раку (КРР), може, таким чином, являти собою тверду композицію масою 2,0 – 3,5 г, яка містить: (a) 1,00 – 3,15 г поліетиленгліколю (ПЕГ), що має середню молекулярну масу в інтервалі 2000 - 10000 Да; і (b) 0,20 – 1,40 г твердої речовини, такої як маніт. Тверда композиція, що відповідає винаходу, призначена для лікування, полегшення і/або попередження колоректального раку (КРР), може, таким чином, являти собою тверду композицію масою 2,5 – 3,5 г, яка містить: (a) 1,25 – 3,15 г поліетиленгліколю (ПЕГ), що має середню молекулярну масу в інтервалі 2000 - 10000 Да; і (b) 0,25 – 1,40 г твердої речовини, такої як маніт. Аналогічно, композиція, що відповідає винаходу, призначена для лікування, полегшення і/або попередження колоректального раку (КРР), може, таким чином, являти собою тверду композицію масою 1,0 – 1,75 г, яка імстить: (a) 0,50 – 1,575 г поліетиленгліколю (ПЕГ), що має середню молекулярну масу в інтервалі 2000 - 10000 Да; і (b) 0,10 – 0,70 г твердої речовини, такої як маніт. Як зазначено вище, ковзна речовина, (наприклад, стеарат магнію) може бути присутньою в твердій композиції, що відповідає винаходу, в кількості 2 мас.% або менше, наприклад, 1 мас.% або менше. Тверда композиція, що відповідає винаходу, масою 2,0 – 3,5 г може, таким чином, містити 0,07 г або менше ковзної речовини, наприклад, 0,35 г або менше ковзної речовини. Наприклад, вона може містити ковзну речовину в кількості 0,002 – 0,0315 г, наприклад, 0,004 – 0,028 г, наприклад, 0,006 – 0,0245 г. Збільшена композиція, що відповідає винаходу, масою 3,0 – 7,0 г може містити 0,14 г або менше ковзної речовини, наприклад, 0,07 г або менше ковзної речовини. Наприклад, вона може містити ковзну речовину в кількості 0,003 – 0,063 г, наприклад, 0,006 – 0,056 г, наприклад, 0,009 – 0,049 г. Зменшена композиція, що відповідає винаходу, масою 1,0 – 1,75 г може містити 0,035 г або менше ковзної речовини, наприклад, 0,0175 г або менше ковзної речовини. Наприклад, вона може містити ковзну речовину в кількості 0,001 – 0,01575 г, наприклад, 0,002 – 0,014 г, наприклад, 0,003 – 0,01225 г. Як зазначено вище, смакова добавка може бути присутньою в твердій композиції, що відповідає винаходу, та у випадку присутності, переважно, коли вона складає 0,1 - 15 мас.% твердої композиції. Тверда композиція, що відповідає винаходу, масою 2,0 – 3,5 г може, таким чином, містити 0,002 – 0,525 г смакової добавки, наприклад, 0,002 – 0,175 г, наприклад, 0,002 – 0,07 г, наприклад, 0,004 – 0,07 г смакової добавки. Збільшена композиція, що відповідає винаходу, масою 3,0 – 7,0 г може містити 0,003 – 1,05 г смакової добавки, наприклад, 0,003 – 0,35 г, наприклад, 0,003 – 0,14 г, наприклад, 0,006 – 0,14 г смакової добавки. Зменшена композиція, що відповідає винаходу, масою 1,0 – 1,75 г може містити 0,001 – 0,2625 г смакової добавки, наприклад, 0,001 – 0,0525 г, наприклад, 0,001 – 0,021 г, наприклад, 0,002 – 0,021 г смакової добавки. 8 UA 107998 C2 5 10 15 20 25 30 35 40 45 50 55 60 Наприклад, тверда композиція, що відповідає винаходу, при значена для лікування, полегшення і/або попередження колоректального раку (КРР), може містити: (a) 50 – 90 мас.% поліетиленгліколю (ПЕГ), що має середню молекулярну масу в інтервалі 2000 - 10000 Да; (b) 10 – 30 мас.% твердої речовини, такої як маніт; (c) 0,1 – 2,0 мас.% ковзної речовини; та (d) 0,1 – 15 мас.% смакової добавки. В одному варіанті втілення тверда композиція, що відповідає винаходу, призначена для лікування, полегшення і/або попередження колоректального раку (КРР), містить: (a) 70 – 90 мас.% поліетиленгліколю (ПЕГ), що має середню молекулярну масу в інтервалі 3000 - 8000 Да; (b) 10 – 25 мас.% твердої речовини, такої як маніт; (c) 0,1 – 1,5 мас.% стеарату магнію; і (d) 0,1 – 2,0 мас.% смакової добавки. Наприклад, тверда композиція, що відповідає винаходу, призначена для лікування, полегшення і/або попередження колоректального раку (КРР), містить: (a) 75 – 89 мас.% поліетиленгліколю (ПЕГ), що має середню молекулярну масу в інтервалі 3000 - 4000 Да; (b) 10 – 20 мас.% твердої речовини, такої як маніт; (c) 0,2 – 0,8 мас.% стеарату магнію; та (d) 0,1 – 1,0 мас.% смакової добавки. Наприклад, тверда композиція, що відповідає винаходу, призначена для лікування, полегшення і/або попередження колоректального раку (КРР), може містити: (a) 1,00 – 3,15 г поліетиленгліколю (ПЕГ), що має середню молекулярну масу в інтервалі 2000 - 10000 Да; (b) 0,20 – 1,40 г твердої речовини, такої як маніт; (c) 0,002 – 0,07 г ковзної речовини; та (d) 0,002 – 0,525 г смакової добавки. В одному варіанті втілення тверда композиція, що відповідає винаходу, призначена для лікування, полегшення і/або попередження колоректального раку (КРР), містить: (a) 1,40 – 3,15 г поліетиленгліколю (ПЕГ), що має середню молекулярну масу в інтервалі 3000 - 8000 Да; (b) 0,20 – 0,875 г твердої речовини, такої як маніт; (c) 0,002 – 0,0525 г стеарату магнію; та (d) 0,002 – 0,07 г смакової добавки. Наприклад, тверда композиція, що відповідає винаходу, призначена для лікування, полегшення і/або попередження колоректального раку (КРР), містить: (a) 1,5 – 3,115 г поліетиленгліколю (ПЕГ), що має середню молекулярну масу в інтервалі 3000 - 4000 Да; (b) 0,20 – 0,70 г твердої речовини, такої як маніт; (c) 0,004 – 0,016 г стеарату магнію; та (d) 0,002 – 0,035 г смакової добавки. Наприклад, тверда композиція, що відповідає винаходу, призначена для лікування, полегшення і/або попередження колоректального раку (КРР), містить: (a) 2273 – 2284 мг поліетиленгліколю (ПЕГ), що має середню молекулярну масу в інтервалі 3000 - 4000 Да; (b) 420 – 446 мг твердої речовини, такої як маніт; (c) 13,5 – 13,75 мг стеарату магнію; та (d) 11 – 42 мг смакової добавки, такої як смакова добавка перцева м'ята або малина/лимон. Тверді композиції, що відповідають винаходу, можуть бути упаковані будь-яким зручним чином. Наприклад, безліч елементів (наприклад, таблеток) твердої композиції, що відповідає даному винаходу, (наприклад, 5, 10, 15 або 20) можуть бути упаковані у спосіб, прийнятий у виробництві вітамінних добавок. Наприклад, вони можуть бути упаковані в пробірку (таку як ПТФЕ (політетрафторетиленова) пробірка), забезпечену засобами закриття, що видаляються та замінюються, наприклад, пробкою. Альтернативно тверді композиції, що відповідають винаходу, можна отримати у банці або іншому контейнері з кришкою, що видаляється або замінюється, або у пакеті або в обгортці (наприклад, обгортці з фольги). Переважно, коли присутній також поглинач вологи. Альтернативно вони можуть бути упаковані в блістер. В одному варіанті втілення тверді композиції упаковані в пробірку, банку, пакет, обгортку або інший контейнер без будь-якої обгортки окремих елементів (наприклад, таблеток). Необов'язково окремі дозовані 9 UA 107998 C2 5 10 15 20 25 30 35 40 45 50 55 форми твердих композицій, що відповідають даному винаходу, можуть мати обгортку. В переважному варіанті втілення запропоновані 30 унітарних доз композиції, що відповідає даному винаходу, розділені на три пробірки (наприклад, по 10 унітарних доз на пробірку) або іншу упаковку, необов'язково разом з інструкціями по застосуванню. Елементи, що відповідають даному винаходу, можуть бути також представлені в багаторазовому пакеті, який дає можливість повторно наповнити раніше використані пробірки дозованими формами, що відповідають винаходу. Тверді композиції, що відповідають винаходу, можна взяти в тому вигляді, як вони представлені, і дати пацієнту для розжовування або розсмоктування. Пацієнту необов'язково запивати тверду композицію водою або іншим напоєм. Деякі пацієнти можуть забажати попити води або іншої рідини разом з твердою композицією, що відповідає винаходу, або скоро після її прийому, щоб полегшити ковтання. Зручна упаковка і відсутність необхідності пити воду або інший напій суттєво підвищують зручність твердих композицій для пацієнтів порівняно з іншими формами продуктів на основі ПЕГ, які продаються у даний час. Композиції, що відповідають даному винаходу, можна приймати перед прийомом їжі або перекусом, разом з прийомом їжі або перекусом або після прийому їжі або перекусу. В одному варіанті втілення пацієнт, як правило, приймає до 6 г (або приблизно стільки) ПЕГ на день, наприклад, 2 – 6 г/день, наприклад, 3 - 5 г/день, наприклад, 4 - 5 г/день. В даному варіанті втілення композиція вільна від компонентів, які внаслідок природи та кількості мають проносну дію. Вважають, що ПЕГ не має суттєвої проносної дії у дорослих при прийомі на рівні 6 г/день. Вважають також, що маніт, компоненти смакової добавки та ковзної речовини не мають суттєвої проносної дії при добових рівнях, на яких їх приймають, коли композиція дає до 6 г ПЕГ/день. Щодо твердої композиції загальною масою 2,0 – 3,5 г і яка містить 85 мас.% ПЕГ, здоровому пацієнту можна рекомендувати приймати 1 або 2, або 1, 2 або 3 на день (щоб забезпечити до 6 г або приблизно стільки ПЕГ/день). Для зменшеної твердої композиції (наприклад, загальною масою 1,0 – 1,75 г), здоровому пацієнту можна рекомендувати приймати 1 - 6 на день, наприклад, 2 - 5 на день (щоб забезпечити до 6 г або приблизно стільки ПЕГ/день). Навпаки, щодо збільшеної твердої композиції (наприклад, загальною масою 3,0 – 7,0 г) здоровому пацієнту можна рекомендувати приймати 1 або 2 на день (щоб забезпечити до 6 г або приблизно стільки ПЕГ/день). Таким чином, даний винахід передбачає тверду композицію для перорального введення у вигляді твердого препарату (який переважно має масу 1,0 – 5,0 г) здоровому пацієнту (такому як людина), призначену для застосування у способі лікування, полегшення і/або попередження колоректального раку (КРР) і (необов'язково) попередження констипації, причому композиція містить: (a) 50 – 90 мас.% (наприклад, 60 - 90 мас.%, переважно 70 - 90 мас.%, більш прийнятно 70 89 мас.%, наприклад, 75 - 89 мас.%, наприклад, 78 - 89 мас.%, 80 - 85 мас.%, 81 - 85 мас.%, 80 84 мас.%, 82 - 84 мас.%) поліетиленгліколю (ПЕГ), що має середню молекулярну масу в інтервалі 2000 - 10000 Да; і (b) 10 – 40 мас.% (наприклад, 10 - 25 мас.%, 10 - 20 мас.%, переважно 12 - 20 мас.%, більш прийнятно 12 - 19 мас.%, 12 - 18 мас.% або 12 - 17 мас.%, наприклад, 14 - 20 мас.%, 14 - 19 мас.% або 14 - 18 мас.%,14 - 17 мас.%) твердої речовини, такої як маніт; разом з (c) необов'язковою ковзною речовиною, необов'язковою смаковою добавкою і/або необов'язковим підсолоджувачем, як описано вище; та причому спосіб передбачає введення зазначеної композиції таким чином, що пацієнт споживає до 6 г (або приблизно стільки) ПЕГ/день. Переважно, коли зазначений спосіб передбачає введення вказаної композиції таким чином, щоб пацієнт споживав від 2 г до 6 г, наприклад, 2 г – 5,5 г/день. Переважно, коли даний спосіб здійснюють на основі щоденного прийому або прийому через день. Переважно, коли спосіб реалізують протягом принаймні двох тижнів, переважно принаймні одного календарного місяця, більш прийнятно принаймні 6 календарних місяців, що слідують один за одним, або принаймні 12 календарних місяців, що слідують один за одним, або принаймні 24 або принаймні 36 календарних місяців, що слідують один за одним. У ряді вищеописаних варіантів втілення винаходу людина може представляти собою пацієнта зі схильністю до розвитку колоректального раку (КРР), основаною, наприклад, на сімейному анамнезі (наприклад, сімейному анамнезі розвитку колоректального раку (КРР)), історії хвороби (наприклад, на лікуванні поліпів товстої кишки, які існували раніше, та/або присутності захворювання, яке викликає у пацієнта схильність до розвитку колоректального раку (КРР), наприклад, сімейного поліпозу або синдрому Лінча і/або попереднього буття 10 UA 107998 C2 5 10 15 20 25 30 35 40 45 50 55 60 колоректального раку (КРР) або аденоми товстої кишки), стані здоров'я або образі життя (наприклад, внаслідок дієти з високим вмістом жиру або сильному споживанні алкоголю). Хоча автори даного винаходу встановили, що середній вік діагнозу колоректального раку (КРР) в нижченаведеній базі даних складає 73,0 роки для чоловіків і 74,9 років для жінок, композиції, що відповідають винаходу, можна використовувати для лікування, полегшення і/або попередження колоректального раку (КРР) у людини у віці 50 років або більше, наприклад 55 років або більше, наприклад, 60 років або більше, наприклад, 60 - 70 років або 65 - 70 або 60 75 років. В інших варіантах втілення людина не страждає констипацією, і способи, що відповідають даному винаходу, можуть як запобігати констипації, так і лікувати або попереджати або полегшувати колоректальний рак (КРР) у цих людей. В інших варіантах втілення винаходу передбачають набір (наприклад, упаковку), що містить безліч унітарних доз (наприклад, 5 або більше, 10 або більше, 20 або більше) композицій, що відповідають винаходу, як описано вище, разом з інструкціями по застосуванню. Наприклад, інструкції по застосуванню можуть визначати, що можна приймати на день один, два або три елементи/таблетки, що відповідають винаходу, або разом, або у розділеній дозі (наприклад, одну таблетку вранці, одну таблетку ввечері). Залежно від цього композиція в пероральній уніфікованій лікарській формі (наприклад, таблетці), призначена для застосування у способі лікування, полегшення і/або попередження колоректального раку (КРР) (і, необов'язково, попередження констипації) у людини, містить кількість (наприклад ефективну та субпроносну кількість, таку як 2,2 г або приблизно стільки) ПЕГ і/або блоксополімеру ПЕГ, причому спосіб передбачає прийом одного, двох або трьох елементів зазначеної композиції на день. Композиція може бути використана у такому способі, як описаний вище. Внаслідок цього композиції, що відповідають винаходу, особливо корисні при постійному (наприклад, щоденному) прийомі людиною, оскільки вони дають приємне відчуття в роті та мають структурну цілісність, а також забезпечують кількість ПЕГ, ефективну в контексті колоректального раку (особливо у поєднанні зі способами, що відповідають винаходу), крім того, дозволяють уникнути надмірних шлунково-кишкових розладів (таких як часте рідке випорожнення), які можна вважати неприємними або в цілому неприйнятними, при прийомі підвищених кількостей ПЕГ на такій постійній основі. Читач даного опису буде мати на увазі, що всі вищеописані варіанти втілення можна розуміти як такі, що розкривають окремо варіант втілення, спрямований на ПЕГ, і варіант втілення, спрямований на сополімер ПЕГ. Для читача даного опису буде очевидно, що термін “який містить” і його граматичні варіанти відносно вищеописаних варіантів втілення винаходу, можна використовувати замість термінів “що складається в основному з” або “що складається з”. Відомості, які підтверджують можливість здійснення винаходу Наступні приклади ілюструють, але не обмежують винахід. Приклад 1: Дослідження зв'язку між впливом проносного засобу макрогол і ризиком розвитку колоректального раку 1. Цілі дослідження Описати частоту виникнення колоректального раку в General Practice Research Database (база даних досліджень загальної лікарської практики) (GPRD) після впливу різних типів проносних засобів. Оцінити будь-який зв'язок між впливом проносного засобу макрогол і ризиком розвитку колоректального раку. 2. Способи Джерело даних і досліджувана популяція GPRD (База даних досліджень загальної лікарської практики) База даних досліджень загальної лікарської практики (GPRD) являє собою комп'ютеризовану базу даних, що містить анонімні дані, зібрані протягом часу, в рамках першої допомоги, у Об'єднаному королівстві. Вона значною мірою складається з кодованих даних, введених у комп'ютерну систему лікарями загальної практики (ЗП) в якості частини клінічного ведення пацієнтів у рамках першої допомоги. Інформація, введена в систему, включає демографічні подробиці, симптоми та медичний діагноз, детальні дані з приписів, лікарських направлень і прийомів, а також результати клінічних досліджень і тестів. Характер отримання даних у різні точки часу в комбінації з великими розмірами зразків і високою якістю даних по консультаціям, факторам ризику, діагнозу, приписам і результатам означає, що GPRD має ряд переваг в плані дослідження. Розподіл віку та статі в популяції пацієнтів у базі даних у будь-якій точці часу точно відповідає оцінкам Служби Національної 11 UA 107998 C2 5 10 15 20 25 30 35 40 45 50 55 60 Статистики для всієї популяції Англії та Уельсу. Крім того, для багатьох супутніх захворювань цифрові дані GPRD добре корелюють з даними інших джерел Об'єднаного Королівства, таких як статистичні дані по раку і цифрові дані, опубліковані Службою Національної Статистики. GPRD є широко використовуваним і визнаним джерелом даних з епідеміології та цінним джерелом для епідеміологічних досліджень. Обговорення плану досліджень Суть як впливу, так і результатів, які представляють інтерес для даного дослідження, розуміє, що приймаючи рішення щодо найбільш прийнятного плану досліджень, необхідно враховувати наступні міркування: 1. Особи, які приймають проносний засіб, будуть відрізнятися в плані ризику для них розвитку колоректального раку (КРР) від осі, які не приймають проносний засіб. Внаслідок цього для зниження ризику “змішування за показаннями” для встановлення будь-якого зв'язку буде необхідна оцінка всередині популяції осіб, що приймають проносний засіб. 2. Ризик колоректального раку (КРР) експоненційно зростає з віком. Внаслідок цього важливо, щоб будь-яке зіставлення випадків захворювання і контролів здійснювали, ґрунтуючись на році народження пацієнта, а не на більш широких вікових інтервалах. 3. Колоректальний рак (КРР) має тривалий латентний період, и статус проявлення під час діагнозу (класично статус проявлення ознак вимірюють в епідеміологічних дослідженнях) не буде являти собою релевантний статус проявлення. 4. Зміни в дефекації можуть являти собою перші прояви симптомів колоректального раку (КРР) і, отже, необхідне спостереження при оцінці будь-якого зв'язку між застосуванням проносного засобу та колоректальним раком (КРР) з тим, щоб проносні засоби не прописувалися внаслідок перших проявів симптомів колоректального раку (КРР). 5. Застосування проносного засобу часто відбувається «за необхідності», з перервами, і пацієнти переключаються з одного продукту на інший. Враховуючі складнощі порівняння, що представляє інтерес, роблять висновок про те, що жоден окремий план досліджень не може дати повну відповідь. З метою створення повної картини досліджень вирішують, що буде необхідно провести дослідження частоти виникнення колоректального раку (КРР) в групах, що одержують різні проносні засоби, у поєднанні з дослідженням типу випадок-контроль, включеним у популяцію дослідження когорти. Способи та результати обох даних досліджень тепер будуть послідовно обговорені. A. Описові дослідження застосування проносного засобу і частоти колоректального раку (КРР) Період досліджень Movicol® дозволений для застосування в Об'єднаному Королівстві в 1998 р., і період досліджень проходить з 1 січня 2000 р. до 31 березня 2009 р. Однак, постійні тенденції в даних по приписам, представлені у зазначеному документі, надані з січня 1992 р. до грудня 2008 р., останнього повного календарного року, для якого доступні дані. Досліджувана популяція Досліджувана популяція складається з усіх пацієнтів в GPRD, постійно зареєстрованих у ній або перенесених із загальної лікарської практики, причому дані MHRA, як вважають, є сучасним стандартом для дослідницьких цілей, і тих, кому прописували ≥ 1 проносний засіб у період часу їх медичної реєстрації, вважали UTS (такими, що відповідають сучасному стандарту). Обмеження за віком були відсутні. Виявлення пацієнтів з колоректальним раком Колоректальний рак визначений відповідно до Міжнародної Класифікації хвороб, 9 вид. і містить ICD-9 153-154.1 (включно). Однак у системі кодування GPRD не використовують коди ICD, тому характерні випадки колоректального раку ідентифіковані на GPRD за допомогою комбинації “зчитуваних кодів” і застосування трьох різних алгоритмів. Ідентифікація осіб, які приймають проносні засоби Пацієнти підходять для включення в дослідження групи з дня, наступного після часу першого зареєстрованого припису приймати проносний засіб. Використовують ті проносні засоби, які класифіковані в розділі 1.6.1 – 1.6.5 Британського національного фармацевтичного довідника (BNF). Засоби на основі ПЕГ в розділі 1.6.4 BNF включають MOVICOL®, який містить приблизно 13,125 г макроголу 3350. Пацієнтів не включають, якщо єдиний припис(и) їм приймати проносний засіб зареєстрований не в період часу, коли медичну документацію вважали такою, що відповідає сучасному стандарту (UTS). Класифікація впливу проносних засобів За впливом проносного засобу пацієнтів ділять на три категорії: 12 UA 107998 C2 5 10 15 20 25 30 35 40 45 50 55 i. Особи, які приймають тільки не макрогол. ii. Особи, які приймають тільки макрогол або перед початком прийому іншого проносного засобу. iii. Особи, які приймають макрогол після прийому іншого проносного засобу. До моменту, коли пацієнти одержують перший припис приймати макрогол на GPRD, їх класифікують як "особа, яка приймає тільки не макрогол”. З моменту одержання припису приймати макрогол їх класифікують або як “особа, яка приймає тільки макрогол або перед началом прийому іншого препарату” або “особа, яка приймає макрогол після іншого препарату”, як відповідає. Це роблять, оскільки під час дослідження існують наступні невизначені моменти: a) проносні засоби, що відрізняються від макроголів, не вважають такими, що викликають будьяке підвищення або зниження ризику розвитку колоректального раку (КРР), b) неясно, чи може одна доза макроголу впливати на ризик розвитку колоректального раку (КРР), чи є пороговий ефект (мінімальна кількість доз, необхідна для досягнення зниження ризику розвитку колоректального раку (КРР)) або чи є зв'язок між дозою або тривалістю та ефектом, і c) якщо мало місце зниження ризику розвитку колоректального раку (КРР), то чи обумовлено це застосуванням макроголу, зниженням ініціації пухлини або зниженням рівня розвитку пухлини. B. Дослідження типу випадок-контроль Досліджувана популяція Дослідження випадок-контроль включено до групи осіб, які приймають проносний засіб, так що всі випадки та контролі виділяють з ідентифікованої вище групи осіб, які приймають проносний засіб. Випадки та контролі підходять для включення в дослідження після дати першого припису їм проносного засобу. Класифікація впливу проносного засобу Як з дослідженням когорти, вплив проносного засобу на пацієнтів ділять на три категорії: i. Прийом тільки не макроголу. ii. Прийом тільки макроголу або перед початком прийому іншого проносного засобу (“макрогол перший”). iii. Прийом макроголу після прийому іншого проносного засобу (“другий проносний засіб перший”). В ході більшості періодів дослідження категорії i. та iii. відображали б сталу практику відповідно до приписних керівництв, тоді як категорія ii була б виключною. Ця ситуація змінилася у 2006 р., і очікують подальших змін після недавньої публікації огляду Cochrane, який робить висновок, що макроголи є проносним засобом першого вибору. Ідентифікація випадків колоректального раку Випадками колоректального раку є всі пацієнти з колоректальним раком (КРР) з недавно поставленими діагнозами з 1 січня 2000 до 31 березня 2009, і вони виявлені за допомогою алгоритмів і способів, описаних вище для дослідження когорти. За індексну дату приймають саму раню дату з підтвердженням діагнозу колоректального раку (КРР), та її визначають з використанням тих же критеріїв, що для описового дослідження росту захворюваності колоректальним раком (КРР). Необхідно, щоб випадки колоректального раку мали ≥6 місяців даних UTS до того, як індексна дата колоректального раку (КРР) дасть можливість зібрати інформацію з супутніх випадкових факторів. Ідентифікація контролів Ідентифікують шість контролів для кожного випадку колоректального раку (КРР) з метою досягнення оптимальної статистичної потужності. За визначенням слід відбирати контролі з популяції, в якій виникають випадки. Внаслідок цього контролі відбирають з популяції когорти осіб, які приймають один і той же проносний засіб, і необхідно, щоб вони не мали захворювання (не мали діагнозу колоректальний рак) на момент і до індексної дати випадку. Крім того, для усунення змішування за віком і статтю вони повинні мати такий же рік народження і бути тієї ж статі, що випадок. Необхідно також, щоб контролі мали ≥6 місяців даних UTS (що відповідають сучасному стандарту) до того, як індексна дата випадку дасть можливість зібрати інформацію по супутнім випадковим факторам, і необхідно, щоб вони отримали ≥1 приписів приймати проносний засіб до індексної дати колоректального раку (КРР) відповідного випадку. Основні обговорення Ґрунтуючись на припущенні, що доля макроголів складає 10% на ринку проносних засобів, і з відбором 6 контролів/випадків для демонстрації 20% зниження ризику розвитку колоректального раку (КРР) для вкладеного дослідження типу випадок-контроль необхідно приблизно 2360 недавно діагностованих випадків; для демонстрації 25% зниження ризику 13 UA 107998 C2 5 10 15 20 25 30 35 40 45 50 55 60 необхідно 1480 випадків. Якщо доля макроголів складає 20% ринку, то дані числа стануть 1290 и 800, відповідно. Датування заднім числом індексної дати колоректального раку Оскільки малоймовірно, що вплив на індексну дату релевантний, вибирають додаткові набори контролів на індексну дату мінус 6 місяців, мінус 12 місяців, мінус 18, 24, 30, 36, 42, 48, 54 і 60 місяців і для кожного з даних наборів аналізів аналізи впливу та факторів ризику здійснюють на базі “нових” індексних дат. Це означає, що будь-які зміни в статусі впливу або факторах ризику в період від “нової” індексної дати до вихідної індексної дати не враховують, ґрунтуючись на тому, що вони нерелевантні, оскільки рак уже є, але просто ще не діагностований. Припускають, що якщо макроголові проносні засоби все ж таки знижають ризик розвитку колоректального раку (КРР), то будь-який виявлений зв'язок має бути більш сильним або залишатися стабільним при визначенні заднім числом індексної дати. Зв'язок між дозою і ефектом Для осмотичних проносних засобів загальну отриману дозу (в мл лактулози та саше макроголів) розраховують для всіх випадків і контролів. Оцінюють зв'язок ризику розвитку колоректального раку (КРР) і приписаною дозою проносного засобу. Ідентифікація даних по факторам потенціного ризику розвитку колоректального раку Інформацію збирають, коли вона доступна, як для випадків, так і для контролів по кожному з супутніх випадкових факторів, перелічених нижче. Ризик розвитку колоректального раку (КРР) пов'язаний з дієтою, і інформація щодо дієти не зареєстрована в GPRD. Однак, інформація щодо соціально-економічного статусу (СЕС) та індексу маси тіла (ІМТ) включена в якості замінюючого критерію. Супутні випадкові фактори присутні на GPRD, і їх представляють або припускають, що вони або є факторами ризику, або мають захисний ефект відносно колоректального раку. Супутні випадкові фактори Паління Алкоголь Індекс маси тіла (ІМТ) Соціально-економічний статус (СЕС) Запальна хвороба кишки (ЗХК) Діагноз раку, іншого, ніж колоректальний рак Діабет Холецистектомія Пприпису прийому: Аспірин у низькій дозі (
ДивитисяДодаткова інформація
Назва патенту англійськоюPeg or peg block copolymers for treating colorectal cancer
Автори англійськоюStein, Peter, Cox, Ian, Smith, Samuel, Jones, Leighton, Plessl, Jorg, de Vries, Corinne, Charlton, Rachel
Автори російськоюСтэйн Питер, Кокс Иен, Смит Семюель, Джонс Лейтон, Плессль Йорг, дэ Врис Коринне, Чарлтон Рэчел
МПК / Мітки
МПК: A61P 35/00, A61K 31/765
Мітки: полегшення, раку, спосіб, колоректального, попередження, лікування
Код посилання
<a href="https://ua.patents.su/24-107998-sposib-likuvannya-polegshennya-i-abo-poperedzhennya-kolorektalnogo-raku.html" target="_blank" rel="follow" title="База патентів України">Спосіб лікування, полегшення і/або попередження колоректального раку</a>
Попередній патент: Захисне покриття для запобігання контамінації стороннім генетичним матеріалом об’єктів біологічного походження та збереження їх властивостей
Наступний патент: Спосіб прогнозування динаміки вогнищевих змін при лікуванні хворих на туберкульоз легень
Випадковий патент: Актиностійкі варіанти людської днкази i, ізольована нуклеїнова кислота, спосіб лікування пацієнтів, які страждають на легеневі захворювання